Adrian Chin y André van Zundert
LA HISTORIA DE LA ANESTESIA ESPINAL
Carl Koller, un oftalmólogo de Viena, en 1884 describió por primera vez el uso de la cocaína tópica para la analgesia ocular. William Halsted y Richard Hall, cirujanos del Hospital Roosevelt en la ciudad de Nueva York, llevaron la idea de la anestesia local un paso más allá al inyectar cocaína en los tejidos y nervios humanos para producir anestesia para la cirugía. James Leonard Corning, un neurólogo de la ciudad de Nueva York, en 1885 describió el uso de la cocaína para la anestesia espinal. Debido a que Corning era un observador frecuente en el Hospital Roosevelt, la idea de usar cocaína en el subaracnoideo El espacio puede provenir de observar a Halsted y Hall administrándose inyecciones de cocaína. Corning primero inyectó cocaína por vía intratecal a un perro y en pocos minutos el perro tenía una marcada debilidad en los cuartos traseros. Luego, Corning inyectó cocaína a un hombre en el espacio intermedio T11-T12 en lo que él pensó que era el espacio subaracnoideo. Como Corning no notó ningún efecto después de 8 minutos, repitió la inyección.
Diez minutos después de la segunda inyección, el paciente se quejó de somnolencia en las piernas pero pudo ponerse de pie y caminar. Debido a que Corning no mencionó la salida de líquido cefalorraquídeo (LCR), lo más probable es que inadvertidamente administró una inyección epidural en lugar de una inyección espinal al paciente.
La presencia de un líquido neuroaxial fue notada por primera vez por Galeno en el año 200 dC, y el LCR fue estudiado más tarde en el siglo XVI por Antonio Valsalva. La punción dural fue descrita en 1500 por Essex Wynter seguida poco después por Heinrich Quincke 1891 meses después.
Augustus Karl Gustav Bier, un cirujano alemán, usó cocaína por vía intratecal en 1898 en seis pacientes para cirugía de las extremidades inferiores. De manera verdaderamente científica, Bier decidió experimentar en sí mismo y desarrolló un dolor de cabeza pospunción dural (PDPH) por sus esfuerzos. Su asistente, el Dr. Otto Hildebrandt, se ofreció como voluntario para realizar el procedimiento después de que Bier no pudiera continuar debido al PDPH. Después de la inyección de cocaína espinal en Hildebrandt, Bier realizó experimentos en la mitad inferior del cuerpo de Hildebrandt. Bier describió pinchazos de aguja y quemaduras de cigarro en las piernas, incisiones en los muslos, avulsión del vello púbico, fuertes golpes con un martillo de hierro en las espinillas y torsión de los testículos. Hildebrandt informó de un dolor mínimo o nulo durante los experimentos; sin embargo, posteriormente sufrió náuseas, vómitos, CPPD, hematomas y dolor en las piernas. Bier atribuyó la CPPD a la pérdida de LCR y consideró que el uso de agujas de calibre pequeño ayudaría a prevenir el dolor de cabeza.
Dudley Tait y Guido Caglieri realizaron la primera anestesia espinal en los Estados Unidos en San Francisco en 1899. Sus estudios incluyeron cadáveres, animales y pacientes vivos para determinar los beneficios de la punción lumbar, especialmente en el tratamiento de la sífilis. Tait y Caglieri inyectaron sales de mercurio y yoduros en el líquido cefalorraquídeo, pero empeoraron el estado de un paciente con sífilis terciaria. Rudolph Matas, un cirujano vascular de Nueva Orleans, describió el uso de cocaína espinal en pacientes y posiblemente fue el primero en usar morfina en el espacio subaracnoideo. Matas también describió la complicación de la muerte tras la punción lumbar. Theodore Tuffier, un cirujano francés en París, estudió la anestesia espinal e informó sobre ella en 1900. Tuffier sintió que la cocaína no debería inyectarse hasta que se reconociera el LCR.
Tuffier enseñó en la Universidad de París al mismo tiempo que Tait era estudiante de medicina allí y muy probablemente fue uno de los mentores de Tait. Las demostraciones de Tuffier en París ayudaron a popularizar la anestesia espinal en Europa.
Arthur Barker, profesor de cirugía en la Universidad de Londres, informó sobre el avance de las técnicas espinales en 1907, incluido el uso de un anestésico local espinal hiperbárico, el énfasis en la esterilidad y la facilidad de la punción dural en la línea media sobre la paramedia. El avance de la esterilidad y la investigación de la disminución de la presión arterial después de la inyección ayudó a que la anestesia espinal fuera más segura y popular. Gaston Labat fue un firme defensor de la anestesia espinal en los Estados Unidos y realizó los primeros estudios sobre los efectos de la posición de Trendelenburg en la presión arterial después de la anestesia espinal. George Pitkin intentó usar un anestésico local hipobárico para controlar el nivel de bloqueo del nervio espinal mezclando procaína con alcohol. Lincoln Sise, anestesiólogo de la Clínica Lahey en Boston, usó la técnica de anestesia espinal hiperbárica de Barker con procaína y tetracaína.
La anestesia espinal se hizo más popular a medida que ocurrían nuevos desarrollos, incluida la introducción en 1946 de la anestesia de bloqueo nervioso en silla de montar por parte de Adriani y Roman-Vega. Sin embargo, en 1947 el muy publicitado caso de Woolley y Roe (Reino Unido) resultó en que dos pacientes quedaron parapléjicos en un día. Al otro lado del Atlántico, los informes de paraplejia en los Estados Unidos hicieron que los anestesiólogos descontinuaran el uso de la anestesia espinal. El desarrollo de nuevos agentes anestésicos intravenosos y bloqueadores neuromusculares coincidió con la disminución del uso de la anestesia espinal. En 1954, Dripps y Vandam describieron la seguridad de los anestésicos espinales en más de 10,000 XNUMX pacientes y se revivió la anestesia espinal.
En el campo de obstetricia, A mediados de la década de 500,000, se habían realizado más de 1950 espinales en mujeres estadounidenses. A pesar de que la anestesia espinal fue la técnica utilizada con más frecuencia para el parto vaginal y la cesárea en la década de 1950, las mejoras posteriores en la tecnología epidural dieron como resultado una disminución de la anestesia espinal obstétrica a fines de la década de 1960. El Tercer Proyecto de Auditoría Nacional (NAP3) estimó que se realizaron 133,525 espinales obstétricas en 2006 en el Reino Unido.
El desarrollo temprano de las agujas espinales fue paralelo al desarrollo temprano de la anestesia espinal. Corning eligió una aguja dorada que tenía una punta biselada corta, una cánula flexible y un tornillo de fijación que fijaba la aguja a la profundidad de la penetración dural. Corning también usó un introductor para la aguja, que tenía un ángulo recto. Quincke usó una aguja biselada que era afilada y hueca. Bier desarrolló su propia aguja afilada que no requería un introductor. La aguja tenía un calibre más grande (calibre 15 o 17) con un bisel de corte largo. Los principales problemas con la aguja de Bier fueron el dolor en la inserción y la pérdida de anestésico local debido al gran orificio en la duramadre después de la punción dural. La aguja de Barker no tenía una cánula interna, estaba hecha de níquel y tenía un bisel afilado de longitud media con un estilete a juego. Labat desarrolló una aguja de níquel irrompible que tenía un bisel corto y afilado con un estilete a juego. Labat creía que el bisel corto minimizaba el daño a los tejidos cuando se insertaba en la espalda.
Herbert Greene se dio cuenta de que la pérdida de LCR era un problema importante en la anestesia espinal y desarrolló una aguja de calibre más pequeño y punta suave que resultó en una menor incidencia de CPPD. Barnett Greene describió el uso de una aguja espinal de calibre 26 en obstetricia con una incidencia disminuida de CPPD. La aguja Greene fue popular hasta la introducción de la aguja Whitacre. Hart y Whitacre29 usaron una aguja con punta de lápiz para disminuir la CPPD del 5% al 10% al 2%. Sprotte modificó la aguja de Whitacre y en 1987 publicó su ensayo con más de 34,000 anestésicos espinales. Las modificaciones de la aguja Sprotte ocurrieron en la década de 1990 para producir la aguja que se usa hoy.
La anestesia espinal ha progresado mucho desde 1885. Todos los aspectos, desde equipos y agentes farmacológicos mejorados hasta una mayor comprensión de la fisiología y la anatomía, han hecho que la anestesia espinal sea cada vez más segura. El conocimiento clínico cambiante ha visto cambios en lo que se considera una contraindicación para la anestesia espinal, y la evolución de técnicas novedosas, como el uso de ultrasonido, ha permitido la anestesia espinal en lo que alguna vez se pensó en situaciones imposibles. No obstante, ninguna técnica está exenta de riesgos y se debe hacer todo lo posible para evitar complicaciones. Aprender a realizar anestesia espinal es una habilidad invaluable que todos los anestesiólogos deben tener en su arsenal.
LOS RIESGOS Y BENEFICIOS DE LA ANESTESIA ESPINAL
Antes de ofrecer anestesia espinal a un paciente, un anestesiólogo no solo debe conocer las indicaciones y contraindicaciones de la anestesia espinal, sino que también debe poder sopesar los riesgos y beneficios de realizar el procedimiento. Esto requiere una comprensión profunda de la evidencia disponible, en particular, cómo se compara la relación riesgo-beneficio con la de cualquier alternativa, y la capacidad de aplicar la evidencia a un escenario clínico determinado. Por lo tanto, un anestesiólogo informado puede ayudar al paciente a tomar una decisión informada.
Contraindicaciones y riesgos de la anestesia espinal
Contraindicaciones de la anestesia espinal
Existen contraindicaciones absolutas y relativas para la raquianestesia (ver Tabla 1). Las contraindicaciones absolutas incluyen la negativa del paciente; infección en el sitio de la inyección; hipovolemia grave no corregida; verdadera alergia a cualquiera de las drogas; y aumento de la presión intracraneal, excepto en casos de seudotumor cerebral (hipertensión intracraneal idiopática). La presión intracraneal alta aumenta el riesgo de hernia uncal cuando se pierde LCR a través de la aguja. La anestesia espinal también está contraindicada cuando se espera que la operación tome más tiempo que la duración del bloqueo del nervio o resulte en una pérdida de sangre tal que sea probable el desarrollo de hipovolemia severa.
TABLA 1. Contraindicaciones de la anestesia espinal.
| Contraindicaciones absolutas | Contraindicaciones Relativas |
|---|---|
| • Negativa del paciente • Infección en el lugar de la inyección • Hipovolemia no corregida • Alergia • Aumento de la presión intracraneal | • Coagulopatía • Sepsis • Estados fijos de gasto cardíaco • Enfermedad neurológica indeterminada |
Coagulopatía, anteriormente considerada una contraindicación absoluta, puede considerarse según el nivel de trastorno. Otra contraindicación relativa de la anestesia espinal es la sepsis distinta del sitio anatómico de la punción (p. ej., corioamnionitis o infección de las extremidades inferiores). Si el paciente está tomando antibióticos y los signos vitales son estables, se puede considerar la anestesia espinal. La anestesia espinal está relativamente contraindicada en enfermedades cardíacas con estados fijos de gasto cardíaco (GC). La estenosis aórtica, que alguna vez se consideró una contraindicación absoluta para la anestesia espinal, no siempre excluye una anestesia espinal cuidadosamente realizada.
Indeterminado enfermedad neurológica es una contraindicación relativa. La esclerosis múltiple y otras enfermedades desmielinizantes son un desafío. Los experimentos in vitro sugieren que los nervios desmielinizados son más susceptibles a la toxicidad de los anestésicos locales. Sin embargo, ningún estudio clínico ha demostrado de manera convincente que la anestesia espinal empeore tales enfermedades neurológicas. De hecho, sabiendo que el dolor, el estrés, la fiebre y la fatiga exacerban estas enfermedades, se puede preferir un bloqueo del nervio neuroaxial central (CNB) sin estrés para la cirugía.
La anestesia espinal en el paciente inmunocomprometido también presenta un desafío para el anestesiólogo y es objeto de una declaración de consenso. Aunque esta declaración de consenso no brinda consejos prescriptivos para cada situación, sí resume la evidencia disponible. Una vez se pensó que la cirugía espinal previa era una contraindicación. La punción dural puede ser difícil y la propagación del anestésico local puede verse restringida por el tejido cicatricial. Sin embargo, hay informes de casos de anestesia espinal exitosa en este entorno, particularmente con la ayuda de ultrasonido. Existen riesgos teóricos al insertar una aguja de cuerpo hueco a través de la tinta del tatuaje. Sin embargo, no se han informado complicaciones por la inserción de una aguja espinal o epidural a través de un tatuaje. Los estiletes pueden disminuir la probabilidad de transmitir un núcleo de tejido al espacio subaracnoideo y, si es necesario, se puede realizar una pequeña incisión en la piel antes de la inserción de la aguja. Los introductores sirven para prevenir la contaminación del LCR con pequeños fragmentos de epidermis, lo que podría conducir a la formación de tumores dermoides de la médula espinal.
Riesgos de la anestesia espinal: complicaciones
Las complicaciones del bloqueo espinal a menudo se dividen en complicaciones mayores y menores. Es tranquilizador que la mayoría de las complicaciones importantes sean raras. Sin embargo, las complicaciones menores son comunes y, por lo tanto, no deben descartarse. Las complicaciones menores incluyen náuseas, vómitos, hipotensión leve, escalofríos, picazón, problemas de audición y retención urinaria. PDPH y el bloqueo espinal fallido son complicaciones significativas y no infrecuentes de la anestesia espinal. Por tanto, las consideramos como complicaciones moderadas (ver Tabla 2). El fracaso de la anestesia espinal se ha mencionado entre el 1% y el 17% y se analiza más adelante en este capítulo.
TABLA 2. Complicaciones de la anestesia espinal.
| Clasificacion "Minor" | Moderado | Clasificacion Mayor |
|---|---|---|
| • Náuseas y vómitos • Hipotensión leve • Temblores • Picazón • Discapacidad auditiva leve transitoria • Retención urinaria | • Columna vertebral fallida • Cefalea pospunción dural | • Trauma directo con aguja • Infección (absceso, meningitis) • Hematoma del canal vertebral • Isquemia de la médula espinal • Síndrome de la cola de caballo • Aracnoiditis • Lesión del nervio periférico • Anestesia espinal total • Colapso cardiovascular • Muerte |
Complicaciones menores de la anestesia espinal
Náuseas y vómitos Las náuseas y los vómitos que se presentan después de la anestesia espinal son angustiantes para el paciente y pueden obstaculizar al cirujano. La incidencia de náuseas y vómitos intraoperatorios (IONV) en cirugía no obstétrica puede ser de hasta el 42 % y puede llegar al 80 % en las parturientas.
Las causas son complejas y multifactoriales. Las causas no relacionadas con la columna vertebral pueden incluir factores del paciente (p. ej., ansiedad, reducción del tono del esfínter esofágico inferior, aumento de la presión gástrica, hiperactividad vagal, cambios hormonales); factores quirúrgicos (exteriorización del útero, tracción peritoneal); y otros factores (p. ej., opioides sistémicos, fármacos uterotónicos, antibióticos, movimiento). La anestesia espinal en sí misma puede causar IONV o náuseas y vómitos posoperatorios (NVPO) a través de una variedad de mecanismos, que incluyen hipotensión, aditivos intratecales, bloqueo nervioso inadecuado o bloqueo nervioso alto. Los factores de riesgo de IONV bajo la columna incluyen una altura máxima del bloqueo nervioso superior a T6, frecuencia cardíaca (FC) inicial de 60 latidos/minuto o más, antecedentes de cinetosis e hipotensión previa después del bloqueo del nervio espinal.
La hipotensión debe ser la primera consideración cuando un paciente se queja de náuseas, especialmente inmediatamente después del inicio de la anestesia espinal. Esto se sabe desde hace mucho tiempo. Evans, en su libro de texto de 1929 sobre anestesia espinal, señaló que "la caída repentina de la presión arterial es seguida por náuseas". Los mecanismos y el manejo de la hipotensión se tratan con mayor detalle en otra parte (ver la sección sobre los efectos cardiovasculares de la anestesia espinal).
Se ha demostrado que una variedad de aditivos intratecales aumentan las IONV o NVPO. La morfina, la diamorfina, la clonidina y la neostigmina intratecales aumentan las náuseas y los vómitos. Sin embargo, el fentanilo intratecal reduce la IONV, tal vez al mejorar la calidad del bloqueo nervioso, disminuir los opioides suplementarios o disminuir la hipotensión.
Si bien el bloqueo del nervio espinal bajo puede causar náuseas por la estimulación quirúrgica, el bloqueo del nervio espinal simpático alto (con hiperactividad parasimpática relativa) también puede provocar náuseas. Se demostró que el glicopirrolato es mejor que el placebo para reducir las náuseas durante la cesárea, aunque la tasa de náuseas seguía siendo alta (42 %). Sin embargo, el glicopirrolato profiláctico puede aumentar la hipotensión después de la anestesia espinal.
Un metanálisis reciente sugirió que la metoclopramida (10 mg) era eficaz y segura para la prevención de las NVIO y las NVPO en el contexto del parto por cesárea bajo bloqueo del nervio neuroaxial.
Otro metanálisis mostró que los antagonistas de los receptores de serotonina 5-HT3 redujeron la incidencia de náuseas y vómitos y la necesidad de antieméticos de rescate posoperatorios cuando se usó morfina intratecal para la cesárea.
A pesar de que algunos estudios muestran un beneficio de la estimulación P6 (pericardio 6 puntos nei guan), con base en la acupuntura china, una revisión sistemática de 2008 encontró resultados inconsistentes en la prevención de IONV y NVPO.
La hipotensión Los mecanismos y el manejo de la hipotensión se tratan en otra parte (ver la sección sobre los efectos cardiovasculares de la anestesia espinal).
Temblando Crowley et al revisaron los escalofríos y la anestesia neuroaxial. La anestesia raquídea y epidural, y de hecho la anestesia general, pueden provocar escalofríos. La incidencia de escalofríos secundarios al bloqueo del nervio neuroaxial es difícil de evaluar dada la heterogeneidad de los estudios, pero es de alrededor del 55 %. En los primeros 30 minutos después del bloqueo nervioso, la anestesia espinal disminuye la temperatura corporal central más rápido que la anestesia epidural. Después de 30 minutos, ambas técnicas hacen que la temperatura baje al mismo ritmo. A pesar de esto, los escalofríos después de la anestesia espinal no son mayores que después de la anestesia epidural. De hecho, la intensidad de los escalofríos parece ser mayor con las epidurales. Los mecanismos postulados para esto incluyen una incapacidad para temblar debido a un bloqueo motor más pronunciado con anestesia espinal y un umbral de escalofríos disminuido con más dermatomas (y, por lo tanto, aferentes termorreguladores) bloqueados durante la anestesia espinal. Se han sugerido varias estrategias para reducir los escalofríos neuroaxiales (ver Tabla 3).
TABLA 3. Estrategias sugeridas para prevenir y tratar los escalofríos por anestesia neuroaxial.
| Prevención | Tratamiento |
|---|---|
| • Precalentar con calentador de aire forzado durante 15 minutos • Evite los fluidos epidurales o intravenosos fríos • Fentanilo intratecal 20 μg • Meperidina intratecal 0.2 mg/kg o 10 mg • Ondansetrón intravenoso 8 mg • Fentanilo epidural • Meperidina epidural | • Meperidina intravenosa 50 mg • Tramadol intravenoso 0.25 mg/kg o 0.5 mg/kg o 1 mg/kg • Clonidina intravenosa 30, 60, 90 o 150 μg |
Picar El prurito es un efecto secundario bien conocido de los opiáceos y es más común con la administración por vía espinal (46 %) en comparación con la epidural (8.5 %) y las vías sistémicas. La gravedad del prurito es proporcional a la dosis de morfina intratecal pero no a la dosis de morfina epidural. El prurito asociado con los opioides neuroaxiales a menudo se distribuye alrededor de la nariz y la cara. Aunque es posible que los síntomas no estén mediados por los receptores opioides, el prurito se puede tratar con el antagonista de los receptores opioides naloxona.
Hay informes sobre el uso de ondansetrón para el prurito inducido por opioides, lo que sugiere un papel de los receptores de serotonina en el prurito inducido por morfina. Un metanálisis de 2009 de pacientes obstétricas que habían recibido morfina intratecal mostró que los antagonistas del receptor 5-HT3 no redujeron la incidencia de prurito pero sí redujeron la gravedad del prurito y la necesidad de tratar el prurito. Los antagonistas del receptor 5-HT3 fueron útiles en el tratamiento del prurito establecido (número necesario a tratar [NNT] = 3).
Oír Deterioro Se ha informado pérdida de la audición, particularmente en el rango de baja frecuencia, después de la anestesia espinal. Las incidencias citadas varían ampliamente (3%–92%). Las emisiones otoacústicas, una medida objetiva de la audición que refleja la función de las células ciliadas externas, demostraron que la pérdida auditiva es más común de lo que se sospechaba, pero transitoria, con una recuperación total en 15 días. Otros autores han concluido de manera similar que la pérdida auditiva comúnmente desaparece espontáneamente. Una comparación de la pérdida auditiva después de la anestesia general y la raquídea concluyó que la pérdida auditiva ocurre independientemente de la técnica. La pérdida de audición puede o no estar asociada con PDPH y puede mejorar con un parche de sangre epidural. La pérdida de audición después del bloqueo del nervio espinal puede estar relacionada con el calibre de la aguja y puede ser menos común en la población obstétrica. Finegold demostró que no se producía pérdida de audición en mujeres que se sometían a cesáreas electivas cuando se usaban agujas Sprotte de calibre 24 o agujas Quincke de calibre 25. Se ha sugerido que el consentimiento para la anestesia espinal debe incluir una discusión por razones médico-legales de la posible pérdida de audición.
Retención Urinaria Postoperatoria La micción es el producto de una compleja interacción de la fisiología. La retención urinaria postoperatoria (POUR), por lo tanto, a menudo tiene un origen multifactorial. Los factores de riesgo del paciente para POUR incluyen sexo masculino y disfunción urológica previa. Los factores de riesgo quirúrgico incluyen cirugía pélvica o prolongada. Los factores anestésicos incluyen fármacos anticolinérgicos, opioides y administración de líquidos (>1000 XNUMX ml). POUR puede ocurrir con anestesia neuroaxial y general.
La aparición de POUR después del bloqueo del nervio neuroaxial se debe a la interrupción neural del reflejo de la micción, así como a la sobredistensión de la vejiga. Los opioides neuroaxiales ejercen un efecto en la médula espinal y el centro pontino de la micción. El bloqueo parasimpático inducido por la anestesia espinal debe terminar antes de que ocurra la micción. Esto generalmente se corresponde con el retorno de los segmentos S2–S4. El tipo y la dosis de anestésico local, así como el uso de opioides neuroaxiales, influyen en el retorno de la micción espontánea. El tiempo hasta la micción es más rápido con 2-cloroprocaína y más lento con bupivacaína.
Una revisión sistemática reciente encontró seis estudios que compararon el efecto de la anestesia neuroaxial con otras técnicas. Cuatro estudios compararon la infiltración local con la anestesia intratecal; tres de estos encontraron incidencias más bajas de retención urinaria con infiltración local. Los otros dos estudios no encontraron diferencias en el tiempo hasta la micción cuando se comparó la anestesia intratecal con la anestesia general en primera instancia y la anestesia general y el bloqueo de nervios periféricos en segunda instancia.
Dolor de cabeza por punción dural El dolor de cabeza posterior a la punción dural, a menudo clasificado como una complicación menor (o al menos no mayor), puede ser grave y debilitante y se ha considerado la complicación neurológica de la anestesia espinal. Es una causa común de reclamaciones médico-legales. La incidencia de CPPD está influenciada por la demografía del paciente y es menos común en Pacientes de edad avanzada. En un grupo de alto riesgo, como las pacientes obstétricas, el riesgo después de una punción lumbar con una aguja de calibre 27 de Whitacre es de alrededor del 1.7 %. El tamaño y el tipo de aguja influyen en la tasa de CPPD. Otros factores de riesgo incluyen menor índice de masa corporal (IMC), género femenino, antecedentes de dolores de cabeza recurrentes y CPPD anterior.
La cefalea pospunción dural no debe considerarse ni una complicación "menor" común ni una complicación "mayor" rara, sino una complicación "moderada" común.
Se remite al lector Dolor de cabeza por punción dural para más información detallada.
Complicaciones mayores de la anestesia espinal Las principales complicaciones de la anestesia espinal incluyen traumatismo directo por aguja, infección (meningitis o formación de abscesos), hematoma del canal vertebral, isquemia de la médula espinal, síndrome de cauda equina (CES), aracnoiditis y lesión de nervios periféricos. El resultado final de estas complicaciones puede ser una discapacidad neurológica permanente. Otras complicaciones importantes incluyen anestesia espinal total (TSA), colapso cardiovascular y muerte.
Trauma directo con aguja lesión neurológica puede ocurrir después de la introducción de la aguja en la médula espinal o los nervios. Aunque la provocación de parestesias durante la anestesia espinal se ha implicado como un factor de riesgo de daño neurológico persistente, no se sabe si una intervención después de la parestesia puede prevenir el desarrollo de complicaciones neurológicas. Un análisis retrospectivo encontró que 298 de 4767 (6.3%) pacientes experimentaron parestesia durante la inserción de la aguja espinal. De los 298, cuatro pacientes tuvieron parestesia persistente después de la operación. Otros dos pacientes con parestesia postoperatoria no tuvieron parestesia durante la inserción de la aguja. Los seis pacientes tuvieron una resolución de los síntomas a los 24 meses. Cuando ocurre parestesia, la aguja espinal puede estar adyacente o penetrar el tejido neural; si este último es el caso, la inyección de anestésico local en el nervio espinal puede provocar daño neurológico permanente. Existen controversias análogas con el bloqueo de nervios periféricos; las implicaciones de las técnicas de parestesia y la inyección extraneural e intraneural son objeto de mucho debate.
Meningitis La meningitis, ya sea bacteriana o aséptica, puede ocurrir después de realizar la anestesia espinal. Las fuentes de infección incluyen bandejas espinales y medicamentos contaminados, flora oral del anestesiólogo y del paciente. infección. La mayoría de los casos de meningitis después de la anestesia espinal en la primera mitad del siglo XX eran asépticos y podían atribuirse a la contaminación química y los detergentes.
Marinac demostró que las causas de la meningitis inducida por fármacos y productos químicos incluyen fármacos antiinflamatorios no esteroideos, ciertos antibióticos, agentes radiográficos y muromonab-CD3. También parece haber una asociación entre la aparición de reacciones de tipo hipersensibilidad y la enfermedad del colágeno, vascular o reumatológica subyacente. Carp y Bailey realizaron punciones lumbares en ratas bacteriémicas, y solo aquellas con un recuento de Escherichia coli circulante superior a 50 UFC/mL en el momento de la punción lumbar desarrollaron meningitis. Aunque también se ha descrito meningitis después de una punción lumbar en niños bacteriémicos, la incidencia de meningitis después de una punción lumbar diagnóstica no es significativamente diferente en pacientes bacteriémicos en comparación con la incidencia espontánea de meningitis. La flora oral puede contaminar el LCR cuando se realiza una anestesia espinal, lo que subraya la importancia de usar una máscara. Streptococcus salivarius, Streptococcus viridans, Staphylococcus aureus, Pseudomonas aeruginosa, Acinetobacter y Mycobacterium tuberculosis se han aislado en casos de meningitis bacteriana después de anestesia espinal o punción lumbar.
Hematoma del canal vertebral Canal vertebral moretón La formación es una complicación rara pero devastadora después de la anestesia espinal. Aunque la mayoría de los hematomas espinales ocurren en el espacio epidural debido al plexo venoso epidural prominente, algunos informes han mencionado la hemorragia subaracnoidea como la causa de los déficits neurológicos. La fuente del sangrado puede ser una arteria lesionada o una vena lesionada. El hematoma espinal y la isquemia de la médula espinal tienen peor pronóstico que las complicaciones infecciosas. Si se desarrollan síntomas neurológicos nuevos o progresivos, se debe obtener una consulta de neurocirugía inmediata y se debe realizar una resonancia magnética nuclear (RMN) de la columna tan pronto como sea posible.
Isquemia de la médula espinal El sistema arterial superficial de la médula espinal consta de tres arterias longitudinales (la arteria espinal anterior y dos arterias espinales posteriores) y un plexo pial.
El cordón posterior está relativamente protegido de la isquemia por abundantes anastomosis. El área central de la médula espinal anterior depende de la arteria espinal anterior y, por lo tanto, es más propensa a la isquemia. Los mecanismos propuestos para la isquemia de la médula espinal secundaria al bloqueo espinal incluyen la hipotensión prolongada, la adición de vasoconstrictores a los anestésicos locales y la compresión del riego arterial por el hematoma del canal vertebral.
Síndrome de cauda equina Se ha notificado síndrome de cauda equina (CES) con el uso de microcatéteres espinales continuos. El uso de lidocaína hiperbárica al 5% para anestesia espinal se asocia con una mayor incidencia de CES, aunque se han implicado otros anestésicos locales.
Otros factores de riesgo para CES incluyen la posición de litotomía, dosis repetidas de solución anestésica local a través de catéteres espinales continuos y posiblemente múltiples anestésicos espinales de inyección única.
Las sugerencias para la prevención de CES por anestesia espinal incluyen la aspiración de LCR antes y después de la inyección de anestésico local. Algunos sugieren que cuando no se puede aspirar el LCR después de inyectar la mitad de la dosis, no se administre una dosis completa.
Limitar la cantidad de anestésico local administrado en el espacio subaracnoideo puede ayudar a prevenir el CES.
Aracnoiditis La aracnoiditis puede ocurrir después de la inyección espinal de una solución anestésica local, pero también se sabe que ocurre después de la inyección intratecal de esteroides. Las causas de la aracnoiditis incluyen infección; mielogramas de tintes a base de aceite; sangre en el espacio intratecal; sustancias neuroirritantes, neurotóxicas o neurolíticas; intervenciones quirúrgicas en la columna vertebral; corticosteroides intratecales; y traumatismos. Se ha informado aracnoiditis después de una punción dural traumática y después de una inyección intratecal no intencional de anestésicos locales, detergentes, antisépticos u otras sustancias.
Lesión del nervio periférico La anestesia raquídea puede provocar indirectamente una lesión de los nervios periféricos. El bloqueo de los nervios sensoriales inducido por la anestesia espinal suprime temporalmente los reflejos protectores normales. Por lo tanto, se debe tener cuidado con la colocación adecuada, evitar los moldes de yeso apretados y observar la circulación distal. Por lo tanto, es imperativo que exista un buen cuidado de enfermería de las extremidades que han quedado insensibles por la anestesia espinal.
Anestesia Espinal Total La anestesia espinal total (TSA) produce depresión respiratoria, compromiso cardiovascular y pérdida del conocimiento. Esto puede o no estar precedido por entumecimiento, parestesia o debilidad de la extremidad superior; dificultad para respirar; náuseas; o ansiedad. El mecanismo de TSA no está claro.
La importancia de proporcionar soporte cardiorrespiratorio y ansiolisis queda ilustrada por el manejo de la TSA intencional. La anestesia espinal total se ha utilizado terapéuticamente para pacientes intratables. dolor. Después de la inyección de 20 ml de lidocaína al 1.5% en el nivel L3-L4, se inclinó a los pacientes con la cabeza hacia abajo. Se administró tiopental para prevenir sensaciones desagradables. Después de la pérdida del conocimiento, parálisis (sin relajante muscular) y dilatación de la pupila, se insertó una vía aérea con máscara laríngea (LMA) y se aplicó ventilación con presión positiva. Se utilizaron efedrina y atropina como apoyo cardiovascular si era necesario. Se requirió ventilación mecánica durante aproximadamente una hora, después de lo cual se retiró la LMA.
Colapso cardiovascular El colapso cardiovascular puede ocurrir después de la anestesia espinal, aunque es un evento raro. Auroy y colaboradores informaron 9 paros cardíacos en 35,439 XNUMX anestésicos espinales realizados. Consulte la sección sobre Efectos cardiovasculares de la anestesia espinal.
Estimación de los riesgos de las principales complicaciones de la anestesia espinal
Mientras que los riesgos menores a menudo se consideran efectos secundarios, las complicaciones mayores son más preocupantes para los médicos y los pacientes. La percepción del riesgo puede verse influida por informes de casos sensacionalistas, como los proporcionados por Woolley y Roe. Los primeros esfuerzos para evaluar el riesgo se vieron obstaculizados por la falta de buenos datos de numerador (número de complicaciones) y denominador (número de bloqueos de nervios espinales). Vandam y Dripps, en un intento de corregir las "impresiones clínicas sin fundamento" de los anestesiólogos de mediados del siglo XX, examinaron los registros de más de 20 10,000 anestésicos espinales. Llegaron a la conclusión de que las objeciones a la anestesia espinal eran inmerecidas. La evidencia retrospectiva de Finlandia para el período 1987-1993 estimó el riesgo de complicaciones mayores después de la anestesia espinal en 1 en 22,000 1990. Se pensó en un esquema de compensación sin culpa para aumentar la veracidad de los datos. Los datos suecos (Moen) del período 1999–1 encontraron un riesgo similar de 20,000 en 30,000 XNUMX–XNUMX XNUMX. Aunque era una buena evidencia en ese momento, la evidencia escandinava fue criticada debido a su diseño retrospectivo, que corre el riesgo de no ser informado. Además, los datos del numerador provenientes de bases de datos administrativas pueden no indicar causalidad ni resultado final.
Auroy intentó abordar las debilidades de un estudio anterior al establecer una línea telefónica directa, lo que permitió una evaluación contemporánea de la causalidad. Este estudio prospectivo de 1998 a 1999 investigó las complicaciones de cualquier tipo de anestesia regional. Los resultados de Auroy se basaron en la contribución voluntaria de los anestesiólogos franceses (tasa de participación <6%) y pueden haber sido sesgados por las diferentes tasas de complicaciones en aquellos que estaban dispuestos a participar. Una revisión de 2007 encontró una incidencia mucho mayor de complicaciones neurológicas después de la anestesia espinal en el trabajo de Auroy (3.7 a 11.8 por 10,000 0.4) en comparación con el trabajo de Moen (10,000 por XNUMX XNUMX). Auroy, a diferencia de Moen, incluyó la neuropatía periférica y la radiculopatía en los datos del numerador.
Diseñar un estudio prospectivo para cuantificar con precisión el riesgo de la raquianestesia ha sido difícil debido a la baja incidencia de complicaciones mayores. El NAP3 del Royal College of Anesthetists es la mejor evidencia hasta la fecha sobre las complicaciones mayores tras la BAC. NAP3 es notable por una variedad de razones: es la auditoría prospectiva más grande de CNB hasta la fecha; logró una tasa de devolución del 100%; y reunió datos de numerador y denominador de una variedad de fuentes. También investigó la causalidad y el resultado.
Los datos del numerador en NAP3 se referían a complicaciones mayores durante un período de 12 meses (2006-2007). Los informes provinieron de reporteros y médicos del hospital local. Se revisaron las autoridades judiciales, las organizaciones de defensa médica, las revistas e incluso las búsquedas en Google de los informes de los medios para identificar las complicaciones perdidas. Las complicaciones se clasificaron como infecciones, hematomas, lesiones nerviosas, colapsos cardiovasculares y errores de ruta equivocada. En particular, la CPPD no se incluyó como una complicación mayor. Las complicaciones fueron examinadas por un panel y se estableció la probabilidad de CNB como la causa. Los datos del denominador se obtuvieron de un censo de 2 semanas y se validaron contactando a varias organizaciones y bases de datos.
Los hallazgos de daño permanente se presentaron de manera optimista o pesimista (ver Tabla 4). Las cifras optimistas excluyeron las complicaciones en las que la recuperación era probable o la causalidad tenue.
TABLA 4. Números útiles para cotizar el riesgo para los pacientes.
| Bloqueo neuroaxial central | Riesgo (pesimista) | Riesgo (Optimista) |
|---|---|---|
| Daño permanente por complicación mayor | 1 en 25,000 | 1 en 50,000 |
| Muerte y paraplejia | 1 en 50,000 | 1 en 150,000 |
El daño permanente después de cualquier tipo de CNB fue pesimistamente 1:23,500 y optimistamente 1:50,500. El riesgo de muerte o paraplejía después de cualquier tipo de CNB fue de forma pesimista de 1:54,500 y de forma optimista de 1:141,500. Las incidencias de complicaciones de espinales y caudales fueron al menos la mitad de las epidurales y combinadas. espinal-epidural (CSE) bloqueos nerviosos. De aproximadamente 700,000 CNB, el 46% eran espinales. Aunque los autores advirtieron contra el análisis de subgrupos, se encontró que el entorno obstétrico tuvo una baja incidencia de complicaciones, mientras que el entorno perioperatorio de adultos tuvo las complicaciones más altas. La recuperación neurológica completa o casi completa ocurrió en el 61% de los casos.
Es importante destacar que NAP3 no examinó complicaciones menores o complicaciones mayores sin daño permanente. Por ejemplo, los pacientes pueden haber tenido un colapso cardiovascular que requirió cuidados intensivos o haber tenido meningitis, pero cuando se recuperaron por completo fueron excluidos incluso del cálculo pesimista. Estas son complicaciones que un paciente consideraría graves. Los autores reconocieron que sus cifras representan una incidencia mínima posible de complicaciones; sin embargo, otros han especulado que pueden haber sobreestimado el riesgo. Como no hubo un grupo de control, NAP3 no puede responder si la CNB es más segura que otras técnicas como la anestesia general.
El estudio NAP3 nos aseguró que el daño permanente como resultado de la anestesia espinal es raro. El gran alcance y la excelente metodología de NAP3 significan que es poco probable que se repita pronto una auditoría similar. Se deben hacer esfuerzos para mejorar las complicaciones "menores" y "moderadas" que tienen más probabilidades de causar problemas a nuestros pacientes. En particular, el PDPH merece especial atención.
Sin embargo, ocurren complicaciones importantes y se debe hacer todo lo posible para prevenirlas. La conciencia del bajo riesgo de complicaciones graves no debe dar lugar a la autocomplacencia.
De hecho, una complicación dada puede volverse tan rara que es poco probable que un solo anestesiólogo la encuentre en toda una vida de práctica. Sin embargo, dada la naturaleza catastrófica de tales complicaciones, la vigilancia continua es de suma importancia.
Indicaciones y Beneficios de la Anestesia Espinal
indicaciones
La anestesia espinal proporciona excelentes condiciones operativas para la cirugía debajo del ombligo. Así, se ha utilizado en los campos de la cirugía general urológica, ginecológica, obstétrica, abdominal inferior y perineal. Asimismo, se ha utilizado en cirugía vascular y ortopédica de miembros inferiores. Más recientemente, la anestesia espinal se ha utilizado en la cirugía por encima del ombligo (ver la sección sobre cirugía laparoscópica).
Beneficios de la anestesia espinal
Aunque la anestesia espinal es una técnica de uso común, con un estimado de 324,950 XNUMX anestesias espinales cada año solo en el Reino Unido, los beneficios de mortalidad y morbilidad son difíciles de probar o refutar. Se planteó la hipótesis de que, debido a la modulación beneficiosa de la respuesta al estrés, la anestesia regional sería más segura que la anestesia general. Sin embargo, los ensayos clínicos han sido contradictorios y continúan los debates sobre la superioridad de una técnica sobre la otra. Las evaluaciones de los beneficios del bloqueo espinal se ven perturbadas por la heterogeneidad de los estudios y los argumentos acerca de si el análisis debe incluir la intención de tratar. Además, gran parte de la evidencia de los beneficios del bloqueo neuroaxial se relaciona con la anestesia epidural, y algunas revisiones no diferencian entre la anestesia espinal y la epidural. Por ejemplo, se ha demostrado que el CNB reduce la pérdida de sangre y los eventos tromboembólicos. Sin embargo, los autores de estos estudios fueron prudentes al no analizar la columna vertebral y epidural anestesia individualmente, ya que el tamaño de la muestra del subgrupo habría sido inadecuado. Se requieren más estudios para dilucidar los beneficios relativos de cada técnica.
Un beneficio obvio de la anestesia espinal es evitar los muchos riesgos de la anestesia general. Sin embargo, debe recordarse que siempre existe la posibilidad de conversión a anestesia general, y una anestesia general emergente puede ser más riesgosa que una anestesia general planificada.
La anestesia espinal es ventajosa en ciertos entornos clínicos. Ahora es común que las mujeres que tienen un parto por cesárea se sometan a un bloqueo del nervio neuroaxial. La anestesia espinal evita los problemas asociados con la anestesia general en el embarazada paciente, en particular los riesgos de vía aérea difícil, conciencia y aspiración. Consulte Anestesia Regional Obstétrica.
Se ha encontrado que la pérdida de sangre materna es menor con la anestesia espinal en comparación con la anestesia general. La disminución de las tasas de mortalidad materna se ha atribuido al aumento de la práctica de la anestesia regional. Además, la anestesia regional permite que la madre esté despierta para el parto y que la pareja esté presente si así lo desea. Sin embargo, una revisión Cochrane no encontró evidencia de la superioridad de la anestesia regional sobre la anestesia general con respecto a los principales resultados maternos o neonatales. con anestesia epidural y general, aunque esto puede deberse al uso de efedrina en los estudios analizados.
No obstante, la anestesia espinal sigue siendo la técnica de elección para muchos anestesiólogos obstétricos debido a la seguridad, la confiabilidad y las expectativas del paciente.
Una revisión de 2005 de las "mejores prácticas" para las fracturas de cadera encontró que la anestesia espinal tiene beneficios consistentes y recomendó el uso de anestesia regional "siempre que sea posible". Los beneficios citados incluyeron mortalidad reducida, trombosis venosa profunda (TVP), requisitos de transfusión y complicaciones pulmonares. Sin embargo, estas recomendaciones, basadas en dos revisiones, ilustran las deficiencias de la evidencia disponible. La primera revisión tuvo una población heterogénea y un poder estadístico limitado para el análisis de subgrupos; por lo tanto, es cuestionable extrapolar los hallazgos a la anestesia espinal para la cirugía de fractura de cadera. La segunda revisión encontró solo una diferencia limítrofe en la mortalidad al mes y ninguna diferencia a los 1 meses. Además, todos los estudios incluidos tenían fallas metodológicas.
La respuesta de estrés a la cirugía cardíaca se reduce con la bupivacaína intratecal en combinación con la anestesia general122 y se atenúa parcialmente con la morfina intratecal. Se ha demostrado que la morfina intratecal en dosis bajas (259 ± 53 μg) facilita la extubación temprana después de la cirugía cardíaca. Un metanálisis de morfina intratecal en cirugía cardíaca mostró una disminución modesta en el uso de morfina y las puntuaciones de dolor, aunque la extubación más temprana solo se observó en un subgrupo de pacientes que recibieron menos de 500 μg de morfina intratecal.
A medida que la anestesia moderna y la atención perioperatoria se vuelvan más seguras, será cada vez más difícil demostrar la ventaja de una técnica sobre otra. De hecho, la técnica ideal puede ser una permutación de la anestesia general, el bloqueo del nervio neuroaxial, el bloqueo del nervio periférico o la analgesia por infiltración local.
Anestesia espinal: el análisis final de riesgo-beneficio
Una vez armado con la evidencia sobre los riesgos y beneficios de la anestesia espinal, el anestesiólogo debe decidir si la evidencia se aplica al paciente individual y a la situación clínica. Aunque las complicaciones pueden ser devastadoras, NAP3 nos aseguró que las complicaciones mayores de la anestesia espinal son raras. Los beneficios convincentes son más difíciles de probar, pero existen ventajas en ciertas situaciones clínicas. Además, la relación riesgo-beneficio debe compararse con la relación riesgo-beneficio de las alternativas disponibles. El aumento histórico en la seguridad de la anestesia raquídea ha ido acompañado de un aumento en la seguridad de las técnicas alternativas, incluida la anestesia epidural, el bloqueo de nervios periféricos, la analgesia por infiltración local y, por supuesto, la anestesia general. Es probable que esta competencia entre técnicas alternativas continúe. Además, se pueden utilizar diferentes modalidades en conjunto, lo que complica la decisión final. El anestesiólogo moderno debe considerar esta matriz de relaciones riesgo-beneficio, que está más allá del alcance de este capítulo.
ANATOMÍA FUNCIONAL DEL BLOQUE ESPINAL
Al revisar el anatomía funcional de bloqueo espinal, debe estar presente un conocimiento íntimo de la columna vertebral, la médula espinal y los nervios espinales. Este capítulo revisa brevemente la anatomía, la anatomía superficial y la sonoanatomía de la médula espinal.
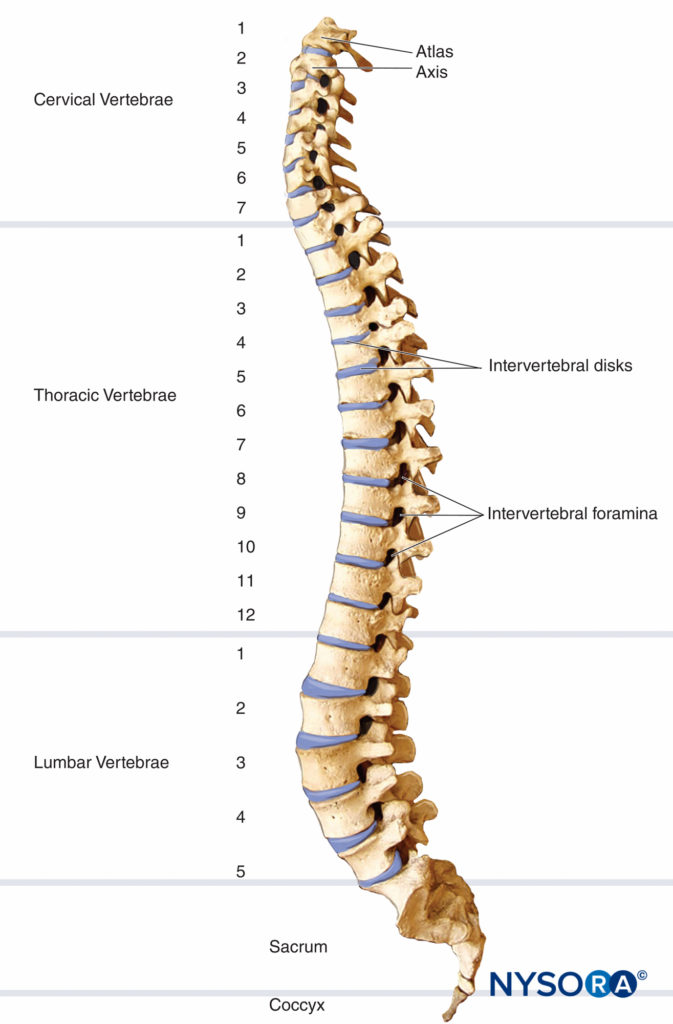
La columna vertebral consta de 33 vértebras: 7 cervicales, 12 torácicas, 5 lumbares, 5 sacras y 4 coxígeas. La columna vertebral suele contener tres curvas. Las curvas cervical y lumbar son convexas anteriormente y la curva torácica es convexa posteriormente. Las curvas de la columna vertebral, junto con la gravedad, la baricidad del anestésico local y la posición del paciente, influyen en la difusión de los anestésicos locales en el espacio subaracnoideo. Figura 1 y XNUMX representa la columna vertebral, las vértebras y los discos intervertebrales y agujeros.
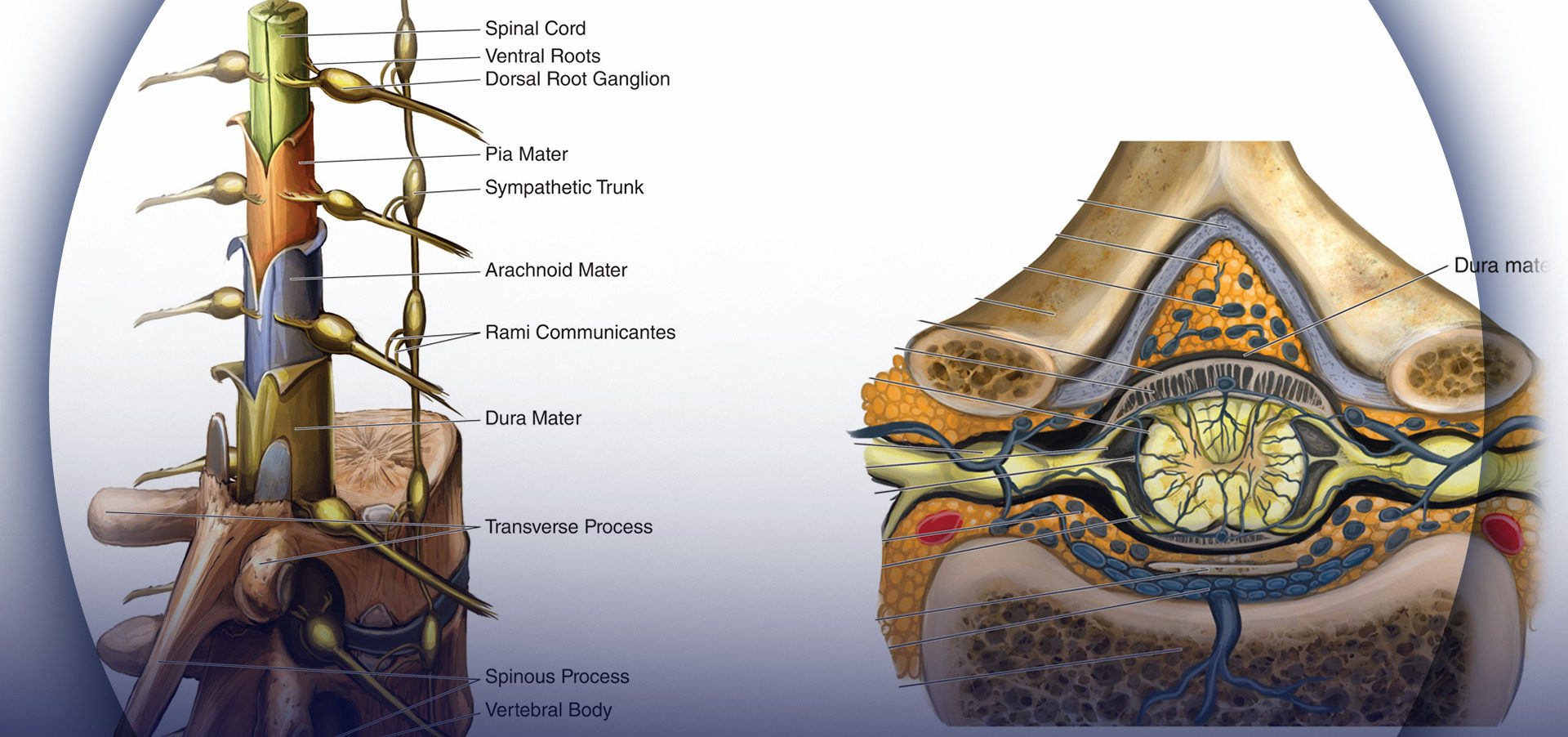
Cinco ligamentos mantienen unida la columna vertebral (Figura 2 y XNUMX). Los ligamentos supraespinosos conectan los vértices de las apófisis espinosas desde la séptima vértebra cervical (C7) hasta el sacro. El ligamento supraespinoso se conoce como ligamento nucal en el área por encima de C7. Los ligamentos interespinosos conectan las apófisis espinosas entre sí. El ligamento amarillo, o ligamento amarillo, conecta las láminas superior e inferior entre sí. Finalmente, los ligamentos longitudinales posterior y anterior unen los cuerpos vertebrales.
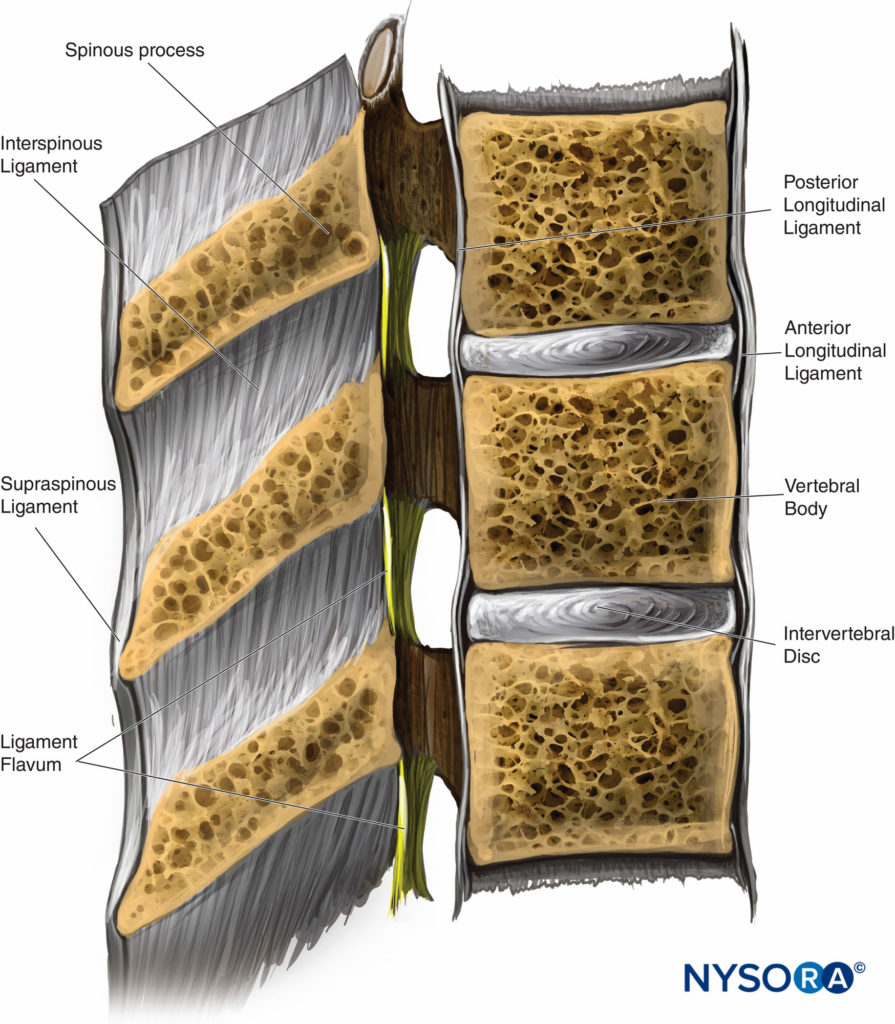
FIGURA 2. Sección transversal del canal espinal y ligamentos adyacentes. (Reproducido con permiso de Leffert LR, Schwamm LH: Neuroaxial anestesia en parturientas con patología intracraneal: una revisión integral y reevaluación del riesgo. Anestesiología. 2013 Sep;119(3):703-718.)
El tres membranas que protegen la médula espinal son la duramadre, la aracnoides y la piamadre. La duramadre, o madre dura, es la capa más externa. El saco dural se extiende hasta la segunda vértebra sacra (S2). La aracnoides es la capa intermedia y el espacio subdural se encuentra entre la duramadre y la aracnoides. La aracnoides, o madre telaraña, también termina en S2, como el saco dural. La piamadre, o madre blanda, se adhiere a la superficie de la médula espinal y termina en el filum terminale, que ayuda a sujetar la médula espinal al sacro. El espacio entre la aracnoides y la piamadre se conoce como espacio subaracnoideo, y los nervios espinales discurren por este espacio, al igual que el LCR. Figura 3 y XNUMX representa la médula espinal, los ganglios de la raíz dorsal y las raicillas ventrales, los nervios espinales, el tronco simpático, las ramas comunicantes y la piamadre, la aracnoides y la duramadre.
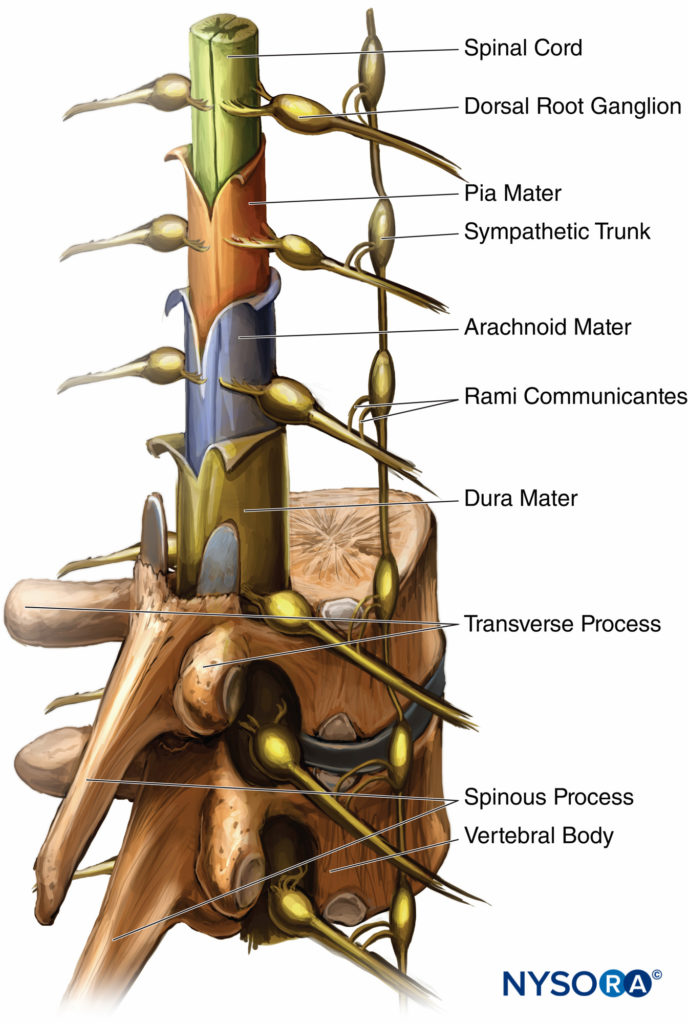
FIGURA 3. Médula espinal con capas meníngeas, ganglios de la raíz dorsal y el tronco nervioso simpático.
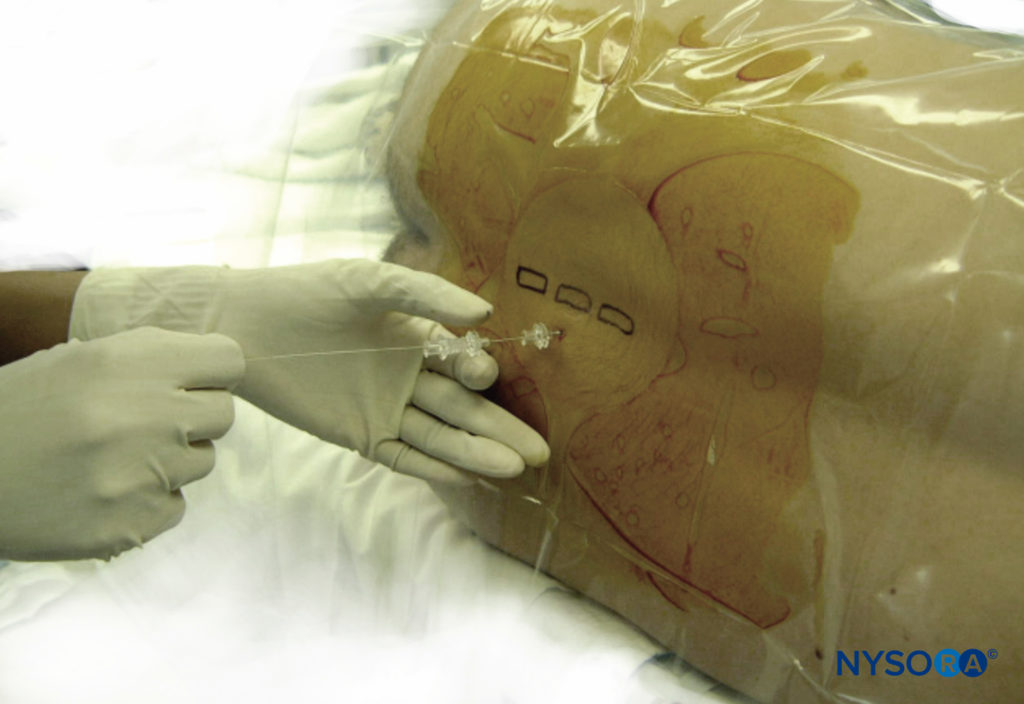
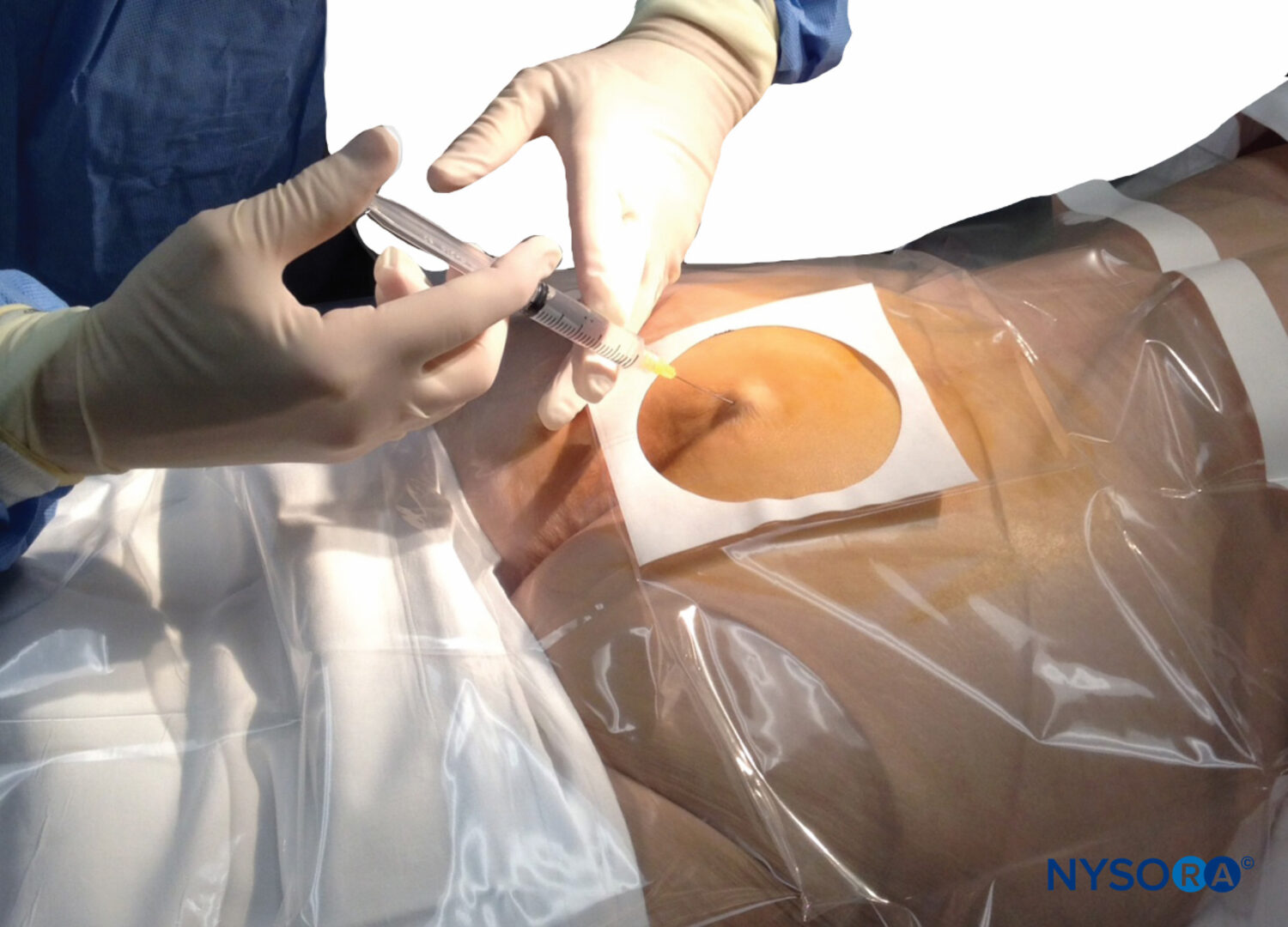
Cuando se realiza una anestesia espinal utilizando el abordaje de la línea media, las capas de la anatomía que se atraviesan (de posterior a anterior) son la piel, la grasa subcutánea, el ligamento supraespinoso, el ligamento interespinoso, el ligamento amarillo, la duramadre, el espacio subdural, la aracnoides y finalmente la espacio subaracnoideo. Cuando se aplica la técnica paramediana, la aguja espinal debe atravesar la piel, la grasa subcutánea, el músculo paraespinoso, el ligamento amarillo, la duramadre, el espacio subdural y la aracnoides y luego pasar al espacio subaracnoideo.
Consejos NYSORA
Cuando se realiza una anestesia raquídea mediante el abordaje de la línea media, las capas anatómicas que se atraviesan (de posterior a anterior) son
• Cuidado de la Piel
• Grasa subcutánea
• Ligamento supraespinoso
• Ligamento interespinoso
• Ligamento amarillo
• Dura madre
• Espacio subdural
• Materia aracnoidea
• Espacio subaracnoideo
Al realizar una anestesia espinal utilizando el abordaje paramediano, la aguja espinal debe atravesar
• Cuidado de la Piel
• Grasa subcutánea
• Músculo paraespinoso
• Ligamento amarillo
• Dura madre
• Espacio subdural
• Materia aracnoidea
• Espacio subaracnoideo
La anatomía del espacio subdural requiere una atención especial. El espacio subdural es un plano meníngeo que se encuentra entre la duramadre y la aracnoides, y se extiende desde la cavidad craneal hasta la segunda vértebra sacra. El examen ultraestructural ha demostrado que este es un espacio adquirido que solo se vuelve real después de la rotura de las células neuroteliales dentro del espacio. El espacio subdural se extiende lateralmente alrededor de la raíz nerviosa dorsal y el ganglio. Hay menos capacidad potencial del espacio subdural adyacente a las raíces nerviosas ventrales. Esto puede explicar la preservación de las fibras motoras y simpáticas anteriores durante el bloqueo del nervio subdural (SDB) (Figura 4 y XNUMX).

FIGURA 4. Catéter epidural en espacio subdural. Vista mejorada de un catéter epidural dentro de un espacio subdural obtenido de un cadáver bajo microscopía electrónica de barrido. Aumento ×20. (Reproducido con permiso de Reina MA, Collier CB, Prats-Galino A, et al: Colocación subdural no intencional de catéteres epidurales durante el intento de anestesia epidural: un estudio anatómico del compartimento subdural espinal. Reg Anesth Pain Med. 2011 noviembre-diciembre;36( 6): 537-541.)
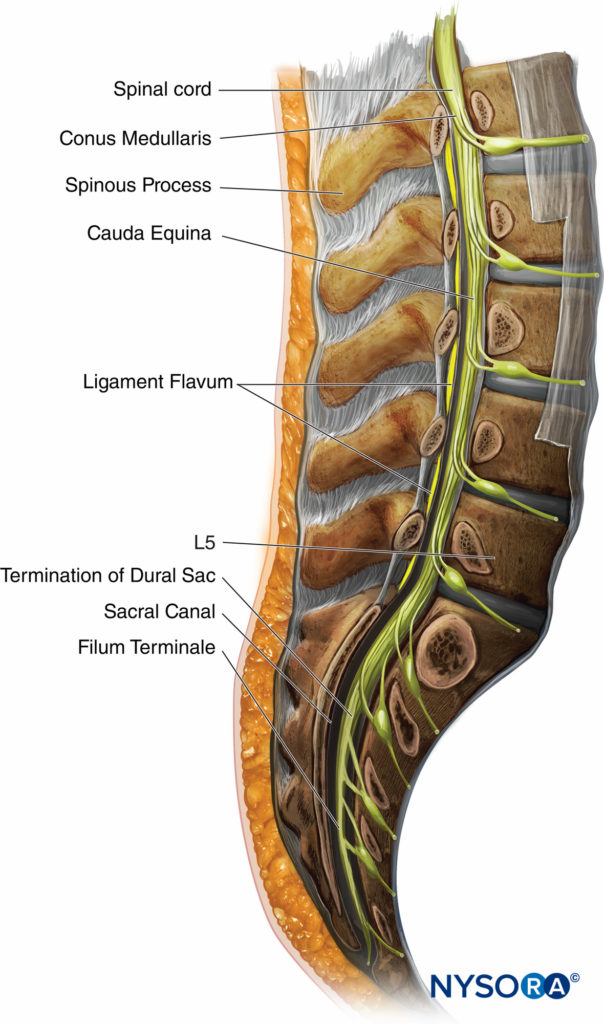
La longitud de la médula espinal varía según la edad. En el primer trimestre, la médula espinal se extiende hasta el final de la columna vertebral, pero a medida que el feto envejece, la columna vertebral se alarga más que la médula espinal. Al nacer, la médula espinal termina aproximadamente en L3. En el adulto, el extremo terminal del cordón, conocido como conus edullaris, se encuentra aproximadamente en L1. Sin embargo, la resonancia magnética y los estudios cadavéricos informaron un cono medular por debajo de L1 en 19% a 58% y por debajo de L2 en 0% a 5%. El conus medullaris puede estar en cualquier lugar entre T12 y L3.
Figura 5 y XNUMX Muestra una sección transversal de las vértebras lumbares y la médula espinal. Se muestra la posición típica del cono medular, cauda equina, terminación del saco dural y filum terminale. Se ha informado una médula espinal sacra en un adulto, aunque esto es extremadamente raro. Siempre se debe tener en cuenta la longitud de la médula espinal cuando se realiza un anestésico neuroaxial, ya que la inyección en la médula puede causar un gran daño y provocar parálisis.
Hay ocho nervios espinales cervicales y siete vértebras cervicales. Los nervios espinales cervicales 1 a 7 están numerados según el cuerpo vertebral a continuación. El octavo nervio cervical sale por debajo del séptimo cuerpo vertebral cervical. Debajo de esto, los nervios espinales se numeran de acuerdo con el cuerpo vertebral de arriba. Las raíces de los nervios espinales y la médula espinal sirven como sitios de destino para la anestesia espinal.
Anatomía de superficie
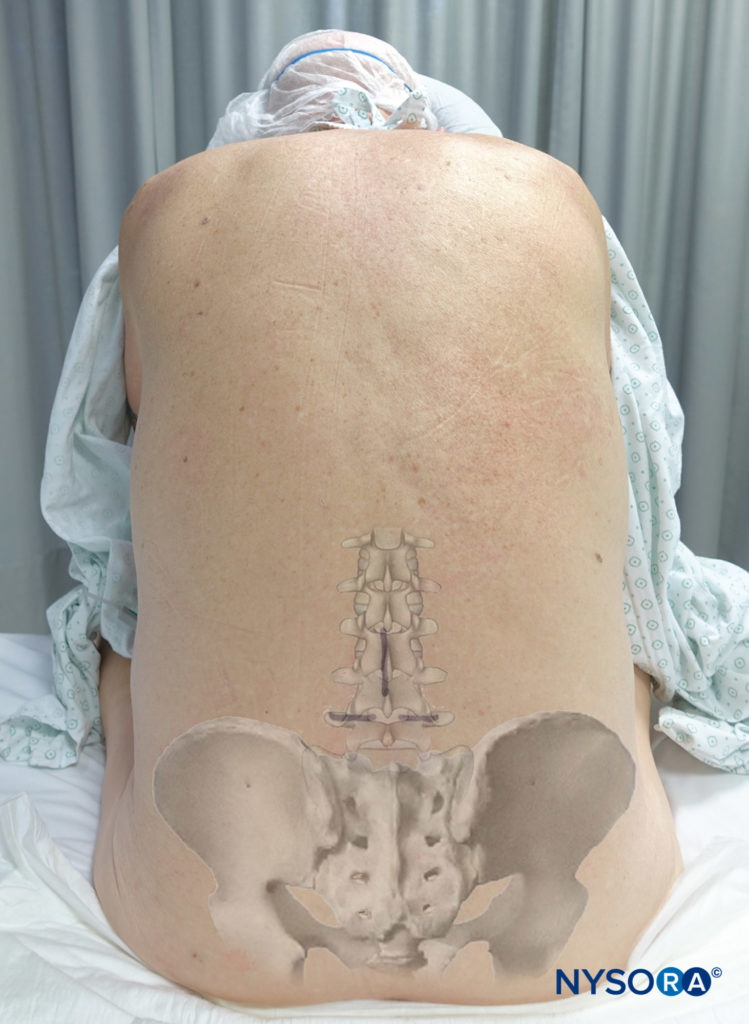
Al prepararse para el bloqueo anestésico espinal, es importante identificar con precisión los puntos de referencia en el paciente.
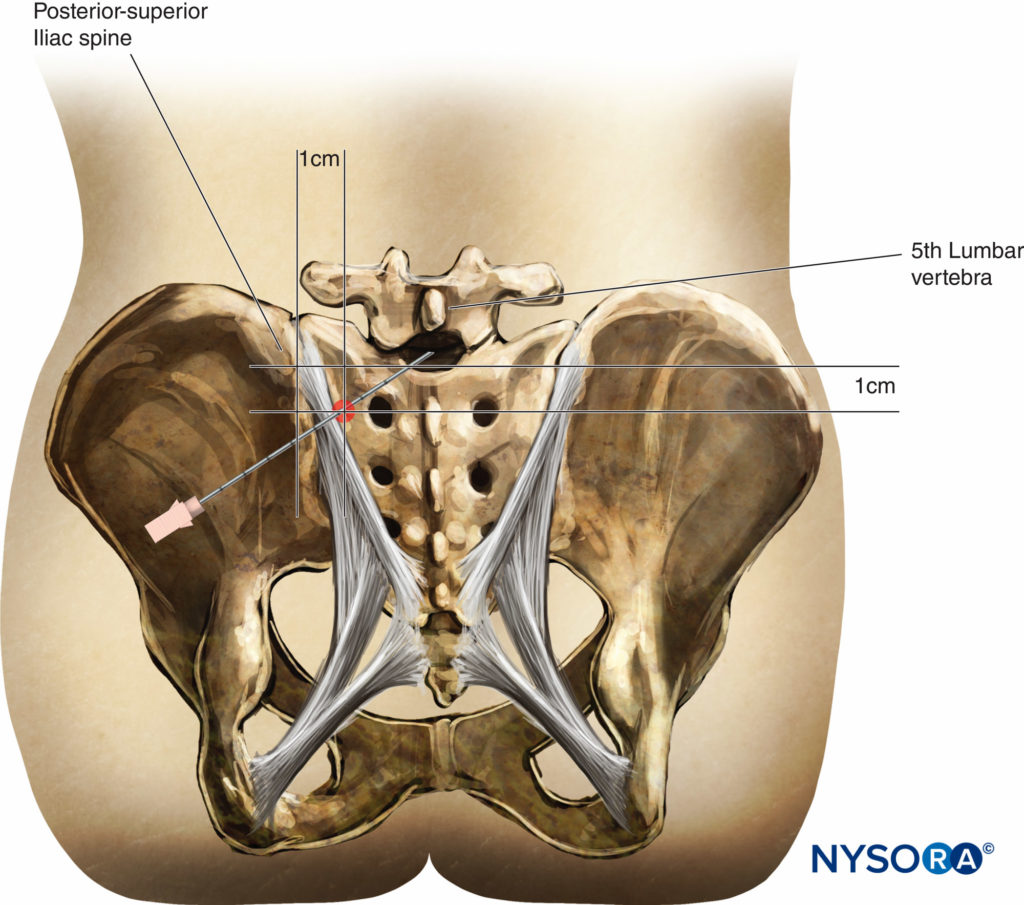
La línea media se identifica palpando las apófisis espinosas. Las crestas ilíacas suelen estar a la misma altura vertical que la cuarta apófisis espinosa lumbar o el espacio intermedio entre la cuarta y quinta vértebras lumbares. Se puede dibujar una línea intercristalina entre las crestas ilíacas para ayudar a localizar este espacio intermedio. Se debe tener cuidado de palpar el área blanda entre las apófisis espinosas para ubicar el espacio intermedio. Según el nivel de anestesia necesario para la cirugía y la capacidad de sentir el espacio intermedio, se puede utilizar el espacio intermedio L3-L4 o el espacio intermedio L4-L5 para introducir la aguja espinal. Debido a que la médula espinal comúnmente termina en el nivel L1 a L2, es convencional no intentar la anestesia espinal en o por encima de este nivel. Más recientemente, se ha descrito la anestesia espinal torácica segmentaria.
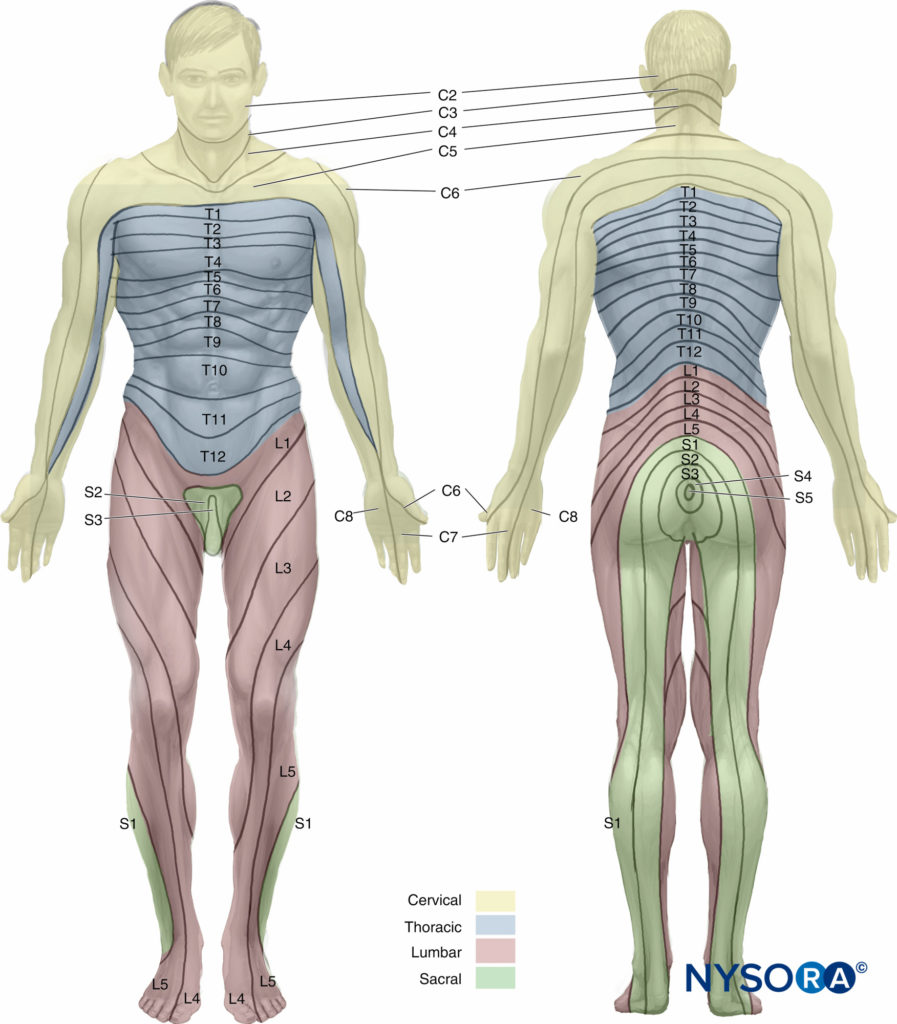
Sería incompleto discutir la superficie anatomía sin mencionar los dermatomas que son importantes para la anestesia espinal. Un dermatoma es un área de piel inervada por fibras sensoriales de un solo nervio espinal. El décimo dermatoma torácico (T10) corresponde al ombligo, el sexto dermatoma torácico (T6) al xifoides y el cuarto dermatoma torácico (T4) a los pezones. Figura 6 y XNUMX ilustra los dermatomas del cuerpo humano. Para lograr la anestesia quirúrgica para un procedimiento dado, la extensión de la anestesia espinal debe alcanzar un determinado nivel dermatomal. Los niveles dermatomales de anestesia espinal para procedimientos quirúrgicos comunes se enumeran en Tabla 5.
TABLA 5. Niveles dermatomales de anestesia espinal para procedimientos quirúrgicos comunes.
| Procedimiento | Nivel dermatomal |
|---|---|
| Cirugía abdominal superior | T4 |
| Cirugía intestinal, ginecológica y urológica | T6 |
| Resección transuretral del próstata | T10 |
| Parto vaginal de un feto y cirugía de cadera | T10 |
| Cirugía de muslo y pierna amputaciones | L1 |
| Cirugía de pie y tobillo | L2 |
| Cirugía perineal y anal | S2 a S5 (bloque de asiento) |
Consejos NYSORA
• El dermatoma T10 corresponde al ombligo.
• El dermatoma T6 corresponde al xifoides.
• El dermatoma T4 corresponde a los pezones.
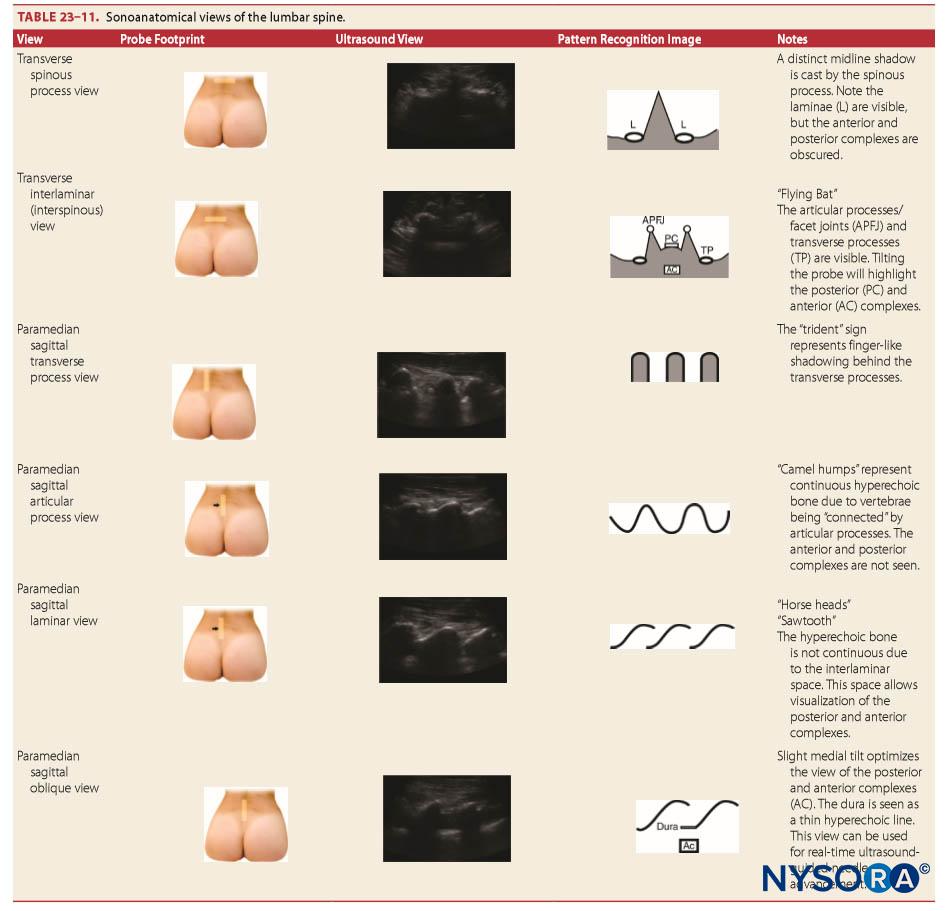
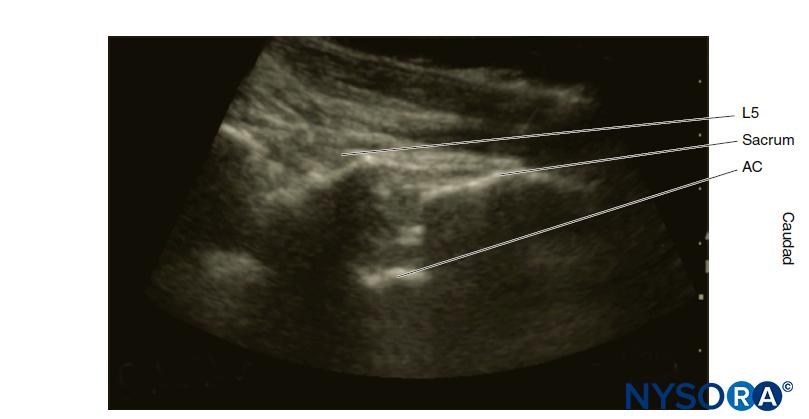
Sonoanatomía
La anatomía de "superficie" se refiere a estructuras lo suficientemente cerca del tegumento para que sean palpables. Sin embargo, debido al hábito corporal, esto puede no ser posible. Ultrasonido neuroaxial permite la visualización sonoanatómica de estas estructuras y estructuras más profundas. Sin embargo, como el haz de ultrasonido no puede penetrar las vértebras óseas, se requieren ventanas ultrasónicas especializadas para visualizar el neuroeje. La técnica de la ecografía neuroaxial se comenta en otra parte (véase la sección sobre avances recientes en anestesia raquídea).
FARMACOLOGÍA
La elección del anestésico local se basa en la potencia del agente, el inicio y la duración de la anestesia y los efectos secundarios del fármaco. En la anestesia espinal se utilizan dos grupos distintos de anestésicos locales, ésteres y amidas, que se caracterizan por el enlace que conecta la porción aromática y la cadena intermedia.
Los ésteres contienen un enlace éster entre la porción aromática y la cadena intermedia, y los ejemplos incluyen procaína, cloroprocaína y tetracaína. Las amidas contienen un enlace amida entre la porción aromática y la cadena intermedia, y los ejemplos incluyen bupivacaína, ropivacaína, etidocaína, lidocaína, mepivacaína y prilocaína. Aunque el metabolismo es importante para determinar la actividad de los anestésicos locales, la liposolubilidad, la unión a proteínas y el pKa también influyen en la actividad.
Consejos NYSORA
• La potencia de los anestésicos locales está relacionada con la liposolubilidad.
• La duración de la acción de un anestésico local se ve afectada por la unión a proteínas.
• El inicio de acción está relacionado con la cantidad de anestésico local disponible en la forma base.
La solubilidad en lípidos se relaciona con la potencia de los anestésicos locales. La baja liposolubilidad indica que se deben administrar concentraciones más altas de anestesia local para obtener el bloqueo nervioso. Por el contrario, la alta solubilidad en lípidos produce anestesia a bajas concentraciones. La unión a proteínas afecta la duración de la acción de un anestésico local. Una mayor unión a proteínas da como resultado una mayor duración de la acción. El pKa de un anestésico local es el pH al cual las formas ionizadas y no ionizadas están presentes por igual en la solución, lo cual es importante porque la forma no ionizada permite que el anestésico local se difunda a través de la vaina lipofílica del nervio y llegue a los canales de sodio en la membrana del nervio. El inicio de acción se relaciona con la cantidad de anestésico local disponible en la forma base. La mayoría de los anestésicos locales siguen la regla de que cuanto menor es el pKa, más rápido comienza la acción y viceversa. Por favor refiérase a Farmacología Clínica de los Anestésicos Locales.
Farmacocinética de los anestésicos locales en el espacio subaracnoideo
La farmacocinética de los anestésicos locales incluye la captación y eliminación del fármaco. Cuatro factores juegan un papel en la captación de anestésicos locales desde el espacio subaracnoideo hacia el tejido neuronal: (1) concentración de anestésico local en el LCR, (2) área de superficie del tejido nervioso expuesta al LCR, (3) contenido de lípidos del tejido nervioso, y (4) flujo de sangre al tejido nervioso.
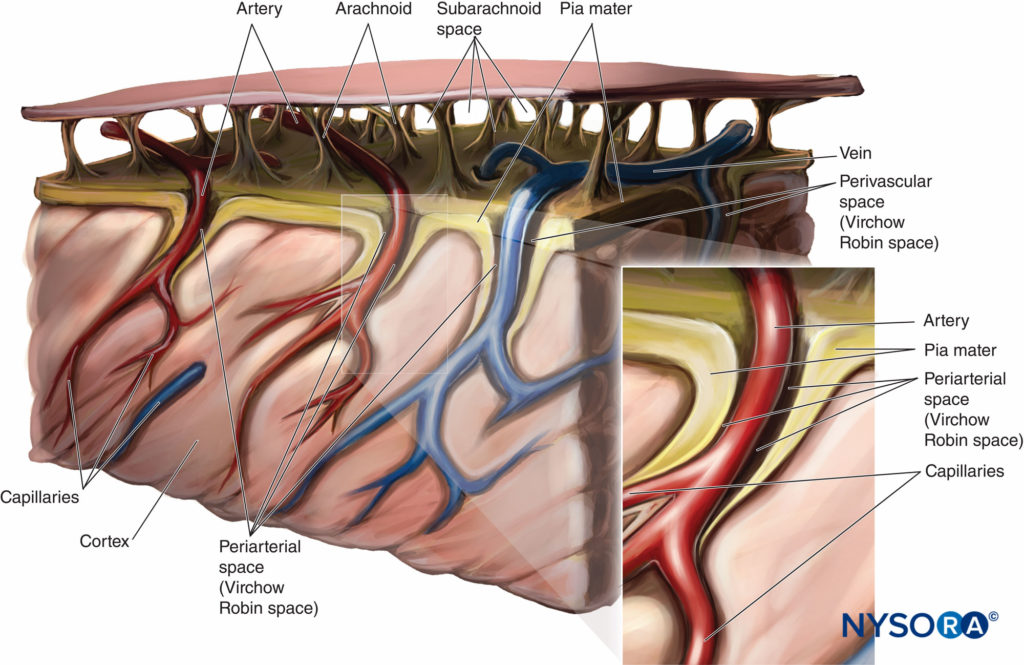
La captación del anestésico local es mayor en el sitio de mayor concentración en el LCR y disminuye por encima y por debajo de este sitio. Como se discutió anteriormente, la captación y la propagación de los anestésicos locales después de la inyección espinal están determinadas por múltiples factores, que incluyen la dosis, el volumen y la baricidad del anestésico local y la posición del paciente. Tanto las raíces nerviosas como la médula espinal absorben anestésicos locales después de la inyección en el espacio subaracnoideo. Cuanto mayor sea el área de superficie de la raíz nerviosa expuesta, mayor será la captación de anestésico local. La médula espinal tiene dos mecanismos para la captación de anestésicos locales. El primer mecanismo es por difusión desde el LCR hacia la piamadre y hacia la médula espinal, que es un proceso lento. Sólo la porción más superficial de la médula espinal se ve afectada por la difusión de anestésicos locales. El segundo método de captación del anestésico local es por extensión a los espacios de Virchow-Robin, que son las áreas de la piamadre que rodean los vasos sanguíneos que penetran en el sistema nervioso central. Los espacios de Virchow-Robin se conectan con las hendiduras perineuronales que rodean los cuerpos de las células nerviosas en la médula espinal y penetran hasta las áreas más profundas de la médula espinal. Figura 7 y XNUMX es una representación de los espacios periarteriales de Virchow-Robin alrededor de la médula espinal.
Consejos NYSORA
Los tres factores modificables más importantes para determinar la distribución de los anestésicos locales son
• Baricidad de la solución anestésica local
• Posición del paciente durante y justo después de la inyección
• Dosis del anestésico inyectado
El contenido de lípidos determina la captación de anestésicos locales. Los tejidos fuertemente mielinizados en el espacio subaracnoideo contienen concentraciones más altas de anestésicos locales después de la inyección. Cuanto mayor sea el grado de mielinización, mayor será la concentración de anestésico local, ya que existe un alto contenido de lípidos en la mielina. Si un área de la raíz nerviosa no contiene mielina, se produce un mayor riesgo de daño nervioso en esa área.
El flujo sanguíneo determina la velocidad de eliminación de los anestésicos locales del tejido de la médula espinal. Cuanto más rápido fluya la sangre en la médula espinal, más rápido se eliminará el anestésico. Esto puede explicar en parte por qué la concentración de anestésicos locales es mayor en la médula espinal posterior que en la médula espinal anterior, aunque se accede más fácilmente a la médula espinal anterior a través de los espacios de Virchow-Robin. Después de administrar un anestésico espinal, el flujo de sangre a la médula espinal puede aumentar o disminuir, según el anestésico local particular que se administre; por ejemplo, la tetracaína aumenta el flujo del cordón, pero la lidocaína y la bupivacaína lo disminuyen, lo que afecta la eliminación del anestésico local.
La eliminación del anestésico local del espacio subaracnoideo es por absorción vascular en el espacio epidural y el espacio subaracnoideo. Los anestésicos locales viajan a través de la duramadre en ambas direcciones. En el espacio epidural puede ocurrir absorción vascular, al igual que en el espacio subaracnoideo. El suministro vascular a la médula espinal consiste en vasos ubicados en la médula espinal y en la piamadre. Debido a que la perfusión vascular de la médula espinal varía, la velocidad de eliminación de los anestésicos locales varía.
Distribuidores
La distribución y disminución de la concentración de los anestésicos locales se basa en el área de mayor concentración, que puede ser independiente del sitio de inyección. Muchos factores afectan la distribución de los anestésicos locales en el espacio subaracnoideo. Tabla 6 enumera algunos de estos factores.
TABLA 6. Determinantes de la difusión del anestésico local en el espacio subaracnoideo.
| Propiedades de la solución anestésica local • Baricidad • Dosis • Volumen • Gravedad específica |
| Caracteristicas del paciente • Posición durante y después de la inyección • Altura (extremadamente baja o alta) • Anatomía de la columna vertebral • Disminución del volumen de líquido cefalorraquídeo (aumento de la presión intraabdominal por aumento de peso, embarazo, etc.) |
| Tecnologia • Sitio de inyección • Dirección del bisel de la aguja |
La baricidad juega un papel importante en la determinación de la propagación del anestésico local en el espacio espinal y es igual a la densidad del anestésico local dividida por la densidad del LCR a 37°C. Los anestésicos locales pueden ser hiperbáricos, hipobáricos o isobáricos en comparación con el LCR, y la baricidad es el principal determinante de cómo se distribuye el anestésico local cuando se inyecta en el LCR. Tabla 7 compara la densidad, la gravedad específica y la baricidad de diferentes sustancias y anestésicos locales.
TABLA 7. Densidad, gravedad específica y baricidad de diferentes sustancias y anestésicos locales.
| Densidad | Gravedad específica | baricidad | ||
|---|---|---|---|---|
| Agua | 0.9933 | 1.0000 | 0.9930 | |
| Fluido cerebroespinal | 1.0003 | 1.0069 | 1.0000 | |
| hipobárico | ||||
| • Tetracaína | 0.33% en agua | 0.9980 | 1.0046 | 0.9977 |
| • Lidocaína | 0.5% en agua | N/A | 1.0038 | 0.9985 |
| Isobárico | ||||
| • Tetracaína | 0.5% en LCR al 50% | 0.9998 | 1.0064 | 0.9995 |
| • Lidocaína | 2% en agua | 1.0003 | 1.0066 | 1.0003 |
| • Bupivacaína | 0.5% en agua | 0.9993 | 1.0059 | 0.9990 |
| Hiperbárica | ||||
| • Tetracaína | 0.5% en dextrosa al 5% | 1.0136 | 1.0203 | 1.0133 |
| • Lidocaína | 5% en dextrosa al 7.5% | 1.0265 | 1.0333 | 1.0265 |
| • Bupivacaína | 0.5% en dextrosa al 8% | 1.0210 | 1.0278 | 1.0207 |
| • Bupivacaína | 0.75% en dextrosa al 8% | 1.0247 | 1.0300 | 1.0227 |
Las soluciones hipobáricas son menos densas que el LCR y tienden a elevarse contra la gravedad. Las soluciones isobáricas son tan densas como el LCR y tienden a permanecer en el nivel en el que se inyectan. Las soluciones hiperbáricas son más densas que el LCR y tienden a seguir la gravedad después de la inyección.
Las soluciones hipobáricas tienen una baricidad de menos de 1.0 en relación con el LCR y generalmente se preparan agregando agua destilada estéril al anestésico local. La tetracaína, la dibucaína y la bupivacaína se han utilizado como soluciones hipobáricas en la anestesia espinal. La posición del paciente es importante después de la inyección de un anestésico espinal hipobárico porque son los primeros minutos los que determinan la propagación de la anestesia. Si el paciente está en posición de Trendelenburg después de la inyección, el anestésico se extenderá en dirección caudal y si el paciente está en posición de Trendelenburg inversa, el anestésico se extenderá cefálicamente después de la inyección.
La baricidad de las soluciones isobáricas es igual a 1.0. La tetracaína y la bupivacaína se han utilizado con éxito para la anestesia espinal isobárica. La gravedad no juega un papel en la difusión de las soluciones isobáricas, a diferencia de los anestésicos locales hipo o hiperbáricos. Por lo tanto, el posicionamiento del paciente no afecta la dispersión de las soluciones isobáricas. La inyección se puede realizar en cualquier posición y luego se puede colocar al paciente en la posición necesaria para la cirugía.
Las soluciones hiperbáricas tienen una baricidad superior a 1.0. Una solución anestésica local puede hacerse hiperbárica agregando dextrosa o glucosa. La bupivacaína, la lidocaína y la tetracaína se han utilizado como soluciones hiperbáricas en la anestesia espinal. El posicionamiento del paciente afecta la difusión del anestésico. Un paciente en posición de Trendelenburg tendría el viaje anestésico en dirección cefálica y viceversa.
Tanto la dosis como el volumen juegan un papel en la distribución de los anestésicos locales después de la inyección espinal. Para obtener más información, consulte la sección Volumen, concentración y dosis de anestésico local.
Efectos del Volumen de la Cisterna Lumbar sobre la Altura del Bloqueo Nervioso
El líquido cefalorraquídeo se produce en el cerebro a razón de 0.35 ml/min y llena el espacio subaracnoideo. Este líquido transparente e incoloro tiene un volumen adulto aproximado de 150 ml, la mitad del cual se encuentra en el cráneo y la otra mitad en el conducto raquídeo. Sin embargo, el volumen del LCR varía considerablemente, y la disminución del volumen del LCR puede deberse a la obesidad, el embarazo o cualquier otra causa de aumento de la presión abdominal. Esto se debe en parte a la compresión del agujero intervertebral, que desplaza el LCR.
Perla Clínica
Debido a la amplia variabilidad en el volumen del LCR, la capacidad de predecir el nivel del bloqueo espinal después de la inyección de anestésico local es muy pobre, incluso si se calcula y utiliza el IMC.
Múltiples factores afectan la distribución de la anestesia local después del bloqueo espinal, uno de los cuales es el volumen del LCR. Carpenter demostró que el volumen de LCR lumbosacro se correlacionaba con la altura máxima del bloqueo del nervio sensorial y la duración de la anestesia quirúrgica. La densidad del LCR se relaciona con el nivel máximo de bloqueo de los nervios sensoriales, y el volumen del LCR lumbosacro se correlaciona con el nivel máximo de bloqueo de los nervios sensoriales y el inicio y la duración del bloqueo de los nervios motores. Sin embargo, debido a la amplia variabilidad en el volumen del LCR, la capacidad de predecir el nivel del bloqueo espinal después de la inyección de anestésico local es deficiente, incluso si se calcula y utiliza el IMC.
Anestésicos locales
La cocaína fue el primer anestésico espinal que se usó, y pronto le siguieron la procaína y la tetracaína. También se han utilizado por vía intratecal lidocaína, 2-cloroprocaína, bupivacaína, mepivacaína y ropivacaína. Además, hay un interés creciente en los medicamentos que producen anestesia y analgesia mientras limitan los efectos secundarios. Se han agregado una variedad de medicamentos, incluidos vasoconstrictores, opioides, agonistas adrenérgicos α2 e inhibidores de la acetilcolinesterasa, a los medicamentos espinales para mejorar la analgesia y reducir el bloqueo motor producido por los anestésicos locales.
La lidocaína se utilizó por primera vez como anestésico espinal en 1945 y, desde entonces, ha sido uno de los anestésicos espinales más utilizados. El inicio de la anestesia se produce en 3 a 5 minutos con una duración de la anestesia que dura de 1 a 1.5 horas. La anestesia espinal con lidocaína se ha utilizado para casos de quirófano de longitud corta a intermedia. El principal inconveniente de la lidocaína es la asociación con síntomas neurológicos transitorios (TNS), que se presentan como dolor lumbar y disestesias en las extremidades inferiores con radiación en las nalgas, los muslos y las extremidades inferiores después de la recuperación de la anestesia espinal. Los TNS ocurren en aproximadamente el 14% de los pacientes que reciben anestesia espinal con lidocaína. La posición de litotomía se asocia con una mayor incidencia de SNT. Debido al riesgo de TNS, la lidocaína ha sido reemplazada principalmente por otros anestésicos locales.
El uso intratecal de 2-cloroprocaína se describió en 1952. En la década de 1980, surgieron preocupaciones con respecto a la neurotoxicidad con el uso de 2-cloroprocaína. Los estudios han sugerido que el bisulfito de sodio, un antioxidante que se usa en combinación con la 2-cloroprocaína, es el responsable. Se han informado déficits neurológicos crónicos en conejos cuando se inyectó bisulfito de sodio en el espacio subaracnoideo lumbar, pero cuando se inyectó 2-cloroprocaína sin conservantes, no se observaron secuelas neurológicas permanentes. Los resultados de los ensayos clínicos han demostrado que la 2-cloroprocaína sin conservantes es segura, de acción breve y aceptable para la cirugía ambulatoria. Sin embargo, no se recomienda agregar epinefrina debido a una asociación con síntomas similares a los de la gripe y dolor de espalda. La 2-cloroprocaína intratecal no está aprobada actualmente por la Administración de Alimentos y Medicamentos (FDA), aunque la etiqueta del paquete indica que puede usarse para la anestesia epidural. El tiempo de inicio es rápido y la duración es de alrededor de 100 a 120 minutos. La dosis varía de 20 a 60 mg, con 40 mg como dosis habitual.
La procaína es un anestésico local de éster de acción corta. La procaína tiene un tiempo de inicio de 3 a 5 minutos y una duración de 50 a 60 minutos. Se ha sugerido una dosis de 50 a 100 mg para la cirugía perineal y de las extremidades inferiores. Sin embargo, existe una incidencia del 14 % de fracaso del bloqueo nervioso asociado con el 10 % de procaína. Las preocupaciones sobre la neurotoxicidad de la procaína han limitado su uso. Por todas estas razones, actualmente la procaína rara vez se usa para la anestesia espinal.
La bupivacaína es uno de los anestésicos locales más utilizados para la anestesia espinal y proporciona anestesia y analgesia adecuadas para casos de quirófano de duración intermedia a larga. La bupivacaína tiene una baja incidencia de SNT. El inicio de la anestesia ocurre en 5 a 8 minutos, con una duración de la anestesia que dura de 90 a 150 minutos. Para la anestesia espinal ambulatoria, se recomiendan dosis pequeñas de bupivacaína para evitar un tiempo de alta prolongado debido a la duración del bloqueo nervioso. La bupivacaína a menudo se envasa al 0.75 % en dextrosa al 8.25 %. Otras formas de bupivacaína espinal incluyen 0.5 % con o sin dextrosa y 0.75 % sin dextrosa.
Consejos NYSORA
• Los TNS limitan el uso de lidocaína intratecal.
• La bupivacaína tiene una incidencia muy baja de SNT.
• El inicio de la anestesia ocurre en 5 a 8 minutos con bupivacaína y una duración de la anestesia que dura de 210 a 240 minutos; por lo tanto, es apropiado para casos de quirófano intermedios a largos.
La tetracaína tiene un inicio de anestesia dentro de los 3 a 5 minutos y una duración de 70 a 180 minutos y, como la bupivacaína, se usa para casos que son de duración intermedia a más larga. La solución al 1% se puede mezclar con glucosa al 10% en partes iguales para formar un anestésico espinal hiperbárico que se usa para cirugía perineal y abdominal. Con tetracaína, los TNS ocurren a una tasa más baja que con la anestesia espinal con lidocaína. La adición de fenilefrina puede jugar un papel en el desarrollo de TNS.
La mepivacaína es similar a la lidocaína y se ha utilizado desde la década de 1960 para la anestesia espinal. La incidencia de TNS informada después de la anestesia espinal con mepivacaína varía ampliamente, con tasas de 0% a 30%.
La ropivacaína se introdujo en la década de 1990. Para aplicaciones en anestesia espinal, se ha encontrado que la ropivacaína es menos potente que la bupivacaína. Los estudios de búsqueda de rango de dosis han demostrado la DE95 de la ropivacaína espinal en cirugía de miembros inferiores (11.4 mg), pacientes embarazadas (26.8 mg) y neonatos (1.08 mg/kg). El uso intratecal de ropivacaína no está generalizado y se esperan datos de seguridad a gran escala. Un estudio inicial identificó dolor de espalda en 5 de 18 voluntarios inyectados con ropivacaína hiperbárica intratecal. Se han notificado SNT con la ropivacaína espinal, aunque la incidencia no es tan común como la que se observa con la lidocaína. Otros estudios pequeños no han demostrado ningún efecto secundario importante.
Tabla 8 muestra algunos de los anestésicos locales utilizados para la anestesia espinal y la duración y concentración de la dosis para diferentes niveles de bloqueo espinal.
TABLA 8. Dosis, duración y comienzo de los anestésicos locales utilizados en la raquianestesia.
| Dosis (mg) A T10 | Dosis (mg) a T4 | Duración (minutos) Natural | con epinefrina | Inicio (minutos) | |
|---|---|---|---|---|---|
| De uso general Bupivacaína 0.75% | 8-12 | 14-20 | 90-110 | 100-150 | 5-8 |
| Menos comúnmente utilizado | |||||
| • Lidocaína al 5 % • Tetracaína al 0.5 % • Mepivacaína al 2 % • Ropivacaína 0.75 % • Levobupivacaína 0.5 % • Cloroprocaína al 3 % | 50-75 6-10 N/A 15-17 10-15 30 | 75-100 12-16 60-80 18-20 N/A 45 | 60-70 70-90 140-160 140-200 135-170 80-120 | 75-100 120-180 N/A N/A N/A N/A | 3-5 3-5 2-4 3-5 4-8 2-4 |
Aditivos a la Anestesia Local
Se han agregado vasoconstrictores a los anestésicos locales y se han estudiado tanto la epinefrina como la fenilefrina. La anestesia se intensifica y prolonga con dosis más pequeñas de anestésicos locales cuando se agrega epinefrina o fenilefrina. Se produce vasoconstricción tisular, limitando así la reabsorción sistémica del anestésico local y prolongando la duración de la acción al mantener el anestésico local en contacto con las fibras nerviosas. Sin embargo, pueden ocurrir complicaciones isquémicas después del uso de vasoconstrictores en la anestesia espinal. En algunos estudios, la epinefrina fue implicada como la causa del CES debido a la isquemia de la arteria espinal anterior. Independientemente, muchos estudios no demuestran una asociación entre el uso de vasoconstrictores para la anestesia espinal y la incidencia de CES. Se ha demostrado que la fenilefrina aumenta el riesgo de TNS y puede disminuir la altura del bloqueo nervioso.
Se cree que la epinefrina funciona al disminuir la absorción del anestésico local y, por lo tanto, prolongar el bloqueo espinal de algunos anestésicos locales. Sin embargo, los vasoconstrictores pueden causar isquemia, y existe una preocupación teórica de isquemia de la médula espinal cuando se agrega epinefrina a los anestésicos espinales. Los modelos animales no han mostrado ninguna disminución en el flujo sanguíneo de la médula espinal o un aumento en la isquemia de la médula espinal cuando se administra epinefrina para el bloqueo espinal, aunque existen algunas complicaciones neurológicas asociadas con la adición de epinefrina.
Consejos NYSORA
• La adición de 0.1 ml de epinefrina 1:1000 a 10 ml de anestésico local produce una concentración de epinefrina de 1:100,000 XNUMX.
• Agregar 0.1 mL de epinefrina 1:1000 a 20 mL de anestésico local produce una concentración de 1:200,000 y así sucesivamente (0.1 mL en 30 mL = 1:300,000).
La dilución de epinefrina con anestésico local es una fuente potencial de error de medicamentos, con errores potencialmente incorrectos por un factor de 10 o 100. Si se usa epinefrina envasada como 1 mg en 1 ml, que es una solución 1:1000, se puede aplicar una regla simple. seguido. Agregar 0.1 ml de epinefrina a 10 ml de anestésico local produce una concentración de epinefrina de 1:100,000 0.1. Agregar 20 ml de epinefrina a 1 ml de anestésico local produce una concentración de 200,000:0.1 30, y así sucesivamente (1 ml en 300,000 ml = XNUMX:XNUMX XNUMX).
La epinefrina prolonga la duración de la anestesia espinal. En el pasado, se pensaba que la epinefrina no tenía ningún efecto sobre la bupivacaína espinal hiperbárica usando regresión de dos segmentos para probar el bloqueo neural. Sin embargo, otro estudio mostró que la epinefrina prolonga la duración de la bupivacaína espinal hiperbárica cuando se utilizaron pinchazos, estimulación nerviosa eléctrica transcutánea (TENS) equivalente a la estimulación quirúrgica y tolerancia de un torniquete neumático en el muslo para determinar el bloqueo neural. Existe controversia con respecto a la prolongación del bloqueo neural de bupivacaína espinal cuando se agrega epinefrina. La misma controversia existe sobre la prolongación de la lidocaína espinal con epinefrina.
Los cuatro tipos de receptores opioides se encuentran en el asta dorsal de la médula espinal y sirven como objetivo para la inyección intratecal de opioides. Los receptores están ubicados en las neuronas de la médula espinal y en las terminales de las fibras aferentes que se originan en el ganglio de la raíz dorsal.
Se han utilizado fentanilo, sufentanilo, meperidina y morfina por vía intratecal. Los efectos secundarios que se pueden observar incluyen prurito, náuseas y vómitos y depresión respiratoria.
Los agonistas adrenérgicos α2 se pueden agregar a las inyecciones espinales de anestésicos locales para mejorar el alivio del dolor y prolongar el bloqueo de los nervios sensoriales y motores. Se ha demostrado una analgesia posoperatoria mejorada en partos por cesárea, fijación de fracturas femorales y artroscopias de rodilla cuando se agrega clonidina a la solución anestésica local. La clonidina prolonga el bloqueo sensorial y motor de un anestésico local después de la inyección espinal.
Se cree que el bloqueo sensorial está mediado por mecanismos presinápticos y postsinápticos. La clonidina induce hiperpolarización en el asta ventral de la médula espinal y facilita la acción del anestésico local, prolongando así el bloqueo motor cuando se usa como aditivo. Sin embargo, cuando se usa sola en inyecciones intratecales, la clonidina no causa bloqueo ni debilidad del nervio motor. Los efectos secundarios pueden ocurrir con el uso de clonidina espinal e incluyen hipotensión, bradicardia y sedación. La clonidina neuroaxial se ha utilizado para el tratamiento del dolor intratable.
Los inhibidores de la acetilcolinesterasa previenen la descomposición de la acetilcolina y producen analgesia cuando se inyectan por vía intratecal. Los efectos antinociceptivos se deben al aumento de la acetilcolina y la generación de óxido nítrico. Se ha demostrado en un modelo de rata que la neuropatía diabética puede aliviarse después de la inyección intratecal de neostigmina.222 Los efectos secundarios de la neostigmina intratecal incluyen náuseas y vómitos, bradicardia que requiere atropina, ansiedad, agitación, inquietud y debilidad en las extremidades inferiores. Aunque la neostigmina espinal proporciona un control prolongado del dolor, los efectos secundarios que se producen no permiten su uso generalizado.
FARMACODINÁMICA DE LA ANESTESIA ESPINAL
La farmacodinámica de la inyección espinal de anestesia local es amplia. Las consecuencias de los efectos cardiovasculares, respiratorios, gastrointestinales, hepáticos y renales de la anestesia espinal se discuten a continuación.
Efectos cardiovasculares de la anestesia espinal
Es bien sabido que la anestesia espinal produce hipotensión. De hecho, un grado de hipotensión a menudo tranquiliza al anestesiólogo de que el bloqueo del nervio es realmente espinal. Sin embargo, la hipotensión puede causar náuseas y vómitos, isquemia de órganos críticos, colapso cardiovascular y, en el caso de la madre embarazada, puede poner en peligro al feto. Históricamente, ha habido cambios en las definiciones, los mecanismos sugeridos y el manejo de la hipotensión.
Definir la hipotensión es problemático. Un estudio encontró 15 definiciones diferentes de hipotensión en 63 publicaciones. Algunas definiciones utilizaron un solo criterio (disminución del 80% desde el inicio), mientras que otras usaron combinaciones (una caída del 80% desde el inicio o una presión arterial sistólica inferior a 100 mmHg). La incidencia de hipotensión en una única cohorte de pacientes varió del 7.4% al 74.1% según la definición utilizada.
Se han sugerido muchos mecanismos para la hipotensión inducida por anestesia espinal, incluidos los efectos circulatorios directos de los anestésicos locales, insuficiencia suprarrenal relativa, parálisis del músculo esquelético, bloqueo del nervio vasomotor medular ascendente e insuficiencia respiratoria concurrente. Sin embargo, el insulto principal es el bloqueo del nervio simpático preganglionar producido por la anestesia espinal. Por lo tanto, se deduce que debido a que la altura del bloqueo nervioso determina la extensión del bloqueo simpático, esto a su vez determina la cantidad de cambio en los parámetros cardiovasculares. Sin embargo, esta relación no se puede predecir. El bloqueo del nervio simpático puede ser variable entre dos y seis dermatomas por encima del nivel sensorial e incompleto por debajo de este nivel. El bloqueo nervioso simpático repentino con anestesia espinal da poco tiempo para la compensación cardiovascular, lo que puede explicar un bloqueo nervioso simpático similar con anestesia epidural, pero menos hipotensión.
Consejos NYSORA
• La anestesia espinal bloquea los nervios de la cadena simpática, que es el principal mecanismo de cambios cardiovasculares.
• La altura del bloqueo nervioso determina el nivel de bloqueo simpático, que determina el grado de cambio en los parámetros cardiovasculares.
El bloqueo del nervio simpático causa hipotensión a través de sus efectos sobre la precarga, la poscarga, la contractilidad y la frecuencia cardíaca, en otras palabras, los determinantes del gasto cardíaco (GC), y por la disminución de la resistencia vascular sistémica (SVR). La precarga disminuye por la venodilatación mediada por el bloqueo del nervio simpático, lo que provoca acumulación de sangre en la periferia y disminución del retorno venoso. Durante el bloqueo de los nervios simpáticos, el sistema venoso se vasodilata al máximo y, por lo tanto, depende de la gravedad para devolver la sangre al corazón. Por lo tanto, el posicionamiento de la paciente y la compresión aortocava en el caso de un útero grávido influye notablemente en el retorno venoso durante la raquianestesia.
El tono vasomotor arterial también puede disminuir mediante el bloqueo del nervio simpático, la disminución de la RVS y la poscarga. La vasodilatación arterial, a diferencia de la venodilatación, no es máxima después del bloqueo raquídeo y el músculo liso vascular sigue conservando cierto tono autónomo después de la denervación simpática. Este tono vascular residual puede perderse en presencia de hipoxia y acidosis, lo que puede explicar el colapso cardiovascular después de la anestesia espinal alta sin apoyo cardiorrespiratorio. Aunque hay vasodilatación por debajo del nivel del bloqueo espinal, hay una vasoconstricción compensatoria por encima, mediada por barorreceptores carotídeos y del arco aórtico. Esto es importante por dos razones. En primer lugar, el bloqueo a niveles dermatómicos más altos puede resultar en una menor compensación. En segundo lugar, el uso de fármacos vasodilatadores como el trinitrato de glicerilo (GTN), el nitroprusiato de sodio o los anestésicos volátiles pueden anular este mecanismo compensatorio y empeorar la hipotensión o incluso provocar un paro cardíaco.
Puede haber un aumento inicial en el CO asociado con una poscarga disminuida. Alternativamente, el CO puede caer debido a la disminución de la precarga. Algunos estudios han demostrado que el CO no cambia o se reduce ligeramente durante el inicio de la anestesia espinal. Otros, en pacientes de edad avanzada, han mostrado un cambio bifásico en el GC con un aumento inicial en los primeros 7 minutos, seguido de una caída (Figura 8 y XNUMX). Esto puede atribuirse a una caída en la poscarga que precede a una caída en la precarga.
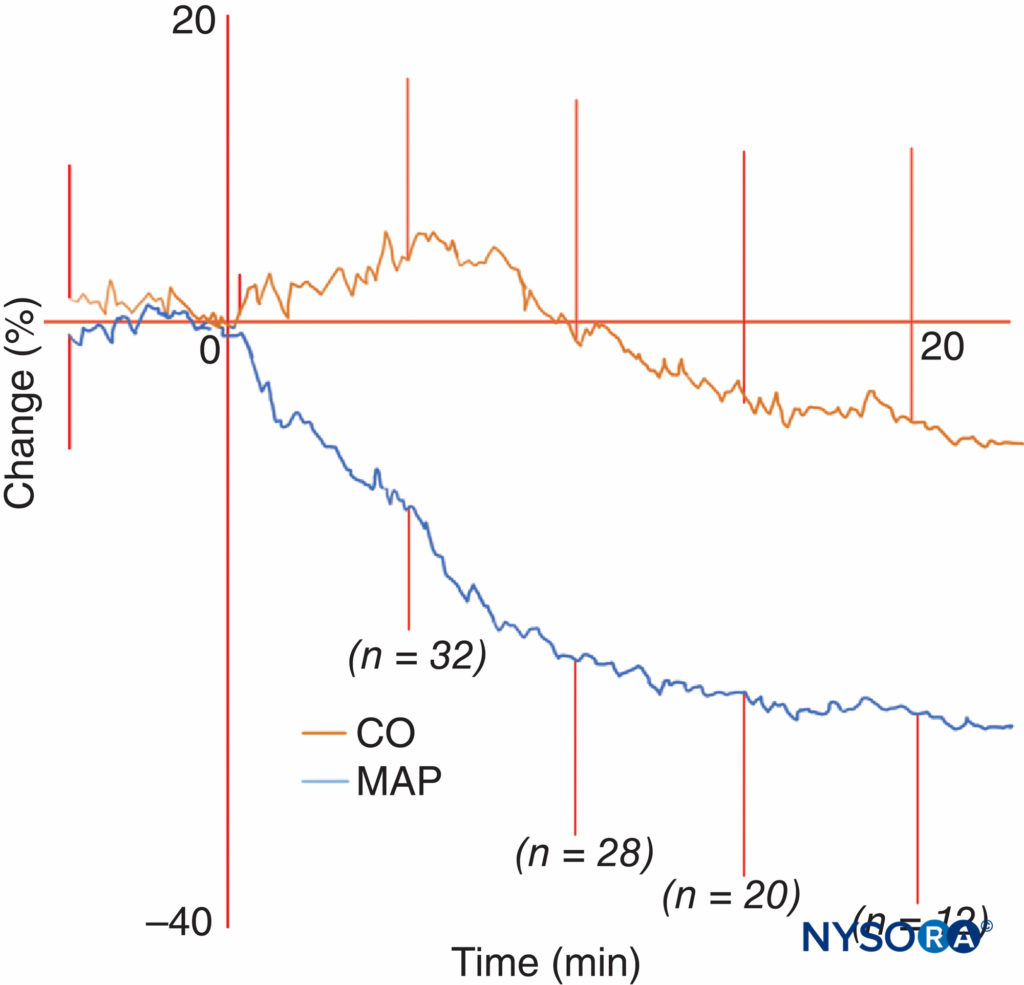
FIGURA 8. Figura del trabajo de Meyhoff et al que muestra una caída en la presión arterial media (PAM) y el gasto cardíaco (GC) bifásico después de la anestesia espinal. Cambios promedio de CO y MAP más o menos la desviación estándar durante el inicio de la anestesia espinal en pacientes de edad avanzada. La inyección subaracnoidea se administra en el tiempo = 0 minutos. Después de finalizar la recopilación de datos, el último registro de CO y MAP aún se representa en el promedio a lo largo del resto del gráfico. Por lo tanto, cada línea es hipotética ya que consta de promedios de 32 pacientes incluso después de la finalización de los datos; esto se hace solo con fines ilustrativos. (Reproducido con permiso de Meyhoff CS, Hesselbjerg L, Koscielniak-Nielsen Z, et al: Biphasic cardiac output changes during inicio of espinal anestésico en pacientes ancianos. Eur J Anaesthesiol. 2007 Sep;24(9):770-775.)
La contractilidad puede verse afectada por el bloqueo de los nervios simpáticos torácicos superiores. Curiosamente, un estudio que investigó el fenómeno común de la depresión del segmento ST en mujeres sanas sometidas a cesárea (25-60 %) encontró que la depresión del ST estaba asociada con un estado contráctil hipercinético.
El efecto de la anestesia espinal en la FC es complejo. La frecuencia cardíaca puede aumentar (secundaria a la hipotensión a través del reflejo de los barorreceptores) o disminuir (ya sea por el bloqueo del nervio simpático de las fibras aceleradoras cardíacas que se originan en los segmentos espinales T1-T4, o por el reflejo de Bainbridge inverso). El reflejo de Bainbridge inverso es una disminución de la FC debido a la disminución del retorno venoso, detectado por los receptores de estiramiento en la aurícula derecha, y es más débil que el reflejo barorreceptor. El reflejo de Bezold-Jarisch (BJR) es otro reflejo que disminuye la FC. El BJR ha sido implicado como causa de bradicardia, hipotensión y colapso cardiovascular después de la anestesia neuroaxial central, en particular la anestesia espinal.
El BJR es un reflejo cardioinhibidor y por lo general no es un reflejo dominante. La asociación con la anestesia espinal es probablemente débil. Se ha culpado al BJR de bradicardia después de la anestesia espinal, especialmente después de una hemorragia. Las contracciones vigorosas de un corazón poco lleno pueden iniciar el BJR. Esto es más probable con el uso de efedrina en lugar de fenilefrina.
Los pacientes jóvenes y sanos (clase 1 de la Sociedad Estadounidense de Anestesiólogos) tienen un mayor riesgo de bradicardia. El uso de betabloqueantes también aumenta el riesgo de bradicardia. La incidencia de bradicardia en la población no embarazada es de alrededor del 13%. Aunque la bradicardia suele tolerarse bien, se pueden producir asistolia y bloqueos de los nervios cardíacos de segundo y tercer grado, por lo que es aconsejable estar atento al controlar a un paciente después de la anestesia raquídea y tratarlo de inmediato.
Los factores de riesgo asociados con la hipotensión incluyen hipovolemia, hipertensión preoperatoria, altura elevada del bloqueo nervioso sensorial, edad mayor de 40 años, obesidad, anestesia combinada general y espinal, consumo crónico de alcohol, IMC elevado y urgencia de cirugía no obstétrica. La hipotensión es menos probable en las mujeres que están en trabajo de parto en comparación con las que se someten a una cesárea electiva. Consulte Anestesia Regional y Enfermedad Cardiovascular.
Manejo de la hipotensión después de la anestesia espinal
Cambio de creencias Las creencias cambiantes en la base teórica de la hipotensión inducida por la columna se han reflejado en los cambios en el tratamiento. Por ejemplo, si se cree que la disminución de la precarga es de importancia primordial, entonces el posicionamiento y la fluidoterapia son los tratamientos de elección y, de manera similar, si la vasodilatación es la culpable, entonces un vasoconstrictor debe ser la primera línea. Esto ha llevado a un debate vigoroso. En la década de 1970, se sugirió no administrar vasopresores hasta que se utilizaran “todos los demás métodos para combatir la hipotensión”, subrayando la importancia de la precarga. La evidencia para respaldar esto se extrapoló de estudios defectuosos en ovejas preñadas sometidas a anestesia general, que sugirieron que los vasopresores afectaron negativamente la circulación uteroplacentaria. El título vasopresor de elección también ha generado mucha controversia. La efedrina se denominaba tradicionalmente porque preservaba el flujo sanguíneo uterino (en los estudios con animales antes mencionados). El trabajo de Ngan Kee, entre otros, ha sugerido que la fenilefrina puede ser el vasopresor de elección, al menos en el entorno obstétrico electivo.
Manejo El manejo de la hipotensión después de la anestesia espinal debe incluir monitoreo frecuente (inicialmente cada minuto) de la presión arterial, además de electrocardiograma (ECG), saturación de oxígeno y monitoreo fetal en el caso de una paciente embarazada. Se debe considerar la monitorización invasiva de la presión arterial si el paciente tiene comorbilidades cardíacas significativas. La fluidoterapia debe usarse en un paciente deshidratado para restaurar el volumen antes de comenzar la anestesia espinal.
Los métodos no farmacológicos para tratar la hipotensión incluyen posicionamiento, compresión de piernas y desplazamiento uterino. La posición de Trendelenburg puede aumentar el retorno venoso al corazón.
Esta posición no debe exceder los 20° porque el Trendelenburg extremo puede conducir a una disminución de la perfusión cerebral y del flujo sanguíneo debido al aumento de la presión venosa yugular. Si el nivel de anestesia espinal no es fijo, la posición de Trendelenburg puede alterar el nivel de anestesia espinal y causar un alto nivel de anestesia espinal en pacientes que reciben soluciones anestésicas locales hiperbáricas.
Esto se puede minimizar levantando la parte superior del cuerpo con una almohada debajo de los hombros mientras se mantiene la parte inferior del cuerpo elevada por encima del nivel del corazón. Una revisión Cochrane en mujeres embarazadas encontró que la compresión de las extremidades inferiores tiene algún beneficio, aunque los diferentes métodos tienen eficacias variables. Debe evitarse la compresión aortocava de un útero grávido. La posición lateral completa da como resultado menos hipotensión que la inclinación lateral izquierda, aunque esto puede no ser práctico. Se puede usar una cuña debajo de la cadera derecha o una mesa basculante para lograr la inclinación lateral izquierda. Sin embargo, se desconoce el grado óptimo de inclinación y puede haber una variabilidad considerable entre diferentes pacientes.
Ha habido opiniones contradictorias sobre el manejo apropiado de líquidos durante la anestesia espinal. Los primeros estudios sugirieron que la "precarga" de cristaloides antes del bloqueo espinal era efectiva. El trabajo más reciente mostró un efecto mínimo de precarga. La precarga de coloides parece ser efectiva, aunque esto debe equilibrarse con el riesgo de reacciones alérgicas y mayores costos. La “cocarga” (administración rápida de líquido inmediatamente después de la anestesia espinal) con cristaloides es mejor que la precarga para prevenir la hipotensión.
La hipotensión se puede limitar reduciendo la dosis del anestésico local espinal. Una revisión encontró que 5 a 7 mg de bupivacaína son suficientes para la cesárea. Sin embargo, el bloqueo nervioso motor completo fue raro, la duración fue limitada y fue esencial un catéter epidural para las dosis de refuerzo tempranas. Un metanálisis en 2011 encontró que las dosis más bajas de bupivacaína se asociaron con una eficacia anestésica más baja pero con menos hipotensión y náuseas.
Existen opiniones contradictorias con respecto al vasopresor de elección para la hipotensión inducida por la médula espinal. La efedrina y la fenilefrina han sido los dos principales contendientes; sin embargo, se han utilizado otros. La efedrina es un agonista directo e indirecto de los receptores α y β. Se consideró que era más seguro que la fenilefrina porque limitaba la vasoconstricción de la circulación uteroplacentaria en los primeros estudios con animales. Sin embargo, la efedrina tiene un inicio de acción lento, está sujeta a taquifilaxia y tiene una eficacia limitada en el tratamiento de la hipotensión. Más preocupante es el aumento del riesgo de acidosis fetal. No se sabe si esto se traduce en peores resultados clínicos.
La fenilefrina es un agonista directo del receptor α1. Se utilizó con éxito en la década de 1960 para la anestesia raquídea en Nueva York, pero cayó en desgracia debido a la preocupación por la mala perfusión de los tejidos. En particular, se observó vasoconstricción uteroplacentaria en modelos animales preñados (algo defectuosos). Trabajos recientes han demostrado que la acidosis fetal no ocurre cuando se usan las dosis habituales. Además, la fenilefrina parece superior a la efedrina para reducir la hipotensión y las náuseas. La fenilefrina se ha utilizado como bolo o como infusión y se ha utilizado para tratar la hipotensión de forma profiláctica y reactiva.Tabla 9).
Los regímenes de dosificación óptimos aún no se han establecido. Ngan Kee previno de manera efectiva la hipotensión en pacientes obstétricas electivas mediante el uso de una combinación de cocarga cristaloide con una infusión profiláctica de fenilefrina.
La fenilefrina es el vasopresor actual de elección para la hipotensión espinal, al menos en el entorno obstétrico electivo. Hay, sin embargo, inconvenientes. Primero, la fenilefrina da como resultado una disminución del CO, aunque la importancia de esto es incierta. En segundo lugar, se ha demostrado que la fenilefrina intravenosa disminuye la altura del bloqueo del nervio espinal en pacientes embarazadas y no embarazadas. En tercer lugar, Cooper se refirió a dos informes de casos de crisis hipertensivas que involucraron fenilefrina y atropina, lo que resultó en una morbilidad significativa. Se sugiere que la hipertensión inducida por vasopresores está limitada por una disminución refleja de la FC. Por lo tanto, la atropina, en este contexto, puede provocar una crisis hipertensiva. Finalmente, la presentación habitual de fenilefrina es altamente concentrada (10 mg/mL) y debe diluirse en una bolsa de 100 mL de solución salina (100 μg/mL). Los anestesiólogos más familiarizados con la efedrina pueden encontrar esto tedioso o, peor aún, pueden cometer un error de concentración del fármaco. Además, como en un caso habitual se requiere mucho menos de una bolsa de fenilefrina de 100 ml, existe el riesgo de contaminación cruzada si se reutilizan las bolsas. El colapso cardiovascular puede ocurrir después de la anestesia espinal, aunque es un evento raro. Auroy y colaboradores informaron 9 paros cardíacos en 35,439 XNUMX anestésicos espinales realizados. La bradicardia suele preceder al paro cardiaco y está justificado el tratamiento temprano y agresivo de la bradicardia. El tratamiento de la bradicardia incluye atropina, efedrina y epinefrina intravenosas. En casos de paro cardíaco después de la anestesia espinal, la epinefrina debe usarse temprano y debe iniciarse el protocolo de soporte vital cardíaco avanzado (ACLS). Se requiere más trabajo sobre la hipotensión inducida por la columna.
Aunque el tratamiento suele estar dirigido a la presión arterial sistólica, la presión arterial media puede ser un mejor objetivo.
También pueden dirigirse a diferentes receptores. Por ejemplo, se ha demostrado que el ondansetrón intravenoso profiláctico reduce la hipotensión, tal vez al modular el BJR. Diferentes subpoblaciones de pacientes pueden requerir diferentes terapias. La mayor parte de la evidencia se relaciona con el entorno obstétrico saludable y electivo, y queda por ver hasta qué punto esto se puede extrapolar a otros grupos. Por último, a pesar de la evidencia publicada de los beneficios de la fenilefrina sobre la efedrina para la cesárea electiva, hay renuencia a cambiar la práctica. Es necesario abordar las barreras psicológicas e institucionales para el cambio.
Efectos respiratorios de la anestesia espinal
En pacientes con fisiología pulmonar normal, la anestesia espinal tiene poco efecto sobre la función pulmonar. Los volúmenes pulmonares, la ventilación por minuto en reposo, el espacio muerto, las tensiones de gases en sangre arterial y la fracción de derivación muestran cambios mínimos después de la anestesia espinal. El principal efecto respiratorio de la anestesia espinal ocurre durante el bloqueo espinal alto cuando la exhalación activa se ve afectada debido a la parálisis de los músculos abdominales e intercostales. Durante el bloqueo espinal alto, se reducen el volumen de reserva espiratorio, el flujo espiratorio máximo y la ventilación máxima por minuto. Los pacientes con enfermedad pulmonar obstructiva que dependen del uso de músculos accesorios para una ventilación adecuada deben ser monitoreados cuidadosamente después del bloqueo espinal. Los pacientes con función pulmonar normal y un bloqueo del nervio espinal alto pueden quejarse de disnea, pero si pueden hablar claramente con una voz normal, la ventilación suele ser adecuada. La disnea suele deberse a la incapacidad de sentir el movimiento de la pared torácica durante la respiración, y la simple seguridad suele ser eficaz para aliviar la angustia del paciente.
Consejos NYSORA
• Las mediciones de gases en sangre arterial no cambian durante la anestesia raquídea alta en pacientes que respiran espontáneamente el aire de la habitación.
• Debido a que una espina dorsal alta generalmente no afecta el área cervical, se preserva el nervio frénico y se produce una función diafragmática normal, y la inspiración se ve mínimamente afectada.
Las mediciones de gases en sangre arterial no cambian durante la anestesia raquídea alta en pacientes que respiran espontáneamente aire ambiente. El principal efecto de la anestesia raquídea alta es sobre la espiración, ya que los músculos de la exhalación se ven afectados. Debido a que una espina dorsal alta por lo general no afecta el área cervical, se preserva el nervio frénico y se produce una función diafragmática normal, y la inspiración se ve mínimamente afectada. Aunque Steinbrook y sus colegas encontraron que la anestesia espinal no se asoció con cambios significativos en la capacidad vital, la presión inspiratoria máxima o la PCO2 espiratoria final en reposo, se observó un aumento de la respuesta ventilatoria al CO2 con la anestesia espinal con bupivacaína. Consulte Anestesia Regional y Enfermedad Sistémica.
Efectos gastrointestinales de la anestesia espinal
La inervación simpática de los órganos abdominales surge de T6 a L2. Debido al bloqueo simpático y la actividad parasimpática sin oposición después del bloqueo espinal, las secreciones aumentan, los esfínteres se relajan y el intestino se contrae.
El aumento de la actividad vagal después del bloqueo del nervio simpático provoca un aumento del peristaltismo del tracto gastrointestinal, lo que puede provocar náuseas. Las náuseas también pueden deberse a isquemia intestinal inducida por hipotensión, que produce serotonina y otras sustancias emetogénicas. La incidencia de IONV en cirugía no obstétrica puede ser de hasta el 42% y puede llegar al 80% en las parturientas.
Efectos hepáticos y renales de la anestesia espinal
El flujo sanguíneo hepático se correlaciona con el flujo sanguíneo arterial. No hay autorregulación del flujo sanguíneo hepático; por lo tanto, a medida que disminuye el flujo sanguíneo arterial después de la anestesia espinal, también lo hace el flujo sanguíneo hepático. Si se mantiene la presión arterial media (PAM) después de colocar un anestésico espinal, también se mantendrá el flujo sanguíneo hepático. Los pacientes con enfermedad hepática deben ser monitoreados cuidadosamente y su presión arterial debe controlarse durante la anestesia para mantener la perfusión hepática. Ningún estudio ha demostrado de manera concluyente la superioridad de la anestesia regional o general en pacientes con enfermedad hepática. En pacientes con enfermedad hepática, se puede administrar anestesia regional o general, siempre que el MAP se mantenga cerca de la línea de base.
Consejos NYSORA
• Si se mantiene la presión arterial media después de colocar un anestésico espinal, no disminuirá el flujo sanguíneo hepático ni renal.
• La anestesia espinal no altera la autorregulación del flujo sanguíneo renal.
El flujo sanguíneo renal está autorregulado. Los riñones permanecen perfundidos cuando la PAM permanece por encima de 50 mm Hg. Pueden ocurrir disminuciones transitorias en el flujo sanguíneo renal cuando la PAM es inferior a 50 mm Hg, pero incluso después de largas disminuciones en la PAM, la función renal vuelve a la normalidad cuando la presión arterial vuelve a la normalidad.
Nuevamente, la atención a la presión arterial es importante después de colocar un anestésico espinal, y el MAP debe estar lo más cerca posible de la línea de base. La anestesia espinal no afecta la autorregulación del flujo sanguíneo renal. Se ha demostrado en ovejas que la perfusión renal cambia poco después de la anestesia espinal.
FACTORES QUE AFECTAN EL NIVEL DE BLOQUEO ESPINAL
Se han sugerido muchos factores como posibles determinantes del nivel de bloqueo espinal. Las cuatro categorías principales de factores son (1) características de la solución anestésica local, (2) características del paciente, (3) técnica de bloqueo espinal y (4) difusión. Las características de la solución anestésica local incluyen baricidad, dosis, concentración y volumen inyectado. Las características del paciente incluyen edad, peso, altura, sexo, presión intraabdominal, anatomía de la columna vertebral, características del líquido cefalorraquídeo y posición del paciente. Las técnicas de bloqueo espinal incluyen el lugar de la inyección, la velocidad de la inyección, la dirección del bisel de la aguja, la fuerza de la inyección y la adición de vasoconstrictores. Aunque se ha postulado que todos estos factores afectan la propagación espinal del anestésico, no se ha demostrado que muchos cambien la distribución del bloqueo cuando todos los demás factores que afectan el bloqueo se mantienen constantes.
Sitio de inyección
El sitio de inyección de anestésicos locales para anestesia espinal puede determinar el nivel de bloqueo. En algunos estudios, la bupivacaína espinal isobárica al 0.5% produce un bloqueo sensorial que se reduce en dos dermatomas por interespacio cuando se comparan las inyecciones en los interespacios L2-L3, L3-L4 y L4-L5. Sin embargo, no existe diferencia en la altura del bloqueo nervioso cuando se inyecta bupivacaína o dibucaína hiperbárica como anestésico espinal en diferentes espacios intermedios.
Edad
Algunos estudios informaron cambios en la altura del bloqueo nervioso después de la anestesia espinal en pacientes ancianos en comparación con pacientes jóvenes, pero otros estudios no informaron diferencias en la altura del bloqueo nervioso. Estos estudios se realizaron con bupivacaína al 0.5% tanto isobárica como hiperbárica.
Consejos NYSORA
La baricidad juega un papel importante en la determinación de la altura del bloqueo nervioso después de la anestesia espinal en poblaciones de mayor edad.
La bupivacaína isobárica parece aumentar la altura del bloqueo nervioso y la bupivacaína hiperbárica no parece cambiar la altura del bloqueo nervioso con el aumento de la edad. Si existe una correlación entre el aumento de la edad y la altura de la anestesia espinal, no es lo suficientemente fuerte por sí misma para ser un predictor confiable en el entorno clínico. Al igual que con el lugar de la inyección, parece que la baricidad juega un papel importante en la determinación de la altura del bloqueo nervioso después de la anestesia espinal en poblaciones de mayor edad, y la edad no es un factor independiente.
Cargo profesional
El posicionamiento del paciente es importante para determinar el nivel de bloqueo después de la anestesia espinal hiperbárica e hipobárica, pero no para las soluciones isobáricas. Las posiciones de sentado, Trendelenburg y jackknife boca abajo pueden cambiar en gran medida la propagación del anestésico local debido al efecto de la gravedad.
Consejos NYSORA
El posicionamiento del paciente es importante para determinar el nivel de bloqueo después de la anestesia espinal hiperbárica e hipobárica, pero no para las soluciones isobáricas.
La combinación de la baricidad de la solución anestésica local y la posición del paciente determina la altura del bloqueo del nervio espinal. La posición sentada en combinación con una solución hiperbárica puede producir analgesia en el perineo. La posición de Trendelenburg también afectará la propagación de los anestésicos locales hiperbáricos e hipobáricos debido al efecto de la gravedad. La posición de navaja en decúbito prono se utiliza para procedimientos rectales, perineales y lumbares con anestesia local hipobárica. Esto evita la propagación rostral del bloqueo espinal después de la inyección.
La flexión de las caderas y las rodillas del paciente en decúbito supino aplana la lordosis lumbar y disminuye la acumulación sacra del anestésico local.
Combinado con la posición de Trendelenburg, esto puede ayudar a la propagación cefálica. Esta posición puede alcanzarse inadvertidamente cuando se coloca un catéter urinario después de la inserción espinal.
Velocidad de inyección
Se ha informado que la velocidad de inyección afecta la altura del bloqueo del nervio espinal, pero los datos disponibles en la literatura son contradictorios. En estudios que utilizaron bupivacaína isobárica, no hay diferencia en la altura del bloqueo del nervio espinal con diferentes velocidades de inyección. Aunque la altura del bloqueo del nervio espinal no cambia con la velocidad de la inyección, se debe usar una inyección suave y lenta cuando se administra un anestésico espinal. Si se aplica una inyección enérgica y la jeringa no está bien conectada a la aguja espinal, la aguja podría desconectarse de la jeringa con pérdida del anestésico local.
Consejos NYSORA
Aunque la altura del bloqueo del nervio espinal no cambia con la velocidad de la inyección, use una inyección suave y lenta cuando administre un anestésico espinal.
Volumen, concentración y dosis de anestésico local
Es difícil mantener constante el volumen, la concentración o la dosis de anestésico local sin cambiar ninguna de las otras variables; por lo tanto, es difícil producir estudios de alta calidad que investiguen estas variables por separado. Axelsson y asociados demostraron que el volumen de anestésico local puede afectar la altura y la duración del bloqueo del nervio espinal cuando se usan dosis equivalentes.
Peng y colaboradores demostraron que la concentración de anestésico local está directamente relacionada con la dosis al determinar la anestesia efectiva. Sin embargo, la dosis de anestésico local juega el papel más importante en la determinación de la duración del bloqueo del nervio espinal, ya que ni el volumen ni la concentración de bupivacaína o tetracaína isobárica alteran la duración del bloqueo del nervio espinal cuando la dosis se mantiene constante. Los estudios han demostrado repetidamente que la duración del bloqueo del nervio espinal es más prolongada cuando se administran dosis más altas de anestésico local. Al realizar un anestésico espinal, tenga en cuenta no solo la dosis de anestésico local, sino también el volumen y la concentración para que el paciente no reciba una sobredosis o una dosis insuficiente.
Consejos NYSORA
Al realizar un anestésico espinal, tenga en cuenta no solo la dosis de anestésico local, sino también el volumen y la concentración para que el paciente no reciba una sobredosis o una dosis insuficiente.
El uso de soluciones hiperbáricas minimiza la importancia de la dosis y el volumen, excepto cuando se utilizan dosis de bupivacaína hiperbárica iguales o inferiores a 10 mg. En esos casos, hay menos extensión cefálica y una duración de acción más corta. Una dosis de bupivacaína hiperbárica entre 10 y 20 mg da como resultado una altura de bloqueo nervioso similar. Cuando se utilizan soluciones hiperbáricas, es importante tener en cuenta que la posición del paciente y la baricidad son los factores más influyentes en la altura del bloqueo nervioso, excepto cuando se utilizan dosis bajas de bupivacaína hiperbárica.
EQUIPOS PARA ANESTESIA ESPINAL
Mantenimiento de la asepsia
Ninguna intervención individual garantiza la asepsia. Por lo tanto, es recomendable un enfoque múltiple.
En el pasado, la mayoría de las instituciones tenían bandejas reutilizables para anestesia espinal. Estas bandejas requerían la preparación de anestesiólogos o personal de anestesia para garantizar que no se produjera contaminación bacteriana y química. Actualmente, las bandejas espinales desechables preparadas comercialmente están disponibles y están en uso en la mayoría de las instituciones. Estas bandejas son portátiles, estériles y fáciles de usar. Figura 9 muestra el contenido de una bandeja de anestesia espinal estándar preparada comercialmente.
La solución ideal para la preparación de la piel debe ser bactericida y tener un efecto rápido y una larga duración. La clorhexidina es superior a la povidona yodada en todos estos aspectos. Además, el agente ideal no debe ser neurotóxico. Desafortunadamente, los agentes bactericidas son neurotóxicos. Por lo tanto, es prudente usar la concentración efectiva más baja y dejar que la preparación se seque. Aunque está sujeto a debate, algunos grupos recomiendan actualmente clorhexidina al 0.5 % en alcohol al 70 %. En teoría, la contaminación del equipo con la preparación de la piel puede dar lugar a la introducción de sustancias neurotóxicas en el tejido neural. Más preocupante es la inyección neuroaxial accidental de solución antiséptica, posiblemente debido a que la solución antiséptica y el anestésico local se colocaron en recipientes adyacentes. Por lo tanto, después de la preparación de la piel, el antiséptico no utilizado debe desecharse antes de comenzar el procedimiento (y los medicamentos intratecales deben extraerse directamente de ampollas estériles). Las soluciones antisépticas coloreadas pueden disminuir la probabilidad de error de medicamento y permitir una fácil identificación de la piel perdida durante la aplicación.
Es difícil demostrar un beneficio de las medidas individuales de control de infecciones debido a la rareza de las complicaciones infecciosas. La evidencia pasada ha sido contradictoria. Por ejemplo, se ha sugerido que puede ocurrir el desprendimiento de escamas de la piel por el “movimiento” de la máscara, lo que aumenta la contaminación bacteriana. Sin embargo, en 1995 hubo llamados para el uso rutinario de máscaras faciales después de que se demostró inequívocamente, utilizando la reacción en cadena de la polimerasa (PCR, por sus siglas en inglés), que un caso de meningitis por Streptococcus salivarius se originó en la garganta del médico que había realizado una punción lumbar.
Creemos firmemente que el uso de máscaras faciales debe ser obligatorio al realizar la anestesia espinal. Un consejo de práctica de la Sociedad Estadounidense de Anestesia Regional y Medicina del Dolor (ASRA) de 2006 recomendó el uso de máscaras además de quitarse las joyas, lavarse bien las manos y guantes quirúrgicos estériles para todas las técnicas de anestesia regional.
Los principales componentes de una técnica aséptica también incluían un gorro quirúrgico y vendas estériles. Otros organismos profesionales internacionales tienen pautas similares.
Los antibióticos profilácticos son innecesarios para la anestesia espinal. Si, como sucede, se requiere profilaxis antibiótica para la prevención de la infección del sitio quirúrgico, puede ser prudente administrar antibióticos antes de la inserción de una aguja espinal.
Se remite al lector Control de Infecciones en Anestesia Regional para obtener más información.
Reanimación y Monitoreo
El equipo de reanimación debe estar disponible siempre que se realice una anestesia espinal. Esto incluye el equipo y los medicamentos necesarios para asegurar las vías respiratorias, proporcionar ventilación y apoyar la función cardíaca. Todos los pacientes que reciben anestesia espinal deben tener una vía intravenosa.
El paciente debe ser monitoreado durante la colocación del anestésico espinal con un oxímetro de pulso, manguito de presión arterial y ECG. La monitorización fetal debe utilizarse en el caso de una paciente embarazada. La presión arterial no invasiva debe medirse inicialmente a intervalos de 1 minuto, ya que la hipotensión puede ser repentina.
Los escalofríos y el hábito corporal pueden dificultar la medición no invasiva de la presión arterial. Se debe considerar la monitorización invasiva de la presión arterial si el paciente tiene una enfermedad cardiovascular importante.
Agujas
Se han desarrollado agujas de diferentes diámetros y formas para la anestesia espinal. Los que se usan actualmente tienen un estilete removible ajustado, que evita que la piel y el tejido adiposo tapen la aguja y posiblemente ingresen al espacio subaracnoideo. Figura 10 y XNUMX muestra los diferentes tipos de agujas utilizadas junto con el tipo de punta al final de la aguja.
Las agujas con punta de lápiz (Sprotte y Whitacre) tienen un bisel redondeado no cortante con una punta sólida. La abertura está ubicada en el costado de la aguja, 2 a 4 mm proximal a la punta de la aguja. Las agujas con biseles de corte incluyen las agujas Quincke y Pitkin. La aguja Quincke tiene una punta afilada con una aguja cortante de longitud media, y la Pitkin tiene una punta afilada y un bisel corto con bordes cortantes. Finalmente, la aguja espinal de Greene tiene una punta redondeada y un bisel no cortante redondeado. Si se va a colocar un catéter espinal continuo, se puede usar una aguja Tuohy para encontrar el espacio subaracnoideo antes de colocar el catéter.
Las agujas con punta de lápiz brindan una mejor sensación táctil de las capas de ligamento encontradas, pero requieren más fuerza para insertarse que las agujas con punta biselada. El bisel de la aguja debe dirigirse longitudinalmente para disminuir la incidencia de CPPD.
Las agujas de calibre pequeño y las agujas con biseles redondeados que no cortan también disminuyen la incidencia de CPPD, pero se desvían más fácilmente que las agujas de calibre más grande. Se remite al lector Anatomía ultraestructural de las meninges espinales y estructuras relacionadas y Dolor de cabeza por punción dural.
Consejos NYSORA
• Las agujas con punta de lápiz brindan una mejor sensación táctil de las capas de ligamento encontradas, pero requieren más fuerza para insertarse que las agujas con punta biselada.
• El uso de introductores ayuda a prevenir el paso de contaminantes epidérmicos al LCR.
Los introductores se han diseñado para ayudar con la colocación de agujas espinales en el espacio subaracnoideo debido a la dificultad de dirigir agujas de pequeño calibre a través de los tejidos. Los introductores también sirven para prevenir la contaminación del LCR con pequeños fragmentos de epidermis, lo que podría conducir a la formación de tumores dermoides de la médula espinal. El introductor se coloca en el ligamento interespinoso en la dirección deseada de la aguja espinal, y luego la aguja espinal se coloca a través del introductor.
POSICIÓN DEL PACIENTE
El posicionamiento adecuado del paciente para la anestesia espinal es esencial para un bloqueo nervioso rápido y exitoso. Se ha demostrado que es un predictor independiente para el primer intento exitoso de bloqueo del nervio neuroaxial.316 Muchos factores entran en juego para el posicionamiento del paciente. Antes de comenzar el procedimiento, tanto el paciente como el anestesiólogo deben estar cómodos. Esto incluye colocar la mesa de operaciones a la altura de la mesa de operaciones, proporcionar mantas o cobertores adecuados para el paciente, garantizar una temperatura ambiente cómoda y proporcionar sedación al paciente si es necesario. El personal capacitado para posicionar a los pacientes es invaluable y los dispositivos comerciales de posicionamiento pueden ser útiles.
Del Compendio de Anestesia Regional: Posicionamiento para la anestesia espinal de un paciente con un índice de masa corporal grande.
Al proporcionar sedación, es importante evitar la sedación excesiva. El paciente debe poder cooperar antes, durante y después de la administración del anestésico espinal. Hay tres posiciones principales para administrar un anestésico espinal: decúbito lateral, sentado y en decúbito prono.
Posición de decúbito lateral
Una posición comúnmente utilizada para colocar un anestésico espinal es la posición de decúbito lateral. El posicionamiento ideal consiste en tener la espalda del paciente paralela al borde de la cama más cercana al anestesiólogo, con las rodillas del paciente flexionadas hacia el abdomen y el cuello flexionado. Figura 11 y XNUMX muestra a un paciente en decúbito lateral.
Es beneficioso tener un asistente para ayudar a sostener y animar al paciente a permanecer en esta posición. Según el lugar de la operación y la posición de la misma, se puede inyectar una solución hipobárica, iso o hiperbárica de anestésico local.
Consejos NYSORA
• Una posición comúnmente utilizada para colocar un anestésico espinal es la posición de decúbito lateral.
• La posición ideal consiste en tener la espalda del paciente paralela al borde de la cama más cercana al anestesiólogo, las rodillas flexionadas hacia el abdomen y el cuello flexionado.
Posición sentada y “Bloqueo nervioso en silla de montar”
Estrictamente hablando, la posición sentada se utiliza mejor para la anestesia lumbar o sacra baja y en los casos en que el paciente es obeso y hay dificultad para encontrar la línea media. En la práctica, sin embargo, muchos anestesiólogos prefieren la posición sentada en todos los pacientes que pueden colocarse de esta manera. La posición sentada evita la potencial rotación de la columna que puede ocurrir con la posición de decúbito lateral. Usar un taburete como reposapiés y una almohada para que el paciente lo sostenga puede ser valioso en esta posición. El paciente debe flexionar el cuello y empujar la parte inferior de la espalda para abrir los espacios intervertebrales lumbares. Figura 12 y XNUMX representa a un paciente en posición sentada, y el espacio intermedio L4-L5 está marcado.
Al realizar un "bloqueo del nervio en silla de montar", el paciente debe permanecer sentado durante al menos 5 minutos después de colocar un anestésico espinal hiperbárico para permitir que el anestésico espinal se asiente en esa región. Si es necesario un nivel más alto de bloqueo, se debe colocar al paciente en decúbito supino inmediatamente después de la colocación de la columna y ajustar la mesa en consecuencia.
Consejos NYSORA
• La posición sentada se utiliza para la anestesia lumbar o sacra baja y en los casos en que el paciente es obeso y hay dificultad para encontrar la línea media en la posición lateral.
• Al realizar un bloqueo del nervio en silla de montar, el paciente debe permanecer sentado durante al menos 5 minutos después de colocar un anestésico espinal hiperbárico para permitir que la columna se asiente en esa región.
Posición prona
La posición boca abajo se puede utilizar para la inducción de la anestesia espinal si el paciente necesita estar en esta posición para la cirugía, como procedimientos rectales, perineales o lumbares. Se prefiere una solución hipobárica o isobárica de anestésico local en la posición de bisturí para estos procedimientos. Esto evita la propagación rostral del anestésico local y disminuye el riesgo de anestesia espinal alta.
Consejos NYSORA
La posición boca abajo se utiliza para la anestesia espinal si el paciente necesita estar en esta posición para la cirugía, como procedimientos rectales, perineales o lumbares.
Otra solución, menos elegante, es inyectar una solución hiperbárica de anestésico local con el paciente en posición sentada y esperar hasta que la anestesia raquídea “haga efecto”, que suele ser de 15 a 20 minutos después de la inyección. Luego se coloca al paciente en decúbito prono con vigilancia vigilante, incluida la comunicación verbal frecuente con el paciente.
TÉCNICA DE PUNCIÓN LUMBAR
Al realizar una anestesia raquídea, se deben colocar monitores apropiados y se debe disponer fácilmente de equipos de reanimación y vías respiratorias. Todo el equipo para el bloqueo espinal debe estar listo para usarse y todos los medicamentos necesarios deben prepararse antes de colocar al paciente para la anestesia espinal. La preparación adecuada para la columna reduce la cantidad de tiempo necesario para realizar el bloqueo nervioso y ayuda a que el paciente se sienta cómodo.
El posicionamiento adecuado es la clave para que la anestesia espinal sea rápida y exitosa. Una vez que el paciente está correctamente posicionado, se debe palpar la línea media. Se palpan las crestas ilíacas y se dibuja una línea entre ellas para encontrar el cuerpo de L4 o el espacio intermedio L4-L5. Se pueden identificar otros espacios intermedios, dependiendo de dónde se inserte la aguja.
La piel debe limpiarse con una solución para la preparación de la piel, como clorhexidina al 0.5 %, y el área debe cubrirse con paños estériles. La solución para la preparación de la piel debe dejarse secar y la solución para la preparación de la piel no utilizada debe retirarse del espacio de trabajo del anestesiólogo. Se inyecta una pequeña roncha de anestésico local en la piel en el lugar previsto para la inserción.
Luego se administra más anestésico local a lo largo de la ruta prevista de inserción de la aguja espinal hasta la profundidad estimada del ligamento supraespinoso. Esto tiene un doble propósito: anestesia adicional para la inserción de la aguja espinal e identificación del camino correcto para la colocación de la aguja espinal. Se debe tener cuidado en pacientes delgados para evitar la punción dural y la anestesia espinal involuntaria en esta etapa.
Consejos NYSORA
• Al realizar una anestesia raquídea, se deben colocar monitores apropiados y se debe tener a mano el equipo de reanimación y las vías respiratorias.
• Todo el equipo para el bloqueo espinal debe estar listo para usarse y todos los medicamentos necesarios deben prepararse antes de colocar al paciente para la anestesia espinal.
Enfoque de línea media
Si se utiliza el abordaje de línea media, palpe el espacio intermedio deseado e inyecte anestésico local en la piel y el tejido subcutáneo. La aguja introductora se coloca con un ligero ángulo cefálico de 10° a 15°. A continuación, se pasa la aguja espinal a través del introductor. La aguja atraviesa el tejido subcutáneo, el ligamento supraespinoso, el ligamento interespinoso, el ligamento amarillo, el espacio epidural, la duramadre y la subaracnoides para llegar al espacio subaracnoideo.
Del Compendio de Anestesia Regional: Inyección de anestesia espinal usando el abordaje de la línea media.
La resistencia cambia a medida que la aguja espinal pasa a través de cada nivel en el camino hacia el espacio subaracnoideo. El tejido subcutáneo ofrece menos resistencia a la aguja espinal que los ligamentos. Cuando la aguja espinal atraviesa la duramadre, a menudo se aprecia un "chasquido". Una vez que se siente este chasquido, se debe retirar el estilete de la aguja para verificar el flujo de LCR. Para las agujas espinales de mayor calibre (calibre 26 a 29), esto suele demorar de 5 a 10 segundos, pero en algunos pacientes puede demorar un minuto o más. Si no hay flujo, algunos sugieren girar la aguja 90° ya que el orificio de la aguja podría estar obstruido. Los desechos pueden obstruir el orificio de la aguja espinal. Si es necesario, retire la aguja y limpie el orificio antes de volver a intentar la anestesia espinal. Una causa común de la imposibilidad de obtener flujo de LCR es que la aguja espinal esté fuera de la línea media. Se debe volver a evaluar la línea media y reposicionar la aguja.
Si la aguja espinal entra en contacto con el hueso, se debe anotar la profundidad de la aguja y colocar la aguja más cefálica. Si se vuelve a hacer contacto con el hueso, se debe comparar la profundidad de la aguja con la del último contacto con el hueso para determinar qué estructura se está contactando. Por ejemplo, si el contacto con el hueso es más profundo que la primera inserción, la aguja debe redirigirse más hacia arriba para evitar la apófisis espinosa inferior. Si el contacto con el hueso tiene aproximadamente la misma profundidad que la inserción original, es posible que se esté haciendo contacto con la lámina y se debe volver a evaluar la línea media. Si el contacto con el hueso es menos profundo que la inserción original, la aguja debe redirigirse caudalmente para evitar la apófisis espinosa superior.
Consejos NYSORA
• Cuando la aguja espinal atraviesa la duramadre, a menudo se aprecia un “chasquido”.
• Una vez que se siente este chasquido, se debe retirar el estilete del introductor para verificar el flujo de LCR.
• Para agujas espinales de un calibre superior (calibre 26–29), esto suele demorar de 5 a 10 segundos, pero en algunos pacientes puede demorar más.
• Si no hay flujo, la aguja puede estar obstruida por una raíz nerviosa y puede resultar útil girarla 90°.
Cuando sea necesario reinsertar la aguja espinal, es importante retirar la aguja hasta el nivel de la piel antes de redirigirla. Solo realice pequeños cambios en el ángulo de dirección cuando vuelva a insertar la aguja espinal, ya que los pequeños cambios en la superficie provocan grandes cambios en la dirección cuando la aguja alcanza mayores profundidades. El arqueamiento y la curvatura de la aguja espinal cuando se inserta a través de la piel o el introductor también pueden desviar la aguja cuando intenta contactar con el espacio subaracnoideo.
Se pueden provocar parestesias al pasar una aguja espinal. El estilete debe retirarse de la aguja espinal y, si se observa LCR y ya no hay parestesia, es seguro inyectar el anestésico local. Es posible que se haya encontrado una raíz nerviosa cauda equina. Si no hay flujo de LCR, es posible que la aguja espinal haya entrado en contacto con una raíz nerviosa espinal que atraviesa el espacio epidural. La aguja debe retirarse y redirigirse hacia el lado opuesto a la parestesia.
Después de que se establezca el flujo libre de LCR, inyecte el anestésico local lentamente a una velocidad inferior a 0.5 ml/s. Se puede intentar una aspiración adicional de LCR en el punto medio y al final de la inyección para confirmar la continuación de la administración subaracnoidea, pero no siempre es posible cuando se utilizan agujas pequeñas. Una vez que se completa la inyección del anestésico local, el introductor y la aguja espinal se retiran como una unidad de la espalda del paciente. Luego se debe colocar al paciente de acuerdo con el procedimiento quirúrgico y la baricidad del anestésico local administrado. La mesa se puede inclinar en la posición Trendelenburg o Trendelenburg inversa según sea necesario para ajustar la altura del bloqueo nervioso después de probar el nivel sensorial. El anestesiólogo debe monitorear cuidadosamente y apoyar los signos vitales.
Del Compendio de Anestesia Regional: Inyección de anestesia espinal que muestra la propagación del anestésico local en el espacio intratecal.
Abordaje paramediano (lateral)
Si el paciente tiene un ligamento interespinoso calcificado o dificultad para flexionar la columna, se puede utilizar un abordaje paramediano para lograr la anestesia espinal. El paciente puede estar en cualquier posición para este abordaje: sentado, lateral o incluso en decúbito prono. Después de palpar las apófisis espinosas lumbares superior e inferior del espacio intermedio deseado, se infiltra anestésico local 1 cm lateral a la cara superior de la apófisis espinosa inferior. La aguja debe dirigirse ligeramente en sentido medial. Una angulación medial de la aguja de 10° y 15° alcanzará la línea media a una profundidad de unos 5.7 cm (tan 80°) y 3.7 cm (tan 75°), respectivamente. Esto demuestra que pequeños cambios en la angulación pueden tener efectos pronunciados en la colocación de la punta de la aguja. Aunque también se requiere una ligera angulación cefálica, un error común es un enfoque inicial demasiado inclinado. Si se hace contacto con la lámina, la aguja debe colocarse en ángulo cefálico y "desviarse" de la lámina hacia el espacio subaracnoideo.
Se han descrito otros métodos. Todas las técnicas implican un eje vertical similar para el sitio de punción (1 a 1.5 cm desde la línea media). Se diferencian en el eje horizontal (p. ej., 1 cm lateral a la apófisis espinosa, 1 cm lateral al espacio intermedio, 1 cm lateral y 1 cm inferior al espacio intermedio, 1 cm lateral y 1 cm inferior a la cara inferior de la espinosa superior). proceso) y el grado de angulación cefálica requerida.
Figura Figura 13 y XNUMX muestra los puntos de referencia utilizados para un abordaje paramediano de la anestesia espinal. Figura 14 y XNUMX muestra el desempeño exitoso de un anestésico espinal paramediano.
Consejos NYSORA
Para el abordaje paramediano:
• Después de palpar las apófisis espinosas lumbares superior e inferior del espacio intermedio deseado, se infiltra anestésico local 1 cm lateral a la cara superior de la apófisis espinosa inferior.
• La aguja debe estar inclinada en una ligera dirección medial y cefálica.
• Si se hace contacto con la lámina, la aguja debe colocarse en ángulo cefálico y "desviarse" de la lámina hacia el espacio subaracnoideo.
• El ligamento amarillo suele ser la primera resistencia identificada.
Enfoque de Taylor
El abordaje de Taylor, o lumbosacro, para la anestesia raquídea es un abordaje paramediano dirigido hacia el espacio intermedio L5-S1. Debido a que este es el espacio intermedio más grande, el enfoque de Taylor se puede usar cuando otros enfoques no tienen éxito o no se pueden realizar. Al igual que con el abordaje paramediano, el paciente puede estar en cualquier posición para este abordaje: sentado, lateral o prono.
La aguja debe insertarse en un punto 1 cm medial e inferior a la espina ilíaca posterosuperior, luego en un ángulo cefálico de 45°-55° y medialmente. Este ángulo debe ser lo suficientemente medial para alcanzar la línea media en el espacio intermedio L5-S1. Después de la inserción de la aguja,
la primera resistencia significativa que se siente es el ligamento amarillo, y luego se perfora la duramadre para permitir el flujo libre de LCR a medida que se ingresa al espacio subaracnoideo. Figura 15 y XNUMX muestra el enfoque de Taylor para la anestesia espinal. Se ha descrito la anestesia raquídea en decúbito prono guiada por ultrasonido en tiempo real a través del enfoque de Taylor y puede mejorar la comodidad y el cumplimiento del paciente durante el procedimiento.
Consejos NYSORA
Para el enfoque de Taylor:
• La aguja debe insertarse en un punto 1 cm medial e inferior a la espina ilíaca posterosuperior, luego en un ángulo cefálico de 45°–55° y medialmente.
• Este ángulo debe ser lo suficientemente medial para alcanzar la línea media en el espacio intermedio L5-S1.
• Después de la inserción de la aguja, la primera resistencia significativa que se siente es el ligamento amarillo.
TÉCNICAS DE CATÉTER CONTINUO
Se puede colocar un catéter permanente para la anestesia espinal continua. Los anestésicos locales se pueden dosificar repetidamente a través del catéter y el nivel y la duración de la anestesia se pueden ajustar según sea necesario para el procedimiento quirúrgico. La colocación de un catéter espinal continuo ocurre de manera similar a la de un anestésico espinal regular, excepto que se usa una aguja de mayor calibre, como una Tuohy, para permitir el paso del catéter. Después de la inserción de la aguja Tuohy, se encuentra el espacio subaracnoideo y el catéter espinal se pasa 2 a 3 cm en el espacio subaracnoideo. Si hay dificultad para pasar el catéter, intente girar la aguja Tuohy 180°. Nunca vuelva a introducir el catéter en el eje de la aguja porque existe el riesgo de cortar el catéter y dejar un trozo en el espacio subaracnoideo. Si es necesario retirar el catéter, retire el catéter y la aguja juntos e intente la espina continua en otro espacio intermedio. La comunicación es fundamental para evitar que un catéter espinal se confunda con el catéter epidural más común. Esto implica el etiquetado, la documentación, la entrega y la vigilancia.
Consejos NYSORA
• Después de la inserción de la aguja Tuohy, se ingresa al espacio subaracnoideo y se pasa el catéter espinal 2–3 cm dentro del espacio subaracnoideo.
• Si hay dificultad para pasar el catéter, intente girar la aguja Tuohy 180°.
• La comunicación es fundamental para evitar que un catéter espinal se confunda con el catéter epidural más común.
Debido a que la aguja que se usa para pasar el catéter espinal es una aguja de gran calibre, existe un riesgo mucho mayor de CPPD, especialmente en pacientes mujeres jóvenes. El síndrome de cauda equina puede ocurrir con catéteres espinales pequeños, por lo que la FDA ha desaconsejado el uso de catéteres de calibre inferior a 24 para la anestesia espinal continua.
En 2008, un ensayo clínico aleatorizado (FDA Investigational Device Exemption) informó sobre la seguridad de los “microcatéteres” espinales continuos en pacientes obstétricas. Se colocó catéter calibre 28 en 329 pacientes; no se informaron resultados neurológicos permanentes. El ensayo comparó la analgesia raquídea continua con la analgesia epidural y encontró puntuaciones iniciales de dolor más bajas, mayor satisfacción del paciente y menos bloqueo nervioso motor en el grupo raquídeo, sin diferencias en los resultados neonatales u obstétricos. Sin embargo, el grupo espinal tuvo puntajes más altos de prurito y una tendencia hacia más CPPD (9 % en comparación con 4 % en el grupo epidural). Los catéteres intratecales fueron más difíciles de retirar que los catéteres epidurales. A un paciente se le rompió un catéter intratecal al retirarlo, aunque lo hizo una persona no capacitada, dejando un fragmento en la espalda del paciente.
SITUACIONES CLÍNICAS ENCONTRADAS EN LA PRÁCTICA DE LA ANESTESIA ESPINAL
Lo Difícil y espinal fallida
Durante mucho tiempo, la anestesia espinal se ha considerado un bloqueo nervioso confiable, con tasas de falla inferiores al 1%. La conversión a anestesia general fue tan baja como 0.5% en un estudio de cohorte prospectivo de pacientes obstétricas. Sin embargo, se han informado tasas de fracaso de hasta el 17%. La anestesia espinal fallida puede presentarse como ausencia completa de bloqueo nervioso, bloqueo nervioso parcial o duración inadecuada del bloqueo nervioso.
Aunque la experiencia puede reducir la posibilidad de una falla espinal, incluso los médicos experimentados se enfrentarán a bloqueos fallidos de los nervios espinales. Después de sentirse tranquilizado por la apariencia del LCR, un bloqueo nervioso posterior fallido o irregular puede dejar al anestesiólogo frustrado y desconcertado. Se requiere un enfoque metódico cuando se trata de un bloqueo espinal fallido.
En un excelente artículo de revisión, Fettes et al clasificaron el fracaso de la anestesia raquídea en cinco grupos: fracaso de la punción lumbar, fracaso de la inyección de la solución, dispersión de la solución en el LCR, acción del fármaco sobre las raíces nerviosas y la médula, y manejo del paciente. Su revisión se resume a continuación.
Punción lumbar fallida
Siempre que haya problemas con la colocación de un anestésico espinal, el anestesiólogo debe volver a evaluar la posición del paciente. Se debe utilizar un miembro del personal de la sala de operaciones que esté capacitado para ayudar con el posicionamiento del paciente. Alternativamente, el posicionamiento del paciente puede mejorarse con dispositivos de posicionamiento comercialmente disponibles. Estos dispositivos pueden ayudar a mantener la flexión de la columna y crear un soporte estable para el paciente, lo que puede ser útil si no hay personal de quirófano capacitado disponible para ayudar con el posicionamiento.
Si no se puede encontrar el espacio intermedio propuesto, se puede intentar el espacio intermedio por encima o por debajo del sitio original de la inyección espinal. Cuando no se puede utilizar la posición sentada o no se tiene éxito, se puede utilizar la posición de decúbito lateral. Puede intentarse la técnica de la línea media o la paramedia lateral. El espacio interlaminar más grande está en L5, y esto se puede buscar a través del enfoque de Taylor, descrito anteriormente en este capítulo.
Se han identificado tres predictores independientes del éxito al realizar el bloqueo del nervio neuroaxial: la posición adecuada, la experiencia del anestesiólogo y la capacidad de palpar los puntos de referencia anatómicos. El posicionamiento inadecuado puede deberse a la incapacidad de los pacientes para flexionar la columna más que a la falla de los anestesiólogos para estimular la flexión. Una espalda predeciblemente difícil no debe usarse para enseñar a los alumnos sin experiencia. Si los puntos de referencia anatómicos son imperceptibles, se puede utilizar la ecografía espinal para ayudar a la punción lumbar (consulte la sección sobre ecografía neuroaxial).
Fallo de inyección de solución
Debido a los pequeños volúmenes de inyección utilizados en la anestesia espinal, las reducciones aparentemente triviales en el volumen de la solución pueden resultar en un bloqueo nervioso menos que adecuado. Las reducciones en la solución inyectada pueden ser el resultado de la pérdida del inyectado cuando la jeringa espinal está unida al conector de la aguja o la pérdida en los tejidos adyacentes al espacio subaracnoideo debido a la migración del orificio de la aguja o al orificio que se extiende a lo largo de varios espacios potenciales (p. ej., el subaracnoideo). y espacios subdurales o epidurales). Las reducciones intencionales de la dosis, generalmente para disminuir los efectos secundarios, también pueden resultar en una disminución de la eficacia.
Fallo en la dispersión de la solución dentro del LCR
La falla en la distribución de la solución dentro del LCR puede deberse a deformidades espinales como cifosis o escoliosis, cirugía previa, tabiques espinales transversales o longitudinales, estenosis espinal o quistes extradurales. Los quistes de Tarlov son un tipo de quiste extradural que se observa incidentalmente en resonancias magnéticas y tiene una incidencia de hasta el 9 %.
Aunque por lo general son asintomáticos, contienen LCR y pueden explicar la aspiración positiva de LCR y el fracaso del bloqueo nervioso completo. El volumen de LCR lumbar es un determinante importante de la diseminación.
Fracaso de la acción del fármaco
El fracaso de la acción del fármaco puede resultar de la administración del fármaco incorrecto. El medicamento correcto puede estar inactivo como resultado de la inestabilidad fisicoquímica (menos probable con los agentes modernos) o puede verse afectado debido a incompatibilidades químicas cuando se usan dos o más agentes. El fenómeno de la resistencia a los anestésicos locales ha sido cuestionado en la literatura.
Fracaso del manejo del paciente
La clásica imagen del dolor de Descartes del siglo XVII que muestra una conexión entre el pie ardiente de un niño y su cerebro a través de la mitad de la espalda: "al igual que cuando tiras de un extremo de una cuerda, haces sonar una campana que cuelga del otro extremo". —podría llevar a uno a creer que la anestesia espinal puede curar todos los dolores. Sin embargo, la percepción del dolor es mucho más compleja y, a pesar de un bloqueo espinal perfecto, un paciente puede experimentar molestias o dolor. Se debe asesorar a los pacientes antes de la operación sobre las sensaciones “normales” esperadas, como jalar, empujar y estirar. Paradójicamente, las pruebas preoperatorias de bloqueo espinal para tranquilizar tanto al paciente como al anestesiólogo pueden angustiar al paciente si se realizan demasiado pronto. Intraoperatoriamente, un paciente puede requerir ansiolisis y analgesia suplementarias o anestesia general.
El manejo de un bloqueo nervioso espinal fallido dependerá de si ocurre antes o durante la operación y de la naturaleza de la falla. Las opciones para optimizar la anestesia espinal incluyen cambiar la posición del paciente para mejorar la extensión y repetir el bloqueo espinal. Deben recordarse dos principios importantes cuando se repite un bloqueo del nervio espinal. Primero, el segundo intento no debe ser idéntico al primero. Esto no es solo para evitar un fracaso repetido, sino también para evitar que se acumule una segunda dosis de anestésico local en un espacio restringido, lo que puede provocar una lesión neurológica. En segundo lugar, una dosis repetida puede provocar una dispersión excesiva del anestésico local. Las alternativas como la anestesia epidural, el bloqueo de nervios periféricos, la infiltración local, la analgesia sistémica y la anestesia general deben considerarse según los méritos del caso y están fuera del alcance de este capítulo.
Bloqueo nervioso subdural involuntario
El bloqueo fallido del nervio subaracnoideo puede ser el resultado de una inyección subdural involuntaria y merece una atención especial. El espacio subdural es un espacio potencial que solo se vuelve real después del desgarro de las células neuroteliales dentro del espacio como resultado de la inserción de una aguja iatrogénica y la inyección de líquido (ver Figura 4 y XNUMX). Los rasgos característicos de un SDB son un alto nivel sensorial con respeto motor y simpático. Esto puede ser el resultado de la capacidad ventral limitada del espacio, lo que resulta en la preservación de las fibras motoras y simpáticas anteriores. Sin embargo, un SDB también puede presentarse de varias maneras diferentes: bloqueo nervioso fallido, bloqueo nervioso unilateral, síndrome de Horner, parálisis del nervio trigémino, insuficiencia respiratoria o pérdida del conocimiento debido a la afectación del tronco encefálico. El inicio del bloqueo nervioso es más lento que el bloqueo del nervio subaracnoideo pero más rápido que el bloqueo del nervio epidural y generalmente se resuelve después de 2 horas.
La incidencia de inyección subdural después de la mielografía con contraste oscila entre el 1 % y el 13 %. Se desconoce la incidencia de SDB después del intento de anestesia espinal. Debido a que la duramadre se rompe intencionalmente durante el intento de anestesia espinal, la incidencia de SDB puede ser mayor en comparación con el bloqueo del nervio epidural (entre 0.024 % y 0.82 % citado de diversas formas). El tamaño del espacio subdural adquirido es probablemente proporcional al volumen de líquido inyectado. Por lo tanto, los volúmenes típicos usados con anestesia espinal pueden no ser tan significativos como los volúmenes usados con anestesia epidural.
Anestesia espinal ambulatoria
Cada año, aumenta el número de cirugías, y más se realizan de forma ambulatoria. Como anestesiólogos, siempre estamos buscando nuevas formas de brindar un cuidado anestésico eficiente que sea seguro, controle el dolor, permita que el paciente sea dado de alta a su hogar de manera oportuna según el protocolo de la unidad de cuidados postanestésicos, y que sea fácil de realizar y reproducible. Anteriormente se ha sugerido que la anestesia espinal puede incorporarse al modelo de cirugía ambulatoria.
Bloqueo unilateral del nervio espinal
El uso de un bloqueo nervioso espinal unilateral para pacientes de edad avanzada y cirugía ambulatoria ha experimentado un resurgimiento. La raquianestesia unilateral fue descrita en 1950 por Ruben y Kamsler. Su informe se refería a 116 pacientes para reducción quirúrgica de fractura de cadera realizada bajo bloqueo espinal unilateral. No se informaron muertes y no se encontró un aumento en el peligro de la operación. Recientemente, la atención ha vuelto al uso de la anestesia espinal unilateral en pacientes de edad avanzada326 y para cirugía ambulatoria.
El uso de anestesia raquídea unilateral produce cambios reducidos en las presiones sistólica, media y diastólica, o la saturación de oxígeno en pacientes traumatizados de edad avanzada (p. ej., fractura de cadera). Mantener el lado operatorio hacia arriba y usar una solución espinal hipobárica en una dosis baja para estos casos da como resultado una excelente anestesia y una notable hemostabilidad cuando el paciente se mantiene en posición lateral durante 5 a 10 minutos antes de reposicionarlo en decúbito supino. Cuando se utilizan soluciones hiperbáricas, el lado operatorio debe ser dependiente.
La cirugía ambulatoria con bupivacaína hiperbárica al 0.5 % tarda aproximadamente 16 minutos para el desarrollo de la anestesia quirúrgica desde el momento de la inyección con anestesia espinal unilateral y 13 minutos con anestesia espinal bilateral tradicional. Se encuentran menos cambios hemodinámicos en el grupo de raquianestesia unilateral, con una regresión más rápida del bloqueo nervioso e igual tiempo para el alta a casa.
En comparación con otras cirugías ambulatorias, se requiere menos bloqueo del nervio motor para la artroscopia de rodilla. Dosis de bupivacaína hiperbárica tan bajas como 4 a 5 mg son eficaces cuando se combinan con posicionamiento unilateral. Las dosis más altas retrasan la recuperación. La adición de opioides intratecales mejora la analgesia pero aumenta los efectos secundarios relacionados con los opioides. La ropivacaína no mejora el tiempo de recuperación.
Al realizar la anestesia espinal unilateral, se sugiere el uso de una aguja de calibre 25 o calibre 27 con punta de lápiz con el orificio dirigido hacia el lado operatorio. Se debe usar bupivacaína en dosis bajas, con bupivacaína hiperbárica (lado operativo hacia abajo) en cirugía ambulatoria y bupivacaína hipobárica (lado operativo hacia arriba) en pacientes traumatizados de edad avanzada. Se debe usar una tasa de inyección lenta para producir un flujo laminar que ayude a producir un bloqueo unilateral. Hay pocas pruebas de que sea útil mantener al paciente en posición lateral durante más de 15 minutos.
La paciente obstétrica
En 1901, Kreis describió el primer anestésico espinal para el parto vaginal. Al año siguiente, Hopkins realizó con éxito la primera anestesia raquídea para una cesárea en una mujer con placenta previa. La anestesia espinal para el trabajo de parto y el parto ha progresado mucho desde entonces. Aunque se hacen muchos argumentos en contra de la anestesia general en la mujer embarazada debido al mayor riesgo de aspiración e intubación difícil, el anestesiólogo debe estar preparado para inducir la anestesia general ante una anestesia espinal fallida o total.
La anestesia regional obstétrica es un tema en sí mismo, y como tal se trata en Anestesia Regional Obstétrica. Los ejemplos de cómo la anestesia espinal difiere en la población obstétrica se enumeran en Tabla 10.
TABLA 10. Anestesia espinal en la paciente obstétrica.
| Consentimiento | • Puede ser difícil obtener un consentimiento verdaderamente informado en una paciente en trabajo de parto. |
| Riesgos | • Menor riesgo de complicaciones mayores permanentes en comparación con el bloqueo neuroaxial para cirugía no obstétrica.26 • Mayor riesgo de cefalea pospunción dural. • Un metanálisis de 2005 mostró que el pH del cordón umbilical, un indicador del bienestar fetal, era más bajo con la anestesia raquídea que con la epidural y la general, aunque esto puede atribuirse al uso de efedrina en los estudios analizados.118 |
| Beneficios | • Evitar los riesgos maternos de la anestesia general, en particular las tres A: aspiración, conciencia y vía aérea difícil. • Evitar la exposición fetal a fármacos anestésicos generales. • Vinculación materna temprana con el recién nacido. • Puede estar presente un compañero o una persona de apoyo. |
| indicaciones | • La anestesia raquídea se puede utilizar para la analgesia del trabajo de parto, el parto con fórceps, el parto por cesárea, la extracción manual de la placenta, la reparación perineal o la cirugía no obstétrica en la paciente obstétrica. |
| Anatomía | • La lordosis lumbar exagerada durante el embarazo puede aumentar la altura de la línea intercristalina de tal manera que el 6 % de las mujeres a término tienen una línea intercristalina igual o superior a L3.352 • La pronunciada flexión lumbar requerida para realizar la anestesia espinal puede ser difícil debido al útero grávido. |
| Fisiología | • La compresión aortocava de un útero grávido puede empeorar la hipotensión inducida por la columna, lo que presenta riesgos tanto para la madre como para el feto. |
| Farmacología | • Las mujeres embarazadas requieren menos anestesia local para lograr el mismo nivel de anestesia que las mujeres no embarazadas. Esta observación probablemente se deba a factores tanto hormonales como mecánicos. |
| Tecnologia | • Esté preparado para pasar a anestesia general. Antes de la colocación de un anestésico espinal, la paciente embarazada debe recibir 30 ml de citrato de sodio 0.3 M por vía oral para disminuir la acidez estomacal. El equipo y los medicamentos necesarios para administrar la anestesia general deben estar fácilmente disponibles. • Después de administrar la anestesia espinal, la paciente debe estar en posición supina con desplazamiento uterino hacia la izquierda. La frecuencia cardíaca fetal debe controlarse mediante Doppler o electrocardiograma (ECG) del cuero cabelludo fetal. • Por lo general, se requiere un bloqueo a nivel de T4 para una cesárea debido a la tracción del peritoneo y la exteriorización uterina. • Algunos pacientes se quejan de disnea debido al bloqueo motor abdominal e intercostal, pero si el paciente es capaz de hablar con claridad, por lo general todo lo que se requiere es tranquilizarlo y monitorearlo. La pérdida sensorial en la extremidad superior o la incapacidad para extender el antebrazo (C7/C8) debe advertir al médico sobre la parálisis diafragmática inminente (C3/C4/C5). • Si la madre desea amamantar al recién nacido, se debe realizar una evaluación de la fuerza de los miembros superiores. La dotación adecuada de personal debe permitir que otra persona, además del anestesiólogo, sea responsable del bienestar del recién nacido. • La hipotensión y las náuseas son comunes, especialmente en el entorno electivo (consulte la sección sobre el manejo de la hipotensión después de la anestesia espinal). La fenilefrina profiláctica y la “cocarga” con líquido previenen eficazmente la hipotensión y las náuseas. El cuadro 23-9 proporciona un régimen sugerido para el manejo de la hipotensión durante la cesárea electiva. |
El paciente anticoagulado
A medida que la población envejece, más pacientes se presentan para cirugía con requisitos pre, intra o posoperatorios de terapia antiplaquetaria, anticoagulante o trombolítica. Se siguen desarrollando agentes novedosos, lo que genera inquietudes en los pacientes que se someten a anestesia raquídea. Estas preocupaciones llevaron a la evolución de las guías ASRA basadas en la evidencia sobre anestesia regional en el paciente que recibe terapia antitrombótica o trombolítica, ahora hasta su tercera edición.
Se remite al lector Anestesia neuroaxial y bloqueos de nervios periféricos en pacientes con anticoagulantes para una discusión en profundidad sobre el uso de la anestesia neuroaxial en el paciente anticoagulado.
Otras situaciones clínicas
La anestesia espinal en el paciente pediátrico y el paciente con neurología preexistente se tratan en Anestesia y analgesia pediátrica epidural y espinal y Anestesia regional en el paciente con enfermedad neurológica preexistente, respectivamente.
DESARROLLOS RECIENTES EN ANESTESIA ESPINAL
Ultrasonido neuroaxial
Se ha demostrado que la palpación convencional de la anatomía superficial no es fiable. La ecografía neuroaxial tiene como objetivo superar las imprecisiones de la anatomía de superficie con la sonoanatomía. La primera descripción de la punción lumbar asistida por ultrasonido fue en 1971. Más recientemente, el ultrasonido neuroaxial se ha utilizado como exploración previa al procedimiento y para la colocación de la aguja en tiempo real. Gran parte de la evidencia con respecto a la ecografía neuroaxial se refiere a la exploración previa al procedimiento antes de la inserción epidural, especialmente en el contexto de la anestesia obstétrica, y ha sido producida por un número limitado de centros especializados. Esta evidencia muestra que la exploración disminuye los intentos de aguja, predice con precisión la profundidad del espacio epidural y puede mejorar la tasa de éxito de los alumnos junior.
La ultrasonografía espinal en el contexto de la anestesia espinal de un solo disparo está menos estudiada. La ecografía permite una mayor precisión en la identificación de los espacios intermedios lumbares. Esto es importante ya que es probable que la palpación de la columna lumbar genere un espacio intermedio más alto de lo esperado, y se ha demostrado que el cono medular está a veces más bajo que el nivel L1 enseñado convencionalmente. Estos dos hechos no sólo suponen un riesgo teórico sino que también han dado lugar a una lesión neurológica persistente. Un estudio observacional en pacientes ortopédicos demostró una predicción ultrasonográfica precisa de la profundidad de la duramadre antes de la inserción espinal. La ultrasonografía previa al procedimiento se ha utilizado para lograr la anestesia espinal en situaciones clínicamente difíciles, como la obesidad, la cifoescoliosis y la cirugía espinal previa, incluidas las barras de Harrington. La anestesia espinal guiada por ultrasonido en tiempo real ha sido descrita en pacientes técnicamente difíciles y en decúbito prono mediante el abordaje de Taylor. Un ensayo aleatorizado que comparó la exploración previa al procedimiento con la palpación estándar para la anestesia espinal en pacientes con puntos de referencia anatómicos superficiales difíciles mostró una diferencia doble en el éxito del primer intento (62 % de ultrasonido frente a 32 % de control).
La ecografía del neuroeje se aprende mejor en talleres y simulaciones personalizados. El avance de ultrasonido en tiempo real de una aguja espinal hacia el espacio subaracnoideo es una habilidad experta, y los profesionales deben poseer habilidades considerables con la sonda y la aguja. El escaneo previo al procedimiento y el marcado de la espalda de un paciente requieren menos coordinación ojo-mano, pero también pueden ser difíciles de aprender. La competencia en la identificación de apófisis espinosas designadas se logró después de escanear a 22 a 36 pacientes. Aquí, describimos seis vistas sonoanatómicas de la columna lumbar y un método simplificado para realizar una exploración neuroaxial previa al procedimiento y describimos los errores comunes de los principiantes.
Sonoanatomía
Diferentes investigadores han descrito un número variable de vistas ecográficas necesarias, a menudo asociadas con apodos de fantasía. Karmakar se refiere a "cabezas de caballo", "jorobas de camello" y signos de "tridente" (vistas paramedianas longitudinales), mientras que Carvalho se refiere a una "sierra" (vista longitudinal) y un "murciélago volador" (vista transversal). El novato no debe confundirse con la nomenclatura variable, ya que son simplemente herramientas de reconocimiento de patrones.
Se requieren ventanas ultrasónicas especializadas para visualizar el neuroeje debido a las estructuras óseas que lo recubren. Seis vistas básicas se muestran en Tabla 11.
Los complejos anterior y posterior son términos útiles para identificar estructuras. El complejo anterior representa la duramadre anterior, el ligamento longitudinal posterior y el cuerpo vertebral posterior. El complejo posterior representa el ligamento amarillo, el espacio epidural y la duramadre posterior.
Mientras que el "objetivo" de la anestesia espinal es el complejo posterior, la visualización del complejo anterior denota una ventana ultrasonográfica clara a través del espacio interlaminar.
Exploración previa al procedimiento con ultrasonido neuroaxial
- Después de colocar al paciente de manera convencional, aplicar una sonda de matriz curva de baja frecuencia (2 a 5 MHz) a la mitad de la espalda baja del paciente en una orientación transversal.
- Optimizar la imagen para compensación de profundidad, frecuencia y ganancia de tiempo.
- Marca la línea media. Esto se hace simplemente alineando la sonda orientada transversalmente de modo que haya simetría en la apariencia del ultrasonido (el lado izquierdo de la pantalla es un espejo del lado derecho). Esto corresponderá a la apófisis espinosa transversal oa la vista interlaminar transversal. Deslizando la sonda aplicada transversalmente en dirección cefálica, se usa un rotulador a intervalos para marcar la piel adyacente a la mitad del borde largo de la sonda. En la práctica, ayuda comenzar por abajo y marcar por encima de la sonda en la piel libre de ultrasonido. gel. Esta técnica asume que existe una simetría real en la anatomía del paciente (sin escoliosis, rotación o metalurgia).
- Identificar la unión lumbosacra. La sonda se orienta para obtener una vista laminar sagital paramediana. Después de identificar la lámina, la sonda se desliza caudalmente hasta que se ve una línea hiperecoica continua (sacro). Debe verse un complejo anterior entre el sacro y la quinta lámina lumbar (v. Figura 16 ).
- Marcar la lámina de L1–L5. La sonda, manteniendo una orientación paramediana, se puede mover hacia la cabeza como un rotulador, de nuevo en el punto medio del borde largo de la sonda, y se usa para marcar la lámina o los espacios interlaminares.
- Obtenga una vista interlaminar transversal al nivel deseado. La sonda se gira transversalmente al nivel deseado (p. ej., L3–L4). Se necesita una ligera inclinación y deslizamiento cefálico-caudal para optimizar la apariencia del complejo posterior y anterior.
- identificar la duramadre (complejo posterior) y marcar la profundidad con calibradores.
- Tenga en cuenta la inclinación de la sonda (generalmente ligeramente cefálica). Esto indica la angulación requerida de la aguja una vez insertada en el punto de inserción óptimo.
- Marque el punto óptimo de inserción de la aguja. Se utiliza un bolígrafo para marcar los cuatro puntos medios de los bordes largo y corto de la sonda. Se baja la sonda y se construye una línea horizontal y otra vertical. Donde se cruzan es el punto óptimo de inserción de la aguja. La línea vertical debe corresponder con la línea media marcada previamente.
- Compruebe el punto de inserción óptimo volviendo a aplicar la sonda y asegurando una buena visión del complejo anterior.


FIGURA 16. Imagen ecográfica de la unión lumbosacra. Se ve una línea hiperecoica continua (sacro). Debe verse un complejo anterior (AC) entre el sacro y la quinta lámina lumbar.
Se pueden obtener vistas adicionales de la columna colocando la sonda en una orientación sagital paramediana y deslizándola lateralmente a través de las vistas laminar paramediana, del proceso articular y del proceso transversal. La vista oblicua paramediana se obtiene inclinando la sonda medialmente, con el objetivo de resaltar los complejos posterior y anterior a través del espacio interlaminar. Esta vista se puede utilizar para la anestesia espinal guiada por ultrasonido en tiempo real.
Trampas
El escollo más importante es, después del entrenamiento inicial, esperar al paciente difícil antes de intentar la ecografía neuroaxial. La exploración por ultrasonido requiere el reconocimiento de patrones, y las habilidades deben adquirirse mediante la exploración de espaldas "fáciles". El marcado cutáneo impreciso se ha postulado como una razón para el fracaso. Se debe tener cuidado para asegurarse de que la sonda de matriz curva esté perpendicular a la piel cuando se utiliza un rotulador. Confundir el complejo anterior con el complejo posterior corre el riesgo de sobrestimar la profundidad de la duramadre (posterior). Al medir la profundidad de la duramadre, la sonda puede hundir la piel, subestimando así la profundidad. La identificación errónea de la unión lumbosacra o la falta de reconocimiento de las anomalías de la unión, presentes en el 12% de la población, dará como resultado un etiquetado incorrecto de los espacios interlaminares. Por último, el gel de ultrasonido debe limpiarse de la piel antes de realizar el bloqueo del nervio neuroaxial.
Cirugía Laparoscópica Con Anestesia Espinal Lumbar
La anestesia espinal lumbar se ha utilizado en los entornos de reparación laparoscópica de hernia inguinal extraperitoneal e intraperitoneal, laparoscopia ginecológica ambulatoria, colecistectomía laparoscópica y reparación laparoscópica de hernia ventral. La cirugía laparoscópica con un paciente despierto requiere algunas consideraciones especiales. En primer lugar, la selección y educación de los pacientes son primordiales. Se debe tener precaución al interpretar las tasas de conversión de anestesia general en ensayos clínicos, ya que es más probable que los pacientes que den su consentimiento para participar en el ensayo toleren un procedimiento despierto. Se debe ofrecer ansiolisis y se debe asesorar a los pacientes sobre las sensaciones esperadas. El neumoperitoneo puede percibirse como un peso sobre el abdomen. Debe discutirse la posibilidad de conversión a anestesia general, que a menudo se debe al dolor en la punta del hombro.
Es posible que sea necesario modificar la técnica quirúrgica y los sitios de trocar. Se ha utilizado el neumoperitoneo con insuflación de óxido nitroso para evitar la irritación peritoneal y el dolor que se cree que está asociado con la insuflación convencional de dióxido de carbono.
Sin embargo, posteriormente se ha utilizado la insuflación de dióxido de carbono. Se ha sugerido evitar la inclinación lateral izquierda con la cabeza hacia arriba que se asocia con irritación diafragmática. Algunos estudios limitaron la insuflación a menos de 11 mmHg y utilizaron una sonda nasogástrica para descomprimir el estómago y reducir el riesgo de aspiración. Otros no modificaron la técnica quirúrgica salvo la insuflación de bajo flujo (se evitaron las sondas nasogástricas y se mantuvo la insuflación de dióxido de carbono a 15 mmHg).
La adición de fentanilo o clonidina intratecal puede disminuir el dolor en la punta del hombro.
Los dos principales inconvenientes de la anestesia raquídea para la colecistectomía laparoscópica parecían ser el dolor en la punta del hombro que generaba insatisfacción del paciente o conversión a anestesia general y una alta tasa de CPPD (hasta un 10 %). Debido a los números pequeños y técnicas heterogéneas en estudios previos, ha sido difícil establecer la técnica ideal.
Tzovaras y colegas en 2008 publicaron un análisis intermedio de un ensayo aleatorio. Cien pacientes fueron aleatorizados a anestesia general o raquídea para la colecistectomía laparoscópica. Ambos brazos del estudio tenían sondas nasogástricas e insuflación de dióxido de carbono hasta un máximo de 10 mmHg. El grupo espinal recibió 3 mL de bupivacaína hiperbárica al 0.5%, 250 μg de morfina y 20 μg de fentanilo inyectados en el nivel L2-L3 a través de una aguja de punta de lápiz de calibre 25 en posición de decúbito lateral derecho. Luego se colocó al paciente en posición de Trendelenburg durante 3 minutos. A pesar de la incomodidad o el dolor intraoperatorio en la punta del hombro en el 43% de los pacientes del grupo espinal, solo la mitad de estos pacientes requirió fentanilo y ningún paciente requirió conversión a anestesia general.
De los que estaban en los grupos de anestesia espinal y general, el 96 % y el 94 %, respectivamente, estaban muy o bastante satisfechos con su procedimiento. Además, el dolor postoperatorio fue menor en el grupo espinal en comparación con el grupo anestesia general. El ensayo se interrumpió porque se alcanzó el criterio principal de valoración (dolor) con los primeros 100 pacientes. Ningún paciente del grupo espinal tuvo una CPPD clásica (G. Tzovaras, comunicación personal, 2012).
Anestesia espinal torácica
La anestesia espinal torácica fue descrita a principios del siglo XX por el profesor Thomas Jonnesco, aunque fue criticada por sus contemporáneos, incluido el profesor Bier. Llamó a su técnica "analgesia espinal general" y describió dos sitios de punción, los espacios intermedios T1900-T1 y T2-L12, según la cirugía requerida. En su artículo, hizo asombrosas afirmaciones de poder realizar cirugías de cabeza y cuello, incluida la laringotomía total, bajo analgesia torácica alta y predijo incorrectamente en 1 que su técnica “en poco tiempo sería universalmente aceptada”.
En 2006, se informó sobre la anestesia espinal torácica para un paciente que requería colecistectomía laparoscópica. La anestesia espinal torácica segmentaria para la colecistectomía laparoscópica demostró ser efectiva en un pequeño número de pacientes sanos, aunque los autores advirtieron que la técnica, aún en sus inicios, no debe usarse en la práctica de rutina.
La anestesia espinal se realiza tradicionalmente en la región lumbar por debajo del nivel del cono medular para evitar lesiones en la médula espinal. Sin embargo, las imágenes de resonancia magnética, aunque en posición supina, han demostrado que el segmento torácico medio a inferior de la médula se encuentra en la parte anterior, de modo que hay un espacio lleno de LCR entre la duramadre y la médula (ver Figura 17 y XNUMX).
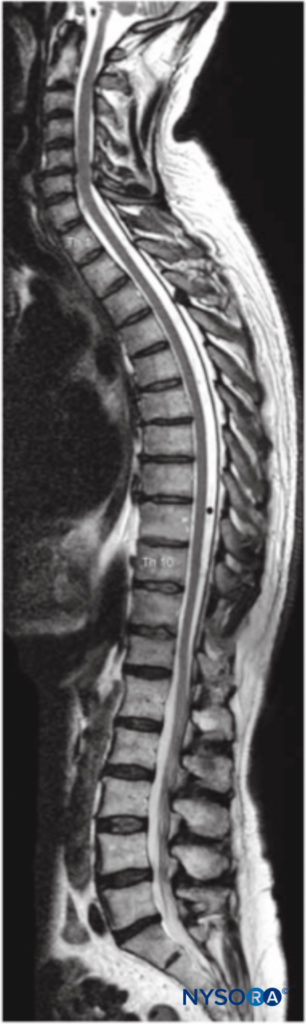
FIGURA 17. Resonancia magnética de línea media de la columna vertebral. En los segmentos torácicos, la médula espinal se posiciona anteriormente dejando un espacio significativo (*) entre la duramadre posterior y la médula espinal. A nivel lumbar, el espacio desaparece casi por completo. (Reproducido con permiso de van Zundert AA, Stultiens G, Jakimowicz JJ, et al: Segmental espinal anestesia para colecistectomía en un paciente con enfermedad pulmonar severa. Br J Anaesth. 2006 Apr;96(4):464-466.)
RESUMEN
La anestesia espinal es una forma de anestesia confiable, segura y efectiva. Mucho ha cambiado desde sus inicios a finales del siglo XIX. El dominio de la anestesia espinal viene con práctica, diligencia y conocimiento de fisiología, farmacología y anatomía.
La seguridad del paciente siempre debe estar a la vanguardia cuando se considera realizar una anestesia espinal. La anestesia espinal es una técnica indispensable en la práctica de la anestesia moderna. Se puede encontrar un video complementario relacionado con la anestesia espinal en Videos educativos para estudiantes de NYSORA: anestesia espinal.
Este texto es una muestra del contenido de la Compendio de Anestesia Regional en NYSORA LMS.
de NYSORA Compendio de Anestesia Regional es simplemente el plan de estudios más completo y práctico sobre anestesia regional de la A a la Z, que presenta el contenido Premium de NYSORA. A diferencia de los libros de texto y los libros electrónicos, el Compendio se actualiza continuamente y presenta los videos, animaciones y contenido visual más nuevos de NYSORA.
El Compendio es uno de varios cursos educativos estándar de oro sobre el Sistema de aprendizaje de NYSORA (NYSORA LMS), y la inscripción para NYSORALMS.com está libre. Sin embargo, el acceso COMPLETO al Compendio se basa en una suscripción anual, ya que requiere un ejército de ilustradores, editores de video y un equipo educativo para continuar convirtiéndolo en la MEJOR herramienta para la educación en todo lo relacionado con la anestesia regional. Si bien puede pensar en el compendio como un libro electrónico sobre esteroides, una prueba rápida le dará una idea en tiempo real de lo increíble que es realmente el Compendio. Su suscripción transformará la forma en que lee sobre la anestesia regional:
- Aprenda visualmente: todo lo regional, incluidos los procedimientos de bloqueo espinal, epidural y nervioso y los protocolos de manejo
- Revise las instrucciones de técnicas paso a paso para más de 60 bloqueos nerviosos
- Acceda a las ilustraciones, animaciones y videos legendarios de NYSORA (como Reverse Ultrasound Anatomy)
- Acceda a la información de RA en cualquier dispositivo a través de la plataforma de escritorio y la aplicación móvil
- Obtenga actualizaciones en tiempo real
- Revise las infografías para la preparación del examen (por ejemplo, EDRA)
- Use el feed de la comunidad con discusiones de casos reales, imágenes y videos publicados y discutidos por suscriptores y los mejores expertos del mundo por igual.
Incluso si no desea suscribirse al Compendio, regístrese en el LMS NYSORA, sea el primero en saber qué hay de nuevo en anestesia regional y participe en discusiones de casos.
Esto es de lo que se alimenta la actividad LMS NYSORA parece:
Estamos convencidos que una vez que experimentas la Compendio en LMS NYSORA, y nunca volverá a sus libros antiguos, y su suscripción ayudará a mantener NYSORA.com gratis para el resto del mundo.
Lectura adicional
- Koller C: Vorlaufige Mittheilung über locale Anasthesirung am Auge. Klin Mbl Augenheilk 1884; 22:60–63.
- Halsted WS: Comentarios prácticos sobre el uso y abuso de la cocaína; sugerido por su empleo invariablemente exitoso en más de mil operaciones quirúrgicas menores. NY Med J 1885; 42:294.
- Corning JL: Anestesia espinal y medicación local de la médula. NY Med J 1885;42:483–485.
- Gorelick PB, Zych D: James Leonard Corning y la historia temprana de la punción espinal. Neurología 1987;37(4):672–674.
- Arendt K, Demaerschalk BM, Wingerchuk DM, Camann W: Agujas de punción lumbar atraumáticas: después de todos estos años, ¿todavía nos estamos perdiendo el punto? Neurólogo 2009;15(1):17–20.
- Wynter E: Cuatro casos de meningitis tuberculosa en los que se realizó paracentesis de la teca vertebral para aliviar la presión del líquido. Lanceta 1891: 981–982.
- Ball C, Westhorpe R: anestesia local: anestesia espinal temprana. Anaesth Cuidados Intensivos 2003;31(5):493.
- Bier A: Experimentos sobre la cocainización de la médula espinal. Dtsch Z Chir 1899; 51: 361–369.
- Marx GF: La primera anestesia espinal. ¿Quién se merece los laureles? Reg Anesth 1994;19(6):429–430.
- Wulf HF: El centenario de la anestesia espinal. Anesthesiology 1998;89(2):500–506.Larson MD: Tait and Caglieri. El primer anestésico espinal en América. Anestesiología 1996;85(4):913–919.
- Matas R: Anestesia local y regional con cocaína y otras drogas analgésicas, incluido el método subaracnoideo, aplicadas en la práctica quirúrgica general. Phil Med J 1900;6:820–843.
- Vandam LD: Sobre los orígenes de la anestesia intratecal. Reg Anesth Pain Med 1998;23(4):335–339; discusión 84–87.
- Tuffier T: Anesthesie medullaire chirurgicale par injection sous-arachnoidienne lombaire de cocaína; técnica y resultados. Semin Med 1900; 20:167.
- Barker AE: Informe de experiencias clínicas con analgesia espinal en 100 casos y algunas reflexiones sobre el procedimiento. BMJ 1907; 1: 665–674.
- Labat G: Alteraciones circulatorias asociadas al bloqueo del nervio subaracnoideo. Long Island Med J 1927;21:573.
- Pitkin G: Anestesia espinal controlable. Am J Surg 1928;5:537.
- Sise LF: Anestesia espinal para operaciones abdominales superiores e inferiores. N Engl J Med 1928;199:61. Sise LF: Pontocainglucosa para anestesia espinal. Surg Clin North Am 1935;15:1501.
- Brown DL, Fink BR: La historia del bloqueo neural y el manejo del dolor. En Cousins MJ, Bridenbaugh PO (eds): Neural block, 3rd ed. Lippincott-Raven, 1998, págs. 3–27.
- Adriani J, Roman-Vega D: Anestesia por bloqueo nervioso en silla de montar. Am J Surg 1946;71:12.
- Maltby JR, Hutter CD, Clayton KC: El caso Woolley y Roe. Br. J. Anaesth 2000;84(1):121–126.
- Kennedy F, Effron AS, Perry G: La parálisis grave de la médula espinal causada por la anestesia espinal. Surg Gynecol Obstet 1950;91(4):385–398.
- Dripps RD, Vandam LD: Seguimiento a largo plazo de pacientes que recibieron 10,098 anestésicos espinales: Fracaso para descubrir secuelas neurológicas importantes. JAMA 1954;156(16):1486–1491.
- Morgan P: Anestesia espinal en obstetricia. Can J Anaesth 1995;42(12): 1145–1163.
- Cook TM, Counsell D, Wildsmith JA: Complicaciones principales del bloqueo del nervio neuroaxial central: Informe sobre el Tercer Proyecto de Auditoría Nacional del Royal College of Anesthetists. Br. J. Anaesth 2009;102(2):179–190.
- Greene HM: Punción lumbar y prevención de la cefalea posterior a la punción dural. JAMA 1926;86:391–392.
- Greene BA: una aguja de punción lumbar de calibre 26: su valor en la profilaxis del dolor de cabeza después de la analgesia espinal para el parto vaginal. Anestesiología 1950;11:464–469.
- Hart JR, Whitacre RJ: Aguja con punta de lápiz en la prevención de la cefalea posespinal. JAMA 1951;147(7):657–658.
- Sprotte G, Schedel R, Pajunk H: [Una aguja universal "atraumática" para anestesia regional de un solo disparo: resultados clínicos y una prueba de 6 años en más de 30,000 anestesias regionales]. Reg Anaesth 1987;10(3):104–108.
- Calthorpe N: La historia de las agujas espinales: llegar al punto. Anestesia 2004;59(12):1231–1241.
- McDonald SB: ¿Está contraindicado el bloqueo neuroaxial en el paciente con estenosis aórtica? Reg Anesth Pain Med 2004;29(5):496–502.
- O'Keefe JH Jr, Shub C, Rettke SR: Riesgo de procedimientos quirúrgicos no cardíacos en pacientes con estenosis aórtica. Mayo Clin Proc 1989;64(4): 400–405.
- Collard CD, Eappen S, Lynch EP, Concepcion M: anestesia espinal continua con monitoreo hemodinámico invasivo para la reparación quirúrgica de la cadera en dos pacientes con estenosis aórtica severa. Anesth Analg 1995; 81(1):195–198.
- Bamford C, Sibley W, Laguna J: Anestesia en la esclerosis múltiple. Can J Neurol Sci 1978;5(1):41–44.
- Kytta J, Rosenberg PH: Anestesia para pacientes con esclerosis múltiple. Ann Chir Gynaecol 1984;73(5):299–303.
- Bouchard P, Caillet JB, Monnet F, Banssillon V: [Anestesia espinal y esclerosis múltiple]. Ann Fr Anesth Reanim 1984;3(3):194–198.
- Levesque P, Marsepoil T, Ho P, Venutolo F, Lesouef JM: [Esclerosis múltiple revelada por anestesia espinal]. Ann Fr Anesth Reanim 1988; 7(1):68–70.
- Vadalouca A, Moka E, Sykiotis C: técnica combinada espinal-epidural para la histerectomía total en una paciente con esclerosis múltiple progresiva avanzada. Reg Anesth Pain Med 2002;27(5):540–541.
- Horlocker TT, Wedel DJ: Anestesia regional en el paciente inmunocomprometido. Reg Anesth Pain Med 2006;31(4):334–345.
- Chin KJ, Macfarlane AJ, Chan V, Brull R: El uso de ultrasonido para facilitar la anestesia espinal en un paciente con laminectomía y fusión lumbar previas: Reporte de un caso. J Clin Ultrasound 2009;37(8):482–485.
- Prasad GA, Tumber PS, Lupu CM: anestesia espinal guiada por ultrasonido. Can J Anaesth 2008;55(10):716–717.
- Costello JF, Balki M: Parto por cesárea bajo anestesia espinal guiada por ultrasonido [corregida] en una parturienta con poliomielitis e instrumentación de Harrington. Can J Anaesth 2008;55(9):606–611.
- Douglas MJ, Swenerton JE: Anestesia epidural en tres parturientas con tatuajes lumbares: una revisión de las posibles implicaciones. Can J Anaesth 2002; 49(10):1057–1060.
- Mavropoulos A, Camann W: Uso de un tatuaje lumbar para ayudar a la anestesia espinal para el parto por cesárea. Int J Obstet Anesth 2009;18(1):98–99.
- Balki M, Carvalho JC: Náuseas y vómitos intraoperatorios durante la cesárea bajo anestesia regional. Int J Obstet Anesth 2005; 14(3):230–241.
- Mishriky BM, Habib AS: Metoclopramida para la profilaxis de náuseas y vómitos durante y después del parto por cesárea: revisión sistemática y metanálisis. Hermano J Anaesth 2012;108(3):374–383.
- Carpenter RL, Caplan RA, Brown DL, Stephenson C, Wu R: Incidencia y factores de riesgo de los efectos secundarios de la anestesia espinal. Anestesiología 1992;76(6):906–916.
- Evans CH: Principios y técnica de la anestesia espinal. Hober, 1929.
- Ure D, James KS, McNeill M, Booth JV: El glicopirrolato reduce las náuseas durante la anestesia espinal para la cesárea sin afectar el resultado neonatal. Br. J. Anaesth 1999;82(2):277–279.
- George RB, Allen TK, Habib AS: antagonistas de los receptores de serotonina para la prevención y el tratamiento del prurito, las náuseas y los vómitos en mujeres sometidas a cesárea con morfina intratecal: revisión sistemática y metanálisis. Anesth Analg 2009;109(1):174–182.
- Allen TK, Habib AS: Estimulación P6 para la prevención de las náuseas y los vómitos asociados con el parto por cesárea bajo anestesia neuroaxial: una revisión sistemática de ensayos controlados aleatorios. Anesth Analg 2008;107(4):1308–1312.
- Crowley LJ, Buggy DJ: Escalofríos y anestesia neuroaxial. Reg Anesth Pain Med 2008;33(3):241–252.
- Saito T, Sessler DI, Fujita K, Ooi Y, Jeffrey R: Efectos termorreguladores de la anestesia raquídea y epidural durante el parto por cesárea. Reg Anesth Pain Med 1998;23(4):418–423.
- Ballantyne JC, Loach AB, Carr DB: Prurito después de opiáceos epidurales y espinales. Pain 1988;33(2):149–160. Bauchat JR: revisión enfocada: morfina neuroaxial y reactivación del herpes oral en la población obstétrica. Anesth Analg 2010;111(5): 1238–1241.
- Crighton IM, Hobbs GJ, Reid MF: Ondansetrón para el tratamiento del prurito después de los opioides espinales. Anestesia 1996;51(2):199–200.
- Schaffartzik W, Hirsch J, Frickmann F, Kuhly P, Ernst A: Pérdida auditiva después de anestesia espinal y general: un estudio comparativo. Anesth Analg 2000;91(6):1466–1472.
- Karatas E, Goksu S, Durucu C, Isik Y, Kanlikama M: Evaluación de la pérdida auditiva después de la anestesia espinal con emisiones otoacústicas. Eur Arch Otorrinolaringol 2006;263(8):705–710.
- Lee CM, Peachman FA: Pérdida auditiva unilateral después de anestesia espinal tratada con parche hemático epidural. Anesth Analg 1986;65(3):312.
- Fog J, Wang LP, Sundberg A, Mucchiano C: La pérdida auditiva después de la anestesia espinal está relacionada con el tamaño de la aguja. Anesth Analg 1990;70(5):517–522.
- Finegold H, Mandell G, Vallejo M, Ramanathan S: ¿La anestesia espinal causa pérdida de audición en la población obstétrica? anesth analg
2002;95(1):198–203; Tabla de contenido. - Michel O, Brusis T: Hipoacusia como secuela de punción lumbar. Ann Otol Rhinol Laryngol 1992;101(5):390–394.
- Mulroy MF, Alley EA: Manejo de los volúmenes de la vejiga cuando se usa anestesia neuroaxial. Int Anesthesiol Clin 2012;50(1):101–110.
- Choi S, Mahon P, Awad IT: Anestesia neuroaxial y disfunción de la vejiga en el período perioperatorio: una revisión sistemática. Can J Anaesth 2012;59(7):681–703.
- Lambert DH: Complicaciones de la anestesia espinal. Int Anesthesiol Clin 1989;27(1):51–55.
- Harrington BE: Cefalea posterior a la punción dural y el desarrollo del parche hemático epidural. Reg Anesth Pain Med 2004;29(2):136–163; discusión 35.
- Vandam LD, Dripps RD: Seguimiento a largo plazo de pacientes que recibieron 10,098 anestésicos espinales; síndrome de disminución de la presión intracraneal (dolor de cabeza y dificultades oculares y auditivas). JAMA 1956;161(7): 586–591.
- Choi PT, Galinski SE, Takeuchi L, Lucas S, Tamayo C, Jadad AR: La CPPD es una complicación común del bloqueo neuroaxial en las parturientas: un metanálisis de estudios obstétricos. Can J Anaesth 2003;50(5): 460–469.
- Horlocker TT: Complicaciones de la anestesia espinal y epidural. Anesthesiol Clin North Am 2000;18(2):461–485.
- Horlocker TT, McGregor DG, Matsushige DK, Schroeder DR, Besse JA: Una revisión retrospectiva de 4767 anestésicos espinales consecutivos: central
Complicaciones del sistema nervioso. Grupo de Resultados Perioperatorios. Anesth Analg 1997;84(3):578–584. - Reiss W, Shariat AN, Kurapati S, Hadzic A: Inyecciones intraneurales. Reg Anesth Pain Med 2011;36(1):97–98.
- Burke D, Wildsmith JA: Meningitis después de la anestesia espinal. Hermano J Anaesth 1997;78(6):635–636.
- Goldman WW Jr, Sanford JP: Una "epidemia" de meningitis química. Am J Med 1960;29:94–101.
- Hurst EW: aracnoiditis adhesiva y bloqueo vascular causado por detergentes y otros irritantes químicos: un estudio experimental. Pathol
Bacteriol 1955;70(1):167–178.Marinac JS: Meningitis aséptica inducida por fármacos y productos químicos: una revisión de la literatura. Ann Pharmacother 1992;26(6):813–822. - Carp H, Bailey S: La asociación entre meningitis y punción dural en ratas bacteriémicas. Anestesiología 1992;76(5):739–742.
- Teele DW, Dashefsky B, Rakusan T, Klein JO: Meningitis después de una punción lumbar en niños con bacteriemia. N Engl J Med 1981;305(18):1079–1081.
- Eng RH, Seligman SJ: Meningitis inducida por punción lumbar. JAMA 1981;245(14):1456–1459.
- Conangla G, Rodriguez L, Alonso-Tarres C, Avila A, de la Campa AG: [Meningitis por Streptococcus salivarius posanestesia espinal]. Neurología
2004;19(6):331–333. - Pandian JD, Sarada C, Radhakrishnan VV, Kishore A: Meningitis iatrogénica después de una punción lumbar: un peligro para la salud prevenible. J Hosp Infect 2004;56(2):119–124.
- Kocamanoglu IS, Sener EB, Tur A, Ustun E, Sahinoglu H: Meningitis estreptocócica después de anestesia espinal: reporte de un caso. Can J Anaesth 2003; 50(3):314–315.
- Yaniv LG, Potasman I: Meningitis iatrogénica: ¿un papel cada vez mayor para los estreptococos viridans resistentes? Caso clínico y revisión de los últimos 20 años. Scand J Infect Dis 2000;32(6):693–696.
- Santillan A, Nacarino V, Greenberg E, Riina HA, Gobin YP, Patsalides A: Anatomía vascular de la médula espinal. J Neurointerv Surg 2012;4(1):
67-74. - Ilias WK, Klimscha W, Skrbensky G, Weinstabl R, Widhalm A: Anestesia microespinal continua: otra perspectiva sobre los mecanismos
inducir el síndrome de cauda equina. Anestesia 1998;53(7):618–623. - Rigler ML, Drasner K, Krejcie TC, et al: Síndrome de cauda equina después de anestesia espinal continua. Anesth Analg 1991;72(3):275–281.
- Benson JS: Alerta de seguridad de la Administración de Drogas y Alimentos de EE. UU.: Síndrome de cauda equina asociado con el uso de catéteres de pequeño calibre en anestesia espinal continua. AANA J 1992;60(3):223.
- Mollmann M, Holst D, Lubbesmeyer H, Lawin P: Anestesia espinal continua: problemas mecánicos y técnicos de la colocación del catéter. Reg Anesth 1993;18(6 Suplemento):469–472.
- Loo CC, Irestedt L: Síndrome de cauda equina después de anestesia espinal con lignocaína hiperbárica al 5%: una revisión de seis casos de síndrome de cauda equina informados al Seguro Farmacéutico Sueco 1993–1997. Acta Anaesthesiol Scand 1999;43(4):371–379.
- Panadero A, Monedero P, Fernandez-Liesa JI, Percaz J, Olavide I, Iribarren MJ: Síntomas neurológicos transitorios repetidos después de anestesia espinal con lidocaína hiperbárica al 5%. Br. J. Anaesth 1998;81(3): 471–472.
- Pavon A, Anadon Senac P: [Neurotoxicidad de la lidocaína intratecal]. Rev Esp Anestesiol Reanim 2001;48(7):326–336.
- Moen V, Dahlgren N, Irestedt L: Complicaciones neurológicas graves después de bloqueos neuroaxiales centrales en Suecia 1990–1999. Anestesiología 2004;101(4):950–959.
- Akioka K, Torigoe K, Maruta H, et al: Un caso de síndrome de cola de caballo después de la anestesia espinal con dibucaína hiperbárica. J Anesth 2001;
15 (2): 106-107. - Lopez-Soriano F, Lajarin B, Verdu JM, Rivas F, Lopez-Robles J: Hemisindrome de cauda equina tras anestesia intradural con bupivacaína para
cirugía de cadera]. Rev Esp Anestesiol Reanim 2002;49(9):494–496. - Vianna PT, Resende LA, Ganem EM, Gabarra RC, Yamashita S, Barreira AA: Síndrome de cauda equina después de tetracaína espinal: evaluación electromiográfica: seguimiento de 20 años. Anestesiología 2001;95(5): 1290–1291.
- Woods WW, Franklin RG: Aracnoiditis adhesiva progresiva después de la anestesia espinal. Calif Med 1951;75(3):196–198.
- Joseph SI, Denson JS: Anestesia espinal, aracnoiditis y paraplejia. JAMA 1958;168(10):1330–1333.
- Parnass SM, Schmidt KJ: Efectos adversos de la anestesia espinal y epidural. Drug Saf 1990;5(3):179–194.
- Roche J: Aracnoiditis inducida por esteroides. Med J Aust 1984;140(5):281–284.
- Aldrete JA: Déficits neurológicos y aracnoiditis después de la anestesia neuroaxial. Acta Anaesthesiol Scand 2003;47(1):3–12.
- Yokoyama M, Itano Y, Kusume Y, Oe K, Mizobuchi S, Morita K: La anestesia espinal total proporciona un alivio transitorio del dolor intratable. Can J Anaesth 2002;49(8):810–813.
- Auroy Y, Benhamou D, Bargues L, et al: Complicaciones mayores de la anestesia regional en Francia: Servicio de línea directa de anestesia regional SOS.
Anesthesiology 2002;97(5):1274–1280. - Vandam LD, Dripps RD: Seguimiento a largo plazo de pacientes que recibieron 10,098 anestésicos espinales. IV. Enfermedad neurológica incidental a traumática
punción lumbar durante la anestesia espinal. JAMA 1960; 172: 1483–1487. - Aromaa U, Lahdensuu M, Cozanitis DA: Complicaciones graves asociadas con anestesia epidural y espinal en Finlandia 1987–1993. Un estudio
basado en reclamos de seguros de pacientes [ver comentario]. Acta Anaesthesiol Scand 1997;41(4):445–452. - Auroy Y, Narchi P, Messiah A, Litt L, Rouvier B, Samii K: complicaciones graves relacionadas con la anestesia regional: resultados de una encuesta prospectiva en Francia. Anestesiología 1997;87(3):479–486.
- Brull R, McCartney CJ, Chan VW, El-Beheiry H: Complicaciones neurológicas después de la anestesia regional: Estimaciones contemporáneas del riesgo.
Anesth Analg 2007;104(4):965–974. - Buggy DJ: Bloqueo del nervio neuroaxial central: Definición más clara del riesgo. Br. J. Anaesth 2009;102(2):151–153.
- van Zundert AA, Stultiens G, Jakimowicz JJ, et al: colecistectomía laparoscópica bajo anestesia espinal torácica segmentaria: una viabilidad
estudiar. Hermano J Anaesth 2007;98(5):682–686. - van Zundert AA, Stultiens G, Jakimowicz JJ, van den Borne BE, van der Ham WG, Wildsmith JA: Anestesia espinal segmentaria para la colecistectomía en un paciente con enfermedad pulmonar grave. Br J Anaesth 2006; 96(4):464–466.
- Hamad MA, El-Khattary OA: colecistectomía laparoscópica bajo anestesia espinal con neumoperitoneo con óxido nitroso: un estudio de viabilidad. Surg Endosc 2003;17(9):1426–1428.
- Tzovaras G, Fafoulakis F, Pratsas K, Georgopoulou S, Stamatiou G, Hatzitheofilou C: colecistectomía laparoscópica bajo anestesia espinal: un estudio piloto. Surg Endosc 2006;20(4):580–582.
- Tzovaras G, Fafoulakis F, Pratsas K, Georgopoulou S, Stamatiou G, Hatzitheofilou C: Anestesia espinal versus anestesia general para la colecistectomía laparoscópica: análisis intermedio de un ensayo aleatorizado controlado. Arch Surg 2008;143(5):497–501.
- Yuksek YN, Akat AZ, Gozalan U, et al: colecistectomía laparoscópica bajo anestesia espinal. Am J Surg 2008;195(4):533–536.
- Cook TM: Informe y hallazgos del 3er Proyecto de Auditoría Nacional del Royal College of Anesthetists. 2009: 17–26.
- Guay J: El efecto de los bloqueos del nervio neuroaxial en la pérdida de sangre quirúrgica y los requisitos de transfusión de sangre: un metanálisis. J Clin Anesth 2006;18(2):
124-128. - Mauermann WJ, Shilling AM, Zuo Z: Una comparación del bloqueo del nervio neuroaxial versus la anestesia general para el reemplazo total de cadera electivo: un metanálisis. Anesth Analg 2006;103(4):1018–1025.
- Afolabi BB, Lesi FE, Merah NA: Anestesia regional versus general para la cesárea. Base de datos Cochrane Syst Rev 2006(4):CD004350.
- Reynolds F, Seed PT: Anestesia para cesárea y estado ácido-base neonatal: un metanálisis. Anestesia 2005;60(7):636–653.
- Beaupre LA, Jones CA, Saunders LD, Johnston DW, Buckingham J, Majumdar SR: Mejores prácticas para pacientes ancianos con fractura de cadera. Una revisión sistemática de la evidencia. J Gen Intern Med 2005;20(11): 1019–1025.
- Rodgers A, Walker N, Schug S, et al: Reducción de la mortalidad y morbilidad postoperatorias con anestesia epidural o espinal: resultados de la descripción general de ensayos aleatorios. BMJ 2000;321(7275):1493.
- Parker MJ, Handoll HH, Griffiths R: Anestesia para la cirugía de fractura de cadera en adultos. Base de datos Cochrane Syst Rev 2004(4):CD000521.
- Lee TW, Grocott HP, Schwinn D, Jacobsohn E: Anestesia espinal alta para cirugía cardíaca: efectos sobre la función del receptor beta-adrenérgico, la respuesta al estrés y la hemodinámica. Anestesiología 2003;98(2):499–510.
- Hall R, Adderley N, MacLaren C, et al: ¿La morfina intratecal altera la respuesta al estrés después de la cirugía de injerto de derivación de la arteria coronaria? Can J Anaesth 2000;47(5):463–466.
- Parlow JL, Steele RG, O'Reilly D: La morfina intratecal en dosis bajas facilita la extubación temprana después de la cirugía cardíaca: resultados de una auditoría retrospectiva de mejora continua de la calidad. Can J Anaesth 2005;52(1):94–99.
- Liu SS, Nerve Block BM, Wu CL: Efectos de la analgesia neuroaxial central perioperatoria sobre el resultado después de una cirugía de derivación de la arteria coronaria: un metanálisis. Anestesiología 2004;101(1):153–161.
- Agarwal D, Mohta M, Tyagi A, Sethi AK: bloqueo del nervio subdural y el anestesista. Anaesth Cuidados Intensivos 2010;38(1):20–26.
- Reina MA, De Leon Casasola O, Lopez A, De Andres JA, Mora M, Fernandez A: El origen del espacio subdural espinal: hallazgos de ultraestructura. Anesth Analg 2002;94(4):991–995; Tabla de contenido.
- Broadbent CR, Maxwell WB, Ferrie R, Wilson DJ, Gawne-Cain M, Russell R: capacidad de los anestesistas para identificar un espacio intermedio lumbar marcado. Anestesia 2000;55(11):1122–1126.
- Saifuddin A, Burnett SJ, White J: La variación de la posición del cono medular en una población adulta. Un estudio de resonancia magnética. Spine (Phila Pa 1976) 1998;23(13):1452–1456.
- Reiman A, Anson B: Terminación vertebral de la médula espinal con reporte de un caso de médula sacra. Rec. Anat 1944;88:127.
- Bromage PR: Complicaciones neurológicas de la anestesia subaracnoidea y epidural. Acta Anaesthesiol Scand 1997;41(4):439–444.
- Reynolds F: Daño al cono medular después de la anestesia espinal. Anestesia 2001;56(3):238–247.
- Covino BG: Farmacología de los agentes anestésicos locales. Hermano J Anaesth 1986;58(7):701–716.
- Greene NM: Captación y eliminación de anestésicos locales durante la anestesia espinal. Anesth Analg 1983;62(11):1013–1024.
- Stienstra R, Greene NM: Factores que afectan la propagación subaracnoidea de las soluciones anestésicas locales. Reg Anesth 1991;16(1):1–6.
- Cohen ES: Distribución de agentes anestésicos locales en el neuroeje del perro. Anestesiología 1968;29(5):1002–1005.
- Schell RM, Brauer FS, Cole DJ, Applegate RL 2.º: Deficiencias persistentes de la raíz nerviosa sacra después de la anestesia raquídea continua. Can J Anaesth 1991;38(7):908–911.
- Hogan Q: Tamaño de las raíces nerviosas torácicas inferiores y lumbosacras humanas. Anestesiología 1996;85(1):37–42.
- Kaneko S, Matsumoto M, Tsuruta S, Hirata T, Gondo T, Sakabe T: La zona de entrada de la raíz nerviosa es muy vulnerable a la tetracaína intratecal en conejos. Anesth Analg 2005;101(1):107–114; Tabla de contenido.
- Takenami T, Yagishita S, Asato F, Hoka S: La neurotoxicidad de la tetracaína administrada por vía intratecal comienza en las raíces posteriores cerca de la entrada en la médula espinal. Reg Anesth Pain Med 2000;25(4):372–379.
- Kristensen JD, Karlsten R, Gordh T: flujo sanguíneo de la médula espinal después de la inyección intratecal de ropivacaína y bupivacaína con o sin epinefrina en ratas. Acta Anaesthesiol Scand 1998;42(6):685–690.
- Dohi S, Matsumiya N, Takeshima R, Naito H: Los efectos de la lidocaína subaracnoidea y la fenilefrina en la médula espinal y el flujo sanguíneo cerebral en perros. Anestesiología 1984;61(3):238–244.
- Kozody R, Palahniuk RJ, Cumming MO: flujo sanguíneo de la médula espinal después de la tetracaína subaracnoidea. Can Anaesth Soc J 1985;32(1):23–29.
- Greene NM: Distribución de soluciones anestésicas locales dentro del espacio subaracnoideo. Anesth Analg 1985;64(7):715–730.
- Horlocker TT, Wedel DJ: Densidad, gravedad específica y baricidad de las soluciones anestésicas espinales a temperatura corporal. Anesth Analg 1993;76(5): 1015–1018.
- Hallworth SP, Fernando R, Columb MO, Stocks GM: El efecto de la postura y la baricidad en la propagación de la bupivacaína intratecal para el parto por cesárea electiva. Anesth Analg 2005;100(4):1159–1165.
- McLeod GA: Densidad de soluciones anestésicas espinales de bupivacaína, levobupivacaína y ropivacaína con y sin dextrosa. Br. J. Anaesth 2004;92(4):547–551.
- Brown DT, Wildsmith JA, Covino BG, Scott DB: Efecto de la baricidad en la anestesia espinal con ametocaína. Br. J. Anaesth 1980;52(6):589–596.
- Siker ES, Wolfson B, Stewart WD, Pavilack P, Pappas MT: Mepivacaína para anestesia espinal: Efectos de los cambios en la concentración y la baricidad. Anesth Analg 1966;45(2):191–196.
- Chambers WA, Edstrom HH, Scott DB: Efecto de la baricidad en la anestesia espinal con bupivacaína. Hermano J Anaesth 1981;53(3):279–282.
- Denson DD, Bridenbaugh PO, Turner PA, Phero JC: Comparación del bloqueo neural y la farmacocinética después de la lidocaína subaracnoidea en el mono rhesus. II: Efectos de volumen, osmolalidad y baricidad. Anesth Analg 1983;62(11):995–1001.
- Hare GM, Ngan JC: Determinación de la densidad de mezclas de opioides anestésicos locales para anestesia espinal. Can J Anaesth 1998;45(4):341–346.
- Bodily MN, Carpenter RL, Owens BD: Anestesia espinal con lidocaína al 0.5%: una solución hipobárica para la cirugía perirrectal de corta estancia. Can J Anaesth 1992;39(8):770–773.
- Lui AC, Polis TZ, Cicutti NJ: Densidades del líquido cefalorraquídeo y soluciones anestésicas espinales en pacientes quirúrgicos a temperatura corporal. Can J Anaesth 1998;45(4):297–303.
- Hogan QH, Prost R, Kulier A, Taylor ML, Liu S, Mark L: Imágenes por resonancia magnética del volumen de líquido cefalorraquídeo y la influencia del hábito corporal y la presión abdominal. Anestesiología 1996;84(6): 1341–1349.
- Carpenter RL, Hogan QH, Liu SS, Crane B, Moore J: El volumen de líquido cefalorraquídeo lumbosacro es el principal determinante de la extensión y duración del bloqueo de los nervios sensoriales durante la anestesia espinal. Anestesiología 1998;89(1): 24–29.
- Higuchi H, Hirata J, Adachi Y, Kazama T: Influencia de la densidad, la velocidad y el volumen del líquido cefalorraquídeo lumbosacro en el alcance y la duración de la anestesia espinal simple con bupivacaína. Anestesiología 2004;100(1): 106–114.
- Schneider M, Ettlin T, Kaufmann M, et al: Toxicidad neurológica transitoria después de la anestesia subaracnoidea hiperbárica con lidocaína al 5%. Anesth Analg 1993;76(5):1154–1157.
- Zaric D, Christiansen C, Pace NL, Punjasawadwong Y: síntomas neurológicos transitorios después de la anestesia espinal con lidocaína versus otros anestésicos locales: una revisión sistemática de ensayos controlados aleatorios. Anesth Analg 2005;100(6):1811–1816.
- Wang BC, Hillman DE, Spielholz NI, Turndorf H: Déficits neurológicos crónicos y nesacaína-CE: ¿un efecto del anestésico 2-cloroprocaína o del antioxidante bisulfito de sodio? Anesth Analg 1984;63(4):445–447.
- Smith KN, Kopacz DJ, McDonald SB: 2-cloroprocaína espinal: un estudio de rango de dosis y el efecto de la epinefrina añadida. Anesth Analg 2004;98(1):81–88; Tabla de contenido.
- Hejtmanek MR, Pollock JE: Cloroprocaína para anestesia espinal: un análisis retrospectivo. Acta Anaesthesiol Scand 2011;55(3):267–272.
- Pollock JE: Cloroprocaína intratecal: aún no es "segura" según los parámetros de la FDA de EE. UU. Int Anesthesiol Clin 2012;50(1):93–100.
- Le Truong HH, Girard M, Drolet P, Grenier Y, Boucher C, Bergeron L: anestesia espinal: una comparación de procaína y lidocaína. Can J Anaesth 2001;48(5):470–473.
- Johnson ME: Neurotoxicidad de la procaína espinal: una precaución. Reg Anesth Pain Med 2001;26(3):288.
- Hampl KF, Schneider MC, Ummenhofer W, Drewe J: síntomas neurológicos transitorios después de la anestesia espinal. Anesth Analg 1995; 81(6):1148–1153.
- Hampl KF, Heinzmann-Wiedmer S, Luginbuehl I, et al: síntomas neurológicos transitorios después de la anestesia espinal: una incidencia más baja con prilocaína y bupivacaína que con lidocaína. Anestesiología 1998; 88(3):629–633.
- Keld DB, Hein L, Dalgaard M, Krogh L, Rodt SA: La incidencia de síntomas neurológicos transitorios (TNS) después de la anestesia espinal en pacientes sometidos a cirugía en posición supina. Lidocaína hiperbárica al 5% versus bupivacaína hiperbárica al 0.5%. Acta Anaesthesiol Scand 2000; 44(3):285–290.
- Freedman JM, Li DK, Drasner K, Jaskela MC, Larsen B, Wi S: síntomas neurológicos transitorios después de la anestesia espinal: un estudio epidemiológico de 1863 pacientes. Anestesiología 1998;89(3):633–641.
- Sumi M, Sakura S, Kosaka Y: Tetracaína intratecal hiperbárica al 0.5 % como posible causa de toxicidad neurológica transitoria. Anesth Analg 1996; 82(5):1076–1077.
- Sakura S, Sumi M, Sakaguchi Y, Saito Y, Kosaka Y, Drasner K: La adición de fenilefrina contribuye al desarrollo de transitorios
síntomas neurológicos después de la anestesia espinal con tetracaína al 0.5%. Anestesiología 1997;87(4):771–778. - Liguori GA, Zayas VM, Chisholm MF: Síntomas neurológicos transitorios después de la anestesia espinal con mepivacaína y lidocaína. anestesiología
1998;88(3):619–623. - Salazar F, Bogdanovich A, Adalia R, Chabas E, Gomar C: Síntomas neurológicos transitorios tras raquianestesia con isobárica al 2%
mepivacaína y lidocaína isobárica al 2%. Acta Anaesthesiol Scand 2001; 45(2):240–245. - Eberhart LH, Morin AM, Kranke P, Geldner G, Wulf H: [Síntomas neurológicos transitorios después de la anestesia espinal. Una sistemática cuantitativa
descripción general (metanálisis) de estudios controlados aleatorios]. Anestesista 2002;51(7):539–546. - Ganapathy S, Sandhu HB, Stockall CA, Hurley D: síntoma neurológico transitorio (TNS) después de la ropivacaína intratecal. Anestesiología 2000;93(6):1537–1539.
- Lee YY, Ngan Kee WD, Chang HK, So CL, Gin T: ropivacaína espinal para cirugía de miembros inferiores: un estudio de respuesta a la dosis. Anesth Analg 2007;105(2):520–523.
- Khaw KS, Ngan Kee WD, Wong EL, Liu JY, Chung R: ropivacaína espinal para la cesárea: un estudio de búsqueda de dosis. Anestesiología 2001;95(6):1346–1350.
- Frawley G, Skinner A, Thomas J, Smith S: Anestesia espinal con ropivacaína en recién nacidos: un estudio de búsqueda de rango de dosis. pediatra anesth
2007;17(2):126–132. - McDonald SB, Liu SS, Kopacz DJ, Stephenson CA: ropivacaína espinal hiperbárica: una comparación con la bupivacaína en voluntarios. anestesiología
1999;90(4):971–977. - Wahedi W, Nolte H, Klein P: [Ropivacaína para anestesia espinal. Un estudio de búsqueda de dosis]. Anestesista 1996;45(8):737–744.
- van Kleef JW, Veering BT, Burm AG: Anestesia espinal con ropivacaína: un estudio doble ciego sobre la eficacia y seguridad de 0.5 % y 0.75 %
soluciones en pacientes sometidos a cirugía menor de miembros inferiores. Anesth Analg 1994;78(6):1125–1130. - Hughes D, Hill D, Fee JP: ropivacaína intratecal o bupivacaína con fentanilo para el trabajo de parto. Hermano J Anaesth 2001;87(5):733–737.
- Breebaart MB, Vercauteren MP, Hoffmann VL, Adriaensen HA: exploración de la vejiga urinaria después de una artroscopia ambulatoria bajo anestesia espinal: comparación entre lidocaína, ropivacaína y levobupivacaína. Br. J. Anaesth 2003;90(3):309–313.
- Brown DL: Anestesia espinal, epidural y caudal. En Miller RD (ed.). Anestesia, 4ª ed. Churchill Livingston, 1994, págs. 1505–1533.
- Pawlowski J, Sukhani R, Pappas AL, et al: El perfil anestésico y de recuperación de dos dosis (60 y 80 mg) de mepivacaína simple para pacientes ambulatorios
anestesia espinal. Anesth Analg 2000;91(3):580–584. - Kallio H, Snall EV, Kero MP, Rosenberg PH: una comparación de soluciones simples intratecales que contienen ropivacaína 20 o 15 mg versus bupivacaína 10 mg. Anesth Analg 2004;99(3):713–717; Tabla de contenido.
- McNamee DA, Parks L, McClelland AM, et al: ropivacaína intratecal para artroplastia total de cadera: estudio comparativo doble ciego con isobárico
Soluciones de 7.5 mg ml(-1) y 10 mg ml(-1). Hermano J Anaesth 2001;87(5):743–747. - Burke D, Kennedy S, Bannister J: Anestesia raquídea con S(-)-bupivacaína al 0.5 % para cirugía electiva de las extremidades inferiores. Reg Anesth Pain Med 1999;24(6):519–523.
- Glaser C, Marhofer P, Zimpfer G, et al: Levobupivacaína versus bupivacaína racémica para anestesia espinal. Anesth Analg 2002;94(1):194–198;
Tabla de contenido. - Alley EA, Kopacz DJ, McDonald SB, Liu SS: Levobupivacaína espinal hiperbárica: una comparación con la bupivacaína racémica en voluntarios. Anesth Analg 2002;94(1):188–193; Tabla de contenido.
- Bridenbaugh PO, Greene NM, Brull SJ: Bloqueo neural espinal (subaracoideo). En Primos MJ, Bridenbaugh PO (eds). Bloqueo neural, 3ª ed. Lippincott-Raven, 1998.
- Tetzlaff JE, Dilger J, Yap E, Smith MP, Schoenwald PK: Síndrome de cauda equina después de la anestesia espinal en un paciente con enfermedad vascular grave. Can J Anaesth 1998;45(7):667–669.
- Lee DS, Bui T, Ferrarese J, Richardson PK: Síndrome de cauda equina después de anestesia espinal total incidental con lidocaína al 2%. J Clin Anesth 1998;10(1):66–69.
- Maehara Y, Kusunoki S, Kawamoto M, et al: Un ensayo multicéntrico prospectivo para determinar la incidencia de síntomas neurológicos transitorios después de la anestesia espinal con fenilefrina añadida a tetracaína al 0.5 %. Hiroshima J Med Sci 2001;50(2):47–51.
- Kozody R, Palahniuk RJ, Wade JG, Cumming MO, Pucci WR: El efecto de la epinefrina subaracnoidea y la fenilefrina en el flujo sanguíneo de la médula espinal. Can Anaesth Soc J 1984;31(5):503–508.
- Porter SS, Albin MS, Watson WA, Bunegin L, Pantoja G: Respuestas del flujo sanguíneo cerebral y de la médula espinal a la inyección subaracnoidea de anestésicos locales con y sin epinefrina. Acta Anaesthesiol Scand 1985;29(3):330–338.
- Concepcion M, Maddi R, Francis D, Rocco AG, Murray E, Covino BG: Vasoconstrictores en anestesia espinal con tetracaína: una comparación de
epinefrina y fenilefrina. Anesth Analg 1984;63(2):134–138. - Armstrong IR, Littlewood DG, Chambers WA: Anestesia espinal con tetracaína: efecto de los vasoconstrictores agregados. Anesth Analg 1983;62(9):
793-795. - Rice LJ, DeMars PD, Whalen TV, Crooms JC, Parkinson SK: Duración de la anestesia espinal en bebés menores de un año de edad. Comparación de tres técnicas hiperbáricas. Reg Anesth 1994;19(5):325–329.
- Chambers WA, Littlewood DG, Scott DB: Anestesia espinal con bupivacaína hiperbárica: efecto de los vasoconstrictores agregados. anesth analg
1982;61(1):49–52. - Moore JM, Liu SS, Pollock JE, Neal JM, Knab JH: El efecto de la epinefrina en la anestesia espinal con bupivacaína hiperbárica en dosis pequeñas: clínica
Implicaciones para la cirugía ambulatoria. Anesth Analg 1998;86(5):973–977. - Racle JP, Poy JY, Benkhadra A, Jourdren L, Fockenier F: [Prolongación de la anestesia espinal con bupivacaína hiperbárica por adrenalina y
clonidina en el anciano]. Ann Fr Anesth Reanim 1988;7(2):139–144. - Vercauteren MP, Jacobs S, Jacquemyn Y, Adriaensen HA: analgesia intratecal durante el trabajo de parto con bupivacaína y sufentanilo: el efecto de agregar 2.25 microgramos de epinefrina. Reg Anesth Pain Med 2001;26(5):473–477.
- Goodman SR, Kim-Lo SH, Ciliberto CF, Ridley DM, Smiley RM: La epinefrina no es una adición útil al fentanilo o la fentanilbupivacaína intratecal para la analgesia del trabajo de parto. Reg Anesth Pain Med 2002;27(4):374–379.
- Gautier PE, Debry F, Fanard L, Van Steenberge A, Hody JL: analgesia espinal-epidural combinada ambulatoria para el trabajo de parto. Influencia de la epinefrina en la combinación bupivacaína-sufentanilo. Reg Anesth 1997;22(2):143–149.
- Chambers WA, Littlewood DG, Logan MR, Scott DB: Efecto de la epinefrina añadida en la anestesia espinal con lidocaína. Anesth Analg 1981;60(6):417–420.
- Chiu AA, Liu S, Carpenter RL, Kasman GS, Pollock JE, Neal JM: Los efectos de la epinefrina en la anestesia espinal con lidocaína: un estudio cruzado.
Anesth Analg 1995;80(4):735–739. - Racle JP, Benkhadra A, Poy JY: Anestesia subaracnoidea producida por lidocaína hiperbárica en pacientes de edad avanzada. Prolongación del efecto con
adrenalina Hermano J Anaesth 1988;60(7):831–835. - Spivey DL: La epinefrina no prolonga la anestesia espinal con lidocaína en parturientas a término. Anesth Analg 1985;64(5):468–470.
- Moore DC, Chadwick HS, Ready LB: la epinefrina prolonga la lidocaína espinal: el dolor en el sitio operatorio es el método más preciso para determinar
Duración de la anestesia local. Anestesiología 1987;67(3):416–418. - Glynn CJ, Mather LE, Cousins MJ, Wilson PR, Graham JR: Narcóticos espinales y depresión respiratoria. Lancet 1979;2(8138):356–357.
- Cunningham AJ, McKenna JA, Skene DS: Anestesia espinal de inyección única con ametocaína y morfina para la prostatectomía transuretral. Br. J. Anaesth 1983;55(5):423–427.
- Nordberg G, Hedner T, Mellstrand T, Dahlstrom B: aspectos farmacocinéticos de la analgesia con morfina intratecal. Anestesiología 1984;60(5): 448–454.
- Abouleish E, Rawal N, Rashad MN: La adición de 0.2 mg de morfina subaracnoidea a la bupivacaína hiperbárica para el parto por cesárea: un estudio prospectivo de 856 casos. Reg Anesth 1991;16(3):137–140.
- Borgeat A, Singer T: Náuseas y vómitos después de la anestesia espinal con morfina. Acta Anaesthesiol Scand 1998;42(10):1231.
- Bonnet F, Buisson VB, Francois Y, Catoire P, Saada M: Efectos de la clonidina oral y subaracnoidea en la anestesia espinal con bupivacaína. registro
Anesth 1990;15(4):211–214. - Dobrydnjov I, Axelsson K, Thorn SE, et al: Clonidina combinada con dosis pequeñas de bupivacaína durante la anestesia espinal para la herniorrafia inguinal: un estudio aleatorizado doble ciego. Anesth Analg 2003;96(5):1496–1503; Tabla de contenido.
- Strebel S, Gurzeler JA, Schneider MC, Aeschbach A, Kindler CH: dosis pequeñas de clonidina intratecal y bupivacaína isobárica para tratamientos ortopédicos
cirugía: un estudio de dosis-respuesta. Anesth Analg 2004;99(4):1231–1238;índice. - Filos KS, Goudas LC, Patroni O, Polyzou V: perfil hemodinámico y analgésico después de la clonidina intratecal en humanos. Una dosis-respuesta
estudiar. Anestesiología 1994;81(3):591–601; discusión 27A–28A. - Hassenbusch SJ, Gunes S, Wachsman S, Willis KD: Clonidina intratecal en el tratamiento del dolor intratable: un estudio de fase I/II. Pain Med 2002;3(2):85–91.
- Ackerman LL, Follett KA, Rosenquist RW: Resultados a largo plazo durante el tratamiento del dolor crónico con clonidina intratecal o combinaciones de clonidina/opioide. J Pain Symptom Manage 2003;26(1):668–677.
- Chen SR, Khan GM, Pan HL: El efecto antialodínico de la neostigmina intratecal está mediado por el óxido nítrico espinal en un modelo de dolor neuropático diabético en ratas. Anestesiología 2001;95(4):1007–1012.
- Ho KM, Ismail H, Lee KC, Branch R: Uso de neostigmina intratecal como complemento de otros medicamentos espinales en la analgesia perioperatoria y periparto: un metanálisis. Anaesth Cuidados Intensivos 2005;33(1):41–53.
- Yegin A, Yilmaz M, Karsli B, Erman M: Efectos analgésicos de la neostigmina intratecal en cirugía perianal. Eur J Anaesthesiol 2003;20(5): 404–408.
- Tan PH, Kuo JH, Liu K, Hung CC, Tsai TC, Deng TY: Eficacia de la neostigmina intratecal para el alivio del dolor de hemiorrafia posinguinal. Acta Anaesthesiol Scand 2000;44(9):1056–1060.
- Klohr S, Roth R, Hofmann T, Rossaint R, Heesen M: Definiciones de hipotensión después de la anestesia espinal para la cesárea: Búsqueda de literatura y aplicación a las parturientas. Acta Anaesthesiol Scand 2010; 54(8):909–921.
- Mark JB, Steele SM: Efectos cardiovasculares de la anestesia espinal. Int Anesthesiol Clin 1989;27(1):31–39.
- Cooper DW: manejo vasopresor de parto por cesárea. Curr Opin Anaesthesiol 2012;25(3):300–308.
- Khaw KS, Ngan Kee WD, Lee SW: Hipotensión durante la anestesia espinal para la cesárea: implicaciones, detección, prevención y tratamiento. Fetal Matern Med Rev 2006;17(2):157–183.
- Shimosato S, Etsten BE: El papel del sistema venoso en la dinámica cardiocirculatoria durante la anestesia espinal y epidural en el hombre. Anestesiología 1969;30(6):619–628.
- Cooper J: Paro cardíaco durante la anestesia espinal. Anesth Analg 2001; 93(1):245.
- Salinas FV, Sueda LA, Liu SS: Fisiología de la anestesia espinal y sugerencias prácticas para una anestesia espinal exitosa. Best Pract Res Clin Anaesthesiol 2003;17(3):289–303.
- Meyhoff CS, Hesselbjerg L, Koscielniak-Nielsen Z, Rasmussen LS: cambios en el gasto cardíaco bifásico durante el inicio de la anestesia espinal en pacientes de edad avanzada. Eur J Anaesthesiol 2007;24(9):770–775.
- Roy L, Ramanathan S: depresión del segmento ST y contractilidad miocárdica durante la cesárea bajo anestesia espinal. Can J Anaesth 1999;46(1):52–55.
- Ou CH, Tsou MY, Ting CK, Chiou CS, Chan KH, Tsai SK: Ocurrencia del reflejo de Bezold-Jarisch durante una cesárea bajo anestesia espinal: informe de un caso. Acta Anaesthesiol Taiwán 2004;42(3):175–178.
- Mackey DC, Carpenter RL, Thompson GE, Brown DL, Bodily MN: bradicardia y asistolia durante la anestesia espinal: informe de tres casos sin morbilidad. Anestesiología 1989;70(5):866–868.
- Campagna JA, Carter C: Relevancia clínica del reflejo de Bezold-Jarisch. Anestesiología 2003;98(5):1250–1260.
- Lesser JB, Sanborn KV, Valskys R, Kuroda M: bradicardia severa durante la anestesia espinal y epidural registrada por un sistema de gestión de información de anestesia. Anestesiología 2003;99(4):859–866.
- Kinsella SM, Tuckey JP: bradicardia perioperatoria y asistolia: relación con el síncope vasovagal y el reflejo de Bezold-Jarisch. Hermano J Anaesth 2001;86(6):859–868.
- Bernards CM, Hymas NJ: Progresión del bloqueo del nervio cardíaco de primer grado al bloqueo del nervio de segundo grado de alto grado durante la anestesia espinal. Can J Anaesth 1992;39(2):173–175.
- Tarkkila P, Isola J: Un modelo de regresión para identificar pacientes con alto riesgo de hipotensión, bradicardia y náuseas durante la anestesia espinal. Acta Anaesthesiol Scand 1992;36(6):554–558.
- Klasen J, Junger A, Hartmann B, et al: diferentes incidencias de hipotensión relevante con anestesia espinal-epidural combinada y anestesia espinal. Anesth Analg 2003;96(5):1491–1495; Tabla de contenido.
- Hartmann B, Junger A, Klasen J, et al: La incidencia y los factores de riesgo de hipotensión después de la inducción de la anestesia espinal: un análisis con recopilación de datos automatizada. Anesth Analg 2002;94(6):1521–1529; Tabla de contenido.
- Ngan Kee WD, Khaw KS, Lau TK, Ng FF, Chui K, Ng KL: Comparación doble ciego aleatoria de fenilefrina versus efedrina para mantener la presión arterial durante la anestesia espinal para la cesárea no electiva. Anestesia 2008;63(12):1319–1326.
- James FM 3rd, Greiss FC Jr, Kemp RA: Una evaluación de la terapia vasopresora para la hipotensión materna durante la anestesia espinal. Anestesiología 1970;33(1):25–34.
- Wildsmith JA: Manejo de la hipotensión durante la anestesia espinal. Reg Anesth Pain Med 2000;25(3):322.
- Sinclair CJ, Scott DB, Edstrom HH: Efecto de la posición de trendelenberg en la anestesia espinal con bupivacaína hiperbárica. Br. J. Anaesth 1982;54(5):497–500.
- Cyna AM, Andrew M, Emmett RS, Middleton P, Simmons SW: Técnicas para prevenir la hipotensión durante la anestesia espinal para la cesárea. Base de datos Cochrane Syst Rev 2006(4):CD002251.
- Husaini SW, Russell IF: Precarga de volumen: falta de efecto en la prevención de la hipotensión inducida por la columna vertebral en la cesárea. Int J Obstet Anesth 1998;7(2):76–81.
- Jackson R, Reid JA, Thorburn J: La precarga de volumen no es esencial para prevenir la hipotensión inducida por la columna vertebral en la cesárea. Br. J. Anaesth 1995;75(3):262–265.
- Dahlgren G, Granath F, Pregner K, Rosblad PG, Wessel H, Irestedt L: Precarga coloidal versus cristaloide para prevenir la hipotensión materna durante la anestesia espinal para la cesárea electiva. Acta Anaesthesiol Scand 2005;49(8):1200–1206.
- Dyer RA, Farina Z, Joubert IA, et al: Precarga de cristaloides versus administración rápida de cristaloides después de la inducción de la anestesia espinal (cocarga) para la cesárea electiva. Anaesth Cuidados Intensivos 2004;32(3): 351–357.
- Roofthooft E, Van de Velde M: anestesia espinal de dosis baja para la cesárea para prevenir la hipotensión inducida por la columna. Curr Opin Anaesthesiol 2008;21(3):259–262.
- Arzola C, Wieczorek PM: Eficacia de la bupivacaína en dosis bajas en la anestesia espinal para el parto por cesárea: revisión sistemática y metanálisis. Hermano J Anaesth 2011;107(3):308–318.
- Ngan Kee WD, Lee A: Análisis multivariante de factores asociados con el pH arterial umbilical y el exceso de base estándar después de una cesárea bajo anestesia espinal. Anestesia 2003;58(2):125–130.
- Labartino L, Mojdehi E, Mauro AL: Manejo de la hipotensión después de la anestesia espinal para la cesárea. Anesth Analg 1966;45(2):179–182.
- Ngan Kee WD, Khaw KS, Ng FF: Comparación de los regímenes de infusión de fenilefrina para mantener la presión arterial materna durante la anestesia espinal para la cesárea. Br. J. Anaesth 2004;92(4): 469–474.
- Ngan Kee WD, Khaw KS, Ng FF: Prevención de la hipotensión durante la anestesia espinal para el parto por cesárea: una técnica eficaz que utiliza una combinación de infusión de fenilefrina y cohidratación con cristaloides. Anestesiología 2005;103(4):744–750.
- Habib AS: Una revisión del impacto de la administración de fenilefrina en la hemodinámica materna y los resultados maternos y neonatales en mujeres sometidas a cesárea bajo anestesia espinal. Anesth Analg 2012;114(2):377–390.
- Park YH, Ryu T, Hong SW, Kwak KH, Kim SO: El efecto de la fenilefrina intravenosa en el nivel de anestesia espinal. Korean J Anesthesiol 2011;61(5):372–376.
- Caplan RA, Ward RJ, Posner K, Cheney FW: Paro cardíaco inesperado durante la anestesia espinal: un análisis de reclamos cerrados de factores predisponentes. Anestesiología 1988;68(1):5–11.
- Lovstad RZ, Granhus G, Hetland S: bradicardia y paro cardíaco asistólico durante la anestesia espinal: informe de cinco casos. Acta Anaesthesiol Scand 2000;44(1):48–52.
- Pan PH, Moore CH, Ross VH: bradicardia materna severa y asistolia después de analgesia combinada espinal-epidural durante el trabajo de parto en una parturienta con obesidad mórbida. J Clin Anesth 2004;16(6):461–464.
- Pollard JB: Paro cardíaco durante la anestesia espinal: mecanismos y estrategias comunes para la prevención. Anesth Analg 2001;92(1):252–256.
- Cooper DW: Efecto de los vasopresores sobre la presión arterial sistólica, media y diastólica durante la anestesia espinal en el embarazo. Int J Obstet Anesth 2008;17(1):90–92.
- Sahoo T, SenDasgupta C, Goswami A, Hazra A: Reducción de la hipotensión inducida por la columna con ondansetrón en parturientas sometidas a cesárea: un estudio aleatorizado doble ciego controlado con placebo. Int J Obstet Anesth 2012;21(1):24–28.
- Smiley RM: Carga de la prueba. Anestesiología 2009;111(3):470–472.
- Greene NM, Brull SJ: Fisiología de la anestesia espinal, 4.ª ed. Williams y Wilkins, 1981.
- Steinbrook RA, Concepcion M, Topulos GP: Respuestas ventilatorias a la hipercapnia durante la anestesia espinal con bupivacaína. Anesth Analg 1988;67(3):247–252.
- Nakayama M, Kanaya N, Fujita S, Namiki A: Efectos de la efedrina en la eliminación de verde de indocianina durante la anestesia espinal: Evaluación por el método del dedo. Anesth Analg 1993;77(5):947–949.
- Zinn SE, Fairley HB, Glenn JD: Función hepática en pacientes con hepatitis alcohólica leve, después de enflurano, óxido nitroso-narcótico y espinal
anestesia. Anesth Analg 1985;64(5):487–490. - Igarashi M, Kawana S, Iwasaki H, Namiki A: [Manejo anestésico para un paciente con citrulinemia y cirrosis hepática]. Masui 1995;
44 (1): 96-99. - Fukuda T, Okutani R, Kono K, Yoshimura Y, Ochiai N: [Manejo anestésico para cesárea de una paciente con diabetes transitoria
insipidus y disfunción hepática severa aguda]. Masui 1993;42(10):1511–1516. - McNeill MJ, Bennet A: Uso de anestesia regional en un paciente con porfiria aguda. Br. J. Anaesth 1990;64(3):371–373.
- Consolo D, Ouardirhi Y, Wessels C, Girard C: [Anestesia obstétrica y porfirias]. Ann Fr Anesth Reanim 2005;24(4):428–431.
- Runciman WB, Mather LE, Ilsley AH, Carapetis RJ, Upton RN: una preparación de ovejas para estudiar las interacciones entre el flujo sanguíneo y el fármaco
disposición. III: Efectos de la anestesia general y raquídea sobre el flujo sanguíneo regional y las tensiones de oxígeno. Hermano J Anaesth 1984;56(11):1247–1258. - Runciman WB, Mather LE, Ilsley AH, Carapetis RJ, Upton RN: una preparación de ovejas para estudiar las interacciones entre el flujo sanguíneo y el fármaco
disposición. IV: Los efectos de la anestesia general y espinal sobre el flujo sanguíneo y la disposición de cefoxitina. Hermano J Anaesth 1985;57(12):1239–1247. - Runciman WB, Mather LE, Ilsley AH, Carapetis RJ, Upton RN: una preparación de ovejas para estudiar las interacciones entre el flujo sanguíneo y el fármaco
disposición. VI: Efectos de la anestesia general o subaracnoidea sobre el flujo sanguíneo y la disposición del clormetiazol. Hermano J Anaesth 1986;58(11):1308–1316. - Mather LE, Runciman WB, Ilsley AH, Carapetis RJ, Upton RN: Una preparación de ovejas para estudiar las interacciones entre el flujo sanguíneo y la disposición del fármaco. V: Los efectos de la anestesia general y subaracnoidea sobre el flujo sanguíneo y la disposición de petidina. Br. J. Anaesth 1986;58(8): 888–896.
- Taivainen T, Tuominen M, Rosenberg PH: Influencia de la obesidad en la propagación de la analgesia espinal después de la inyección de bupivacaína simple al 0.5 % en el
Espacio intermedio L3–4 o L4–5. Br. J. Anaesth 1990;64(5):542–546. - Tuominen M, Taivainen T, Rosenberg PH: Propagación de la anestesia espinal con bupivacaína simple al 0.5 %: Influencia del espacio intervertebral utilizado
para inyección Br. J. Anaesth 1989;62(4):358–361. - Tuominen M, Kuulasmaa K, Taivainen T, Rosenberg PH: Previsibilidad individual de la anestesia espinal repetida con bupivacaína isobárica. Acta Anaesthesiol Scand 1989;33(1):13–14.
- Sundnes KO, Vaagenes P, Skretting P, Lind B, Edstrom HH: analgesia espinal con bupivacaína hiperbárica: efectos del volumen de solución. hermano
J Anaesth 1982;54(1):69–74. - Konishi R, Mitsuhata H, Saitoh J, Hirabayashi Y, Shimizu R: [La propagación de la dibucaína hiperbárica subaracnoidea en la parturienta a término]. Masui 1997;46(2):184–187.
- Veering BT, Ter Riet PM, Burm AG, Stienstra R, Van Kleef JW: Anestesia espinal con bupivacaína hiperbárica al 0.5 % en pacientes de edad avanzada: efecto
del sitio de la inyección en la extensión de la analgesia. Hermano J Anaesth 1996;77(3):343–346. - Cameron AE, Arnold RW, Ghorisa MW, Jamieson V: analgesia espinal con bupivacaína al 0.5% simple. Variación en la extensión del bloqueo nervioso con
edad del paciente Anestesia 1981;36(3):318–322. - Pitkanen M, Haapaniemi L, Tuominen M, Rosenberg PH: Influencia de la edad en la anestesia espinal con bupivacaína isobárica al 0.5%. Br. J. Anaesth 1984;56(3):279–284.
- Veering BT, Burm AG, Vletter AA, van den Hoeven RA, Spierdijk J: El efecto de la edad sobre la absorción sistémica y la disposición sistémica de bupivacaína después de la administración subaracnoidea. Anestesiología 1991;74(2):250–257.
- Racle JP, Benkhadra A, Poy JY, Gleizal B: analgesia espinal con bupivacaína hiperbárica: influencia de la edad. Br. J. Anaesth 1988;60(5): 508–514.
- Schiffer E, Van Gessel E, Gamulin Z: Influencia del sexo en la densidad del líquido cefalorraquídeo en adultos. Br. J. Anaesth 1999;83(6):943–944.
- Pargger H, Hampl KF, Aeschbach A, Paganoni R, Schneider MC: efecto combinado de las variables del paciente en el nivel sensorial después de la espinal 0.5 %
bupivacaína simple. Acta Anaesthesiol Scand 1998;42(4):430–434. - Povey HM, Jacobsen J, Westergaard-Nielsen J: analgesia subaracnoidea con bupivacaína hiperbárica al 0.5 %: efecto de un período de 60 minutos sentado. Acta Anaesthesiol Scand 1989;33(4):295–297
- Alston RP, Littlewood DG, Meek R, Edstrom HH: anestesia espinal con bupivacaína hiperbárica: efectos de la concentración y el volumen cuando
administrado en posición sentada. Br. J. Anaesth 1988;61(2):144–148. - Alston RP: Anestesia espinal con bupivacaína al 0.5% 3 mL: Comparación de soluciones simples e hiperbáricas administradas a pacientes sentados. Br. J. Anaesth 1988;61(4):385–389.
- Mitchell RW, Bowler GM, Scott DB, Edstrom HH: Efectos de la postura y la baricidad en la anestesia espinal con bupivacaína al 0.5% 5 ml. Un estudio doble ciego. Br. J. Anaesth 1988;61(2):139–143.
- Povey HM, Olsen PA, Pihl H: analgesia espinal con bupivacaína hiperbárica al 0.5%: efectos de diferentes posiciones del paciente. Acta Anaesthesiol Scand 1987;31(7):616–619.
- Maroof M, Khan RM, Siddique M, Tariq M: La anestesia espinal hipobárica con bupivacaína (0.1 %) proporciona un bloqueo nervioso sensorial selectivo para la cirugía anorrectal. Can J Anaesth 1995;42(8):691–694.
- Fettes PD, Jansson JR, Wildsmith JA: Anestesia espinal fallida: mecanismos, manejo y prevención. Hermano J Anaesth 2009;102(6):739–748.
- Tuominen M, Pitkanen M, Rosenberg PH: Efecto de la velocidad de inyección de bupivacaína simple al 0.5 % sobre la propagación de la anestesia raquídea. Br. J. Anaesth 1992;69(2):148–149.
- Van Gessel EF, Praplan J, Fuchs T, Forster A, Gamulin Z: Influencia de la velocidad de inyección en la distribución subaracnoidea de la bupivacaína isobárica
0.5%. Anesth Analg 1993;77(3):483–487. - Stienstra R, Van Poorten F: La velocidad de la inyección no afecta la distribución subaracnoidea de la bupivacaína simple al 0.5 %. Reg Anesth 1990;
15 (4): 208-210. - Bucx MJ, Kroon JW, Stienstra R: Efecto de la velocidad de inyección en el nivel sensorial máximo para anestesia espinal usando bupivacaína simple
0.5% a temperatura ambiente. Reg Anesth 1993;18(2):103–105. - Axelsson KH, Edstrom HH, Sundberg AE, Widman GB: anestesia espinal con bupivacaína hiperbárica al 0.5 %: efectos del volumen. acta
Anaesthesiol Scand 1982;26(5):439–445. - Peng PW, Chan VW, Perlas A: Concentración anestésica mínima eficaz de lidocaína hiperbárica para anestesia espinal. Can J Anaesth 1998;45(2):122–129.
- Alfonsi P, Brusset A, Levy R, Gauneau P, Chauvin M: [Anestesia espinal con bupivacaína sin glucosa en el anciano: efecto de la concentración y el volumen en el perfil hemodinámico]. Ann Fr Anesth Reanim 1991;10(6):543–547.
- Pflug EA, Aasheim GM, Beck HA: anestesia espinal: bupivacaína versus tetracaína. Anesth Analg 1976;55(4):489–492.
- Sheskey MC, Rocco AG, Bizzarri-Schmid M, Francis DM, Edstrom H, Covino BG: Un estudio de dosis-respuesta de bupivacaína para anestesia espinal. Anesth Analg 1983;62(10):931–935.
- Kopacz DJ: 2-cloroprocaína espinal: dosis mínima eficaz. Reg Anesth Pain Med 2005;30(1):36–42.
- Van Zundert AA, Grouls RJ, Korsten HH, Lambert DH: Anestesia espinal. Volumen o concentración: ¿qué importa? Reg Anesth 1996;21(2):112–118.
- Cook TM, Fischer B, Bogod D, et al: Soluciones antisépticas para bloqueo neuroaxial central: ¿Qué concentración de clorhexidina en alcohol debemos usar? Br J Anaesth 2009;103:456–457.Schweizer RT: el movimiento de la mascarilla como posible causa de herida
contamination. Lancet 1976;2(7995):1129–1130. - Veringa E, van Belkum A, Schellekens H: Meningitis iatrogénica por Streptococcus salivarius después de una punción lumbar. J Hosp Infect 1995;29(4):316–318.
- Hebl JR: La importancia e implicaciones de las técnicas asépticas durante la anestesia regional. Reg Anesth Pain Med 2006;31(4):311–323.
- Asociación de Anestesistas de Gran Bretaña e Irlanda. Control de infecciones en anestesia. Anestesia 2008;63(9):1027–1036.
- Ross BK, Chadwick HS, Mancuso JJ, Benedetti C: Aguja Sprotte para anestesia obstétrica: menor incidencia de punción dural posterior
dolor de cabeza. Reg Anesth 1992;17(1):29–33. - de Filho GR, Gomes HP, da Fonseca MH, Hoffman JC, Pederneiras SG, Garcia JH: Predictores del bloqueo nervioso neuroaxial exitoso: un estudio prospectivo. Eur J Anaesthesiol 2002;19(6):447–451.
- Lee PJ, Tang R, Sawka A, Krebs C, Vaghadia H: Informe breve: Anestesia espinal guiada por ultrasonido en tiempo real utilizando el enfoque de Taylor. anesth
Analg 2011;112(5):1236–1238. - Palmer CM: Anestesia espinal continua y analgesia en obstetricia. Anesth Analg 2010;111(6):1476–1479.
- Arkoosh VA, Palmer CM, Yun EM, et al: Una comparación multicéntrica aleatoria, con doble enmascaramiento, de la seguridad de la analgesia intratecal continua durante el trabajo de parto con un catéter de calibre 28 frente a la analgesia epidural continua durante el trabajo de parto. Anestesiología 2008;108(2):286–298.
- Sng BL, Lim Y, Sia AT: un estudio de cohorte prospectivo observacional de la incidencia y las características de la anestesia espinal fallida para la cesárea
sección. Int J Obstet Anesth 2009;18(3):237–241. - Levy JH, Islas JA, Ghia JN, Turnbull C: Un estudio retrospectivo de la incidencia y las causas del fracaso de la anestesia espinal en un hospital universitario.
Anesth Analg 1985;64(7):705–710. - Hoppe J, Popham P: Fracaso total de la anestesia espinal en obstetricia. Int J Obstet Anesth 2007;16(3):250–255.
- Reina MA, Collier CB, Prats-Galino A, Puigdellivol-Sanchez A, Maches F, De Andres JA: Colocación subdural no intencional de catéteres epidurales durante el intento de anestesia epidural: un estudio anatómico del compartimento subdural espinal. Reg Anesth Pain Med 2011;36(6):537–541.
- Capdevila X, Dadure C: Manejo perioperatorio del ingreso hospitalario de un día: La anestesia regional es mejor que la anestesia general. Acta Anaesthesiol Belg 2004;55 (suplemento): 33–36.
- Ruben JE, Kamsler PM: anestesia espinal unilateral para la reducción quirúrgica de fracturas de cadera. Am J Surg 1950;79(2):312–317.
- Khatouf M, Loughnane F, Boini S, et al: [Anestesia espinal unilateral en pacientes ancianos por trauma de cadera: un estudio piloto]. Ann Fr Anesth Reanim 2005;24(3):249–254.
- Cappelleri G, Aldegheri G, Danelli G, et al: anestesia espinal con levobupivacaína hiperbárica y ropivacaína para artroscopia de rodilla ambulatoria: un estudio prospectivo, aleatorizado, doble ciego. Anesth Analg 2005;101(1):77–82; Tabla de contenido.
- Fanelli G, Borghi B, Casati A, Bertini L, Montebugnoli M, Torri G: Anestesia espinal unilateral con bupivacaína para artroscopia de rodilla ambulatoria. Grupo de Estudio Italiano sobre Anestesia Espinal Unilateral. Can J Anaesth 2000;47(8):746–751.
- Nair GS, Abrishami A, Lermitte J, Chung F: revisión sistemática de la anestesia espinal con bupivacaína para la artroscopia de rodilla ambulatoria. Hermano J Anaesth 2009;102(3):307–315.
- Casati A, Fanelli G: anestesia espinal unilateral. Lo último. Minerva Anestesiol 2001;67(12):855–862.
- Schneider MC, Holzgreve W: [hace 100 años: Oskar Kreis, pionero en analgesia obstétrica espinal en la Clínica Universitaria de Mujeres de Basilea]. Anestesista 2001;50(7):525–528.
- Horlocker TT, Wedel DJ, Rowlingson JC, et al: Anestesia regional en el paciente que recibe terapia antitrombótica o trombolítica: Directrices basadas en la evidencia de la Sociedad Estadounidense de Anestesia Regional y Medicina del Dolor (tercera edición). Reg Anesth Pain Med 2010;35(1):64–101.
- Bogin IN, Stulin ID: [Aplicación del método de ecoespondilografía bidimensional para determinar puntos de referencia en punciones lumbares]. Zh Nevropatol Psikhiatr Im SS Korsakova 2;1971(71):12–1810.Perlas A: Evidencia del uso de ultrasonido en bloqueos nerviosos neuroaxiales. Reg Anesth Pain Med 1811;2010(35 suplementos):S2–S43.
- Chin KJ, Karmakar MK, Peng P: Ultrasonografía de la columna torácica y lumbar de adultos para el bloqueo neuroaxial central. Anestesiología 2011;114(6):1459–1485.
- Chin KJ, Perlas A: Ultrasonografía de la columna lumbar para bloqueos nerviosos del plexo neuroaxial y lumbar. Curr Opin Anaesthesiol 2011;24(5):567–572.
- Chin KJ, Perlas A, Singh M, et al: Un enfoque asistido por ultrasonido facilita la anestesia espinal para la artroplastia articular total. Can J Anaesth 2009;56(9):643–650.
- O'Donnell D, Prasad A, Perlas A: Anestesia espinal asistida por ultrasonido en pacientes obesos. Can J Anaesth 2009;56(12):982–983.
- Chin KJ, Chan VW, Ramlogan R, Perlas A: Anestesia espinal guiada por ultrasonido en tiempo real en pacientes con una anatomía espinal desafiante: informes de dos casos. Acta Anaesthesiol Scand 2010;54(2):252–255.
- Chin KJ, Perlas A, Chan V, Brown-Shreves D, Koshkin A, Vaishnav V: Las imágenes por ultrasonido facilitan la anestesia espinal en adultos con puntos de referencia anatómicos superficiales difíciles. Anestesiología 2011;115(1):94–101.
- Margarido CB, Arzola C, Balki M, Carvalho JC: Curvas de aprendizaje de los anestesiólogos para la evaluación ecográfica de la columna lumbar. Can J Anaesth 2010;57(2):120–126.
- Halpern SH, Banerjee A, Stocche R, Glanc P: El uso de ultrasonido para la identificación del proceso espinoso lumbar: un estudio piloto. Can J Anaesth 2010;57(9):817–822.
- Carvalho JC: Epidurales y espinales facilitadas por ultrasonido en obstetricia. Anesthesiol Clin 2008;26(1):145–158, vii–viii.
- Bron JL, van Royen BJ, Wuisman PI: La importancia clínica de las anomalías de transición lumbosacras. Acta Orthop Belg 2007;73(6):687–695.
- Spivak H, Nudelman I, Fuco V, et al: Reparación laparoscópica de hernia inguinal extraperitoneal con anestesia espinal e insuflación de óxido nitroso. Surg Endosc 1999;13(10):1026–1029.
- Schmidt J, Carbajo MA, Lampert R, Zirngibl H: Reparación intraperitoneal laparoscópica con malla de politetrafluoroetileno (IPOM) para la hernia inguinal durante la anestesia espinal en pacientes con afecciones médicas graves. Surg Laparosc Endosc Percutan Tech 2001;11(1):34–37.
- Vaghadia H, Viskari D, Mitchell GW, Berrill A: Anestesia espinal selectiva para laparoscopia ambulatoria. I: Características de tres soluciones hipobáricas. Can J Anaesth 2001;48(3):256–260.
- Tzovaras G, Zacharoulis D, Georgopoulou S, Pratsas K, Stamatiou G, Hatzitheofilou C: Reparación laparoscópica de hernia ventral bajo anestesia espinal: un estudio de viabilidad. Am J Surg 2008;196(2):191–194.
- Chilvers CR, Vaghadia H, Mitchell GW, Merrick PM: Anestesia espinal hipobárica con dosis pequeñas de lidocaína y fentanilo para laparoscopia ambulatoria de corta duración. II. Dosis óptima de fentanilo. Anesth Analg 1997; 84(1):65–70.
- Ghodki PS, Sardesai SP, Thombre SK: Evaluación del efecto de la clonidina intratecal para disminuir el dolor en la punta del hombro en laparoscopia bajo anestesia espinal. Indio J Anaesth 2010;54(3):231–234.
- Jonnesco T. Observaciones SOBRE LA ANALGESIA ESPINAL GENERAL. Br Med J 1909;2(2550):1396–1401.
- Lee AJ, Ranasinghe JS, Chehade JM, Arheart K, Saltzman BS, Penning DH, et al: Evaluación por ultrasonido del nivel vertebral de la línea intercristalina en el embarazo. Anesth Analg 2011;113(3):559–564.