Miguel A. Reina, Carlo D. Franco, Alberto Prats-Galino, Fabiola Machés, Andrés López y José A de Andrés
INTRODUCCIÓN
La investigación reciente sobre la ultraestructura del saco dural espinal humano y su contenido ha mejorado nuestra comprensión de la microestructura de la duramadre, la capa aracnoidea, la aracnoides trabecular, la piamadre y las raíces nerviosas. En este capítulo se revisan los conceptos nuevos y tradicionales sobre estas estructuras y se analizan sus posibles implicaciones clínicas. También se discute la distribución de la grasa epidural y su posible papel en la disposición y la cinética de las inyecciones neuroaxiales.
SACO DURAL
El saco dural rodea la médula espinal dentro de la columna vertebral. Separa el espacio epidural del espacio subaracnoideo, terminando en la segunda vértebra sacra. En una forma idealizada, el saco dural es cilíndrico con un grosor que varía de aproximadamente 1 mm en la región cervical y se adelgaza gradualmente a medida que desciende.Figuras 1 y 2). En la región lumbar, el grosor del saco dural alcanza los 0.3 mm, aunque las medidas tomadas desde anteroposterior o lateral pueden variar algo incluso al mismo nivel vertebral. La duramadre es la capa más externa del saco dural y es responsable del 90% de su espesor total. Esta estructura fibrosa, aunque permeable, proporciona cierta protección mecánica a la médula espinal y sus elementos neurales. El 10% interno del saco dural está formado por la capa aracnoidea, que es una lámina celular que agrega poca resistencia mecánica adicional.
FIGURA 1. Saco dural humano. (Reproducida con permiso de Reina MA, López García A, de Andrés JA, et al: Thickness variación of the dural sac. Rev Esp Anestesiol Reanim. 1999 Oct;46(8):344-349.)
FIGURA 2. Saco dural humano y médula espinal final. (Reproducida con autorización de Reina MA, Pulido P, López A. El saco dural humano: Rev Arg Anestesiol. 2007; 65:167-184.)
DURA MADRE
La duramadre comprende aproximadamente 80 láminas concéntricas (Figura 3 y XNUMX). Cada lámina dural tiene un espesor de aproximadamente 5 μm y consta de láminas más delgadas que contienen principalmente fibras de colágeno.Figuras 4 y 5). Las fibras de colágeno están orientadas en diferentes direcciones pero siempre dentro del plano concéntrico de la lámina dural; por lo tanto, no se cruzan entre las láminas. Cada fibra de colágeno tiene una superficie lisa y mide aproximadamente 0.1 μm (Figura 6 y XNUMX). Las fibras elásticas son más pequeñas, miden 2 μm de diámetro y tienen una superficie más rugosa que la de las fibras de colágeno.Figura 7 y XNUMX).
FIGURA 3. Grosor del saco dural. Microscopía electrónica de barrido. Aumento ×300. (Reproducido con permiso de Reina MA, Dittmann M, López A, et al: New prospects in the microscopic structure of human dura mater in the dorso lumbar region. Reg Anesth. 1997 Mar-Abr;22(2):161-166. )
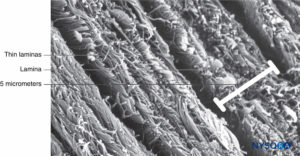
FIGURA 4. Grosor parcial del saco dural. Detalles de láminas durales. Microscopía electrónica de barrido. Ampliación ×4,000. (Reproducida con permiso de Reina MA, López A, Dittmann M, et al: Structure of human dura mater thick by scanelectron microscopy. Rev Esp Anestesiol Reanim. 1996 Apr;43(4):135-137.)
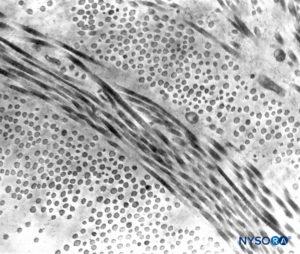
FIGURA 5. Grosor parcial del saco dural. Detalles de láminas durales. Microscopio de transmisión por electrones. Ampliación ×20,000. (Reproducido con autorización de Raj P: Textbook of Regional Anesthesia. Philadelphia: Churchill Livingstone; 2002.)
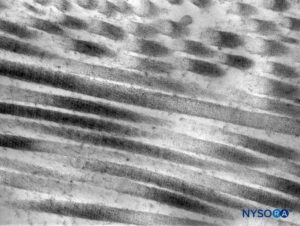
FIGURA 6. Fibras de colágeno en el espesor del saco dural. Microscopio de transmisión por electrones. Ampliación ×50,000. (Reproducido con autorización de Raj P: Textbook of Regional Anesthesia. Philadelphia: Churchill Livingstone; 2002.)
Contrariamente a la descripción clásica de las fibras dentro de las láminas durales dispuestas longitudinalmente y paralelas al eje longitudinal de la columna vertebral, las fibras en realidad están distribuidas multidireccionalmente al azar dentro de cada una de las láminas durales concéntricas.Figuras 8 a 10). Los mastocitos y los macrófagos también están presentes dentro de la duramadre (Figuras 11 y 12).
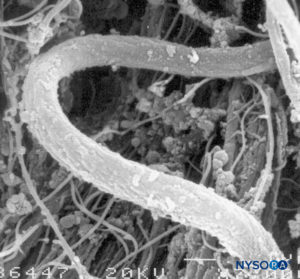
FIGURA 7. Fibras elásticas del saco dural. Microscopía electrónica de barrido. Ampliación ×7000. (Reproducida con permiso de Reina MA, López A, Dittmann M, et al: External and internal surface of human dura mater by scanelectron microscopy. Rev Esp Anestesiol Reanim. 1996 Apr;43(4):130-4.)

FIGURA 8. Detalle de la superficie epidural del saco dural. Microscopía electrónica de barrido. Ampliación ×6500. (Reproducido con permiso de Dittmann M, Reina MA, López A: Neue ergebnisse bei der darstellung der dura mater spineis mittles rasterelektronenmikroskopie. Anaesthesist. 1998 May;47(5):409-413.)
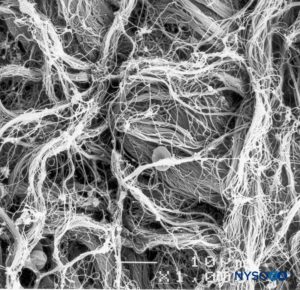
FIGURA 9. Detalle de la superficie epidural del saco dural. Microscopía electrónica de barrido. Ampliación ×1000. (Reproducida con permiso de Reina MA, López A, Dittmann M, et al: External and internal surface of human dura mater by scanelectron microscopy. Rev Esp Anestesiol Reanim. 1996 Apr;43(4):130-4.)
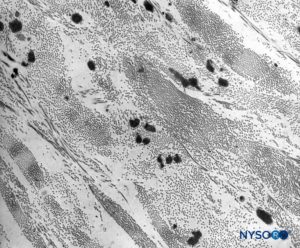
FIGURA 10. Colágeno y fibras elásticas en el espesor del saco dural. Microscopio de transmisión por electrones. Ampliación ×7,000. (Reproducido con autorización de Raj P: Textbook of Regional Anesthesia. Philadelphia: Churchill Livingstone; 2002.)
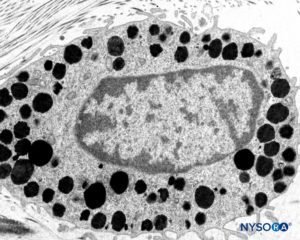
FIGURA 11. Mastocitos en el espesor de la duramadre. Microscopio de transmisión por electrones. Ampliación ×15,000. (Reproducida con autorización de Reina MA, Pulido P, López A. El saco dural humano: Rev Arg Anestesiol. 2007;65:167-184.)
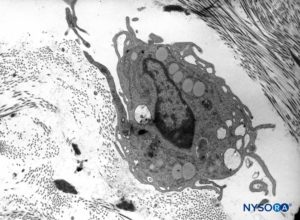
FIGURA 12. Macrófago en el espesor de la duramadre. Microscopio de transmisión por electrones. Ampliación ×7000. (Reproducido con autorización de Raj P: Textbook of Regional Anesthesia. Philadelphia: Churchill Livingstone; 2002.)
CAPA ARACNOIDES
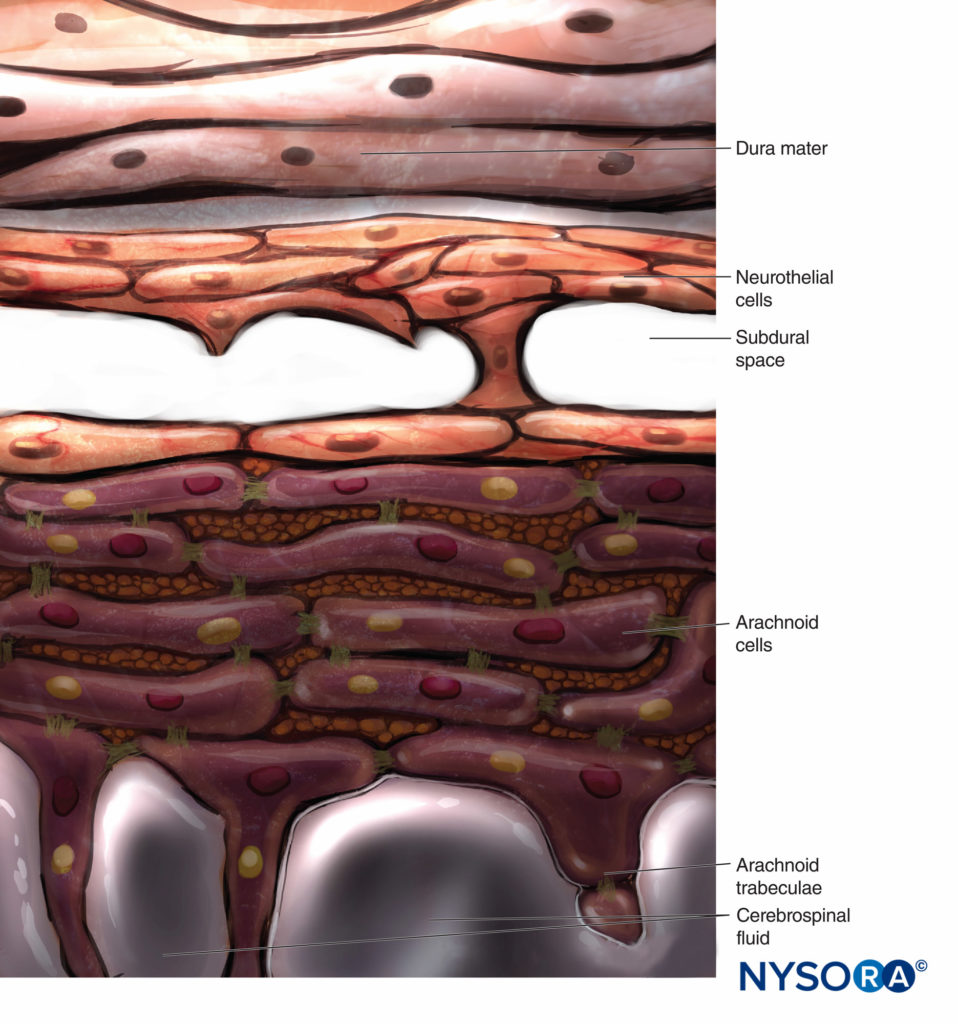
Convencionalmente, la capa aracnoidea se describe como una membrana fina en estrecho contacto con la superficie interna de la duramadre, pero sin adherirse a ella. Sin embargo, investigaciones recientes determinaron que no hay espacio entre la duramadre y la capa aracnoidea (ver espacio subdural). La capa aracnoidea es semipermeable y sirve como barrera para limitar el paso de sustancias a través del saco dural (Figuras 13 y 14). Su espesor es de unos 50-60 μm (Figuras 15 y 16). En su interior, las células aracnoideas se unen fuertemente mediante uniones de membrana específicas con un grosor de alrededor de 10 a 15 μm. Las fibras de colágeno en el centro de la capa aracnoidea dan fuerza a la lámina y mejoran su resistencia mecánica. Las células neuroteliales planas y alargadas ocupan la parte exterior de la capa. Arrancar la capa aracnoidea expone el espacio subdural. Las células neuroteliales se pueden encontrar adheridas a la superficie interna de la duramadre o a la superficie externa de la capa aracnoidea.Figura 17 y XNUMX).
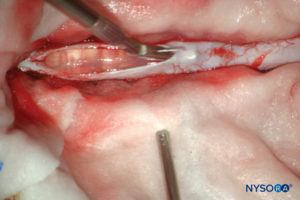
FIGURA 13. Disección del saco dural humano. (Reproducido con autorización de Reina MA, Pulido P, López A. El saco dural humano. Rev Arg Anestesiol. 2007; 65:167-184.)
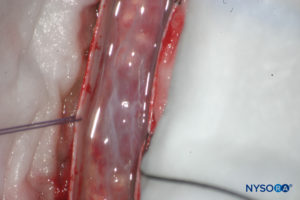
FIGURA 14. Disección del saco dural humano. La duramadre está abierta; la capa aracnoidea está cerrada. (Reproducido con autorización de Reina MA, Pulido P, López A. El saco dural humano. Rev Arg Anestesiol. 2007; 65:167-184.)
BLOQUEO NEURAXIAL Y LESIONES DURALES
Perforar el saco dural durante un bloqueo subaracnoideo provoca una rotura mecánica tanto de la duramadre como de la capa aracnoidea. El área de la sección transversal del sitio de punción producido por una aguja de calibre 25 es similar independientemente de si la aguja tiene una punta de lápiz o un extremo cortante. Sin embargo, la morfología de la lesión varía según el diseño de la punta de la aguja. Las agujas con punta de lápiz producen una lesión más grande y de apariencia más áspera en las fibras durales, mientras que las agujas cortantes producen una lesión en forma de U o un colgajo que se asemeja a la tapa abierta de una lata.Figuras 8 a 31).
Cuando se utilizan agujas de corte (bisel largo), la orientación del bisel (p. ej., paralela o perpendicular al eje principal de la médula) no afecta significativamente el tamaño o la morfología de las lesiones en la duramadre y la lámina aracnoidea (ver Figura 24 y XNUMX). La lesión que produce la aguja en el saco dural tiene dos componentes, dural y aracnoides. Se cree que el componente aracnoideo es vital para limitar la fuga de líquido cefalorraquídeo desde el espacio subaracnoideo al espacio epidural. Por lo tanto, el tamaño y la morfología de las lesiones aracnoideas parecen ser más importantes para el sellado laminar y la fuga cerebroespinal que el tamaño y la morfología de las laceraciones durales.
Se ha pensado que la incidencia de cefalea pospunción dural (CPPD) se ve afectada por el tipo de aguja utilizada (punta de lápiz versus cortante) y del bisel. La creencia tradicional de que las agujas cortantes provocan lesiones durales más grandes (desgarros) se estableció en la década de 1940 y puede haber sido consecuencia de las imperfecciones en el diseño de las agujas de esa época. Sin embargo, las agujas modernas producen una lesión limpia en forma de U o un colgajo que se asemeja a la tapa abierta de una lata (v. Figura 24 y XNUMX).
Después de retirar la aguja, el colgajo en forma de U tiende a volver a su posición original debido a la presión del líquido cefalorraquídeo y las propiedades elásticas de la duramadre. El orificio dural se ocluye casi por completo después de aproximadamente 15 minutos. Por otro lado, las lesiones producidas por agujas de punta de lápiz implican una lesión más compleja con desgarro, seccionamiento y separación de fibras. La extensión de la lesión dural causada por una aguja depende de varios factores, incluido el diámetro externo de la aguja, los mecanismos de sellado dural y aracnoideo, el diseño de la punta de la aguja y la calidad de la fabricación de la aguja. Las agujas que tienen el mismo diseño de punta pero diferentes métodos de fabricación pueden no tener la misma calidad de superficie y pueden contener microfracturas o imperfecciones, lo que da como resultado lesiones residuales y desgarros más o menos extensos de la fibra dural.
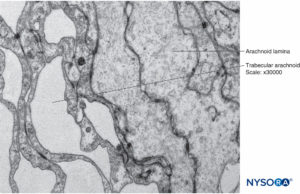
FIGURA 15. Células aracnoideas en el espesor de la capa aracnoidea. Microscopio de transmisión por electrones. Ampliación ×40,000.
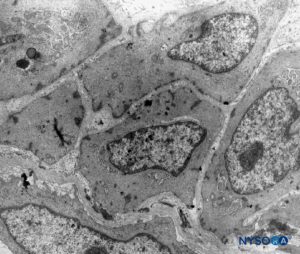
FIGURA 16. Células aracnoideas en el espesor de la capa aracnoidea. Microscopio de transmisión por electrones. Ampliación ×4400. (Reproducido con autorización de Raj P: Textbook of Regional Anesthesia. Philadelphia: Churchill Livingstone; 2002.)
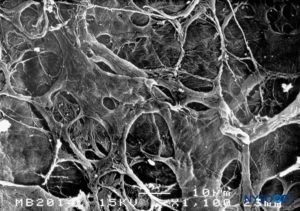
FIGURA 17. Superficie interna de la duramadre. Microscopía electrónica de barrido. Ampliación ×1100. (Reproducido con permiso de Reina MA, Dittmann M, López A, et al: New prospects in the microscopic structure of human dura mater in the dorso lumbar region. Reg Anesth. 1997 Mar-Abr;22(2):161-166. )
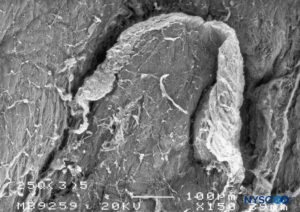
FIGURA 18. Lesión dura-aracnoidea producida con aguja Quincke 25-G. Superficie epidural. Microscopía electrónica de barrido. Aumento ×150. (Reproducido con permiso de Reina MA, Castedo J, López A, et al: Cefalea pospuncion dural: Ultraestructura de las lesiones durables y abuja's husos usos en las punciones lumbers. Rev Arg Anesthesiol. 2008 Jan-Mar 66(1):6- 26)
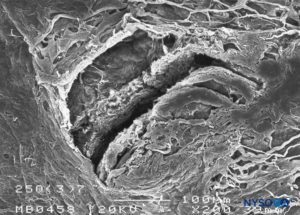
FIGURA 19. Lesión dura-aracnoidea producida con aguja Quincke 25-G. Superficie aracnoidea. Microscopía electrónica de barrido. Aumento ×200. (Reproducido con autorización de Reina MA, Castedo J, López A. Cefalea pospunción dural: Ultraestructura de las lesiones durales y agujas espinales usadas en las punciones lumbares. Rev Arg Anestesiol. 2008 Jan-Mar 66(1):6-26.)
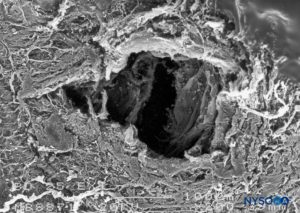
FIGURA 20. Lesión dura-aracnoidea producida con aguja Whitacre 25-G. Superficie epidural. Microscopía electrónica de barrido. Aumento ×200. (Reproducida con autorización de Reina MA, López-García A, de Andrés-Ibáñez JA, et al: Electron microscopy of the lesions Producen in the human dura mater by Quincke beveled and Whitacre needles. Rev Esp Anestesiol Reanim. 1997 Feb;44( 2):56-61.)
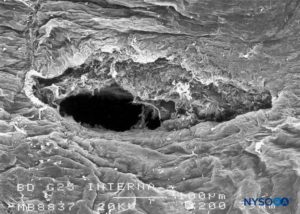
FIGURA 21. Lesión dura-aracnoidea producida con aguja Whitacre 25-G. Superficie aracnoidea. Microscopía electrónica de barrido. Aumento ×200. (Reproducida con permiso de Reina MA, López-García A, de Andrés-Ibáñez JA, et al: Electron microscopy of the lesions Producen in the human dura mater by Quincke beveled and Whitacre needles. Rev Esp Anestesiol Reanim. 1997 Feb;44( 2):56-61.)
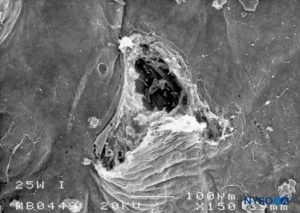
FIGURA 22. Lesión dura-aracnoidea producida con aguja Whitacre 25-G. Superficie aracnoidea. Microscopía electrónica de barrido. Aumento ×200. (Reproducido con permiso de Reina MA, De Leon Casasola OA, et al: An in vitro study of dural lesions producido by Scanning Electronic Microscopy. Reg Anesth Pain Med. 2000 Jul-Aug;25(4):393-402.)

FIGURA 23. Lesión dura-aracnoidea producida con aguja Quincke 22-G. Superficie epidural. Microscopía electrónica de barrido. Aumento ×80. (Reproducido con autorización de Reina MA, Castedo J, López A. Cefalea pospunción dural: Ultraestructura de las lesiones durales y agujas espinales usadas en las punciones lumbares. Rev Arg Anestesiol. 2008 Jan-Mar 66(1):6-26.)
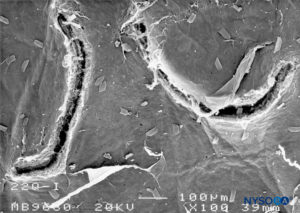
FIGURA 24. Lesión dura-aracnoidea producida con aguja Quincke 22-G. Superficie aracnoidea. Microscopía electrónica de barrido. Aumento ×100. (Reproducido con autorización de Raj P: Textbook of Regional Anesthesia. Philadelphia: Churchill Livingstone; 2002.)
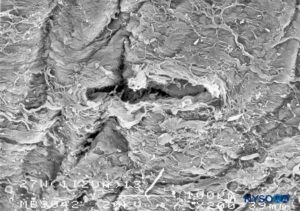
FIGURA 25. Lesión dura-aracnoidea producida con aguja Whitacre 27-G. Superficie epidural. Microscopía electrónica de barrido. Aumento ×200. (Reproducido con autorización de Reina MA, Castedo J, López A. Cefalea pospunción dural: Ultraestructura de las lesiones durales y agujas espinales usadas en las punciones lumbares. Rev Arg Anestesiol. 2008 Jan-Mar 66(1):6-26.)
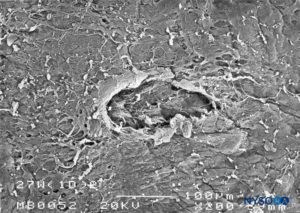
FIGURA 26. Lesión dura-aracnoidea producida con aguja Whitacre 27-G. Superficie epidural. Microscopía electrónica de barrido. Aumento ×200. (Reproducido con autorización de Reina MA, Castedo J, López A. Cefalea pospunción dural: Ultraestructura de las lesiones durales y agujas espinales usadas en las punciones lumbares. Rev Arg Anestesiol. 2008 Jan-Mar 66(1):6-26.)
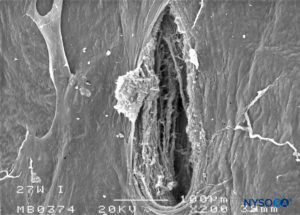
FIGURA 27. Lesión dura-aracnoidea producida con aguja Whitacre 27-G. Superficie aracnoidea. Microscopía electrónica de barrido. Aumento ×200. (Reproducido con autorización de Reina MA, Castedo J, López A. Cefalea pospunción dural: Ultraestructura de las lesiones durales y agujas espinales usadas en las punciones lumbares. Rev Arg Anestesiol. 2008 Jan-Mar 66(1):6-26.)
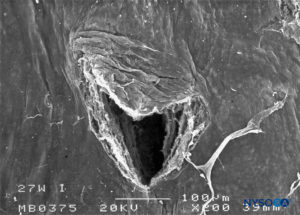
FIGURA 28. Lesión dura-aracnoidea producida con aguja Whitacre 27-G. Superficie aracnoidea. Microscopía electrónica de barrido. Aumento ×200. (Reproducido con autorización de Reina MA, Castedo J, López A. Cefalea pospunción dural: Ultraestructura de las lesiones durales y agujas espinales usadas en las punciones lumbares. Rev Arg Anestesiol. 2008 Jan-Mar 66(1):6-26.)
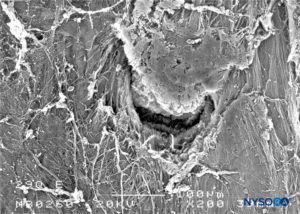
FIGURA 29. Lesión dura-aracnoidea producida con aguja Quincke 29-G. Superficie epidural. Microscopía electrónica de barrido. Aumento ×200. (Reproducido con autorización de Reina MA, Castedo J, López A. Cefalea pospunción dural: Ultraestructura de las lesiones durales y agujas espinales usadas en las punciones lumbares. Rev Arg Anestesiol. 2008 Jan-Mar 66(1):6-26.)
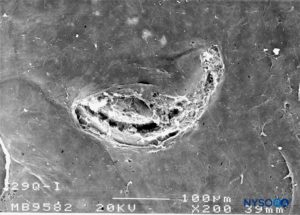
FIGURA 30. Lesión dura-aracnoidea producida con aguja Quincke 29-G. Superficie aracnoidea. Microscopía electrónica de barrido. Aumento ×200. (Reproducido con autorización de Reina MA, Castedo J, López A. Cefalea pospunción dural: Ultraestructura de las lesiones durales y agujas espinales usadas en las punciones lumbares. Rev Arg Anestesiol. 2008 Jan-Mar 66(1):6-26.
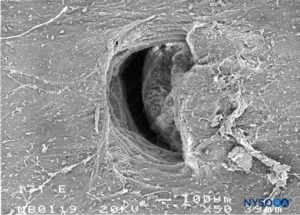
FIGURA 31. Lesión dura-aracnoidea producida con aguja Tuohy 17-G. Superficie aracnoidea. Microscopía electrónica de barrido. Aumento ×50. (Reproducido con autorización de Reina MA, Castedo J, López A. Cefalea pospunción dural: Ultraestructura de las lesiones durales y agujas espinales usadas en las punciones lumbares. Rev Arg Anestesiol. 2008 Jan-Mar 66(1):6-26.)
La deformación de la aguja espinal provocada por los contactos con los huesos vertebrales u otras estructuras resistentes durante el procedimiento neuroaxial también puede aumentar el tamaño de la lesión dural. También puede ocurrir la introducción iatrogénica de fragmentos de piel en el espacio subaracnoideo.
CEFALEA POSTPUNCIÓN DURAL Y TIPO DE AGUJAS
La etiología de la CPPD es multifactorial. Mientras que el capítulo específico sobre CPPD se centra en la fisiopatología, la prevención y el tratamiento, esta sección se centra en los factores anatómicos y relacionados con el equipo que pueden influir en la aparición y gravedad de la CPPD. Inicialmente, se pensó que las agujas con punta de lápiz producían perforaciones menos traumáticas del saco dural. A medida que se conoció mejor la morfología de las lesiones durales, se propusieron otras explicaciones. Los estudios microscópicos de las lesiones producidas por las agujas espinales mostraron que las agujas con punta de lápiz producen una lesión de tipo "estallido" con un daño extenso en las fibras. Sin embargo, el mayor desgarro de fibras producido por las agujas de punta de lápiz puede promover una mayor respuesta inflamatoria en los bordes de la lesión que, paradójicamente, da como resultado una oclusión más temprana y una menor incidencia de CPPD. Las agujas cortantes, por otro lado, producen un desgarro “más limpio” de la duramadre con una menor respuesta inflamatoria que resulta en un sellado tardío de la punción, lo que podría aumentar la incidencia de dolor de cabeza espinal.
Una punta de aguja desafilada después de chocar contra el hueso puede causar más daño a las fibras. La deformación de la punta depende del ángulo de colisión y la fuerza aplicada. Las agujas cortantes son especialmente susceptibles a la deformación de la punta de la aguja después de chocar contra el hueso, a diferencia de las agujas de punta de lápiz. Sin embargo, debido a que los estudios de CPPD generalmente involucran a muchos anestesistas y diferentes técnicas, el impacto definitivo de la deformación de la aguja en la CPPD es difícil de estudiar y en este momento sigue siendo solo hipotético.
Como se mencionó, la lesión dural producida por la aguja espinal tiene dos componentes, una lesión duramadre y una lesión de la capa aracnoidea. Si bien el componente externo o dural del saco proporciona resistencia mecánica, no es lo suficientemente elástico para evitar la fuga de líquido cefalorraquídeo. Por el contrario, la lesión interna o aracnoidea puede retraerse para cerrar el defecto creado por la introducción de la aguja en el espacio subaracnoideo y evitar la fuga de líquido cefalorraquídeo. Debido a que el componente aracnoideo es probablemente más importante en la fisiopatología de la CPPD que la propia duramadre, estas lesiones deben denominarse lesiones “dura-aracnoideas”.
ARACNOIDES TRABECULAR
La aracnoides se compone de dos capas, la aracnoides trabecular y las capas aracnoideas. La aracnoides trabecular se fusiona con el plano celular de la piamadre y emite proyecciones a todas las estructuras que atraviesan el espacio subaracnoideo, incluidos los vasos sanguíneos y las raíces nerviosas. Las proyecciones que cubren las raíces nerviosas se denominan vainas aracnoideas (Figuras 32 a 40).
Durante el movimiento, estas vainas se estabilizan y previenen movimientos excesivos de las raíces nerviosas dentro del saco dural. Sin embargo, las vainas confieren poca protección mecánica contra traumatismos. Las características de las vainas aracnoideas en la cauda equina son variables; unos son laxos, mientras que otros están formados por planos superpuestos de los mismos componentes con un aspecto más compacto. El grosor de una vaina aracnoidea varía de 10 a 60 μm. En algunos casos, una o más raíces nerviosas están envueltas por una sola vaina aracnoidea y, en otros, la raíz nerviosa no tiene ninguna vaina.
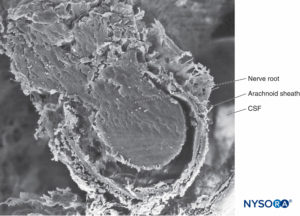
FIGURA 32. Capa aracnoidea trabecular. Las proyecciones de la aracnoides trabecular que cubren las raíces nerviosas se denominan vainas aracnoideas. LCR = líquido cefalorraquídeo. Microscopía electrónica de barrido. Aumento ×100. (Reproducida con autorización de Reina MA, López A, De Andrés JA: Hipótesis sobre las bases anatómicas del síndrome de cauda equina y la irritación transitoria de raíces nerviosas tras raquianestesia. Rev Esp Anestesiol Reanim. 1999 Mar;46(3):99-105. )
VAINAS ARACNOIDEAS DE LAS RAÍCES NERVIOSAS Y SU PAPEL POTENCIAL EN LAS LESIONES NERVIOSAS
Algunos casos de síndrome de cauda equina y síndrome neurológico transitorio podrían explicarse por la existencia de vainas aracnoideas que rodean las raíces nerviosas dentro del saco dural y el hecho de que se pueden insertar agujas o (micro)catéteres en ellas. Es posible que una solución anestésica inyectada accidentalmente en la vaina aracnoidea de un nervio raquídeo no se diluya con el líquido cefalorraquídeo circundante, lo que expone la raíz nerviosa a una concentración anestésica superior a la esperada. En consecuencia, la concentración del anestésico local podría ser de magnitudes superiores (p. ej., 20 a 25 veces) en comparación con la concentración del anestésico en el resto del saco dural.
Una concentración tan alta de anestésico local dentro de la vaina aracnoidea podría tener efectos nocivos sobre las raíces nerviosas, a diferencia de una inyección típica de la misma solución anestésica dentro del saco dural pero fuera de la vaina aracnoidea. Debido a que se necesita tiempo para establecer el equilibrio dentro y fuera de la vaina, se podría desarrollar una lesión nerviosa sin un traumatismo directo con la aguja. Las inyecciones de anestésico local a través de un microcatéter en estas vainas aracnoideas podrían ser más devastadoras que una sola inyección. Esto se debe a que la inyección de un solo volumen grande eventualmente se diluiría por la fuga fuera de la vaina, mientras que las dosis repetidas de pequeños volúmenes pueden provocar neurotoxicidad debido a la exposición continua o repetida a una alta concentración de anestésicos locales. El síndrome de irritación radicular transitoria y el síndrome de cauda equina pueden reflejar diferentes grados de daño nervioso relacionados con la concentración del anestésico local y la duración de la exposición. La inyección de anestésico local dentro de las vainas aracnoideas en áreas cercanas a la médula espinal o al cono medular podría afectar varias raíces nerviosas, mientras que la inyección en áreas más distales podría afectar raíces nerviosas individuales.

FIGURA 33. Capa aracnoidea trabecular. Detalle de vainas aracnoideas. LCR = líquido cefalorraquídeo. Microscopía electrónica de barrido. Aumento x500. (Reproducido con autorización de Raj P: Textbook of Regional Anesthesia. Philadelphia: Churchill Livingstone; 2002.)
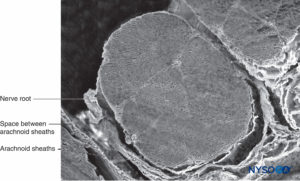
FIGURA 34. Raíz nerviosa y vaina aracnoidea. Microscopía electrónica de barrido. Aumento ×60. (Reproducido con permiso de Torres LM: Textbook of Anesthesia and Pain Management. Aran Ed; 2001.)
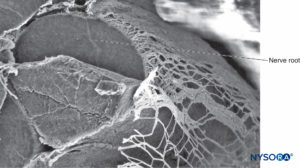
FIGURA 35. Raíz nerviosa y vaina aracnoidea. Microscopía electrónica de barrido. Aumento ×80. (Reproducido con autorización de Reina MA, Villanueva MC, López A: Aracnoides trabecular, piamadre espinal humana y anestesia subaracnoidea, Rev Arg Anestesiol 2008;66: 111–133.)
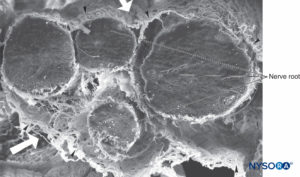
FIGURA 36. Raíz de cuatro nervios y sus vainas aracnoideas. Microscopía electrónica de barrido. Aumento ×100. (Reproducida con autorización de Reina MA, López A, De Andrés JA: Hipótesis sobre las bases anatómicas del síndrome de cauda equina y la irritación transitoria de raíces nerviosas tras raquianestesia. Rev Esp Anestesiol Reanim. 1999 Mar;46(3):99-105. )

FIGURA 37. Médula espinal humana y capa aracnoidea trabecular. LCR = líquido cefalorraquídeo. Microscopía electrónica de barrido. Aumento ×40. (Reproducido con permiso de Reina MA, Machés F, López A, et al: The ultrastructure of the spine arachnoid in human and its impact on espinal anestesia, cauda equina syndrome, and transient neurological syndrome. Tech Reg Anesth Pain Management. 2008 July; 12(3):153-160.)
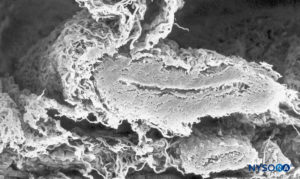
FIGURA 38. Vaso subaracnoideo y capa aracnoidea trabecular. Microscopía electrónica de barrido. Aumento ×120. (Reproducido con autorización de Raj P: Textbook of Regional Anesthesia. Philadelphia: Churchill Livingstone; 2002.)
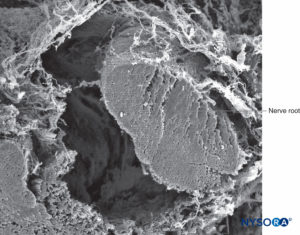
FIGURA 39. Raíz nerviosa y vaina aracnoidea. Microscopía electrónica de barrido. Aumento ×100. (Reproducido con permiso de Torres LM: Textbook of Anesthesia and Pain Management. Aran Ed; 2001.)
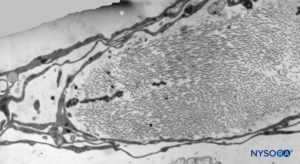
FIGURA 40. Detalle de la capa aracnoidea trabecular. Microscopio de transmisión por electrones. Aumento ×5000. (Reproducido con autorización de Reina MA, Villanueva MC, López A: Aracnoides trabecular, piamadre espinal humana y anestesia subaracnoidea. Rev Arg Anestesiol. 2008;66:111–133.)
PIAMADRE
La estructura de la piamadre incluye una capa celular y un compartimento subpial (Figuras 41 y 42). La capa celular consta de células piales planas superpuestas con una apariencia suave y brillante (Figura 43 y XNUMX). Su espesor es de 3 a 5 células piales (10-15 μm) a nivel medular (Figuras 44 a 46) y de 2 a 3 células (3–4 μm) a nivel de la raíz nerviosa. La sustancia fundamental amorfa se encuentra alrededor de las células piales, y las células miden en promedio 0.5 a 1 μm.
El compartimento subpial tiene grandes cantidades de fibras de colágeno, sustancia fundamental amorfa, fibroblastos y una pequeña cantidad de macrófagos y vasos sanguíneos. El compartimento subpial está encerrado entre la capa celular pial y una membrana basal en contacto con las células neurogliales.
El compartimento subpial de las vértebras torácicas bajas tiene un grosor de 130 a 200 μm; aquí, las variaciones en las medidas son más significativas que en la capa celular pial (ver Figuras 41 y 42). A nivel del cono medular, el grosor de la piamadre se reduce a 80-100 μm; su grosor continúa disminuyendo hasta apenas 50-60 μm en los orígenes de la cauda equina. A nivel de la raíz nerviosa, el grosor del compartimento subpial es de 10 a 12 μm.
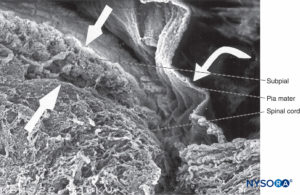
FIGURA 41. Piamadre humana y médula espinal. Microscopía electrónica de barrido. Aumento ×70. (Reproducido con autorización de Reina MA, De Leon Casasola O, et al: Ultrastructural Findings in Human Spinal Pia Mater en relación con la anestesia subaracnoidea. Anesth Analg. 2004 May;98(5):1479-1485.)
A nivel del cono medular existen perforaciones o fenestraciones circulares, ovoides o elípticas en toda la superficie de la capa celular de la piamadre (Figuras 47 a 49). Si bien el tamaño de estas fenestraciones varía, la mayoría mide de 12 a 15 μm de largo y de 4 a 8 μm de ancho. A nivel de la raíz nerviosa, la piamadre muestra fenestraciones similares pero de menor tamaño (1–4 μm) (Figura 50 y XNUMX).Numerosos macrófagos rodean las células piales. Los macrófagos se diferencian de las células de la piamadre en que carecen de procesos citoplasmáticos largos, contienen inclusiones unidas a la membrana y un número variable de vacuolas, especialmente en las áreas periféricas de su citoplasma. Los macrófagos y otras células inflamatorias que se observan dentro de la piamadre podrían originarse en los vasos sanguíneos subpiales y subaracnoideos o en las células piales inmaduras como resultado de un estímulo desconocido. Las fenestraciones encontradas en la piamadre parecen estar asociadas con la migración de algunas células piales inmaduras como parte de una respuesta inflamatoria.
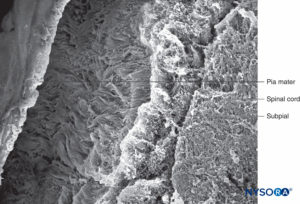
FIGURA 42. Compartimento subpial y piamadre humana. Microscopía electrónica de barrido. Aumento ×100. (Reproducido con autorización de Raj P: Textbook of Regional Anesthesia. Philadelphia: Churchill Livingstone; 2002.)

FIGURA 43. Detalle de la piamadre. Microscopía electrónica de barrido. Aumento ×500. (Reproducido con autorización de Reina MA, Wikinski J, De Andrés JA: Una rara complicación de la anestesia epidural y subaracnoidea. Tumores epidermoideos espinales iatrogénicos. Rev Arg Anestesiol. 2008;66:319-336.)
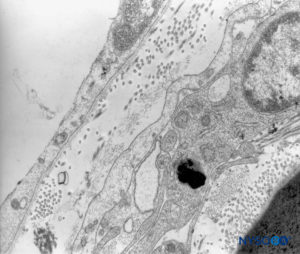
FIGURA 44. piamadre humana. Detalle de células piales. Microscopio de transmisión por electrones. Ampliación ×12,000. (Reproducida con autorización de Reina MA, Wikinski J, De Andrés JA: Una rara complicación de la anestesia epidural y subaracnoidea. Tumores epidermoideos espinales iatrogénicos. Rev Arg Anestesiol. 2008;66:319-336.)
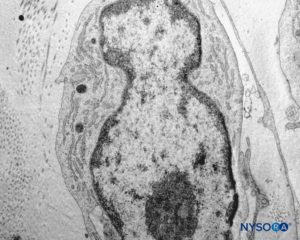
FIGURA 45. Detalle de células piales. Microscopio de transmisión por electrones. Ampliación ×12,000. (Reproducido con autorización de Reina MA, Wikinski J, De Andrés JA: Una rara complicación de la anestesia epidural y subaracnoidea. Tumores epidermoideos espinales iatrogénicos. Rev Arg Anestesiol. 2008;66:319-336.)
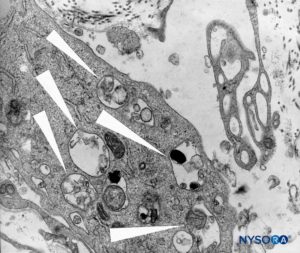
FIGURA 46. Detalle de células macrófagas en piamadre espinal. Microscopio de transmisión por electrones. Ampliación ×12,000. (Reproducido con autorización de Reina MA, Wikinski J, De Andrés JA: Una rara complicación de la anestesia epidural y subaracnoidea. Tumores epidermoideos espinales iatrogénicos. Rev Arg Anestesiol. 2008;66:319-336.)
LIGAMENTOS DEL SACO DURAL
El espacio epidural contiene formaciones fibrosas que cruzan y anclan el saco dural al canal vertebral. Estas formaciones de tejido conectivo se denominan ligamentos meningovertebrales anterior, lateral y posterior.Figuras 51 y 52). El ligamento meningo-vertebral anterior, que conecta el saco dural con el ligamento longitudinal posterior de la columna, es más compacto. En algunos pacientes, los colgajos fibrosos que fijan el saco dural al ligamento longitudinal posterior pueden dividir de manera incompleta el espacio epidural anterior. Los ligamentos anteriores se extienden desde C7 a L5 con una orientación craneocaudal y adquieren una orientación transversa en el nivel torácico T8-9. La longitud de estos ligamentos varía de aproximadamente 0.5 a 29 mm. En el canal sacro, los ligamentos se engrosan para formar un tabique medial perforado, el “ligamento sacro anterior de Trolard”. El ligamento meningo-vertebral lateral y el ligamento meningo-vertebral posterior ("Giorda-lengo") son más delgados y no afectan la circulación de los fluidos inyectados en el espacio epidural. La “plica mediana dorsalis” es una estructura fibrosa longitudinal y discontinua que se encuentra en la región medio sagital a lo largo del espacio epidural posterior, particularmente en la región lumbar.
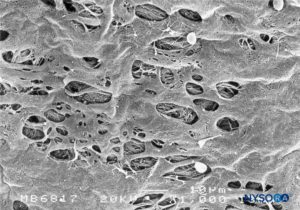
FIGURA 47. Fenestraciones en la piamadre humana del cono medular. Microscopía electrónica de barrido. Ampliación ×1000. (Reproducida con autorización de Reina MA, López García A, de Andrés JA: Anatomical description of a natural perforation present in the human lumbar pia mater. Rev Esp Anestesiol Reanim. 1998;45:4-7.)
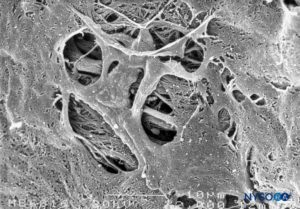
FIGURA 48. Fenestraciones en la piamadre humana del cono medular. Microscopía electrónica de barrido. Ampliación ×2000. (Reproducida con autorización de Reina MA, López García A, de Andrés JA: Anatomical description of a natural perforation present in the human lumbar pia mater. Rev Esp Anestesiol Reanim. 1998;45:4-7.)
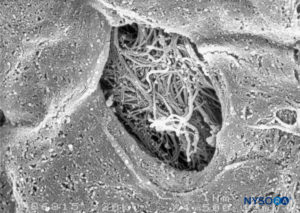
FIGURA 49. Detalle de fenestración en piamadre humana. Microscopía electrónica de barrido. Aumento ×1500. (Reproducida con autorización de Reina MA, López García A, de Andrés JA: Anatomical description of a natural perforation present in the human lumbar pia mater. Rev Esp Anestesiol Reanim. 1998;45:4-7.)
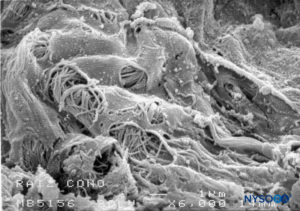
FIGURA 50. Fenestraciones en la piamadre humana de la raíz nerviosa. Microscopía electrónica de barrido. Ampliación ×6000. (Reproducido con autorización de Reina MA, Villanueva MC, López A: Aracnoides trabecular, piamadre espinal humana y anestesia subaracnoidea. Rev Arg Anestesiol. 2008;66:111–133.)
GRASA EPIDURAL
La grasa epidural se extiende lateralmente hacia el sitio donde se encuentran las facetas articulares y el ligamento amarillo. Ubicada entre los arcos vertebrales y los agujeros intervertebrales, la grasa envuelve las raíces nerviosas dentro de las vainas durales pero sin adherirse a ellas. Esto permite el desplazamiento de la duramadre dentro del canal vertebral durante la flexión/extensión. La grasa epidural se adhiere en la línea media posteriormente por un pedículo vascular en un punto donde se unen las porciones derecha e izquierda del ligamento amarillo. La cantidad de grasa epidural posterior aumenta caudalmente, desde L1–2 hasta L4–5, y puede alcanzar los 16–25 mm. Su anchura también aumenta en dirección craneocaudal desde 6 mm en el espacio intermedio L1-2 hasta 13 mm en el espacio intermedio L4-5. El pedículo de la grasa epidural posterior se corresponde topográficamente con la plica mediana dorsalis.
Los depósitos de grasa epidurales están en contacto con la superficie posterior del saco dural y la lámina vertebral, pero se adhieren solo al pedículo vascular. En cuanto a la grasa epidural posterior, es homogénea y no está separada por tabiques fibrosos; lateralmente, la grasa epidural aparece dividida. A veces, un plano septal se extiende entre la salida de la raíz nerviosa en la lámina vertebral y el ligamento longitudinal posterior. Mirando por delante, la duramadre se une al canal vertebral a la altura de los discos. Es en esta región epidural anterior donde se encuentran los vasos venosos anteriores.
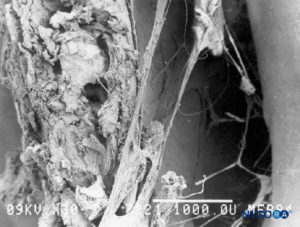
FIGURA 51. espacio epidural. Formaciones fibrosas que atraviesan el espacio epidural. Microscopía electrónica de barrido. Aumento ×30. (Reproducida con autorización de Reina MA, Pulido P, López A. El saco dural humano. Rev Arg Anestesiol. 2007;65:167-184.)
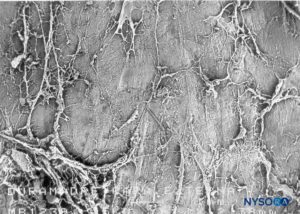
FIGURA 51. espacio epidural. Formaciones fibrosas que atraviesan el espacio epidural. Microscopía electrónica de barrido. Aumento ×30. (Reproducida con autorización de Reina MA, Pulido P, López A. El saco dural humano. Rev Arg Anestesiol. 2007;65:167-184.)
CARACTERÍSTICAS DE LA GRASA EPIDURAL EN LAS REGIONES CERVICAL, TORÁCICA, LUMBAR Y SACRA
La distribución de la grasa epidural es variable a lo largo del canal espinal, pero tiende a ser más consistente en diferentes niveles vertebrales. Por ejemplo, a nivel cervical, el tejido adiposo está ausente o casi inexistente y, en ocasiones, forma un pequeño depósito posterior que se observa con cortes axiales de resonancia magnética (C7 a T1), con aumento de la intensidad de la señal en las secuencias potenciadas en T1. La grasa epidural generalmente no se encuentra en las regiones anterior y lateral. A nivel torácico, la grasa epidural forma una amplia banda posterior con “indentaciones”. Esta banda es más gruesa alrededor del espacio intervertebral y alrededor del disco intervertebral, haciéndose más fina a nivel de los cuerpos vertebrales y cerca de la base de las apófisis espinales de cada vértebra. En la región torácica media-superior (T1-7), la grasa epidural sigue un patrón continuo con hendiduras más evidentes, mientras que en la región torácica inferior (T8-12) la grasa epidural se vuelve discontinua.
A nivel lumbar, la grasa epidural en los espacios epidurales anterior y posterior permanece separada. La grasa epidural posterior es más prominente alrededor de los discos de L3–4 y L4–5. En algunos pacientes, la grasa epidural posterior tiene forma de cono, con el vértice ubicado en la parte posterior. El grosor de la grasa epidural en la zona lumbar inferior ocupa alrededor del 32% del diámetro de la sección transversal del canal vertebral. Por debajo de L4-5, termina el saco dural y comienza el canal sacro. Aquí, las raíces nerviosas están envueltas por manguitos durales y la grasa epidural es el componente principal dentro de los manguitos.
La morfología y distribución de la grasa epidural puede verse alterada en condiciones patológicas. La lipomatosis epidural, por ejemplo, se caracteriza por un aumento del volumen de grasa epidural. Los depósitos de grasa excesivos alrededor del saco dural pueden causar compresión de la médula espinal o de la raíz nerviosa, lo que lleva a síntomas neurológicos. En la cifoescoliosis, la grasa epidural se distribuye asimétricamente y el tejido adiposo predomina en la porción cóncava de la curvatura, mientras que la médula espinal se desplaza contra el arco vertebral. En pacientes con estenosis del canal espinal, la grasa epidural está característicamente ausente o marcadamente reducida alrededor de la zona estenótica.
GRASA EPIDURAL Y FARMACOCINÉTICA DE LOS INYECTADOS EPIDURAL
La distribución de la grasa epidural en el canal vertebral lumbar es desigual, siendo más abundante en la región dorsal que en las regiones ventral y lateral. La cantidad total, la distribución y la morfología de la grasa en el espacio epidural y los manguitos de las raíces nerviosas afectan la difusión de sustancias a través de estos compartimentos.
Los cambios en la cantidad de grasa epidural durante procesos patológicos pueden alterar la absorción de fármacos durante el bloqueo epidural. Sin embargo, incluso en ausencia de procesos patológicos, las variaciones locales en la cantidad de grasa dentro del canal espinal lumbar podrían alterar la cinética de los fármacos. Es posible que las variaciones en la distancia entre la grasa y los tejidos nerviosos vecinos afecten la disposición de los fármacos inyectados y la cinética de los fármacos lipofílicos. En la actualidad, sin embargo, el impacto de la ultraestructura de los manguitos epidurales y de las raíces nerviosas en la cinética del fármaco durante la inyección epidural sigue sin estar claro.
ESPACIO SUBDURAL
En contraste con la descripción clásica de un “espacio subdural” entre la duramadre y la aracnoides dorsal, los estudios han demostrado la presencia de un tejido sólido pero delicado compuesto por células neuroteliales especializadas (Figura 53 y XNUMX). Las células neuroteliales también se denominan células del borde dural. Estas células fusiformes alargadas con extensiones ramificadas son frágiles y poco cohesivas entre sí (Figuras 54 y 55). Las uniones intercelulares entre las células neuroteliales son más susceptibles al desgarro y se pueden ver fragmentos celulares junto a las células neuroteliales desgarradas.Figuras 56 y 57). Cuando se produce un desgarro a lo largo del compartimento subdural, las pequeñas fisuras se fusionan con otras más grandes. Las débiles fuerzas cohesivas entre las células neuroteliales y la falta de fibras de colágeno facilitan el ensanchamiento de una fisura, produciendo la impresión de un espacio subdural. Por lo tanto, el espacio subdural clásico parece ser un artefacto iatrogénico.
El estudio de la estructura del compartimento subdural puede arrojar luz sobre el origen de los hematomas subdurales craneales y espinales asociados a la hipotensión del líquido cefalorraquídeo.
El bloqueo anestésico subdural, causado por la inyección inadvertida de anestésico local parcial o totalmente entre la duramadre y la aracnoides, da como resultado una anestesia raquídea o epidural altamente impredecible y complicaciones debido a un bloqueo de alto nivel imprevisto. La disección de las uniones intercelulares débiles entre las células neuroteliales puede permitir que los fluidos inyectados se acumulen en el espacio subdural. La extensión del bloqueo subdural es impredecible ya que depende del volumen de anestésico local inyectado y la naturaleza de la disección (cefálica o circunferencial). Si la disección es principalmente cefálica, solo unos pocos mililitros de solución anestésica pueden bloquear los síntomas cardiorrespiratorios.
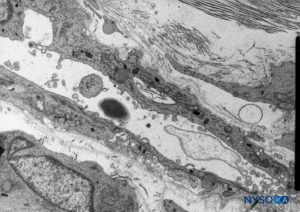
FIGURA 53. Células neuroteliales en el compartimento subdural. Microscopio de transmisión por electrones. Aumento ×5000. (Reproducido con autorización de Reina MA, De León Casasola OA, et al: The origin of the spine subdural space. Ultrastructure Finding. Anesth Analg. 2002 Apr;94(4):991-995.)

FIGURA 54. Células neuroteliales en el compartimento subdural. Microscopía electrónica de barrido. Ampliación ×3000. (Reproducido con autorización de Reina MA, De León Casasola OA, et al: The origin of the spine subdural space. Ultrastructure Finding. Anesth Analg. 2002 Apr;94(4):991-995.)
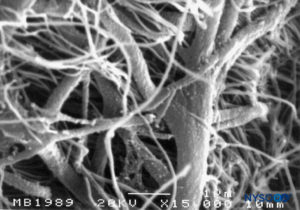
FIGURA 54. Células neuroteliales en el compartimento subdural. Microscopía electrónica de barrido. Ampliación ×3000. (Reproducido con autorización de Reina MA, De León Casasola OA, et al: The origin of the spine subdural space. Ultrastructure Finding. Anesth Analg. 2002 Apr;94(4):991-995.)
PUÑOS DE RAÍZ NERVIOSA
Las proyecciones bilaterales del saco dural (materia) sobre las raíces nerviosas forman los manguitos de raíces nerviosas o manguitos durales (Figura 58 y XNUMX). Las extensiones laterales de la duramadre y la capa aracnoidea rodean las raíces nerviosas cuando salen del conducto vertebral. El saco dural puede contener cierta cantidad de líquido cefalorraquídeo alrededor de la raíz nerviosa. Los manguitos de raíz nerviosa (mangas) tienen componentes celulares internos y fibrilares externos (Figura 59 y XNUMX). Las células leptomeníngeas, de naturaleza similar a las células aracnoideas o piales, forman el componente celular de los manguitos radiculares. Estas células son alargadas, más anchas alrededor del núcleo, estratificadas y orientadas longitudinalmente al eje de la raíz nerviosa.Figura 60 y XNUMX).
En el nivel de preganglio, el componente celular de un manguito radicular tiene un grosor de 5.8 a 13 μm. Estas células tienen prolongaciones citoplasmáticas que invaden las células vecinas, dejando poco espacio extracelular. Las uniones entre las membranas celulares son del tipo desmosomas y tienen uniones estrechas (Figura 61 y XNUMX). Las células contienen mitocondrias en su citoplasma y retículo endoplásmico rugoso. Cada célula tiene un grosor de aproximadamente 0.15 a 0.8 μm en ambos extremos y de 2.2 a 4.9 μm en el núcleo. El componente celular está dispuesto en dos capas concéntricas separadas por fibras de colágeno.
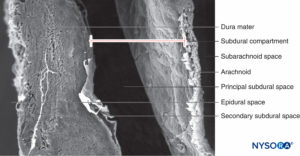
FIGURA 56. Espacio subdural humano en las meninges lumbares. Microscopía electrónica de barrido. Aumento ×180. (Reproducida con autorización de Reina MA, López A, De Andrés JA, Villanueva MC, Cortés L: ¿Existe el espacio subdural? Rev Esp Anestesiol Reanim. 1998 Nov;45(9):367-376.)
FIGURA 58. Manguito de raíz nerviosa humana. (Reproducida con autorización de Reina MA, Villanueva MC, López A, et al: Fat inside the dural sheath of lumbar nervious roots in human. Rev Esp Anestesiol Reanim. 2007 May;54(5):297-301.)
En el nivel posganglionar, el componente celular tiene de 9 a 14 capas concéntricas unicelulares y mide de 18 a 50 μm. Sus uniones son del tipo desmosoma. La morfología del componente celular a nivel ganglionar muestra cambios de transición mientras conserva muchas de las características que se muestran a nivel posganglionar. El componente celular consta de 25 a 30 láminas unicelulares concéntricas y tiene un grosor de 55 a 60 μm. Los aspectos ultraestructurales del componente celular en los niveles pre, post y ganglionares son similares. Las células tienen un retículo endoplásmico rugoso ampliamente distribuido y algunas también contienen vacuolas grandes (0.1 μm) que ocupan casi la mitad del espacio citoplasmático. Una estructura similar a una membrana que se encuentra en su citoplasma puede estar involucrada en la producción de vesículas (0.05 a 0.07 μm) necesarias para la pinocitosis. Las fibras de colágeno junto con los axones mielinizados y amielínicos se ven en la cara interna del plano celular y forman parte de la estructura fibrilar endoneural. Las uniones de membrana especializadas entre las células en los niveles pre, post y ganglionar aseguran un efecto de barrera, limitando el paso de sustancias desde el espacio epidural a los axones nerviosos.
El componente fibrilar reside en la porción externa del manguito de la raíz y tiene un espesor de 100 a 150 μm.Figura 62 y XNUMX). Está constituido mayoritariamente por fibras de colágeno dispuestas en láminas concéntricas con escasas fibras elásticas. Un gran número de adipocitos separan las láminas durales en grupos de tres a cinco capas concéntricas.Figura 63 y XNUMX). La microscopía electrónica de barrido muestra adipocitos (Figura 63 y XNUMX) que se extiende desde el saco dural hasta los ganglios de la raíz dorsal. Los adipocitos se pueden encontrar sobresaliendo desde el interior de la pared construida por el componente fibrilar, fuera de la superficie epidural externa del manguito radicular (Figuras 64 y 65). La porción fibrilar en el saco dural contiene alrededor de 80 láminas durales con fibras de colágeno orientadas en diferentes direcciones y pocas fibras elásticas. Su espesor varía entre 270 y 350 μm a nivel lumbar. Los adipocitos no se encuentran dentro del espesor del saco dural.
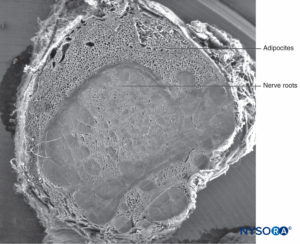
FIGURA 59. Manguito de raíz nerviosa humana. Microscopía electrónica de barrido. Aumento ×12. (Reproducida con permiso de Reina MA, Villanueva MC, Machés F, et al: Ultrastructure of human spine nervio root cuff in lumbar spine. Anesth Analg. 2008 Jan;106(1): 339-344.)
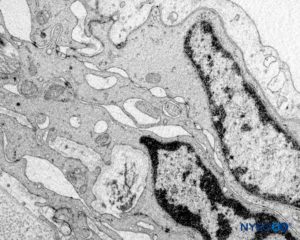
FIGURA 60. Manguito de raíz nerviosa humana. Detalle de barrera celular de transición. Microscopio de transmisión por electrones. Ampliación ×20,000. (Reproducido con permiso de Reina MA, Villanueva MC, Machés F, et al: Ultrastructure of human spine nervio root cuff in lumbar spine. Anesth Analg. 2008 Jan;106(1):339-344.)
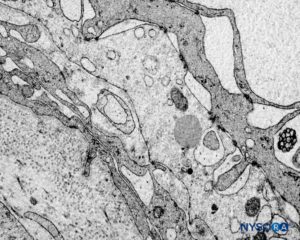
FIGURA 61. Manguito de raíz nerviosa humana. Detalle de barrera celular de transición. Microscopio de transmisión por electrones. Ampliación ×3000. (Reproducida con permiso de Reina MA, Machés F, Pulido P, López A, De Andrés JA. Ultrastructure of Human Spinal Meninges. En: Aldrete A. Arachnoiditis, Mexico: Alfil Ed; 2010. pp. 29-46.)
Las variaciones del grosor dural a lo largo del saco dural y las diferencias relacionadas con el componente fibrilar externo no alteran el efecto barrera, que es responsabilidad exclusiva del componente celular.
La microscopía electrónica de barrido ha demostrado que los adipocitos miden de 50 a 70 μm y son similares a los que se encuentran en muestras de nervios periféricos del nervio ciático. El hecho de que los adipocitos parezcan más pequeños y carezcan de forma esférica probablemente se deba a la pérdida de grasa de sus vacuolas durante la preparación de la muestra. La grasa en los manguitos de la raíz cubre grupos de axones de la raíz, aunque no se ven adipocitos encerrando los axones individualmente. Esta grasa ocupa parcial o totalmente el espesor del componente fibrilar de los manguitos radiculares.
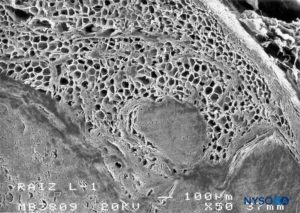
FIGURA 62. Manguito de raíz nerviosa humana. Detalle de tejido graso en espesor de manguito de raíz nerviosa. Microscopía electrónica de barrido. Aumento ×50. (Reproducida con autorización de Reina MA, Villanueva MC, López A, et al: Fat inside the dural sheath of lumbar nervious roots in human. Rev Esp Anestesiol Reanim. 2007 May;54(5):297-301.)
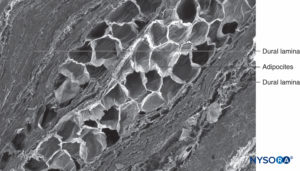
FIGURA 63. Manguito de raíz nerviosa humana. Detalle de láminas durales en espesor de manguito de raíz nerviosa. Microscopía electrónica de barrido. Aumento ×150. (Reproducido con permiso de Reina MA, Villanueva MC, Machés F, et al: Ultrastructure of human spine nervio root cuff in lumbar spine. Anesth Analg. 2008 Jan;106(1):339-344.)

FIGURA 64. Manguito de raíz nerviosa humana. Adipocitos en manguito de raíz nerviosa. Microscopía electrónica de barrido. Aumento ×400. (Reproducido con permiso de Reina MA, Villanueva MC, Machés F, et al: Ultrastructure of human spine nervio root cuff in lumbar spine. Anesth Analg. 2008 Jan;106(1):339-344.)
FIGURA 65. Adipocitos en la superficie epidural del manguito de la raíz nerviosa. Microscopía electrónica de barrido. Aumento ×300. (Reproducido con permiso de Reina MA, Villanueva MC, López A, et al: Fat inside the dural sheath of lumbar nervious roots in human. Rev Esp Anestesiol Reanim. 2007 May;54(5):297-301.)
TEJIDO ADIPOSO EN PUÑOS DE RAÍCES Y CINÉTICA DE FÁRMACOS
El tejido adiposo se puede encontrar en el espacio epidural y dentro de los manguitos de la raíz nerviosa. La grasa de los manguitos nerviosos está en contacto directo con los axones de las raíces nerviosas y puede desempeñar un papel en la cinética de las sustancias lipofílicas inyectadas cerca de las raíces nerviosas. El pequeño espacio dentro de los manguitos radiculares y la gran cantidad de fármacos disponibles en caso de inyección en el manguito pueden exponer los elementos neurales a una alta concentración de anestésico local, así como a una propagación retrógrada hacia el espacio subaracnoideo.
RESUMEN
Este capítulo describió las características anatómicas de las meninges neuroaxiales y las estructuras relacionadas y analizó sus posibles implicaciones clínicas.
Referencias
- Reina MA, López A, De Andrés JA: Variación del grosor de la duramadre humana. Rev Esp Anestesiol Reanim 1999;46:344–349.
- Reina MA, Pulido P, López A: El saco dural humano. Rev Arg Anestesiol 2007; 65:167–184.
- Reina MA, López A, Dittmann M, De Andrés JA: Estructura del espesor de la duramadre humana por microscopía electrónica de barrido. Rev Esp Anestesiol Reanim 1996;43:135–137.
- Reina MA, Dittmann M, López A, van Zundert A: Nuevas perspectivas en la estructura microscópica de la duramadre humana en la región dorso lumbar. Reg Anesth 1997;22:161–166.
- Dittmann M, Reina MA, López A: Neue ergebnisse bei der darstellung der duramadre spinelis mittles rasterelektronenmikroskopie. Anestesista 1998;47:409–413.
- Reina MA, López A, Dittmann M, De Andrés JA: Superficie externa e interna de la duramadre humana por microscopía electrónica de barrido. Rev Esp Anestesiol Reanim 1996;43:130–134.
- Reina MA, Villanueva MC, López A: Aracnoides trabecular, piamadre espinal humana y anestesia subaracnoidea. Rev Arg Anestesiol 2008;66: 111–133.
- Reina MA, De León Casasola OA, López A, De Andrés JA, Mora M, Fernández A: El origen del espacio subdural espinal. Hallazgo de ultraestructura. Anesth Analg 2002;94:991–995.
- Reina MA, López A, De Andrés JA, Villanueva MC, Cortés L: ¿Existe el espacio subdural? [en español]. Rev Esp Anestesiol Reanim 1998;45:367–376.
- Reina MA, De León Casasola OA, López A, De Andrés JA, Martín S, Mora M: Estudio in vitro de lesiones durales producidas por agujas Quincke y Whitacre calibre 25 evaluadas por microscopía electrónica de barrido. Reg Anesth Pain Med 2000;25:393–402.
- Reina MA, López A, Badorrey V, De Andrés JA, Martín S: Lesiones durararacnoideas producidas por agujas espinales Quincke 22G durante una punción lumbar. J Neurol Neurosurg Psiquiatría 2004;75:893–897.
- Reina MA, López-García A, de Andrés-Ibáñez JA, et al: Microscopía electrónica de las lesiones producidas en la duramadre humana por agujas Quincke biseladas y Whitacre. Rev Esp Anestesiol Reanim 1997;44:56–61.
- Jokinen MJ, Pitkänen MT, Lehtonen E: Puntas de aguja espinal deformadas y perforaciones durales asociadas examinadas mediante microscopía electrónica de barrido. Acta Anaesthesiol Scand 1996;40:687–690.
- Puolakka R, Andersson LC, Rosenberg PH: Análisis microscópico de tres puntas de agujas espinales diferentes después de una punción subaracnoidea experimental. Reg Anesth Pain Med 2000;25:163–169.
- Benham M: Daño de la aguja espinal durante la práctica clínica de rutina. Anestesia 1996;51:843–845.
- Reina MA, López A, Manzarbeitia F, Amador V, Goxencia I, Olmedilla MC: Fragmentos de piel transportados por agujas espinales en cadáveres. Rev Esp Anestesiol Reanim 1995;42:383–385.
- Reina MA, López-García A, Dittmann M, de Andrés JA, Blázquez MG: Tumores epidermoides espinales iatrogénicos. Una complicación tardía de la punción espinal. Rev Esp Anestesiol Reanim 1996;43:142–146.
- Reina MA, Wikinski J, De Andrés JA: Una rara complicación de la anestesia epidural y subaracnoidea. Tumores epidermoideos espinales iatrogénicos. Rev Arg Anestesiol 2008; 66:319–336.
- Reina MA, Castedo J, López A: Cefalea pospunción dural: Ultraestructura de las lesiones durales y agujas espinales usadas en las punciones lumbares. Rev Arg Anestesiol 2008;66:6–26.
- Reina MA, López A, De Andrés JA: Hipótesis sobre las bases anatómicas del síndrome de cauda equina y síndrome de irritación radicular transitoria posanestesia espinal. Rev Esp Anestesiol Reanim 1999;46:99–105.
- Reina MA, Machés F, López A, De Andrés JA: La ultraestructura de la aracnoides espinal en humanos y su impacto en la raquianestesia, síndrome de cauda equina y síndrome neurológico transitorio. Tech Reg Anesth Pain Management 2008;12:153–160.
- Reina MA, De Leon Casasola O, Villanueva MC, López A, Maches F, De Andrés JA: Hallazgos ultraestructurales en la piamadre espinal humana en relación con la anestesia subaracnoidea. Anesth Analg 2004;98:1479–1485.
- Reina MA, López García A, de Andrés JA: Descripción anatómica de una perforación natural presente en la piamadre lumbar humana. Rev Esp Anestesiol Reanim 1998;45:4–7.
- Luyendijk W: La plica mediana dorsal de la duramadre y su relación con la peridurografía lumbar. Neurorradiología 1976;11:147–149.
- Blomberg R: La banda de tejido conectivo dorsomedial en el espacio epidural lumbar de los humanos: un estudio anatómico mediante epiduroscopia en casos de autopsia. Anesth Analg 1986;65:747–752.
- Reina MA, Pulido P, Castedo J, Villanueva MC, López A, De Sola R: Características y distribución de la grasa epidural. Rev Esp Anestesiol Reanim 2006;53: 315–324.
- Reina MA, Pulido P, Castedo J, Villanueva MC, López A, De Andrés JA: La grasa epidural en diferentes enfermedades. Aportes de la resonancia magnética y posibles implicaciones en la anestesia epidural y espinal. Rev Esp Anestesiol Reanim 2007;54:173–178.
- Reina MA, López A, Benito-Leon J, Pulido P, María F: Hematoma intracraneal y espinal, una rara complicación de la anestesia epidural y espinal. Rev Esp Anestesiol Reanim 2004;51:28–39.
- Reina MA, López A, Maches F, De Andrés JA: Origen del hematoma subdural espinal. Rev Esp Anestesiol Reanim 2004;51:240–246.
- Reina MA, Villanueva MC, Machés F, Carrera A, López A, De Andrés JA: Ultraestructura del manguito de la raíz del nervio espinal humano en la columna lumbar. Anesth Analg 2008;106:339–344.
- Reina MA, De Andrés J, Machés F, López A: New insights of human spine root cuffs. In van Zundert A: Aspectos destacados del dolor, la terapia y la anestesia regional, 16.ª ed. Permanyer, 2007, págs. 163-173.
- Reina MA, Villanueva MC, López A, De Andrés JA: Grasa dentro de la vaina dural de raíces nerviosas lumbares en humanos. Rev Esp Anestesiol Reanim 2007;54:169–172.
- Reina MA, López A, De Andrés JA: Tejido adiposo dentro de los nervios periféricos. Estudio del nervio ciático humano. Rev Esp Anestesiol Reanim 2002;49:397–402.
- Reina MA, Machés F, Pulido P, López A, De Andrés JA: Ultraestructura de las meninges espinales humanas. En Aldrete A: Aracnoiditis. Alfil Ed, 2010, págs. 29–246.
- Reina MA. Atlas de Anatomía Funcional para Anestesia Regional y Medicina del Dolor. Imágenes de Estructura Humana, Ultraestructura y Reconstrucción 3D. Springer, 2015, págs. 705–748.
- Reina MA, De Andrés JA, López A: Anestesia subaracnoidea y epidural. En Raj P: Libro de texto de anestesia regional. Churchill Livingston, 2002, págs. 307–324.
- Reina MA, De Andrés JA, López García A: Anatomía en el bloqueo espinal. En Torres LM (ed.). Libro de texto de anestesia y manejo del dolor. Aran Ed, 2001, págs. 1135–1155.
- Selander D, Sjöstrand J: Propagación longitudinal de anestésicos locales inyectados intraneuralmente. Un estudio experimental de la distribución neural inicial después de inyecciones intraneurales. Acta Anaesthesiol Scand 1978;22:622–634.
Consejos NYSORA
- La forma del saco dural es cilíndrica y su grosor es variable.
- La duramadre es permeable y ocupa el 90% del espesor del saco dural.
- La capa aracnoidea es semipermeable y gobierna el paso de sustancias.
- Las lesiones dura-aracnoideas pueden diferir según el tipo de aguja espinal.
- Las agujas de punta de lápiz producen una lesión más destructiva, mientras que las agujas cortantes producen una lesión en forma de U, aunque el tamaño de ambas es similar.
- La aracnoides trabecular cubre las raíces nerviosas y forma vainas aracnoideas.
- La piamadre tiene fenestraciones a nivel del cono medular.
- La distribución de la grasa epidural es variable a lo largo del canal espinal pero es consistente en diferentes niveles vertebrales.
- El volumen de grasa epidural aumenta en la lipomatosis epidural, se distribuye asimétricamente en la cifoescoliosis y está ausente en la estenosis.
- De hecho, el “espacio subdural” está ocupado por un tejido delicado compuesto por células neuroteliales especializadas. El desgarro del compartimento subdural da origen a lo que conocemos como espacio subdural.
- En los manguitos radiculares, hay un componente celular que gobierna la difusión de sustancias. Los manguitos radiculares también contienen un gran número de adipocitos en su espesor.