Michael J. Barrington, Richard Brull, Miguel A. Reina y Admir Hadzic
INTRODUCCIÓN
Esta sección revisa varios factores que pueden contribuir a las complicaciones neurológicas después de los bloqueos de nervios periféricos (BNP) y sugiere principios de práctica e implicaciones de las modalidades de monitoreo para mitigar el riesgo de complicaciones neurológicas.
CONSIDERACIONES ANATÓMICAS DE LA LESIÓN NERVIOSA RELACIONADA CON EL BLOQUEO NERVIOSO PERIFÉRICO
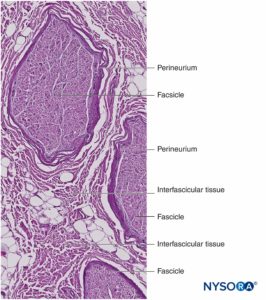
Un nervio es un órgano distinto que comprende tejido neural, un estroma de tejido conectivo específico y un suministro de sangre designado (Figura 1 y XNUMX). Las células nerviosas, o neuronas, se componen de un cuerpo celular, dendritas y un axón.
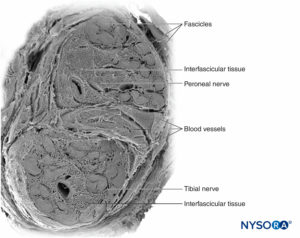
FIGURA 1. Nervio ciático humano. Microscopía electrónica de barrido. (Reproducido con autorización de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
El axón es una extensión citoplásmica de la neurona que transmite señales eléctricas a lo largo de su longitud desde el cuerpo celular proximalmente hasta cualquier lugar desde unos pocos milímetros hasta casi 1 m distalmente. La mayoría de los nervios periféricos pueden transmitir tanto señales motoras aferentes como sensoriales eferentes.
En el sistema nervioso periférico, la gran mayoría de los axones están mielinizados, caracterizados por una vaina de células de Schwann que recubre el axón en una capa de mielina.Figura 2 y XNUMX). Las células de Schwann se interrumpen en espacios interpuestos, conocidos como nodos de Ranvier, donde ocurre el proceso de despolarización y repolarización durante la propagación saltatoria del potencial de acción. Junto con su vaina de mielina, cada axón está unido por una capa delgada de tejido conectivo llamada endoneuro (Figura 3 y XNUMX) y luego se denomina fibra nerviosa.
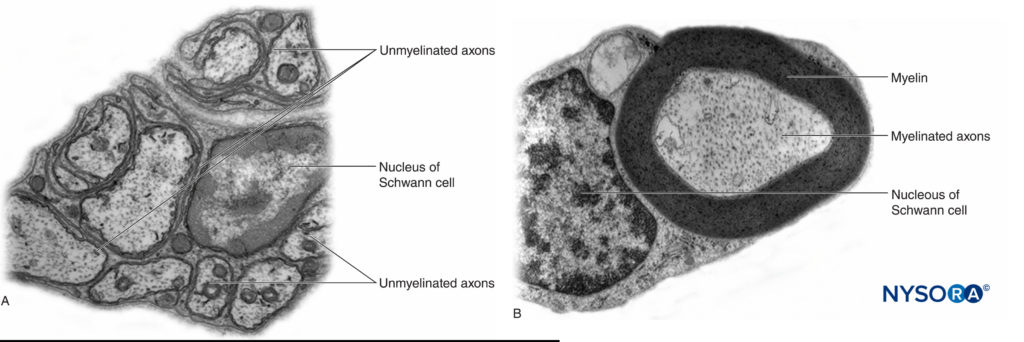
FIGURA 2. A: Axón no mielinizado de una raicilla nerviosa humana. B: axón mielinizado de un nervio ciático humano. Microscopio de transmisión por electrones. (Reproducido con autorización de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
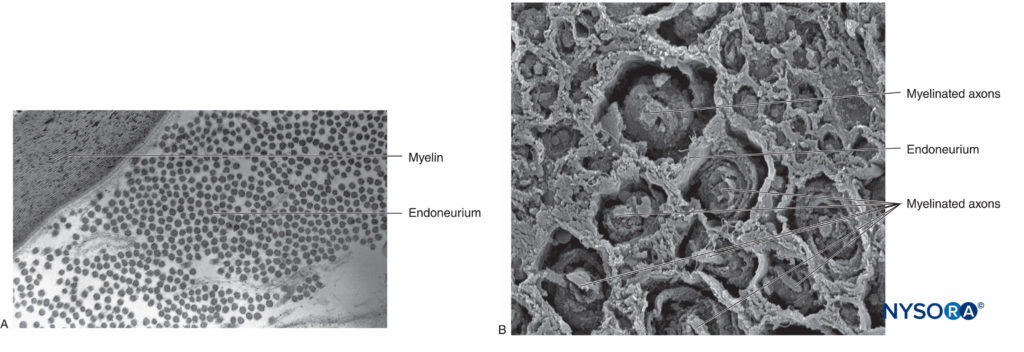
FIGURA 3. Endoneuro. Axones mielinizados envueltos por endoneuro obtenido de un nervio ciático humano. A: Microscopía electrónica de transmisión. (Reproducido con autorización de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.) B: Microscopía electrónica de barrido. (Reproducido con autorización de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
Las fibras nerviosas se organizan en grupos llamados fascículos (Figura 4 y XNUMX). Dentro de cada fascículo, las fibras nerviosas forman un plexo intraneural en el que los axones toman diferentes posiciones a lo largo de su trayecto.Figura 5 y XNUMX). En la vecindad de las articulaciones, los fascículos son más delgados y numerosos y tienden a estar rodeados por una mayor cantidad de tejido conectivo, lo que reduce la vulnerabilidad de los fascículos a agresiones como la presión y el estiramiento.
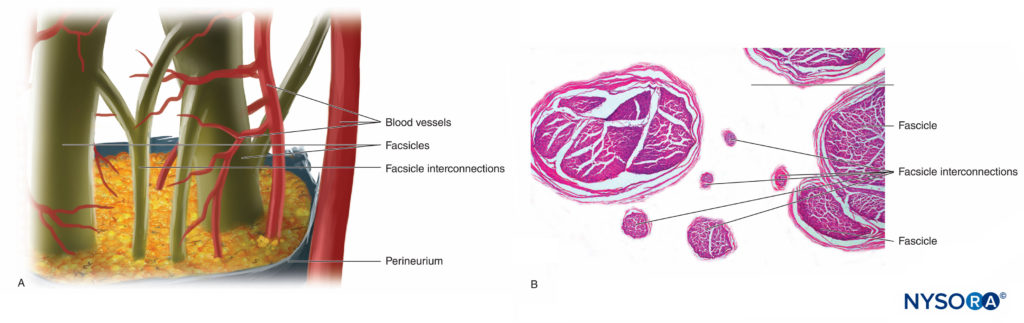
FIGURA 5. Plexo intraneural. Un diagrama. B: Fascículos y fascículos de interconexión. (B, Reproducido con autorización de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
Cada fascículo está rodeado por perineuro que consta de capas continuas y concéntricas de 8 a 18 células (Figura 6 y XNUMX). El grosor del perineurio es típicamente de 7 a 20 μm. Las capas de células perineuriales proporcionan una barrera para la difusión de sustancias dentro y fuera de los fascículos. El espacio entre las células perineurales se compone de sustancias amorfas fundamentales, fibras de colágeno y fibroblastos. Estas fibras de colágeno se pueden alinear en diferentes direcciones, pero predominantemente a lo largo del eje longitudinal del fascículo.Figura 6 y XNUMX). El perineurio permite cierto movimiento de axones dentro de un fascículo y mantiene la presión intrafascicular mientras actúa como una barrera física eficaz contra las lesiones mecánicas y químicas. Asimismo, el perineuro sirve como una importante barrera de difusión, evitando la exposición de los axones a sustancias potencialmente nocivas, como los anestésicos locales.
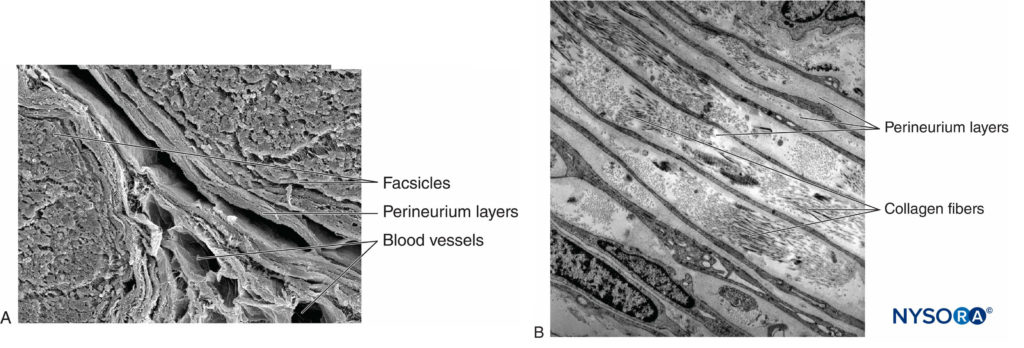
FIGURA 6. Perineurio. Capas perineurales del nervio ciático humano. A: Microscopía electrónica de transmisión. (Reproducido con permiso de Reina MA, López A, Villanueva MC, et al: The blood-nerve barrier in periférico Nervios. Rev Esp Anestesiol Reanim. 2003 Feb;50(2):80-86.) B: Microscopía electrónica de barrido. (Reproducido con autorización de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
Los grupos de fascículos están unidos por un epineuro, la más gruesa de las tres capas de tejido conectivo que encierran grupos de fascículos junto con su tejido de soporte interfascicular y adipocitos.Figura 1 y XNUMX). El epineuro se compone principalmente de fibras de colágeno y un pequeño número de vasos sanguíneos (Figura 7 y XNUMX). Las fibras de colágeno del epineuro son similares en tamaño y apariencia a las fibras de colágeno de la duramadre o manguitos durales. El epineuro le da al nervio su apariencia externa característica en las imágenes de ultrasonido (es decir, aparece como una estructura discreta).
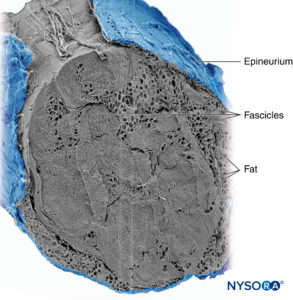
FIGURA 7. epineuro. Nervio tibial humano: detalle de fascículos, tejido interfascicular y epineuro. Microscopía electrónica de barrido. (Reproducido con permiso de Reina
MA, Arriazu R, Collier CB, et al: Microscopía electrónica de nervios periféricos humanos de relevancia clínica para la práctica de neurociencia
bloques Una revisión estructural y ultraestructural basada en datos experimentales y de laboratorio originales. Rev Esp Anestesiol Reanim. 2013 diciembre; 60 (10): 552–562.)
Los nervios periféricos tienen dos sistemas vasculares independientes pero interconectados. El sistema extrínseco consta de arterias, arteriolas y venas que se encuentran dentro del epineuro, mientras que el sistema vascular intrínseco comprende un grupo de capilares longitudinales que discurren dentro de los fascículos y el endoneuro.Figura 8 y XNUMX). La anastomosis entre los dos sistemas vasculares está formada por vasos (Figura 1 y XNUMX) que se originan en el epineuro y atraviesan el perineuro. La lesión de estos vasos puede dar lugar a una serie de complicaciones, desde isquemia hasta inflamación por hematoma.
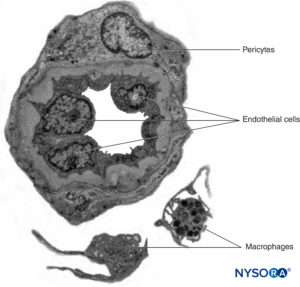
FIGURA 8. Capilares continuos endoneurales. Microscopio de transmisión por electrones. (Reproducido con autorización de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
Las raíces nerviosas tienen menos resistencia a la tracción y elasticidad en comparación con los axones y sus elementos de soporte en los troncos nerviosos periféricos. Los axones incluidos dentro de las raíces nerviosas espinales no están rodeados por un perineurio u otra estructura con efecto de barrera. Más distalmente (p. ej., nervios espinales y troncos/divisiones del plexo), los fascículos tienen su propio perineurio protector (Figuras 9, 10 y 11) y tienen una disposición plexiforme que contribuye a su resistencia a la tracción. Los troncos nerviosos dentro de los lechos tisulares, los fascículos dentro de los troncos nerviosos y los axones dentro de los fascículos tienen un curso ligeramente ondulado, lo que da como resultado un exceso de longitud relativo. Además, los nervios suelen estar unidos de forma laxa por su epineuro a las estructuras adyacentes. Hay una red no especializada de tejido conectivo areolar (fascia profunda) que llena el espacio entre estructuras especializadas como nervios, músculos y vasos.Figura 12 y XNUMX). Este tejido conecta holgadamente estas estructuras para permitir el movimiento de una sobre otra. Este movimiento se reduce cuando los nervios están atados al entrar en vasos sanguíneos, ramas u otros puntos de referencia.
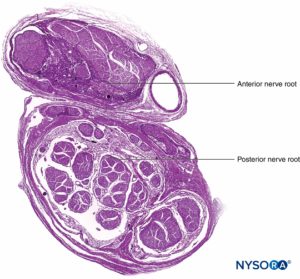
FIGURA 9. Raíz nerviosa ventral y dorsal. Sección transversal en el manguito de la raíz del séptimo nervio entre el saco dural y el ganglio de la raíz dorsal. (Usado con permiso de MA Reina.)
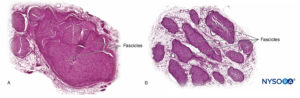
FIGURA 10. raíz nerviosa. Sección transversal en el ganglio de la raíz dorsal externa del manguito de la raíz del séptimo nervio. A: exterior a 2 mm. B: Exterior a 5 mm. (Usado con permiso de MA Reina.)
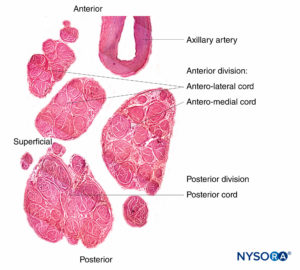
FIGURA 11. Cordones del plexo braquial. Cordón anteromedial, cordón anterolateral y cordón posterior. Detalles de fascículos y tejido interfascicular dentro de las cuerdas. (Reproducido con autorización de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
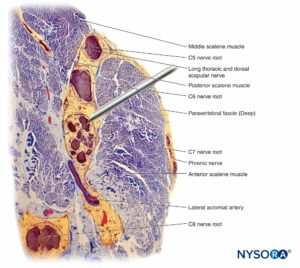
FIGURA 12. Interacción de la aguja de bloqueo y el plexo braquial interescalénico. La colocación de la aguja en los fascículos (como se muestra aquí) provoca una lesión fascicular. Se pueden cometer lesiones adicionales cuando se realiza una inyección a través de una aguja colocada intrafascicularmente. Observe la diferencia de tamaño entre la aguja y los fascículos. (Reproducido con autorización de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
Para una revisión más completa, véase Tejidos conectivos de los nervios periféricos.
Consejos NYSORA
La pérdida de tono muscular, como ocurre durante la anestesia, teóricamente expone los elementos neurales a fuerzas de tracción. Sin embargo, también hay características anatómicas que protegen contra la tracción lateral o las lesiones por estiramiento. Por ejemplo, en el caso de bloqueos interescalénicos del plexo braquial, las raíces de los nervios espinales cuarto, quinto y sexto se alojan en la canaleta de las apófisis transversas y, por lo tanto, están relativamente protegidas de estas fuerzas. Las raíces dorsal y ventral de los nervios raquídeos se protegen aún más de la tracción lateral mediante el acuñamiento de un cono de duramadre que rodea el complejo raíz nerviosa-nervio raquídeo en el agujero intervertebral.
FISIOPATOLOGÍA DE LA LESIÓN DE LOS NERVIOS PERIFÉRICOS
Gravedad de la lesión del nervio periférico
Los principales determinantes del pronóstico de la lesión del nervio periférico (PNI) son la gravedad de la lesión y la integridad residual de los axones. La gravedad de la PNI generalmente se clasifica de acuerdo con el grado relativo de alteración axonal. Tradicionalmente, se cree que las lesiones axonales proximales (es decir, cercanas al cuerpo celular) son más graves que las lesiones axonales distales (es decir, más cercanas al objetivo de inervación), ya que la probabilidad de inervación y recuperación parece variar indirectamente con la distancia entre la ubicación de la lesión axonal y el tejido diana.
Las dos clasificaciones anatómicas más utilizadas son las clasificaciones de Seddon y Sunderland (Tabla 1). La clasificación más utilizada en la práctica clínica es la clasificación de Seddon de tres niveles, que incluye (de leve a grave) neuropraxia, axonotmesis y neurotmesis. La neuropraxia se refiere al daño a la vaina de mielina típicamente asociado con el estiramiento o la compresión del nervio donde los axones y los elementos de soporte (endoneurio, perineuro y epineuro) permanecen intactos. El pronóstico de una lesión neuropráxica es favorable y la recuperación completa de la función ocurre en semanas o meses.
TABLA 1. Clasificación de la lesión nerviosa.
| Seddon3 | Sunderland4 | Procesos | Pronóstico |
|---|---|---|---|
| neuropraxia | 1 | Daño a la mielina Ralentización y bloqueo de la conducción | Bueno |
| Axonotmesis | 2 | Pérdida de continuidad axonal; endoneuro intacto sin conducción | Suficientemente bueno |
| Neurotmesis | 3 | Pérdida de continuidad axonal y endoneural; perineurio intacto sin conducción | Pobre |
| 4 | Pérdida de continuidad axonal, endoneural y perineural; epineuro intacto sin conducción | ||
| 5 | Transección completa del nervio sin conducción |
Consejos NYSORA
La mayoría de los síntomas neurológicos posoperatorios asociados con la anestesia regional tienden a seguir un patrón neuropráxico de lesión y recuperación.
La axonotmesis se refiere a la lesión axonal asociada con empalamiento fascicular, aplastamiento de nervios o lesión tóxica, con daño al endoneuro y posiblemente al perineuro.Figura 13 y XNUMX). La recuperación después de la pérdida axonal puede ser prolongada y variable, dependiendo de la extensión (parcial o completa) de la interrupción del perineurio y de la distancia desde el sitio de la lesión hasta el músculo correspondiente.
Finalmente, la neurotmesis se refiere a la sección completa del nervio, incluidos los axones, el endoneuro, el perineurio y el tejido conjuntivo epineural. Por lo general, requiere una intervención quirúrgica. El pronóstico suele ser malo.
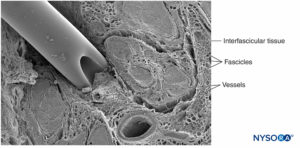
FIGURA 13. Nervio tibial humano. Punción in vitro de nervio con aguja de neuroestimulación. Microscopía electrónica de barrido. (Reproducido con autorización de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
Mecanismos de lesión
El mecanismo de PNI relacionado con el uso de PNB cae en una de tres categorías amplias: lesión mecánica y por inyección (traumática), vascular (isquémica) y química (neurotoxicidad). La mayor parte de la información sobre lesiones por inyección de nervios periféricos se obtiene de investigaciones experimentales en modelos animales. Debido a que tal investigación no es posible en humanos, los mecanismos de PNI no se comprenden completamente. Esto se debe a que los modelos animales varían significativamente en las especies utilizadas, los nervios inyectados y los protocolos de estudio, lo que dificulta extrapolar fácilmente dichos datos a la práctica clínica real.
Lesiones Mecánicas y por Inyección
Las lesiones mecánicas o traumáticas incluyen lesiones por compresión, estiramiento, laceración o inyección. La compresión o el atrapamiento de los nervios pueden producir un bloqueo de la conducción y, si se prolonga, una desmielinización focal de algunos axones. El traumatismo por aguja y otras agresiones mecánicas a los nervios dan como resultado un aumento en la producción de neuropéptidos y la actividad del asta dorsal. La compresión nerviosa relacionada con la aguja puede ser el resultado de un contacto enérgico entre la aguja y el nervio debido a una aguja que se acerca o a una inyección dentro del nervio mismo. Se ha postulado que una inyección intraneural puede provocar una presión intraneural alta sostenida que, cuando supera la presión de oclusión capilar, puede provocar isquemia nerviosa y lesiones potenciales.
Las inyecciones inadvertidas de antibióticos, esteroides, colágeno bovino, toxina botulínica y anestésicos locales en los nervios periféricos se han asociado con déficits neurológicos nocivos. En un modelo cadavérico de inyección intraneural deliberada del nervio ciático, la punta de la aguja interrumpió el 3% de los axones. Aunque es posible que se produzca algún grado de lesión axonal incluso en ausencia de lesión del perineuro, el sitio anatómico real de la lesión (p. ej., inyección) es fundamental para el pronóstico. Una de las principales causas de la PNI relacionada con el bloqueo es la inyección de anestésico local en un fascículo, lo que provoca un traumatismo directo con la aguja y la inyección, rotura del perineuro y pérdida del entorno protector dentro del fascículo con la consiguiente degeneración axonal y de mielina. Las lesiones por estiramiento de los nervios pueden producirse cuando los nervios o los plexos se colocan en una posición no fisiológica o fisiológica exagerada. Por último, la lesión mecánica por laceración se produce cuando el nervio se lesiona con una aguja, y es muy poco probable que se produzca una recuperación espontánea después de una sección completa. Tabla 2 indica las recomendaciones basadas en la evidencia para reducir el riesgo de PNI relacionadas con bloqueos.
TABLA 2. Recomendaciones basadas en evidencia para reducir el riesgo de PNI relacionada con el bloqueo.
| Es posible que la inserción de una aguja intraneural no siempre provoque una lesión nerviosa. |
| Se debe evitar la colocación e inyección de agujas intrafasciculares. |
| Ni la presencia ni la ausencia de parestesia durante el avance de la aguja o durante la inyección del anestésico local es completamente predictiva de lesión nerviosa. |
| La provocación de dolor intenso durante el avance de la aguja o al inyectar el anestésico local debe incitar al cese de la inyección. |
| La presencia de una respuesta motora evocada a una corriente de menos de 0.5 (0.1 ms) indica una relación íntima entre la aguja y el nervio, contacto entre la aguja y el nervio o colocación intraneural de la aguja. Esta información es útil en la toma de decisiones clínicas. |
| La monitorización de la presión de inyección puede detectar la inyección en un espacio tisular poco compatible, como un fascículo nervioso. |
| La ecografía puede detectar la inyección intraneural, aunque tal detección puede ocurrir demasiado tarde para evitar lesiones, ya que una pequeña cantidad de inyectado es suficiente para romper el fascículo. |
| La tecnología de ultrasonido actual no tiene una resolución adecuada para discernir entre una inyección interfascicular e intrafascicular. |
| No todos los operadores ni en todos los pacientes obtienen imágenes adecuadas de la interfaz aguja-nervio. |
Lesión vascular
El daño a la vasculatura nerviosa durante los bloqueos nerviosos puede resultar en isquemia local o difusa y ocurre cuando hay lesión vascular directa, oclusión aguda de las arterias de las que derivan los vasa nervorum o hemorragia dentro de una vaina nerviosa. La circulación epineural es un componente crítico de la circulación neural general y su eliminación reduce el suministro de sangre nerviosa en un 50%. En la mayoría de las circunstancias, ningún vaso individual domina el patrón en toda la longitud del nervio; sin embargo, el nervio ciático es una excepción a esta regla, ya que recibe su mayor aporte arterial en la región glútea de la arteria comitans nervi ischiadici.
Consejos NYSORA
La irrigación vascular del nervio ciático es menos abundante que la irrigación de la mayoría de los demás nervios periféricos. Esto puede explicar la observación clínica con respecto a por qué la adición de epinefrina al anestésico local parece prolongar el bloqueo ciático significativamente más que para la mayoría de los otros PNB.
Los nervios con abundancia de tejido conjuntivo pueden ser menos susceptibles a la compresión porque las fuerzas externas no se transmiten directamente a los vasos epineuriales. Los anestésicos locales y los complementos reducen potencialmente el flujo sanguíneo neural de una manera dependiente del agente y de la concentración. La epinefrina tiene el potencial de causar vasoconstricción local, pero su papel en causar isquemia nerviosa y lesión es controvertido. El trauma por la inyección puede comprometer aún más el flujo sanguíneo. La isquemia neural también puede ocurrir después de la interrupción de la microvasculatura intrafascicular, altas presiones de inyección, torniquetes y otros insultos compresivos. Los factores relacionados con la punción involuntaria de un vaso, que da como resultado la formación de un hematoma interno o externo que puede comprimir mecánicamente los fascículos desde dentro o fuera de la vaina del nervio y causar inflamación del nervio, se han implicado en la lesión neurológica.
Lesión química
La lesión nerviosa química se debe a la toxicidad tisular de las soluciones inyectadas (p. ej., anestésicos locales, alcohol o fenol) o sus aditivos. La solución tóxica puede inyectarse directamente en el nervio o en los tejidos adyacentes, provocando una reacción inflamatoria aguda o una fibrosis crónica que afecta indirectamente al nervio. Gran parte de la investigación sobre la neurotoxicidad de los anestésicos locales se ha realizado en modelos in vitro, en particular con aplicación intratecal.
Existe evidencia de que casi todos los anestésicos locales pueden tener efectos miotóxicos, neurotóxicos y citotóxicos en varios tejidos bajo ciertas condiciones; sin embargo, los anestésicos locales varían en su potencial neurotóxico. Varios estudios han demostrado que los anestésicos locales pueden provocar la fragmentación del ADN y alterar el potencial de membrana en las mitocondrias, lo que provoca el desacoplamiento de la fosforilación oxidativa, lo que puede provocar apoptosis. También existe una correlación directa entre la concentración del anestésico local y la duración de la exposición al nervio, con la muerte de las células de Schwann, la infiltración con macrófagos y el daño de la mielina. Algunos anestésicos locales tienen un efecto vasoconstrictor intrínseco que puede disminuir el flujo sanguíneo a los nervios, lo que podría provocar isquemia y lesiones.
Sin embargo, la dificultad inherente de extrapolar estos estudios de laboratorio a la práctica clínica de los BNP modernos es que existe una disminución sustancial en la concentración de anestésicos locales cuando llega a los axones.
El sitio de aplicación del anestésico local (extraneural, intraneural, interfascicular, intrafascicular) (Figuras 12, 14 y 15) puede ser el principal determinante de si se producirá neurotoxicidad, especialmente si la concentración es alta y la duración de la exposición es prolongada. La mayoría de las sustancias químicas, incluidos todos los anestésicos locales, inyectados por vía intrafascicular provocan una lesión fascicular grave, mientras que las mismas sustancias inyectadas por vía intraneural pero interfascicular causan menos lesión o ninguna lesión detectable. De hecho, la penetración de la aguja en un nervio puede provocar un daño mínimo si no se combina con la inyección de anestésico local dentro del fascículo nervioso.
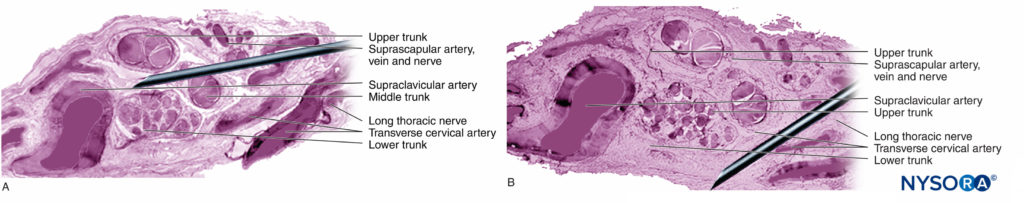
FIGURA 14. Superposición de la aguja en el plexo braquial supraclavicular. Si la aguja de neuroestimulación perfora el nervio, en comparación con las imágenes estáticas, la aguja lesiona los fascículos. En A. y B. se muestran diferentes enfoques. (Reproducido con autorización de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
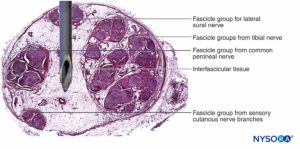
FIGURA 15. Superposición de la aguja en el nervio ciático, abordaje posterior. Si la aguja de neuroestimulación perfora el nervio, según las imágenes estáticas, la aguja lesiona los fascículos. Observe la diferencia de tamaño entre la aguja y los fascículos. Si hay una gran cantidad de tejido interfascicular, como ocurre dentro del nervio ciático, se reduce el riesgo de lesión fascicular. (Reproducido con autorización de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
En un modelo de roedores, Whitlock demostró que la inyección intrafascicular de ropivacaína al 0.75 % provocaba anomalías histológicas graves, como desmielinización, degeneración axonal y degeneración walleriana. Sin embargo, la inyección extrafascicular de ropivacaína al 0.75 % también produjo lesión axonal, aunque de gravedad reducida. Farber y sus colegas informaron recientemente que todos los anestésicos locales de uso común (bupivacaína, lidocaína y ropivacaína) produjeron lesión nerviosa cuando se inyectaron por vía intrafascicular. En su estudio, el grado de lesión disminuyó al aumentar la distancia desde el lugar de la inyección. Cabe destacar que incluso la administración de solución salina por vía intrafascicular resultó en un daño intermedio en los nervios, lo que indica un nivel de lesión inicial asociado con la inyección de cualquier agente en un nervio.
Consejos NYSORA
Si bien la importancia clínica de la neurotoxicidad sigue siendo controvertida, la ubicación de la punta de la aguja durante la inyección del anestésico local juega un papel crucial en la determinación de la probabilidad y la gravedad de la lesión nerviosa.
Lesión Inflamatoria
Los mecanismos inflamatorios de la PNI se reconocen cada vez más como un mecanismo importante en el déficit neurológico post-PNB. Las respuestas inflamatorias no específicas dirigidas a los nervios periféricos pueden ocurrir lejos del sitio de la cirugía o dentro de la extremidad operada, donde puede ser difícil distinguirlas de otras causas de PNI. Se han propuesto mecanismos inflamatorios como responsables de la lesión persistente del nervio frénico después del bloqueo interescalénico para cirugía de hombro.Figura 12 y XNUMX). Kaufman et al. informaron de una serie de 14 pacientes con parálisis diafragmática crónica después de un bloqueo interescalénico.
Durante la exploración quirúrgica, las adherencias, el engrosamiento de la fascia, los cambios vasculares y el tejido cicatricial (presente en 10 de 14 pacientes) que afectaban al nervio frénico sugerían inflamación crónica y eran compatibles con neuropatía por compresión. Investigaciones recientes sugirieron que la inyección intratecal e intraneural de gel de ultrasonido también puede provocar inflamación en los nervios subaracnoideos y periféricos, respectivamente.
ETIOLOGÍA DE LA LESIÓN NERVIOSA TRAS EL BLOQUEO DEL NERVIO PERIFÉRICO
Factores anestésicos
Varios estudios han informado que el tipo de anestesia (regional versus general) no parece influir en la incidencia de PNI. La Universidad de Michigan realizó un análisis retrospectivo de la PNI y no identificó la PNB como un factor de riesgo independiente para la PNI en su serie. Tres estudios epidemiológicos de la Clínica Mayo informaron que la anestesia regional no aumenta el riesgo de PNI después de la artroplastia total de rodilla (TKA), la artroplastia total de cadera (THA) y la artroplastia total de hombro. La literatura quirúrgica reciente sugirió que el riesgo de lesión neurológica posoperatoria asociada con el BNP puede ser mayor que el informado en la literatura sobre anestesia. Discutimos varios factores técnicos relacionados con la PNB que pueden aumentar el riesgo de PNI.
Inyección intraneural
Evitar el traumatismo deliberado de los nervios, incluida la inyección intraneural, es probablemente un principio clave de seguridad de la anestesia regional. Sin embargo, la inyección intraneural puede ocurrir en la práctica clínica sin que se produzcan signos manifiestos de lesión nerviosa. De hecho, la inyección epineural intraneural (pero probablemente extrafascicular) no intencional puede ser más común de lo que se creía anteriormente. Los presuntos riesgos de la inyección intraneural han sido cuestionados por Bigeleisen et al., quienes informaron que la punción del nervio y la aparente inyección intraneural durante el bloqueo del plexo braquial axilar en pacientes sanos no produjeron lesión neurológica. Un estudio más amplio realizado por Liu reclutó a 257 pacientes jóvenes y sanos que se sometieron a un bloqueo interescalénico o supraclavicular guiado por ecografía para una cirugía de hombro. La incidencia de inyección intraneural no intencional fue del 17 % sin que se produjera INP. Sin embargo, la experiencia clínica es limitada y los tamaños de muestra de los estudios actuales son inadecuados para capturar eventos poco frecuentes, como la lesión nerviosa. Por el contrario, en un informe de caso de Cohen, la INP se produjo después de una inyección intraneural durante un bloqueo interescalénico guiado por ecografía.
Desafortunadamente, los informes de inyección intraneural no nos informan sobre los sitios de inyección en relación con los fascículos. Distinguir el epineuro externo de un nervio periférico de los tejidos circundantes mediante imágenes de ultrasonido es un desafío.
Orebaugh realizó inyecciones de interescaleno simuladas (aunque con pequeños volúmenes) en un modelo de cadáver. Las imágenes por ultrasonido no pueden diferenciar los componentes neurales extrafasciculares e intrafasciculares en el rango de ubicaciones en las que se realiza la BNP. Además, una inyección adyacente al epineuro externo puede generar un halo similar en apariencia a una inyección intraneural, lo que dificulta distinguir la colocación peligrosa de la aguja de la no peligrosa. Es importante destacar que solo una pequeña cantidad de anestésico local (p. ej., 0.1 a 0.5 ml) es suficiente para romper el fascículo y su perineurio.
Consejos NYSORA
Confiar en la observación de la inflamación de los nervios en la ecografía durante los PNB como método de control es inadecuado para la detección de la inyección intrafascicular y la prevención de lesiones.
Los datos experimentales y clínicos más recientes sugieren que la PNI de la inyección de anestésico local en el nervio ocurre y sigue siendo un peligro clínico real. Las secuelas de una lesión de este tipo pueden ser duraderas y requerir una intervención quirúrgica.
PNB proximal versus distal y riesgo de lesión neurológica
Las inyecciones de BNP en sitios más proximales (es decir, raíces del plexo braquial frente a nervios periféricos del plexo braquial) (Figuras 9, 10 y 11) pueden tener un mayor riesgo de lesión nerviosa en comparación con los sitios distales de BNP. Esto probablemente se deba a las diferencias en la arquitectura neural, principalmente la proporción de tejido (conectivo) neural versus no neural (Figura 16 y XNUMX). Desde el punto de vista clínico, la inyección intraneural en el tejido conjuntivo extrafascicular dentro del epineuro puede no provocar lesión nerviosa. Esto es consistente con el trabajo experimental que ha correlacionado la inyección intrafascicular con la lesión por inyección del nervio periférico.
La organización estructural del nervio periférico proporciona información sobre el riesgo relativo de lesión mecánica entre diferentes nervios o incluso en diferentes ubicaciones dentro del mismo nervio.Figura 16 y XNUMX). Debido a que el epineuro es típicamente una capa más dura que el tejido adiposo circundante, los nervios tienden a ser "empujados" por una aguja que avanza, en lugar de penetrarlos.
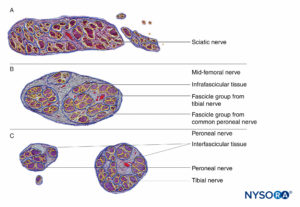
FIGURA 16. Sección transversal del nervio ciático en la región subglútea (A), la región femoral media (B) y los nervios tibial y peroneo en la región poplítea (C). (Reproducido con autorización de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
De manera similar, cuando una aguja penetra el epineuro, es mucho más probable que la punta de la aguja y la inyección entren en el tejido adiposo interfascicular que en los fascículos.Figura 15 y XNUMX). El tejido adiposo dentro del epineuro permite que los fascículos escapen del avance de la aguja; sin embargo, esta protección puede verse socavada por el avance brusco de la aguja o por el contacto forzado de la aguja con el nervio. Los nervios caracterizados por fascículos apretados y un alto contenido de tejido fascicular a tejido conjuntivo pueden tener un mayor riesgo de lesión nerviosa mecánica que aquellos caracterizados por un menor contenido de tejido fascicular a tejido conjuntivo.
Se informan incidencias relativamente altas de secuelas neurológicas transitorias después del bloqueo interescalénico, donde hay una proporción de 1:1 de tejido neural a no neural.Figura 12 y XNUMX). Varios estudios documentaron una incidencia bastante alta de síntomas neurológicos después del bloqueo del plexo braquial, pero sin secuelas graves. En otros estudios, hubo números absolutos bajos de complicaciones neurológicas relacionadas con el BNP de las extremidades superiores, lo que hace que cualquier comparación de los resultados en los sitios proximales con los sitios distales sea problemática.
Se han informado tasas de lesiones después de la BNP de las extremidades inferiores de 0.41 % (intervalo de confianza [IC] 95 %, 0.02–9.96) en la región glútea, en comparación con 0.24 % (IC 95 %, 0.10–0.61) en la región poplítea, lo que indica que no diferencia significativa. Es posible que muchos de los síntomas neurológicos informados por los pacientes después de la BNP sean inflamatorios y se deban al contacto de la aguja con el nervio o a la inyección forzada, lo que lleva a una inflamación intraneural que conduce a los síntomas, como lo demostró Steinfeldt. Por lo tanto, la sabiduría de la enseñanza de Selander de que “los nervios deben manejarse con cuidado” sigue siendo relevante.
Tipo de aguja
Las características de la punta de la aguja influyen en la probabilidad de penetración fascicular y lesión nerviosa. Las agujas de bisel largo tienen más probabilidades de perforar y entrar en el fascículo en comparación con las agujas de bisel corto; sin embargo, las agujas de bisel corto parecen causar más daño en caso de penetración fascicular (Figura 17 y XNUMX). La gravedad de la lesión nerviosa después de la perforación del nervio de la aguja también está relacionada con el diámetro de la aguja; sin embargo, no existe tal diferencia con respecto a la extensión de la inflamación después de un traumatismo del nervio de la aguja.
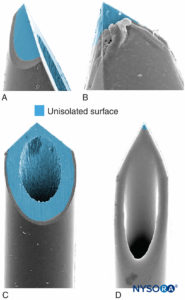
FIGURA 17. Se presenta neuroestimulación calibre 21, aguja periférica tipo A (A y B) y tipo D (C y D). Microscopía electrónica de barrido. (Reproducido con autorización de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
El efecto del diseño de la aguja sobre la probabilidad y la gravedad de la lesión nerviosa mecánica ha sido ampliamente debatido. No sorprende que el traumatismo mecánico con aguja y la inyección intraneural sean mecanismos clave en la lesión nerviosa iatrogénica, como ocurre con la anestesia regional. Por ejemplo, en el entorno de la anestesia neuroaxial, las lesiones durales producidas por diferentes tipos de agujas varían mucho en morfología; una aguja de Whitacre produce una apertura más traumática, con desgarro y ruptura severa de las fibras de colágeno, que una aguja de estilo Quincke. Del mismo modo, la probabilidad y el alcance de la lesión mecánica de los fascículos nerviosos después de la inyección intraneural durante la BNP también dependen del diseño de la punta de la aguja. Parece intuitivo que los tipos de agujas de bisel corto tienen menos probabilidades de penetrar las capas protectoras de tejido conjuntivo de los nervios periféricos (epineuro, perineuro). De hecho, Selander y sus colegas documentaron que una aguja con un bisel de 45° tiene muchas menos probabilidades de penetrar el perineuro e infligir una lesión fascicular que una aguja con un bisel de 15°. Sin embargo, si un fascículo nervioso queda atrapado accidentalmente durante un procedimiento de bloqueo nervioso, las lesiones inducidas por agujas de bisel corto pueden ser más graves y tardar más en repararse que las inducidas por agujas de bisel largo.
Factores quirúrgicos
Requisitos de posicionamiento quirúrgico
Pueden ocurrir complicaciones neurológicas después del posicionamiento para requisitos quirúrgicos. Los mecanismos de lesión nerviosa relacionados con la cirugía incluyen tracción, transección, compresión, contusión, isquemia y estiramiento. Independientemente del mecanismo, la vía final de la lesión nerviosa puede incluir los siguientes factores: alteración física de los vasos sanguíneos intraneurales que causa isquemia en parches o hemorragia; presiones venosas intraneurales elevadas; edema endoneural; alteración del flujo axoplásmico; daño de las células de Schwann; desplazamiento de mielina; degeneración axonal; y degeneración walleriana. Durante la cirugía, los pacientes se colocan en posiciones que de otro modo no tolerarían a menos que estén anestesiados. Además, las fuerzas físicas requeridas durante la cirugía (p. ej., colocación de prótesis) pueden ser excesivas, lo que podría estresar las estructuras anatómicas alejadas del sitio quirúrgico, incluida la columna vertebral.
En un análisis de reclamos cerrados, 9 de 53 lesiones del plexo braquial relacionadas con la anestesia se relacionaron con el posicionamiento intraoperatorio (aparatos ortopédicos para los hombros con la cabeza hacia abajo [tres reclamos], el brazo del paciente suspendido en una barra [dos reclamos] y otras malas posiciones [ cuatro afirmaciones]). Sólo dos reclamaciones estaban relacionadas con una técnica de anestesia regional.
Efectos del torniquete neumático
El inflado del torniquete causa daño a los nervios por deformación mecánica o isquemia. Las características principales de la neuropatía por torniquete incluyen debilidad o parálisis, disminución del sentido del tacto, la vibración y la posición, y sensación conservada de calor, frío y dolor. En un modelo experimental, la compresión con torniquete resultó en un aumento de la permeabilidad vascular, edema intraneural y degeneración del nervio ciático.
Por ejemplo, la compresión con torniquete durante la cirugía de meniscectomía puede provocar la denervación del nervio femoral y una recuperación funcional retrasada. Se han propuesto torniquetes más anchos, con presiones más bajas del manguito y limitando la duración del inflado como métodos para prevenir la neuropatía por torniquete.
Neuropatía inflamatoria posquirúrgica
Los pacientes con neuropatía inflamatoria posquirúrgica suelen presentar una neuropatía de inicio tardío y distante de la cirugía. Las neuropatías son focales y multifocales con dolor y debilidad. Un mecanismo inflamatorio-inmune es responsable, y hay evidencia de degeneración axonal e inflamación mediada por linfocitos.
Consejos NYSORA
No todos los episodios de PNI son de origen mecánico.
Factores del paciente
Neuropatía preexistente
Un déficit neurológico preoperatorio o compromiso neural, ya sea por atrapamiento de nervios o por razones metabólicas, isquémicas, tóxicas, hereditarias y de desmielinización, puede estar presente en pacientes que se presentan para cirugía. Muchas de estas condiciones neurológicas preexistentes son subclínicas, pero pueden estar asociadas con un mayor riesgo de PNI después de la operación. Por ejemplo, la espondilosis cervical, que a menudo se pasa por alto, pero que es común, puede provocar una apertura áspera e irregular del agujero intervertebral.
El complejo nervio espinal-raíz nerviosa se somete a traumatismos repetidos, lo que da como resultado una fibrosis que reduce su movilidad. En consecuencia, el complejo nervio espinal-raíz nerviosa tiene un mayor riesgo de lesión por tracción durante el movimiento y posicionamiento de las extremidades superiores. El nervio cubital puede quedar atrapado en el túnel cubital en el codo o en la muñeca. Los factores de riesgo para la neuropatía cubital perioperatoria incluyen sexo masculino, hábitos corporales extremos y hospitalización prolongada.
Las neuropatías diabéticas son frecuentes y representan una amplia gama de entidades clínicas que suelen dar lugar a una polineuropatía sensitiva simétrica distal. Las neuropatías diabéticas asimétricas comprenden neuropatía motora proximal aguda o subaguda (a menudo dolorosa), neuropatía craneal, neuropatía troncal o toracoabdominal (a menudo dolorosa) y neuropatía por atrapamiento en las extremidades. La radiculopatía lumbar diabética puede presentarse con dolor que se irradia desde la espalda a las extremidades inferiores y debilidad leve.
Puede haber neuropatía difusa con electromiografía anormal de los músculos paraespinales y los músculos inervados por los nervios del plexo sacro, glúteo, femoral y ciático. Los pacientes ancianos con diabetes pueden tener compromiso proximal y distal combinados, lo que los coloca en mayor riesgo de PNI. Las fibras nerviosas diabéticas pueden ser más susceptibles a los efectos tóxicos de los anestésicos locales debido a la hipoxia isquémica crónica y porque los nervios están expuestos a mayores concentraciones de anestésicos locales relacionadas con la disminución del flujo sanguíneo. Se ha informado que la aparición de PNI después del bloqueo neuroaxial en pacientes con neuropatía diabética es mayor (0.4 %; IC 95 %, 0.1–1.3 %) que en la población general; sin embargo, su verdadera relevancia clínica es controvertida ya que muchos de estos pacientes se encuentran entre los mayores beneficiarios de los BNP.
De manera similar, se desconoce el riesgo real de BNP en el contexto de enfermedad vascular periférica grave, vasculitis, tabaquismo e hipertensión. Independientemente, los pacientes con estas condiciones podrían ser más vulnerables a más lesiones isquémicas durante el período perioperatorio, de manera similar a los pacientes con neuropatías inducidas por alcohol y cisplatino. Los pacientes con esclerosis múltiple y neuropatía hereditaria pueden tener compromiso neural preoperatorio subclínico dentro del sistema nervioso periférico.
Estenosis del canal espinal lumbar
La estenosis del canal espinal lumbar puede exagerar una lesión periférica y afectar negativamente la recuperación física. La estenosis del canal espinal es un factor de riesgo para la parálisis peronea común después de la ATC y puede ser significativa en casos de paraplejía o síndrome de cauda equina después de la anestesia epidural. Hebl documentó déficits neurológicos nuevos o progresivos después de la anestesia neuroaxial en pacientes con estenosis preexistente del canal espinal o enfermedad del disco lumbar. En total, 10 (1.1 %, IC del 95 %: 0.5 %–2.0 %) pacientes desarrollaron nuevos déficits o empeoramiento de los síntomas preexistentes. La frecuencia de complicaciones fue mayor en los pacientes que tenían radiculopatía compresiva o múltiples diagnósticos neuroaxiales centrales. Sin embargo, es probable que haya múltiples factores etiológicos porque los déficits a menudo se correlacionan con el lado de la patología preexistente o el procedimiento quirúrgico. Un resumen de los factores anatómicos, anestésicos, quirúrgicos y del paciente que contribuyen a la PNI se incluye en Tabla 3.
TABLA 3. Resumen de los factores anatómicos, anestésicos, quirúrgicos y del paciente que contribuyen a la lesión nerviosa perioperatoria.
| Factor que potencialmente contribuye o es relevante para el PNI | Comentario | |
|---|---|---|
| Anatómico | Morfología interna del nervio, incluido el tejido conjuntivo que soporta fascículos y axones1,63 | El tejido epineural puede ofrecer protección contra traumatismos directos y compresión externa. |
| Factores anatómicos generales: ubicación, trayecto, relaciones, inserciones y movilidad relativa de los nervios1 | - | |
| Estructuras específicas están en riesgo | Ejemplos: nervio cubital en el codo,76,99 CPN 81,100,101 | |
| Anestésico | tipo de anestesia | EA y GA pero no PNB se asociaron con PNI.47 PNB no asociado con PNI después de ATR,48 Eso,49 o TSA.50 |
| Extremidad insensata | Pone los nervios en riesgo de compresión o estiramiento.76 | |
| Sitio de BNP: proximal con mayor riesgo versus BNP distal | No respaldado por evidencia clínica | |
| Nivel de sedación durante el bloqueo nervioso | Sigue siendo controvertido. Sin embargo, con el control objetivo de la relación entre la aguja y el nervio y la disposición del inyectado (EE. UU., estimulación nerviosa, control de la presión de apertura de la inyección), es probable que este problema desaparezca. Para conocer la última recomendación publicada, consulte el Asesoramiento práctico de ASRA | |
| Traumatismo mecánico por aguja, catéter o inyectado | - | |
| Toxicidad del anestésico local directo | Dependiente del tiempo y la concentración; riesgo con exposición intrafascicular mayor que extrafascicular6,15 | |
| isquemia neural | Secundario a la compresión,76 vasoconstrictores,19,20 inyección intrafascicular,54 torniquete82,103 | |
| Quirúrgica | Trauma: contusión, compresión, retracción, tracción, transección | |
| Posicionamiento perioperatorio76 | ||
| Torniquete: duración del inflado y presión81,104 Hinchazón, yeso Los procedimientos específicos tienen un perfil de riesgo único95 | Asociado con déficits clínicos marcados80 y cambios patológicos en EMG84 Los riesgos de PNI después de TKA,48 THA,49 y TSA50 fueron 0.79%, 0.72% y 2.2%, respectivamente |
|
| Pacientes | El compromiso neural preoperatorio teóricamente aumenta el riesgo de PNI | La etiología incluye causas de atrapamiento, metabólicas, isquémicas, tóxicas,93 hereditarias y de desmielinización.94 |
| Estenosis del canal lumbar | Puede ser un factor de riesgo significativo después del bloqueo neuroaxial96,98 | |
| Otro | mecanismo inflamatorio | Causa no mecánica alejada física y temporalmente del PNB43 |
MONITOREO DE LA DISTANCIA AGUJA-NERVIO DURANTE EL PNBS Y PREVENCIÓN DE COMPLICACIONES
Aunque recientemente se cuestionó el riesgo de contacto entre la aguja y el nervio, la colocación de la aguja intraneural y la inyección intraneural en series clínicas pequeñas en las que no se produjeron lesiones evidentes, se siguen notificando lesiones nerviosas relacionadas con el BNP. El equipo de Susan MacKinnon recientemente advirtió severamente contra la inyección intraneural intencional en base a sus resultados de neurotoxicidad luego de inyecciones intrafasciculares de anestésicos locales.
Esta publicación en una de las principales revistas de la especialidad (Anesthesia and Analgesia) advirtió específicamente contra las recomendaciones recientes de algunos proveedores de que la inyección intraneural no presenta riesgos y, de hecho, puede ser beneficiosa para la calidad del bloque.
Es importante señalar que la advertencia del equipo de MacKinnon proviene de décadas de práctica clínica de cirugía de reparación de nervios periféricos y más de 350 publicaciones científicas sobre el tema. Aunque la incidencia de lesiones nerviosas relacionadas con el BNP es relativamente poco común, se encuentran entre las complicaciones incapacitantes más comunes relacionadas con la administración de anestesia y es probable que no se notifiquen en la literatura debido a implicaciones médicas legales y relacionadas con la reputación institucional. El impacto potencialmente devastador de una lesión nerviosa grave en la calidad de vida del paciente exige un enfoque sistemático para mitigar el riesgo mediante la estandarización de las técnicas de inyección.
Provocación mecánica de parestesias
La asociación entre la provocación mecánica de parestesias y la consiguiente PNI ha sido objeto de debate durante mucho tiempo. Si bien algunos ensayos de observación grandes han implicado la provocación de parestesias como un factor de riesgo para PNI, tal asociación no ha sido respaldada por otros. Además, la aparición de parestesias no es un signo sensible del contacto entre la aguja y el nervio, ya que solo el 38 % de los pacientes experimentaron parestesias durante la visualización en tiempo real del contacto entre la aguja y el nervio.
Por lo tanto, la ausencia de parestesias durante la realización de un bloqueo nervioso no excluye de manera confiable el contacto entre la aguja y el nervio, y se han informado lesiones nerviosas tanto en pacientes que experimentaron parestesias graves como en aquellos que no experimentaron parestesias durante el procedimiento de BNP. Independientemente, una parestesia severa o dolor al avanzar la aguja o la inyección, puede indicar la colocación de la aguja intraneural y, cuando está presente, debe provocar el cese de la inyección y el reposicionamiento de la aguja.
No se ha estudiado si y cómo el uso de la sedación profunda influye en la percepción e interpretación de la parestesia como síntoma por parte de los pacientes. Del mismo modo, los PNB guiados por ultrasonido a menudo involucraron múltiples inyecciones de alícuotas de anestésico local en varias áreas anatómicas diferentes. No se sabe cómo la difusión del anestésico local durante las técnicas de inyecciones múltiples y el bloqueo sensorial incipiente que ocurre durante el procedimiento pueden tener un impacto en el valor de la parestesia como monitor de seguridad.
Estimulación de los Nervios Periféricos
La respuesta motora a la estimulación de los nervios periféricos se basa en la ley de Coulomb, según la cual se requiere una intensidad de corriente menor (mA; o, más correctamente, energía eléctrica) para provocar una respuesta motora o sensorial cuando la punta de la aguja se acerca al nervio.
Voelckel et al. informaron por primera vez sobre la importancia de evitar la inyección cuando la respuesta motora se obtiene con una intensidad de corriente muy baja (<0.2 mA) y el riesgo de lesión nerviosa. Se produjo lesión nerviosa histológica en el 50 % de los cerdos cuando la respuesta motora se obtuvo a menos de 0.2 mA, en comparación con ningún cambio histológico a 0.3–0.5 mA. Se ha demostrado que la presencia de una respuesta motora a menos de 0.2 mA es un indicador específico pero no sensible de la colocación de agujas intraneurales tanto en animales como en humanos.
La estimulación de los nervios periféricos como técnica de localización de nervios se caracteriza por una sensibilidad relativamente baja pero una alta especificidad para predecir la proximidad relativa entre la aguja y el nervio, lo que sugiere que tal respuesta en realidad refleja la distancia entre la aguja y el axón. Tanto los datos experimentales como los informes clínicos han demostrado que una respuesta motora provocada puede no ser provocada de forma fiable cuando la aguja se coloca en la vecindad inmediata del nervio o incluso intraneuralmente. Sin embargo, la misma investigación indicó que cuando se provoca una respuesta motora a una intensidad de corriente baja (p. ej., < 0.5 mA, 0.1 ms), la punta de la aguja se coloca invariablemente sobre el nervio o dentro del nervio. Es importante destacar que la estimulación de los nervios periféricos ha resistido la prueba del tiempo, como lo demuestran los conjuntos de datos publicados más grandes relacionados con la PNI, todos los cuales se basaron principalmente en la estimulación de los nervios periféricos para lograr una PNB segura y exitosa.
Supervisión de la presión de inyección de apertura
La asociación entre altas presiones de inyección e inyección intrafascicular fue descrita por primera vez en 1979 por Selander y posteriormente estudiada en varios modelos animales. En un modelo de perro, una inyección intrafascicular intencional se asoció con una presión de inyección de apertura alta (≥25 psi) y la lesión nerviosa clínica e histológica correspondiente. Por el contrario, las inyecciones extrafasciculares no se asociaron con presiones de inyección altas ni con lesiones nerviosas. En otro estudio en un modelo canino, la presión de inyección alta (≥20 psi) también se asoció con la inyección intrafascicular, así como con lesiones nerviosas clínicas e histológicas, mientras que la inyección intraneural pero interfascicular se asoció con una presión de inyección baja (<10 psi) y ausencia de alteraciones neurológicas. o consecuencias histológicas. Durante la inyección intraneural en los nervios medianos de los cerdos, Lupu y sus colegas no pudieron detectar una correlación significativa entre la presión máxima generada y la lesión nerviosa clínica o histológica. En este estudio, las presiones máximas de inyección estaban muy por debajo de 25 psi, pero 7 de 10 muestras de nervios tenían evidencia de daño axonal en el examen histológico. En un caso, se produjo daño axonal después de una presión de inyección máxima de solo 2.2 psi. Es importante destacar que los déficits funcionales medidos hasta 7 días después del insulto estuvieron ausentes en los 10 cerdos estudiados. Más recientemente, en el primer estudio de este tipo en tejido humano, Orebaugh y sus colegas informaron que el 100 % de las inyecciones directamente en las raíces del plexo braquial de cadáveres humanos frescos dieron como resultado presiones de inyección altas (>30 psi), con una ocurrencia de propagación del inyectado. en el espacio epidural. Es importante destacar que el análisis de las curvas de presión de inyección alcanzadas indicó que todas las inyecciones en las raíces del plexo braquial se asociaron con presiones superiores a 15 psi.
Krol et al informaron datos similares sobre la relación entre la presión de inyección y el nervio en los nervios periféricos. En un estudio sobre el control de la presión durante las inyecciones de BNP de los nervios mediano, radial y cubital en cadáveres humanos frescos, los autores informaron diferencias significativas entre las presiones de inyección intraneural y perineural. Las presiones de inyección intraneural mostraron baja especificidad pero alta sensibilidad con la colocación de la aguja intraneural.
Varios estudios han utilizado la presión de inyección como herramienta de control para la inyección intraneural (intraepineural) durante el bloqueo del nervio ciático sin complicaciones. Robards y sus colegas estudiaron a 24 pacientes, cada uno de los cuales recibió una inyección dentro del nervio ciático al nivel de la fosa poplítea. Se registraron presiones de inyección inferiores a 20 psi en 20 pacientes, mientras que en los 20 pacientes restantes se observaron presiones de inyección superiores a 4 psi, lo que provocó el cese de la inyección; ninguno de los pacientes sufrió ninguna disfunción neurológica, lo que sugiere que las inyecciones que ocurrieron intraneuralmente fueron extrafasciculares.
En un estudio de los umbrales de estimulación intraneural durante bloqueos supraclaviculares del plexo braquial guiados por ultrasonido, Bigeleisen y sus colegas informaron que una combinación de alta resistencia a la inyección, estimulación de baja corriente y dolor durante la inyección coincidió en dos pacientes con una colocación de aguja intraneural que requirió reposicionar la aguja antes. completando la inyección sin complicaciones.
Más allá del riesgo de lesión neurológica, las altas presiones de inyección pueden provocar otros efectos no deseados o complicaciones graves. Por ejemplo, Gadsden y sus colegas informaron que la presión de inyección alta durante el bloqueo del plexo lumbar conlleva un riesgo de diseminación epidural (Figuras 18 y 19). En este estudio, las presiones de inyección superiores a 20 psi durante el bloqueo del plexo lumbar condujeron a un riesgo inaceptable de bloqueo epidural de alto nivel, en algunos pacientes hasta el nivel T3, lo que requirió la terminación anticipada del estudio por razones de seguridad.
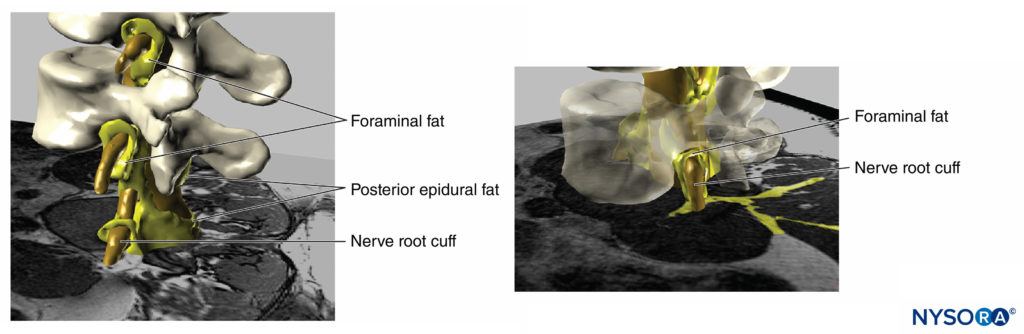
FIGURA 18. Reconstrucción tridimensional de imagen de resonancia magnética de vértebras, saco dural, grasa epidural y tejido adiposo foraminal. Las áreas pintadas de amarillo representan interconexiones entre los tejidos adiposos que pueden servir como rutas potenciales para la propagación de soluciones inyectadas. (Usado con permiso de MA Reina.)
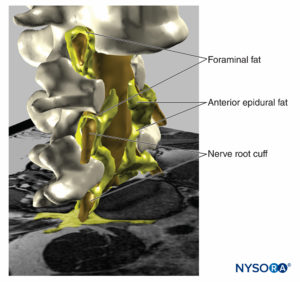
FIGURA 19. Reconstrucción tridimensional de vértebras, saco dural, grasa epidural y grasa foraminal a partir de imágenes de resonancia magnética de un paciente. Podemos ver el camino potencial a través de la grasa desde la grasa epidural, la grasa foraminal, a otros compartimentos de grasa, ya que la grasa envuelve las raíces nerviosas fuera del canal foraminal de la columna vertebral o la grasa que se encuentra entre las fascias musculares. Se extrajeron dos cuerpos vertebrales, lo que permitió visualizar la grasa epidural en el espacio epidural anterior. (Usado con permiso de MA Reina.)
Más recientemente, Gautier et al informaron que la alta presión de inyección durante la inyección interescalénica puede conducir a una propagación epidural sustancial del inyectado. El informe de Gautier ofreció una explicación para la muerte respiratoria y cardiovascular precipitada que ocasionalmente se informó inmediatamente después del bloqueo interescalar, y también sugirió que la fuerza/presión de inyección se debe controlar durante el proceso de inyección. La evaluación de la presión de inyección (resistencia) durante la PNB es de creciente interés para médicos e investigadores. Esto no es sorprendente, dado que la inyección en fascículos nerviosos densamente empaquetados requiere más fuerza para iniciar una inyección (presión de apertura) que las inyecciones perineurales o intraneuronales-interfasciculares en el tejido conjuntivo perineural o perifascicular laxo (Figuras 12, 14y 15).
En un intento por estandarizar el seguimiento y la documentación de los procedimientos de bloqueo nervioso, un grupo de expertos norteamericanos sugirió documentar la resistencia a la inyección como uno de los elementos de la nota clínica estándar. Sin embargo, dos grupos independientes encontraron que la precisión del médico para medir la presión de inyección o el tejido que se inyecta es limitada cuando se usa una técnica subjetiva de sensación de jeringa, lo que cuestiona la confiabilidad de las evaluaciones subjetivas. Mientras tanto, se han recomendado varios medios para monitorear las presiones de inyección.
En conjunto, los datos hasta la fecha sugieren que una presión de inyección de apertura alta puede detectar una inyección intrafascicular, pero no una inyección interfascicular intraneural. En el primer estudio en pacientes, Gadsden y sus colegas demostraron que la presión de inyección de apertura con la punta de la aguja a 1 mm de distancia de las raíces nerviosas del plexo braquial interescalénico fue consistentemente inferior a 15 psi (presión máxima media de 8.2 ± 2.4 psi). Por el contrario, la presión de apertura de la inyección durante el contacto entre la aguja y el nervio fue de 15 psi o más (presión máxima media de 20.9 ± 3.7 psi) en 35 de 36 inyecciones. En este estudio, abortar la inyección cuando la presión de inyección de apertura alcanzó los 15 psi impidió de manera confiable el comienzo de la inyección en el 97 % de los casos de contactos entre la aguja y el nervio. Además, la inyección de apertura alta puede correlacionarse bien con otros índices de contacto entre la aguja y el nervio, como estimulación de baja corriente y parestesia en la inyección.
En un estudio de seguimiento, Gadsden et al utilizaron una metodología similar para determinar si una presión de apertura alta también puede detectar el contacto entre la aguja y el nervio en los nervios periféricos, como el nervio femoral. Los investigadores informaron que la alta presión de inyección de apertura detectó consistentemente (97 %) el contacto entre la aguja y el nervio y evitó una inyección contra el nervio femoral o los fascículos. Además, su investigación sugirió que la presión de inyección de apertura alta puede detectar la inserción de la aguja en un plano de tejido incorrecto. En este informe, la imposibilidad de inyectar anestésico local con una presión de inyección de apertura inferior a 15 psi detectó el 100 % de los casos de colocación de la aguja en el aspecto incorrecto de la fascia ilíaca.
Se necesita más investigación para determinar los beneficios clínicos de la monitorización de la presión de inyección de rutina y los valores de presión de inyección de apertura "seguros" reales para varios procedimientos de bloqueo nervioso. Independientemente, existen datos suficientes para sugerir que el control de la presión de inyección de apertura durante los bloqueos de los nervios interescalénico y femoral agrega información de seguridad crítica adicional que puede influir en la toma de decisiones clínicas. La monitorización de la presión de inyección puede resultar más útil por su valor predictivo negativo para la lesión del nervio funcional, ya que no se han informado casos de neuropatía clínicamente significativa en la literatura con presiones de inyección bajas. Según los datos disponibles, evitar la alta resistencia y la presión de inyección de apertura superior a 15 psi parece ser una estrategia prudente. Como mínimo, esto se debe a que durante las inyecciones de bloqueo nervioso, las inyecciones en el tejido conectivo perineural laxo nunca deberían requerir más de 15 psi; por lo tanto, cuando se alcanza una presión de apertura de 15 psi antes de que realmente ocurra la inyección, el operador tiene la oportunidad de reposicionar la aguja lejos del nervio antes de inyectar posiblemente en el espacio de tejido incorrecto o en partes vulnerables del nervio (fascículos, contacto entre la aguja y el nervio) .
Impedancia eléctrica
El monitoreo de la impedancia eléctrica mide la resistencia al flujo de una corriente alterna en un circuito eléctrico y podría agregarse a los estimuladores nerviosos existentes. La impedancia eléctrica es sensible a los cambios en la composición de los tejidos, en particular el contenido de agua. En un modelo de nervio ciático de cerdo, Tsui y sus colegas demostraron que los nervios tienen una mayor impedancia eléctrica que el músculo circundante y el líquido intersticial debido a su bajo contenido de agua y alto contenido de lípidos. Descubrieron que la impedancia eléctrica aumentaba abruptamente al entrar en el compartimento intraneural en relación con el compartimento extraneural. No se pudo determinar el valor absoluto al que se produjo la colocación de la aguja intraneural debido a la variación sustancial de los datos.
Si bien la monitorización de la impedancia eléctrica parece prometedora para detectar la colocación de la punta de la aguja intraneural, necesariamente implica que la punción del nervio debe ocurrir antes de que se detecte un cambio en la impedancia. También hay pruebas razonablemente sólidas de que la medición de la impedancia eléctrica puede diferenciar la colocación intravascular de la perineural de una aguja cuando se inyecta dextrosa al 5% en agua antes de realizar el bloqueo. Según los datos actualmente disponibles, la monitorización de la impedancia puede diferenciar entre determinados tejidos, como el músculo y el tejido adiposo/conectivo. Sin embargo, la variabilidad de las mediciones de impedancia entre diferentes nervios o incluso los mismos nervios en diferentes ubicaciones requiere más investigación antes de que se puedan hacer recomendaciones sobre la posible aplicabilidad clínica de esta modalidad.
Ultrasonido
Aunque el ultrasonido puede detectar la inyección intraneural, el uso generalizado de la guía por ultrasonido no ha disminuido la tasa de PNI. En animales, el ultrasonido es lo suficientemente sensible para detectar tan solo 1 mL de inyectado; sin embargo, una cantidad mucho menor de inyectado es suficiente para lesionar los fascículos.
Independientemente, ningún estudio en animales o humanos hasta la fecha ha demostrado definitivamente una asociación entre la visualización ecográfica en tiempo real de la inyección intraneural de anestésico local y la consiguiente lesión nerviosa funcional (o clínicamente importante). Una razón puede ser que la resolución de las máquinas de ultrasonido actuales producidas no es lo suficientemente alta como para diferenciar la inyección intrafascicular potencialmente peligrosa de la inyección en el compartimento extrafascicular potencialmente más indulgente.
Además, la capacidad de interpretar dichas imágenes depende en gran medida del usuario, y la capacidad de obtener imágenes de alta definición y calidad varía entre los pacientes. El uso de la guía por ultrasonido ha facilitado sustancialmente la enseñanza y popularizado la utilización de BNP al mismo tiempo que disminuye la incidencia de toxicidad sistémica de los anestésicos locales. Sin embargo, en los estudios realizados hasta la fecha, la ecografía no ha disminuido la incidencia de PNI. Se cubre más información sobre ultrasonido y monitoreo en Monitoreo, Documentación y Consentimiento para Procedimientos de Anestesia Regional.
Consejos NYSORA
Los principales mecanismos de lesión mediada por BNP incluyen trauma mecánico, isquemia, toxicidad por anestésicos locales e inflamación. La principal fuente de complicaciones neurológicas mediadas por BNP es probablemente la lesión fascicular mecánica o la inyección de anestésico local en un fascículo, lo que provoca la degeneración axonal y de la mielina.
RESUMEN
Las complicaciones neurológicas asociadas con el BNP son multifactoriales y están asociadas con una variedad de procesos perioperatorios y factores del paciente, anestésicos y quirúrgicos. La anatomía de los nervios periféricos es variable en ubicación, estructura y susceptibilidad a las lesiones. Los principales mecanismos de lesión mediada por BNP incluyen trauma mecánico, isquemia, toxicidad por anestésicos locales e inflamación. La principal fuente de complicaciones neurológicas mediadas por BNP es probablemente la lesión fascicular mecánica o la inyección de anestésico local en un fascículo, lo que provoca la degeneración axonal y de la mielina. Las incidencias informadas de complicaciones neurológicas después de la BNP varían significativamente, y la interpretación de la literatura es difícil debido a las diversas metodologías de estudio, incluidas las diferencias en los resultados neurológicos capturados. Afortunadamente, la mayoría de los déficits neurológicos posoperatorios parecen resolverse con el tiempo, y la incidencia de complicaciones neurológicas graves a largo plazo atribuibles a la BNP es relativamente poco común.
Evitar el traumatismo deliberado de los nervios, incluida la inyección intraneural, es un principio clave de seguridad de la anestesia regional. En este momento, existe evidencia de que el control objetivo de la colocación de la aguja y la inyección, como ultrasonido, estimulación nerviosa y presión de apertura de la inyección, puede ayudar a detectar el contacto entre la aguja y el nervio y la colocación de la aguja intraneural. Aunque, al igual que con muchos otros monitores en la práctica clínica (p. ej., oximetría de pulso), no hay evidencia de que estos monitores puedan reducir la incidencia de complicaciones neurológicas, hay datos que sugieren que su combinación debería conferir seguridad adicional durante las PNB. La selección cuidadosa de los pacientes, el uso combinado de más de una técnica o monitor de localización de nervios, evitar la inyección con presión de inyección de apertura y limitar el número de pases de aguja e inyecciones donde sea apropiado disminuirá aún más el riesgo y hará que la práctica de BNP sea menos un arte que una ciencia.
Referencias
- Sunderland S: Lesiones nerviosas y su reparación: una evaluación crítica. Churchill Livingstone, 1991.
- Boezaart AP: Lo que llamamos rosa con cualquier otro nombre olería igual de dulce, y sus espinas dolerían tanto. Reg Anesth Pain Med 2009;34:3–7.
- Seddon HJ: una clasificación de las lesiones nerviosas. Br Med J 1942;2: 237–239.
- Sunderland S: una clasificación de las lesiones de los nervios periféricos que producen pérdida de función. Cerebro 1951; 74: 491–516.
- Brull R, McCartney CJ, Chan VW, El-Beheiry H: Complicaciones neurológicas después de la anestesia regional: estimaciones contemporáneas del riesgo. Anesth Analg 2007;104:965–974.
- Hogan QH: Fisiopatología de la lesión del nervio periférico durante la anestesia regional. Reg Anesth Pain Med 2008;33:435–441.
- Burnett MG, Zager EL: Fisiopatología de la lesión del nervio periférico: una breve revisión. Neurocirugía Focus 2004;16:E1.
- Steinfeldt T, Poeschl S, Nimphius W, et al: avance forzado de la aguja durante el contacto entre la aguja y el nervio en un modelo porcino: resultado histológico. Anesth Analg 2011;113:417–420.
- Kerns JM: La microestructura de los nervios periféricos. Techn Reg Anesth Pain Manag 2008;12:127–133.
- Gentili F, Hudson AR, Kline D, Hunter D: Cambios tempranos después de la lesión por inyección de los nervios periféricos. Can J Surg 1980;23:177–182.
- Whitlock EL, Brenner MJ, Fox IK, Moradzadeh A, Hunter DA, Mackinnon SE: Lesión por inyección de nervio periférico inducida por ropivacaína en el modelo de roedores. Anesth Analg 2010;111:214–220.
- Mackinnon SE, Hudson AR, Gentili F, Kline DG, Hunter D: lesión por inyección de nervio periférico con agentes esteroides. Plast Reconstr Surg 1982; 69:482–490.
- Gentili F, Hudson AR, Hunter D: Aspectos clínicos y experimentales de las lesiones por inyección de los nervios periféricos. Can J Neurol Sci 1980;7:143–151.
- Sala-Blanch X, Ribalta T, Rivas E, et al: Lesión estructural del nervio ciático humano después de la inserción de una aguja intraneural. Reg Anesth Pain Med 2009;34:201–205.
- Gentili F, Hudson A, Kline DG, Hunter D: Lesión por inyección de nervio periférico: un estudio experimental. Neurocirugía 1979;4:244–253.
- Hadzic A, Dilberovic F, Shah S, et al: La combinación de inyección intraneural y alta presión de inyección conduce a lesiones fasciculares y déficits neurológicos en perros. Reg Anesth Pain Med 2004;29:417–423.
- Selander D, Edshage S, Wolff T: ¿Paresthesiae o no paresthesiae? Lesiones nerviosas tras bloqueos axilares. Acta Anaesthesiol Scand 1979;23:27–33.
- Selander D, Sjostrand J: Propagación longitudinal de anestésicos locales inyectados intraneuralmente. Un estudio experimental de la distribución neural inicial después de inyecciones intraneurales. Acta Anaesthesiol Scand 1978;22: 622–634.
- Myers RR, Heckman HM: Efectos de la anestesia local sobre el flujo sanguíneo nervioso: estudios que utilizan lidocaína con y sin epinefrina. Anestesiología 1989;71:757–762.
- Partridge BL: Los efectos de los anestésicos locales y la epinefrina en el flujo sanguíneo del nervio ciático de rata. Anestesiología 1991;75:243–250.
- Rodriguez J, Taboada M, Garcia F, Bermudez M, Amor M, Alvarez J: Hematoma intraneural tras bloqueo femoral guiado por neuroestimulación en paciente con deficiencia de factor XI: reporte de caso. J Clin Anesth 2011;23:
234-237. - Ben-David B, Stahl S: Bloqueo axilar complicado por hematoma y lesión del nervio radial. Reg Anesth Pain Med 1999;24:264–266.
- Mackinnon SE, Hudson AR, Llamas F, Dellon AL, Kline DG, Hunter DA: lesión del nervio periférico por inyección de quimopapaína. J Neurosurg 1984;61:1–8.
- Topuz K, Kutlay M, Simsek H, Atabey C, Demircan M, Senol Guney M: Protocolo de tratamiento quirúrgico temprano para la lesión del nervio ciático debido a la inyección: un estudio retrospectivo. Br J Neurosurg 2011;25:509–515.
- Amaniti E, Drampa F, Kouzi-Koliakos K, et al: miotoxicidad de la ropivacaína después de una inyección intramuscular única en ratas. Eur J Anaesthesiol 2006;23: 130–135.
- Beyzadeoglu T, Torun Kose G, Ekinci ID, Bekler H, Yilmaz C: Citotoxicidad de los anestésicos locales en el cartílago articular de ratas: un estudio experimental. Acta Orthop Traumatol Turc 2012;46:201–207.
- Cereda CM, Tofoli GR, Maturana LG, et al: Evaluación de la neurotoxicidad local y la miotoxicidad de los complejos de ciclodextrina de bupivacaína y ropivacaína. Anesth Analg 2012;115:1234–1241.
- Dragoo JL, Braun HJ, Kim HJ, Phan HD, Golish SR: La condrotoxicidad in vitro de los anestésicos locales de dosis única. Am J Sports Med 2012;40:794–799.
- Mishra P, Stringer MD: Lesión del nervio ciático por inyección intramuscular: un problema persistente y global. Int J Clin Pract 2010;64:1573–1579.
- Nouette-Gaulain K, Dadure C, Morau D, et al: Toxicidad muscular inducida por bupivacaína dependiente de la edad durante el bloqueo nervioso periférico continuo en ratas. Anestesiología 2009;111:1120–1127.
- Padera R, Bellas E, Tse JY, Hao D, Kohane DS: miotoxicidad local por liberación sostenida de bupivacaína a partir de micropartículas. Anestesiología 2008;108:921–928.
- Small SP: Prevención de la lesión del nervio ciático por inyecciones intramusculares: revisión de la literatura. J Adv Nurs 2004;47:287–296.
- Zink W, Sinner B, Zausig Y, Graf BM: [Miotoxicidad de los anestésicos locales: ¿mito experimental o verdad clínica?]. Anestesista 2007;56:118–127.
- Pérez-Castro R, Patel S, Garavito-Aguilar ZV et al: Citotoxicidad de los anestésicos locales en células neuronales humanas. Anesth Analg 2009;108:997–1007.
- Radwan IA, Saito S, Goto F: La neurotoxicidad de los anestésicos locales en las neuronas en crecimiento: un estudio comparativo de lidocaína, bupivacaína, mepivacaína y ropivacaína. Anesth Analg 2002;94:319–324, índice.
- Farber SJ, Saheb-Al-Zamani M, Zieske L, et al: lesión del nervio periférico después de la inyección de anestésico local. Anesth Analg 2013;117:731–739.
- Lirk P, Haller I, Myers RR, et al: Mitigación de los efectos neurotóxicos directos de la lidocaína y la amitriptilina mediante la inhibición de la proteína quinasa activada por mitógeno p38 in vitro e in vivo. Anestesiología 2006;104:1266–1273.
- Yang S, Abrahams MS, Hurn PD, Grafe MR, Kirsch JR: La toxicidad de las células de Schwann del anestésico local depende del tiempo y la concentración. Reg Anesth Pain Med 2011;36:444–451.
- Kalichman MW: Mecanismos fisiológicos por los cuales los anestésicos locales pueden causar lesiones en los nervios y la médula espinal. Reg Anesth 1993; 18:448–452.
- Gentili F, Hudson AR, Hunter D, Kline DG: Lesión por inyección nerviosa con agentes anestésicos locales: un estudio con microscopia óptica y electrónica, microscopia fluorescente y peroxidasa de rábano picante. Neurocirugía 1980;6:263–272.
- Farber SJ, Saheb-Al-Zamani M, Zieske L, et al: lesión del nervio periférico después de la inyección de anestésico local. Anesth Analg 2013;117:731–739.
- Ahn KS, Kopp SL, Watson JC, Scott KP, Trousdale RT, Hebl JR: neuropatía inflamatoria posquirúrgica. Reg Anesth Pain Med 2011;36: 403–405.
- Staff NP, Engelstad J, Klein CJ, et al: Neuropatía inflamatoria posquirúrgica. Cerebro 2010;133:2866–2880.
- Kaufman MR, Elkwood AI, Rose MI, et al: Tratamiento quirúrgico de la parálisis diafragmática permanente después del bloqueo del nervio interescalénico para cirugía de hombro. Anestesiología 2013;119:484–487.
- Pintaric TS, Cvetko E, Strbenc M, Mis K, Podpecan O, Mars T, Hadzic A. Cambios inflamatorios intraneurales y perineurales en lechones después de la inyección de gel de ultrasonido, endotoxina, NaCl al 0.9% o inserción de aguja sin inyección. Anesth Analg 2014;118(4):869–873.
- Pintaric TS, Hadzic A, Strbenc M, Podpecan O, Podbregar M, Cvetko E. Respuesta inflamatoria después de la inyección de gel acuoso en el espacio subaracnoideo en lechones. Reg Anesth Pain Med 2013;38(2):100–105.
- Welch MB, Brummett CM, Welch TD, et al: Lesiones perioperatorias de los nervios periféricos: un estudio retrospectivo de 380,680 10 casos durante un período de 2009 años en una sola institución. Anestesiología 111;490:497–XNUMX.
- Jacob AK, Mantilla CB, Sviggum HP, Schroeder DR, Pagnano MW,
Hebl JR: lesión nerviosa perioperatoria después de la artroplastia total de rodilla: riesgo de anestesia regional durante un estudio de cohorte de 20 años. Anestesiología 2011;114: 311–317. - Jacob AK, Mantilla CB, Sviggum HP, Schroeder DR, Pagnano MW,
Hebl JR: lesión nerviosa perioperatoria después de una artroplastia total de cadera: riesgo de anestesia regional durante un estudio de cohorte de 20 años. Anestesiología 2011;115: 1172–1178. - Sviggum HP, Jacob AK, Mantilla CB, Schroeder DR, Sperling JW,
Hebl JR: lesión nerviosa perioperatoria después de la artroplastia total de hombro: evaluación del riesgo después de la anestesia regional. Reg Anesth Pain Med 2012;37:490–494. - Lenters TR, Davies J, Matsen FA 3.º: Los tipos y la gravedad de las complicaciones asociadas con la anestesia por bloqueo del plexo braquial interescalénico: evidencia local y nacional. J Hombro Codo Surg 2007;
16: 379-387. - Widmer B, Lustig S, Scholes CJ, et al: Incidencia y gravedad de las complicaciones debidas a bloqueos del nervio femoral realizados para cirugía de rodilla. Rodilla 2013;20:181–185.
- Hogan QH: Revisión de la función del nervio frénico después del bloqueo interescalénico: ahora, la perspectiva a largo plazo. Anestesiología 2013;119:250–252.
- Gadsden J, Gratenstein K, Hadzic A: Inyección intraneural y lesión del nervio periférico. Int Anesthesiol Clin 2010;48:107–115.
- Liu SS, YaDeau JT, Shaw PM, Wilfred S, Shetty T, Gordon M: Incidencia de inyección intraneural no intencional y complicaciones neurológicas posoperatorias con bloqueos nerviosos interescalénicos y supraclaviculares guiados por ecografía. Anestesia 2011;66:168–174.
- Bigeleisen PE: la punción del nervio y la aparente inyección intraneural durante el bloqueo axilar guiado por ecografía no invariablemente resultan en una lesión neurológica. Anestesiología 2006;105:779–783.
- Bigeleisen PE, Moayeri N, Groen GJ: Umbrales de estimulación extraneural versus intraneural durante el bloqueo supraclavicular guiado por ecografía. Anestesiología 2009;110:1235–1243.
- Sala Blanch X, Lopez AM, Carazo J, et al: Inyección intraneural durante el bloqueo del nervio ciático guiado por estimulador nervioso en la fosa poplítea. Hermano J Anaesth 2009;102:855–861.
- Cohen JM, Gray AT: Déficits funcionales después de la inyección intraneural durante el bloqueo interescalénico. Reg Anesth Pain Med 2010;35:397–399.
- Orebaugh SL, McFadden K, Skorupan H, Bigeleisen PE: Inyección subepineural en la colocación de la punta de la aguja interescalén guiada por ecografía. Reg Anesth Pain Med 2010;35:450–454.
- Altermatt FR, Cummings TJ, Auten KM, Baldwin MF, Belknap SW, Reynolds JD: apariencia ultrasonográfica de las inyecciones intraneurales en el modelo porcino. Reg Anesth Pain Med 2010;35:203–206.
- Moayeri N, Bigeleisen PE, Groen GJ: Arquitectura cuantitativa del plexo braquial y los compartimentos circundantes, y su posible importancia para los bloqueos del plexo. Anestesiología 2008;108:299–304.
- Moayeri N, Groen GJ: Las diferencias en la arquitectura cuantitativa del nervio ciático pueden explicar las diferencias en la vulnerabilidad potencial a la lesión del nervio, el tiempo de inicio y el volumen anestésico efectivo mínimo. Anestesiología 2009;111:1128–1134.
- Borgeat A, Ekatodramis G, Kalberer F, Benz C: Complicaciones agudas y no agudas asociadas con el bloqueo interescalénico y la cirugía del hombro: un estudio prospectivo. Anestesiología 2001;95:875–880.
- Candido KD, Sukhani R, Doty R Jr, et al: Secuelas neurológicas después del bloqueo del plexo braquial interescalénico para cirugía de hombro/brazo: la asociación de factores del paciente, anestésicos y quirúrgicos con la incidencia y el curso clínico. Anesth Analg 2005;100:1489–1495, índice.
- Bilbao Ares A, Sabate A, Porteiro L, Ibanez B, Koo M, Pi A: Complicaciones neurológicas asociadas al bloqueo interescalénico y supraclavicular ecoguiado en cirugía electiva de hombro y brazo. Estudio observacional prospectivo en un hospital universitario.]. Rev Esp Anestesiol Reanim 2013;60:384–391.
- Auroy Y, Benhamou D, Bargues L, et al: Complicaciones mayores de la anestesia regional en Francia: Servicio de línea directa de anestesia regional SOS. Anestesiología 2002;97:1274–1280.
- Barrington MJ, Watts SA, Gledhill SR, et al: Resultados preliminares de la Colaboración de Anestesia Regional de Australasia: una auditoría prospectiva de más de 7000 bloqueos de nervios periféricos y plexos por complicaciones neurológicas y de otro tipo. Reg Anesth Pain Med 2009;34:534–541.
- Fanelli G, Casati A, Garancini P, Torri G: Estimulador nervioso y técnica de inyección múltiple para bloqueo de miembros superiores e inferiores: tasa de falla, aceptación del paciente y complicaciones neurológicas. Grupo de Estudio de Anestesia Regional. Anesth Analg 1999;88:847–852.
- Selander D, Dhuner KG, Lundborg G: lesión del nervio periférico debido a las agujas de inyección utilizadas para la anestesia regional. Un estudio experimental de los efectos agudos del traumatismo por punta de aguja. Acta Anaesthesiol Scand 1977;21:182–188.
- Steinfeldt T, Nimphius W, Werner T, et al: Lesión nerviosa por perforación nerviosa con aguja en anestesia regional: ¿importa el tamaño? Hermano J Anaesth 2010;104:245–253.
- Steinfeldt T, Werner T, Nimphius W, et al: Análisis histológico después de la punción del nervio periférico con punta de lápiz o punta de aguja Tuohy. Anesth Analg 2011;112:465–470.
- Reina MA, de Leon-Casasola OA, Lopez A, De Andres J, Martin S, Mora M: Estudio in vitro de lesiones durales producidas por agujas Quincke y Whitacre calibre 25 evaluadas por microscopía electrónica de barrido. Reg Anesth Pain Med 2000;25:393–402.
- Selander D: Lesión del nervio periférico causada por agujas de inyección. Hermano J Anaesth 1993;71:323–325.
- Selander DE: Conferencia Labat 2006. Anestesia regional: aspectos, pensamientos y algo de ética honesta; sobre biseles de agujas y lesiones nerviosas, y dolor de espalda después de la anestesia espinal. Reg Anesth Pain Med 2007;32:341–350.
- Winfree CJ, Kline DG: lesiones nerviosas de posicionamiento intraoperatorio. Surg Neurol 2005;63:5–18; discusión 18.
- Kroll DA, Caplan RA, Posner K, Ward RJ, Cheney FW: lesión nerviosa
asociado a la anestesia. Anestesiología 1990;73:202–207. - Jankowski CJ, Keegan MT, Bolton CF, Harrison BA: Neuropatía después del bloqueo del plexo braquial axilar: ¿es el torniquete? Anestesiología 2003;99:1230–1232.
- Kornbluth ID, Freedman MK, Sher L, Frederick RW: Parálisis femoral del nervio safeno después del uso de torniquetes: informe de un caso. Arch Phys Med Rehabil 2003;84:909–911.
- Maguina P, Jean-Pierre F, Grevious MA, Malk AS: Parálisis de la rama interósea posterior después de la aplicación de un torniquete neumático para cirugía de la mano. Plast Reconstr Surg 2008;122:97e–99e.
- Barner KC, Landau ME, Campbell WW: Una revisión de la lesión nerviosa perioperatoria en las extremidades inferiores: parte I. J Clin Neuromuscul Dis 2002;4: 95–99.
- Nitz AJ, Dobner JJ, Matulionis DH: Evaluación estructural del nervio ciático de rata después de la compresión del torniquete y la manipulación vascular. Anat Rec 1989;225:67–76.
- Dobner JJ, Nitz AJ: Postmeniscectomía torniquete parálisis y secuelas funcionales. Am J Sports Med 1982;10:211–214.
- Weingarden SI, Louis DL, Waylonis GW: cambios electromiográficos en pacientes posmeniscectomía. Papel del torniquete neumático. JAMA 1979;241:1248–1250.
- Fabre T, Piton C, Andre D, Lasseur E, Durandeau A: Atrapamiento del nervio peroneo. J Bone Joint Surg Am 1998;80:47–53.
- Prielipp RC, Warner MA: Lesión nerviosa perioperatoria: ¿un grito silencioso? Anestesiología 2009;111:464–466.
- Warner MA, Warner ME, Martin JT: Neuropatía cubital. Incidencia, resultado y factores de riesgo en pacientes sedados o anestesiados. Anestesiología 1994;81:1332–1340.
- Morales-Vidal S, Morgan C, McCoyd M, Hornik A: neuropatía periférica diabética y el tratamiento del dolor neuropático periférico diabético. Postgrado Med 2012;124:145–153.
- Kalichman MW, Calcutt NA: Bloqueo de conducción inducido por anestésicos locales y lesión de fibras nerviosas en ratas diabéticas con estreptozotocina. Anestesiología 1992;77:941–947.
- Hebl JR, Kopp SL, Schroeder DR, Horlocker TT: Complicaciones neurológicas después de la anestesia o analgesia neuroaxial en pacientes con neuropatía sensitivomotora periférica preexistente o polineuropatía diabética. Anesth Analg 2006;103:1294–1299.
- Neal JM, Bernards CM, Hadzic A, et al: Asesoramiento práctico de ASRA sobre complicaciones neurológicas en anestesia regional y medicina del dolor. Reg Anesth Pain Med 2008;33:404–415.
- Mellion M, Gilchrist JM, de la Monte S: Neuropatía periférica relacionada con el alcohol: ¿nutricional, tóxica o ambas? Nervio muscular 2011; 43: 309–316.
- Hebl JR, Horlocker TT, Pritchard DJ: Plexopatía braquial difusa después del bloqueo interescalénico en un paciente que recibe quimioterapia con cisplatino: el síndrome de doble aplastamiento farmacológico. Anesth Analg 2001;92:249–251.
- Hebl JR: Anestesia regional guiada por ecografía y prevención de lesiones neurológicas: ¿realidad o ficción? Anestesiología 2008;108:186–188.
- Uskova AA, Plakseychuk A, Chelly JE: El papel de la cirugía en las lesiones nerviosas posoperatorias después del reemplazo total de cadera. J Clin Anesth 2010;22: 285–293.
- Moen V, Dahlgren N, Irestedt L: Complicaciones neurológicas graves después de bloqueos neuroaxiales centrales en Suecia 1990–1999. Anestesiología 2004;101:950–959.
- Kubina P, Gupta A, Oscarsson A, Axelsson K, Bengtsson M: Dos casos de síndrome de cauda equina después de anestesia espinal-epidural. Reg Anesth 1997;22:447–450.
- Hebl JR, Horlocker TT, Kopp SL, Schroeder DR: bloqueo neuroaxial en pacientes con estenosis espinal preexistente, enfermedad del disco lumbar o cirugía de columna previa: eficacia y complicaciones neurológicas. anesth analg
2010; 111: 1511-1519. - Barner KC, Landau ME, Campbell WW: Una revisión de la lesión nerviosa perioperatoria en las extremidades superiores. J Clin Neuromuscul Dis 2003;4: 117–123.
- Sunderland S: La susceptibilidad relativa a la lesión de las divisiones poplíteas medial y lateral del nervio ciático. Br J Surg 1953;41:300–302.
- Sunderland S: El nervio ciático y sus divisiones tibial y peronea común. Características anatómicas y fisiológicas. Nervios y lesiones nerviosas, Churchill Livingstone, 1978, págs. 924–966.
- Bernards CM, Hadzic A, Suresh S, Neal JM: Anestesia regional en pacientes anestesiados o muy sedados. Reg Anesth Pain Med 2008;33: 449–460.
- Nitz AJ, Dobner JJ, Matulionis DH: Aplicación de torniquetes neumáticos e integridad nerviosa: función motora y electrofisiología. Exp. Neurol 1986;94:264–279.
- Horlocker TT, Cabanela ME, Wedel DJ: ¿La analgesia epidural posoperatoria aumenta el riesgo de parálisis del nervio peroneo después de una artroplastia total de rodilla? Anesth Analg 1994;79:495–500.
- Sala-Blanch X, Lopez AM, Carazo J, et al: Inyección intraneural durante el bloqueo del nervio ciático guiado por estimulador nervioso en la fosa poplítea. Hermano J Anaesth 2009;102:855–861.
- Jeng CL, Rosenblatt MA: Inyecciones intraneurales y anestesia regional: lo conocido y lo desconocido. Minerva Anestesiol 2011;77:54–58.
- Moore DC: “Sin parestesias, sin anestesia”, ¿el estimulador nervioso o ninguno? Reg Anesth 1997;22:388–390.
- Auroy Y, Narchi P, Messiah A, Litt L, Rouvier B, Samii K: complicaciones graves relacionadas con la anestesia regional: resultados de una encuesta prospectiva en Francia. Anestesiología 1997;87:479–486.
- Winchell SW, Wolfe R: La incidencia de neuropatía después de los bloqueos nerviosos de las extremidades superiores. Reg Anesth Pain Med 1985;10:12–15.
- Urban MK, Urquhart B: Evaluación de la anestesia del plexo braquial para la cirugía de las extremidades superiores. Reg Anesth 1994; 19: 175–182.
- Liguori GA, Zayas VM, YaDeau JT, et al: Técnicas de localización nerviosa para el bloqueo del plexo braquial interescalénico: una comparación prospectiva y aleatoria de parestesia mecánica versus estimulación eléctrica. Anesth Analg 2006;103:761–767.
- Perlas A, Niazi A, McCartney C, Chan V, Xu D, Abbas S: La sensibilidad de la respuesta motora a la estimulación nerviosa y parestesia para la localización nerviosa evaluada por ultrasonido. Medicamento para el dolor Reg Anesth
2006; 31: 445-450. - Klein SM, Melton MS, Grill WM, Nielsen KC: Estimulación nerviosa periférica en anestesia regional. Reg Anesth Pain Med 2012;37: 383–392.
- Voelckel WG, Klima G, Krismer AC, et al: Signos de inflamación después del bloqueo del nervio ciático en cerdos. Anesth Analg 2005;101:1844–1846.
- Chan VW, Brull R, McCartney CJ, Xu D, Abbas S, Shannon P: Un estudio ultrasonográfico e histológico de inyección intraneural y estimulación eléctrica en cerdos. Anesth Analg 2007;104:1281–1284, índice.
- Tsai TP, Vuckovic I, Dilberovic F, et al: La intensidad de la corriente estimulante puede no ser un indicador fiable de la colocación de la aguja intraneural. Reg Anesth Pain Med 2008;33:207–210.
- Robards C, Hadzic A, Somasundaram L, et al: Inyección intraneural con estimulación de baja corriente durante el bloqueo del nervio ciático poplíteo. Anesth Analg 2009;109:673–677.
- Reiss W, Kurapati S, Shariat A, Hadzic A: Lesión nerviosa que complica el bloqueo del plexo braquial supraclavicular guiado por ultrasonido/electroestimulación. Reg Anesth Pain Med 2010;35:400–401.
- Urmey WF, Stanton J: Incapacidad para provocar consistentemente una respuesta motora después de la parestesia sensorial durante la administración de bloqueo interescalénico. Anestesiología 2002;96:552–554.
- Watts SA: Complicaciones neurológicas a largo plazo asociadas con la cirugía y el bloqueo de nervios periféricos: resultados después de 1065 bloqueos consecutivos. Anaesth Cuidados Intensivos 2007;35:24–31.
- Orebaugh SL, Williams BA, Vallejo M, Kentor ML: Resultados adversos asociados con bloqueos de nervios periféricos basados en estimulador con versus sin visualización de ultrasonido. Reg Anesth Pain Med 2009;34: 251–255.
- Selander D, Brattsand R, Lundborg G, Nordborg C, Olsson Y: Anestésicos locales: importancia del modo de aplicación, concentración y adrenalina para la aparición de lesiones nerviosas. Un estudio experimental de la degeneración axonal y el daño de la barrera después de la inyección intrafascicular o la aplicación tópica de bupivacaína (Marcain). Acta Anaesthesiol Scand 1979;23:127–136.
- Kapur E, Vuckovic I, Dilberovic F, et al: Resultado neurológico e histológico después de inyecciones intraneurales de lidocaína en nervios ciáticos caninos. Acta Anaesthesiol Scand 2007;51:101–107.
- Lupu CM, Kiehl TR, Chan VW, El-Beheiry H, Madden M, Brull R: La expansión nerviosa observada en la ecografía predice una lesión nerviosa histológica pero no funcional después de una inyección intraneural en cerdos. Reg Anesth Pain Med 2010;35:132–139.
- Orebaugh SL, Mukalel JJ, Krediet AC, et al: Inyección en la raíz del plexo braquial en un modelo de cadáver humano: distribución de la inyección y efectos en el neuroeje. Reg Anesth Pain Med 2012;37:525–529.
- Andrzej Krol, Matthew Szarko, Arber Vala, Jose De Andres: Monitoreo de la presión de las inyecciones intraneurales y perineurales en los nervios mediano, radial y cubital; Lecciones de un estudio cadavérico. Anesth Dolor Med. 2015 junio;5(3):e22723. DOI: 10.5812/aapm.22723.
- Sala-Blanch X, de Riva N, Carrera A, Lopez AM, Prats A, Hadzic A: El bloqueo poplíteo ciático guiado por ecografía con una sola inyección en la división ciática da como resultado un bloqueo más rápido que la técnica clásica de estimulación nerviosa. Anesth Analg 2012;114:1121–1127.
- Sala-Blanch X, Lopez AM, Pomes J, Valls-Sole J, Garcia AI, Hadzic A: No hay evidencia clínica o electrofisiológica de lesión nerviosa después de la inyección intraneural durante el bloqueo poplíteo ciático. Anestesiología 2011;115:589–595.
- Gadsden JC, Lindenmuth DM, Hadzic A, Xu D, Somasundarum L, Flisinski KA: El bloqueo del plexo lumbar con inyección de alta presión conduce a la propagación contralateral y epidural. Anestesiología 2008;109:683–688.
- Tsui BC, Li LX, Pillay JJ: Técnica de inyección de aire comprimido para estandarizar las presiones de inyección en bloque. Can J Anaesth 2006;53:1098–1102.
- Siegmueller C, Ramessur S: Una forma sencilla y económica de medir la presión de inyección durante el bloqueo de nervios periféricos. Anestesia 2011;66:956.
- Gerancher JC, Viscusi ER, Liguori GA, et al: Desarrollo de un formulario de nota de procedimiento de bloqueo nervioso periférico estandarizado. Reg Anesth Pain Med 2005;30:67–71.
- Claudio R, Hadzic A, Shih H, et al: Presiones de inyección realizadas por anestesiólogos durante el bloqueo nervioso periférico simulado. Reg Anesth Pain Med 2004;29: 201–205.
- Theron PS, Mackay Z, Gonzalez JG, Donaldson N, Blanco R: Un modelo animal de "sensación de jeringa" durante el bloqueo de nervios periféricos. Reg Anesth Pain Med 2009;34:330–332.
- Ip VH, Tsui BC: Conceptos prácticos en el control de las presiones de inyección durante los bloqueos de nervios periféricos. Int Anesthesiol Clin 2011;49: 67–80.
- Gadsden JC, Choi JJ, Lin E, Robinson A: La presión de apertura de la inyección detecta constantemente el contacto entre la aguja y el nervio durante el bloqueo del plexo braquial interescalénico guiado por ecografía. Anestesiología 2014;120: 1246–1253.
- Tsui BC, Pillay JJ, Chu KT, Dillane D: Impedancia eléctrica para distinguir la colocación intraneural de la aguja extraneural en los nervios porcinos durante la exposición directa y la guía por ultrasonido. Anestesiología 2008;109:479–483.
- Byrne K, Tsui BC: Conceptos prácticos en estimulación nerviosa: impedancia y otros avances recientes. Int Anesthesiol Clin 2011;49:81–90.
- Sauter AR, Dodgson MS, Kalvoy H, Grimnes S, Stubhaug A, Klaastad Ø: El umbral actual para la estimulación nerviosa depende de la impedancia eléctrica del tejido: un estudio de estimulación nerviosa eléctrica guiada por ultrasonido del nervio mediano. Anesth Analg 2009;108:1338–1343.
- Sitios BD, Spence BC, Gallagher JD, Wiley CW, Bertrand ML, Blike GT: Caracterización del comportamiento de los novatos asociado con el aprendizaje de la anestesia regional periférica guiada por ultrasonido. Reg Anesth Pain Med 2007;32: 107–115.
- Sitios BD, Taenzer AH, Herrick MD, et al: Incidencia de toxicidad sistémica anestésica local y síntomas neurológicos posoperatorios asociados con 12,668 bloqueos nerviosos guiados por ultrasonido: un análisis de un registro clínico prospectivo. Reg Anesth Pain Med 2012;37:478–482.