jeff gadsden
INTRODUCCIÓN
La incidencia de complicaciones de la anestesia general ha disminuido sustancialmente en las últimas décadas, en gran parte debido a los avances en el control de la función respiratoria y cardiovascular durante la administración de la anestesia. El uso de monitores objetivos como oximetría de pulso, capnografía, electrocardiografía, etc., permite a los médicos identificar oportunamente los parámetros fisiológicos cambiantes, intervenir rápida y adecuadamente y guiar sus decisiones terapéuticas.
La práctica de la anestesia regional ha adolecido tradicionalmente de una falta de monitores objetivos que ayuden al médico a monitorear más objetivamente la relación aguja-nervio y prevenir lesiones neurológicas. La práctica de los bloqueos de nervios periféricos se basaba tradicionalmente en puntos finales subjetivos para medir el riesgo potencial para el paciente. Sin embargo, esto está cambiando con la introducción y adopción de métodos estandarizados mediante los cuales realizar bloqueos nerviosos periféricos de manera segura con el mínimo riesgo posible para el paciente. Por ejemplo, en lugar de depender de sentir "clics", "chasquidos" y "arañazos" para identificar la posición de la punta de la aguja, los médicos ahora pueden monitorear la interacción en las capas fasciales de la aguja mediante ultrasonografía. Del mismo modo, la cuantificación de la intensidad de corriente mínima y la resistencia a la inyección se puede utilizar para recopilar datos adicionales útiles en la toma de decisiones clínicas para minimizar el riesgo de colocación de la aguja en un plano de tejido no deseado, intravascularmente o en estructuras anatómicas vulnerables intraneuralmente. Por lo tanto, los avances recientes en la monitorización pueden reducir las tres complicaciones más temidas del bloqueo de nervios periféricos: lesión nerviosa, toxicidad de los anestésicos locales, y daño involuntario a las estructuras adyacentes ("percance de la aguja").
El monitoreo objetivo y la justificación de su uso se analizan en la primera parte de esta sección. La última sección se centra en la documentación de los procedimientos de bloqueo nervioso, que es un registro lógico de la información objetiva obtenida por los monitores. La documentación objetiva y sólida de cómo se realizó un bloqueo nervioso tiene implicaciones médico-legales obvias y proporciona una base de datos útil para guiar los avances en seguridad y eficacia.
MONITOREO
Medios disponibles para monitorear las relaciones aguja-nervio
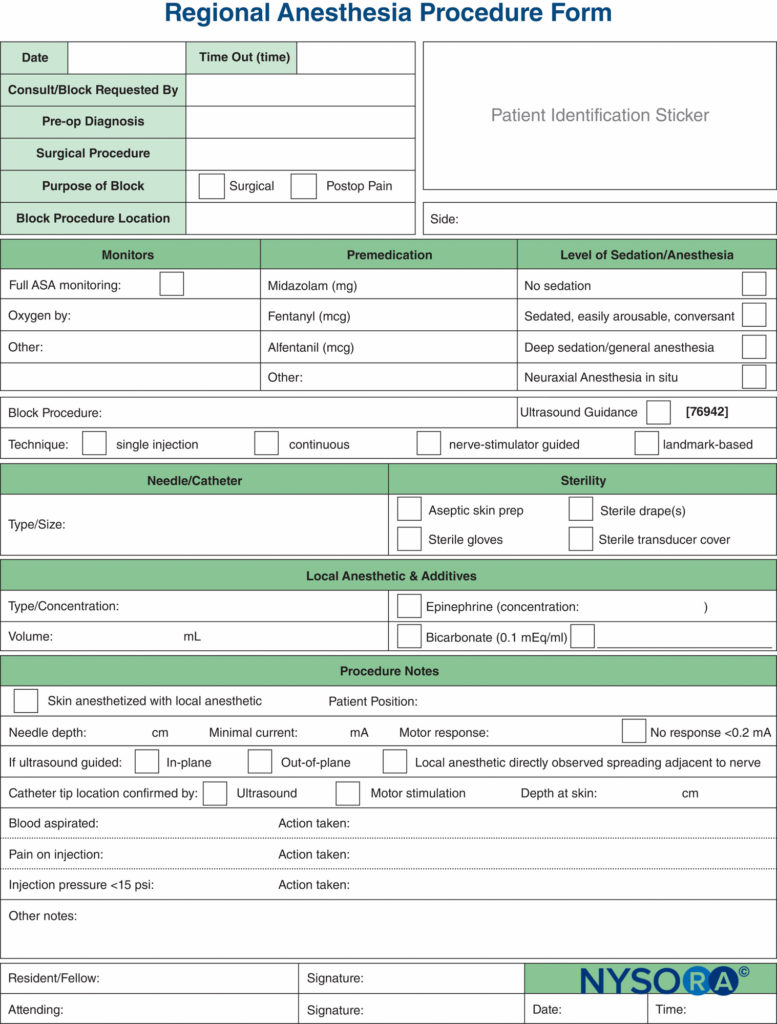
Los monitores, tal como se utilizan en la práctica médica, son dispositivos que evalúan un estado fisiológico específico y advierten al médico de un daño inminente. Los monitores discutidos en este capítulo incluyen aquellos para estimulación nerviosa, ultrasonografía y monitoreo de la presión de inyección. Cada uno de estos tiene su propio conjunto distinto de ventajas y limitaciones, y cada uno se usa mejor de manera aditiva y complementaria (Figura 1 y XNUMX) para minimizar la posibilidad de lesiones al paciente, en lugar de confiar únicamente en la información proporcionada por un solo monitor. Hay suficiente información basada en evidencia de que la combinación de los tres monitores probablemente produzca el proceso más seguro posible durante la práctica de bloqueos de nervios periféricos.
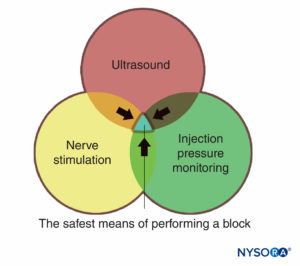
FIGURA 1. Tres modos de monitoreo de bloqueos de nervios periféricos para lesiones del paciente. El área superpuesta de los tres (área azul) representa la forma más segura de realizar un bloqueo.
Otro control farmacológico que muchos médicos utilizan regularmente es el uso de epinefrina en el anestésico local. Hay algunas pruebas que respaldan esta práctica como un medio para mejorar la seguridad de la mayoría de los pacientes durante los bloqueos de nervios periféricos. En primer lugar, actúa como marcador de la absorción intravascular. La inyección intravenosa de 10 a 15 μg de epinefrina aumenta de forma fiable la presión arterial sistólica en más de 15 mmHg, incluso en pacientes sedados o tratados con bloqueadores β. El reconocimiento de este aumento puede permitir la detección temprana de la inyección intravascular y permite que el médico detenga rápidamente la inyección y agudice la vigilancia de los signos de toxicidad sistémica. En segundo lugar, la epinefrina disminuye el nivel plasmático máximo del anestésico local, lo que reduce el riesgo de toxicidad sistémica. Las preocupaciones con respecto a los efectos vasculares de la epinefrina, la vasoconstricción y la isquemia nerviosa no se han comprobado y, de hecho, las concentraciones de 2.5 μg/mL (1:400,000 XNUMX) se han asociado con un aumento del flujo sanguíneo nervioso, probablemente debido al predominio de la β -efecto de la droga. Por lo tanto, la epinefrina puede mejorar la seguridad durante la administración de dosis más altas de anestésicos locales sin riesgo documentado de isquemia de las extremidades y muerte neurológica.
Cabe señalar que el uso de la guía por ultrasonido durante los bloqueos de nervios periféricos ha disminuido significativamente el riesgo de toxicidad sistémica grave de los anestésicos locales por varias razones. Lo más probable es que esto se deba a que la guía por ultrasonido ha permitido reducir el volumen y la dosis de anestésico local para lograr la mayoría de los procedimientos de bloqueo nervioso mediante el control de su propagación. Además, la observación de la trayectoria de la aguja en la ecografía, la evitación de la colocación intravascular y la confirmación de la propagación del anestésico local en los tejidos se suman a una mayor seguridad con la anestesia regional guiada por ecografía.
Estimulación nerviosa
La neuroestimulación reemplazó en gran medida a la parestesia como medio principal de localización nerviosa en la década de 1980. Sin embargo, su utilidad como método para localizar nervios con precisión ha sido cuestionada recientemente por los datos de varios estudios que demostraron que la respuesta motora evocada (EMR) puede estar ausente a pesar del contacto íntimo entre la aguja y el nervio, según lo confirmado por ultrasonografía. De hecho, en varios contactos entre la aguja y el nervio o incluso en la colocación de una aguja intraneural, puede ser necesaria una intensidad de corriente inesperadamente alta para provocar un EMR. Por ejemplo, en algunos casos, se podría obtener un EMR solo con una intensidad de corriente relativa de más de 1 mA, incluso con la colocación de una aguja intraneural como se ve en la ecografía.
Probablemente hay múltiples factores que contribuyen a la explicación de este fenómeno. El factor más importante es probablemente la derivación de la corriente eléctrica a lo largo del camino de menor resistencia (impedancia). En otras palabras, incluso cuando la aguja está en las inmediaciones del nervio, la corriente eléctrica puede no optar necesariamente por viajar hacia el nervio, sino que viaja a lo largo del camino de menor resistencia para salir a través del electrodo de piel. Un factor adicional puede incluir la distribución no uniforme de fibras motoras y sensoriales en el nervio compuesto.
Esto, sin embargo, no significa que la estimulación eléctrica de los nervios periféricos sea obsoleta en la era de la guía por ultrasonido. Por ejemplo, los datos de varios estudios en animales y humanos sugirieron que la presencia de una respuesta motora a una corriente muy baja (es decir, < 0.2 mA) está asociada con la colocación de la punta de la aguja intraneural y la inflamación intraneural después de una inyección en esta condición (Tabla 1). Voelckel et al. informaron que cuando se inyectó anestésico local a corrientes entre 0.3 y 0.5 mA, el tejido nervioso resultante no mostró signos de un proceso inflamatorio, mientras que las inyecciones a menos de 0.2 mA dieron como resultado una infiltración linfocítica y granulocítica en el 50% de los nervios. Tsai et al. realizó un estudio similar investigando el efecto de la distancia al nervio sobre la corriente requerida; mientras que se registró un rango de corrientes para una variedad de distancias, los únicos casos en los que la respuesta del motor se obtuvo a menos de 0.2 mA fueron cuando la punta de la aguja se colocó intraneuralmente.
TABLA 1. Resumen de estudios recientes sobre la corriente de estimulación nerviosa y la posición de la punta de la aguja.
| ESTUDIO | Asunto | Método | Hallazgos |
|---|---|---|---|
| Voelckel y otros (2005)11 | Cerdos (n = 10) | • Bloqueos del nervio ciático posterior realizados bilateralmente • Dos grupos- Inyección después de EMR a 0.3–0.5 mA- Inyección después de EMR a < 0.2 mA • 6 horas después de la inyección, se recolectan los nervios ciáticos para el análisis histológico | • Aspecto normal y saludable de los nervios en el grupo de alta corriente • El 50% de los nervios en el grupo de baja corriente mostró evidencia de linfocitos y granulocitos polimórficos sub-, peri-. e intraneuralmente • Un espécimen en el grupo de baja corriente mostró una gran interrupción del perineuro y múltiples fibras nerviosas |
| Tsai y otros (2008)12 | Cerdos (n = 20) | • Anestesia general • Nervios ciáticos expuestos bilateralmente • Corriente aplicada con aguja a varias distancias desde 2 cm hasta intraneural • Dos observadores cegados acordaron la corriente mínima requerida para obtener la contracción del casco • 40 intentos en cada distancia | • Las contracciones del nervio ciático solo se pueden obtener a 0.1 cm o menos • Amplia gama de corrientes requeridas para provocar la respuesta del motor • Solo cuando intraneural resultó una respuesta motora de corriente < 0.2 mA |
| Bigeleisen y otros (2009)13 | Pacientes para cirugía de mano/muñeca (n = 55) | • Bloqueo supraclavicular • Corriente mínima (mA) registrada- Con aguja fuera del tronco nervioso (pero haciendo contacto con el nervio)- Dentro del tronco • Posición "intraneural" confirmada ecográficamente con una inyección de 5 ml de anestésico local | • Umbral de corriente mínima mediana fuera del nervio 0.60 mA ± 0.37 mA • La mediana del umbral mínimo de corriente fuera del nervio fue de 0.30 ± 0.19 mA • No se observó EMR en ningún momento con < 0.2 mA cuando la aguja se colocó fuera del nervio |
| Wiesmann y otros (2014)14 | Cerdos (n = 6) | • Modelo de plexo braquial abierto • Estimulación en tres posiciones: intraneural, contacto aguja-nervio y 1 mm de distancia del nervio • 3 duraciones de pulso probadas (0.1, 0.3 y 1 ms) | • La intensidad de la corriente no puede distinguir entre contacto intraneural y aguja-nervio • Respuesta motora < 0.2 mA (independientemente de la duración del pulso) indica contacto intraneural o aguja-nervio |
Bigeleisen et al. estudiaron a 55 pacientes programados para cirugía de miembros superiores que recibieron bloqueos supraclaviculares del plexo braquial guiados por ecografía. Los autores se propusieron determinar el umbral mínimo de corriente para la respuesta motora tanto dentro como fuera del primer tronco encontrado. Informaron que el umbral de estimulación mínima mediana fue de 0.60 mA fuera del nervio y de 0.3 mA dentro del nervio. Sin embargo, no se observó EMR con corrientes de estimulación de 0.2 mA o menos fuera del nervio, mientras que el 36 % de los pacientes tuvieron una contracción de EMR con corrientes inferiores a 0.2 mA con la colocación de la aguja intraneural. Para refinar aún más esta relación, Wiesmann y sus colegas aplicaron una corriente eléctrica al plexo braquial de cerdos en tres posiciones diferentes (intraneural, con la aguja en contacto con el epineuro y a 1 mm del nervio) mientras variaban la duración del pulso (0.1, 0.3 , y 1.0 ms). El umbral mínimo de corriente para provocar una respuesta motora fue idéntico entre las posiciones de contacto intraneural y aguja-nervio, y ambas fueron significativamente más bajas que la posición a 1 mm de distancia. La duración del pulso no tuvo efecto sobre el umbral mínimo de corriente. Estos autores concluyeron que una respuesta motora de menos de 0.2 mA (independientemente de la duración del pulso) indicaba contacto intraneural o entre la aguja y el nervio. Esto es importante porque se ha establecido que, incluso en ausencia de punción del epineuro, incluso el contacto forzado de la aguja con el nervio (epineuro) produce inflamación y la posibilidad de lesión del nervio.
En conjunto, los datos disponibles sugieren que la sensibilidad de una "corriente baja" para provocar un EMR en una relación aguja-nervio potencialmente peligrosa (colocación intraneural/epineural) es de alrededor del 75 %. Sin embargo, la especificidad del EMR cuando está presente a menos de 0.5 mA se acerca al 100 %. En otras palabras, una corriente estimulante de baja intensidad provoca una respuesta motora (p. ej., < 0.2 mA según Voelckel et al), la punta siempre es intraneural o está íntimamente relacionada con el epineuro. Por lo tanto, la utilidad del estimulador nervioso es obvia: la aparición inesperada de un EMR a 0.5 mA indica una relación peligrosa entre la aguja y el nervio (p. ej., contacto entre la aguja y el nervio) y puede permitir que el operador detenga el avance de la aguja antes de que entre en el nervio. .
Se acepta universalmente que la inyección de anestésico local en el nervio conlleva un factor de riesgo de lesión del nervio; por lo tanto, el depósito extraneural de anestésico local constituye una práctica más segura. Si bien es incuestionablemente útil, la ultrasonografía está lejos de ser un monitor infalible de la relación entre la aguja y el nervio. Debido a que la inyección en un fascículo conlleva un alto riesgo de lesiones, la adición de un control eléctrico de la posición de la punta de la aguja es útil para la seguridad, particularmente en pacientes con anatomía ecográfica desafiante cuando la obtención de imágenes resulta difícil o la calidad de la imagen es deficiente. Si se provoca un EMR con corrientes por debajo de 0.5 mA, esto indica una relación estrecha entre la aguja y el nervio que debe provocar una ligera extracción de la aguja y una inyección cuidadosa mientras se evita una presión de inyección de apertura superior a 15 psi. En general, la estimulación nerviosa agrega poco al costo de un procedimiento de bloqueo nervioso, en términos de tiempo o costo, y también puede servir como una confirmación funcional útil de la imagen anatómica que se muestra en la pantalla de ultrasonido (p. ej., "¿Es el nervio mediano o cubital?" ?”). Por estas razones, la estimulación nerviosa debe utilizarse de forma rutinaria junto con la ecografía como un valioso control adicional de la posición de la punta de la aguja. Aprender más acerca de Estimuladores nerviosos eléctricos y localización de nervios periféricos.
Ecografia
El ultrasonido ha revolucionado la práctica de la anestesia regional y ha permitido una evolución sustancial de la subespecialidad de un arte practicado por unos pocos a una ciencia más reproducible. Las ventajas son que el ultrasonido permite ver la aguja en tiempo real y, por lo tanto, guiar la aguja de manera más rápida y precisa hacia el objetivo. El ultrasonido también permite una inyección adicional cuando el primer intento no es adecuado y deposita con precisión el inyectado en los espacios tisulares para un bloqueo nervioso reproducible. Además, la ecografía permite realizar bloqueos nerviosos incluso en pacientes paralizados, amputados que no tienen una extremidad para una EMR, etc.
El ultrasonido tiene el potencial de mejorar la seguridad de los bloqueos de nervios periféricos por varias razones. Las estructuras adyacentes de importancia se pueden ver y evitar. El resurgimiento de la popularidad del bloqueo supraclavicular es prueba de ello. Antes de la ecografía, este bloqueo altamente efectivo era relativamente impopular como medio para anestesiar el plexo braquial por temor a causar un neumotórax, debido a la proximidad del plexo y la vista de la colocación de la aguja en la pleura y la cavidad torácica. Sin embargo, debido a que el plexo braquial y, lo que es más importante, la costilla, la pleura y la arteria subclavia pueden identificarse en la ecografía, el bloqueo supraclavicular se ha vuelto común en la práctica clínica. De todos modos, no se debe pensar en el ultrasonido como una prueba de fallas porque las complicaciones, incluido el neumotórax, todavía ocurren con la guía del ultrasonido. De manera similar, hay informes de colocación de agujas intravasculares e intraneurales presenciadas por (ya pesar del uso de) ultrasonido.
Una ventaja importante de la detección por ultrasonido es la capacidad de determinar la distancia entre la piel y el objetivo. Esto, junto con las agujas que tienen marcas de profundidad grabadas en el costado, confiere un margen de seguridad adicional al advertir al médico de una "distancia de detención" o una profundidad más allá de la cual el médico debe dejar de avanzar la aguja hacia el tejido más profundo y volver a evaluar. Otra ventaja importante de la ecografía es la capacidad de ver la distribución del anestésico local en tiempo real. (Figura 2 y XNUMX). Si no se observa la expansión tisular correspondiente cuando comienza la inyección, es posible que la punta de la aguja no esté donde debería estar y el médico puede detener la inyección y volver a evaluar la ubicación de la punta de la aguja. Esto es particularmente importante en las áreas vasculares, ya que la falta de propagación del anestésico local puede indicar la colocación de una aguja intravascular. Por otro lado, el monitoreo por ultrasonido se puede utilizar para diagnosticar la colocación de la punta de una aguja intraarterial cuando se observa un "rubor" ecogénico en la luz de la arteria, lo que disminuye el riesgo de toxicidad sistémica.
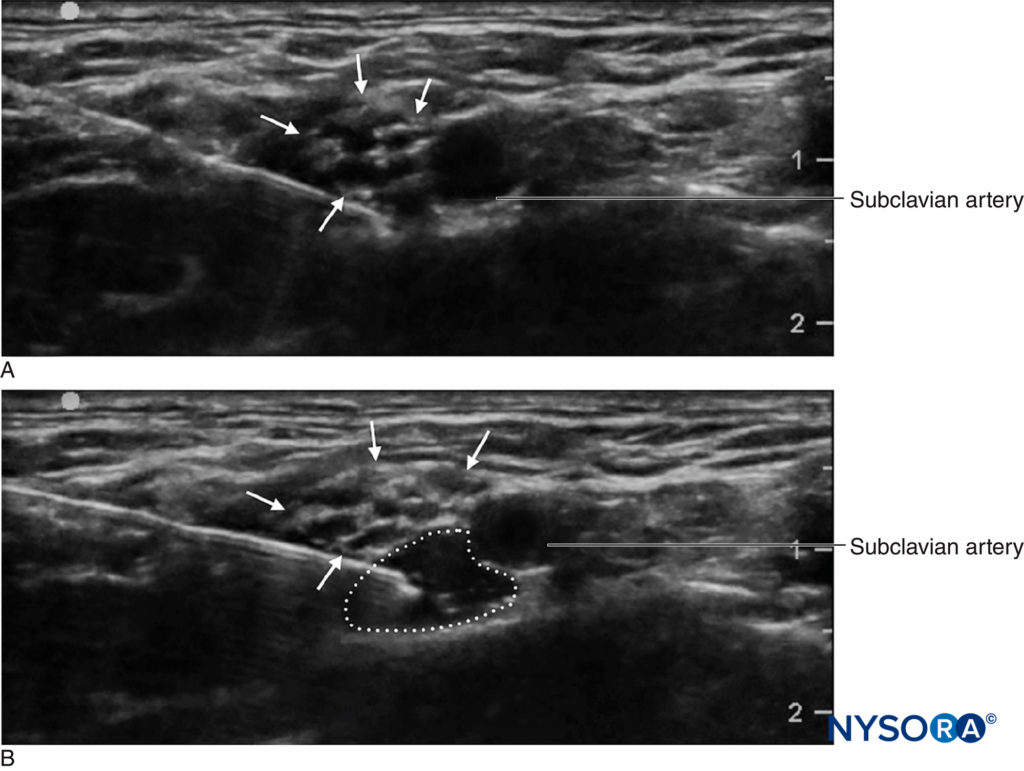
FIGURA 2. Bloqueo del plexo braquial supraclavicular que muestra el plexo (flechas) adyacente a la arteria subclavia (SA). A Antes y B después del depósito de 10 mL de anestésico local (contorno punteado).
La ecografía parece disminuir el riesgo de toxicidad sistémica del anestésico local (LAST). En un análisis de un gran registro multicéntrico de bloqueos de nervios periféricos (>25,000 65 bloqueos de nervios periféricos), el riesgo de LAST se redujo en más del 10 % con el uso de guía por ultrasonido. El mecanismo propuesto por los autores fue la capacidad de reducir sustancialmente los volúmenes y dosis de anestésico local requeridos para lograr el bloqueo regional. De hecho, la disminución de la dosis y el volumen de anestésico local necesarios para el éxito de la anestesia regional ha sido una tendencia constante durante la última década. Numerosos informes han documentado reducciones sustanciales en el volumen requerido para efectuar un bloqueo equivalente en comparación con las técnicas de anestesia regional guiadas por ultrasonido. Por ejemplo, los bloqueos del plexo braquial se pueden realizar con menos de 7 ml de anestésico local, sin sacrificar la eficacia de la anestesia o la analgesia. Incluso si todo el volumen del inyectado se administra por vía intravenosa por accidente, es poco probable que se produzca una LAST grave resultante de, por ejemplo, un volumen de 0.5 ml de ropivacaína al XNUMX % en un adulto de tamaño medio. bloqueos no ha disminuido el riesgo o la incidencia de lesiones nerviosas.
Esta decepcionante observación se documentó en varios informes y es probable que sea multifactorial. La capacidad de discernir la relación aguja-nervio depende del usuario y de la anatomía. De hecho, los estudios han demostrado que los profesionales pueden perder aproximadamente una de cada seis inyecciones intraneurales. En segundo lugar, la resolución actual de la máquina de ultrasonido puede no ser adecuada para discernir entre una ubicación de la punta de la aguja intrafascicular y extrafascicular. Esta diferencia es crucial, ya que es probable que una inyección intraneural (pero extrafascicular) no se asocie con lesión, mientras que la inyección dentro de los fascículos produce daño clínico e histológico. Es importante destacar que no se puede confiar en la inflamación del nervio como advertencia de una inyección intraneural porque una vez que esto se detecta en la ecografía, puede ser demasiado tarde para prevenir una lesión. Esto se debe a que incluso una cantidad minúscula de anestésico local producirá daño si se inyecta en el fascículo; sin embargo, es posible que la ecografía no detecte cantidades tan pequeñas de anestésico local (p. ej., 0.1 a 0.5 ml). Por lo tanto, confiar en la confirmación visual de la expansión del tejido puede provocar daños antes de que se detecte la expansión en la pantalla.
Supervisión de la presión de inyección
Una inyección de lidocaína mientras la punta de la aguja estaba en una posición intrafascicular en los nervios ciáticos caninos se asoció con una presión de apertura alta (> 20 psi), seguida de un retorno de la presión de inyección a la normalidad (es decir, < 5 psi) después de la ruptura fascicular. Por el contrario, las inyecciones extrafasciculares perineurales e intraneurales produjeron bajas presiones de apertura e inyección. Las extremidades en las que se asociaron inyecciones en el nervio ciático con altas presiones de inyección de apertura experimentaron signos clínicos de neuropatía (desgaste muscular, debilidad), así como evidencia histológica de lesión neurológica (inflamación, alteración de la arquitectura nerviosa). La implicación es que la inyección en un compartimento de baja distensibilidad, como dentro de los fascículos unidos al perineurio, requiere una presión de inyección de apertura alta antes de que se pueda iniciar la inyección.
La posición de la punta de la aguja intraneural también se asocia con presiones de inyección de apertura altas en cadáveres humanos. Orebaugh et al colocaron agujas en raíces cervicales cadavéricas mediante ultrasonido y cuantificaron la presión en el transcurso de una inyección de 5 ml de ropivacaína y tinta durante 15 s. En contraste con las agujas de control colocadas fuera de las raíces (presión máxima < 20 psi), las inyecciones intraneurales dieron como resultado una presión máxima media de 49 psi (rango 37–66 psi). De manera similar, Krol et al. realizaron inyecciones intraneurales y perineurales guiadas por ultrasonido en nervios más distales en cadáveres humanos frescos (nervios mediano, cubital y radial) y también informaron que la presión de inyección de apertura fue superior a 15 psi intraneuralmente, mientras que las presiones de inyección de apertura extraneural eran menos de 10 psi.
En un estudio clínico de 16 pacientes sometidos a cirugía de hombro, el contacto entre la aguja y el nervio durante el bloqueo interescalénico del plexo braquial se asoció con una inyección de apertura superior a 15 psi. De hecho, en el contacto de la aguja con el nervio y justo antes de la entrada de la aguja en las raíces del plexo braquial, el flujo del inyectado no pudo comenzar a presiones inferiores a 15 psi. Detener una inyección cuando la presión de inyección de apertura requerida para comenzar una inyección alcanzó los 15 psi permitió evitar la inyección en esta posición peligrosa en el 97% de los sujetos. Por el contrario, una posición de la aguja a 1 mm del nervio se asoció con el inicio del flujo a presiones de apertura inferiores a 15 psi. Por lo tanto, como monitor del contacto entre la aguja y el nervio, una presión de inyección de apertura superior a 15 psi fue mucho más sensible que una corriente de umbral mínima de 0.5 o 0.2 mA o la aparición de parestesia.
Estos datos sugieren que cuando la presión en el sistema se acerca a 15 psi sin la capacidad de comenzar el flujo del inyectado, esta presión de inyección de apertura alta puede indicar una relación peligrosa entre la aguja y el nervio o la colocación de la aguja en un plano de tejido incorrecto. Por lo tanto, se debe detener la inyección y reevaluar la posición de la aguja.
¿Cómo se debe monitorear la presión de inyección? Desafortunadamente, el uso de la "sensación de la mano" para evitar una presión de inyección alta no es confiable. Los estudios de profesionales experimentados que desconocían la presión de la inyección y se les pidió que realizaran una inyección simulada utilizando equipos estándar revelaron amplias variaciones en la presión aplicada, algunas de las cuales superaban con creces los umbrales de seguridad establecidos. De manera similar, los anestesiólogos se desempeñaron mal cuando se les pidió que distinguieran entre la inyección intraneural y la inyección en otros tejidos, como músculos o tendones, en un modelo animal. Por lo tanto, el único monitoreo significativo y reproducible es mediante el uso de un método objetivo y cuantificable para monitorear la presión de inyección de apertura.
Si bien la práctica de monitorear la presión de inyección durante los bloqueos de nervios periféricos es relativamente nueva, existen varias opciones de monitoreo. Tsui et al describieron una "técnica de inyección de aire comprimido" mediante la cual se introducen 10 ml de aire en la jeringa junto con el anestésico local. Sosteniendo la jeringa en posición vertical, se puede evitar un umbral máximo de 1 atm (o 14.7 psi) permitiendo que solo la porción de gas del contenido de la jeringa se comprima a la mitad de su volumen original, o 5 ml (Figura 3 y XNUMX). Esto se basa en la ley de Boyle, que establece que la presión × el volumen debe ser constante. Una presión de 20 psi o menos se considera un umbral seguro para iniciar la inyección durante los bloqueos de nervios periféricos. La ley de Boyle también se ha empleado en otro aparato simple que utiliza una llave de paso de cuatro vías y una jeringa de 1 ml llena de aire. Si, durante el inicio de la inyección, el menisco de fluido alcanza el punto medio en la jeringa de 1 ml (es decir, 0.5 ml), esto indica que la presión del sistema se ha duplicado (es decir, otra atmósfera o 14.7 psi). Estas son formas económicas y disponibles en todas partes para limitar la presión de inyección durante los bloqueos de nervios periféricos. Las limitaciones prácticas incluyen la necesidad de sostener la jeringa en posición vertical o de cerrar periódicamente la llave de paso de la jeringa de 1 ml al aspirar para que no entre aire en el tubo de inyección.
FIGURA 3. La técnica de inyección de aire comprimido. Se coloca una burbuja de aire de 10 ml en la jeringa de anestésico local, que luego se invierte. La compresión de esa burbuja en un sistema cerrado a la mitad de su volumen original (es decir, 5 ml) aumentará la presión en el sistema en 1 atm (14.7 psi).
Otra opción para controlar la presión de inyección es el uso de manómetros de presión desechables en línea fabricados específicamente para este fin. Estos dispositivos unen el tubo de la jeringa y la aguja y, a través de un pistón accionado por resorte, permiten al médico monitorear continuamente la presión en el sistema de aguja-tubo-jeringa. En el eje del pistón hay marcas que delimitan tres umbrales de presión diferentes: menos de 15 psi, 15–20 psi y más de 20 psi (Figura 4 y XNUMX). Una ventaja de este método es la facilidad con la que un ayudante que está realizando la inyección puede leer y comunicar las presiones alcanzadas. Este método también permite la documentación objetiva de la presión de inyección durante un procedimiento de bloqueo de nervio periférico. Es importante destacar que la presión de apertura (presión a la que comienza el flujo) es independiente del tamaño de la jeringa, el tubo y la aguja o la velocidad de inyección (ley de Pascal) (Figura 5 y XNUMX). Si bien se puede generar una presión mayor con una jeringa más pequeña y se puede lograr una presión de inyección más alta mediante una inyección rápida, la presión de apertura a la que comienza el flujo es la misma e independiente de estas variables para los tamaños comunes de jeringa-tubo-aguja (es decir, 18– calibre 25). Sin embargo, cuando comienza la inyección, estos factores influirán en la presión de inyección alcanzada. Por lo tanto, se sugiere una velocidad de inyección lenta y constante con todos los procedimientos de bloqueo nervioso (10 a 15 ml/min). La presión de inyección de apertura se vuelve relevante con cada cambio de posición de la aguja y la consiguiente inyección. La monitorización de la presión puede ser un monitor de seguridad útil en varios otros aspectos de los bloqueos de nervios periféricos. En un estudio de pacientes que recibieron bloqueos del plexo lumbar asignados al azar a presiones bajas (<15 psi) versus altas (>20 psi), Gadsden et al demostraron que el 60 % de los pacientes en el grupo de alta presión experimentó un bloqueo epidural bilateral.
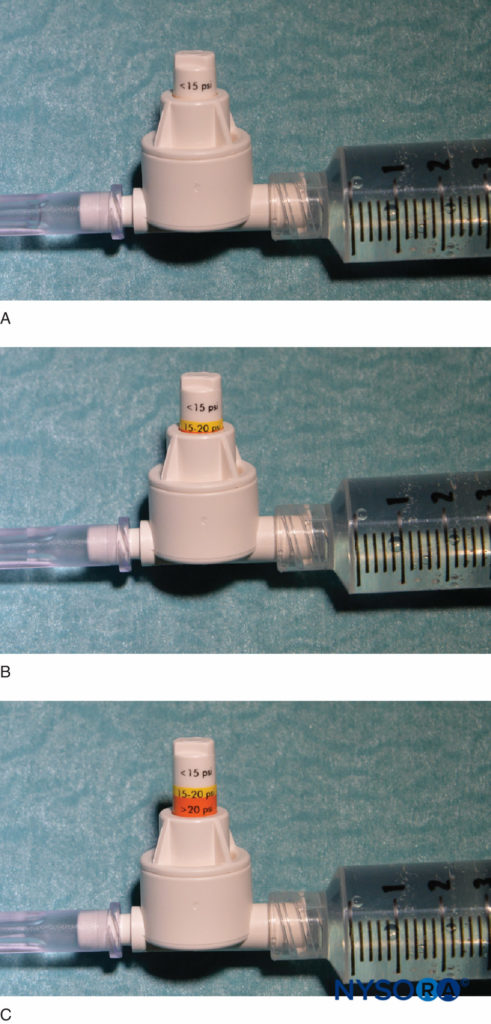
FIGURA 4. Un ejemplo de un manómetro de presión en línea disponible comercialmente (B-Smart, B. Braun Medical, Bethlehem, PA). Como se ve en A–C, respectivamente, el monitor muestra rangos de presión en color en el pistón móvil: 0–15 psi (blanco), 15–20 psi (amarillo) y más de 20 psi (naranja). En el uso clínico, la presión de inyección de apertura exacta (OIP) es menos importante que la prevención de exceder el rango de OIP asociado con la lesión fascicular (>15 psi). Prácticamente, esto se evita abortando la inyección con la aparición de cualquier color en el pistón durante todo el ciclo de inyección (>15 psi). Es importante destacar que la presión de apertura (presión a la que comienza el flujo) es independiente del tamaño de la jeringa, el tubo y la aguja o la velocidad de inyección (ley de Pascal).
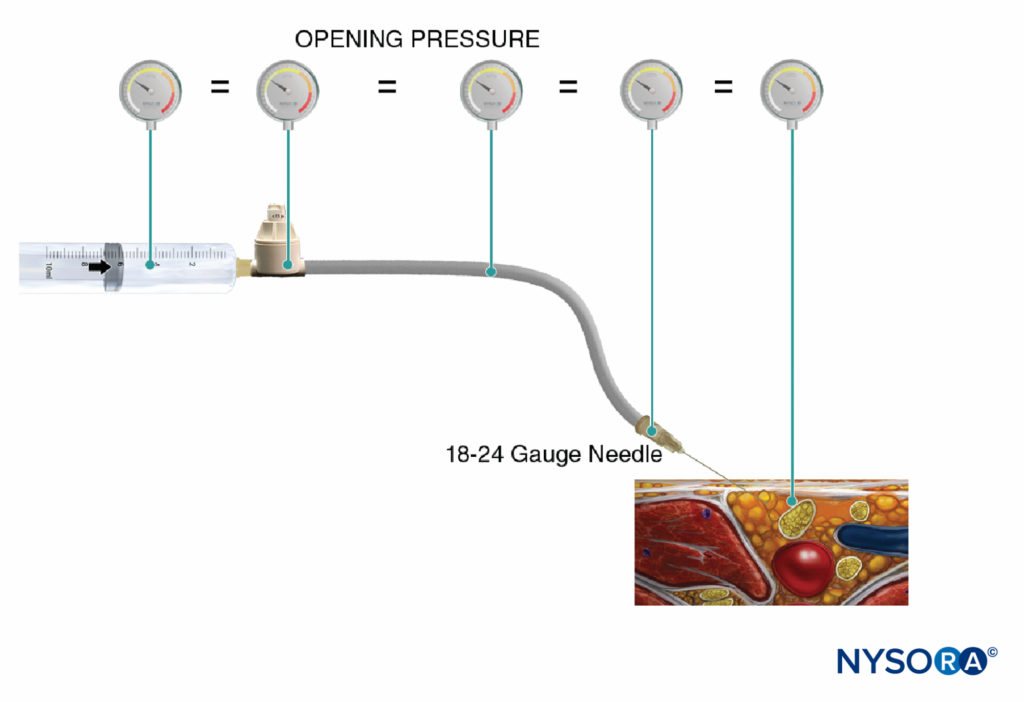
FIGURA 5. La presión de inyección de apertura (presión a la que comienza el flujo) es independiente del tamaño de la jeringa, el tubo y la aguja o la velocidad de inyección, y es igual en todo el sistema de inyección (ley de Pascal).
Además, el 50% de los pacientes del mismo grupo desarrollaron un bloqueo epidural en la distribución torácica, mientras que ningún paciente del grupo de baja presión experimentó un bloqueo epidural o bilateral. De manera similar, Gautier et al demostraron que cuando los voluntarios fueron asignados al azar a presiones bajas (<15 psi) versus altas (>20 psi) durante el bloqueo interescalénico del plexo braquial, se produjo diseminación epidural cervical en el 11 % de las inyecciones de alta presión (frente al 0 % en las inyecciones). grupo de baja presión). Además, todos los sujetos solicitaron que se detuviera la inyección en la condición de alta presión debido a la incomodidad, pero no durante la inyección de baja presión. Estos datos sugieren que monitorear la presión de inyección de apertura es importante para varios aspectos de la seguridad y la comodidad del paciente durante la práctica de bloqueos de nervios periféricos.
Resumen
La anestesia regional ha estado haciendo una transición del arte a la ciencia, a medida que se desarrollan medios más rigurosos y precisos para localizar los nervios. Se debe esperar el mismo proceso para monitorear el bloqueo periférico. El uso conjunto de neuroestimulación, ultrasonografía y control de la presión de inyección proporciona un paquete complementario de datos objetivos que pueden guiar a los médicos para realizar los bloqueos más seguros posibles.
Figura 6 y XNUMX es un diagrama de flujo que describe cómo se utilizan estos monitores en nuestra práctica.
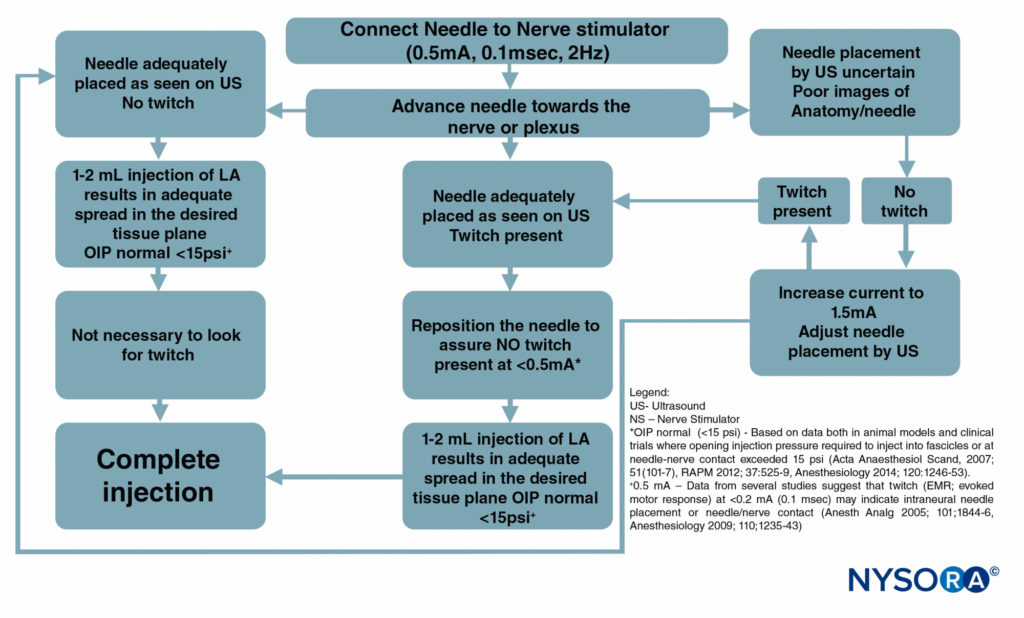
FIGURA 6. Un diagrama de flujo que muestra el orden de monitoreo correcto de los procedimientos de bloqueo nervioso mediante la combinación de ultrasonido (US), estimulación nerviosa (NS) y monitoreo de la presión de inyección. LA = anestésico local.
DOCUMENTACIÓN
Notas del procedimiento de bloque
La documentación de los procedimientos de bloqueo nervioso ha quedado rezagada con respecto a la documentación de la anestesia general y, a menudo, se relega a unas pocas líneas garabateadas en la esquina del registro anestésico. La creciente presión de las fuentes legales, de facturación y regulatorias ha provocado un esfuerzo por mejorar la documentación de los bloqueos nerviosos periféricos. Las muestras de un formulario de documentación de bloqueo de nervio periférico que incorpora todos los elementos de monitoreo mencionados anteriormente en este capítulo se muestran en Figuras 7 y 8. Estos pueden ser adoptados y modificados para adaptarse a las prácticas individuales. Los formularios tienen una serie de características que deben ser consideradas por las instituciones que intentan formular su propia nota de procedimiento. Estos incluyen lo siguiente:
Los registros en papel se están reemplazando cada vez más por sistemas electrónicos de mantenimiento de registros médicos. La documentación de bloques es simple con sistemas computarizados como estos, ya que las variables de bloque se pueden seleccionar rápidamente de una lista indicando los elementos de documentación relevantes, mientras que cualquier elemento narrativo se puede escribir rápidamente usando un teclado (Figura 8 y XNUMX). La legibilidad y la capacidad de corregir errores son ventajas del e-block note.

FIGURA 8. Captura de pantalla de una página de documentación en bloque tomada de un registro médico electrónico.
Otro aspecto útil de la documentación del bloqueo de nervios periféricos es la grabación de una imagen de ultrasonido o un videoclip, que se almacenará como una copia impresa en el expediente del paciente o como una copia digital en el registro de salud electrónico (EHR) o en un disco duro seguro separado. Esto no solo es una buena práctica desde el punto de vista médico-legal, sino que también es un paso obligatorio que debe tomarse si el médico desea facturar por el uso de la guía por ultrasonido. Cualquier copia impresa debe tener una etiqueta de identificación del paciente adjunta, la fecha registrada y cualquier hallazgo pertinente resaltado con un marcador, como la aplicación de anestesia local alrededor del nervio. Ejemplos adicionales de documentación altamente práctica de bloqueo de nervios esenciales y procedimientos de anestesia espinal se muestran en Figuras 9 y 10, respectivamente.
| Características útiles de un procedimiento de bloqueo de nervio periférico Nota | Ejemplo |
|---|---|
| Elementos que guían al médico para cumplir con un estándar de atención dado | Un espacio para indicar el uso de epinefrina en la solución anestésica local o si no se usó, por qué no |
| Un compromiso entre la eficiencia y la capacidad de individualización | Información registrada utilizando casillas de verificación y espacios en blanco |
| Documentación para protegerse contra los desafíos médico-legales comunes | El médico debe indicar el nivel de conciencia del paciente. |
| Documentación de cumplimiento con las agencias reguladoras (p. ej., Comisión Conjunta) | Las casillas de verificación indican lateralidad |
| Elementos para facilitar una facturación exitosa | Idioma requerido por muchas compañías de seguros que indican el bloque solicitado específicamente por el cirujano |
| Documentación de los médicos involucrados y en qué capacidad | ¿El asistente era el individuo que realizaba el bloqueo o estaba él o ella dirigiendo médicamente a un residente? |
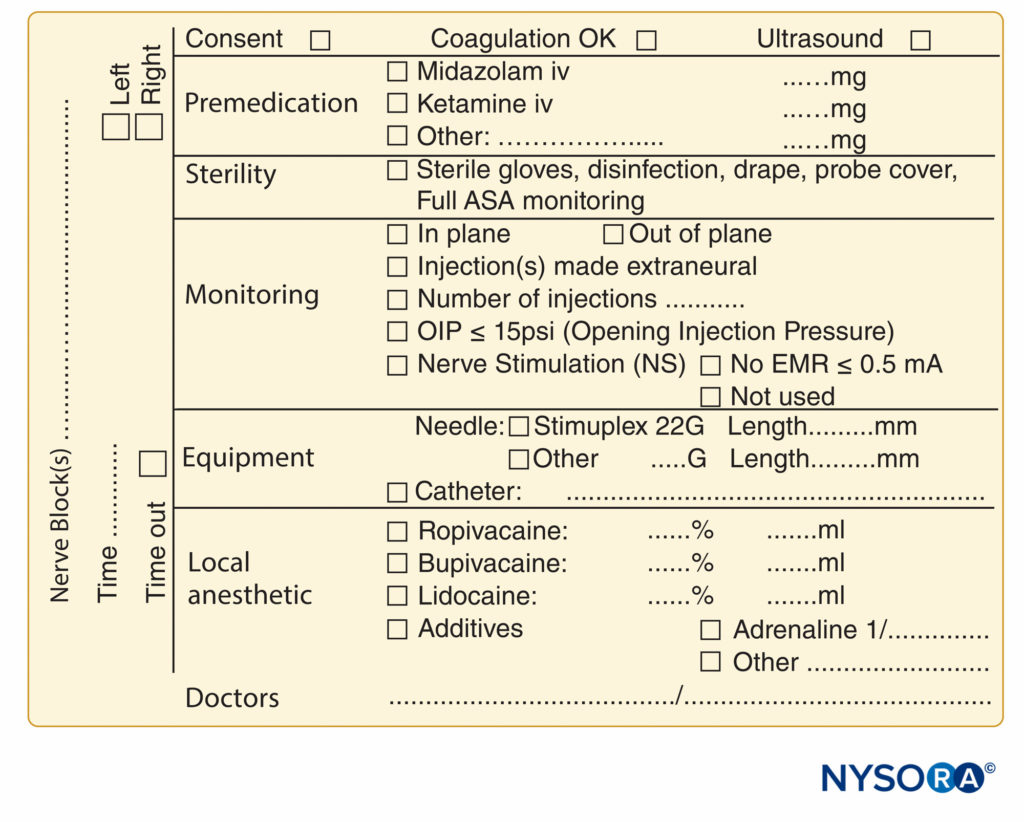
FIGURA 9. Elementos esenciales de la documentación de los procedimientos de bloqueo de nervios periféricos utilizados en NYSORA-Europe CREER (Centro de investigación, educación y recuperación mejorada de la cirugía ortopédica) en ZOL (Ziekenhuis Oost-Limburg), Genk, Bélgica.
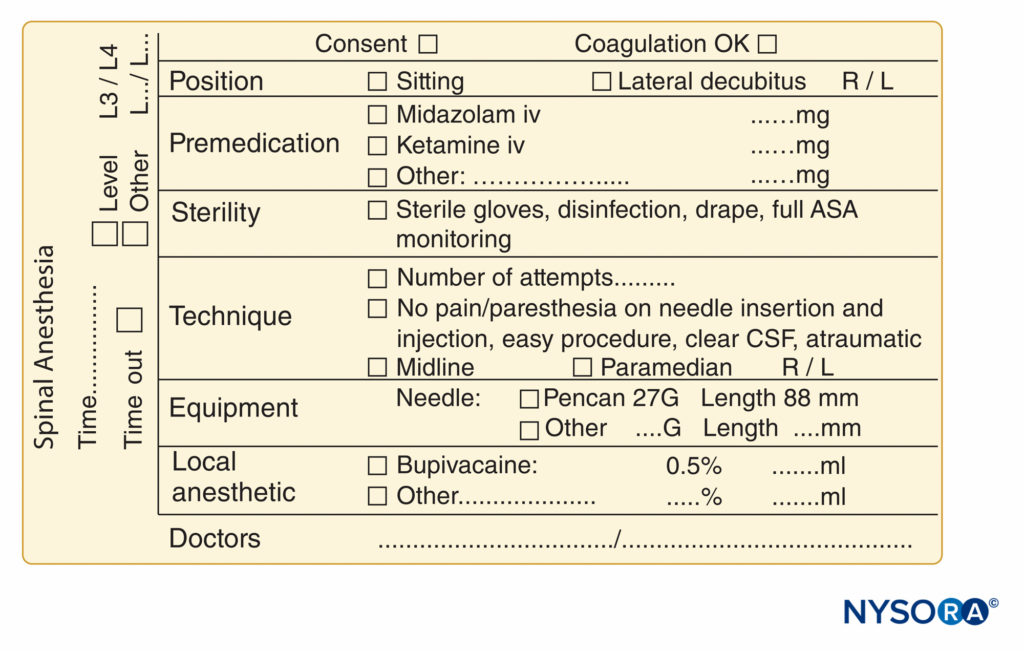
FIGURA 10. Elementos esenciales de la documentación de los procedimientos de anestesia espinal utilizados en NYSORA-Europe CREER (Centro de Investigación, Educación y Recuperación Mejorada de la Cirugía Ortopédica) en ZOL (Ziekenhuis Oost-Limburg), Genk, Bélgica.
Consentimiento Informado
La documentación del consentimiento informado es un aspecto importante de la práctica de la anestesia regional. Los patrones de práctica varían ampliamente en este tema y, a menudo, no se obtiene el consentimiento específico por escrito para los procedimientos de bloqueo nervioso. Sin embargo, la documentación escrita de este proceso puede ser importante por varias razones:
- Los pacientes suelen estar distraídos y ansiosos el día de la cirugía (cuando se obtienen muchos consentimientos) y es posible que no recuerden los detalles de una conversación con su anestesiólogo. Los estudios han demostrado que un registro escrito del proceso de consentimiento informado mejora el recuerdo del paciente de los riesgos y beneficios.
- Un consentimiento por escrito establece que se produjo una discusión de riesgos y beneficios entre el paciente y el médico.
- Un documento específico para la anestesia regional se puede adaptar para incluir todos los riesgos comunes y graves; esto le permite al médico explicárselos al paciente como una cuestión de rutina y reduce la posibilidad de omitir riesgos importantes.
Los siguientes consejos se pueden utilizar para maximizar el proceso de consentimiento:
| Sugerencias para mejorar el proceso de consentimiento. |
|---|
| Ser breve. Una explicación simple y breve ayuda a recordar los riesgos y beneficios más que los párrafos extensos. |
| Incluya no solo los riesgos graves y mayores, sino también los beneficios y los resultados esperados del procedimiento anestésico regional propuesto. Es difícil para los pacientes tomar una decisión informada si solo se discuten los riesgos. |
| Utilice el proceso de consentimiento como un medio para educar al paciente simultáneamente. |
| Ofrezca una copia del formulario al paciente. Se ha demostrado que esto ayuda a recordar la información relacionada con el consentimiento. |
Referencias
- Buhre W, Rossaint R: Manejo perioperatorio y monitoreo en anestesia. Lancet 2003;362:1839–1846.
- Guinard JP, Mulroy MF, Carpenter RL, Knopes KD: Dosis de prueba: contenido óptimo de epinefrina con y sin bloqueo beta-adrenérgico agudo. Anestesiología 1990;73:386–392.
- Tanaka M, Sato M, Kimura T, Nishikawa T: La eficacia de la dosis de prueba intravascular simulada en pacientes sedados. Anesth Analg 2001;93: 1612–1617, índice.
- Karmakar MK, Ho AM-H, Law BK, Wong ASY, Shafer SL, Gin T: Farmacocinética arterial y venosa de la ropivacaína con y sin epinefrina después del bloqueo paravertebral torácico. Anestesiología 2005;103:704–711.
- Van Obbergh LJ, Roelants FA, Veyckemans F, Verbeeck RK: En niños, la adición de epinefrina modifica la farmacocinética de la ropivacaína inyectada caudalmente. Can J Anaesth 2003;50:593–598.
- Neal JM: Efectos de la epinefrina en los anestésicos locales sobre los sistemas nerviosos central y periférico: neurotoxicidad y flujo sanguíneo neural. Reg Anesth Pain Med 2003;28:124–134.
- Sitios BD, Taenzer AH, Herrick MD, et al: Incidencia de toxicidad sistémica anestésica local y síntomas neurológicos posoperatorios asociados con 12,668 bloqueos nerviosos guiados por ultrasonido: un análisis de un registro clínico prospectivo. Reg Anesth Pain Med 2012;37(5):478–482.
- Perlas A, Niazi A, McCartney C, Chan V, Xu D, Abbas S: La sensibilidad de la respuesta motora a la estimulación nerviosa y parestesia para la localización nerviosa evaluada por ultrasonido. Reg Anesth Pain Med 2006;31:445–450.
- Chan VWS, Brull R, McCartney CJL, Xu D, Abbas S, Shannon P: Un estudio ultrasonográfico e histológico de inyección intraneural y estimulación eléctrica en cerdos. Anesth Analg 2007;104:1281–1284, índice.
- Robards C, Hadzic A, Somasundaram L, et al: Inyección intraneural con estimulación de baja corriente durante el bloqueo del nervio ciático poplíteo. Anesth Analg 2009;109:673–677.
- Voelckel WG, Klima G, Krismer AC, et al: Signos de inflamación después del bloqueo del nervio ciático en cerdos. Anesth Analg 2005;101:1844–1846.
- Tsai TP, Vuckovic I, Dilberovic F, et al: La intensidad de la corriente estimulante puede no ser un indicador fiable de la colocación de la aguja intraneural. Reg Anesth Pain Med 2008;33:207–210.
- Bigeleisen PE, Moayeri N, Groen GJ: Umbrales de estimulación extraneural versus intraneural durante el bloqueo supraclavicular guiado por ecografía. Anestesiología 2009;110:1235–1243.
- Wiesmann T, Bornträger A, Vassiliou T, et al: La intensidad de corriente mínima para provocar una respuesta motora provocada no puede discernir entre el contacto entre la aguja y el nervio y la inserción de la aguja intraneural. Anesth Analg 2014;118:681–686.
- Steinfeldt T, Graf J, Schneider J, et al: Consecuencias histológicas del contacto entre la aguja y el nervio después de la estimulación nerviosa en un modelo porcino. Anesthesiol Res Pract 2011;2011:591851.
- Steinfeldt T, Poeschl S, Nimphius W, et al: avance forzado de la aguja durante el contacto entre la aguja y el nervio en un modelo porcino: resultado histológico. Anesth Analg 2011;113:417–420.
- Gadsden J, Latmore M, Levine DM, Robinson A: La presión de inyección de apertura alta se asocia con el contacto entre la aguja y el nervio y entre la aguja y la fascia durante el bloqueo del nervio femoral. Reg Anesth Pain Med 2016;41(1):50–55.
- Hogan QH: Fisiopatología de la lesión del nervio periférico durante la anestesia regional. Reg Anesth Pain Med 2008;33:435–441.
- Whitlock EL, Brenner MJ, Fox IK, Moradzadeh A, Hunter DA, Mackinnon SE: Lesión por inyección de nervio periférico inducida por ropivacaína en el modelo de roedores. Anesth Analg 2010;111(1):214–220.
- Sala-Blanch X, Ribalta T, Rivas E, et al: Lesión estructural del nervio ciático humano después de la inserción de una aguja intraneural. Reg Anesth Pain Med 2009;34:201–205.
- Hadzic A, Dilberovic F, Shah S, et al: La combinación de inyección intraneural y alta presión de inyección conduce a lesiones fasciculares y déficits neurológicos en perros. Reg Anesth Pain Med 2004;29:417–423.
- Gauss A, Tugtekin I, Georgieff M, Dinse-Lambracht A, Keipke D, Gorsewski G: Incidencia de neumotórax clínicamente sintomático en el bloqueo del plexo braquial infraclavicular y supraclavicular guiado por ecografía. Anestesia 2014;69:327–336.
- Russon K, Blanco R: Inyección intraneural accidental en el nervio musculocutáneo visualizado con ultrasonido. Anesth Analg 2007;105:1504–1505, índice.
- Schafhalter-Zoppoth I, Zeitz ID, Gray AT: Empalamiento involuntario del nervio femoral e inyección intraneural visualizados por ultrasonido. Anesth Analg 2004;99:627–628.
- Loubert C, Williams SR, Hélie F, Arcand G: Complicación durante el bloqueo regional guiado por ecografía: inyección intravascular accidental de anestésico local. Anestesiología 2008;108:759–760.
- Vadeboncouer T, Weinberg G, Oswald S, Angelov F: Detección temprana de inyección intravascular durante el bloqueo del plexo braquial supraclavicular guiado por ecografía. Reg Anesth Pain Med 2008;33:278–279.
- Martínez Navas A, DE LA Tabla González RO: La técnica guiada por ultrasonido permitió la detección temprana de inyección intravascular durante un bloqueo de plexo braquial infraclavicular. Acta Anaesthesiol Scand 2009;53:968–970.
- Barrington MJ, Kluger R: La guía por ultrasonido reduce el riesgo de toxicidad sistémica del anestésico local después del bloqueo de los nervios periféricos. Reg Anesth Pain Med 2013;38:289–297.
- Orebaugh SL, Kentor ML, Williams BA: Resultados adversos asociados con bloqueos de nervios periféricos guiados por estimulador nervioso y guiados por ultrasonido por parte de aprendices supervisados: actualización de una base de datos de un solo sitio. Reg Anesth Pain Med 2012;37:577–582.
- Casati A, Baciarello M, Di Cianni S, et al: Efectos de la guía por ultrasonido sobre el volumen anestésico efectivo mínimo requerido para bloquear el nervio femoral. Hermano J Anaesth 2007;98:823–827.
- Sandhu NS, Bahniwal CS, Capan LM: Viabilidad de un bloqueo infraclavicular con un volumen reducido de lidocaína con guía ecográfica. J Ultrasonido Med 2006;25:51–56.
- Vandepitte C, Gautier P, Xu D, Salviz EA, Hadzic A: volumen efectivo de ropivacaína al 0.75 % a través de un catéter necesario para el bloqueo interescalénico del plexo braquial. Anestesiología 2013;118:863–867.
- Riazi S, Carmichael N, Awad I, Holtby RM, McCartney CJL: Efecto del volumen de anestésico local (20 frente a 5 ml) sobre la eficacia y las consecuencias respiratorias del bloqueo interescalénico del plexo braquial guiado por ecografía. Hermano J Anaesth 2008;101:549–556.
- O'Donnell B, Riordan J, Ahmad I, Iohom G: Informes breves: una evaluación clínica de las características del bloqueo utilizando un mililitro de lidocaína al 2% en el bloqueo del plexo braquial axilar guiado por ecografía. Anesth Analg 2010;111:808–810.
- Krediet AC, Moayeri N, Bleys RLAW, Groen GJ: Intraneural o extraneural: precisión diagnóstica de la evaluación por ultrasonido para localizar la inyección de bajo volumen. Reg Anesth Pain Med 2014;39:409–413.
- Liu SS, YaDeau JT, Shaw PM, Wilfred S, Shetty T, Gordon M: Incidencia de inyección intraneural no intencional y complicaciones neurológicas posoperatorias con bloqueos nerviosos interescalénicos y supraclaviculares guiados por ecografía. Anestesia 2011;66:168–174.
- Hara K, Sakura S, Yokokawa N, Tadenuma S: Incidencia y efectos de la inyección intraneural no intencional durante el bloqueo del nervio ciático subglúteo guiado por ecografía. Reg Anesth Pain Med 2012;37:289–293.
- Bigeleisen PE: la punción del nervio y la aparente inyección intraneural durante el bloqueo axilar guiado por ecografía no invariablemente resultan en una lesión neurológica. Anestesiología 2006;105:779–783.
- Selander D, Dhunér KG, Lundborg G: lesión de nervio periférico debido a agujas de inyección utilizadas para anestesia regional. Un estudio experimental de los efectos agudos del traumatismo por punta de aguja. Acta Anaesthesiol Scand 1977;21:182–188.
- Orebaugh SL, Mukalel JJ, Krediet AC, et al: Inyección en la raíz del plexo braquial en un modelo de cadáver humano: distribución de la inyección y efectos en el neuroeje. Reg Anesth Pain Med 2012;37:525–529.
- Krol A, Szarko M, Vala A, De Andres J: Monitoreo de presión de inyecciones intraneurales y perineurales en los nervios mediano, radial y cubital: lecciones de un estudio cadavérico. Anesth Pain Med 2015;5:e22723.
- Gadsden JC, Choi JJ, Lin E, Robinson A: La presión de inyección de apertura detecta constantemente el contacto entre la aguja y el nervio durante el bloqueo del plexo braquial interescalénico guiado por ecografía. Anestesiología 2014;120: 1246–1253.
- Claudio R, Hadzic A, Shih H, et al: Presiones de inyección realizadas por anestesiólogos durante el bloqueo nervioso periférico simulado. Reg Anesth Pain Med 2004;29:201–205.
- Theron PS, Mackay Z, Gonzalez JG, Donaldson N, Blanco R: Un modelo animal de "sensación de jeringa" durante el bloqueo de nervios periféricos. Reg Anesth Pain Med 2009;34:330–332.
- Tsui BCH, Knezevich MP, Pillay JJ: Presiones de inyección reducidas mediante una técnica de inyección de aire comprimido (CAIT): un estudio in vitro. Reg Anesth Pain Med 2008;33:168–173.
- Patil J, Ankireddy H, Wilkes A, Williams D, Lim M: Un manómetro improvisado para inyecciones de anestesia/bloqueo nervioso regional: un estudio inicial. J Clin Monit Comput 2015. doi:10.1007/s10877-015-9701-z.
- Gadsden JC, Lindenmuth DM, Hadzic A, Xu D, Somasundarum L, Flisinski KA: El bloqueo del plexo lumbar con inyección de alta presión conduce a la propagación contralateral y epidural. Anestesiología 2008;109: 683–688.
- Gautier P, Vandepitte C, Schaub I, et al: La disposición de radiocontraste en el espacio interescalénico en voluntarios sanos. Anesth Analg 2015;120:1138–1141.
- Gerancher JC, Grice SC, Dewan DM, Eisenach J: Una evaluación del consentimiento informado antes de la analgesia epidural para el trabajo de parto y el parto. Int J Obstet Anesth 2000;9:168–173.