Malikah Latmore, Matthew Levine y Jeff Gadsden
INTRODUCCIÓN
Los pacientes con enfermedad sistémica coexistente pueden tener un mayor riesgo de complicaciones perioperatorias específicas relacionadas con la cirugía y la anestesia. A menudo se piensa que la anestesia regional es especialmente beneficiosa para los pacientes. Sin embargo, los cambios fisiológicos que ocurren con algunas técnicas de anestesia regional deben entenderse y verse dentro del contexto de la fisiopatología de un paciente individual para que la técnica utilizada brinde el máximo beneficio al paciente y reduzca el riesgo de complicaciones. Este capítulo se centra en la fisiopatología de las enfermedades sistémicas a las que se enfrenta con frecuencia el anestesiólogo regional y analiza la interacción entre las técnicas comunes de anestesia regional y la enfermedad del paciente.
ENFERMEDAD PULMONAR
Los pacientes quirúrgicos con insuficiencia pulmonar coexistente tienen riesgo de complicaciones pulmonares intraoperatorias o posoperatorias, independientemente de la técnica anestésica. Un creciente cuerpo de evidencia sugiere que la anestesia regional puede estar asociada con mejores resultados pulmonares en comparación con la anestesia general. Sin embargo, el bloqueo anestésico regional puede conllevar riesgos en algunos pacientes. Una comprensión profunda de la fisiología respiratoria y las implicaciones de las técnicas de anestesia regional es crucial para el uso seguro y eficaz de la anestesia regional en estos pacientes.
Anestesia epidural y espinal
La mayoría de los efectos pulmonares de la anestesia neuroaxial se deben al bloqueo motor de la musculatura intercostal y abdominal. Si se produce una captación sistémica significativa del anestésico local, también se puede observar cierta depresión respiratoria mioneural directa y central, aunque esto juega un papel menor en general. Dado que la anestesia neuroaxial produce un bloqueo “diferencial” de fibras motoras, sensitivas y autonómicas, el grado de deterioro de la función respiratoria depende de la extensión relativa del bloqueo motor segmentario. El uso de concentraciones diluidas de anestésico local epidural puede proporcionar un bloqueo sensorial adecuado hasta los niveles cervicales, al mismo tiempo que se preserva la función motora de los músculos respiratorios en los segmentos somáticos inferiores. La parálisis diafragmática (bloqueo del nervio frénico, C3-C5) en ausencia de anestesia espinal total no ocurre con el bloqueo neuroaxial, ya que incluso un bloqueo sensorial tan alto como C3 solo producirá un bloqueo motor aproximadamente en T1 a T3. Lo más probable es que la apnea que sigue a la anestesia neuroaxial alta se deba a la hipoperfusión del tronco encefálico como resultado de la hipotensión y es poco probable que esté relacionada con el bloqueo del nervio frénico. La respiración espontánea regresa después de la reanimación con volumen adecuado y/o terapia vasopresora.
Consejos NYSORA
- La apnea asociada con un anestésico espinal alto se relaciona con mayor frecuencia con la hipotensión y la hipoperfusión del tronco del encéfalo, más que con el bloqueo motor de las raíces nerviosas que inervan el nervio frénico (C3-5).
- La estrategia clave de reanimación es apoyar la ventilación mientras se mantiene la presión arterial con líquidos y terapia vasopresora.
Con un alto nivel de anestesia epidural o espinal, la musculatura de la pared torácica y los músculos intercostales pueden verse afectados. Esto puede incluso resultar en un movimiento alterado de la pared torácica durante la respiración espontánea. Durante la anestesia neuroaxial alta, la pared torácica más complaciente se retrae durante la inspiración y en realidad puede mostrar un movimiento paradójico de la caja torácica. Algunos, sin embargo, han encontrado que el bloqueo epidural a los niveles sensoriales de T6 o incluso T1 puede aumentar la contribución de la expansión de la pared torácica al volumen corriente. Esto puede explicarse por un bloqueo motor incompleto de los músculos intercostales altos o por el papel compensador que juegan los músculos “accesorios” de la respiración, como los músculos escalenos anterior y medio.
La anestesia epidural lumbar no afecta la ventilación por minuto en reposo, el volumen corriente ni la frecuencia respiratoria. Asimismo, la capacidad residual funcional (FRC) y la capacidad de cierre parecen permanecer relativamente sin cambios durante la anestesia epidural lumbar. Pruebas de función respiratoria dependientes del esfuerzo, como el volumen espiratorio forzado en un segundo (FEV1), la capacidad vital forzada y el flujo espiratorio máximo muestran disminuciones moderadas en el contexto del bloqueo epidural lumbar, lo que refleja la dependencia de estos índices en la musculatura intercostal y abdominal. Esta disminución de la función pulmonar aumenta proporcionalmente a medida que el bloqueo avanza en dirección cefálica desde las regiones lumbares inferiores a las superiores.
La anestesia epidural torácica no tiene efecto sobre la ventilación por minuto, el volumen corriente o la frecuencia respiratoria, pero produce una disminución modesta de la capacidad vital (VC), FEVXNUMX.1, capacidad pulmonar total y tasa máxima de flujo medioespiratorio (Tabla 1). Incluso la anestesia epidural cervical baja/torácica alta (C4-T9) en pacientes con enfermedad pulmonar obstructiva crónica (EPOC) grave que se someten a cirugía mamaria produce solo una disminución muy leve del VEFXNUMX1. Un estudio de voluntarios encontró que la anestesia epidural torácica alta (nivel sensorial T1) condujo a un aumento en la FRC de aproximadamente un 15 % sin cambios en el volumen corriente o la frecuencia respiratoria. Este hallazgo un tanto sorprendente puede explicarse por dos mecanismos propuestos por los investigadores. Primero, la mayoría de los voluntarios exhibieron una disminución en el volumen sanguíneo intratorácico, un fenómeno fisiológico confirmado por Arndt y colegas. En segundo lugar, el estudio también encontró que la posición del diafragma al final de la espiración se desplazó caudalmente, lo que puede estar relacionado con un aumento relativo en la actividad tónica diafragmática o una reducción en la presión intraabdominal.
TABLA 1. El efecto de la anestesia epidural en los volúmenes y la mecánica del respirador.
| VC | TLC | FRC | VT | RR | MV | FEV1 | FVC | ||
|---|---|---|---|---|---|---|---|---|---|
| LEA | ↔ | ↔ | ↔ | ↔ | ↔ | ↔ | ↓ | ↓ | ↓ |
| TEA | ↓ | ↓ | ↑ | ↔ | ↔ | ↔ | ↓ | ↓ | ↓ |
La anestesia epidural cervical reduce la CV y el FEV1 en un grado similar al de las epidurales torácicas altas que se extienden a niveles cervicales inferiores. Los estudios en pacientes sanos han demostrado una reducción del 15 al 30 % en la CV y el FEVXNUMX.1 con epidurales cervicales (bloqueo sensorial de C2) que varió según el nivel y la concentración del anestésico local.
La respuesta ventilatoria a la hipercarbia y la hipoxia se conserva con anestesia neuroaxial. Las presiones parciales de oxígeno (Po2) y dióxido de carbono (Pco2) prácticamente no cambian durante la anestesia epidural o raquídea. Además, el tono broncomotor no se altera de manera significativa, a pesar de las preocupaciones teóricas sobre la broncoconstricción secundaria a la simpatolisis. De hecho, la anestesia epidural se ha utilizado con éxito en pacientes de alto riesgo con EPOC y asma sometidos a operaciones abdominales.
Se ha demostrado que la anestesia neuroaxial en varios entornos conduce a una reducción de las complicaciones pulmonares posoperatorias en comparación con la anestesia general. Perlas y sus colegas informaron una asociación entre la anestesia espinal y una mortalidad más baja a los 30 días. Las razones detrás de esto probablemente sean multifactoriales, debido en parte a una analgesia superior, deterioro diafragmático reducido, respuesta alterada al estrés y una menor incidencia de hipoxemia posoperatoria. La anestesia epidural proporciona un mejor control del dolor que la anestesia general con opiáceos posoperatorios para cirugía abdominal y torácica, lo que conduce a una menor ferulización, un mecanismo de tos más efectivo y volúmenes pulmonares posoperatorios preservados, incluidos FRC y VC. Un estudio que comparó directamente la anestesia epidural y general en pacientes de alto riesgo concluyó que los resultados generales, incluida la necesidad de ventilación postoperatoria prolongada, mejoraron con la técnica regional. Otro ensayo en pacientes sometidos a cirugía vascular de miembros inferiores informó una reducción de más del 50 % en la incidencia de insuficiencia respiratoria en el grupo asignado al azar a anestesia epidural.
Los pacientes que se someten a reparación de fracturas de cadera también se benefician de la anestesia regional. Neumann et al. comparó la anestesia neuroaxial con la general para la reparación de fracturas de cadera en más de 18,000 25 pacientes y encontró una reducción del 141 % en las complicaciones pulmonares en aquellos que recibieron técnicas neuroaxiales. Un metanálisis de 9000 ensayos aleatorizados (incluidos más de 55 pacientes) que compararon la anestesia regional y general para la cirugía de cadera mostró una reducción del riesgo de embolia pulmonar, neumonía y depresión respiratoria del 39 %, 59 % y XNUMX %, respectivamente, con la anestesia regional. Curiosamente, estos resultados no cambiaron independientemente de si la anestesia neuroaxial se continuó en el período posoperatorio, lo que ilustra que el efecto beneficioso de la anestesia epidural y espinal sobre la fisiología pulmonar ocurre, al menos en parte, en el momento de la agresión quirúrgica.
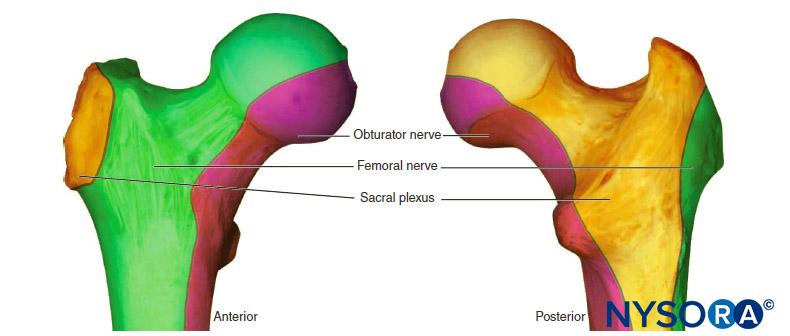
Bloque del plexo braquial
En ausencia de complicaciones raras como el neumotórax, cualquier alteración en la mecánica respiratoria que se observe con el bloqueo del plexo braquial se debe principalmente al bloqueo del nervio frénico y a la parálisis hemidiafragmática.Figura 1 y XNUMX). Se ha demostrado que esto ocurre en el 100 % de los pacientes que reciben bloqueo interescalénico cuando se realiza sin guía ecográfica y utilizando entre 34 y 52 ml de anestésico local. Cuando ocurre paresia diafragmática, hay una reducción asociada del 27% tanto en la FVC como en el FEVXNUMX.1. Si bien la importancia clínica de esta reducción en pacientes sanos no está del todo clara, puede ser útil estratificar el riesgo de los pacientes a punto de someterse a bloqueos interescalénicos como lo haría un paciente sometido a una resección pulmonar. En otras palabras, formule la pregunta: "¿Tolerará este paciente un FEV perioperatorio?"1 reducción del 27%?”
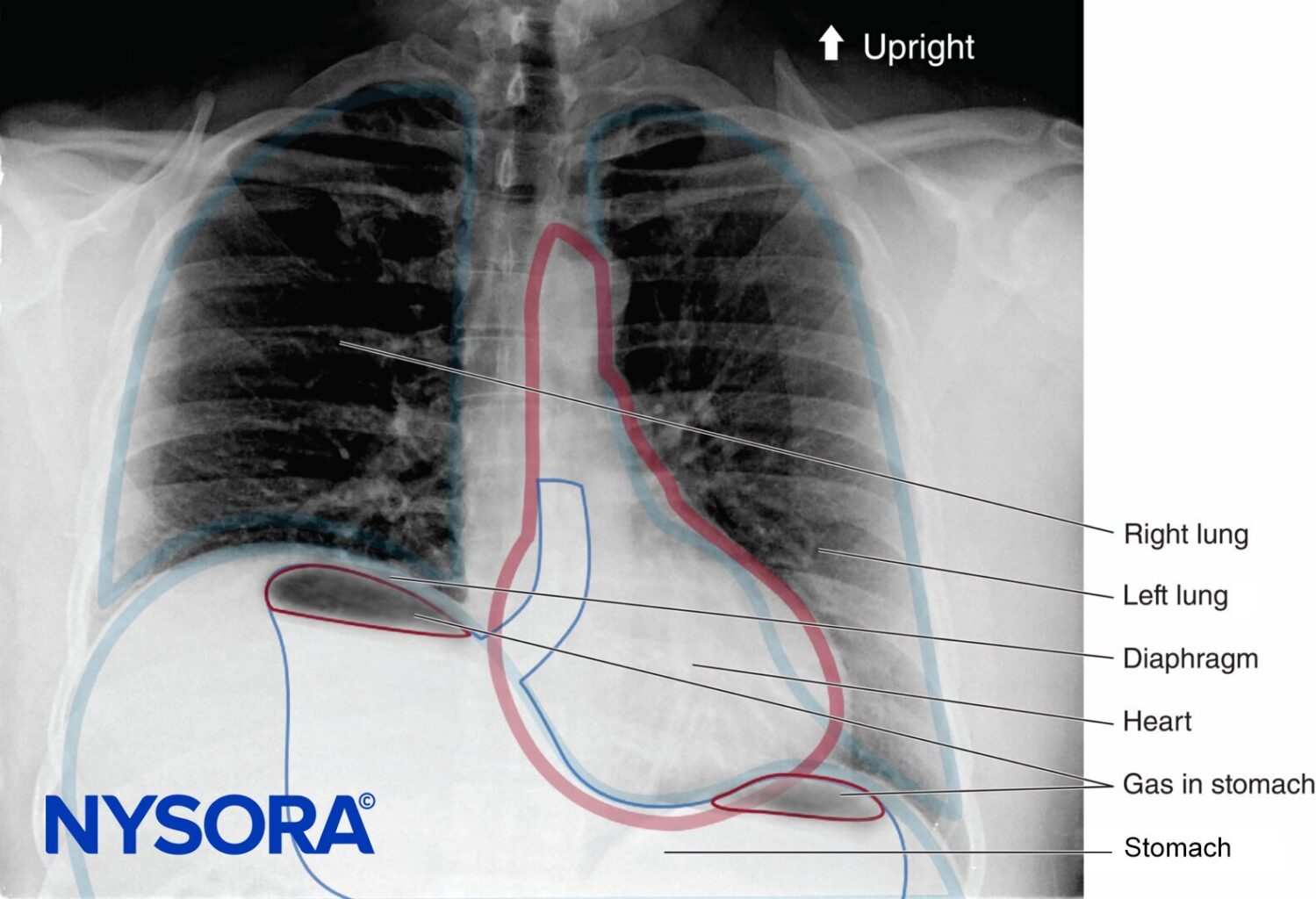
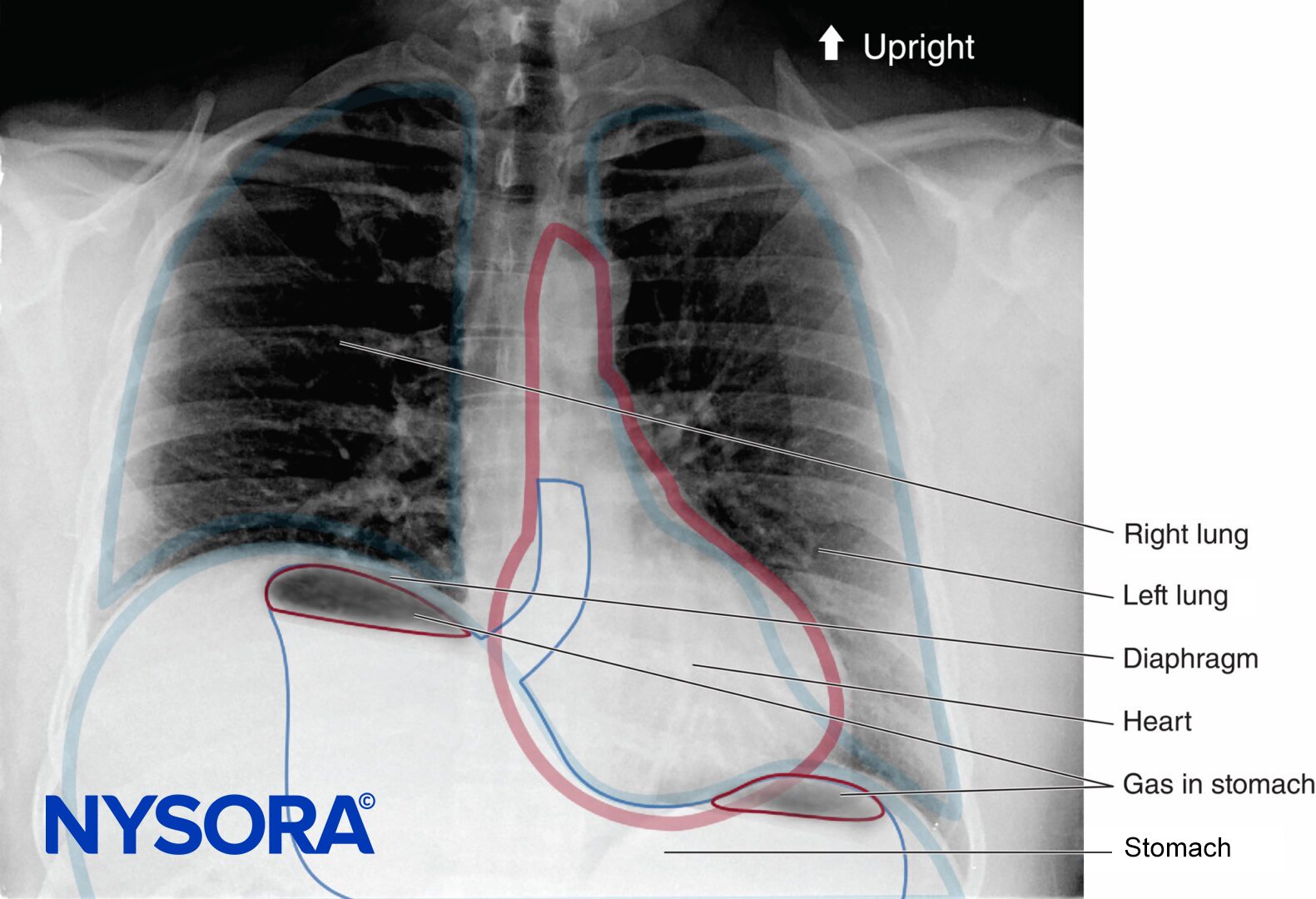
FIGURA 48-1. Radiografía de tórax en posición vertical de un paciente sometido a un bloqueo interescalénico del plexo braquial derecho. Obsérvese el hemidiafragma derecho elevado.
Algunos investigadores han intentado reducir la incidencia de parálisis del nervio frénico disminuyendo el volumen de anestésico local. Sin embargo, Sinha et al. no encontraron reducción en la incidencia de paresia hemidiafragmática (medida por ultrasonido) cuando el volumen de ropivacaína al 0.5% se redujo de 20 ml a 10 ml. Otros han informado que la reducción del volumen a 5 ml disminuye la incidencia en un 45 % a 50 % y da como resultado una disminución significativa del FEVXNUMX.1 y flujo espiratorio máximo (PEF). Los volúmenes bajos de anestésico local no garantizan la preservación de la función del nervio frénico. Se ha informado compromiso respiratorio clínicamente significativo que requiere intubación traqueal después de un bloqueo del plexo braquial interescalénico utilizando un volumen de 3 ml de mepivacaína al 2%.
Consejos NYSORA
- El bloqueo interescalénico con volúmenes bajos (≤ 5 ml) de anestésico local puede reducir, pero no eliminar, el riesgo de bloqueo frénico y paresia diafragmática.
- Por lo tanto, el bloqueo interescalénico del plexo braquial debe evitarse en pacientes que no pueden tolerar una disminución del 25% en la función respiratoria.
El riesgo de bloqueo del nervio frénico disminuye a medida que se avanza más distalmente a lo largo del plexo. El abordaje axilar del plexo braquial no tiene efecto sobre la función del diafragma y presenta una buena opción para aquellos pacientes con reserva pulmonar marginal (es decir, que no pueden tolerar una reducción del 27% en la función pulmonar). Por otro lado, el bloqueo supraclavicular se ha asociado tradicionalmente con una incidencia del 50-67% de parálisis hemidiafragmática, aunque estudios recientes han demostrado que con guía ecográfica la incidencia puede llegar a ser cero. El abordaje infraclavicular probablemente esté lo suficientemente alejado del trayecto del nervio frénico como para evitar el diafragma,40,41 aunque existen reportes de casos de afectación del nervio frénico.42,43 Estas discrepancias probablemente se relacionan con los diferentes abordajes del bloqueo infraclavicular; por ejemplo, el “bloqueo coracoideo” se realiza con un sitio de punción relativamente lateral o distal, mientras que el bloqueo infraclavicular vertical comienza en una ubicación más medial. También puede haber algunas variaciones anatómicas en el trayecto del nervio frénico, como un nervio frénico accesorio, que lo haría más susceptible de bloquearse en los niveles más distales del plexo braquial.44
Aunque los bloqueos infraclavicular o axilar pueden ser deseables por sus perfiles de preservación pulmonar relativa, tienen la desventaja de proporcionar una anestesia incompleta para el hombro y requieren un mayor grado de experiencia para realizarlos. Sin embargo, se han empleado soluciones creativas para solucionar este problema. Martinez y sus colegas combinaron un bloqueo infraclavicular con un bloqueo del nervio supraescapular para la cirugía emergente de la cabeza humeral en un paciente con asma aguda y un FEVXNUMX inicial1 de 1.13 L (32% previsto). También se ha sugerido la combinación de bloqueos axilares y supraescapulares como alternativa al bloqueo interescalénico. Por lo tanto, una selección cuidadosamente considerada de bloqueos de nervios periféricos puede proporcionar una anestesia completa de la extremidad superior y evitar complicaciones respiratorias en pacientes con enfermedad pulmonar.
Los bloqueos continuos del plexo braquial con catéteres perineurales pueden extender los beneficios del bloqueo del plexo al período posoperatorio y reducir el dolor posoperatorio, los requisitos de opioides orales y sus efectos secundarios, y los trastornos del sueño después de la cirugía de hombro. Sin embargo, ha habido informes de complicaciones atribuidas a la paresia prolongada del nervio frénico que puede ocurrir con esta técnica. Estos han incluido dolor torácico, atelectasia, derrame pleural y disnea. Esto es especialmente preocupante porque muchos pacientes son dados de alta con catéteres y es posible que no tengan acceso a una intervención oportuna en caso de que surjan estas complicaciones. Por otro lado, el grado de deterioro respiratorio clínicamente significativo con el bloqueo interescalénico continuo varía entre los pacientes y, de hecho, el bloqueo interescalénico puede tolerarse bien, en especial si se usan concentraciones relativamente diluidas de anestésico local que proporcionan solo un bloqueo parcial del nervio frénico. Maurer et al. informaron el caso de un paciente sin enfermedad pulmonar preexistente que se sometió a una artroplastia de hombro bilateral con bloqueo interescalénico continuo bilateral combinado y anestesia general. La analgesia postoperatoria se mantuvo en el hospital durante 72 horas a través de los catéteres con infusiones de 7 mL/h de ropivacaína al 0.2% por cada lado (total 14 mL/h). A pesar de una marcada reducción posoperatoria en la FVC (60 %) desde el inicio, así como evidencia ecográfica de deterioro diafragmático, el paciente tuvo un curso posoperatorio sin incidentes (con analgesia excelente) y una buena recuperación. Este ejemplo anecdótico ilustra que la importancia clínica de la paresia frénica en pacientes con buena función respiratoria es cuestionable. Sin embargo, el uso de técnicas continuas de plexo braquial debe ser cuidadosamente considerado en pacientes con enfermedad pulmonar preexistente, especialmente si van a ser dados de alta con los catéteres colocados. Otras complicaciones que pueden tener implicaciones pulmonares incluyen la migración del catéter interpleural, epidural o incluso intratecal y la irritación del nervio frénico.
Consejos NYSORA
- Las consecuencias clínicas del frénico en pacientes con función respiratoria normal suelen ser asintomáticas o leves.
- El uso de técnicas continuas del plexo braquial debe considerarse cuidadosamente en pacientes con enfermedad pulmonar significativa preexistente.
- Cuando esté indicado, el catéter puede administrarse en bolo con una pequeña cantidad de anestésico local de acción corta (p. ej., cloroprocaína al 2 %, 5 ml) para evaluar el efecto sobre la función respiratoria antes de usar anestésicos locales de acción prolongada.
- En pacientes sintomáticos con catéter permanente, una inyección de NaCl al 0.9% puede acortar la duración del bloqueo frénico (y del plexo braquial) ("lavado").
Bloqueos de nervios paravertebrales e intercostales
Varios estudios han investigado los efectos de los bloqueos paravertebrales e intercostales sobre la función pulmonar en pacientes con fracturas costales o sometidos a toracotomía. Se ha demostrado que el bloqueo intercostal mejora la saturación arterial de oxígeno (Sao2) y la tasa de flujo espiratorio máximo (PEFR) en pacientes con fracturas traumáticas de costillas asociadas con dolor intenso. Además de una función pulmonar mejorada, algunos estudios encontraron un control del dolor significativamente mejorado y una estancia hospitalaria más corta después de la colocación del catéter intercostal. Del mismo modo, Kar-makar y los co-investigadores encontraron que el bloqueo paravertebral continuo durante un período de cuatro días en pacientes con múltiples costillas fracturadas condujo a una mejora significativa en la frecuencia respiratoria, FVC, PEFR, Sao2, y la relación entre la presión parcial de oxígeno y la fracción de oxígeno inspirado (Pao2:fio2). Estos hallazgos probablemente estén relacionados con el efecto favorable de la analgesia en los esfuerzos respiratorios del paciente y la mejora de la mecánica respiratoria, lo que facilita la desconexión del soporte del ventilador y el regreso a las actividades de la vida diaria en pacientes que de otro modo estaban angustiados por sus lesiones.
Los bloqueos paravertebrales son eficaces para el tratamiento del dolor después de una toracotomía y pueden mejorar significativamente la espirometría posoperatoria. Una revisión de 55 ensayos controlados aleatorios de técnicas analgésicas después de una toracotomía posterolateral reveló que el bloqueo paravertebral fue el método que mejor preservó la función pulmonar en comparación con la analgesia intercostal o epidural. Los resultados combinados mostraron una preservación promedio de aproximadamente el 75 % de la función pulmonar preoperatoria cuando se usó analgesia paravertebral frente al 55 % para la analgesia intercostal y epidural. Además, Davies et al demostraron que incluso cuando se obtuvo una analgesia comparable con el bloqueo paravertebral y la epidural torácica, el perfil de efectos secundarios con el bloqueo paravertebral fue significativamente mejor, lo que resultó en menos complicaciones pulmonares y menos hipotensión, náuseas y retención urinaria. No está claro por qué el bloqueo paravertebral podría resultar en una mejora de la PEFR y la SaO2 en comparación con la analgesia epidural en este y otros estudios, pero puede estar relacionado con una mayor utilización de opioides, una mayor incidencia de náuseas y vómitos y la presencia de músculo intercostal bilateral. bloqueo (y por lo tanto disminución de la movilidad de la pared torácica) en las cohortes epidurales.
Consejos NYSORA
- El bloqueo paravertebral o intercostal proporciona una analgesia excelente después de una fractura de costilla y una toracotomía.
- Estos bloqueos también dan como resultado una mejor espirometría y resultados pulmonares.
Complicaciones pulmonares no relacionadas con bloqueo de conducción
Las complicaciones pulmonares relacionadas con el uso de técnicas de anestesia regional se dividen en dos categorías. Los primeros son los relacionados directa o indirectamente con los cambios fisiológicos que ocurren con el propio bloqueo. Los ejemplos incluyen atelectasia y neumonía resultantes de la incapacidad para movilizar secreciones. La segunda categoría comprende las que son independientes del efecto del bloqueo, y aunque hay reportes esporádicos de complicaciones raras como hemorragia pulmonar y quilotórax, la más común de ellas es el neumotórax. No es sorprendente que los neumotórax ocurran con mayor frecuencia cuando el sitio de punción se superpone a la pleura, y especialmente cuando se realizan bloqueos supraclaviculares e intercostales. La incidencia general notificada es baja, pero es probable que no se notifiquen las cifras reales, ya que muchas punciones pleurales darán como resultado pequeños neumotórax que se resuelven espontáneamente. Los refinamientos de las técnicas infraclaviculares publicadas anteriormente basadas en estudios de resonancia magnética y el uso generalizado de la guía por ultrasonido pueden conferir seguridad adicional a estos procedimientos, aunque es importante señalar que se han informado neumotórax con técnicas guiadas por ultrasonido, lo que destaca el hecho de que la guía por ultrasonido es una forma imperfecta. medio de prevención de eventos adversos.
ENFERMEDAD RENAL
La disfunción renal está comúnmente presente en la población quirúrgica. La lesión renal aguda perioperatoria representa aproximadamente el 50% de todos los pacientes que requieren hemodiálisis aguda en los Estados Unidos. Los pacientes con insuficiencia renal crónica se presentan con frecuencia para procedimientos como la creación de derivaciones vasculares y la revascularización de las extremidades inferiores. Las técnicas de anestesia regional suelen ser opciones ideales para proporcionar anestesia a estos pacientes y procedimientos.
Efecto de la anestesia regional sobre la función renal
El tratamiento de los pacientes con riesgo de disfunción renal perioperatoria debe centrarse en dos principios: evitar los agentes nefrotóxicos y mantener la perfusión renal. Los anestésicos locales no poseen propiedades nefrotóxicas per se y, de hecho, se ha demostrado que la coadministración de procaína mitiga algunos de los efectos nefrotóxicos del cisplatino en ratas. De mayor relevancia es el efecto de la hipotensión inducida por anestésicos sobre el flujo sanguíneo renal. Los riñones son capaces de autorregularse en una amplia variedad de presiones arteriales medias (aproximadamente 80 a 180 mmHg) y mantener la tasa de filtración glomerular (GFR) mediante cambios autónomos en la resistencia vascular renal. Por debajo del llamado límite inferior de autorregulación, el riñón comienza a cerrar sus procesos fisiológicos dependientes de energía y, como resultado, la tasa de filtración glomerular y la diuresis disminuyen. En última instancia, si no se controla, se desarrolla isquemia renal, especialmente en la médula renal sensible. Aunque la anestesia neuroaxial y la simpatectomía concurrente pueden reducir la presión arterial media (PAM), a menudo se conserva el flujo sanguíneo renal. Se cree que esto refleja un aumento en el volumen sistólico del ventrículo izquierdo en respuesta a la caída de la resistencia vascular sistémica (RVS). Rooke y sus colegas estudiaron las respuestas hemodinámicas y la perfusión de órganos abdominales (medida por gammagrafía) en 15 pacientes sometidos a anestesia espinal con lidocaína con un bloqueo sensorial que va desde T1 a T10. Mientras que la PAM y la SVR cayeron en promedio un 33 % y un 26 %, respectivamente, el volumen de sangre en los riñones aumentó aproximadamente un 10 %. Sin embargo, puede haber límites en el grado de compensación proporcionado por el gasto cardíaco. Un estudio que usó un modelo de primates mostró que aunque el flujo sanguíneo renal se vio mínimamente afectado por la anestesia espinal T10, se redujo significativamente por un bloqueo sensorial T1. Este hallazgo ilustra nuevamente que los niveles lumbares y torácicos bajos de anestesia neuroaxial en pacientes con enfermedad renal son bien tolerados fisiológicamente y que los cambios significativos no comienzan a manifestarse hasta que se alcanzan niveles más altos.
El sistema renina-angiotensina, que se inicia en el riñón en respuesta a una reducción de la perfusión renal, desempeña una función importante en la homeostasis de la presión arterial. Sirve como un mecanismo humoral complementario a los sistemas nerviosos simpáticos. Hopf y sus colegas realizaron un estudio para determinar si la anestesia epidural torácica suprimía la respuesta de la renina a la hipotensión inducida. Las concentraciones plasmáticas de renina y vasopresina se midieron antes, durante y después de un desafío hipotensor con nitroprusiato en pacientes con y sin anestesia epidural torácica (niveles sensoriales T1 a T11). Con un sistema nervioso simpático intacto (es decir, sin epidural), los niveles de renina en plasma se duplicaron en respuesta al desafío hipotensor que duró 15 minutos. Por el contrario, no hubo cambios en la concentración de renina cuando se indujo hipotensión al mismo MAP en la cohorte epidural. Esto sugiere que las fibras simpáticas juegan un papel clave en el sistema renina-angiotensina y que la anestesia epidural torácica interfiere con la integridad funcional de ese sistema.
Consejos NYSORA
- Niveles lumbares y torácicos bajos de anestesia neuroaxial significativamente hemodinámica renal.
Por razones obvias, la función renal posoperatoria es la principal preocupación cuando se administra anestesia a los receptores de un trasplante renal. Varios estudios han analizado el efecto de la anestesia general versus regional (o epidural/general combinada) sobre la función renal posoperatoria en este contexto. Si bien se ha demostrado que la anestesia regional reduce la respuesta de estrés a la cirugía de trasplante renal y mejora el control del dolor posoperatorio, no se demostró que la técnica anestésica tenga un efecto sobre el resultado del injerto en poblaciones pediátricas o adultas. Además, se demostró que la elección de la técnica anestésica para los donantes vivos es independiente del resultado del injerto del receptor. Otros datos de resultados no relacionados con trasplantes, incluidos los del gran metanálisis de Rodgers et al., indican que la anestesia regional se asocia con un menor riesgo de insuficiencia renal posoperatoria que la anestesia general. Sin embargo, los autores advirtieron que los intervalos de confianza eran amplios y compatibles tanto con un efecto nulo como con una reducción del riesgo de dos tercios. En general, parece que una anestesia regional bien administrada no afecta negativamente la función renal perioperatoria o el resultado renal en comparación con la anestesia general.
Consideraciones para la Anestesia Regional en Insuficiencia Renal Crónica
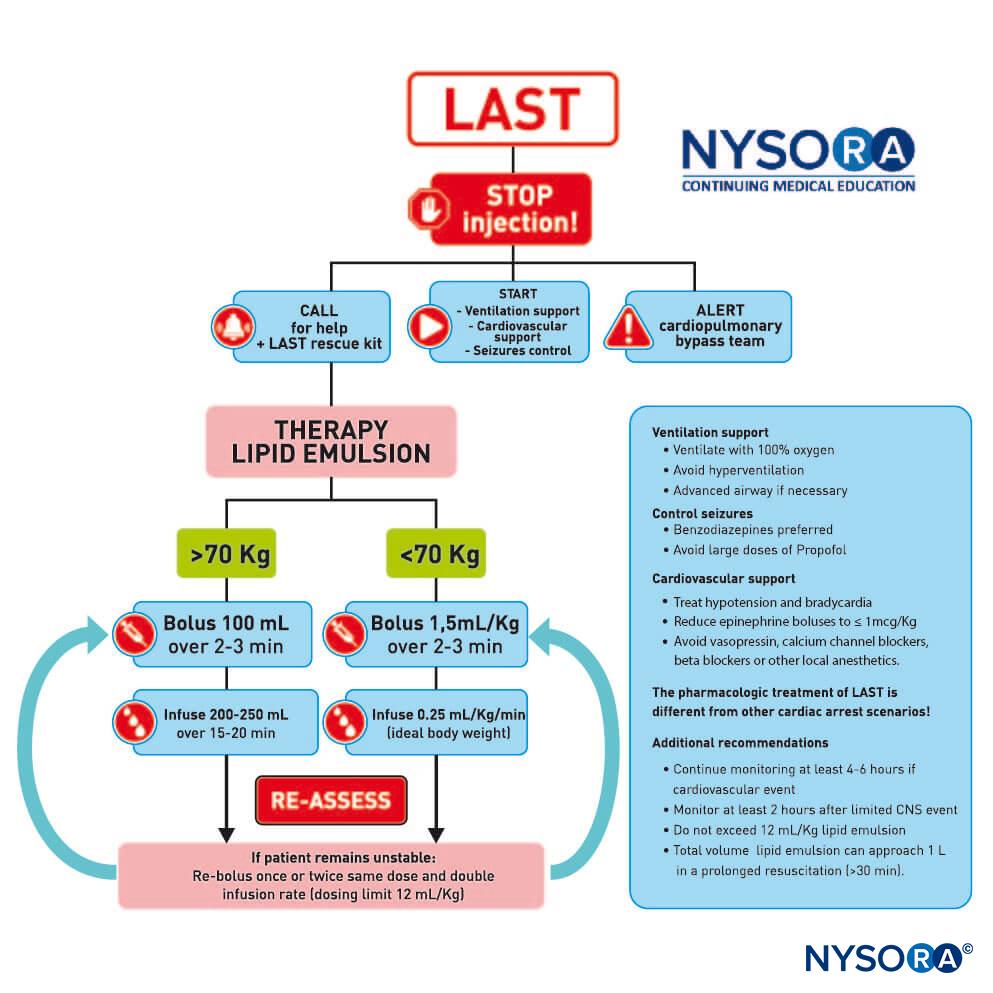
Los pacientes con insuficiencia renal crónica a menudo manifiestan un gran número de cambios fisiopatológicos que pueden influir en el cuidado anestésico regional. Estos pueden incluir la presencia de una acidosis metabólica con desequilibrio aniónico, alteraciones electrolíticas como hiperpotasemia y coagulopatías debidas a disfunción plaquetaria inducida por uremia. Las concentraciones plasmáticas de anestésico local después de los bloqueos de nervios periféricos suelen ser lo suficientemente altas como para causar toxicidad cardíaca o del sistema nervioso central (SNC) en cualquier paciente, incluso cuando no se ha producido una inyección intravascular obvia. Esto probablemente esté relacionado con la dosis cuando se realizan "bloqueos de gran volumen", como los bloqueos del plexo. Algunos autores han recomendado que las dosis se ajusten en pacientes con insuficiencia renal crónica con base en las observaciones de toxicidad que se supone que están relacionadas con acidosis o hiperpotasemia concurrentes. De hecho, la evidencia experimental sugiere que la acidemia disminuye la unión a proteínas de la bupivacaína, lo que aumenta la fracción libre y el riesgo de toxicidad. Además, se ha demostrado que la hiperpotasemia (5.4 frente a 2.7 mEq/L) en perros da como resultado que solo se requiera la mitad de la dosis de bupivacaína para inducir cardiotoxicidad. Curiosamente, el nivel de potasio no tuvo ningún efecto en los mismos animales. Este es un hallazgo ominoso, ya que sugiere que el llamado margen de seguridad de los niveles plasmáticos entre la toxicidad cardíaca y del SNC, que ya es relativamente estrecho con la bupivacaína, es incluso menos fiable en presencia de hiperpotasemia.
Consejos NYSORA
- La acidemia y la hiperpotasemia disminuyen la unión a proteínas de la bupivacaína, aumentando así la fracción libre y el riesgo de toxicidad.
- Los pacientes con uremia pueden tener niveles plasmáticos más altos de anestésico local después del bloqueo de nervios periféricos.
Incluso en ausencia de alteraciones electrolíticas o acidobásicas, las concentraciones plasmáticas de anestésicos locales después del bloqueo de nervios periféricos suelen ser más altas en pacientes con insuficiencia renal crónica. La razón de esto no está del todo clara, pero puede relacionarse con el aumento del flujo sanguíneo (y, por lo tanto, de la absorción en el lugar de la inyección) debido a la circulación hiperdinámica que a menudo se observa en los pacientes urémicos. Por otro lado, los niveles de glucoproteína ácida a1 (AAG) aumentan en la uremia y pueden tener un efecto protector al unir más anestésico local en el torrente sanguíneo. Los niveles aumentados de AAG también dan como resultado una fracción libre reducida disponible para el metabolismo hepático y un volumen de distribución reducido. Estas dos consecuencias farmacocinéticas parecen equilibrarse entre sí, de modo que la vida media sérica no cambia significativamente. La hemodiálisis es ineficaz para eliminar la lidocaína del plasma y, por lo tanto, no se puede confiar en ella para tratar la toxicidad. Sin embargo, la emulsión de lípidos se ha utilizado con éxito para tratar la toxicidad sistémica tanto cardiovascular como neurológica en pacientes con insuficiencia renal.
No existe una diferencia significativa entre los pacientes con insuficiencia renal crónica y los pacientes sanos con respecto a la latencia, la duración o la calidad del bloqueo de los nervios periféricos. En un estudio de anestesia espinal en pacientes con insuficiencia renal crónica versus pacientes sanos, Orko y colaboradores encontraron que la calidad del bloqueo era similar pero que tanto el tiempo de inicio como la duración del bloqueo se redujeron en pacientes con uremia. Los autores postularon un espacio intratecal de volumen contraído en pacientes urémicos como un mecanismo para el inicio más rápido, pero la causa real sigue sin estar clara. La duración más corta del bloqueo sensorial puede estar nuevamente relacionada con una mayor captación en el contexto de una circulación hiperdinámica. La coagulopatía urémica se caracteriza por un defecto de la agregación plaquetaria que probablemente se deba a un efecto tóxico de las sustancias urémicas sobre la unión del fibrinógeno al receptor plaquetario de glicoproteína IIb/IIIa. Esto a menudo se manifiesta en un sangrado clínicamente apreciable, y se ha publicado al menos un caso de hematoma subaracnoideo que condujo a paraplejía después de una anestesia espinal en un paciente con insuficiencia renal crónica. Los pacientes sometidos a hemodiálisis requieren anticoagulación intermitente y pueden presentarse en el quirófano con un estado de coagulación incierto. Se debe tener cuidado para delinear la heparina u otros regímenes anticoagulantes. A pesar de esta disfunción plaquetaria, los pacientes urémicos tienen un mayor riesgo de eventos trombóticos. Más tarde se descubrió que un caso de hipoxia después de un bloqueo del plexo braquial en un paciente urémico era secundario a una embolia pulmonar. Los autores del informe sugirieron que un mecanismo probable fue el desalojo de un trombo preexistente del brazo proximal, facilitado por la manipulación relacionada con el bloqueo y la vasodilatación de la extremidad superior.
Varios estudios han comparado técnicas anestésicas para la creación de fístulas arteriovenosas, un procedimiento que es común en pacientes con enfermedad renal en etapa terminal y es muy adecuado para el bloqueo del plexo braquial. Algunos investigadores han llegado a la conclusión de que existe poca diferencia en el resultado entre la anestesia general, local y del plexo braquial para esta operación. Mouquet y sus colegas estudiaron específicamente los efectos de estas tres técnicas en el flujo sanguíneo de la arteria braquial y concluyeron que tanto la anestesia general como el bloqueo del plexo braquial mejoraron el flujo sanguíneo a través de la fístula durante la cirugía, mientras que la infiltración local no lo hizo. Varios estudios posteriores han demostrado un mayor diámetro de la vena, mayores tasas de formación de fístulas nativas, mayor flujo sanguíneo de la fístula y un tiempo de maduración más corto cuando se usa anestesia regional, en comparación con la anestesia general o local.
ENFERMEDAD HEPATICA
La lesión o disfunción hepática puede variar desde una “transaminitis” asintomática leve hasta insuficiencia hepática franca. Hay muchas causas de enfermedad hepática, tanto adquiridas como congénitas, pero todas se manifiestan como insuficiencia de la función de las células parenquimatosas (es decir, hepatitis aguda y crónica, cirrosis) o colestasis. Las consideraciones para la anestesia regional en pacientes con enfermedad hepática incluyen la posibilidad de alteraciones en la disposición y el metabolismo de los anestésicos locales, el efecto de la anestesia regional en la perfusión hepática y la posible coagulopatía relacionada con la disfunción hepática.
Farmacocinética de los anestésicos locales en la enfermedad hepática
Los anestésicos locales de amida se metabolizan en los microsomas hepáticos por el sistema del citocromo P450. Una disminución en la función microsomal, como puede verse en la enfermedad hepática aguda o crónica, puede conducir a una reducción en la biotransformación y eliminación de estos fármacos, poniendo al paciente en riesgo de toxicidad por anestésicos locales. Al igual que con otros fármacos que se metabolizan en el hígado, la tasa de extracción hepática determina la importancia relativa de la perfusión hepática frente a la actividad enzimática intrínseca en la depuración global del fármaco. Por ejemplo, la bupivacaína tiene una relación de extracción baja (es decir, su eliminación es más sensible a las alteraciones en la actividad de las enzimas hepáticas), mientras que la etidocaína exhibe una relación de extracción relativamente alta y depende de una perfusión hepática adecuada para su eliminación. La lidocaína tiene una relación de extracción hepática intermedia y, por lo tanto, depende tanto de la perfusión como de la actividad enzimática. La enfermedad hepática grave, como la cirrosis, puede afectar tanto la perfusión hepática como la función enzimática intrínseca. En este escenario, es probable que se reduzca la depuración de todos los anestésicos locales de amida, independientemente de su relación de extracción. Debido a que el volumen de distribución de los anestésicos locales (y muchos otros fármacos) aumenta en la enfermedad hepática, los niveles plasmáticos reales pueden no diferir significativamente de los de los pacientes sanos con una sola dosis, a pesar de la depuración disminuida. La distribución alterada puede estar relacionada con niveles reducidos de AAG en plasma, que se reducen en proporción a la gravedad de la enfermedad hepática. Clínicamente, parece que los bloqueos nerviosos periféricos de dosis única con anestésicos locales de amida probablemente no requieren un ajuste de dosis en esta población, mientras que las infusiones continuas o los bolos repetidos tienen el potencial de acumularse a niveles tóxicos. Esto está respaldado por un estudio que compara los niveles plasmáticos de levobupivacaína en pacientes sometidos a resección hepática o cirugía colorrectal que recibieron levobupivacaína epidural en bolos repetidos. Se encontró que los pacientes en el grupo de resección hepática tenían niveles plasmáticos significativamente más altos, lo que se correlacionó con la eliminación de verde de indocianina (una medida de la función hepática) y la concentración de bilirrubina plasmática.
El sistema enzimático del citocromo P450 está sujeto a inducción o inhibición por una variedad de fármacos y nutrientes dietéticos. Esto puede desempeñar un papel en el metabolismo posterior de los anestésicos locales de amida. Por ejemplo, las sustancias que inhiben las enzimas microsomales, como la cimetidina o el jugo de toronja, pueden provocar una acumulación de anestésico local, lo que aumenta el riesgo de toxicidad, especialmente en el contexto de una disfunción hepática preexistente.
Los anestésicos locales de éster son eliminados por las colinesterasas plasmáticas en la sangre y el hígado. La enfermedad hepática grave puede provocar una disminución de los niveles de colinesterasa y prolongar la semivida plasmática de ésteres como la procaína. Por otro lado, las esterasas de glóbulos rojos permanecen intactas durante la enfermedad hepática y pueden proporcionar alguna función hidrolítica. Debido a que la colinesterasa plasmática es extremadamente eficiente, es poco probable que una deficiencia enzimática secundaria a una enfermedad hepática pueda afectar la hidrólisis de los anestésicos locales de tipo éster en un grado suficiente para causar toxicidad.
Consejos NYSORA
- La farmacocinética de los anestésicos locales en pacientes con enfermedad hepática puede ser compleja debido a la disminución de la producción de proteínas y del metabolismo de los fármacos.
- Los bloqueos nerviosos periféricos en dosis única de inyección con anestésicos locales de tipo amida probablemente no requieran un ajuste de la dosis en pacientes con enfermedad hepática.
Efecto de la anestesia regional sobre el flujo sanguíneo hepático
El riego sanguíneo hepático es único en el sentido de que se basa tanto en el retorno venoso portal como en el flujo sanguíneo de la arteria hepática, que constituyen aproximadamente el 75 % y el 25 % del flujo total, respectivamente. La regulación del flujo sanguíneo hepático es compleja. El sistema portal es pasivo y no está sujeto a autorregulación, mientras que la arteria hepática puede aumentar o disminuir su contribución al flujo en respuesta a alteraciones en el flujo venoso portal. La arteria hepática también se autorregula en respuesta a MAP, de la misma manera que lo hacen los vasos cerebrales o renales, pero puede depender de una respuesta simpática intacta.
Se ha demostrado que la anestesia general provoca una disminución del flujo sanguíneo hepático, lo que puede provocar isquemia y disfunción hepática posoperatoria. Se sabe menos sobre los efectos de la anestesia regional en la perfusión hepática. Grietz et al. realizó una epidural alta (nivel de bloqueo T1 a T4) en 16 perros y examinó el efecto sobre la hemodinámica sistémica y hepática. El PAM y el flujo venoso portal se redujeron en comparación con los valores de control, en un 52 % y un 26 %, respectivamente. Por el contrario, el flujo de la arteria hepática no cambió, lo que probablemente se relacione con una reducción de la resistencia de la arteria hepática del 51 %. Además, se conservó el consumo hepático de oxígeno gracias a una mayor extracción de oxígeno. Otro estudio realizado por Vagts y colegas encontró que la anestesia epidural torácica en cerdos anestesiados se asoció con una disminución de la presión arterial media y del flujo sanguíneo de la arteria hepática, pero no hubo cambios en el suministro o consumo de oxígeno hepático ni en la presión parcial de oxígeno tisular en comparación con los cerdos que recibieron anestesia general sola. Tomados en conjunto, estos hallazgos deberían tranquilizar al médico de que la anestesia neuroaxial alta puede tolerarse bien con respecto a la oxigenación hepática, a pesar de una reducción modesta en PAM. Se debe tener cuidado para mantener el gasto cardíaco y la presión de perfusión durante la anestesia para asegurar la perfusión adecuada de todos los órganos vitales.
Coagulopatía hepática
La enfermedad hepática grave se asocia con anomalías del sistema de coagulación. La causa es multifactorial y puede incluir disminución de la síntesis de proteínas procoagulantes, disminución de la eliminación de factores de coagulación activados, deficiencia nutricional (p. ej., vitamina K, folato), síntesis de fibrinógeno funcionalmente anormal, esplenomegalia secundaria a hipertensión portal (trombocitopenia secuestrada), alteraciones cualitativas. defectos plaquetarios y supresión de la trombopoyesis de la médula ósea (p. ej., por alcohol, infección por el virus de la hepatitis). Debido a la complejidad potencial de la coagulopatía, puede ser necesario realizar pruebas de laboratorio adicionales, como pruebas de factor de coagulación y fibrinógeno, para delinear completamente la naturaleza del problema. Las deficiencias del factor de coagulación se pueden tratar con una transfusión de plasma fresco congelado con suplementos de vitamina K, o ambos. La transfusión de plaquetas puede ser necesaria en caso de trombocitopenia. También se han utilizado otras terapias, como el factor VIIa recombinante, para corregir el sangrado asociado con la insuficiencia hepática.
Dado que los factores de coagulación dependientes de la vitamina K son más susceptibles a la enfermedad hepatocelular, el tiempo de protrombina (PT) y el índice internacional normalizado (INR) se utilizan a menudo como marcadores de la integridad del sistema de coagulación. Sin embargo, se ha demostrado que el valor predictivo del PT/INR sobre la hemorragia durante los procedimientos de cabecera, como la punción lumbar o la colocación de una vía central, es pobre. Como tal, es importante sopesar cuidadosamente los riesgos y beneficios de una técnica anestésica neuroaxial en un paciente con sospecha de coagulopatía inducida por el hígado.
Aunque un INR de menos de 1.5 "debe estar asociado con una hemostasia normal" según las pautas de consenso sobre anticoagulación de la Sociedad Estadounidense de Anestesia Regional y Medicina del Dolor (ASRA), esta declaración se aplica principalmente a la anticoagulación inducida por warfarina y puede no ser un indicador confiable. de la probabilidad de sangrado problemático en la insuficiencia hepática. La analgesia epidural se usa con frecuencia durante y después de una resección hepática mayor, aunque existen algunos problemas de seguridad ya que es común el trastorno posoperatorio de los parámetros de coagulación; sin embargo, no hay informes de hematoma epidural en este contexto. Los riesgos asociados con la realización de bloqueos nerviosos periféricos en pacientes con parámetros de coagulación anormales son menos claros. Obviamente, el riesgo de sangrado aumenta con las técnicas en las que la aguja se coloca cerca de un vaso sanguíneo importante. Debe realizarse una consideración cuidadosa de los riesgos y beneficios al considerar el bloqueo del plexo lumbar en pacientes con coagulopatía, ya que una hemorragia retroperitoneal en este espacio puede ser extensa y no evidente hasta que el paciente está en estado de shock. Asimismo, se debe tener cuidado al realizar bloqueos en la vecindad de vasos sanguíneos no comprimibles (p. ej., la arteria subclavia en el caso de bloqueo infraclavicular) en pacientes que tienen una anomalía de la coagulación. Los riesgos de la anestesia regional en el marco de un trastorno se explican detalladamente en “Anestesia regional en el enfermo crítico".
Consejos NYSORA
- Los bloqueos profundos, como el ciático anterior o el plexo lumbar, deben practicarse con especial cuidado en pacientes con coagulopatía.
- De manera similar, se deben considerar cuidadosamente los bloqueos en la vecindad de vasos sanguíneos no comprimibles, como la arteria en la fosa.
DIABETES MELLITUS
La diabetes es una enfermedad multisistémica caracterizada por intolerancia a los carbohidratos y desregulación de la insulina que tiene muchas implicaciones para el anestesiólogo regional. Además de las preocupaciones anestésicas habituales, como la presencia de enfermedad arterial coronaria, cerebrovascular y renal, los diabéticos tienen una alta incidencia de neuropatía periférica preexistente, lo que tiene implicaciones para el rendimiento y el éxito del bloqueo y presenta un riesgo de complicaciones neurológicas. Otras consideraciones son el efecto de la anestesia regional sobre la homeostasis de la glucosa y el mayor riesgo de infección en pacientes diabéticos.
Neuropatía periférica en diabéticos
La neuropatía diabética es una de las enfermedades neurológicas más comunes y afecta hasta al 100% de los pacientes diabéticos con enfermedad de larga evolución. Los pacientes pueden estar asintomáticos, pero en los pacientes afectados, los síntomas se describen típicamente como parestesias, pérdida sensorial o dolor neuropático. Se cree que el mecanismo de la neuropatía diabética está relacionado con un efecto osmótico y metabólico directo de la hiperglucemia crónica en las neuronas o con una lesión microvascular que conduce a la isquemia nerviosa.
La realización de bloqueos nerviosos en pacientes con neuropatía periférica es controvertida. Kalichman y Calcutt estudiaron la histología del nervio ciático en ratas después del bloqueo con lidocaína y encontraron significativamente más edema nervioso en los nervios de las ratas con diabetes en comparación con los controles sanos. La razón del edema es probablemente multifactorial y puede incluir la presencia de una barrera hemato-nerviosa alterada o una menor captación de anestésico local, lo que lleva a una mayor duración del baño nervioso. Un aumento en la presión del líquido endoneural debido al edema puede contraer los vasos transperineurales pequeños, precipitando la isquemia en un nervio ya comprometido. Esto puede traducirse en una mayor incidencia de parestesias posoperatorias después de los bloqueos nerviosos, incluidos los bloqueos neuroaxiales, en diabéticos. Al-Nasser informó un caso de parestesias y dolor bilaterales prolongados (> 8 semanas) en las extremidades inferiores después de la analgesia epidural lumbar con ropivacaína al 0.2% en un paciente diabético sometido a prostatectomía radical. Los estudios electromiográficos posoperatorios mostraron neuropatía sensitiva generalizada tanto en miembros superiores como inferiores, lo que indica que el paciente, aunque asintomático, tenía una neuropatía preexistente que pudo haberlo predispuesto a esta rara complicación. Los estudios han demostrado una duración prolongada del bloqueo sensorial y motor después del bloqueo del nervio ciático en diabéticos en comparación con los no diabéticos y que la duración del bloqueo aumenta a medida que empeora el control glucémico (medido por los niveles de hemoglobina glicosilada). Un estudio en ratas diabéticas mostró una prolongación similar del efecto anestésico local que se revirtió con 2 semanas de tratamiento con insulina pero que no se vio afectado por 6 horas de insulina, lo que sugiere que el aumento de la sensibilidad a los anestésicos locales está mediado por cambios crónicos en el sistema nervioso en lugar de el nivel actual de glucosa en sangre. No está claro si esta mayor sensibilidad a los anestésicos locales representa un mayor riesgo de complicaciones neurológicas. Se desconoce la prevalencia real de complicaciones neurológicas en diabéticos que reciben bloqueos nerviosos, pero probablemente sea bastante baja. La diabetes es una enfermedad común, y los informes de complicaciones neurológicas en la literatura son escasos, lo que sugiere que en la gran mayoría de los casos, la recuperación de los bloqueos de los nervios periféricos transcurre sin incidentes.
También se debe considerar que los pacientes con diabetes tienen un mayor riesgo de complicaciones infecciosas de la anestesia regional debido a la supresión inmunitaria que se produce como resultado de la enfermedad. La diabetes ha sido implicada como un factor de riesgo de infección después del bloqueo tanto periférico como neuroaxial. Aunque no está claro hasta qué punto la diabetes realmente aumenta el riesgo de infección, parece prudente estar más alerta con las precauciones de control de infecciones en estos pacientes.
El efecto de la neuropatía diabética sobre la electrolocalización de los nervios durante el uso de un estimulador nervioso es otro tema de controversia. Los pacientes con diabetes de larga data pueden requerir una intensidad de corriente algo mayor para producir una respuesta motora. Si bien los estudios de conducción nerviosa en diabéticos con neuropatía muestran consistentemente una reducción en la velocidad de conducción y la amplitud de los nervios motores y sensoriales, este no suele ser el caso en la práctica clínica real, ya que la mayoría de los pacientes con diabetes tienen umbrales de intensidad de corriente similares a los de los no diabéticos. pacientes diabéticos sin neuropatía.
Consejos NYSORA
- Los pacientes con diabetes son propensos a una neuropatía metabólica que altera la conducción nerviosa.
- Sólo ocasionalmente se necesita una corriente estimulante de mayor intensidad para obtener espasmos musculares visibles cuando se usa un estimulador nervioso para electrolocalizar los nervios.
Efecto de la anestesia regional sobre la homeostasis de la glucosa
Es bien conocido que la cirugía realizada en combinación con la anestesia general provoca una respuesta contrarreguladora que aumenta significativamente los niveles plasmáticos de glucosa, así como los niveles de cortisol y catecolaminas. Esta llamada respuesta al estrés se ha considerado durante mucho tiempo un mecanismo de defensa homeostático que es importante en la adaptación de un organismo a los estímulos dañinos, proporcionando sustratos para la energía en momentos de necesidad. Sin embargo, los períodos prolongados de hiperglucemia pueden tener efectos nocivos en los pacientes, con evidencia que respalda un aumento en las tasas de mortalidad, la duración de la estancia hospitalaria y la incidencia de infecciones nosocomiales. La hiperglucemia puede ser particularmente peligrosa en pacientes que han sufrido un traumatismo.
Se ha demostrado que la anestesia regional mejora la respuesta hiperglucémica a la cirugía y, por lo tanto, puede desempeñar un papel en este fenómeno protector. Una prueba de tolerancia a la glucosa intraoperatoria dio como resultado niveles de glucosa en plasma marcadamente elevados en pacientes que recibieron anestesia general versus epidural para procedimientos tales como herniorrafia inguinal e histerectomía. Asimismo, la histerectomía abdominal realizada bajo anestesia raquídea se asocia con niveles de glucosa intra y postoperatorios más bajos en comparación con la neuroleptoanestesia. El bloqueo retrobulbar reduce la respuesta de estrés hiperglucémico a la cirugía de cataratas y de cerclaje escleral.
La homeostasis de la glucosa es compleja y es probable que varios factores contribuyan a la acción saludable de la anestesia regional sobre el control glucémico. Estos pueden incluir la inhibición de la gluconeogénesis hepática así como la inhibición de las respuestas de catecolaminas y cortisol a la cirugía. Además, la "ausencia de anestesia general" puede ser un factor causal en el control de la glucemia, ya que se ha demostrado que los agentes volátiles como el halotano y el enflurano alteran la tolerancia a la glucosa en los perros. Parece claro a partir de los datos disponibles que para mejorar los resultados de la cirugía mayor, los anestesiólogos deben evitar que la mayor cantidad posible de información nociceptiva llegue a los sistemas nervioso central y neuroendocrino. El uso de anestesia regional puede facilitar fácilmente este objetivo y puede ser especialmente pertinente para los diabéticos "frágiles" en quienes el control estricto de la glucemia es difícil en el mejor de los casos.
NEUROPATÍA TIROIDEA
La diabetes y la uremia son las neuropatías metabólicas más frecuentes; sin embargo, varias otras neuropatías menos comunes también tienen implicaciones para el anestesiólogo regional. Estas incluyen aquellas neuropatías que resultan del uso de ciertos medicamentos o la exposición a toxinas y aquellas relacionadas con enfermedades del tejido conectivo, autoinmunes y vasculares. Una de las causas más prevalentes de neuropatía metabólica es la asociada con hipotiroidismo manifiesto. La neuropatía tiroidea es un fenómeno principalmente sensorial que no se conoce bien pero que está presente en aproximadamente el 40 % de los pacientes diagnosticados con hipotiroidismo. Es más evidente en el mixedema franco, pero los estudios de conducción nerviosa han mostrado evidencia de deterioro de la velocidad en el hipotiroidismo subclínico. Es más probable que la neuropatía tiroidea se presente como un atrapamiento de nervios periféricos, en particular del nervio mediano, y estos pacientes se derivan con frecuencia para la descompresión del túnel carpiano. También es común el atrapamiento del octavo nervio craneal que conduce a la sordera. Los pacientes pueden quejarse de disestesias en un patrón de guante y media, así como dolores lancinantes que sugieren compresión de la raíz nerviosa. Los reflejos tendinosos profundos “colgados” (respuesta refleja enérgica con retorno tardío al tono normal) son un sello distintivo del hipotiroidismo y probablemente se relacionen tanto con la neuropatía como con la miopatía. Desde el punto de vista patológico, los nervios afectados muestran depósito mucinoso y, en casos avanzados, desmielinización segmentaria con pérdida de fibras nerviosas mielinizadas grandes.
Existen pocos datos sobre el efecto que puede tener la neuropatía tiroidea preexistente en el manejo de la anestesia regional en esta población. Una posible consecuencia de realizar anestesia regional en pacientes con atrapamiento de nervios es lo que se ha denominado el “síndrome de doble aplastamiento”. Esto se refiere a la mayor susceptibilidad de los nervios a sufrir lesiones o deterioro en una ubicación anatómica cuando ya están comprimidos o lesionados de otro modo en otra ubicación separada. Un ejemplo clásico es el paciente con síntomas del síndrome del túnel carpiano después de un trauma aparentemente menor o una lesión en el nervio mediano, que luego se descubre que tiene compresión de la raíz nerviosa C6. Aunque originalmente se describió en términos de lesión mecánica, se ha reconocido que los factores metabólicos y farmacológicos pueden contribuir al síndrome de doble aplastamiento, incluido el hipotiroidismo. Por lo tanto, puede ser que los pacientes con neuropatía tiroidea tengan un mayor riesgo de lesión neurológica cuando reciben bloqueos de anestesia regional, ya que un traumatismo menor con la aguja en un nervio susceptible puede producir déficits neurológicos funcionales. Aunque esto sigue siendo especulativo en la actualidad, esta posibilidad refuerza la necesidad de una historia detallada y documentación del déficit neurológico preexistente en pacientes con hipotiroidismo y la consideración cuidadosa de las técnicas en estos pacientes. Finalmente, si se sospecha, se ha demostrado que la neuropatía tiroidea es corregible en muchos casos mediante un tratamiento rápido con terapia de reemplazo de la tiroides, lo que puede causar esta complicación.
OBESIDAD
La obesidad es un problema cada vez más frecuente; las tasas de obesidad en todo el mundo se han duplicado desde 1980. En los últimos 20 años, ha habido un aumento espectacular de la obesidad en los EE. UU., con un 35 % de adultos y un 17 % de niños y adolescentes que cumplen los criterios para obesidad en 2012. Además de las consideraciones anestésicas habituales para pacientes con obesidad mórbida, como la presencia de diversas comorbilidades cardiopulmonares, gastrointestinales y endocrinas, la abundancia de tejido extra puede presentar un desafío para los anestesiólogos regionales. Se ha demostrado que la obesidad afecta la capacidad de los anestesiólogos para identificar correctamente los espacios intermedios de la columna lumbar. Los resultados se ven afectados de manera similar en pacientes con sobrepeso. En un estudio de más de 9000 bloqueos mixtos en una sola institución, los pacientes con un índice de masa corporal (IMC) superior a 30 kg/m2 tenían 1.62 veces más probabilidades de sufrir un bloqueo regional fallido que aquellos con un IMC inferior a 25 kg/m2. mXNUMX. Como era de esperar, los investigadores mencionaron la dificultad en la identificación de puntos de referencia, el posicionamiento del paciente y la longitud insuficiente de la aguja utilizada como los principales impedimentos para la colocación exitosa del bloqueo. Estos hallazgos están respaldados por un estudio de bloqueos axilares utilizando la guía de un estimulador nervioso, donde la obesidad se asoció con un mayor tiempo de ejecución del bloqueo, menor tasa de éxito, mayor tasa de complicaciones y menor satisfacción del paciente. A pesar de estas dificultades relativas, las tasas de éxito del bloqueo en pacientes obesos fueron altas y las tasas de complicaciones graves fueron bajas. La anestesia regional sigue siendo una opción atractiva para los pacientes obesos porque puede reducir la incidencia de complicaciones cardiopulmonares y de las vías respiratorias en comparación con las experimentadas durante la anestesia general.
Consejos NYSORA
- Los pacientes obesos tienen más probabilidades de experimentar un bloqueo regional fallido que los pacientes con un IMC dentro del rango normal.
- Las razones para esto incluyen superficies difíciles o puntos de referencia sonográficos, dificultad en el posicionamiento del paciente.
Los pacientes obesos parecen beneficiarse de los bloqueos anestésicos regionales guiados por imágenes. La fluoroscopia se ha utilizado en la colocación de catéteres en el plexo braquial axilar, en la realización de bloqueos del nervio ciático y como ayuda para facilitar la anestesia espinal en pacientes con obesidad mórbida. Sin embargo, su uso está limitado por la necesidad de relacionar la anatomía neural con estructuras que parecen radiodensas, como huesos, agujas o vasos inyectados con contraste.
El ultrasonido puede ser especialmente útil en pacientes obesos con puntos de referencia superficiales oscurecidos, aunque el exceso de tejido adiposo puede dificultar el examen de ultrasonido debido a la atenuación del haz de ultrasonido. Esta dificultad se puede superar en parte disminuyendo la frecuencia del transductor para aumentar la profundidad de penetración, aunque se reducirá la resolución de la imagen (Figura 2 y XNUMX). Cuando se escanearon los nervios mediano y ciático en voluntarios con peso normal y obesos, Marhofer et al. concluyeron que la visualización de los nervios periféricos superficiales es independiente del IMC, mientras que los nervios más profundos son más difíciles de visualizar en sujetos obesos. Los estudios realizados en parturientas obesas y en pacientes no obstétricas con puntos de referencia anatómicos superficiales difíciles han verificado la utilidad de la ecografía para identificar el espacio epidural y otras estructuras espinales antes de realizar un bloqueo neuroaxial. Hasta la fecha, pocos estudios han comparado los bloqueos de nervios periféricos guiados por ecografía con técnicas guiadas por puntos de referencia o estimuladores nerviosos en la población obesa; sin embargo, la ecografía parece ser una modalidad útil para este grupo de pacientes potencialmente desafiante.
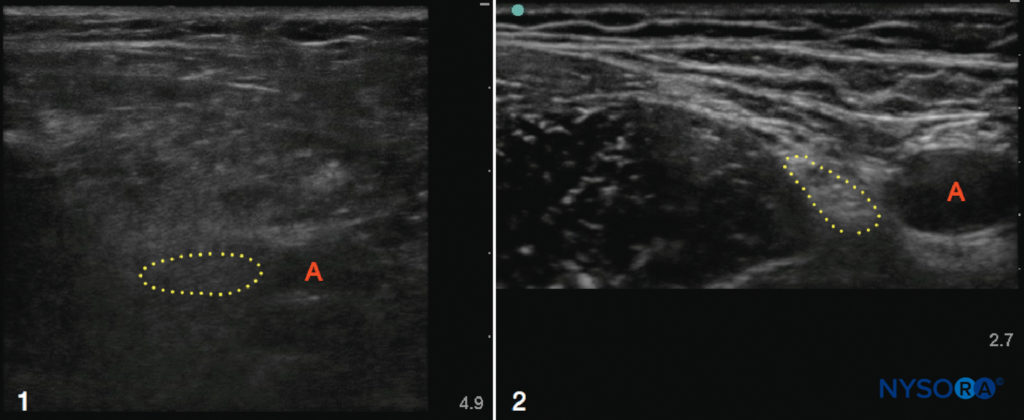
FIGURA 2. Ecografías de las regiones femorales en un paciente obeso (1) y un paciente delgado (2). Tenga en cuenta la mayor profundidad requerida para obtener imágenes de la arteria (A) y el nervio (contorno punteado) en el ejemplo obeso, así como la mala calidad de resolución general debido al exceso de tejido adiposo. Por el contrario, los planos nervioso, arterial, muscular y fascial en el paciente delgado son nítidos y bien definidos.
La obesidad puede tener un efecto sobre la dosificación de medicamentos espinales, aunque el tema es algo controvertido. Una noción común es que el aumento de la masa abdominal conduce a la compresión del volumen intratecal por la congestión de los plexos epidurales, lo que lleva a un aumento de la altura del bloqueo, y potencialmente peligroso, durante la anestesia espinal. Esto está respaldado por datos que correlacionan la altura del bloque con el peso del paciente durante la anestesia espinal estandarizada para la cistoscopia. De hecho, algunos autores han defendido la consideración de la anestesia espinal de "dosis baja" en los obesos mórbidos, debido a las amplias variaciones en sus requisitos de dosificación. En una parturienta con sobrepeso extremo (IMC = 66 kg/m2), la cesárea se completó con éxito con una dosis espinal de 5 mg de bupivacaína como único agente anestésico. Sin embargo, el peso del paciente no se correlaciona necesariamente con el grado de compresión del saco tecal, y muchos investigadores han argumentado que el peso por sí solo no es un predictor confiable de la altura del bloqueo durante la anestesia espinal. Un estudio de búsqueda de dosis de bupivacaína hiperbárica en pacientes que se sometieron a un reemplazo de rodilla no encontró diferencias en la dosis requerida para lograr un bloqueo de T12 entre pacientes obesos y no obesos, pero sí encontró una duración del bloqueo ligeramente más larga y una incidencia reducida de dolor de torniquete en el grupo obeso . Sin embargo, ningún paciente en el grupo obeso tenía un IMC superior a 40, por lo que estos hallazgos pueden no ser un reflejo de la población con obesidad mórbida. Probablemente sea razonable abordar la dosificación espinal de los pacientes con obesidad mórbida con cierto grado de precaución y, cuando sea práctico, ajustar gradualmente la dosis anestésica.
Referencias
- Duggan M, Kavanagh BP: Modificaciones perioperatorias de la función respiratoria. Best Pract Res Clin Anaesthesiol 2010;24:145–155.
- Cuschieri RJ, Morran CG, Howie JC, McArdle CS: Dolor posoperatorio y complicaciones pulmonares: comparación de tres regímenes analgésicos. Br J Surg 1985;72:495–498.
- Ballantyne JC, Carr DB, deFerranti S, Suarez T, Lau J, Chalmers TC, Angelillo IF, Mosteller F: Los efectos comparativos de las terapias analgésicas postoperatorias sobre el resultado pulmonar: metanálisis acumulativos de ensayos controlados aleatorios. Anesth Analg 1998;86:598–612.
- Slinger P, Shennib H, Wilson S: función pulmonar posterior a la toracotomía: una comparación de infusiones epidurales versus intravenosas de meperidina. J Cardiothorac Vasc Anesth 1995;9:128–134.
- Lier F van, Geest PJ van der, Hoeks SE, et al: La analgesia epidural se asocia con mejores resultados de salud de pacientes quirúrgicos con enfermedad pulmonar obstructiva crónica. Anestesiología 2011;115:315–321.
- Neuman MD, Silber JH, Elkassabany NM, Ludwig JM, Fleisher LA: eficacia comparativa de la anestesia regional frente a la general para la cirugía de fractura de cadera en adultos. Anestesiología 2012;117:72–92.
- Cousins MJ, Veering B. Bloqueo neural epidural. En: Cousins MJ, Bridenbaugh PO, Carr DB, Horlocker TT (eds), Cousins and Bridenbaugh's Neural block in Clinical Anesthesia and Pain Medicine, 4.ª ed. Filadelfia: Lippincott Williams & Wilkins, 2008.
- Michalek P, David I, Adamec M, Janousek L: Anestesia epidural cervical para procedimiento combinado de cuello y extremidades superiores: un estudio piloto. Anesth Analg 2004;99:1833–1836, índice.
- Eisele J, Trenchard D, Burki N, Guz A: El efecto del bloqueo de la pared torácica sobre la sensación y el control respiratorios en el hombre. Clin Sci 1968;35:23–33.
- Kochi T, Sako S, Nishino T, Mizuguchi T: Efecto de la anestesia extradural torácica alta sobre la respuesta ventilatoria a la hipercapnia en voluntarios normales. Hermano J Anaesth 1989;62:362–367.
- Yamakage M, Namiki A, Tsuchida H, Iwasaki H: cambios en el patrón ventilatorio y la saturación de oxígeno arterial durante la anestesia espinal en el hombre. Acta Anaesthesiol Scand 1992;36:569–571.
- Warner DO, Warner MA, Ritman EL: Función de la pared torácica humana durante la anestesia epidural. Anestesiología 1996;85:761–773.
- Troyer A De, Kelly S: Acción de los músculos accesorios del cuello en la caja torácica de los perros. J Appl Physiol Respir Environ Exerc Physiol 1984;56:326–332.
- Labaille T, Clergue F, Samii K, Ecoffey C, Berdeaux A: respuesta ventilatoria al CO2 después de la lidocaína intravenosa y epidural. Anestesiología 1985;63:179–183.
- Sakura S, Saito Y, Kosaka Y: Efecto de la anestesia epidural lumbar sobre la respuesta ventilatoria a la hipercapnia en pacientes jóvenes y ancianos. J Clin Anesth 1993;5:109–113.
- Sakura S, Saito Y, Kosaka Y: Los efectos de la anestesia epidural en la respuesta ventilatoria a la hipercapnia y la hipoxia en pacientes de edad avanzada. Anesth Analg 1996;82:306–311.
- McCarthy GS: El efecto de la analgesia extradural torácica sobre la distribución de gas pulmonar, la capacidad residual funcional y el cierre de las vías respiratorias. Hermano J Anaesth 1976;48:243–248.
- Lundh R, Hedenstierna G, Johansson H: relaciones ventilación-perfusión durante la analgesia epidural. Acta Anaesthesiol Scand 1983;27: 410–416.
- Reber A, Bein T, Högman M, Khan ZP, Nilsson S, Hedenstierna G: Aireación pulmonar e intercambio de gases pulmonares durante la anestesia epidural lumbar y en posición de litotomía en pacientes de edad avanzada. Anestesia 1998;53:854–861.
- Moir DD: función ventilatoria durante la analgesia epidural. Hermano J Anaesth 1963;35:3–7.
- Groeben H, Schäfer B, Pavlakovic G, Silvanus MT, Peters J: Función pulmonar bajo anestesia epidural segmentaria torácica alta con ropivacaína o bupivacaína en pacientes con enfermedad pulmonar obstructiva grave que se someten a cirugía mamaria. Anestesiología 2002;96: 536–541.
- Arndt JO, Höck A, Stanton-Hicks M, Stühmeier KD: Anestesia peridural y distribución de sangre en humanos en decúbito supino. Anestesiología 1985;63:616–623.
- Capdevila X, Biboulet P, Rubenovitch J, Serre-Cousine O, Peray P, Deschodt J, Athis F d': Los efectos de la anestesia epidural cervical con bupivacaína sobre la función pulmonar en pacientes conscientes. Anesth Analg 1998;86:1033–1038.
- Kolker AR, Hirsch CJ, Gingold BS, Stamatos JM, Wallack MK: Uso de anestesia epidural y ventilación espontánea durante procedimientos transabdominales de colon y recto en grupos seleccionados de pacientes de alto riesgo. Dis Colon Rectum 1997;40:339–343. Técnica de anestesia y mortalidad después de una artroplastia total de cadera o rodilla: un estudio de cohorte retrospectivo emparejado por puntuación de propensión. Perlas A, Chan VW, Beattie S. Anestesiología. 2016 octubre; 125 (4): 724–31.
- Liu S, Carpenter RL, Neal JM: Anestesia y analgesia epidural. Su papel en el resultado postoperatorio. Anestesiología 1995;82: 1474–1506.
- Rodgers A, Walker N, Schug S, et al: Reducción de la mortalidad y morbilidad postoperatorias con anestesia epidural o espinal: resultados de la descripción general de ensayos aleatorios. BMJ 2000;321:1493.
- Wahba WM, Don HF, Craig DB: Analgesia epidural posoperatoria: efectos sobre los volúmenes pulmonares. Can Anaesth Soc J 1975;22:519–527.
- Yeager MP, Glass DD, Neff RK, Brinck-Johnsen T: Anestesia y analgesia epidural en pacientes quirúrgicos de alto riesgo. Anestesiología 1987;66: 729–736.
- Christopherson R, Beattie C, Frank SM, et al: Morbilidad perioperatoria en pacientes asignados al azar a anestesia epidural o general para cirugía vascular de las extremidades inferiores. Grupo de estudio de ensayo de anestesia aleatoria de isquemia perioperatoria. Anestesiología 1993;79:422–434.
- Urmey WF, Talts KH, Sharrock NE: Cien por ciento de incidencia de paresia hemidiafragmática asociada con la anestesia del plexo braquial interescalénico diagnosticada por ultrasonografía. Anesth Analg 1991;72: 498–503.
- Urmey WF, McDonald M: Paresia hemidiafragmática durante el bloqueo del plexo braquial interescalénico: efectos sobre la función pulmonar y la mecánica de la pared torácica. Anesth Analg 1992;74:352–357.
- Sinha SK, Abrams JH, Barnett JT, et al: La disminución del volumen de anestésico local de 20 a 10 ml para el bloqueo interescalénico guiado por ecografía a nivel del cricoides no reduce la incidencia de paresia hemidiafragmática. Reg Anesth Pain Med 2011;36:17–20.
- Lee JH, Cho SH, Kim SH, et al: Ropivacaína para el bloqueo interescalénico guiado por ecografía: 5 ml proporcionan una analgesia similar pero menos parálisis del nervio frénico que 10 ml. Can J Anaesth 2011;58:1001–1006.
- Riazi S, Carmichael N, Awad I, Holtby RM, McCartney CJL: Efecto del volumen de anestésico local (20 frente a 5 ml) sobre la eficacia y las consecuencias respiratorias del bloqueo interescalénico del plexo braquial guiado por ecografía. Hermano J Anaesth 2008;101:549–556.
- Koscielniak-Nielsen ZJ: paresia hemidiafragmática después de la suplementación interescalénico de bloqueo axilar insuficiente con 3 ml de mepivacaína al 2%. Acta Anaesthesiol Scand 2000;44:1160–1162.
- Knoblanche GE: La incidencia y etiología del bloqueo del nervio frénico asociado con el bloqueo del plexo braquial supraclavicular. Anaesth Cuidados Intensivos 1979;7:346–349.
- Mak PH, Irwin MG, Ooi CG, Chow BF: Incidencia de la parálisis diafragmática después del bloqueo supraclavicular del plexo braquial y su efecto sobre la función pulmonar. Anestesia 2001;56:352–356.
- Neal JM, Moore JM, Kopacz DJ, Liu SS, Kramer DJ, Plorde JJ: Análisis cuantitativo de la función respiratoria, motora y sensorial después del bloqueo supraclavicular. Anesth Analg 1998;86:1239–1244.
- Renes SH, Spoormans HH, Gielen MJ, Rettig HC, Geffen GJ van: La paresia hemidiafragmática se puede evitar en el bloqueo del plexo braquial supraclavicular guiado por ecografía. Reg Anesth Pain Med 2009;34: 595–599.
- Rodríguez J, Bárcena M, Rodríguez V, Aneiros F, Alvarez J: Efectos del bloqueo del plexo braquial infraclavicular sobre la función respiratoria y la extensión del bloqueo. Reg Anesth Pain Med 1998;23:564–568.
- Dullenkopf A, Blumenthal S, Theodorou P, Roos J, Perschak H, Borgeat A: Excursión diafragmática y función respiratoria después de la técnica de Raj modificada del bloqueo del plexo infraclavicular. Reg Anesth Pain Med 2004;29:110–114.
- Gentili ME, Deleuze A, Estèbe JP, Lebourg M, Ecoffey C: Insuficiencia respiratoria grave tras bloqueo infraclavicular con ropivacaína al 0.75%: reporte de un caso. J Clin Anesth 2002;14:459–461.
- Yang CW, Jung SM, Kwon HU, Kang PS, Cho CK, Choi HJ: paresia hemidiafragmática transitoria después del bloqueo infraclavicular sagital lateral guiado por ecografía. J Clin Anesth 2013;25:496–498.
- Bigeleisen PE: variaciones anatómicas del nervio frénico y su implicación clínica para el bloqueo supraclavicular. Br J Anaesth 2003; 91:916–917.
- Verelst P, Zundert A van: Impacto respiratorio de las estrategias analgésicas para la cirugía de hombro. Reg Anesth Pain Med 2013;38:50–53.
- Martínez J, Sala-Blanch X, Ramos I, Gomar C: Bloqueo combinado del plexo infraclavicular con bloqueo del nervio supraescapular para la cirugía de la cabeza humeral en un paciente con insuficiencia respiratoria: una alternativa de abordaje. Anestesiología 2003;98:784–785.
- Ilfeld BM, Morey TE, Wright TW, Chidgey LK, Enneking FK: Bloqueo interescalénico continuo del plexo braquial para el control del dolor posoperatorio en el hogar: un estudio aleatorizado, doble ciego, controlado con placebo. anesth. Anal. 2003; 96:1089–1095, índice
- Mariano ER, Afra R, Loland VJ, et al: Bloqueo interescalénico continuo del plexo braquial a través de un abordaje posterior guiado por ecografía: un estudio aleatorizado, con triple enmascaramiento y controlado con placebo. Anesth Analg 2009;108:1688–1694.
- Souron V, Reiland Y, Delaunay L: Derrame pleural y dolor torácico después del bloqueo interescalénico continuo del plexo braquial. Reg Anesth Pain Med 2003;28:535–538.
- Sardesai AM, Chakrabarti AJ, Denny NM: Colapso del lóbulo inferior durante la anestesia local continua del plexo braquial interescalénico en el hogar. Reg Anesth Pain Med 2004;29:65–68.
- Ilfeld BM, Morey TE, Wright TW, Chidgey LK, Enneking FK: infusión de ropivacaína perineural interescalénico: una comparación de dos regímenes de dosificación para la analgesia posoperatoria. Reg Anesth Pain Med 2004;29: 9–16.
- Borgeat A, Perschak H, Bird P, Hodler J, Gerber C: Analgesia interescalénica controlada por el paciente con ropivacaína al 0.2 % versus analgesia intravenosa controlada por el paciente después de una cirugía mayor de hombro: efectos sobre la función diafragmática y respiratoria. Anestesiología 2000;92: 102–108.
- Ilfeld BM, Le LT, Ramjohn J, et al: Los efectos de la concentración y la dosis del anestésico local en los bloqueos nerviosos infraclaviculares continuos: un estudio multicéntrico, aleatorizado, con observador enmascarado y controlado. Anesth Analg 2009;108:345–350.
- Maurer K, Ekatodramis G, Hodler J, Rentsch K, Perschak H, Borgeat A: bloqueo interescalénico continuo bilateral del plexo braquial para la analgesia después de una artroplastia de hombro bilateral. Anestesiología 2002;96:762–764.
- Salinas FV: Ubicación, ubicación, ubicación: bloqueos continuos de nervios periféricos y catéteres estimulantes. Reg Anesth Pain Med 2003;28:79–82.
- Souron V, Reiland Y, Traverse A De, Delaunay L, Lafosse L: Migración interpleural de un catéter interescalénico. Anesth Analg 2003;97:1200–1201.
- Faust A, Fournier R, Hagon O, Hoffmeyer P, Gamulin Z: Déficit sensorial y motor parcial de la extremidad inferior ipsilateral después del bloqueo interescalénico continuo del plexo braquial. Anesth Analg 2006;102:288–290.
- Osinowo OA, Zahrani M, Softah A: Efecto del bloqueo del nervio intercostal con bupivacaína al 0.5 % sobre la tasa de flujo espiratorio máximo y la saturación de oxígeno arterial en las fracturas de costillas. J Trauma 2004;56:345–347.
- Truitt MS, Murry J, Amos J, et al: Bloqueo continuo del nervio intercostal para fracturas de costillas: ¿listo para el horario de máxima audiencia? J Trauma 2011;71:1548–1552; discusión 1552.
- Karmakar MK, Critchley LAH, Ho AM-H, Gin T, Lee TW, Yim APC: infusión paravertebral torácica continua de bupivacaína para el tratamiento del dolor en pacientes con múltiples costillas fracturadas. Cofre 2003;123: 424–431.
- Murata H, Salviz EA, Chen S, Vandepitte C, Hadzic A: Informe de caso: bloqueo paravertebral torácico continuo guiado por ecografía para el tratamiento ambulatorio del dolor agudo de fracturas costales unilaterales multinivel. Anesth Analg 2013;116:255–257.
- Buckley M, Edwards H, Buckenmaier CC 3rd, Plunkett AR: Bloqueo nervioso paravertebral torácico continuo en un residente de anestesia que trabaja, cuando los opioides no son una opción. Mil Med 2011; 176: 578–580.
- Richardson J, Sabanathan S, Shah R: Función pulmonar espirométrica posterior a la toracotomía: el efecto de la analgesia. Una revisión. J Cardiovasc Surg (Torino) 1999;40:445–456.
- Davies RG, Myles PS, Graham JM: Una comparación de la eficacia analgésica y los efectos secundarios del bloqueo paravertebral versus epidural para la toracotomía: una revisión sistemática y metanálisis de ensayos aleatorios. Hermano J Anaesth 2006;96:418–426.
- Richardson J, Sabanathan S, Jones J, Shah RD, Cheema S, Mearns AJ: una comparación prospectiva y aleatoria de bupivacaína epidural o paravertebral equilibrada preoperatoria y continua sobre el dolor postoracotomía, la función pulmonar y las respuestas al estrés. Hermano J Anaesth 1999;83: 387–392.
- Thomas PW, Sanders DJ, Berrisford RG: Hemorragia pulmonar después del bloqueo paravertebral percutáneo. Br. J. Anaesth 1999; 83:668–669.
- Fine PG, Bubela C: Quilotórax tras bloqueo del plexo celíaco. Anestesiología 1985;63:454–456.
- Shanti CM, Carlin AM, Tyburski JG: Incidencia de neumotórax por bloqueo de nervios intercostales para analgesia en fracturas de costillas. J Trauma 2001;51: 536–539.
- Naja Z, Lönnqvist PA: Bloqueo nervioso paravertebral somático. Incidencia de bloqueo fallido y complicaciones. Anestesia 2001;56:1184–1188.
- Borgeat A, Ekatodramis G, Kalberer F, Benz C: Complicaciones agudas y no agudas asociadas con el bloqueo interescalénico y la cirugía del hombro: un estudio prospectivo. Anestesiología 2001;95:875–880.
- Brown DL, Cahill DR, Bridenbaugh LD: Bloqueo del nervio supraclavicular: análisis anatómico de un método para prevenir el neumotórax. Anesth Analg 1993;76:530–534.
- Bhatia A, Lai J, Chan VWS, Brull R: Informe de caso: neumotórax como complicación del abordaje supraclavicular guiado por ultrasonido para bloqueo del plexo braquial. Anesth Analg 2010;111:817–819.
- Klaastad Ø, Smith HJ, Smedby O, et al: Un nuevo bloqueo del plexo braquial infraclavicular: la técnica lateral y sagital, desarrollada por estudios de resonancia magnética. Anesth Analg 2004;98:252–256, índice.
- Chan VWS, Perlas A, Rawson R, Odukoya O: Bloqueo del plexo braquial supraclavicular guiado por ecografía. Anesth Analg 2003;97:1514–1517.
- Perlas A, Lobo G, Lo N, Brull R, Chan VWS, Karkhanis R: Bloqueo supraclavicular guiado por ultrasonido: resultado de 510 casos consecutivos. Reg Anesth Pain Med 2009;34:171–176.
- Gauss A, Tugtekin I, Georgieff M, Dinse-Lambracht A, Keipke D, Gorsewski G: Incidencia de neumotórax clínicamente sintomático en el bloqueo del plexo braquial infraclavicular y supraclavicular guiado por ecografía. Anestesia 2014;69:327–336.
- Fenoglio C, Boicelli CA, Ottone M, Addario C, Chiari P, Viale M: efecto protector del clorhidrato de procaína en las alteraciones inducidas por cisplatino en el riñón de rata. Medicamentos contra el cáncer 2002;13:1043–1054.
- Navar LG: Autorregulación renal: perspectivas de estudios de riñón completo y nefrona única. Am J Physiol 1978;234:F357–F370.
- Suleiman MY, Passannante AN, Onder RL, Greene-Helms WF, Perretta SG: Alteración del flujo sanguíneo renal durante la anestesia epidural en sujetos normales. Anesth Analg 1997;84:1076–1080.
- Rooke GA, Freund PR, Jacobson AF: Respuesta hemodinámica y cambio en el volumen de sangre de los órganos durante la anestesia espinal en hombres ancianos con enfermedad cardíaca. Anesth Analg 1997;85:99–105.
- Sivarajan M, Amory DW, Lindbloom LE, Schwettmann RS: cambios sistémicos y regionales del flujo sanguíneo durante la anestesia espinal en el mono rhesus. Anestesiología 1975;43:78–88.
- Hopf HB, Schlaghecke R, Peters J: El bloqueo neural simpático por anestesia epidural torácica suprime la liberación de renina en respuesta a la hipotensión arterial. Anestesiología 1994;80:992–999; discusión 27A–28A.
- Hadimioglu N, Ulugol H, Akbas H, Coskunfirat N, Ertug Z, Dinckan A: La combinación de anestesia epidural y anestesia general atenúa la respuesta de estrés a la cirugía de trasplante renal. Transplant Proc 2012;44: 2949–2954.
- Ricaurte L, Vargas J, Lozano E, Díaz L, Organ Transplant Group: Anestesia y trasplante renal. Transplant Proc 2013;45:1386–1391.
- Sener M, Torgay A, Akpek E, et al: Anestesia regional versus general para la nefrectomía del donante: efectos sobre la función del injerto. Proceso de trasplante 2004; 36:2954–2958.
- Gould DB, Aldrete JA: Cardiotoxicidad de la bupivacaína en un paciente con insuficiencia renal. Acta Anaesthesiol Scand 1983; 27:18–21.
- Lucas LF, Tsueda K: Depresión cardiovascular después del bloqueo del plexo braquial en dos pacientes diabéticos con insuficiencia renal. Anestesiología 1990;73: 1032–1035.
- Coyle DE, Denson DD, Thompson GA, Myers JA, Arthur GR, Bridenbaugh PO: La influencia del ácido láctico en la unión a proteínas séricas de la bupivacaína: diferencias entre especies. Anestesiología 1984;61:127–133.
- Avery P, Redon D, Schaenzer G, Rusy B: La influencia del potasio sérico en la toxicidad cerebral y cardíaca de la bupivacaína y la lidocaína. Anestesiología 1984;61:134–138.
- Pere P, Salonen M, Jokinen M, Rosenberg PH, Neuvonen PJ, Haasio J: Farmacocinética de la ropivacaína en pacientes urémicos y no urémicos después del bloqueo del plexo braquial axilar. Anesth Analg 2003;96:563–569, índice.
- Rodríguez J, Quintela O, López-Rivadulla M, Bárcena M, Diz C, Alvarez J: Altas dosis de mepivacaína para el bloqueo del plexo braquial en pacientes con insuficiencia renal crónica terminal. Un estudio piloto. Eur J Anaesthesiol 2001;18:171–176.
-
Mostert JW, Evers JL, Hobika GH, Moore RH, Kenny GM, Murphy GP: La respuesta hemodinámica a la insuficiencia renal crónica estudiada en el estado azotémico. Hermano J Anaesth 1970;42:397–411.
-
Vasson MP, Baguet JC, Arveiller MR, Bargnoux PJ, Giroud JP, Raichvarg D: Glicoproteína ácida alfa-1 sérica y urinaria en la insuficiencia renal crónica. Nephron 1993;65:299–303.
-
Mather LE, Thomas J: Unión de bupivacaína a fracciones de proteínas plasmáticas. J Pharm Pharmacol 1978;30:653–654.
-
Vaziri ND, Saiki JK, Hughes W: Aclaramiento de lidocaína por hemodiálisis. South Med J 1979; 72: 1567–1568.
-
Shih YH, Chen CH, Wang YM, Liu K: Reversión exitosa de la bradicardia de unión severa inducida por bupivacaína y lidocaína mediante emulsión de lípidos después del bloqueo del plexo braquial infraclavicular en un paciente urémico. Acta Anaesthesiol Taiwán 2011;49:72–74.
-
Lange DB, Schwartz D, DaRoza G, Gair R: Uso de emulsión de lípidos intravenosos para revertir la toxicidad del sistema nervioso central de una sobredosis de anestésico local iatrogénico en un paciente en diálisis peritoneal. Ann Pharmacother 2012;46:e37.
-
Rice AS, Pither CE, Tucker GT: Concentraciones plasmáticas de bupivacaína después del bloqueo supraclavicular del plexo braquial en pacientes con insuficiencia renal crónica. Anestesia 1991;46:354–357.
-
McEllistrem RF, Schell J, O'Malley K, O'Toole D, Cunningham AJ: Bloqueo interescalénico del plexo braquial con lidocaína en la insuficiencia renal crónica: un estudio farmacocinético. Can J Anaesth 1989;36:59–63.
-
Orko R, Pitkänen M, Rosenberg PH: Anestesia subaracnoidea con bupivacaína al 0.75 % en pacientes con insuficiencia renal crónica. Hermano J Anaesth 1986;58:605–609.
-
Gawaz MP, Dobos G, Späth M, Schollmeyer P, Gurland HJ, Mujais SK: Deterioro de la función de la glicoproteína IIb-IIIa de la membrana plaquetaria en la enfermedad renal en etapa terminal. J Am Soc Nephrol 1994;5:36–46.
-
Grejda S, Ellis K, Arino P: Paraplejía después de la anestesia espinal en un paciente con insuficiencia renal crónica. Reg Anesth 1989; 14:155–157.
-
Boccardo P, Remuzzi G, Galbusera M: Disfunción plaquetaria en insuficiencia renal. Semin Thromb Hemost 2004;30:579–589.
-
Rose M, Ness TJ: Hipoxia después del bloqueo interescalénico. Reg Anesth Pain Med 2002;27:94–96.
-
Alsalti RA, el-Dawlatly AA, al-Salman M, et al: Fístula arteriovenosa en pacientes con insuficiencia renal crónica: comparación entre tres técnicas anestésicas diferentes. Oriente Medio J Anaesthesiol 1999;15:305–314.
-
Solomonson MD, Johnson ME, Ilstrup D: Factores de riesgo en pacientes sometidos a cirugía para crear una fístula arteriovenosa. Anesth Analg 1994;79:694–700.
-
Elsharawy MA, Al-Metwalli R: ¿La anestesia regional influye en el resultado temprano de la fístula arteriovenosa en la parte superior del brazo? Saudi J Kidney Dis Transpl 2010;21:1048–1052.
-
Mouquet C, Bitker MO, Bailliart O, et al: Anestesia para la creación de una fístula en el antebrazo en pacientes con insuficiencia renal terminal. Anestesiología 1989;70:909–914.
-
Malinzak EB, Gan TJ: Anestesia regional para cirugía de acceso vascular. Anesth Analg 2009;109:976–980.
-
Schenk WG: Mejora del acceso a la diálisis: la anestesia regional mejora la prevalencia de la fístula arteriovenosa. Am Surg 2010;76:938–942.
-
Sahin L, Gul R, Mizrak A, et al: El bloqueo del plexo braquial infraclavicular guiado por ecografía mejora el flujo sanguíneo posoperatorio en las fístulas arteriovenosas. J Vasc Surg 2011;54:749–753.
-
Rahimzadeh P, Safari S, Faiz SHR, Alavian SM: Anestesia para pacientes con enfermedad hepática. Hepat Mon 2014;14:e19881.
-
Tucker GT, Mather LE: Farmacocinética clínica de los anestésicos locales. Clin Pharmacokinet 1979;4:241–278.
-
Tucker GT, Mather LE: Farmacología de los agentes anestésicos locales. Farmacocinética de los agentes anestésicos locales. Br J Anaesth 1975; suplemento 47: 213–224.
-
Rosenberg PH, Veering BT, Urmey WF: Dosis máximas recomendadas de anestésicos locales: un concepto multifactorial. Reg Anesth Dolor Med 2004; 29:564–575; discusión 524.
-
Magorian T, Wood P, Caldwell J, et al: La farmacocinética y los efectos neuromusculares del bromuro de rocuronio en pacientes con enfermedad hepática. Anesth Analg 1995;80:754–759.
-
Servin F, Cockshott ID, Farinotti R, Haberer JP, Winckler C, Desmonts JM: Farmacocinética de las infusiones de propofol en pacientes con cirrosis. Hermano J Anaesth 1990;65:177–183.
-
Jokinen MJ, Neuvonen PJ, Lindgren L, et al: Farmacocinética de la ropivacaína en pacientes con enfermedad hepática crónica en etapa terminal. Anestesiología 2007;106:43–55.
-
Barry M, Keeling PW, Weir D, Feely J: La gravedad de la cirrosis y la relación de la concentración de glicoproteína ácida alfa 1 con la unión de lidocaína a proteínas plasmáticas. Clin Pharmacol Ther 1990;47:366–370.
-
Thomson PD, Melmon KL, Richardson JA, et al: Farmacocinética de la lidocaína en insuficiencia cardíaca avanzada, enfermedad hepática e insuficiencia renal en humanos. Ann Intern Med 1973; 78: 499–508.
-
Lauprecht AE, Wenger FA, El Fadil O, Walz MK, Groeben H: Concentraciones plasmáticas de levobupivacaína después de una resección hepática mayor. J. Anesth 2011; 25:369–375.
-
Naguib M, Magboul MM, Samarkandi AH, Attia M: Efectos adversos e interacciones farmacológicas asociadas con la anestesia local y regional. Drug Saf 1998;18:221–250.
-
Reidenberg MM, James M, Dring LG: La tasa de hidrólisis de procaína en suero de sujetos normales y pacientes enfermos. Clin Pharmacol Ther 1972;13:279–284.
-
Calvo R, Carlos R, Erill S: Efectos de la enfermedad y la acetazolamida en la hidrólisis de procaína por enzimas de glóbulos rojos. Clin Pharmacol Ther 1980;27:179–183.
-
Lautt WW, Greenway CV: Revisión conceptual del lecho vascular hepático. Hepatología 1987;7:952–963.
-
Lautt WW, Macedo MP: Circulación hepática y toxicología. Drug Metab Rev 1997;29:369–395.
-
Gelman S: Anestesia general y circulación hepática. Can J Physiol Pharmacol 1987;65:1762–1779.
-
Greitz T, Andreen M, Irestedt L: Hemodinámica y consumo de oxígeno en el perro durante el bloqueo epidural alto con especial referencia a la región esplácnica. Acta Anaesthesiol Scand 1983;27:211–217.
-
Vagts DA, Iber T, Puccini M, et al: Los efectos de la anestesia epidural torácica sobre la perfusión y la oxigenación hepáticas en cerdos sanos durante la anestesia general y el estrés quirúrgico. Anesth Analg 2003;97:1824–1832.
-
Kelly DA, Tuddenham EG: Problemas hemostáticos en la enfermedad hepática. Tripa 1986; 27: 339-349.
-
Shami VM, Caldwell SH, Hespenheide EE, Arseneau KO, Bickston SJ, Macik BG: factor VII activado recombinante para la coagulopatía en insuficiencia hepática fulminante en comparación con la terapia convencional. Trasplante de hígado 2003;9:138–143.
-
Dzik WH: Predicción de hemorragia mediante ensayos de detección de coagulación preoperatoria. Curr Hematol Rep 2004;3:324–330.
-
Horlocker TT, Wedel DJ, Rowlingson JC, et al: Anestesia regional en el paciente que recibe terapia antitrombótica o trombolítica: Directrices basadas en la evidencia de la Sociedad Estadounidense de Anestesia Regional y Medicina del Dolor (tercera edición). Reg Anesth Pain Med 2010;35:64–101.
-
Tzimas P, Prout J, Papadopoulos G, Mallett SV: Anestesia y analgesia epidural para la resección hepática. Anestesia 2013;68:628–635.
-
Coursin DB, Connery LE, Ketzler JT: problemas de manejo perioperatorio de diabetes e hiperglucemia. Crit Care Med 2004;32:S116–S125.
-
Greene DA, Stevens MJ, Feldman EL: Neuropatía diabética: alcance del síndrome. Am J Med 1999;107:2S–8S.
-
Downs CA, Faulkner MS: Estrés tóxico, inflamación y sintomatología de complicaciones crónicas en diabetes. World J Diabetes 2015;6: 554–565.
-
Kalichman MW, Calcutt NA: Bloqueo de conducción inducido por anestésicos locales y lesión de fibras nerviosas en ratas diabéticas con estreptozotocina. Anestesiología 1992;77:941–947.
-
Al-Nasser B: Efectos tóxicos de la analgesia epidural con ropivacaína al 0.2% en un paciente diabético. J Clin Anesth 2004;16:220–223.
-
Cuvillon P, Reubrecht V, Zoric L, et al: Comparación de la duración del bloqueo del nervio ciático subglúteo en pacientes diabéticos y no diabéticos tipo 2. Hermano J Anaesth 2013;110:823–830.
-
Sertoz N, Deniz MN, Ayanoglu HO: Relación entre el nivel de hemoglobina glicosilada y el rendimiento del bloqueo del nervio ciático en pacientes diabéticos. Pie Tobillo Int 2013;34:85–90.
-
Kroin JS, Buvanendran A, Tuman KJ, Kerns JM: Efecto del control glucémico agudo versus continuo sobre la duración del bloqueo del nervio ciático con anestesia local en ratas diabéticas. Reg Anesth Pain Med 2012;37:595–600.
-
Gronwald C, Vowinkel T, Hahnenkamp K: Procedimientos anestésicos regionales en pacientes inmunodeprimidos: riesgo de infección. Curr Opin Anaesthesiol 2011;24:698–704.
-
Sitios BD, Gallagher J, Sparks M: El bloqueo poplíteo guiado por ecografía demuestra una respuesta motora atípica a la estimulación nerviosa en 2 pacientes con diabetes mellitus. Reg Anesth Pain Med 2003;28:479–482.
-
Keyl C, Held T, Albiez G, Schmack A, Wiesenack C: Aumento del umbral de estimulación nerviosa eléctrica del nervio ciático en pacientes con gangrena del pie diabético: un estudio prospectivo de cohortes paralelas. Eur J Anaesthesiol 2013;30:435–440.
-
Partanen J, Niskanen L, Lehtinen J, Mervaala E, Siitonen O, Uusitupa M: Historia natural de la neuropatía periférica en pacientes con diabetes mellitus no insulinodependiente. N Engl J Med 1995;333:89–94.
-
Krinsley JS: Efecto de un protocolo intensivo de manejo de glucosa en la mortalidad de pacientes adultos críticamente enfermos. Mayo Clin Proc 2004;79: 992–1000.
- Falciglia M, Freyberg RW, Almenoff PL, D'Alessio DA, Render ML: La mortalidad relacionada con la hiperglucemia en pacientes en estado crítico varía según el diagnóstico de ingreso. Crit Care Med 2009;37:3001–3009.
- Sung J, Bochicchio GV, Joshi M, Bochicchio K, Tracy K, Scalea TM: La hiperglucemia al ingreso predice el resultado en pacientes traumatizados en estado crítico. J Trauma 2005;59:80–83.
- Jensen CH, Berthelsen P, Kühl C, Kehlet H: Efecto de la analgesia epidural sobre la tolerancia a la glucosa durante la cirugía. Acta Anaesthesiol Scand 1980;24: 472–474.
- Houghton A, Hickey JB, Ross SA, Dupre J: Tolerancia a la glucosa durante la anestesia y la cirugía. Comparación de anestesia general y extradural. Hermano J Anaesth 1978;50:495–499.
- Møller IW, Hjortsø E, Krantz T, Wandall E, Kehlet H: El efecto modificador de la anestesia espinal en la respuesta hiperglucémica y corticosuprarrenal intra y posoperatoria a la cirugía. Acta Anaesthesiol Scand 1984;28:266–269.
- Barker JP, Robinson PN, Vafidis GC, Hart GR, Sapsed-Byrne S, Hall GM: La analgesia local previene las respuestas de cortisol y glucémica a la cirugía de cataratas. Hermano J Anaesth 1990;64:442–445.
- Vogt G, Heiden M, Lösche CC, Lipfert P: Un bloqueo retrobulbar preoperatorio en pacientes sometidos a cerclaje escleral reduce el dolor, la respuesta al estrés endógeno y mejora la vigilancia. Reg Anesth Pain Med 2003;28: 521–527.
- Milosavljevic SB, Pavlovic AP, Trpkovic SV, Ilić AN, Sekulic AD: Influencia de la anestesia espinal y general en la respuesta metabólica, hormonal y hemodinámica en pacientes quirúrgicos electivos. Med Sci Monit 2014;20:1833–1840.
- Camu F: intolerancia a los carbohidratos durante la anestesia con halotano en perros. Acta Anaesthesiol Belg 1973;24:177–188.
- Richardson J, Jones J, Atkinson R: El efecto del bloqueo paravertebral torácico en los potenciales evocados somatosensoriales intercostales. Anesth Analg 1998;87:373–376.
- Mendell JR, Sahenk Z: Práctica clínica. Neuropatía sensorial dolorosa. N Engl J Med 2003;348:1243–1255.
- Duyff RF, Bosch J Van den, Laman DM, Loon BJ van, Linssen WH: Hallazgos neuromusculares en la disfunción tiroidea: un estudio prospectivo clínico y de electrodiagnóstico. J Neurol Neurosurg Psychiatr 2000;68: 750–755.
- Misiunas A, Niepomniszcze H, Ravera B, Faraj G, Faure E: Neuropatía periférica en el hipotiroidismo subclínico. Tiroides 1995;5:283–286.
- Khedr EM, El Toony LF, Tarkhan MN, Abdella G: Alteraciones del sistema nervioso central y periférico en el hipotiroidismo: hallazgos electrofisiológicos. Neuropsicobiología 2000;41:88–94.
- Shirabe T, Tawara S, Terao A, Araki S: Polineuropatía mixedematosa: un estudio microscópico de luz y electrónico del nervio periférico y el músculo. J Neurol Neurosurg Psychiatr 1975;38:241–247.
- Upton AR, McComas AJ: El doble aplastamiento en los síndromes de atrapamiento nervioso. Lancet 1973; 2: 359–362.
- Hebl JR, Horlocker TT, Pritchard DJ: Plexopatía braquial difusa después del bloqueo interescalénico en un paciente que recibe quimioterapia con cisplatino: el síndrome de doble aplastamiento farmacológico. Anesth Analg 2001;92:249–251.
- Schenker M, Kraftsik R, Glauser L, Kuntzer T, Bogousslavsky J, Barakat-Walter I: La hormona tiroidea reduce la pérdida de neuronas sensoriales axotomizadas en los ganglios de la raíz dorsal después de la sección del nervio ciático en ratas adultas. Exp. Neurol 2003;184:225–236.
- Norcross-Nechay K, Richards GE, Cavallo A: Los potenciales evocados muestran anomalías tempranas y tardías en niños con hipotiroidismo congénito. Neuropediatría 1989;20:158–163.
- Organización Mundial de la Salud. Obesidad y sobrepeso. Actualizado en enero de 2015. http://www.who.int/mediacentre/factsheets/fs311/en/.
- Centros de Control y Prevención de Enfermedades. Obesidad y sobrepeso para profesionales: datos y estadísticas; hechos. Actualizado el 14 de septiembre de 2015. http://www.cdc.gov/obesity/data/facts.html.
- Broadbent CR, Maxwell WB, Ferrie R, Wilson DJ, Gawne-Cain M, Russell R: capacidad de los anestesistas para identificar un espacio intermedio lumbar marcado. Anestesia 2000;55:1122–1126.
- Nielsen KC, Guller U, Steele SM, Klein SM, Greengrass RA, Pietrobon R: Influencia de la obesidad en la anestesia regional quirúrgica en el entorno ambulatorio: un análisis de 9,038 bloques. Anestesiología 2005;102:181–187.
- Hanouz JL, Grandin W, Lesage A, Oriot G, Bonnieux D, Gérard JL: Bloqueo del plexo braquial axilar con múltiples inyecciones: influencia de la obesidad en la tasa de fracaso y la incidencia de complicaciones agudas. Anesth Analg 2010; 111:230–233.
- Pham-Dang C, Meunier JF, Poirier P, et al: Un nuevo enfoque axilar para el bloqueo continuo del plexo braquial. Un estudio clínico y anatómico. Anesth Analg 1995;81:686–693.
- Tan WS, Spigos DG: Bloqueo del nervio ciático bajo guía fluoroscópica. Cardiovasc Intervent Radiol 1986; 9:59–60.
- Eidelman A, Shulman MS, Novak GM: imágenes fluoroscópicas para anestesia espinal técnicamente difícil. J Clin Anesth 2005;17:69–71.
- Brodsky JB, Mariano ER: Anestesia regional en el paciente obeso: puntos de referencia perdidos y guía ecográfica en evolución. Best Pract Res Clin Anaesthesiol 2011;25:61–72.
- Al-Nasser B: revisión del bloqueo interescalénico para la analgesia posoperatoria después de la cirugía de hombro en pacientes obesos. Acta Anaesthesiol Taiwán 2012; 50:29–34.
- Marhofer P, Pilz-Lubsczyk B, Lönnqvist PA, Fleischmann E: Anestesia regional periférica guiada por ecografía: un estudio de viabilidad en mujeres obesas versus de peso normal. Int J Obes (Londres) 2014;38:451–455.
- Wallace DH, Currie JM, Gilstrap LC, Santos R: guía ecográfica indirecta para la anestesia epidural en pacientes embarazadas obesas. Reg Anesth 1992; 17:233–236.
- Grau T, Leipold RW, Horter J, Conradi R, Martin E, Motsch J: El espacio epidural lumbar en el embarazo: visualización por ultrasonografía. Hermano J Anaesth 2001;86:798–804.
- Chin KJ, Perlas A, Chan V, Brown-Shreves D, Koshkin A, Vaishnav V: Las imágenes por ultrasonido facilitan la anestesia espinal en adultos con puntos de referencia anatómicos superficiales difíciles. Anestesiología 2011;115:94–101.
- McCulloch WJ, Littlewood DG: Influencia de la obesidad en la analgesia espinal con bupivacaína isobárica al 0.5%. Hermano J Anaesth 1986;58:610–614.
- Reyes M, Pan PH: Anestesia espinal en dosis muy bajas para cesárea en una paciente con preeclampsia con obesidad mórbida y sus posibles implicaciones. Int J Obstet Anesth 2004;13:99–102.
- Norris MC: Variables del paciente y la propagación subaracnoidea de la bupivacaína hiperbárica en la parturienta a término. Anestesiología 1990;72:478–482.
- Greene NM: Distribución de soluciones anestésicas locales dentro del espacio subaracnoideo. Anesth Analg 1985;64:715–730.
- Stienstra R, Greene NM: Factores que afectan la propagación subaracnoidea de las soluciones anestésicas locales. Reg Anesth 1991; 16:1–6.
- Kim WH, Lee JH, Ko JS, et al: El efecto del índice de masa corporal en la anestesia espinal para la artroplastia de reemplazo total de rodilla: un estudio de dosis-respuesta. Anaesth Cuidados Intensivos 2012;40:410–416.