Kenneth D. Candido, Anthony R. Tharian e Alon P. Winnie
INTRODUÇÃO
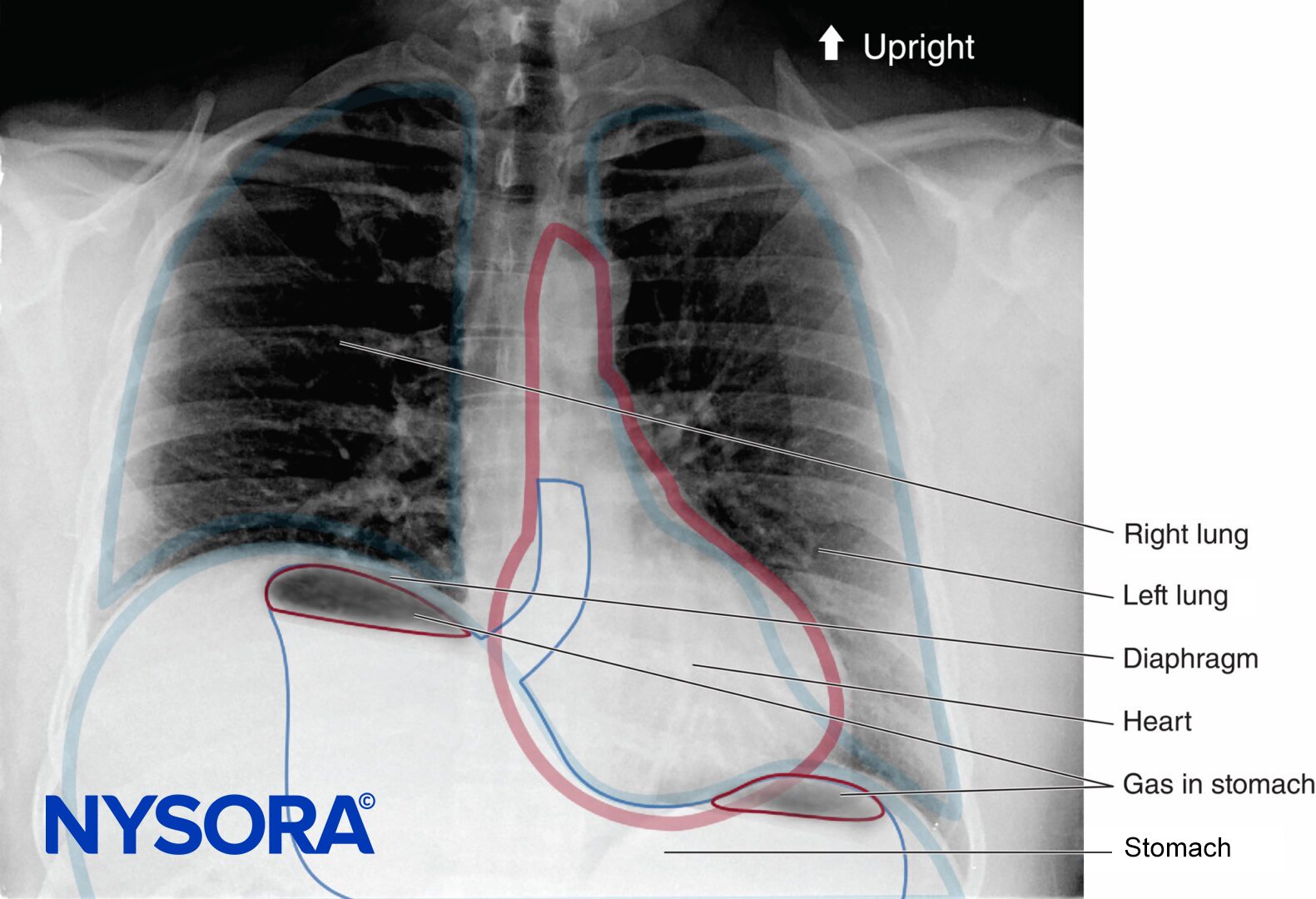
A técnica de anestesia regional intravenosa (IVRA), ou “bloqueio de Bier”, foi introduzida pela primeira vez em 1908 pelo cirurgião alemão August Bier. Um bloqueio de Bier consiste essencialmente em injetar soluções anestésicas locais no sistema venoso de uma extremidade superior ou inferior que foi exsanguinada por compressão ou gravidade e que foi isolada por meio de um torniquete da circulação central. Na técnica original de Bier, o anestésico local procaína em concentrações de 0.25% a 0.5% era injetado através de uma cânula intravenosa, que havia sido colocada entre duas bandagens de Esmarch utilizadas como torniquetes para dividir o braço em componentes proximal e distal. Após injetar o anestésico local, Bier observou dois tipos distintos de anestesia: um início quase imediato de anestesia “direta” entre os dois torniquetes e então, após um atraso de 5 a 7 minutos, uma anestesia “indireta” distalmente torniquete. Ao realizar dissecções do sistema venoso da extremidade superior em cadáveres após a injeção de azul de metileno, Bier foi capaz de determinar que a anestesia direta foi resultado da anestesia local banhando terminações nervosas nuas nos tecidos, enquanto a anestesia indireta foi provavelmente devido a anestesia local sendo transportada para a substância dos nervos via vasa nervorum, onde ocorre um típico bloqueio de condução. A conclusão de Bier foi que dois mecanismos de anestesia estavam associados a essa técnica: bloqueio de infiltração periférica e bloqueio de condução. A técnica, como originalmente descrita por Bier, permanece essencialmente inalterada na prática moderna nos últimos 106 anos, exceto pela introdução da preparação de duplo torniquete do tipo pneumático usada na prática clínica atual (XNUMX).Figura 1).
FIGURA 1.Sistema de torniquete pneumático duplo para uso em anestesia regional intravenosa da extremidade superior ou inferior.
Um bloco de Bier pode ser usado para procedimentos cirúrgicos breves ou manipulações da extremidade superior ou inferior. No entanto, a técnica encontrou sua maior aceitação para uso na extremidade superior porque problemas de torniquete e outras questões de segurança parecem surgir com mais frequência quando a ARIV é usada nas extremidades inferiores. O bloqueio de Bier também é um procedimento que encontrou utilidade como adjuvante do tratamento para pacientes que sofrem de síndromes dolorosas regionais complexas (SDRCs) (anteriormente conhecidas como distrofia simpática reflexa, com dor mantida pelo simpático) como alternativa aos bloqueios ganglionares simpáticos repetidos. Nesse sentido, a ARIV demonstrou diminuir a inflamação neurogênica, fenômeno possivelmente associado à SDRC, com pouco comprometimento da função sensorial, pelo menos quando a mepivacaína é o anestésico local escolhido para o bloqueio. A sensibilidade ao frio diminui significativamente 10 a 30 minutos após o bloqueio, mesmo com a redução da temperatura da pele no lado bloqueado.
A simpatectomia química usando ARIV com agentes como guanetidina ou bretílio pode durar até 5 dias, em comparação com bloqueios anestésicos locais, que normalmente proporcionam analgesia com duração de apenas algumas horas. Testes sensoriais quantitativos (QSART, teste quantitativo do reflexo do axônio sudomotor) antes e depois de tais bloqueios demonstraram que é possível prever quais pacientes terão alívio duradouro da dor usando bloqueios de guanetidina IVRA após lesão traumática ou cirurgia.
Embora a ARIV seja um método seguro e eficaz de administração de anestésicos locais para bloqueio de extremidades tanto para cirurgia quanto para controle da dor, uma grande pesquisa publicada observou que a maioria dos residentes de anestesia do terceiro ano (CA-3) realizou menos de 10 desses bloqueios durante todo o curso de sua formação.
ANATOMIA
A única anatomia relevante é a localização e distribuição das veias da mão, da fossa antecubital e da região do pé e tornozelo.
INDICAÇÕES
Extremidade superior
A anestesia regional intravenosa com anestésico local, mais comumente lidocaína 0.5%–1% (prilocaína 1% na Europa), é apropriada para cirurgia e manipulação das extremidades que requerem anestesia de até 1 hora de duração. É mais adequado para operações periféricas de tecidos moles, como ganglionectomia, liberação do túnel do carpo, cirurgia de contratura de Dupuytren ou redução de fraturas. No entanto, a necessidade de exsanguinar a extremidade com a bandagem de Esmarch, manobra potencialmente dolorosa, pode impossibilitar a realização de certos procedimentos com essa técnica (Figura 2 e Figura 3).
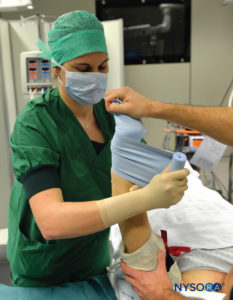
FIGURA 2.Início do processo de exsanguinação da extremidade superior esquerda elevada usando uma bandagem de Esmarch bem enrolada da mão distal até a extremidade superior proximal na base do torniquete distal.
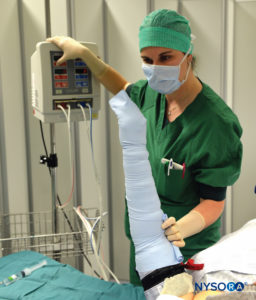
FIGURA 3. Mantendo a bandagem de Esmarch bem enrolada, primeiro os torniquetes distais e depois os proximais estão 50-100 mm Hg acima da pressão arterial sistólica.
Da mesma forma, as manipulações dos nervos ulnar, mediano ou radial podem causar parestesias, que podem exigir o uso de analgésicos ou sedativos parenterais adjuvantes. Um novo uso da ARIV é para anestesiar a mão antes da injeção de toxina botulínica A (BTX-A) para o tratamento da hiperidrose. A BTX-A reduz significativamente a produção de suor, medida pelo teste de Minor e quantificada pela análise do corneômetro, mas a injeção é dolorosa, a menos que a mão seja previamente anestesiada; IVRA foi considerado adequado para esta finalidade. De acordo com um estudo recente, não houve diferença no grau e duração da analgesia entre ARIV e bloqueio do gânglio estrelado (BSG) usando uma combinação de 70 mg de lidocaína e 30 μg de clonidina em pacientes com SDRC tipo 1 afetando as extremidades superiores. O estudo concluiu que o IVRA era preferível ao SGB neste cenário devido ao seu menor risco de efeitos colaterais indesejáveis e execução mais fácil do que o SGB.
A ARIV de membros superiores tem sido utilizada ocasionalmente para analgesia/anestesia prolongada (ou seja, cirurgias que devem persistir por mais de 1 hora), com um período obrigatório de desinsuflação do torniquete de pelo menos 1 minuto antes de restabelecer o estado anestesiado.
Extremidade mais baixa
A anestesia regional intravenosa pode ser usada para intervenções cirúrgicas breves da extremidade inferior de maneira análoga à descrita para a cirurgia da extremidade superior. Os procedimentos cirúrgicos que podem ser realizados com essa abordagem incluem a excisão de uma massa; reparo do nervo digital; cirurgia de fratura/luxação da falange; e excisão navicular acessória. Qualquer procedimento ortopédico do pé, tornozelo ou extremidade inferior distal que exija aproximadamente 45 minutos ou menos para ser concluído pode ser adequado para essa modalidade.
Embora a ARIV tenha sido associada a um aumento da incidência de síndrome de compartimento no tratamento de fraturas da diáfise da tíbia e, portanto, foi considerado contraindicado nesses casos, um estudo em voluntários não mostrou diferença significativa nas pressões teciduais antes e após a insuflação do torniquete, independentemente do volume de solução salina utilizado (≤1.5 mL/kg) ou em função da tempo após a injeção de solução salina durante a insuflação do torniquete. Os autores concluíram que, no membro atraumático normal, a ARIV simulada com solução salina normal (NS) não aumenta a pressão tecidual no compartimento anterior da perna.
Pediatria
A anestesia regional intravenosa tem sido uma escolha aceitável em pacientes pediátricos selecionados para a redução de fraturas da extremidade superior. Um estudo retrospectivo comparando ARIV e sedação consciente para a redução de fraturas pediátricas do antebraço descobriu que a ARIV é um método seguro, eficiente e de baixo custo para reduzir fraturas pediátricas do antebraço. Havia 600 pacientes no grupo IVRA e 645 pacientes no grupo sedação consciente. Nenhum paciente apresentou síndrome compartimental ou necessidade de readmissão secundária à aplicação de gesso. Alguma intervenção no gesso por causa do aperto foi necessária por 28 pacientes (4.34%) no grupo de sedação processual e 13 pacientes (2.16%) no grupo IVRA.
CONTRAINDICAÇÕES
A única contraindicação absoluta à ARIV é a recusa do paciente. As contra-indicações relativas incluem o seguinte:
• Lesões por esmagamento de uma extremidade
• Incapacidade de localizar veias periféricas
• Infecções locais da pele
• Celulite
• Fraturas compostas
• Pacientes com história convincente de alergia a anestésicos locais
• Pacientes com lesões vasculares graves na extremidade
• Shunts arteriovenosos vasculares preexistentes e pacientes nos quais um torniquete é inadequado (ou seja, pacientes com doença vascular periférica grave)
• Doença falciforme
• Cirurgias planejadas por >1 hora geralmente não são uma boa indicação para anestesia regional IV devido à ocorrência de dor de torniquete.

Do compêndio de anestesia regional: anestesia regional intravenosa (IVRA, bloco de Bier): mecanismo de ação, indicações e contra-indicações infográfico.
EQUIPAMENTO
Figura 1 para Figura 8 mostrar equipamentos usados em IVRA
1. Agentes anestésicos locais: lidocaína HCl, 0.25%–0.1% (alternativa é prilocaína, 0.5%)
2. Um torniquete de borracha (dreno de Penrose) de 12–18 pol. de comprimento (30–45 cm) e 7/8 pol. de largura (2.3 cm) para uso antes de colocar a cânula intravenosa
3. Um extracateter intravenoso de calibre 20 ou 22 (cateter sobre agulha) (Figura 5)
4. Um saco de 500 mL ou 1 L de solução intravenosa conectado a um conjunto de infusão (vs. um hep lock) a ser conectado à cânula intravenosa para manter sua permeabilidade até que a solução anestésica seja injetada na extremidade isolada (pode substituir uma porta intravenosa lavada com solução salina)
5. Monitores padrão da Sociedade Americana de Anestesiologistas (ASA) (eletrocardiógrafo, pressão arterial, oxímetro de pulso)
6. Equipamento de ressuscitação (cateter intravenoso, solução cristalóide e conjunto de infusão para a extremidade superior contralateral) (para ARIV da extremidade superior)
7. Dois torniquetes pneumáticos de tamanho apropriado para a extremidade selecionada (Figuras 6 e 9)
8. Um curativo Esmarch de 60 pol. de comprimento (152 cm) e 4 pol. de largura (10 cm) para exsanguinar o braço (Figuras 2, 3, e 7)
9. Conjunto de preparação de pele estéril
10. Uma seringa Luer lock de 30 ou 50 mL
11. Um copo medidor graduado para misturar a solução, preferencialmente com capacidade de 100 mL
12. Fita adesiva, vários tamanhos
Saiba mais sobre o Equipamento para anestesia regional.
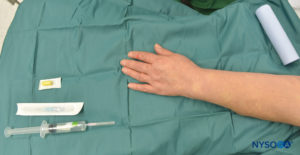
FIGURA 4. O equipamento para ARIV consiste em curativo de Esmarch, frascos de anestésico local, torniquete de borracha, extracateter intravenoso (IV) (cateter sobre agulha), swabs com álcool e uma seringa para retirar o anestésico local.
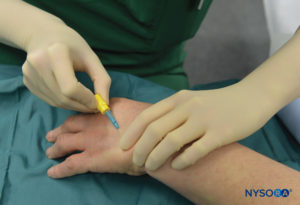
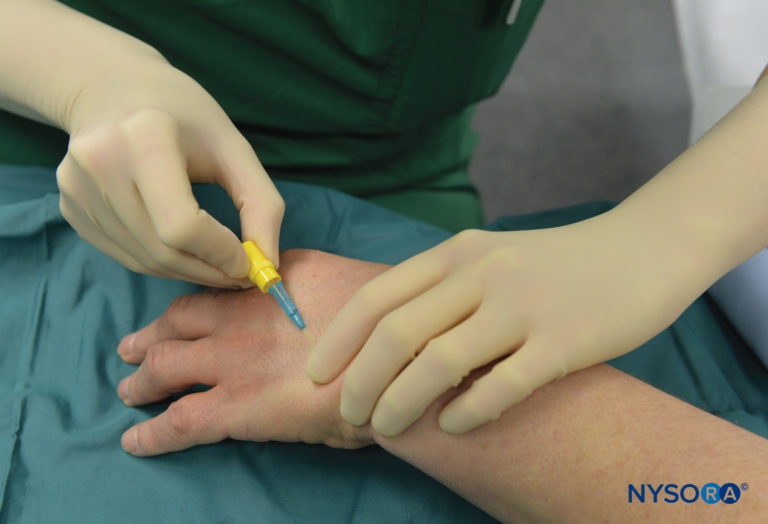
FIGURA 5.Cânula intravenosa e Hep-Lock colocados em uma veia distal da mão em preparação para ARIV.
PREPARAÇÃO DO PACIENTE
O paciente fica em decúbito dorsal desde que a veia selecionada para colocação esteja prontamente acessível. O equipamento de ressuscitação é verificado e os torniquetes pneumáticos são testados e preparados para uso. Para cirurgia no cotovelo, a agulha será colocada no antebraço ou fossa antecubital. Para procedimentos na mão ou antebraço, uma veia no dorso da mão é melhor selecionada (Figura 5).
Para procedimentos de membros inferiores, uma veia no pé, tornozelo ou perna é escolhida. Após a obtenção de acesso intravenoso em uma extremidade não operada (alternativamente, um acesso venoso central pode ser garantido), um complemento completo de Monitores ASA é aplicado e os sinais vitais basais são avaliados. Se o paciente estiver com dor intensa, pequenas alíquotas de analgésicos intravenosos podem agora ser administradas (ou seja, fentanil 1–2 μg/kg) para facilitar o processo de exsanguinação. Como a cooperação total do paciente não é essencial para o sucesso, pequenas doses de benzodiazepínico solúvel em água (ou seja, midazolam 15–25 μg/kg) podem ser administradas alternativamente para ansiólise. Um benefício importante na escolha de um benzodiazepínico é a supressão da resposta convulsiva associada à toxicidade do anestésico local, uma preocupação válida no paciente submetido à ARIV devido ao grande volume do agente sendo administrado diretamente no sistema vascular.
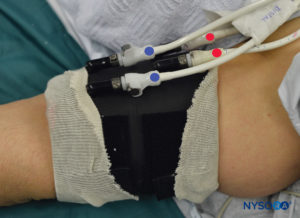
FIGURA 6. Torniquete proximal (VERMELHO) e distal (AZUL) claramente rotulado do sistema de torniquete duplo. O torniquete é sempre inflado na seguinte ordem: Distal, Proximal. Uma vez que a funcionalidade é verificada, o torniquete distal (AZUL) é esvaziado.
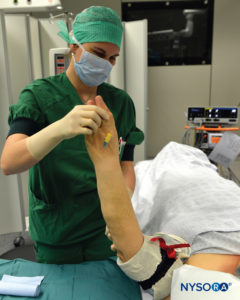
FIGURA 7. Elevação da extremidade para permitir exsanguinação passiva.
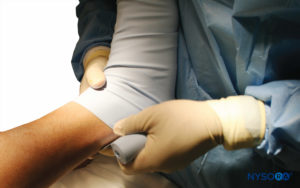
FIGURA 8. A extremidade inferior direita elevada é envolvida com uma bandagem de Esmarch firmemente enrolada no torniquete.
TÉCNICA

Do Compêndio de Anestesia Regional: Anestesia regional intravenosa (IVRA, bloco de Bier): Infográfico de técnica.
IVRA de Extremidade Superior
A seguir está a técnica para IVRA para procedimentos de extremidades superiores:
1. Um cateter de plástico permanente é inserido em uma veia periférica o mais distalmente possível sob rigorosas precauções assépticas (Figura 5).
2. Um torniquete pneumático duplo é colocado no manguito proximal na parte superior do braço (Figuras 6 e 7). Embora, por convenção, os torniquetes sejam colocados na área do bíceps, um estudo descobriu que a dosagem de lidocaína pode ser quase reduzida pela metade quando o torniquete foi colocado no antebraço em vez do braço. Vinte pacientes submetidos a cirurgias de antebraço e mão receberam ARIV com uma combinação de lidocaína 1.5 mg/kg e cetorolaco 0.15 mg/kg com um torniquete colocado no antebraço. Outros 20 pacientes submetidos a procedimentos semelhantes receberam ARIV com o dobro da dose dos mesmos medicamentos e com o torniquete colocado na parte superior do braço. A anestesia cirúrgica foi avaliada como excelente em todos os 20 pacientes do grupo torniquete no braço, enquanto foi avaliada como excelente em 19/20 pacientes no grupo torniquete no antebraço. O início e a regressão do bloqueio sensorial foram semelhantes em ambos os grupos. Um estudo recente comparando a colocação de torniquete no antebraço (n = 28) com 8 mL de lidocaína a 2% e cetorolaco 10 mg e colocação de torniquete no braço superior (n = 28) com 15 mL de lidocaína a 2% e cetorolaco 20 mg descobriu que pacientes no antebraço o grupo torniquete experimentou menos desconforto, menos intervenções de sedação e maior probabilidade de contornar a unidade de recuperação pós-anestésica (SRPA) quando comparado ao grupo com torniquete no braço.
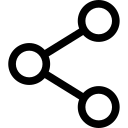
3. Todo o braço é elevado para permitir exsanguinação passiva (Figura 7), e uma bandagem de borracha de Esmarch é enrolada em espiral ao redor do braço da ponta dos dedos da mão até o manguito distal do torniquete duplo para exsanguinar o braço (Figuras 2 e 3).
4. A artéria axilar é ocluída digitalmente, e enquanto a pressão é mantida sobre ele, o manguito pneumático proximal é inflado a 50-100 mm Hg acima da pressão arterial sistólica, após o que o curativo de Esmarch é removido.
5. Após a insuflação do manguito proximal e a remoção da bandagem de Esmarch, são injetados 30–50 mL de lidocaína HCl a 0.5% através do cateter de plástico permanente, o volume dependendo do tamanho do braço a ser anestesiado.
6. Ao nível da mesa de procedimento, a cânula intravenosa na extremidade cirúrgica é retirada e a pressão é aplicada rapidamente sobre o local com gaze estéril.
7. Cerca de 25 a 30 minutos após o início da anestesia ou quando um paciente se queixa de dor no torniquete, o manguito distal é inflado e o manguito proximal é desinsuflado para minimizar o desenvolvimento da dor do torniquete.
IVRA de Extremidade Inferior
A única diferença significativa na ARIV para as extremidades superiores e inferiores é que a técnica de ARIV para a extremidade inferior requer volumes relativamente maiores de soluções anestésicas locais em virtude da óbvia disparidade de tamanho entre as extremidades superiores e inferiores. Isso é necessário para preencher mais completamente o compartimento vascular maior da extremidade inferior, desde a cânula intravenosa distal até o torniquete proximal (100 mL vs. 50 mL).
CONSIDERAÇÕES FARMACOLÓGICAS
Considerações Anestésicas Locais
A lidocaína é o anestésico local protótipo usado para ARIV nos Estados Unidos. Na Europa, no entanto, a prilocaína pode ser mais comumente usada e, de fato, tem sido objeto da maioria dos ensaios clínicos. Tentativas foram feitas para maximizar a eficácia da lidocaína, minimizando os efeitos colaterais ou Toxicidade do agente. A alcalinização da lidocaína a 0.5% (usando bicarbonato de sódio a 1.4%) para ARIV foi estudada em 31 pacientes. Os autores não encontraram vantagem clínica na prática da alcalinização da lidocaína no que diz respeito ao bloqueio sensorial, bloqueio motor ou aparecimento de dor pós-operatória. Quando a lidocaína foi comparada com a 2-cloroprocaína alcalinizada e não alcalinizada, ambas usadas em concentrações de 0.5% e usadas exclusivamente para cirurgia da mão, a cloroprocaína alcalinizada se comportou de forma semelhante à lidocaína, mas a cloroprocaína simples não ofereceu benefícios e produziu mais efeitos colaterais do que a lidocaína.
Outro estudo comparando ARIV com lidocaína de baixa concentração/alto volume (concentração de 0.5% de 30-50 mL de lidocaína) e lidocaína de alta concentração/baixo volume (concentração de 2% de 12-15 mL de lidocaína) em pacientes submetidos à cirurgia de extremidade superior mostraram um início mais rápido e regressão tardia do bloqueio sensorial no grupo de alta concentração/baixo volume. Não houve diferenças significativas nos dados hemodinâmicos, como pressão arterial sistólica e diastólica, pressão arterial média e frequência cardíaca entre os dois grupos.
A lidocaína foi comparada com a ropivacaína para ARIV de extremidades superiores em dois estudos separados. Duas doses de ropivacaína (1.2 e 1.8 mg/kg) foram comparadas com uma dose de lidocaína (3.0 mg/kg) em 15 voluntários. A recuperação do bloqueio sensorial e motor após a liberação do torniquete foi mais lenta com o grupo de alta dose de ropivacaína. Mais pacientes no grupo lidocaína (5 de 5) apresentaram tontura após a liberação do torniquete, contra apenas 1 no grupo ropivacaína em altas doses. No segundo estudo, 51 pacientes foram randomizados para receber ropivacaína 0.375% ou lidocaína 0.5% em um volume de 0.4 mL/kg até 25 mL. A analgesia pós-operatória medida pela primeira solicitação de analgésicos foi superior no grupo ropivacaína.
A progressão do bloqueio sensorial na mão após ARIV com 20 mL de ropivacaína a 0.3% e um torniquete duplo colocado no antebraço foi estudada em 10 voluntários saudáveis. O anestésico local foi injetado através de um cateter intravenoso de calibre 22, colocado em uma veia proeminente no dorso da mão após a exsanguinação da mão com uma bandagem de Esmarch e inflar sequencialmente o torniquete distal a 150 mm Hg ou 20 mm Hg acima do sangue sistólico pressão (o que for maior) e o torniquete proximal para 250 mm Hg. O torniquete distal foi então desinsuflado e a bandagem de Esmarch removida. Os valores basais para sensação de frio e toque foram determinados antes do bloqueio, e os valores atualizados foram obtidos repetidamente e continuamente, começando 5 minutos após a injeção do anestésico local e continuando até que a perda de sensação fosse obtida em todas as áreas. Houve uma perda quase imediata da percepção do frio, seguida por uma propagação retardada e desigual da perda da sensação de toque. A propagação inicial da anestesia foi notada tanto proximal quanto distalmente no dorso da mão e depois progrediu para a ponta dos dedos, com uma propagação proximal tardia sobre a superfície palmar da mão até o punho.
A prilocaína foi comparada com a lidocaína, bem como com outros anestésicos locais usados para ARIV. Ao avaliar o início do bloqueio sensorial e motor, 40 mL de prilocaína a 0.5% (100 mg) foram comparados com o mesmo volume e mesma concentração de cloroprocaína em 10 voluntários submetidos à ARIV. O início do bloqueio motor não diferiu entre os grupos, e a sensação foi recuperada quase igualmente bem. No entanto, a recuperação da função motora foi mais curta no grupo prilocaína, e mais pacientes com cloroprocaína demonstraram sinais de irritação venosa ou urticária antecubital por 30-45 minutos após a desinsuflação do torniquete. As alterações da frequência cardíaca também foram mais notáveis no grupo cloroprocaína. O mesmo grupo de pesquisadores expandiu seu estudo para incluir 60 pacientes, 30 em cada um dos respectivos grupos detalhados anteriormente. Agora, os pesquisadores descobriram que a recuperação completa do bloqueio sensorial foi mais rápida no grupo da prilocaína (7.1 vs. 9.8 minutos). Caso contrário, a incidência de efeitos colaterais permaneceu maior no grupo cloroprocaína.
Em seguida, esses pesquisadores compararam prilocaína a 0.5% com a mesma concentração de articaína (um anestésico local mais recente do tipo aminoamida que contém tiofeno e é farmacologicamente semelhante à mepivacaína) para ARIV de extremidade superior. A articaína, um potente anestésico local com baixo grau de toxicidade devido ao seu rápido metabolismo com esterases, foi considerada uma alternativa adequada à prilocaína. Dez voluntários participaram desta comparação cruzada, duplo-cego, dos dois agentes.
Eles não encontraram diferença significativa entre os dois em relação ao início da anestesia ou bloqueio motor ou na recuperação da função sensorial ou motora. No entanto, 80% dos indivíduos apresentaram erupções cutâneas após receberem articaína, contra 20% no grupo prilocaína.
Quando a prilocaína a 0.5% foi comparada com as mesmas concentrações de articaína ou lidocaína em três grupos de 10 pacientes cada para ARIV, verificou-se que o início do bloqueio sensorial foi significativamente menor no grupo articaína, que também apresentou os menores picos de concentração plasmática de anestésico local após a liberação do torniquete. A prilocaína pura 1% foi comparada com o mesmo anestésico local combinado com quatro aditivos diferentes para ARIV: bupivacaína 0.25%, clonidina 150 μg, sufentanil 25 μg ou tenoxicam 20 mg. O grupo adicionado de sufentanil demonstrou o início mais rápido do bloqueio sensorial; os escores de dor pós-operatória foram melhorados com a adição de clonidina ou tenoxicam. Caso contrário, não houve diferenças significativas entre os cinco grupos em relação ao início e duração do bloqueio sensorial. Ao contrário da situação observada para a lidocaína com adição de bicarbonato como adjuvante, a adição de bicarbonato à prilocaína parece encurtar o tempo de início e prolongar a duração da anestesia durante a ARIV.
O uso de mepivacaína para IVRA foi estudado. Dezesseis pacientes foram avaliados usando 1.4 mg/kg em 40 mL no total para ARIV versus bloqueios salinos realizados nos mesmos indivíduos no braço contralateral. A oclusão arterial foi mantida por 20 minutos. A hiperemia reativa foi atenuada no braço tratado com mepivacaína durante o período de avaliação de 60 minutos, indicando que a mepivacaína é um vasoconstritor potente com ação de longa duração. Esse achado tem implicações para o uso de mepivacaína em indivíduos com comprometimento do fluxo sanguíneo da extremidade superior ou com SDRC, para os quais provavelmente não deve ser considerado o anestésico local de escolha.
O mesmo grupo de estudo avaliou os efeitos da mepivacaína IVRA na dor em queimação intracutânea induzida por capsaicina e no fluxo sanguíneo microvascular da pele, medido por Doppler imagem de perfusão. A hiperemia reativa foi menor no braço tratado com mepivacaína 10 minutos após a liberação do torniquete, e a área do alargamento foi menor após capsaicina nos braços tratados com mepivacaína. Os autores concluíram que a mepivacaína IVRA não teve efeitos na função sensorial pós-IVRA de fibras aferentes finas, mas diminuiu diferencialmente a propagação do flare induzido por capsaicina.
Dicas NYSORA
• A lidocaína é a droga protótipo usada para IVRA nos Estados Unidos; a prilocaína é preferida na Europa.
• A alcalinização da lidocaína confere vantagem mínima, se houver, à lidocaína comercial para ARIV.
• As potentes propriedades vasoconstritoras da mepivacaína diminuem sua atratividade geral como agente primário para ARIV.
Adjuntos de Anestésicos Locais para IVRA
Uma revisão sistemática da literatura foi realizada para avaliar o uso de adjuvantes dos anestésicos locais para IVRA. Vinte e nove estudos preencheram os critérios de serem randomizados, duplo-cegos e controlados. Os dados de 1217 indivíduos do estudo foram revisados e os agentes estudados incluíram opióides (fentanil, sufentanil, meperidina e morfina); clonidina; relaxantes musculares (atracúrio, pancurônio, mivacúrio); tramadol; agentes anti-inflamatórios não esteróides (AINEs) (cetorolaco, tenoxicam, acetilsalicilato); alcalinização com bicarbonato de sódio; a adição de potássio; e alterações de temperatura. Os autores encontraram evidências sólidas que apoiam o uso de AINEs em geral e cetorolaco em particular para melhorar a analgesia pós-operatória e prolongar a tolerância ao torniquete durante a ARIV. Os opióides se saíram mal quando usados para ARIV, com apenas meperidina em doses de 30 mg ou mais mostrando benefícios substanciais no pós-operatório às custas de náuseas, vômitos e tonturas pós-deflação. Os relaxantes musculares melhoraram o bloqueio motor pós-operatório e foram benéficos na redução de fraturas em que o relaxamento muscular é imperativo para bons resultados.
Agonistas alfa2 (clonidina e dexmedetomidina)
A clonidina foi adicionada à prilocaína e à lidocaína como adjuvante da ARIV para cirurgia de extremidades. Quando 2 μg/kg foram adicionados à prilocaína 0.5% de forma randomizada e duplo-cega em 56 pacientes submetidos à cirurgia de extremidade superior, não houve diferença entre os grupos quanto ao início ou duração do bloqueio sensorial ou motor. Os pacientes que receberam clonidina tiveram redução significativa da pressão arterial após a liberação do torniquete (24%–48%), enquanto a frequência cardíaca permaneceu inalterada.
Os autores concluíram que a clonidina era de benefício limitado como adjuvante dos anestésicos locais.35 A adição de clonidina à prilocaína suprimiu dramaticamente a dor do torniquete, mas não alterou a dor pós-operatória após a desinsuflação do torniquete.
A clonidina não oferece benefícios mensuráveis quando adicionada à lidocaína para ARIV em pacientes submetidos à liberação do túnel do carpo.
A dexmedetomidina é apropriadamente oito vezes mais seletiva em relação aos α-adrenorreceptores do que a clonidina. Como tal, tem sido usado em IVRA para determinar se pode avançar alguns dos achados benéficos observados com o último agente. Trinta pacientes submetidos à cirurgia de mão sob ARIV receberam lidocaína 0.5% isolada ou lidocaína mais dexmedetomidina 0.5 μg/kg.
O grupo dexmedetomidina apresentou um início mais rápido do bloqueio sensorial e motor; recuperação prolongada do bloqueio sensorial e motor; tolerância prolongada ao torniquete; e melhor qualidade da analgesia em comparação com o grupo que recebeu apenas anestésico local.
Um tempo de início do bloqueio sensorial encurtado; tempos prolongados de recuperação do bloqueio sensorial e motor; duração prolongada da analgesia para torniquete; e analgesia pós-operatória prolongada foram observados em pacientes submetidos a ARIV com dexmedetomidina em outro estudo randomizado, duplo-cego, comparando os efeitos de lornoxicam ou dexmedetomidina em ARIV com prilocaína em pacientes submetidos à cirurgia de mão ou antebraço. Neste estudo, a ARIV foi alcançada com prilocaína a 2% a 3 mg/kg no grupo controle (n = 25), prilocaína a 2% a 3 mg/kg mais dexmedetomidina 0.5 μg/kg no grupo dexmedetomidina (n = 25), e prilocaína 2% a 3 mg/kg mais lornoxicam 8 mg no grupo lornoxicam (n = 25). Em cada grupo, as drogas foram diluídas com soro fisiológico 0.9% até um volume total de 40 mL.
Um estudo mais recente comparando os efeitos da dexmedetomidina quando adicionada à lidocaína para ARIV e quando administrada por via parenteral como pré-medicação antes da ARIV descobriu que ambos os grupos tiveram similarmente melhor qualidade da anestesia e analgesia perioperatória. Este estudo foi feito em pacientes submetidos à liberação do túnel do carpo randomizados em três grupos.
A ARIV foi feita com 40 mL de lidocaína a 0.5%. Uma dose única de dexmedetomidina 0.5 μg/kg e solução placebo (solução salina) em um volume total de 20 mL foi administrada ao grupo P (n = 15) e grupo S (n = 15), respectivamente, antes da ARIV. Dexmedetomidina a 0.5 μg/kg de foi adicionada à lidocaína no grupo A (n = 15) durante ARIV. O início e o tempo de recuperação do bloqueio sensorial e motor, a escala visual analógica (VAS) intra-operatória-pós-operatória, o escore de sedação de Ramsay (RSS), as necessidades de analgésicos, as variáveis hemodinâmicas e os efeitos colaterais foram anotados. O início do bloqueio sensorial e o tempo de recuperação significativamente reduzidos nos grupos P e A, o tempo de início do bloqueio motor reduzido no grupo P e os escores VAS intraoperatórios e a necessidade de analgésicos diminuídos nos grupos P e A foram encontrados. A RSS intraoperatória no grupo P e a RSS pós-operatória nos grupos P e A foram maiores do que no grupo S. A frequência cardíaca intraoperatória e pós-operatória e a pressão arterial média (PAM) pós-operatória do grupo P foram significativamente menores do que nos grupos A e S, respectivamente.
Opióides
Como os receptores de opiáceos foram descobertos no sistema nervoso periférico e com a demonstração de que os opióides podem produzir analgesia eficaz e duradoura quando injetados em conjunto com anestésicos locais para bloqueio do plexo braquial, vários pesquisadores tentaram diminuir o potencial de toxicidade do local. ARIV apenas com anestésico adicionando opióides para reduzir a concentração de lidocaína. Embora não tenha sido comprovado que a adição de fentanil à lidocaína para ARIV resulte em melhora da analgesia e redução dos riscos, a adição de fentanil em doses de 200 μg à prilocaína 0.5% resultou em analgesia mais completa do que em pacientes que tiveram 100 μg adicionado, ou quando prilocaína simples foi usada para ARIV. Náuseas pós-operatórias e efeitos colaterais no sistema nervoso central foram maiores nos grupos que receberam fentanil versus aqueles que receberam apenas anestésico local. Dois outros estudos, no entanto, descobriram que a adição de opióides à prilocaína não melhorou o sucesso com a técnica. Mais pesquisas sobre os efeitos da adição de opióides à prilocaína para IVRA podem resolver essa discrepância.
Alguns pesquisadores descobriram que a adição de opióides e relaxantes musculares à lidocaína a 0.25% proporciona a mesma analgesia e relaxamento muscular que a lidocaína a 0.5% isoladamente, enquanto reduz a probabilidade de toxicidade sistêmica. Os adjuvantes adicionados à lidocaína incluíram 50 μg de fentanil mais 0.5 mg de pancurônio, fentanil mais rocurônio, fentanil mais D-tubocurarina e fentanil mais vecurônio. Em cada caso, os autores relataram excelentes condições operacionais, e como a concentração de lidocaína foi capaz de ser reduzida para 0.20% (ou seja, mais da metade do normal usado), o potencial de toxicidade sistêmica foi pelo menos pela metade.
Quando meperidina 0.25%, 40 mL (100 mg), foi utilizada como agente solitário para ARIV, foi produzido bloqueio motor completo, tão eficaz quanto o produzido pela lidocaína. O início do bloqueio motor foi tão ou mais rápido que o início do bloqueio sensorial em cada um dos 15 pacientes deste grupo de estudo. No entanto, quando comparada à lidocaína pura neste estudo, houve maior incidência de tontura, náusea e dor no local da injeção.
tramadol
O tramadol foi avaliado para uso em ARIV da extremidade superior. Sessenta voluntários divididos em quatro grupos de 15 pacientes cada receberam ARIV com 40 mL de tramadol 0.25% (100 mg), soro fisiológico 0.9%, lidocaína 0.5% ou lidocaína mais tramadol 0.25%. O início e a recuperação do bloqueio sensorial e motor foram semelhantes entre o tramadol e apenas solução salina normal. local. A conclusão dos autores foi que o tramadol sozinho não possui efeitos anestésicos locais, mas pode modificar os efeitos se adicionado a um anestésico local, como a lidocaína.
Em outro estudo comparando lidocaína a 0.5% com e sem 50 mg de tramadol para ARIV de extremidade superior, o grupo adicionado de tramadol experimentou menos dor de torniquete do que o grupo apenas local, mas como no estudo mencionado anteriormente, houve vários casos de urticária cutânea no grupo tramadol, mas não no grupo lidocaína. Tramadol (100 mg) adicionado à lidocaína para ARIV para anestesia do membro superior agiu de forma semelhante ao sufentanil (25 μg) ou clonidina (1 μg/kg) adicionado à anestesia local com relação aos dados hemodinâmicos intraoperatórios, tempo de recuperação do bloqueio sensorial, início e recuperação do bloqueio motor, escores de sedação e dor pós-operatória.61 Em resumo, o tramadol é ineficaz como agente isolado para ARIV, mas pode conferir alguma vantagem quando adicionado à lidocaína. Essa vantagem, no entanto, pode ser compensada pela incidência significativa de efeitos colaterais dermatológicos do tramadol administrado por via intravenosa em uma extremidade exsanguinada.
Relaxantes Musculares
Uma pequena dose de relaxante muscular não despolarizante pode ser escolhida como adjuvante ao anestésico local administrado para ARIV; entretanto, como a D-tubocurarina libera histamina mesmo em doses criteriosas, provavelmente é melhor evitar completamente esse agente. Atracúrio foi adicionado à lidocaína em um esforço para melhorar o relaxamento muscular durante a ARIV, particularmente durante a redução de fraturas e luxações da extremidade superior. A adição de 3 mg de atracúrio à lidocaína para ARIV resultou em diminuição do tempo de início da analgesia na mão, mas não no local do torniquete. Não houve benefício adicional em adicionar este agente ou adicionar alfentanil à lidocaína no mesmo estudo. Um estudo utilizando 2 mg de atracúrio adicionado a 40 mL de lidocaína a 0.5% para ARIV para cirurgia de mão em 40 pacientes randomizados para um dos dois grupos constatou que a adição de atracúrio proporcionou maior grau de relaxamento muscular, redução mais fácil de fraturas e melhores condições de operação, bem como menos dor após a cirurgia.
Neostigmina
A neostigmina tem sido sugerida como coanalgésico quando usada para epidural e intratecal analgesia e anestesia, mas faltam evidências de seu benefício no sistema nervoso periférico. Em dois estudos, um usando neostigmina adicionada à lidocaína e outro usando o adjuvante adicionado à prilocaína, houve achados conflitantes. Quando a neostigmina (1 mg) foi adicionada à lidocaína a 0.5% para ARIV em um estudo de 54 voluntários randomizados em um dos três grupos de estudo, verificou-se que a adição do adjuvante não proporcionou nenhum benefício em termos de analgesia ou anestesia em comparação com os controles. Quando metade da dose de neostigmina (0.5 mg) foi adicionada à prilocaína (3 mg/kg) para ARIV em 30 pacientes randomizados para um dos dois grupos de tratamento, verificou-se que o grupo adjuvante demonstrou encurtamento do início do bloqueio sensorial e motor tempos de recuperação do bloqueio sensorial e motor prolongados, melhor qualidade da anestesia e tempo prolongado para a primeira necessidade de analgésico versus o grupo de prilocaína simples.
Um estudo mais recente analisando o efeito da adição de 0.5 mg de neostigmina a 40 mL de lidocaína a 0.5% para ARIV em pacientes submetidos a cirurgias eletivas ou de emergência de antebraço e mão randomizados em dois grupos, com 1 mL de solução salina isotônica adicionado a 40 mL de 0.5% lidocaína no grupo controle, notou tempos de início de bloqueio sensitivo e motor significativamente mais curtos e tempos de recuperação mais longos no grupo neostigmina quando comparado ao grupo controle. A qualidade da anestesia intraoperatória e a frequência da dor do torniquete foram semelhantes em ambos os grupos. Parece que os achados conflitantes com duas doses diferentes de neostigmina adicionadas à lidocaína para ARIV precisarão ser confirmados por trabalho adicional incorporando amostras maiores de pacientes para resolver a discrepância nos dois pequenos estudos mencionados anteriormente.
Agentes anti-inflamatórios não esteroides
Outras tentativas de melhorar a ARIV com lidocaína incluem o uso de AINEs para suprimir a dor do torniquete enquanto aumenta a analgesia pós-operatória. Embora o cetorolaco tenha demonstrado alguma eficácia, outros AINEs não se saíram tão favoravelmente. O cetorolaco foi estudado como adjuvante da lidocaína usando um torniquete no antebraço ou no braço em pacientes submetidos à cirurgia de mão ou antebraço. Neste estudo, os pacientes foram randomizados em dois grupos: grupo UA, composto por 20 pacientes submetidos à ARIV com torniquete no braço; e grupo FA, composto por 20 pacientes submetidos à ARIV com torniquete no antebraço. Os pacientes do grupo do torniquete no braço receberam ARIV com lidocaína a 0.5% na dose de 3 mg/kg mais cetorolaco 0.3 mg/kg. A ARIV no grupo do torniquete no antebraço foi estabelecida com lidocaína a 0.5% a 0.15 mg/kg mais cetorolaco 0.15 mg/kg. Não houve diferença estatisticamente significativa no início e na duração do bloqueio sensorial e na necessidade de suplementação analgésica entre os dois grupos. Os escores de dor pós-operatória também foram semelhantes entre os dois grupos. Os autores concluíram que a ARIV com torniquete no antebraço com lidocaína a 0.5% na dose de 1.5 mg/kg mais cetorolaco 0.15 mg/kg é uma opção segura e clinicamente viável que fornece anestesia e analgesia perioperatória semelhante à fornecida pela ARIV com torniquete no braço superior com 0.5% lidocaína na dose de 3 mg/kg mais cetorolaco 0.3 mg/kg, reduzindo a dose de lidocaína e cetorolaco pela metade.
Outro AINE, tenoxicam, foi adicionado à prilocaína em um estudo com 45 pacientes no total. A dose de 20 mg do AINE foi utilizada em pacientes submetidos a ARIV para redução de fraturas de Colles, com os pacientes divididos em três grupos. Um grupo recebeu apenas anestesia local; um recebeu local mais tenoxicam; e um grupo teve ARIV apenas com anestésico local mais um AINE intravenoso. Neste último grupo, o tenoxicam (20 mg) foi injetado no braço contralateral, oposto ao braço do procedimento de ARIV. O grupo que recebeu o AINE adicionado ao anestésico local apresentou analgesia superior e escores de dor mais baixos do que qualquer um dos outros dois grupos de pacientes.
Um estudo mais recente comparando os efeitos analgésicos intra e pós-operatórios do lornoxicam e do fentanil quando adicionados à lidocaína para ARIV em pacientes submetidos à cirurgia de mão mostrou aumento do tempo de recuperação do bloqueio sensorial e do tempo da primeira necessidade de analgésico no grupo lornoxicam, sem aumento da incidência de efeitos colaterais, quando comparado ao grupo lidocaína somente e ao grupo lidocaína com fentanil. Neste estudo, um total de 45 pacientes foram randomizados em três grupos. Os pacientes do grupo 1 receberam 3 mg/kg de lidocaína a 2% (40 mL); o grupo 2 recebeu 3 mg/kg de lidocaína, 38 mL mais lornoxicam 2 mL (4 mg/mL); e o grupo 3 recebeu 3 mg/kg de lidocaína, 38 mL mais 2 mL de fentanil (0.05 mg/mL). Este estudo também concluiu que a adição de fentanil à lidocaína IVRA (grupo 3) pareceu ser superior à lidocaína IVRA (grupo 1) e lornoxicam adicionado à lidocaína IVRA (grupo 2) na diminuição da dor do torniquete; no entanto, isso foi feito à custa do aumento dos efeitos colaterais, como coceira.
O dexcetoprofeno é outro AINE que foi estudado como adjuvante da lidocaína para ARIV. Neste estudo prospectivo, randomizado e controlado por placebo, os pacientes agendados para cirurgia eletiva de tecidos moles da mão ou do antebraço foram divididos aleatoriamente em três grupos. Todos os 45 pacientes receberam lidocaína a 0.5% como ARIV. Dexcetoprofeno 50 mg foi administrado por via intravenosa ou adicionado à solução de ARIV, e o grupo controle recebeu um volume igual de solução salina por via intravenosa e como parte da ARIV. Os tempos de início do bloqueio sensorial e motor, tempo de recuperação e consumo de analgésicos pós-operatórios foram registrados. Em comparação com os controles, a adição de dexcetoprofeno à solução de ARIV resultou em início mais rápido do bloqueio sensorial e motor, maior tempo de recuperação, diminuição dos escores de dor intra e pós-operatória e diminuição da necessidade de analgésicos no pós-operatório. A formulação farmacológica de dexcetoprofeno utilizada neste estudo continha etanol como excipiente. Os autores afirmaram que o efeito neurolítico do etanol pode ter contribuído para o desenvolvimento mais rápido do bloqueio sensorial e motor e maiores tempos de recuperação no grupo ARIV neste estudo.
Outros Agentes Específicos: Corticosteróides
As propriedades anti-inflamatórias dos esteróides do tipo glicocorticóide foram avaliadas quando esses agentes foram adicionados a anestésicos locais para ARIV em pacientes com artrite reumatóide (AR). Em um estudo randomizado, duplo-cego, cruzado, controlado por placebo, 20 pacientes com AR receberam 50 mg de metilprednisolona em mepivacaína 0.25% ou mepivacaína pura para ARIV de extremidade superior. A outra extremidade recebeu o tratamento oposto. Uma semana depois, os mesmos medicamentos foram injetados nas extremidades contralaterais, respectivamente. Cinquenta por cento dos pacientes relataram melhora subjetiva em 1 e 6 semanas; parâmetros objetivos como a força de preensão não mudaram até a avaliação de 6 semanas, momento em que um aumento significativo foi observado, assim como a redução na diástase de preensão e dor invocada pelo movimento. Este relatório sugeriu que os corticosteróides administrados por ARIV podem fornecer analgesia sustentada em certos pacientes com AR.
A ARIV esteróide também foi usada como tratamento adjuvante da SDRC tipo 1. Metilprednisolona (40 mg) foi adicionada à lidocaína para ARIV de forma randomizada, duplo-cega e controlada por placebo em 22 pacientes. Os tratamentos foram aplicados uma vez por semana, por até três sessões de blocos. Os pesquisadores não encontraram nenhum benefício em adicionar o esteróide ao local no que diz respeito à melhora da intensidade da dor ou ao encurtamento do curso da doença. Curiosamente, uma série de casos envolvendo 168 pacientes com SDRC tipo 1 da extremidade superior tratados com ARIV usando 25 mL de lidocaína a 0.5% e 125 mg de metilprednisolona diluídos em 10 mL de solução salina normal e acompanhados por um período de 5 anos relatou ausência completa de dor em 92% dos pacientes ao final do período de seguimento. A ARIV foi realizada com o torniquete mantido inflado por 20 minutos, tempo durante o qual a extremidade afetada foi manipulada na tentativa de aumentar a amplitude de movimento. O torniquete foi então esvaziado gradualmente para evitar a entrada rápida dos agentes injetados na circulação.
O mesmo processo foi repetido uma ou duas vezes por semana, dependendo da intensidade e persistência dos sintomas do paciente, e entre as sessões os pacientes foram mantidos sob fisioterapia leve, que não foi prolongada ou estressante. Uma média de 4.8 sessões foi necessária para aliviar os sintomas e proporcionar uma extremidade funcional. Os autores atribuíram os resultados clínicos ao estágio inicial da SDRC tipo 1 no início do tratamento e ao aumento da dosagem de metilprednisolona em comparação com estudos anteriores.
Acetaminofeno
Devido aos seus conhecidos efeitos analgésicos, o acetaminofeno (APAP) (paracetamol) tem sido estudado como adjuvante aos anestésicos locais em pacientes submetidos à cirurgia de mão sob ARIV. Sessenta pacientes submetidos à cirurgia de mão foram randomizados em três grupos. Todos os grupos receberam lidocaína IVRA (3 mg/kg) diluída com solução salina normal até um volume total de 40 mL. O grupo 1 recebeu lidocaína IVRA mais solução salina intravenosa. Grupo 2 recebeu lidocaína IVRA e uma mistura de APAP (300 mg) mais solução salina intravenosa; e o grupo 3 recebeu lidocaína IVRA mais APAP intravenoso (300 mg). O tempo de início do bloqueio sensorial e motor, a dor do torniquete e o uso de analgésicos foram avaliados durante a cirurgia. Após a deflação do torniquete, pontuações VAS em 1, 2, 4, 6, 12 e 24 horas; o tempo até a primeira necessidade de analgésico; consumo total de analgésicos nas primeiras 24 horas; e os efeitos colaterais foram observados. Não houve diferença significativa no início dos bloqueios sensoriais entre os três grupos; no entanto, a duração do bloqueio sensorial foi significativamente maior no grupo 2. O tempo de início do bloqueio motor foi menor e a duração do bloqueio motor foi maior no grupo 2. A dor do torniquete foi reduzida e a qualidade dos escores da anestesia conforme relatado pelo anestesiologista, que estava cego à droga do estudo, também foi significativamente maior no grupo 2. Não houve diminuição demonstrável nos escores de dor pós-operatória entre os três grupos. Os autores apontaram a dosagem arbitrária de APAP (300 mg) como deficiência do estudo. Estudos adicionais de variação de dose são necessários para otimizar a dosagem de paracetamol quando usado como adjuvante da lidocaína para ARIV.
Outro estudo que avaliou o efeito do APAP, quando adicionado à lidocaína na ARIV, no tempo de início do bloqueio sensorial e motor, na dor do torniquete e na analgesia pós-operatória, encontrou menor tempo de início do bloqueio sensorial; atraso no início da dor do torniquete; e redução dos escores de dor pós-operatória e consumo de analgésicos. A dosagem de paracetamol foi idêntica ao estudo anterior (lidocaína a 0.5% diluída com 300 mg de APAP intravenoso para um volume total de 40 mL). O grupo controle recebeu lidocaína 0.5% diluída com soro fisiológico 0.9% até um volume total de 40 mL. O tempo de início e a duração do bloqueio motor não foram avaliados neste estudo. Na tentativa de explicar o tempo de início mais rápido do bloqueio sensorial no grupo lidocaína-acetaminofeno, os autores investigaram o pH da mistura de lidocaína paracetamol e constataram que o valor de pH dessa mistura foi de 5.88, inferior ao pH da lidocaína –mistura salina normal, que foi de 6.16. Isso contradiz o fato de que quanto maior o pH do anestésico local, maior a penetração do nervo e, portanto, mais rápido o início do bloqueio neural. Neste estudo, os autores atribuíram o início mais rápido do bloqueio sensorial a possíveis efeitos antinociceptivos do APAP em locais periféricos.
Nitroglicerina
O efeito da nitroglicerina (NTG), quando adicionado à lidocaína para ARIV, foi estudado em um estudo prospectivo, randomizado e duplo-cego.76 Trinta pacientes submetidos à cirurgia de mão foram divididos aleatoriamente em dois grupos. O grupo controle (grupo C, n = 15) recebeu dose total de 40 mL com 3 mg/kg de lidocaína diluída em soro fisiológico e o grupo GTN (grupo NTG, n = 15) recebeu mais 200 μg de NTG. Tempos de início de bloqueio sensitivo e motor reduzidos; tempos prolongados de recuperação do bloqueio sensorial e motor; diminuição da dor do torniquete; e melhor qualidade da anestesia foram observadas no grupo NTG. As necessidades de analgésicos pós-operatórios também foram significativamente diminuídas no grupo NTG. Os autores atribuíram o menor tempo de início do bloqueio sensorial e motor aos efeitos vasodilatadores do NTG que promove a distribuição do anestésico local aos nervos. Alguns dos outros mecanismos que podem contribuir para a melhora da analgesia com NTG podem incluir o metabolismo de NTG em óxido nítrico, que por sua vez causa um aumento na concentração intracelular de monofosfato de guanosina cíclico, que produz
modulação da dor no sistema nervoso central e periférico. Os geradores de óxido nítrico também demonstraram induzir efeitos anti-inflamatórios e analgesia, bloqueando a hiperalgesia e o componente neurogênico do edema inflamatório por aplicação tópica.
Midazolam
O midazolam mostrou acelerar o início do bloqueio sensorial e motor e melhorar a analgesia pós-operatória quando adicionado à bupivacaína para o bloqueio do plexo braquial. O midazolam demonstrou ter efeitos analgésicos mediados pelos receptores GABA (ácido γ-aminobutírico) na medula espinhal em estudos com animais. Receptores GABA também foram encontrados em nervos periféricos. O midazolam também mostrou reduzir a atividade das fibras A-delta e C.
Em um estudo desenhado para avaliar o efeito do midazolam quando adicionado à lidocaína para ARIV, 40 pacientes submetidos à cirurgia de mão foram divididos aleatoriamente em dois grupos. O grupo controle recebeu 3 mg/kg de lidocaína a 2% diluída com soro fisiológico até um volume total de 40 mL, e o grupo midazolam recebeu mais 50 μg/kg de midazolam. Não houve diferenças estatisticamente significativas nos tempos de início e recuperação do bloqueio sensorial e motor entre os dois grupos. No entanto, uma pontuação subjetiva de avaliação da dor usando a escala de classificação numérica (NRS) para a dor do torniquete foi significativamente diminuída no grupo do midazolam. A qualidade da anestesia avaliada pelo paciente e pelo cirurgião também foi significativamente melhor no grupo do midazolam.
Os escores de dor pós-operatória da NRS também foram significativamente menores no grupo do midazolam nas primeiras 2 horas de pós-operatório.
No entanto, os escores de sedação pós-operatória também foram maiores no grupo midazolam. Os autores indicaram que a maior analgesia pós-operatória após a desinsuflação do torniquete pode ser explicada pelo efeito sistêmico do midazolam, além do efeito analgésico periférico.
Outro estudo envolveu 60 pacientes submetidos à cirurgia de mão randomizados em dois grupos, com o grupo controle e o grupo midazolam recebendo ARIV com dosagem exatamente idêntica de lidocaína e midazolam como no estudo anterior. Este estudo mostrou tempos de início de bloqueio sensorial e motor reduzidos e tempos de recuperação de bloqueio motor e sensorial prolongados, além de escores de dor de torniquete e escores de dor pós-operatória diminuídos. Os achados conflitantes em relação aos tempos de início do bloqueio sensorial e motor podem justificar mais estudos com tamanhos de amostra maiores para resolver a discrepância. Atualmente, tudo o que se pode afirmar é que o midazolam parece ser promissor como adjuvante do anestésico local quando usado para ARIV de membros superiores.
Ketamina
A cetamina é um potente agente analgésico cujo principal mecanismo de ação é o antagonismo dos receptores de glutamato N-metil-D-aspartato (NMDA) que desempenham um papel crucial no mecanismo de processamento da dor ao nível da medula espinhal. Estudos em animais indicaram a presença de receptores NMDA em nervos periféricos. A cetamina também demonstrou produzir bloqueio transitório dos canais de sódio e potássio dos nervos periféricos. A possível presença de receptores NMDA em nervos periféricos, bem como a capacidade da cetamina de bloquear localmente os canais de sódio, aponta para um possível sítio de ação periférico da cetamina, além de seus sítios centrais de ação bem estabelecidos.
A cetamina foi estudada como adjuvante na lidocaína IVRA em pacientes submetidos à cirurgia de mão e sua eficácia no controle da dor intraoperatória do torniquete, analgesia pós-operatória e efeitos colaterais foi comparada com a mesma dosagem de cetamina administrada sistemicamente. Neste estudo randomizado, duplo-cego, de controle sistêmico, 40 pacientes submetidos à cirurgia ambulatorial da mão foram randomizados em dois grupos. No grupo “ARIV”, 0.1 mg/kg de cetamina em 1 mL de solução salina foi adicionado à lidocaína da ARIV e 1 mL de solução salina normal foi administrado por via intravenosa periférica. No grupo “sistêmico”, 1 mL de solução salina normal foi adicionado à seringa IVRA e 0.1 mg/kg de cetamina em 1 mL de solução salina normal foi administrado por via intravenosa periférica. Ambos os grupos receberam 40 mL de lidocaína a 0.5% para ARIV.
O estudo não encontrou diferença entre os grupos nos parâmetros do estudo mencionados, e os autores concluíram que a cetamina IVRA e a cetamina intravenosa sistêmica eram indistinguíveis em termos de dor intraoperatória ao torniquete e consumo de analgésico pós-operatório. A velocidade de início e a duração do bloqueio sensorial e motor não foram medidas neste estudo. Outro estudo comparando a eficácia da cetamina e da clonidina quando adicionadas separadamente a 40 mL de lidocaína a 0.5% para ARIV em pacientes submetidos à cirurgia de mão ou antebraço encontrou atraso no início da dor do torniquete e diminuição do consumo de analgésicos em ambos os grupos quando comparados ao grupo controle recebendo 40 mL de lidocaína a 0.5% com soro fisiológico adicionado. A cetamina teve um efeito mais potente nos parâmetros do estudo quando comparado à clonidina. Neste estudo envolvendo 45 pacientes randomizados em três grupos, a ARIV foi realizada com 40 mL de lidocaína a 0.5% e solução salina, 1 μg/kg de clonidina ou 0.1 mg/kg de cetamina.
Tratamentos IVRA específicos para CRPS
Agentes ou antagonistas bloqueadores adrenérgicos, particularmente aqueles eficazes no receptor α, mostraram-se promissores no tratamento de CRPS, particularmente quando esses agentes são usados para ARIV. Outros adjuvantes adrenérgicos liberam e, posteriormente, previnem a recaptação de norepinefrina na junção neurovascular. Seu uso na SDRC é intuitivo porque suspeita-se que a fisiopatologia da doença inclua o receptor α e seja mediada pela norepinefrina. No entanto, há grande controvérsia em relação a esse tema, principalmente quando as pesquisas atuais são comparadas com os achados de estudos realizados há quase 40 anos. Guanetidina, reserpina e bretílio foram todos avaliados para ARIV para CRPS. Quando 15 mg de guanetidina foram adicionados a 0.5% de prilocaína em um grupo de 57 pacientes com SDRC da extremidade superior e da mão, a guanetidina não foi considerada mais eficaz do que a solução salina normal no tratamento da alodinia e dor em queimação da SDRC após fraturas do rádio distal.
Esses achados corroboraram o trabalho realizado em um estudo duplo-cego, randomizado e multicêntrico sete anos antes. Sessenta pacientes com distrofia simpática reflexa (DSR)/causalgia receberam quatro bloqueios de ARIV em intervalos de 7 dias com guanetidina ou placebo em lidocaína a 4%. A longo prazo, não houve diferença observada entre o grupo placebo e o grupo guanetidina, e apenas 0.5% dos pacientes em geral em todos os grupos tiveram uma resolução de seu problema.
Bretylium tem sido usado também em CRPS. Em um estudo randomizado e controlado, lidocaína a 0.5% foi comparada com o mesmo anestésico local ao qual foi adicionado 1.5 mg/kg de bretílio. Uma diminuição da dor de 30% ou mais foi considerada significativa. O grupo bretílio-local teve alívio da dor por 20 ± 17.5 dias, ao contrário do grupo lidocaína somente, em que a analgesia persistiu por apenas 2.7 ± 3.7 dias. O bretílio foi muito superior ao anestésico local sozinho no tratamento da SDRC neste estudo.
A anestesia regional intravenosa com bretílio foi utilizada para demonstrar que uma redução no tônus simpático dos músculos do antebraço em exercício aumentaria o fluxo sanguíneo, reduziria a acidose muscular e atenuaria as respostas reflexas. A ARIV com bretílio aumentou o fluxo sanguíneo, bem como o consumo de oxigênio no antebraço em exercício, embora tanto o potássio venoso quanto o conteúdo de íons hidrogênio estivessem elevados durante a fase de exercício, implicando que os efeitos reflexos não foram afetados pelo bloqueio do bretílio.
COMPLICAÇÕES
As complicações decorrentes da ARIV podem ser classificadas como relacionadas a medicamentos ou equipamentos (ou seja, torniquete). As complicações relacionadas aos medicamentos dependem dos agentes, incluindo anestésicos locais e adjuvantes, administrados diretamente no sistema vascular. As complicações relacionadas ao equipamento incluem todos os dispositivos e técnicas usados para isolar o espaço vascular da circulação sistêmica. A desinsuflação inadvertida ou não intencional do balonete, a falha do balonete, um aumento súbito da pressão venosa dentro do tecido ocluído a um nível superior à pressão do balonete e uma circulação interóssea intacta podem contribuir para complicações da ARIV.
A lidocaína é o anestésico local mais comumente utilizado para ARIV e, portanto, é o agente sobre o qual a maioria das complicações foram relatadas. Felizmente, a lidocaína não se acumula muito nos canais de sódio em concentrações plasmáticas terapêuticas e, como se liga e se dissocia rapidamente do canal, os acúmulos tóxicos da droga no canal são atípicos.97,98 Concentrações plasmáticas excessivas de lidocaína , como estão associados a bolus intravenosos de grandes doses com um sistema de torniquete defeituoso, resultam em vasodilatação periférica e diminuição da contratilidade cardíaca, geralmente observada clinicamente como hipotensão. O início usual da ARIV usando lidocaína em concentrações de 0.5% é rápido (cerca de 4.5 ± 0.3 minutos), e o término da anestesia após a desinsuflação do torniquete também é rápido (5.8 ± 0.5 minutos). sintomas de toxicidade cardiovascular ou do sistema nervoso central se o torniquete for esvaziado pelo menos 99 minutos após a injeção da droga no sistema venoso, embora o zumbido tenha sido observado nos períodos pós-deflação de 30 e 20 segundos após os tempos de insuflação padrão.
No entanto, uma pesquisa bibliográfica no PubMed® da American National Library of Medicine, no Embase® e no MEDLINE®, abrangendo o período de 1950 a 2007, revelou 24 casos de convulsões, com convulsões relatadas em 12 casos enquanto o manguito ainda estava inflado e em 9 casos após a desinsuflação do manguito. A informação não estava disponível em três casos. As convulsões que ocorreram durante a insuflação do torniquete foram relatadas com a pressão do torniquete excedendo a pressão arterial sistólica inicial em 150 mm Hg. As convulsões que ocorreram após a desinsuflação do torniquete foram relatadas com tempos de torniquete de até 60 minutos e com um atraso de até 10 minutos após a desinsuflação do torniquete. A dose mais baixa de anestésico local associada à convulsão foi de 1.4 mg/kg para lidocaína, 4 mg/kg para prilocaína e 1.3 mg/kg para bupivacaína.
Embora cerca de 70% da dose administrada de lidocaína permaneça dentro dos tecidos do membro isolado após a desinsuflação do torniquete, os 30% restantes entram na circulação sistêmica durante os 45 minutos seguintes. Muito mais droga é liberada dos tecidos do membro isolado na circulação após a desinsuflação do torniquete se o membro for exercitado inadvertidamente, enfatizando a importância de manter a extremidade previamente anestesiada quiescente por algum tempo imediatamente após a desinsuflação do torniquete.
O outro anestésico local comumente utilizado para ARIV, a prilocaína, está associado à formação de metemoglobina (MetHb), que ocorre cerca de 4 a 8 horas após sua administração. Felizmente, metemoglobinemia significativa não foi relatada quando a prilocaína foi usada para ARIV. A prilocaína (0.5%) administrada para ARIV tem um início de analgesia de cerca de 11 minutos (±6.8 minutos), e o término da analgesia após a deflação do torniquete é em média de 7.2 minutos (±4.6 minutos).25 O uso desse agente para ARIV parece ser extraordinariamente seguro. De fato, em uma pesquisa com 45,000 bloqueios de ARIV com prilocaína, não houve efeitos colaterais graves e nenhuma morte usando esse medicamento por essa técnica.102 Em termos de eficácia, a prilocaína parece ser equivalente à lidocaína quando usada para ARIV.
Quando os opioides são administrados em combinação com anestésicos locais para ARIV na tentativa de prolongar a analgesia após a desinsuflação do manguito, efeitos colaterais ocasionais tipicamente atribuídos aos opioides administrados sistemicamente podem ser observados após a desinsuflação do manguito. Estes incluem náuseas, vômitos e sedação leve.
Quando drogas bloqueadoras neurovasculares são administradas em conjunto com anestésicos locais para melhorar as condições cirúrgicas em pacientes submetidos à redução de fraturas, não há relatos de complicações desses adjuvantes.
Dicas NYSORA
• Um sistema de torniquete intacto é essencial para o desempenho seguro e bem-sucedido da IVRA.
• A deflação não intencional do torniquete ou a presença de uma comunicação vascular mesmo com um torniquete intacto e funcional pode resultar em toxicidade sistêmica grave.
• Quando os procedimentos cirúrgicos são inferiores a 30 minutos, a desinsuflação e a insuflação intermitentes do manguito podem prolongar efetivamente o tempo para atingir as concentrações arteriais de pico do anestésico local, mas podem não ser totalmente confiáveis para minimizar a toxicidade devido à liberação do anestésico local na circulação.
• O torniquete não deve ser desinsuflado até pelo menos 30 minutos após a injeção do anestésico local (e adjuvantes, se usados) no sistema venoso isolado.
Além disso, o próprio torniquete pode ser uma fonte de complicações, pois pode causar dor isquêmica e desconforto.
A hipertensão sistêmica pode resultar da insuflação do torniquete que é sustentada ou prolongada. O mau uso ou mau funcionamento do equipamento é uma fonte importante e evitável de complicações devido a esta técnica. Mesmo um torniquete intacto e totalmente funcional pode estar associado ao vazamento de drogas administradas de uma extremidade supostamente isolada para a circulação sistêmica.
A ARIV de membro inferior tem uma incidência de quase 100% de vazamento de anestésico local por baixo do torniquete, contra cerca de 25% de incidência de bloqueio de membro superior. Como corolário desse fenômeno de vazamento, o uso de ARIV para analgesia de membros inferiores tem uma alta incidência associada de bloqueio de baixa qualidade (quase 40% em um estudo prospectivo). O fármaco pode vazar por um manguito aparentemente em pleno funcionamento e obter acesso à circulação sistêmica através da circulação interóssea, que não é afetada pela oclusão de músculos, tecidos moles e canais vasculares que o acompanham. Esse fator é reconhecido há quase 50 anos, mas não parece ser significativo na produção de complicações decorrentes da ARIV.
A deflação do torniquete após ARIV está associada a sinais e sintomas de toxicidade sistêmica do anestésico local, variando de eventos leves relacionados ao sistema nervoso central, como zumbido e dormência perioral, a convulsões e, finalmente, a um colapso cardiovascular devastador. Estes se correlacionam com as concentrações de anestésicos locais no sangue arterial e não com as concentrações venosas.
Outra complicação da ARIV é a dor do torniquete, que não raramente ocorre se um dispositivo pneumático duplo não for utilizado (Figura 1 e Figura 9). Recomendamos o uso de tal torniquete para qualquer procedimento realizado com IVRA que deva durar mais de 30 minutos. Mesmo quando essas diretrizes são seguidas, no entanto, eventos adversos ocorrem após a deflação do torniquete após um intervalo de tempo “seguro”. Muito raros, relatos isolados de complicações neurológicas, incluindo danos aos nervos mediano, ulnar e musculocutâneo, estão associados à ARIV. A causa dessas complicações parece ser a pressão direta do torniquete aplicado a esses nervos, que posteriormente exibem alterações histológicas semelhantes a lesões por esmagamento. Recomenda-se que o tempo de torniquete não exceda 2 horas para reduzir a probabilidade de danos capilares e musculares secundários à acidose tecidual.
Síndrome do compartimento pode ocorrer raramente após ARIV, especialmente quando a ARIV é usada para redução de fraturas de membros inferiores de ossos longos, e pode ser devido tanto ao grande volume de anestésico local injetado para efeito de analgesia quanto à exsanguinação inadequada ou incompleta do membro antes da realização da cirurgia. quadra. Há um relato de caso dessa complicação após injeção inadvertida de solução salina hipertônica quando se pretendia injetar anestésico local.
Uma paciente grávida de 33 anos submetida a ARIV para liberação endoscópica do túnel do carpo apresentou um episódio grave de sensação de membro fantasma após a injeção do anestésico local.
Os sintomas desapareceram com a dissipação do IVRA. Há um relato da devastadora necessidade de amputação do braço em um paciente de 28 anos cujas artérias radial e ulnar trombosaram após ARIV após um breve tempo de oclusão de torniquete. , ou talvez uma reação medicamentosa idiossincrática seja puramente especulativa. Três casos, incluindo morte ou danos cerebrais permanentes associados a IVRA, foram relatados no ASA Closed Claims Project para os anos de 1980 a 1999. As especificidades desses casos não são conhecidas.
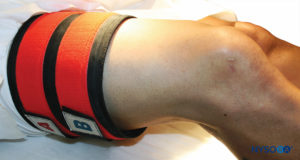
FIGURA 9.O sistema de torniquete duplo é colocado na coxa direita proximal, em preparação para ARIV do membro inferior direito.
Toxicidade Anestésica Local
Embora a lidocaína seja o agente anestésico local mais comumente utilizado para ARIV nos Estados Unidos, na Europa a prilocaína 0.5% é mais rotineiramente escolhida. A prilocaína, no entanto, é metabolizada em ortotoluidina, um composto oxidante capaz de converter hemoglobina em MetHb. Isso geralmente é preocupante apenas quando a dose de prilocaína excede 600 mg, o que, mesmo para ARIV de membros inferiores em que volumes de até 100 mL são utilizados, não deve ser alcançado (ou seja, 100 mL × 0.5% de prilocaína = 500 mg) .
Dicas NYSORA
• A metemoglobinemia grave é uma emergência médica que requer reconhecimento imediato e tratamento adequado.
• Uma boa história e alto nível de suspeição são necessários para fazer o diagnóstico.
• Para metemoglobinemia por exposição a drogas, a terapia tradicional de primeira linha consiste na infusão de azul de metileno (MB).
• A dextrose deve ser administrada porque a principal fonte de NADH (nicotinamida adenina dinucleotídeo reduzido [hidrogenado]) nos glóbulos vermelhos é o catabolismo do açúcar por meio da glicólise. A dextrose também é necessária para formar NADPH (fosfato NAD reduzido [hidrogenado]) através do shunt de hexose monofosfato, que é necessário para que o MB seja eficaz.
• A dose de MB é de 1 a 2 mg/kg IV em 5 minutos (a dose total não deve exceder 7–8 mg/kg).
• A MB pode causar dispneia, dor torácica ou hemólise.
• MB fornece um transportador de elétrons artificial para a redução de MetHb através da via NADPH-dependente. A resposta é rápida; a dose pode ser repetida em
1 hora se o nível de MetHb ainda estiver alto 1 hora após a infusão inicial.
• A metemoglobinemia de rebote pode ocorrer até 18 horas após a administração de MB devido à absorção prolongada de agentes lipofílicos (benzocaína) do tecido adiposo. É razoável realizar medições seriadas dos níveis de MetHb após o tratamento com MB. O MB não deve ser administrado a pacientes com deficiência de glicose-6-fosfato desidrogenase (G6PD) porque a redução da MetHb pelo MB é dependente do NADPH gerado pela G6PD (hemólise). Um tratamento alternativo para esses pacientes é o ácido ascórbico (2 mg/kg).
• A transfusão de sangue ou exsanguineotransfusão pode ser útil em pacientes em choque. O oxigênio hiperbárico tem sido usado com sucesso anedótico em casos graves.
A deflação do torniquete após a cirurgia é um passo crítico para minimizar a possibilidade de Toxicidade associado ao IVRA. Em primeiro lugar, é absolutamente obrigatório que o torniquete não seja esvaziado a menos que tenham decorrido pelo menos 30 minutos desde a injeção do anestésico local, mesmo que a duração da cirurgia ou da manipulação tenha sido curta. Se a cirurgia for breve e o paciente precisar se recuperar na SRPA, é aceitável cortar o torniquete distal enquanto ele é inflado, remover o paciente da área de operação (com o torniquete inflado) e transferir o paciente para um ambiente de cuidado monitorado. Em nenhum momento alguém deve remover o torniquete pinçado, no entanto, até que o período de 30 minutos iniciado com a injeção da solução anestésica local tenha decorrido. Nesse momento, o paciente deve ser monitorado continuamente por pelo menos 15 minutos após a liberação do torniquete na SRPA. Pelo menos um caso de parada cardíaca foi relatado quando o torniquete foi liberado logo após a injeção de anestésico local, onde a duração da cirurgia foi extremamente curta.
Em segundo lugar, é absolutamente essencial que a desinsuflação do torniquete seja realizada de forma “cíclica” da seguinte forma: O manguito é desinsuflado (após um mínimo de 30 minutos) e imediatamente reinsuflado. O paciente é observado ou questionado cuidadosamente quanto à ocorrência de sintomas associados à toxicidade do anestésico local, como zumbido, tontura, gosto metálico na boca e assim por diante. Obviamente, sinais de estimulação do sistema nervoso central também podem representar toxicidade anestésica local e também devem ser procurados. Se não houver tais sinais ou sintomas após cerca de 1 minuto, o manguito é novamente desinsuflado e novamente imediatamente reinsuflado por um período de cerca de 1 a 2 minutos, com o paciente sendo observado e questionado quanto à toxicidade sistêmica do anestésico local. Se nenhum aparecer neste momento, o torniquete pode ser esvaziado com segurança e removido da extremidade. A segurança dessa desinsuflação/reinsuflação cíclica é que, com cada desinsuflação, apenas uma pequena fração do anestésico local administrado (e não ligado) pode entrar na circulação sistêmica, minimizando a possibilidade de um aumento súbito e sustentado do nível sanguíneo de o anestésico local.
RESUMO
A anestesia regional intravenosa é um complemento valioso ao arsenal de médicos em qualquer especialidade que lida com o paciente com lesão aguda. A simplicidade da técnica e a relativa segurança (se mantida a estrita adesão ao protocolo listado anteriormente) a tornam uma alternativa atraente para bloqueio do plexo braquial (para cirurgia ou manipulação da extremidade superior) e Espinhal or bloqueio peridural (para cirurgia ou manipulação de membros inferiores). A simples capacidade de identificar e acessar uma veia periférica e aplicar um torniquete pneumático torna esta uma das modalidades de bloqueio regional mais “amigáveis” na prática clínica. Não há necessidade de ter facilidade com um estimulador de nervo periférico ou interpretar imagens obtidas de uma máquina de ultra-som. Uma das únicas desvantagens potenciais associadas à ARIV é a duração finita da anestesia/analgesia associada ao seu uso. A relativa incapacidade de prolongar a analgesia por muito tempo no período pós-procedimento diminui sua utilidade. Para essas ocasiões, a inserção e manutenção contínua do cateter por meio da anestesia do plexo garante uma alternativa atraente.
REFERÊNCIAS
- Bier A: Uber einen neun weg anestesia local an den gliedmassen zuerzeugen. Arch Klin Chir 1908;86:1007–1016.
- Bier A: Sobre um novo método de anestesia local. Muench Med Wschir 1909; 56:589.
- Bier A: Sobre anestesia venosa. Berl Klin Wschr 1909;46: 477–489.
- Bier A: Sobre anestesia local com referência especial à anestesia venosa. Edimburgo Med J 19105:103-123.
- Morrison J: Anestesia local intravenosa. Br J Surg 1930–1931;18:641–647.
- Herreros L: Anestesia regional por via intravenosa. Anestesiologia 1946;7:558–560.
- Holmes CMcK: Analgesia regional intravenosa. Lancet 1963;1:245-247.
- Kalman S, Svenson H, Lisander B, et al: Alterações sensoriais quantitativas em humanos após bloqueio regional intravenoso com mepivacaína. Reg Anesth Pain Med 1999;24:236–241.
- Wahren L, Torebjork E, Nystorm B: Teste sensorial quantitativo antes e depois do bloqueio regional de guanetidina em pacientes com neuralgia na mão. Pain 1991;46:23-30.
- Smith M, Sprung J, Zura A, et al: Uma pesquisa de exposição a técnicas de anestesia regional em programas de treinamento de residência em anestesia americano. Reg Anesth Pain Med 1999;24:11–16.
- Blaheta H, Vollert B, Zuder D, et al: A anestesia regional intravenosa (bloqueio de Bier) para a terapia com toxina botulínica da hiperidrose palmar é segura e eficaz. Dermatol Surg 2002;28:666–671.
- Bosdotter Enroth S, Rystedt A, Covaciu L, et al: Anestesia regional intravenosa bilateral do antebraço com prilocaína para tratamento com toxina botulínica da hiperidrose palmar. J Am Acad Dermatol 2010;63(3): 466–474.
- Nascimento MSA, Klamt JG e Prado WA: Bloqueio regional intravenoso é semelhante ao bloqueio ganglionar simpático para tratamento da dor em pacientes com síndrome dolorosa complexa regional tipo 1. Braz J Med Biol Res 2010; 43(12):1239-1244.
- Glickman L, Mackinnon S, Rao T, et al: Anestesia regional intravenosa contínua. J Hand Surg 1992;17:82–86.
- Mabee J, Shean C, Orlinsky M, et al: Os efeitos do bloqueio de Bier simulado IVRA na pressão do tecido intracompartimental. Acta Anesthesiol Scand 1997;41:208–213.
- Aarons CE, Fernandez MD, Willsey M, Peterson B, Key C, Fabregas J: Anestesia regional Bier block e gesso para fraturas do antebraço: segurança no cenário do departamento de emergência pediátrica. J Pediatr Orthop 2014;34:45–49.
- Singh R, Bhagawat A, Bhadoria P, Kohli A: ARIV de antebraço, usando lidocaína a 0.5% na dose de 1.5 mg/kg com cetorolaco 0.15 mg/kg para cirurgias de mão e punho. Minerva Anestesiol 2010;76:109–114.
- Chiao FB, Chen J, Lesser JB, Resta-Flarer F, Bennett H: O torniquete do antebraço com manguito único na anestesia regional intravenosa resulta em menos dor e menos necessidade de sedação do que o torniquete no braço. Br J Anaesth 2013;111(2):271–275.
- Benlabed M, Jullien P, Guelmi K, et al: alcanização de lidocaína a 0.5% para anestesia regional intravenosa. Reg Anesth 1990; 15:59-60.
- Lavin P, Henderson C, Vaghadia H: 2-clorprocaína não alcalinizada e alcalinizada versus lidocaína para anestesia regional intravenosa durante cirurgia ambulatorial da mão. Can J Anaesth 1999;46:939–945.
- Ulus A, Gurses E, Oztrurk I, Serin S: Avaliação comparativa de dois volumes diferentes de lidocaína em anestesia regional intravenosa. Med Sci Monit 2013;19:978–983.
- Chan V, Weisbrod M, Kaszas Z, et al: Comparação de ropivacaína e lidocaína para anestesia regional intravenosa em voluntários: Um estudo preliminar sobre eficácia anestésica e nível sanguíneo. Anestesiologia 1999;90: 1602-1608.
- Peng P, Coleman M, McCartney C, et al: Comparação do efeito anestésico entre ropivacaína a 0.375% versus lidocaína a 0.5% em anestesia regional intravenosa no antebraço. Reg Anesth Pain Med 2002;27;595–599.
- Horn JL, Cordo P, Kunster D, et al: Progressão da anestesia regional intravenosa no antebraço com ropivacaína. Reg Anesth Pain Med 2011;36(2): 177-180.
- Pitkanen M, Suzuki N, Rosenberg P: Anestesia regional intravenosa com prilocaína a 0.5% ou clorprocaína a 0.5%. Uma comparação duplamente cega em voluntários. Anestesia 1992;47:618–619.
- Pitkanen M, Kytta J, Rosenberg P: Comparação de 2-cloroprocaína e prilocaína para anestesia regional intravenosa do braço: um estudo clínico. Anestesia 1993;48:1091–1093.
- Pitkanen M, Xu M, Haasio J, et al: Comparação de 0.5% de articaína com 0.5% de prilocaína em anestesia regional intravenosa do braço: Um estudo cruzado em voluntários. Reg Anesth Pain Med 1999;24:131–135.
- Simon M, Gielen M, Albernik N, et al: Anestesia regional intravenosa com articaína a 0.5%, lidocaína a 0.5% ou prilocaína a 0.5%. Um estudo clínico randomizado duplo-cego. Reg Anesth 1997;22:29–34.
- Hoffman V, Vercauteren M, Van Steenberge A, et al: Anestesia regional intravenosa. Avaliação de quatro diferentes aditivos para prilocaína. Acta Anesthesiol Belg 1997;48:71–76.
- Armstrong P, Brockway M, Wildsmith J: Alcalinização da prilocaína para anestesia regional intravenosa. Anestesia 1990;45:11–13.
- Solak M, Akturk G, Erciyes N, et al: A adição de bicarbonato de sódio à solução de prilocaína durante a anestesia regional IV. Acta Anesthesiol Scand 1991;35:572–574.
- Kalman S, Bjorn K, Tholen E, et al: A mepivacaína como um bloqueio regional intravenoso interfere na hiperemia reativa e diminui o fluxo sanguíneo no estado de equilíbrio. Reg Anesth 1997;22:552–556.
- Kalman S, Liderfalk C, Wardell K, et al: Efeito diferencial na vasodilatação e dor após capsaicina intradérmica em humanos durante a decadência da anestesia regional intravenosa com mepivacaína. Reg Anesth Pain Med 1998;23:402–408.
- Choyce A, Peng P: Uma revisão sistemática de adjuntos para anestesia regional intravenosa para procedimentos cirúrgicos. Can J Anaesth 2002;49: 32–45.
- Kleinschmidt S, Stockl W, Wilhelm W, et al: A adição de clonidina à prilocaína para anestesia regional intravenosa. Eur J Anesthesiol 1997;14:40–46.
- Cucchia G, Chasot-Di Dio V, et al: Efeito da adição de clonidina ao anestésico local durante o bloqueio de Bier na analgesia pré e pós-operatória. Br J Anaesth 1997;78(Suppl 1):78–79.
- Ivie CS, Viscomi CM, Adams DC, Friend AF, Murphy TR, Parker CJ: Clonidina como adjuvante à anestesia regional intravenosa: Um estudo randomizado, duplo-cego, controlado por placebo, de variação de dose. Anestesiol Clin Pharmacol 2011;27(3):323–327.
- Memis D, Turan A, Karamanlioglu B, et al: Adicionando dexmedetomidina à lidocaína para anestesia regional intravenosa. Anesth Analg 2004;98: 835–840.
- Kol IO, Ozturk H, Kaygusuz K, Gursoy S, Comert B, Mimaroglu C: Adição de dexmedetomidina ou lornoxicam à prilocaína em anestesia regional intravenosa para cirurgia de mão ou antebraço: Um estudo controlado randomizado. Clin Drug Investig 2009;29(2):121–129.
- Mirzak A, Gul R, Erkutlu I, Alptekin M, Oner U: Pré-medicação com dexmedetomidina isolada ou em conjunto com lidocaína a 0.5% para ARIV. J Surg Res 2010;164(2):242–247.
- Fields H, Emson P, Leigh B, et al: Múltiplos locais de receptores opiáceos em fibras aferentes primárias. Natureza 1980; 284: 351-353.
- Young W, Wamsley J, Zarbin M, et al: Os receptores opióides sofrem fluxo axonal. Ciência 1980; 210:76-78.
- Boogaerts J, Balatoni E, Lafont N, et al: Utilization des morphiniques dans les blocs neuralux peripheriques. Congres Ser Ars Medicina 1985;3:143–150.
- Gobeaux D, Landais A: Utilization deux morphiniques dans les blocs du plexus braquial. J Can Anesth 1988;36:437–440.
- Gobeaux D, Landais A, Bexon G, et al: Adjonction de fentanyl la lidocaine adrenalina para o bloqueio do plexo braquial. J Can Anesth 1987;35:195–199.
- Viel E, Eledjam J, de la Coussaye J, et al: Bloqueio do plexo braquial com opióides para alívio da dor pós-operatória: Comparação entre buprenorfina e morfina. Reg Anesth 1989;14:274–278.
- Candido K, Khan M, Raja D, et al: Bloqueio do plexo braquial para alívio da dor pós-operatória. Reg Anesth 2000;25:23.
- Arhtur J, Mian T, Heavner J, et al: Fentanil e lidocaína versus lidocaína para bloqueio de Bier. Reg Anesth 1992;17:223–227.
- Bobart V, Hartmannsgruber M, Atanassoff P, et al: Analgesia/anestesia após fentanil mais lidocaína versus lidocaína simples para anestesia regional intravenosa. Anesth Analg 1998:86:S-3.
- Pitkanen M, Rosenberg P, Pere P, et al: Mistura de fentanil-prilocaína para anestesia regional intravenosa em pacientes submetidos à cirurgia. Anestesia 1992;47:395–398.
- Armstrong P, Power I, Wildsmith J: Adição de fentanil à prilocaína para anestesia regional intravenosa. Anestesia 1991;46:278–280.
- Gupta A, Begntsson M, Bjornsson A, et al: Falta de efeito analgésico periférico da morfina em baixa dose durante anestesia regional intravenosa. Reg Anesth 1993;18:250–253.
- Abdulla W, Fadhil N: Uma nova abordagem para anestesia regional intravenosa. Anesth Analg 1992;75:597–601.
- Sztark F, Thicoipe M, Favarel-Garriques J, et al: O uso de lidocaína a 0.25% com fentnail e pancurônio para anestesia regional intravenosa. Anesth Analg 1997;84:777–779.
- Subxedar D, Gevirtz C, Malik V, et al: Anestesia regional intravenosa: Avaliação prospectiva de lidocaína a 0.25% com fentanil e rocurônio. Reg Anesth 1997;22:41.
- Thapar P, Skerman J: Avaliação de lidocaína a 0.2% com fentanil e D-tubocurarina para anestesia regional intravenosa. Reg Anesth 1997; 84: S342.
- Santhosh MC, Rohini BP, Roopa S, Raghavendra PR: Estudo de lidocaína 0.5% isolada e combinação de lidocaína 0.25% com fentanil e vecurônio em anestesia regional intravenosa para cirurgias de membros superiores. Rev Bras Anestesiol 2013;63(3):254–257.
- Acalovschi I, Cristea T: Anestesia regional intravenosa com meperidina. Anesth Analg 1995;81:539–543.
- Acalovschi I, Cristea T, Margarit S, et al: Tramadol adicionado à lidocaína para anestesia regional intravenosa. Anesth Analg 2001;92:209–214.
- Tan S, Pay L, Chan S: Anestesia regional intravenosa com lidocaína e tramadol. Ann Acad Med Cingapura 2001;30:516–519.
- Alayurt S, Memis D, Pamucku Z: A adição de sufentanil, tramadol ou clonidina à lidocaína para anestesia regional intravenosa. Anaesth Intensive Care 2004;32:22–27.
- Kurt N, Kurt I, Aygunes B, et al: Efeitos da adição de alfentanil ou atracúrio à solução de lidocaína para anestesia regional intravenosa. Eur J Anesthesiol 2002;19:522–525.
- Elhakim M, Sadek R: Adição de atracúrio à lidocaína para anestesia regional intravenosa. Acta Anesthesiol Scand 1994;38:542–544.
- McCartney C, Brill S, Rawson R, et al: Nenhum benefício anestésico ou analgésico de neostigmina 1 mg adicionado à anestesia regional intravenosa com lidocaína 0.5% para cirurgia de mão. Reg Anesth Pain Med 2003;28:414–417.
- Turan A, Karamanlyoglu B, Memis D, et al: Anestesia regional intravenosa com prilocaína e neostigmina. Anesth Analg 2002;95: 1419–1422.
- Sethi D, Wason R: Anestesia regional intravenosa com lidocaína e neostigmina para cirurgia de membro superior. J Clin Anesth 2010;22(5): 324–328.
- Singh R, Bhagwat A, Bhadoria P, Kohli A: ARIV de antebraço, usando lidocaína a 0.5% na dose de 1.5 mg/kg com cetorolaco 0.15 mg/kg para cirurgias de mão e punho. Minerva Anestesiol 2010;76(2):109–114.
- Jones N, Pugh S: A adição de tenoxicam à prilocaína para anestesia regional intravenosa. Anestesia 1996;51:446–448.
- Sertoz N, Kocaoglu N, Ayanoglu HO: Comparação de lornoxicam e fentanil quando adicionados à lidocaína em anestesia regional intravenosa. Rev Bras Anestesiol 2013;63(4):311–316.
- Yurtlu S, Hanci V, Kargi E, Erdogan G, et al: O efeito analgésico do dexcetoprofeno quando adicionado à lidocaína para anestesia regional intravenosa: um estudo prospectivo, randomizado e controlado por placebo. J Int Med Res 2011;39(5):1923–1931.
- Bengtsson A, Bengtsson M, Nilsson I, et al: Efeitos da administração regional intravenosa de metilprednisolona mais mepivacaína na artrite reumatóide. Scand J Rheumatol 1998;27:277–280.
- Taskaynatan M, Ozgul A, Tan A, et al: Bloqueio de Bier com metilprednisolona e lidocaína em CRPS Tipo 1: Um estudo randomizado, duplo-cego controlado por placebo. Reg Anesth Pain Med 2004;29:408–412.
- Varitimidis SE, Papatheodorou LK, Dailiana ZH, Poultsides L, Malizos KN: Síndrome dolorosa complexa regional tipo I como consequência de trauma ou cirurgia de membro superior: Manejo com anestesia regional intravenosa, usando lidocaína e metilprednisolona. J Hand Surg Eur 2011;36(9):771–777.
- Sen H, Kulachi Y, Bicerer E, Ozkan S, Dagli G, Turan A: O efeito analgésico do paracetamol quando adicionado à lidocaína para anestesia regional intravenosa. Anesth Analg 2009;109(4):1327–1330.
- Ko MJ, Lee JH, Cheong SH, et al: Comparação dos efeitos do acetaminofeno ao cetorolaco quando adicionado à lidocaína para anestesia regional intravenosa. Korean J Anesthesiol 2010;58(4):357–361.
- Sen S, Ugur B, Aydin ON, et al: O efeito analgésico da nitroglicerina adicionada à lidocaína na anestesia regional intravenosa. Anesth Analg 2006;102(3):916–920.
- Lauretti GR, Perez MV, Reis MP, Pereira NL: Avaliação duplo-cega da nitroglicerina transdérmica como adjuvante da morfina oral no tratamento da dor no câncer. J Clin Anesth 2002:14:83-86).
- Lauretti GR, de Olivera R, Reis MP, et al: A nitroglicerina transdérmica aumenta a analgesia pós-operatória com sufentanil espinhal após cirurgia ortopédica. Anestesiologia 1999;90:734–739.
- Ferreira SH, Lorenzette BB, Faccioli LH: bloqueio de hiperalgesia e edema neurogênico por aplicação tópica de NTG. Eur J Pharmacol 1992;217:207–209.
- Jaro K, Batra YK, Panda NB: Bloqueio do plexo braquial com midazolam e bupivacaína melhora a analgesia. Can J Anaesth 2005;52:822–826.
- Laig N, Khan MN, Arif M, Khan S: Midazolam com bupivacaína para melhorar a qualidade da analgesia no bloqueio do plexo braquial para cirurgias de membros superiores. J Coll Physicians Surg Pak 2008;18:674–678.
- Nishiyama T, Tamai H, Hanaoka K: Concentrações séricas e no líquido cefalorraquidiano de midazolam após administração epidural em cães. Anesth Analg 2003;96:159–162.
- Bhisitkul RB, Villa JE, Kocsis JD: Receptores axonais GABA estão presentes seletivamente em fibras sensoriais normais e regeneradas em nervos periféricos de ratos. Exp Brain Res 1987:66:659–663.
- Brown DA, Marsh S: Receptores GABA axonais em troncos nervosos periféricos de mamíferos. Brain Res 1978;156:187–191.
- Cairns BE, Sessle BJ, Hu JW: A ativação de receptores periféricos GABA-A inibe a atividade muscular da mandíbula evocada pela articulação temporomandibular. J Neurophysiol 1999;81:1966-1969.
- Kontinen VK, Dickenson AH: Efeitos do midazolam no modelo de ligação do nervo espinhal de dor neuropática em ratos. Dor 2000;85:425–431.
- Farouk S, Aly AJ: Qualidade da analgesia com lidocaína com e sem midazolam para anestesia regional intravenosa. J Anesth 2010;24(6): 864–868.
- Kashefi P, Montazeri K, Honarmand A, Safavi M, Hosseini HM: O efeito analgésico do midazolam quando adicionado à lidocaína para anestesia regional intravenosa. J Res Med Sci 2011;16(9):1139–1148.
- Carlton SM, Hargett GL, Coggeshall RE: Localização e ativação de receptores de glutamato em axônios mielinizados de pele glabra de rato. Neurosci Lett 1995;197:25-28.
- Brau ME, Sander F, Vogel W, Hempelmann G: Mecanismos de bloqueio da cetamina e seus enantiômeros no nervo periférico enzimaticamente desmielinizado, conforme revelado por experimentos de canal único. Anestesiologia 1997;86:394–404.
- Viscomi CM, Friend C, Parker C, Murphy T, Yarnell M: Cetamina como adjuvante na anestesia regional intravenosa com lidocaína: um estudo de controle sistêmico randomizado, duplo-cego. Reg Anesth Pain Med 2009;34(2): 130–133.
- Georgias NK, Maidatsi PG, Kyriakidis AM, et al: Clonidina versus cetamina para prevenir a dor do torniquete durante anestesia regional intravenosa com lidocaína. Reg Anesth Pain Med 2001;26(6):512–517.
- Livingstone J, Atkins R: bloqueio regional de guanetidina intravenosa no tratamento da síndrome de dor regional complexa pós-traumática 1 (algodistrofia) da mão. J Bone Joint Surg Br 2002;84:380–386.
- Ramamurthy S, Hoffman J: guanetidina regional intravenosa no tratamento da distrofia simpática reflexa/causalgia. Um estudo randomizado, duplo-cego. Grupo de Estudo da Guanetidina. Anesth Analg 1995;81: 718–723.
- Hord A, Rooks M, Stephens B, et al: Bretílio regional intravenoso e lidocaína para o tratamento da distrofia simpática reflexa: Um estudo randomizado, duplo-cego. Anesth Analg 1992;74:818–821.
- Lee F, Shoemaker J, McQuillan P, et al: Efeitos do bloqueio de Bier do antebraço com bretílio nas respostas hemodinâmicas e metabólicas ao aperto de mão. Am J Physiol Heart Circ 2000;279:H586–H593.
- Bader A, Concepcion M, Hurley R, et al: Comparação de lidocaína e prilocaína para anestesia regional intravenosa. Anestesiologia 1988;69: 409–412.
- Tucker G, Boas R: Aspectos farmacocinéticos da anestesia intravenosa. Anestesiologia 1971;34:538–549.
- Ware R: Anestesia regional intravenosa com bupivacaína. Uma comparação duplamente cega com a lidocaína. Anestesia 1979;34:231–235.
- Smith C, Steinhaus J, Haynes C: A segurança e eficácia da anestesia regional intravenosa. South Med J 1968;61:1057–1060.
- Guay J: Eventos adversos associados à anestesia regional intravenosa (Bier Block): Uma revisão sistemática de complicações. J Clin Anesth 2009;21: 585–594.
- Bartholomew K, Sloan J: Prilocaína para o bloco de Bier: Quão seguro é seguro? Arch Emerg Med 1990;7:189–195.
- Sukhani R, Garcia C, Munhall R, et al: Disposição de lidocaína após anestesia regional intravenosa com diferentes técnicas de deflação Anesth Analg 1989;68:633–637.
- Mazze R, Dunbar R: Concentrações plasmáticas de lidocaína após anestesia regional caudal, peridural lombar, axilar e intravenosa. Anestesiologia 1966;27:574-579.
- Dunbar R, Mazze R: Anestesia regional intravenosa: Experiência com 779 casos. Anesth Analg 1967;46:806–813.
- Davies J, Walford A: Anestesia regional intravenosa para cirurgia do pé. Acta Anesthesiol Scand 1986;30:145–147.
- Kim D, Shuman C, Sadr B: Anestesia regional intravenosa para cirurgia ambulatorial do pé e tornozelo. Um estudo prospectivo. Ortopedia 1993:16; 1109-1113.
- Cotev S, Robin G: Estudos experimentais sobre anestesia regional intravenosa usando lidocaína radioativa. Br J Anaesth 1966;38:936–940.
- Hargrove R, Hoyle J, Parker J: Níveis de lidocaína no sangue após analgesia regional intravenosa. Anestesia 1996;21:37–41.
- Larsen U, Hommelgaard P: Paralisia de torniquete pneumático após anestesia regional intravenosa. Anestesia 1987;42:526–528.
- Shaw-Wilgis E: Observações sobre os efeitos da isquemia do torniquete. J Bone Joint Surg 1971;1104:190.
- Mabee J, Bostwick T, Burke M: síndrome compartimental iatrogênica da injeção de solução salina hipertônica no bloco de Bier. J Emerg Med 1994;12: 473-476.
- Quigley J, Popich G, Lanz U: Síndrome compartimental do antebraço e da mão: relato de caso. Clin Orthop 1981;161:247–251.
- Hastings H 2º, Misamore G: Síndrome compartimental resultante de anestesia regional intravenosa. J Hand Surg 1987;12:559–562.
- Dominguez E: Sensação angustiante do membro fantasma do membro superior durante anestesia regional intravenosa. Reg Anesth Pain Med 2001;26:72–74.
- Luce E, Mangubat E: Perda de mão e antebraço após bloqueio de Bier: Relato de caso. J Hand Surg 1983;8:280–283.
- Lee LA, Posner K, Domino KB, et al: Lesões associadas à anestesia regional nas décadas de 1980 e 1990. Uma análise de sinistros fechados. Anestesiologia 2004;101:143–152.
- Kennedy B, Duthie A, Parbrook G, Carr T: Anestesia regional intravenosa: Uma avaliação. Br Med J 1965;5440:954-957.