Colin JL McCartney e Stephen Choi
INTRODUÇÃO
Os bloqueios de nervos periféricos oferecem muitos benefícios para os pacientes, incluindo controle superior da dor e redução dos efeitos colaterais relacionados à anestesia geral. Para otimizar o alívio da dor e reduzir a dose total de anestésico local, seria útil adicionar um medicamento que acelerasse o início e prolongasse o bloqueio sensorial ou o efeito analgésico. Melhorias em nosso conhecimento dos mecanismos de dor do sistema nervoso periférico (SNP) nos permitem desenvolver métodos para prolongar a analgesia enquanto reduz os efeitos adversos mediados central e perifericamente. Nos últimos 20 anos, vários medicamentos foram testados, e vários se mostraram clinicamente úteis quando adicionados ao anestésico local para bloqueio de nervos periféricos ou quando usados para infiltração local ou analgesia intra-articular. Essas drogas são conhecidas como adjuvantes analgésicos. Este capítulo examina a lógica e a base de evidências atual para o uso de adjuvantes analgésicos e resume as melhores estratégias para otimizar o controle da dor e reduzir os efeitos adversos após cirurgia sob bloqueio de nervo periférico, infiltração local ou injeção de drogas no espaço intra-articular.
JUSTIFICATIVA PARA USO
A transmissão da dor no SNC e no SNP envolve um conjunto complexo de neurotransmissores e vias que não são facilmente bloqueadas por um tipo de droga ou técnica isolada. O envolvimento de várias classes de neurotransmissores no local da lesão, nervo periférico, corno dorsal da medula espinhal e locais supraespinhais é responsável pela transmissão da nocicepção. O uso de agonistas em receptores inibitórios e antagonistas em receptores excitatórios permite uma abordagem “multimodal” com otimização do controle da dor e redução dos efeitos adversos. Em 1645, Descartes propôs um mecanismo para a transmissão da dor, sugerindo que um impulso de dor periférica era transmitido diretamente da periferia para o cérebro por um sistema “hardwired” sem qualquer modulação intermediária.Figura 1).
Essa teoria da transmissão da dor era amplamente considerada verdadeira até recentemente, há 40 anos. Em 1965, Melzack e Wall propuseram sua inovadora teoria de controle do portão da dor que sugeria que a dor poderia ser modulada ou “fechada” em vários pontos no caminho da dor. Pesquisas subsequentes identificaram o corno dorsal (lâmina II) da medula espinhal como um importante local de modulação potencial, e os tratamentos subsequentes para dor aguda e crônica utilizaram esse conhecimento com bons resultados. Tratamentos como o uso de opioides espinhais e estimulação elétrica nervosa transcutânea (TENS) foram desenvolvidos à luz desse conhecimento. A teoria do portão também mudou muitas estratégias de manejo da dor (muitas vezes malsucedidas) de técnicas em que tentamos eliminar as vias da dor quimicamente ou cirurgicamente para técnicas de modulação mais recentes pelas quais tentamos inibir as influências excitatórias e aumentar as influências inibitórias dentro da via da dor. Nas últimas décadas, avanços importantes também ocorreram em nosso conhecimento de como a dor é gerada e transmitida do SNP para o sistema nervoso central (SNC). A modulação da dor no SNP também envolve numerosos transmissores e mecanismos que excitam e inibem as vias nociceptivas. No SNP, em condições fisiológicas normais, os sinais nociceptivos são produzidos quando as fibras A-α e C são estimuladas pelo calor, pressão ou vários produtos químicos produzidos por dano tecidual e inflamação (potássio, histamina, bradicinina, prostaglandinas, trifosfato de adenosina [ATP]) . Os sinais nociceptivos são transmitidos para as camadas superficiais da lâmina II do corno dorsal da medula espinhal, onde são modulados tanto no nível pré-sináptico quanto pós-sináptico e também por vias de controle descendentes excitatórias e inibitórias do tronco encefálico.Figura 2). Os sinais que são bem sucedidos em cruzar este portão viajam para o tronco encefálico e tálamo antes de atingir o córtex cerebral para produzir um estímulo de dor. Mediadores químicos em uma ampla gama são produzidos no SNP e têm influências excitatórias e inibitórias na transmissão do nervo sensorial periférico tanto na fase aguda quanto na fase crônica da lesão.Figura 3). Estes podem ativar diretamente o nervo (ATP, glutamato, 5-hidroxitriptamina [5-HT], histamina, bradicinina); aumentar a despolarização sensibilizando o nervo a outros estímulos (prostaglandinas, prostaciclina e citocinas como interleucinas); ou fornecem um papel regulador no neurônio sensorial, células inflamatórias e fibras simpáticas (bradicinina, taquicinina e fator de crescimento nervoso).
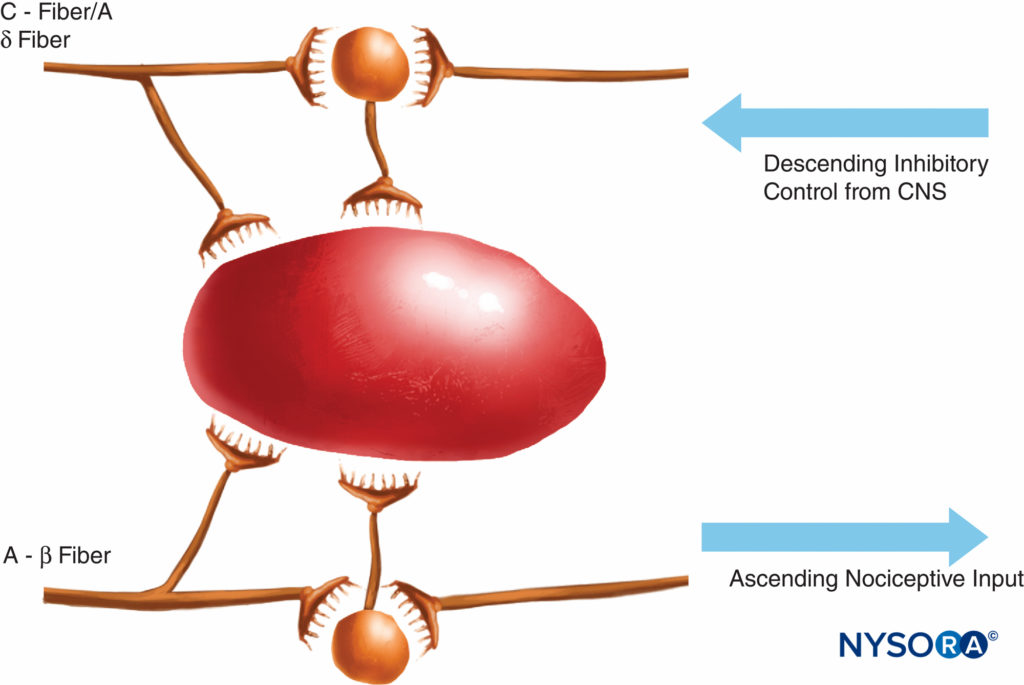
FIGURA 2. A teoria do portão propôs que pequenas fibras (C) ativavam sistemas excitatórios (neurônio preto) que subsequentemente excitavam células de saída; essas últimas células tiveram sua atividade controlada pelo equilíbrio de inibições mediadas por fibras grandes (A-β) (mediadas por opióides endógenos) e também por sistemas de controle descendentes do sistema nervoso central (mediados por norepinefrina e serotonina).
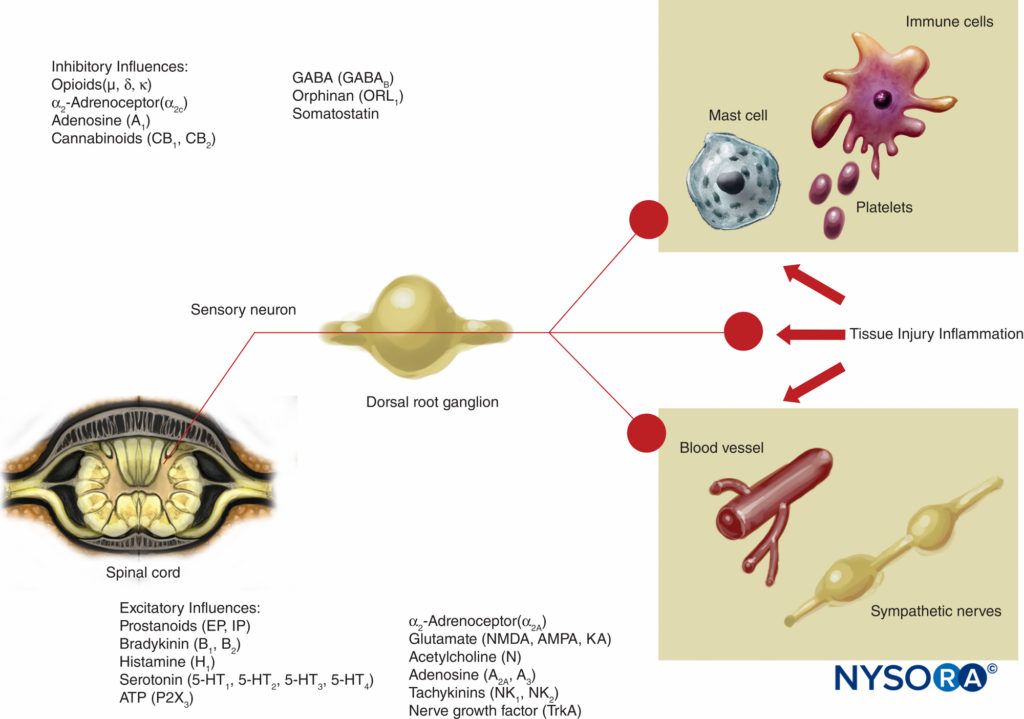
FIGURA 3. Influências excitatórias e inibitórias na atividade nervosa periférica por mediadores liberados por lesão e inflamação tecidual e por uma variedade de agentes que atuam nos neurorreceptores. AMPA = ácido a-amino-3-hidroxi-5-metilisoxazol-4-propiónico; KA = ácido caínico; NMDA = N-metil-d-aspartato; NK = neuroquinina; TrkA = receptor de tropomiosina quinase A.
JUSTIFICATIVA PARA USO DE ADJUVANTES ANALGÉSICOS
Como observado anteriormente, a transmissão da dor no SNC e no SNP envolve um conjunto complexo de neurotransmissores e vias que não são facilmente bloqueadas por um tipo de droga ou técnica isolada. Vários medicamentos do arsenal do anestesiologista, incluindo opioides, anti-inflamatórios não esteroides (AINEs), α2-agonistas, dexametasona e antagonistas de N-metil-aspartato (NMDA), têm atividade nesses locais de ação e podem ser benéficos se aplicado no PNS. É importante ressaltar que nenhum demonstrou neurotoxicidade em concentrações clinicamente relevantes.
Esse conhecimento pode auxiliar o anestesiologista regional de várias maneiras:
- Na seleção de adjuvantes aos anestésicos locais para acelerar o início, prolongar o efeito e reduzir a dose total necessária.
- Sugira agentes que possam aumentar a analgesia pós-operatória sem prolongar os efeitos adversos dos anestésicos locais.
- Sugerir agentes que atuam predominantemente em locais periféricos sem efeitos centrais, otimizando a analgesia e minimizando os efeitos colaterais do SNC.
ANALGÉSICOS OPIÓIDES
Durante a inflamação, os receptores opióides são expressos nas fibras sensoriais periféricas e nas células imunes; além disso, os opióides endógenos são liberados dessas células e equilibram o aumento do estado nociceptivo produzido pela inflamação. Um número crescente de trabalhos sugere uma relação íntima entre os opióides endógenos e o sistema imunológico. Christoph Stein e colegas em Berlim realizaram vários estudos pioneiros que descreveram a capacidade do sistema imunológico de fornecer opioides endógenos e a capacidade da inflamação de estimular o movimento dos receptores opioides para o local da lesão, permitindo assim a antinocicepção. No entanto, essas alterações não ocorrem imediatamente após a lesão e podem levar até 96 horas para ocorrer. Receptores opióides e neuropeptídeos (por exemplo, substância P) são sintetizados no gânglio da raiz dorsal e transportados ao longo dos microtúbulos intra-axonais para os processos centrais e periféricos do neurônio aferente primário.Figura 4). Nos terminais, os receptores opióides são incorporados à membrana neuronal e tornam-se receptores funcionais. Na ativação por opióides exógenos ou endógenos (liberados pelas células imunes), os receptores opióides se acoplam a proteínas G inibitórias. Isso leva à supressão direta ou indireta (por meio da diminuição do monofosfato de adenosina cíclico) das correntes de Ca2+ ou Na+ e subsequente atenuação da liberação da substância P.
A permeabilidade do perineuro é aumentada dentro do tecido inflamado, aumentando a capacidade dos opióides de atingir os receptores-alvo. Numerosos estudos aplicaram opióides no SNP para nervos periféricos ou para o espaço intra-articular. Embora muitos estudos afirmem um benefício analgésico de opioides aplicados perifericamente, poucos estudos incorporaram um grupo controle com um opioide aplicado sistemicamente para comparação. Sem a inclusão de um controle, é impossível interpretar se o opióide periférico está tendo um efeito periférico verdadeiro ou se está sendo transportado para o SNC para induzir analgesia. A verdadeira analgesia opióide mediada perifericamente pode ser benéfica se estiver associada à melhora da analgesia ou redução dos efeitos adversos em comparação com a administração sistêmica. Se o efeito for mediado centralmente, não há benefício claro em relação à administração sistêmica.
Opióides perineural
Os receptores opióides identificados nas fibras aferentes primárias são transportados do gânglio da raiz dorsal para o local da inflamação; no entanto, enquanto estão em transporte axonal, podem não ser facilmente alcançados pelos agonistas opióides. Isso pode explicar o motivo de duas revisões sistemáticas recentes publicadas em 1997 e 2000 terem encontrado poucas evidências do benefício da adição de opióides aos anestésicos locais no bloqueio de nervos periféricos. Uma tabela atualizada de estudos que examinam a administração perineuronal de opióides (excluindo buprenorfina e tramadol) mostra que o benefício analgésico permanece ambíguo.tabela 1). Além disso, Peng e Choyce revisaram o uso de opióides em anestesia regional intravenosa (ARIV) com conclusões decepcionantes semelhantes.
TABELA 1. Resultados de estudos que examinaram o efeito de opióides perineuronais/perineurais (excluindo tramadol e buprenorfina).
| Estudos totais | Resultados gerais | Resultados de controle sistêmico |
|---|---|---|
| estudos 19 | 10 suporte | 7 controle sistêmico: 5 de apoio; 2 negativo |
| Negativo 9 | 12 sem controle sistêmico: 5 suporte; 7 negativo. |
Apesar desses resultados decepcionantes, os dois agonistas opióides que demonstraram eficácia analgésica quando administrados perineuronalmente são a buprenorfina e o tramadol. A buprenorfina é um agonista parcial do receptor µ com uma afinidade do receptor muito alta em comparação com o fentanil (24 vezes) ou a morfina (50 vezes). Além disso, possui lipossolubilidade intermediária, o que lhe permite atravessar a membrana neural. Candido e colaboradores adicionaram 0.3 mg de buprenorfina (um agonista opióide parcial) a uma combinação de mepivacaína e tetracaína no bloqueio axilar e encontraram um aumento de quase 100% na duração da analgesia em comparação com a administração de bloqueio axilar mais a mesma dose de buprenorfina intramuscular com sem aumento significativo de efeitos adversos. Isso apóia o efeito analgésico periférico da buprenorfina e os achados anteriores de dois estudos que examinaram a buprenorfina sem um grupo controle sistêmico. Os estudos que examinam a buprenorfina são apresentados com mais detalhes em tabela 2.
TABELA 2. Estudos examinando a buprenorfina como adjuvante analgésico com anestésicos locais.
| Autor/Data | Pacientes/ Grupos | Tipo de bloco | Dose | Anestesia local | Sistêmico Control | Resultados |
|---|---|---|---|---|---|---|
| Viel 1989 | 20/2 | supraclavicular | 3 mcg / kg | Bupivacaína 0.5% 40 mL | Não | Analgesia prolongada em relação ao grupo morfina (35 vs. 18.25 h); nenhuma diferença no bloqueio sensorial. |
| Bacia 1997 | 89/4 | supraclavicular | 3 µg/kg | Bupivacaína 0.5% Lidocaína 1% | Não | Analgesia prolongada em comparação com o grupo controle (20 vs. 11.5 h) |
| Candido 2001 | 40/2 | supraclavicular | 0.3 mg | Mepivacaína 1% Tetracaína 0.2% | Não | Analgesia prolongada em comparação com o grupo controle (17.4 vs. 5.3 h) |
| Candido 2002 | 60/3 | Axilar | 0.3 mg | Mepivacaína 1% | Sim | A duração média da analgesia pós-operatória foi de 22.3 h no grupo axilar versus 12.5 h no grupo IM e 6.6 h no grupo placebo. |
| Tetracaína 0.2% | IM |
O tramadol é um agonista opióide fraco com alguma seletividade para o receptor µ que também inibe a recaptação de norepinefrina e estimula a liberação de serotonina no espaço intratecal. A norepinefrina e a serotonina são transmissores da via de controle descendente na medula espinhal e aumentam a analgesia. Kapral e colaboradores utilizaram uma dose de 100 mg de tramadol como adjuvante da mepivacaína no bloqueio do plexo braquial axilar. Eles dividiram 60 pacientes em três grupos: um grupo recebeu mepivacaína 1% com 2 mL de solução salina, o segundo grupo recebeu mepivacaína 1% com 100 mg de tramadol e o terceiro grupo recebeu mepivacaína 1% com 2 mL de solução fisiológica e 100 mg de tramadol por via intravenosa. Este estudo demonstrou um aumento da duração do bloqueio motor e sensorial no grupo tramadol axilar que significativamente (p < 01) superou tanto o grupo intravenoso quanto o placebo. Robaux e colegas posteriormente realizaram um estudo dose-resposta com placebo e doses de 40, 100 e 200 mg de tramadol adicionadas a uma dose fixa de mepivacaína 1.5% no bloqueio axilar e descobriram que a dose de 200 mg proporcionou a melhor analgesia sem aumento de efeitos adversos. Alemanno e colaboradores utilizaram a dose de 1.5 mg/kg de tramadol como adjuvante à levobupivacaína a 0.5% (0.5 mL/kg) para bloqueio interescalênico. Aqui, 120 pacientes foram divididos em três grupos: um grupo recebeu apenas anestésico local, o segundo grupo recebeu anestésico local com tramadol sistêmico e o terceiro grupo recebeu anestésico local com tramadol perineural. Enquanto ambos os grupos que receberam tramadol experimentaram analgesia prolongada em comparação com placebo, o grupo que recebeu tramadol perineural apresentou analgesia prolongada em comparação com tramadol sistêmico (14.5 vs. 10.1 horas; p < 001).
Opióides intra-articulares e outras vias periféricas de administração
Os agonistas opióides administrados no tecido inflamado se ligarão aos receptores opióides nos terminais sensoriais e induzirão analgesia. Estudos em animais indicaram que esses receptores opióides periféricos são expressos 96 horas após a lesão inflamatória inicial. A administração intra-articular de opióides, portanto, só produzirá analgesia em pacientes com inflamação preexistente. Kalso e colaboradores examinaram sistematicamente o papel dos opióides intra-articulares em 1997 e estabeleceram que existiam evidências de um benefício prolongado da morfina intra-articular sem efeitos adversos significativos em doses de 1 a 5 mg. Nenhuma resposta à dose foi detectada. Artigos recentes apoiaram esse achado e mostraram o benefício da morfina intra-articular, tramadol, buprenorfina e sufentanil. No entanto, uma revisão sistemática dos efeitos da morfina intra-articular demonstrou apenas um leve efeito analgésico [escala analógica visual para dor (VAS) redução de 12-17 mm], mas não pôde excluir que o efeito foi mediado pela absorção sistêmica.
ALPHA2-AGONISTAS E CLONIDINA
A clonidina é um agonista α2 com alguns efeitos estimulatórios α1. Tradicionalmente, tem sido usado como agente anti-hipertensivo e tem sido observado por muitos anos efeitos sedativos e analgésicos. Mais recentemente, foi determinado que os receptores α2 existem no corno dorsal da medula espinhal, e a estimulação desses receptores produz efeitos analgésicos ao inibir a liberação pré-sináptica de transmissores excitatórios, incluindo substância P e glutamato. A clonidina intratecal medeia a analgesia aumentando os níveis de acetilcolina, que por sua vez estimula os receptores muscarínicos. A excitação muscarínica aumenta os níveis de ácido γ-aminobutírico na fibra aferente primária, inibindo a liberação do neurotransmissor excitatório glutamato. A clonidina injetada próximo aos nervos periféricos com ou sem drogas anestésicas locais parece mediar a analgesia de várias maneiras. A clonidina tem propriedades anestésicas locais e inibe tonicamente os potenciais de ação compostos das fibras C maiores que as fibras A-α no nervo ciático de rato e foi comparável à lidocaína em sua capacidade de inibir as fibras C no nervo vago de coelho. A clonidina também tem um efeito farmacocinético na redistribuição do anestésico local mediada por um efeito vasoconstritor no receptor α1. Modelos animais recentes demonstraram e apoiaram trabalhos anteriores que a clonidina facilita predominantemente o bloqueio de nervos periféricos por meio de corrente catiônica ativada por hiperpolarização e que esse efeito é independente de qualquer efeito vasoconstritor. Uma adição mais recente à seleção de α2-agonistas é a dexmedetomidina, que é seletiva para o receptor α2 e que atualmente é estudada principalmente como agente sedativo em unidades de terapia intensiva. Pode-se esperar que a dexmedetomidina produza não apenas uma analgesia mais profunda, mas também maiores efeitos adversos devido à seletividade da ação. A estimulação do receptor α2 produz hipotensão, bradicardia e sedação em doses mais altas, e esses efeitos podem superar quaisquer benefícios analgésicos produzidos pelo uso desses agentes.
Aplicação perineuronal
Mais de 30 estudos em humanos já examinaram o efeito da clonidina em anestésicos locais no bloqueio de nervos periféricos. Há boas evidências desses estudos de que a clonidina em doses de até 1.5 µg/kg prolonga o bloqueio sensorial e a analgesia quando administrada com anestésicos locais para bloqueio de nervos periféricos. Isso apóia a opinião inicial de Murphy e colegas de que a clonidina é um adjuvante benéfico quando adicionada ao bloqueio de nervos periféricos e que o efeito é provavelmente mediado no SNP. Embora vários estudos tenham examinado o efeito da clonidina adicionada ao bloqueio de nervos periféricos, apenas alguns controlaram um efeito sistêmico. Singelyn e colaboradores avaliaram 30 pacientes que receberam bloqueio do plexo braquial axilar com 40 mL de mepivacaína a 1% mais epinefrina 5 µg/mL. Os pacientes foram randomizados em três grupos e receberam (1) anestésico local isolado, (2) anestésico local mais 150 µg de clonidina administrados por via subcutânea ou (3) 150 µg de clonidina no bloqueio do plexo braquial com anestésico local. A clonidina adicionada ao bloqueio do plexo braquial axilar retardou o aparecimento da dor em duas vezes, sem efeitos adversos quando comparado ao controle sistêmico. Hutschala e colaboradores demonstraram recentemente o efeito analgésico periférico da clonidina em voluntários quando adicionada ao bloqueio do plexo braquial com bupivacaína a 0.25%.
No entanto, outros estudos recentes não demonstraram benefício geral da adição de clonidina a anestésicos locais de ação prolongada, como bupivacaína e ropivacaína. Mais recentemente, uma meta-análise de Popping e colegas estimou que a clonidina prolongou a analgesia pós-operatória, o bloqueio sensorial e o bloqueio motor em 122, 74 e 141 minutos, respectivamente. A clonidina, no entanto, também aumentou a probabilidade de hipotensão (odds ratio [OR] 3.61), desmaio (OR 5.07), sedação (OR 2.28) e bradicardia (OR 3.09). Não houve resposta à dose observada entre um intervalo de 30 e 300 µg, com a maioria recebendo 150 µg. A adição de clonidina a bloqueios nervosos periféricos contínuos não é benéfica. Ilfeld e colaboradores demonstraram em dois estudos que tanto 0.1 quanto 0.2 µg/mL de clonidina adicionados a uma infusão contínua de ropivacaína 0.2% não conseguiram reduzir os escores de dor ou o uso de analgésico oral após cirurgia de membro superior. A dexmedetomidina, como postulado anteriormente, de fato produz um efeito mais profundo na analgesia quando aplicada perineuralmente em conjunto com anestésicos locais. Quatro estudos examinaram isso recentemente, e uma meta-análise sugeriu que a dexmedetomidina prolonga os efeitos analgésicos dos bloqueios do plexo braquial em 284 minutos. Curiosamente, apesar das preocupações iniciais de que a dexmedetomidina possa ter maiores efeitos hemodinâmicos do que a clonidina, esse não parece ser o caso.
Anestesia Regional Intravenosa
A anestesia regional intravenosa é uma técnica anestésica regional útil e simples, especialmente para pequenos procedimentos periféricos de membros superiores que são limitados pela tolerância ao torniquete e má analgesia pós-operatória. A clonidina foi demonstrada em vários estudos para melhorar o tempo de início e a tolerância ao torniquete intraoperatório. Apenas um estudo demonstrou melhora da analgesia pós-operatória no pós-operatório imediato em comparação com placebo. Reuben e colaboradores randomizaram 45 pacientes para 40 mL de lidocaína a 0.5% com clonidina 1 µg/kg, lidocaína isolada com clonidina intravenosa e lidocaína isolada com solução salina intravenosa. Os pacientes que receberam clonidina com lidocaína experimentaram significativamente menos dor e solicitaram menos analgésicos do que os pacientes dos outros dois grupos. Doses mais altas de clonidina (150 µg) produziram significativamente mais sedação e incidência de hipotensão. Até o momento, apenas um estudo usou dexmedetomidina na ARIV. Memis e colaboradores adicionaram 0.5 µg/kg de dexmedetomidina à lidocaína a 0.5% e demonstraram redução no tempo de início e melhora na analgesia pós-operatória em comparação com placebo, sem efeitos adversos significativos.
Técnicas intra-articulares
O efeito intra-articular da clonidina foi examinado quando administrado com e sem anestésico local e demonstrou ter efeitos benéficos na analgesia pós-operatória. A adição de morfina e clonidina pode ter efeitos aditivos. Dois estudos examinaram essa questão, com um demonstrando melhora da analgesia e o outro sem diferença. Ensaios pré-clínicos demonstraram que, semelhante aos opióides, a analgesia mediada por clonidina é potencializada pela inflamação, embora atualmente o mecanismo não seja evidente.
DEXAMETASONA
A dexametasona é um potente corticosteróide sintético com aproximadamente sete vezes a potência anti-inflamatória da prednisolona e muito pouca atividade mineralocorticóide. A meia-vida é de aproximadamente 36 a 54 horas no ambiente perioperatório. A eficácia da dexametasona como antiemético pós-operatório (4 a 10 mg por via intravenosa) foi confirmada por mais de 60 ensaios clínicos randomizados, com uma meta-análise recente estimando OR de 0.31 e um número necessário para tratar de 3.7 (NNT). Dadas suas propriedades anti-inflamatórias sistêmicas, os efeitos analgésicos de uma única dose intravenosa pré-operatória de dexametasona foram investigados em mais de 24 ensaios randomizados com efeitos modestos em até 24 horas. Esta meta-análise, publicada em 2011, incluiu 2751 pacientes e estimou que os escores da escala de avaliação verbal para dor (VRS) foram reduzidos a um máximo de 0.64 pontos até 24 horas após a administração de dexametasona. Antes dessas revisões, estudos in vitro e murinos da ação farmacológica específica da dexametasona renderam várias novas aplicações além da administração sistêmica.
Aplicação Perineural
Acredita-se que os corticosteróides perineurais exerçam seu efeito por vários mecanismos, incluindo atenuar a liberação de mediadores inflamatórios, reduzir a descarga neuronal ectópica e inibir a descarga mediada por canais de potássio de fibras C nociceptivas. Acredita-se amplamente que a dexametasona melhora a qualidade e a duração do bloqueio de nervos periféricos quando administrada em conjunto com anestésicos locais. A Food and Drug Administration (FDA) dos EUA (ou qualquer outro órgão regulador), no entanto, não aprova a dexametasona para administração perineural. No entanto, vários estudos avaliaram os efeitos da combinação de dexametasona (4 a 10 mg) com anestésico local para bloqueios de nervos periféricos. Bloqueios de nervos periféricos de membros superiores e inferiores realizados com dexametasona demonstraram prolongamento da analgesia ou bloqueio sensitivo/motor variando de aproximadamente 50% a 75% além do realizado apenas com anestésico local. Apenas um estudo até o momento comparou a dexametasona perineural à sistêmica no contexto de bloqueios de nervos periféricos. Este estudo randomizou pacientes para bloqueio interescalênico do plexo braquial com placebo ou 8 mg de dexametasona perineural ou sistêmica. Os autores demonstraram prolongamento do bloqueio em ambos os grupos de dexametasona de 12 horas a aproximadamente 20 e 22 horas para administração sistêmica e perineural, respectivamente, e concluíram que a administração sistêmica e perineural de dexametasona eram equivalentes. Mais estudos são necessários comparando os efeitos da dexametasona perineural e sistêmica antes que as conclusões finais possam ser tiradas. Preocupações com complicações relacionadas à dexametasona, como efeitos na glicemia e neurotoxicidade do conservante usado em frascos multidose, não foram aparentes na prática. Em particular, uma dose única de dexametasona, administrada por via perineural ou sistêmica, não aumentou a glicemia em um grau clinicamente significativo. Estudos em murinos de bissulfito de sódio não demonstraram neurotoxicidade com administração intratecal.
Anestesia Regional Intravenosa
Bigat e colegas investigaram os efeitos da adição de dexametasona à lidocaína IVRA em um estudo randomizado. Setenta e cinco pacientes foram randomizados para lidocaína com placebo, 8 mg de dexametasona com lidocaína ou 8 mg de dexametasona sistêmica. Neste estudo, a dexametasona sistêmica não exerceu efeito sobre a eficácia da ARIV, enquanto a lidocaína mais dexametasona demonstrou características de bloqueio melhoradas.
ANTAGONISTAS DO RECEPTOR N-METIL-ASPARTATO
Dentro do corno dorsal da medula espinhal tanto ácido ionotrópico [N-metil-aspartato (NMDA)], ácido α-amino-3-hidroxi-5-metilisoxazol-4-propiônico (AMPA), ácido caínico (KA) e metabotrópico os receptores de glutamato estão envolvidos na sinalização nociceptiva e na sensibilização central em condições de dor crônica. Recentemente, vários receptores de glutamato foram encontrados em terminais nervosos periféricos e podem contribuir para a sinalização da dor periférica. A injeção do glutamato agonista do receptor de NMDA no músculo masseter produz dor em ratos e humanos. A injeção subsequente de antagonistas do receptor de NMDA, como cetamina e dextrometorfano, atenua a dor.
Vários estudos examinaram o efeito de antagonistas de NMDA na produção de analgesia mediada perifericamente em pacientes. Tverskoy e colegas infiltraram bupivacaína com 0.3% de cetamina ou placebo para pacientes com herniorrafia inguinal e descobriram que a cetamina melhorou significativamente as ações anestésicas e analgésicas de um anestésico local administrado para anestesia infiltrativa. A cetamina tem sido usada como único anestésico na ARIV, mas os pacientes sofreram efeitos adversos excessivos na desinsuflação do torniquete. Outros trabalhadores adicionaram cetamina (0.1 mg/mL) ou clonidina (1 µg/kg) à lidocaína para ARIV. Os pacientes do grupo cetamina tiveram o melhor controle da dor, embora tanto a clonidina quanto a cetamina tenham reduzido significativamente o consumo de analgésicos em comparação com a lidocaína isolada, com efeitos colaterais psicomiméticos leves no grupo cetamina. Dois estudos examinaram o uso de cetamina intra-articular. Dal e colaboradores randomizaram pacientes para cetamina intra-articular (0.5 mg/kg), neostigmina, bupivacaína ou placebo. Os pacientes que receberam os três medicamentos tiveram melhorias semelhantes na analgesia com flexão do joelho em comparação com placebo; no entanto, o grupo cetamina teve a maior duração da analgesia. Brill e colegas realizaram um estudo de dose-resposta usando até 1 mg/kg de cetamina intra-articular após artroscopia do joelho e descobriram que o benefício analgésico ocorreu apenas na primeira hora após a cirurgia em comparação com placebo. O magnésio tem efeitos de bloqueio de NMDA e bloqueia o canal iônico no receptor de NMDA durante estados fisiológicos normais. A entrada nociceptiva persistente no corno dorsal da medula espinhal remove o magnésio, permitindo o influxo de cálcio e alterações intracelulares que levam a estados de dor persistentes. Turan et al exploraram esse potencial analgésico no SNP adicionando 1.5 g de magnésio à lidocaína 0.5% para ARIV. O magnésio reduziu o tempo de início e prolongou significativamente o efeito analgésico até 6 horas após a cirurgia, sem diferença nos efeitos adversos. Em geral, os antagonistas de NMDA podem ter um potencial significativo para produzir analgesia mediada perifericamente no futuro, embora os agentes atualmente disponíveis (exceto magnésio em ARIV) tenham efeitos limitados e em doses mais altas produzam efeitos adversos excessivos.
INIBIÇÃO DA CICLOOXIGENASE
As prostaglandinas sensibilizam as terminações nervosas periféricas aos efeitos de mediadores químicos endógenos liberados durante a lesão tecidual. Os AINEs inibem a produção de prostaglandinas através do seu conhecido efeito de inibição da ciclooxigenase (COX). A aplicação de AINEs diretamente no SNP parece, portanto, fazer sentido como meio de reduzir a dor por mecanismo periférico.
Anestesia Regional Intravenosa
Vários autores adicionaram cetorolaco à ARIV em doses de 5 a 60 mg, produzindo melhora na tolerância ao torniquete intraoperatório e analgesia pós-operatória. Steinberg e colegas realizaram um estudo de dose-resposta com cetorolaco em ARIV usando placebo, doses de 5, 10, 15, 20, 30 e 60 mg de cetorolaco. Verificou-se que 20 mg era a dose ideal, com doses mais baixas produzindo menos analgesia e doses mais altas não sendo mais eficazes. Ácido acetilsalicílico de lisina 90 mg (equivalente a 50 mg de ácido acetilsalicílico) foi adicionado à prilocaína para ARIV com prolongamento da analgesia pós-operatória.
Administração intra-articular
O uso de cetorolaco isolado, com anestésico local ou anestésico local e morfina, não é mais eficaz do que o anestésico local isolado quando administrado no espaço intra-articular. Leia mais sobre Infiltração Intra-articular e Periarticular de Anestésicos Locais.
Infiltração
O cetorolaco foi infiltrado com sucesso em uma dose de 30 a 60 mg após o reparo da hérnia, dando um efeito semelhante à infiltração com bupivacaína. No entanto, a infiltração local não foi mais eficaz do que a administração sistêmica.
ANALGESIA COLINÉRGICA
Os receptores muscarínicos mediam a analgesia no corno dorsal da medula espinhal, e a neostigmina produziu analgesia quando administrada tanto no espaço intratecal quanto no epidural. A neostigmina também foi aplicada no SNP em vários estudos, com resultados geralmente decepcionantes. Van Elstraete e colaboradores e Bone e colaboradores adicionaram neostigmina 500 µg ao anestésico local no bloqueio axilar do plexo braquial. Um estudo não demonstrou diferença e o outro encontrou apenas redução significativa da dor em 24 horas, sem diferença em outros momentos. A neostigmina adicionada ao anestésico local para ARIV também foi decepcionante. Turan e colaboradores adicionaram 500 µg de neostigmina à prilocaína 0.5% e encontraram melhora no início e na compensação do bloqueio sensorial e motor com o tempo prolongado até a primeira solicitação de analgésico. No entanto, McCartney e colaboradores realizaram estudo semelhante utilizando neostigmina 1 mg adicionado à lidocaína 0.5%, sem diferenças encontradas entre os grupos. No geral, a neostigmina parece decepcionante como adjuvante analgésico para bloqueio de nervos periféricos ou ARIV. A neostigmina, entretanto, tem sido utilizada com sucesso como adjuvante analgésico para uso intra-articular após artroscopia do joelho. Yang e colegas de trabalho realizaram um estudo de dose-resposta e descobriram que 500 µg eram mais eficazes, que eram mais eficazes do que 2 mg de morfina intra-articular. A eficácia da via analgésica colinérgica intra-articular comparada aos maus resultados com aplicação perineuronal pode estar relacionada à presença da resposta inflamatória no espaço intra-articular, aumentando a eficácia analgésica da acetilcolina por um mecanismo ainda não definido .
RESUMO
Os bloqueios de nervos periféricos proporcionam benefícios anestésicos e analgésicos significativos para nossos pacientes. Adjuvantes analgésicos como opióides, α2-agonistas, antagonistas do receptor NMDA e outros agentes podem ser adicionados aos anestésicos locais tanto para facilitar o início quanto para prolongar os efeitos anestésicos e analgésicos por mecanismos existentes no SNP. Vários agentes são eficazes quando administrados no espaço perineuronal ou intra-articular e quando administrados em ARIV ou infiltração local.tabela 3). O tamanho do efeito de cada adjuvante em particular é variável, com a dexametasona produzindo o maior tamanho do efeito. Nosso conhecimento em evolução dos mecanismos nociceptivos no SNP permitirá que novas técnicas sejam desenvolvidas no futuro para melhorar ainda mais o controle da dor.
TABELA 3. Melhores adjuvantes analgésicos no sistema nervoso periférico por via de administração.
| Rota | Agente e Dose |
|---|---|
| Perineural/perineural | Dexametasona 4–10 mg; buprenorfina 0.3 mg; clonidina 1–2 μg/kg; tramadol 200 mg |
| IVRA | Dexmedetomidina 0.5 μg/kg; magnésio 1.5 g |
| Intra-articular | Clonidina 150 μg; morfina 5 mg |
| Infiltração local | Cetamina 3 mg/mL |
NB: Vários estudos de autoria do Dr. S. Reuben que desde então foram retratados foram referenciados na edição anterior deste texto. Essas referências foram removidas. Todas as referências restantes nas quais o Dr. Reuben esteve envolvido e que não foram retratadas ainda são referenciadas.
REFERÊNCIAS
- Kehlet H, Dahl JB: O valor da “multimodal” ou “analgesia balanceada” no tratamento da dor pós-operatória. Anesth Analg 1993;77:1048–1056.
- Raja SN, Meyer RA, Ringkamp M, et al: Mecanismos neurais periféricos de nocicepção. In Wall PD, Melzack R (eds): Textbook of Pain, 4ª ed. Churchill-Livingstone, 1999, pp 11–57.
- Dickenson AH: A teoria do controle do portão da dor resiste ao teste do tempo. Br J Anaesth 2002;88:755–757.
- Millan MJ: A indução da dor: uma revisão integrativa. Prog Neurobiol 1999;57:1–164.
- Sawynok J: Analgésicos tópicos e de ação periférica. Pharmacol Rev 2003;55:1–20.
- Williams BA, Hough KA, Tsui BY, Ibinson JW, Gold MS, Gebhart GF: Neurotoxicidade de adjuvantes usados em anestesia perineural e analgesia em comparação com ropivacaína. Reg Anesth Pain Med 2011; 36(3): 225-230.
- Likar R, Mousa SA, Philippitsch G, et al: O aumento do número de células inflamatórias que expressam opióides não afeta a analgesia com morfina intra-articular. Br J Anaesth 2004;93:375–380.
- Brack A, Rittner HL, Machelska H, et al: Controle da dor inflamatória pelo recrutamento mediado por quimiocinas de células polimorfonucleares contendo opióides. Pain 2004;112:229–238.
- Machelska H, Cabot PJ, Mousa SA, et al: Controle da dor na inflamação governada por selectinas. Nat Med 1998;4:1425–1428.
- Stein C, Schafer M, Machelska H: Atacando a dor em sua fonte: Novas perspectivas sobre opióides. Nat Med 2003;9:1003–1008.
- Mousa SA, Zhang Q, Sitte N, et al: células de memória contendo beta-endorfinas e receptores mu-opióides sofrem transporte para o tecido inflamado periférico. J Neuroimmunol 200;115:71-78.
- Picard PR, Tramer MR, McQuay HJ, et al: Eficácia analgésica de opióides periféricos (todos, exceto intra-articular): Uma revisão sistemática qualitativa de ensaios clínicos randomizados. Pain 1997;72:309–318.
- Murphy DB, McCartney CJ, Chan VW: Novos adjuntos analgésicos para bloqueio do plexo braquial: Uma revisão sistemática. Anesth Analg 2000;90: 1122–1128.
- Fanelli G, Casati A, Magistris L, et al: O fentanil não melhora as características do bloqueio nervoso da anestesia axilar do plexo braquial realizada com ropivacaína. Acta Anesthesiol Scand 2001;45:590–594.
- Karakaya D, Buyukgoz F, Baris S, et al: A adição de fentanil à bupivacaína prolonga a anestesia e a analgesia no bloqueio axilar do plexo braquial. Reg Anesth Pain Med 2001;26:434–438.
- Likar R, Koppert W, Blatnig H, et al: Eficácia da analgesia de morfina periférica em tecido inflamado, não inflamado e perineural de pacientes de cirurgia odontológica. J Dor Sintoma Gerenciar 2001;21:330–337.
- Nishikawa K, Kanaya N, Nakayama M, et al: O fentanil melhora a analgesia, mas prolonga o início do bloqueio do plexo braquial axilar por mecanismo periférico. Anesth Analg 2000;91:384–387.
- Choyce A, Peng P: Uma revisão sistemática de adjuntos para anestesia regional intravenosa para procedimentos cirúrgicos. Can J Anaesth 2002;49: 32–45.
- Gutstein H, Akil H: analgésicos opióides. Em Hardman J, Limbird L (eds): Goodman & Gilman's The Pharmacologic Basis of Therapeutics, 10ª ed. McGraw-Hill, 2001, pág. 601.
- Lanz E, Simko G, Theiss D, et al: Epidural buprenorphine - Um estudo duplo-cego de analgesia pós-operatória e efeitos colaterais. Anesth Analg 1984;63:593–598.
- Candido KD, Winnie AP, Ghaleb AH, et al: Buprenorfina adicionada ao anestésico local para bloqueio do plexo braquial axilar prolonga a analgesia pós-operatória. Reg Anesth Pain Med 2002;27:162–167.
- Candido KD, Franco CD, Khan MA, et al: Buprenorfina adicionada ao anestésico local para bloqueio do plexo braquial para fornecer analgesia pós-operatória em pacientes ambulatoriais. Reg Anesth Pain Med 2001;26:352–356.
- Viel EJ, Eledjam JJ, De La Coussaye JE, et al: Bloqueio do plexo braquial com opióides para alívio da dor pós-operatória: Comparação entre buprenorfina e morfina. Reg Anesth 1989;14:274–278.
- Bazin JE, Massoni C, Bruelle P, et al: A adição de opióides aos anestésicos locais no bloqueio do plexo braquial: Os efeitos comparativos da morfina, buprenorfina e sufentanil. Anestesia 1997;52: 858-862.
- Alhashemi JA, Kaki AM: Efeito da administração intratecal de tramadol na dor pós-operatória após ressecção transuretral da próstata. Br J Anaesth 2003;91:536–540.
- Kapral S, Gollmann G, Waltl B, et al: Tramadol adicionado à mepivacaína prolonga a duração de um bloqueio axilar do plexo braquial. Anesth Analg 1999;88:853–856.
- Robaux S, Blunt C, Viel E, et al: Tramadol adicionado a 1.5% de mepivacaína para bloqueio do plexo braquial axilar melhora a analgesia pós-operatória dose-dependente. Anesth Analg 2004;98:1172–1177.
- Alemmano F, Ghisi D, Fanelli A, et al: Tramodol e levobupivacaína a 0.5% para bloqueio interescalênico de injeção única. Minerva Anestesiol 2013;78(3): 291–296.
- Kalso E, Tramer MR, Carroll D, et al: Alívio da dor de morfina intra-articular após cirurgia de joelho: Uma revisão sistemática qualitativa. Pain 1997;71:127–134.
- Brandsson S, Karlsson J, Morberg P, et al: Morfina intra-articular após reconstrução artroscópica do LCA: Um estudo duplo-cego controlado por placebo de 40 pacientes. Acta Orthop Scand 2000;71:280–285.
- Rasmussen S, Larsen AS, Thomsen ST, et al: Glicocorticóide intra-articular, bupivacaína e morfina reduzem a dor, a resposta inflamatória e a convalescença após meniscectomia artroscópica. Pain 1998;78:131–134.
- Alagol A, Calpur OU, Kaya G, et al: O uso de tramadol intra-articular para analgesia pós-operatória após cirurgia artroscópica do joelho: uma comparação de diferentes doses intra-articulares e intravenosas. Knee Surg Sports Traumatol Arthrosc 2004;12:184–188.
- Varrassi G, Marinangeli F, Ciccozzi A, et al: Buprenorfina intra-articular após artroscopia do joelho. Um estudo randomizado, prospectivo, duplo-cego. Acta Anesthesiol Scand 1999;43:51–55.
- Vranken JH, Vissers KC, de Jongh R, et al: A administração intraarticular de sufentanil facilita a recuperação após artroscopia de joelho ambulatorial. Anesth Analg 2001;92:625–628.
- Gupta A, Bodin L, Holmstrom B, Berggren: Uma revisão sistemática dos efeitos analgésicos periféricos da morfina intra-articular. Anesth Analg 2001;93(3):761–770.
- Unnerstall JR, Kopajtic TA, Kuhar MJ: Distribuição de sítios de ligação de agonistas alfa 2 no sistema nervoso central de ratos e humanos: Análise de alguns correlatos anatômicos funcionais dos efeitos farmacológicos da clonidina e agentes adrenérgicos relacionados. Brain Res 1984;319:69-101.
- Kuraishi Y, Hirota N, Sato Y, et al: Inibição noradrenérgica da liberação da substância P dos aferentes primários no corno dorsal espinhal do coelho. Brain Res 1985;359:177–182.
- Fleetwood-Walker SM, Mitchell R, Hope PJ, et al: Um receptor alfa 2 medeia a inibição seletiva pela noradrenalina de respostas nociceptivas de neurônios do corno dorsal identificados. Brain Res 1985;334:243–254.
- Baba H, Kohno T, Okamoto M, et al: facilitação muscarínica da liberação de GABA na substância gelatinosa do corno dorsal espinhal de rato. J Physiol 1998; 508:83-93.
- Butterworth JF 5th, Strichartz GR: Os agonistas alfa 2-adrenérgicos clonidina e guanfacina produzem bloqueio tônico e fásico de condução nas fibras do nervo ciático de ratos. Anesth Analg 1993;76:295–301.
- Gaumann DM, Brunet PC, Jirounek P: A clonidina aumenta os efeitos da lidocaína no potencial de ação da fibra C. Anesth Analg 1992;74:719–725.
- Eisenach JC, Gebhart GF: Amitriptilina intratecal. Interações antinociceptivas com morfina intravenosa e clonidina intratecal, neostigmina e carbamilcolina em ratos. Anestesiologia 1995;83: 1036-1045.
- Kroin JS, Buvanendran A, Beck DR, et al: O prolongamento da clonidina da analgesia da lidocaína após o bloqueio do nervo ciático em ratos é mediado pela corrente de cátions ativada por hiperpolarização, não por alfa-adrenorreceptores. Anestesiologia 2004;101:488–494.
- Singelyn FJ, Dangoisse M, Bartholomee S, et al: A adição de clonidina à mepivacaína prolonga a duração da anestesia e analgesia após o bloqueio axilar do plexo braquial. Reg Anesth 1992;17:148–150.
- Hutschala D, Mascher H, Schmetterer L, et al: A clonidina adicionada à bupivacaína aumenta e prolonga a analgesia após o bloqueio do plexo braquial por meio de um mecanismo local em voluntários saudáveis. Eur J Anesthesiol 2004; 21:198-204.
- Culebras X, Van Gessel E, Hoffmeyer P, et al: A clonidina combinada com um anestésico local de ação prolongada não prolonga a analgesia pós-operatória após o bloqueio do plexo braquial, mas induz alterações hemodinâmicas. Anesth Analg 2001;92:199–204.
- Popping DM, Elia N, Marret E, Wenk M, Tramer MR. Clonidina como adjuvante de anestésicos locais para bloqueios de nervos e plexos periféricos: uma meta-análise de estudos randomizados. Anestesiologia 2009;111(2): 406–415.
- Ilfeld BM, Morey TE, Enneking FK: Infusão perineural infraclavicular contínua com clonidina e ropivacaína em comparação com ropivacaína isolada: Um estudo randomizado, duplo-cego e controlado. Anesth Analg 2003;97:706–712.
- Ilfeld BM, Morey TE, Thannikary LJ, et al: Clonidina adicionada a uma infusão perineural interescalênica contínua de ropivacaína para melhorar a analgesia pós-operatória: um estudo randomizado, duplo-cego e controlado. Anesth Analg 2005;100:1172–1178.
- Abdallah FW, Brull R: Efeitos facilitadores da dexmedetomidina perineural no bloqueio do nervo neuraxial e periférico: uma revisão sistemática e meta-análise. Br J Anaesth 2013;110(6):915–925.
- Alayurt S, Memis D, Pamukcu Z: A adição de sufentanil, tramadol ou clonidina à lidocaína para anestesia regional intravenosa. Anaesth Intensive Care 2004;32:22–27.
- Gentili M, Bernard JM, Bonnet F: A adição de clonidina à lidocaína para anestesia regional intravenosa previne a dor do torniquete. Anesth Analg 1999;88:1327–1330.
- Reuben SS, Steinberg RB, Klatt JL, et al: Anestesia regional intravenosa com lidocaína e clonidina. Anestesiologia 1999;91:654–658.
- Lurie SD, Reuben SS, Gibson CS, et al: Efeito da clonidina na dor do torniquete nos membros superiores em voluntários saudáveis. Reg Anesth Pain Med 2000;25:502–505.
- Memis D, Turan A, Karamanlioglu B, et al: Adicionando dexmedetomidina à lidocaína para anestesia regional intravenosa. Anesth Analg 2004;98:835–840.
- Joshi W, Reuben SS, Kilaru PR, et al: Analgesia pós-operatória para cirurgia artroscópica ambulatorial do joelho com clonidina e/ou morfina intra-articular. Anesth Analg 2000;90:1102–1106.
- Tan PH, Buerkle H, Cheng JT, et al: Comparação paralela duplo-cega de múltiplas doses de apraclonidina, clonidina e placebo administrados por via intra-articular a pacientes submetidos à cirurgia artroscópica do joelho. Clin J Pain 2004;20:256–260.
- Gentili M, Juhel A, Bonnet F: Efeito analgésico periférico da clonidina intra-articular. Pain 1996;64:593-596.
- Gentili M, Houssel P, Osman M, et al: Morfina intra-articular e clonidina produzem analgesia comparável, mas a combinação não é mais eficaz. Br J Anaesth 1997;79:660–661.
- Buerkle H, Schapsmeier M, Bantel C, et al: Ação antinociceptiva térmica e mecânica da clonidina administrada por via espinhal vs perifericamente no modelo de articulação do joelho inflamada do rato. Br J Anaesth 1999;83:436–441.
- Esteróides corticais adrenais. Em Drug Facts and Comparisons, 5ª ed. Fatos e Comparações, 1997, pp 122-128.
- De Oliveira GS Jr, Castro-Alves LJ, Ahmad S, Kendall MC, McCarthy RJ: Dexametasona para prevenir náuseas e vômitos pós-operatórios: uma metanálise atualizada de ensaios clínicos randomizados. Anesth Analg 2013;116(1):58–74.
- De Oliveira GS Jr, Almeida MD, Benzon HT, McCarthy RJ: Dexametasona sistêmica de dose única perioperatória para dor pós-operatória: uma meta-análise de ensaios clínicos randomizados. Anestesiologia 2011;115(3): 575–588.
- Attardi B, Takimoto K, Gealy R, Severns C, Levitan ES: regulação positiva induzida por glicocorticóides de um mRNA do canal de K+ da hipófise in vitro e in vivo. Canais de Receptores 1993;1:287–293.
- Eker HE, Cok OY, Aribogan A, Arslan G: Manejo da dor neuropática com metilprednisolona no local da lesão nervosa. Pain Med 2012;13:443–451.
- Johansson A, Hao J, Sjolund B: A aplicação local de corticosteróides bloqueia a transmissão em fibras C nociceptivas normais. Acta Anesthesiol Scand 1990;34:335–338.
- Cummings KC 3rd, Napierkowski DE, Parra-Sanchez I, et al: Efeito da dexametasona na duração dos bloqueios do nervo interescalênico com ropivacaína ou bupivacaína. Br J Anaesth 2011;107:446–453.
- Fredrickson MJ, Danesh-Clough TK, White R: Adjuvante dexametasona para bloqueios ciáticos e de tornozelo com bupivacaína: Resultados de 2 ensaios randomizados controlados por placebo. Reg Anesth Pain Med 2013;38(4):300–307.
- Movafegh A, Razazian M, Hajimaohamadi F, Meysamie A: Dexametasona adicionada à lidocaína prolonga o bloqueio do plexo braquial axilar. Anesth Analg 2006;102:263–267.
- Parrington SJ, O'Donnell D, Chan VW, et al: Dexametasona adicionada à mepivacaína prolonga a duração da analgesia após bloqueio do plexo braquial supraclavicular. Reg Anesth Pain Med 2010;35:422–426.
- Tandoc MN, Fan L, Kolesnikov S, Kruglov A, Nader ND: Dexametasona adjuvante com bupivacaína prolonga a duração do bloqueio interescalênico: um estudo prospectivo randomizado. J Anesth 2011;25:704–709.
- Vieira PA, Pulai I, Tsao GC, Manikantan P, Keller B, Connelly NR. Dexametasona com bupivacaína aumenta a duração da analgesia no bloqueio do plexo braquial interescalênico guiado por ultrassom. Eur J Anesthesiol 2010;27:285–288.
- Desmet M, Braems H, Reynvoet M, et al: IV e dexametasona perineural são equivalentes no aumento da duração analgésica de um bloqueio interescalênico de injeção única com ropivacaína para cirurgia do ombro: um estudo prospectivo, randomizado e controlado por placebo. Br J Anaesth 2013; 111(3):445–452. Epub antes da impressão.
- Thangaswamy CR, Rewari V, Trikha A, Dehran M, Chandralekha: Dexametasona antes da histerectomia laparoscópica total: Um estudo de dose-resposta controlado randomizado. J Anesth 2010;24:24–30.
- Worni M, Schudel HH, Seifert E, et al: Ensaio controlado randomizado em esteróide de dose única antes da tireoidectomia para doença benigna para melhorar a náusea pós-operatória, dor e função vocal. Ann Surg 2008; 248: 1060–1066.
- Taniguchi M, Bollen AW, Drasner K. Bissulfito de sódio: bode expiatório para neurotoxicidade da cloroprocaína? Anestesiologia 2004;100(1):85–91.
- Bigat Z, Boztug N, Hadimioglu N, Cete N, Coskunfirat N, Ertok E: A dexametasona melhora a qualidade da anestesia regional intravenosa e analgesia? Um estudo clínico randomizado e controlado. Anesth Analg 2006;102(2):605–609.
- Coderre TJ, Katz J, Vaccarino AL, et al: Contribuição da neuroplasticidade central para a dor patológica: Revisão de evidências clínicas e experimentais. Pain 1993;52:259–285.
- Price DD, Mao J, Mayer DJ: Mecanismos neurais centrais de estados de dor normais e anormais. In Fields HL, Liebskind JC (eds): Progress in Pain Research and Management. IASP Press, 1994;61-84.
- Dickenson AH, Chapman V, Green GM: A farmacologia de eventos mediados por aminoácidos excitatórios e inibitórios na transmissão e modulação da dor na medula espinhal. Gen Pharmacol 1997;28: 633-638.
- Alfredson H, Forsgren S, Thorsen K, et al: Receptores de glutamato NMDAR1 localizados em nervos em tendões de Aquiles humanos. Implicações para o tratamento? Cirurgia de Joelho Sports Traumatol Arthrosc 2001;9:123–126.
- Cairns BE, Hu JW, Arendt-Nielsen L, et al: Diferenças relacionadas ao sexo na dor humana e descarga aferente de rato evocadas pela injeção de glutamato no músculo masseter. J Neurophysiol 2001;86:782–791.
- Svensson P, Cairns BE, Wang K, et al: A injeção do fator de crescimento do nervo no músculo masseter humano evoca alodinia mecânica e hiperalgesia de longa duração. Pain 2003;104:241–247.
- Cairns BE, Svensson P, Wang K, et al: A ativação de receptores NMDA periféricos contribui para a dor humana e descargas aferentes de ratos evocadas pela injeção de glutamato no músculo masseter. J Neurophysiol 2003;90:2098–2105.
- Tverskoy M, Oren M, Vaskovich M, et al: A cetamina aumenta os efeitos anestésicos e analgésicos locais da bupivacaína por mecanismo periférico: Um estudo em pacientes pós-operatórios. Neurosci Lett 1996; 215:5-8.
- Amiot JF, Bouju P, Palacci JH, et al: Anestesia regional intravenosa com cetamina. Anestesia 1985;40:899–901.
- Gorgias NK, Maidatsi PG, Kyriakidis AM, et al: Clonidina versus cetamina para prevenir a dor do torniquete durante anestesia regional intravenosa com lidocaína. Reg Anesth Pain Med 2001;26:512–517.
- Dal D, Tetik O, Altunkaya H, et al: A eficácia da cetamina intra-articular para analgesia pós-operatória em cirurgia artroscópica ambulatorial. Artroscopia 2004;20:300–305.
- Brill S, McCartney CJ, Sawyer R, et al: Analgesia intra-articular com cetamina após artroscopia do joelho: Um estudo de descoberta de dose. Pain Clin 2005;17: 25–29.
- Turan A, Memis D, Karamanlioglu B, et al: Anestesia regional intravenosa com lidocaína e magnésio. Anesth Analg 2005;100: 1189–1192.
- Reuben SS, Steinberg RB, Kreitzer JM, et al: Anestesia regional intravenosa com lidocaína e cetorolaco. Anesth Analg 1995;81: 110–113.
- Steinberg RB, Reuben SS, Gardner G: A relação dose-resposta do cetorolaco como componente da anestesia regional intravenosa com lidocaína. Anesth Analg 1998;86:791–793.
- Corpataux JB, Van Gessel EF, Donald FA, et al: Efeito na analgesia pós-operatória de pequenas doses de acetilsalicilato de lisina adicionados à prilocaína durante anestesia regional intravenosa. Anesth Analg 1997;84:1081–1085.
- Reuben SS, Duprat KM: Comparação da infiltração da ferida com cetorolaco versus anestesia regional intravenosa com cetorolaco para analgesia pós-operatória após cirurgia ambulatorial da mão. Reg Anesth 1996;21:565–568.
- Ben-David B, Katz E, Gaitini L, et al: Comparação de IM e infiltração local de cetorolaco com e sem anestésico local. Br J Anaesth 1995;75:409–412.
- Connelly NR, Reuben SS, Albert M, et al: Uso de cetorolaco pré-incisional em pacientes com hérnia: Intravenosa versus sítio cirúrgico. Reg Anesth 1997; 22:229-232.
- Bosek V, Cox CE: Comparação do efeito analgésico do cetorolaco administrado localmente e sistemicamente em pacientes com mastectomia. Ann Surg Oncol 1996;3:62–66.
- Van Elstraete AC, Pastureau F, Lebrun T, et al: Neostigmina adicionada ao bloqueio do plexo axilar com lidocaína para analgesia pós-operatória. Eur J Anesthesiol 2001;18:257–260.
- Bone HG, Van Aken H, Booke M, et al: Aprimoramento da anestesia do bloqueio do plexo braquial axilar pela coadministração de neostigmina. Reg Anesth Pain Med 1999;24:405–410.
- Turan A, Karamanlyoglu B, Memis D, et al: Anestesia regional intravenosa com prilocaína e neostigmina. Anesth Analg 2002;95(5): 1419–1422.
- McCartney CJ, Brill S, Rawson R, et al: Nenhum benefício anestésico ou analgésico de neostigmina 1 mg adicionado à anestesia regional intravenosa com lidocaína 0.5% para cirurgia de mão. Reg Anesth Pain Med 2003;28: 414–417.
- Yang LC, Chen LM, Wang CJ, et al: Analgesia pós-operatória por neostigmina intra-articular em pacientes submetidos à artroscopia do joelho. Anestesiologia 1998;88:334–339.
- Gentili M, Enel D, Szymskiewicz O, et al: Analgesia pós-operatória por clonidina intra-articular e neostigmina em pacientes submetidos à artroscopia do joelho. Reg Anesth Pain Med 2001;26:342–347.
Colin JL McCartney e Stephen Choi