John Butterworth IV
INTRODUÇÃO
A anestesia e a analgesia locais e regionais parecem estar a passar por um renascimento, como se pode verificar pela participação em reuniões especializadas e pelo aumento substancial da actividade de investigação, como evidenciado pelo número crescente de publicações científicas. Em contraste com a anestesia geral, em que o mecanismo molecular permanece objeto de especulação, o local onde os anestésicos locais (AL) se ligam para produzir bloqueios nervosos foi clonado e mutado. Este capítulo se concentra nos mecanismos de anestesia e toxicidade, especialmente porque o conhecimento desses mecanismos ajudará o clínico a realizar uma anestesia regional mais segura e eficaz.
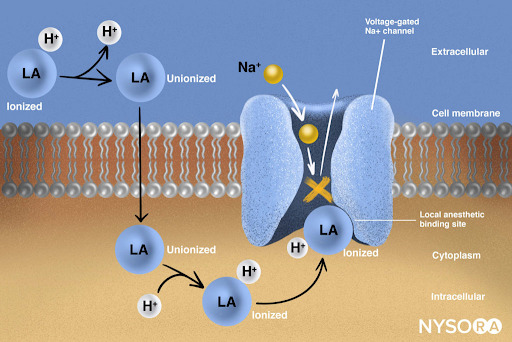
Do Compêndio de Anestesia Regional: Mecanismo de ação dos anestésicos locais. Os anestésicos locais atuam ligando-se à subunidade α dos canais de Na+ dependentes de voltagem, impedindo assim a geração e condução de impulsos nervosos. Subsequentemente, os íons Na+ não podem fluir para dentro da célula, interrompendo assim a transmissão da onda de despolarização que avança ao longo do nervo. A fração de moléculas de anestésico local está na forma ionizada. As moléculas do anestésico local mudam de ionizadas para não ionizadas em uma fração de segundo.
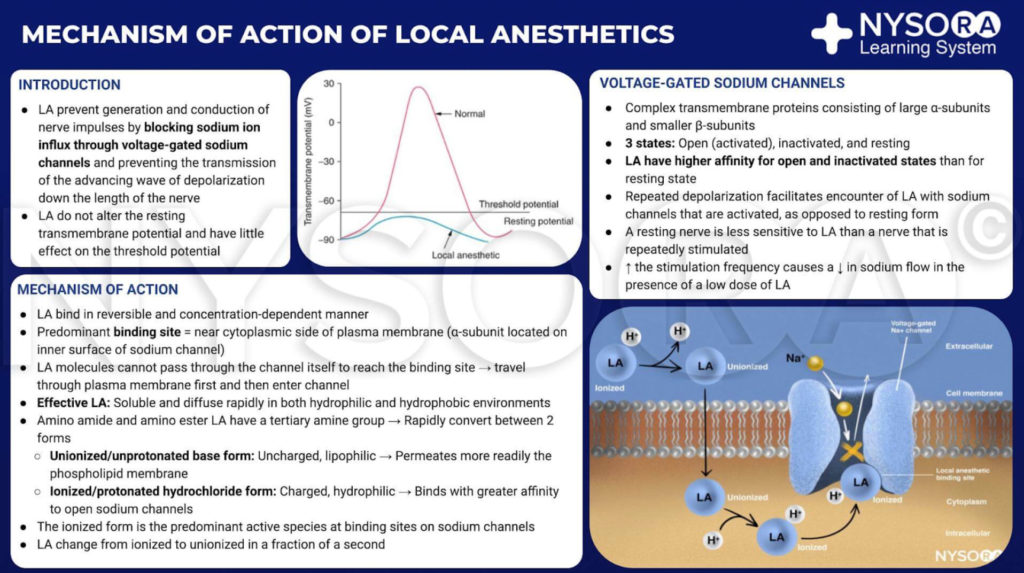
Do Compêndio de Anestesia Regional: Mecanismo de ação dos anestésicos locais infográfico.
PRÉ-HISTÓRIA E HISTÓRIA
Os incas consideravam a coca um presente do filho do deus sol e limitavam seu uso à “crosta superior” da sociedade. Eles reconheceram e usaram as propriedades medicinais da cocaína muito antes de o composto ser trazido para a Europa para que suas propriedades fossem “descobertas”. Os incas às vezes tratavam dores de cabeça persistentes com trepanação, e a coca era ocasionalmente usada para facilitar esse procedimento. A anestesia local foi realizada com o operador mastigando folhas de coca e aplicando a polpa macerada na pele e nas bordas da ferida enquanto usava uma faca de tumi para perfurar o osso. No século XVI, tendo desestruturado a sociedade inca, os conquistadores começaram a pagar os trabalhadores com pasta de cocaína.
Os trabalhadores geralmente enrolavam as folhas de cocaína em bolas (chamadas cocadas), unidas por guano ou amido de milho. Essas cocadas liberavam a cocaína de base livre como consequência da alcalinidade do guano e da prática de mascar as cocadas com cinzas ou cal (tais compostos alcalinos aumentam o pH, favorecendo a forma de cocaína de base livre sobre o sal cloridrato de carga positiva) . Essa prática provavelmente marca o nascimento da cocaína “free-base” e é o antecedente histórico da cocaína “rock” ou “crack” tão frequentemente abusada nas sociedades ocidentais. A cocaína foi trazida de volta a Viena por um explorador/médico chamado Scherzer. Em Viena, o químico Albert Niemann isolou e cristalizou o cloridrato de cocaína pura em 1860. A Merck Company distribuiu lotes desse agente aos médicos para fins de investigação. Sigmund Freud foi o mais proeminente desses experimentadores de cocaína. Freud revisou seu trabalho experimental em uma monografia dedicada à cocaína, Über Coca. Freud e Carl Koller (estagiário de oftalmologia) tomaram cocaína por via oral e notaram que a droga deixava suas línguas insensíveis. Koller e Joseph Gartner iniciaram uma série de experimentos usando cocaína para produzir anestesia tópica da conjuntiva.
O nascimento da anestesia local e regional data de 1884, quando Koller e Gartner relataram seu sucesso na produção de anestesia tópica com cocaína no olho de sapos, coelhos, cães e humanos. O uso de anestesia local rapidamente se espalhou pelo mundo. O cirurgião americano William Halsted, do Hospital Roosevelt, em Nova York, relatou usar cocaína para produzir bloqueio do nervo mandibular em 1884 e produzir bloqueio do plexo braquial menos de um ano depois. Esses bloqueios foram realizados expondo cirurgicamente os nervos e, em seguida, injetando-os sob visão direta. Leonard Corning injetou cocaína perto da espinha de cães, produzindo o que provavelmente foi o primeiro epidural em 1885. A raquianestesia com cocaína foi realizada pela primeira vez em 1898 por August Bier. Cocaína raquianestesia foi usado para tratar a dor do câncer em 1898. A anestesia peridural caudal foi introduzida em 1902 por Sicard e Cathelin. Bier descrito anestesia regional intravenosa em 1909. Em 1911, Hirschel relatou as três primeiras anestesias percutâneas do plexo braquial. Fidel Pages relatou o uso de anestesia epidural para cirurgia abdominal em 1921. A cocaína logo foi incorporada a muitos outros produtos, incluindo a formulação original da Coca-Cola criada por Pemberton em 1886. Tônicos de vinho e outros medicamentos “patenteados” da época comumente continham cocaína (Figura 1). Essa prática terminou quando a cocaína foi regulamentada pelo precursor da Food and Drug Administration (FDA) no início de 1900.

FIGURA 1. Exemplos de produtos que incorporaram cocaína antes de se tornar uma substância controlada. Vinhos fortificados com cocaína eram particularmente populares como “tônicos”. (Usado com permissão da Addiction Research Unit, University of Buffalo.)
QUÍMICA MEDICINAL
A cocaína e todos os outros ALs contêm um anel aromático e uma amina nas extremidades opostas da molécula, separadas por uma cadeia de hidrocarbonetos e uma ligação éster ou amida.Figura 2). A cocaína, o éster arquetípico, é o único LA que ocorre naturalmente. A procaína, o primeiro éster sintético LA, foi introduzida em 1904 por Einhorn. A introdução da amida LA lidocaína em 1948 foi transformadora. A lidocaína rapidamente se tornou usada para todas as formas de anestesia regional. Outros AL de amida baseados na estrutura da lidocaína (prilocaína, etidocaína) apareceram posteriormente. Uma série relacionada de ALs de amida com base em 2',6'-pipecoloxilidida foi introduzida (mepivacaína, bupivacaína, ropivacaína e levobupivacaína). A ropivacaína e a levobupivacaína são os únicos ALs de enantiômero único (isômero óptico único) disponíveis comercialmente. Ambos são enantiômeros S(–), evitando o aumento da toxicidade cardíaca associada a misturas racêmicas e aos isômeros R(+) (discutido em uma seção subsequente). Todos os outros LAs existem como racematos ou não possuem carbonos assimétricos.
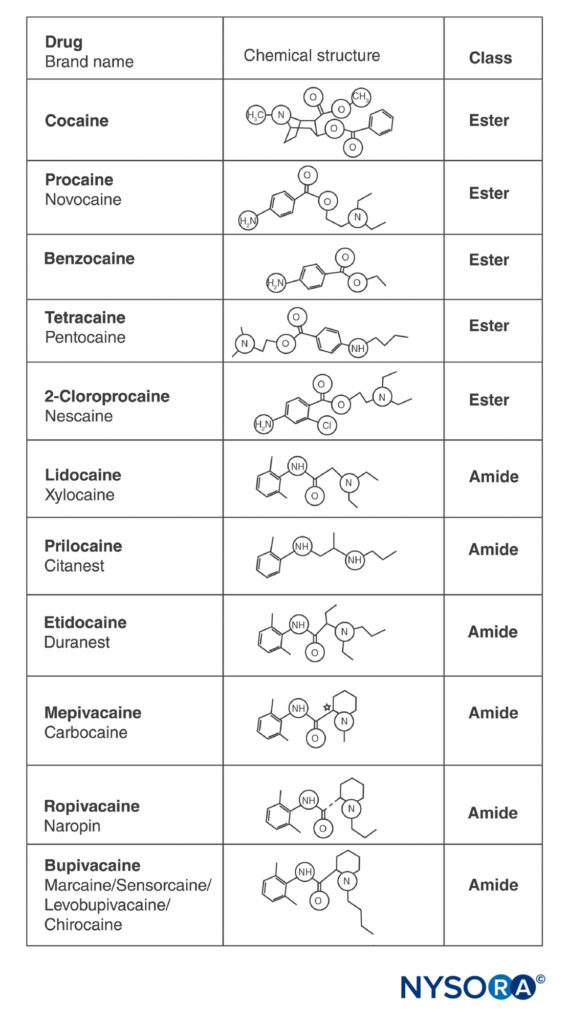
FIGURA 2. Estruturas de anestésicos locais comumente usados.
Dicas NYSORA
- Todos os ALs contêm um anel aromático e uma amina nas extremidades opostas da molécula, separados por uma cadeia de hidrocarbonetos e uma ligação éster ou amida.
BIOFÍSICA DE CANAIS DE SÓDIO VOLTAGEM E ANESTÉSICOS LOCAIS
Os estudos dos mecanismos de ação do AL nos nervos periféricos são estudos das interações entre os AL e os canais de Na+ dependentes de voltagem, porque os canais de Na+ contêm o sítio de ligação do AL. Os canais de Na são proteínas integrais de membrana que iniciam e propagam potenciais de ação em axônios, dendritos e tecido muscular; iniciar e manter oscilações do potencial de membrana em células especializadas do coração e do cérebro; e forma e filtra as entradas sinápticas. Os canais de Na compartilham características estruturais com outros canais iônicos dependentes de voltagem que existem como tetrâmeros, cada um com seis segmentos helicoidais transmembrana (por exemplo, canais de Ca e K dependentes de voltagem). Os canais de Na contêm uma subunidade α maior e uma ou duas subunidades β menores, dependendo da espécie e do tecido de origem. A subunidade α, o local de condução de íons e ligação de LA, tem quatro domínios homólogos, cada um com seis segmentos de membrana α-helicoidal.Figura 3). A superfície externa da subunidade α é fortemente glicosilada, o que serve para orientar o canal adequadamente dentro da membrana plasmática.Figura 4). Os invertebrados têm apenas um ou dois genes da subunidade α do canal Na, e o papel fisiológico normal desses canais não é claro (os animais sobrevivem quando os canais não estão presentes).
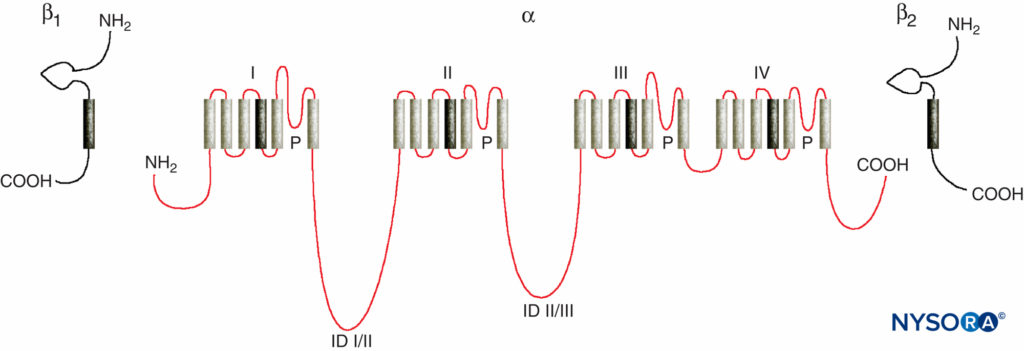
FIGURA 3. Estrutura “cartoon” das subunidades do canal de Na. Observe que a subunidade α tem quatro domínios, cada um contendo seis segmentos que atravessam a membrana. (Reproduzido com permissão de Plummer NW, Meisler MH: Evolution and Diversity of Mamíferos Sodio Channel Genes. Genomics. 1999 Apr 15;57(2):323-331.)
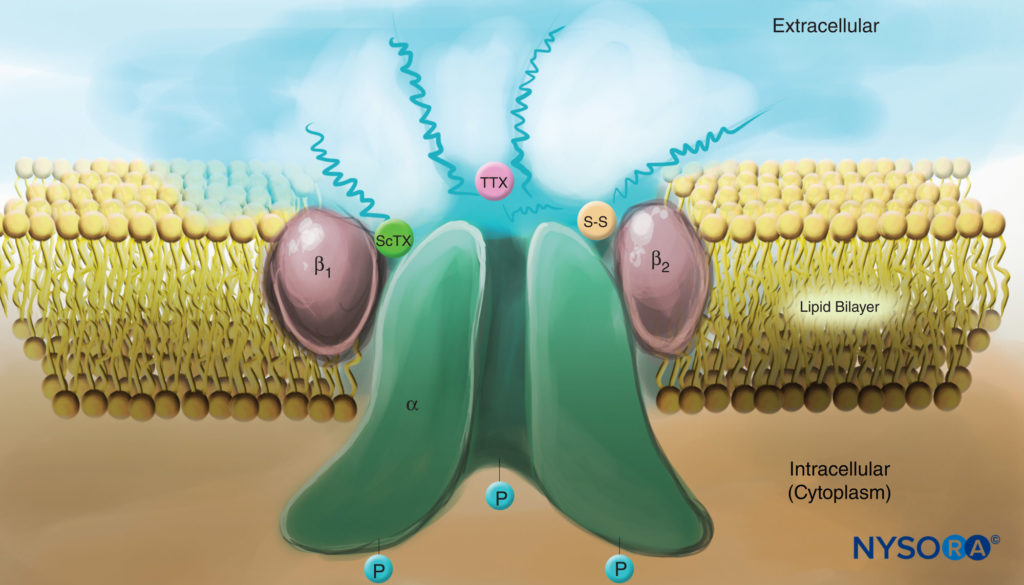
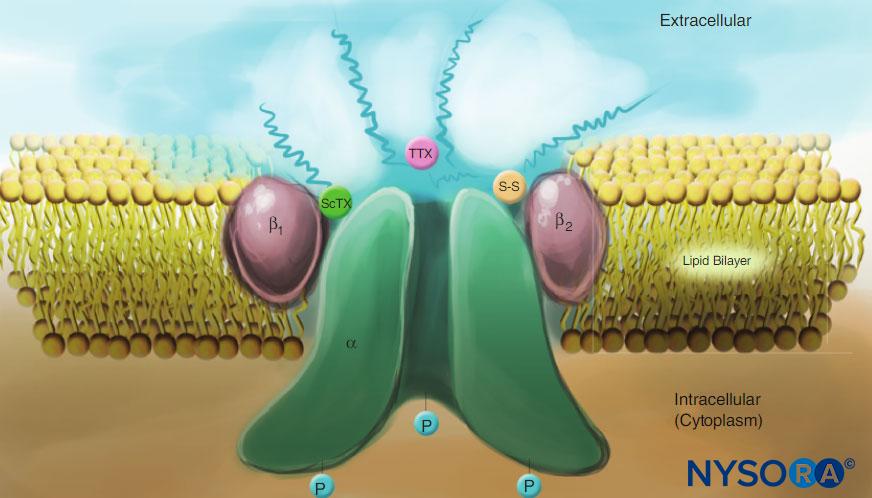
FIGURA 4. Desenho de um canal de Na na membrana plasmática. Observe que todas as três subunidades são fortemente glicosiladas no lado extracelular (ver linhas “onduladas”). Em contraste com os anestésicos locais, observe que tanto a toxina do escorpião (ScTX) quanto a tetrodotoxina (TTX) têm locais de ligação na superfície externa do canal. Observe também que o lado citoplasmático do canal é fosforilado. (Reproduzido com permissão de Catterall WA: Biologia celular e molecular de canais de sódio dependentes de voltagem. Physiol Rev. 1992 Out;72(4 Supl):S15-S48.)
TABELA 1. Canal de Na dependente de voltagem – isoformas neurais.
| Nav 1.1 | Nav 1.2 | Nav 1.3 | Nav 1.6 | Nav 1.7 | Nav 1.8 | Nav 1.9 | |
|---|---|---|---|---|---|---|---|
| Cromossoma | 2 | 2 | 2 | 12 | 2 | 3 | 3 |
| Onde identificado | SNC, DRG | CNS | SNC regulado positivamente, após lesão | DRG (grande e pequeno), CNS, Ranvier | DRG (grande e pequeno) | DRG (pequeno) | DRG (pequeno) |
| Inativação | pomposidade | pomposidade | pomposidade | pomposidade | pomposidade | Devagar | Devagar |
| TTX | Sensível | Sensível | Sensível | Sensível | Sensível | Insensível | Insensível |
Fonte: Adaptado com permissão de Novakovic SD, Eglen RM, Hunter JC: Regulação da distribuição de canais de Na+ no sistema nervoso. Tendências Neurociências. 2001 ago;24(8):473-478.
Os seres humanos, em contraste, têm nove genes de subunidade α do canal de Na ativos em quatro cromossomos, com expressão celular específica e localização de produtos gênicos.v 1.4 gene (por convenção, os geneticistas referem-se às isoformas dos canais de Na dependentes de voltagem como Nav 1.x) fornece canais para o músculo esquelético, e o Nav 1.5 gene fornece canais para o músculo cardíaco, deixando sete Nav isoformas no tecido neural (tabela 1). Os genes definidos contribuem com formas específicas de canais de Na para cada um dos axônios não mielinizados, nódulos de Ranvier em axônios motores e pequenos nociceptores do gânglio da raiz dorsal. Enquanto todas as subunidades α do canal de Na ligam-se aos LAs de forma semelhante, sua afinidade para as neurotoxinas de ligação varia. Mutações nas subunidades α e β do canal de Na levam a doenças musculares, cardíacas e neurais. Por exemplo, mutações herdadas em Nav 1.5 têm sido associados à síndrome congênita do QT longo, síndrome de Bruguda e outras doenças do sistema de condução. Foi demonstrado que certos Nav isoformas proliferam em modelos animais de dor crônica. A existência de Na específicov Os produtos da subunidade α do gene oferecem a possibilidade atraente de que algum dia os inibidores possam ser desenvolvidos para cada Na específica.v forma de subunidade α. Tais desenvolvimentos, já em andamento para algumas isoformas Nav, podem revolucionar o tratamento da dor crônica. O bloqueio de impulsos em uma fibra nervosa requer que um comprimento definido de nervo se torne inexcitável (para evitar que o impulso “pule” sobre o segmento bloqueado). Assim, à medida que a concentração de AL aumenta, ele deve ser aplicado ao longo de um comprimento menor do nervo para evitar a condução do impulso, como mostrado em Figura 5. Tanto a condução normal quanto a maneira pela qual os ALs inibem a condução diferem entre as fibras nervosas mielinizadas e não mielinizadas. A condução em fibras mielinizadas ocorre em saltos de um nó Ranvier para o próximo, um processo denominado condução saltatória. Para bloquear os impulsos nas fibras nervosas mielinizadas, geralmente é necessário que os ALs inibam canais em três nodos de Ranvier sucessivos.Figura 6). As fibras não mielinizadas, sem o mecanismo saltatório, conduzem muito mais lentamente do que as fibras mielinizadas. As fibras não mielinizadas são relativamente resistentes aos ALs, apesar de seu diâmetro menor, devido à dispersão dos canais de Na pela membrana plasmática. Essas diferenças entre as fibras nervosas surgem durante o desenvolvimento quando os canais de Na começam a se agrupar nos nódulos de Ranvier em axônios mielinizados. O agrupamento nodal de canais, essencial para a transmissão de sinal de alta velocidade, é iniciado pelas células de Schwann no sistema nervoso periférico e por oligodendrócitos no sistema nervoso central (SNC). Canais de Na podem existir em pelo menos três conformações nativas: “repouso”, “aberto” e “inativado”, descrito pela primeira vez por Hodgkin e Huxley. Durante um potencial de ação, os canais neuronais de Na se abrem brevemente, permitindo que os íons Na extracelulares fluam para dentro da célula, despolarizando a membrana plasmática. Após apenas alguns milissegundos, os canais de Na se inativam (onde a corrente de Na cessa). Os canais de Na retornam à conformação de repouso com a repolarização da membrana. O processo pelo qual os canais passam da forma condutora para a forma não condutora é denominado gating. A abertura é assumida como resultado de movimentos de dipolos em resposta a mudanças no potencial. O processo pelo qual os canais dependentes de voltagem operam provavelmente envolve movimentos de sensores de voltagem em forma de pá dentro do perímetro externo do canal.Figura 7). A velocidade dos processos de gating difere entre Nav Formas de subunidade α: As formas musculares e nervosas esqueléticas se comportam mais rapidamente do que as formas cardíacas.
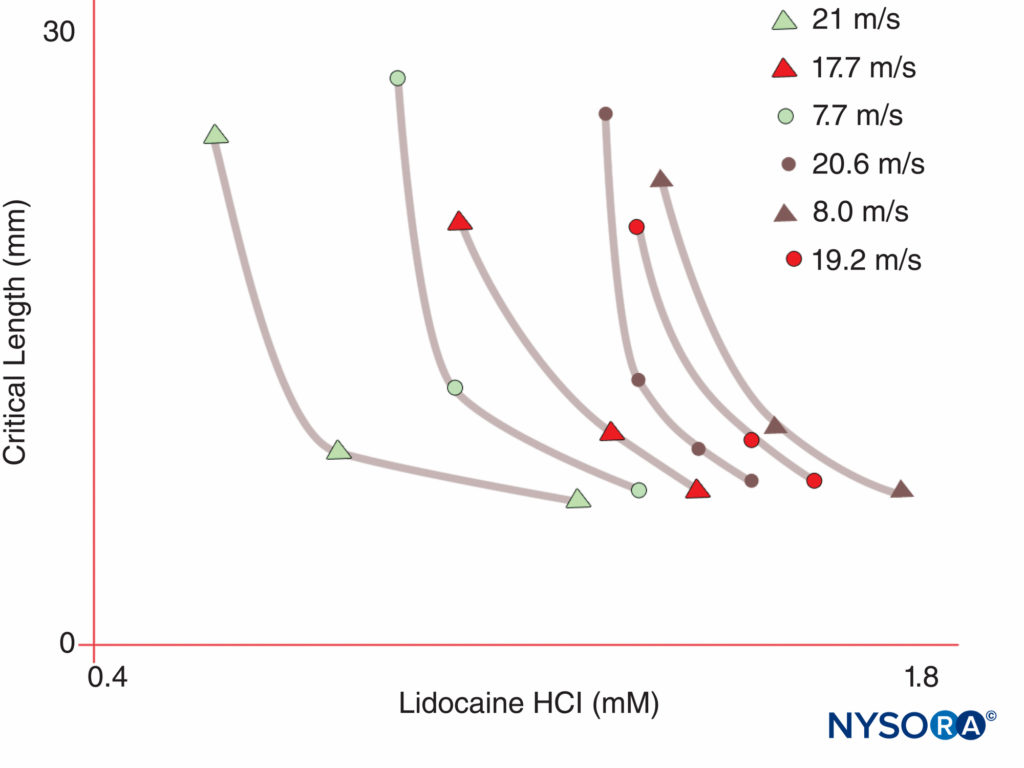
FIGURA 5. Observe que a concentração de anestésico local necessária para produzir o bloqueio do nervo diminui à medida que o comprimento do nervo exposto ao anestésico local aumenta. (Reproduzido com permissão de Raymond SA, Steffensen SC, Gugino LD, et al: O papel do comprimento do nervo exposto a anestésicos locais na ação de bloqueio do impulso. Anesth Analg. 1989 May;68(5):563-570.)
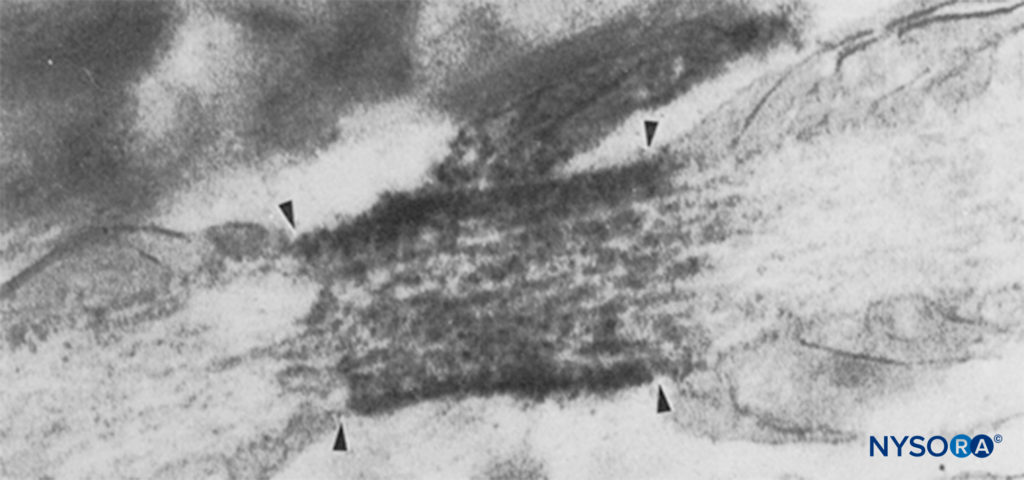
FIGURA 6. Micrografia eletrônica de um nó de Ranvier. Os canais de Na foram imunomarcados e aparecem como grânulos densos dentro das quatro setas. A região paranodal é indicada por “pn” e um astrócitos é indicado por “as”. (Reproduzido com permissão de Black JA, Friedman B, Waxman SG, et al: Localização imunoultraestrutural de canais de sódio em nós de Ranvier e astrócitos perinodais em nervo óptico de rato. Proc R Soc Lond B Biol Sci. 1989 Out 23;238 (1290):39-51.)
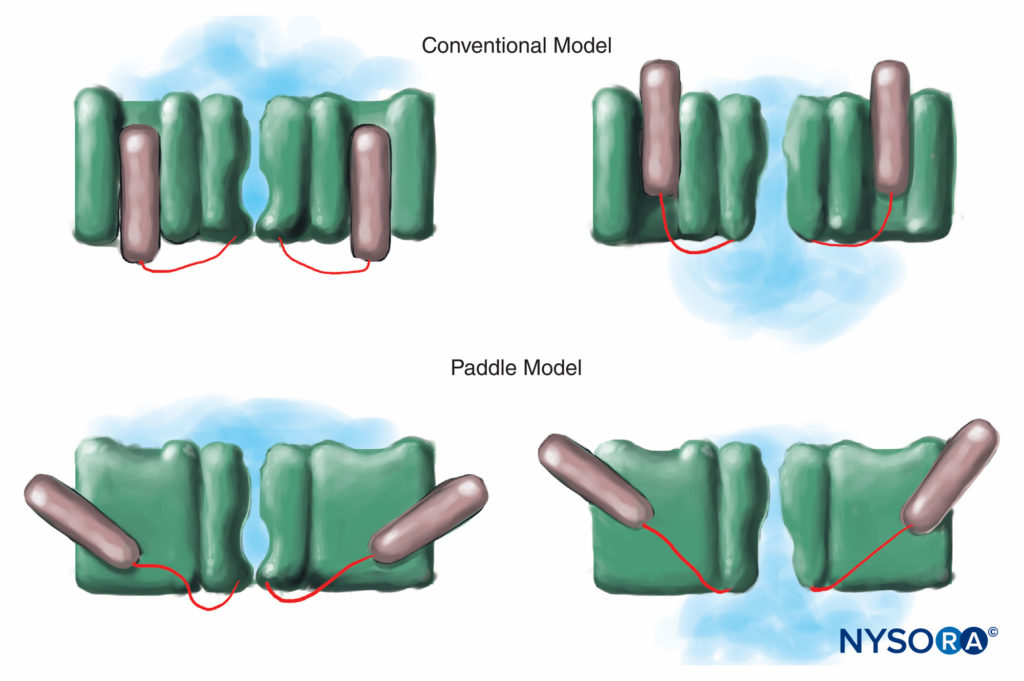
FIGURA 7. No modelo convencional de voltagem, a parte sensível à voltagem do canal desliza “para dentro e para fora” da membrana. Estudos mais recentes de difração de raios X do canal K sugerem que um mecanismo mais apropriado é o de estruturas semelhantes a pás deslizando diagonalmente através da membrana plasmática. (Reproduzido com permissão de Arhem P: Voltage sensing in ion channels: a 50-year-old mistério resolvido? Lancet. 2004 Apr 10;363(9416):1221-1223.)
A anestesia ocorre quando os ALs ligam-se aos canais de Na+ e inibem a permeabilidade ao Na+ subjacente aos potenciais de ação. Nossa compreensão dos mecanismos de AL foi refinada por várias observações importantes. Taylor confirmou que os ALs inibem seletivamente os canais de Na nos nervos. Strichartz observou pela primeira vez o bloqueio dependente do uso com LAs, mostrando a importância da abertura do canal para a ligação de LA. A dependência de uso (ou frequência) descreve como a inibição de LA das correntes de Na aumenta com despolarizações repetitivas (“uso”). Trens repetitivos de despolarizações aumentam a probabilidade de um AL encontrar um canal de Na+ que esteja aberto ou inativado, com ambas as formas tendo maior afinidade com AL do que os canais em repouso.Figura 8). Assim, o potencial de membrana influencia tanto a conformação do canal de Na quanto a afinidade do canal de Na pelos ALs. O bloqueio dependente do uso parece importante para o funcionamento dos ALs como antiarrítmicos e também pode estar subjacente à eficácia das concentrações reduzidas de AL no controle da dor. Finalmente, usando mutagênese sítio-dirigida, Ragsdale e Wang localizaram a ligação de LA a aminoácidos específicos em D4S6 de Nav 1.2 e Nav 1.4. Alguns isômeros ópticos LA conferem maior segurança aparente do que seu enantiômero oposto. Por exemplo, sob voltagem clamp, o isômero R(+)-bupivacaína inibe mais potentemente as correntes cardíacas de Na do que o isômero S(–)-bupivacaína (levobupivacaína).Figura 9). Muitos outros tipos de produtos químicos também se ligam e inibem os canais de Na, incluindo anestésicos gerais, inibidores da substância P, agonistas α2-adrenérgicos, antidepressivos tricíclicos e toxinas nervosas. As toxinas nervosas estão atualmente sendo testadas em animais e humanos como possíveis substitutos para os LAs.
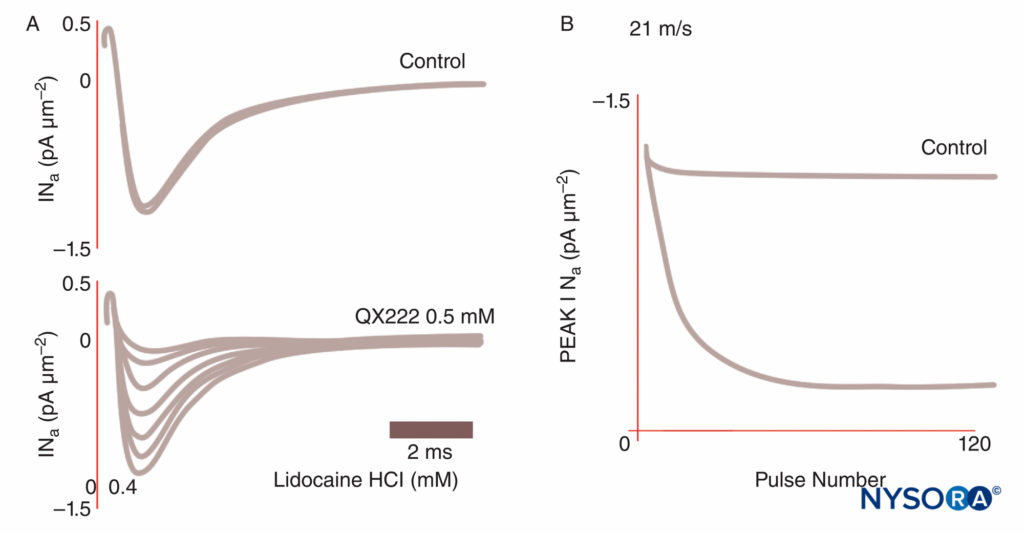
FIGURA 8. Bloqueio dependente do uso de correntes de Na em fibras de Purkinje. Sob condições de controle, cada um de um trem de impulsos resulta em traçados de corrente idênticos. Na presença do anestésico local QX222, o primeiro impulso tem aproximadamente a mesma amplitude de tamanho que sob condições de controle. Cada impulso sucessivo é menor (pico reduzido INa), refletindo um bloqueio acumulado de canais de Na, até que um nadir seja alcançado. (Reproduzido com permissão de Hanck DA, Makielski JC, Sheets MF: Kinetic effects of quaternary lidocaine block of cardiac sódio channels: a gating current study. J Gen Physiol. 1994 Jan;103(1):19-43.)
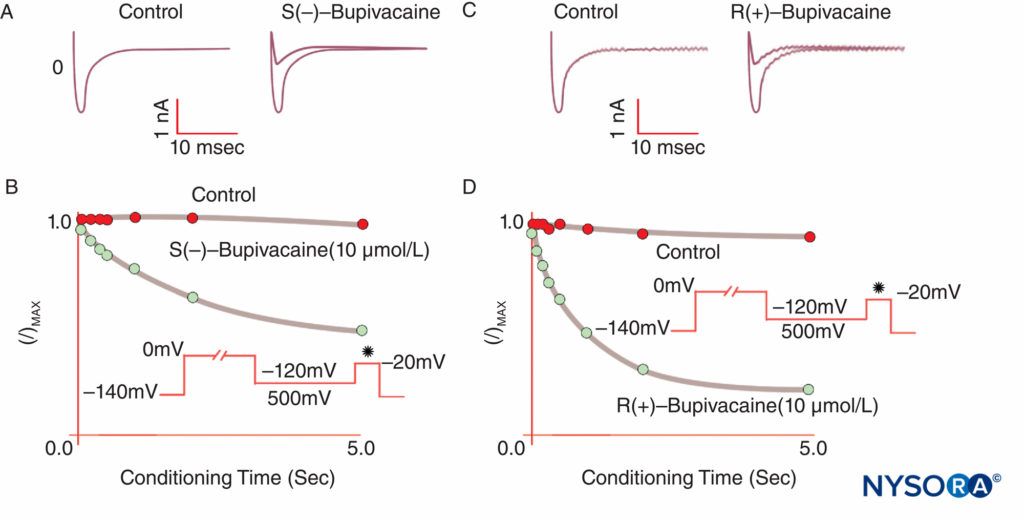
FIGURA 9. Potência reduzida da S(–) bupivacaína em relação à R(+)-bupivacaína na inibição de correntes de Na cardíaca sob voltagem clamp. Após uma despolarização de “condicionamento” padrão de comprimentos variados, o isômero S(–) produz menos redução de I/Imax do que o isômero R(+). (Reproduzido com permissão de Valenzuela C, Snyders DJ, Bennett PB, et al: Bloqueio estereosseletivo de canais de sódio cardíacos por bupivacaína em miócitos ventriculares de cobaias. Circulation. 1995 Nov 15;92(10):3014-3024.)
FARMACODINÂMICA ANESTÉSICA LOCAL
Na prática clínica, os ALs são tipicamente descritos por sua potência, duração de ação, velocidade de início e tendência ao bloqueio nervoso sensorial diferencial. Essas propriedades não são classificadas de forma independente.
Potência e Duração
A potência de bloqueio do nervo dos ALs aumenta com o aumento do peso molecular e com o aumento da lipossolubilidade. LAs maiores e mais lipofílicos permeiam as membranas nervosas mais facilmente e ligam-se aos canais de Na+ com maior afinidade. Por exemplo, a etidocaína e a bupivacaína têm maior lipossolubilidade e potência do que a lidocaína e a mepivacaína, com as quais estão intimamente relacionadas quimicamente.
Dicas NYSORA
- A potência de bloqueio do nervo dos ALs aumenta com o aumento do peso molecular e com o aumento da lipossolubilidade.
Os ALs mais lipossolúveis são relativamente insolúveis em água, altamente ligados a proteínas no sangue, removidos menos facilmente pela corrente sanguínea das membranas nervosas e mais lentamente “lavados” de nervos isolados in vitro. Assim, o aumento da lipossolubilidade está associado ao aumento da ligação às proteínas no sangue, aumento da potência e maior duração da ação. A extensão e a duração da anestesia podem ser correlacionadas com o conteúdo de AL dos nervos em experimentos com animais. Em animais, blocos de maior profundidade e maior duração surgem de volumes menores de AL mais concentrado, em comparação com volumes maiores de AL menos concentrado.
Velocidade de início
Muitos livros e artigos de revisão afirmam que o início da anestesia em nervos isolados diminui com o aumento da lipossolubilidade do AL e o aumento do pKa.tabela 2). Em qualquer pH, a porcentagem de moléculas de AL presentes na forma não carregada, em grande parte responsável pela permeabilidade da membrana, diminui com o aumento do pKa. de outras AL. Finalmente, a taxa de início do LA está associada à taxa de difusão aquosa, que diminui com o aumento do peso molecular.
TABELA 2. Características anestésicas locais que tendem a se agrupar.
Físico e Químico
- Aumento da lipossolubilidade
- Aumento da ligação proteica
Farmacológico e Toxicológico
- Aumentando a potência
- Aumentando o tempo de início
- Aumentando a duração da ação
- Tendência crescente para toxicidade sistêmica grave
- Em geral, todos tendem a classificar juntos
Bloqueio do Nervo Sensorial Diferencial
A anestesia regional e o manejo da dor seriam transformados por um AL que inibiria seletivamente a transmissão da dor, deixando outras funções intactas. No entanto, anestesia sensorial suficiente para incisão na pele geralmente não pode ser obtida sem comprometimento motor. Como foi demonstrado pela primeira vez por Gasser e Erlanger em 1929, todos os ALs bloquearão fibras menores (diâmetro) em concentrações mais baixas do que as necessárias para bloquear fibras maiores do mesmo tipo. Como um grupo, as fibras não mielinizadas são resistentes aos LAs em comparação com as fibras A-δ mielinizadas maiores. A bupivacaína e a ropivacaína são relativamente seletivas para as fibras sensoriais. A bupivacaína produz um início mais rápido do bloqueio sensorial do que motor, enquanto a mepivacaína, substância química intimamente relacionada, não demonstra início diferencial durante os bloqueios do nervo mediano.Figura 10). A verdadeira anestesia diferencial pode ser possível quando os antagonistas seletivos da isoforma Nav estiverem disponíveis. Descobriu-se que certas isoformas Nav são predominantes nos gânglios da raiz dorsal e (como observado anteriormente) as populações relativas de várias isoformas Nav podem mudar em resposta a vários estados de dor.
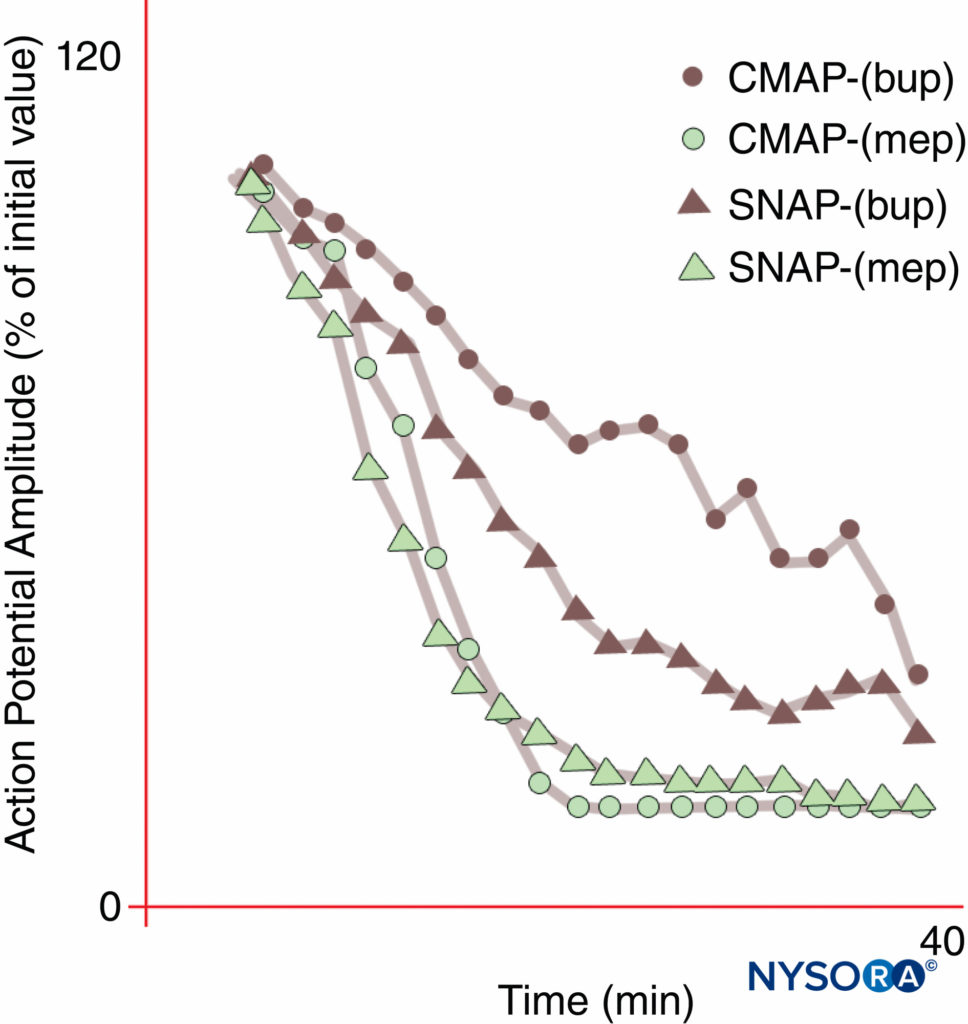
FIGURA 10. Início diferencial do bloqueio do nervo mediano com bupivacaína 0.3% (bup), mas não com mepivacaína 1% (mep). Observe que o potencial de ação motora composto (CMAP) é inibido menos do que o potencial de ação do nervo sensorial (SNAP) durante o início do bloqueio da bupivacaína nesses voluntários normais. No estado estacionário (20 min), CMAP e SNAP são inibidos de forma comparativa. Por outro lado, a mepivacaína produziu inibição mais rápida de CMAP e SNAP, e não houve início diferencial de bloqueio. (Reproduzido com permissão de Butterworth J, Ririe DG, Thompson RB, et al: Início diferencial do bloqueio do nervo mediano: comparação randomizada, duplo-cega de mepivacaína e bupivacaína em voluntários saudáveis. Br J Anaesth. 1998 Out;81(4): 515-521.)
Outros fatores que influenciam a atividade anestésica local
Muitos fatores influenciam a capacidade de um determinado AL de produzir anestesia regional adequada, incluindo a dose, local de administração, aditivos, temperatura e gravidez. À medida que a dose de AL aumenta, a probabilidade de sucesso e a duração da anestesia aumentam, enquanto o atraso no início e a tendência ao bloqueio diferencial diminuem. Em geral, o início mais rápido e a duração mais curta da anestesia ocorrem com injeções espinhais ou subcutâneas; um início mais lento e uma duração mais longa são obtidos com bloqueios de plexo.
Dicas NYSORA
- A eficácia de um determinado AL é influenciada pela dose, local de administração, aditivos, temperatura e alterações na suscetibilidade neural, observadas durante a gravidez.
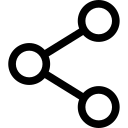
A epinefrina é frequentemente adicionada às soluções de AL para causar vasoconstrição e servir como marcador para injeção intravascular. A epinefrina e outros α1-agonistas aumentam a duração do AL em grande parte por prolongar e aumentar as concentrações intraneurais de AL. O fluxo sanguíneo é reduzido apenas brevemente, e o bloqueio persistirá por muito tempo após o efeito α1-adrenérgico no fluxo sanguíneo ter se dissipado. Outras adições populares de LA incluem clonidina, NaHCO3, opióides, dexametasona e hialuronidase. Anestésicos locais sem carga têm maior potência aparente em pH básico, onde uma fração aumentada de moléculas de AL não é carregada, do que em pH mais ácido.Figura 11). As bases de AL não carregadas difundem-se através das bainhas e membranas nervosas mais rapidamente do que os AL carregados, acelerando o início da anestesia. Alguns estudos clínicos mostraram que a adição de bicarbonato de sódio teve uma ação inconsistente durante o bloqueio clínico do nervo; no entanto, nem todos os estudos demonstraram um início mais rápido da anestesia. Pode-se antecipar que o bicarbonato teria seu maior efeito quando adicionado às soluções de AL às quais a epinefrina foi adicionada pelo fabricante. Essas soluções são mais ácidas do que as soluções de AL “simples” (sem epinefrina) para aumentar a vida útil. O bicarbonato diminui a duração da lidocaína em animais. Curiosamente, uma vez que os ALs ganham acesso ao lado citoplasmático do canal de Na+, os íons H+ potencializam o bloqueio dependente do uso. Prolongamento acentuado da anestesia local pode ser alcançado pela incorporação de ALs em lipossomas, como foi feito com bupivacaína em algumas formulações.
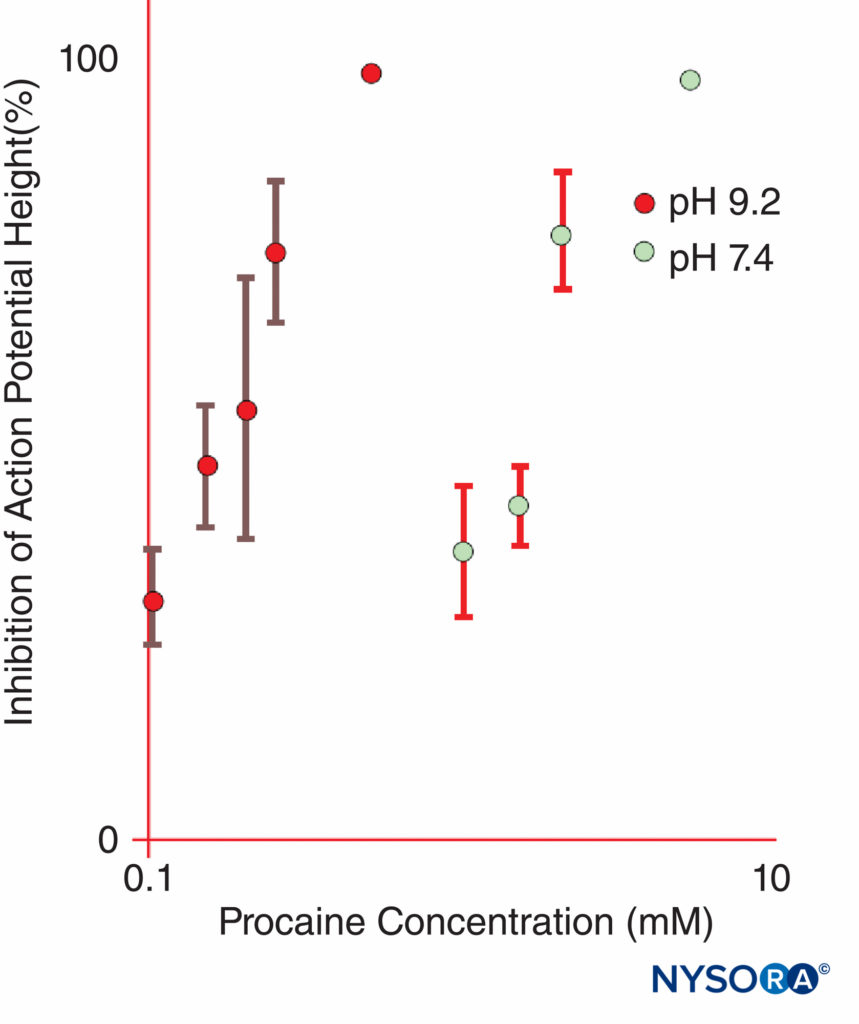
FIGURA 11. A potência da procaína na inibição dos potenciais de ação do composto em nervos ciáticos isolados de rã é dramaticamente aumentada em pH 9.2 em comparação com pH 7.4. (Reproduzido com permissão de Butterworth JF, Lief PA, Strichartz GR: A atividade anestésica local dependente do pH do dietilaminoetanol, um metabólito da procaína. Anestesiologia. 1988 Apr;68(4):501-506.)
Dicas NYSORA
- A gravidez aumenta a suscetibilidade neural aos LAs.
Mulheres grávidas e animais grávidas demonstram maior suscetibilidade neural aos LAs. Além disso, a disseminação da anestesia neuraxial provavelmente aumenta durante a gravidez devido à diminuição do volume do líquido cefalorraquidiano toracolombar.
CONCENTRAÇÕES SANGUÍNEAS E FARMACOCINÉTICA
As concentrações máximas de AL variam de acordo com o local da injeção (Figura 12). Com a mesma dose de LA, bloqueios intercostais consistentemente produzem maiores concentrações de pico de LA do que epidural ou blocos de plexo. Como foi discutido recentemente por outros, faz pouco sentido falar de doses “máximas” de ALs, exceto em referência a um procedimento específico de bloqueio de nervo, uma vez que os níveis sanguíneos de pico variam amplamente de acordo com o local do bloqueio. No sangue, todos os ALs estão parcialmente ligados a proteínas, principalmente à glicoproteína α1-ácida e secundariamente à albumina.
A afinidade pela glicoproteína α1-ácida correlaciona-se com a hidrofobicidade do LA e diminui com a protonação (acidez). A extensão da ligação às proteínas é influenciada pela concentração de α1-glicoproteína ácida. Tanto a ligação protéica quanto a concentração protéica diminuem durante a gravidez. Durante a infusão de longa duração de LA e combinações de LA-opióides, as concentrações de proteínas de ligação ao LA aumentam progressivamente. esperado para demonstrar Toxicidade LA após doses menores em bolus intravenosos.
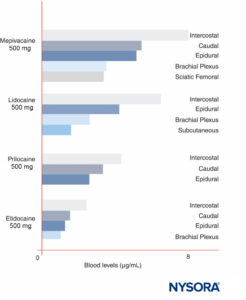
FIGURA 12. Concentrações sanguíneas máximas de anestésicos locais após várias formas de anestesia regional. Observe que os bloqueios intercostais resultam consistentemente nas maiores concentrações de anestésico local no sangue, que os bloqueios de plexo resultam nas menores concentrações de anestésico local no sangue e que as técnicas peridural/caudal estão no meio. (Reproduzido com permissão de Covino BG, Vassallo HG: Local Anesthetics: Mechanisms of Action and Clinical Use. Grune & Stratton; 1976.)
Dicas NYSORA
- As recomendações sobre doses máximas de ALs comumente encontradas em textos de farmacologia não são muito úteis na prática clínica da anestesia regional.
- As concentrações séricas de ALs dependem da técnica de injeção, local de injeção e adição de aditivos ao AL.
- Qualquer recomendação sobre a dose máxima segura de AL pode ser válida apenas em referência a um procedimento específico de bloqueio de nervo.
Os ésteres sofrem hidrólise rápida no sangue, catalisada por esterases não específicas. A procaína e a benzocaína são metabolizadas em ácido para-aminobenzóico (PABA), a espécie responsável pela anafilaxia a esses agentes. Doses mais altas de benzocaína, normalmente para anestesia tópica para endoscopia, podem levar a níveis de metemoglobinemia com risco de vida. As amidas sofrem metabolismo no fígado. A lidocaína sofre N-deal-quilação oxidativa (pelos citocromos CYP 1A2 e CYP 3A4 em monoetil glicina xilidida e glicina xilidida). Bupivacaína, ropivacaína, mepivacaína e etidocaína também sofrem N-desalquilação e hidroxilação. A prilocaína é hidrolisada em o-toluidina, o agente que causa a metemoglobinemia. Doses de prilocaína de apenas 400 mg em adultos saudáveis podem produzir concentrações de metemoglobinemia suficientemente grandes para causar cianose clínica. A depuração da amida LA é altamente dependente do fluxo sanguíneo hepático, extração hepática e função enzimática; portanto, a depuração da amida LA é reduzida por fatores que diminuem o fluxo sanguíneo hepático, como o receptor β-adrenérgico ou bloqueadores do receptor H2, e por insuficiência cardíaca ou hepática. A disposição dos ALs amida é alterada na gravidez devido ao aumento do débito cardíaco, fluxo sanguíneo hepático e depuração, bem como o declínio mencionado anteriormente na ligação às proteínas. A insuficiência renal tende a aumentar o volume de distribuição de LAs amida e aumentar o acúmulo de subprodutos metabólicos de LAs éster e amida. Teoricamente, a deficiência de colinesterase e os inibidores de colinesterase deveriam aumentar o risco de toxicidade sistêmica de éster ALs; entretanto, não há relatos clínicos confirmatórios. Algumas drogas inibem vários citocromos responsáveis pelo metabolismo do AL; no entanto, a importância dos inibidores de citocromo varia dependendo da espécie específica de AL. Os betabloqueadores e os bloqueadores dos receptores H2 inibem o CYP 2D6, o que pode contribuir para a redução do metabolismo da amida LA. O itraconazol não tem efeito sobre o fluxo sanguíneo hepático, mas inibe a eliminação do CYP 3A4 e da bupivacaína em 20%–25. A ropivacaína é hidroxilada pelo CYP 1A2 e metabolizada em 2',6'-pipecoloxilidida pelo CYP 3A4. A inibição da fluvoxamina do CYP 1A2 reduz a depuração da ropiva-caína em 70%. Por outro lado, a coadministração com inibidores fortes do CYP 3A4 (cetoconazol, itraconazol) tem apenas um pequeno efeito na depuração da ropivacaína.
EFEITOS COLATERAIS TÓXICOS DIRETOS
É uma suposição comum, mas equivocada, que todas as ações do AL, incluindo os efeitos colaterais tóxicos, surgem da interação com os canais de Na+ dependentes de voltagem. Há evidências abundantes de que os ALs se ligarão a muitos outros alvos além dos canais de Na, incluindo canais de K e Ca dependentes de voltagem, canais KATP, enzimas, receptores N-metil-D-aspartato, receptores β-adrenérgicos, modulação mediada por proteína G canais de K e Ca e receptores nicotínicos de acetilcolina. A ligação de LA a qualquer um ou a todos esses outros sites pode ser a base da produção de LA de Espinhal or analgesia epidural e pode contribuir para efeitos colaterais tóxicos.
Efeitos colaterais do sistema nervoso central
A toxicidade do anestésico local no SNC surge do bloqueio seletivo da inibição das vias excitatórias no SNC, produzindo uma sequência estereotipada de sinais e sintomas à medida que a concentração de AL no sangue aumenta gradualmente.tabela 3). Com doses aumentadas de AL, podem surgir convulsões na amígdala. Com mais dosagem de LA, a excitação do SNC progride para depressão do SNC e eventual parada respiratória. Os ALs mais potentes (no bloqueio do nervo) produzem convulsões em concentrações sanguíneas mais baixas e em doses mais baixas do que os ALs menos potentes. Em estudos com animais, tanto a acidose metabólica quanto a respiratória diminuíram a dose convulsiva de lidocaína.
TABELA 3. Progressão dos sinais e sintomas de toxicidade à medida que a dose (ou concentração) do anestésico local aumenta gradualmente.
- Vertigem
- Zumbido
- Sentimentos sinistros
- Dormência circummoral
- Linguagem
- Tremores
- Empurrões mioclônicos
- Convulsões
- Coma
- Colapso cardiovascular
Toxicidade Cardiovascular
Em experimentos de laboratório, a maioria dos ALs não produzirá toxicidade cardiovascular (CV) até que a concentração sanguínea exceda três vezes a necessária para produzir convulsões; no entanto, existem relatos clínicos de toxicidade simultânea do SNC e CV com bupivacaína.tabela 4). Em cães, doses supraconvulsivas de bupivacaína produzem arritmias mais comumente do que doses supraconvulsivas de ropivacaína e lidocaína. Os ALs produzem sinais CV de excitação do SNC (aumento da frequência cardíaca, pressão arterial e débito cardíaco) em concentrações mais baixas do que aquelas associadas à depressão cardíaca. A hipocapnia reduz as alterações induzidas pela ropivacaína nos segmentos ST e na contratilidade ventricular esquerda.
Dicas NYSORA
- Em experimentos de laboratório, a maioria dos ALs não produzirá toxicidade CV até que a concentração sanguínea exceda três vezes a necessária para produzir convulsões.
TABELA 4. Doses convulsivas versus letais de anestésicos locais em cães.
| Lidocaína | Bupivacaína | Tetracaína | |
|---|---|---|---|
| Dose produzindo convulsões em todos os animais (mg/kg) | 22 | 5 | 4 |
| Dose produzindo letalidade em todos os animais (mg/kg) | 76 | 20 | 27 |
Os anestésicos locais ligam e inibem os canais cardíacos de Na (Nav 1.5 isoforma). A bupivacaína liga-se mais avidamente e por mais tempo do que a lidocaína aos canais cardíacos de sódio. Como observado anteriormente, certos isômeros ópticos R(+) ligam-se aos canais cardíacos de Na mais avidamente do que os isômeros ópticos S(–). Essas observações laboratoriais levaram ao desenvolvimento clínico da levobupivacaína e da ropivacaína. Os anestésicos locais inibem a condução no coração com a mesma ordem de potência do bloqueio nervoso. Os anestésicos locais produzem depressão miocárdica dose-dependente, possivelmente devido à interferência com os mecanismos de sinalização do Ca dentro do músculo cardíaco. Esses anestésicos se ligam e inibem os canais cardíacos de Ca e K dependentes de voltagem em concentrações maiores do que aquelas em que a ligação aos canais de Na é máxima. Os ALs ligam-se a receptores β-adrenérgicos e inibem a formação de adenosina monofosfato cíclico (AMP) estimulada por epinefrina. Em ratos, a ordem de classificação para toxicidade cardíaca parece ser bupivacaína > levobupivacaína > ropivacaína. Em cães, a lidocaína foi a menos potente, e a bupivacaína e a levobupivacaína foram mais potentes do que a ropivacaína na inibição da função ventricular esquerda avaliada por ecocardiografia.tabela 5). Em cães, tanto a estimulação elétrica programada quanto a ressuscitação com epinefrina provocaram mais arritmias após a administração de bupivacaína e levobupivacaína do que após a administração de lidocaína ou ropivacaína. O mecanismo pelo qual a toxicidade CV é produzida pode depender de qual LA foi administrado. Quando os ALs foram administrados ao ponto de hipotensão extrema, os cães que receberam lidocaína puderam ser ressuscitados, mas necessitaram de infusão contínua de epinefrina para neutralizar a depressão miocárdica induzida por AL. Por outro lado, muitos cães que receberam bupivacaína ou levobupivacaína ao ponto de hipotensão extrema não puderam ser ressuscitados. Após a bupivacaína, levobupivacaína ou ropivacaína, os cães que podiam ser desfibrilados geralmente não necessitavam de terapia adicional. Da mesma forma, em suínos, comparando lidocaína com bupivacaína, a razão de potência para depressão miocárdica foi de 1:4, enquanto foi de 1:16 para arritmogênese. Os ALs produzem dilatação do músculo liso vascular em concentrações clínicas. A cocaína é o único AL que produz consistentemente vasoconstrição local.
Reações alérgicas
Dicas NYSORA
- Reações imunológicas verdadeiras aos LAs são raras.
- A verdadeira anafilaxia parece mais comum com LAs éster que são metabolizados diretamente em PABA do que com outros LAs.
- As injeções intravenosas acidentais de LAs às vezes são diagnosticadas erroneamente como reações alérgicas.
- Alguns pacientes podem reagir a conservantes, como o metilparabeno, incluído nos ALs.
Reações imunológicas verdadeiras aos LAs são raras. As injeções intravenosas acidentais de LAs às vezes são diagnosticadas erroneamente como reações alérgicas. A verdadeira anafilaxia parece mais comum com LAs éster que são metabolizados diretamente em PABA do que em outros LAs. Alguns pacientes podem reagir a conservantes, como metil-parabeno, incluídos nos ALs. Vários estudos têm demonstrado que pacientes encaminhados para avaliação de aparente alergia ao AL, mesmo após apresentarem sinais ou sintomas de anafilaxia, quase nunca demonstram alergia verdadeira ao AL administrado. Por outro lado, o teste cutâneo de AL tem um excelente valor preditivo negativo. Em outras palavras, 97% dos pacientes que não respondem ao teste cutâneo de LA também não terão uma reação alérgica ao LA em um ambiente clínico.
TABELA 5. Efeitos dos anestésicos locais nos índices de função miocárdica medidos em cães.
| Anestesia local | LVDP (CE50 para base de 125%) (mcg/ml) | dP/dtmax (CE50 para base de 65%) (mcg/ml) | %FE (EC50 para base de 65%) (mcg/ml) |
|---|---|---|---|
| Bupivacaína | 2.2 (1.2 – 4.4) | 2.3 (1.7 – 3.1) | 2.1 (1.47 – 3.08) |
| Levobupivacaína | 1.7 (0.9 – 3.1) | 2.4 (1.9 – 3.1) | 1.3 (0.9 – 1.8) |
| Ropivacaína | 4.0 (2.1 – 7.5)a/sup> | 4.0 (3.1 – 5.2)b | 3.0 (2.1 – 4.2)a/sup> |
| Lidocaína | 6.8 (3.0 – 15.4)c | 8.0 (5.7 – 11.0)d | 5.5 (3.5 – 8.7)d |
Efeitos neurotóxicos
Durante a década de 1980, a 2-cloroprocaína (na época formulada com metabissulfito de sódio em pH relativamente ácido) ocasionalmente produziu síndrome da cauda equina após injeção intratecal acidental de grandes doses durante tentativa de administração epidural. Se a “toxina” é a 2-cloroprocaína ou o metabissulfito de sódio permanece incerto: a 2-cloroprocaína está sendo testada como substituto da lidocaína na raquianestesia humana, e uma série de publicações sugere que ela pode ser segura e eficaz. Ao mesmo tempo, outros pesquisadores associaram reações neurotóxicas em animais a grandes doses de 2-cloroprocaína em vez de metabissulfito. Há também controvérsia sobre sintomas neurológicos transitórios e déficits sacrais persistentes após raquianestesia com lidocaína. Os relatos e a controvérsia persuadiram muitos médicos a abandonar a raquianestesia com lidocaína. Ao contrário de outras soluções espinais de AL, a lidocaína a 5% interrompe permanentemente a condução quando aplicada a nervos isolados ou a neurônios isolados. Isso pode ser o resultado do aumento do cálcio intracelular induzido pela lidocaína e não parece envolver o bloqueio do canal de Na+. Embora seja impossível “provar a segurança”, vários estudos sugerem que a cloroprocaína ou a mepivacaína podem substituir a lidocaína para raquianestesias breves.
Tratamento da Toxicidade Anestésica Local
O tratamento das reações adversas do AL depende da sua gravidade. As reações menores podem terminar espontaneamente. Convulsões induzidas por ALs devem ser tratadas mantendo uma via aérea pérvia e fornecendo oxigênio. As convulsões podem ser encerradas com midazolam intravenoso (0.05–0.10 mg/kg) ou propofol (0.5–1.5 mg/kg) ou uma dose paralítica de succinilcolina (0.5–1 mg/kg), seguida de ventilação com bolsa e máscara (ou intubação traqueal). A depressão CV do AE manifestada por hipotensão moderada, pode ser tratada por infusão de fluidos intravenosos e vasopressores (fenilefrina 0.5–5 μg/kg/min, norepinefrina 0.02–0.2 μg/kg/min, ou vasopressina 40 μg IV). Se houver insuficiência miocárdica, epinefrina (1–5 μg/kg IV em bolus) pode ser necessária. Quando a toxicidade progride para parada cardíaca, as diretrizes para o tratamento da toxicidade do AL conforme desenvolvidas pela Sociedade Americana de Anestesia Regional e Medicina da Dor (ASRA) são razoáveis e certamente preferíveis aos esquemas de ressuscitação caóticos identificados em uma pesquisa nacional antes da publicação do diretriz. Faz sentido que a amiodarona seja substituída pela lidocaína e, com base em vários experimentos com animais, que doses menores e incrementais de epinefrina sejam usadas inicialmente em vez de bolus de 1 mg. Experimentos em animais e relatórios clínicos demonstram a notável capacidade da infusão de lipídios para ressuscitar a parada cardíaca induzida pela bupivacaína.Figura 13). Dado o status quase não tóxico da infusão de lipídios, não se pode apresentar um argumento convincente para negar essa terapia a um paciente que necessite de ressuscitação por intoxicação por LA. Com toxicidade cardíaca por bupivacaína não responsiva, a circulação extracorpórea deve ser considerada. Parece que a ameaça da toxicidade sistêmica grave do anestésico local pode estar em declínio, seja por um melhor tratamento ou por mudanças nas técnicas. Uma minoria argumentaria que o risco foi exagerado desde o início, pelo menos em mãos experientes. Muitos profissionais acreditam que a orientação por ultrassom durante bloqueios de nervos periféricos levou a práticas mais seguras e menos riscos. Embora essa visão permaneça controversa, existem estudos que apoiam essa crença.
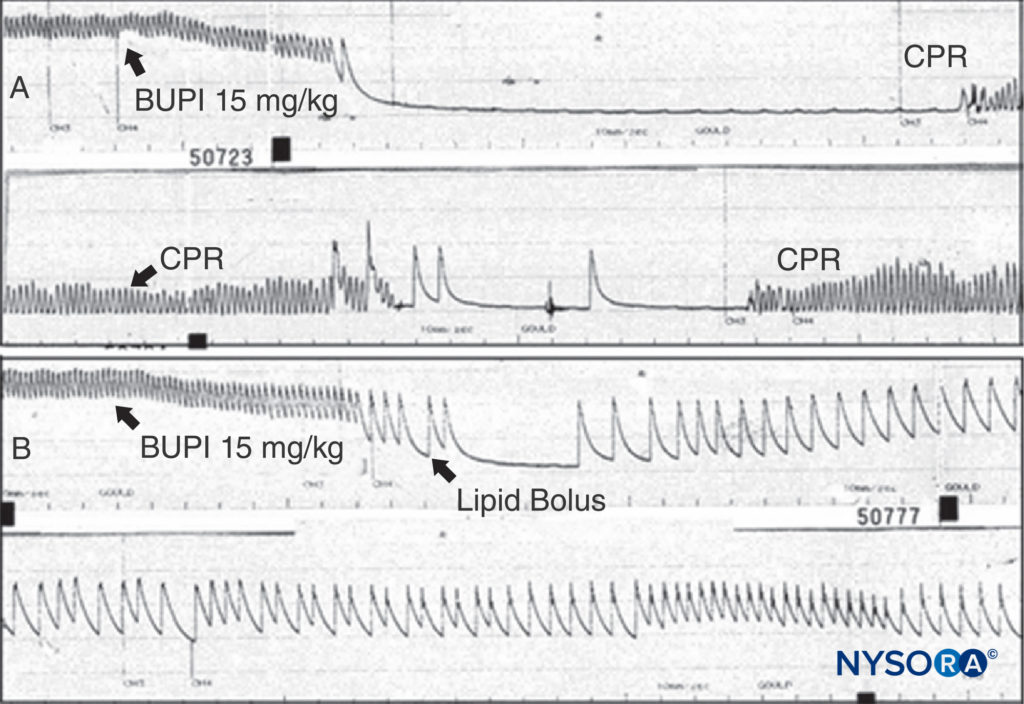
FIGURA 13. A: Um rato anestesiado recebe bupivacaína 15 mg/kg conforme indicado. A pressão arterial diminui rapidamente para parada cardíaca. A ressuscitação cardiopulmonar (RCP) é administrada, mas nenhuma pressão arterial é observada quando a RCP é descontinuada. B: O mesmo experimento é realizado, mas é administrado um bolus de lipídio; observe que a pressão arterial nunca é perdida (apesar de ser usada a mesma dose de bupivacaína) e que a parada cardíaca não ocorre. (Reproduzido com permissão de Weinberg G: Conceitos atuais na ressuscitação de pacientes com toxicidade cardíaca por anestésico local. Reg Anesth Pain Med. 2002 Nov-Dec;27(6):568-575.)
RESUMO
Após mais de um século de uso na medicina ocidental, os ALs continuam sendo ferramentas importantes para o médico do século XXI. Bloqueios de nervos periféricos são quase certamente o resultado da inibição dos canais de Na+ dependentes de voltagem nas membranas neuronais. Os mecanismos da anestesia raquidiana e peridural permanecem incompletamente definidos. A dose apropriada e segura de ALs varia de acordo com o procedimento específico de bloqueio do nervo. Os mecanismos pelos quais diferentes ALs produzem toxicidade CV provavelmente variam: os agentes mais potentes (p. Os temores sobre a toxicidade sistêmica do LA diminuíram com LAs mais seguros, práticas de anestesia regional mais seguras e tratamentos aprimorados. Há um esforço renovado para produzir formulações de anestésicos locais de liberação retardada clinicamente aplicáveis para estender a duração dos ALs atualmente disponíveis.
REFERÊNCIAS
- Vandam LD: Alguns aspectos da história da anestesia local. Em Strichartz GR (ed): Anestésicos Locais: Manual de Farmacologia Experimental. Springer-Verlag, 1987, pp 1-19.
- Calatayud J, Gonzalez A: História do desenvolvimento e evolução da anestesia local desde a folha de coca. Anestesiologia 2003;98:1503–1508.
- Strichartz GR: Anestésicos Locais: Manual de Farmacologia Experimental. Springer-Verlag, 1987.
- de Jong RH: Anestésicos Locais. Mosby-Year Book, 1994.
- Chaves TE: A História da Anestesia Cirúrgica. Biblioteca de madeira, Museu de Anestesiologia, 1996.
- Butterworth JF IV, Strichartz GR: Mecanismos moleculares de anestesia local: Uma revisão. Anestesiologia 1990;72:711–734.
- Tetzlaff J: Farmacologia Clínica de Anestésicos Locais. Butterworth-Heinemann, 2000.
- Ahern CA, Payandeh J, Bosmans F, Chanda B. O guia do carona para a galáxia do canal de sódio dependente de voltagem. J Gen Physiol. 2016;147:1–24.
- de Lera Ruiz M, Kraus RL. Canais de sódio dependentes de voltagem: estrutura, função, farmacologia e indicações clínicas. J Med Chem. 2015;58:7093–7118.
- Lopreato GF, Lu Y, Southwell A, et al: Evolução e divergência de genes de canais de sódio em vertebrados. Proc Natl Acad Sci USA 2001; 98:7588–7592.
- Savio-Galmiberti E. Gollob MH, Darbar D: Canais de sódio dependentes de voltagem: Biofísica, farmacologia e canalopatias relacionadas. Front Pharmacol 2012;3:1–19
- Chen-Izu Y, Shaw RM, Pitt GS, et al. Função, regulação, estrutura, tráfico e sequestro do canal de Na+. J Fisiol. 2015;593:1347–1360
- Hille B: Canais Iônicos de Membranas Excitáveis, 3ª ed. Sinauer, 2001.
- Jiang Y, Lee A, Chen J, et al: estrutura de raios-X de um canal K+ dependente de voltagem. Natureza 2003;423:33–41.
- Freites JA, Tobias DJ. Detecção de Tensão em Membranas: Das Correntes Macroscópicas aos Movimentos Moleculares. J Membro Biol. 2015;248:419–430.
- Taylor RE. Efeito da procaína nas propriedades elétricas da membrana do axônio de lula. Am J Physiol 1959;196:1070-1078.
- Strichartz GR. A inibição de correntes de sódio em nervo mielinizado por derivados quaternários de lidocaína. J Gen Physiol. 1973;62:37-57.
- Ragsdale DS, McPhee JC, Scheuer T, et al: Determinantes moleculares do bloqueio dependente do estado dos canais de Na+ por anestésicos locais. Ciência 1994;265:1724-1728.
- Wang GK, Quan C, Wang S: Um receptor anestésico local comum para benzocaína e etidocaína em canais mu1 Na+ dependentes de voltagem. Pflugers Arch 1998;435:293–302.
- Sudoh Y, Cahoon EE, Gerner P, et al: Antidepressivos tricíclicos como anestésicos locais de ação prolongada. Dor 2003;103:49–55.
- Kohane DS, Lu NT, Gokgol-Kline AC, et al: As propriedades anestésicas locais e toxicidade de homólogos de saxitonina para bloqueio do nervo ciático de rato in vivo. Reg Anesth Pain Med 2000;25:52–59.
- Butterworth JF IV, Strichartz GR: Os agonistas alfa 2-adrenérgicos clonidina e guanfacina produzem bloqueio tônico e fásico de condução nas fibras do nervo ciático de ratos. Anesth Analg 1993;76:295–301.
- Sanchez V, Arthur GR, Strichartz GR: Propriedades fundamentais dos anestésicos locais. I. A dependência da ionização da lidocaína e partição octanol:tampão em solvente e temperatura. Anesth Analg 1987;66: 159–165.
- Strichartz GR, Sanchez V, Arthur GR, et al: Propriedades fundamentais dos anestésicos locais. II. Coeficientes de partição octanol:tampão medidos e valores de pKa de drogas usadas clinicamente. Anesth Analg 1990;71:158–170.
- Popitz-Bergez FA, Leeson S, Strichartz GR, et al: Relação entre déficit funcional e anestésico local intraneural durante bloqueio de nervo periférico. Um estudo no nervo ciático do rato. Anestesiologia 1995;83:583–592.
- Sinnott CJ, Cogswell LP III, Johnson A, et al: Sobre o mecanismo pelo qual a epinefrina potencializa o bloqueio do nervo periférico da lidocaína. Anestesiologia 2003;98:181–188.
- Nakamura T, Popitz-Bergez F, Birknes J, et al: O papel crítico da concentração para o bloqueio de lidocaína do nervo periférico in vivo: Estudos de função e absorção de drogas no rato. Anestesiologia 2003;99: 1189–1197.
- Brouneus F, Karami K, Beronius P, et al: Propriedades de transporte difuso de alguns anestésicos locais aplicáveis à formulação iontoforética das drogas. Int J Pharm 2001;218:57–62.
- Gissen AJ, Covino BG, Gregus J: Sensibilidades diferenciais de fibras nervosas de mamíferos a agentes anestésicos locais. Anestesiologia 1980;53:467–474.
- Raymond SA, Gissen AJ: Mecanismos de bloqueio nervoso diferencial. Em Strichartz GR (ed): Handbook of Experimental Pharmacology: Local Anesthetics. Springer-Verlag, 1987, pp 95-164.
- Butterworth J, Ririe DG, Thompson RB, et al: Início diferencial do bloqueio do nervo mediano: Comparação randomizada e duplo-cega de mepivacaína e bupivacaína em voluntários saudáveis. Br J Anaesth 1998; 81:515-521.
- Novakovic SD, Eglen RM, Hunter JC: Regulação da distribuição dos canais de Na+ no sistema nervoso. Trends Neurosci 2001;24:473–478.
- Covino BG, Vasallo HG: Anestésicos Locais. Grune & Stratton, 1976.
- Kohane DS, Lu NT, Cairns BE, et al: Efeitos de agonistas e antagonistas adrenérgicos no bloqueio nervoso induzido por tetrodotoxina. Reg Anesth Pain Med 2001;26:239–245.
- Butterworth JF IV, Lief PA, Strichartz GR: A atividade anestésica local dependente do pH do dietilaminoetanol, um metabólito da procaína. Anestesiologia 1988;68:501–506.
- Fagraeus L, Urban BJ, Bromage PR: Propagação da analgesia epidural no início da gravidez. Anestesiologia 1983;58:184–187.
- Butterworth JF IV, Walker FO, Lysak SZ: A gravidez aumenta a suscetibilidade do nervo mediano à lidocaína. Anestesiologia 1990;72:962-965.
- Popitz-Bergez FA, Leeson S, Thalhammer JG, et al: Captação intraneural de lidocaína comparada com diferenças analgésicas entre ratas grávidas e não grávidas. Reg Anesth 1997;22:363–371.
- Scott DB, Jebson PJ, Braid DP, et al: Fatores que afetam os níveis plasmáticos de lidocaína e prilocaína. Br J Anaesth 1972;44:1040–1049.
- Rosenberg PH, Veering BTh, Urmey WF: Doses máximas recomendadas de anestésicos locais: Um conceito multifatorial. Reg Anesth Pain Med 2004;29:564–575.
- Taheri S, Cogswell LP III, Gent A, et al: Fatores hidrofóbicos e iônicos na ligação de anestésicos locais à principal variante da glicoproteína alfa1-ácida humana. J Pharmacol Exp Ther 2003;304:71-80.
- Fragneto RY, Bader AM, Rosinia F, et al: Medidas de ligação proteica da lidocaína durante a gravidez. Anesth Analg 1994;79: 295–297.
- Thomas JM, Schug SA: Avanços recentes na farmacocinética dos anestésicos locais. Enantiômeros de amida de ação prolongada e infusões contínuas. Clin Pharmacokinet 1999;36:67-83.
- Rothstein P, Arthur GR, Feldman HS, et al: Bupivacaína para bloqueios do nervo intercostal em crianças: concentrações sanguíneas e farmacocinética. Anesth Analg 1986;65:625–632.
- Bokesch PM, Castaneda AR, Ziemer G, et al: A influência de um shunt cardíaco direito-esquerdo na farmacocinética da lidocaína. Anestesiologia 1987; 67:739-744.
- Palkama VJ, Neuvonen PJ, Olkkola KT: Efeito do itraconazol na farmacocinética dos enantiômeros da bupivacaína em voluntários saudáveis. Br J Anaesth 1999;83:659–661.
- Oda Y, Furuichi K, Tanaka K, et al: Metabolismo de um novo anestésico local, ropivacaína, pelo citocromo hepático humano P450. Anestesiologia 1995; 82:214-220.
- Ekstrom G, Gunnarsson UB: A ropivacaína, um novo agente anestésico local do tipo amida, é metabolizada pelos citocromos P450 1A e 3A em microssomas hepáticos humanos. Drug Metab Dispos 1996;24:955-961.
- Hirota K, Browne T, Appadu BL, et al: Os anestésicos locais interagem com os sítios de ligação da diidropiridina nos canais de Ca2+ tipo L neuronais? Br J Anaesth 1997;78:185–188.
- Olschewski A, Olschewski H, Brau ME, et al: Efeito da bupivacaína nos canais de potássio dependentes de ATP em cardiomiócitos de ratos. Br J Anaesth 1999;82:435–438.
- Sugimoto M, Uchida I, Fukami S, et al: Os efeitos dependentes das subunidades alfa e gama dos anestésicos locais nos receptores GABA(A) recombinantes. Eur J Pharmacol 2000;401:329–337.
- Englesson S, Grevsten S: A influência das alterações ácido-base na toxicidade do sistema nervoso central de agentes anestésicos locais. II. Acta Anesthesiol Scand 1974;18:88–103.
- Feldman HS, Arthur GR, Covino BG: Toxicidade sistêmica comparativa de doses convulsivas e supraconvulsivas de ropivacaína, bupivacaína e lidocaína intravenosas no cão consciente. Anesth Analg 1989;69: 794-801.
- Porter JM, Markos F, Snow HM, et al: Efeitos das alterações do pH respiratório e metabólico e hipóxia na cardiotoxicidade induzida pela ropivacaína em cães. Br J Anaesth 2000;84:92–94.
- Chernoff DM: Análise cinética da inibição fásica das correntes neuronais de sódio pela lidocaína e bupivacaína. Biophys J 1990; 58:53-68.
- Feldman HS, Covino BM, Sage DJ: Efeitos cronotrópicos e inotrópicos diretos de agentes anestésicos locais em átrios isolados de cobaias. Reg Anesth 1982;7:149-156.
- Reiz S, Nath S: Cardiotoxicidade de agentes anestésicos locais. Br J Anaesth 1986;58:736–746.
- McCaslin PP, Butterworth J: A bupivacaína suprime as oscilações de [Ca(2+)](i) em cardiomiócitos de ratos neonatos com aumento de K+ extracelular e é revertida com aumento de Mg(2+) extracelular. Anesth Analg 2000;91:82–88.
- Butterworth JF IV, Brownlow RC, Leith JP, et al: Bupivacaína inibe a produção de monofosfato cíclico-3',5'-adenosina. Um possível fator contribuinte para a toxicidade cardiovascular. Anestesiologia 1993;79:88–95.
- Butterworth J, James RL, Grimes J: Relações de afinidade de estrutura e estereoespecificidade de várias séries homólogas de anestésicos locais para o receptor beta2-adrenérgico. Anesth Analg 1997;85:336–342.
- Ohmura S, Kawada M, Ohta T, et al: Toxicidade sistêmica e ressuscitação em ratos infundidos com bupivacaína, levobupivacaína ou ropivacaína. Anesth Analg 2001;93:743–748.
- Dony P, Dewinde V, Vanderick B, et al: A toxicidade comparativa de ropivacaína e bupivacaína em doses equipotentes em ratos. Anesth Analg 2000;91:1489–1492.
- Chang DH, Ladd LA, Copeland S, et al: Efeitos cardíacos diretos de bupivacaína intracoronária, levobupivacaína e ropivacaína em ovelhas. Br J Pharmacol 2001;132:649-658.
- Groban L, Deal DD, Vernon JC, et al: Arritmias ventriculares com ou sem estimulação elétrica programada após superdosagem incremental com lidocaína, bupivacaína, levobupivacaína e ropivacaína. Anesth Analg 2000;91:1103–1111.
- Groban L, Deal DD, Vernon JC, et al: Ressuscitação cardíaca após superdosagem incremental com lidocaína, bupivacaína, levobupivacaína e ropivacaína em cães anestesiados. Anesth Analg 2001;92:37–43.
- Groban L, Deal DD, Vernon JC, et al: A estereosseletividade ou estrutura do anestésico local prediz a depressão miocárdica em caninos anestesiados? Reg Anesth Pain Med 2002;27:460–468.
- Nath S, Haggmark S, Johansson G, et al: Depressor diferencial e cardiotoxicidade eletrofisiológica de anestésicos locais: Um estudo experimental com referência especial à lidocaína e bupivacaína. Anesth Analg 1986;65:1263–1270.
- Carpenter RL, Kopacz DJ, Mackey DC: Precisão das medições do fluxo capilar com laser Doppler para prever a perda de sangue de incisões na pele em porcos. Anesth Analg 1989;68:308–311.
- deShazo RD, Nelson HS: Uma abordagem ao paciente com história de hipersensibilidade ao anestésico local: Experiência com 90 pacientes. J Allergy Clin Immunol 1979;63:387-394.
- Berkun Y, Ben-Zvi A, Levy Y, et al: Avaliação de reações adversas aos anestésicos locais: Experiência com 236 pacientes. Ann Allergy Asthma Immunol 2003;91:342–345.
- Gissen AJ, Datta S, Lambert D: A controvérsia da cloroprocaína. I. Uma hipótese para explicar as complicações neurais da epidural com cloroprocaína. Reg Anesth 1984; 9:124-134.
- Gissen AJ, Datta S, Lambert D: A controvérsia da cloroprocaína. II. A cloroprocaína é neurotóxica? Reg Anesth 1984; 9:135-145.
- Winnie AP, Nader AM: A profecia de Santayana se cumpriu. Reg Anesth Pain Med 2001;26:558–564.
- Kouri ME, Kopacz DJ: Spinal 2-chloroprocaine: Uma comparação com lidocaína em voluntários. Anesth Analg 2004;98:75–80.
- Taniguchi M, Bollen AW, Drasner K: Bissulfito de sódio: bode expiatório para a neurotoxicidade da cloroprocaína? Anestesiologia 2004;100:85–91.
- Lambert LA, Lambert DH, Strichartz GR: Bloqueio de condução irreversível em nervo isolado por altas concentrações de anestésicos locais. Anestesiologia 1994;80:1082–1093.
- Gold MS, Reichling DB, Hampl KF, et al: Toxicidade da lidocaína em neurônios aferentes primários do rato. J Pharmacol Exp Ther 1998;285:413-421.
- Neal JM, Bernards CM, Butterworth JF 4th, et al. Aconselhamento prático da ASRA sobre toxicidade sistêmica de anestésicos locais. Reg Anesth Pain Med. 2010;35: 152–61
- Corcoran W, Butterworth J, Weller RS, et al. Toxicidade cardíaca induzida por anestésico local: um levantamento das estratégias de prática contemporânea entre os departamentos acadêmicos de anestesiologia. Anesth Analg. 2006;103:1322–6
- El-Boghdadly K, Chin KJ. Toxicidade sistêmica do anestésico local: Desenvolvimento profissional contínuo. Pode J Anaesth. 2016;63:330–349
- Krismer AC, Hogan QH, Wenzel V, et al: A eficácia da epinefrina ou vasopressina para ressuscitação durante a anestesia epidural. Anesth Analg 2001;93:734–742.
- Mayr VD, Raedler C, Wenzel V, et al: Uma comparação de epinefrina e vasopressina em um modelo suíno de parada cardíaca após injeção intravenosa rápida de bupivacaína. Anesth Analg 2004;98:1426–1431.
- Weinberg GL, Vade Boncouer T, Ramaraju GA, et al: Pré-tratamento ou ressuscitação com infusão de lipídios altera a dose-resposta para assistolia induzida por bupivacaína em ratos. Anestesiologia 1998;88:1071–1075.
- Weinberg G, Ripper R, Feinstein DL, et al: A infusão de emulsão lipídica resgata cães da toxicidade cardíaca induzida pela bupivacaína. Reg Anesth Pain Med 2003;28:198–202.
- Fettiplace MR, Weinberg G. Passado, presente e futuro da terapia de ressuscitação lipídica. JPEN J Parenter Enteral Nutr. 2015;39(1 Supl): 72S-83S.
- Soltesz EG, van Pelt F, Byrne JG: Circulação extracorpórea emergente para cardiotoxicidade da bupivacaína. J Cardiothorac Vasc Anesth 2003;17: 357–358.
- Vasques F, Behr AU, Weinberg G, et al. Uma Revisão de Casos de Toxicidade Sistêmica Anestésica Local Desde a Publicação das Recomendações da Sociedade Americana de Anestesia Regional: A Quem Pode Interessar. Reg Anesth Pain Med. 2015;40:698–705.
- Liu SS, Ortolan S, Sandoval MV, Curren J, Fields KG, Memtsoudis SG, YaDeau JT. Parada Cardíaca e Convulsões Causadas por Toxicidade Sistêmica Anestésica Local Após Bloqueios de Nervos Periféricos: Devemos Ainda Temer o Ceifador? Reg Anesth Pain Med. 2016;4:5–21.
- Barrington MJ, Kluger R. A orientação por ultrassom reduz o risco de toxicidade sistêmica do anestésico local após bloqueio de nervo periférico. Reg Anesth Pain Med. 2013;38:289–299.
- Neal JM, Brull R, Horn JL, et al. A Segunda Sociedade Americana de Anestesia Regional e Medicina da Dor Avaliação de Medicina Baseada em Evidências de Anestesia Regional Guiada por Ultrassom: Resumo Executivo. Reg Anesth Pain Med. 2016;41:181–194