Observação: Se você está procurando informações sobre Anestesia e Analgesia Epidural para pacientes, clique aqui.
Roulhac D. Toledano e Marc Van de Velde*
*Os autores gostariam de agradecer a Michael A. Maloney, MB, BAO, ChB, por sua ajuda com as tabelas e figuras.
INTRODUÇÃO
As indicações clínicas para anestesia peridural e analgesia se expandiram significativamente nas últimas décadas. A analgesia epidural é frequentemente usada para complementar a anestesia geral (AG) para procedimentos cirúrgicos em pacientes de todas as idades com comorbidade moderada a grave; proporcionar analgesia no intraoperatório, pós-operatório, periparto, e configurações de fim de vida; e pode ser usado como anestésico primário para cirurgias desde o mediastino até as extremidades inferiores. Além disso, as técnicas epidurais são cada vez mais utilizadas para procedimentos diagnósticos, terapia da dor aguda e tratamento da dor crônica. O bloqueio peridural também pode reduzir a resposta ao estresse cirúrgico, o risco de recorrência do câncer, a incidência de eventos tromboembólicos perioperatórios e, possivelmente, a morbidade e mortalidade associadas a cirurgias de grande porte.
Este capítulo aborda os fundamentos da anestesia e analgesia epidural. Após um breve histórico da transformação das técnicas de cateter único para cateter peridural contínuo, revisa (1) as indicações e contra-indicações do bloqueio peridural; (2) considerações anatômicas básicas para colocação epidural; (3) efeitos fisiológicos do bloqueio epidural; (4) farmacologia das drogas utilizadas para anestesia e analgesia peridural; (5) técnicas para colocação epidural bem sucedida; e (6) complicações maiores e menores associadas ao bloqueio peridural. Este capítulo também aborda várias áreas de controvérsia em relação às técnicas epidurais. Isso inclui controvérsias sobre a anatomia do espaço epidural, a dose tradicional do teste de epinefrina, métodos usados para identificar o espaço epidural e se determinados resultados clínicos podem ser melhorados com técnicas epidural quando comparados ao GA. Informações mais detalhadas sobre os anestésicos locais (AL), o mecanismo de bloqueio do neuroeixo, a combinado raqui-peridural (CSE), técnica, anestesia obstétrica e complicações de bloqueio neuroaxial central é fornecido seguindo os links.
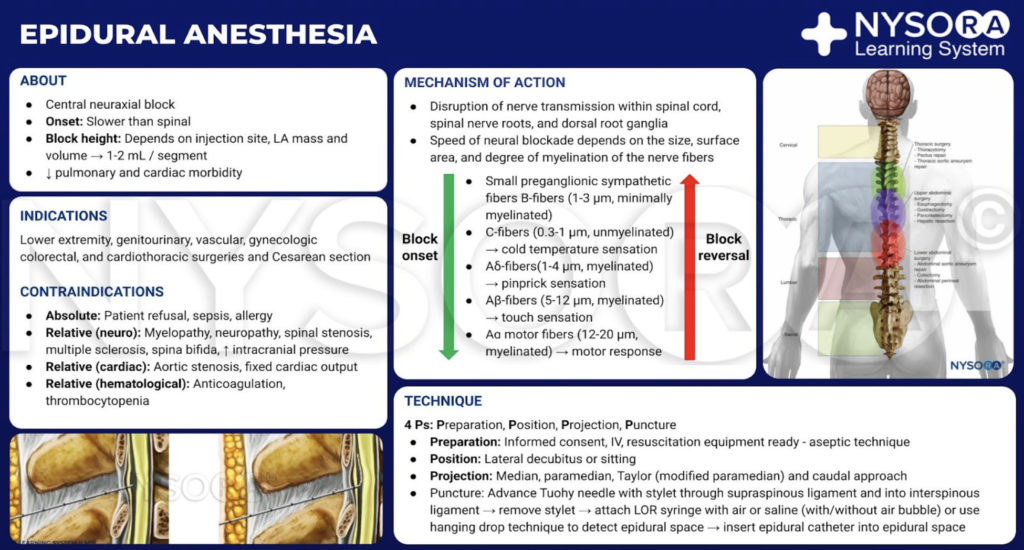
Do Compêndio de Anestesia Regional: Infográfico de anestesia epidural.
BREVE HISTÓRIA
O neurologista J. Leonard Corning propôs injetar uma solução anestésica no espaço epidural na década de 1880, mas dedicou sua pesquisa principalmente aos bloqueios do nervo subaracnóideo. Apesar de cunhar o termo raquianestesia, ele pode, sem saber, estar investigando o espaço peridural. Os médicos franceses Jean Sicard e Fernand Cathelin são creditados com a primeira administração intencional de anestesia epidural. Na virada do século 20, eles introduziram independentemente bloqueios do nervo caudal de disparo único com cocaína para procedimentos neurológicos e geniturinários, respectivamente.
Dezenove anos depois, o cirurgião espanhol Fidel Pagés Miravé descreveu uma abordagem toracolombar de injeção única para anestesia “peridural”, identificando o espaço epidural por meio de sutis distinções táteis nos ligamentos. Dentro de uma década e aparentemente sem o conhecimento do trabalho de Pagés, o cirurgião italiano Achille Dogliotti popularizou uma técnica de perda de resistência (LOR) reprodutível para identificar o espaço peridural. Contemporaneamente, o cirurgião argentino Alberto Gutiérrez descreveu o “sinal da gota” para identificação do espaço peridural.
Uma série de inovações de Eugene Aburel, Robert Hingson, Waldo Edwards e James Southworth, entre outros, tentaram prolongar a técnica epidural de injeção única. No entanto, o anestesiologista cubano Manual Martinez Curbelo é creditado por ter adaptado a técnica subaracnóidea contínua de Edward Tuohy para o espaço epidural em 1947. Seus esforços foram facilitados por um amplo conhecimento de anatomia, uma experiência em primeira mão observando Tuohy na Clínica Mayo e a disponibilidade de Agulhas Tuohy calibre 16 e pequenos cateteres ureterais graduados 3.5-French, que se curvavam à medida que saíam da ponta da agulha. Várias modificações da agulha Tuohy, em si uma modificação da agulha Huber, surgiram desde então.
O cateter peridural também evoluiu desde suas origens como um cateter ureteral modificado. Atualmente, vários fabricantes usam misturas de nylon para produzir cateteres finos e resistentes a dobras, com resistência à tração e rigidez apropriadas. O cateter reforçado com fio representa o mais recente avanço tecnológico em design de cateter peridural. A adição de uma bobina de aço inoxidável circunferencial dentro de um cateter de náilon ou poliuretano confere maior flexibilidade em comparação com os cateteres de náilon padrão e pode diminuir a incidência de canulação venosa, colocação intratecal, migração do cateter e parestesias.
INDICAÇÕES
Esta seção apresenta indicações comuns e controversas para o uso de bloqueio peridural lombar e torácico em cirurgias de membros inferiores, geniturinárias, vasculares, ginecológicas, colorretais e cardiotorácicas. Também revisa indicações menos comuns e novas para anestesia e analgesia peridural, inclusive para o tratamento de pacientes com sepse e distúrbios médicos incomuns (tabela 1).
TABELA 1. Exemplos de aplicações para bloqueio peridural.
| Especialidade | Procedimento Cirúrgico |
|---|---|
| Cirurgia ortopédica | Grande cirurgia de quadril e joelho, fraturas pélvicas |
| Cirurgia obstétrica | cesariana, analgesia de parto |
| Cirurgia ginecológica | Histerectomia, procedimentos do assoalho pélvico |
| Cirurgia geral | Cirurgia de mama, hepática, gástrica, colônica |
| cirurgia pediátrica | Correção de hérnia inguinal, cirurgia ortopédica |
| Cirurgia ambulatorial | Pé, joelho, quadril, cirurgia anorretal |
| Cirurgia cardiotoráxica | Toracotomia, esofagectomia, timectomia, cirurgia de revascularização do miocárdio (com e sem bomba) |
| Cirurgia urológica | Prostatectomia, cistectomia, litotripsia, nefrectomia |
| Cirurgia vascular | Amputação de membro inferior, procedimentos de revascularização |
| Condições médicas | Hiperreflexia autonômica, miastenia gravis, feocromocitoma, hipertermia maligna conhecida ou suspeita |
Bloqueio peridural lombar
A anestesia peridural tem sido administrada mais comumente para procedimentos envolvendo membros inferiores, pelve, períneo e abdome inferior, mas está sendo cada vez mais utilizada como único anestésico ou como complemento à AG para uma maior diversidade de procedimentos. Esta seção examina várias indicações comuns para bloqueio epidural lombar, incluindo cirurgia ortopédica de membros inferiores, procedimentos vasculares infrainguinais e cirurgias ginecológicas geniturinárias e vaginais. Quando aplicável, revisa as vantagens e desvantagens do uso de técnicas neuroaxiais versus AG para procedimentos específicos.
Cirurgia Ortopédica Maior de Membros Inferiores
Tanto a tromboprofilaxia anticoagulante perioperatória quanto a crescente dependência de bloqueios de nervos periféricos influenciaram o uso atual de bloqueio peridural lombar contínuo para cirurgia de membros inferiores. No entanto, o bloqueio do neuroeixo como único anestésico ou como suplemento para GA ou técnicas periféricas ainda é amplamente utilizado para grandes cirurgias ortopédicas dos membros inferiores. O controle eficaz da dor pós-operatória proporcionado por bloqueios de nervos periféricos ou neuraxiais, ou uma combinação das duas técnicas, melhora a satisfação do paciente, permite a deambulação precoce, acelera a recuperação funcional e pode encurtar o tempo de internação, principalmente após cirurgias de grande porte no joelho. Outros benefícios potenciais do uso de bloqueio neuroaxial em vez de AG incluem a redução da incidência de trombose venosa profunda (TVP) em pacientes submetidos à cirurgia de artroplastia total de quadril e joelho, melhora da função cognitiva pós-operatória e diminuição da perda sanguínea intraoperatória e necessidade de transfusão. Uma metanálise recente também demonstrou redução estatisticamente significativa no tempo operatório quando o bloqueio neuroaxial foi usado em pacientes submetidos à artroplastia total de quadril eletiva, embora os autores não tenham feito distinção entre as técnicas raquidiana e peridural.
Principais procedimentos ortopédicos que podem ser realizados sob peridural, CSE, ou epidural e GA integrados incluem artroplastia primária de quadril ou joelho, cirurgia para fratura de quadril, artroplastia de revisão, artroplastia total de joelho bilateral, enxerto ósseo acetabular e inserção de próteses femorais de haste longa.tabela 2). Raquianestesia pode ser a técnica preferida em alguns desses casos, particularmente se a dor pós-operatória prevista for leve ou insignificante (por exemplo, artroplastia total do quadril) ou se um bloqueio de nervo periférico suplementar for planejado.
TABELA 2. Cirurgias ortopédicas adequadas para anestesia peridural, raqui-peridural combinada ou peridural-geral integrada.
| Procedimento | Nível Sensorial Exigido |
|---|---|
| Redução fechada e externa fixação da pelve | Técnica neuroaxial raramente adequado para cirurgia; epidural útil para pós-operatório analgesia |
| Artroplastia de quadril, artrodese, sinovectomia | T10 |
| Fixação interna de redução aberta de fratura acetabular | T10 |
| Fixação interna de redução aberta do fêmur, tíbia, tornozelo ou pé | T12 |
| Redução fechada e externa fixação do fêmur e da tíbia | T12 |
| Acima e abaixo do joelho amputação | T12 (T8 com torniquete) |
| Artrotomia do joelho | T12 (T8 com torniquete) |
| Artroscopia do joelho | T12 |
| Reparação/reconstrução do joelho ligamentos | T12 |
| Substituição total do joelho | T12 (T8 com torniquete) |
| Tíbia distal, tornozelo e pé procedimentos | T12 |
| Artroscopia do tornozelo, artrotomia, artrodese | T12 |
| Amputação transmetatarsal | T12 |
A anestesia para T10 com colocação da agulha em L3 a L4 é adequada para a maioria desses procedimentos.
O uso de anestesia neuroaxial para cirurgia ortopédica de grande porte não é isento de riscos e desafios. Pacientes idosos, vítimas de trauma e indivíduos com hemofilia que desenvolvem complicações de sangramento recorrente em suas articulações podem não ser candidatos adequados para bloqueio regional. Em geral, os procedimentos peridurais são bem tolerados em pacientes com comorbidades relacionadas à idade, como doença pulmonar restritiva, depuração hepática prolongada de drogas, hipertensão (HAS), doença arterial coronariana (DAC) e insuficiência renal. Pacientes idosos podem se beneficiar da diminuição da confusão pós-operatória e do delírio associados à anestesia regional, desde que a hipotensão intraoperatória seja mantida ao mínimo. No entanto, a prevenção de alterações hemodinâmicas induzidas pela simpatectomia excessiva pode ser um desafio, pois esses pacientes são menos capazes de responder à hipotensão e mais propensos à descompensação cardíaca e edema pulmonar em resposta à administração rápida de fluidos. Uma técnica peridural com nível sensorial abaixo de T10, apropriada para muitas cirurgias ortopédicas, e administração criteriosa de fluidos e vasopressores podem minimizar esses riscos.
Pacientes idosos comumente se apresentam para cirurgia com medicamentos anticoagulantes ou antiplaquetários e podem representar um risco de lesão neurológica relacionada ao bloqueio neuroaxial central. Se uma técnica epidural for selecionada para esses ou outros pacientes de alto risco, deve-se levar em consideração o momento apropriado do início do bloqueio e da remoção do cateter em relação ao momento da administração do medicamento anticoagulante. Para pacientes com trauma, obter o posicionamento adequado para administração de anestesia peridural pode representar um desafio. O início do bloqueio neuroaxial na posição lateral pode melhorar as chances de sucesso. No intraoperatório, a dor do torniquete pode ser antecipada com bloqueio raquidiano ou peridural, mas ocorre mais frequentemente com este último. Embora o mecanismo permaneça mal compreendido, geralmente se apresenta dentro de uma hora após a insuflação do torniquete, aumenta de intensidade ao longo do tempo e é acompanhado por taquicardia e pressão arterial elevada. A administração de morfina sem preservativo intratecal ou epidural pode retardar o início da dor do torniquete.
Cirurgia Vascular de Membros Inferiores
Existem vários benefícios potenciais do uso de anestesia e analgesia neuroaxial para procedimentos vasculares de membros inferiores.
Pacientes submetidos à cirurgia vascular comumente apresentam múltiplas doenças sistêmicas importantes, como DAC, doença cerebrovascular (DCV), diabetes mellitus (DM), insuficiência renal crônica, hipertensão crônica e doença pulmonar obstrutiva crônica (DPOC). Os pacientes que se apresentam para embolectomia arterial também podem ter condições que os predispõem à formação de trombos intracardíacos, como estenose mitral ou fibrilação atrial. Evitar AG nesta população de pacientes de alto risco possivelmente aumenta a perviedade do enxerto, reduzindo a necessidade de reexploração e reduzindo o risco de complicações tromboembólicas; essas são algumas das vantagens do uso da anestesia regional. No entanto, o manejo desses indivíduos é muitas vezes complicado pela alta probabilidade de estarem tomando medicamentos antiplaquetários ou anticoagulantes pré-cirúrgicos e exigirão anticoagulação sistêmica adicional no intra e pós-operatório. Assim, esses pacientes são considerados de risco aumentado para hematoma epidural; é necessária uma análise cuidadosa do risco-benefício antes de iniciar o bloqueio peridural.
Deve-se considerar também o tipo de procedimento vascular a ser realizado, a duração prevista do procedimento, a possível necessidade de monitorização invasiva e a remoção oportuna do cateter peridural antes da transição para a terapia de anticoagulação oral. Manter a normotermia, garantir que a força motora possa ser avaliada prontamente no pós-operatório e fornecer sedação adequada durante procedimentos longos são desafios adicionais.
Os procedimentos vasculares infrainguinais que são adequados para bloqueio peridural incluem cirurgias de bypass arterial, embolectomia arterial e trombectomia venosa ou excisão de veia.tabela 3).
TABELA 3. Exemplos de procedimentos vasculares realizados com bloqueio peridural.
| Correção de aneurisma da aorta abdominal (técnica neuroaxial raramente adequada como único anestésico) |
| Bypass aortofemoral |
| Bypass da artéria renal |
| Bypass da artéria mesentérica |
| Bypass arterial infrainguinal com veia safena ou enxerto sintético |
| Embolectomia |
| Trombectomia |
| Procedimentos endovasculares (dilatação por balão intraluminal com colocação de stent; reparo de aneurisma) |
A titulação lenta dos ALs para atingir um nível T8-T10, mantendo a estabilidade hemodinâmica, é ideal. A adição de epinefrina aos ALs é controversa devido a preocupações de que seu efeito vasoconstritor possa comprometer um suprimento sanguíneo já tênue para a medula espinhal. Os estudos até o momento não conseguiram demonstrar diferença na morbidade e mortalidade cardiovascular e pulmonar com o uso de anestesia peridural em comparação com AG para esses procedimentos, embora as técnicas peridurais possam ser superiores para promover a sobrevida do enxerto.
Procedimentos geniturinários inferiores
O bloqueio peridural lombar como anestésico primário ou adjuvante ao AG é uma opção apropriada para uma variedade de procedimentos geniturinários. A anestesia peridural com nível sensorial T9-T10 pode ser usada para ressecção transuretral da próstata (RTU), embora a raquianestesia possa ser preferida devido à sua cobertura sacral melhorada, bloqueio sensorial mais denso e duração mais curta. Ambas as técnicas são consideradas superiores à AG por vários motivos, incluindo detecção precoce de alterações do estado mental associadas à síndrome de RTUP; a capacidade do paciente de comunicar a dor irruptiva se ocorrer uma complicação indesejada, como perfuração da cápsula prostática ou da bexiga; o potencial para diminuição do sangramento; e a diminuição dos riscos de eventos tromboembólicos perioperatórios e sobrecarga de líquidos (tabela 4). Além disso, os pacientes que se apresentam para esta e outras cirurgias de próstata geralmente são idosos, com múltiplas comorbidades e têm baixo risco para certas complicações do bloqueio neuroaxial, como cefaléia pós-punção da dura-máter (CPPD).
TABELA 4. Benefícios do bloqueio neuroaxial central versus anestesia geral para ressecção transuretral da próstata.
| Detecção precoce de alterações do estado mental |
| Detecção precoce de dor irruptiva (indicativa de perfuração capsular/bexiga) |
| Perda de sangue reduzida |
| Diminuição da incidência de trombose venosa profunda |
| Diminuição da incidência de sobrecarga circulatória |
| Melhor controle da dor pós-operatória |
Outros procedimentos transuretrais, como cistoscopia e extração de cálculo ureteral, podem ser realizados sob AG, anestesia tópica ou bloqueio neuroaxial, dependendo da extensão e complexidade do procedimento, comorbidades do paciente e preferência do paciente, anestesiologista e cirurgião. É importante notar que os pacientes paraplégicos e tetraplégicos compreendem um subconjunto de pacientes que se apresentam para cistoscopias repetidas e procedimentos de extração de cálculos; a anestesia neuroaxial é frequentemente preferida nesses pacientes devido ao risco de hiperreflexia autonômica (HA) (consulte a seção separada sobre este tópico).
Como esses procedimentos são realizados em regime ambulatorial, o bloqueio peridural residual prolongado deve ser evitado. Embora haja alguma variabilidade interindividual, um nível sensorial tão alto quanto T8 é necessário para procedimentos envolvendo os ureteres, enquanto um nível sensorial T9-T10 é apropriado para procedimentos envolvendo a bexiga.tabela 5).
TABELA 5. Nível sensorial necessário para procedimentos geniturinários.
| Procedimento | Nível Sensorial Necessário |
|---|---|
| Nefrectomia | Considerar anestesia geral-peridural combinada |
| Cistectomia | T4 |
| Litotripsia extracorpórea por ondas de choque | T6 |
| Prostatectomia aberta | T8 |
| Extração de cálculo ureteral | T8 |
| Cistoscopia | T9 |
| Ressecção transuretral da próstata | T9 |
| Cirurgia envolvendo testículos | T10 |
| Cirurgia envolvendo pênis | L1 |
| Procedimentos uretrais | Bloco sacral |
Cirurgias ginecológicas vaginais
Várias cirurgias ginecológicas vaginais podem ser realizadas com bloqueio peridural, embora raquianestesia única ou GA e, em alguns casos, bloqueio de nervo paracervical ou anestesia tópica possam ser mais apropriados.tabela 6). Uma dilatação e curetagem (D&C) pode ser realizada sob bloqueio do nervo paracervical, GA ou bloqueio neuroaxial.
TABELA 6. Procedimentos ginecológicos vaginais adequados para bloqueio peridural.
| Dilatação e curetagem |
| Histeroscopia (com ou sem meios de distensão) |
| Procedimentos para incontinência urinária |
| Histerectomia |
Se a anestesia neuroaxial for selecionada, um nível sensorial T10 é apropriado. Embora a histeroscopia diagnóstica ambulatorial possa ser realizada sob AL, a histeroscopia com meios de distensão normalmente requer anestesia geral ou neuraxial.
A anestesia peridural pode ter a desvantagem de aumentar a absorção de glicina em relação ao GA. No entanto, as alterações do estado mental relacionadas à absorção da solução de irrigação hipotônica são mais facilmente detectadas em pacientes acordados. Para procedimentos de incontinência urinária, a anestesia peridural oferece a vantagem de permitir que o paciente participe do teste de tosse intraoperatório, o que teoricamente diminui o risco de disfunção miccional pós-operatória, embora a incidência desse desfecho desagradável não pareça aumentar sob AG. Um nível sensorial T10 fornece anestesia suficiente para procedimentos vesicais, mas o nível deve ser estendido para T4 se o peritônio for aberto. A histerectomia vaginal pode ser realizada sob anestesia geral ou neuraxial (mais comumente raquidiana). Um nível sensorial T4-T6 é apropriado para procedimentos uterinos.
Anestesia e Analgesia Peridural Torácica
Os benefícios e as indicações da anestesia peridural torácica (TEA) estão se expandindo.tabela 7). O TEA oferece analgesia perioperatória superior em comparação com opioides sistêmicos, diminui as complicações pulmonares pós-operatórias, diminui a duração do íleo pós-operatório e diminui a mortalidade em pacientes com fraturas múltiplas de costelas, entre outras coisas. Esta seção explora o papel do TEA como anestésico primário ou como adjuvante do AG para cirurgia cardíaca, torácica, abdominal, colorretal, geniturinária e ginecológica.Figura 1). Também revisa o papel em expansão do TEA para cirurgia torácica videoassistida (CTVA) e cirurgia laparoscópica.
TABELA 7. Benefícios da anestesia peridural torácica e analgesia.
| Melhor analgesia perioperatória em comparação com outros modalidades |
| Diminuição das complicações pulmonares pós-operatórias |
| Diminuição da duração do íleo pós-operatório |
| Diminuição da duração da ventilação mecânica |
| Diminuição da mortalidade em pacientes com fraturas de costela |
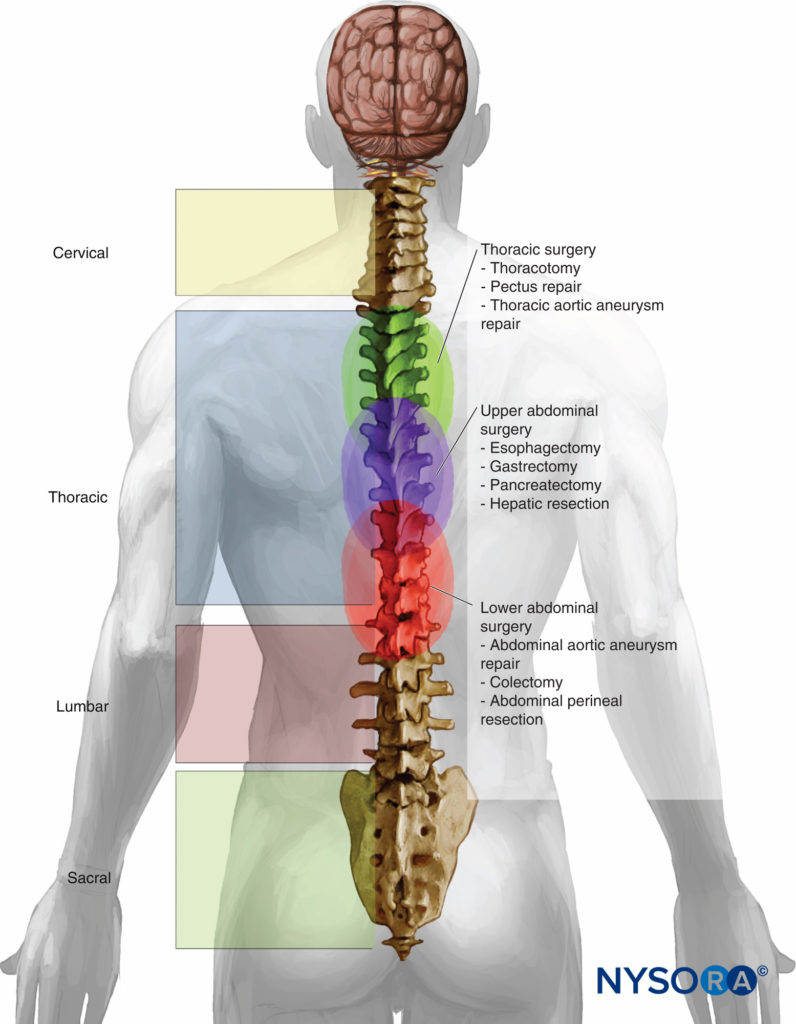
Figura 1. Nível de colocação em cirurgias realizadas com anestesia peridural torácica e analgesia.
Cirurgia cardíaca
TEA elevado (bloqueio dos cinco segmentos torácicos superiores) como adjuvante da AG em cirurgia cardíaca com circulação extracorpórea (CEC) ganhou interesse nas últimas décadas. Os benefícios pretendidos incluem melhor distribuição do fluxo sanguíneo coronariano, redução da demanda de oxigênio, melhora da função ventricular esquerda regional, redução da incidência de arritmias supraventriculares, atenuação da resposta ao estresse cirúrgico, melhor estabilidade hemodinâmica intraoperatória, recuperação mais rápida da consciência, melhor analgesia pós-operatória, e redução das complicações renais e pulmonares pós-operatórias.
Vários desses benefícios potenciais podem ser atribuídos ao bloqueio seletivo da inervação simpática cardíaca (os segmentos espinhais T1-T4). No entanto, a inserção de um cateter peridural em pacientes que necessitam de heparinização total para CEC traz o risco de hematoma peridural.
A evidência em suporte de TEA elevado para cirurgia cardíaca não é conclusiva. Um estudo de Liu e colegas comparando TEA com AG tradicional à base de opióides para cirurgia de revascularização do miocárdio (RM) com CEC não encontrou diferença nas taxas de mortalidade ou infarto do miocárdio, mas demonstrou uma redução estatisticamente significativa no risco de arritmias cardíacas pós-operatórias e complicações pulmonares, melhora dos escores de dor e extubação traqueal precoce no grupo TEA. Em contraste, um ensaio clínico randomizado recente que comparou os efeitos clínicos de fast-track GA com TEA versus fast-track GA sozinho em mais de 600 pacientes submetidos a cirurgia cardíaca eletiva (tanto com bomba quanto sem bomba) não encontrou diferença estatisticamente significativa em 30 dias sobrevida livre de infarto do miocárdio, complicações pulmonares, insuficiência renal ou acidente vascular cerebral. O tempo de ventilação mecânica, tempo de permanência na unidade de terapia intensiva (UTI), tempo de internação hospitalar e qualidade de vida em 30 dias de seguimento também foram semelhantes para os dois grupos. No geral, o papel do TEA como adjuvante do AG para cirurgia cardíaca com CEC permanece controverso.
O papel do TEA elevado na cirurgia de revascularização do miocárdio sem CEC também é debatido na literatura. A TEA oferece as vantagens de evitar a intubação da traqueia em casos selecionados de CRM, extubação precoce em pacientes que receberam AG e redução da dor e morbidade pós-operatórias. Mas, permanecem as preocupações sobre a ventilação comprometida com um alto bloqueio sensorial, hipotensão devido à simpaticólise e hematoma epidural, apesar da dose de heparina muito reduzida em comparação com os casos de CEC. Um recente estudo prospectivo e controlado randomizado de mais de 200 pacientes submetidos à cirurgia OPCAB descobriu que a adição de alto TEA ao GA reduziu significativamente a incidência de arritmias pós-operatórias, melhorou o controle da dor e melhorou a qualidade da recuperação. Até que dados de resultados mais definitivos estejam disponíveis, o papel das técnicas neuraxiais na cirurgia OPCAB permanece incerto.
Procedimentos Cirúrgicos Torácicos e Abdominais Superiores
Anestesia e analgesia epidural são comumente usadas para cirurgia abdominal alta e torácica, incluindo gastrectomia, esofagectomia, lobectomia e procedimentos de aorta torácica descendente.tabela 8).
TABELA 8. Indicações para anestesia peridural torácica e analgesia.
| Região anatômica | Procedimento |
|---|---|
| Tórax | Toracotomia |
| Reparação de pectus |
|
| Correção de aneurisma torácico |
|
| Timectomia |
|
| Cirurgia torácica videoassistida | |
| Abdome superior | Esofagectomia |
| Gastrectomia |
|
| Pancreatectomia |
|
| Colecistectomia |
|
| Ressecção hepática | |
| Inferior do abdome | Correção de aneurisma de aorta abdominal |
| Colectomia |
|
| Ressecção intestinal |
|
| Ressecção perineal abdominal | |
| Urogenital/ ginecológico | Cistectomia |
| Nefrectomia |
|
| Reparo ureteral |
|
| Prostatectomia Radical Abdominal |
|
| Debulking do tumor ovariano |
|
| Exenteração pélvica |
|
| Histerectomia abdominal total |
É menos comumente usado para VATS, a menos que a conversão para um procedimento aberto seja altamente antecipada ou se o paciente estiver em alto risco de complicações da AG. O bloqueio peridural para muitos desses procedimentos comumente serve como adjuvante da AG e como componente essencial do controle da dor pós-operatória. A administração concomitante de TEA alto com AG, no entanto, traz riscos de bradicardia intraoperatória, hipotensão e alterações na resistência das vias aéreas. Há algum debate sobre se a ativação intraoperatória do bloqueio epidural é necessária para avaliar os benefícios analgésicos do TEA ou se a ativação pós-operatória produz benefícios equivalentes. Uma revisão sistemática de Møiniche e colegas descobriu que o momento de vários tipos de analgesia, incluindo epidurais, opióides intravenosos e ALs periféricos, não influenciou a qualidade do controle da dor pós-operatória.
A anestesia peridural torácica iniciada na região torácica média a alta também pode ser usada para procedimentos mamários. Os benefícios podem incluir analgesia pós-operatória superior, diminuição da incidência de náuseas e vômitos pós-operatórios (NVPO), maior satisfação do paciente e evitar a intubação traqueal em pacientes com comorbidades moderadas a graves. O nível sensorial necessário depende do procedimento: Um nível que se estende de T1 a T7 é adequado para aumento de mama; C5–T7 é necessário para mastectomia radical modificada; e C5-L1 é necessário para mastectomia com reconstrução com retalho miocutâneo do músculo reto do abdome (TRAM) (tabela 9). O cateter peridural pode ser introduzido em T2-T4 para obter bloqueio segmentar dos dermátomos torácicos para a maioria dos procedimentos de mama; a colocação em T8–T10 é apropriada para a reconstrução do retalho TRAM.
TABELA 9. Nível sensorial necessário para procedimentos mamários.
| Cirurgia | Segmento quadra |
|---|---|
| Mastectomia radical modificada | C5–T7 |
| Mastectomia com reto transverso retalho abdominal | C5–L1 |
| mastectomia parcial; aumento de mama | T1 – T7 |
O bloqueio peridural fornece um adjuvante útil ao AG para procedimentos dentro da cavidade torácica, como cirurgia pulmonar e esofágica. Os benefícios do TEA para esses procedimentos incluem maior analgesia pós-operatória; redução da morbidade pulmonar (por exemplo, atelectasia, pneumonia e hipoxemia); resolução rápida do íleo pós-operatório; e diminuição do catabolismo pós-operatório, que pode poupar massa muscular. O bloqueio epidural segmentar de T1-T10 fornece bloqueio sensorial da incisão da toracotomia e do local de inserção do dreno torácico.
As cirurgias do abdome superior que podem ser realizadas com anestesia peridural e analgesia incluem esofagectomia, gastrectomia, pancreatectomia, ressecção hepática e colecistectomia. Colecistectomia laparoscópica com bloqueio peridural30 e gastrectomia distal com anestesia geral e peridural combinada também foram relatadas. A colocação de cateter peridural médio-torácico com bloqueio segmentar estendendo-se de T5 (T4 para cirurgia laparoscópica) a T8 é apropriado para a maioria dos procedimentos abdominais superiores e, devido à preservação das raízes nervosas lombares e sacrais, tem risco mínimo de déficits motores dos membros inferiores, retenção urinária, hipotensão, e outras sequelas da anestesia peridural lombar.
Procedimentos Vasculares Suprainguinais
A peridural médio-torácica pode ser usada como adjuvante à AG para cirurgias da aorta abdominal e seus principais ramos. O bloqueio peridural para bypass aortofemoral, bypass da artéria renal e reparo de aneurismas da aorta abdominal pode fornecer controle superior da dor pós-operatória, facilitar a extubação precoce da traqueia, permitir a deambulação precoce e diminuir o risco de eventos tromboembólicos em pacientes com risco particularmente alto de essa complicação desagradável. No entanto, o bloqueio peridural intraoperatório pode complicar o manejo das alterações hemodinâmicas associadas ao pinçamento e despinçamento da aorta, bem como comprometer a avaliação precoce da função motora no pós-operatório imediato. Um nível sensorial de T6 a T12 é necessário para uma incisão abdominal extensa; um nível que se estende de T4 a T12 é necessário para atingir a desnervação das vísceras.
Litotripsia Extracorpórea por Ondas de Choque, Prostatectomia, Cistectomia, Nefrectomia
A litotripsia extracorpórea por ondas de choque (LECO) com ou sem imersão em água pode ser realizada sob anestesia geral ou neuroaxial. Um nível sensorial T6-T12 é necessário quando as técnicas neuroaxiais são selecionadas. O bloqueio peridural está associado a menos hipotensão intraoperatória do que a raquianestesia de injeção única, embora ambas as técnicas sirvam para evitar AG em pacientes potencialmente de alto risco.
A cirurgia aberta da próstata, a cistectomia radical e derivação urinária e a nefrectomia simples, parcial e radical podem ser realizadas sob bloqueio do neuroeixo, isoladamente ou em combinação com AG, dependendo do procedimento. Algumas vantagens potenciais do neuroeixo em comparação com o GA para prostatectomia retropúbica radical incluem diminuição da perda sanguínea intraoperatória e transfusões, diminuição da incidência de eventos tromboembólicos pós-operatórios, melhora da analgesia e nível de atividade até 9 semanas de pós-operatório, retorno mais rápido da função intestinal e vários outros ainda -vantagens contestadas da anestesia neuraxial, como menor tempo de alta hospitalar e redução de custos hospitalares. Para o procedimento aberto, os pacientes podem necessitar de sedação generosa na ausência de uma técnica combinada neuroaxial geral. É necessário nível sensitivo T6, com colocação de cateter na região médio-torácica. A cistectomia radical é realizada em pacientes com câncer de bexiga invasivo e pode ter melhores resultados com um anestésico geral-epidural combinado em comparação com AG isolado.
O bloqueio peridural pode proporcionar hipotensão controlada no intraoperatório, contribuindo para a diminuição da perda sanguínea e otimizando o alívio da dor pós-operatória. Uma epidural médio-torácica com nível sensorial T6 é apropriada. Embora a AG seja frequentemente necessária para nefrectomia radical devido a preocupações com o posicionamento do paciente, hipotensão intraoperatória e potencial para perda significativa de sangue intraoperatória, a analgesia epidural proporciona alívio da dor pós-operatória mais eficaz do que os opioides sistêmicos, evitando os efeitos adversos do último.
Várias outras cirurgias relacionadas à urologia podem ser realizadas com bloqueio neuroaxial como único anestésico ou como adjuvante ao AG. O uso de uma técnica combinada de GA-peridural em pacientes com tumores adrenais funcionais submetidos à adrenalectomia laparoscópica é seguro e eficaz e pode ter o benefício adicional de minimizar as flutuações nos níveis hormonais. É importante notar, no entanto, que o bloqueio epidural pode não diminuir os efeitos pressores da estimulação direta do tumor. O uso de anestesia peridural para biópsia laparoscópica retroperitoneal para pacientes que não são candidatos à biópsia percutânea também foi relatado.
Cirurgias Abdominais Inferiores e Ginecológicas
A histerectomia abdominal total é frequentemente realizada sob AG, uma anestesia geral e epidural combinada ou anestesia neuraxial com ou sem sedação. Embora ainda não seja rotina, a laparoscopia ginecológica é cada vez mais realizada sob anestesia neuraxial, comumente com diminuição da inclinação de Trendelenburg, pressões de insuflação de CO2 reduzidas (abaixo de 15 mm Hg) e opioides suplementares ou anti-inflamatórios não esteroides (AINEs) para minimizar a dor referida no ombro. O bloqueio peridural para procedimentos abertos tem as vantagens de proporcionar analgesia pós-operatória prolongada, diminuir a incidência de NVPO e eventos tromboembólicos perioperatórios e influenciar potencialmente a função imune perioperatória e, de forma relacionada, a recorrência de câncer em pacientes submetidas à histerectomia por câncer ovariano ou relacionado. O efeito de analgesia preemptiva proposto pelo bloqueio neuroaxial durante a histerectomia abdominal requer mais investigação. Um nível sensorial que se estende até T4 ou T6 fornece anestesia suficiente para procedimentos envolvendo o útero. A inserção de cateter peridural na região lombar com altos volumes de ALs para aumentar o nível sensorial ou a colocação de baixo a médio torácico é apropriada. A dor visceral associada à manipulação intestinal e peritoneal diminui à medida que o nível do bloqueio é aumentado; um nível T3-T4 pode ser ótimo.
Colectomia aberta e laparoscópica, sigmoidectomia e apendicectomia estão entre outras cirurgias do abdome inferior que podem ser realizadas sob anestesia neuroaxial, com ou sem AG. De particular interesse em pacientes submetidos à cirurgia intestinal, o bloqueio peridural torácico diminui a duração do íleo pós-operatório, possivelmente sem afetar a cicatrização e vazamento anastomótico. A analgesia pós-operatória superior associada a infusões peridural contínuas, com ou sem opioides, provavelmente melhora a função pulmonar pós-operatória em pacientes submetidos à cirurgia gastrointestinal (GI), embora não tenham sido realizados ensaios clínicos randomizados específicos. Em combinação com alimentação e deambulação precoces, o TEA desempenha um papel na alta hospitalar precoce após certas cirurgias gastrointestinais. Um resultado semelhante foi demonstrado após a ressecção colônica laparoscópica, seguida de analgesia epidural por 2 dias e nutrição oral precoce e mobilização (ou seja, reabilitação multimodal). A colocação de cateter peridural entre T9 e T11 geralmente é apropriada para procedimentos abdominais inferiores; um bloqueio sensorial que se estende até T7 ou T9 é necessário para a maioria das cirurgias colônicas (ressecção de sigmóide, ileotransversostomia, hemicolectomia).
Distúrbios Médicos Incomuns e Cenários Clínicos
Anestesia e analgesia peridural também podem ser indicadas no manejo perioperatório de pacientes com condições médicas específicas ou doenças coexistentes, como miastenia gravis (MG), HA, hipertermia maligna (HM), DPOC, feocromocitoma (ver discussão anterior) e sepsia. Vários outros subgrupos de pacientes podem se beneficiar de técnicas de cateter peridural contínuo, incluindo pacientes em cuidados paliativos, parturientes com comorbidades e pacientes em risco de malignidade recorrente.
Miastenia grave
Pacientes com MG apresentam desafios particulares aos anestesiologistas, incluindo respostas anormais a agentes bloqueadores neuromusculares despolarizantes e não despolarizantes; potencial dificuldade em reverter o bloqueio neuromuscular residual em pacientes em uso de inibidores da colinesterase; necessidade de ventilação mecânica pós-operatória prolongada; risco de insuficiência respiratória pós-cirúrgica; e preocupações com o manejo da dor pós-operatória. O bloqueio epidural elimina a necessidade de relaxantes musculares intraoperatórios em pacientes miastênicos e proporciona alívio da dor pós-operatória superior em comparação com opioides, minimizando o risco de depressão respiratória induzida por opioides e disfunção pulmonar. Devido à possibilidade de que o metabolismo do éster AL possa ser prolongado em pacientes em uso de inibidores da colinesterase, os AL amida podem ser preferidos para o tratamento de pacientes miastênicos. Doses reduzidas de ALs também podem ser apropriadas. A preocupação com o comprometimento da função respiratória de um paciente miastênico com uma peridural alta parece ser infundada.
Hiperreflexia Autonômica
As técnicas epidurais são adequadas para o manejo perioperatório de pacientes com HA. A HA ocorre em até 85% dos pacientes com lesões na medula espinhal em T4-T7 ou acima como resultado da atividade simpática desinibida. Em resposta à estimulação visceral ou cutânea abaixo do nível da lesão e na ausência de inibição central descendente, os pacientes podem desenvolver hiperatividade simpática aguda e extrema. Geralmente, ocorre vasoconstrição intensa abaixo do nível da lesão medular, com vasodilatação acima. Os pacientes podem apresentar sudorese, náusea, rubor, palidez, calafrios, obstrução nasal, visão turva, dor de cabeça, dificuldade para respirar, convulsões e arritmias cardíacas. A bradicardia reflexa é vista na maioria dos casos. A hipertensão grave com risco de vida pode resultar em hemorragia intracraniana, isquemia miocárdica, edema pulmonar e morte. O bloqueio peridural como único anestésico, como suplemento ao AG ou para analgesia de parto atenua as perturbações fisiológicas associadas à HA, embora o bloqueio nervoso incompleto de segmentos sacrais ou segmentos perdidos possa contribuir para uma alta taxa de falha. A raquianestesia, cujo nervo bloqueia o ramo aferente desse reflexo potencialmente letal, e a AG profunda previnem de forma mais confiável a HA.
Hipertermia maligna
O manejo anestésico da HM apresenta um desafio para o anestesiologista. A HM é uma síndrome clínica de metabolismo marcadamente acelerado, desencadeada principalmente por agentes voláteis e pelo agente despolarizante succinilcolina. Pacientes suscetíveis podem desenvolver febre, taquicardia, hipercapnia, taquipneia, arritmias, hipoxemia, sudorese profusa, hipertensão, mioglobinúria, acidose mista e rigidez muscular em resposta à exposição a agentes voláteis ou succinilcolina, embora tenham sido relatados casos em que não há evidência agente desencadeante. As complicações tardias podem incluir coagulopatia de consumo, insuficiência renal aguda, necrose muscular, edema pulmonar e sequelas neurológicas. Evitar a exposição a agentes desencadeantes é uma pedra angular no manejo de pacientes suscetíveis à HM.
Sempre que adequado, são recomendados bloqueios de nervos neuroaxiais locais, periféricos ou centrais, pois essas técnicas são relatadas como mais seguras do que o uso de AG. Tanto os AL de éster quanto de amida são considerados seguros em pacientes suscetíveis à HM, assim como a epinefrina, embora ainda haja controvérsia na literatura.
Doença de obstrução pulmonar crônica
O bloqueio peridural é uma opção anestésica razoável para pacientes com DPOC submetidos a cirurgias de grande porte devido a preocupações com ventilação mecânica prolongada. No entanto, se as técnicas epidurais reduzem as complicações pulmonares em pacientes com DPOC Não é conhecido. Em uma recente análise controlada por propensão de mais de 500 pacientes com DPOC submetidos à cirurgia abdominal, a analgesia peridural como adjuvante à AG foi associada a uma redução estatisticamente significativa no risco de pneumonia pós-operatória. Pacientes com o tipo mais grave de DPOC se beneficiaram desproporcionalmente. O estudo também encontrou um efeito benéfico não significativo da analgesia peridural na mortalidade em 30 dias, tendência que foi demonstrada em outros estudos.
Cirurgia Pediátrica
Existe uma considerável quantidade de literatura dedicada ao uso de anestesia regional para cirurgia pediátrica, tanto em regime de internação quanto ambulatorial. As vantagens do bloqueio neuroaxial para a população pediátrica incluem analgesia pós-operatória ideal, que é particularmente importante no reparo de escoliose extensa, reparo de pectus excavatum e procedimentos abdominais e torácicos maiores; requisitos reduzidos de AG; despertar precoce; e alta precoce no ambulatório. Certos subgrupos de pacientes pediátricos, como aqueles com fibrose cística, história familiar de HM ou história de prematuridade, também se beneficiam do uso de anestesia neuroaxial em vez de AG. No entanto, a recusa dos pais, a preocupação com a realização de bloqueios nervosos regionais em pacientes anestesiados e as preocupações com as vias aéreas em pacientes com reservas limitadas de oxigênio representam desafios para o uso rotineiro de bloqueio neuroaxial nessa população de pacientes.
A abordagem caudal única do espaço peridural, com ou sem sedação, é comumente usada em pacientes pediátricos para uma variedade de cirurgias, incluindo circuncisão, correção de hipospádia, herniorrafia inguinal e orquidopexia.
Cateteres caudais contínuos podem ser avançados cefálicos a níveis vertebrais mais elevados e usados como único anestésico ou como adjuvante ao AG. A anestesia lombar e o TEA proporcionam um bloqueio sensorial mais confiável em níveis segmentares mais altos em crianças mais velhas. Ver "Anestesia Regional em Pacientes Pediátricos: Considerações Gerais” para uma discussão mais detalhada dos bloqueios do nervo caudal e Anestesia caudal.
Cirurgia Ambulatorial
A raquianestesia ou bloqueios de nervos periféricos são preferíveis às técnicas peridurais para a maioria dos cenários clínicos no ambiente ambulatorial devido a preocupações com o início relativamente lento do bloqueio epidural, retenção urinária, imobilidade prolongada, CPPD e alta tardia. O uso de ALs de ação curta, quando apropriado, pode evitar essas preocupações. As técnicas epidurais têm as vantagens de permitir a titulação lenta dos ALs, a capacidade de adaptar a altura e a duração do bloqueio nervoso ao procedimento cirúrgico e uma diminuição do risco de sintomas neurológicos transitórios (SNT) quando comparados com a raquianestesia. Artroplastia total de quadril, artroscopia de joelho, cirurgia de pé, herniorrafia inguinal, laparoscopia pélvica e procedimentos anorretais estão entre as muitas cirurgias ambulatoriais que podem ser realizadas com bloqueio neuroaxial como anestésico primário. Para obter informações sobre bloqueio regional no ambiente ambulatorial, consulte: Bloqueios de Nervos Periféricos para Cirurgia Ambulatorial.
Analgesia e Anestesia do Trabalho de Parto
As parturientes constituem o maior grupo isolado a receber analgesia epidural. Para o alívio adequado da dor durante a primeira fase do trabalho de parto, é necessária a cobertura dos dermátomos de T10 a L1; a analgesia deve se estender caudalmente até S2-S4 (para incluir o nervo pudendo) durante o segundo estágio do trabalho de parto. A colocação epidural no interespaço L3-L4 é mais comum em pacientes em trabalho de parto.
No entanto, os pontos de referência anatômicos de superfície podem ser difíceis de apreciar em pacientes obstétricas e podem não identificar de forma confiável o interespaço pretendido neste subgrupo de pacientes devido à rotação anterior da pelve e à lordose lombar exagerada. Vários outros fatores podem afetar a facilidade de colocação peridural e disseminação de ALs administrados por via peridural em parturientes, incluindo ingurgitamento de veias peridural, níveis hormonais elevados e ganho de peso excessivo. Referir-se "Anestesia Regional Obstétrica” para obter informações adicionais sobre técnicas epidurais em pacientes em trabalho de parto.
Gerais
Surgiram várias aplicações não anestésicas para procedimentos epidurais. As técnicas de infusão de cateter peridural estão sendo cada vez mais utilizadas para o controle da dor no final da vida em crianças e adultos, incluindo aqueles com dor relacionada ao câncer. Há também um interesse crescente em saber se a anestesia peridural e a analgesia podem ter um papel protetor na sepse. De particular interesse é se os pacientes criticamente enfermos podem se beneficiar do aumento da perfusão e oxigenação dos órgãos esplâncnicos, bem como da imunomodulação, observada em pacientes saudáveis que receberam anestesia peridural. No entanto, estudos adicionais são necessários para avaliar o risco e os benefícios das técnicas peridurais na sepse. Outra nova aplicação para LAs peridurais propõe que infusões contínuas podem melhorar o fluxo sanguíneo placentário em parturientes com perfusão uterina cronicamente comprometida e restrição de crescimento intrauterino.
Há um crescente corpo de literatura dedicada aos potenciais efeitos benéficos da analgesia epidural em pacientes com câncer, embora os dados sejam preliminares e às vezes contraditórios. O estresse cirúrgico e certos agentes anestésicos suprimem a função imunológica do hospedeiro, incluindo sua capacidade de eliminar células tumorais circulantes, e podem predispor os pacientes com câncer a infecções pós-operatórias, crescimento tumoral e metástases. Estudos recentes demonstraram melhora da função imune perioperatória com o uso de TEA em pacientes submetidas a histerectomia radical laparoscópica eletiva para câncer de colo do útero. Os adjuvantes regionais da anestesia também demonstraram ter efeitos benéficos contra a recorrência de câncer de mama e próstata. Esses efeitos protetores podem refletir tanto a diminuição das necessidades de opióides quanto a redução da resposta ao estresse neuro-humoral associada ao bloqueio epidural.
CONTRAINDICAÇÕES
Complicações graves das técnicas epidurais são raras. No entanto, hematomas epidurais, abscessos epidurais, lesão nervosa permanente, infecção e colapso cardiovascular, entre outros eventos adversos, têm sido atribuídos ao bloqueio neuroaxial. Como resultado, uma compreensão das condições que podem predispor certas populações de pacientes a essas e outras complicações é essencial. Esta seção revisa as contraindicações absolutas, relativas e controversas para a colocação epidural (tabela 10). Em última análise, uma análise de risco-benefício com ênfase particular nas comorbidades do paciente, anatomia das vias aéreas, preferências do paciente e tipo e duração da cirurgia é recomendada antes do início do bloqueio peridural.
TABELA 10. Contra-indicações ao bloqueio peridural.
| absoluto | Recusa do paciente |
| Anormalidades graves de coagulação (por exemplo, coagulação intravascular disseminada franca) |
|
| Relativo e controverso | Sepsia |
| Pressão intracraniana elevada |
|
| Anticoagulantes |
|
| Trombocitopenia |
|
| Outras diáteses hemorrágicas |
|
| Nervo central preexistente distúrbios do sistema (por exemplo, esclerose múltipla) |
|
| Febre/infecção (por exemplo, vírus varicela zoster) |
|
| Estados dependentes de pré-carga (por exemplo, estenose aórtica) |
|
| Cirurgia anterior nas costas, lesão neurológica preexistente, dor nas costas |
|
| Colocação em adultos anestesiados |
|
| Colocação de agulha através de tatuagem |
Contra-indicações absolutas
Embora as contraindicações ao bloqueio peridural tenham sido classificadas historicamente como absolutas, relativas e controversas, as opiniões sobre as contraindicações absolutas evoluíram com os avanços nos equipamentos, técnicas e experiência do profissional. Atualmente, a recusa do paciente pode ser considerada a única contraindicação absoluta ao bloqueio peridural. Embora a coagulopatia seja considerada uma contraindicação relativa, é contraindicado iniciar o bloqueio neuroaxial na presença de anormalidades graves de coagulação, como coagulação intravascular disseminada (CIVD) franca. A maioria das outras condições patológicas compreende contraindicações relativas ou controversas e requer uma análise cuidadosa do risco-benefício antes do início do bloqueio peridural.
Contra-indicações Relativas e Controversas
Sepsia
Há um interesse crescente no uso de anestesia e analgesia peridural para modular as respostas inflamatórias e para prevenir ou tratar isquemia miocárdica, disfunção respiratória e isquemia esplâncnica em pacientes sépticos. No entanto, não há evidências suficientes para determinar se o bloqueio peridural é prejudicial ou protetor na sepse. Apesar dos potenciais benefícios das técnicas regionais neste cenário, muitos anestesiologistas podem relutar em iniciar o bloqueio peridural em pacientes sépticos devido a preocupações com hipovolemia relativa, hipotensão refratária, coagulopatia e a introdução de patógenos transmitidos pelo sangue no espaço epidural ou subaracnóideo. Se a anestesia regional for selecionada, uma técnica de dosagem de início lento após ou com administração concomitante de antibiótico, fluido intravenoso e vasopressor pode ser viável.
Aumento da Pressão Intracraniana
A punção dural acidental (ADP) no contexto de pressão intracraniana (PIC) elevada com evidência radiológica de fluxo obstruído do líquido cefalorraquidiano (LCR) ou efeito de massa com ou sem desvio da linha média pode colocar os pacientes em risco de hérnia cerebral e outra deterioração neurológica. Pacientes com PIC aumentada na linha de base também podem apresentar um aumento adicional na pressão na injeção peridural do medicamento. A consulta com um especialista em neurologia é fortemente recomendada, e a localização de sinais e sintomas neurológicos deve ser descartada pela história e exame físico antes do início do bloqueio neuroaxial em pacientes com novos sintomas neurológicos ou lesões intracranianas conhecidas.tabela 11). Uma árvore de decisão pode ajudar a avaliar se é seguro prosseguir com técnicas neuroaxiais na presença de lesões ocupantes de espaço intracraniano.Figura 2).
TABELA 11. Sinais e sintomas de pressão intracraniana elevada.
| Dor de cabeça |
| sonolência |
| Nausea e vomito |
| Convulsões de início recente |
| Diminuição do nível de consciência |
| Papiledema |
| Alterações pupilares |
| Sinais neurológicos focais |
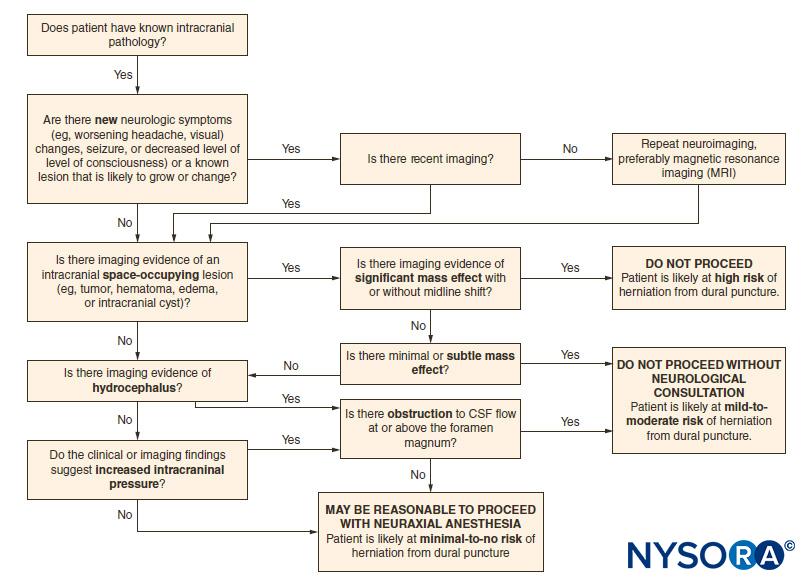
Figura 2. Algoritmo de segurança para bloqueio neuroaxial em pacientes com lesões ocupantes de espaço intracraniano. LCR = líquido cefalorraquidiano. (Reproduzido com permissão de Leffert LR, Schwamm LH: Anestesia neuroaxial em parturientes com patologia intracraniana: uma revisão abrangente e reavaliação de risco. Anestesiologia. 2013 Sep;119(3):703-718.)
Coagulopatia
A coagulopatia é uma contraindicação relativa à colocação epidural, embora seja necessária uma análise minuciosa da etiologia e gravidade da coagulopatia caso a caso. Os anticoagulantes aumentam o risco de hematoma epidural e devem ser suspensos em tempo hábil antes do início do bloqueio epidural. Precauções também devem ser tomadas antes da remoção do cateter peridural, pois a remoção do cateter pode ser tão traumática quanto a colocação do cateter.
Dicas NYSORA
• A colocação de agulha e cateter peridural acarreta risco de hematoma peridural em pacientes em uso de anticoagulantes. Precauções semelhantes devem ser observadas durante a colocação e remoção de cateteres peridurais.
A Sociedade Americana de Anestesia Regional e Medicina da Dor atualiza periodicamente suas diretrizes para o início da anestesia regional em pacientes que recebem terapia antitrombótica ou trombolítica. Resumidamente, as técnicas neuroaxiais em pacientes que recebem heparina não fracionada subcutânea (HNF) com regimes de dosagem de 5000 U a cada 12 horas são consideradas seguras.tabela 12).
TABELA 12. Bloqueio peridural em pacientes recebendo terapia antitrombótica.
| AINEs (aspirina) | Sem contraindicação |
| Clopidogrel | Aguarde 7 dias antes da colocação epidural |
| 5000 U de HNF subcutânea a cada 12 horas | Sem contraindicação |
| >10,000 U de HNF subcutânea diariamente | Segurança não estabelecida |
| heparina intravenosa | Aguardar pelo menos 60 minutos após a instrumentação antes da administração de heparina; considerar aPTT e esperar 2 a 4 horas antes da remoção do cateter |
| Dose tromboprofilática de LMWH | Aguarde 12 horas antes da colocação epidural |
| Dose terapêutica de LMWH | Aguarde 24 horas antes da colocação epidural |
| Varfarina | Aguarde a normalização do INR antes do bloqueio neuroaxial; remover cateter neuroaxial quando INR < 1.5 |
Os riscos e benefícios da HNF três vezes ao dia ou mais de 10,000 U por dia devem ser avaliados individualmente; vigilância deve ser mantida para detectar neurodéficits novos ou agravados neste cenário. Para pacientes recebendo heparina por mais de 4 dias, uma contagem de plaquetas deve ser avaliada antes do bloqueio do nervo neuroaxial ou da remoção do cateter devido a preocupações com trombocitopenia induzida por heparina (HIT). Em pacientes que recebem heparinização sistêmica, recomenda-se avaliar o tempo de tromboplastina plasmática ativada (TTPa) e descontinuar a heparina por 2 a 4 horas antes da manipulação ou remoção do cateter. A administração de heparina intravenosa no intraoperatório deve ser adiada por pelo menos 1 hora após a colocação epidural; não é necessário um atraso antes da administração de heparina subcutânea. Nos casos de heparinização total para CEC, precauções adicionais incluem adiar a cirurgia por 24 horas no caso de uma punção traumática, controlar rigidamente o efeito e a reversão da heparina e remover os cateteres quando a coagulação normal for restaurada.
O bloqueio epidural em pacientes em uso de aspirina e AINEs não aspirina é considerado seguro, pois o risco de hematoma epidural é baixo. A colocação da agulha deve ser adiada por 12 horas em pacientes recebendo tromboprofilaxia com heparina de baixo peso molecular (HBPM) e por 24 horas naqueles recebendo doses terapêuticas. Recomenda-se que a varfarina seja descontinuada por vários dias antes da cirurgia e que a razão normalizada internacional (INR) retorne à linha de base antes do início das técnicas epidurais. Um INR abaixo de 1.5 é considerado suficiente para a remoção do cateter, embora muitos médicos possam se sentir à vontade para manipular cateteres com valores de INR mais altos. Consulte o Capítulo 52 para obter informações mais detalhadas sobre esses e mais novos agentes.
As técnicas neuroaxiais são contraindicadas no cenário de CIVD, o que pode complicar sepse, trauma, insuficiência hepática, descolamento de placenta, embolia de líquido amniótico e transfusão maciça, entre outros processos patológicos.tabela 13). Se a CIVD se desenvolver após a colocação epidural, o cateter deve ser removido assim que os parâmetros normais de coagulação forem restaurados.
TABELA 13. Condições associadas à coagulação intravascular disseminada.
| Sepsia |
| Trauma (lesão na cabeça, lesão extensa de tecidos moles, embolia gordurosa, hemorragia maciça) |
| Transfusão maciça |
| Malignidade (carcinoma pancreático, doença mieloproliferativa) |
| Periparto (embolia do líquido amniótico, descolamento prematuro da placenta, síndrome HELLP [hemólise, enzimas hepáticas elevadas e baixa contagem de plaquetas], placentação anormal) |
| Distúrbios vasculares (aneurisma da aorta, hemangioma gigante) |
| Distúrbios imunológicos (reação hemolítica transfusional, rejeição de transplante, reação alérgica grave) |
| Insuficiência hepática |
Trombocitopenia e outros distúrbios hemorrágicos comuns
A trombocitopenia, que pode ser causada por várias condições patológicas, é uma contraindicação relativa à anestesia neuraxial.
Embora atualmente não exista uma contagem de plaquetas universalmente aceita abaixo da qual a colocação epidural deva ser evitada, muitos médicos se sentem confortáveis com uma contagem de plaquetas acima de 70,000 mm3 na ausência de sangramento clínico. O ponto de corte pode ser maior ou menor, no entanto, dependendo da etiologia da trombocitopenia, do histórico de sangramento, da tendência do número de plaquetas, das características individuais do paciente (por exemplo, uma via aérea difícil conhecida ou suspeita) e da experiência do profissional e do nível de conforto. Em geral, a função plaquetária é normal em condições como trombocitopenia gestacional e púrpura trombocitopênica imune (PTI).
Dicas NYSORA
• A etiologia da trombocitopenia, o histórico de sangramento do paciente e a tendência da contagem de plaquetas devem ser levados em consideração ao determinar a segurança do início do bloqueio peridural em pacientes trombocitopênicos. Certas condições, como PTI e trombocitopenia gestacional, estão associadas ao funcionamento das plaquetas, apesar de uma baixa contagem de plaquetas.
Uma contagem de plaquetas abaixo de 50,000 mm3 no cenário de PTI pode responder a corticosteroides ou imunoglobulina intravenosa (IGIV), quando necessário. Defeitos plaquetários funcionais podem estar presentes em várias condições menos comuns, como síndrome HELLP (hemólise, enzimas hepáticas elevadas e baixa contagem de plaquetas); púrpura trombocitopênica trombótica (TTP); e síndrome hemolítico-urêmica (SHU). Outras condições como lúpus eritematoso sistêmico (LES), síndrome antifosfolípide, doença de von Willebrand tipo 2B (vWD), TIH e CID estão associadas a trombocitopenia de vários graus.tabela 14).
TABELA 14. Causas de trombocitopenia.
| auto-imune | Trombocitopênico idiopático púrpura |
| Trombocitopênico trombótico púrpura |
|
| Síndrome antifosfolipídica |
|
| Lúpus eritematoso sistêmico | |
| Periparto | Trombocitopenia gestacional |
| Pré-eclâmpsia (HELLP [hemólise, enzimas hepáticas elevadas e baixa contagem de plaquetas] síndrome) |
|
| doença de von Willebrand | Tipo 2B |
| Relacionado a drogas | Induzido por heparina trombocitopenia |
| Metildopa |
|
| Sulfametoxazol | |
| Linfoproliferativo distúrbios | |
| Hemolítico urêmico síndrome |
Não foi estabelecida uma contagem padrão de plaquetas para a remoção do cateter. Embora algumas fontes sugiram que 60,000 mm3 seja apropriado, a remoção do cateter sem sequelas adversas foi relatada em contagens abaixo desse ponto de corte. Se o número ou a função das plaquetas estiver prejudicado após a colocação de um cateter epidural, como no caso de CIVD intraoperatória, o cateter deve permanecer in situ até que a coagulopatia seja resolvida. Outras diáteses hemorrágicas comuns que constituem contraindicações relativas ao início do bloqueio peridural incluem hemofilia, vWD e distúrbios relacionados a anticoagulantes lúpicos e anticorpos anticardiolipina. A hemofilia A e B são doenças ligadas ao X caracterizadas por deficiências nos fatores VIII e IX, respectivamente. Embora faltem diretrizes específicas, os procedimentos neuroaxiais são considerados seguros em portadores da doença com níveis de fator normal e sem complicações hemorrágicas. Técnicas neuroaxiais têm sido realizadas sem sequelas adversas em pacientes homozigotos após terapia de reposição de fator uma vez que os níveis de fator e o TTPa se normalizem. Pacientes com anticoagulantes lúpicos e anticorpos anticardiolipina estão predispostos à agregação plaquetária, trombocitopenia e, devido às interações entre anticorpos e membranas plaquetárias, trombose. Como resultado, muitos desses pacientes são anticoagulados com heparina no período periparto ou perioperatório. Os níveis de heparina devem ser monitorados com um teste de heparina no sangue, tempo de trombina ou teste de coagulação ativada antes de realizar o bloqueio neuroaxial. É importante notar que o TTPa está elevado na linha de base nesses pacientes e provavelmente permanecerá elevado após a descontinuação da heparina devido a interações entre os anticorpos circulantes e os testes de coagulação.
A doença de Von Willebrand é o distúrbio hemorrágico hereditário mais comum. É caracterizada por uma deficiência quantitativa (tipo 1 e tipo 3) ou qualitativa (tipo 2) no fator de von Willebrand (vWF), uma glicoproteína plasmática que se liga e estabiliza o fator VIII e medeia a adesão plaquetária em locais de lesão vascular. A apresentação clínica da vWD varia: Pacientes com tipo 1, o tipo mais comum, apresentam sangramento mucocutâneo, hematomas fáceis e menorragia; pacientes com vWD tipo 2 podem apresentar sangramento moderado a grave e, no caso do tipo 2B, trombocitopenia; o tipo 3, que é raro, apresenta sangramento grave, incluindo hemartroses (tabela 15).
TABELA 15. Classificação da doença de von Willebrand.
| Formato | Distúrbio subjacente | Apresentação Clínica/Características |
|---|---|---|
| 1 | Quantidade deficiente de vWF | Sangramento mucocutâneo, epistaxe, hematomas fáceis, menorragia |
| 2A | Defeito na qualidade do vWF | Sangramento moderado |
| 2B | FvW anormal | Sangramento moderado; trombocitopenia; risco de trombose |
| 2M | Ligação anormal do vWF | Cru; sangramento significativo |
| 2N | Sítios de ligação do vWF inativos | Pode ver baixo fator VIII e níveis normais de vWF |
| 3 | Deficiência grave de vWF | Hemorragias graves, hemartroses, hematomas musculares |
Tanto as opções de tratamento quanto a decisão de prosseguir com o bloqueio neuroaxial também variam com as diferentes apresentações da doença. O tipo I responde à desmopressina (DDAVP), que promove a secreção de vWF armazenado das células endoteliais e resulta em um rápido aumento tanto no vWF plasmático quanto no fator VIII. Concentrados de fator VIII e crioprecipitado são opções de tratamento para vWD tipo 2 e tipo 3. Exames laboratoriais especializados podem ajudar a confirmar o diagnóstico e o tipo de vWD, mas não estão amplamente disponíveis; testes de coagulação padrão podem servir para descartar outros distúrbios hemorrágicos. Além de uma história e exame físico completos, colaboração com um hematologista e outros membros da equipe e uma revisão de quaisquer resultados laboratoriais pertinentes, uma análise de risco-benefício deve ser realizada antes do início de procedimentos epidural em pacientes com vWD.
Distúrbios Preexistentes do Sistema Nervoso Central
Historicamente, a administração de bloqueio neuroaxial tem sido contraindicada em pacientes com doença preexistente do sistema nervoso central (SNC), incluindo esclerose múltipla (EM), síndrome pós-pólio (SPP) e síndrome de Guillain-Barré (SGB). No caso da EM, os nervos desmielinizados foram considerados mais vulneráveis à neurotoxicidade induzida por LA. Um estudo inicial de Bader e colegas sugeriu uma associação entre a recidiva da EM e concentrações mais altas de AL peridural entre as parturientes, embora um estudo subsequente na mesma população de pacientes não tenha demonstrado um efeito adverso da anestesia peridural na taxa de recidiva ou na progressão da doença. Um estudo retrospectivo mais recente de Hebl e colegas não encontrou evidências de recidiva da EM após anestesia espinhal ou peridural em 35 pacientes, 18 dos quais receberam bloqueio peridural. Embora seja improvável que a anestesia e a analgesia peridural causem exacerbações da EM, faltam estudos definitivos sobre as propriedades farmacológicas dos ALs na EM, os regimes de dosagem ideais e se os ALs interagem diretamente com as lesões da EM. Até que mais dados estejam disponíveis, é razoável usar ALs de baixa concentração e realizar uma avaliação completa e documentação da gravidade da doença e do estado neurológico antes do início do bloqueio neuroaxial central em pacientes com EM. Esses pacientes também devem ser informados do possível agravamento dos sintomas, independentemente da técnica anestésica.
A decisão de realizar anestesia peridural em pacientes com SPP, a doença do neurônio motor mais prevalente na América do Norte, requer uma análise cuidadosa dos riscos e benefícios potenciais caso a caso. A SPP é uma manifestação tardia da infecção aguda da poliomielite que se apresenta com fadiga, dor nas articulações e atrofia muscular em grupos musculares previamente afetados. As técnicas epidurais nesta população de pacientes podem ser complicadas por punções difíceis relacionadas à anatomia anormal da coluna, potencial piora dos sintomas e fraqueza respiratória transitória. Alternativamente, o AG apresenta desafios relacionados à sensibilidade a relaxantes musculares e sedativos e riscos de comprometimento respiratório e aspiração. Embora os dados sejam limitados, não há evidências de que as técnicas epidurais contribuam para o agravamento dos sintomas neurológicos em pacientes com SPP.
Também faltam evidências ligando as técnicas epidurais à ativação ou recorrência do GBS. GBS apresenta fraqueza motora progressiva, paralisia ascendente e arreflexia, provavelmente atribuível a uma resposta inflamatória pós-infecção. Idade avançada no início e doença inicial grave estão entre os fatores de risco para disfunção neurológica prolongada. A anestesia peridural tem sido usada com sucesso em pacientes com SGB, mais comumente em pacientes obstétricas, embora respostas hemodinâmicas exageradas (hipotensão e bradicardia), disseminação de ALs acima do normal e piora dos sintomas neurológicos tenham sido relatadas. Como sempre, uma análise risco-benefício é necessária antes da realização do bloqueio peridural em pacientes com SGB, assim como a avaliação e documentação do exame neurológico do paciente e uma discussão completa dos riscos da anestesia. É razoável evitar técnicas regionais durante períodos de inflamação neuronal aguda.
Pacientes com espinha bífida também podem representar um desafio único para os anestesiologistas. A espinha bífida oculta ocorre quando o arco neural não fecha sem herniação das meninges ou tecidos neurais. É mais comumente limitado a uma vértebra, embora uma pequena porcentagem de indivíduos afetados tenha envolvimento de duas ou mais vértebras com anormalidades neurológicas associadas, anormalidades medulares subjacentes e escoliose. Em geral, o uso de técnicas peridurais não é contraindicado em pacientes com espinha bífida oculta, embora a colocação no nível da lesão oculta, mais comumente em L5 a S1, possa ter um risco aumentado de punção dural e desigual ou maior que resposta normal aos LAs. Em contraste, a colocação epidural em pacientes com espinha bífida cística tem vários riscos potenciais, incluindo risco de lesão direta da medula devido a um cone medular baixo, disseminação imprevisível ou maior do que o esperado de ALs e aumento do risco de punção dural .
Febre ou infecção
Existe controvérsia quanto à administração de anestesia neuroaxial em pacientes febris e em indivíduos infectados pelo vírus da imunodeficiência humana (HIV), vírus herpes simplex tipo 2 (HSV-2) e vírus varicela zoster (VZV). O uso de anestesia regional na presença de febre baixa de origem infecciosa é controverso devido à preocupação de disseminação do agente infeccioso para o espaço peridural ou subaracnóideo, com posterior meningite ou formação de abscesso peridural. Felizmente, as complicações infecciosas da anestesia regional são raras, e os estudos até o momento não conseguiram demonstrar uma relação causal entre procedimentos neuroaxiais, com ou sem punção dural, e complicações neurológicas subsequentes. Embora não existam diretrizes universais, os dados disponíveis sugerem que a febre não impede a administração segura de anestesia peridural e analgesia. O manejo anestésico de pacientes febris deve ser baseado em uma análise individual de risco-benefício. Independentemente de a anestesia geral ou regional ser escolhida, a antibioticoterapia deve ser concluída antes ou durante o início da anestesia. A adesão a técnicas assépticas rigorosas e monitoramento pós-procedimento para detectar e tratar quaisquer complicações são essenciais.
Historicamente, tem havido preocupações sobre a segurança de procedimentos neuroaxiais em indivíduos infectados pelo HIV devido tanto ao risco teórico de inoculação do vírus no SNC quanto à possibilidade de que as manifestações neurológicas do HIV possam ser atribuídas à técnica anestésica. No entanto, o SNC é infectado precocemente no curso da infecção pelo HIV, e não há evidências de que a instrumentação neuroaxial, incluindo um remendo de sangue peridural (EBP) para o tratamento da CPPD, confira risco adicional de disseminação viral para o SNC. Também não há evidências de que a introdução de sangue infectado pelo HIV no LCR possa exacerbar uma infecção preexistente do SNC, como a meningite. As preocupações de que as sequelas neurológicas do HIV possam ser atribuídas à técnica neuroaxial também parecem infundadas, pois é improvável uma relação temporal entre a colocação epidural e o início dos déficits neurológicos. No entanto, recomenda-se a documentação completa de qualquer déficit neurológico preexistente, uma vez que as complicações neurológicas do HIV não são incomuns e que os indivíduos HIV positivos apresentam alto risco de outras doenças sexualmente transmissíveis que afetam o SNC. Os riscos potenciais devem ser discutidos com antecedência e, como sempre, uma técnica asséptica rigorosa para proteger tanto o paciente quanto o anestesista deve ser mantida.
As áreas de preocupação em relação ao uso de anestesia regional em pacientes com HSV-2 incluem o risco de introdução do vírus no SNC durante a administração de anestesia neuroaxial; a possibilidade de que uma infecção disseminada que se desenvolve após um anestésico regional possa ser atribuída ao próprio anestésico, apesar da falta de relação causal; e a segurança das técnicas neuroaxiais em surtos primários de HSV-2, que podem ser silenciosos e difíceis de distinguir de surtos secundários, mas mais comumente apresentam viremia, sintomas constitucionais, lesões genitais e, em uma pequena porcentagem de pacientes, meningite asséptica. Não há casos documentados de complicações sépticas ou neurológicas após procedimentos neuroaxiais em pacientes com infecção secundária (ou seja, recorrente) por HSV; entretanto, a segurança da anestesia regional em pacientes com infecção primária não foi estabelecida. Crosby e colegas conduziram uma análise retrospectiva de 6 anos de 89 pacientes com infecção secundária por HSV que receberam anestesia peridural para cesariana e relataram que nenhum paciente sofreu complicações sépticas ou neurológicas.
Da mesma forma, em seu levantamento retrospectivo de 164 parturientes com infecção secundária por HSV que receberam raquianestesia, peridural ou GA para cesariana, Bader et al não relataram resultados adversos relacionados ao anestésico. Com base nos achados nestas e em outras séries relatadas, parece seguro usar raquianestesia ou peridural em pacientes com infecção secundária por HSV. Na pendência de dados mais conclusivos, no entanto, parece prudente evitar o bloqueio neuroaxial em pacientes com viremia de HSV-2. Também existem preocupações em relação ao uso de anestesia regional em adultos com infecções primárias ou recorrentes por VZV, como herpes zoster (ou seja, zona) e neuralgia pós-herpética (NPH). No entanto, procedimentos neuroaxiais, incluindo injeções epidurais de esteróides, não são raramente usados para tratar herpes zoster agudo, prevenir NPH e tratar a dor associada à NPH, muitas vezes em conjunto com terapia antiviral. A presença de lesões ativas no local da injeção é considerada uma contraindicação a essas e outras técnicas do neuroeixo. Para o pequeno subgrupo de pacientes infectados com VZV primário quando adultos, podem ocorrer complicações graves, como meningite asséptica, encefalite e pneumonia por varicela. A realização de anestesia regional neste cenário é mais controversa, mas pode ser preferível à GA em alguns casos, principalmente devido a preocupações com pneumonia. Em última análise, uma análise cuidadosa do risco-benefício, além da avaliação e documentação de quaisquer déficits neurológicos preexistentes, é recomendada antes do início do bloqueio neuroaxial nesses pacientes.
Infecção cutânea localizada no local da punção com agulha pretendida é outra contraindicação relativa ao bloqueio do neuroeixo, principalmente devido a preocupações de que o abscesso epidural espinhal (ASE) ou meningite possa resultar. A disseminação hematogênica de uma infecção localizada tem sido implicada na SEA, embora uma relação causal não esteja claramente estabelecida nos casos relatados. A manutenção de precauções estéreis estritas e um baixo índice de suspeita na presença de sinais neurológicos podem minimizar o risco. A inserção da agulha deve ser tentada após a administração apropriada do antibiótico, e um local distante da infecção localizada é recomendado.
Cirurgia nas costas anterior, lesão neurológica preexistente e dor nas costas
Tradicionalmente, uma história de cirurgia anterior nas costas era considerada uma contraindicação relativa ao bloqueio do neuroeixo devido a preocupações com infecção, exacerbação de déficits neurológicos preexistentes e maior probabilidade de bloqueio nervoso difícil ou malsucedido. As dificuldades técnicas podem estar relacionadas a alterações degenerativas acima ou abaixo do nível de fusão, aderências no espaço peridural, obliteração do espaço peridural, tecido cicatricial denso no ponto de entrada da agulha na superfície da pele, presença de material de enxerto e presença de hastes extensas que impedem a identificação ou o acesso à linha média. Apesar dessas preocupações, um grande estudo retrospectivo de pacientes com história de estenose espinhal, neuropatia periférica ou radiculopatia lombar descobriu que a cirurgia espinhal prévia não afetou a taxa de sucesso ou a frequência de complicações técnicas. Em pacientes com hastes metálicas (por exemplo, hastes de Harrington), radiografias anteroposteriores e laterais ou uma cópia do relatório cirúrgico podem ajudar a identificar a extensão da instrumentação, bem como a presença de anormalidades anatômicas adicionais. A ultrassonografia pode auxiliar na identificação da linha média em casos epidurais desafiadores. Complicações potenciais, como disseminação craniana irregular, limitada ou excessiva de ALs e um risco aumentado de CPPD se forem necessárias várias tentativas de colocação, devem ser discutidas com o paciente durante o processo de consentimento informado. É importante notar que dificuldades técnicas semelhantes encontradas durante a técnica original podem ser esperadas durante um procedimento de EBP. Devido a essas e outras preocupações, a raquianestesia pode ser preferida, quando apropriado, ao bloqueio peridural.
A dor nas costas é um problema onipresente que não deve ser considerado uma contraindicação ao bloqueio neuraxial e, em vez disso, é uma indicação relativamente comum para injeções peridural de esteróides e AL. Um estudo recente encontrou uma taxa maior do que a relatada anteriormente de novos déficits neurológicos e piora de sintomas preexistentes em pacientes com radiculopatia compressiva ou múltiplos distúrbios neurológicos (estenose espinhal ou doença do disco lombar) que receberam anestesia neuraxial. No entanto, uma relação causal não foi claramente estabelecida. Muitas das preocupações em relação aos procedimentos neuraxiais em pacientes com dor nas costas podem ser abordadas antes do início da anestesia neuraxial com uma história e exame físico completos; não raramente, a causa da dor nas costas não é de origem neurológica. Nesses casos, as técnicas regionais não estão associadas a dor nas costas de início recente e é improvável que exacerbem a condição preexistente. Como os pacientes com condições neurológicas pré-existentes podem apresentar risco aumentado de complicações neurológicas pós-operatórias após técnicas neuraxiais, é necessária uma análise cuidadosa do risco-benefício caso a caso. Déficits ou sintomas neurológicos preexistentes e sua gravidade devem ser documentados.
Estados Dependentes de Pré-carga
Tradicionalmente, o bloqueio do neuroeixo tem sido considerado contraindicado em pacientes com estenose aórtica (EA) grave e outras condições dependentes da pré-carga, como cardiomiopatia obstrutiva hipertrófica (hipertrofia septal assimétrica, ASH), devido ao risco de descompensação aguda em resposta à diminuição da vascularização sistêmica. resistência (RV). Os estágios posteriores da EA estão associados à diminuição da complacência diastólica, relaxamento prejudicado, aumento da demanda miocárdica de oxigênio e diminuição da perfusão do endocárdio. A RVS diminuída no contexto de GA ou bloqueio neuroaxial leva à diminuição da perfusão e da contratilidade coronariana, com uma redução adicional do débito cardíaco (DC) e piora da hipotensão. Bradicardia, taquicardia e outras arritmias também são mal toleradas. As evidências atuais sobre anestesia regional em pacientes com EA são baseadas em relatos de casos e carecem da validade científica fornecida por ensaios clínicos randomizados. No entanto, parece que CSE cuidadosamente titulada e técnicas contínuas de epidural e espinhal, mais comumente com monitoramento invasivo, podem ser opções aceitáveis para pacientes com EA. Os anestésicos espinhais de injeção única são geralmente contraindicados, pois o início gradual do bloqueio simpático é essencial.
Os objetivos anestésicos para pacientes com EHA são semelhantes, com ênfase na manutenção da pré-carga, pós-carga, euvolemia e resistência vascular, evitando taquicardia e maior contratilidade. O monitoramento invasivo e, se necessário, a ecocardiografia transtorácica intermitente podem ajudar a orientar as necessidades de fluidos e vasopressores, bem como orientar o manejo em caso de descompensação aguda.
Colocação epidural em pacientes anestesiados
O início do bloqueio peridural em adultos sob AG é controverso devido a preocupações de que esses pacientes não possam responder à dor e, portanto, podem apresentar risco aumentado de complicações neurológicas. De fato, parestesias durante a realização do bloqueio nervoso e dor na injeção de AL foram identificadas como fatores de risco para déficits neurológicos graves após técnicas regionais. Consequentemente, alguns especialistas consideram a comunicação próxima com o paciente um componente essencial para a realização segura da epidural. Os dados atuais apoiam a prática de inserção epidural em pacientes acordados ou minimamente sedados, mas a colocação de agulha e cateter em adultos anestesiados pode ser uma alternativa aceitável em casos selecionados. Estudos de inserção peridural lombar durante a GA demonstraram que o risco de complicações neurológicas é pequeno. Em geral, o risco relativo da administração de bloqueio peridural em pacientes anestesiados, comparado com a colocação epidural em pacientes acordados, é desconhecido devido à baixa incidência geral de complicações neurológicas graves associadas à anestesia regional.
Inserção de agulha através de uma tatuagem
A preocupação de que a punção de uma tatuagem durante a colocação epidural possa ter sequelas adversas parece infundada na literatura. Os riscos teóricos estão relacionados principalmente à introdução de um pigmento potencialmente tóxico ou carcinogênico no espaço epidural, subdural ou subaracnóideo. No entanto, até o momento, nenhuma complicação significativa relacionada à inserção de uma agulha através de uma tatuagem foi relatada na literatura, embora possíveis consequências a longo prazo não possam ser descartadas.
ANATOMIA
A compreensão da anatomia da coluna vertebral, canal medular, espaço peridural e seu conteúdo e as variações anatômicas comumente encontradas entre os indivíduos é essencial para o início seguro e eficaz do bloqueio peridural. Uma imagem mental tridimensional da anatomia da coluna vertebral também auxilia na solução de problemas quando a identificação do espaço peridural é ambígua ou quando ocorrem complicações do cateterismo peridural, como bloqueio unilateral, canulação intravascular ou migração de cateter. Esta seção apresenta as considerações anatômicas básicas para anestesia e analgesia epidural bem-sucedidas e revisa várias controvérsias no campo da anatomia aplicada, incluindo a precisão dos pontos de referência anatômicos para estimar o nível do processo espinhoso, a existência (ou falta dela) de um compartimento subdural e o conteúdo do espaço peridural.
Coluna vertebral
Aparência geral
Sete vértebras cervicais, 12 torácicas, 5 lombares, 5 sacrais fundidas e 3 a 5 (mais comumente 4) vértebras coccígeas fundidas compreendem a coluna vertebral. A coluna vertebral é reta quando vista dorsal ou ventralmente. Quando vistas de lado, as regiões cervical e lombar são côncavas posteriormente (lordose), e as regiões torácica e sacral são côncavas anteriormente (cifose).Figura 3).
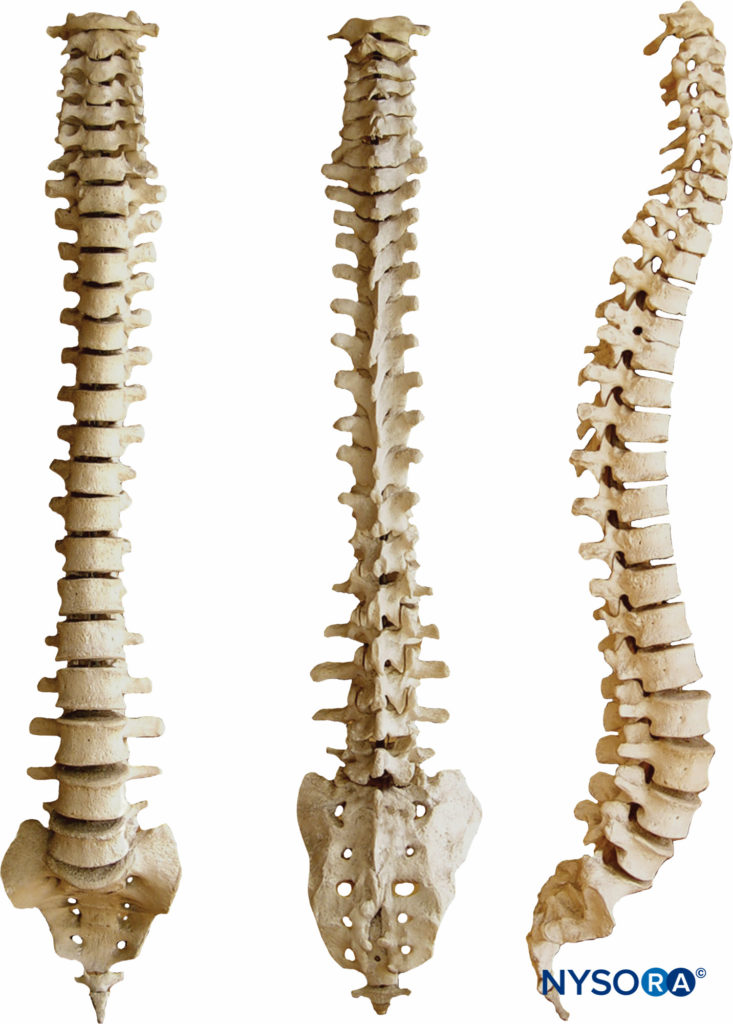
Figura 3. Curvas fisiológicas da coluna vertebral: vistas anterior, posterior e lateral (da esquerda para a direita).
As quatro curvas fisiológicas da coluna vertebral estão totalmente desenvolvidas aos 10 anos de idade e tornam-se mais pronunciadas durante a gravidez e com o envelhecimento. Na posição supina, C5 e L3 são posicionados nos pontos mais altos da lordose; os picos de cifose ocorrem em T5 a T7 e em S2.
Dicas NYSORA
C5 e L3 compreendem os pontos mais altos da lordose na posição supina; os pontos mais altos da cifose são T5 a T7 e S2.
Estrutura das vértebras
Com exceção de C1 e C2 e das regiões sacral e coccígea fundidas, a estrutura geral de cada vértebra consiste em um corpo vertebral anterior (corpo, centro) e um arco ósseo posterior. O arco é formado pelas lâminas; os pedículos, que se estendem das margens póstero-laterais do corpo vertebral; e a superfície posterior do próprio corpo vertebral. Além dos processos espinhosos, que são formados pela fusão das lâminas na linha média, o arco vertebral suporta três pares de processos que emergem do ponto de junção das lâminas e pedículos: dois processos transversos, dois processos articulares superiores e dois processos processos articulares inferiores. Os arcos vertebrais adjacentes envolvem o canal vertebral e circundam porções da medula espinhal longitudinal. O canal espinhal se comunica com o espaço paravertebral por meio de lacunas entre os pedículos de vértebras sucessivas. Esses forames intervertebrais servem como passagens para os nervos, artérias e veias segmentares.
Há variação substancial no tamanho e forma dos corpos vertebrais, dos processos espinhosos e do canal espinhal em diferentes níveis da coluna vertebral.Figura 4). C3 a C7 têm os corpos vertebrais menores, enquanto o canal medular neste nível é largo, medindo 25 mm. Essas vértebras cervicais, com exceção de C7, possuem processos espinhosos curtos e bifurcados. C7, a vértebra prominens, tem um processo espinhoso horizontal longo, delgado e facilmente palpável que se projeta na base do pescoço que muitas vezes serve como um ponto de referência da superfície durante procedimentos epidural. No entanto, o primeiro processo espinhoso torácico pode ser tão ou mais proeminente que C7 em até um terço dos indivíduos do sexo masculino, bem como em pacientes magros e em pacientes com escoliose e doenças degenerativas. As proeminências da vértebra também podem ser difíceis de distinguir de C6 em até metade dos indivíduos, mais comumente do sexo feminino.
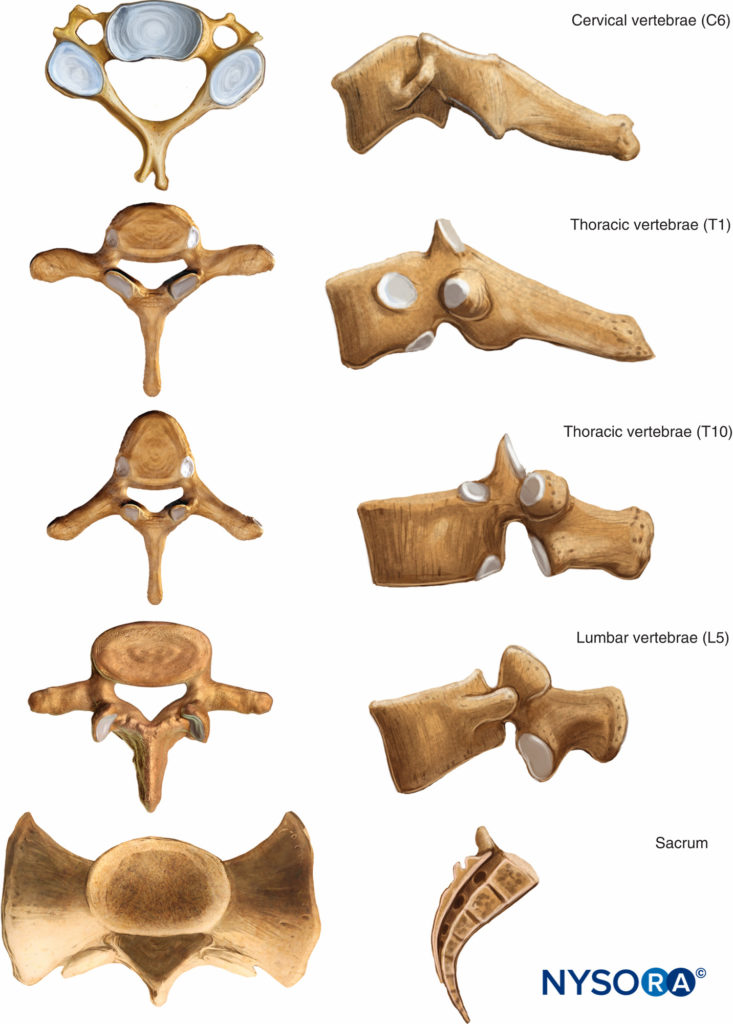
Figura 4. Tamanho e forma dos corpos vertebrais em diferentes níveis da coluna vertebral.
Os corpos vertebrais torácicos são maiores que os corpos vertebrais cervicais e são mais largos na dimensão posterior do que na anterior, contribuindo para a curvatura torácica característica. Os processos espinhosos torácicos longos e delgados, com pontas que apontam caudalmente, são mais angulados entre T4 e T9, dificultando a inserção da agulha peridural na linha média na região médio-torácica. Além de T10, eles se assemelham cada vez mais aos da região lombar. Cada vértebra torácica se articula com costelas ao longo da borda dorsolateral de seu corpo, uma característica que pode ajudar a distinguir as regiões torácica inferior e lombar superior. O ângulo inferior da escápula e a 12ª costela são amplamente utilizados na prática clínica para estimar o nível da cruz do processo espinhoso de L1.tabela 16).
TABELA 16. Marcos anatômicos para identificar os processos espinhosos de T7 e T12, respectivamente. A linha imaginária que conecta a margem mais caudal da 12ª costela é frequentemente presumida
níveis vertebrais.
| Vértebras proeminentes | C7 |
| Raiz da espinha da escápula | T3 |
| Ângulo inferior da escápula | T7 |
| Margem de costela | L1 |
| Aspecto superior do ilíaco crista | L3, L4 |
| Ilíaca Posterior Superior coluna | S2 |
As vértebras lombares são os maiores segmentos móveis, com dimensões anteriores mais espessas do que posteriores que contribuem para a curvatura lombar característica. Os processos espinhosos nesta região são rombos e grandes, com pontas que apontam posteriormente.
Variações anatômicas na região lombossacral que podem ter implicações clínicas não são incomuns. A sacralização da última vértebra lombar, marcada pela fusão de L5 ao osso sacro, e a lombarização de S1 e S2, em que a fusão é incompleta, podem dificultar a numeração e a identificação do nível lombar correto. Embora provavelmente não tenha significância clínica, pacientes com sacralização também têm uma posição mais alta do cone medular, que demarca o término em forma de cone da medula espinhal, do que aqueles com lombarização ou sem vértebras de transição lombossacrais. Na ausência dessas vértebras de transição, o interespaço maior e mais facilmente palpável corresponde a L5 a S1.
Marcos anatômicos de superfície para identificar o nível da coluna vertebral
Os pontos de referência da superfície são frequentemente usados para identificar o nível espinhal pretendido durante o início da anestesia epidural.Figura 5).
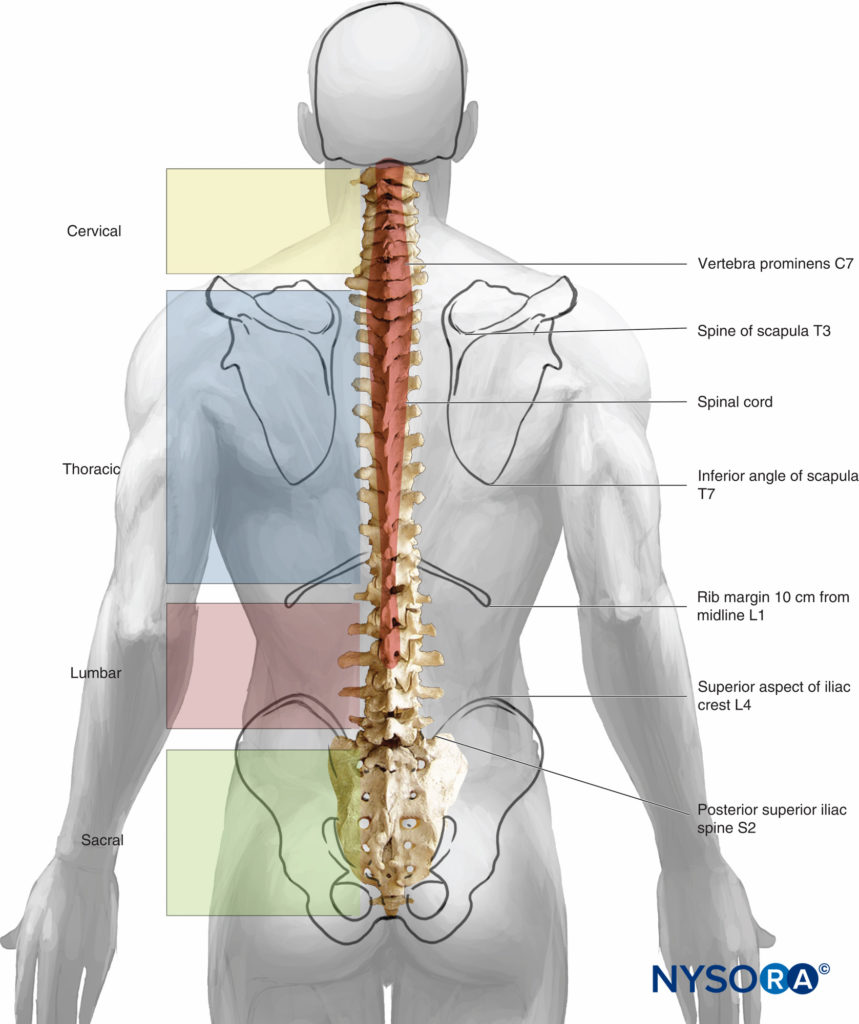
Figura 5. Marcos esqueléticos usados para determinar o nível de colocação epidural.
No entanto, a palpação e a inspeção dos marcos anatômicos da superfície podem não ajudar a localizar o espaço intervertebral correto, principalmente quando se consideram as variações individuais no nível vertebral desses marcos, a terminação variável do cone medular entre o terço médio de T12 e o terço superior de L3, e mau registro dos anestesiologistas na identificação do interespaço correto.
Armadilhas comuns no uso de pontos de referência esqueléticos para identificar o nível de punção incluem o seguinte: A vértebra proeminente é comumente confundida com C6 e T1; a escápula pode ser difícil de identificar durante a colocação do TEA em pacientes obesos; rastrear a vértebra ligada à 12ª costela pode ser enganoso, principalmente em pacientes obesos; e a linha que liga as espinhas ilíacas póstero-superiores, frequentemente usada para identificar S2, comumente cruza a linha média em níveis variáveis entre L5 e S1. Vários estudos demonstraram que a linha de Tuffier (também conhecida como linha de Jacoby ou linha intercristal), que une o aspecto superior das cristas ilíacas, pode cruzar a linha média em pelo menos um, e talvez dois, níveis acima do interespaço L4-L5 previsto, principalmente em gestantes, idosos e pacientes obesos. Os anestesiologistas têm um histórico ruim de estimar o interespaço correto com base em pontos de referência externos. Van Gessel e colegas descobriram que o nível de punção lombar é identificado erroneamente em até 59% das vezes. Em um estudo mais recente, Broadbent e colaboradores descobriram que os praticantes identificam o nível lombar correto em apenas 29% dos casos; o espaço é identificado erroneamente por dois níveis da coluna vertebral, sendo o nível real superior ao previsto, em 14% dos casos. Lirk et al confirmaram a tendência de anestesistas treinados de colocar a agulha peridural mais cranialmente do que o pretendido, na maioria das vezes dentro de um interespaço do nível previsto, também na coluna cervical e torácica. Em geral, dada a importância de selecionar o local correto da punção, recomenda-se cautela ao usar pontos anatômicos de superfície para identificar espaços intervertebrais. A crescente dependência da determinação ultrassonográfica do nível da coluna vertebral pode diminuir a incidência de complicações relacionadas à identificação errônea do interespaço pretendido.
Articulações e Ligamentos da Coluna Vertebral
Geral
As vértebras adjacentes das regiões cervical, torácica e lombar, excluindo C1 e C2, são separadas e amortecidas por discos intervertebrais fibrocartilaginosos. O núcleo macio e elástico de cada disco, o núcleo pulposo, é composto principalmente de água, bem como de fibras elásticas e reticulares espalhadas. A fibrose do anel fibrocartilaginoso circunda o núcleo pulposo e fixa os discos aos corpos das vértebras adjacentes. Os discos, que representam até um quarto do comprimento de uma coluna vertebral adulta, perdem seu teor de água à medida que envelhecemos, contribuindo para o encurtamento da coluna vertebral, reduzindo sua eficácia como almofadas e tornando-os mais propensos a lesões , principalmente na região lombar.
Os processos articulares surgem na junção entre os pedículos e as lâminas. Os processos articulares superior e inferior projetam-se cranial e caudalmente, respectivamente, em ambos os lados de cada vértebra. Os arcos vertebrais são conectados por articulações facetárias, que ligam os processos articulares inferiores de uma vértebra com os processos articulares superiores da vértebra mais caudal. As articulações facetárias são fortemente inervadas pelo ramo medial do ramo dorsal dos nervos espinhais. Essa inervação serve para direcionar a contração do músculo que movimenta a coluna vertebral.
Os ligamentos longitudinais
Os ligamentos longitudinais anterior e posterior sustentam a coluna vertebral, unindo os corpos vertebrais e os discos intervertebrais.Figura 6). O ligamento longitudinal posterior, que forma a parede anterior do canal vertebral, é menos largo que o anterior e enfraquece com a idade e outros processos degenerativos. Clinicamente, a hérnia de disco ocorre principalmente na porção paramediana do disco posterior, em pontos fracos do ligamento longitudinal posterior. Essa área compreende o espaço peridural anterior, em oposição ao espaço peridural posterior, mais clinicamente relevante, e não deve interferir na colocação da agulha peridural.
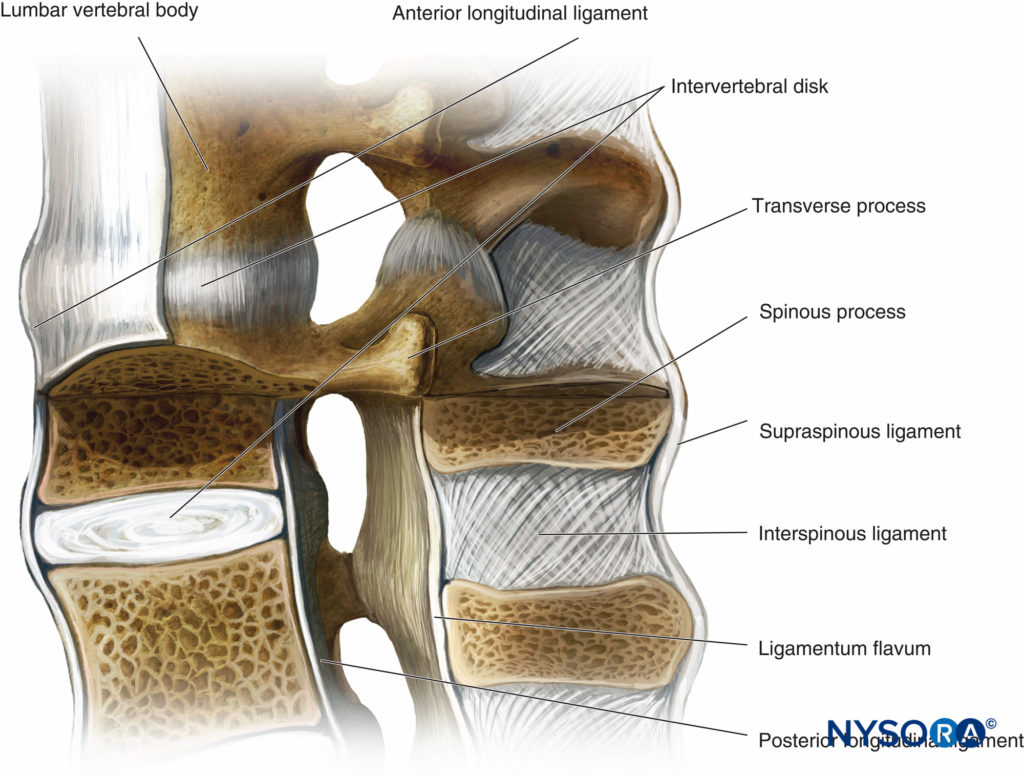
Figura 6 Ligamentos do canal vertebral.
Dicas NYSORA
• A hérnia de disco ocorre principalmente em pontos fracos no ligamento longitudinal posterior em uma área que compreende o espaço epidural anterior, em oposição ao espaço epidural posterior clinicamente mais relevante.
No entanto, a documentação completa da dor preexistente e déficits neurológicos em pacientes com hérnia de disco conhecida é recomendada antes do início da anestesia epidural. Também de relevância clínica, uma extensão lateral membranosa do ligamento longitudinal posterior pode servir como uma barreira para a disseminação de soluções epidurais e parece isolar as veias anteriores à dura, afastando-as do restante do espaço epidural.
Dicas NYSORA
• Uma extensão lateral membranosa do ligamento longitudinal posterior parece isolar as veias no espaço peridural anterolateral, onde a punção da veia peridural e a canulação do cateter são mais prováveis de ocorrer.
Ligamentos supraespinhosos e interespinhosos
Vários outros ligamentos que sustentam a coluna vertebral servem como marcos anatômicos chave durante a colocação da agulha peridural. O ligamento supraespinhoso conecta as pontas dos processos espinhosos de C7 a L5; acima de C7 e estendendo-se até a base do crânio, é chamado de ligamento da nuca. Este ligamento relativamente superficial e inextensível é mais proeminente na região torácica superior e torna-se mais fino e menos visível em direção à região lombar inferior. O ligamento interespinhoso, diretamente anterior ao ligamento supraespinhoso, atravessa o espaço entre os processos espinhosos adjacentes em direção póstero-craniana. É menos desenvolvido na região cervical, o que pode contribuir para uma falsa LOR durante procedimentos peridurais cervicais.
No exame histológico, o ligamento interespinhoso parece ter cavidades na linha média intermitentes preenchidas com gordura. Ambos os ligamentos supra e interespinhosos são compostos de fibras colágenas que produzem um som característico de “esmagamento” ou uma sensação tátil distinta à medida que a agulha peridural avança. Durante o início da colocação epidural através da abordagem da linha média, esses ligamentos servem como locais apropriados para engatar a agulha, embora alguns profissionais possam engatar a agulha mais perto do espaço epidural, no ligamento amarelo. Uma agulha epidural “flexível” que se inclina lateralmente antes da fixação da seringa LOR pode indicar uma abordagem fora da linha média, longe dos ligamentos supra ou interespinhosos.
O Flavum do Ligamento
O ligamento amarelo conecta a lâmina das vértebras adjacentes da margem inferior de C2 à margem superior de S1. Lateralmente, estende-se para o forame intervertebral, onde se une à cápsula do processo articular.
Anteriormente, limita o canal vertebral e forma a borda posterior do espaço epidural. Em cada nível espinhal, os ligamentos amarelos direito e esquerdo unem-se de forma descontínua em um ângulo agudo com a abertura orientada na direção ventral, ocasionalmente formando lacunas na linha média preenchidas com gordura epidural. Em contraste com os ligamentos colagenosos inter e supraespinhosos, o ligamento amarelo compreende principalmente fibras elásticas espessas dispostas longitudinalmente em uma rede apertada.
Áreas de ossificação do ligamento amarelo ocorrem em diferentes níveis do canal vertebral e parecem ser uma variante normal. Esses esporões ósseos, que podem contribuir para sintomas neurológicos preexistentes e potencialmente impedir o avanço da agulha peridural, são mais comumente encontrados na região torácica inferior, entre T9 e T11, e diminuem em frequência e tamanho nas direções caudal e cranial.
O ligamento amarelo apresenta características variáveis, muitas das quais são contestadas na literatura, em diferentes níveis vertebrais. Primeiro, sua espessura varia em diferentes níveis e, possivelmente, em diferentes estados fisiológicos, com uma faixa de 1.5 a 3.0 mm no segmento cervical, 3.0 a 5.0 mm no segmento torácico, 5.0 a 6.0 mm no segmento lombar e 2.0 mm. –6.0 mm na região caudal (tabela 17). Em pacientes grávidas isoladas, foi relatado que o ligamento amarelo é tão espesso quanto 10 mm, presumivelmente devido ao edema. Também digno de nota, a espessura do flavum varia dentro do próprio interespaço, sendo a região caudal significativamente mais espessa que a rostral.
TABELA 17. Espessura do ligamento amarelo em diferentes níveis vertebrais.
| Nível Vertebral | Espessura (mm) |
|---|---|
| Cervical | 1.5-3.0 |
| Thoracic | 3.0-5.0 |
| Lombar | 5.0-6.0 |
| Fluxo | 2.0-6.0 |
Dicas NYSORA
• O ligamento amarelo varia em espessura em diferentes níveis da coluna e é mais espesso na região lombar. Sua espessura também varia dentro de cada interespaço.
Clinicamente, esses graus variados de espessura podem influenciar o risco de punção dural inadvertida ou determinar se a injeção de uma solução anestésica no espaço epidural é possível com a agulha de infiltração da pele.
Outra controvérsia diz respeito à incidência e localização das lacunas formadas pela fusão incompleta dos ligamentos amarelos direito e esquerdo. Em seu estudo de 52 cadáveres humanos, Lirk e colegas descobriram que até 74% da flava na região cervical são descontínuas na linha média. Essas lacunas variam em localização, com algumas ocupando toda a altura do ligamento amarelo entre os sucessivos arcos vertebrais e outras ocupando apenas o terço caudal.Figura 7).
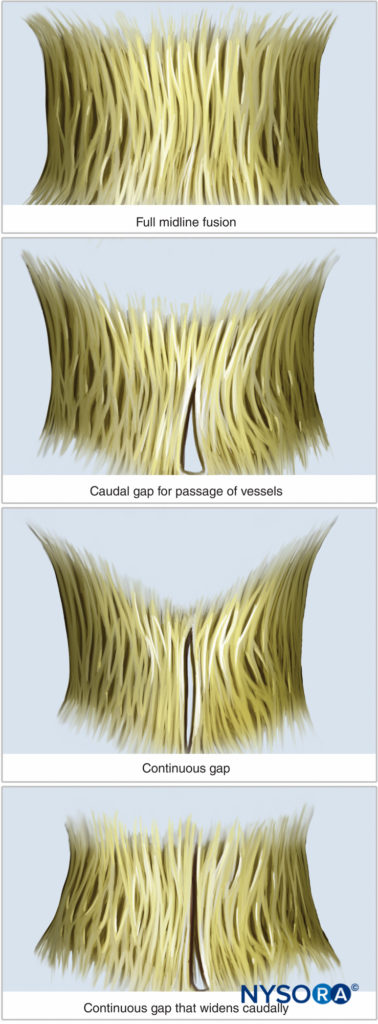
Figura 7. Ligamentum flavum com diferentes tipos de lacunas na linha média.
As veias que conectam os plexos venosos vertebrais externos e internos posteriores não raramente atravessam a porção caudal das lacunas. Em outro estudo em cadáveres, Lirk et al determinaram que os gaps da linha média torácica eram menos frequentes do que os gaps cervicais, mas mais frequentes do que os da região lombar, com incidência tão alta quanto 35.2% em T10 a T11. Em estudos em cadáveres do ligamento amarelo lombar, as lacunas foram encontradas mais comumente em L1 e L2 (22.2%) e diminuíram caudalmente (11.4% em L2 a L4; 9.3% em L4 a L5; 0% em L5 a S1). Clinicamente, essas lacunas podem contribuir para a falha na identificação do espaço peridural pela técnica LOR na linha média. O som característico “pop” e a sensação tátil conferida pela penetração das fibras elásticas do ligamento amarelo podem estar ausentes no contexto de um arco ligamentar descontínuo. A profundidade do espaço peridural na linha média também pode ser afetada.
Dicas NYSORA
• As lacunas da linha média do ligamento amarelo representam a fusão incompleta dos ligamentos amarelos direito e esquerdo. São comuns na coluna cervical e diminuem de frequência nas regiões torácica e lombar. A espessura variável do ligamento amarelo e a presença de falhas na linha média podem contribuir para a falha na identificação do espaço peridural.
O Canal Espinhal Geral
As vértebras servem principalmente para sustentar o peso da cabeça, pescoço e tronco; transferir esse peso para os membros inferiores; e proteger o conteúdo do canal espinhal, incluindo a medula espinhal. Uma extensão da medula oblonga, a medula espinhal serve como canal entre o SNC e os nervos periféricos através de 31 pares de nervos espinhais (8 cervicais, 12 torácicos, 5 lombares, 5 sacrais e 1 coccígeo).Figura 8). O cordão adulto mede aproximadamente 45 cm ou 18 polegadas e tem duas regiões de diâmetro alargado em C2-T2 e em T9-L2, áreas que correspondem à origem do suprimento nervoso para as extremidades superiores e inferiores. No entanto, seu nível de terminação varia com a idade, bem como entre indivíduos de faixas etárias semelhantes. Como resultado de uma discrepância no ritmo de crescimento da medula espinhal e da coluna vertebral durante o desenvolvimento, a medula espinhal ao nascer termina aproximadamente em L3. Aos 6-12 meses de idade, o nível de terminação é paralelo ao dos adultos, mais comumente na L1. Abaixo do cone medular, as raízes longas dorsais e ventrais de todos os nervos espinhais abaixo de L1 formam um feixe conhecido como cauda equina, ou cauda de cavalo. Uma coleção de fios de tecido fibroso livre de neurônios envoltos em pia-máter compreende o filum terminale e se estende da ponta inferior do cone medular até a segunda ou terceira vértebra sacral.
Figura 8. Coluna vertebral com nervos espinhais.
Nervos espinhais
Os nervos espinhais são classificados como nervos mistos porque contêm tanto um componente sensorial quanto um motor e, em muitos casos, fibras autonômicas. Cada nervo se forma a partir da fusão das raízes nervosas dorsais (sensoriais) e ventrais (somáticas e viscerais motoras) à medida que saem do canal vertebral distalmente aos gânglios da raiz dorsal, que contêm os corpos celulares dos neurônios sensoriais em ambos os lados da medula espinhal e situam-se entre os pedículos das vértebras adjacentes.
Em geral, as raízes dorsais são maiores e mais facilmente bloqueadas do que as ventrais, fenômeno que pode ser explicado em parte pela maior área de superfície para exposição aos ALs proporcionada pelas raízes dorsais agrupadas.
No nível cervical, o primeiro par de nervos espinhais sai entre o crânio e C1. Os nervos cervicais subsequentes continuam a sair acima da vértebra correspondente, assumindo o nome da vértebra imediatamente seguinte. Entretanto, ocorre uma transição entre a sétima vértebra cervical e a primeira torácica, onde sai um oitavo par de nervos cervicais; depois disso, os nervos espinhais saem abaixo da vértebra correspondente e recebem o nome da vértebra imediatamente acima.
Os nervos espinhais se dividem em ramos primários anterior e posterior logo após saírem do forame intervertebral. Os ramos anteriores (ventrais) suprem o lado ventrolateral do tronco, as estruturas da parede do corpo e os membros. Os ramos primários posteriores (dorsais) inervam regiões específicas da pele que se assemelham a faixas horizontais que se estendem da origem de cada par de nervos espinhais, chamados dermátomos, e os músculos das costas. Clinicamente, o conhecimento dos dermátomos é essencial no planejamento de anestésicos para regiões cutâneas específicas.Figura 9), embora a anestesia possa não ser conferida de forma confiável às vísceras subjacentes devido a uma inervação separada, e há uma sobreposição significativa na inervação do nervo espinhal de dermátomos adjacentes.tabela 18).
TABELA 18. Correlação de referência de superfície ao nível dermatomal.
| Nível do bloco | Marco anatômico |
|---|---|
| C6 | polegar |
| C8 | Quinto dedo |
| T1 | Aspecto interno do braço |
| T4 | Mamilo |
| T6 | Processo xifóide |
| T10 | Umbigo |
| T12 | Ligamento inguinal |
| S1 | Aspecto lateral do pé |
| S2-S4 | Períneo |
Existe uma relação intrincada entre os nervos espinhais e o sistema nervoso autônomo.Figura 10). As fibras nervosas simpáticas pré-ganglionares originam-se na medula espinhal de T1 a L2 e são bloqueadas em graus variados durante a anestesia peridural.
Eles saem da medula espinhal com os nervos espinhais e formam a cadeia simpática, que se estende por todo o comprimento da coluna vertebral nas faces anterolaterais dos corpos vertebrais. A cadeia dá origem ao gânglio estrelado, aos nervos esplâncnicos e ao plexo celíaco, entre outras coisas. Existem benefícios potenciais e desvantagens marcantes no bloqueio epidural do sistema nervoso simpático. O TEA parece aumentar a mobilidade GI bloqueando o suprimento simpático para os gânglios mesentéricos inferiores, reduzindo assim a incidência de íleo pós-operatório. A anestesia epidural também pode bloquear a resposta de estresse sistêmico à cirurgia, em parte pelo bloqueio do sistema nervoso simpático. No entanto, o bloqueio simpático torácico médio a baixo pode estar associado à dilatação dos leitos vasculares esplâncnicos, aumento acentuado da capacitância venosa, diminuição da pré-carga para o coração direito e muitos outros efeitos indesejáveis. quadra).
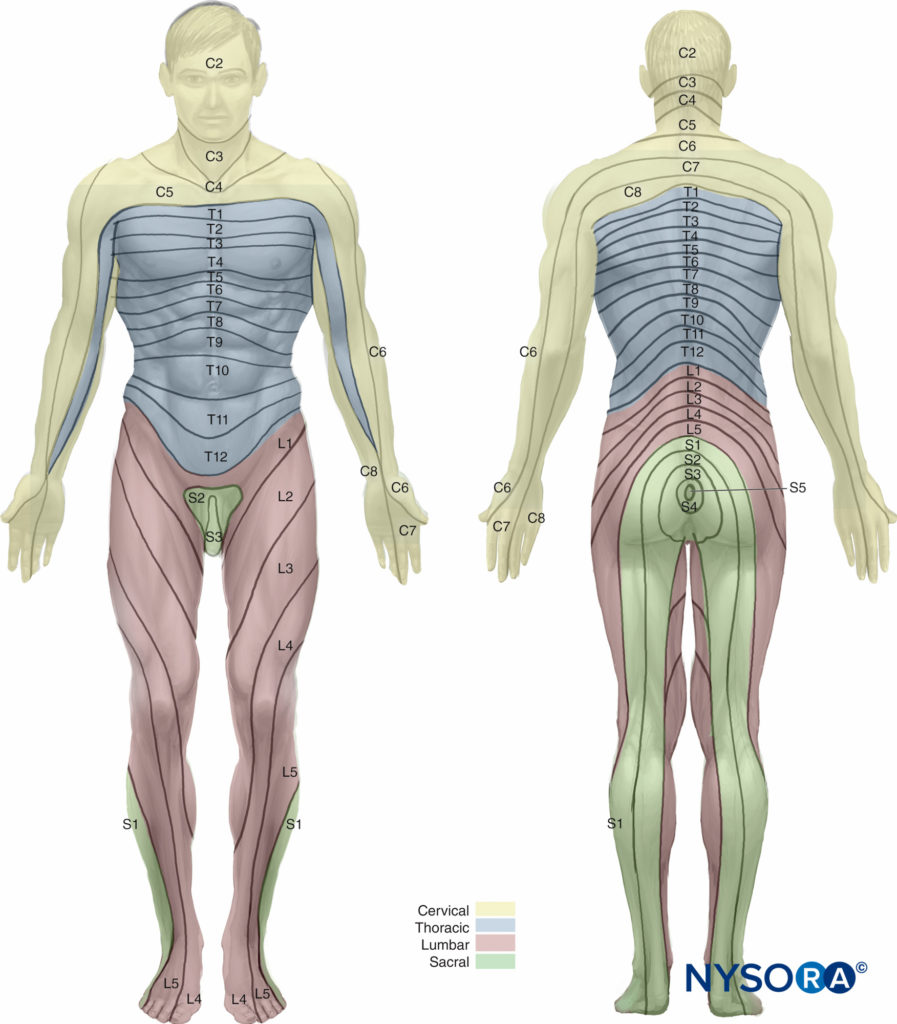
Figura 9. Distribuição de dermátomos.
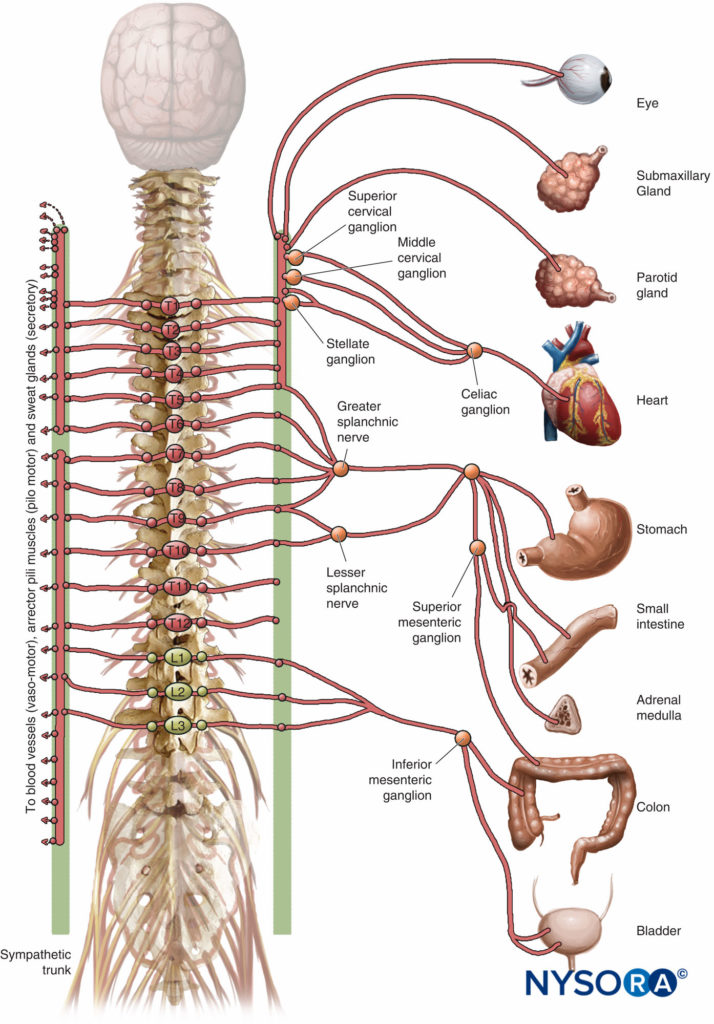
Figura 10. Sistema nervoso simpático.
Os componentes cranianos e sacrais compreendem o sistema nervoso parassimpático. O nervo vago, em particular, fornece inervação parassimpática a uma ampla área, incluindo cabeça, pescoço, órgãos torácicos e partes do trato digestivo. A inervação parassimpática da bexiga, do intestino grosso descendente e do reto se originam nos níveis S2 a S4 da medula espinhal.
Meninges espinhais
As meninges espinhais cobrem a medula e as raízes nervosas e são contínuas com as meninges cranianas que circundam e protegem o cérebro.Figura 11). A dura-máter, camada mais externa resistente, predominantemente colagenosa, envolve o SNC e fornece pontos localizados de fixação ao crânio, sacro e vértebras para ancorar a medula espinhal dentro do canal vertebral. Cranialmente, a dura-máter espinhal se funde com o periósteo no nível do forame magno; caudalmente, funde-se com elementos do filum terminale e contribui para a formação do ligamento coccígeo; lateralmente, a dura-máter circunda as raízes nervosas à medida que elas saem do forame intervertebral. A dura-máter toca o canal espinhal em áreas, mas não adere a ele, exceto em condições patológicas. Também confere permeabilidade e resistência mecânica ao saco dural, que termina em S1 a S2 em adultos e S3 a S4 em bebês. Os manguitos da raiz do nervo espinhal, que foram postulados para desempenhar um papel na captação de ALs administrados por via peridural, são projeções laterais tanto da dura-máter quanto da lâmina aracnóide subjacente.
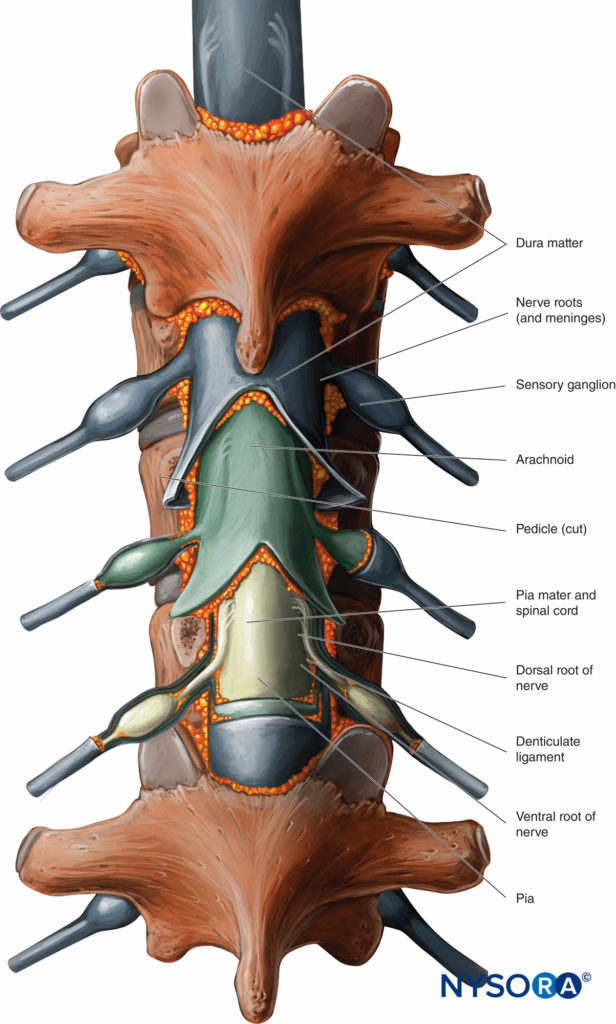
Figura 11. Meninges espinhais.
A aracnóide flexível, a camada meníngea média, está frouxamente aderida à face interna da dura-máter e envolve a medula espinhal e o LCR circundante dentro do espaço subaracnóideo. É composto por camadas de células semelhantes a epiteliais conectadas por junções apertadas e oclusivas, que conferem sua baixa permeabilidade.
As camadas de células da aracnóide são orientadas paralelamente ao longo eixo da medula espinhal (cefalocaudad), um achado que levou alguns pesquisadores a afirmar que a arquitetura da aracnóide, ao invés da dura-máter, explica a diferença na taxas de dor de cabeça entre inserções perpendiculares e paralelas de agulhas espinhais chanfradas. Em virtude de sua flexibilidade, a aracnóide pode “arrastar” e resistir à punção por uma agulha avançada durante o início da anestesia espinhal ou CSE. Um septo subaracnóideo descontínuo (septum posticum) que se estende da medula espinhal posterior até a aracnóide pode contribuir para a disseminação irregular de ALs no espaço subaracnóideo.
A camada meníngea mais interna, a pia-máter, reveste estreitamente a medula espinhal subjacente e seus vasos sanguíneos, bem como raízes nervosas e vasos sanguíneos no espaço subaracnóideo, e parece ter áreas fenestradas que podem influenciar a transferência de ALs durante os bloqueios do nervo subaracnóideo. . Caudalmente, a pia-máter continua
da ponta inferior do cone medular como o filum terminale e se funde no ligamento sacrococcígeo.
É possível que uma cavidade possa ser criada na interface aracnóide-dura que possa explicar bloqueios nervosos epidurais irregulares ou falhos com disseminação cefálica maior do que o esperado (os chamados bloqueios nervosos subdurais). Pesquisas iniciais sugeriram que o espaço extra-aracnóideo subdural compreendia um verdadeiro espaço potencial, com fluido seroso
que permitia o movimento das camadas dura e aracnóide uma ao lado da outra. Blomberg usou a espinaloscopia em estudos de cadáveres para demonstrar sua existência em até 66% dos humanos.
No entanto, evidências recentes sugerem que, ao contrário de um espaço potencial, essa interface aracnóide-dura é uma área propensa a estresse mecânico que se abre apenas após trauma direto, como injeção de ar ou fluido. Também é possível que essas fendas possam realmente ocorrer entre as camadas da aracnóide em vez de entre as células da borda dural na interface aracnóide-dura. Mais informações sobre meninges espinhais e estruturas relacionadas são detalhadas em “Anatomia Ultraestrutural das Meninges Espinhais e Estruturas Relacionadas".
Dicas NYSORA
Fissuras podem se formar na interface aracnóide-dura como resultado de estresse mecânico e trauma direto. A injeção de um grande volume de AL destinado ao espaço epidural nesta área pode resultar em bloqueio do nervo subdural.
Fornecimento de sangue
As artérias vertebrais e segmentares suprem a medula espinhal. Uma única artéria espinhal anterior e duas artérias espinhais posteriores, e seus ramos, originam-se das artérias vertebrais e suprem os dois terços anteriores da medula espinhal e o restante da medula, respectivamente.Figura 12). A artéria anterior é fina no nível médio-torácico da medula espinhal, uma área que também tem suprimento sanguíneo colateral limitado. As artérias segmentares, que emergem de ramos das artérias cervical e ilíaca, entre outras, se espalham por toda a extensão da medula espinhal e se anastomosam com as artérias anterior e posterior. A artéria de Adamkiewicz está entre as maiores artérias segmentares e é mais comumente unilateral, originando-se do lado esquerdo da aorta entre T8 e L1. Com relação ao sistema venoso, as veias espinhais anterior e posterior, que se anastomosam com o plexo vertebral interno no espaço peridural, drenam para as veias ázigos, hemiázigos, ilíacas internas, entre outras veias segmentares, via veias intervertebrais. O plexo venoso vertebral interno consiste em dois vasos longitudinais anteriores e dois posteriores com distribuição variável e postula-se que esteja envolvido na colocação de agulha e cateter peridural sangrento ou traumático.
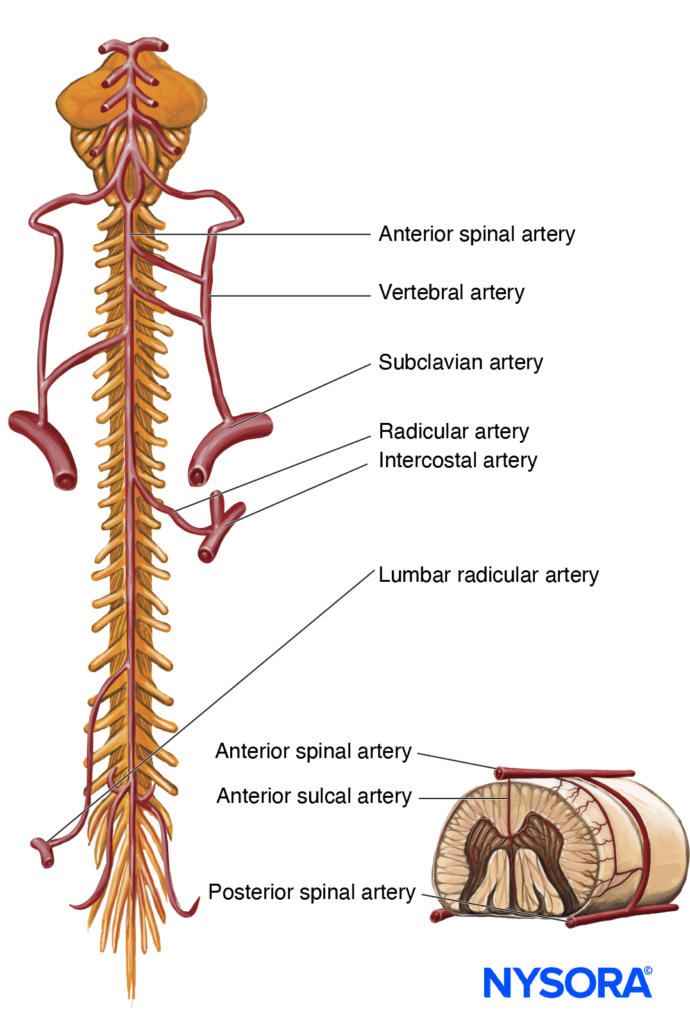
Figura 12. Suprimento sanguíneo da medula espinhal.
Espaço epidural
O espaço epidural circunda a dura-máter circunferencialmente e se estende desde o forame magno até o ligamento sacrococcígeo. O espaço é limitado posteriormente pelo ligamento amarelo, lateralmente pelos pedículos e forames intervertebrais e anteriormente pelo ligamento longitudinal posterior. Dos três compartimentos do espaço peridural (posterior, lateral e anterior), o espaço peridural posterior é o mais relevante clinicamente. O espaço epidural em geral contém tecido adiposo, vasos sanguíneos, raízes nervosas e tecido conjuntivo frouxo em uma distribuição não uniforme. As veias no espaço são contínuas com os vasos ilíacos na pelve e o sistema ázigos nas paredes do corpo abdominal e torácica. Como o plexo não tem válvulas, o sangue de qualquer um dos sistemas conectados pode fluir para os vasos epidurais.
Em contraste com o dogma tradicional, esses vasos estão localizados principalmente no espaço epidural anterior, onde são amplamente confinados pela extensão membranosa do ligamento longitudinal posterior106 (Figura 13). Esta área é provavelmente um local comum de punção de vasos sanguíneos por cateter peridural. Também de significância clínica, a pressão subatmosférica do espaço peridural diminui significativamente na região lombar, afetando potencialmente tanto a técnica de queda suspensa quanto a forma de onda da pressão peridural de identificação do espaço peridural.
O conteúdo do espaço peridural e suas implicações clínicas têm sido amplamente debatidos na literatura. A quantidade de tecido adiposo no espaço peridural parece afetar a disseminação do AL, mas ainda não está claro se a gordura peridural prolonga a duração do bloqueio nervoso servindo como reservatório ou diminui a quantidade de droga disponível, retardando assim o início ou ambos. Especula-se que a redução do tecido adiposo com a idade seja responsável, em parte, pelos níveis mais altos e início mais rápido da anestesia peridural em idosos.
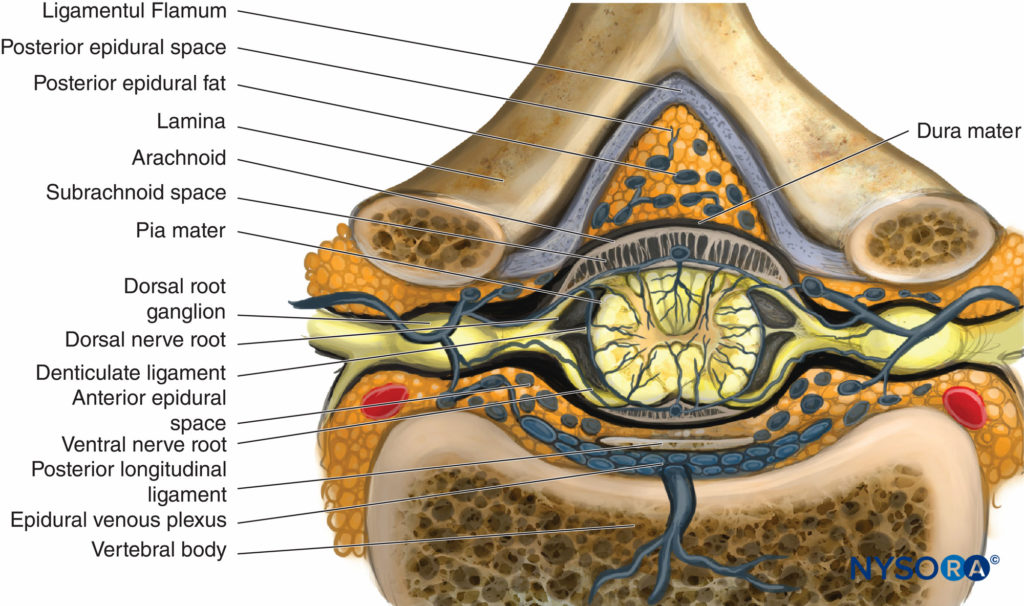
Figura 13. Distribuição da veia peridural na região lombar.
Da mesma forma, o aumento do tecido adiposo na região lombar inferior, onde o saco dural afunila, pode contribuir para os efeitos variáveis das injeções de AL abaixo de L4-L5. Finalmente, o tecido adiposo na fenda da linha média, onde o ligamento amarelo se funde, pode alterar a sensação tátil que normalmente é apreciada durante a técnica LOR.
Outra controvérsia anatômica do espaço peridural diz respeito se os septos, alternadamente descritos como fios esparsos e como uma membrana contínua que liga a dura-máter ao ligamento amarelo, obstruem o avanço do cateter, afetam a disseminação e o aparecimento de ALs e contribuem para bloqueios nervosos unilaterais e não intencionais. punções durais. No entanto, esses septos foram identificados mais recentemente como um artefato do coxim adiposo epidural posterior da linha média. Esses anexos gordurosos da linha média não parecem ter um efeito clinicamente significativo na disseminação dos ALs. Em vez disso, Hogan postulou que a distribuição da solução não é uniforme e direcionada entre os caminhos entre as estruturas no espaço epidural de acordo com as pressões diferenciais.
Distância da pele ao espaço epidural
A distância da pele ao espaço epidural varia em diferentes níveis da coluna vertebral. Na região cervical, Han e colegas descobriram que a profundidade média do espaço pele-peridural (através da abordagem da linha média) era mais rasa em C5 e C6 e aumentava na direção caudal. Fujinaka et al observaram que é difícil prever a profundidade real do espaço peridural cervical com base nas características clínicas. Em contraste, Aldrete e colaboradores, usando ressonância magnética (RM) para medir a profundidade da pele ao ligamento amarelo interno, notaram a maior profundidade nos níveis C6 a T1, com média de 5.7 cm, possivelmente devido a a presença de tecido adiposo (a chamada corcunda) na área. A profundidade do espaço na região médio-torácica a partir da linha média é influenciada principalmente pelo ângulo caudal agudo dos processos espinhosos. Como resultado do ângulo acentuado e impedimentos ósseos nesta região, a abordagem paramediana é frequentemente preferida para a colocação epidural médio-torácica. Vários estudos têm procurado medir a profundidade do espaço peridural ao nível lombar. Estudos de parturientes mostram uma faixa de profundidade da pele ao espaço de 2 a 9 cm, com 89% na faixa de 3.5 a 7.5 cm. Em sua busca por um modelo multivariado para prever a distância em uma população obstétrica, Segal e colegas confirmaram associações relatadas anteriormente entre aumento de peso e aumento de profundidade, bem como entre raça oriental e espaços mais rasos, sem associação independente entre raça e profundidade após o controle para peso. Em um estudo anterior, Sutton e Linter registraram que a pele ao espaço extradural em 3011 parturientes era de 4 a 6 cm em 76% das participantes do estudo. Pacientes com profundidade rasa de 2 a 4 cm, compreendendo 16% da população do estudo, apresentaram um risco três vezes maior de punção dural não intencional. É importante notar que a profundidade rasa está dentro da faixa de comprimento da agulha de infiltração do AL. Em geral, as estimativas da profundidade do espaço peridural não podem ser aplicadas à população em geral, como variáveis independentes, como grau de flexão, posicionamento do paciente, ondulações e edema na pele e tecido subcutâneo, ângulo de inserção da agulha, entre outras coisas, são difíceis de quantificar e controlar. Em um futuro próximo, a determinação de rotina por ultrassom da profundidade ao espaço individualmente antes ou durante a colocação da agulha epidural pode fornecer o meio mais confiável de diminuir o risco de punção dural inadvertida e outras complicações da anestesia epidural. A fluoroscopia é mais indicada na região cervical, onde lesão medular, raquianestesia total e injeção intra-arterial estão entre as possíveis complicações.
A profundidade variável do espaço peridural posterior é outra medida clinicamente relevante que pode influenciar na incidência de punção dural inadvertida. O espaço peridural posterior visto no plano sagital da linha média tem sido descrito como dente de serra, caracterizando sua forma segmentada. Embora os estudos sejam conflitantes, em cada nível segmentar, a profundidade do espaço peridural posterior parece mais rasa na extremidade caudal. Apesar dessas variações, a distância entre o ligamento amarelo e a dura é tipicamente estimada em 7 mm, com uma ampla faixa de 2 mm a 2.5 cm. Essa distância ântero-posterior é maior na região lombar, em L3-L4, diminui na região torácica e está ausente na região cervical.
EFEITOS FISIOLÓGICOS DO BLOQUEIO PERIDURAL
O bloqueio peridural proporciona anestesia cirúrgica, relaxamento muscular intraoperatório e alívio da dor intraparto e pós-operatória com amplos efeitos diretos e indiretos em vários sistemas fisiológicos. A extensão desses efeitos fisiológicos depende do nível de colocação e do número de segmentos da coluna bloqueados. Em geral, bloqueios do nervo peridural torácico alto (ou seja, acima de T5) e bloqueios do nervo peridural extenso estão associados a alterações fisiológicas mais profundas do que os bloqueios de nervo com níveis sensoriais baixos (ou seja, abaixo de T10). Esta seção revisa as alterações fisiológicas relacionadas à anestesia peridural e analgesia.
Bloco diferencial
O bloqueio diferencial ocorre quando as funções nervosas sensoriais, motoras e simpáticas são obnubiladas em diferentes taxas e em diferentes graus. Pode ser observado tanto no início quanto na regressão do bloqueio nervoso. Em geral, o bloqueio simpático, que não é incomumente incompleto, estende-se de dois a seis dermátomos acima do bloqueio sensitivo, que por sua vez é mais alto do que o bloqueio motor. O bloqueio sensorial também ocorre com menor concentração ou dose total de AL e se desenvolve mais rapidamente que o bloqueio motor. Entre as funções sensoriais, a temperatura é bloqueada primeiro, seguida pela picada de alfinete e, por fim, pelo toque.
Embora o mecanismo do bloqueio diferencial não tenha sido totalmente elucidado, pode ser atribuído às características anatômicas dos nervos bloqueados (por exemplo, diâmetro e presença ou ausência de mielina), ao comprimento do tecido nervoso bloqueado (é necessário um comprimento mínimo de nervo bloqueado para bloqueio neuronal eficaz), diferenças na composição da membrana lipídica do nervo e do canal iônico, atividade axonal concomitante durante o início do bloqueio do nervo e tipo e concentração de AL. Esses e vários outros mecanismos podem contribuir coletivamente para o bloqueio diferencial.
Efeitos do sistema nervoso central
O fluxo sanguíneo cerebral (FSC) é autorregulado e não é afetado pelo bloqueio epidural, a menos que o paciente apresente hipotensão acentuada. No entanto, a anestesia neuroaxial parece ter um efeito sedativo e reduzir as necessidades anestésicas de vários agentes, incluindo midazolam, propofol, tiopental, fentanil e agentes voláteis. O grau de sedação e o efeito poupador da concentração alveolar mínima (CAM) parecem correlacionar-se com a altura e o nível do bloqueio do nervo sensitivo; o bloqueio dos dermátomos torácicos médios está associado a maiores efeitos sedativos do que o bloqueio dos segmentos lombares inferiores. Embora os dados sejam conflitantes, LAs de maior concentração podem contribuir para um maior efeito poupador de MAC. A adição de adjuvantes opióides, como a morfina, à solução peridural de AL não parece reduzir ainda mais a necessidade de agentes voláteis, embora contribua para melhores escores de dor pós-operatória. Em geral, as necessidades anestésicas diminuídas têm sido mais comumente atribuídas à diminuição da entrada aferente induzida pelo bloqueio do nervo neuroaxial, em vez de efeitos sistêmicos dos ALs, farmacocinética alterada ou ação direta dos ALs no cérebro.
Vários estudos demonstraram redução das necessidades hipnóticas e anestésicas após o bloqueio do neuroeixo central. Em um estudo inicial de 53 homens adultos de estado físico I e II da Sociedade Americana de Anestesiologistas (ASA), Tverskoy e colegas determinaram que o bloqueio subaracnóideo de bupivacaína diminuiu os requisitos hipnóticos para midazolam e tiopental. Um estudo que se seguiu, também em pacientes estado físico ASA I e II, determinou que a bupivacaína peridural diminuiu profundamente as necessidades hipnóticas de midazolam. Da mesma forma, em um pequeno estudo prospectivo, randomizado, duplo-cego e controlado por placebo, Hodgson e colegas descobriram que a anestesia peridural com lidocaína reduziu a CAM do sevoflurano em até 50%. Mais recentemente, a bupivacaína epidural administrada por via caudal demonstrou ter um efeito poupador nas necessidades intravenosas de fentanil e sevoflurano durante cirurgias ortopédicas em crianças.
Efeitos Cardiovasculares e Hemodinâmicos
As alterações cardiovasculares associadas à anestesia peridural e analgesia resultam principalmente do bloqueio da condução das fibras nervosas simpáticas. Essas alterações incluem vasodilatação venosa e arterial, RVS reduzida, alterações na cronotropia e inotropia e alterações associadas na pressão arterial e DC. O tipo e a intensidade dessas alterações estão relacionados ao nível de bloqueio do nervo, ao número total de dermátomos bloqueados e , relacionado, o tipo e a dose de LA administrado. Em geral, bloqueios do nervo peridural lombar ou torácico baixo não estão associados a alterações hemodinâmicas significativas, enquanto bloqueios do nervo torácico mais altos (particularmente aqueles envolvendo as fibras simpáticas T1-T4) podem causar alterações mais acentuadas, nem todas prejudiciais. No entanto, fatores como gravidez, idade, comorbidades, posicionamento do paciente e hipovolemia podem complicar o cenário clínico e os efeitos cardiovasculares previstos.
Hipotensão
A hipotensão associada ao bloqueio neuroaxial resulta principalmente da vasodilatação e do aumento da capacitância do leito vascular. Tanto a inibição direta do fluxo simpático para os nervos que inervam os vasos sanguíneos quanto a diminuição da liberação de catecolaminas endógenas das glândulas adrenais contribuem para a vasodilatação arterial e venosa. Em geral, o músculo liso arteriolar mantém o tônus autônomo, mesmo no cenário de simpatectomia completa, enquanto as veias e vênulas se dilatam ao máximo. No entanto, ocorre um grau de vasodilatação arteriolar. O efeito venodilatador também predomina devido à grande quantidade de sangue no sistema venoso em relação ao sistema arterial.
O grau de hipotensão associado ao bloqueio peridural correlaciona-se com o nível sensorial. Por exemplo, um aumento mais acentuado da capacitância venosa ocorre com o bloqueio da saída simpática para as veias esplâncnicas (T6 a L1) devido à dilatação do extenso leito esplâncnico. Com bloqueios do nervo peridural baixo, a vasoconstrição das áreas não bloqueadas e a liberação de catecolaminas do sistema medular adrenal compensam parcialmente o acúmulo venoso e arteriolar e as reduções na pressão arterial média. Em geral, pacientes saudáveis e normovolêmicos apresentam uma diminuição nominal da resistência periférica e da pressão arterial durante o início e a manutenção do bloqueio epidural. Os fatores de risco para hipotensão apreciável durante a anestesia neuroaxial incluem nível sensorial acima de T5, baixa pressão basal, aumento da idade e anestesia geral neuroaxial combinada.
Pacientes gravemente hipovolêmicos e pacientes com comprometimento cardíaco também são mais propensos a apresentar hipotensão significativa que requer vasopressor e suporte inotrópico. A hipotensão ocorre mais comumente com raquianestesia do que com epidurais, apesar de graus equivalentes de bloqueio simpático.
Frequência Cardíaca e Função Cardíaca
Em geral, as alterações da frequência cardíaca e da função ventricular variam com o nível de bloqueio, com alterações mais pronunciadas à medida que o nível aumenta. Quando as fibras simpáticas cardíacas de T1 a T4 são bloqueadas, ocorre diminuição da contratilidade cardíaca e bradicardia, resultando em diminuição do DC. A bradicardia também resulta da diminuição da atividade do receptor de estiramento atrial atribuída à diminuição da pressão atrial direita. O agrupamento venoso também contribui para a redução do DC, particularmente com bloqueios nervosos mais altos. Missant et al estudaram os efeitos da anestesia peridural na função ventricular esquerda e direita em um modelo de porco e descobriram que a anestesia peridural lombar reduziu a RVS sem afetar a função ventricular esquerda ou direita. No entanto, o TEA reduziu a contratilidade ventricular esquerda e reduziu minimamente a RVS, preservando a função ventricular direita.
O bloqueio neuroaxial parece ter certos efeitos benéficos no sistema cardiovascular, como melhora do fluxo sanguíneo miocárdico e do equilíbrio de oxigênio no miocárdio. Observou-se que a oxigenação tecidual melhora com TEA elevado em certas circunstâncias, particularmente com a administração de fluidos intravenosos.
O TEA também parece ter efeitos antianginosos que melhoram a perfusão coronária e melhoram a recuperação da isquemia miocárdica reversível. Se isso resulta em melhor resultado cardíaco perioperatório após cirurgia cardíaca ou torácica de grande porte, no entanto, é assunto de debate contínuo. Vários autores levantaram a hipótese de que o TEA também pode proteger contra arritmias pós-operatórias e fibrilação atrial após grandes cirurgias cardíacas e torácicas. No entanto, os dados são conflitantes. Svircevic e cols. realizaram uma meta-análise comparando AG e TEA para cirurgia cardíaca e observaram menos arritmias supraventriculares no pós-operatório.
Efeitos pulmonares
As alterações motoras e simpáticas associadas à anestesia peridural podem afetar a função pulmonar, dependendo do nível de bloqueio. Em geral, o volume corrente permanece inalterado mesmo durante bloqueios nervosos neuroaxiais altos, enquanto a capacidade vital pode ser reduzida devido à diminuição do volume de reserva expiratório que ocorre quando os músculos acessórios envolvidos na expiração são bloqueados.
A capacidade de tossir e limpar as secreções respiratórias também pode ser prejudicada, particularmente em pacientes com função respiratória gravemente comprometida no início do estudo. No entanto, a função muscular inspiratória não é afetada e deve permanecer suficiente para fornecer uma função ventilatória adequada.
Níveis sensoriais mais altos podem resultar em alterações mais acentuadas na função pulmonar. Em um estudo sentinela, Freund et al inseriram um cateter peridural lombar e administraram um volume médio de 20 mL de lidocaína a 2%. Obteve-se um extenso bloqueio nervoso para T4, mas a diminuição da capacidade vital foi mínima. No entanto, a inserção do cateter em níveis mais altos, com maior disseminação concomitante de AL, resulta em desarranjo pulmonar mais pronunciado.
Em contraste, quando o TEA é usado no pós-operatório, um efeito líquido positivo na função pulmonar pode ser observado, provavelmente porque o maior alívio da dor evita a imobilização. Em um artigo de revisão recente, Lirk e Hollmann determinaram o papel do TEA e confirmaram os benefícios em grandes cirurgias abdominais e torácicas.
A rara ocorrência de parada respiratória após bloqueio peridural ou espinhal pode ser atribuída à hipoperfusão do centro respiratório no tronco encefálico, e não aos efeitos diretos do AL no nervo frênico ou no SNC.
Efeitos gastrointestinais
O fluxo simpático para o trato GI surge de T5 a T12, enquanto a inervação parassimpática é suprida pelo nervo vago. A simpatectomia associada ao bloqueio peridural nos níveis torácicos médio a baixo resulta em tônus vagal sem oposição, que se manifesta clinicamente com peristaltismo aumentado, esfíncteres relaxados, aumento das secreções GI e, provavelmente, restauração mais rápida da motilidade GI na fase pós-operatória . Náuseas e vômitos geralmente acompanham a hiperperistalse e podem ser tratados efetivamente com atropina intravenosa. Teoricamente, o aumento da motilidade intestinal poderia contribuir para a ruptura das anastomoses cirúrgicas, mas isso não foi demonstrado na literatura. Em vez disso, o TEA pode diminuir o risco de vazamento anastomótico e melhorar a perfusão intestinal perioperatória, embora os dados sejam um pouco conflitantes. Numerosos estudos experimentais e clínicos demonstraram que o TEA protege contra a hipoperfusão esplâncnica e reduz o íleo pós-operatório. No entanto, benefícios semelhantes não são observados com anestesia peridural lombar.
Efeitos renais/geniturinários
Como o fluxo sanguíneo renal (FSR) é mantido por autorregulação, a anestesia peridural tem pouco efeito sobre a função renal em indivíduos saudáveis. Mecanismos compensatórios e de feedback (dilatação arteriolar aferente e vasoconstrição arteriolar eferente) garantem um FSR constante em uma ampla faixa de pressões (50-150 mHg). Durante períodos transitórios de hipotensão abaixo de 50 mm Hg, o fornecimento de oxigênio aos rins é mantido adequadamente.
O bloqueio neuroaxial no nível lombar foi postulado para prejudicar o controle da função da bexiga secundária ao bloqueio das raízes nervosas S2-S4, que transportam os nervos simpáticos e parassimpáticos que inervam a bexiga. A retenção urinária pode ocorrer até que o bloqueio do nervo desapareça. O médico deve evitar administrar um volume excessivo de fluidos intravenosos se não houver um cateter urinário.
Efeitos neuroendócrinos
O estresse cirúrgico produz uma variedade de alterações na resposta humoral e imune do hospedeiro. O aumento do catabolismo protéico e o consumo de oxigênio são comuns. Concentrações plasmáticas aumentadas de catecolaminas, vasopressina, hormônio do crescimento, renina, angiotensina, cortisol, glicose, hormônio antidiurético e hormônio estimulante da tireoide foram documentadas após estimulação simpática associada a cirurgias minimamente invasivas e grandes cirurgias abertas. As manifestações perioperatórias da resposta ao estresse cirúrgico podem incluir hipertensão, taquicardia, hiperglicemia, função imunológica suprimida e função renal alterada. Níveis aumentados de catecolaminas também podem causar aumento da pós-carga ventricular esquerda e, em combinação com outras respostas patológicas ao estresse (p. aumentam a produção de endotelina e agravam a disfunção endotelial coronariana), desencadeiam síndromes coronarianas agudas e infartos do miocárdio em pacientes com doença cardíaca coexistente. Acredita-se que a informação sensorial aferente do sítio cirúrgico desempenhe um papel fundamental nessa resposta.
A resposta ao estresse cirúrgico pode ser influenciada pelo bloqueio simpático durante a anestesia peridural e analgesia. Os mecanismos envolvidos não foram resolvidos, mas provavelmente incluem bloqueio direto de sinais aferentes e eferentes durante o estresse cirúrgico e efeitos diretos dos agentes AL. Brodner et al demonstraram que o TEA combinado com GA resultou em uma resposta ao estresse cirúrgico reduzido quando comparado ao GA sozinho.
O efeito mais crítico da ativação neuroendócrina no período perioperatório é o aumento da norepinefrina plasmática, que atinge o pico aproximadamente 18 horas após o início do estímulo cirúrgico. O aumento da norepinefrina plasmática está associado à ativação do óxido nítrico no endotélio de pacientes com doença aterosclerótica, produzindo vasoespasmo paradoxal. Assim, em pacientes com doença aterosclerótica significativa, a combinação de vasoespasmo e estado de hipercoagulabilidade podem ser os fatores modulados pelos efeitos cardioprotetores do TEA. De fato, estudos indicaram que o fluxo sanguíneo da artéria coronária é melhorado com TEA.
termorregulação
A hipotermia tem efeitos colaterais significativos, como aumento da morbidade cardíaca, coagulação prejudicada, aumento da perda de sangue e aumento do risco de infecção. A taxa e gravidade da hipotermia associada à anestesia peridural é semelhante à observada durante os casos sob AG. A hipotermia associada à anestesia neuroaxial deve-se principalmente à vasodilatação periférica, resultando na redistribuição de calor do centro para a periferia. Além disso, a produção de calor reduzida (devido à atividade metabólica reduzida) resulta em um balanço de calor negativo devido à perda de calor inalterada. Finalmente, o controle termorregulatório é prejudicado. É importante notar que o reaquecimento com dispositivos de aquecimento de ar forçado ocorre mais rapidamente com anestesia neuroaxial em comparação com GA devido à vasodilatação periférica.
Sistema de coagulação
O pós-operatório é um estado de hipercoagulabilidade acentuado. O bloqueio neuroaxial está associado a uma diminuição do risco de TVP e embolia pulmonar, bem como a uma diminuição do risco de trombose arterial e venosa.
FARMACOLOGIA DO BLOQUEIO PERIDURAL
Uma compreensão da fisiologia da condução nervosa e da farmacologia dos ALs é essencial para o sucesso do bloqueio epidural. A potência e a duração dos ALs, o bloqueio preferencial das fibras sensoriais e motoras e a duração prevista da cirurgia ou necessidade de analgesia pós-operatória são fatores que devem ser considerados antes de iniciar o bloqueio peridural. Esta seção abrange vários aspectos práticos para obter anestesia e analgesia peridural eficazes.
As soluções epidurais podem conter um AL com ou sem droga adjuvante. A dose, o volume e a concentração, bem como o local de injeção da solução de AL variam, resultando em diferentes efeitos farmacodinâmicos. As fibras nervosas A, B e C variam em tamanho e na presença de uma bainha de mielina. As fibras A-delta e C são responsáveis pela transmissão da temperatura e da dor. As fibras B são fibras autônomas. As fibras A maiores (especialmente as fibras A-alfa) são fibras motoras. As fibras C são não mielinizadas e de menor tamanho. Como não possuem bainha de mielina protetora e barreira de difusão, são rapidamente bloqueadas. As fibras A e B são mielinizadas e maiores em tamanho do que as fibras C. As fibras B são responsáveis pela transmissão do sistema nervoso autônomo. São menores em tamanho que as fibras A-delta, mas maiores que as fibras C. É amplamente aceito que as fibras autonômicas são mais suscetíveis ao bloqueio do nervo AE do que as fibras sensoriais. O AL administrado por via epidural bloqueia preferencialmente a função neural simpática; isso explica o bloqueio do dermátomo simpático mais extenso quando comparado aos bloqueios nervosos sensitivos e motores. No entanto, Ginosar et al sugeriram recentemente que a função sensorial era mais suscetível ao bloqueio do que a função simpática. Vários outros estudos concordaram. A dose e a concentração de AL utilizada podem explicar os diferentes achados nesses estudos. Por causa de sua bainha de mielina espessa, as fibras motoras requerem muito mais AL e muito mais tempo antes que um bloqueio nervoso adequado seja alcançado.
Os anestésicos locais produzem bloqueio reversível do nervo bloqueando a passagem de sódio através da membrana nervosa. Quando o LA é injetado no espaço epidural, várias coisas ocorrem. A maior parte do AL injetado é absorvida no sangue venoso e grande parte é retida no tecido adiposo epidural. Os principais locais de ação de um AL administrado por via epidural são as raízes nervosas ventrais e dorsais que passam pelo espaço epidural. No entanto, com base em estudos usando ALs marcados, os ALs podem atravessar a dura-máter e penetrar na medula espinhal, mas em menor grau do que sua penetração nas raízes nervosas espinhais. As raízes nervosas segmentares são fibras nervosas sensoriais, motoras e simpáticas mistas. Assim, todos os três tipos de fibras serão afetados (em graus variados).
Escolha de Anestésicos Locais
Os medicamentos usados para bloqueio peridural podem ser categorizados em AL de ação curta, intermediária e longa. O início do bloqueio epidural nos dermátomos imediatamente ao redor do local da injeção geralmente pode ser detectado em 5 ou 10 minutos, se não antes. O tempo para o efeito máximo varia com o tipo de AL e a dose/volume administrado (tabela 19).
TABELA 19. Anestésicos locais comumente usados para anestesia peridural e analgesia.
| Droga | Concentração (%) | Tempo de início (min) | Duração (min) |
|---|---|---|---|
| 2-Cloroprocaína | 3 | 5-15 | 30-90 |
| Lidocaína | 2 | 10-20 | 60-120 |
| Bupivacaína | 0.0625-0.5 | 15-20 | 160-220 |
| Ropivacaína | 0.1-0.75 | 15-20 | 140-220 |
| Levobupivacaína | 0.0625-0.5 | 15-20 | 150-225 |
O AL de ação mais curta para bloqueio neuroaxial é a cloroprocaína, um éster. No passado, a cloroprocaína foi associada à aracnoidite adesiva quando grandes volumes foram administrados acidentalmente no espaço subaracnóideo. Além disso, dor nas costas intensa não foi raramente relatada quando grandes volumes foram administrados no espaço epidural, provavelmente devido ao ácido etilenodiaminotetracético (EDTA) e conservantes bissulfito na solução. Desde 1996, a cloroprocaína sem conservantes está disponível e não foi associada a efeitos neurotóxicos ou dor nas costas. Em ambientes ambulatoriais e para cesarianas de emergência com epidurais in situ, a cloroprocaína pode fornecer excelente anestesia cirúrgica rapidamente, sem atrasar a alta da sala de recuperação.
Administrada por via epidural, a lidocaína a 2% é um AL de ação intermediária comumente usado para anestesia cirúrgica. Quando a epinefrina é adicionada à solução (1:200,000), ela prolonga a duração da ação em até 60%.
Os AL de ação prolongada usados para bloqueio peridural são bupivacaína, levobupivacaína (não mais disponível nos Estados Unidos) e ropivacaína. Concentrações diluídas (por exemplo, 0.1% a 0.25%) podem ser usadas para analgesia, enquanto concentrações mais altas (por exemplo, 0.5%) podem ser mais apropriadas para anestesia cirúrgica. A adição de epinefrina a essas soluções pode prolongar a duração da ação, embora esse efeito seja menos confiável com agentes de ação longa versus intermediária. Reações cardiotóxicas graves (hipotensão, bloqueio do nervo atrioventricular, fibrilação ventricular e torsades de pointes) refratárias aos métodos usuais de ressuscitação podem resultar da injeção intravascular acidental de bupivacaína. A justificativa para a resistência às medidas de ressuscitação está em seu alto grau de ligação proteica e efeito mais pronunciado no bloqueio dos canais de sódio cardíacos. A levobupivacaína, o enantiômero S da bupivacaína, tem perfil semelhante à bupivacaína, mas com efeitos cardiotóxicos menos pronunciados. A ropivacaína, um análogo da mepivacaína, tem um perfil de ação semelhante ao da bupivacaína. Na maioria dos estudos, a ropivacaína demonstrou uma duração de ação ligeiramente menor do que a bupivacaína, potencialmente com um bloqueio do nervo motor menos denso em doses equipotentes. Um impedimento para o uso mais amplo da ropivacaína na prática clínica é o seu custo mais elevado.
Início e duração dos anestésicos locais
A alcalinização dos ALs, que são comercializados em estado ionizado solúvel em água, acelera o início. Ao aumentar a concentração da forma não ionizada, mais AL lipossolúvel fica disponível para penetrar na bainha neural e na membrana nervosa. A adição de bicarbonato de sódio imediatamente antes da injeção de lidocaína, mepivacaína ou cloroprocaína produz um início de anestesia clinicamente significativo mais rápido e também pode contribuir para um bloqueio nervoso mais denso. No entanto, a ropivacaína e a bupivacaína irão precipitar com a adição de bicarbonato, a menos que seja utilizada uma concentração muito baixa. A combinação de drogas de ação curta e longa para início rápido e um bloqueio nervoso sensorial prolongado não provou ser eficaz. Por exemplo, a mistura de 2-cloroprocaína com bupivacaína para o início rápido da primeira e longa duração da última resulta na redução da duração e eficácia da bupivacaína.160 A administração contínua do medicamento e o uso de aditivos eliminam a necessidade de misturar ALs.
Dicas NYSORA
A combinação de ALs de ação curta e intermediária ou longa para início rápido com duração de ação prolongada não provou ser eficaz. Droga contínua
a administração e o uso de aditivos evitam a necessidade de misturar os ALs.
A adição de epinefrina a certos ALs pode aumentar a duração da ação, provavelmente diminuindo a absorção vascular. O efeito é maior com 2-cloroprocaína, lidocaína e mepivacaína e é menos eficaz com os agentes de ação mais prolongada. Outros vasoconstritores, como a fenilefrina, não demonstraram ser tão eficazes na redução dos níveis sanguíneos de pico de AL como a epinefrina.
Adjuvantes aos Anestésicos Locais no Espaço Peridural
Uma variedade de outras classes de drogas tem sido estudada mais recentemente para tentar melhorar a qualidade do bloqueio neuroaxial. Além de vários opióides (por exemplo, fentanil, sufentanil e preparações de morfina); agonistas α-adrenérgicos; inibidores da colinesterase; agonistas-antagonistas opióides semi-sintéticos; cetamina; e midazolam foram estudados, com resultados mistos. A administração de clonidina no espaço peridural tem sido extensivamente estudada. Agonista α2-adrenérgico, a clonidina parece prolongar a duração da ação dos ALs, embora o mecanismo permaneça obscuro. Estudos em animais mostraram que a clonidina reduz o fluxo sanguíneo regional da medula espinhal, diminuindo, portanto, a taxa de eliminação da droga. Kroin e colegas demonstraram que o mecanismo pelo qual a clonidina prolonga a duração de um bloqueio nervoso quando misturado com ALs não é mediado por α-adrenorreceptores; em vez disso, está mais provavelmente relacionado à corrente de cátions Ih ativada por hiperpolarização.
Alguns dos benefícios potenciais da administração de clonidina no espaço epidural podem incluir o seguinte:
1. Prolongamento e aumento dos efeitos dos ALs epidurais sem risco adicional de hipotensão
2. Redução nos requisitos de dose de LA para analgesia epidural de parto
3. Analgesia eficaz sem comprometimento motor
4. Efeito sinérgico com opióides e agonistas-antagonistas opióides
5. Modulação da resposta ao estresse em cirurgia torácica
6. Preservação da função pulmonar após toracotomia
7. Possível redução na resposta de citocinas, reduzindo ainda mais a sensibilidade à dor
Os efeitos colaterais comumente associados à clonidina epidural incluem hipotensão independente da dose, bradicardia, sedação e boca seca. A combinação de clonidina com outros agentes, como opioides, anticolinérgicos, agonistas-antagonistas opioides e cetamina, pode aumentar os efeitos benéficos desses medicamentos e minimizar os efeitos colaterais adversos.
A neostigmina, um inibidor da colinesterase, é uma adição mais recente à lista de aditivos epidurais para analgesia seletiva. O mecanismo de ação para seu efeito analgésico parece ser a inibição da quebra da acetilcolina e a estimulação indireta dos receptores muscarínicos e nicotínicos na medula espinhal. Embora a experiência com neostigmina epidural seja limitada, foi relatado que ela proporciona alívio da dor pós-operatória sem induzir depressão respiratória, comprometimento motor ou hipotensão. Quando combinado com outros opioides, clonidina e ALs, pode proporcionar benefícios semelhantes aos da clonidina sem o perfil de efeitos colaterais de qualquer um desses medicamentos administrados isoladamente. Observações em pacientes com dor oncológica mostraram a promessa de que seu uso pode estar associado a menos náuseas e vômitos do que a aplicação intratecal. Em uma investigação randomizada de 48 pacientes para receber 0, 1, 2 ou 4 μg/kg de neostigmina peridural, além de um anestésico espinhal de bupivacaína para pequenas cirurgias de joelho, nenhum caso de náusea ou vômito intraoperatório foi observado, e os escores de náusea pós-operatória não foram observados. diferem entre os grupos. Esses resultados precisam ser corroborados por mais estudos antes que a neostigmina epidural possa ser recomendada para a prática diária.
Outros agentes, como cetamina, tramadol, droperidol e midazolam, foram considerados para administração epidural, com resultados mistos. Considerável controvérsia envolve o uso de midazolam por via intratecal. Apesar de várias publicações recomendarem seu uso, estudos recentes demonstraram que mesmo uma dose única de midazolam intratecal pode ter efeitos neurotóxicos. Até que seu perfil de segurança possa ser garantido em seres humanos, não é recomendado para uso neuroaxial neste momento.
Um agente que se mostra promissor é a formulação de liberação prolongada de um dos opióides mais antigos, a morfina. DepoDur, o nome comercial da morfina epidural de liberação prolongada, usa um sistema de liberação de drogas chamado DepoFoam. O DepoFoam é composto por partículas microscópicas à base de lipídios com vesículas internas que contêm o medicamento ativo e o liberam lentamente. Estudos recentes demonstraram alívio eficaz da dor com efeitos colaterais relativamente menores por até 48 horas quando administrado adequadamente. No entanto, as preocupações com a depressão respiratória tardia limitaram seu uso clínico nesta fase inicial de seu uso clínico.
Outros fatores que afetam o local de injeção do bloqueio peridural
O bloqueio peridural é mais eficaz quando o bloqueio do nervo ou o cateter é inserido em um local que corresponde aos dermátomos cobertos pela incisão cirúrgica. O início mais rápido e o bloqueio nervoso mais denso ocorrem no local da injeção. Ao inserir o cateter mais próximo da distribuição do dermátomo do sítio cirúrgico, uma dose menor do fármaco pode ser administrada, reduzindo assim os efeitos colaterais. Este conceito é especialmente importante quando a analgesia peridural torácica é usada para analgesia pós-operatória.
Após a injeção peridural lombar, os efeitos analgésicos e anestésicos se espalham mais cranialmente do que caudalmente. É importante notar que há um atraso no início da anestesia nos segmentos L5-S1 secundário ao maior tamanho dessas raízes nervosas. Com a injeção torácica, o AL se espalha uniformemente a partir do local da injeção, mas encontra resistência ao bloqueio na região lombar devido às raízes nervosas maiores. Ao controlar a dose na região torácica, pode-se estabelecer um verdadeiro bloqueio segmentar afetando apenas a região torácica. As regiões lombar e sacral serão poupadas, evitando assim bloqueio simpático mais extenso e consequente hipotensão e disfunção vesical associada, bem como bloqueio motor de membros inferiores.
Dose, Volume e Concentração
A dose de ALs necessária para anestesia peridural ou analgesia é função da concentração da solução e do volume injetado. A concentração da droga afeta a densidade do bloqueio nervoso; quanto maior a concentração, mais profundo o bloqueio nervoso motor e sensorial. Concentrações mais baixas podem produzir seletivamente um bloqueio nervoso sensorial.
O volume e a dose total de AL são as variáveis que afetam o grau de disseminação do bloqueio nervoso. Um volume maior da mesma concentração de AL bloqueará um número maior de segmentos do nervo. No entanto, se a dose total de AL não for alterada, mas a concentração for duplicada, o volume pode ser reduzido pela metade para obter uma distribuição semelhante de AL. Uma diretriz geralmente aceita para dosagem de anestesia epidural em adultos é de 1 a 2 mL por segmento a ser bloqueado. Esta diretriz deve ser ajustada para pacientes mais baixos e para pacientes muito altos. Por exemplo, para atingir um nível sensorial T10 a partir de uma injeção L3-L4, aproximadamente 8 mL de AL devem ser administrados. Abaixo das concentrações do equivalente a 1% de lidocaína, o bloqueio do nervo motor é mínimo, independentemente do volume do AL injetado, a menos que as doses sejam administradas em intervalos repetidos.
O tempo para repetir uma dose de LAs depende da duração da droga. As doses devem ser administradas antes que o bloqueio do nervo regrida ao ponto em que o paciente sinta dor, comumente referido como “tempo para regressão de dois segmentos”. Isso é definido como o tempo que leva para o bloqueio do nervo sensorial regredir em dois níveis de dermátomos. Quando a regressão de dois segmentos ocorreu, um terço a metade da dose inicial de carga pode ser administrada com segurança para manter o bloqueio do nervo. Por exemplo, o tempo para regressão de dois segmentos da lidocaína é de 60 a 140 minutos (tabela 20).
TABELA 20. Redosagem de anestésicos locais.
| Droga | Concentração (%) | Tempo para dois segmentos Regressão (min) | Tempo recomendado para “Recarga” Dose a partir da dose inicial (min) |
|---|---|---|---|
| 2-Cloroprocaína | 3 | 45-75 | 45 |
| Lidocaína | 2 | 60-140 | 60 |
| Bupivacaína | 0.10 | 180-260 | 120 |
| Ropivacaína | 0.10 | 180-260 | 120 |
Posicionamento do paciente
O posicionamento do paciente durante o início do bloqueio peridural não parece afetar a disseminação resultante da analgesia ou anestesia. O paciente pode ser colocado na posição lateral ou sentado. A linha média da coluna é mais fácil de palpar quando o paciente está sentado, principalmente no paciente obeso, tornando o bloqueio do nervo tecnicamente mais fácil. Quer o paciente esteja sentado ou em decúbito lateral, não há diferença significativa na altura do bloqueio nervoso. Foi sugerido em um estudo de Seow e associados que há um tempo de início, duração e densidade ligeiramente mais rápidos do bloqueio do nervo motor no lado dependente quando a epidural é colocada com o paciente em decúbito lateral.
Características do paciente: idade, peso, altura e gravidez
Com o avançar da idade, a dose de AL necessária para atingir um bloqueio nervoso específico é reduzida. Alguns estudos observaram diferença não clinicamente significativa na altura do bloqueio nervoso (entre um e quatro segmentos acima) com volume e concentração fixos de AL em pacientes com mais de 50 anos. forames, o que teoricamente limita a saída dos AL do espaço peridural. A diminuição da gordura epidural, que permite que mais droga banhe os nervos, e alterações na complacência do espaço epidural, que podem levar a uma maior disseminação cefálica, também foram propostas.
Há pouca correlação entre a disseminação da analgesia e o peso do paciente. Entretanto, em pacientes obesos mórbidos, pode haver compressão do espaço peridural relacionada ao aumento da pressão intra-abdominal; um bloqueio nervoso maior pode ser obtido com uma determinada dose de AL.
A altura parece desempenhar pouco papel nos requisitos de LA. Para pacientes curtos (≤5 pés 2 pol.), a prática comum tem sido reduzir a dose para 1 mL por segmento a ser bloqueado (em vez de 2 mL por segmento). Bromage sugeriu um regime de dosagem mais preciso de aumentar a dose de LA em 0.1 mL por segmento para cada 2 polegadas acima de 5 pés de altura. A prática mais segura é usar dosagem incremental e monitorar o efeito para evitar níveis anestésicos excessivamente altos.
A gravidez causa um aumento da sensibilidade tanto aos AL quanto aos anestésicos gerais, embora os estudos sobre as causas sejam conflitantes. Níveis elevados de progesterona e endorfinas endógenas podem contribuir. Evidências conflitantes sobre a disseminação de LA em indivíduos grávidas versus não grávidas foram publicadas.
Bloqueio do Nervo Epidural Intermitente versus Contínuo
A decisão de usar dosagem intermitente após a dose de carga inicial, uma infusão contínua ou dosagem em bolus intermitente controlada pelo paciente ou programada pode ser influenciada pela natureza da cirurgia ou procedimento, equipe e equipamento.
Todas essas opções podem fornecer analgesia ou anestesia peridural segura e eficaz. As vantagens da infusão contínua incluem maior estabilidade cardiovascular, menor necessidade de mão de obra, menor incidência de taquifilaxia, menor frequência e gravidade dos efeitos colaterais relacionados às injeções em bolus, menor disseminação rostral, menor risco de potencial de contaminação e a capacidade de atingir um estado de equilíbrio. de anestesia. A dosagem manual intermitente em bolus, por outro lado, é simples e não requer equipamentos adicionais (por exemplo, dispositivos de infusão).
TÉCNICA EPIDURAL
Vários fatores influenciam o sucesso do bloqueio peridural, incluindo a experiência e o conhecimento da anatomia do clínico, o preparo e o posicionamento do paciente, o nível de inserção do cateter peridural e a técnica utilizada para iniciar o procedimento.
Esta seção revisa os fatores que contribuem para a colocação epidural bem-sucedida, começando com a seleção e preparação do paciente, requisitos de equipamentos e recomendações atuais para a prevenção de complicações infecciosas associadas a técnicas neuraxiais. Em seguida, apresenta aspectos técnicos da colocação peridural cervical, torácica e lombar e aborda várias controvérsias relacionadas à técnica de bloqueio do neuroeixo, como o método ideal para identificar o espaço peridural e a eficácia da dose de teste peridural.
Avaliação do paciente
Como no caso de qualquer anestésico, os riscos e benefícios da colocação epidural devem ser discutidos com o paciente de maneira consistente com o consentimento informado. Quaisquer preocupações e dúvidas devem ser abordadas antes da administração da pré-medicação. Quando existe uma barreira linguística, intérpretes treinados ou serviços de tradução por telefone devem ser utilizados. O histórico médico do paciente e a lista de medicamentos ativos devem ser revistos antes do início do bloqueio peridural, com ênfase especial na presença de condições que possam predispor o paciente a complicações graves. A terapia medicamentosa que influencia a função de coagulação do paciente ou a resposta fisiológica ao bloqueio das fibras simpáticas pré-ganglionares deve ser levada em consideração, inclusive quando a última dose foi administrada. A última ingestão oral do paciente também deve ser documentada. Para aqueles pacientes que recebem bloqueio peridural como único anestésico ou como adjuvante ao AG para procedimentos cirúrgicos eletivos, as diretrizes da ASA para nada por via oral devem ser aplicadas. Pacientes com condições médicas que pioram com pós-carga ou pré-carga reduzida (por exemplo, EA grave, estenose mitral, cardiomiopatia hipertrófica) e pacientes que podem apresentar piora da falta de ar, como aqueles com doença pulmonar restritiva ou DPOC grave, podem necessitar de testes adicionais. Condições clínicas que predispõem os pacientes a infecções do neuroeixo, como imunossupressão, DM, pancreatite e abuso de álcool ou drogas, podem exigir avaliação adicional ou estudos laboratoriais. Déficits neurológicos preexistentes ou distúrbios do SNC devem ser avaliados e documentados. História de sensibilidade ou reação adversa a opioides ou ALs e complicações relacionadas a procedimentos peridurais anteriores requerem investigação adicional.
O exame físico deve incluir uma avaliação da coluna vertebral para evidência de escoliose ou cirurgia anterior nas costas, infecção focal, amplitude de movimento severamente limitada ou outros achados que possam tornar a colocação epidural mais desafiadora ou impossível. A obesidade, especialmente a obesidade central, pode obscurecer os pontos de referência da superfície.
Estudos laboratoriais de rotina não são necessários para a colocação epidural em pacientes saudáveis para procedimentos de rotina. Muitos médicos podem optar por obter uma contagem completa de células sanguíneas (CBC), particularmente quando uma perda de sangue apreciável é esperada ou quando o paciente está anêmico. A avaliação inicial do estado de coagulação do paciente ou da contagem de plaquetas deve ser obtida em pacientes com distúrbios de coagulação conhecidos ou suspeitos, diáteses hemorrágicas e trombocitopenia, bem como em pacientes recebendo terapia antitrombótica ou trombolítica ou qualquer medicamento conhecido por afetar a qualidade ou função plaquetária (além de AINEs de rotina).
Dicas NYSORA
• Não são necessários estudos laboratoriais de rotina para iniciar o bloqueio epidural em pacientes saudáveis para procedimentos de rotina.
• Pacientes com distúrbios hemorrágicos conhecidos ou suspeitos e aqueles recebendo terapia antitrombótica ou trombolítica requerem avaliação do estado basal de coagulação ou contagem de plaquetas (e possivelmente função plaquetária).
• Pacientes submetidos a cirurgias com previsão de perda sanguínea ou alterações hemodinâmicas podem necessitar de exames complementares, incluindo hemograma completo.
PREPARAÇÃO
Um cateter intravenoso de grande calibre para administração de fluidos ou medicamentos de emergência deve ser fixado antes do início do bloqueio epidural. A pré-carga de fluido não é necessária e pode ser prejudicial em certos subgrupos de pacientes com pressão oncótica colóide sérica diminuída (por exemplo, aqueles com queimaduras, pacientes com pré-eclâmpsia).
No entanto, condições reversíveis, como hipovolemia grave, devem ser tratadas antes da colocação e dosagem do bloqueio nervoso.
O monitoramento apropriado durante a realização do bloqueio epidural depende do objetivo do bloqueio do nervo epidural e de quando e onde a epidural deve ser administrada. Bloqueios de nervos peridural para analgesia, como para analgesia de parto, requerem monitoramento intermitente da pressão arterial durante a colocação e durante a infusão epidural, bem como oximetria de pulso contínua com monitoramento da frequência cardíaca durante a colocação e início do bloqueio nervoso. O monitoramento do eletrocardiograma (ECG) deve estar disponível. Em pacientes em trabalho de parto, o monitoramento da frequência cardíaca fetal antes e após a colocação é recomendado se o monitoramento contínuo não for viável.
Sedativos ou analgésicos não são raramente administrados para aliviar o estresse e o desconforto do paciente durante a colocação epidural e podem exigir monitores e equipamentos adicionais, como uma cânula nasal. Se pré-medicações forem administradas, o pessoal médico que possa fornecer monitoramento contínuo deve estar presente. Vale ressaltar que a sedação excessiva deve ser evitada para garantir a cooperação do paciente durante o posicionamento, detectar a presença de parestesias durante a colocação e avaliar o nível de bloqueio sensorial e o efeito da dose teste (se administrada). Monitores ASA padrão são necessários para o início e manejo intraoperatório da anestesia epidural. Medicamentos e equipamentos de emergência devem estar prontamente disponíveis durante o início de todos os procedimentos neuroaxiais centrais (tabela 21).
TABELA 21. Equipamentos de emergência e medicamentos para início do bloqueio neuroaxial.
| Equipamento de via aérea | Bolsa Ambu com máscara |
| Fonte de oxigênio |
|
| Vias aéreas orais e nasais |
|
| Cabos e lâminas de laringoscópio |
|
| Tubos endotraqueais |
|
| Eschmann estilete/bougie |
|
| Seringas e agulhas | |
| Medicamentos de emergência | efedrina |
| Fenilefrina |
|
| Epinefrina |
|
| Atropina |
|
| Sedativo/hipnótico |
|
| emulsão lipídica a 20% |
|
| Succinilcolina |
Comunicação com a equipe cirúrgica
Uma discussão com a equipe cirúrgica sobre a abordagem operatória, o posicionamento desejado do paciente, a duração estimada do procedimento cirúrgico, os objetivos anestésicos ou analgésicos do bloqueio e as necessidades de analgésicos pós-operatórios podem ajudar a determinar se uma peridural contínua, uma única -injeção epidural, ou um CSE é preferível. A equipe cirúrgica também pode compartilhar informações sobre o paciente que não estejam prontamente disponíveis no prontuário ou imediatamente aparentes durante a entrevista pré-operatória.
Quando viável, para minimizar atrasos desnecessários, o bloqueio nervoso pode ser iniciado na área pré-operatória ou na sala de cirurgia enquanto a equipe de enfermagem está montando o equipamento cirúrgico.
Onde quer que o bloqueio do nervo seja realizado, é essencial espaço suficiente para o anestesiologista e, idealmente, um assistente, bem como equipamentos adequados de iluminação, monitoramento e reanimação.
Equipamentos necessários
Bandejas epidurais descartáveis, estéreis e comercialmente preparadas estão disponíveis em vários fabricantes. Um kit padrão normalmente inclui o seguinte: um campo estéril; cotonetes de preparação; 4 × 4 esponjas de gaze; uma toalha de papel; solução de iodopovidona; uma ampola de cloreto de sódio 0.9% sem conservantes; uma ampola de 5 mL de lidocaína a 1.5% com epinefrina 1:200,000; uma ampola de 5 mL de lidocaína a 1% para infiltração cutânea; um dispositivo de filtragem (agulha ou canudo); um filtro bacteriano; agulhas e seringas de vários tamanhos; uma agulha peridural estilete com marcações em cm; uma seringa LOR de vidro ou plástico de 5 ou 10 mL (ou Luer lock ou Luer slip); um dispositivo de fixação de conector de cateter; um cateter peridural com gradações de centímetros e um conector/adaptador; um dispositivo auxiliar de rosca (TAD); um protetor de agulha para descarte de objetos cortantes; e rótulos.
Em um kit epidural adulto, a agulha epidural é tipicamente de calibre 17 ou 18 e 9 cm (aproximadamente 3.5 pol.) de comprimento, com marcações na superfície em intervalos de 1 cm. Agulhas mais longas de até 15 cm (6 pol.) de comprimento estão disponíveis para pacientes obesos. A agulha Tuohy, que é comumente fornecida em kits não personalizados, tem uma ponta curva com um bisel rombudo projetado para permitir uma identificação mais fácil do tecido à medida que a agulha avança e facilitar a passagem do cateter epidural. As asas na junção da haste e do cubo da agulha podem permitir um melhor controle à medida que a agulha é passada através do tecido, particularmente ao usar a técnica de “droping drop” para identificação do espaço epidural, embora alguns profissionais possam preferir agulhas peridurais sem asas ou com asas acopláveis (Figura 14).

Figura 14. Agulhas epidurais: configuração bisel e asa.
Agulhas epidurais com abertura posterior para saída de uma agulha espinhal (para CSEs) e agulhas de duplo lúmen com aberturas separadas para agulha espinhal e cateter também estão disponíveis.
Cateteres epidurais variam em diâmetro, materiais e design de ponta. Em kits preparados comercialmente, cateteres de calibre 19 são geralmente pareados com agulhas peridurais de calibre 17; Cateteres de calibre 20 são emparelhados com agulhas de calibre 18. Muitos cateteres epidurais atualmente disponíveis são misturas de náilon com vários graus de rigidez para facilitar o rosqueamento. Alguns cateteres de náilon rígidos têm pontas flexíveis especialmente projetadas para se desviarem de veias, nervos e outros obstáculos encontrados no espaço epidural. Cateteres reforçados com fio incorporados em um cateter de poliuretano ou de nylon representam um avanço tecnológico mais recente e estão se tornando cada vez mais populares.Figura 15). As versões para adultos têm diâmetro de 19 gauge e foram projetadas para uso com agulha epidural de calibre 17; versões pediátricas estão disponíveis em alguns fabricantes.

Figura 15. Cateter reforçado com fio de orifício único. (Usado com permissão da Epimed International.)
Muitos cateteres de nylon e reforçados com fio disponíveis comercialmente são fabricados nas versões de orifício único e multiorifício (Figura 16). A falta de dados robustos impede uma avaliação completa sobre se os resultados clínicos, como a incidência de parestesias, canulação da veia peridural, migração intratecal e analgesia adequada, são melhorados com o design uniport ou multiport. No entanto, um estudo prospectivo, duplo-cego, randomizado e controlado de 2009, realizado por Spiegel et al, investigou o sucesso da analgesia de parto, o número de episódios de dor irruptiva que requerem medicação suplementar e a ocorrência de complicações, como parestesias e colocação de cateter intravascular e intratecal , em 493 parturientes que receberam um cateter de poliuretano reforçado com fio de orifício único ou um cateter de nylon reforçado com fio de vários orifícios. Os autores não encontraram diferença estatisticamente significativa nos resultados entre os dois grupos e postularam que a flexibilidade proporcionada pela bobina de fio pode eliminar qualquer uma das vantagens potenciais do design multiporta.

Figura 16. Cateter multi-orifício reforçado com fio. (Usado com permissão da Epimed International.)
Dicas NYSORA
• O uso de cateteres peridurais reforçados com fio parece reduzir a incidência de complicações associadas às técnicas peridurais, incluindo canulação da veia epidural, parestesias e analgesia inadequada.
• Os dados atuais sugerem que os resultados clínicos são semelhantes com o uso de cateteres de mola uniport e multiport; a flexibilidade proporcionada pela bobina de aço inoxidável parece anular quaisquer benefícios potenciais de um projeto multiportas.
Equipamentos adicionais que podem ser necessários para o início de procedimentos epidural incluem clorexidina 0.5% com etanol (Hydrex®) ou clorexidina 2% com álcool isopropílico 70% (ChloraPrep®), que não é fornecido em bandejas de epidural; um curativo transparente estéril e oclusivo para o local da punção; e fita adesiva para prender o cateter. Para minimizar o risco remoto de aracnoidite química, a solução de desinfecção da pele não deve entrar em contato com os medicamentos ou equipamentos epidural e deve ter tempo adequado para secar. Normalmente, um grande curativo transparente (por exemplo, Tegaderm”) e fita adesiva são suficientes para evitar o deslocamento do cateter e manter o local de inserção epidural visível e limpo. Uma caneta estéril para rotular os medicamentos e uma agulha espinhal de calibre 25 ou 27 (para CSEs) podem ser colocadas no campo estéril.
Dicas NYSORA
• Recomenda-se um curativo oclusivo estéril transparente para evitar o deslocamento do cateter.
• O cateter e suas marcações em centímetros devem estar visíveis para o anestesista para garantir que o cateter permaneça no local de inserção original e que o LCR e o retorno do heme estejam ausentes antes da dosagem.
Analgesia e sedação durante o início do bloqueio do nervo
Analgesia ou sedação podem ser fornecidas para melhorar o conforto do paciente durante o bloqueio neuroaxial. No entanto, há evidências emergentes de que os sedativos intravenosos podem aumentar a percepção da dor de uma maneira específica do agente e do tipo de dor. A sedação leve com um benzodiazepínico (mais comumente midazolam) ou um opioide de ação curta antes da colocação epidural geralmente é suficiente. Isso também pode ser apropriado para pacientes obstétricas. Em um pequeno estudo randomizado duplo-cego, Frölich e colegas descobriram que a analgesia materna e a sedação com fentanil e midazolam antes da colocação da coluna vertebral não estavam associadas a efeitos neonatais adversos. É importante ressaltar que as mães tanto do grupo que recebeu pré-medicação quanto do grupo controle não mostraram diferença na capacidade de recordar os nascimentos de seus bebês.
Para aqueles que preferem estar “adormecidos” durante a colocação epidural, uma infusão de propofol pode ser titulada para manter a sedação sem comprometimento respiratório em situações clínicas selecionadas.
No entanto, é preferível ter pacientes adultos acordados e cooperativos o suficiente para alertar o anestesista sobre a presença de parestesias durante o início do bloqueio neuroaxial e para participar da avaliação do nível sensorial. Em cenários clínicos em que a administração de pré-medicação antes da colocação epidural pode não ser apropriada, parece haver um efeito placebo do uso de palavras mais suaves e tranquilizadoras durante a administração de pápulas cutâneas de lidocaína, que muitas vezes é considerada a parte mais dolorosa da procedimento. Estudos sugerem que as dicas a seguir também podem servir para reduzir a dor na injeção de AL: A cloroprocaína (com ou sem bicarbonato de sódio) pode ser menos dolorosa do que a lidocaína para infiltração na pele; ajustar o pH da lidocaína para aproximar o pH fisiológico reduz a dor na injeção; e a crioanalgesia (resfriamento da pele) pode ser tão eficaz quanto tamponar a solução de AL com bicarbonato de sódio.
Dicas NYSORA
As dicas a seguir podem servir para reduzir a dor na injeção de LA para infiltração na pele:
• Comunicação com o paciente durante o procedimento e garantia verbal
• Ajustar o pH da lidocaína com a adição de bicarbonato de sódio para aproximar mais o pH fisiológico
• Resfriamento da pele (crioanalgesia) ou anestésico tópico antes da punção da pele
Posicionamento do paciente
O posicionamento ideal do paciente é essencial para a colocação epidural bem-sucedida. Dependendo do estado clínico do paciente (p. , ou posição prona pode ser usada.
Cada posição tem vantagens e desvantagens. Independentemente de qual posição é selecionada para o início de procedimentos neuroaxiais, é útil ter um assistente para ajudar a manter a posição até que o procedimento seja concluído. Em geral, embora o bloqueio do nervo peridural possa ser iniciado com o paciente em qualquer posição que permita acesso às costas, o posicionamento inadequado pode transformar uma colocação epidural fácil em um desafio desnecessariamente. Vários dispositivos de posicionamento estão disponíveis comercialmente para facilitar o posicionamento do paciente sem o auxílio da equipe de enfermagem.
Posição sentada
Em geral, é tecnicamente mais fácil identificar a linha média na posição sentada, principalmente em pacientes obesos e escolióticos. Os anestesistas também podem ser mais experientes e mais confortáveis em realizar procedimentos neuraxiais na posição sentada. A posição sentada também foi observada como a via mais direta para o espaço peridural, com menor distância da pele ao espaço e, no caso de ESC com AL sem dextrose e opioides intratecais hipobáricos, maior disseminação cefálica do bloqueio do nervo sensitivo . No entanto, pacientes idosos, parturientes em estágios avançados de trabalho de parto, pacientes com fraturas de quadril, pacientes fortemente sedados e pacientes não cooperativos podem não ser capazes de assumir ou manter a posição sentada.tabela 22).
TABELA 22. Vantagens da posição sentada para
início do bloqueio neuroaxial.
| Mais fácil de identificar a linha média, particularmente em obesos e pacientes escolióticos |
| Praticantes mais experientes na posição sentada |
| Menor tempo de procedimento |
| Menor distância da pele ao espaço epidural |
| Maior disseminação cefálica de soluções hipobáricas |
Se a posição sentada for escolhida, o paciente deve ser auxiliado a sentar-se na mesa ou na cama da sala de cirurgia com as costas dos joelhos tocando a borda da cama e os pés apoiados em um banquinho ou pendurados sobre a cama. O paciente deve relaxar os ombros e curvar as costas em direção ao clínico, assumindo uma posição “desleixada” ou “gato louco”. É útil ter um assistente de pé na frente do paciente e ajudá-lo a atingir a flexão máxima da coluna (Figura 17). Flexionar o pescoço deve ajudar a flexionar a parte inferior da coluna e abrir os espaços vertebrais (Figura 18). Pedir ao paciente para abraçar um travesseiro também pode ajudar no posicionamento.
Figura 17. A,B: Colocação epidural na posição sentada com assistente ajudando a posicionar o paciente.
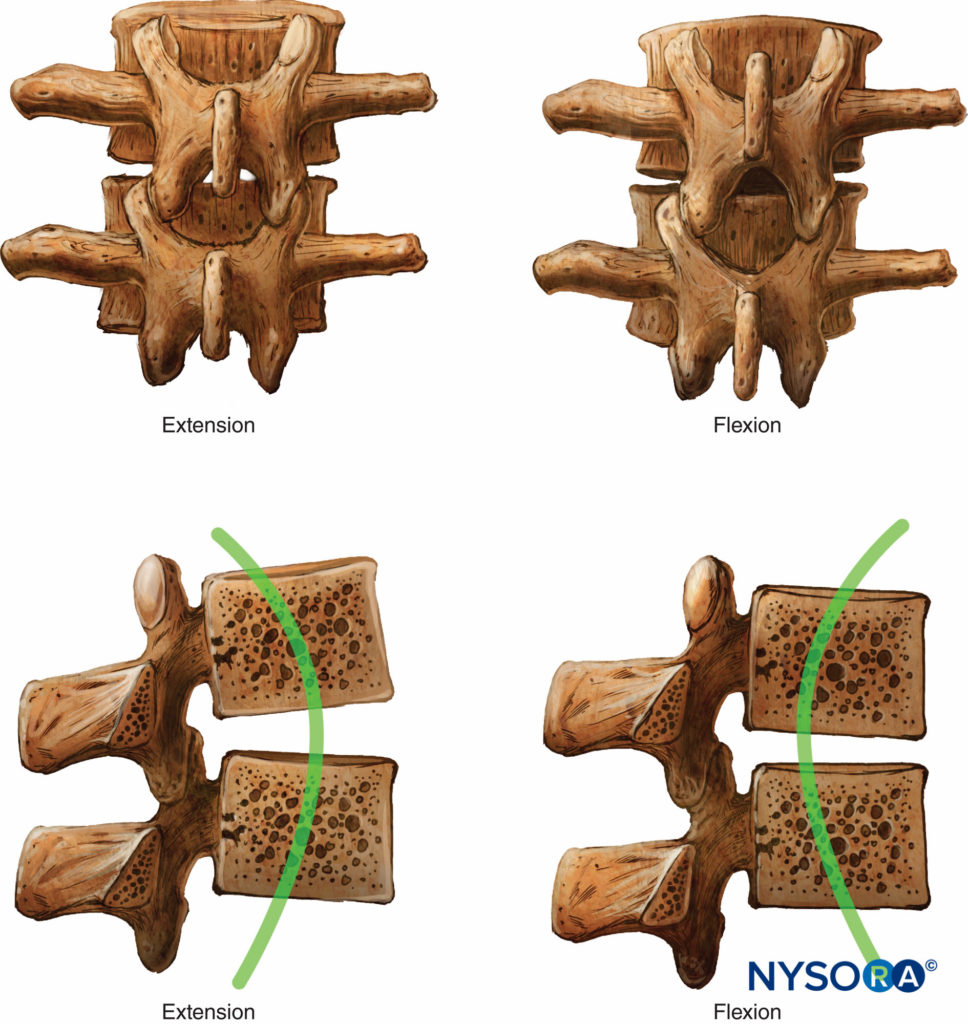
Figura 18. Flexão versus extensão durante a colocação epidural.
Posição Decúbito Lateral
A posição de decúbito lateral pode ser mais apropriada para pacientes que não podem assumir confortavelmente a posição sentada. Os benefícios adicionais incluem o seguinte: A sedação pode ser usada de forma mais liberal; os reflexos vagais podem ser minimizados; alterações hemodinâmicas podem ser mais bem toleradas; pode haver menos necessidade de um assistente bem treinado para ajudar a manter o posicionamento; e parece haver uma incidência reduzida de canulação não intencional da veia peridural e punção dural.tabela 23). Finalmente, no caso de CSEs com AL hiperbáricos, bloqueios nervosos unilaterais para certos procedimentos ortopédicos podem ser mais facilmente obtidos na posição lateral.
TABELA 23.
| A sedação pode ser usada mais liberalmente |
| Movimento reduzido do paciente |
| Maior conforto do paciente |
| Melhor cooperação do paciente |
| Maior satisfação do paciente |
| Deslocamento reduzido do cateter |
| Diminuição da incidência de canulação da veia peridural |
| Atenuação dos reflexos vagais |
| Alterações hemodinâmicas melhor toleradas |
| A assistência à beira do leito pode não ser necessária |
| Bloqueio unilateral intencional para procedimentos cirúrgicos viável |
Na posição de decúbito lateral, o dorso do paciente deve ficar totalmente alinhado com a borda da mesa ou cama (Figura 19).
Figura 19. Colocação epidural na posição lateral.
A posição de decúbito lateral esquerdo pode ser preferível para médicos destros e pode proporcionar melhor estabilidade hemodinâmica para parturientes. O plano coronal do paciente deve ser perpendicular ao chão, com as pontas dos processos espinhosos apontando para a parede. As coxas devem estar flexionadas em direção ao abdome e os joelhos encostados no peito; o pescoço deve estar em posição neutra ou flexionado de modo que o queixo fique apoiado no peito. Pedir ao paciente para “assumir a posição fetal” pode ajudar a flexionar ao máximo a coluna. Os quadris devem estar alinhados um acima do outro, e o braço não dependente deve se estender e repousar sobre o quadril não dependente. A cabeça do paciente pode precisar ser elevada com um travesseiro para evitar a rotação da coluna. Pacientes obesos ou com quadris maiores podem precisar de travesseiros adicionais para manter o alinhamento adequado. Direcionar a agulha em direção a uma linha imaginária que se estende cefálica e caudal do umbigo pode otimizar as chances de inserção na linha média, o que é particularmente importante durante o início de CSEs.tabela 24). O bisel da agulha epidural é direcionado para a cabeça do paciente.
TABELA 24. Dicas para alcançar a posição lateral ideal.
| Alinhar as costas do paciente com a borda da mesa ou cama |
| Alinhar o plano coronal perpendicular ao piso |
| Flexione as coxas em direção ao abdômen |
| O pescoço deve estar neutro ou flexionado |
| Alinhe os quadris um acima do outro |
| Descanse o braço não dependente no quadril não dependente |
| Elevar a cabeça com travesseiro para evitar a rotação da coluna |
Controle de infecção
A adesão a técnicas assépticas rigorosas é essencial durante o início e a manutenção do bloqueio do neuroeixo. A Força Tarefa da ASA sobre Complicações Infecciosas Associadas a Técnicas Neuraxiais aconselha as seguintes medidas: remover jóias nos dedos e pulsos; lave cuidadosamente as mãos antes de usar luvas; usar toucas, máscaras (trocadas a cada novo encontro com o paciente) e luvas estéreis; usar clorexidina com álcool para preparação da pele; cobrir o paciente em condições estéreis; e cubra o local de inserção do cateter com um curativo oclusivo estéril. Uma única aplicação de clorexidina com álcool parece tão eficaz quanto duas aplicações para desinfecção da pele. Quando a clorexidina, que não é fornecida em kits epidural, não está disponível, o uso de iodopovidona com álcool é preferível ao uso de iodopovidona sozinho. Todas as soluções antissépticas são consideradas neurotóxicas se entrarem em contato direto com as meninges; deve-se tomar cuidado para manter as agulhas e medicamentos na bandeja epidural separados dos desinfetantes da pele. Os filtros bacterianos podem ser úteis para pacientes com infusões peridural contínuas crônicas ou prolongadas, mas não há dados que apoiem que eles diminuam a incidência de infecções relacionadas ao cateter. O cateter deve
permanecer no local não mais do que o necessário, e as desconexões do cateter e as trocas de filtro devem ser mantidas ao mínimo. Os dados são insuficientes para apoiar o uso de uma bata cirúrgica durante o início de procedimentos peridurais (tabela 25).
TABELA 25. Técnica asséptica durante o início e a manutenção do bloqueio peridural.
| Remova jóias nos dedos e pulsos |
| Realizar lavagem cuidadosa das mãos antes de enluvar |
| Use touca, máscara e luvas estéreis |
| Use clorexidina com álcool para preparação da pele |
| Colocar o paciente em condições estéreis |
| Cubra o local de inserção do cateter com curativo estéril e oclusivo |
| Manter o cateter no lugar não mais do que o necessário |
| Mantenha a desconexão do cateter e as trocas de filtro no mínimo |
Técnicas para identificar o espaço peridural
Três técnicas podem ser utilizadas para identificar o espaço peridural: LOR, gota suspensa e ultrassonografia. Apesar do crescente interesse em procedimentos neuraxiais assistidos por ultrassom, a técnica LOR, que se baseia nas diferentes densidades do tecido à medida que a agulha passa pelos ligamentos no espaço epidural, é a técnica mais usada. Tanto LOR para fluido, com ou sem bolha de ar, quanto ar são reconhecidos como meios aceitáveis de identificação do espaço epidural. Ensaios randomizados comparando solução salina com ar para LOR sugeriram que a solução salina é superior. No entanto, esses ensaios podem exagerar a diferença entre os dois meios, forçando o anestesista a usar uma técnica menos preferida. Independentemente de qual técnica é usada durante a colocação epidural de rotina, é importante ter em mente que LOR ao ar não é recomendado para procedimentos de PBE.
Faltam evidências na literatura sobre o melhor método para identificar o espaço peridural em crianças, que são comumente anestesiadas durante a colocação. Recentemente, o uso de ultra-som tem sido defendido. No entanto, a técnica pode ser complicada e requer experiência com imagens de ultra-som. Com refinamentos na tecnologia e expansão da experiência do profissional, a orientação por ultrassom pode facilitar a colocação de cateteres peridurais nessa população de pacientes.
Perda de resistência ao ar
A técnica LOR to air está associada a várias complicações (tabela 26). O ar é compressível e pode resultar em um LOR falso e, consequentemente, em um aumento da incidência de ADP. ADP na configuração de LOR para ar pode resultar em pneumoencéfalo, uma dor de cabeça severa que se desenvolve imediatamente após a injeção de ar no espaço subaracnóideo. O pneumoencéfalo, por sua vez, pode resultar em lesão neurológica grave, como hemiparesia e convulsões generalizadas, além de náuseas e vômitos e retardo na recuperação da AG.
TABELA 26. Complicações associadas à perda de resistência ao ar.
| Pneumoencéfalo |
| Aumento do risco de punção dural acidental |
| Início mais rápido dos sinais e sintomas da CPPD |
| Maior incidência de CPPD |
| Bloco incompleto/desigual |
| Compressão da medula espinhal ou da raiz nervosa pelo ar |
| Embolia aérea venosa |
| Enfisema subcutâneo |
| Aumento da incidência de canulação da veia peridural |
| Inserção de cateter difícil |
A incidência de CPPD e o início dos sintomas também podem ser maiores quando a técnica de LOR ao ar é utilizada para identificar o espaço peridural. Além disso, a técnica LOR to air tem sido associada a uma maior incidência de segmentos não bloqueados ou alívio da dor irregular e déficits neurológicos relacionados à compressão de raízes nervosas ou da medula espinhal por bolhas de ar. Foi relatado embolia aérea venosa (VAE) na presença de lágrimas no plexo venoso epidural ou se a pressão da fonte de ar for maior que a pressão venosa. Finalmente, tanto o aumento da incidência de canulação venosa peridural quanto a dificuldade de inserção do cateter têm sido associados à LOR ao ar, particularmente na ausência de predistensão líquida do espaço peridural, embora os dados sejam conflitantes.
Os defensores da LOR para o ar acham que é mais fácil detectar o ADP se apenas o ar for usado, pois qualquer retorno de fluido é inegavelmente LCR na ausência de injeção de solução salina. No caso de um ADP ambíguo, o LCR pode ser diferenciado da solução salina com o uso de uma tira reagente de urina para verificar glicose e proteínas; se positivo, o diagnóstico de LCR pode ser feito. O LCR também pode ser diferenciado de solução salina ou LA pelo diferencial de temperatura; Espera-se que o LCR seja a temperatura corporal. Os defensores da abordagem LOR ao ar também apontam para o bloqueio do nervo sensorial inadequado e atraso no início do bloqueio do nervo que pode ocorrer se grandes volumes de solução salina forem injetados no espaço epidural, presumivelmente devido a um efeito de diluição. Isso, no entanto, pode ser evitado limitando a quantidade de solução salina injetada. Para os profissionais que realizam rotineiramente CSEs, pode-se argumentar também que a injeção de solução salina complica a identificação do LCR antes da administração de medicamentos intratecais.
Para identificar o espaço peridural com a técnica LOR ao ar, avance a agulha lentamente, exercendo pressão contínua ou intermitente na seringa LOR. À medida que a agulha entra no ligamento amarelo, geralmente há uma sensação distinta de aumento da resistência seguida de um sutil “ceder” quando uma leve pressão é exercida no êmbolo. Evite injetar ar ao identificar o espaço epidural devido a preocupações com pneumoencéfalo (no caso de ADP) e analgesia irregular e inadequada.
Perda de resistência à solução salina com ou sem bolha de ar
A seringa é preenchida com 2–3 mL de solução salina ou solução salina com uma bolha de ar claramente visível. A bolha fornece um medidor da pressão adequada a ser aplicada na seringa LOR; ela comprimirá e fornecerá alguma resistência se a ponta da agulha epidural estiver engatada no ligamento, mas se dissipará sem esforço com apenas uma leve pressão quando a agulha entrar no espaço epidural. A solução salina pode ser injetada diretamente para pré-distensão de fluidos. A pequena bolha de ar não deve resultar em complicações associadas ao LOR ao ar se também for injetado. Omitir a bolha de ar ao realizar uma PBE devido à possibilidade remota de que o ar possa ser introduzido no espaço subaracnóideo através da brecha meníngea.
Com LOR para solução salina com ou sem ar, a agulha é avançada da mesma forma que com ar. A pressão contínua ou intermitente pode ser exercida no êmbolo da agulha.
A técnica da gota suspensa
A técnica da gota suspensa baseia-se na pressão subatmosférica do espaço epidural, que é mais pronunciada e confiável nas regiões cervical e torácica do que nos segmentos lombares. A tensão dural da agulha epidural avançada também contribui para a pressão que parece “sugar” a gota de fluido. Para identificar o espaço peridural com esta abordagem, é necessária uma agulha peridural com asas. Uma gota de solução salina é colocada no centro da agulha assim que a agulha estiver engatada no ligamento. A agulha é avançada continuamente com o polegar e os dedos indicadores segurando firmemente as asas e o terceiro ao quinto dedos de ambas as mãos posicionados contra as costas do paciente. A entrada no espaço epidural é sinalizada pela entrada da gota no centro da agulha.
A técnica da gota suspensa é mais eficaz na região torácica, onde a pressão subatmosférica é mais notável. No entanto, esta técnica apresenta um risco maior de ruptura meníngea, em parte devido à proximidade da agulha peridural com a dura. Além disso, pacientes com doença pulmonar obstrutiva grave podem apresentar pressão subatmosférica atenuada, mesmo na região torácica; a técnica de queda suspensa pode não ser apropriada neste cenário.
Ultrassonografia
A tecnologia de ultrassom está sendo cada vez mais utilizada para auxiliar na identificação do espaço peridural. Estudos sugerem que o uso da ultrassonografia para identificar a profundidade prevista para o espaço, principalmente em parturientes obesas, e para identificar a linha média antes da colocação reduz o número de tentativas, minimiza o risco de complicações e facilita o procedimento sem prolongar significativamente o procedimento. A orientação por ultrassom também serve para ajudar a identificar o interespaço correto, o que pode ser difícil com base apenas em pontos anatômicos. Consulte o Capítulo 40 para obter informações mais detalhadas sobre técnicas neuraxiais guiadas por ultrassom.
Técnica de bloqueio peridural
Existem quatro abordagens comuns para o espaço epidural: linha média, paramediana, Taylor (paramediana modificada) e caudal. A experiência clínica em cada uma dessas técnicas dá ao anestesiologista mais flexibilidade ao realizar o bloqueio peridural. Para todas as abordagens, os monitores devem estar no lugar e a pele deve ser preparada e coberta de forma estéril antes do início do procedimento. Equipamentos de emergência e medicamentos devem estar imediatamente disponíveis. Sedação pode ser usada, conforme apropriado. Em geral, o bisel da agulha epidural deve estar voltado para a face cefálica, independentemente da abordagem usada para acessar o espaço epidural, a menos que um bloqueio nervoso unilateral intencional seja desejado (por exemplo, para procedimentos ortopédicos de membros inferiores realizados sob CSE).
Abordagem da linha média
Essa abordagem é mais comumente usada para colocação epidural na posição sentada e para procedimentos epidural na região lombar, torácica baixa e coluna cervical.
1. Uma bandeja epidural pode ser colocada à direita do anestesiologista para destros e à esquerda para canhotos.
2. Identifique o interespaço desejado pelos marcos anatômicos da superfície e palpação ou com ultrassonografia. A agulha usada para anestesiar a pele também pode ser usada como “agulha localizadora” para ajudar a identificar pontos de referência ósseos, principalmente em pacientes obesos.
3. Infiltre a pele e o tecido subcutâneo com AL (mais comumente lidocaína a 1%) ao longo do trajeto pretendido da agulha peridural entre os processos espinhosos adjacentes. Uma grande pápula cutânea com menor volume de AL no tecido subcutâneo servirá para anestesiar adequadamente a pele sem
obscurecendo os marcos.
4. Insira a agulha epidural com estilete ao longo do mesmo trajeto com o bisel orientado cefálico. Durante a inserção da agulha, o dorso da mão não injetora do anestesiologista pode repousar nas costas do paciente com o polegar e o dedo indicador segurando o eixo da agulha peridural. Uma abordagem modificada é avançar com a mão dominante firmemente enrolada ao redor do eixo da agulha epidural enquanto o dedo indicador e o polegar da mão não dominante seguram e guiam o eixo da agulha. Colocar as pontas dos dedos médios nas costas do paciente e segurar as asas da agulha com os polegares e os indicadores é um método alternativo para engatar a agulha.
Para engatar a agulha epidural adequadamente, avance através da pele, tecido subcutâneo, tecido adiposo, ligamento supraespinhoso, ligamento interespinhoso e, possivelmente, no ligamento amarelo; nesse ponto, a agulha deve assentar firmemente na linha média (Figura 20). Se a haste da agulha oscilar ou se desviar lateralmente, ela não está devidamente ancorada no ligamento. A agulha epidural pode ser engatada no ligamento interespinhoso ou no ligamento amarelo.
Figura 20. Agulha peridural engatada no ligamento da linha média.
Dicas NYSORA
• A agulha peridural avança através da pele, tecido subcutâneo, ligamento supraespinhoso, ligamento interespinhoso e ligamento amarelo antes de atingir o espaço peridural.
• A agulha pode ser engatada no ligamento interespinhoso ou no ligamento amarelo durante o início do bloqueio epidural.
• Desvio lateral ou agulha “trêmula” indica que a agulha não está devidamente encaixada no ligamento, necessitando de retirada e redirecionamento para a linha média.
Determinar quais ligamentos são atravessados é uma habilidade adquirida. O ligamento interespinhoso pode parecer “arenoso” contra a agulha que avança, enquanto o ligamento amarelo oferece mais resistência. No entanto, lacunas na linha média no ligamento amarelo não são incomuns, e pacientes obstétricas podem ter ligamentos mais moles. A profundidade da pele ao ligamento amarelo geralmente varia de 4 a 6 cm em adultos de tamanho normal, embora haja uma grande variabilidade. Após a penetração dos ligamentos, não é mais aconselhável mudar a direção da ponta da agulha sem retirar a agulha vários centímetros ou até o nível da pele. O estilete deve ser colocado na agulha peridural durante o redirecionamento para evitar o acúmulo de detritos ósseos ou tampões de tecido mole que podem dificultar o fluxo do LCR em caso de ADP.
5. Remova o estilete da agulha epidural e prenda a seringa LOR com ar ou solução salina (com ou sem bolha de ar) firmemente ao cubo da agulha. Seringas LOR de vidro ou plástico de baixa resistência são apropriadas. Deve-se tomar cuidado para garantir que as seringas de vidro não sejam “pegajosas”.
Múltiplas posições das mãos são apropriadas para avançar a agulha peridural no espaço peridural: o dorso da mão não dominante pode repousar firmemente nas costas do paciente, com o polegar e o indicador segurando a haste da agulha, enquanto a pressão é exercida no êmbolo LOR de forma contínua ou intermitentemente pelo polegar da mão dominante. A mão não dominante pode repousar nas costas do paciente com o polegar e o indicador estendendo-se e estabilizando o cubo da agulha, enquanto o polegar da mão dominante aplica pressão.Figura 21). Ou, o médio ao quarto ou quinto dedos das mãos não dominantes podem descansar nas costas, com ambos os polegares e indicadores segurando as asas da agulha epidural e a mão dominante liberando intermitentemente sua posição e exercendo pressão sobre o êmbolo da seringa LOR.Figura 22).
Figura 21. Avanço da agulha epidural: mão não dominante nas costas do paciente com polegar e indicador no cubo da agulha.
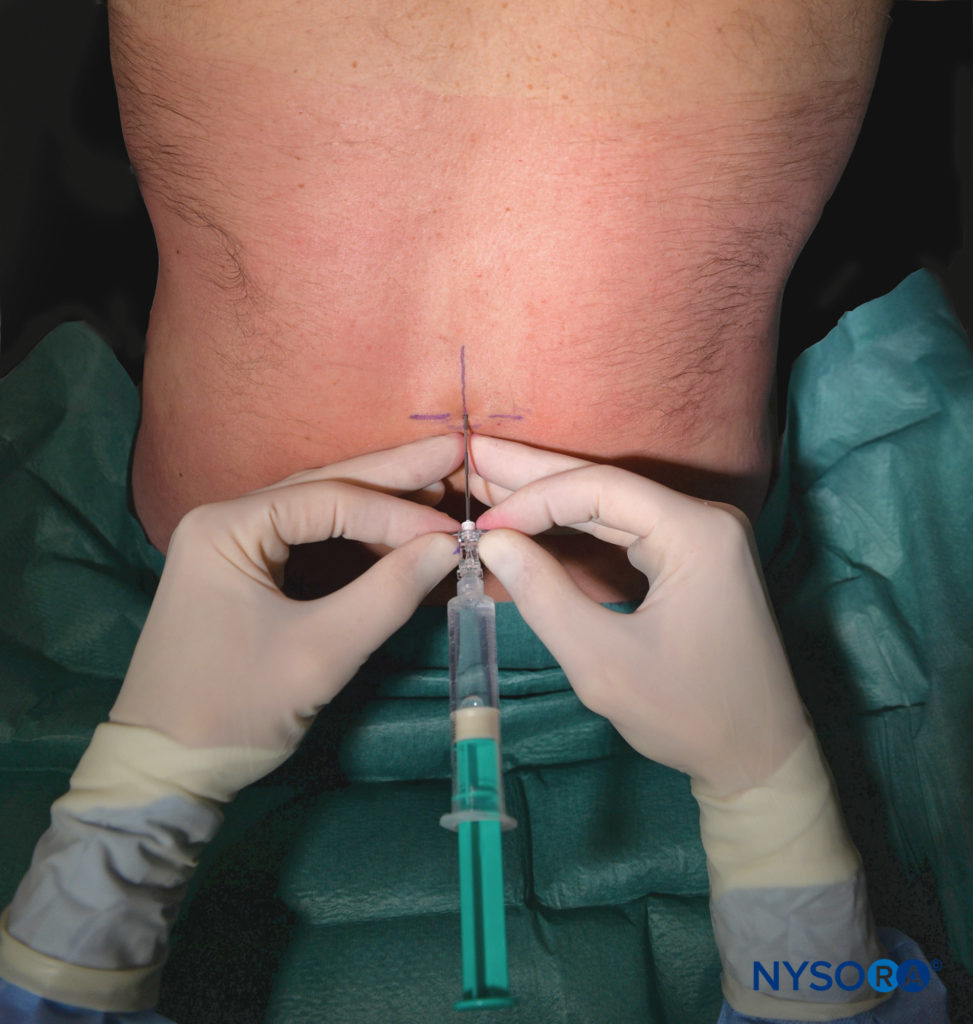
Figura 22. Avanço da agulha epidural: polegares e indicadores segurando as asas.
À medida que a agulha entra no espaço epidural, o êmbolo da seringa LOR de repente “cede”. Evite injetar todo o conteúdo da seringa, principalmente com LOR ao ar, se possível. Para peridural contínua, um pequeno volume de solução salina pode ser injetado no espaço peridural para dilatar o espaço, reduzindo assim o risco de canulação da veia peridural e facilitando a inserção do cateter. Observe a profundidade da agulha na pele. A marcação na agulha na pele representa a profundidade da pele ao espaço epidural. Como as marcações em centímetros não são numeradas, pode ser útil contar o número de marcações em centímetros entre a pele e o cubo da agulha epidural e subtrair esse número do comprimento da agulha. Por exemplo, se 4 marcas permanecerem visíveis entre a pele e o cubo da agulha, subtraia 4 de 9 (o comprimento comum de uma agulha peridural) para determinar que a profundidade do espaço peridural é de 5 cm.
Insira o cateter com auxílio do dispositivo de inserção que se encaixa no cubo da agulha peridural até visualizar a marca de 15 cm entrando no cubo da agulha; em seguida, remova a agulha sem deslocar o cateter (Figura 23). O cateter não deve ser enfiado mais de 5–6 cm no espaço epidural; 2–3 cm é apropriado para procedimentos cirúrgicos curtos. Para determinar onde o cateter deve ser fixado na pele, adicione 2–6 cm, dependendo da distância que o cateter deve ser enfiado, à profundidade previamente calculada para o espaço epidural. Por exemplo, se a agulha entrou no espaço epidural a 7 cm, o cateter deve ser fixado na marca de 12 cm na pele para garantir que 5 cm do cateter fiquem no espaço epidural.
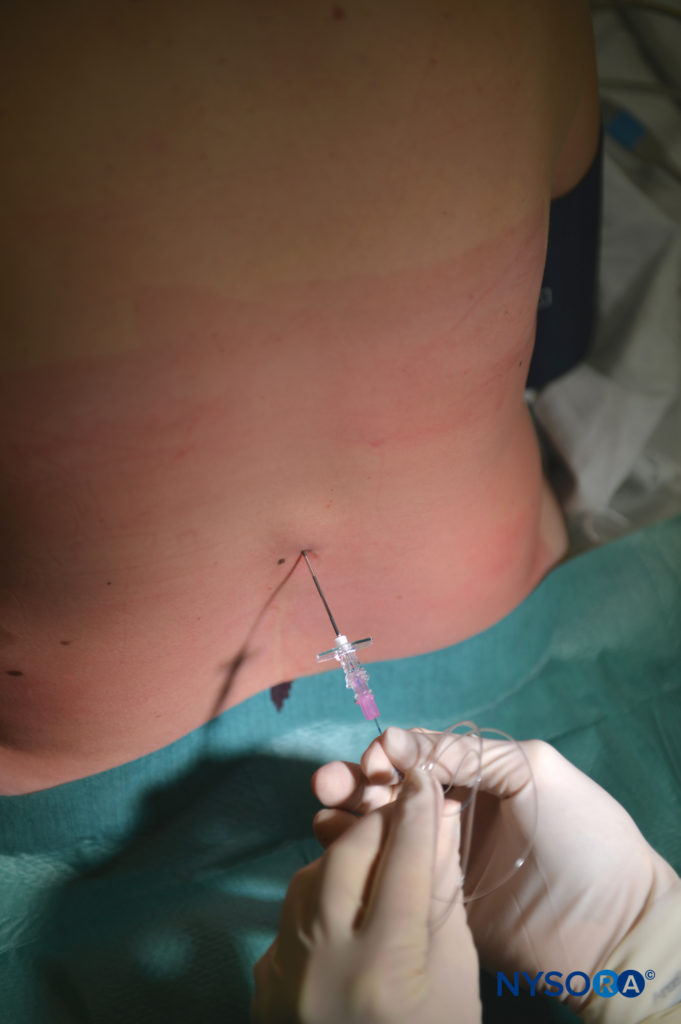
Figura 23. Inserção do cateter peridural.
Dicas NYSORA
• Uma maneira fácil de medir a profundidade do espaço peridural ao usar a técnica LOR é contar o número de marcações em centímetros visíveis entre a pele e o cubo da agulha. Subtraia esse número do comprimento da agulha. Por exemplo, a maioria das agulhas epidurais tem 9 cm de comprimento. Se as marcações de 4 centímetros forem visíveis após a identificação do espaço epidural, subtraia 4 de 9 para concluir que a profundidade do espaço é de 5 cm. O cateter epidural não deve ser inserido mais do que 5 ou 6 cm além dessa distância (ou seja, fixado a 10–11 cm na pele).
Para a técnica epidural de injeção única, menos comum, o AL pode ser administrado diretamente através da agulha em doses divididas ao longo de vários minutos. Esta técnica, no entanto, requer que o paciente permaneça imóvel durante a dosagem e pode resultar em pressão dolorosa com grandes volumes. Para a técnica de cateter contínuo, a administração de AL através da agulha não é recomendada, pois não é possível verificar o posicionamento correto do cateter.
Um curativo oclusivo transparente deve ser aplicado sobre o local de inserção para permitir a inspeção do cateter. O cateter deve ser preso às costas do paciente com o conector no ombro do paciente. O uso de fita transparente tem a vantagem de permitir que o médico visualize as janelas de “flashback” proximal e distal do cateter antes de administrar bolus de AL.
Abordagem Paramediana
A abordagem paramediana oferece uma abertura maior no espaço epidural do que a abordagem da linha média e é particularmente útil para pacientes que não podem ser posicionados facilmente ou que não podem flexionar a coluna durante a colocação epidural; para pacientes com ligamentos calcificados ou deformidades da coluna vertebral (por exemplo, cifoescoliose, cirurgia lombar prévia); e para técnicas peridurais na região torácica baixa a média. Os processos espinhosos de T4 a T9 são agudamente angulados e têm pontas que apontam caudalmente, dificultando a inserção da agulha peridural na linha média.
A “sensação” da abordagem paramediana é diferente da abordagem da linha média porque diferentes tecidos são penetrados. Os ligamentos supraespinhoso e interespinhoso são estruturas da linha média que não são atravessadas na abordagem paramediana.
Em vez disso, a agulha peridural penetra no tecido paraespinhoso com pouca resistência antes de entrar no ligamento amarelo. Várias abordagens para a técnica paramediana foram descritas. Essencialmente, a entrada da agulha é direcionada caudal e lateralmente ao aspecto inferior do processo espinhoso superior do interespaço desejado e caminha para fora da lâmina em direção cefálica.Figura 24).
1. Identifique o interespaço pretendido com pontos de referência de superfície, palpação ou orientação por ultrassom. Levante uma pápula de pele aproximadamente 1 cm lateral e 1 cm caudal à face inferior do processo espinhoso superior do nível espinhal desejado.
2. A agulha peridural é inserida a 15° do plano sagital, angulada em direção à linha média com inclinação cefálica.
3. Se for encontrado osso (provavelmente lâmina, se a profundidade e o ângulo de abordagem forem apropriados), a agulha é redirecionada em direção cefálica e medial (Ver Parte VI, Anestesia Pediátrica). Se o aspecto lateral do processo espinhoso for encontrado, a agulha deve ser redirecionada lateralmente e cefálica.
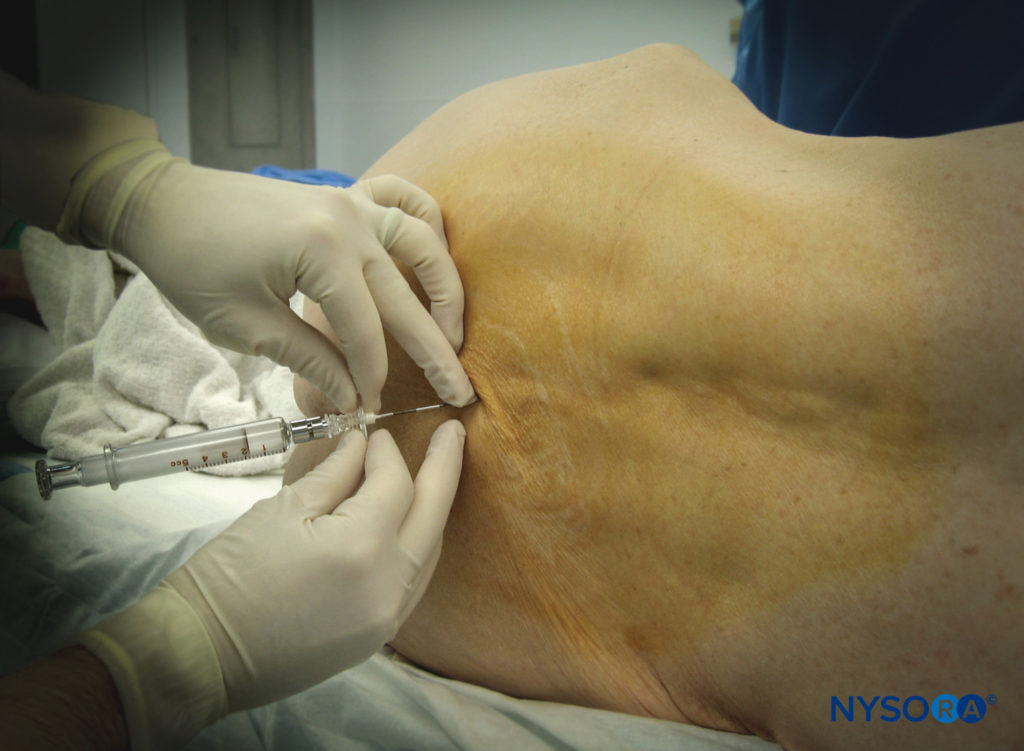
Figura 24. Técnica peridural paramediana.
Abordagem Taylor
A abordagem de Taylor é uma abordagem paramediana modificada utilizando o grande interespaço L5-S1. É uma excelente abordagem para cirurgia de quadril ou para qualquer cirurgia de extremidade inferior em pacientes com trauma que não toleram a posição sentada. Essa abordagem pode fornecer o único acesso disponível ao espaço peridural em pacientes com ligamentos ossificados.
1. Com o paciente sentado ou em decúbito lateral, uma pápula cutânea é colocada 1 cm medial e 1 cm caudal à espinha ilíaca póstero-superior.
2. A agulha peridural é inserida neste local em direção medial e cefálica em um ângulo de 45° a 55°.
3. Como na abordagem paramediana clássica, a primeira resistência sentida antes da entrada no espaço epidural é na entrada no ligamento amarelo.
4. Se a agulha entrar em contato com o osso (geralmente o sacro), a agulha deve ser passada para fora do osso no ligamento e depois no espaço epidural em direções progressivamente mais medial e cefálica.
Abordagem caudal
A abordagem caudal é comumente usada em pediatria para colocação de cateter peridural de injeção única ou contínua para analgesia intra e pós-operatória. Em adultos, geralmente é reservado para procedimentos que requerem bloqueio dos nervos sacrais e lombares (por exemplo, cirurgias anais e vaginais, herniorrafia inguinal, cistoscopia); epidurografia; e lise de aderências em pacientes com lombalgia com radiculopatia após cirurgia da coluna vertebral.
O sacro é um osso de formato triangular formado pela fusão das vértebras sacrais. A não fusão do quinto arco vertebral sacral cria a estrutura conhecida como hiato sacral, que é coberta pelo ligamento sacrococcígeo (uma extensão do ligamento amarelo) e delimitada por proeminências ósseas conhecidas como cornos sacrais. O hiato sacral é o ponto de acesso ao espaço epidural sacro. Geralmente é identificado como um sulco acima do cóccix (Figura 25).
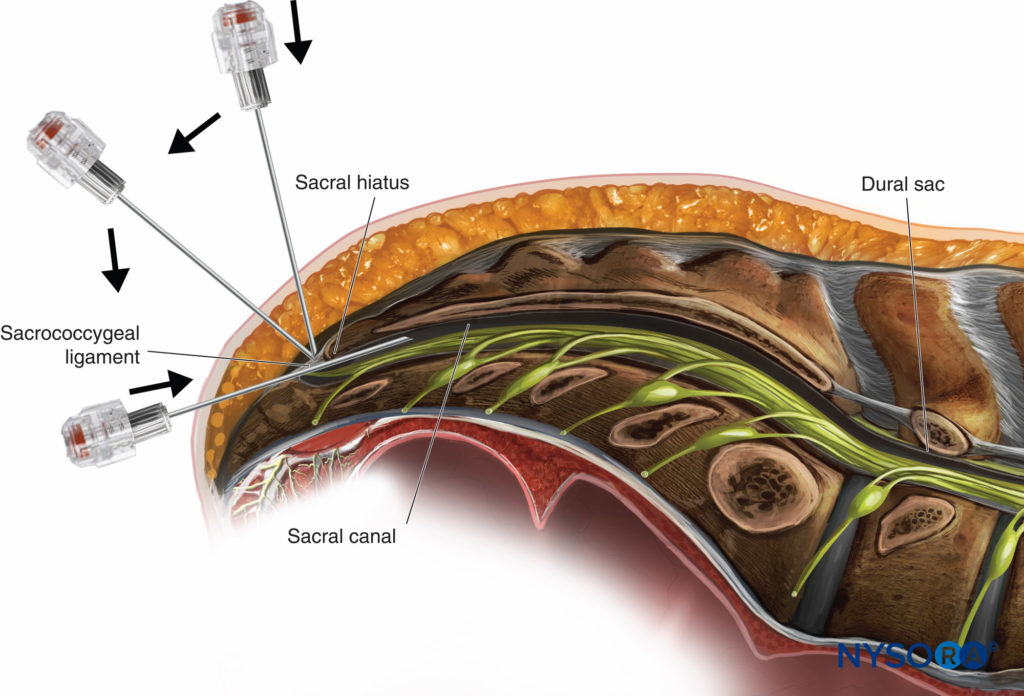
Figura 25. Abordagem caudal para colocação de cateter peridural.
Se a fluoroscopia não for usada, existem dois métodos para identificar o hiato:(1) O hiato sacral situa-se no ápice de um triângulo equilátero conectando as espinhas ilíacas póstero-superiores e apontando caudalmente. (2) As protuberâncias ósseas (os cornos sacrais) que circundam o hiato sacral podem ser palpadas aplicando-se uma pressão firme com o dedo indicador enquanto ele se move cefálica do cóccix.
1. Coloque o paciente em decúbito lateral ou de bruços (com o travesseiro sob a pelve e os quadris girados internamente, se de bruços). Na posição lateral, a perna dependente é levemente flexionada, enquanto a perna não dependente é flexionada em maior grau (até o joelho entrar em contato com a cama).
2. Avance a agulha com uma inclinação de 45° (em relação à superfície da pele).
3. Um “estalo” ou “estalo” distinto é sentido quando a agulha perfura a membrana sacrococcígea.
4. Se o aspecto dorsal da placa ventral do sacro for encontrado, retire a agulha levemente, diminua a ângulo de inserção e avance novamente. O ângulo da agulha é abaixado até ficar quase plano contra a pele (ou seja, paralelo ao plano coronal) para pacientes do sexo masculino. Pacientes do sexo feminino podem necessitar de uma inclinação de 15°.
5. Depois que o LOR for encontrado, avance a agulha levemente no canal caudal. Avançar muito pode levar a ADP ou injeção intravascular não intencional ou canulação da veia epidural durante a colocação do cateter. Se o LOR for ambíguo, vários mililitros de solução salina podem ser injetados através da agulha caudal enquanto se palpa a pele sobrejacente ao sacro. A agulha provavelmente está posicionada corretamente se uma protuberância na pele não se desenvolver.
6. Aspire sangue ou LCR antes de injetar LA.
7. Um cateter epidural pode ser inserido através da agulha e avançado até o nível desejado.
Bloqueio peridural cervical
Técnicas epidurais cervicais de injeção única ou contínuas são usadas para uma variedade de procedimentos cirúrgicos e de dor, incluindo endarterectomia de carótida, tireoidectomia e condições de dor cervical crônica. As abordagens da linha média e paramediana são usadas para realizar procedimentos cervicais, embora a orientação fluoroscópica esteja se tornando cada vez mais comum. O bloqueio peridural cervical pode ser iniciado na posição prona, lateral ou sentada. A posição prona é mais comumente usada para procedimentos assistidos por fluoroscopia, embora a posição sentada possa ser usada. Seja qual for a posição utilizada, a flexão do pescoço serve para aumentar a distância do ligamento amarelo à dura-máter, aumentando a margem de segurança para esses procedimentos e para expandir o espaço interlaminar.
Assim como no caso dos procedimentos peridurais lombares e torácicos, tanto a técnica de LOR quanto a de queda suspensa são métodos adequados para identificar o espaço epidural. Tanto ar (de preferência um pequeno volume) ou solução salina (com ou sem bolha de ar) podem ser usados para LOR. No entanto, o ligamento amarelo é descontínuo na linha média na região cervical em uma grande porcentagem de pacientes, contribuindo para uma falsa LOR. Além disso, é importante ter em mente que o ligamento amarelo é mais fino neste nível (1.5-3 mm) do que nos níveis lombar e torácico.
Na região cervical, o interespaço C7-T1 é mais amplo e de fácil acesso. Além disso, a profundidade da pele ao espaço peridural é maior nesse interespaço e a distância do espaço peridural ao saco dural é maior do que em outros níveis cervicais. No entanto, o uso de pontos de referência de palpação e superfície para identificar o nível C7-T1 nem sempre é confiável; a vértebra proeminente (presumivelmente C7) não é incomumente confundida com C6 e T1 em certas populações de pacientes. Injeções de dose única neste nível devem ser administradas lentamente. Para técnicas de cateter contínuo, o cateter geralmente é rosqueado não mais que 2–3 cm.
Iniciação e Manejo do Bloqueio Peridural
Dose de teste
Antes de administrar medicamentos através do cateter peridural, a colocação subaracnóidea, intravascular e subdural deve ser descartada. Embora rara, a migração do cateter pode ocorrer após a confirmação inicial de que o cateter está no espaço peridural; cada bolus deve ser precedido pela confirmação da localização adequada do cateter.
Embora a eficácia do AL com epinefrina na detecção de cateteres mal posicionados tenha sido questionada, muitos médicos ainda confiam rotineiramente na dose do teste farmacológico. A dose clássica combina 3 mL de lidocaína a 1.5% com 15 μg de epinefrina.
A injeção intratecal de 45 mg de lidocaína deve produzir um bloqueio do nervo motor significativo se o cateter estiver no espaço subaracnóideo, embora evidências recentes sugiram que isso nem sempre seja confiável. Uma alteração na frequência cardíaca de 20% ou mais (ou, alternativamente, um aumento na frequência cardíaca de 10 a 25 batimentos por minuto) em 1 minuto sugere que o cateter foi colocado (ou migrou para) um vaso e deve ser substituído. Se a frequência cardíaca não aumentar em 20% ou mais ou se um bloqueio do nervo motor significativo não se desenvolver em 5 minutos, a dose de teste é considerada negativa. Exceções a esta regra foram observadas em pacientes em trabalho de parto, pacientes anestesiados e pacientes recebendo agentes bloqueadores β-adrenérgicos.
Confiar nas alterações do ECG após a dose do teste e o uso de estimuladores de nervo têm sido defendidos como métodos alternativos para confirmar a colocação epidural, embora esses métodos também apresentem deficiências.
A segurança e eficácia da dose teste tradicional é debatida na literatura. Em pacientes em trabalho de parto, uma alteração na frequência cardíaca atribuída à epinefrina pode, na verdade, ser devido a uma contração dolorosa, contribuindo para uma interpretação falso-positiva. Alternativamente, um resultado de teste verdadeiro positivo nesta população de pacientes pode resultar em uma diminuição induzida por epinefrina no fluxo sanguíneo uterino. Pacientes com hipertensão, incluindo mulheres com pré-eclâmpsia, podem apresentar um aumento grave da pressão arterial que pode não ser bem tolerado após uma dose intravenosa de 15 μg de epinefrina. Anestésicos gerais voláteis podem interferir na resposta à epinefrina e contribuir para uma alta porcentagem de resultados falso-negativos em crianças, que são mais comumente anestesiadas durante a colocação epidural. Em pacientes em uso de agentes bloqueadores β-adrenérgicos, as alterações da frequência cardíaca podem não ser confiáveis. Um aumento na pressão arterial sistólica maior que 20 mm Hg tem sido usado como indicador de injeção intravascular nessa população de pacientes.
Estudos adicionais são necessários para determinar a estratégia ideal para detectar a colocação de cateter intratecal e intravascular. Felizmente, com o uso generalizado de infusões de AL de baixa concentração para analgesia epidural, o risco de toxicidade sistêmica de AL é bastante reduzido; a utilidade de uma dose de teste tradicional para avaliar a canulação intravascular neste cenário é limitada. Além disso, as inovações de design de cateter peridural nas últimas décadas, particularmente a introdução de cateteres flexíveis, contribuíram para uma diminuição acentuada na incidência de migração de cateter intratecal e canulação ou migração venosa epidural. No entanto, a dosagem incremental de AL (ou seja, alíquotas de 3 a 5 mL), com aspiração simultânea de sangue e LCR e observação cuidadosa, é necessária ao administrar uma epidural. No futuro, novos métodos de detecção de cateteres mal posicionados, como orientação de sinal acústico, estimulação nervosa e inserção guiada por ultrassom, podem substituir a dose de teste clássica.
Regime de dosagem
Após a aspiração do cateter peridural para verificar se há sangue ou LCR ou após uma dose de teste negativa, o cateter pode ser dosado para fornecer analgesia ou anestesia. Como mencionado, a concentração de AL determina a densidade do bloqueio nervoso, enquanto o volume e a dose total de AL determinam a propagação. Como orientação geral, a dose de carga inicial pode ser determinada da seguinte forma: 1–2 mL de AL por segmento a ser bloqueado em uma peridural lombar, 0.7 mL por segmento para uma peridural torácica e 3 mL por segmento para uma peridural caudal. A dose de ataque deve ser administrada através do cateter em alíquotas de 3 a 5 mL em intervalos de 3 a 5 minutos, permitindo tempo para avaliar a resposta do paciente à dosagem e evitar toxicidade sistêmica. Doses de carga apropriadas para analgesia pós-operatória incluem 10 mL de 0.2%–0.25% de bupivacaína, levobupivacaína ou ropivacaína com ou sem adjuvantes; entretanto, os pacientes podem apresentar graus variados de bloqueio do nervo motor. Evidências recentes sugerem que volumes maiores de ALs de baixa concentração podem proporcionar melhor disseminação e analgesia melhorada. Até 20 mL de bupivacaína 0.0625%–0.125% ou a dose equipotente de ropivacaína podem ser administrados de forma incremental como dose de ataque. ALs de maior concentração são necessários para anestesia cirúrgica. Até 20 mL de lidocaína a 2%, com ou sem epinefrina 1:200,000 e bicarbonato de sódio, ou 15 mL de bupivacaína a 0.5% ou ropivacaína podem ser usados para iniciar a anestesia peridural na região lombar.
A manutenção do nível desejado de anestesia pode ser realizada por meio de dosagem intermitente ou contínua após a dose de carga inicial. Com bolus manuais, um quarto a um terço da quantidade inicial pode ser administrado em intervalos de tempo, dependendo da duração da ação do AL inicial (ou seja, ação curta, intermediária ou longa), embora vários regimes de manutenção sejam apropriados. Bolus manuais geralmente são administrados durante cirurgias prolongadas; uma infusão contínua, entretanto, pode ser iniciada após o bolus inicial para manter a anestesia cirúrgica. As infusões contínuas requerem a mesma atenção diligente ao paciente que qualquer outro anestésico. A taxa de infusão usual é entre 4 e 15 mL/h. A ampla variação geralmente depende da idade, peso, extensão do bloqueio sensorial ou motor desejado em um determinado paciente; local de inserção do cateter; e o tipo e dose de LA. Assim, a individualização é necessária, e uma regra fixa não pode ser aplicada para esse fim.
A analgesia peridural controlada pelo paciente (PCEA), mais comumente com infusões de ALs de baixa concentração e adjuntos opióides, é cada vez mais usada para analgesia pós-operatória e para pacientes em trabalho de parto. Um bolus de demanda em intervalos programados, com ou sem dose de carga e infusão de fundo, pode ser programado para otimizar o conforto do paciente com menor consumo de AL. Bombas que fornecem bolus obrigatórios automatizados em intervalos de tempo, com ou sem infusão basal, foram desenvolvidas, embora ainda não estejam amplamente disponíveis.
Para bloqueio peridural torácico, vários regimes de dosagem podem ser usados para minimizar as alterações hemodinâmicas e o comprometimento respiratório (em pacientes acordados). Uma dose inicial de 3 a 6 mL de bupivacaína diluída 0.125%–0.25% ou 0.1%–0.2% de ropivacaína com ou sem fentanil, hidromorfona ou morfina sem conservantes pode ser seguida por 3 mL de bupivacaína 0.25%–0.5% a cada 30 min. Um regime alternativo é o seguinte: Administrar uma dose de ataque com 3–6 mL de bupivacaína 0.125% ou ropivacaína 0.1%–0.2% com um opióide (fentanil 2 μg/mL ou hidromorfona 20 μg/mL) pelo menos 30 minutos antes do fim do caso, conforme tolerado. Iniciar uma infusão de bupivacaína a 0.0625% ou ropivacaína a 0.1% com fentanil ou hidromorfona a 3–5 mL/h antes de o paciente sair da sala de cirurgia.
O nível e a duração da anestesia peridural dependem principalmente do local da injeção e do volume e concentração do fármaco. Outros fatores como idade, gravidez e sexo são fatores menos importantes, mas precisam ser considerados. A adição de epinefrina fresca e bicarbonato de sódio a 8.4% à lidocaína, mepivacaína e cloroprocaína diminuirá a latência, melhorará a qualidade e prolongará a duração do bloqueio nervoso. A epinefrina é menos eficaz com os ALs de ação prolongada. A adição de bicarbonato à ropivacaína e bupivacaína pode causar precipitação. A adição de opióides (por exemplo, fentanil) demonstrou melhorar a qualidade do bloqueio nervoso sem qualquer efeito na duração.
Dosagem de Recarga
Doses repetidas, comumente chamadas de “reforços”, devem ser administradas antes que o nível do bloqueio do nervo tenha diminuído mais de dois dermátomos. Um quarto a um terço ou mais da dose de carga original de AL pode ser administrado para cada dose repetida, embora possam ser necessárias diferentes doses de reforço para diferentes cenários clínicos. Por exemplo, se o paciente estiver confortável, mas o nível sensorial não for adequado, uma reposição de AL de alto volume e baixa concentração pode ser apropriada. Este também pode ser o caso se o bloqueio for unilateral ou irregular, mas o paciente desejar manter a força motora. No entanto, se a paciente precisar de um bloqueio nervoso mais denso para anestesia cirúrgica ou para o segundo estágio do trabalho de parto, por exemplo, menor volume de um AL de maior concentração pode ser uma escolha melhor. Em geral, o anestesiologista deve ter um conhecimento prático das características do AL usado para implementar adequadamente um protocolo de redosagem.
Problema resolvido
A colocação epidural apresenta desafios únicos que estão diretamente relacionados à experiência do profissional, ao cenário clínico e às características do paciente, entre outras coisas. A maioria desses problemas pode ser superada se o clínico reconhecer o problema, estiver familiarizado com a anatomia da coluna vertebral e souber como fazer ajustes na técnica.tabela 27).
TABELA 27. Resolução de problemas durante o início do bloqueio peridural.
| Problema | Possível explicação | Açao Social |
|---|---|---|
| Disquete de agulha; agulha ângulos lateralmente | Entrada fora da linha média; supraespinhoso perdido ligamento | Reavalie a linha média; redirecionar agulha |
| Contato ósseo < 2 cm | Processo espinhoso contactado; flexão da coluna inadequado | Reidentificar o interespaço; coloque a agulha na caudal região do interespaço |
| Contato ósseo em ≥ 4 cm | Entrada da agulha muito lateral; lâmina contatada | Redirecionar a agulha para a linha média |
| Resistência óssea todo | Ligamentos ossificados; coluna artrítica | Considere a abordagem paramediana |
| Incapacidade de avançar cateter | Falsa perda de resistência; epidural estreito espaço; agulha muito próxima da dura-máter; orifício de agulha obstruído | Predistensão de fluidos; gire o bisel da agulha; use mais rígido cateter; avance levemente a agulha peridural; tente uma nova colocação em diferentes interespaços; retirar a agulha para o ligamento amarelo e recomeçar |
| Heme em cateter | Canulação da veia peridural; entrada de agulha também lateral; veias epidurais ingurgitadas | Retire o cateter 1–2 cm e lave com soro fisiológico; realizar nova colocação se o heme persistir; considerar iniciar procedimento epidural em lateral posição |
| Retorno de fluido quente e claro em agulha ou cateter | Punção dural acidental; intratecal localização | Distinguir líquido cefalorraquidiano de soro fisiológico ou anestesia local; se o líquido cefalorraquidiano, considerar coluna contínua ou nova colocação em interespaço diferente |
| Dor/parestesia em inserção de cateter | Cateter avançado > 6 cm na epidural espaço; cateter perto da raiz nervosa | Retirar o cateter para < 6 cm no espaço epidural (2–3 cm para procedimentos cirúrgicos curtos); executar nova colocação se a dor persistir |
| Incapacidade de palpar processos espinhosos | Obesidade; artrite grave; paciente com cirurgia nas costas anterior | Otimize a posição do paciente; considere a linha média abordagem para pacientes obesos; usar localizador longo agulha para ajudar a identificar pontos de referência ósseos; considerar a colocação em posição lateral se o paciente incapaz de flexionar a coluna; usar ultrassonografia |
| Incapacidade de flexionar a coluna | Idoso; artrite; paciente com anterior instrumentação espinhal | Considere a abordagem paramediana; considerar colocação em posição lateral |
| Curvatura da coluna | Escoliose | Usar ultrassonografia; se possível, execute procedimento abaixo do nível de curvatura (caso contrário agulha direta na curva) |
Dificuldade em identificar o espaço peridural
Várias medidas de solução de problemas podem ajudar se ocorrer LOR equívoco ao tentar identificar o espaço epidural. Primeiro, certifique-se de que a seringa LOR esteja firmemente conectada à agulha epidural. Se estiver usando a técnica LOR para ar, em seguida, coloque 2–3 mL de solução salina na seringa LOR e empurre suavemente (ou seja, com o dedo mínimo). Se estiver usando LOR para salina, omita a bolha para esta etapa. A solução salina fluirá facilmente se a ponta da agulha epidural estiver no espaço epidural, mas encontrará resistência se a ponta da agulha estiver em tecido mole.
Se a resistência for encontrada, continue injetando a solução salina no tecido mole e, em seguida, retome a técnica LOR original. Muitas vezes, o feedback familiar da seringa LOR retorna depois que a solução salina se dissipou nos planos dos tecidos moles.
Outro método para distinguir entre o tecido mole e o espaço epidural durante a técnica de LOR para solução salina é colocar uma pequena bolha na seringa de LOR. A bolha deve comprimir em graus variados quando a agulha peridural estiver em tecido mole ou ligamento, mas injetará sem esforço se a agulha estiver no espaço peridural.
Se o LOR ainda for ambíguo, insira uma agulha espinhal de calibre 25 ou 27 através da agulha epidural para perfurar a dura-máter. Se o LCR estiver visível na agulha espinhal, a agulha epidural está posicionada corretamente. A ausência de LCR indica que o espaço peridural ainda não foi encontrado ou que a agulha peridural está fora da linha média, no espaço peridural lateral. Se o LOR permanecer ambíguo, tente enfiar o cateter.
Muitos cateteres, particularmente as versões flexíveis ou reforçadas com fio, não avançarão se a agulha peridural não estiver totalmente no espaço peridural.
Parestesias durante a colocação de agulha ou cateter peridural
Os pacientes não raramente relatam parestesias durante procedimentos epidural, particularmente no questionamento direto pelo clínico. Como uma parestesia indica que a agulha ou cateter está próximo a um nervo, a agulha deve ser retirada e redirecionada se a sensação persistir. Alternativamente, o procedimento epidural pode ser iniciado em outro interespaço. Na maioria das vezes, no entanto, a agulha pode simplesmente ser redirecionada para longe do lado em que a parestesia foi detectada. Durante a colocação do cateter, a pré-distensão de fluidos pode ajudar a reduzir a incidência de parestesias, embora os dados sejam conflitantes. Enfiar o cateter não mais do que 5-6 cm parece reduzir o risco de parestesias. O uso de cateteres flexíveis e, em particular, cateteres reforçados com fio também parece reduzir a incidência de parestesias. Se uma parestesia for transitória, é aceitável continuar avançando a agulha ou enfiando o cateter.
Punção Dural Acidental
A punção dural acidental complica cerca de 1% dos procedimentos peridurais, embora a incidência relatada varie substancialmente na literatura. As opções de manejo incluem a colocação de um cateter espinhal contínuo ou a retirada da agulha peridural e a repetição do procedimento peridural em um interespaço diferente. Se um cateter espinhal é colocado ou uma nova colocação epidural é realizada, a escolha deve ser feita rapidamente para evitar a saída excessiva de LCR através da agulha epidural de grande calibre. Uma técnica espinhal contínua pode ter a pequena vantagem de reduzir a incidência de CPPD e a necessidade de uma EBP (ver discussão a seguir), embora os dados sejam limitados e conflitantes. Nos casos em que a identificação do espaço peridural foi difícil ou com pacientes de alto risco (p. Esta opção evita o risco de uma segunda punção dural e foi relatado para fornecer analgesia e anestesia confiáveis, embora os dados sejam conflitantes. As desvantagens de rosquear um cateter espinhal contínuo incluem o risco de uma injeção acidental de grandes doses de AL destinadas ao espaço epidural e, possivelmente, um risco aumentado de infecção. Protocolos devem estar em vigor para alertar todos os provedores quando um cateter espinhal foi colocado.
Se o médico optar por colocar a epidural em outro interespaço, ele corre o risco de um segundo ADP. Além disso, há uma preocupação com a passagem do AE do espaço peridural para o subaracnóideo através da brecha dural, resultando em um bloqueio nervoso maior do que o previsto. Embora possa não ser necessário, é razoável reduzir a taxa basal para bombas contínuas ou PCEA; como sempre, tenha cuidado ao injetar bolus de AL ou morfina epidural. As evidências não suportam o uso do cateter peridural para PBE profilática, embora estudos mais recentes possam demonstrar algum benefício. Considerações mais elaboradas da anatomia, fisiopatologia e tratamento da CPPD são discutidas em Cefaleia pós-punção dural.
Dificuldade de enfiar o cateter
Dificuldade em enfiar o cateter não é incomum, mesmo que a agulha esteja devidamente encaixada no espaço epidural. Esse problema é mais comum com cateteres flexíveis de ponta macia. As medidas de resolução de problemas incluem a confirmação de que a agulha peridural está devidamente posicionada no espaço peridural (ver discussão anterior); injetar vários mililitros de solução salina para “abrir” o espaço epidural; avançar levemente a agulha peridural para que todo o bisel fique engatado no espaço peridural (a seringa LOR com soro fisiológico sem bolha de ar deve ser colocada durante esta etapa); girar o bisel da agulha peridural; inserir um cateter diferente e menos flexível; retrair a agulha até o ligamento e identificar novamente o espaço peridural; e repetir o procedimento epidural em um nível espinhal diferente. Ocasionalmente, a agulha peridural é obstruída com detritos teciduais que bloqueiam a passagem do cateter pelo nervo. Substituir e depois remover o estilete pode servir para remover os detritos obstrutivos. A pressão subatmosférica é variável na região lombar; É improvável que pedir ao paciente que respire fundo facilite a passagem do cateter, principalmente quando com cateteres flexíveis reforçados com fio. Em geral, realizar uma nova colocação em outro interespaço parece conferir menos risco de ADP do que girar a agulha ou avançar cautelosamente a agulha epidural. Se optar por recomeçar em outro interespaço, retire a agulha e o cateter simultaneamente para evitar o cisalhamento do cateter.
Bloqueio de Nervo Unilateral
Após uma epidural ter sido administrada adequadamente, o paciente pode queixar-se de que um lado está densamente bloqueado, enquanto o lado oposto apresenta dor e função motora intactas. A explicação mais comum para um bloqueio unilateral do nervo é que o cateter avançou muito no espaço epidural, permitindo que a ponta do cateter entre no forame intervertebral ou esteja próxima de um nervo. Os dados atuais sugerem que não há indicação para avançar um cateter (seja orifício de extremidade única ou multiorifício) mais de 6 cm no espaço epidural. Se um bloqueio unilateral do nervo persistir apesar da profundidade de inserção adequada, considere puxar o cateter 1–2 cm para trás, deixando 3–4 cm (2–3 cm para procedimentos curtos) no espaço epidural. Se o paciente permanecer desconfortável apesar da manipulação do cateter, coloque o paciente em decúbito lateral com o lado desbloqueado para baixo e administre vários mililitros de AL diluído. Se essas manobras não surtirem efeito, substitua o cateter.
Sangue na agulha ou cateter epidural
A canulação da veia peridural não é incomum, embora a incidência tenha diminuído substancialmente com o uso generalizado de cateteres flexíveis. As veias epidurais situam-se principalmente no espaço epidural anterior, delimitado pelo ligamento longitudinal posterior e sua fáscia. Uma punção sangrenta pode ser uma indicação de que a inserção da agulha ou do cateter é muito lateral e deve ser redirecionada para a linha média. Outras medidas para minimizar o risco de canulação da veia peridural durante a inserção do cateter incluem o uso de cateteres reforçados com fio, a administração de fluido para abrir o espaço peridural antes da passagem do cateter e evitar a inserção do cateter além de 5-6 cm, entre outras ( veja Toxicidade Sistêmica Anestésica Local). Se o sangue retornar através do cateter apesar dessas medidas, o cateter pode ser ligeiramente retirado e lavado com solução salina. Isso pode ser repetido até que o sangue pare de retornar ou haja comprimento insuficiente do cateter no espaço epidural, momento em que o cateter deve ser substituído.
Dor apesar da altura e densidade adequadas do bloqueio do nervo
A dor persistente apesar da altura e densidade adequadas do bloqueio do nervo pode ser resultado de bloqueio incompleto (“janela” de dor), bloqueio “irregular” ou má disseminação sacral. Uma janela de dor na qual uma área pequena e distinta permanece desbloqueada apesar de um bloqueio nervoso denso pode ser difícil de solucionar. É razoável administrar recargas e virar o paciente com o lado da janela do cateter para baixo. A injeção de opioides no espaço epidural também pode ajudar. No entanto, realizar uma técnica CSE que forneça densidade da porção espinhal ou substituir a peridural
em outro interespaço pode ser necessário. Deve-se ter extremo cuidado ao decidir realizar anestesia CSE em caso de falha na anestesia epidural, pois pode haver um risco maior de raquianestesia alta. Sempre que possível, um cateter espinhal contínuo com dosagem gradual do anestésico espinhal deve ser considerado.
Um bloqueio de nervo “manchado” ou “irregular” pode resultar da injeção de ar ao usar a técnica LOR para ar, de variações anatômicas individuais que contribuem para dermátomos “perdidos” ou da migração do cateter. Administrar AL adicional, com ou sem opióide, após um período de tempo suficiente desde que a dose inicial é apropriada. Também pode ajudar a retirar o cateter 1–2 cm e colocar o paciente com o lado menos bloqueado na posição dependente. No entanto, também é razoável substituir o cateter, principalmente se forem administrados múltiplos reabastecimentos e se houver uma alta probabilidade de conversão para anestesia cirúrgica.
No caso de má disseminação sacral, as seguintes medidas podem ajudar: Elevar a cabeceira do leito e redose o cateter com AL mais concentrado; administrar 100 μg de fentanil peridural para melhorar a qualidade do bloqueio nervoso; ou injetar neostigmina sem conservantes 500–750 μg ou clonidina 75 μg por via peridural.
A substituição de uma epidural autônoma por uma CSE também melhora a analgesia sacral, pois o nervo sacral é grande e ocasionalmente difícil de bloquear com ALs administrados no espaço epidural.
Analgesia inadequada apesar do cateter peridural totalmente dosado
Na maioria das vezes, a melhor estratégia é substituir o cateter peridural. Para avaliar se uma epidural está funcionando adequadamente, sinta se ambas as pernas estão quentes ao toque (a vasodilatação induzida pelo AL deve aquecer as extremidades inferiores se a epidural estiver posicionada corretamente e em pleno funcionamento). Avaliar também se o paciente apresenta diminuição da percepção da temperatura e diminuição da resposta à picada de agulha nos dermátomos que correspondem ao bloqueio sensorial esperado. Considere administrar uma dose definitiva de AL (por exemplo, 5–10 mL de lidocaína a 2% com ou sem epinefrina em doses incrementais) para determinar se o cateter está funcionando, desde que o bloqueio motor resultante não seja contraindicado. Avaliar a força motora do paciente e a percepção de temperatura e dor após cada dose. Monitore os sinais vitais para qualquer indicação de hipotensão induzida pela simpatectomia. É aconselhável não administrar mais de 10 mL de AL se o cateter permanecer ambíguo; remover o cateter e realizar uma anestesia espinhal incorre no risco de uma espinha alta ou total se uma quantidade excessiva de AL já tiver sido administrada por via peridural. Evidências recentes sugerem que o número de reposições é um indicador confiável de que uma epidural usada para analgesia pode ser usada com sucesso para anestesia cirúrgica. Se várias recargas tiverem sido administradas e o grau de analgesia permanecer ambíguo, o cateter deve ser removido e substituído.
Bloqueio Dissipador de Nervos que Requer Doses Maiores
Esse problema ocorre por vários motivos possíveis. Pacientes que receberam CSEs com fentanil espinhal ou uma combinação de opióide e AL podem experimentar uma transição abrupta do alívio para um bloqueio do nervo peridural inadequado, particularmente se o anestésico espinhal tiver resolvido antes que um volume suficiente da infusão peridural tenha se acumulado. Doses cada vez maiores de AL por epidural podem ser necessárias para compensar a dose de carga epidural inadequada e para atender às altas expectativas do paciente após experimentar o conforto da porção espinhal. Alternativamente, se o cateter peridural foi usado para analgesia e foi administrado com frequência, pode ocorrer taquifilaxia para o AL. Outra possibilidade é que o cateter tenha migrado para um vaso (ver discussão anterior) ou tenha se deslocado completamente do espaço epidural. Se o cateter permanecer em seu local de inserção inicial, administre um bolus de AL de maior concentração e aumente a taxa de infusão (se contínua). Considere adicionar um opióide ou clonidina para melhorar a qualidade do bloqueio do nervo.
Falha na analgesia epidural
O problema da falha na analgesia epidural é frequentemente observado em obstetrícia. Um cateter peridural é colocado e dosado, mas o paciente permanece desconfortável. Mais AL é administrado, com melhora subjetiva. Em seguida, a paciente é levada ao centro cirúrgico para cesariana, que exige nível sensitivo T4 denso, e o bloqueio do nervo é inadequado. Existem várias opções se uma epidural falhar apesar das medidas de solução de problemas. Em situações eletivas, o cateter peridural pode ser substituído, preferencialmente em outro interespaço, e redosado cautelosamente para diminuir o risco de bloqueio peridural alto. Para procedimentos mais urgentes, um CSE pode ser realizado. Uma dose reduzida de medicação espinhal é necessária se um grande volume de AL peridural foi administrado durante a solução de problemas ou se o paciente tiver um bloqueio parcial do nervo. Com um CSE, o nível sensorial pode ser aumentado conforme necessário com dosagem epidural suplementar. Uma dose reduzida de dose única espinhal também pode ser apropriada se a velocidade de início for uma preocupação.
No entanto, substituir uma técnica epidural com falha por uma técnica espinhal incorre no risco de raquianestesia alta ou total. Infiltrar a pele e o tecido subcutâneo com AL ou realizar um bloqueio de nervo periférico, dependendo do tempo restante da cirurgia e do tipo de cirurgia, podem oferecer alternativas. A conversão para GA é apropriada se não houver tempo suficiente para repetir a técnica neuroaxial ou para colocar um bloqueio de nervo periférico ou se a realização de outro procedimento neuroaxial apresentar risco indevido.
Idealmente, uma epidural não funcionante será reconhecida e substituída antes que grandes doses de AL tenham sido administradas e antes que técnicas anestésicas alternativas sejam necessárias. O número de bolus necessários para manter a analgesia adequada é um indicador confiável de que uma peridural usada para analgesia pode falhar na conversão para anestesia cirúrgica. Como regra geral, se a função do cateter permanecer ambígua durante a dosagem, pare de injetar após um volume predeterminado (por exemplo, 10 mL) para garantir que a execução de outra técnica regional não leve a raquianestesia alta ou total ou à toxicidade sistêmica do AL (LAST).
Dificuldade em remover o cateter peridural
Ocasionalmente, encontra-se resistência na tentativa de remoção do cateter peridural. O uso de força excessiva pode causar a quebra do cateter e fragmentos do cateter retidos. Em caso de aprisionamento do cateter, colocar o paciente em decúbito lateral ou na posição de inserção original e aplicar tração contínua e suave pode facilitar a remoção. Às vezes, pode ser necessário posicionar o paciente na mesma posição em que o cateter foi inserido. Fixar o cateter na pele sob tração e tentar removê-lo mais tarde, enfiar um estilete e injetar solução salina em um cateter reforçado com fio também foram observados para auxiliar na remoção. Relatos de sequelas neurológicas de fragmentos retidos são raros, sugerindo que a remoção cirúrgica é injustificada no paciente assintomático.
COMPLICAÇÕES E EFEITOS COLATERAIS COMUNS
As complicações do bloqueio epidural podem ser classificadas amplamente como relacionadas ao medicamento ou ao procedimento. Complicações potenciais relacionadas a drogas incluem LAST, alergia a LAs, lesão direta do tecido nervoso induzida por LA e erros de drogas ou modo de administração. As complicações relacionadas ao procedimento podem ser leves a moderadas ou transitórias, como dor nas costas, pneumoencéfalo e CPPD. Complicações potencialmente fatais incluem injeção subdural de ALs, meningite espinhal total ou alta, infecciosa ou asséptica, parada cardíaca, ASE, formação de hematoma epidural e lesões neurológicas permanentes. Em contraste com as complicações, vários efeitos colaterais conhecidos ou esperados acompanham o início e a manutenção do bloqueio peridural sem afetar adversamente os resultados do paciente a longo prazo. Esta seção revisa as complicações e os efeitos colaterais comuns associados ao bloqueio peridural, com ênfase nos fatores de risco, medidas preventivas e tratamento. Várias das complicações são abordadas com mais detalhes em outras partes deste livro.
Toxicidade Sistêmica Anestésica Local
A toxicidade sistêmica do anestésico local resulta da concentração plasmática excessiva no sangue devido a injeção intravascular não intencional ou, menos comumente, absorção sistêmica do local da injeção. A injeção intravascular direta pode ocorrer com a canulação não intencional da veia epidural durante a colocação do cateter ou subsequente migração do cateter para um vaso. Os fatores de risco para canulação intravascular incluem trauma nos vasos peridurais durante o início do bloqueio nervoso, uso de cateteres rígidos, gravidez e posicionamento do paciente durante a colocação epidural, entre outros.tabela 28).
TABELA 28. Fatores de risco para canulação da veia peridural.
| Trauma de vasos peridurais durante o início do bloqueio |
| Várias tentativas de colocação |
| Cateter rígido e não flexível |
| Veias peridurais ingurgitadas (por exemplo, gravidez) |
| Posição sentada |
O risco de canulação da veia peridural em pacientes obstétricas pode ser reduzido com o início do bloqueio peridural na posição lateral, o uso de cateteres reforçados com fio, o uso de cateteres de orifício único (versus multiorifícios), pré-distensão de fluidos com soro fisiológico prévio para enfiar o cateter e limitar a profundidade do cateter a 6 cm ou menos (tabela 29). Limitar o número de tentativas de colocação epidural; evitando o espaço peridural lateral, onde é mais provável a punção do vaso; e evitar a administração direta de ALs através da agulha peridural também pode reduzir o risco de injeção intravascular direta.
TABELA 29. Estratégias para evitar a canulação da veia peridural.
| Colocação em posição lateral |
| Uso de cateter flexível reforçado com fio |
| Uso de cateter único versus multiorifício |
| Predistensão de fluido antes de enfiar o cateter |
| Limite a profundidade de inserção do cateter a < 6 cm de inserção |
Embora os dados sejam inconclusivos quanto ao papel do material do cateter e configuração da ponta, o uso de cateteres flexíveis pode reduzir o risco de migração subsequente do cateter para um vaso. Devido ao efluxo preferencial da porta proximal de cateteres multiporta durante as técnicas de infusão contínua, permanece uma possibilidade remota de que uma porta distal possa migrar para um vaso despercebida até que um bolus manual seja administrado. Isso pode ser evitado com o uso de um cateter de orifício único.
A dosagem do cateter peridural em incrementos de 3 a 5 mL com aspiração negativa frequente de sangue e LCR é recomendada para detectar cateteres mal posicionados. A maioria dos cateteres peridurais disponíveis comercialmente tem janelas de “flashback” distal e proximal para facilitar a visualização de sangue ou LCR na aspiração. O uso de curativo e fita transparente melhora a visualização dessas janelas. Embora o uso da dose de teste de epinefrina tradicional seja controverso, uma dose de teste pode ser usada para avaliar se a ponta do cateter está em um vaso sanguíneo.
O grau de absorção sistêmica é determinado em parte pelo local da injeção, a dose e concentração do AL injetado, as propriedades do AL administrado, a vascularização do local da injeção e a presença ou ausência de epinefrina na solução. Certas condições e comorbidades, como idade avançada, insuficiência hepática, baixa concentração de proteínas plasmáticas, disfunção cardíaca grave, cardiopatia isquêmica, anormalidades da condução cardíaca e acidose metabólica e respiratória, também podem predispor os pacientes à toxicidade sistêmica. Em geral, a absorção sistêmica do espaço epidural é menos provável de
ocorrem do que em áreas de maior vascularização. As áreas de maior concentração plasmática de absorção em ordem decrescente são as seguintes: intercostal, caudal, paracervical, epidural, plexo braquial e ciático/femoral.tabela 30).
TABELA 30. Ordem relativa do pico de concentração plasmática do anestésico local associado à anestesia regional (ordem decrescente).
| Intercostal |
| Fluxo |
| paracervical |
| Epidural |
| Plexo braquial |
| Ciático/femoral |
No entanto, o trauma nos vasos durante o início do procedimento epidural pode levar a uma absorção intravascular mais rápida do espaço epidural do que o previsto. A adição de epinefrina à solução de AL diminui a absorção sistêmica, mas pode não ser apropriada em áreas altamente vasculares, onde a absorção sistêmica é provável, ou para todas as populações de pacientes. A epinefrina também pode prolongar desnecessariamente a duração da ação dos ALs. A toxicidade associada à absorção sistêmica de ALs pode ser reduzida pela seleção cuidadosa do paciente, mantendo-se vigilante quanto a sinais e sintomas de toxicidade, limitando a dose total de AL administrada, uso de concentrações apropriadas de AL e, possivelmente, usando os ALs amida mais recentes, como como ropivacaína e levobupivacaína.
A bupivacaína racêmica tem sido associada a maior cardiotoxicidade devido à maior ligação e dissociação mais lenta dos canais iônicos no miocárdio.
Os primeiros sinais e sintomas de toxicidade do AL no SNC incluem tontura, tontura, zumbido, dormência e formigamento perioral, fala arrastada, diplopia ou visão turva, inquietação e confusão. Espasmos musculares, tremores dos músculos faciais e extremidades, calafrios e convulsões generalizadas ocorrem em concentrações plasmáticas mais altas, seguidas de depressão global do SNC, manifestada por sonolência, inconsciência e parada respiratória. Acidose, hipercapnia e hipóxia predispõem e exacerbam a toxicidade do SNC. As manifestações cardiovasculares em altas concentrações plasmáticas incluem hipotensão, bradicardia e outras arritmias e parada cardíaca.tabela 31).
Quando o LAST for reconhecido ou suspeito, abstenha-se de administrar LA adicional e peça assistência. O tratamento requer atenção imediata ao suporte das vias aéreas, supressão da atividade convulsiva e preparação para ressuscitação cardiopulmonar e, possivelmente, CEC. As diretrizes atuais recomendam limitar as doses individuais de epinefrina a menos de 1 μg/kg durante os esforços de ressuscitação. A terapia com emulsão lipídica (20%) deve ser iniciada com uma dose de carga inicial de 1.5 mL/kg, seguida por uma infusão contínua de 0.25 mL/kg/min por um mínimo de 10 minutos após a estabilidade circulatória ter sido restaurada. Referir-se Toxicidade Sistêmica Anestésica Local para uma discussão mais detalhada de LAST.
TABELA 31. Sinais e sintomas de anestesia local
toxicidade sistêmica.
| Sistema nervoso central Toxicidade | Toxicidade Cardiovascular |
|---|---|
| Formigamento perioral e entorpecimento | Hipotensão |
| Tonturas/tonturas | Vasodilatação periférica |
| Zumbido | Bradicardia, condução atrasos |
| Distúrbios visuais | Arritmias ventriculares |
| Inquietação, agitação | Paragem cardíaca |
| Fala arrastada | |
| Tremendo | |
| Convulsões generalizadas | |
| Depressão respiratória/ prender |
Alergia a anestésicos locais
As verdadeiras reações alérgicas aos LAs podem ocorrer, mas felizmente são raras. A maioria das reações documentadas não é mediada por imunoglobulina E (IgE) e pode ser atribuída a reações a outros agentes administrados concomitantemente (por exemplo, aditivos, epinefrina, conservantes, antibióticos) ou a uma reação de hipersensibilidade tardia tipo IV (por exemplo, dermatite de contato leve). Alternativamente, as reações relatadas podem ser decorrentes de ansiedade, episódio vasovagal, estimulação simpática endógena ou uma resposta adversa do paciente ao próprio procedimento cirúrgico, odontológico, oftálmico ou obstétrico.
Com base em uma extensa revisão da literatura, Bhole e colegas estimaram a prevalência de alergia mediada por IgE verdadeira em menos de 1%. Uma reação mediada por imunocomplexos associada a níveis reduzidos ou depletados de complemento sérico é ainda mais rara.
Quando um paciente relata um histórico de alergia aos ALs, é importante obter um histórico detalhado, incluindo qual AL foi implicado, a dose e via de administração, a reação que ocorreu e o quadro clínico. As reações alérgicas verdadeiras podem apresentar uma série de sinais e sintomas dermatológicos, cardíacos ou respiratórios, como urticária, prurido, angioedema, hipotensão, choque e broncoespasmo. Embora a literatura atual sugira que as reações alérgicas aos ALs amida são mais comuns do que as reações aos ALs do tipo ligação éster, isso pode refletir o uso preferencial atual dos primeiros. Historicamente, reações adversas, especialmente dermatite de contato, foram relatadas com mais frequência com agentes éster, como procaína, benzocaína, tetracaína e cloroprocaína. Isso pode ser parcialmente atribuído ao fato de que os compostos éster são derivados do ácido para-aminobenzóico (PABA), um aditivo encontrado em muitos utensílios domésticos (por exemplo, loção, protetor solar, cosméticos); a hipótese de exposição anterior ao PABA pode sensibilizar os indivíduos aos ésteres LAs. Alternativamente, o metilparabeno, um conservante em LAs amida e éster que é metabolizado em PABA, pode ser responsável por muitas das reações alérgicas relatadas. Reatividade cruzada entre os grupos amida e éster foi relatada, mas é extremamente rara e provavelmente atribuível a um conservante comum. A reatividade cruzada pode ocorrer entre LAs éster e, menos comumente, entre LAs amida.
Atualmente, faltam testes confiáveis para identificar a sensibilidade aos ALs. A presença de triptase de mastócitos séricos pode confirmar uma reação anafilática no pós-operatório imediato, enquanto testes cutâneos, testes intradérmicos e testes de provocação subcutânea podem ajudar a identificar o agente causador. O manejo de uma reação alérgica aos ALs inclui a remoção do agente agressor; administração precoce de epinefrina intravenosa para tratar hipotensão e colapso cardiovascular; suporte de via aérea, se necessário; e, possivelmente, administração intravenosa de bloqueadores dos receptores de histamina-1 e -2, broncodilatadores e corticosteróides.
Aracnoidite
A aracnoidite é uma doença rara marcada por alterações inflamatórias na aracnóide. Embora o mecanismo preciso permaneça obscuro, a fibrose se desenvolve e as adesões se formam entre as raízes nervosas e as membranas que circundam o cérebro, a medula espinhal e a cauda equina. Em casos crônicos e adesivos, os depósitos de colágeno acabam encapsulando as raízes nervosas, criando atrofia das raízes nervosas como resultado de uma interrupção no suprimento sanguíneo. Trauma, cirurgia, infecções, contaminantes, desinfetantes, meios de contraste, tumores, hemorragia subaracnóidea e a administração subaracnóidea de irritantes (por exemplo, esteróides) podem precipitar essas alterações inflamatórias. A administração intratecal acidental de grandes volumes de cloroprocaína contendo o conservante bissulfito de sódio também tem sido associada à aracnoidite, embora o papel do conservante tenha sido questionado em estudos recentes.
A relação entre bloqueio do nervo peridural ou colocação de cateter e aracnoidite não foi claramente estabelecida na literatura. Não existem dados sobre o risco de aracnoidite com o uso da solução anti-séptica clorexidina em humanos; no entanto, é prudente manter a solução longe de todos os medicamentos e equipamentos nos kits de raquianestesia e peridural e deixá-la secar antes de iniciar procedimentos neuroaxiais. A clorexidina em álcool continua a ser a solução de escolha para a desinfecção da pele antes do início do bloqueio neuroaxial central.
A apresentação clínica da aracnoidite é complexa, com sintomatologia variada, podendo demorar vários meses. As características clínicas mais comuns são dor nas costas que irradia para as extremidades inferiores e aumenta com o esforço; dor nas nádegas; espasmos musculares; diminuição da amplitude de movimento do tronco; anormalidades sensoriais; fraqueza motora ou paralisia abaixo do nível da lesão que normalmente não progride; e disfunção do esfíncter urinário (tabela 32).
Infelizmente, a apresentação clínica mista pode levar a erros de diagnóstico, e a aracnoidite pode ser atribuída incorretamente a estenose espinhal, doença do disco lombar, tumores espinhais ou outras lesões compressivas da coluna. O diagnóstico pode ser confirmado por mielografia, tomografia computadorizada (TC) ou ressonância magnética. Achados característicos de ressonância magnética mostram conglomerados de raízes que residem centralmente no saco dural, aderências que prendem as raízes nervosas perifericamente e tecido mole substituindo o espaço subaracnóideo.
TABELA 32. Apresentação clínica da aracnoidite.
| Dor nas costas irradiando para as extremidades inferiores, piora com a atividade |
| Dor nas nádegas |
| Espasmos musculares |
| Fraqueza/paralisia motora |
| Diminuição da amplitude de movimento do tronco |
| Disfunção do esfíncter urinário |
Infelizmente, é improvável uma melhora neurológica significativa com as terapias atuais, incluindo corticosteroides intravenosos, AINEs e antibioticoterapia. Os déficits podem evoluir para incapacidade grave e permanente.
Dor lombar
A dor nas costas é uma queixa pós-operatória comum, com incidência que varia de 3% a 31% após cirurgia não obstétrica, independentemente da técnica anestésica. Embora a etiologia seja multifatorial, tanto a lombalgia pós-operatória quanto a dor periparto são frequentemente atribuídas a técnicas neuroaxiais quando existe uma associação temporal.
A dor nas costas após o bloqueio epidural é mais comum, mais grave e mais duradoura do que após procedimentos espinhais. Trauma local, inflamação dos ligamentos, punção com agulha de um disco intervertebral, estiramento das cápsulas e ligamentos articulares além de seu alcance fisiológico e espasmo muscular podem ser responsáveis por algumas das dores nas costas pós-epidural relatadas. O uso de agulhas maiores, a inserção de cateteres e o aumento do volume dos ALs, quando comparados às técnicas espinhais, também podem desempenhar um papel. Grandes doses epidurais de 2-cloroprocaína contendo o conservante EDTA também foram associadas à dor nas costas; complicações semelhantes não foram observadas com 2-cloroprocaína sem conservantes. Em um estudo recente, Hakim e colegas identificaram os seguintes fatores de risco independentes para dor lombar persistente (ou seja, ≥3 meses) após cirurgia não obstétrica com anestesia epidural: múltiplas tentativas de colocação epidural, índice de massa corporal (IMC) mais alto, cirurgia em posição de litotomia e tempo cirúrgico superior a 2.5 horas.
A dor nas costas após o bloqueio epidural geralmente é autolimitada e deve desaparecer em 7 a 10 dias. Os pacientes devem ser encorajados a evitar o repouso no leito. AINEs, acetaminofeno ou calor podem proporcionar alívio sintomático. Se a dor persistir, progredir ou for desproporcional ao esperado, outras etiologias, como TNS, hérnia de disco, estenose espinhal, aracnoidite, sacroileíte, lesão musculoesquelética, lesão nervosa, abscesso epidural e hematoma epidural, devem ser consideradas . As intervenções profiláticas que podem ajudar a prevenir a dor nas costas associada a procedimentos epidural incluem a realização de um bloqueio do nervo de campo para anestesiar os nervos espinhais recorrentes que inervam os ligamentos e músculos interespinhosos antes de iniciar o bloqueio epidural; adição de AINEs ao AL usado para infiltração da pele; e administração de dexametasona epidural.
Apesar da ampla associação entre dor nas costas musculoesquelética e procedimentos neuraxiais, estudos de mulheres grávidas que receberam analgesia epidural para dor de parto fornecem evidências convincentes de que a dor nas costas não está relacionada a técnicas neuraxiais. Vários ensaios clínicos randomizados e estudos de coorte prospectivos mostraram que a dor nas costas pós-parto nova e de longo prazo não é causada pela analgesia epidural intraparto.
Cefaleia pós-punção dural
A cefaleia pós-punção dural é uma complicação comum da raquianestesia, punções lombares (“torneiras espinhais”) e procedimentos peridurais complicados por ADP ou ruptura dural não reconhecida. A incidência de ADP é geralmente aceita como sendo igual ou inferior a 1%; até 80% dos pacientes podem apresentar PDPH após ADP. Embora o mecanismo preciso permaneça mal compreendido, os sinais e sintomas de CPPD parecem resultar do vazamento de LCR através do orifício dural. Na posição vertical, o tecido cerebral cede na abóbada craniana, criando tração dolorosa na dura-máter, foice do cérebro, vasos sanguíneos cerebrais, tentório, nervos cranianos e raízes nervosas. Essa tração também contribui para as paralisias de nervos cranianos que não são raras em pacientes com CPPD. A vasodilatação cerebral compensatória em resposta à diminuição do LCR também parece desempenhar um papel na gênese e gravidade da CPPD.
Falta na literatura uma definição universalmente aceita de CPPD. De acordo com a International Headache Society, uma CPPD se desenvolve dentro de 5 dias após uma punção lombar, geralmente acompanhada de rigidez de nuca ou sintomas auditivos subjetivos,
e resolve-se espontaneamente dentro de 2 semanas ou após tratamento eficaz com EBP. Clinicamente, os pacientes geralmente se queixam de uma cefaleia fronto-occipital que é leve ou ausente na posição supina e se intensifica quando a cabeça é elevada. A dor pode se estender para o pescoço, ombros e extremidades superiores e pode ser acompanhada de náuseas e vômitos, tontura, diplopia, zumbido, visão turva, nistagmo e perda auditiva. O envolvimento do nervo craniano deve levar a uma avaliação e tratamento rápidos. A dor de cabeça se desenvolve dentro de 48 horas na grande maioria dos casos (mais comumente nas primeiras 24 horas) (tabela 33). As dores de cabeça que ocorrem durante ou imediatamente após procedimentos epidural são mais prováveis devido à injeção acidental de ar durante a identificação do espaço epidural com a técnica LOR to air (pneumoencéfalo).
TABELA 33. Sinais e sintomas de cefaleia pós-punção dural.
| Cefaleia fronto-occipital; intensifica quando a cabeça é elevado |
| Rigidez do pescoço |
| Dor no pescoço, ombro e/ou braço |
| Perda auditiva de zumbido |
| Náuseas, vômitos, tonturas |
| Diplopia, visão turva, nistagmo |
A CPPD geralmente se resolve espontaneamente em 1 a 2 semanas, mas pode durar meses ou até anos; uma porcentagem substancial de pacientes pode desenvolver dores de cabeça crônicas após ADP com uma agulha Tuohy de grande calibre.
Os fatores de risco para CPPD incluem idade mais jovem, sexo feminino, IMC mais baixo, gravidez, empurrar durante o segundo estágio do trabalho de parto, uso de agulhas cortantes versus agulhas espinhais atraumáticas e uso de agulhas de calibre maior.tabela 34). Há evidências menos convincentes sobre o papel da orientação do bisel da agulha, o número de punções durais, a abordagem usada para entrar no espaço epidural (paramediano vs. linha média), o posicionamento do paciente durante o início do procedimento epidural e a técnica usada para identificar a epidural espaço (LOR ao ar versus solução salina com ou sem bolha de ar).
TABELA 34. Fatores de risco para cefaleia pós-punção dural.
| Idade mais jovem |
| Gênero feminino |
| Índice de massa corporal baixo |
| Perda de resistência ao ar |
| Empurrando durante o segundo estágio do trabalho de parto |
| Uso de agulha de corte |
| Uso de agulha de calibre maior |
Várias intervenções para a prevenção ou tratamento da CPPD têm sido propostas. Parece haver pouco benefício de medidas conservadoras, como repouso no leito e administração agressiva de fluidos. No entanto, o alívio sintomático pode ser obtido com analgésicos, agentes farmacológicos com propriedades vasoconstritoras (cafeína, teofilina, sumatriptano) e, possivelmente, corticotropina (ACTH). Em uma revisão sistemática quantitativa das evidências disponíveis para medidas de prevenção da CPPD, Apfel et al descobriram que a administração de morfina epidural antes da remoção do cateter pode conferir alguma vantagem, mas essa conclusão foi baseada em um pequeno estudo controlado randomizado. Em uma meta-análise recente, Heesen et al. sugeriram que a inserção de um cateter intratecal após ADP pode proteger contra PDPH e pode reduzir a necessidade de EBP, mas estudos adicionais são necessários. As evidências até o momento sobre o uso rotineiro de PBE profilática não são conclusivas. Existem dados limitados para apoiar o remendo epidural com solução salina normal, dextrano 40 e gelatina e cola de fibrina.
O tampão sanguíneo peridural, preferencialmente no início da cefaleia, continua sendo o padrão-ouro para o tratamento. Estudos observacionais relataram recuperação rápida em mais de 90% dos pacientes após EBP, embora o alívio possa ser transitório em uma pequena porcentagem desses pacientes. Um estudo controlado randomizado bem desenhado em pacientes de neurologia demonstrou que a EBP oferece resolução completa dos sintomas em uma grande porcentagem de pacientes e reduz a gravidade dos sintomas naqueles que não apresentam resolução completa. Além disso, o tratamento precoce com uma EBP diminui o tempo de internação hospitalar e visitas à emergência e permite que os pacientes retomem suas atividades da vida diária mais cedo do que seria possível com a conduta expectante.
Antes de realizar uma PBE, outras causas de cefaleia, como pré-eclâmpsia/eclâmpsia e meningite, devem ser descartadas. Em certos cenários clínicos, também pode ser necessário descartar PIC elevada. Usando técnicas estéreis, o espaço epidural no nível ou abaixo do nível de ADP anterior é identificado usando LOR para solução salina normal. A bolha de ar é omitida devido à preocupação de que o ar possa entrar na brecha dural, levando ao pneumoencéfalo. Até 20 mL de sangue do paciente (retirado assepticamente) é injetado lentamente no espaço; o médico deve parar de injetar sangue se o paciente sentir dor ou pressão moderada a intensa na região lombar ou no pescoço. Embora o volume ideal de sangue ainda não tenha sido determinado, a injeção de mais de 20 mL parece não conferir nenhum benefício adicional. O paciente normalmente permanece em decúbito dorsal por pelo menos 1 hora após a EBP. Dor nas costas e, menos frequentemente, dor no pescoço são comumente sentidas durante o procedimento e, quando graves, podem alertar o médico para parar de injetar sangue. Para minimizar o risco de infecções e sequelas relacionadas, tanto a aquisição de sangue autólogo quanto a identificação do espaço peridural devem ser realizadas com técnicas rigorosas de assepsia. Para uma discussão mais aprofundada sobre PDPH, consulte Cefaleia pós-punção durale.
Injeção Subdural
O espaço subdural tem sido descrito historicamente como um espaço potencial entre a aracnóide normalmente aderente e a dura-máter sobrejacente, embora possa representar uma fenda ao longo da camada de células da borda dural que resulta apenas de dano tecidual direto. A injeção de uma pequena dose de AL na área pode ter profundos efeitos hemodinâmicos e simpatolíticos.
A injeção subdural é uma ocorrência relativamente rara, com uma incidência estimada de 0.1%–0.82% das injeções peridurais. As características clínicas que podem ajudar a distinguir a anestesia subdural da peridural ou raquidiana incluem um bloqueio sensorial maior do que o esperado com má disseminação caudal e preservação sacral; um nível mais alto do que o previsto de bloqueio motor de densidade variável; e uma velocidade de início que mais se assemelha à anestesia epidural (10-20 minutos). As injeções subdurais geralmente resultam em bloqueio bilateral, embora bloqueios nervosos unilaterais ou irregulares possam ocorrer, com alterações sensoriais e motoras mais notáveis nas extremidades superiores e analgesia e anestesia inadequadas nas extremidades inferiores. Os pacientes podem desenvolver síndrome de Horner (ptose, miose e anidrose), anestesia facial e corneana e dispneia. Além disso, hipotensão leve a moderada pode se desenvolver (tabela 35). O tratamento pode exigir suporte cardiovascular e respiratório, incluindo administração de fluidos intravenosos e vasopressores e, possivelmente, intubação endotraqueal com ventilação mecânica. No entanto, relatos de casos descrevem o uso de cateteres subdurais para obter anestesia cirúrgica.
TABELA 35. Apresentação clínica de um bloqueio do nervo subdural.
| Bloqueio sensorial acima do esperado |
| Difusão caudal pobre, poupando o sacro |
| Bloco de motor mais alto do que o esperado de densidade variável |
| bloqueio geralmente bilateral, mas pode ser unilateral ou assimétrico |
| Síndrome de Horner (ptose, miose, anidrose) |
| Anestesia facial e corneana |
| Dispnéia |
| Hipotensão |
Anestesia espinhal total
A raquianestesia total, que complica cerca de 1 em 1400 tentativas de procedimentos peridurais, pode resultar de ADP não reconhecido com injeção não intencional de uma dose epidural de AL, administração de uma grande dose de AL no compartimento subdural e migração não detectada da ponta do cateter epidural no espaço subaracnóideo. Também foi observado quando um orifício de um cateter multiorifícios está alojado no espaço subaracnóideo; com translocação de AL por quebra dural acidental ou intencional; após técnicas de CSE; e após a falha do bloqueio epidural ser substituído por uma técnica espinhal.
A raquianestesia total geralmente se desenvolve minutos após a administração do AL, embora possa ocorrer inesperadamente mais tarde com mudanças no posicionamento do paciente ou após a migração de um cateter peridural previamente funcional para o espaço subaracnóideo. Durante a raquianestesia total, o AL se espalha alto o suficiente para bloquear toda a medula espinhal e, ocasionalmente, o tronco encefálico. Alterações sensoriais e motoras ascendentes desenvolvem-se rapidamente, seguidas de hipotensão profunda, bradicardia, dispneia e dificuldade de fonação e deglutição. Inconsciência e apnéia podem resultar da ação direta do AL no tronco encefálico, paralisia dos músculos respiratórios e hipoperfusão cerebral. O tratamento inclui suporte das vias aéreas e, se necessário, intubação endotraqueal; a administração de oxigênio a 100%; e suporte hemodinâmico com fluidos intravenosos e vasopressores. A epinefrina deve ser usada precocemente e em doses crescentes para estabilizar a frequência cardíaca e a pressão arterial em pacientes instáveis. À medida que o bloqueio do nervo retrocede, o paciente recupera a consciência e o controle da respiração, seguido pela recuperação da função motora e sensorial. A administração de sedação até a regressão do bloqueio nervoso pode ser apropriada quando o paciente estiver estável.
A raquianestesia total geralmente pode ser evitada durante as técnicas de cateter peridural contínuo pela administração cuidadosa de AL em pequenas doses divididas, com aspiração frequente e, possivelmente, o uso de uma dose de teste epidural. Os pacientes devem ser monitorados durante as reabastecimentos, durante a dosagem incremental para obter anestesia cirúrgica e durante o uso de PCEAs. Queixas incomuns do paciente e alterações hemodinâmicas inesperadas podem justificar a remoção e substituição imediata do cateter. Se a punção dural não intencional for reconhecida durante a colocação da agulha, a agulha pode ser removida e colocada em outro interespaço ou um cateter espinhal pode ser inserido. Se o ADP for reconhecido após a inserção do cateter, é apropriado prosseguir com uma técnica espinhal contínua ou repetir o procedimento epidural em outro interespaço. Uma dose reduzida de AL pode ser necessária se um cateter for colocado com sucesso em um nível espinhal diferente após uma punção prévia da dura-máter. Se um cateter espinhal for colocado, o cateter deve ser claramente rotulado, a bomba de infusão deve ser rotulada e configurada com uma dose reduzida e todos os profissionais envolvidos devem ser informados. Idealmente, procedimentos e políticas devem estar em vigor em relação ao gerenciamento de cateteres espinhais.
Abscesso epidural espinhal
O abscesso epidural espinhal é uma doença rara que acomete desproporcionalmente pacientes idosos e imunocomprometidos. Indivíduos com permanência prolongada em unidade de terapia intensiva, usuários de drogas intravenosas e pacientes com bacteremia, DM, dependência de álcool, câncer, HIV e doença renal terminal apresentam risco aumentado em comparação com a população em geral.tabela 36). Nas últimas décadas, a incidência de AAE aumentou, em parte devido ao aumento da instrumentação da coluna vertebral, ao aumento do uso de drogas ilícitas e ao envelhecimento da população.
TABELA 36. Condições predisponentes para abscesso epidural espinhal.
| Idoso | Injeção de esteróide |
| diabetes mellitus | Alcoolismo |
| HIV / AIDS | Doença hepática |
| Uso crônico de esteróides | Insuficiência renal |
| Insuficiência adrenal | Artrite reumatóide |
| Cateter peridural crônico | Celulite |
| Urinário prolongado cateterização | Abscesso do psoas |
| Dispositivo vascular permanente | Uso de drogas intravenosas |
| Coluna vertebral recente instrumentação | Osteomielite |
Estima-se que 5% dos AEEs estejam associados a procedimentos peridurais. Os fatores de risco para essa complicação rara incluem infusões prolongadas de cateter peridural e infecção localizada ou sistêmica no momento do início do bloqueio do nervo. O local da colocação epidural também parece colocar alguns pacientes em maior risco de formação de SEA, com cateteres torácicos e lombares implicados com mais frequência do que os cateteres cervicais. A má adesão à técnica estéril e, possivelmente, múltiplas tentativas de colocação epidural podem colocar os pacientes em risco adicional.
As bactérias obtêm acesso ao espaço epidural por disseminação hematogênica (mais comumente) ou disseminação contígua; a fonte de acesso não é identificada no restante dos casos. Staphylococcus aureus e, cada vez mais, S. aureus resistente à meticilina (MRSA) são responsáveis pela grande maioria dos casos de SEA. Patógenos menos comumente envolvidos incluem Escherichia coli, Pseudomonas aeruginosa e Staphylococcus epidermidis, sendo o último mais comumente associado a procedimentos neuroaxiais, incluindo bloqueio peridural e injeções peridural de esteróides. A infecção parece lesar a medula espinhal por compressão mecânica direta ou trombose (oclusão vascular por tromboflebite séptica) ou uma combinação dos dois, embora o mecanismo preciso não tenha sido elucidado.
O diagnóstico precoce, o tratamento imediato e o acompanhamento consistente são essenciais para evitar danos neurológicos irreversíveis da AEE. Os sintomas clínicos mais comuns são dor nas costas, febre e alterações neurológicas, como fraqueza nas pernas ou déficits sensoriais, mas a maioria dos pacientes não apresenta essa tríade. Em vez disso, os pacientes podem apresentar disfunção da bexiga, sepse, meningite, paraplegia ou tetraplegia, infecção do trato urinário (ITU), alterações do estado mental, inflamação no local do cateter, dor de cabeça, rigidez do pescoço ou náuseas e vômitos. Os sintomas mais comumente aparecem em 7 dias, mas podem ser retardados por 60 dias ou mais. A contagem elevada de leucócitos (leucócitos) e a velocidade de hemossedimentação (VHS) ou proteína C reativa também podem estar presentes, mas esses achados laboratoriais são inespecíficos. Se houver suspeita de AEE, a RM com gadolínio é a ferramenta diagnóstica de escolha. Alguns pesquisadores propuseram que a ressonância magnética seja considerada em pacientes que receberam cateteres peridurais se sinais sistêmicos e locais de infecção (por exemplo, pus ou eritema no local de inserção epidural) se desenvolverem, mesmo na ausência de déficits neurológicos.
A administração intravenosa de antibióticos de amplo espectro, em última análise, adaptada às culturas de sangue ou tecidos, sem drenagem cirúrgica, pode ser o tratamento apropriado para AEE na ausência de sintomas neurológicos. No entanto, a intervenção cirúrgica imediata (laminectomia descompressiva, desbridamento do tecido infectado e drenagem do abscesso) pode ser necessária, dependendo da apresentação clínica. Muito provavelmente devido a um atraso no diagnóstico ou a um diagnóstico inicial incorreto, a morbidade associada à AEE permanece alta em 33%–47%, enquanto a mortalidade é estimada em 5%. O estado neurológico antes da intervenção é o preditor mais forte do resultado final. Há também uma forte associação entre mau prognóstico e idade superior a 70 anos, infecção por cepa de MRSA e presença de DM ou insuficiência adrenal.
O risco e as sequelas a longo prazo da SEA podem ser reduzidos com seleção cuidadosa do paciente, manutenção de técnicas estéreis rigorosas durante o início de procedimentos epidural, administração de antibióticos antes do início do bloqueio neuroaxial em pacientes com febre ou infecção localizada, remoção de cateteres de demora ao primeiro sinal de infecção no local da punção e manutenção de alto índice de suspeição em pacientes com fatores de risco que apresentam queixas neurológicas inespecíficas ou sinais locais e sistêmicos de infecção, possivelmente várias semanas após um procedimento epidural.
Meningite
A meningite bacteriana após anestesia peridural é um evento raro. Os microrganismos podem ser transmitidos por meio de seringas, cateteres, agulhas, tubos de infusão e medicamentos injetados no espaço epidural, bem como pelo clínico ou paciente. Complicações infecciosas semelhantes podem ocorrer com procedimentos não anestésicos, como EBP, mielografia, injeção peridural de esteroides e punção lombar diagnóstica. A maioria dos casos parece ser causada por contaminação do local da punção por organismos da naso ou orofaringe do profissional de saúde. Menos comumente, contaminantes da pele incompletamente esterilizada e disseminação direta ou hematogênica de um local infeccioso endógeno estão implicados. Acredita-se que uma punção dural, como no cenário de um CSE, espinhal ou ADP, coloca os pacientes em maior risco, permitindo a transferência de patógenos transmitidos pelo sangue através da barreira hematoencefálica. No entanto, a incidência de meningite bacteriana permanece baixa, apesar do uso crescente de CSE e técnicas espinhais. Além disso, a punção lombar diagnóstica no contexto de bacteremia raramente está associada à meningite. Fatores de risco adicionais incluem falhas na técnica asséptica, reinserção do estilete que foi exposto ao ar ambiente, dificuldade em realizar o procedimento neuroaxial e, de forma relacionada, múltiplas tentativas de colocação raquidiana ou epidural.
Sinais e sintomas de meningite incluem febre, dor de cabeça, letargia, confusão, rigidez da nuca, náusea/vômito, fotofobia e sinal de Kernigtabela 37).
TABELA 37. Sinais e sintomas de meningite bacteriana.
| Febre |
| Alterações do estado mental (letargia, confusão) |
| Dor de cabeça |
| Rigidez nucal |
| Náuseas, vómitos |
| Dor lombar |
| Fotofobia |
| Convulsões |
| Déficits neurológicos focais |
| Sinal de Kernig |
| Sinal de Brudzinski |
Os sintomas geralmente se apresentam dentro de 6 a 36 horas após o procedimento anestésico. Como a apresentação clínica inicial é semelhante à de uma CPPD, o diagnóstico de meningite pode ser tardio. A meningite pode ser distinguida da CPPD pela presença de febre, alterações do estado mental (isto é, letargia e confusão) e uma dor de cabeça que não é de natureza posicional. O diagnóstico é confirmado com análise e cultura do LCR com ou sem TC de crânio prévia. O LCR é frequentemente turvo, com leucocitose (predominantemente neutrófilos), elevado teor de proteína e baixa concentração de glicose. O diagnóstico precoce é essencial. Patógenos comuns incluem Streptococcus salivarius e outras cepas de estreptococos viridans, S. aureus, P. aeruginosa, Neisseria meningitidis e Enterococcus faecalis. Em muitos casos, nenhum organismo é isolado. O tratamento da meningite bacteriana inclui antibioticoterapia empírica imediata de amplo espectro, como vancomicina com uma cefalosporina de terceira geração, em última análise, adaptada aos resultados da cultura de sangue ou LCR. As sequelas neurológicas podem incluir paralisia de nervos cranianos, hemiparesia, quadriparesia e afasia. Se o diagnóstico e o tratamento forem tardios, pode ocorrer a morte. Adesão às precauções assépticas completas, incluindo remoção de joias, lavagem das mãos, preparação adequada da pele com pacotes individuais de solução antisséptica (de preferência clorexidina com álcool), uso de campo e curativo estéreis e, no mínimo, uso de touca, luvas estéreis e máscaras faciais (trocadas entre cada consulta com o paciente) é fundamental para minimizar o risco de meningite bacteriana associada à instrumentação neuroaxial. Alternativas às técnicas neuroaxiais devem ser oferecidas a pacientes com alto risco de complicações infecciosas, e pacientes com bacteremia conhecida ou suspeita devem iniciar antibioticoterapia antes da instrumentação neuroaxial.
Lesão da medula espinhal e da raiz nervosa
Os déficits neurológicos podem ser causados por trauma direto na medula espinhal ou nos nervos espinhais, por isquemia da medula espinhal, por injeção acidental de drogas ou produtos químicos neurotóxicos, ou por hematomas ou abscessos. Felizmente, lesão neurológica grave é uma complicação extremamente rara da anestesia neuraxial, com incidência estimada de 0.03%–0.1%. Horlocker e colaboradores avaliaram os prontuários de mais de 4000 pacientes que receberam peridurais lombares para cirurgia torácica enquanto sob IG e não encontraram nenhum caso de complicações neurológicas. Em outra extensa revisão de 45,000 pacientes submetidos à colocação epidural, 40 casos de lesões neurológicas foram relatados. É digno de nota que 22 desses pacientes apresentaram parestesias durante o procedimento epidural. Houve alguns relatos de casos de mielopatia e paraplegia ocorrendo com epidurais torácicas colocadas em pacientes anestesiados, mas essas complicações são extremamente raras. A maioria das neuropatias periféricas associadas a técnicas neuroaxiais se resolvem espontaneamente. Aqueles que se tornam permanentes são geralmente limitados a parestesias persistentes e fraqueza motora limitada.
Síndrome de Cauda Equina
A síndrome da cauda equina (CES), um estado raro de comprometimento neurológico devido à compressão da raiz lombossacral, é caracterizada por disfunção intestinal e vesical, dor lombar, perda sensorial perineal e outros déficits sensoriais irregulares, ciática unilateral ou bilateral e motor dos membros inferiores fraqueza. Tem sido associada a trauma, infecção, posição de litotomia e compressão isquêmica por hematoma, abscesso, tumor, prolapso de disco intervertebral ou espondilolistese. A CES também tem sido associada à neurotoxicidade direta de grandes volumes ou altas concentrações de ALs hiperbáricos no LCR sacro. As raízes nervosas da cauda equina têm um epineuro pouco desenvolvido e fluxo sanguíneo limitado e parecem ser particularmente suscetíveis ao agrupamento de ALs que podem acompanhar infusões espinhais contínuas com cateteres microbore, injeção intratecal acidental de grandes doses de AL destinados à anestesia epidural, e repetir as injeções intratecais após falha do bloqueio do nervo espinhal. Casos de CES também foram relatados após raquianestesia de tiro único.
Se a neurotoxicidade intrínseca dos ALs, fatores microambientais, doses excessivamente grandes de ALs, o cateter microbore usado para raquianestesia contínua, o posicionamento do paciente, o procedimento cirúrgico ou uma combinação desses fatores são os principais responsáveis pela CES não foi totalmente elucidado na literatura . A Food and Drug Administration (FDA) dos EUA removeu do mercado os cateteres espinhais contínuos de pequeno calibre no início da década de 1990, após uma série de relatos de CES em associação com seu uso. No entanto, a raquianestesia contínua continua sendo uma técnica útil. O uso de concentrações mais baixas de AL, limitando a dose total de AL, limitando a profundidade de inserção do cateter espinhal e usando manobras para aumentar a disseminação de AL se houver suspeita de má distribuição podem minimizar o risco de CES. Alguns pesquisadores também defenderam o uso de alternativas à lidocaína hiperbárica a 5%, uma vez que existem alternativas seguras. Infelizmente, a CES é uma deficiência permanente.
Os sintomas consistentes com esta síndrome devem levar a uma consulta neurológica precoce e estudos de imagem. Corticosteróides em altas doses; descompressão cirúrgica (por exemplo, no caso de cisto sinovial lombar, hemangioma ou tumores metastáticos); e tratamento do distúrbio subjacente com agentes quimioterápicos ou antibióticos (por exemplo, no caso de malignidade ou formação de abscesso) foram usados, mas há dados limitados sobre terapias ideais e o curso da recuperação.
Hematoma epidural
O hematoma epidural é uma ocorrência rara que pode levar à compressão do cordão, isquemia do cordão ou mielopatia semelhante à causada por um tumor ocupante de espaço. A incidência de hematoma associado ao bloqueio peridural é estimada em 1:150,000, um pouco superior à dos anestésicos espinhais (1:220,000). No entanto, a incidência varia dramaticamente com a população de pacientes e pode ser significativamente maior em um subgrupo de pacientes com espaço epidural menos complacente e maior probabilidade de distúrbios de coagulação. De fato, anormalidades hemostáticas durante o início do bloqueio peridural ou a remoção do cateter peridural estão presentes na maioria dos casos relatados, embora uma grande proporção dos casos documentados também ocorra espontaneamente, sem fatores predisponentes.
A colocação complicada de agulha ou cateter peridural também parece colocar o paciente em risco de formação de hematoma peridural. Os distúrbios de coagulação que predispõem ao desenvolvimento de hematoma epidural podem ser iatrogênicos ou secundários à doença de base. Distúrbios iatrogênicos que podem predispor os pacientes à formação de hematoma epidural são frequentemente associados à terapia antitrombótica ou trombolítica. As diretrizes mais recentes da Sociedade Americana de Anestesia Regional e Medicina da Dor podem ser usadas para auxiliar o anestesiologista a determinar o período mais adequado e seguro para iniciar o bloqueio peridural em pacientes anticoagulados (ver Anestesia neuroaxial e bloqueios de nervos periféricos em pacientes em uso de anticoagulantes).
A trombocitopenia é uma causa relativamente comum de coagulopatia e pode estar relacionada à gravidez (trombocitopenia gestacional, síndrome HELLP ou pré-eclâmpsia/eclâmpsia), distúrbios imunológicos (por exemplo, PTI) ou disfunção hepática, entre outras coisas. Infelizmente, não há contagem de plaquetas universalmente aceita que possa ser considerada segura para a realização do bloqueio neuroaxial, e não há teste à beira do leito amplamente disponível para avaliar a função plaquetária. A natureza do distúrbio subjacente deve ser levada em consideração (por exemplo, o processo é dinâmico, com queda rápida de plaquetas? A função plaquetária está intacta apesar de um número baixo? O paciente está em terapia antiplaquetária concomitante?
Ele ou ela tem outro distúrbio que afeta a coagulação? e assim por diante), e pacientes com trombocitopenia devem ser abordados com cautela antes do início do bloqueio neuroaxial.
Sinais e sintomas de hematoma epidural podem progredir rapidamente de déficits sensoriais ou motores leves para paraplegia e incontinência devastadoras. Os primeiros sinais incluem dor nas costas e pressão, com déficits motores e sensoriais. A dor nas costas associada ao hematoma epidural pode ser grave e persistente.
Seguem-se incontinência intestinal e vesical, dor radicular e piora dos déficits neurológicos dos membros inferiores. O início dos sintomas geralmente ocorre dentro de 12 horas a 2 dias após o início do bloqueio neuroaxial ou da remoção de um cateter peridural. Infelizmente, déficits motores e sensoriais nesse período podem ser confundidos com bloqueio peridural residual. A recorrência do bloqueio motor e sensorial após a resolução parcial ou total ou, alternativamente, o bloqueio prolongado do nervo deve levantar a preocupação de um hematoma epidural e a consulta imediata com um neurologista ou neurocirurgião, bem como uma ressonância magnética imediata. Uma ressonância magnética negativa não pode descartar um hematoma em desenvolvimento, que pode não ser reconhecido por um radiologista inexperiente. A descompressão cirúrgica dentro de 8 horas é recomendada para minimizar o risco de lesão neurológica permanente.
Síndrome da Artéria Espinhal Anterior
A síndrome da artéria espinhal anterior (ASAS) ocorre mais comumente em pacientes com doença vascular e diminuição concomitante do fluxo sanguíneo espinhal devido a obstrução, compressão ou hipotensão. No entanto, também foi descrito no cenário de hérnia de disco torácica aguda, espondilose, malformação arteriovenosa e condições patológicas semelhantes que podem interromper o fluxo sanguíneo tênue na distribuição da artéria espinhal anterior. ASAS é a complicação neurológica mais comum após cirurgia da aorta abdominal, mas também foi relatada após cirurgia na coluna torácica. Perda maciça de sangue e hipotensão persistente induzida por anestesia neuraxial têm sido implicadas no desenvolvimento intraoperatório desta síndrome potencialmente fatal. ASAS apresenta-se com paraplegia imediata e indolor e perda da função sensorial dos membros inferiores. A propriocepção e o sentido de vibração são poupados. O prognóstico é ruim, com déficits neurológicos permanentes e incapacitantes. A correção da hipotensão intraoperatória é essencial em pacientes de alto risco para ASAS.
Parada cardíaca
A parada cardíaca resultando em morte ou dano cerebral é uma complicação rara do bloqueio peridural. As causas incluem raquianestesia total não intencional, LAST, isquemia miocárdica, comprometimento respiratório ou qualquer um dos vários eventos circulatórios que não se enquadram nessas categorias, como bloqueio completo das fibras pré-ganglionares do acelerador cardíaco ou predominância vagal no cenário de bloqueio simpático. Embora o mecanismo do aumento do tônus vagal não tenha sido totalmente elucidado, o bloqueio dos eferentes simpáticos resulta em vasodilatação e diminuição do retorno venoso. A diminuição da pré-carga, por sua vez, pode aumentar o tônus vagal cardíaco. Bradicardia, DC reduzido e parada cardíaca podem ocorrer e podem ser atribuídas em parte à atividade reflexa. O paradoxal reflexo de Bezold-Jarisch, por exemplo, desencadeia a desaceleração da frequência cardíaca em resposta à diminuição do volume ventricular para permitir mais tempo para o enchimento completo do coração.
Para minimizar o risco de parada cardíaca associada à predominância vagal após procedimentos no neuroeixo, Pollard e colaboradores propuseram a manutenção de pré-carga adequada, o uso de drogas vagolíticas e agentes pressores, se necessário, seleção adequada do paciente e cautela ao mudar o posicionamento do paciente. A administração precoce de epinefrina é recomendada se a bradicardia for acentuada. A vasopressina pode ser mais eficaz que a epinefrina para ressuscitação cardiopulmonar durante a anestesia peridural devido ao seu efeito mais duradouro e à melhora do perfil ácido-base após múltiplas doses, embora seja recomendada a adesão ao protocolo de suporte avançado de vida cardiovascular (ACLS) mais atual. Os fatores de risco relacionados ao paciente para parada cardíaca após anestesia neuroaxial incluem sexo masculino, estado físico ASA I, frequência cardíaca basal baixa (abaixo de 60), nível sensorial acima de T6, idade abaixo de 50, uso de agentes bloqueadores β-adrenérgicos e intervalo PR prolongado. O início rápido de ação dos ALs, o uso de ALs que causam um bloqueio nervoso simpático mais profundo e uma disseminação mais ampla do bloqueio nervoso também foram associados à hipotensão e bradicardia após o bloqueio epidural. Ligouri e colaboradores identificaram os seguintes fatores secundários que podem precipitar ou contribuir para a gravidade do aumento do tônus vagal associado à bradicardia e assistolia durante a anestesia peridural: administração de opioides, hipoxemia, sedação, hipercapnia, uso crônico de medicamentos e doença médica coexistente.
Side Effects
Vários efeitos colaterais comuns acompanham os procedimentos peridurais, incluindo febre transitória em pacientes obstétricas, náuseas e vômitos, prurido associado a opioides no neuroeixo, calafrios e retenção urinária. Numerosos estudos encontraram uma associação entre analgesia de parto peridural e febre materna intraparto de início recente, embora a relação possa não ser causal. O aumento da temperatura materna é muitas vezes subclínico e autolimitado e não parece ter efeito adverso sobre o feto.
Náuseas e vômitos são comuns após GA e bloqueio neuroaxial. No contexto de anestesia peridural e analgesia, náuseas e vômitos podem ser atribuídos à hipotensão ou aos adjuvantes peridurais, como os opióides. Opióides lipofílicos, como fentanil e sufentanil, administrados por via epidural parecem conferir algum risco diminuído de náusea e vômito quando comparados à morfina epidural. A administração de ondansetrona intravenosa (possivelmente em combinação com outros agentes antieméticos), oxigênio suplementar e ansiolíticos, bem como a correção imediata da hipotensão e hipovolemia, é recomendada na abordagem multimodal da terapia. A dexametasona intravenosa também parece ser eficaz na redução de náuseas e vômitos associados à morfina epidural. A efedrina, que se acredita ter efeitos antieméticos não relacionados aos seus efeitos hemodinâmicos, anti-histamínicos e anticolinérgicos também se mostram promissores.
O prurido, um efeito colateral comum dos opióides neuroaxiais, é observado com mais frequência durante as raquianestesia do que nas epidurais. Geralmente é transitória e afeta mais comumente o nariz e outras áreas da face. O antagonista opióide puro naloxona efetivamente reverte o prurido induzido por opióides, mas ao custo de reverter a analgesia. A nalbufina agonista-antagonista parcial parece ser o tratamento mais eficaz do prurido induzido por opióides. Muitas vezes, uma única dose de 5 mg é suficiente; uma segunda dose de 5 mg é ocasionalmente necessária. Os anti-histamínicos são ineficazes; o prurido induzido por opióides não é uma reação mediada por histamina.
O tremor é outro efeito colateral comum da analgesia e anestesia neuraxial, ocorrendo mais rapidamente e mais intensamente na raquianestesia versus peridural. O mecanismo permanece incerto, mas pode estar relacionado em parte ao comprometimento do controle termorregulatório central e redistribuição do calor corporal.
A hipotensão, definida por uma redução superior a 20% na pressão arterial sistólica, diastólica ou média, é comum após o bloqueio epidural. Bloqueios do nervo torácico alto, obesidade, anestesia geral e neuroaxial concomitante, hipovolemia e perda sanguínea excessiva no intraoperatório estão entre os fatores de risco. Os pacientes podem apresentar náuseas, vômitos, tontura, alterações do estado mental, falta de ar, dificuldade para respirar e arritmias cardíacas. Colapso cardiovascular pode acompanhar casos graves. Idealmente, a pressão arterial deve ser mantida dentro de 20% da linha de base de repouso do paciente. Os métodos propostos para reduzir a incidência de hipotensão após bloqueio neuroaxial incluem a administração criteriosa de vasopressores (mais comumente, efedrina ou fenilefrina); expansão de volume com uma solução cristalóide ou colóide no momento do início do bloqueio do nervo (isto é, uma co-carga); manutenção do deslocamento uterino à esquerda após 18 a 20 semanas de gestação em pacientes obstétricas; mudar o posicionamento do paciente (por exemplo, de supino para sentado) gradualmente; colocação do bloqueio nervoso em segmento inferior da coluna, quando viável; titulação lenta de AL epidurais; e redução da dose de AL intratecal ou epidural. Em casos de hipotensão grave, a elevação das extremidades inferiores ou a colocação de calças militares antichoque reduzirão o acúmulo venoso. Agentes pressores α e β-adrenérgicos alternativos, como norepinefrina e epinefrina, também devem ser considerados. O posicionamento do paciente em Trendelenburg reverso na tentativa de limitar a propagação do AE deve ser evitado; Trendelenburg servirá para aliviar o acúmulo venoso nas extremidades inferiores e melhorar o fluxo sanguíneo para o coração e o cérebro.tabela 38). Muitas dessas medidas para reduzir a incidência e a gravidade da hipotensão após o bloqueio do neuroeixo permanecem em debate na literatura e estão além do escopo deste capítulo.
TABELA 38. Tratamento da hipotensão após bloqueio neuroaxial.
| Interromper a infusão epidural, se aplicável |
| Expansão de volume com administração intravenosa de fluidos |
| A administração intravenosa de vasopressores (fenilefrina e/ou efedrina) |
| Colocar o paciente na posição de Trendelenburg |
| Assegurar o deslocamento uterino após 18-20 semanas de gestação |
| Elevar os membros inferiores |
| Administrar atropina 0.4-0.5 mg IV com concomitante bradicardia |
| Enrole as pernas com meias de dissuasão tromboembólica/ mangueira de compressão pneumática; colocar antichoque militar calças |
| Administração de norepinefrina ou epinefrina conforme necessário |
RESUMO
Tanto as indicações das técnicas neuraxiais quanto a população de pacientes considerada adequada para esses procedimentos se expandiram nas últimas décadas. O bloqueio peridural está sendo atualmente defendido como adjuvante da AG para cirurgias cardiotorácicas, vasculares de grande porte e outras cirurgias de alto risco; como único anestésico em cirurgias anteriormente realizadas exclusivamente sob AG; e para o manejo da dor aguda e crônica. As técnicas neuroaxiais também estão sendo cada vez mais utilizadas no ambiente ambulatorial, onde a diminuição da NVPO e o melhor alívio da dor permitem alta mais cedo; para uma variedade de procedimentos de diagnóstico; e para aliviar a dor em adultos e crianças no cenário de fim de vida.
Os benefícios do bloqueio peridural estão bem estabelecidos. As técnicas epidurais proporcionam alívio ideal da dor após cirurgias de grande porte e têm sido associadas a menos complicações cardiovasculares, respiratórias, gastrointestinais e hematológicas quando comparadas ao GA. A incidência de eventos tromboembólicos perioperatórios, o tempo de retorno da função GI e o tempo de permanência na terapia intensiva, entre outras coisas, parecem ser reduzidos com o bloqueio peridural. Além disso, a anestesia epidural tem sido associada à sobrevida prolongada e diminuição das taxas de recorrência de câncer em pacientes com câncer de mama, cólon localizado, próstata e ovário. No entanto, o potencial papel do bloqueio peridural na redução da mortalidade após cirurgias de grande porte ainda é debatido na literatura.
Apesar das muitas vantagens potenciais do bloqueio peridural, as técnicas neuroaxiais não são isentas de riscos, embora complicações maiores sejam raras. Uma análise de risco-benefício caso a caso e o consentimento informado do paciente são garantidos antes do início do bloqueio epidural.
Este texto é uma amostra do conteúdo do Compêndio de Anestesia Regional no NYSORA LMS.
NYSORA Compêndio de Anestesia Regional é simplesmente o currículo mais abrangente e prático em Anestesia Regional de A a Z, apresentando o conteúdo Premium do NYSORA. Ao contrário de livros didáticos e e-books, o Compêndio é continuamente atualizado e apresenta os mais novos vídeos, animações e conteúdo visual do NYSORA.
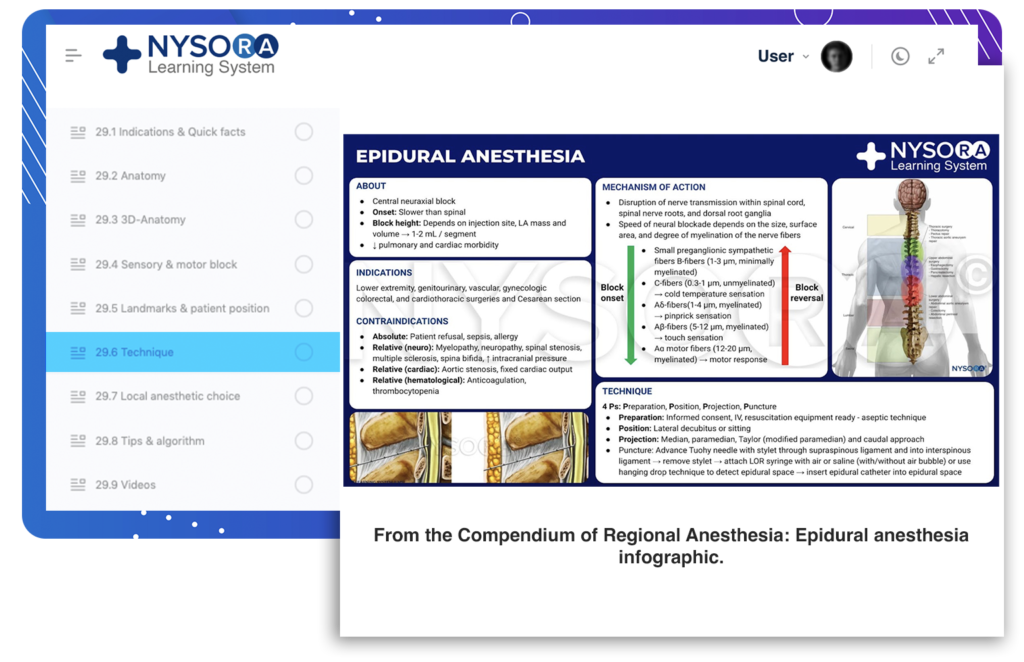
O Compêndio é um dos vários cursos educacionais padrão ouro no Sistema de Aprendizagem da NYSORA (o NYSORA LMS), e o registro para NYSORALMS. com é grátis. O acesso COMPLETO ao Compêndio, no entanto, é baseado em uma assinatura anual, pois requer um exército de ilustradores, editores de vídeo e uma equipe educacional para continuar tornando-o a MELHOR ferramenta de educação sobre anestesia regional. Embora você possa pensar no compêndio como um ebook sobre esteróides, um teste rápido lhe dará uma sensação em tempo real de quão incrível o compêndio realmente é. Sua assinatura transformará a maneira como você lê sobre anestesia regional:
- Aprenda visualmente: tudo regional, incluindo procedimentos de bloqueio espinhal, epidural e nervoso e protocolos de gerenciamento
- Revise as instruções de técnicas passo a passo para mais de 60 bloqueios nervosos
- Acesse as ilustrações, animações e vídeos lendários do NYSORA (como Reverse Ultrasound Anatomy)
- Acesse informações de RA em qualquer dispositivo por meio da plataforma de desktop e aplicativo móvel
- Receba atualizações em tempo real
- Revise infográficos para preparação para exames (por exemplo, EDRA)
- Use o feed da comunidade com discussões de casos reais, imagens e vídeos postados e discutidos por assinantes e pelos maiores especialistas do mundo.
Mesmo que não queira subscrever o Compêndio, registe-se no NYSORA LMS, seja o primeiro a saber o que há de novo em anestesia regional e participe de discussões de casos.
Aqui está o que a atividade se alimenta NYSORA LMS parece:
Estamos convencidos de que, uma vez que você experimente o Compêndio na NYSORA LMS, e você nunca mais voltará aos seus livros antigos, e sua assinatura oferecerá suporte para manter o NYSORA.com gratuito para o resto do mundo.
Leitura adicional
- Frölich MA, Caton D: Pioneiros no design de agulhas epidural. Anesth Analg 2001;93:215–220.
- Cortés RC: Anestesia peridural lombar, 1931-1936: Uma segunda estreia. Rev Esp Anestesiol Reanim 2005;52:159–168.
- Dogliotti AM: Raquianestesia peridural segmentar: Um novo método de bloqueio nervoso. Am J Surg 1933; 20:107-118.
- Curbelo MM: Anestesia segmentar peridural contínua por meio de cateter ureteral. Curr Res Anesth Analg 1949;28:13–23.
- Modig J, Borg T, Karlström G, et al: Tromboembolismo após artroplastia total do quadril: Papel da anestesia peridural e geral. Anesth Analg 1983;62:174–180.
- Jørgensen LN, Rasmussen LS, Nielsen P, et al: Eficácia antitrombótica de analgesia extradural contínua após artroplastia de joelho. Br J Anaesth 1991;66:8–12.
- Rodgers A, Walker N, Schug S, et al: Redução da mortalidade e morbidade pós-operatória com anestesia epidural ou raquidiana: Resultados da visão geral de estudos randomizados. BMJ 2000;321:1–12.
- Mauermann WJ, Shilling AM, Zuo Z: Uma comparação do bloqueio do nervo neuroaxial versus anestesia geral para artroplastia total de quadril eletiva: uma meta-análise. Anesth Analg 2006;103:1018–1025.
- Schindler I: Anestesia regional em idosos: indicações e contra-indicações. Acta Anesthesiol Scand Suppl 1997;111:209–211.
- Cherng CH, Wong CS, Chang FL, et al: A morfina peridural atrasa o início da dor do torniquete durante a anestesia peridural com lidocaína. Anesth Analg 2002;94:1614–1616.
- Christopherson R, Beattie C, Frank SM, et al: Morbidade perioperatória em pacientes randomizados para anestesia peridural ou geral para cirurgia vascular de membros inferiores. Anestesiologia 1993;79:422–434.
- Sproviero M: Anestesia neuroaxial para procedimentos geniturinários em adultos. Em Wong CA (ed): Anestesia espinhal e epidural. McGraw-Hill, 2007, pp 229-236.
- Soriano D, Ajaj S, Chuong T, et al: spray de lidocaína e histeroscopia ambulatorial: ensaio randomizado controlado por placebo. Obstet Gynecol 2000;96:661–664.
- Goldenberg M, Cohen SB, Etchin A, et al: Um estudo prospectivo randomizado comparativo de anestesia geral versus peridural para ressecção endometrial histeroscópica transcervical. Am J Obstet Gynecol 2001;184: 273–276.
- Murphy M, Heit MH, Fouts L, et al. Efeito da anestesia na função miccional após procedimento de fita vaginal sem tensão. Obstet Gynecol 2003; 101:666-670.
- Nerve Block BM, Liu SS, Rowlingson AJ, et al: Eficácia da analgesia epidural pós-operatória: Uma meta-análise. JAMA 2003;290:2455–2463.
- Ballantyne JC, Carr DB, deFerranti S, et al: Os efeitos comparativos de
terapias analgésicas pós-operatórias no resultado pulmonar: meta-análises cumulativas de estudos randomizados e controlados. Anesth Analg 1998;86: 598–612. - Liu SS, Wu CL: Efeito da analgesia pós-operatória em grandes
complicações: Uma atualização sistêmica das evidências. Anesth Analg 2007;104:689–702. - Manion SC, Brennan TJ: Analgesia peridural torácica e manejo da dor aguda. Anestesiologia 2011;115:181–188.
- Nygård E, Kofoed KF, Freiburg J, et al: Efeitos da analgesia peridural torácica alta no fluxo sanguíneo do miocárdio em pacientes com doença cardíaca isquêmica. Circulação 2005;111:2165–2170.
- Scott NB, Turfrey DJ, Ray DA, et al: Um estudo prospectivo randomizado dos potenciais benefícios da anestesia peridural torácica e analgesia em pacientes
submetidos à cirurgia de revascularização do miocárdio. Anesth Analg 2001;93:
528-535. - Loick HM, Schmidt C, Van Aken, et al: Anestesia peridural torácica alta, mas não clonidina, atenua a resposta ao estresse perioperatório via simpatólise e reduz a liberação de troponina T em pacientes submetidos à cirurgia de revascularização do miocárdio. Anesth Analg 1999;88:701–709.
- Liu SS,Nerve Block BM, Wu CL: Efeitos da analgesia neuraxial central perioperatória no resultado após cirurgia de revascularização do miocárdio: uma meta-análise. Anestesiologia 2004;101:153–161.
- Svircevic V, Nierich AP, Moons KG, et al: Anestesia peridural torácica para cirurgia cardíaca: um estudo randomizado. Anestesiologia 2011;114:
262-270. - Caputo M, Alwair H, Rogers CA, et al: A anestesia peridural torácica melhora os resultados precoces em pacientes submetidos à cirurgia de revascularização do miocárdio sem circulação extracorpórea: um estudo prospectivo, randomizado e controlado. Anestesiologia 2011;114:380–390.
- Møiniche S, Kehlet H, Dahl JB: Uma revisão sistemática qualitativa e quantitativa de analgesia preventiva para alívio da dor pós-operatória: O papel do momento da analgesia. Anestesiologia 2002;96:725–741.
- Groeben H, Schäfer B, Pavlakovic G, et al: Função pulmonar sob anestesia peridural segmentar torácica alta com ropivacaína ou bupivacaína em pacientes com doença pulmonar obstrutiva grave submetidos à cirurgia de mama. Anestesiologia 2002;96:536–541.
- Diaz N, Wong CA: Anestesia neuroaxial para cirurgia geral. Em Wong CA (ed): Anestesia espinhal e epidural. McGraw-Hill, 2007, pp 221-227.
- Matot I, Scheinin O, Eid A, et al: anestesia peridural e analgesia na ressecção hepática. Anesth Analg 2002;95:1179–1181.
- Zhang HW, Chen YJ, Cao MH, et al: Colecistectomia laparoscópica sob anestesia epidural: Uma comparação retrospectiva de 100 pacientes. Am Surg 2012;78:107–110.
- Asakura K, Nakazawa K, Tanaka N, et al. Caso de parada cardíaca por
espasmo coronário durante a gastrectomia distal laparoscópica. Masui 2011; 60:75-79. - Shir Y, Raja SN, Frank SM, et al: Perda sanguínea intraoperatória durante prostatectomia retropúbica radical. Anestesia peridural versus geral. Urologia 1995;45:993-999.
- Gottschalk A, Smith DS, Jobes DR, et al: Analgesia epidural preventiva e recuperação da prostatectomia radical: um estudo controlado randomizado. JAMA 1998;279:1076–1082.
- Stevens RA, Mikat-Stevens M, Flanigan R, et al: A escolha da técnica anestésica afeta a recuperação da função intestinal após a prostatectomia radical? Urologia 1998;52:213-218.
- Ozyuvaci E, Altan A, Karadeniz T, et al: Anestesia geral versus anestesia peridural e geral na cistectomia radical. Urol Int 2005;74: 62–67.
- Micali S, Jarrett TW, Pappa P, et al: Eficácia da anestesia peridural para biópsia renal retroperitoneoscópica. Urologia 2000;55:590.
- Richards JT, Read JR, Chambers WA. Anestesia peridural como método de analgesia preventiva para histerectomia abdominal. Anestesia 1998;53:296–298.
- Mihic DN, Abram SE: Anestesia regional ideal para histerectomia abdominal: bloqueio combinado dos nervos subaracnóideo e epidural em comparação com outras técnicas regionais. Eur J Anesthesiol 1993;10:
297-301. - Holte K, Kehlet H: analgesia epidural e risco de vazamento anastomótico. Reg Anesth Pain Med 2001;26:111.
- Kehlet H, Mogensen T: Permanência hospitalar de 2 dias após sigmoidectomia aberta com programa de reabilitação multimodal. Br J Surg 1999;86: 227–230.
- Bardram L, Funch-Jensen P, Kehlet H: Reabilitação rápida em pacientes idosos após ressecção laparoscópica do cólon. Br J Surg 2000;87: 1540–1545.
- Blichfeldt-Lauridsen L, Hansen BD: Anestesia e miastenia gravis. Acta Anesthesiol Scand 2012;56:17–22.
- Kirsh JR, Diringer MN, Borel CO, et al: A morfina peridural lombar pré-operatória melhora a analgesia pós-operatória e a função ventilatória após timectomia transesternal em pacientes com miastenia gravis. Crit Care Med 1991;19:1474–1479.
- Bagshaw O: Uma combinação de anestesia intravenosa total e peridural torácica para timectomia na miastenia gravis juvenil. Pediatra Anaesth 2007;17:370–374.
- Hambly PR, Martin B: Anestesia para lesões crônicas da medula espinhal. Anestesia 1998;53:273–289.
- Lambert DH, Deane RS, Mazuzan JE: Anestesia e controle da pressão arterial em pacientes com lesão medular. Anesth Analg 1982;61: 344–348.
- Ordenação H: Incidência de hipertermia maligna na Dinamarca. Anesth Analg 1985;64:700–704.
- van Lier F, van der Geest PJ, Hoeks SE, et al: A analgesia epidural está associada a melhores resultados de saúde de pacientes cirúrgicos com doença pulmonar obstrutiva crônica. Anestesiologia 2011;115:315–321.
- Mulroy MF, Salinas FV: Técnicas neuroaxiais para anestesia ambulatorial. Int Anesthesiol Clin 2005;43:129–141.
- Anghelescu DL, Faughnan LG, Baker JN, et al: Uso de bloqueios nervosos peridurais e periféricos no final da vida em crianças e adultos jovens com câncer: A colaboração entre um serviço de dor e um serviço de cuidados paliativos. Pediatra Anaesth 2010;20:1070–1077.
- Sielenkämper AW, Van Aken H: Analgesia epidural na sepse: muito cedo para julgar um novo conceito. Medicina Intensiva 2004;30:1987–1989.
- Strümper D, Louwen F, Durieux ME, et al: Anestésicos locais epidurais: Um novo tratamento para retardo do crescimento fetal? Diagnóstico Fetal Ter 2005; 20:208-213.
- Hong JY, Lim KT: Efeito da analgesia peridural preemptiva na resposta de citocinas e dor pós-operatória em histerectomia radical laparoscópica para câncer de colo do útero. Reg Anesth Pain Med 2008;33:44–51.
- Exadaktylos AK, Buggy DJ, Moriarty DC, et al: A técnica anestésica para cirurgia de câncer de mama primário pode afetar a recorrência ou metástase? Anestesiologia 2006;105:660–664.
- Biki B, Mascha E, Moriarty DC, et ai. Técnica anestésica para cirurgia de prostatectomia radical afeta a recorrência do câncer: uma análise retrospectiva. Anestesiologia 2008;109:180–187.
- Freise H, Van Aken H: Riscos e benefícios da anestesia peridural torácica. Br J Anaesth 2011;107:859–868.
- Mutz C, Vagts DA: Anestesia peridural torácica na sepse – é prejudicial ou protetora? Crit Care 2009;13:182.
- Su TM, Lan CM, Yang LC, et al: Tumor cerebral apresentando hérnia fatal após o parto sob anestesia epidural. Anestesiologia 2002;96:508–509.
- Grocott HP, Mutch WA: Anestesia peridural e pressão intracraniana agudamente aumentada: Hidrodinâmica do espaço peridural lombar em um modelo suíno. Anestesiologia 1996;85:1086–1091.
- Leffert LR, Schwamm LH: Anestesia neuroaxial em parturientes com patologia intracraniana: Uma revisão abrangente e reavaliação do risco. Anestesiologia 2013;119:703–718.
- Vandermeulen EP, Van Aken H, Vermylen J: Anticoagulantes e anestesia raqui-peridural. Anesth Analg 1994;79:1165–1177.
- Horlocker TT, Wedel DJ, Rowlingson JC, et al: Anestesia regional no paciente recebendo terapia antitrombótica ou trombolítica: Diretrizes baseadas em evidências da Sociedade Americana de Anestesia Regional e Medicina da Dor (terceira edição). Reg Anesth Pain Med 2010;35:64–101.
- O'Rourke, N, Khan K, Hepner DL: Contra-indicações para anestesia neuraxial. Em Wong CA (ed): Anestesia espinhal e epidural. McGraw-Hill, 2007, pp 127-149.
- Choi S, Brull R: Técnicas neuroaxiais em pacientes obstétricas e não obstétricas com diátese hemorrágica comum. Anesth Analg 2009;109: 648–660.
- Bader AM, Hunt CO, Datta S, et al: Anestesia para a paciente obstétrica com esclerose múltipla. J Clin Anesth 1988;1:21–24.
- Confavreux C, Hutchinson M, Horas MM, et al: Taxa de recaída relacionada à gravidez na esclerose múltipla. Gravidez no Grupo de Esclerose Múltipla. N Engl J Med 1998;339:285–291.
- Hebl JR, Horlocker TT, Schroeder DR: Anestesia e analgesia neuroaxial em pacientes com doenças do sistema nervoso central preexistentes. Anesth Analg 2006;103:223–228.
- Lirk P, Birmingham B, Hogan Q: Anestesia regional em pacientes com neuropatia preexistente. Int Anesthesiol Clin 2011;49:144–165.
- Wiertlewski S, Magot A, Drapier S, et al: Agravamento dos sintomas neurológicos após anestesia epidural para trabalho de parto em uma paciente Guillain-Barré. Anesth Analg 2004;98:825–827.
- Toledano RD, Pian-Smith MC: Vírus da imunodeficiência humana: considerações e manejo materno e fetal. Em Suresh MS, Segal BS, Preston RL, et al (eds): Anestesia de Shnider e Levinson para Obstetrícia, 5ª ed. Lippincott Williams & Wilkins, 2013, pp 595-605.
- Crosby ET, Halpern SH, Rolbin SH: Anestesia epidural para cesariana em pacientes com infecções recorrentes por herpes simples genital: Uma revisão retrospectiva. Can J Anaesth 1989;36:701–704.
- Bader AM, Camann WR, Datta S: Anestesia para cesariana em pacientes com infecções pelo vírus herpes simplex tipo 2. Reg Anesth 1990; 15:261-263.
- Brown NW, Parsons APR, Kam PCA: Considerações anestésicas em uma parturiente com varicela apresentando-se para cesariana. Anestesia 2003;58:1092–1095.
- Hebl JR, Horlocker TT, Kopp SL, et al: Bloqueio neuroaxial em pacientes com estenose espinhal preexistente, doença do disco lombar ou cirurgia prévia da coluna: eficácia e complicações neurológicas. Anesth Analg 2010;111: 1511–1519.
- McDonald SB: O bloqueio neuroaxial é contraindicado no paciente com estenose aórtica? Reg Anesth Pain Med 2004;29:496–502.
- Ferguson EA, Paech MJ, Veltman MG: Cardiomiopatia hipertrófica e cesariana: Uso intraoperatório de ecocardiografia transtorácica. Int J Obstet Anesth 2006;15:311–316.
- Rosenquist RW, Birnbach DJ: Inserção epidural em adultos anestesiados: Seus pacientes vão agradecer? Anesth Analg 2003;96:1545–1546.
- Horlocker TT, Abel MD, Messick JM, et al: Pequeno risco de complicações neurológicas graves relacionadas à colocação de cateter peridural lombar em pacientes anestesiados. Anesth Analg 2003;96:1547–1552.
- Han KR, Kim C, Park SK, et al: Distância ao espaço peridural cervical adulto. Reg Anesth Pain Med 2003;28:95–97.
- Stonelake PS, Burwell RG, Webb JK: Variação nos níveis vertebrais das proeminências da vértebra e covinhas sacrais em indivíduos com escoliose. J Anat 1988;159:165–172.
- Hughes RJ, Saifuddin A: Imagem das vértebras de transição lombossacrais. Clin Radiol 2004;59:984–991.
- Kim JT, Bahk JH, Sung J: Influência da idade e sexo na posição do cone medular e linha de Tuffier em adultos. Anestesiologia 2003;99: 1359–1363.
- Saifuddin A, Burnett SJ, White J: A variação da posição do cone medular em uma população adulta. Um estudo de ressonância magnética. Spine 1998; 23:1452-1456.
- Vandermeersch E, Kick O, Mollmann M, et al: CSE—A combinação de anestesia raquidiana e peridural. Reg Anaesth 1991;14:108–112.
- Lirk P, Hogan Q: Anatomia espinhal e epidural. Em Wong CA (ed): Anestesia espinhal e epidural. McGraw-Hill, 2007, 1–25.
- Lee AJ, Ranasinghe JS, Chehade JM, et al: Avaliação ultrassonográfica do nível vertebral da linha intercristal na gravidez. Anesth Analg 2011;113:559–564.
- Van Gessel EF, Forster A, Gamulin Z: Anestesia espinhal contínua: Para onde vão os cateteres espinhais? Anesth Analg 1993;76:1004–1007.
- Broadbent CR, Maxwell WB, Ferrie R, et al: Capacidade dos anestesistas para identificar um interespaço lombar marcado. Anestesia 2000;55: 1122-1126.
- Lirk P, Messner H, Deibl M, et al: Precisão na estimativa do nível correto do espaço intervertebral durante anestesia lombar, torácica e cervical. Acta Anesthesiol Scand 2004;48:347–349.
- Hogan QH: Anatomia peridural lombar. Um novo visual pela seção criomicrótomo. Anestesiologia 1991;75:767–775.
- Heylings DJ: Ligamentos supraespinhosos e interespinhosos da coluna lombar humana. J Anat 1978;125:127–131.
- Han KR, Kim C, Park SK, et al: Distância ao espaço peridural cervical adulto. Reg Anesth Pain Med 2003;28:95–97.
- Zarzur E: Estudos anatômicos do ligamento amarelo humano. Anesth Analg 1984;63:499–502.
- Williams DM, Gabrielsen TO, Latack JT, et al: Ossificação na inserção cefálica do ligamento amarelo. Um estudo anatômico e CT. Radiologia 1984;150:423–426.
- Brown DL: anestesia raquidiana, peridural e caudal. Em Miller RD, Fleisher LE, Johns RA, et al (eds): Miller's Anesthesia, 6ª ed. Elsevier, 2005, pp 1653-1683.
- Westbrook JL, Renowden SA, Carrie LE: Estudo da anatomia da região extradural usando ressonância magnética. Br J Anaesth 1993; 71:495-498.
- Lirk P, Kolbitsch C, Putz G, et al: Ligamento cervical e torácico alto
flavum frequentemente não consegue se fundir na linha média. Anestesiologia 2003;99: 1387-1390. - Lirk P, Colvin J, Steger B, et al: Incidência do ligamento torácico inferior
flavum lacunas da linha média. Br J Anaesth 2005;94:852–855. - Lirk P, Moriggl B, Colvin J, et al: A incidência de lacunas da linha média do ligamento amarelo lombar. Anesth Analg 2004;98:1178–1180.
- Reina MA, Villanueva MC, Machés F, et al: A ultraestrutura do manguito da raiz do nervo espinhal humano na coluna lombar. Anesth Analg 2008; 106:339-344.
- Bernards CM: Sofisma em medicina: lições do espaço epidural.
Reg Anesth Pain Med 2005;30:56–66. - Reina MA, De León Casasola O, Villanueva MC, et al: Achados ultraestruturais na pia-máter espinhal humana em relação à anestesia subaracnóidea. Anesth Analg 2004;98:1479–1485.
- Blomberg RG: O espaço extraarchnoideo subdural lombar de humanos: Um estudo anatômico usando raquianestesia em casos de autópsia. Anesth Analg 1987;66:177–180.
- Haines DE: Sobre a questão de um espaço subdural. Anat Rec 1991; 230: 3–21.
- Boon JM, Abrahams PH, Meiring JH, et al: Punção lombar: revisão anatômica de uma habilidade clínica. Clin Anat 2004;17:544–553.
- Hogan QH: Anatomia epidural: Novas observações. Can J Anaesth 1998;45:R40–48.
- Bernards CM: Anestesia peridural. Em Mulroy MF, Bernards CM, McDonald SB, et al (eds): A Practical Approach to Regional Anesthesia, 4ª ed. Lippincott Williams & Wilkins, 2009, pág. 104.
- Igarashi T, Hirabayashi Y, Shimizu R, et al: A estrutura extradural lombar muda com o aumento da idade. Br J Anaesth 1997;78:149–152.
- Blomberg R: A banda de tecido conjuntivo dorsomediano no espaço epidural lombar de humanos: um estudo anatômico usando epiduroscopia em casos de autópsia. Anesth Analg 1986;65;747-752.
- Hogan QH, Toth J: Anatomia dos tecidos moles do canal vertebral. Reg Anesth Pain Med 1999;24;303–310.
- Hogan QH: Distribuição da solução no espaço epidural: Exame por seção criomicrótomo. Reg Anesth Pain Med 2002;27:150–156.
- Fujinaka MK, Lawson EF, Schukteis G, Wallace MS: Profundidade epidural cervical: correlação entre ângulo da agulha, anatomia cervical e área de superfície corporal. Pain Med 2012;13:665–669.
- Aldrete JA, Mushin AU, Zapata JC, et al: Distâncias entre a pele e o espaço peridural cervical como lidas em filmes de ressonância magnética: Consideração da “corcunda”. J Clin Anesth 1998;10:309–313.
- Segal S, Beach M, Eappen S: Um modelo multivariado para prever a distância da pele ao espaço epidural em uma população obstétrica. Reg Anesth 1996;21:451–455.
- Sutton DN, Linter SP: Profundidade do espaço extradural e punção dural.
Anestesia 1991;46:97–98. - Reynolds AF, Roberts PA, Pollay M, et al: Anatomia quantitativa do
espaço peridural toracolombar. Neurocirurgia 1986;17:905-907. - Hogan QH: Anatomia epidural examinada por seção de criomicrótomo. Influência da idade, nível vertebral e doença. Reg Anesth 1996;21: 395–406.
- Toprak HI, Ozpolat Z, Ozturk E, et al: Bupivacaína hiperbárica afeta as doses de midazolam necessárias para sedação após raquianestesia. Eur J Anesthesiol 2005;22:904–906.
- Shono A, Sakura S, Saito Y, et al: Comparação de anestesia peridural com lidocaína 1% e 2% combinada com anestesia geral com sevoflurano utilizando um índice bispectral constante. Br J Anaesth 2003;91:825–829.
- Koo M, Sabaté A, Dalmau A, et al: Necessidades de sevoflurano durante a cirurgia coloproctológica: Diferença entre dois regimes epidurais diferentes. J Clin Anesth 2003;15:97–102.
- Eappen S, Kissin I: Efeito do bloqueio do nervo subaracnóideo bupivacaína nas necessidades anestésicas para tiopental em ratos. Anestesiologia 1998;88: 1036-1042.
- Tverskoy M, Shagal M, Finger J, et al: O bloqueio subaracnóideo de bupivacaína diminui os requisitos hipnóticos de midazolam e tiopental. J Clin Anesth 1994;6:487–490.
- Tverskoy M, Shifrin V, Finger J, et al: Efeito do bloqueio do nervo epidural bupivacaína nos requisitos hipnóticos de midazolam. Reg Anesth 1996;21: 209–213.
- Hodgson PS, Liu SS, Gras TW: A anestesia peridural tem efeitos anestésicos gerais? Um estudo prospectivo, randomizado, duplo-cego, controlado por placebo. Anestesiologia 1999;91:1687–1692.
- Reinoso-Barbero F, Martínez-García E, Hernández-Gancedo MC, et al: O efeito da bupivacaína epidural nas necessidades de manutenção de sevoflurano avaliadas pelo índice bispectral em crianças. Eur J Anesthesiol 2006;23:460–464.
- Holte K, Foss NB, Svensén C, et al: Anestesia epidural, hipotensão e
alterações do volume intravascular. Anestesiologia 2004;100:281–286. - Meisner A, Rolf A, Van Aken H: Anestesia peridural torácica e o paciente com doença cardíaca: benefícios, riscos e controvérsias. Anesth Analg 1997;85, 517-528.
- Missant C, Claus P, Rex S, Wouters PF: Efeitos diferenciais da anestesia peridural lombar e torácica na resposta hemodinâmica à direita aguda
sobrecarga de pressão ventricular. Br J Anaesth 2010;104:143–149. - Buggy DJ, Doherty WL, Hart EM, Pallet EJ: Tensão de oxigênio na ferida pós-operatória com analgesia epidural ou intravenosa: Um ensaio clínico prospectivo, randomizado e simples-cego. Anestesiologia 2002;97:952–958.
- Kabon B, Fleischmann E, Treschan T, et al: Anestesia peridural torácica
aumenta a oxigenação dos tecidos durante grandes cirurgias abdominais. Anesth Analg 2003;97:1812–1817. - Olausson K, Magnusdottir H, Lurje L, et al: Anti-isquêmico e antianginoso
Efeitos da anestesia peridural torácica versus os da terapia médica convencional no tratamento da angina pectoris instável refratária grave. Circulação 1997;96:2178–2182. - Richter A, Cederholm I, Fredrikson M, et al: Efeito da analgesia peridural torácica de longo prazo na angina pectoris refratária: uma experiência de 10 anos. J Cardiothorac Vasc Anesth 2012;26:822–828.
- Rolf N, Van de Velde M, Wouters PF, et al: A anestesia peridural torácica melhora a recuperação funcional do atordoamento miocárdico em cães conscientes. Anesth Analg 1996;83:935–940.
- Rolf N, Meissner A, Van Aken H, et al: Os efeitos da epidural torácica
anestesia na recuperação funcional do atordoamento miocárdico em cães anestesiados com propofol. Anesth Analg 1997;84:723–729. - Freise H, Van Aken HK: Riscos e benefícios da anestesia peridural torácica. Br J Anaesth 2011;107:859–868.
- Svircevic V, van Dijk D, Nierich AP, et al: Meta-análise de anestesia peridural torácica versus anestesia geral para cirurgia cardíaca. Anestesiologia 2011;114:271–282.
- Gu WJ, Wei CY, Huang DQ, et al: Meta-análise de ensaios clínicos randomizados sobre a eficácia da anestesia peridural torácica na prevenção da fibrilação atrial após cirurgia de revascularização do miocárdio. BMC Cardiovasc Disord 2012;12:1–7.
- Freund FG, Bonica JJ, Ward RJ, et al: Reserva ventilatória e nível de bloqueio do nervo motor durante raquianestesia alta e peridural. Anestesiologia 1967;28:834-837.
- Groeben H: Anestesia peridural e função pulmonar. J Anesth 2006;20:290–299.
- Lirk P, Hollmann MW: Resultado após anestesia regional: pesando riscos e benefícios. Minerva Anestesiol 2014;80:610–618.
- Sielenkämper AW, Van Aken H: Anestesia peridural torácica: Mais do que apenas anestesia/analgesia. Anestesiologia 2003;99:523–525.
- Brodner G, Van Aken H, Hertle L, et al: O manejo perioperatório multimodal – combinando analgesia peridural torácica, mobilização forçada e nutrição oral – reduz o estresse hormonal e metabólico e melhora a convalescença após cirurgia urológica de grande porte. Anesth Analg 2001;92:1594–1600.
- Frank SM, Beattie C, Christopherson R, et al: Anestesia peridural versus anestesia geral, temperatura ambiente da sala de cirurgia e idade do paciente como preditores de hipotermia inadvertida. Anestesiologia 1992;77: 252–257.
- Matsukawa T, Sessler DI, Christensen R, et al: Fluxo de calor e distribuição
durante a anestesia peridural. Anestesiologia 1995;83: 961-967. - Szmuk P, Ezri T, Sessler D, et al: A raquianestesia acelera o reaquecimento pós-operatório ativo. Anestesiologia 1997;87:1050–1054.
- Backman SB: Anestesia regional: vasodilatação mediada por simpatectomia. Can J Anaesth 2009;56:702–703.
- Greene NM: Área de bloqueio nervoso diferencial em raquianestesia com tetracaína hiperbárica. Anestesiologia 1958;19:45-50.
- Brull SJ, Greene NM: Zonas de bloqueio nervoso sensorial diferencial durante anestesia extradural. Br J Anaesth 1991;66:651–655.
- Valley MA, Bourke DL, Hamil MP, et al: Curso de tempo de bloqueio simpático durante anestesia epidural: estudos de fluxometria com laser Doppler ou perfusão cutânea regional. Anesth Analg 1993;76:289–294.
- Ginosar Y, Weiniger CF, Kurz V, et al: Simpatectomia mediada por vasodilatação: Um estudo randomizado variando de concentração de bupivacaína epidural. Can J Anaesth 2009;56:213–221.
- Bengsston M: Alterações no fluxo sanguíneo e temperatura da pele durante a analgesia espinhal avaliadas por fluxometria laser Doppler e termografia infravermelha. Acta Anesthesiol Scand 1984;28:625–630.
- Kimura T, Goda Y, Kemmotsu O, et al: Diferenças regionais no fluxo sanguíneo da pele e temperatura durante raquianestesia total. Can J Anaesth 1992;39:123–127.
- Bromage PR, Joyal AC, Binney JC: Anestésicos locais: penetração do espaço extradural espinhal no neuroeixo. Ciência 1963; 140: 392-394.
- Moore D, Spierdijk J, VanKleef J, et al: Neurotoxicidade da cloroprocaína: Quatro casos adicionais. Anesth Analg 1982;61:155–159.
- Lynch C 3rd: Depressão da contratilidade miocárdica in vitro por bupivacaína, etidocaína e lidocaína. Anesth Analg 1986;65: 551–559.
- Graf B, Martin E, Bosnjak Z: Efeito estereoespecífico de isômeros de bupivacaína na condução atrioventricular no coração perfundido isolado de cobaia. Anestesiologia 1997;86:410–419.
- McClure JH: Ropivacaína. Br J Anaesth 1996;76:300–307.
- Bader AM, Datta A, Flanagan H, et al: Comparação do bloqueio de condução induzido por bupivacaína e ropivacaína em nervo vago de coelho isolado. Anesth Analg 1989;68:724–727.
- Curatolo M, Petersen-Felix S, Arendt-Nielsen L, et al: A adição de bicarbonato de sódio à lidocaína aumenta a profundidade do bloqueio epidural. Anesth Analg 1998;86:341–347.
- Corke BC, Carlson CG, Dettbarn WD: A influência da 2-cloroprocaína na potência analgésica subsequente da bupivacaína. Anestesiologia 1984;60:25–27.
- Stanton-Hicks M, Berges PU, Bonica JJ: Efeitos circulatórios do bloqueio do nervo peridural. 1973. Comparação dos efeitos da epinefrina e da fenilefrina. Anestesiologia 39;308:314–XNUMX.
- Bouguet D: A clonidina caudal adicionada aos anestésicos locais aumenta a analgesia pós-operatória após cirurgia anal em adultos. Anestesiologia 1994; 81:A942.
- Kroin JS, Buvanendran A, Beck DR, et al: O prolongamento da clonidina da analgesia da lidocaína após o bloqueio do nervo ciático em ratos é mediado pela corrente de cátions ativada por hiperpolarização, não por alfa-adrenorreceptores. Anestesiologia 2004;101:488–494.
- Landau R, Schiffer E, Morales M, et al: O efeito poupador de dose da clonidina adicionada à ropivacaína para analgesia epidural do parto. Anesth Analg 2002;95:728–734.
- Kayacan N, Arici G, Karsli B, et al: Analgesia peridural controlada pelo paciente no trabalho de parto: A adição de fentanil ou clonidina à bupivacaína. Agri 2004;16:59–66.
- Novak-Jankovic V, Paver-Eržen V, Bovill JG, et al: Efeito da clonidina epidural e intravenosa na resposta neuroendócrina e imunológica ao estresse em pacientes submetidos à cirurgia pulmonar. Eur J Anesthesiol 2000; 17:50-56.
- Matot I, Drenger B, Weissman C, et al: Clonidina peridural, bupivacaína e metadona como único agente analgésico após toracotomia para ressecção pulmonar. Anestesia 2004;59:861–866.
- Wu CT, Jao SW, Borel CO: O efeito da clonidina epidural na resposta perioperatória de citocinas, dor pós-operatória e função intestinal em pacientes submetidos à cirurgia colorretal. Anesth Analg 2004;99: 502–509.
- Roelants F, Lavand'homme PM, Mercier-Fuzier V: Administração epidural de neostigmina e clonidina para induzir analgesia de parto: avaliação da eficácia e efeito poupador do anestésico local. Anestesiologia 2005;102:1205–1210.
- Boogmans T, Vertommen J, Valkenborgh T, et al: Neostigmina peridural e clonidina melhoram a qualidade da analgesia epidural espinhal combinada no trabalho de parto: um estudo randomizado, duplo-cego controlado. Eur J Anesthesiol 2014;31:190–196.
- Roelants F, Lavand'homme PM: A neostigmina epidural combinada com sufentanil proporciona analgesia balanceada e seletiva no início do trabalho de parto. Anestesiologia 2004;101:439–444.
- Omais M, Lauretti G, Paccola CA: Morfina peridural e neostigmina para analgesia pós-operatória após cirurgia ortopédica. Anesth Analg 2002;95:1698–1701.
- Habib AS, Gan TJ. Uso de neostigmina no manejo da dor pós-operatória aguda e dor do parto: uma revisão. CNS Drugs 2006;20: 821-839.
- Lauretti GR, Gomes JM, Reis MP, Pereira NL:. Baixas doses de cetamina peridural ou neostigmina, mas não midazolam, melhoram a analgesia da morfina na terapia da dor epidural terminal do câncer. J Clin Anesth 1999; 11(8):663-668.
- Lauretti GR, de Oliveira R, Perez MV, et al: Analgesia pós-operatória por neostigmina intra-articular e epidural após cirurgia de joelho. J Clin Anesth 2000;12:444–448.
- Johansen MJ, Gradert TL, Sattefield WC, et al: Segurança da infusão contínua de midazolam intratecal no modelo de ovelhas. Anesth Analg 2004;98:1528–1535.
- Bharti N, Madan R, Mohanty PR, et al: Midazolam intratecal adicionado à bupivacaína melhora a duração e a qualidade da raquianestesia. Acta Anesthesiol Scand 2003;47:1101–1105.
- Tucker AP, Mezzatesta J, Nadeson R, et al: Midazolam intratecal II: Combinação com fentanil intratecal para dor de parto. Anesth Analg 2004;98:1521–1527.
- Ugur B, Basaloglu K, Yurtseven T, et al: Neurotoxicidade com administração de dose única intratecal de midazolam. Eur J Anesthesiol 2005;22: 907-912.
- Yaksh TL, Allen JW: Insights pré-clínicos sobre a implementação de midazolam intratecal: um conto de advertência. Anesth Analg 2004;98: 1509–1511.
- Gambling D, Hughes T, Martin G, et al: Uma comparação de Depodur, uma nova morfina epidural de liberação prolongada de dose única, com morfina epidural padrão para alívio da dor após cirurgia abdominal inferior. Anesth Analg 2005;100:1065–1074.
- Viscusi ER, Martin G, Hartrick CT, et al: Quarenta e oito horas de alívio da dor pós-operatória após artroplastia total do quadril com uma nova formulação de morfina epidural de liberação prolongada. Anestesiologia 2005;102:1014–1022.
- Carvalho B, Riley E, Cohen SE, et al: Dose única, morfina epidural de liberação sustentada no manejo da dor pós-operatória após cesariana eletiva: Resultados de um estudo multicêntrico randomizado controlado. Anesth Analg 2005;100:1150–1158.
- Magnusdottir H, Kimo K, Ricksten S: A analgesia peridural torácica alta não inibe a atividade do nervo simpático nas extremidades inferiores. Anestesiologia 1999;91:1299–1304.
- Basse L, Werner M, Kehlet H: A drenagem urinária é necessária durante a anestesia peridural contínua após ressecção colônica. Reg Anesth Pain Med 2000;25:498–501.
- Galindo A, Hernandez J, Benavides O, et al: Qualidade da anestesia espinhal extradural: A influência do diâmetro da raiz do nervo espinhal. Br J Anaesth 1975;47:41–47.
- Duggan J, Bowler GM, McClure JH, et al: Bloqueio do nervo extradural com bupivacaína: Influência da dose, volume, concentração e características do paciente. Br J Anaesth 1998;61:324–331.
- Sakura S, Sumi M, Kushizaki H, et al: A concentração de lidocaína afeta a intensidade do bloqueio do nervo sensorial durante a anestesia peridural lombar. Anesth Analg 1999;88:123–127.
- Hodgkinson R, Husain FJ: Obesidade, gravidade e propagação da anestesia epidural. Anesth Analg 1981;60:421–424.
- Seow LT, Lips FJ, Cousins MJ: Efeito da posição lateral no bloqueio peridural para cirurgia. Anaesth Intensive Care 1983;11:97–102.
- Park WY, Hagins FM, Rivat EL, et al: Idade e resposta à dose epidural em homens adultos. Anestesiologia 1982;56:318–320.
- Park WY, Massengale M, Kim SI, et al: Idade e disseminação de soluções anestésicas locais no espaço peridural. Anesth Analg 1980;59:768–771.
- Veering BT, Burm AG, van Kleef JW, et al: Anestesia epidural com bupivacaína: Efeitos da idade no bloqueio neural e farmacocinética. Anesth Analg 1987;66:589–593.
- Hirabayashi Y, Shimizu R, Matsuda I, et al: Efeito da complacência extradural e resistência na disseminação da analgesia extradural. Br J Anaesth 1990;65:508–513.
- Bromage PR, Bufoot MF, Crowell DE, et al: Qualidade do bloqueio peridural. I. Influência de fatores físicos. Br J Anaesth 1964;36: 342–352.
- Grundy EM, Zamora AM, Winnie AP: Comparação da propagação da anestesia peridural em mulheres grávidas e não grávidas. Anesth Analg 1978;57:544–546.
- Arakawa M: A gravidez aumenta a eficácia da anestesia peridural lombar? Int J Obstet Anesth 2004;13:86–90.
- Henke VG, Bateman BT, Leffert LR: Raquianestesia na pré-eclâmpsia grave. Anaesth Analg 2013;117:686–693.
- Spiegel JE, Vasudevan A, Li Y, et al: Um estudo prospectivo randomizado comparando dois cateteres peridural flexíveis para analgesia de parto. Br J Anaesth 2009;103:400–405.
- Frölich MA, Zhang K, Ness TJ: Efeito da sedação na percepção da dor. Anestesiologia 2013;118:611–621.
- Frölich MA, Burchfield DJ, Euliano TY, et al: Uma dose única de fentanil e midazolam antes da cesariana não tem efeitos adversos neonatais. Can J Anaesth 2006;53:79–85.
- Varelmann D, Pancaro C, Cappiello EC, et al: Hiperalgesia induzida por Nocebo durante a injeção de anestésico local. Anesth Analg 2010;110: 868–870.
- Marica LS, O'Day T, Janosky J, et al: A cloroprocaína é menos dolorosa do que a lidocaína para anestesia por infiltração da pele. Anesth Analg 2002;94: 351–354.
- Cepeda MS, Tzortzopoulou A, Thackrey M, et al: Ajustando o pH da lidocaína para reduzir a dor na injeção. Sistema de banco de dados Cochrane Rev 2010;12:CD006581.
- Al Shahwan MA: Comparação prospectiva entre lidocaína-epinefrina a 1% tamponada e resfriamento da pele na redução da dor da infiltração de anestésico local. Dermatol Surg 2012;38:1654–1659.
- Hamilton CL, Riley ET, Cohen SE: Mudanças na posição dos cateteres peridurais associados ao movimento do paciente. Anestesiologia 1997;86: 778–784.
- Richardson MG, Thakur R, Abramowicz JS, et al: A postura materna influencia a extensão do bloqueio nervoso sensorial produzido por bupivacaína livre de dextrose intratecal com fentanil para analgesia de parto. Anesth Analg 1996;83:1229–1233.
- Tsen LC: As técnicas neuroaxiais para analgesia de parto devem ser colocadas em decúbito lateral. Int J Obstet Anesth 2008;17:146–149.
- Força-Tarefa da Sociedade Americana de Anestesiologistas sobre Complicações Infecciosas Associadas a Técnicas Neuroaxiais: Consultoria prática para a prevenção, diagnóstico e tratamento de complicações infecciosas associadas a técnicas neuroaxiais. Anestesiologia 2010;112:530–545.
- Malhotra S, Dharmadasa A, Yentis SM: Uma contra duas aplicações de clorexidina/etanol para desinfecção da pele: Implicações para anestesia regional. Anestesia 2011;66:574–578.
- Bogod DS: A picada na cauda: antissepsia e o neuroeixo revisitado.
Anestesia 2012;67:1305–1309. - Segal S, Arendt KW: Um estudo retrospectivo da eficácia da perda de resistência ao ar ou solução salina para identificação do espaço peridural. Anesth Analg 2010;110:558–563.
- Laviola S, Kirvelä M, Spoto M: Pneumoencéfalo com cefaleia intensa e dilatação pupilar unilateral após punção dural acidental durante anestesia peridural para cesariana. Anesth Analg 1999;88: 582–583.
- Van de Velde M: Identificação do espaço peridural: Pare de usar a técnica de perda de resistência ao ar! Acta Anaesthiol Belg 2006;57: 51–54.
- Dalens B, Bazin JE, Haberer JP: Bolhas epidurais como causa de analgesia incompleta durante anestesia epidural. Anesth Analg 1987;66: 679-683.
- Naulty JS, Ostheimer GW, Datta S, et al: Incidência de embolia aérea venosa durante a inserção de cateter peridural. Anestesiologia 1982;57: 410–412.
- Evron S, Sessler D, Sadan O, et al: Identificação do espaço epidural: Perda de resistência com ar, lidocaína ou a combinação de ar e lidocaína. Anesth Analg 2004;99:245–250.
- Balki M, Lee Y, Halpern S, et al: Imagem de ultra-som da coluna lombar no plano transverso: A correlação entre a profundidade estimada e real para o espaço epidural em parturientes obesas. Anesth Analg 2009;108: 1876–1881.
- Mhyre JM: Por que as doses do teste farmacológico não identificam o cateter intratecal não intencional em obstetrícia? Anesth Analg 2013; 116:4-7.
- Tsui B, Gupta S, Finucane B: Confirmação da colocação do cateter peridural usando estimulação nervosa. Can J Anaesth 1998;45: 640–644,1998.
- Lyons GR, Kocarev MG, Wilson RC, et al: Uma comparação de volumes mínimos de anestésico local e doses de bupivacaína epidural (0.125% p/ve 0.25% p/v) para analgesia no trabalho de parto. Anesth Analg 2007;104: 412–415.
- Wong CA, Ratliff JT, Sullivan JT, et al: Uma comparação randomizada de bolus peridural intermitente programado com infusão peridural contínua para analgesia de parto. Anesth Analg 2006;102:904–909.
- Heesen M, Klohr S, Rossaint R, et al: A incidência de punção dural acidental em mulheres em trabalho de parto pode ser reduzida? Uma revisão sistemática e meta-análise. Minerva Anestesiol 2013;79:1187–1197.
- Van de Velde M, Schepers R, Berends N, et al: Dez anos de experiência com punção dural acidental e cefaleia pós-punção dural em um departamento de anestesia obstétrica terciária. Int J Obstet Anesth 2008;17: 329–335.
- Agerson AN, Scavone BM: Remendo de sangue peridural profilático após punção dural não intencional para a prevenção de cefaleia pós-punção dural em parturientes. Anesth Analg 2012;115:133–136.
- Bauer ME, Kountanis JA, Tsen LC, et al: Fatores de risco para falha na conversão de analgesia epidural de parto para anestesia cesariana: Uma revisão sistemática e meta-análise de estudos observacionais. Int J Obstet Anesth 2012;21:294–309.
- Toledano RD, Kodali BS, Camann WR: Drogas anestésicas na prática obstétrica e ginecológica. Rev Obstet Gynecol 2009;2: 93–100.
- Mhyre JM, Greenfield ML, Tsen LC, et al: Uma revisão sistemática de ensaios clínicos randomizados que avaliam estratégias para evitar a canulação da veia peridural durante a colocação de cateter peridural obstétrico. Anesth Analg 2009;108:1232–1242.
- Neal JM, Mulroy MF, Weinberg GL: Lista de verificação da Sociedade Americana de Anestesia Regional e Medicina da Dor para o gerenciamento da toxicidade sistêmica do anestésico local: versão 2012. Reg Anesth Pain Med 2012;37:16–18.
- Bhole MV, Manson AL, Seneviratne SL, et al: Alergia mediada por IgE a anestésicos locais: Separando fato de percepção: uma perspectiva do Reino Unido. Br J Anaesth 2012;108:903–911.
- Rice I, Wee MY, Thomson K: Peridurais obstétricas e aracnoidite adesiva crônica. Br J Anaesth 2004;92:109–120.
- Taniguchi M, Bollen AW, Drasner K: Bissulfito de sódio: bode expiatório para a neurotoxicidade da cloroprocaína? Anestesiologia 2004;100:85–91.
- Checketts MR: Lave e vá, mas com o quê? Soluções anti-sépticas da pele para bloqueio do nervo neuroaxial central. Anestesia 2012;67:819–822.
- Na EH, Han SJ, Kim MH: Ocorrência tardia de aracnoidite espinhal após um bloqueio do nervo caudal. J Med Spinal Med 2011;34:616–619.
- Ross JS, Masaryk T, Modic M, et al: RM de aracnoidite lombar. Am J Roentgenol 1987;149:1025-1032.
- Wang YL, Hsieh JR, Chung HS, et al: A adição local de tenoxicam reduz a incidência de dor lombar após anestesia peridural lombar. Anestesiologia 1998;89:1414–1417.
- Stevens RA, Urmey WF, Urquhart, et al: Dor nas costas após anestesia peridural com cloroprocaína. Anestesiologia 1993;78:492–497.
- Hakim SH, Narouze S, Shaker NN, et al: Fatores de risco para dor lombar persistente de início recente após cirurgia não obstétrica realizada com anestesia epidural. Reg Anesth Pain Med 2012;37:175–182.
- Wilkinson HA: Anestesia de bloqueio nervoso de campo para punção lombar. JAMA 1983;249:2177.
- Wang YL, Tan PP, Yang CH, et al: A dexametasona peridural reduz a incidência de dor nas costas após anestesia peridural lombar. Anesth Analg 1997;84:376–378.
- Breen TW: Analgesia epidural e dor nas costas. Em Halpern Sh, Douglas MJ (eds): Anestesia Obstétrica Baseada em Evidências. BMJ Books, 2005, pp 208-216.
- Arendt K, Demaerschalk BM, Wingerchuck DM, et al: Agulhas de punção lombar atraumáticas: depois de todos esses anos, ainda estamos perdendo o ponto? Neurologista 2009;15:17–20.
- Brownridge P: O manejo da cefaleia após punção dural acidental em pacientes obstétricas. Anaesth Intensive Care 1983;11:4–15.
- Comitê de Classificação de Cefaleias da Sociedade Internacional de Cefaleias: A Classificação Internacional de Cefaleias, terceira edição. Cefalalgia 2013;33:629–808.
- Webb CA, Weyker PD, Zhang L, et al: Punção dural não intencional com agulha de Tuohy aumenta o risco de cefaleia crônica. Anesth Analg 2012;115:124–132.
- Apfel CC, Saxena A, Cakmakkaya OS, et al: Prevenção de cefaleia pós-punção dural após punção dural acidental: Uma revisão sistemática quantitativa. Br J Anaesth 2010;105:255–263.
- Oedit R, van Kooten F, Bakker SL, et al: Eficácia do tampão sanguíneo epidural para o tratamento da cefaleia pós-punção lombar BLOPP: Um ensaio clínico randomizado, cego para observadores e controlado. BMC Neurol 2005;
5: 12. - van Kooten F, Oedit R, Bakker SL, et al: Remendo de sangue epidural na dor de cabeça pós-punção dural: Um ensaio clínico controlado randomizado, observado-cego. J Neurol Neurosurg Psychiatry 2008;79:553–559.
- Angle P, Tang SL, Thompson D, et al: O manejo expectante da cefaleia pós-punção dural aumenta o tempo de internação hospitalar e as visitas à emergência. Can J Anaesth 2005;52:397–402.
- Paech MJ, Doherty DA, Christmas T, et al: O volume de sangue para remendo de sangue peridural em obstetrícia: um ensaio clínico randomizado e cego. Anesth Analg 2011;113:126–133.
- Haines DE: Sobre a questão de um espaço subdural. Anat Rec 1991; 230:3-21.
- Lubenow T, Keh-Wong E, Kristof K, et al: Injeção subdural inadvertida: Uma complicação do bloqueio do nervo epidural. Anesth Analg 1988;67: 175–179.
- Paech MJ, Godkin R, Webster S: Complicações da analgesia e anestesia epidural obstétrica: Uma análise prospectiva de 10,995 casos. Int J Obstet Anesth 1998;7:5–11.
- Cappiello E, Tsen LC: Complicações e efeitos colaterais das técnicas neuroaxiais centrais. Em Wong CA (ed): Anestesia espinhal e epidural. McGraw-Hill, 2007, pp 152-182.
- Grewal S, Hocking G, Wildsmith JA: Abscessos epidurais. Br J Anaesth 2006;96:292–302.
- Darouiche R, Abscesso epidural espinhal: N Engl J Med 2006;355: 2012–2020.
- Connor DE, Chittiboina P, Caldito G, et al: Comparação do manejo operatório e não operatório do abscesso epidural espinhal: Uma revisão retrospectiva de preditores clínicos e laboratoriais de resultados neurológicos. J Neurosurg Spine 2013;19:119–127.
- Curry WT, Hoh BL, Amin-Hanjani S, et al: Abscesso epidural espinhal: apresentação clínica, tratamento e resultado. Surg Neurol 2005;63:364–371.
- Okano K, Kondo H, Tsuchiya R, et al: Abscesso epidural espinhal associado a cateterismo epidural: Relato de caso e revisão da literatura. Jpn J Clin Oncol 1999;29:49–52.
- Danner RL, Hartman BJ: Atualização em abscesso epidural espinhal: 35 casos e revisão da literatura. Rev Infect Dis 1987;9:265–274.
- Huang PY, Chen SF, Chang WN, et al: Abscesso epidural espinhal em adultos causado por Staphylococcus aureus: características clínicas e fatores prognósticos. Clin Neurol Neurosurg 2012;114:572–576.
- Baer ET: Meningite bacteriana pós-punção dural. Anestesiologia 2006; 105:381-393.
- Reynolds F: Infecções neurológicas após anestesia neuroaxial. Anesthesiol Clin 2008;26:23–52.
- Usubiaga JE: Complicações neurológicas após anestesia peridural. Int Anesthesiol 1975;13:1–153.
- Kane RE: Déficits neurológicos após raquianestesia ou peridural. Anesth Analg 1981;60:150–161.
- Kao M, Tsai S, Tsou M, et al: Paraplegia após detecção tardia de lesão medular inadvertida durante cateterismo peridural torácico em paciente idoso anestesiado. Anesth Analg 2004;99:580–583.
- Loo CC, Irestedt L: Síndrome da cauda equina após raquianestesia com lidocaína hiperbárica a 5%: Uma revisão de seis casos de síndrome da cauda equina relatados ao Seguro Farmacêutico Sueco 1993-1997. Acta Anesthesiol Scand 1999;43:371–379.
- Lambert DH, Hurley RJ: Síndrome da cauda equina e raquianestesia contínua. Anesth Analg 1991;72:817–819.
- Gerancher JC: Síndrome da cauda equina após uma única administração espinhal de lidocaína hiperbárica a 5% através de uma agulha Whitacre de calibre 25. Anestesiologia 1997;87:687–689.
- Benson JS: Alerta de segurança da US Food and Drug Administration: síndrome da cauda equina associada ao uso de cateteres de pequeno calibre em raquianestesia contínua. AANA J 1992;60:223.
- Rigler ML, Drasner K, Krejcie, TC, et al: Síndrome da cauda equina após raquianestesia contínua. Anesth Analg 1991;72:275–281.
- Gaiser RR: A lidocaína intratecal deve ser usada no século XXI? J Clin Anesth 21;2000:12–476.
- Walters MA, Van de Velde M, Wilms G: Hematoma intratecal agudo após anestesia neuraxial: atraso no diagnóstico após imagem radiológica aparentemente normal. Int J Obstet Anesth 2012;21:181–185.
- Auroy Y, Narchi P, Messias A, et al: Complicações graves relacionadas à anestesia regional: Resultados de uma pesquisa prospectiva na França. Anestesiologia 1997;87:479–486.
- Pollard JB: Mecanismos e estratégias comuns para prevenção e tratamento de parada cardíaca durante anestesia peridural. J Clin Anesth 2002;14:52–56.
- Pollard JB: Parada cardíaca durante raquianestesia: mecanismos comuns e estratégias de prevenção. Anesth Analg 2001;92:252–256.
- Krismer AC, Hogan QH, Wenzel V, et al: A eficácia da epinefrina ou vasopressina para ressuscitação durante a anestesia epidural. Anesth Analg 2001;93:734–742.
- Curatolo M, Scaramozzino P, Venuti FS, et al: Fatores associados à hipotensão e bradicardia após bloqueio peridural. Anesth Analg 1996;83:1033–1040.
- Liguori GA, Sharrock NE: Assistolia e bradicardia grave durante anestesia peridural em pacientes ortopédicos. Anestesiologia 1997;86: 250–257.
- Camann WR, Hortvet LA, Hughes N, et al: Regulação da temperatura materna durante analgesia extradural para trabalho de parto. Br J Anaesth 1991;67: 565–568.
- Borgeat A, Ekatodramis G, Schenker CA: Náuseas e vômitos pós-operatórios em anestesia regional: Uma revisão. Anestesiologia 2003;98: 530–547.
- Allen TK, Jones CA, Habib AS: Dexametasona para a profilaxia de náuseas e vômitos pós-operatórios associados à administração de morfina no neuroeixo: Uma revisão sistemática e meta-análise. Anesth Analg 2012;114:813–822.
- Turnbull J, Moonesinghe R: Perioperatórias perioperatórias: A controvérsia continua. Br J Hosp Med 2011;72:538.
- Dong H, Zhang Y, Xi H: Os efeitos da anestesia epidural e analgesia na citotoxicidade das células natural killer e na resposta das citocinas em pacientes com câncer de ovário epitelial submetidos à ressecção radical, J Int Med Research 2012;40:1822–1829.