Jason Choi, Liane Germond e Alan C. Santos
INTRODUÇÃO
A maioria das mulheres sente dor moderada a intensa durante o trabalho de parto e parto, muitas vezes exigindo alguma forma de analgesia farmacológica. A falta de preparação psicológica adequada combinada com medo e ansiedade pode aumentar muito a sensibilidade da paciente à dor e aumentar ainda mais o desconforto durante o trabalho de parto. No entanto, a analgesia obstétrica habilmente conduzida, além de aliviar a dor e a ansiedade, pode beneficiar a mãe de muitas outras maneiras. Este capítulo se concentra no manejo de pacientes obstétricas com foco principal nas técnicas de anestesia regional.
Alterações Fisiológicas da Gravidez
A gravidez resulta em mudanças significativas que afetam a maioria dos sistemas de órgãos maternos.tabela 1). Essas mudanças são iniciadas por hormônios secretados pelo corpo lúteo e pela placenta. Tais mudanças têm implicações importantes para o anestesiologista que cuida da paciente grávida. Este capítulo revisa as alterações fisiológicas mais relevantes da gravidez e discute a abordagem do manejo obstétrico usando anestesia regional.
Alterações no Sistema Cardiovascular
O consumo de oxigênio aumenta durante a gravidez, pois o sistema cardiovascular materno é necessário para atender às crescentes demandas metabólicas de um feto em crescimento. O resultado final dessas alterações é um aumento da frequência cardíaca (15%-25%) e do débito cardíaco (até 50%) em comparação com os valores anteriores à gravidez. Além disso, menor resistência vascular é encontrada nos leitos uterinos, renais e outros vasculares. Essas alterações resultam em uma pressão arterial mais baixa devido à diminuição da resistência periférica, que excede o aumento do débito cardíaco. A diminuição da resistência vascular deve-se principalmente à secreção de estrogênios, progesterona e prostaciclina. Aumentos particularmente significativos no débito cardíaco ocorrem durante o trabalho de parto e no período pós-parto imediato devido ao aumento do volume sanguíneo do útero contraído.
Dicas NYSORA
- Alterações cardiovasculares e armadilhas na gravidez avançada incluem o seguinte:
- Aumento da frequência cardíaca (15%–25%) e do débito cardíaco (até 50%).
- Diminuição da resistência vascular nos leitos uterino, renal e outros leitos vasculares.
- A compressão da aorta inferior na posição supina pode diminuir ainda mais a perfusão uteroplacentária e resultar em asfixia fetal.
- Hipotensão significativa é mais provável de ocorrer em mulheres grávidas versus não grávidas submetidas à anestesia regional, necessitando de deslocamento uterino ou manobras de inclinação pélvica lateral, pré-carga intravascular e vasopressores.
A partir do segundo trimestre, a compressão aortocava pelo útero aumentado torna-se progressivamente mais importante, atingindo seu efeito máximo em 36-38 semanas, após o que pode ser aliviada à medida que a cabeça fetal desce para a pelve. O débito cardíaco pode diminuir quando os pacientes estão em decúbito dorsal, mas não em decúbito lateral. A oclusão venosa pelo feto em crescimento causa síndrome hipotensiva supina em 10% das gestantes e se manifesta como taquicardia materna, hipotensão arterial, desmaio e palidez.
A compressão da aorta inferior nesta posição pode diminuir ainda mais a perfusão uteroplacentária e resultar em asfixia fetal. Deslocamento uterino ou inclinação pélvica lateral devem ser aplicados rotineiramente durante o manejo anestésico da paciente grávida. O deslocamento uterino é melhor alcançado colocando-se a paciente em decúbito lateral esquerdo. Nesta posição, a atividade vagal cardíaca será aumentada em comparação com a posição supina. A colocação de uma cunha sob a pelve óssea tem sido usada para obter a inclinação uterina. No entanto, recentemente foi demonstrado que a inclinação uterina é mais eficaz quando a mãe é colocada em decúbito lateral esquerdo completo e, em seguida, é virada em decúbito dorsal sobre a cunha pélvica.
Alterações no eletrocardiograma são comuns no final da gravidez. O eixo QRS pode inicialmente se deslocar para a direita durante o primeiro trimestre, girando para a esquerda no terceiro trimestre como resultado da expansão do útero. Um encurtamento dos intervalos PR e QT e um aumento da frequência cardíaca também estão presentes. O encurtamento do intervalo QT pode ter implicações para mulheres com síndrome do QT longo. De fato, Seth et al. encontraram redução do risco (razão de risco [RR] = 0.38) de eventos cardíacos durante a gravidez em mulheres com síndrome do QT prolongado. No entanto, também foi encontrado um risco aumentado de eventos cardíacos pós-parto nos primeiros nove meses após o parto, o que sugere que o intervalo QT se prolonga novamente no período pós-parto precoce. Há também uma tendência a contrações atriais prematuras, taquicardia sinusal e taquicardia supraventricular paroxística.
TABELA 1. Resumo das alterações fisiológicas da gravidez a termo.
| Variável | Mudar | QuantidadeTotal |
|---|---|---|
| Volume total de sangue | Crescimento | 25% –40% |
| Volume do plasma | Crescimento | 40% –50% |
| Fibrinogênio | Crescimento | 50% |
| Atividade da colinesterase sérica | Baixa | 20% –30% |
| Débito cardíaco | Crescimento | 30% –50% |
| Ventilação por minuto | Crescimento | 50% |
| Ventilação alveolar | Crescimento | 70% |
| Capacidade residual funcional | Baixa | 20% |
| Consumo de oxigenio | Crescimento | 20% |
| Tensão arterial de dióxido de carbono | Baixa | 10mmHg |
| Tensão arterial de oxigênio | Crescimento | 10mmHg |
| Concentração alveolar mínima | Baixa | 32% –40% |
Alterações no Sistema Respiratório
A ventilação minuto aumenta desde o início da gravidez até um máximo de 50% acima do normal até o termo. Isto é principalmente resultado de um aumento de 40% no volume corrente e um pequeno aumento na frequência respiratória. O espaço morto não muda significativamente durante a gravidez; assim, a ventilação alveolar é aumentada em 70% a termo. Após o parto, à medida que os níveis de progesterona no sangue diminuem, a ventilação volta ao normal dentro de 1 a 3 semanas.
A elevação do diafragma ocorre com o aumento do tamanho do útero. O volume de reserva expiratório, o volume residual e a capacidade residual funcional (CRF) diminuem no terceiro trimestre da gravidez. No entanto, como também há aumento do volume de reserva inspiratório, a capacidade pulmonar total permanece inalterada. Uma CRF diminuída é tipicamente assintomática em parturientes saudáveis. Aqueles com alterações preexistentes no volume de fechamento como resultado de tabagismo, obesidade, escoliose ou outra doença pulmonar podem apresentar fechamento precoce das vias aéreas com o avanço da gravidez, levando à hipoxemia. As posições de Trendelenburg e supina também exacerbam a relação anormal entre o volume de fechamento e a CRF. O volume residual e a CRF voltam ao normal logo após o parto.
As mulheres grávidas muitas vezes têm dificuldade com a respiração nasal. A friabilidade das membranas mucosas durante a gravidez pode causar sangramento grave, especialmente na instrumentação das vias aéreas. Essas alterações são causadas pelo aumento do líquido extracelular e do ingurgitamento vascular. Também pode ser difícil realizar a laringoscopia em parturientes obesas, de pescoço curto e com mamas aumentadas. O uso de um laringoscópio de cabo curto provou ser útil.
Dicas NYSORA
O edema das vias aéreas pode ser grave em mulheres grávidas, particularmente naquelas com pré-eclâmpsia, naquelas nas quais a posição de Trendelenburg é usada por períodos prolongados e naquelas nas quais agentes tocolíticos são usados.
Alterações metabólicas
O consumo de oxigênio aumenta durante o início da gravidez, com um aumento geral de 20% a termo. Independentemente disso, o aumento da ventilação alveolar que ocorre durante a gravidez na verdade leva a uma redução na pressão parcial de dióxido de carbono no sangue arterial (PaCO2) para 32 mm Hg e um aumento na pressão parcial de oxigênio no sangue arterial (PaO2) para 106 mm Hg. A base do tampão plasmático diminui de 47 para 42 mEq; consequentemente, o pH permanece praticamente inalterado. A absorção materna e a eliminação de anestésicos inalatórios são aumentadas devido ao aumento da ventilação alveolar e diminuição da CRF. No entanto, a diminuição da CRF e o aumento da taxa metabólica predispõem a mãe ao desenvolvimento de hipoxemia durante os períodos de apnéia ou hipoventilação.
Alterações no Sistema Gastrointestinal
Os efeitos da gravidez no sistema gastrointestinal são controversos. Foi proposto que o aumento da produção de progesterona causa diminuição da motilidade gastrointestinal e absorção mais lenta dos alimentos. As secreções gástricas são mais ácidas e o tônus do esfíncter esofágico inferior está diminuído. No entanto, estudos mais recentes utilizando técnicas radiográficas, ultrassonográficas e de diluição de corantes demonstraram que o esvaziamento gástrico de materiais líquidos e sólidos não diminui em nenhum momento da gravidez.
O risco de regurgitação na indução da anestesia geral depende, em parte, do gradiente entre o esfíncter esofágico inferior e as pressões intragástricas. Em parturientes com “azia”, o tônus do esfíncter esofágico inferior é bastante reduzido. Nenhum regime profilático de rotina único pode ser recomendado com certeza. A eficácia dos antiácidos não particulados profiláticos é diminuída pela mistura inadequada com o conteúdo gástrico, tempo inadequado de administração e a tendência dos antiácidos de aumentar o volume gástrico. A administração de antagonistas do receptor de histamina (H2), como cimetidina e ranitidina, requer antecipação e tempo cuidadoso, uma vez que seu início de ação é relativamente lento. Nas mulheres de maior risco, pode-se argumentar para a administração de metoclopramida intravenosa (IV) antes da cesariana eletiva. Este antagonista da dopamina acelera o esvaziamento gástrico e aumenta o tônus do esfíncter esofágico inferior em repouso em mulheres não grávidas e grávidas. No entanto, existem dados conflitantes sobre sua eficácia (talvez devido ao momento da administração) e a frequência de efeitos colaterais, como reações extrapiramidais e disfunção neurológica transitória.
Alterações endócrinas que influenciam o volume plasmático, a composição do sangue e o metabolismo da glicose
O volume plasmático e o volume total de sangue começam a aumentar no início da gestação, resultando em um aumento de 40%–50% e 25%–40%, respectivamente, no termo. Essas alterações são devidas a um aumento da atividade mineralocorticóide durante a gravidez, o que resulta em retenção de sódio e aumento do conteúdo de água corporal. O aumento relativamente menor no volume de glóbulos vermelhos (20%) é responsável por uma redução relativa na hemoglobina (para 11-12 g/L) e no hematócrito (para 35%); a contagem de plaquetas, no entanto, permanece inalterada. As concentrações plasmáticas de fibrinogênio aumentam durante a gravidez normal em aproximadamente 50%, enquanto a atividade do fator de coagulação é variável. Os fatores de coagulação I, VII, VIII, IX, X e XII aumentam durante a gravidez, enquanto as concentrações dos fatores XI e XIII diminuem e as concentrações dos fatores II e V permanecem inalteradas durante a gravidez.
A atividade da colinesterase sérica diminui para um nível de 20% abaixo do normal até o termo e atinge um nadir no puerpério. O efeito final dessas alterações na colinesterase sérica é de relevância insignificante para o metabolismo de doses clinicamente usadas de succinilcolina ou anestésicos locais do tipo éster (2-cloroprocaína). A razão albumina-globulina diminui devido à redução relativamente maior na concentração de albumina. Uma diminuição na concentração de proteínas séricas pode ser clinicamente significativa, pois pode-se esperar que as frações livres de drogas ligadas a proteínas aumentem.
O lactogênio placentário humano e o cortisol aumentam a tendência à hiperglicemia e cetose, o que pode exacerbar o diabetes mellitus preexistente. A capacidade da paciente de lidar com uma carga de glicose está diminuída e a passagem transplacentária de glicose pode estimular a secreção fetal de insulina, levando, por sua vez, à hipoglicemia neonatal no pós-parto imediato.
Respostas alteradas a medicamentos na gravidez
A gravidez resulta em um aumento mediado pela progesterona na sensibilidade neural aos anestésicos locais. Doses mais baixas de anestésico local são necessárias por segmento dermátomo de bloqueio peridural ou espinhal. Isso tem sido atribuído a uma maior disseminação do anestésico local nos espaços peridural e subaracnóideo como resultado do ingurgitamento venoso peridural e aumento da sensibilidade ao bloqueio anestésico local devido à progesterona. A concentração alveolar mínima para agentes inalatórios diminui em 8 a 12 semanas de gestação e pode estar relacionada a um aumento nos níveis de progesterona.
Dicas NYSORA
- Durante a gravidez, há um aumento mediado pela progesterona na sensibilidade neural aos anestésicos locais.
- As doses de anestésico local precisam ser reduzidas por segmento de dermátomo de bloqueio peridural ou espinhal.
TRANSFERÊNCIA PLACENTAL DE ANESTÉSICOS LOCAIS
Os anestésicos locais atravessam facilmente a placenta por difusão simples. Vários fatores influenciam a transferência placentária de drogas, incluindo as características físico-químicas da própria droga, concentrações maternas de drogas no plasma, propriedades da placenta e eventos hemodinâmicos dentro da unidade feto-materna. membranas biológicas mais facilmente, e o grau de ionização é importante porque a porção não ionizada de um fármaco é mais lipofílica do que o fármaco ionizado. Os anestésicos locais são bases fracas, com grau de ionização relativamente baixo e lipossolubilidade considerável. As concentrações relativas do fármaco existentes nas formas não ionizada e ionizada podem ser estimadas a partir da equação de Henderson-Hasselbalch:
pH = pKaa + log (base)/(cátion)
A proporção de base para cátion torna-se particularmente importante com anestésicos locais porque a forma não ionizada penetra nas barreiras teciduais, enquanto a forma ionizada é farmacologicamente ativa no bloqueio da condução nervosa. O pKa (constante de dissociação ácida) é o pH no qual as concentrações de base livre e cátion são iguais. Para os anestésicos locais amida, o pKa Os valores (7.7-8.1) são suficientemente próximos do pH fisiológico, de modo que mudanças no estado bioquímico materno ou fetal podem alterar significativamente a proporção de drogas ionizadas e não ionizadas.Figura 1). No estado de equilíbrio, as concentrações de anestésicos locais não ionizados no plasma fetal e materno são iguais. Com a acidose fetal, há uma tendência maior de a droga existir na forma ionizada, que não pode se difundir de volta pela placenta. Isso faz com que uma maior quantidade total de anestésico local se acumule no plasma e tecidos fetais. Isso é chamado de aprisionamento de íons.
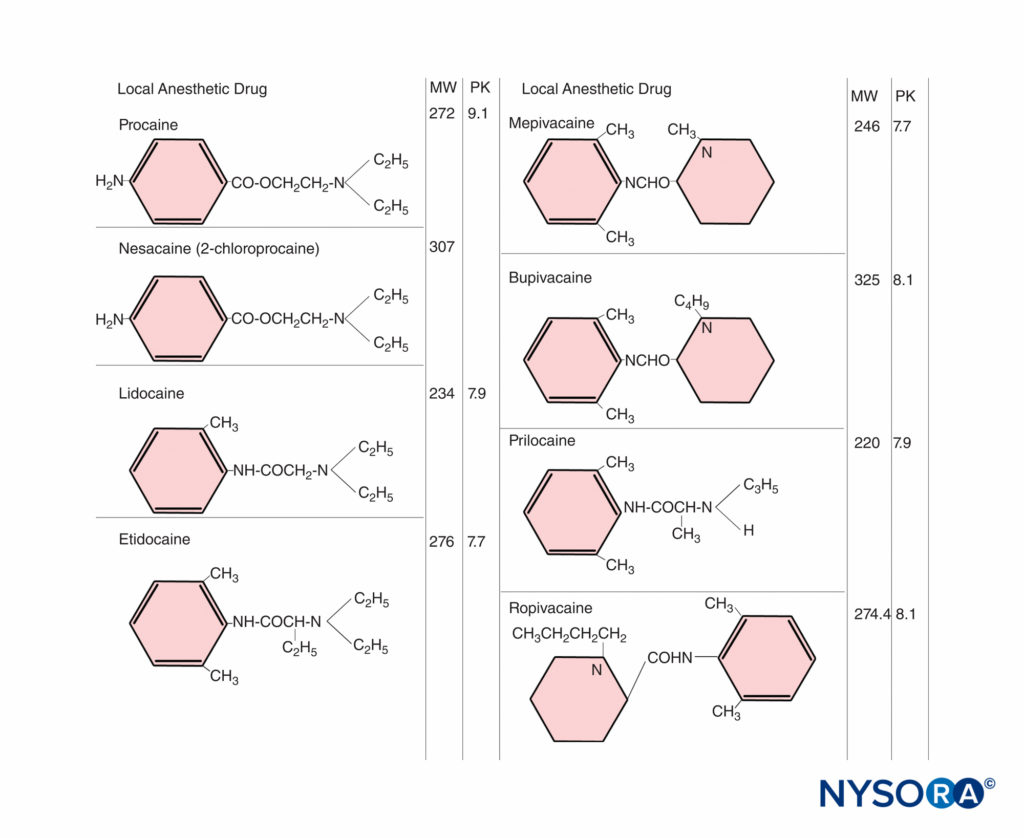
FIGURA 1. Estruturas químicas dos anestésicos locais. PM = peso molecular; PK = constante de ionização.
Dicas NYSORA
A administração prolongada de drogas altamente ligadas a proteínas (p. ex., bupivacaína) pode levar a um acúmulo fetal substancial das drogas.
Os efeitos da ligação às proteínas plasmáticas maternas sobre a taxa e a quantidade de anestésico local acumulado no feto são inadequadamente compreendidos. Estudos em animais mostraram que a taxa de transferência é mais lenta para medicamentos que se ligam extensivamente às proteínas plasmáticas maternas, como a bupivacaína. No entanto, com a administração prolongada de drogas altamente ligadas a proteínas, como a bupivacaína, pode ocorrer acúmulo substancial da droga no feto.
O gradiente de concentração do fármaco livre entre o sangue materno e fetal é um fator significativo. Do lado materno, a dose administrada, o modo e local de administração e o uso de vasoconstritores podem influenciar a exposição fetal. As taxas de distribuição, metabolismo e excreção da droga, que podem variar, são igualmente importantes. Doses mais altas resultam em concentrações mais altas no sangue materno. A taxa de absorção pode variar com o local da injeção. Por exemplo, um bolus IV resulta na concentração sanguínea mais alta. Acreditava-se que a administração intratecal resultava em concentrações plasmáticas insignificantes de anestésicos locais. No entanto, sabemos agora que a raquianestesia induzida com 75 mg de lidocaína resulta em concentrações plasmáticas maternas semelhantes às relatadas por outros após anestesia peridural. Além disso, níveis significativos da droga podem ser encontrados na veia umbilical ao nascimento. A administração repetida pode resultar em altas concentrações sanguíneas maternas, dependendo da dose e da frequência de reinjeção, além das características cinéticas da droga. A meia-vida dos anestésicos locais amida é relativamente longa, de modo que injeções repetidas podem levar ao acúmulo no plasma materno.Figura 2). Em contraste, a 2-cloroprocaína, um anestésico local éster, sofre hidrólise enzimática rápida na presença de pseudocolinesterase. Após a injeção epidural, a meia-vida média na mãe é de aproximadamente 3 minutos; após a reinjeção, a 2-cloroprocaína pode ser detectada no plasma materno por apenas 5 a 10 minutos, e não ocorreu acúmulo dessa droga.
A gravidez está associada a alterações fisiológicas que também podem influenciar a farmacocinética materna e a ação das drogas anestésicas. Essas alterações podem ser progressivas durante o curso da gestação e muitas vezes são difíceis de prever para um fármaco individual. No entanto, a meia-vida de eliminação da bupivacaína após injeção epidural mostrou ser semelhante em mulheres grávidas e não grávidas.
As alterações do fluxo sanguíneo regional fetal também podem afetar a quantidade de droga absorvida pelos órgãos individuais. Por exemplo, durante asfixia e acidose, uma proporção maior do débito cardíaco fetal perfunde o cérebro, o coração e a placenta do feto. A infusão de lidocaína resultou em aumento da captação da droga no coração, cérebro e fígado de fetos de babuínos asfixiados em comparação com fetos controle não asfixiados.
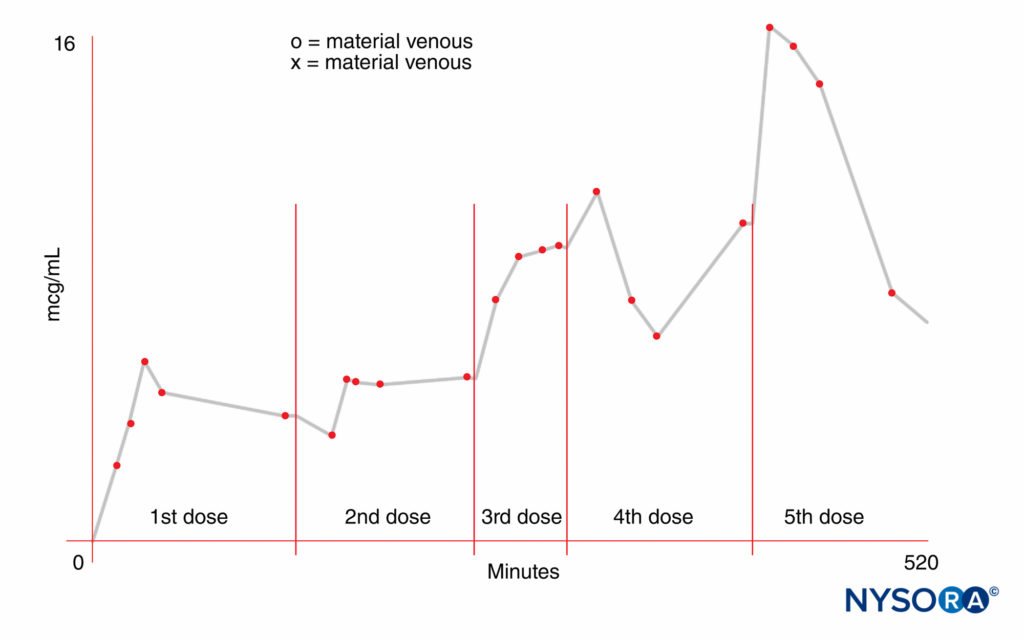
FIGURA 2. Aumento da concentração sanguínea materna de anestésico local após doses repetidas (300 mg) de mepivacaína.
Risco de exposição a drogas: feto versus recém-nascido
O feto pode excretar anestésicos locais de volta à circulação materna após a reversão do gradiente de concentração do fármaco livre através da placenta. Isso pode ocorrer mesmo se a concentração plasmática total do fármaco na mãe exceder a do feto, pois há menor ligação às proteínas no plasma fetal. A 2-cloroprocaína é a única droga que é metabolizada no sangue fetal tão rapidamente que, mesmo com acidose, evita-se uma exposição substancial do feto.
Tanto os recém-nascidos a termo quanto os prematuros possuem as enzimas hepáticas necessárias para a biotransformação dos anestésicos locais do tipo amida. Em um estudo comparativo, a farmacocinética da lidocaína entre ovelhas adultas e cordeiros fetais/neonatais indicou que a depuração metabólica no recém-nascido era semelhante e a depuração renal maior que a do adulto. No entanto, a meia-vida foi maior no recém-nascido; isso está relacionado a um maior volume de distribuição e captação tecidual, de modo que, a qualquer momento, o fígado e os rins do neonato ficam expostos a uma fração menor de lidocaína acumulada no organismo. Resultados semelhantes foram relatados em outro estudo envolvendo administração de lidocaína a lactentes humanos em uma unidade de terapia intensiva neonatal.
A depressão neonatal ocorre em concentrações sanguíneas de mepivacaína ou lidocaína que são aproximadamente 50% menores do que aquelas que produzem toxicidade sistêmica no adulto. No entanto, bebês acidentalmente injetados no útero com mepivacaína (destinado à anestesia caudal materna) pararam de convulsionar quando o nível de mepivacaína caiu abaixo do limiar para convulsões no adulto. A toxicidade relativa do sistema nervoso central e a toxicidade cardiorrespiratória dos anestésicos locais foram estudadas em ovelhas. As doses necessárias para produzir toxicidade no cordeiro fetal e recém-nascido foram maiores do que as necessárias na ovelha. No feto, essa diferença foi atribuída à liberação placentária do fármaco para a mãe e à melhor manutenção das tensões gasométricas durante as convulsões, enquanto que no cordeiro recém-nascido, um maior volume de distribuição provavelmente foi responsável pelas doses mais altas necessárias para induzir os efeitos tóxicos.
Tem sido sugerido que a bupivacaína pode estar implicada como uma possível causa de icterícia neonatal devido à sua alta afinidade pelas membranas eritrocitárias fetais, resultando em uma diminuição da filtrabilidade e deformabilidade, tornando os indivíduos mais propensos à hemólise. No entanto, um estudo mais recente não conseguiu demonstrar a produção de bilirrubina em recém-nascidos cujas mães receberam bupivacaína para anestesia peridural durante o trabalho de parto e parto.
Estudos neurocomportamentais revelaram mudanças sutis na função neurológica e adaptativa do recém-nascido com anestesia regional. No caso da maioria dos agentes anestésicos, essas alterações são pequenas e transitórias, durando apenas 24 a 48 horas.
ANESTESIA PARA TRABALHO E PARTO VAGINAL
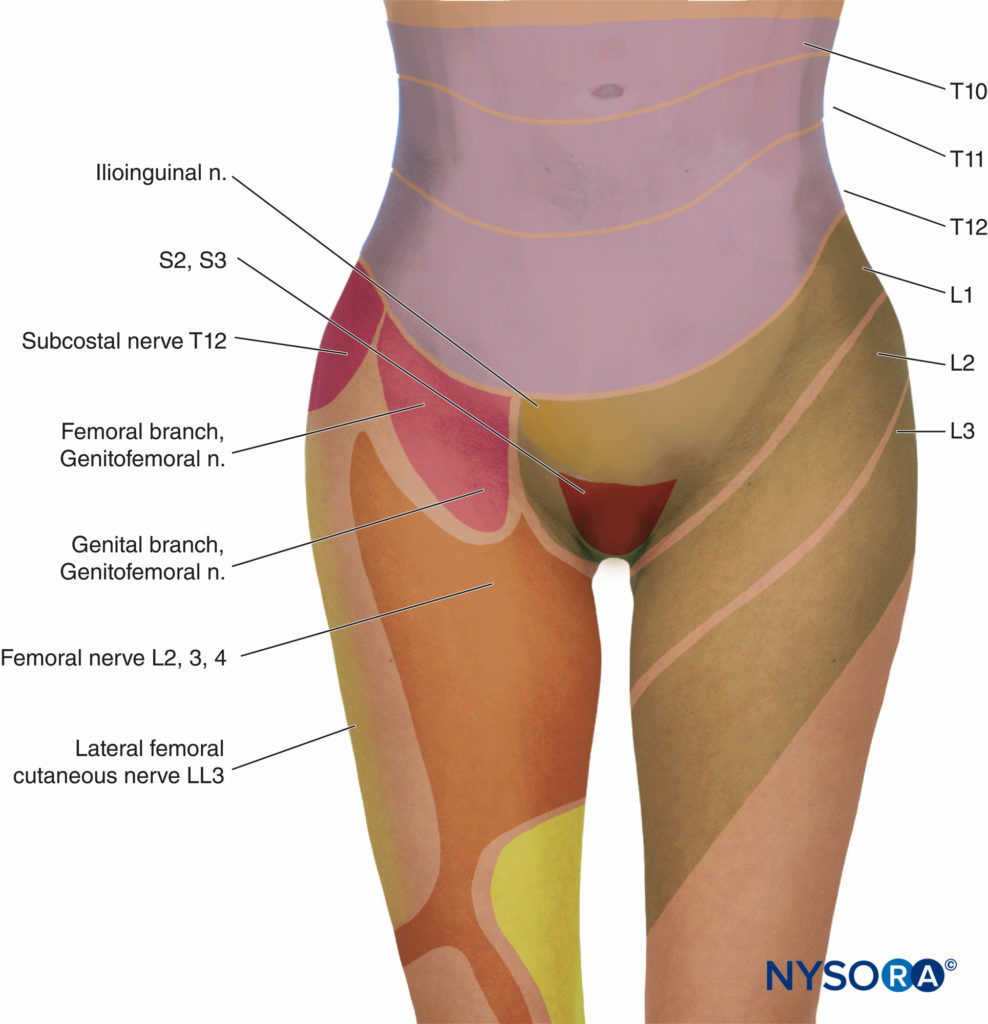
Na primeira fase do trabalho de parto, a dor é causada por contrações uterinas relacionadas à dilatação do colo do útero e distensão do segmento uterino inferior. Os impulsos da dor são conduzidos nas fibras aferentes viscerais do tipo C, que acompanham os nervos simpáticos. No início do trabalho de parto, apenas os dermátomos torácicos inferiores (T11-T12) são afetados. No entanto, com dilatação cervical progressiva durante a fase de transição, os dermátomos adjacentes podem estar envolvidos e a dor referida de T10 a L1. Durante o segundo estágio, impulsos de dor adicionais devido à distensão da abóbada vaginal e do períneo são transportados pelo nervo pudendo, que é composto por fibras sacrais inferiores (S2-S4).
A analgesia regional pode beneficiar a mãe de outras maneiras além de aliviar a dor e a ansiedade. Em estudos com animais, a dor pode causar hipertensão materna e redução do fluxo sanguíneo uterino. A analgesia epidural atenua os aumentos do débito cardíaco materno, da frequência cardíaca e da pressão arterial que ocorrem com as contrações uterinas dolorosas e os esforços de “pressão”. Ao reduzir a secreção materna de catecolaminas, a analgesia epidural pode converter um padrão de trabalho de parto previamente disfuncional em normal. A analgesia regional pode beneficiar o feto ao eliminar a hiperventilação materna com dor, o que muitas vezes leva a uma redução da tensão arterial de oxigênio fetal devido a um desvio para a esquerda da curva de dissociação de oxigênio-hemoglobina materna.
Os métodos mais frequentemente escolhidos para aliviar a dor do parto são a psicoprofilaxia, a medicação sistêmica e a analgesia regional. A analgesia inalatória, a analgesia espinhal convencional e o bloqueio paracervical são menos comumente usados. A anestesia geral raramente é necessária, mas pode ser indicada para relaxamento uterino em alguns partos complicados.
Analgesia Sistêmica
As vantagens dos analgésicos sistêmicos incluem facilidade de administração e aceitação pelo paciente. No entanto, a droga, a dose, o momento e o método de administração devem ser escolhidos com cuidado para evitar a depressão materna e neonatal. As drogas usadas para analgesia sistêmica são opióides, tranquilizantes e, ocasionalmente, cetamina.
Opióides Sistêmicos
No passado, a meperidina era o analgésico sistêmico mais comumente usado para melhorar a dor durante o primeiro estágio do trabalho de parto. Pode ser administrado por injeção intravenosa (analgesia efetiva em 5 a 10 minutos) ou por via intramuscular (efeito máximo em 40 a 50 minutos). Também foi comumente usado para dor pós-operatória na população em geral. Mas com a popularidade de sua administração, começaram a surgir efeitos colaterais perturbadores. Um dos efeitos colaterais mais graves foi a ocorrência de convulsões tanto pelo efeito primário da droga quanto pelo metabólito da droga, a normeperidina. Na paciente grávida com risco de convulsões – isto é, com hipertensão induzida pela gravidez ou pré-eclâmpsia – confundir o quadro pela administração de um medicamento conhecido por causar convulsões complica o atendimento ao paciente. Outros efeitos colaterais são náuseas e vômitos, depressão da ventilação relacionada à dose, hipotensão ortostática, potencial para depressão neonatal e euforia desproporcional ao efeito analgésico, levando ao uso indevido da droga. A meperidina também pode causar alterações transitórias da frequência cardíaca fetal, como diminuição da variabilidade batimento a batimento e taquicardia. Entre outros fatores, o risco de depressão neonatal está relacionado ao intervalo entre a última injeção do medicamento e o parto. A transferência placentária de um metabólito ativo, normeperidina, que tem uma longa meia-vida de eliminação no neonato (62 horas), também tem sido implicada em contribuir para a depressão neonatal e disfunção neurocomportamental neonatal sutil. Os efeitos da meperidina administrada sistemicamente no curso do trabalho de parto são controversos. Tem sido sugerido que a administração de meperidina pode prolongar a fase latente do trabalho de parto, mas encurtar a duração cumulativa do primeiro estágio do trabalho de parto. No entanto, um estudo recente não mostrou benefício com a administração de meperidina para possivelmente encurtar o primeiro estágio do trabalho de parto em mulheres com distocia.
A experiência com os opióides sintéticos mais recentes, como fentanil e alfentanil, tem sido limitada. Embora sejam potentes, sua utilidade durante o trabalho de parto é limitada por sua curta duração de ação. No entanto, essas drogas oferecem uma vantagem quando a analgesia de início rápido, mas de curta duração é necessária (por exemplo, com aplicação de fórceps). Por exemplo, uma única injeção intravenosa de fentanil, até 1 mcg/kg, resulta em alívio imediato da dor sem depressão neonatal grave, mas por um curto período de tempo. O alfentanil pode estar associado a maior depressão neonatal do que a analgesia controlada pelo paciente (PCA) equivalente com meperidina. Em outro estudo, alfentanil PCA não forneceu analgesia adequada em comparação com fentanil PCA. Para analgesia mais prolongada, o fentanil pode ser administrado com dispositivos de liberação controlados pelo paciente. Mais comumente, fentanil (15–25 mcg) e sufentanil (5–10 mcg) têm sido usados com anestésicos locais em uma dose raquidiana inicial com um anestésico local durante a colocação de uma peridural raquidiana contínua para trabalho de parto com excelente alívio da dor.
O remifentanil é um opióide que é rapidamente metabolizado pelas colinesterases séricas e teciduais e, consequentemente, tem um tempo de meia-vida curto (3 minutos), sensível ao contexto. Quando usado em dosagem em bolus (0.3–0.8 mcg/kg por bolus), o remifentanil demonstrou ter um nível aceitável de efeitos colaterais maternos e um efeito mínimo no neonato. O remifentanil atravessa a placenta e parece ser rapidamente metabolizado ou redistribuído no neonato. Em um estudo, os escores de Apgar e neurocomportamentais foram bons em neonatos cujas mães receberam uma infusão intravenosa de remifentanil, 0.1 mcg/kg/min, durante o parto cesariana sob anestesia peridural. Quando administrado por PCA, verificou-se que o remifentanil proporciona melhor alívio da dor, estabilidade hemodinâmica equivalente, menos sedação e menos dessaturação de oxigênio em comparação com a meperidina. Em um recente estudo duplo-cego, o remifentanil PCA foi comparado à peridural lombar para analgesia equivalente. Vinte e seis por cento das mulheres no grupo de remifentanil relataram escores de dor aceitáveis em comparação com 56% das mulheres que receberam analgesia epidural lombar. Em países fora dos Estados Unidos, o óxido nitroso intermitente tem sido usado para analgesia de parto. Ao comparar o remifentanil com o óxido nitroso, verificou-se que o remifentanil proporciona melhor alívio da dor com menos efeitos colaterais. No entanto, o remifentanil pode resultar em hipoventilação e hipoxemia, portanto, a saturação de oxigênio deve ser monitorada rotineiramente durante PCA com remifentanil IV.
Agonistas-antagonistas opióides, como butorfanol e nalbufina, também têm sido usados para analgesia obstétrica. Esses medicamentos têm os benefícios propostos de uma menor incidência de náuseas, vômitos e disforia, bem como um “efeito teto” na depressão da ventilação. A nalbufina intramuscular (IM) foi comparada à meperidina em um estudo duplo-cego. A analgesia foi comparável em ambos os grupos; no entanto, a nalbufina foi associada ao aumento da sedação materna em comparação com a meperidina. O butorfanol é provavelmente o mais popular dos agonistas-antagonistas mistos; ao contrário da meperidina, ela é metabolizada em metabólitos inativos e tem efeito teto na depressão da ventilação em doses superiores a 2 mg. Butorfanol resulta em alívio da dor materna comparável à meperidina e nenhuma diferença nos escores de Apgar. No entanto, o uso de butorfanol foi associado a menos efeitos colaterais maternos, como náusea, vômito e tontura, do que a meperidina. Uma desvantagem potencial é a alta incidência de sedação materna. A dose recomendada é de 1 a 2 mg por injeção IV ou IM. A nalbufina 10 mg IV ou IM é uma alternativa ao butorfanol. A naloxona, um antagonista opióide puro, não deve ser administrada à mãe pouco antes do parto para prevenir a depressão ventilatória neonatal, pois reverte a analgesia materna no momento em que é mais necessária. Em alguns casos, foi relatado que a naloxona causa edema pulmonar materno e até parada cardíaca. Se necessário, o medicamento deve ser administrado diretamente ao recém-nascido IM (0.1 mg/kg).
Ketamina
A cetamina é um analgésico potente. No entanto, também pode induzir uma amnésia inaceitável que pode interferir na lembrança do parto pela mãe. No entanto, a cetamina é um adjuvante útil para analgesia regional incompleta durante o parto vaginal ou para manipulações obstétricas. Em doses baixas (0.2-0.4 mg/kg), a cetamina fornece analgesia adequada sem causar depressão neonatal.
Técnicas Regionais de Analgesia
As técnicas regionais proporcionam excelente analgesia com efeitos depressores mínimos na mãe e no feto. As técnicas mais comumente usadas para anestesia do parto incluem bloqueios neuroaxiais centrais (raquidiano, peridural e combinado raquiperidural), paracervicais e pudendos e, menos frequentemente, bloqueios simpáticos lombares. A hipotensão resultante da simpatectomia é a complicação mais comum que ocorre com o bloqueio neuroaxial central. Portanto, a pressão arterial materna deve ser monitorada em intervalos regulares, normalmente a cada 2 a 5 minutos por aproximadamente 15 a 20 minutos após o início do bloqueio e em intervalos de rotina a partir de então. A analgesia regional pode ser contraindicada na presença de coagulopatia grave, hipovolemia aguda ou infecção no local de inserção da agulha. A corioamnionite sem sepse não é uma contraindicação ao bloqueio neuroaxial central.
Analgesia epidural
A analgesia eficaz para o primeiro estágio do trabalho de parto é alcançada bloqueando os dermátomos T10-Ll com uma baixa concentração de anestésico local, muitas vezes em combinação com um opióide lipossolúvel. Para o segundo estágio do trabalho de parto, devido à dor devido à distensão vaginal e pressão perineal, o bloqueio deve ser estendido para incluir os segmentos pudendos, S2-4 (Figuras 3 e 4). Existe a preocupação de que o início precoce da analgesia epidural durante a fase latente do trabalho de parto (dilatação cervical de 2 a 4 cm) possa resultar em prolongamento do primeiro estágio do trabalho de parto e maior incidência de distocia e parto cesáreo, particularmente em mulheres nulíparas. De modo geral, a primeira fase do trabalho de parto não é prolongada pela analgesia peridural, desde que se evite a compressão aortocava. Castanha et ai. demonstraram que a incidência de parto cesáreo não foi diferente em mulheres nulíparas com analgesia epidural iniciada durante a fase latente (a 4 cm de dilatação) em comparação com mulheres cuja analgesia foi iniciada durante a fase ativa. Outros demonstraram que a analgesia peridural não está associada a um aumento da incidência de parto cesáreo em comparação com PCA IV em mulheres nulíparas.
No entanto, um prolongamento do segundo estágio do trabalho de parto foi relatado em mulheres nulíparas, possivelmente devido à diminuição das forças expulsivas ou ao mau posicionamento do feto.
Assim, com o uso de analgesia epidural, o American College of Obstetricians and Gynecologists (ACOG) definiu um segundo estágio do trabalho de parto anormalmente prolongado como mais de 3 horas em mulheres nulíparas e mais de 2 horas em mulheres multíparas.
Um segundo estágio mais longo do trabalho de parto pode ser minimizado pelo uso de uma solução anestésica local ultradiluída em combinação com um opióide. As amidas de ação prolongada, como bupivacaína, ropivacaína e levobupivacaína, são mais frequentemente usadas porque produzem excelente analgesia sensorial, preservando a função motora, particularmente nas baixas concentrações usadas para analgesia epidural.
Dicas NYSORA
- A analgesia durante o primeiro estágio do trabalho de parto é obtida bloqueando os dermátomos T10-Ll com uma baixa concentração de anestésico local (ver Figura 3).
- A analgesia para o segundo estágio do trabalho de parto e parto requer o bloqueio dos segmentos S2-4 por causa da dor devido à distensão vaginal e pressão perineal.
A analgesia para o primeiro estágio do trabalho de parto pode ser obtida com 5–10 mL de bupivacaína, ropivacaína ou levobupivacaína (0.125%–0.25%), seguido de uma infusão contínua (8–12 mL/h) de bupivacaína a 0.0625% ou levobupivacaína, ou ropivacaína a 0.1%. Fentanil 1–2 mcg/mL ou sufentanil 0.3–0.5 mcg/mL podem ser adicionados. Durante o parto real, o períneo pode ser bloqueado com 10 mL de bupivacaína a 0.5%, lidocaína a 1% ou, se for necessário efeito rápido, cloroprcaína a 2% em posição semi-reclinada. usando uma solução diluída de anestésico local.
A aspiração por cateter sozinha nem sempre é diagnóstica. Por esse motivo, alguns autores acreditam que uma dose teste deva ser administrada para melhorar a detecção de um cateter peridural colocado por via intratecal ou intravascular. Se injetado em um vaso sanguíneo, 15 mcg de epinefrina resulta em uma alteração na frequência cardíaca de 20 a 30 bpm com um leve aumento da pressão arterial em 30 segundos após a administração. A duração é de aproximadamente 30 segundos. O anestesiologista deve observar o oxímetro de pulso durante o primeiro minuto após a injeção para determinar se ocorreu uma injeção intravascular acidental. No entanto, a taquicardia associada a uma dose de teste intravenosa de epinefrina não é um indicador confiável de injeção intravascular durante o trabalho de parto porque pode ser confundida com uma contração uterina dolorosa. Além disso, a epinefrina não é confiável em pacientes que receberam um antagonista do receptor beta-adrenérgico. Outros sinais sutis de injeção intravascular podem incluir uma sensação de apreensão ou desconforto ou palpitações. É importante fracionar a dose total de anestésico local e observar o paciente em intervalos de um minuto.
A analgesia peridural controlada pelo paciente (PCEA) é uma alternativa segura e eficaz às técnicas convencionais de bolus ou infusão. A aceitação materna é excelente e as demandas de mão de obra de anestesia podem ser reduzidas. Estudos mostraram que PCEA com uma infusão peridural contínua relativamente baixa e recargas requereram menos intervenções anestésicas em comparação com PCEA sem uma infusão epidural de taxa basal. A analgesia inicial é alcançada com doses em bolus de anestésico local. Quando a mãe estiver confortável, a PCEA pode ser iniciada com uma infusão de manutenção (8–12 mL/h) de anestésico local (bupivacaína, levobupivacaína ou ropivacaína 0.0625%–0.125%) com ou sem opioide (fentanil 1–2 mcg /mL ou sufent-anil 0.3–0.5 mcg/mL). A máquina pode ser programada para administrar um bolus de demanda epidural de 8 mL com um período de bloqueio de 10 minutos entre as doses.
A abordagem caudal, em vez da lombar, pode resultar em um início mais rápido da analgesia perineal e, portanto, pode ser preferível à abordagem epidural lombar quando um parto vaginal iminente é previsto. No entanto, a analgesia caudal não é mais popular devido à colocação ocasionalmente dolorosa da agulha, alta taxa de falha, contaminação potencial no local da injeção e riscos de injeção fetal acidental. Antes da injeção caudal, um exame de toque retal deve ser realizado para excluir a colocação da agulha na apresentação fetal. O “bloqueio em sela” da coluna baixa praticamente eliminou a necessidade de anestesia caudal na prática moderna.
Analgesia espinhal
Uma única injeção intratecal, geralmente de um opióide e uma pequena dose de anestésico local, para analgesia de parto tem os benefícios de um início confiável e rápido da analgesia no primeiro estágio do trabalho de parto. No entanto, injeções intratecais repetidas podem ser necessárias para um trabalho de parto prolongado, aumentando assim o risco de cefaleia pós-punção da dura-máter. Além disso, o bloqueio motor pode ser desconfortável para algumas mulheres e pode prolongar o segundo estágio do trabalho de parto. Esta técnica é mais útil para parturientes multíparas que estão progredindo rapidamente no trabalho de parto e requerem analgesia ou anestesia de curta duração antes da dilatação cervical completa e parto vaginal antecipado ou em situações em que a analgesia peridural contínua não é possível.
Os microcateteres foram introduzidos para raquianestesia contínua na década de 1980. Eles foram posteriormente retirados quando encontrados associados a déficits neurológicos, possivelmente relacionados à má distribuição do anestésico local na região da cauda equina. Felizmente, em um estudo multi-institucional recente, nenhum caso de sintomas neurológicos ocorreu após o uso de microcateteres de calibre 28 para analgesia espinhal contínua em mulheres em trabalho de parto. A raquianestesia também é uma alternativa segura e eficaz à anestesia geral para parto instrumental.
Analgesia combinada raqui-peridural
A analgesia combinada raqui-peridural (CSE) é uma técnica analgésica ideal para uso durante o trabalho de parto. Combina o início rápido e confiável da analgesia profunda resultante da injeção espinhal com a flexibilidade e a duração mais longa das técnicas epidurais. Em uma meta-análise recente, o início da analgesia para CSE foi significativamente mais rápido do que com uma técnica epidural (2-5 minutos vs. 10-15 minutos).
Técnica
Depois de identificar o espaço peridural usando uma agulha peridural convencional (ou especializada), uma agulha espinhal mais longa (127 mm), ponta de lápis, é avançada no espaço subaracnóideo através da agulha peridural. Após a injeção intratecal, a agulha espinhal é removida e um cateter epidural é inserido. A injeção intratecal de fentanil 10–25 mcg ou sufentanil 2.5–5 mcg, isoladamente ou em combinação com até 1 mL de bupivacaína isobárica 0.25%, produz analgesia profunda com duração de 60–120 minutos com bloqueio motor mínimo.
Deve-se notar que a incidência de prurido é maior com a administração intratecal de opióides do que com a administração epidural de opióides. Um opióide isolado pode proporcionar alívio suficiente para a fase latente precoce, mas a adição de bupivacaína é quase sempre necessária para uma analgesia satisfatória durante o trabalho de parto avançado. Outros adjuvantes também têm sido usados. A adição de adjuvantes, como clonidina e neostigmina, tem sido decepcionante. Uma infusão epidural de bupivacaína 0.03%–0.0625% com um opioide pode ser iniciada dentro de 10 minutos após a injeção espinhal. Alternativamente, o componente epidural pode ser ativado quando necessário. Mulheres com estabilidade hemodinâmica e função motora preservada que não necessitam de monitoramento fetal contínuo podem deambular com assistência. Antes da deambulação, as mulheres devem ser observadas por 30 minutos após a administração do medicamento intratecal ou epidural para avaliar o bem-estar materno e fetal. Um estudo recente indicou que a administração precoce de analgesia CSE em mulheres nulíparas não aumentou a taxa de parto por cesariana.
Dicas NYSORA
A injeção intratecal de fentanil 10–25 mcg ou sufent-anil 5–10 mcg isoladamente ou, mais comumente, com 1 mL de bupivacaína isobárica 0.25% produz analgesia profunda com duração de 90–120 minutos com bloqueio motor mínimo.
Os efeitos colaterais mais comuns dos opioides intratecais são prurido, náusea, vômito e retenção urinária. A disseminação rostral resultando em depressão respiratória tardia é rara com fentanil e sufentanil e geralmente ocorre dentro de 30 minutos após a injeção. Padrões transitórios não tranquilizadores da frequência cardíaca fetal podem ocorrer devido à hiperestimulação uterina, presumivelmente como resultado de uma rápida diminuição das catecolaminas maternas, resultando nos efeitos sem oposição da ocitocina.
Um estudo preliminar de O'Gorman et al. sugere que a bradicardia fetal pode ocorrer na ausência de hiperestimulação ou hipotensão uterina e não está relacionada à insuficiência útero-placentária. A incidência de anormalidades da frequência cardíaca fetal pode ser maior em mulheres multíparas com um trabalho de parto doloroso e de rápida progressão. A maioria dos estudos demonstrou que a incidência de cesariana de emergência não é maior com analgesia CSE do que após analgesia epidural convencional. A cefaleia pós-punção dural é sempre um risco após a injeção intratecal. No entanto, a incidência de cefaleia não é maior com a analgesia CSE em comparação com a analgesia epidural padrão.
A colocação não intencional de cateter intratecal através do local da punção dural também é rara após o uso de uma agulha espinhal de calibre 27 para analgesia CSE. Existe a possibilidade de o fármaco administrado por via peridural vazar intratecalmente através da punção dural, particularmente se grandes volumes de fármaco forem injetados rapidamente. De fato, as necessidades de drogas epidural são aproximadamente 30% menores com a analgesia CSE do que com as técnicas epidural lombar padrão para parto por cesariana. Alguns médicos não defendem a técnica de analgesia CSE para o trabalho de parto devido à preocupação com um cateter peridural “não comprovado” que pode precisar ser usado de emergência para cesariana. O paciente pode ter um bloqueio parcial insuficiente para cirurgia com uma epidural que pode ou não funcionar. Um algoritmo para o manejo do paciente no caso de uma epidural incompleta é apresentado em Figura 5.
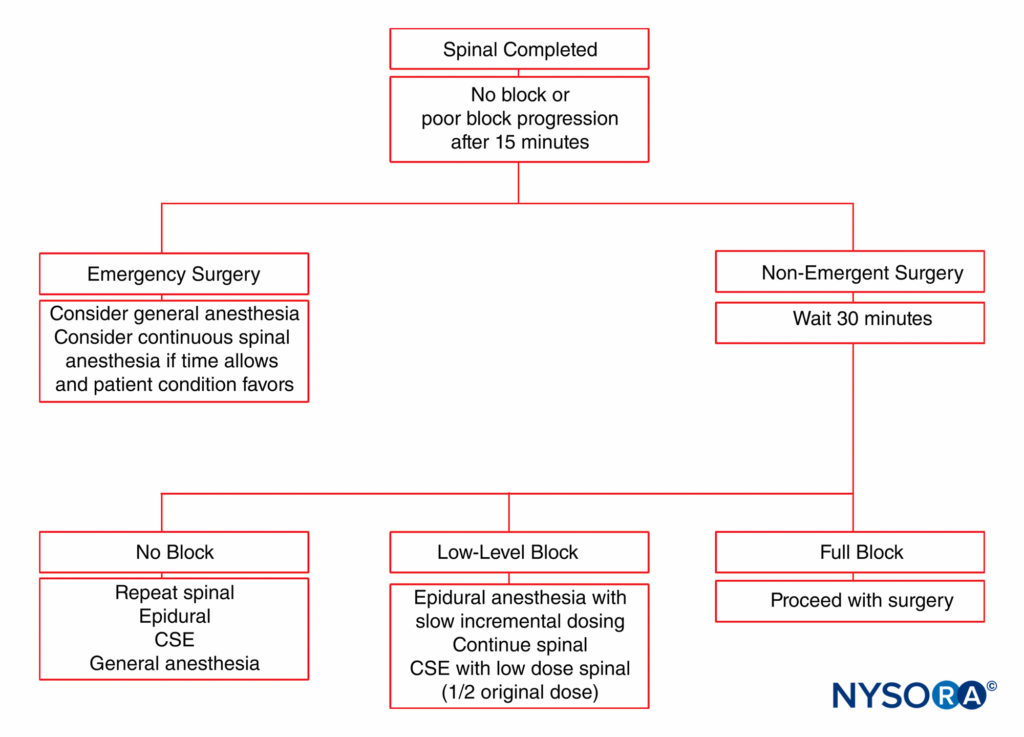
FIGURA 5. Algoritmo de manejo para uma paciente obstétrica com anestesia neuroaxial inadequada. CSE, combinado raqui-peridural.
Bloqueio Paracervical
Ainda em 2001, apenas 2% a 3% das parturientes nos Estados Unidos receberam bloqueio paracervical durante o trabalho de parto. Embora o bloqueio paracervical alivie efetivamente a dor durante o primeiro estágio do trabalho de parto, atualmente é pouco utilizado nos Estados Unidos devido à sua associação com alta incidência de bradicardia fetal, particularmente com o uso de bupivacaína. Isso pode estar relacionado à constrição da artéria uterina ou aumento do tônus uterino.
O uso de levobupivacaína em comparação com bupivacaína racêmica demonstrou resultar em menos bradicardia fetal. O bloqueio paracervical é uma técnica útil para fornecer analgesia para curetagem uterina. A técnica é muito simples e envolve uma injeção submucosa de anestésico local no fórnice vaginal próximo às fibras neurais que inervam o útero.Figura 6).
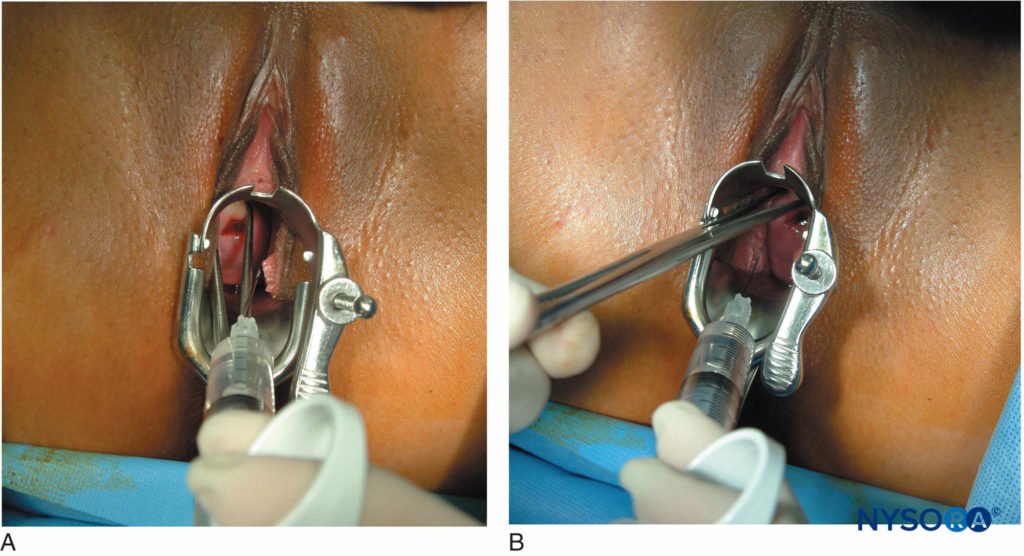
FIGURA 6. (A) e (B): Bloqueio paracervical para curetagem uterina. A técnica envolve uma injeção submucosa de anestésico local no fórnice vaginal, próximo às fibras neurais que inervam o útero.
Bloqueio Simpático Lombar Paravertebral
O bloqueio simpático lombar paravertebral é uma alternativa razoável ao bloqueio neuroaxial central. O bloqueio simpático lombar interrompe efetivamente a transmissão dolorosa dos impulsos cervicais e uterinos durante o primeiro estágio do trabalho de parto. Leighton et ai. mostraram que as mulheres que receberam bloqueios simpáticos lombares tiveram uma taxa mais rápida de dilatação cervical durante as primeiras duas horas de analgesia e um segundo estágio de trabalho de parto mais curto em comparação com a analgesia epidural. No entanto, não houve diferença na taxa de dilatação durante a fase ativa do trabalho de parto. Embora haja menor risco de bradicardia fetal com bloqueio simpático lombar em comparação com bloqueio paracervical, dificuldades técnicas associadas à realização do bloqueio e riscos de injeção intravascular têm dificultado seu uso rotineiro. Hipotensão também pode ocorrer com bloqueios simpáticos lombares.
Bloqueio do nervo pudendo
Os nervos pudendos são derivados das raízes nervosas sacrais inferiores (S2-4) e suprem a abóbada vaginal, períneo, reto e seções da bexiga. Os nervos são facilmente bloqueados por via transvaginal, onde dão voltas em torno das espinhas isquiáticas.
Um estudo recente demonstrou que um bloqueio do nervo pudendo não fornece analgesia confiável para o segundo estágio do trabalho de parto, provavelmente relacionado à inervação da parte superior da vagina por fibras lombares, em vez de sacrais. No entanto, o bloqueio é útil para episiotomia e reparo. Também pode haver benefícios pós-parto do bloqueio do nervo pudendo. Por exemplo, um bloqueio unilateral do nervo pudendo guiado por estimulador de nervo com ropivacaína foi associado à diminuição da dor e menor necessidade de analgesia suplementar durante as primeiras 48 horas após a realização da episiotomia mediolateral no parto vaginal.
ANESTESIA PARA PARTO DE CESÁREA
As indicações mais comuns para cesariana incluem falha de progressão, estado fetal não tranquilizador, desproporção cefalopélvica, má apresentação, prematuridade e cirurgia uterina prévia envolvendo o corpo. A escolha da anestesia deve depender da urgência do procedimento, além da condição da mãe e do feto. Após uma discussão abrangente dos riscos e benefícios de todas as opções de anestesia, os desejos da mãe devem ser considerados. Antes do início de qualquer técnica anestésica, o equipamento de reanimação da mãe e do recém-nascido deve ser disponibilizado (tabela 2).
TABELA 2. Equipamento de ressuscitação na sala de parto.
| Aquecedor radiante |
| Sucção com manômetro e armadilha de sucção |
| Cateteres de sucção |
| Oxigênio de parede com medidor de vazão |
| Dispositivo de ventilação de pressão positiva bolsa-máscara de ressuscitação (≤ 750 mL) |
| Máscaras infantis |
| Via aérea orofaríngea infantil |
| Tubos endotraqueais: 2.5, 3.0, 3.5 e 4.0 mm |
| Estiletes de tubo endotraqueal |
| Laringoscópio(s) e lâmina(s) |
| Bandeja de cateterismo de artéria umbilical estéril |
| Agulhas, seringas, torneiras de três vias |
| Medicamentos e soluções: • 1:10,000 epinefrina • Cloridrato de naloxona • Bicarbonato de Sódio • Expansores de volume |
Vantagens da Anestesia Regional na Paciente Obstétrica
A cesariana é responsável por mais de 30% de todos os nascimentos e é o procedimento cirúrgico mais comum realizado nos Estados Unidos, com mais de 1 milhão realizados a cada ano. Uma pesquisa de 1992 sobre as práticas de anestesia obstétrica nos Estados Unidos demonstrou que a maioria das pacientes submetidas à cesariana o faz sob raquianestesia ou peridural.
As técnicas regionais têm várias vantagens: reduzem o risco de aspiração gástrica, evitam o uso de drogas anestésicas depressoras e permitem que a mãe permaneça acordada durante o parto. A perda de sangue operatória também pode ser reduzida com anestesia regional em comparação com anestesia geral. De modo geral, com as técnicas regionais, a duração da anestesia pré-parto não afeta o resultado neonatal, desde que não haja compressão aortocava prolongada ou hipotensão. O risco de hipotensão pode ser maior do que durante o parto vaginal porque o bloqueio sensorial deve se estender pelo menos até o dermátomo T4. Estudos mostraram que a pré-carga com cristaloides não previne de forma confiável a hipotensão induzida pela anestesia neuraxial. De fato, estudos recentes indicam que a co-carga intravenosa no momento da injeção intratecal é tão eficaz quanto a pré-hidratação antes do neurobloqueio. Se ocorrer hipotensão apesar dessas medidas, o deslocamento uterino para a esquerda deve ser aumentado, a taxa de infusão IV aumentada e efedrina IV 5-15 mg (ou fenilefrina 25-50 mcg) administrada de forma incremental. O maior sucesso na prevenção da hipotensão foi encontrado com uma infusão contínua de baixa dose de fenilefrina até o parto.
Anestesia Espinhal
O bloqueio subaracnóideo é provavelmente o anestésico regional mais comumente administrado para cesariana devido à sua velocidade de início e confiabilidade. Tornou-se também uma alternativa à anestesia geral para cesariana de emergência.
Soluções hiperbáricas de lidocaína 5%, tetracaína 1.0% ou bupivacaína 0.75% têm sido utilizadas. No entanto, a bupivacaína tornou-se o fármaco mais utilizado para raquianestesia para cesariana. Utilizando bupivacaína hiperbárica a 0.75%, Norris demonstrou que não é necessário ajustar a dose da droga com base na altura do paciente. Além disso, a idade, o peso e o comprimento da coluna vertebral do paciente não afetam o bloqueio neuroaxial resultante. Estudos recentes usando ropivacaína espinhal mostraram menos hipotensão e recuperação mais rápida, mas um início mais lento em comparação com a bupivacaína. No entanto, questiona-se se a ropivacaína produz raquianestesia de qualidade semelhante à da bupivacaína. A monitorização hemodinâmica durante a cesariana deve ser semelhante à utilizada para outros procedimentos cirúrgicos, exceto que a pressão arterial deve ser monitorada no mínimo a cada 3 minutos antes do nascimento do bebê. Antes do parto, o oxigênio deve ser administrado rotineiramente para otimizar a oxigenação fetal. Relatos de síndrome neurológica transitória e/ou síndrome da cauda equina foram associados à lidocaína em doses superiores a 60 mg, seja em uma preparação de 5% ou 2%. Isso levou alguns médicos a evitar o uso de lidocaína para administração intratecal (consulte “Toxicidade sistêmica de anestésicos locais” abaixo). tabela 3 lista os anestésicos locais e as dosagens comumente usadas para cesariana com bloqueio subaracnóideo.
TABELA 3. Anestésicos locais comumente usados para cesariana com bloqueio subaracnóideo.
| Dosagem por Altura do Paciente (cm) | Bupivacaína 0.75% em 8.25% Dextrose (mg) | Bupivacaína 0.5% (isobárica) (mg) |
|---|---|---|
| 150-160 cm | 8 | 8 |
| 160-180 | 10 | 10-12.5 |
| > 180 cm | 12 | 12.5-15 |
| Início de ação | 2 – 4 min | 5 – 10 min |
Apesar de um nível dermatomal adequado, as mulheres podem apresentar graus variados de desconforto visceral, principalmente durante a exteriorização do útero e tração das vísceras abdominais. A melhora da analgesia perioperatória pode ser obtida pela adição de fentanil 20 mcg ou morfina sem conservantes 0.1 mg à solução anestésica local. A morfina sem conservantes produz analgesia significativa em doses que variam de 0.1 a 0.25 mg. Doses mais altas de morfina espinhal resultam em maior prurido. A depressão respiratória tardia pode ocorrer com a morfina espinhal, mas é extremamente rara e mais frequentemente associada a comorbidades, como a obesidade. A depressão respiratória é devida à disseminação rostral da morfina subaracnóidea. Em um estudo retrospectivo de 1915 parturientes que receberam 0.15 mg de morfina espinhal para cesariana, cinco pacientes (0.26%) apresentaram bradipneia e uma paciente necessitou de naloxona. Além disso, a clonidina espinhal, em doses de 60 a 150 mcg, melhora a analgesia intraoperatória e diminui o tremor em mulheres submetidas a cesariana. No entanto, hipotensão e sedação foram relatadas com clonidina espinhal e podem limitar seu uso rotineiro. Náuseas e vômitos podem ser aliviados pela administração de ondansetrona ou metoclopramida. A sedação materna deve ser evitada, se possível. Se o bloqueio inicial não for adequado, existe a preocupação com a repetição da injeção espinhal e a possibilidade de anestesia espinhal alta inadvertida. Ver Figura 5 para uma gama de opções disponíveis em situações em que a raquianestesia não se mostra adequada para a cirurgia.
Dicas NYSORA
- Mesmo com nível dermatomal adequado para cirurgia, mulheres submetidas à cesariana podem sentir desconforto, principalmente durante a exteriorização do útero e tração das vísceras abdominais.
- A analgesia perioperatória pode ser potencializada pela adição de fentanil 20 mcg ou morfina sem conservantes 0.1 mg à solução anestésica local.
Anestesia Epidural Lombar
A anestesia peridural tem um início de ação mais lento e uma maior necessidade de drogas para estabelecer um bloqueio sensorial adequado em comparação com a raquianestesia. As vantagens são um risco reduzido percebido de cefaleia pós-punção dural e a capacidade de titular o anestésico local através do cateter peridural. No entanto, a colocação correta do cateter epidural e evitar a injeção intratecal ou intravascular inadvertida são essenciais.
A aspiração do cateter peridural para sangue ou líquido cefalorraquidiano não é 100% confiável para detectar o posicionamento incorreto do cateter. Por esta razão, uma “dose de teste” é frequentemente usada para descartar a colocação inadvertida de cateter intravascular ou intratecal. Uma pequena dose de anestésico local, lidocaína 45 mg ou bupivacaína 5 mg, produz um bloqueio sensorial e motor prontamente identificável se injetado por via intratecal. No entanto, um estudo recente sugeriu que 15 mg de ropivacaína não foi uma dose de teste intratecal útil porque um início lento do bloqueio motor pode impedir o diagnóstico oportuno de injeção intratecal. A adição de 15 mcg de epinefrina com monitoramento cuidadoso contínuo da frequência cardíaca e da pressão arterial pode anunciar a injeção intravascular com um aumento transitório da frequência cardíaca e da pressão arterial. No entanto, uma dose de teste de epinefrina não é confiável porque os resultados falso-positivos ocorrem na forma de taquicardia relacionada a contrações uterinas dolorosas. Além disso, a epinefrina pode potencialmente reduzir a perfusão uteroplacentária em alguns pacientes. A eletrocardiografia e a aplicação de um critério de frequência cardíaca pico a pico podem melhorar a detecção (10 batimentos acima da frequência cardíaca máxima antes da injeção de epinefrina). A injeção rápida de 1 mL de ar com monitoramento simultâneo do Doppler precordial parece ser um indicador confiável da colocação do cateter intravascular. Mais importante, um teste negativo, embora tranquilizador, não elimina a necessidade da administração fracionada de anestésico local.
Dicas NYSORA
- A aspiração do cateter peridural para sangue ou líquido cefalorraquidiano não é absolutamente confiável para detectar o posicionamento incorreto do cateter.
- Uma “dose de teste” é frequentemente usada para descartar a colocação inadvertida de cateter intravascular ou intratecal.
- Uma pequena dose de anestésico local, lidocaína 45 mg ou bupivacaína 5 mg, produz um bloqueio sensorial e motor facilmente identificável se injetado por via intratecal.
- A adição de 15 mcg de epinefrina com monitoramento hemodinâmico cuidadoso pode sinalizar injeção intravascular quando seguida por um aumento transitório da frequência cardíaca e da pressão arterial.
- No entanto, o uso de uma dose-teste de epinefrina é controverso porque os resultados falso-positivos ocorrem na presença de contrações uterinas.
Escolhas Anestésicas Locais
Os agentes anestésicos locais mais usados são 2-cloro-procaína 3%, bupivacaína 0.5% e lidocaína 2% com epinefrina 1:200,000. A anestesia adequada geralmente pode ser alcançada com 15 a 25 mL de anestésico local administrado em doses divididas. O paciente deve ser monitorado como na raquianestesia. Devido à sua taxa de metabolismo extremamente alta no plasma materno e fetal, a 2-cloroprocaína fornece um bloqueio confiável e de início rápido com risco mínimo de toxicidade sistêmica. É o anestésico local de escolha na presença de acidose fetal e quando um bloqueio peridural preexistente deve ser rapidamente estendido para uma cesariana de urgência. Déficits neurológicos após a administração intratecal inadvertida maciça da droga ocorreram com a formulação contendo uma concentração relativamente alta de bissulfito de sódio em um pH baixo.
Em uma nova formulação de 2-cloroprocaína (Nesacaína-MPF), o ácido etilenodiaminotetracético (EDTA) foi substituído por bissulfito de sódio. No entanto, dor nas costas espasmódica grave foi descrita após injeção epidural de grandes volumes de Nesacaína-MPF em pacientes cirúrgicos, mas não em parturientes. Isso foi atribuído a uma lixiviação de cálcio induzida por EDTA dos músculos paravertebrais. A formulação mais recente de 2-cloroprocaína não contém aditivos e é embalada em um frasco âmbar para evitar a oxidação.
A bupivacaína 0.5% fornece anestesia profunda de início mais lento para parto cesáreo, mas de ação mais longa. Considerável atenção foi dada à droga porque foi relatado que a injeção intravascular não intencional poderia resultar não apenas em convulsões, mas também em parada cardíaca quase simultânea, com pacientes muitas vezes refratários à ressuscitação. A maior cardiotoxicidade da bupivacaína (e etidocaína) em comparação com outros anestésicos locais amida foi bem estabelecida. Ao usar anestésicos locais amida potentes de ação prolongada, o fracionamento da dose de indução é fundamental. A lidocaína tem início e duração intermediários aos da 2-cloroprocaína e da bupivacaína. A necessidade de incluir epinefrina na solução anestésica local para garantir anestesia lombossacral adequada limita o uso de lidocaína em mulheres com hipertensão materna e insuficiência uteroplacentária.
O alívio prolongado da dor pós-operatória pode ser proporcionado pela administração peridural de um opióide, como morfina 4 mg, ou uso de PCEA. Pode ocorrer depressão respiratória tardia com o uso de morfina; portanto, o paciente deve ser cuidadosamente monitorado no pós-operatório. Recentemente, uma preparação de morfina encapsulada em lipídios (DepoDur) foi aprovada para analgesia pós-cesariana. Pode ser usado apenas por via epidural, pode durar até 48 horas, e o paciente deve ser monitorado quanto à depressão respiratória tardia. Uma limitação potencial em obstetrícia é que, uma vez administrado o fármaco, o anestésico local adicional não pode ser injetado por via peridural por um período de até uma hora, pois o anestésico local pode causar uma liberação descontrolada de morfina do lipídio. Carvalho et ai. avaliaram a administração peridural de 5, 10 e 15 mg de morfina de liberação prolongada para analgesia pós-cesariana e demonstraram que as doses de 10 mg e 15 mg proporcionaram boa analgesia por até 48 horas após a cirurgia. Não foram observados efeitos colaterais significativos. Outro estudo mostrou escores de dor mais baixos e menos necessidade de analgesia suplementar para pacientes que receberam morfina de liberação prolongada em comparação com a morfina sem conservantes. Não foram observadas diferenças nos escores de náusea, prurido ou sedação. Além disso, a administração em bolus de fentanil epidural (50-100 mcg) resultou em atividade nos locais de ação espinhal e supraespinal e na melhoria da qualidade da anestesia.
COMPLICAÇÕES ANESTÉSICAS
Mortalidade Materna
Um estudo de óbitos relacionados à anestesia nos Estados Unidos entre 1979 e 1990 mostrou que a taxa de letalidade com anestesia geral foi 16.7 vezes maior do que com anestesia regional. A maioria das mortes relacionadas à anestesia foi resultado de parada cardíaca devido à hipoxemia quando foram encontradas dificuldades para proteger as vias aéreas. Alterações anatômicas e fisiológicas induzidas pela gravidez, como redução da CRF, aumento do consumo de oxigênio e edema de orofaringe, podem expor a paciente a sérios riscos de dessaturação durante os períodos de apnéia e hipoventilação.
Aspiração Pulmonar
O risco de inalação do conteúdo gástrico é aumentado em mulheres grávidas, particularmente se houver dificuldade em estabelecer uma via aérea ou se os reflexos das vias aéreas estiverem obnubilados. As medidas para diminuir os riscos de aspiração incluem avaliação abrangente das vias aéreas, administração profilática de antiácidos não particulados e o uso preferencial de anestesia regional. Se ocorrer aspiração, o manejo inclui tratamento imediato da hipoxemia com pressão positiva contínua nas vias aéreas (CPAP) e possível broncoscopia rígida. Estudos recentes não suportam a administração de corticosteróides ou lavagem pulmonar com solução salina e bicarbonato para neutralizar a acidez. Antibióticos profiláticos não são recomendados porque o conteúdo gástrico é estéril.
Hipotensão
A anestesia regional pode estar associada à hipotensão, que está relacionada ao grau e à rapidez da simpatólise induzida pelo anestésico local. Assim, maior estabilidade hemodinâmica pode ser observada com a anestesia peridural, onde a titulação gradual do anestésico local permite melhor controle do nível de bloqueio, bem como tempo adequado para administração de vasopressores em antecipação à redução da pressão arterial.
O risco de hipotensão é menor em mulheres em trabalho de parto em comparação com mulheres que não estão em trabalho de parto. A pré-hidratação materna com 15 mL/kg de solução de Ringer com lactato antes do início da anestesia regional e evitar a compressão aortocava pode diminuir a incidência de hipotensão. Foi demonstrado que, para uma prevenção eficaz da hipotensão, o aumento do volume sanguíneo da pré-carga deve ser suficiente para resultar em um aumento significativo do débito cardíaco. Isso só foi possível com a administração de hetastarch 0.5–1 L. No entanto, existe controvérsia quanto à eficácia da carga de volume na prevenção da hipotensão. Um estudo recente usando uma infusão profilática de fenilefrina combinada com uma co-carga cristalóide rápida administrada no momento da injeção intratecal reduziu acentuadamente a incidência de hipotensão induzida pela raquianestesia. Se ocorrer hipotensão apesar da pré-hidratação, as medidas terapêuticas devem incluir aumento do deslocamento do útero, infusão rápida de fluidos IV, titulação de efedrina IV (5-10 mg) e administração de oxigênio. Na presença de taquicardia materna, a fenilefrina 25-50 mcg pode substituir a efedrina em mulheres com função uteroplacentária normal. A vigilância contínua e o manejo ativo da hipotensão podem prevenir sequelas graves tanto na mãe quanto no recém-nascido.
Anestesia espinhal alta
A raquianestesia alta ou total é uma complicação rara da injeção intratecal na prática moderna. Ocorre com uma disseminação cefálica excessiva do anestésico local no espaço subaracnóideo. A administração intratecal não intencional de medicação epidural como resultado de punção dural ou migração do cateter também pode resultar nessa complicação. Deslocamento uterino para a esquerda e administração contínua de fluidos e vasopressores podem ser necessários para alcançar a estabilidade hemodinâmica. A posição de Trendelenburg reversa não impede a disseminação cefálica e pode causar colapso cardiovascular devido ao acúmulo venoso relacionado à simpatectomia. O controle rápido das vias aéreas é essencial e a intubação endotraqueal pode ser necessária para garantir a oxigenação sem aspiração.
Dicas NYSORA
- As pacientes obstétricas frequentemente se queixam de dificuldade respiratória durante o parto cesáreo sob anestesia neuroaxial.
- Embora as razões mais comuns sejam a incapacidade de sentir a “respiração” à medida que os segmentos abdominal e torácico são anestesiados (incluindo os receptores de estiramento), os médicos devem descartar uma anestesia iminente da “espinha alta” por meio de exames repetitivos.
- As seguintes manobras são úteis para descartar a possibilidade de anestesia neuraxial alta:
– A capacidade do paciente de fonar
– A capacidade do paciente de apertar a mão do praticante (indica que o nível do bloqueio está abaixo do nível do plexo braquial (C6-T1)
Toxicidade Sistêmica de Anestésicos Locais
A injeção intravascular não intencional ou o acúmulo de droga após repetidas injeções epidural podem resultar em altos níveis séricos de anestésico local. A rápida absorção do anestésico local de locais de injeção altamente vascularizados também pode ocorrer após bloqueios paracervicais e pudendos. O equipamento de ressuscitação deve estar sempre disponível quando qualquer bloqueio nervoso importante for realizado. Acesso IV, equipamento de vias aéreas, medicamentos de emergência e equipamento de sucção devem estar imediatamente acessíveis. Para evitar a toxicidade sistêmica dos agentes anestésicos locais, é essencial a adesão estrita às dosagens recomendadas e evitar a injeção intravascular não intencional.
Apesar dessas precauções, podem ocorrer convulsões com risco de vida e, mais raramente, colapso cardiovascular. A atividade convulsiva foi tratada com tiopental 25-50 mg IV ou diazepam 5-10 mg. Na prática clínica atual, propofol 20–50 mg ou midazolam 2–4 mg é mais comumente usado. A via aérea deve ser avaliada e a oxigenação mantida. Se ocorrer colapso cardiovascular, o algoritmo Advanced Cardiac Life Support (ACLS) deve ser seguido. Em um relato de caso de 2006, a emulsão lipídica foi usada para tratar a parada cardíaca refratária resultante da toxicidade da bupivacaína. O mecanismo de ação não é claro, mas pode resultar da maior afinidade da bupivacaína pelo lipídio ou porque o lipídio fornece um substrato para um sistema de energia mitocondrial envenenado por bupivacaína. Mais estudos são necessários para determinar a eficácia deste tratamento. No entanto, parece prudente que o tratamento de uma gestante intoxicada com bupivacaína inclua a administração de emulsão lipídica no início da ressuscitação. O protocolo atual recomendado para resgate de lipídios (consulte http://www.lipidrescue.org) envolve uma emulsão lipídica a 20%: um bolus inicial de 1.5 mL/kg, seguido de 0.25 mL/kg/min por 30 a 60 minutos. A administração precoce de lipídios também demonstrou prevenir a progressão para parada cardíaca quando a bupivacaína foi injetada por via intravascular.
Sempre que houver parada cardíaca materna, independentemente da causa, o feto deve ser nascido precocemente, geralmente dentro de 5 minutos, caso as tentativas de reanimação não tenham sucesso em aliviar a compressão aortocava e garantir a eficiência da massagem cardíaca.
Cefaleia pós-punção dural
As mulheres grávidas têm um risco maior de desenvolver uma cefaleia pós-punção dural (CPPD) caso ocorra uma punção dural inadvertida. Em uma meta-análise recente, o risco de CPPD foi de 52.1% (intervalo de confiança de 95% [IC], 51.4–52.8%) após uma punção dural acidental com uma agulha peridural. A pressão epidural reduzida aumenta o risco de vazamento de líquido cefalorraquidiano através da abertura dural. Russel et ai. relataram que a colocação de um cateter intratecal após uma punção dural acidental não diminuiu a incidência de cefaleia ou a necessidade de tampão sanguíneo em comparação com a repetição de uma epidural. A incidência de cefaleia foi maior com o uso de agulha de calibre 16 em comparação com agulha epidural de calibre 18. A fisiopatologia e o manejo da cefaleia pós-punção dural são discutidos em mais detalhes em Cefaleia pós-punção dural.
Complicações Neurológicas
Seqüelas neurológicas do bloqueio neuroaxial central, embora raras, foram relatadas. A pressão exercida por uma agulha ou cateter nas raízes nervosas espinhais produz dor imediata e requer reposicionamento. Infecções como abscesso epidural e meningite são muito raras e podem ser uma manifestação de sepse sistêmica. Nos últimos anos, vários casos de abscesso peridural foram relatados após cateterismo peridural em pacientes obstétricas.
Os fatores de risco potenciais identificados nesses casos são infecções de ponto de entrada de organismos causadores usuais (por exemplo, Staphylococcus aureus), possíveis fontes sistêmicas de infecção, técnica asséptica inadequada e cateterismo prolongado. Hematoma epidural também pode ocorrer, geralmente associado a defeitos de coagulação. No entanto, o hematoma epidural também pode ocorrer espontaneamente, sem relação com a instrumentação. A patogênese pode ser devido a uma arquitetura vascular peridural enfraquecida. A irritação da raiz nervosa pode ter uma recuperação prolongada, com duração de semanas ou meses. A lesão do nervo periférico como resultado de instrumentação, posição de litotomia ou compressão pela cabeça fetal pode ocorrer mesmo na ausência de técnica neuroaxial.
ANESTESIA REGIONAL NA GRAVIDEZ COMPLICADA
A gravidez e o parto são considerados de alto risco quando acompanhados de condições desfavoráveis ao bem-estar da mãe ou do feto, ou ambos. Problemas maternos podem estar relacionados à gravidez; isto é, pré-eclâmpsia-eclâmpsia, distúrbios hipertensivos da gravidez ou hemorragia anteparto resultante de placenta prévia ou descolamento prematuro de placenta. Diabetes melito; problemas cardíacos, renais crônicos e neurológicos; anemia falciforme; asma; obesidade; e abuso de drogas não estão relacionados à gravidez, mas muitas vezes são afetados por ela. Prematuridade (gestação inferior a 37 semanas), pós-maturidade (gestação de 42 semanas ou mais), retardo do crescimento intrauterino e gestação múltipla são condições fetais associadas ao risco. Durante o trabalho de parto e parto, má apresentação fetal (p. risco para a mãe ou para o feto. Em geral, o manejo anestésico da parturiente de alto risco é baseado nas mesmas considerações maternas e fetais que o manejo de mães e fetos saudáveis. No entanto, há menos espaço para erros, pois muitas dessas funções podem ser comprometidas antes da indução da anestesia.
Pré-eclâmpsia-EclâmpsiaPatofisiologia e Sinais e Sintomas
Os distúrbios hipertensivos ocorrem em aproximadamente 7% de todas as gestações e são uma das principais causas de mortalidade materna. O critério diagnóstico mais recente para pré-eclâmpsia é referido como “aumento proteináceo da pressão arterial”. A presença ou ausência de edema não é mais considerada um dos critérios exigidos. Em vez de uma elevação específica da pressão arterial, uma pressão arterial consistentemente 15% acima da linha de base agora é considerada diagnóstica. O aparecimento adicional de convulsões é diagnóstico de eclâmpsia. A pré-eclâmpsia-eclâmpsia é uma doença exclusiva do ser humano, ocorrendo predominantemente em mulheres jovens nulíparas. Os sintomas geralmente aparecem após a vigésima semana de gestação, ocasionalmente mais cedo com uma mola hidatiforme. O parto do bebê e da placenta é o único tratamento eficaz; como resultado, a pré-eclâmpsia é uma das principais causas de parto prematuro iatrogênico em países desenvolvidos.
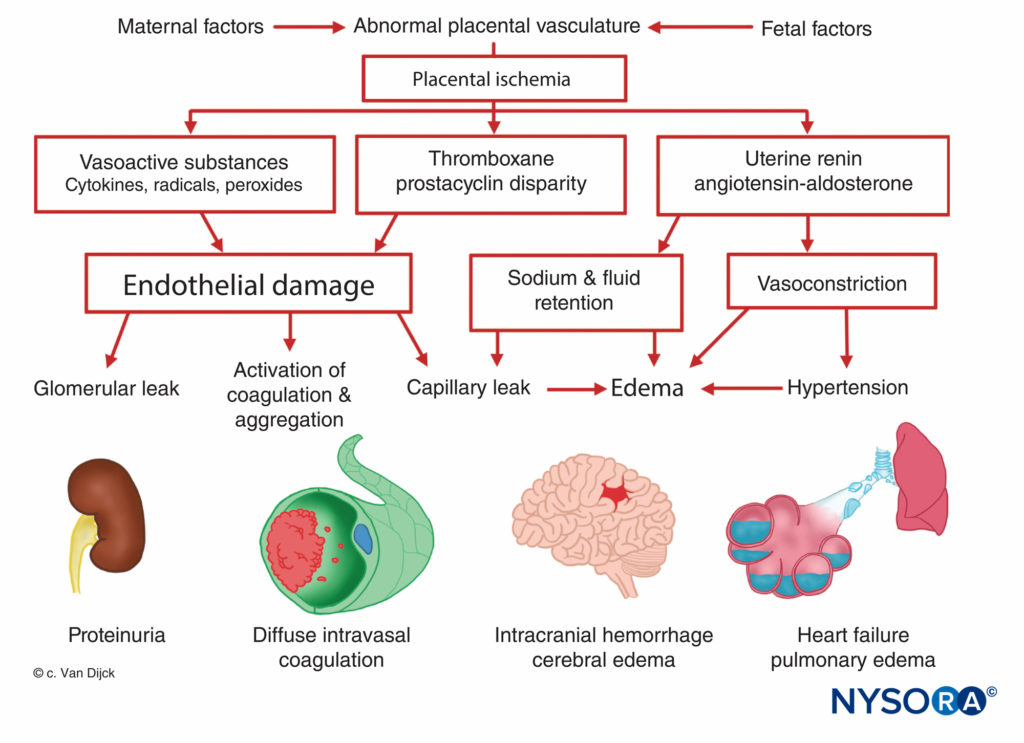
A origem da pré-eclâmpsia-eclâmpsia é desconhecida, mas todos os pacientes manifestam isquemia placentária. A diminuição da perfusão placentária ocorre no início da gravidez em mulheres destinadas à pré-eclâmpsia, e há uma falha da invasão trofoblástica normal. Na gravidez normal, o diâmetro das artérias espiraladas aumenta aproximadamente quatro vezes para criar tubos flácidos que fornecem um caminho de baixa resistência para o espaço interviloso. Essa angiogênese é resultado da invasão do trofoblasto nos segmentos decidual e miometrial das artérias espiraladas. No entanto, em mulheres com pré-eclâmpsia, o miométrio não é invadido. Isso causa implantação placentária superficial, resultando em diminuição da perfusão placentária e isquemia relacionada às artérias espirais musculares rígidas. A isquemia placentária resulta em liberação de renina uterina, aumento da atividade da angiotensina e vasoconstrição arteriolar generalizada, causando hipertensão, hipóxia tecidual e dano endotelial.Figura 7). A fixação de plaquetas em locais de lesão endotelial resulta em coagulopatias, ocasionalmente em coagulação intravascular disseminada. O aumento da secreção de aldosterona mediada pela angiotensina leva ao aumento da reabsorção de sódio e edema. A proteinúria, sinal de pré-eclâmpsia, também é atribuída à isquemia placentária, que leva à degeneração tecidual local e à liberação de tromboplastina com posterior deposição de fibrina nos vasos glomerulares constritos. Como resultado, ocorre um aumento da permeabilidade à albumina e outras proteínas plasmáticas. Além disso, há uma diminuição da produção de prostaglandina E, um potente vasodilatador secretado no trofoblasto, que normalmente equilibra os efeitos hipertensivos do sistema renina-angiotensina.
Muitos dos sintomas associados à pré-eclâmpsia, incluindo isquemia placentária, vasoconstrição sistêmica e aumento da agregação plaquetária, podem resultar de um desequilíbrio entre a produção placentária de prostaciclina e tromboxano. Durante a gravidez normal, a placenta produz quantidades iguais dos dois, mas em uma gravidez pré-eclâmptica, há sete vezes mais tromboxano do que prostaciclina.
De acordo com a teoria mais recente, a lesão das células endoteliais é fundamental para o desenvolvimento da pré-eclâmpsia. Essa lesão ocorre como resultado da redução da perfusão placentária, levando à produção e liberação de substâncias (possivelmente peroxidases lipídicas) causando lesão às células endoteliais. A função anormal das células endoteliais contribui para o aumento da resistência periférica e outras anormalidades observadas na pré-eclâmpsia por meio da liberação de fibronectina, endotelina e outras substâncias.
Em modelos de roedores, duas proteínas antiangiogênicas placentárias foram identificadas e provavelmente desempenham um papel na patogênese da pré-eclâmpsia. A tirosina quinase-1 solúvel do tipo fms (sFlt-1) é regulada positivamente na placenta de mulheres com pré-eclâmpsia. Os níveis elevados de proteína sFlt-1 antagonizam e reduzem o fator de crescimento vascular terminal-telial (VEGF) e o fator de crescimento placentário (PlGF). Levine et ai. demonstraram que níveis aumentados de sFlt-1 e níveis reduzidos de PlGF previam o desenvolvimento subsequente de pré-eclâmpsia. Outra proteína antiangiogênica, a endoglina solúvel (sEng), está elevada nos casos de síndrome HELLP (que consiste em hemólise, enzimas hepáticas elevadas e baixa contagem de plaquetas).
Dicas NYSORA
A pré-eclâmpsia é classificada como grave se estiver associada a qualquer um dos seguintes:
- Pressão arterial sistólica consistentemente mais de 15% acima da linha de base
- Pressão arterial diastólica consistentemente mais de 15% acima da linha de base
- Proteinúria de 5 g/24 h
- Oligúria de 400 mL/24 h
- Distúrbios cerebrovisuais
- Edema pulmonar ou cianose
- Dor epigástrica
- Retardo de crescimento intra-uterino
Na pré-eclâmpsia-eclâmpsia grave, todos os principais sistemas orgânicos são afetados devido ao vasoespasmo generalizado. O fluxo sanguíneo cerebral global não está diminuído, mas a hipoperfusão focal não pode ser descartada. A autópsia revelou necrose hemorrágica na proximidade de pré-capilares trombosados, sugerindo intensa vasoconstrição. Edema e pequenos focos de degeneração têm sido atribuídos à hipóxia. Hemorragias petequiais são comuns após o início das convulsões. Os sintomas relacionados às alterações acima incluem dor de cabeça, vertigem, cegueira cortical, hiperreflexia e convulsões. Hemorragia cerebral e edema são as principais causas de morte na pré-eclâmpsia-eclâmpsia, que juntas respondem por aproximadamente 50% das mortes. A insuficiência cardíaca pode ocorrer em casos graves como resultado de vasoconstrição periférica e aumento da viscosidade sanguínea por hemoconcentração. A diminuição do suprimento sanguíneo para o fígado pode levar à necrose periportal de extensão e gravidade variáveis. As hemorragias subcapsulares são responsáveis pela dor epigástrica encontrada em casos graves. Nos rins, há inchaço das células endoteliais glomerulares e deposição de fibrina, levando a uma constrição do lúmen capilar. O fluxo sanguíneo renal e a taxa de filtração glomerular diminuem, resultando em redução da depuração do ácido úrico e, em casos graves, aumento da creatinina.
Embora a pré-eclâmpsia seja acompanhada por retenção exagerada de água e sódio, o deslocamento de líquidos e proteínas do compartimento intravascular para o extravascular pode resultar em hipovolemia, hipoproteinemia e hemoconcentração, que pode ser agravada ainda mais pela proteinúria. O risco de hipoperfusão uteroplacentária e mau resultado fetal correlaciona-se com o grau de depleção plasmática e proteica materna.
A aderência plaquetária em locais de dano endotelial pode resultar em coagulopatia de consumo, que se desenvolve em aproximadamente 20% dos pacientes com pré-eclâmpsia. Trombocitopenia leve, com contagem de plaquetas de 100,000–150,000/mm, é o achado mais comum. O prolongamento dos tempos de protrombina e tromboplastina parcial indica consumo de procoagulantes. O tempo de sangramento, prolongado em aproximadamente 25% dos pacientes com contagem normal de plaquetas, não é mais considerado um teste confiável de coagulação. A síndrome HELLP é uma forma particular de pré-eclâmpsia grave caracterizada por hemólise, enzimas hepáticas elevadas e plaquetas baixas.
Os objetivos do manejo da paciente com pré-eclâmpsia-eclâmpsia são prevenir ou controlar as convulsões, melhorar a perfusão dos órgãos, normalizar a pressão arterial e corrigir anormalidades da coagulação. A base da terapia anticonvulsivante nos Estados Unidos é o sulfato de magnésio. Sua eficácia na prevenção de convulsões está bem fundamentada, mas seu mecanismo de ação permanece controverso. O paciente geralmente recebe uma dose de ataque de 4 g em uma solução a 20%, administrada em 5 minutos, seguida de uma infusão contínua de 1 a 2 g/h.
A terapia anti-hipertensiva na pré-eclâmpsia é usada para diminuir o risco de hemorragia cerebral na mãe, mantendo ou mesmo melhorando a perfusão tecidual. Não há evidências que sugiram que a terapia anti-hipertensiva retarde a progressão da doença ou melhore o resultado perinatal. A expansão do volume plasmático combinada com a vasodilatação cumpre esses objetivos. A hidralazina é o vasodilatador mais comumente usado porque aumenta os fluxos sanguíneos uteroplacentário e renal. No entanto, os efeitos colaterais incluem taquicardia, palpitações, cefaleia e trombocitopenia neonatal. O nitroprussiato é usado durante a laringoscopia e a intubação para evitar elevações perigosas da pressão arterial. O trimetafano, um agente bloqueador do gânglio, é útil em emergências hipertensivas quando o edema cerebral e o aumento da pressão intracraniana são uma preocupação, pois não causa vasodilatação no cérebro. Outros agentes que têm sido usados para controlar a pressão arterial materna incluem α-metildopa, nitroglicerina e, agora com mais frequência, labetalol.
A coagulopatia de consumo pode exigir infusão de sangue total fresco, concentrados de plaquetas, plasma fresco congelado e crioprecipitado. O parto é indicado em casos refratários ou se a gravidez estiver próxima do termo. Em casos graves, o manejo agressivo deve continuar por pelo menos 24 a 48 horas após o parto.
Gerenciamento de Anestesia
Existem muito poucas contra-indicações para anestesia peridural no trabalho de parto e parto. Na presença de anormalidades graves de coagulação ou déficit grave de volume plasmático, a relação risco-benefício favorece outras formas de anestesia. Em pacientes com depleção de volume posicionadas com deslocamento uterino à esquerda, a anestesia peridural não causa redução inaceitável da pressão arterial e leva a uma melhora significativa da perfusão placentária. Com o uso do xenônio radioativo, foi demonstrado que o fluxo sanguíneo interviloso aumentou em aproximadamente 75% após a indução da analgesia peridural (10 mL de bupivacaína 0.25%). A depuração total do corpo materno dos anestésicos locais amida é prolongada na pré-eclâmpsia, e a administração repetida dessas drogas pode levar a concentrações sanguíneas mais altas do que em pacientes normotensas.
Para parto por cesariana, o nível sensorial da anestesia regional deve se estender até T3-4, tornando a fluidoterapia adequada e o deslocamento uterino esquerdo ainda mais vitais.
A anestesia peridural tem sido preferida à raquianestesia em mulheres com pré-eclâmpsia por causa de seu início de ação mais lento e controlabilidade. No passado, o rápido início da simpatectomia relacionada à raquianestesia estava associado à hipotensão, principalmente em pacientes com depleção de volume. No entanto, em dois estudos recentes, a incidência de hipotensão, administração perioperatória de fluidos e efedrina e condições neonatais foram semelhantes em mulheres com pré-eclâmpsia que receberam anestesia peridural ou raquidiana para cesariana. Aya et ai. conduziram um estudo de coorte prospectivo que mostrou que o risco de hipotensão significativa induzida pela raquianestesia foi significativamente menor em mulheres com pré-eclâmpsia em comparação com gestantes normotensas. Há uma sensibilidade aumentada aos vasopressores na pré-eclâmpsia; portanto, geralmente são necessárias doses mais baixas de efedrina e fenilefrina para corrigir a hipotensão.
Hemorragia Anteparto
A hemorragia anteparto ocorre mais comumente em associação com placenta prévia (implantação placentária anormal no segmento uterino inferior e oclusão parcial a total do orifício cervical interno) e descolamento prematuro da placenta. A placenta prévia ocorre em 0.11% de todas as gestações, resultando em uma incidência de até 0.9% de mortalidade materna e 17-26% de mortalidade perinatal. Pode estar associada a apresentação fetal anormal, como decúbito transversal ou nádegas. Deve-se suspeitar de placenta prévia sempre que uma paciente apresentar sangramento vaginal vermelho-vivo e indolor, geralmente após o sétimo mês de gravidez. O diagnóstico é confirmado por ultrassonografia. A menos que a borda inferior da placenta esteja a mais de 2 cm do orifício cervical interno, geralmente é necessário um parto abdominal. Se o sangramento não for abundante e o feto for imaturo, o manejo obstétrico é conservador para prolongar a gravidez. Em casos graves ou se o feto estiver maduro no início dos sintomas, o parto imediato é indicado, geralmente por cesariana. Uma histerectomia de emergência pode ser necessária devido à hemorragia grave, mesmo após a expulsão da placenta, devido à atonia uterina. Em pacientes submetidas a cirurgia uterina prévia, principalmente cesariana prévia, o risco de hemorragia grave é ainda maior, devido à maior incidência de placenta acreta (penetração do miométrio por vilosidades placentárias).
A abrupção placentária ocorre em 0.2 a 2.4% das gestantes, geralmente nas 10 semanas finais de gestação e em associação com doenças hipertensivas. As complicações incluem útero de Couvelaire (que ocorre quando o sangue extravasado disseca entre as fibras do miométrio), insuficiência renal, coagulação intravascular disseminada e necrose da hipófise anterior (isto é, síndrome de Sheehan). A mortalidade materna é alta (1.8–11.0%), e a taxa de mortalidade perinatal é ainda maior (superior a 50%). O diagnóstico de descolamento prematuro da placenta é baseado na presença de sensibilidade uterina, hipertonia e sangramento vaginal de sangue escuro e coagulado. O sangramento pode ser ocultado se as margens placentárias permanecerem presas à parede uterina. Alterações na pressão arterial materna e na pulsação, indicativas de hipovolemia, podem ocorrer se a perda de sangue for grave. Os movimentos fetais podem aumentar durante a hipóxia aguda e diminuir se a hipóxia for gradual. Bradicardia fetal e morte podem ocorrer.
Gerenciamento de Anestesia
Geralmente é necessário o estabelecimento de monitorização invasiva (linha arterial, cateter venoso central) e reposição de volemia por cateter de calibre 14 ou 16. Se existirem anormalidades de coagulação, componentes sanguíneos e plasma fresco congelado, crioprecipitado e concentrados de plaquetas podem ser necessários. A escolha do anestésico para uma mulher com descolamento prematuro de placenta depende da condição materna e fetal e da urgência do procedimento. A anestesia geral é indicada na presença de hemorragia descontrolada e anormalidades de coagulação.
A anestesia epidural pode ser usada, principalmente se houver uma epidural funcional durante o trabalho de parto no momento do descolamento e não houver instabilidade hemodinâmica. Vicente et ai. observaram que a anestesia peridural piorou significativamente a hipotensão materna, o fluxo sanguíneo uterino e a PaO2 e o pH fetais durante hemorragia não tratada em ovelhas grávidas. No entanto, tratava-se de hipotensão não corrigida, que, com a hemodinâmica de reposição volêmica intravascular, voltou ao normal mesmo com anestesia peridural.
Parto Prematuro
O trabalho de parto prematuro e o parto apresentam um desafio significativo para o anestesiologista, pois tanto a mãe quanto o bebê podem estar em risco. A definição de prematuridade foi alterada para distinguir entre o bebê prematuro, nascido antes da 2ª semana de gestação, e o bebê pequeno para a idade gestacional, que pode nascer a termo, mas cujo peso é mais de 8 desvios padrão abaixo O significativo. Embora o parto prematuro ocorra em 10-80% de todos os nascimentos, é responsável por aproximadamente 24% das mortes neonatais precoces. Complicações graves, como síndrome do desconforto respiratório, hemorragia intracraniana, hipoglicemia, hipocalcemia e hiperbilirrubinemia, são propensas a se desenvolver em bebês prematuros. Obstetras frequentemente tentam inibir o trabalho de parto prematuro para obter tempo para a maturidade pulmonar fetal. Atrasar o parto em até 48 a 2 horas pode ser benéfico se os glicocorticóides forem administrados à mãe para aumentar a maturidade pulmonar fetal. Vários agentes têm sido usados para suprimir a atividade uterina (tocólise), como etanol, sulfato de magnésio, inibidores de prostaglandinas, β-simpaticomiméticos e bloqueadores dos canais de cálcio. Os fármacos β-adrenérgicos, como ritodrina e terbutalina, são os tocolíticos mais utilizados. Seu efeito predominante é a estimulação do receptor βXNUMX, que resulta em inibição miometrial, vasodilatação e broncodilatação. Inúmeras complicações maternas, incluindo hipotensão, hipocalemia, hiperglicemia, isquemia miocárdica, edema pulmonar e morte, foram relatadas como resultado desses tocolíticos.
Gerenciamento de Anestesia
Complicações podem ocorrer devido a interações com drogas e técnicas anestésicas. Com o uso de anestesia regional, a vasodilatação periférica causada pela estimulação β-adrenérgica aumenta o risco de instabilidade hemodinâmica na presença de taquicardia, hipotensão e hipocalemia preexistentes. Sabe-se que o prematuro é mais vulnerável que o recém-nascido a termo aos efeitos das drogas utilizadas na analgesia e anestesia obstétrica. No entanto, existem poucos estudos sistêmicos para determinar a farmacocinética materna e fetal e a dinâmica de drogas ao longo da gestação.
Existem várias causas postuladas de aumento da sensibilidade a drogas em recém-nascidos prematuros: menos proteína disponível para ligação a drogas; níveis mais elevados de bilirrubina, que podem competir com o fármaco pela ligação às proteínas; maior acesso de medicamentos ao sistema nervoso central devido a uma barreira hematoencefálica pouco desenvolvida; maior água corporal total e menor teor de gordura; e uma capacidade diminuída de metabolizar e excretar drogas. No entanto, a maioria das drogas usadas em anestesia apresenta baixo a moderado grau de ligação no soro fetal: aproximadamente 50% para bupivacaína, 25% para lidocaína, 52% para meperidina e 75% para tiopental. um recém-nascido prematuro, as preocupações com os efeitos das drogas no recém-nascido são muito menos importantes do que prevenir a asfixia e o trauma ao feto. Para o parto vaginal, a anestesia epidural bem conduzida é vantajosa para proporcionar um bom relaxamento perineal. Antes da indução do bloqueio peridural, o anestesiologista deve certificar-se de que o feto não está hipóxico nem acidótico. A asfixia resulta em uma redistribuição do débito cardíaco fetal, o que aumenta o fornecimento de oxigênio a órgãos vitais, como cérebro, coração e glândulas supra-renais. Independentemente disso, essas alterações no feto prematuro podem ser melhor preservadas com bupivacaína ou cloroprocaína do que com lidocaína. Os prematuros com apresentação pélvica geralmente são nascidos por cesariana. A anestesia regional pode ser usada com sucesso, com nitroglicerina disponível para relaxamento uterino, se necessário.
Dicas NYSORA
- Ao dar à luz um bebê prematuro, as preocupações com os efeitos das drogas no recém-nascido são muito menos importantes do que prevenir asfixia e trauma para o feto.
- Antes de induzir o bloqueio peridural, deve-se verificar se o feto não está hipóxico nem acidótico.
A analgesia regional durante o trabalho de parto e parto vaginal tornou-se a técnica preferida de alívio da dor em pacientes selecionadas de alto risco porque previne a obnubilação da mãe e a depressão do feto e reduz muitos dos potenciais efeitos fisiológicos adversos do trabalho de parto, como o aumento do consumo de oxigênio e alterações hemodinâmicas. Para cesariana, a anestesia regional surgiu como uma técnica segura e eficaz em parturientes de alto risco, em parte devido à capacidade adicional de fornecer analgesia pós-operatória prolongada.
CIRURGIA NÃO OBSTÉTRICA NA GESTANTE
Aproximadamente 1.6 a 2.2% das gestantes são submetidas à cirurgia por motivos não relacionados ao parto. Além do trauma, as emergências mais comuns são abdominais, aneurismas intracranianos, valvopatias cardíacas e feocromocitoma.
Quando surge a necessidade de cirurgia, as considerações anestésicas estão relacionadas às alterações na condição fisiológica materna com o avanço da gravidez, a teratogenicidade das drogas anestésicas, os efeitos indiretos da anestesia no fluxo sanguíneo uteroplacentário e o potencial de aborto ou parto prematuro. Os riscos devem ser equilibrados para proporcionar o resultado mais favorável para mãe e filho. Cinco grandes estudos tentaram relacionar cirurgia e anestesia durante a gravidez humana ao resultado fetal determinado por anomalias, parto prematuro ou morte intrauterina. Embora esses estudos não tenham correlacionado cirurgia e exposição anestésica com anomalias congênitas, todos os estudos demonstraram aumento da incidência de morte fetal, principalmente após operações realizadas no primeiro trimestre. Nenhum agente ou técnica anestésica em particular foi implicado. A condição que necessitou de cirurgia foi o fator mais relevante, com maior mortalidade fetal após cirurgia pélvica ou procedimentos realizados por indicação obstétrica; isto é, incompetência cervical.
A citotoxicidade dos agentes anestésicos está intimamente associada à biodegradação, que, por sua vez, é influenciada pela oxigenação e fluxo sanguíneo hepático. Assim, as complicações associadas à anestesia – hipóxia materna, hipotensão, administração de vasopressores, hipercarbia, hipocarbia e distúrbios eletrolíticos – podem ser fatores maiores na teratogênese do que o próprio uso dos agentes.
As evidências experimentais sobre a exposição a drogas e agentes específicos são discutidas brevemente, com o entendimento de que é difícil extrapolar dados laboratoriais para a situação clínica em humanos. Um número muito grande de pacientes deve ser exposto a um teratógeno suspeito antes que sua segurança possa ser determinada. Fatores complicadores incluem a frequência de exposição materna a uma multiplicidade de drogas; a dificuldade em separar os efeitos do processo da doença de base e do tratamento cirúrgico daqueles da droga administrada; diferentes graus de risco com o estágio da gestação; e a variedade, e não a consistência, de anomalias que aparecem em associação com um agente. Com relação aos agentes anestésicos regionais, os anestésicos locais não demonstraram ser teratogênicos em animais ou humanos.
Cuidados foram tomados com sedativos antes da colocação do bloqueio devido a vários relatos descrevendo uma relação específica entre diazepam e fissuras orais; no entanto, outros estudos não confirmaram isso. Um estudo prospectivo de 854 mulheres que ingeriram diazepam durante o primeiro trimestre não demonstrou maior risco de fenda palatina ou lábio leporino. Atualmente, o diazepam não é um teratógeno comprovado.
Recentemente, tem havido preocupação em relação aos efeitos neurocognitivos adversos em crianças expostas a anestésicos durante a vida fetal. De fato, ratos neonatos expostos a anestesia geral in utero tiveram um grau maior de déficits neuroadaptativos do que um grupo controle. Da mesma forma, os bebês nascidos sob anestesia geral para cesariana também apresentaram comprometimento leve da cognição em comparação com a anestesia regional. A dificuldade com este estudo é que ele era de natureza retrospectiva, e existia o potencial de viés de seleção de pacientes. Por exemplo, o uso de anestesia geral é reservado para situações de emergência, como estado fetal não tranquilizador ou descolamento de placenta, que, em nossa opinião, afetaria mais a neurocognição do que o anestésico. O mais preocupante é que os bebês nascidos de parto vaginal apresentaram perfis semelhantes aos de crianças nascidas de parto cesáreo com anestesia geral. No entanto, parece prudente evitar a anestesia geral em preferência às técnicas regionais durante a gravidez devido às considerações maternas e fetais discutidas anteriormente. Existem poucos dados para orientar a tomada de decisão médica, mas a alteração do tipo de técnica cirúrgica (por exemplo, conversão de apendicectomia laparoscópica para aberta) deve ser considerada para facilitar o uso da anestesia regional. Como a dor e apreensão materna podem resultar em diminuição do fluxo sanguíneo uterino e deterioração do feto (semelhante às infusões de epinefrina ou norepinefrina), deve-se considerar a intervenção precoce para aliviar a dor pós-operatória com técnicas regionais (isto é, bloqueio de nervo periférico ou infusão epidural).
Dicas NYSORA
Os anestésicos locais não demonstraram ser teratogênicos em animais ou humanos.
RESUMO
A gravidez resulta em uma série de mudanças fisiológicas significativas que requerem ajustes nas técnicas de anestesia e analgesia para o manejo seguro e eficaz da paciente grávida. É prudente adiar a cirurgia, quando possível, até depois do nascimento do bebê. Apenas a cirurgia de emergência deve ser considerada durante o primeiro trimestre. As técnicas regionais tornaram-se as mais aceitas para o alívio da dor durante o trabalho de parto e parto vaginal. Da mesma forma, as técnicas neuroaxiais são agora as técnicas mais utilizadas para administrar anestésicos para parto cesáreo. Os avanços na anestesia regional e seu uso rotineiro generalizado resultaram em segurança materna significativamente maior em comparação com a anestesia geral.
REFERÊNCIAS
- Melzack R, Taenzer P, Feldman P, Kinch RA: O parto ainda é doloroso após o treinamento de parto preparado. Can Med Assoc J 1981;125:357.
- Goodman RP, Killom AP, Brash AR, Branch RA: Produção de prostaciclina durante a gravidez: comparação da produção durante a gravidez normal e gravidez complicada por hipertensão. Am J Obstet Gynecol 1982; 142:817.
- Kerr MG, Scott DB, Samuel E: Estudos da veia cava inferior no final da gravidez. BMJ 1964;1:532.
- Howard BK, Goodson JH, Mengert WE: Síndrome hipotensiva supina no final da gravidez. Obstet Gynecol 1953;1:371.
- Kuo CD, Chen GY, Yang MJ, Tsai YS: O efeito da posição na atividade nervosa autônoma no final da gravidez. Anestesia 1997;52:1161–1165.
- Kundra P, Velraj J, Amirthalingam U, et al: Efeito do posicionamento das posições supina e lateral esquerda para inclinação lateral esquerda nas velocidades do fluxo sanguíneo materno e formas de onda em parturientes a termo. Anestesia 2012;67: 889–893.
- Carruth JE, Mivis SB, Brogan DR, Wenger NK: O eletrocardiograma na gravidez normal. Am Heart J 1981;102:1075–1078.
- Seth R, Moss AJ, McNitt S, et al: Síndrome do QT longo e gravidez. J Am Coll Cardiol 2007;49:1092–1098.
- Prowse CM, Gaensler EA: Alterações respiratórias e ácido-base durante a gravidez. Anestesiologia 1965;26:381.
- Moya F, Smith BE: Captação, distribuição e transporte placentário de drogas e anestésicos. Anestesiologia 1965;26:465.
- Archer GW, Marx GF: Oxigenação arterial durante apnéia em parturientes. Br J Anaesth 1974;46:358.
- Whitehead EM, Smith M, Dean Y, O'Sullivan G: Uma avaliação dos tempos de esvaziamento gástrico na gravidez e no puerpério. Anestesia 1993;48:53–57.
- La Salvia LA, Steffen EA: Tempo de esvaziamento gástrico retardado no trabalho de parto. Am J Obstet Gynecol 1950;59:1075-1081.
- Wong CA, Loffredi M, Ganchiff JN, et al: Esvaziamento gástrico de água na gravidez a termo. Anestesiologia 2002;96:1395–1400.
- Davison JS, Davison MC, Hay DM: Tempo de esvaziamento gástrico no final da gravidez e trabalho de parto. J Obstet Gynaecol Br Commonw 1970;77: 37–41.
- Brock-Utne JG, Dow TGB, Dimopoulos GE, et al: Pressões do esfíncter gástrico e esofágico inferior (LOS) no início da gravidez. Br J Anaesth 1981;53:381.
- Wyner J, Cohen SE: Volume gástrico no início da gravidez: Efeito da metoclopramida. Anestesiologia 1982;57:209.
- Cohen SE, Woods WA, Wyner J: Eficácia antiemética de droperidol e metoclopramida. Anestesiologia 1984;60:67.
- Scheller MS, Sears KL: Disfunção neurológica pós-operatória associada à administração pré-operatória de metoclopramida. Anesth Analg 1987;66:274.
- Lund CJ, Donovan JC: Volume de sangue durante a gravidez. Am J Obstet Gynecol 1967;98:393.
- Pritchard J, MacDonald P: Adaptação materna à gravidez. Em Williams JW, Pritchard J, MacDonald P (eds), Williams Obstetrics, 16ª ed. Nova York: Appleton-Century-Crofts, 1980, p. 236.
- Gerbasi FR, Buttoms S, Farag A, Mammen E: Aumento da coagulação intravascular associada à gravidez. Obstet Gynecol 1990;75:385–389.
- Wildsmith JAW: Pseudocolinesterase sérica, gravidez e suxametônio. Anestesia 1972;27:90.
- Coryell MN, Praia EF, Robinson AR, et al: Metabolismo das mulheres durante o ciclo reprodutivo: XVII. Mudanças nos padrões eletroforéticos das proteínas plasmáticas ao longo do ciclo e após o parto. J Clin Invest 1950;29:1559.
- Datta S, Kitzmiller JL, Naulty JS, et al: Status ácido-base de mães diabéticas e seus bebês após raquianestesia para cesariana. Anesth Analg 1982;61:662.
- Datta S, Lambert DH, Gregus J, et al: Sensibilidades diferenciais de fibras nervosas de mamíferos durante a gravidez. Anesth Analg 1983;62:1070.
- Gin T, Chan MTV: Diminuição da concentração alveolar mínima de isoflurano em gestantes. Anestesiologia 1994;81:829.
- Brown WU, Bell GC, Alper MH: Acidose, anestésicos locais e o recém-nascido. Obstet Gynecol 1976;48:27.
- Hamshaw-Thomas A, Rogerson N, Reynolds F: Transferência de bupivacaína, lidocaína e petidina através da placenta de coelho: Influência da ligação de proteínas maternas e fluxo fetal. Placenta 1984;5:61.
- Kennedy RL, Miller RP, Bell JU, et al: Captação e distribuição de bupivacaína em cordeiros fetais. Anestesiologia 1986;65:247.
- Kuhnert PM, Kuhnert BR, Stitts JM, Gross TL: O uso de uma técnica de monitoramento de íons selecionados para estudar a disposição da bupivacaína na mãe, feto e recém-nascido após anestesia peridural para cesariana. Anestesiologia 1981;55:611.
- Kuhnert BR, Philipson EH, Pimental R, et al: Disposição da lidocaína na mãe, feto e recém-nascido após raquianestesia. Anesth Analg 1986;65:139.
- Morishima HO, Daniel SS, Finster M, et al: Transmissão de cloridrato de mepivacaína (Carbocaína) através da placenta humana. Anestesiologia 1966;27:147.
- Kuhnert BR, Kuhnert PM, Prochaska AL, Gross TL: Níveis plasmáticos de 2-cloroprocaína em pacientes obstétricas e seus neonatos após anestesia peridural. Anestesiologia 1980;53:21.
- Pihlajamaki K, Kanto J, Lindberg R, et al: Administração extradural de bupivacaína: farmacocinética e metabolismo em mulheres grávidas e não grávidas. Br J Anaesth 1990;64:556.
- Morishima HO, Covino BG: Toxicidade e distribuição de lidocaína em fetos de babuínos não asfixiados e asfixiados. Anestesiologia 1981;54:182.
- Morishima HO, Finster M, Pedersen H, et al: Farmacocinética da lidocaína em cordeiros fetais e neonatais e ovelhas adultas. Anestesiologia 1979;50:431.
- Mihaly GW, Moore RG, Thomas J, et al: A farmacocinética e metabolismo dos anestésicos locais anilida em recém-nascidos. Eur J Clin Pharmacol 1978;13:143.
- Finster M, Poppers PJ, Sinclair JC, et al: Intoxicação acidental do feto com anestésico local durante anestesia caudal. Am J Obstet Gynecol 1965;92:922.
- Morishima HO, Pedersen H, Finster M, et al: Toxicidade da lidocaína em ovelhas adultas, recém-nascidas e fetais. Anestesiologia 1981;55:57.
- Gale R, Ferguson JE II, Stevenson D: Efeito da analgesia epidural com cloridrato de bupivacaína na produção de bilirrubina neonatal. Obstet Gynecol 1987;70:692.
- Brockhurst NJ, Littleford JA, Halpern SH: O escore de capacidade neurológica e adaptativa: uma revisão sistemática de seu uso na pesquisa de anestesia obstétrica. Anestesiologia 2000;92:237.
- Morishima HO, Yeh MN, James LS: Redução do fluxo sanguíneo uterino e hipoxemia fetal com estresse materno agudo: observação experimental no babuíno grávida. Am J Obstet Gynecol 1979;134:270.
- Ueland K, Hansen JM: Dinâmica cardiovascular materna: Ill. Trabalho de parto e parto sob analgesia local e caudal. Am J Obstet Gynecol 1969; 103:8.
- Moir DD, Willocks J: Manejo da ação uterina incoordenada sob analgesia peridural contínua. BMJ 1967;2:396.
- Miller FC, Petrie RH, Arce JJ, et al: Hiperventilação durante o trabalho de parto. Am J Obstet Gynecol 1974; 120:489.
- Beaule PE, Smith MI, Nguyen VN: Convulsão induzida por meperidina após revisão de artroplastia de quadril. J Artroplastia 2005;19:516–519.
- Hagmeyer KO, Mauro LS, Mauro VF: Convulsões relacionadas à meperidina associadas a bombas de analgesia controladas pelo paciente. Ann Pharmacother 1993;27:29-32.
- Kaiko RF, Grabinski PY, Heidrick G, et al: Efeitos excitatórios do sistema nervoso central da meperidina em pacientes com câncer. Ann Neurol 1983;13: 180-185.
- Kuhnert BR, Linn PL, Kennard MJ, Kuhnert PM: Efeito de baixas doses de meperidina no comportamento neonatal. Anesth Analg 1985;64:335.
- Sosa CG, Balagueer E, Alonso JG, et al: Meperidina para distocia durante o primeiro estágio do trabalho de parto: um estudo controlado randomizado. Am J Obstet Gynecol 2004;191:1212–1218.
- Eisele JH, Wright R, Rogge P: Níveis de fentanil materno e neonatal em cesariana. Anesth Analg 1982;61:179.
- Shannon KT, Ramanathan S: Medicação sistêmica para analgesia de parto. Obstet Pain Manage 1995;2:1–6.
- Morley-Foster PK, Reid DW, Vandeberghe H: Uma comparação da analgesia controlada pelo paciente fentanil e alfentanil para analgesia de parto. Can J Anaesth 2000;47:113–119.
- Muir HA, Breen T, Campbell DC, et al: O fentanil PCA intravenoso é um método eficaz para fornecer analgesia de parto? Anestesiologia 1999; (Fornecimento):A28.
- Vercauteren M, Bettens K, Van Springel G, et al: Analgesia de parto intratecal: Podemos usar a mesma mistura que é usada por via epidural? Int J Obstet Anesth 1997;6:242–246.
- Breen TW, Giesinger Cm, Halpern SH: Comparação de lidocaína peridural e fentanil com sufentanil intratecal para analgesia no início do trabalho de parto. Int J Obstet Anesth 1999;8:226–230.
- Kapila A, Glass PS, Jacobs JR, et al: Medidos meios-tempos sensíveis ao contexto de remifentanil e alfentanil. Anestesiologia 1995;83:968-975.
- Evron S, Glezerman M, Sadan O, et al: Remifentanil: um novo analgésico sistêmico para a dor do parto. Anesth Analg 2005;100:233–238.
- Kan RE, Hughes SC, Rosen M, et al: Remifentanil intravenoso: transferência placentária, efeitos maternos e neonatais. Anestesiologia 1998;88:1467.
- Thurlow JA, Laxton CH, Dick A, et al: Remifentanil por analgesia controlada pelo paciente em comparação com meperidina intramuscular para alívio da dor no trabalho de parto. Br J Anaesth 2002;88:374–378.
- Volmanen P, Sarvela J, Akural EI, et al: Remifentanil intravenoso versus levobupivacaína epidural com fentanil para alívio da dor no início do trabalho de parto: um estudo randomizado, controlado e duplo-cego. Acta Anesthesiol Scand 2008;52:249–255.
- Volmanen P, Akural E, Raudaskoski T, et al: Comparação de remifentanil e óxido nitroso na analgesia do parto. Acta Anesthesiol Scand 2005;49: 453–458.
- Maduska AL, Hajghassemali M: Uma comparação duplamente cega de butorfanol e meperidina no trabalho de parto: alívio da dor materna e efeito no recém-nascido. Can Anaesth Soc J 1978;25:398.
- Wilson CM, McClean E, Moore J, Dundee JW: Uma comparação duplo-cega de petidina intramuscular e nalbufina no trabalho de parto. Anestesia 1986;41:1207–1213.
- Hodgkinson R, Huff RW, Hayashi RH, Husain FJ: Comparação duplo-cega de analgesia materna e neurocomportamento neonatal após butorfanol intravenoso e meperidina. J Int Med Res 1979;7:224–230.
- Thorp JA, Hu DH, Albin RM, et al: O efeito da analgesia epidural intraparto no trabalho de parto nulípara: Um estudo prospectivo, controlado e randomizado. Am J Obstet Gynecol 1993;169:851.
- Sharma SK, Sidawi JE, Ramin SM, et al: Parto cesárea: Um estudo randomizado de analgesia peridural versus meperidina controlada pelo paciente durante o trabalho de parto. Anestesiologia 1997;87:487.
- Halpern SH, Leighton BL, Ohlsson A, et al: Efeito da analgesia opióide epidural vs parenteral no progresso do trabalho de parto: uma meta-análise. JAMA 1998;280:2105.
- Ramin SM, Gambling DR, Lucas MJ, et al: Ensaio randomizado de analgesia epidural versus intravenosa no trabalho de parto. Obstet Gynecol 1995;86:783.
- Chestnut DH, Vincent RD, McGrath JM, et al: A administração precoce de analgesia epidural afeta o resultado obstétrico em mulheres nulíparas que estão recebendo ocitocina intravenosa? Anestesiologia 1994;80:1193.
- Chestnut DH, McGrath JM, Vincent RD, et al: A administração precoce de analgesia epidural afeta o resultado obstétrico em mulheres nulíparas que estão em trabalho de parto espontâneo? Anestesiologia 1994;80:1201.
- Colégio Americano de Obstetrícia e Ginecologia: Fórceps Obstétrico. AGOG Committee on Obstetrics Maternal and Fetal Medicine, Committee Opinion, 1989.
- Chestnut DH, Laszewski LJ, Pollack RL, et al: Infusão peridural contínua de 0.0625% bupivacaína-0.0002% fentanil durante o segundo estágio do trabalho de parto. Anestesiologia 1990;72:613.
- Birnbach DJ, Chestnut DH: A dose do teste epidural na prática obstétrica: ela perdeu sua utilidade? Anesth Analg 1999;88:971.
- Norris MC, Ferrenbach D, Dalman H, et al: A epinefrina melhora a acurácia diagnóstica da aspiração durante a analgesia epidural do parto? Anesth Analg 1999;88:1073.
- Guinard JP, Mulroy MF, Carpenter RL, Knopes KD. Doses de teste: conteúdo ideal de epinefrina com e sem bloqueio beta-adrenérgico agudo. Anestesiologia 1990;73:386–392.
- Visconti C, Eisenach JC: Analgesia peridural controlada pelo paciente durante o trabalho de parto. Obstet Gynecol 1991;77:348.
- Halpern S: Recentes avanços na analgesia epidural controlada pelo paciente para o trabalho de parto. Curr Opin Anesthesiol 2005;18:247–251.
- Minty RG, Kelly L, Minty A, Hammett DC: Analgesia intratecal de dose única para controlar a dor do parto: é uma alternativa útil à analgesia epidural? Can Fam Physician 2007;53:437–442.
- Rigler ML, Drasner K, Krejcie TC, et al: Síndrome da cauda equina após raquianestesia contínua. Anesth Analg 1991;72:275.
- Arkoosh VA, Palmer CM, Van Maren GA, et al: Analgesia de parto intratecal contínua: segurança e eficácia. Anestesiologia 1998;(Supl):A8.
- Simons SW, Cyna AM, Dennis AT, Hughes D: Analgesia combinada raqui-peridural versus epidural no trabalho de parto. Sistema de banco de dados Cochrane Rev 2007;3:CD003401.
- Campbell DC, Camann WR, Datta S: A adição de bupivacaína ao sufentanil intratecal para analgesia de parto. Anesth Analg 1995;81:305.
- Labbene I, Gharsallah H, Abderrahaman A, et al: Efeitos de 15 mcg de clonidina intratecal adicionados a bupivacaína e sufentanil para analgesia de parto. Tunis Med 2011;89:853–859.
- Collis RE, Davies DWL, Aveling W: Comparação randomizada de analgesia epidural espinhal combinada e analgesia epidural padrão no trabalho de parto. Lancet 1995;345:1413.
- McLeod A, Fernando R, Página F, et al: Uma avaliação do equilíbrio materno e marcha usando posturografia computadorizada. Anestesiologia 1999; (Fornecimento):A8.
- Wong CA, Scavone BM, Peaceman AM, et al: O risco de parto cesáreo com analgesia neuraxial dado trabalho de parto precoce versus tardio. N Engl J Med 2005;352:655.
- Cohen SE, Cherry CM, Holbrook RH, et al: Sufentanil intratecal para analgesia de parto: alterações sensoriais, efeitos colaterais e alterações da frequência cardíaca fetal. Anesth Analg 1993;77:1155.
- Clarke VT, Smiley RM, Finster M: Hiperatividade uterina após injeção intratecal de fentanil para analgesia durante o trabalho de parto: uma causa de bradicardia fetal? Anestesiologia 1994;81:1083.
- O'Gorman DA, Birnbach DJ, Kuczkowski KM, et al: Uso da velocimetria do fluxo umbilical na avaliação da patogênese da bradicardia fetal após analgesia epidural raquidiana combinada em parturientes. Anestesiologia 2000;(Supl):A2.
- Riley ET, Vogel TM, EI-Sayed YY, et al: O viés de seleção de pacientes contribui para o aumento da incidência de bradicardia fetal após analgesia raqui-peridural combinada para o trabalho de parto. Anestesiologia 1999;91:A1054.
- Nielson PE, Erickson R, Abouleish E, et al: Alterações da frequência cardíaca fetal após sufentanil intratecal ou bupivacaína epidural para analgesia de parto: incidência e significado clínico. Anesth Analg 1996;83:742.
- Albright GA, Forester RM: A analgesia peridural combinada com sufentanil subaracnóideo aumenta a incidência de cesariana de emergência? Reg Anesth 1997;22:400.
- Norris MC, Grieco WM, Borkowski M, et al: Complicações da analgesia do parto: peridural versus técnicas combinadas de peridural espinhal. Anesth Analg 1995;79:529.
- Leighton BL, Arkoosh VA, Huffnagle S, et al: A disseminação dermatomal de bupivacaína epidural com e sem sufentanil intratecal prévio. Anesth Analg 1996;83:526.
- Bucklin BA, Hawkins JL, Anderson JR, Ullrich FA: Pesquisa de força de trabalho de anestesia obstétrica: atualização de vinte anos. Anestesiologia 2005;103:645–653.
- Baxi LV, Petrie RH, James LS: Oxigenação fetal humana após bloqueio paracervical. Am J Obstet Gynecol 1979;135:1109.
- Palomaki O, Huhtala H, Kirkinen P: Um estudo comparativo da segurança de levobupivacaína a 0.25% e bupivacaína racêmica a 0.25% para bloqueio paracervical no primeiro estágio do trabalho de parto. Acta Obstet Gynecol Scand 2005;84: 956-961.
- Leighton BL, Halpern SH, Wilson DB: Bloqueios simpáticos lombares aceleram o parto induzido no início e no segundo estágio em mulheres nulíparas. Anestesiologia 1999;90:1039–1046.
- Pace MC, Aurilio C, Bulletti C, et al: Analgesia subaracnóidea em trabalho de parto avançado: uma comparação de analgesia subaracnóidea e bloqueio pudendo em trabalho de parto avançado. Qualidade analgésica e resultado obstétrico. Ann NY Acad Sci 2004;1034:356–363.
- Aissaoui Y, Bruyere R, Mustapha H, et al: Um estudo controlado randomizado de bloqueio do nervo pudendo para alívio da dor após episiotomia. Anesth Analg 2008;107:625–629.
- Berghella V, Baxter JK, Chauhan SP: Cirurgia baseada em evidências para cesariana. Am J Obstet Gynecol 2005;193:1607–1617.
- Hawkins JL, Gibbs CP, Orleans M, et al: Pesquisa de força de trabalho de anestesia obstétrica 1992 vs 1981. Anestesiologia 1994;81:A1128.
- Shnider SM, Levinson G: Anestesia para cesariana. Em Shnider SM, Levinson G (eds): Anesthesia for Obstetrics, 2ª ed. Baltimore: Williams & Wilkins, 1987, p. 159.
- Dyer RA, Farina Z, Joubert IA, et al: Pré-carga de cristalóide versus administração rápida de cristalóide após indução de raquianestesia para cesariana eletiva. Anaesth Intensive Care 2004;32:35–35-7.
- Marx GF, Luykx WM, Cohen S: Estado fetal-neonatal após cesariana por sofrimento fetal. Br J Anaesth 1984;56:1009.
- Norris MC: Altura, peso e disseminação da bupivacaína hiperbárica subaracnóidea na parturiente a termo. Anesth Analg 1988;67:555.
- Hartwell BL, Aglio LS, Hauch MA, et al: Comprimento da coluna vertebral e disseminação de bupivacaína subaracnóide hiperbárica no termo parturiente. Reg Anesth 1991;16:17–19.
- Ogun CO, Kirgiz EN, Duman A, et al: Comparação de bupivacaína-morfina intratecal isobárica e ropivacaína-morfina para cesariana. Br J Anaesth 2003;90:659–664.
- Hunt GO, Naulty S, Bader AM, et al: Analgesia perioperatória com fentanil-bupivacaína subaracnóidea para cesariana. Anestesiologia 1989;71:535.
- Palmer CM, Emerson S, Volgoropolous D, et al: Relação dose-resposta de morfina intratecal para analgesia pós-cesariana. Anestesiologia 1999;90:437–444.
- Kato R, Shimamoto H, Terui K, et al: Depressão respiratória retardada associada a 0.15 mg de morfina intratecal para cesariana. Uma revisão de 1915 casos. J Anesth 2008;22:112–116.
- Roelants F: O uso de drogas adjuvantes neuroaxiais (neostigmina, clonidina) em obstetrícia. Curr Opin Anesthesiol 2006;19:233–237.
- Ngan Kee WD, Khaw KS, Lee BB, et al: As limitações da ropivacaína com epinefrina como dose de teste epidural em parturientes. Anesth Analg 2001;92:1529–1531.
- Leighton BL, Norris MC, Sosis M, et al: Limitações da epinefrina como marcador de injeção intravascular em mulheres em trabalho de parto. Anestesiologia 1987;66:688.
- Gissen AJ, Datta S, Lambert D: A controvérsia da cloroprocaína: a cloroprocaína é neurotóxica? Reg Anaesth 1984;9:135.
- Hynson JM, Sessler DI, Glosten B: Dor nas costas em voluntários após anestesia epidural com cloroprocaína. Anesth Analg 1991;72:253.
- Albright GA: Parada cardíaca após anestesia regional com etidocaína ou bupivacaína. Anestesiologia 1979;51:285.
- Carvalho B, Riley E, Cohen SE, et al: Morfina peridural de liberação sustentada em dose única no manejo da dor pós-operatória após cesariana eletiva: resultados de um estudo multicêntrico randomizado controlado. Anesth Analg 2005;100:1150–1158.
- Carvalho B, Roland LM, Chu FL, et al: Dose única, morfina epidural de liberação prolongada (DepoDur) comparada à morfina epidural convencional para dor pós-cesariana. Anesth Analg 2007;105:176–183.
- Ginsar Y, Riley ET, Anst MS: O local de ação do fentanil epidural em humanos: a diferença entre infusão e administração em bolus. Anesth Analg 2003;97:1428–1438.
- Marik PE: Pneumonite aspirativa e pneumonia aspirativa. N Engl J Med 2001;344:665–671.
- Brizgys RV, Dailey PA, Shnider SM, et al: A incidência e os efeitos neonatais da hipotensão materna durante a anestesia peridural para cesariana. Anestesiologia 1987;67:782.
- Ueyama H, He YL, Tanigami H, et al: Efeitos da pré-carga cristalóide e colóide ou volume sanguíneo na parturiente submetida à raquianestesia para cesariana eletiva. Anestesiologia 1999;91:1571.
- Rout CC, Roche DA: Hipotensão espinhal associada à cesariana: a pré-carga funcionará? Anestesiologia 1999;91:1565.
- Ngan Kee WD, Kaw KS, Ng FF: Prevenção de hipotensão durante raquianestesia para cesariana: uma técnica eficaz usando combinação de infusão de fenilefrina e co-hidratação cristalóide. Anestesiologia 2005;103:744–750.
- Ramanathan S, Grant GJ: Terapia vasopressora para hipotensão devido à anestesia epidural. Acta Anesthesiol Scand 1988;32:559.
- Rosenblatt MA, Abel M, Fischer GW, et al: Uso bem-sucedido de uma emulsão lipídica a 20% para ressuscitar um paciente após uma suposta parada cardíaca relacionada à bupivacaína. Anestesiologia 2006;105:217–218.
- Kasten GW, Martin ST: Ressuscitação da toxicidade cardiovascular induzida por bupivacaína durante oclusão parcial da veia cava inferior. Anesth Analg 1986;65:341.
- Choi PT, Galinski SE, Takeuchi L, et al: PDPH é uma complicação comum do bloqueio neuroaxial em parturientes: uma meta-análise de estudos obstétricos. Can J Anaesth 2003;50:460–469.
- Russell IF: Um estudo prospectivo controlado de analgesia espinhal contínua versus analgesia epidural repetida após punção dural acidental no trabalho de parto. Int J Obstet Anesth 2012;21:7–16.
- Maynard SE, Min JY, Merchan J, et al: Excesso de tirosina quinase 1 tipo fms solúvel placentária (sFlt1) pode contribuir para disfunção endotelial, hipertensão e proteinúria na pré-eclâmpsia. J Clin Invest 2003;111: 649–658.
- Tada S, Yasue A, Nishizawa H, Sekiya T, Hirota Y, Udagawa Y: Hematoma epidural espinal espontâneo durante a gravidez: relato de três casos. J Obstet Gynaecol Res 2011;37:1734–1738.
- Bodurka D: O que há de novo em ginecologia e obstetrícia. J Am Coll Surg 2005;201:265–274.
- Basso O, Rasmussen S, Weinberg CR, et al: Tendências na sobrevivência fetal e infantil após pré-eclâmpsia. JAMA 2006;296:1357–1362.
- Luttun A, Carmeliet P: Receptor solúvel de VEGF Flt1: o fator de pré-eclâmpsia elusivo descoberto? J Clin Invest 2003;111:60–62.
- Keogh RJ, Harris LK, Freeman A, et al: O trofoblasto derivado do feto usa o ligante indutor de apoptose relacionado ao fator de necrose tumoral da citocina apoptótica para induzir a morte das células do músculo liso. Circ Res 2007;100:834–841.
- Walsh S: Pré-eclâmpsia: Um desequilíbrio na produção placentária de prostaciclina e tromboxano. Am J Obstet Gynecol 1985;152:335.
- Roberts J, Taylor R, Musci T, et al: Pré-eclâmpsia: um distúrbio de células endoteliais. Am J Obstet Gynecol 1989;152:1200.
- Venkatesha S, Toporsian M, Lam C, et al: A endoglina solúvel contribui para a patogênese da pré-eclâmpsia. Nat Med 2006;12:642.
- Levine RJ, Karumanchi SA: Fatores angiogênicos circulantes na pré-eclâmpsia. Clin Obstet Gynecol 2005;48:372–386.
- Chesley L: Volumes de plasma e glóbulos vermelhos durante a gravidez. Am J Obstet Gynecol 1972:112:440.
- Rodgers R, Levin J: Uma reavaliação crítica do tempo de sangramento. Semin Thromb Hemost 1990:16:1–20.
- Abalos E, Duley L, Steyn DW, Henderson-Smart DJ: Terapia medicamentosa anti-hipertensiva para hipertensão leve a moderada durante a gravidez. Sistema de banco de dados Cochrane Rev 207;1:CD002252.
- Groenendijk R, Trimbos M, Wallenburg H: Medidas hemodinâmicas na pré-eclâmpsia: observações preliminares. Am J Obstet Gynecol 1984; 150:232.
- Aya AG, Vialles N, Tanoubi I, et al: Hipotensão induzida por raquianestesia: Uma comparação de risco entre pacientes com pré-eclâmpsia grave e mulheres saudáveis submetidas a parto cesáreo prematuro. Anesth Analg 2005;101: 869–875.
- Cotton D, Gonik B, Dorman K, Harris R: Alterações cardiovasculares na hipertensão grave induzida pela gravidez: Relação da pressão venosa central com a pressão capilar pulmonar. Am J Obstet Gynecol 1985;151:762.
- Hogg B, Hauth J, Caritis S, et al: Segurança do trabalho de parto anestesia peridural para mulheres com doença hipertensiva grave. Am J Obstet Gynecol 1999; 181: 1099.
- Newsome L, Bramwell R, Curling P: Efeitos hemodinâmicos da anestesia peridural lombar. Anesth Analg 1986;65:31.
- Jouppila P, Jouppila R, Hollmen A, Koivula A: Analgesia peridural lombar para melhorar o fluxo sanguíneo interviloso durante o trabalho de parto na pré-eclâmpsia grave. Obstet Gynecol 1982;52:158.
- Ramanathan J, Botorff M, Jeter J, et al: A farmacocinética e os efeitos maternos e neonatais da lidocaína epidural na pré-eclâmpsia. Anesth Analg 1986;65:120.
- Wallace D, Leveno KJ, Cunningham F, et al: Comparação randomizada de anestesia geral e regional para cesariana em gestações complicadas por pré-eclâmpsia grave. Obstet Gynecol 1995;86:193.
- Hood D, Curry R: Raquianestesia versus peridural para cesariana em pacientes com pré-eclâmpsia grave: uma pesquisa retrospectiva. Anestesiologia 1999;90:1276.
- Oyelese Y, Smulian JC: Placenta prévia, placenta acreta e vasa prévia. Obstet Gynecol 2006;107:927–941.
- Chestnut DH, Dewan D, Redick L, et al: Manejo anestésico para histerectomia obstétrica: um estudo multi-institucional. Anestesiologia 1989;70:607.
- Vincent RD Jr, Chestnut DH, Sipes SL, et al: A anestesia epidural piora o fluxo sanguíneo uterino e a oxigenação fetal durante a hemorragia em ovelhas grávidas. Anestesiologia 1992;76:799–806.
- Santos A, Tun E, Bobby P, et al: Os efeitos da bupivacaína, l-nitro-l-arginina-metil-éster e fenilefrina nas adaptações cardiovasculares à asfixia no cordeiro fetal prematuro. Anesth Analg 1997;84:1299.
- Morishima HO, Pedersen H, Santos AS, et al: Efeitos adversos da lidocaína administrada pela mãe no feto de cordeiro prematuro asfixiado. Anestesiologia 1989;71:110.
- Shnider SM, Webster G: Riscos maternos e fetais da cirurgia durante a gravidez. Am J Obstet Gynecol 1965; 92:891.
- Brodsky J, Cohen E, Brown BJ, et al: Cirurgia durante a gravidez e resultado fetal. Am J Obstet Gynecol 1980;138:1165.
- Smith B: Prognóstico fetal após anestesia durante a gestação. Anesth Analg 1963;42:521.
- Duncan P, Pope W, Cohen M, Greer N: Risco fetal de anestesia e cirurgia durante a gravidez. Anestesiologia 1986;64:790.
- Heinonen O, Slone O, Shapiro S: Defeitos congênitos e drogas na gravidez. Em defeitos congênitos e drogas na gravidez. Littleton, MA: Publishing Sciences Group, 1977, p. 516.
- Grabowski C, Paar J: Os efeitos teratogênicos de doses graduadas de hipóxia no embrião de galinha. Am J Anat 1958;103:313.
- Saxen I, Saxen L: Associação entre ingestão materna de diazepam e fissuras orais. Lancet 1975;2:498.
- Safra M, Oakley G: Associação entre fissura labial com ou sem fissura palatina e exposição pré-natal ao diazepam. Lancet 1975; 2:478.
- Shiono PH, Mills JL: Fissuras orais e uso de diazepam durante a gravidez. N Engl J Med 1984;311:919-920.
- Shepard TH: Catalogue of Teratogenic Agents, 7ª ed. Baltimore: Johns Hopkins University Press, 1992.
- Palanisamy A, Baxter MG, Keel PK, Xie Z, Crosby G, Culley DJ: Ratos expostos ao isoflurano in utero durante o início da gestação apresentam comportamento anormal quando adultos. Anestesiologia 2011;114:521–528.
- Sprung J, Fleich RP, Wilder RT, et al: Anestesia para cesariana e dificuldade de aprendizagem em uma coorte de nascimento de base populacional. Anestesiologia 2009;111:302–310.
- Adamsons K, Mueller-Heubach E, Myers R: Produção de asfixia fetal no macaco rhesus pela administração de catecolaminas à mãe. Am J Obstet Gynecol 1971;109:148.