Miguel A. Reina, Carlo D. Franco, Alberto Prats-Galino, Fabiola Machés, Andrés López e Jose A de Andrés
INTRODUÇÃO
Pesquisas recentes sobre a ultraestrutura do saco dural espinhal humano e seu conteúdo aumentaram nossa compreensão da microestrutura da dura-máter, camada aracnóide, aracnóide trabecular, pia-máter e manguitos da raiz nervosa. Este capítulo revisa conceitos novos e tradicionais sobre essas estruturas e discute suas possíveis implicações clínicas. A distribuição da gordura epidural e seu possível papel na disposição e cinética das injeções neuroaxiais também são discutidas.
SACO DURAL
O saco dural envolve a medula espinhal dentro da coluna vertebral. Separa o espaço epidural do espaço subaracnóideo, terminando na segunda vértebra sacral. De forma idealizada, o saco dural é cilíndrico, com espessura variando de cerca de 1 mm na região cervical e tornando-se gradativamente mais fino à medida que desce.Figuras 1 e 2). Na região lombar, a espessura do saco dural chega a 0.3 mm, embora as medidas tomadas em anteroposterior ou lateral possam variar um pouco mesmo no mesmo nível vertebral. A dura-máter é a camada mais externa do saco dural e é responsável por 90% de sua espessura total. Essa estrutura fibrosa, embora permeável, fornece proteção mecânica à medula espinhal e seus elementos neurais. Os 10% internos do saco dural são formados pela camada aracnoide, que é uma lâmina celular que adiciona pouca resistência mecânica extra.
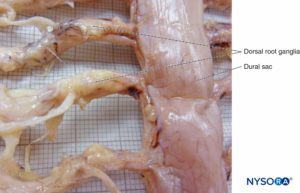
FIGURA 1. Saco dural humano. (Reproduzido com permissão de Reina MA, López García A, de Andrés JA, et al: Variação da espessura do saco dural. Rev Esp Anestesiol Reanim. 1999 Out;46(8):344-349.)
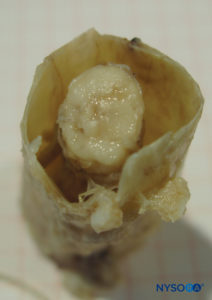
FIGURA 2. Saco dural humano e medula espinhal terminal. (Reproduzido com permissão de Reina MA, Pulido P, López A. El saco dural humano: Rev Arg Anestesiol. 2007; 65:167-184.)
DURA-MÁTER
Dura mater compreende aproximadamente 80 lâminas concêntricas (Figura 3). Cada lâmina dural tem uma espessura de aproximadamente 5 μm e consiste em lâminas mais finas contendo principalmente fibras de colágeno.Figuras 4 e 5). As fibras colágenas são orientadas em diferentes direções, mas sempre dentro do plano concêntrico da lâmina dural; portanto, eles não cruzam entre as lâminas. Cada fibra de colágeno tem uma superfície lisa e mede aproximadamente 0.1 μm.Figura 6). As fibras elásticas são menores, medindo 2 μm de diâmetro, e têm uma superfície mais rugosa que a das fibras colágenas.Figura 7).
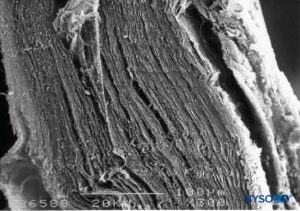
FIGURA 3. Espessura do saco dural. Microscopia eletrônica de varredura. Ampliação × 300. (Reproduzido com permissão de Reina MA, Dittmann M, López A, et al: Novas perspectivas na estrutura microscópica da dura-máter humana na região dorso lombar. Reg Anesth. 1997 Mar-Apr;22(2):161-166. )
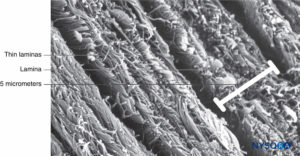
FIGURA 4. Espessura parcial do saco dural. Detalhes das lâminas durais. Microscopia eletrônica de varredura. Ampliação × 4,000. (Reproduzido com permissão de Reina MA, López A, Dittmann M, et al: Estrutura da espessura da dura-máter humana por microscopia eletrônica de varredura. Rev Esp Anestesiol Reanim. 1996 Apr;43(4):135-137.)
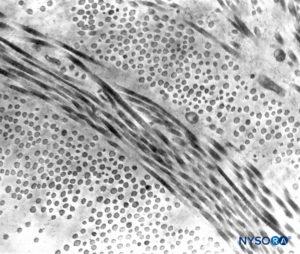
FIGURA 5. Espessura parcial do saco dural. Detalhes das lâminas durais. Microscopia eletrônica de transmissão. Ampliação × 20,000. (Reproduzido com permissão de Raj P: Textbook of Regional Anesthesia. Philadelphia: Churchill Livingstone; 2002.)
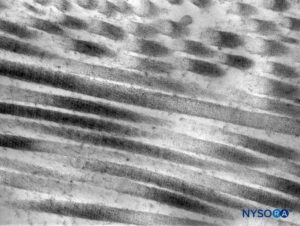
FIGURA 6. Fibras de colágeno na espessura do saco dural. Microscopia eletrônica de transmissão. Ampliação × 50,000. (Reproduzido com permissão de Raj P: Textbook of Regional Anesthesia. Philadelphia: Churchill Livingstone; 2002.)
Ao contrário da descrição clássica das fibras dentro das lâminas durais sendo dispostas longitudinalmente e paralelamente ao longo eixo da coluna vertebral, as fibras são, na verdade, distribuídas multidirecionalmente de forma aleatória dentro de cada uma das lâminas durais concêntricas.Figuras 8 para 10). Mastócitos e macrófagos também estão presentes na dura-máter.Figuras 11 e 12).
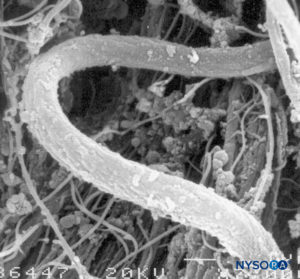
FIGURA 7. Fibras elásticas do saco dural. Microscopia eletrônica de varredura. Ampliação × 7000. (Reproduzido com permissão de Reina MA, López A, Dittmann M, et al: Superfície externa e interna da dura-máter humana por microscopia eletrônica de varredura. Rev Esp Anestesiol Reanim. 1996 Abr;43(4):130-4.)

FIGURA 8. Detalhe da superfície epidural do saco dural. Microscopia eletrônica de varredura. Ampliação × 6500. (Reproduzido com permissão de Dittmann M, Reina MA, López A: Neue ergebnisse bei der darstellung der dura mater Spinalis mittles rasterelektronenmikroskopie. Anaesthesist. 1998 May;47(5):409-413.)
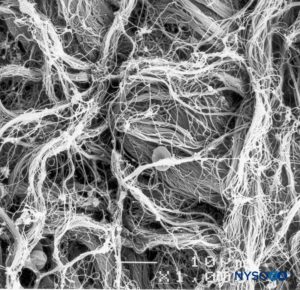
FIGURA 9. Detalhe da superfície epidural do saco dural. Microscopia eletrônica de varredura. Ampliação ×1000. (Reproduzido com permissão de Reina MA, López A, Dittmann M, et al: Superfície externa e interna da dura-máter humana por microscopia eletrônica de varredura. Rev Esp Anestesiol Reanim. 1996 Abr;43(4):130-4.)
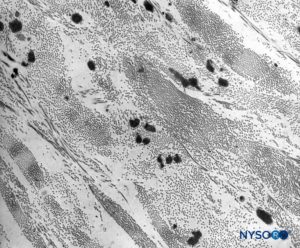
FIGURA 10. Colágeno e fibras elásticas na espessura do saco dural. Microscopia eletrônica de transmissão. Ampliação × 7,000. (Reproduzido com permissão de Raj P: Textbook of Regional Anesthesia. Philadelphia: Churchill Livingstone; 2002.)
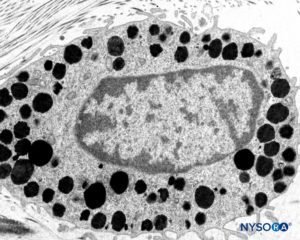
FIGURA 11. Mastócitos na espessura da dura-máter. Microscopia eletrônica de transmissão. Ampliação × 15,000. (Reproduzido com permissão de Reina MA, Pulido P, López A. El saco dural humano: Rev Arg Anestesiol. 2007;65:167-184.)
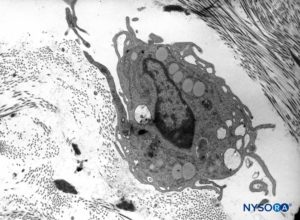
FIGURA 12. Macrófago na espessura da dura-máter. Microscopia eletrônica de transmissão. Ampliação × 7000. (Reproduzido com permissão de Raj P: Textbook of Regional Anesthesia. Philadelphia: Churchill Livingstone; 2002.)
CAMADA ARACNÓIDE
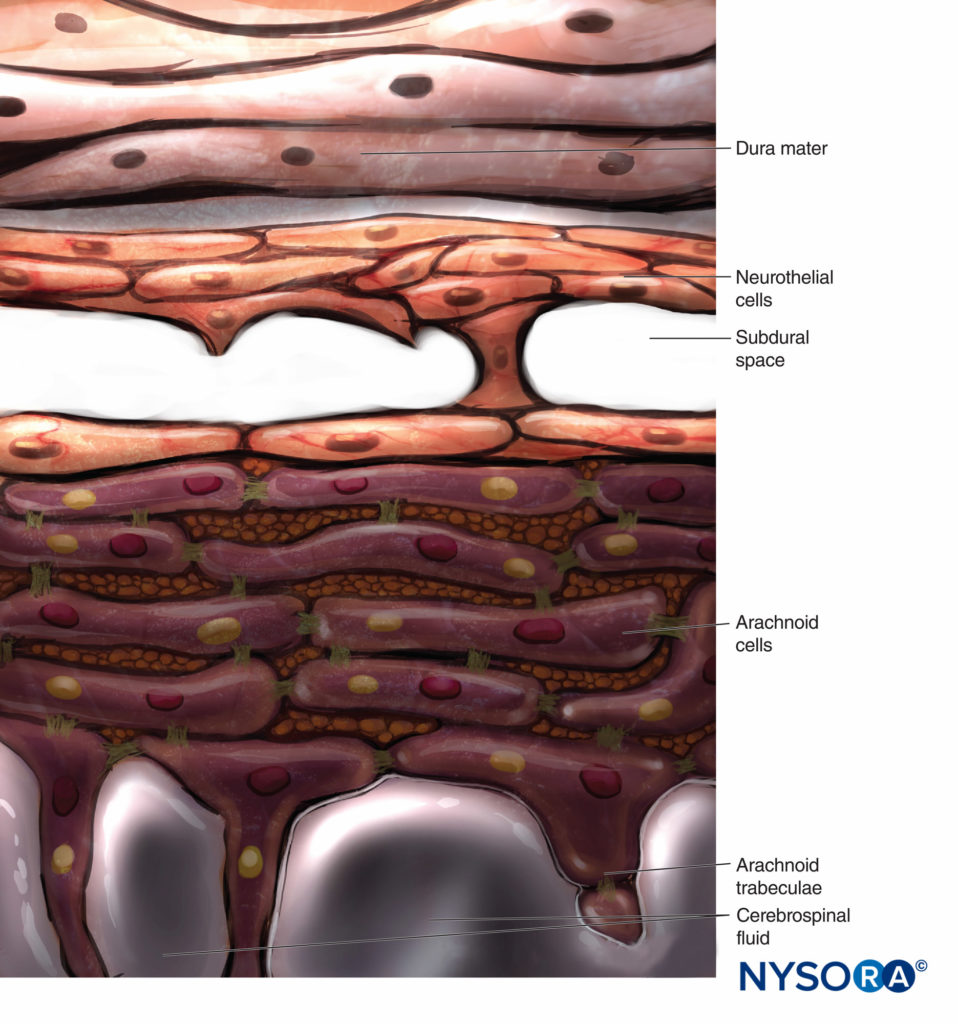
Convencionalmente, a camada aracnóide é descrita como uma membrana fina em contato próximo, mas não aderindo à superfície interna da dura-máter. Pesquisas recentes, no entanto, determinaram que não há espaço entre a dura-máter e a camada aracnóide (ver espaço subdural). A camada aracnoide é semipermeável e serve como barreira para limitar a passagem de substâncias através do saco dural.Figuras 13 e 14). Sua espessura é de cerca de 50-60 μm (Figuras 15 e 16). Em seu interior, as células aracnóides se unem fortemente por junções de membrana específicas com espessura de cerca de 10 a 15 μm. As fibras de colágeno no centro da camada aracnóide conferem resistência à lâmina e melhoram sua resistência mecânica. Células neuroteliais achatadas e alongadas ocupam a porção externa da camada. Rasgar a camada aracnóide expõe o espaço subdural. As células neuroteliais podem ser encontradas aderidas à superfície interna da dura-máter ou à superfície externa da camada aracnóide.Figura 17).
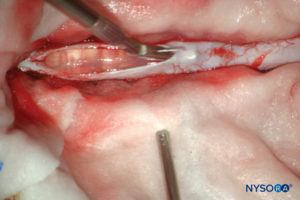
FIGURA 13. Dissecção do saco dural humano. (Reproduzido com permissão de Reina MA, Pulido P, López A. El saco dural humano. Rev Arg Anestesiol. 2007; 65:167-184.)
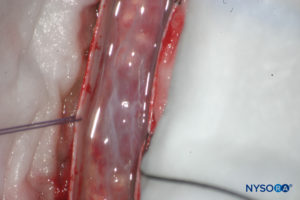
FIGURA 14. Dissecção do saco dural humano. A dura-máter é aberta; camada aracnóide é fechada. (Reproduzido com permissão de Reina MA, Pulido P, López A. El saco dural humano. Rev Arg Anestesiol. 2007; 65:167-184.)
BLOQUEIO NEURAXIAL E LESÕES DURAIS
A perfuração do saco dural durante um bloqueio subaracnóideo causa ruptura mecânica tanto da dura-máter quanto da camada aracnóide. A área da seção transversal do local da punção produzida por uma agulha de calibre 25 é semelhante, independentemente de a agulha ter ponta de lápis ou ponta cortante. No entanto, a morfologia da lesão varia de acordo com o desenho da ponta da agulha. Agulhas de ponta de lápis produzem uma lesão maior e de aparência mais áspera nas fibras durais, enquanto as agulhas cortantes produzem uma lesão em forma de U ou aba semelhante à tampa aberta de uma lata.Figuras 8 para 31).
Ao usar agulhas cortantes (bisel longo), a orientação do bisel (p. Figura 24). A lesão que a agulha produz no saco dural tem dois componentes, dural e aracnóide. Acredita-se que o componente aracnóide é vital para limitar o vazamento de líquido cefalorraquidiano do espaço subaracnóideo para o espaço epidural. Portanto, o tamanho e a morfologia das lesões aracnoides parecem ser mais importantes para o selamento laminar e fístula cefalorraquidiana do que o tamanho e a morfologia das lacerações durais.
Acredita-se que a incidência de cefaleia pós-punção dural (CPPD) seja afetada pelo tipo de agulha utilizada (ponta de lápis versus corte) e pelo bisel. A crença tradicional de que agulhas cortantes resultam em lesões durais maiores (lágrimas) foi estabelecida na década de 1940 e pode ter sido consequência das imperfeições no desenho das agulhas daquela época. As agulhas modernas, no entanto, produzem uma lesão ou retalho limpo em forma de U que se assemelha à tampa aberta de uma lata (ver Figura 24).
Após a retirada da agulha, o retalho em forma de U tende a retornar à sua posição original devido à pressão do líquido cefalorraquidiano e às propriedades elásticas da dura-máter. O orifício dural é quase completamente ocluído após aproximadamente 15 minutos. Por outro lado, as lesões produzidas por agulhas de ponta de lápis envolvem uma lesão mais complexa com rasgo, seccionamento e separação das fibras. A extensão da lesão dural causada por uma agulha depende de vários fatores, incluindo o diâmetro externo da agulha, mecanismos de vedação dural e aracnoide, design da ponta da agulha e qualidade da fabricação da agulha. Agulhas com o mesmo desenho de ponta, mas métodos de fabricação diferentes, podem não ter a mesma qualidade de superfície e podem conter microfraturas ou imperfeições, resultando em rasgos mais ou menos extensos da fibra dural e lesões residuais.
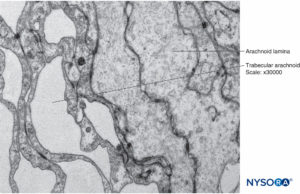
FIGURA 15. Células aracnóides na espessura da camada aracnóide. Microscopia eletrônica de transmissão. Ampliação × 40,000.
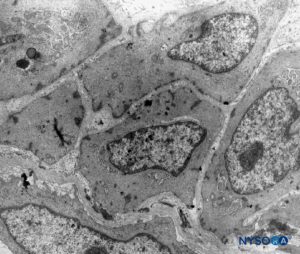
FIGURA 16. Células aracnóides na espessura da camada aracnóide. Microscopia eletrônica de transmissão. Ampliação × 4400. (Reproduzido com permissão de Raj P: Textbook of Regional Anesthesia. Philadelphia: Churchill Livingstone; 2002.)
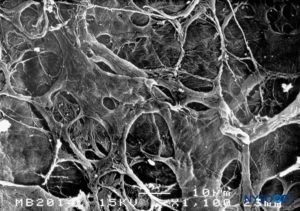
FIGURA 17. Superfície interna da dura-máter. Microscopia eletrônica de varredura. Ampliação × 1100. (Reproduzido com permissão de Reina MA, Dittmann M, López A, et al: Novas perspectivas na estrutura microscópica da dura-máter humana na região dorso lombar. Reg Anesth. 1997 Mar-Apr;22(2):161-166. )
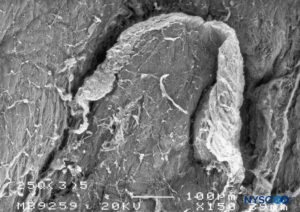
FIGURA 18. Lesão dura-aracnóidea produzida com agulha Quincke 25-G. Superfície epidural. Microscopia eletrônica de varredura. Ampliação × 150. (Reproduzido com permissão de Reina MA, Castedo J, López A, et al: Cefalea pospuncion dural: Ultraestructura de las lesões duráveis y usos de fusos de abuja em punciones madeireiras. Rev Arg Anesthesiol. 2008 Jan-Mar 66(1):6- 26)
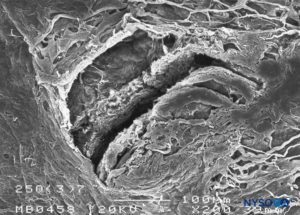
FIGURA 19. Lesão dura-aracnóidea produzida com agulha Quincke 25-G. Superfície aracnóide. Microscopia eletrônica de varredura. Ampliação × 200. (Reproduzido com permissão de Reina MA, Castedo J, López A. Cefalea pospunción dural: Ultraestructura de las lesiones durales y agujas espinales usadas en las punciones lombares. Rev Arg Anestesiol. 2008 Jan-Mar 66(1):6-26.)
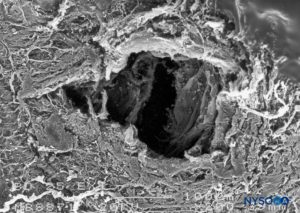
FIGURA 20. Lesão dura-aracnóidea produzida com agulha Whitacre 25 G. Superfície epidural. Microscopia eletrônica de varredura. Ampliação × 200. (Reproduzido com permissão de Reina MA, López-García A, de Andrés-Ibáñez JA, et al: Microscopia eletrônica das lesões produzidas na dura-máter humana pelas agulhas Quincke biseladas e Whitacre. Rev Esp Anestesiol Reanim. 1997 Fev;44( 2):56-61.)
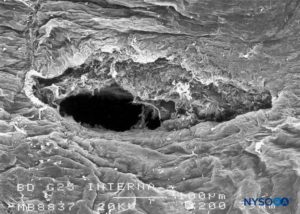
FIGURA 21. Lesão dura-aracnóidea produzida com agulha Whitacre 25 G. Superfície aracnóide. Microscopia eletrônica de varredura. Ampliação × 200. (Reproduzido com permissão de Reina MA, López-García A, de Andrés-Ibáñez JA, et al: Microscopia eletrônica das lesões produzidas na dura-máter humana pelas agulhas Quincke biseladas e Whitacre. Rev Esp Anestesiol Reanim. 1997 Fev;44( 2):56-61.)
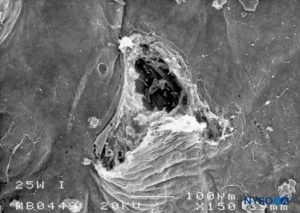
FIGURA 22. Lesão dura-aracnóidea produzida com agulha Whitacre 25 G. Superfície aracnóide. Microscopia eletrônica de varredura. Ampliação × 200. (Reproduzido com permissão de Reina MA, De Leon Casasola OA, et al: Um estudo in vitro de lesões durais produzidas por microscopia eletrônica de varredura. Reg Anesth Pain Med. 2000 Jul-Aug;25(4):393-402.)

FIGURA 23. Lesão dura-aracnóidea produzida com agulha Quincke 22-G. Superfície epidural. Microscopia eletrônica de varredura. Ampliação × 80. (Reproduzido com permissão de Reina MA, Castedo J, López A. Cefalea pospunción dural: Ultraestructura de las lesiones durales y agujas espinales usadas en las punciones lombares. Rev Arg Anestesiol. 2008 Jan-Mar 66(1):6-26.)
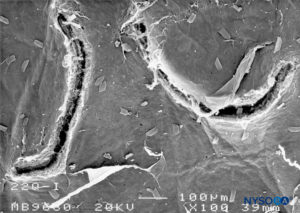
FIGURA 24. Lesão dura-aracnóidea produzida com agulha Quincke 22-G. Superfície aracnóide. Microscopia eletrônica de varredura. Ampliação × 100. (Reproduzido com permissão de Raj P: Textbook of Regional Anesthesia. Philadelphia: Churchill Livingstone; 2002.)
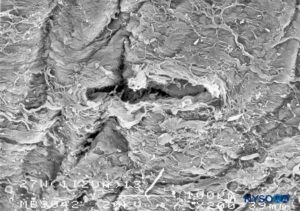
FIGURA 25. Lesão dura-aracnóidea produzida com agulha Whitacre 27 G. Superfície epidural. Microscopia eletrônica de varredura. Ampliação × 200. (Reproduzido com permissão de Reina MA, Castedo J, López A. Cefalea pospunción dural: Ultraestructura de las lesiones durales y agujas espinales usadas en las punciones lombares. Rev Arg Anestesiol. 2008 Jan-Mar 66(1):6-26.)
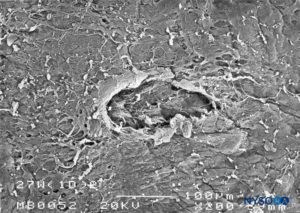
FIGURA 26. Lesão dura-aracnóidea produzida com agulha Whitacre 27 G. Superfície epidural. Microscopia eletrônica de varredura. Ampliação × 200. (Reproduzido com permissão de Reina MA, Castedo J, López A. Cefalea pospunción dural: Ultraestructura de las lesiones durales y agujas espinales usadas en las punciones lombares. Rev Arg Anestesiol. 2008 Jan-Mar 66(1):6-26.)
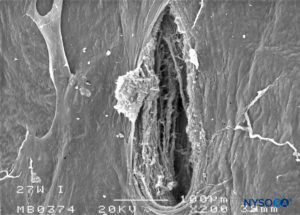
FIGURA 27. Lesão dura-aracnóidea produzida com agulha Whitacre 27 G. Superfície aracnóide. Microscopia eletrônica de varredura. Ampliação × 200. (Reproduzido com permissão de Reina MA, Castedo J, López A. Cefalea pospunción dural: Ultraestructura de las lesiones durales y agujas espinales usadas en las punciones lombares. Rev Arg Anestesiol. 2008 Jan-Mar 66(1):6-26.)
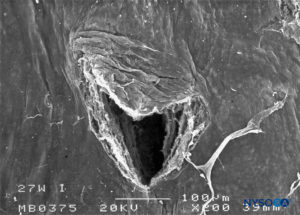
FIGURA 28. Lesão dura-aracnóidea produzida com agulha Whitacre 27 G. Superfície aracnóide. Microscopia eletrônica de varredura. Ampliação × 200. (Reproduzido com permissão de Reina MA, Castedo J, López A. Cefalea pospunción dural: Ultraestructura de las lesiones durales y agujas espinales usadas en las punciones lombares. Rev Arg Anestesiol. 2008 Jan-Mar 66(1):6-26.)
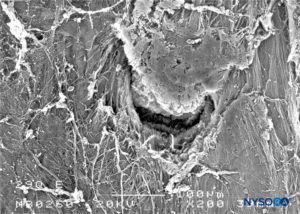
FIGURA 29. Lesão dura-aracnóidea produzida com agulha Quincke 29-G. Superfície epidural. Microscopia eletrônica de varredura. Ampliação × 200. (Reproduzido com permissão de Reina MA, Castedo J, López A. Cefalea pospunción dural: Ultraestructura de las lesiones durales y agujas espinales usadas en las punciones lombares. Rev Arg Anestesiol. 2008 Jan-Mar 66(1):6-26.)
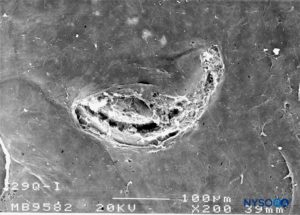
FIGURA 30. Lesão dura-aracnóidea produzida com agulha Quincke 29-G. Superfície aracnóide. Microscopia eletrônica de varredura. Ampliação × 200. (Reproduzido com permissão de Reina MA, Castedo J, López A. Cefalea pospunción dural: Ultraestructura de las lesões durais e agujas espinais usadas nas punções lombares. Rev Arg Anestesiol. 2008 Jan-Mar 66(1):6-26.
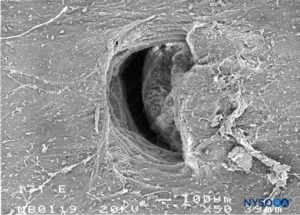
FIGURA 31. Lesão dura-aracnóidea produzida com agulha Tuohy 17G. Superfície aracnóide. Microscopia eletrônica de varredura. Ampliação ×50. (Reproduzido com permissão de Reina MA, Castedo J, López A. Cefalea pospunción dural: Ultraestructura de las lesiones durales y agujas espinales usadas en las punciones lombares. Rev Arg Anestesiol. 2008 Jan-Mar 66(1):6-26.)
A deformação da agulha espinhal causada por contatos com ossos vertebrais ou outras estruturas resistentes durante o procedimento neuroaxial também pode aumentar o tamanho da lesão dural. A introdução iatrogênica de fragmentos de pele no espaço subaracnóideo também pode ocorrer.
DOR DE CABEÇA PÓS-PUNÇÃO E TIPO DE AGULHAS
A etiologia da CPPD é multifatorial. Enquanto o capítulo específico sobre CPPD se concentra na fisiopatologia, prevenção e tratamento, esta seção se concentra em fatores anatômicos e relacionados a equipamentos que podem influenciar a ocorrência e gravidade da CPPD. Inicialmente, pensava-se que as agulhas de ponta de lápis resultavam em perfurações menos traumáticas do saco dural. À medida que a morfologia das lesões durais se tornou mais conhecida, outras explicações foram propostas. Estudos microscópicos de lesões produzidas por agulhas espinhais mostraram que as agulhas de ponta de lápis produzem uma lesão do tipo “explosão” com danos extensos nas fibras. No entanto, o aumento do rasgo das fibras produzido pelas agulhas de ponta de lápis pode promover maior resposta inflamatória nas bordas da lesão que, paradoxalmente, resulta em oclusão mais precoce e menor incidência de CPPD. Agulhas cortantes, por outro lado, produzem um rasgo “mais limpo” da dura-máter com menor resposta inflamatória que resulta em retardo no selamento da punção, o que pode aumentar a incidência de cefaleia espinhal.
Uma ponta de agulha embotada após colidir contra o osso pode causar mais danos às fibras. A deformação da ponta depende do ângulo de colisão e da força aplicada. As agulhas de corte são especialmente suscetíveis à deformação da ponta da agulha após colidir contra o osso, ao contrário das agulhas de ponta de lápis. No entanto, como os estudos de CPPD geralmente envolvem muitos anestesistas e diferentes técnicas, o impacto definitivo da deformação da agulha na CPPD é difícil de estudar e, neste momento, permanece apenas hipotético.
Como mencionado, a lesão dural produzida pela agulha espinhal tem dois componentes, uma lesão da dura-máter e uma lesão da camada aracnoide. Embora o componente externo ou dural do saco forneça resistência mecânica, ele não é elástico o suficiente para evitar o vazamento de líquido cefalorraquidiano. Em contraste, a lesão interna ou aracnoide pode se retrair para fechar o defeito criado pela introdução da agulha no espaço subaracnóideo e evitar o vazamento de líquido cefalorraquidiano. Como o componente aracnóide é provavelmente mais importante na fisiopatologia da CPPD do que a própria dura-máter, essas lesões devem ser chamadas de lesões dura-aracnóideas.
ARACNÓIDE TRABECULAR
A aracnóide-máter consiste em duas camadas, a aracnóide trabecular e a aracnóide. A aracnóide trabecular funde-se com o plano celular da pia-máter e emite projeções para todas as estruturas que atravessam o espaço subaracnóideo, incluindo vasos sanguíneos e raízes nervosas. As projeções que cobrem as raízes nervosas são chamadas de bainhas aracnóides.Figuras 32 para 40).
Durante o movimento, essas bainhas estabilizam e evitam movimentos excessivos das raízes nervosas dentro do saco dural. No entanto, as bainhas conferem pouca proteção mecânica contra traumas. As características das bainhas aracnóides na cauda equina são variáveis; alguns são frouxos, enquanto outros são formados por planos sobrepostos dos mesmos componentes com uma aparência mais compacta. A espessura de uma bainha aracnóide varia de 10 a 60 μm. Em alguns casos, uma ou mais raízes nervosas são envoltas por uma única bainha aracnoide e, em outros, a raiz nervosa não possui nenhuma bainha.
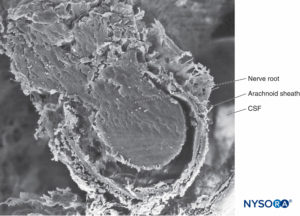
FIGURA 32. Camada trabecular aracnoide. As projeções da aracnóide trabecular que cobrem as raízes nervosas são chamadas de bainhas aracnóides. LCR = líquido cefalorraquidiano. Microscopia eletrônica de varredura. Ampliação × 100. (Reproduzido com permissão de Reina MA, López A, De Andrés JA: Hipótese sobre as bases anatômicas da síndrome da cauda equina e irritação transitória da raiz nervosa após raquianestesia. Rev Esp Anestesiol Reanim. 1999 Mar;46(3):99-105. )
BAINHAS ARACNÓIDES DE RAÍZES NERVOSAS E SEU PAPEL POTENCIAL NAS LESÕES NERVOSAS
Alguns casos de síndrome da cauda equina e síndrome neurológica transitória podem ser explicados pela existência de bainhas aracnóides ao redor das raízes nervosas dentro do saco dural e pelo fato de agulhas ou (micro)cateteres poderem ser inseridos nelas. Uma solução anestésica acidentalmente injetada na bainha aracnoide de um nervo espinhal pode não ser diluída pelo líquido cefalorraquidiano circundante, expondo assim a raiz nervosa a uma concentração anestésica maior do que a esperada. Consequentemente, a concentração do anestésico local pode ser muito maior (por exemplo, 20 a 25 vezes) em comparação com a concentração do anestésico no restante do saco dural.
Essa alta concentração de anestésico local dentro da bainha aracnoide pode ter efeitos deletérios nas raízes nervosas, ao contrário de uma injeção típica da mesma solução anestésica dentro do saco dural, mas fora da bainha aracnoide. Como leva tempo para estabelecer o equilíbrio dentro e fora da bainha, uma lesão nervosa pode se desenvolver sem trauma direto com agulha. As injeções de anestésico local através de um microcateter nessas bainhas aracnoides podem ser mais devastadoras do que uma única injeção. Isso ocorre porque a injeção de um único grande volume acabaria sendo diluída por vazamento fora da bainha, enquanto doses repetidas de pequenos volumes podem ter maior probabilidade de levar à neurotoxicidade devido à exposição contínua ou repetida a uma alta concentração de anestésicos locais. A síndrome de irritação transitória da raiz e a síndrome da cauda equina podem refletir diferentes graus de dano nervoso relacionado à concentração do anestésico local e à duração da exposição. A injeção de anestésico local dentro de bainhas aracnoides em áreas próximas à medula espinhal ou ao cone medular pode afetar várias raízes nervosas, enquanto a injeção em áreas mais distais pode afetar raízes nervosas únicas.

FIGURA 33. Camada trabecular aracnóide. Detalhe das bainhas aracnóides. LCR = líquido cefalorraquidiano. Microscopia eletrônica de varredura. Ampliação x500. (Reproduzido com permissão de Raj P: Textbook of Regional Anesthesia. Philadelphia: Churchill Livingstone; 2002.)
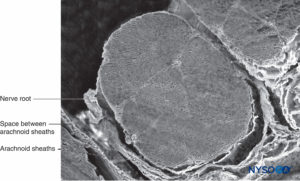
FIGURA 34. Raiz nervosa e bainha aracnoide. Microscopia eletrônica de varredura. Ampliação ×60. (Reproduzido com permissão de Torres LM: Textbook of Anesthesia and Pain Management. Aran Ed; 2001.)
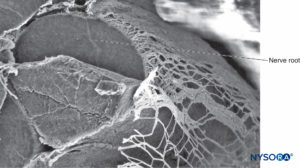
FIGURA 35. Raiz nervosa e bainha aracnoide. Microscopia eletrônica de varredura. Ampliação ×80. (Reproduzido com permissão de Reina MA, Villanueva MC, López A: Aracnoides trabecular, piamadre espinal humana y anestesia subaracnoidea, Rev Arg Anestesiol 2008;66: 111–133.)
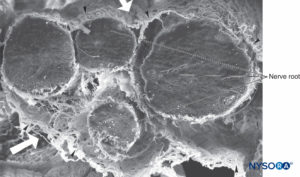
FIGURA 36. Raiz de quatro nervos e suas bainhas aracnóides. Microscopia eletrônica de varredura. Ampliação × 100. (Reproduzido com permissão de Reina MA, López A, De Andrés JA: Hipótese sobre as bases anatômicas da síndrome da cauda equina e irritação transitória da raiz nervosa após raquianestesia. Rev Esp Anestesiol Reanim. 1999 Mar;46(3):99-105. )

FIGURA 37. Medula espinhal humana e camada trabecular aracnóide. LCR = líquido cefalorraquidiano. Microscopia eletrônica de varredura. Ampliação ×40. (Reproduzido com permissão de Reina MA, Machés F, López A, et al: A ultraestrutura da aracnóide espinhal em humanos e seu impacto na raquianestesia, síndrome da cauda equina e síndrome neurológica transitória. Tech Reg Anesth Pain Management. 2008 julho; 12(3):153-160.)
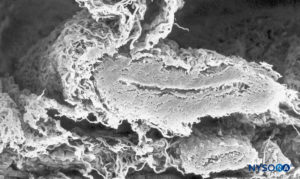
FIGURA 38. Vaso subaracnóideo e camada trabecular aracnoide. Microscopia eletrônica de varredura. Ampliação × 120. (Reproduzido com permissão de Raj P: Textbook of Regional Anesthesia. Philadelphia: Churchill Livingstone; 2002.)
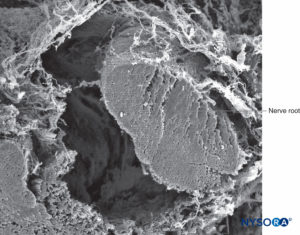
FIGURA 39. Raiz nervosa e bainha aracnoide. Microscopia eletrônica de varredura. Ampliação ×100. (Reproduzido com permissão de Torres LM: Textbook of Anesthesia and Pain Management. Aran Ed; 2001.)
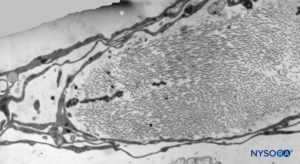
FIGURA 40. Detalhe da camada trabecular aracnóide. Microscopia eletrônica de transmissão. Ampliação × 5000. (Reproduzido com permissão de Reina MA, Villanueva MC, López A: Aracnoides trabecular, piamadre espinal humana y anestesia subaracnoidea. Rev Arg Anestesiol. 2008;66:111–133.)
PIA MATER
A estrutura da pia-máter inclui uma camada celular e um compartimento subpial (Figuras 41 e 42). A camada celular consiste em células piais planas e sobrepostas com uma aparência lisa e brilhante.Figura 43). Sua espessura é de 3 a 5 células pial (10-15 μm) no nível medular (Figuras 44 para 46) e 2 a 3 células (3–4 μm) ao nível da raiz nervosa. A substância fundamental amorfa é encontrada ao redor das células piais, e as células medem em média 0.5–1 μm.
O compartimento subpial possui grande quantidade de fibras colágenas, substância fundamental amorfa, fibroblastos e um pequeno número de macrófagos e vasos sanguíneos. O compartimento subpial é encerrado entre a camada celular pial e uma membrana basal em contato com as células neurogliais.
O compartimento subpial das vértebras torácicas baixas tem uma espessura de 130-200 μm; aqui, as variações nas medidas são mais significativas do que na camada celular pial (ver Figuras 41 e 42). Ao nível do cone medular, a espessura da pia-máter é reduzida para 80–100 μm; sua espessura continua a diminuir para apenas 50-60 μm nas origens da cauda equina. Ao nível da raiz nervosa, a espessura do compartimento subpial é de 10-12 μm.
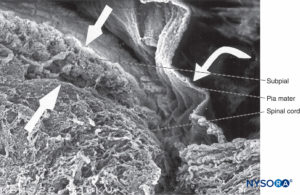
FIGURA 41. Pia-máter humana e medula espinhal. Microscopia eletrônica de varredura. Ampliação × 70. (Reproduzido com permissão de Reina MA, De Leon Casasola O, et al: Achados ultraestruturais na pia-máter espinhal humana em relação à anestesia subaracnóidea. Anesth Analg. 2004 May;98(5):1479-1485.)
Ao nível do cone medular, há perfurações ou fenestrações circulares, ovóides ou elípticas sobre toda a superfície da camada celular da pia-máter (Figuras 47 para 49). Embora o tamanho dessas fenestrações varie, a maioria mede 12–15 μm de comprimento e 4–8 μm de largura. Ao nível da raiz nervosa, a pia-máter mostra fenestrações semelhantes, mas tamanho menor (1-4 μm) (Figura 50). Numerosos macrófagos circundam as células pial. Os macrófagos diferem das células pial por não possuírem longos processos citoplasmáticos, contendo inclusões ligadas à membrana e um número variável de vacúolos, especialmente nas áreas periféricas de seu citoplasma. Os macrófagos e outras células inflamatórias observadas dentro da pia-máter podem se originar de vasos sanguíneos subpiais e subaracnóideos ou de células piais imaturas como resultado de um estímulo desconhecido. As fenestrações encontradas na pia-máter parecem estar associadas à migração de algumas células piais imaturas como parte de uma resposta inflamatória.
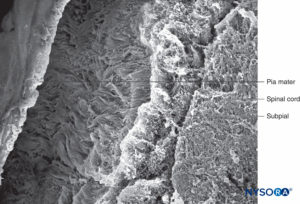
FIGURA 42. Pia-máter humana e compartimento subpial. Microscopia eletrônica de varredura. Ampliação × 100. (Reproduzido com permissão de Raj P: Textbook of Regional Anesthesia. Philadelphia: Churchill Livingstone; 2002.)

FIGURA 43. Detalhe da pia mater. Microscopia eletrônica de varredura. Ampliação × 500. (Reproduzido com permissão de Reina MA, Wikinski J, De Andrés JA: Una rara complicación de la anestesia epidural y subaracnoidea. Tumores epidermoideos espinales iatrogénicos. Rev Arg Anestesiol. 2008;66:319-336.)
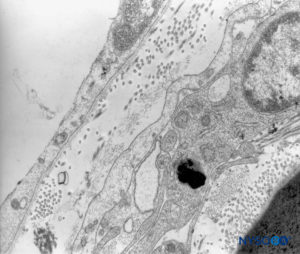
FIGURA 44. Pia-máter humana. Detalhe das células pial. Microscopia eletrônica de transmissão. Ampliação × 12,000. (Reproduzido com permissão de Reina MA, Wikinski J, De Andrés JA: Una rara complicación de la anestesia epidural y subaracnoidea. Tumores epidermoideos espinales iatrogénicos. Rev Arg Anestesiol. 2008;66:319-336.)
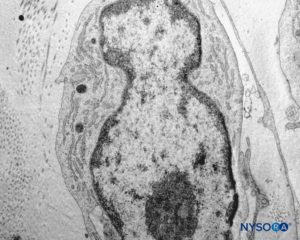
FIGURA 45. Detalhe das células pial. Microscopia eletrônica de transmissão. Ampliação × 12,000. (Reproduzido com permissão de Reina MA, Wikinski J, De Andrés JA: Una rara complicación de la anestesia epidural y subaracnoidea. Tumores epidermoideos espinales iatrogénicos. Rev Arg Anestesiol. 2008;66:319-336.)
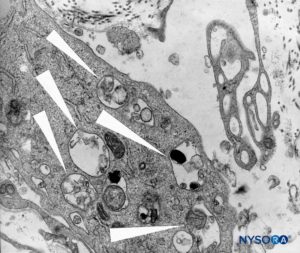
FIGURA 46. Detalhe das células macrofágicas na pia-máter espinhal. Microscopia eletrônica de transmissão. Ampliação × 12,000. (Reproduzido com permissão de Reina MA, Wikinski J, De Andrés JA: Una rara complicación de la anestesia epidural y subaracnoidea. Tumores epidermoideos espinales iatrogénicos. Rev Arg Anestesiol. 2008;66:319-336.)
LIGAMENTOS DO SACO DURAL
O espaço epidural contém formações fibrosas que cruzam e ancoram o saco dural ao canal vertebral. Essas formações de tecido conjuntivo são chamadas de ligamentos meningovertebrais anterior, lateral e posterior.Figuras 51 e 52). O ligamento meningovertebral anterior, que conecta o saco dural ao ligamento longitudinal posterior da coluna, é mais compacto. Em alguns pacientes, retalhos fibrosos que fixam o saco dural ao ligamento longitudinal posterior podem dividir incompletamente o espaço peridural anterior. Os ligamentos anteriores estendem-se de C7 a L5 com orientação craniocaudal e adquirem orientação transversal no nível torácico T8-9. O comprimento desses ligamentos varia de cerca de 0.5 a 29 mm. No canal sacral, os ligamentos engrossam para formar um septo medial perfurado, o “ligamento sacral anterior de Trolard”. O ligamento meningovertebral lateral e o ligamento meningovertebral posterior (“Giorda-lengo”) são mais finos e não afetam a circulação de fluidos injetados no espaço epidural. A “plica mediana dorsalis” é uma estrutura fibrosa longitudinal e descontínua que pode ser encontrada na região sagital mediana ao longo do espaço peridural posterior, principalmente na região lombar.
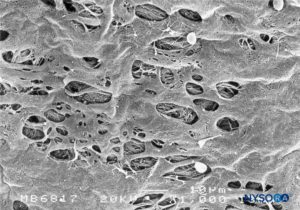
FIGURA 47. Fenestrações na pia-máter humana do cone medular. Microscopia eletrônica de varredura. Ampliação ×1000. (Reproduzido com permissão de Reina MA, López García A, de Andrés JA: Descrição anatômica de uma perfuração natural presente na pia-máter lombar humana. Rev Esp Anestesiol Reanim. 1998;45:4-7.)
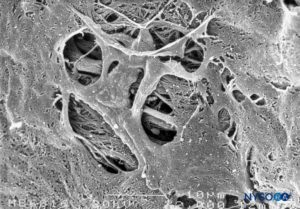
FIGURA 48. Fenestrações na pia-máter humana do cone medular. Microscopia eletrônica de varredura. Ampliação ×2000. (Reproduzido com permissão de Reina MA, López García A, de Andrés JA: Descrição anatômica de uma perfuração natural presente na pia-máter lombar humana. Rev Esp Anestesiol Reanim. 1998;45:4-7.)
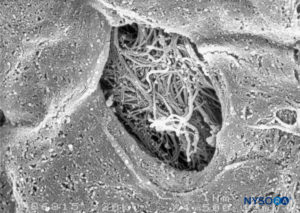
FIGURA 49. Detalhe da fenestração em pia-máter humana. Microscopia eletrônica de varredura. Ampliação × 1500. (Reproduzido com permissão de Reina MA, López García A, de Andrés JA: Descrição anatômica de uma perfuração natural presente na pia-máter lombar humana. Rev Esp Anestesiol Reanim. 1998;45:4-7.)
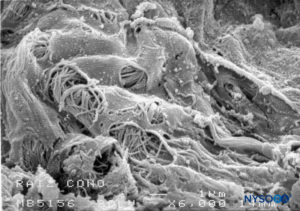
FIGURA 50. Fenestrações em pia-máter humana de raiz nervosa. Microscopia eletrônica de varredura. Ampliação ×6000. (Reproduzido com permissão de Reina MA, Villanueva MC, López A: Aracnoides trabecular, piamadre espinal humana y anestesia subaracnoidea. Rev Arg Anestesiol. 2008;66:111–133.)
GORDURA EPIDURAL
A gordura epidural se estende lateralmente em direção ao local onde as facetas articulares e o ligamento amarelo se encontram. Localizada entre os arcos vertebrais e os forames intervertebrais, a gordura envolve as raízes nervosas dentro das mangas durais, mas sem aderir a elas. Isso permite o deslocamento da dura dentro do canal vertebral durante a flexão/extensão. A gordura epidural adere na linha média posteriormente por um pedículo vascular em um ponto onde as porções direita e esquerda do ligamento amarelo se encontram. A quantidade de gordura peridural posterior aumenta caudalmente, de L1–2 a L4–5, podendo chegar a 16–25 mm. Sua largura também aumenta na direção craniocaudal de 6 mm no interespaço L1-2 para 13 mm no interespaço L4-5. O pedículo da gordura epidural posterior corresponde topograficamente com a plica mediana dorsalis.
Os depósitos de gordura epidural estão em contato com a superfície posterior do saco dural e a lâmina vertebral, mas aderem apenas ao pedículo vascular. Em relação à posterior, a gordura epidural é homogênea e não é separada por septos fibrosos; lateralmente, a gordura epidural aparece dividida. Às vezes, um plano septal se estende entre a saída da raiz nervosa na lâmina vertebral e o ligamento longitudinal posterior. Olhando para o anterior, a dura-máter se une ao canal vertebral na altura dos discos. É nesta região epidural anterior que se encontram os vasos venosos anteriores.
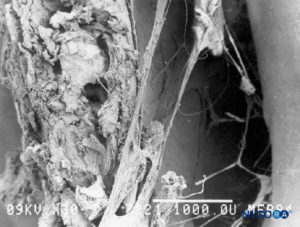
FIGURA 51. Espaço peridural. Formações fibrosas que atravessam o espaço epidural. Microscopia eletrônica de varredura. Ampliação ×30. (Reproduzido com permissão de Reina MA, Pulido P, López A. El saco dural humano. Rev Arg Anestesiol. 2007;65:167-184.)
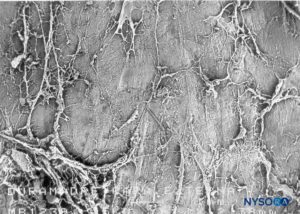
FIGURA 51. Espaço peridural. Formações fibrosas que atravessam o espaço epidural. Microscopia eletrônica de varredura. Ampliação ×30. (Reproduzido com permissão de Reina MA, Pulido P, López A. El saco dural humano. Rev Arg Anestesiol. 2007;65:167-184.)
CARACTERÍSTICAS DA GORDURA EPIDURAL NAS REGIÕES CERVICAL, TORÁCICA, LOMBAR E SACRAL
A distribuição da gordura epidural é variável ao longo do canal espinhal, mas tende a ser mais consistente em diferentes níveis vertebrais. Por exemplo, no nível cervical, o tecido adiposo está ausente ou quase inexistente e, às vezes, forma um pequeno depósito posterior visto em cortes axiais de ressonância magnética (C7 a T1), com aumento da intensidade de sinal nas sequências ponderadas em T1. A gordura epidural geralmente não é encontrada nas regiões anterior e lateral. No nível torácico, a gordura epidural forma uma ampla faixa posterior com “reentrâncias”. Essa faixa é mais espessa ao redor do espaço intervertebral e ao redor do disco intervertebral, tornando-se mais fina ao nível dos corpos vertebrais e próximo à base dos processos espinhais de cada vértebra. Na região torácica média-superior (T1-7), a gordura epidural segue um padrão contínuo com reentrâncias mais evidentes, enquanto na região torácica inferior (T8-12) a gordura epidural torna-se descontínua.
Ao nível lombar, a gordura peridural nos espaços peridural anterior e posterior permanece separada. A gordura epidural posterior é mais proeminente ao redor dos discos de L3-4 e L4-5. Em alguns pacientes, a gordura epidural posterior é em forma de cone, com o ápice localizado na parte posterior. A espessura da gordura epidural na zona lombar inferior ocupa cerca de 32% do diâmetro transversal do canal vertebral. Abaixo de L4-5, o saco dural termina e o canal sacral começa. Aqui, as raízes nervosas são envolvidas por mangas durais, e a gordura epidural é o principal componente dentro das mangas.
A morfologia e distribuição da gordura epidural podem ser alteradas em condições patológicas. A lipomatose epidural, por exemplo, é caracterizada pelo aumento do volume de gordura epidural. Depósitos excessivos de gordura ao redor do saco dural podem causar compressão da medula espinhal ou da raiz nervosa, levando a sintomas neurológicos. Na cifoescoliose, a gordura epidural é distribuída de forma assimétrica e o tecido adiposo predomina na porção côncava da curvatura, enquanto a medula espinhal é deslocada contra o arco vertebral. Em pacientes com estenose do canal espinhal, a gordura epidural é caracteristicamente ausente ou marcadamente reduzida ao redor da zona estenótica.
GORDURA EPIDURAL E FARMACOCINÉTICA DOS INJETOS EPDIURAIS
A distribuição da gordura peridural no canal vertebral lombar é desigual, sendo mais abundante na região dorsal do que nas regiões ventral e lateral. A quantidade total, distribuição e morfologia da gordura no espaço epidural e nos manguitos das raízes nervosas afetam a difusão de substâncias através desses compartimentos.
Alterações na quantidade de gordura peridural durante processos patológicos podem alterar a absorção de fármacos durante o bloqueio peridural. No entanto, mesmo na ausência de processos patológicos, variações locais na quantidade de gordura no canal espinhal lombar podem alterar a cinética da droga. É possível que variações na distância entre a gordura e os tecidos nervosos vizinhos afetem a disposição das drogas injetadas e a cinética das drogas lipofílicas. Atualmente, no entanto, o impacto da ultraestrutura dos manguitos epidural e da raiz nervosa na cinética da droga durante a injeção epidural permanece incerto.
ESPAÇO SUBDURAL
Em contraste com a descrição clássica de um “espaço subdural” entre a dura-máter e a aracnóide dorsal, estudos têm demonstrado a presença de um tecido sólido, porém delicado, composto por células neuroteliais especializadas.Figura 53). As células neuroteliais também são chamadas de células da borda dural. Essas células alongadas e fusiformes com extensões ramificadas são frágeis e pouco coesas entre si.Figuras 54 e 55). As junções intercelulares entre as células neuroteliais são mais suscetíveis à ruptura, e fragmentos celulares podem ser vistos ao lado de células neuroteliais rasgadas.Figuras 56 e 57). Quando a ruptura ocorre ao longo do compartimento subdural, pequenas fissuras se fundem em maiores. Forças coesivas fracas entre as células neuroteliais e a falta de fibras colágenas facilitam o alargamento de uma fissura, produzindo a impressão de um espaço subdural. Assim, o espaço subdural clássico parece ser um artefato iatrogênico.
O estudo da estrutura do compartimento subdural pode esclarecer a origem dos hematomas subdurais cranianos e espinhais associados à hipotensão do líquido cefalorraquidiano.
O bloqueio anestésico subdural, causado pela injeção inadvertida de anestésico local parcial ou totalmente entre a dura-máter e a aracnóide, resulta em anestesia raquidiana ou peridural altamente imprevisível e complicações devido a um bloqueio de alto nível imprevisto. A dissecção das junções intercelulares fracas entre as células neuroteliais pode permitir que os fluidos injetados se acumulem no espaço subdural. A extensão do bloqueio subdural é imprevisível, pois depende do volume de anestésico local injetado e da natureza da dissecção (cefálica ou circunferencial). Se a dissecção for principalmente cefálica, apenas alguns mililitros de solução anestésica podem bloquear os sintomas cardiorrespiratórios.
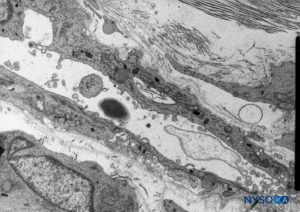
FIGURA 53. Células neuroteliais no compartimento subdural. Microscopia eletrônica de transmissão. Ampliação × 5000. (Reproduzido com permissão de Reina MA, De León Casasola OA, et al: A origem do espaço subdural espinhal. Achado de ultraestrutura. Anesth Analg. 2002 Apr;94(4):991-995.)

FIGURA 54. Células neuroteliais no compartimento subdural. Microscopia eletrônica de varredura. Ampliação × 3000. (Reproduzido com permissão de Reina MA, De León Casasola OA, et al: A origem do espaço subdural espinhal. Achado de ultraestrutura. Anesth Analg. 2002 Apr;94(4):991-995.)
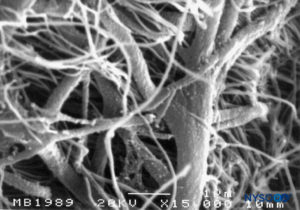
FIGURA 54. Células neuroteliais no compartimento subdural. Microscopia eletrônica de varredura. Ampliação × 3000. (Reproduzido com permissão de Reina MA, De León Casasola OA, et al: A origem do espaço subdural espinhal. Achado de ultraestrutura. Anesth Analg. 2002 Apr;94(4):991-995.)
MANGUEIRAS DE RAIZ NERVOSA
As projeções bilaterais do saco dural (matéria) sobre as raízes nervosas formam os manguitos das raízes nervosas ou mangas durais.Figura 58). Extensões laterais da dura-máter e da camada aracnoide circundam as raízes nervosas à medida que saem do canal vertebral. O saco dural pode conter uma certa quantidade de líquido cefalorraquidiano ao redor da raiz nervosa. Os manguitos da raiz nervosa (mangas) têm componentes celulares internos e fibrilares externos (Figura 59). As células leptomeníngeas, de natureza semelhante às células aracnóides ou piais, formam o componente celular dos manguitos radiculares. Essas células são alongadas, mais largas ao redor do núcleo, estratificadas e orientadas longitudinalmente ao eixo da raiz nervosa.Figura 60).
No nível pré-ganglionar, o componente celular de um manguito radicular tem 5.8–13 μm de espessura. Essas células possuem prolongamentos citoplasmáticos que invadem as células vizinhas, deixando pouco espaço extracelular. As uniões entre as membranas celulares são do tipo desmossoma e têm junções apertadas (Figura 61). As células contêm mitocôndrias em seu citoplasma e retículo endoplasmático rugoso. Cada célula tem cerca de 0.15-0.8 μm de espessura em ambas as extremidades e 2.2-4.9 μm no núcleo. O componente celular está disposto em duas camadas concêntricas mantidas separadas por fibras de colágeno.
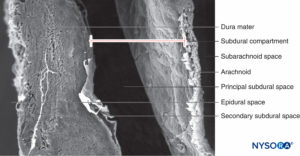
FIGURA 56. Espaço subdural humano nas meninges lombares. Microscopia eletrônica de varredura. Ampliação × 180. (Reproduzido com permissão de Reina MA, López A, De Andrés JA, Villanueva MC, Cortés L: O espaço subdural existe? Rev Esp Anestesiol Reanim. 1998 Nov;45(9):367-376.)
FIGURA 58. Manguito de raiz nervosa humana. (Reproduzido com permissão de Reina MA, Villanueva MC, López A, et al: Gordura dentro da bainha dural de raízes nervosas lombares em humanos. Rev Esp Anestesiol Reanim. 2007 May;54(5):297-301.)
No nível pós-gânglio, o componente celular tem 9-14 camadas concêntricas de célula única e mede 18-50 μm. Suas uniões são do tipo desmossomo. A morfologia do componente celular no nível do gânglio mostra mudanças transicionais, mantendo muitas das características mostradas no nível pós-gânglio. O componente celular consiste de 25 a 30 lâminas concêntricas unicelulares e tem uma espessura de 55 a 60 μm. Os aspectos ultraestruturais do componente celular nos níveis pré, pós e ganglionar são semelhantes. As células apresentam retículo endoplasmático rugoso amplamente distribuído, e algumas também contêm grandes vacúolos (0.1 μm) que ocupam quase metade do espaço citoplasmático. Uma estrutura semelhante à membrana encontrada em seu citoplasma pode estar envolvida na produção de vesículas (0.05–0.07 μm) necessárias para a pinocitose. As fibras de colágeno juntamente com os axônios mielinizados e não mielinizados são vistos no lado interno do plano celular e fazem parte da estrutura fibrilar endoneural. As uniões especializadas da membrana entre as células nos níveis pré, pós e ganglionar garantem um efeito de barreira, limitando a passagem de substâncias do espaço epidural para os axônios nervosos.
O componente fibrilar reside na porção externa do manguito radicular e tem uma espessura de 100 a 150 μm.Figura 62). Consiste principalmente de fibras colágenas dispostas em lâminas concêntricas com escassas fibras elásticas. Um grande número de adipócitos separa as lâminas durais em grupos de três a cinco camadas concêntricas.Figura 63). A microscopia eletrônica de varredura mostra adipócitos (Figura 63) estendendo-se do saco dural até os gânglios da raiz dorsal. Os adipócitos podem ser encontrados saindo de dentro da parede construída pelo componente fibrilar, fora da superfície epidural externa do manguito radicular.Figuras 64 e 65). A porção fibrilar do saco dural contém cerca de 80 lâminas durais com fibras colágenas orientadas em diferentes direções e poucas fibras elásticas. A sua espessura varia entre 270 e 350 μm ao nível lombar. Os adipócitos não são encontrados na espessura do saco dural.
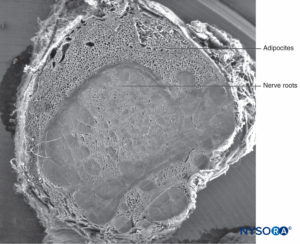
FIGURA 59. Manguito de raiz nervosa humana. Microscopia eletrônica de varredura. Ampliação ×12. (Reproduzido com permissão de Reina MA, Villanueva MC, Machés F, et al: Ultrastructure of human espinal nervo raiz manguito na coluna lombar. Anesth Analg. 2008 Jan;106(1): 339-344.)
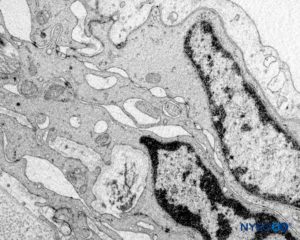
FIGURA 60. Manguito de raiz nervosa humana. Detalhe da barreira celular de transição. Microscopia eletrônica de transmissão. Ampliação × 20,000. (Reproduzido com permissão de Reina MA, Villanueva MC, Machés F, et al: Ultrastructure of human espinal nervo raiz manguito na coluna lombar. Anesth Analg. 2008 Jan;106(1):339-344.)
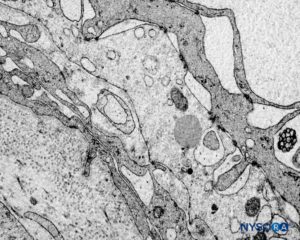
FIGURA 61. Manguito de raiz nervosa humana. Detalhe da barreira celular de transição. Microscopia eletrônica de transmissão. Ampliação × 3000. (Reproduzido com permissão de Reina MA, Machés F, Pulido P, López A, De Andrés JA. Ultrastructure of Human Spinal Meninges. In: Aldrete A. Arachnoiditis, Mexico: Alfil Ed; 2010. pp. 29-46.)
Variações na espessura dural ao longo do saco dural e diferenças relacionadas ao componente fibrilar externo não alteram o efeito barreira, que é de responsabilidade exclusiva do componente celular.
A microscopia eletrônica de varredura mostrou que os adipócitos medem de 50 a 70 μm e são semelhantes aos encontrados em amostras de nervos periféricos do nervo ciático. O fato de os adipócitos parecerem menores e não terem uma forma esférica é provavelmente devido à perda de gordura de seus vacúolos durante a preparação da amostra. A gordura nos manguitos radiculares cobre grupos de axônios radiculares, embora os adipócitos não sejam vistos envolvendo os axônios individualmente. Essa gordura ocupa parcial ou totalmente a espessura do componente fibrilar dos manguitos radiculares.
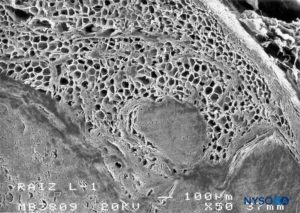
FIGURA 62. Manguito de raiz nervosa humana. Detalhe do tecido adiposo na espessura do manguito da raiz nervosa. Microscopia eletrônica de varredura. Ampliação ×50. (Reproduzido com permissão de Reina MA, Villanueva MC, López A, et al: Gordura dentro da bainha dural de raízes nervosas lombares em humanos. Rev Esp Anestesiol Reanim. 2007 May;54(5):297-301.)
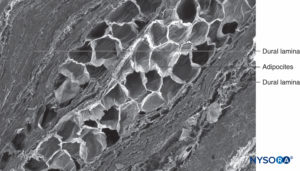
FIGURA 63. Manguito de raiz nervosa humana. Detalhe das lâminas durais na espessura do manguito da raiz nervosa. Microscopia eletrônica de varredura. Ampliação × 150. (Reproduzido com permissão de Reina MA, Villanueva MC, Machés F, et al: Ultrastructure of human espinal nervo raiz manguito na coluna lombar. Anesth Analg. 2008 Jan;106(1):339-344.)

FIGURA 64. Manguito de raiz nervosa humana. Adipócitos no manguito da raiz nervosa. Microscopia eletrônica de varredura. Ampliação × 400. (Reproduzido com permissão de Reina MA, Villanueva MC, Machés F, et al: Ultrastructure of human espinal nervo raiz manguito na coluna lombar. Anesth Analg. 2008 Jan;106(1):339-344.)
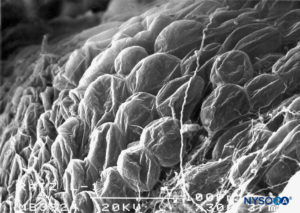
FIGURA 65. Adipócitos na superfície epidural do manguito da raiz nervosa. Microscopia eletrônica de varredura. Ampliação × 300. (Reproduzido com permissão de Reina MA, Villanueva MC, López A, et al: Gordura dentro da bainha dural de raízes nervosas lombares em humanos. Rev Esp Anestesiol Reanim. 2007 May;54(5):297-301.)
TECIDO ADIPOSO EM CUNHAS DE RAIZ E CINÉTICA DE DROGAS
O tecido adiposo pode ser encontrado no espaço epidural e dentro dos manguitos das raízes nervosas. A gordura nos manguitos nervosos está em contato direto com os axônios das raízes nervosas e pode desempenhar um papel na cinética de substâncias lipofílicas injetadas perto das raízes nervosas. O pequeno espaço dentro dos balonetes radiculares e a grande quantidade de drogas disponíveis no caso de uma injeção no balonete podem expor os elementos neurais a uma alta concentração de anestésico local, bem como uma disseminação retrógrada em direção ao espaço subaracnóideo.
RESUMO
Este capítulo delineou as características anatômicas das meninges neuroaxiais e estruturas relacionadas e discutiu suas potenciais implicações clínicas.
REFERÊNCIAS
- Reina MA, López A, De Andrés JA: Variação da espessura da dura-máter humana [em espanhol]. Rev Esp Anestesiol Reanim 1999;46:344–349.
- Reina MA, Pulido P, López A: El saco dural humano. Rev Arg Anestesiol 2007; 65:167-184.
- Reina MA, López A, Dittmann M, De Andrés JA: Estrutura da espessura da dura-máter humana por microscopia eletrônica de varredura [em espanhol]. Rev Esp Anestesiol Reanim 1996;43:135–137.
- Reina MA, Dittmann M, López A, van Zundert A: Novas perspectivas na estrutura microscópica da dura-máter humana na região dorso lombar. Reg Anesth 1997;22:161–166.
- Dittmann M, Reina MA, López A: Neue ergebnisse bei der darstellung der dura mater espinalis mittles rasterelektronenmikroskopie. Anestesista 1998;47:409–413.
- Reina MA, López A, Dittmann M, De Andrés JA: Superfície externa e interna da dura-máter humana por microscopia eletrônica de varredura [em espanhol]. Rev Esp Anestesiol Reanim 1996;43:130–134.
- Reina MA, Villanueva MC, López A: Aracnoides trabecular, piamadre espinal humana e anestesia subaracnoidea. Rev Arg Anestesiol 2008;66: 111–133.
- Reina MA, De León Casasola OA, López A, De Andrés JA, Mora M, Fernández A: A origem do espaço subdural espinhal. Descoberta de ultraestrutura. Anesth Analg 2002;94:991–995.
- Reina MA, López A, De Andrés JA, Villanueva MC, Cortés L: ¿Existe espaço subdural? [em espanhol]. Rev Esp Anestesiol Reanim 1998;45:367–376.
- Reina MA, De León Casasola OA, López A, De Andrés JA, Martín S, Mora M: Um estudo in vitro de lesões durais produzidas por agulhas Quincke e Whitacre de calibre 25 avaliadas por microscopia eletrônica de varredura. Reg Anesth Pain Med 2000;25:393–402.
- Reina MA, López A, Badorrey V, De Andrés JA, Martín S: Lesões dura-aracnóides produzidas por agulhas espinhais Quincke 22G durante uma punção lombar. J Neurol Neurosurg Psychiatry 2004;75:893–897.
- Reina MA, López-García A, de Andrés-Ibáñez JA, et al: Microscopia eletrônica das lesões produzidas na dura-máter humana por agulhas chanfradas de Quincke e Whitacre [em espanhol]. Rev Esp Anestesiol Reanim 1997;44:56–61.
- Jokinen MJ, Pitkänen MT, Lehtonen E: Pontas de agulha espinhal deformadas e perfurações durais associadas examinadas por microscopia eletrônica de varredura. Acta Anesthesiol Scand 1996;40:687–690.
- Puolakka R, Andersson LC, Rosenberg PH: Análise microscópica de três diferentes pontas de agulha espinhal após punção subaracnóidea experimental. Reg Anesth Pain Med 2000;25:163–169.
- Benham M: Danos na agulha espinhal durante a prática clínica de rotina. Anestesia 1996;51:843–845.
- Reina MA, López A, Manzarbeitia F, Amador V, Goxencia I, Olmedilla MC: Fragmentos de pele transportados por agulhas espinhais em cadáveres [em espanhol]. Rev Esp Anestesiol Reanim 1995;42:383–385.
- Reina MA, López-García A, Dittmann M, de Andrés JA, Blázquez MG: Tumores epidermóides espinhais iatrogênicos. Uma complicação tardia da punção espinhal [em espanhol]. Rev Esp Anestesiol Reanim 1996;43:142–146.
- Reina MA, Wikinski J, De Andrés JA: Uma rara complicação da anestesia epidural e subaracnoidea. Tumores epidermoideos espinales iatrogénicos. Rev Arg Anestesiol 2008; 66:319-336.
- Reina MA, Castedo J, López A: Cefalea pospunción dural: Ultraestructura de las lesões durales e agujas espinales usadas nas punciones lombares. Rev Arg Anestesiol 2008;66:6–26.
- Reina MA, López A, De Andrés JA: Hipótese sobre as bases anatômicas da síndrome da cauda equina e síndrome da irritação radicular transitória pós raquianestesia [em espanhol]. Rev Esp Anestesiol Reanim 1999;46:99–105.
- Reina MA, Machés F, López A, De Andrés JA: A ultraestrutura da aracnóide espinhal em humanos e seu impacto na raquianestesia, síndrome da cauda equina e síndrome neurológica transitória. Tech Reg Anesth Pain Management 2008;12:153–160.
- Reina MA, De Leon Casasola O, Villanueva MC, López A, Maches F, De Andrés JA: Achados ultraestruturais na pia-máter espinhal humana em relação à anestesia subaracnóidea. Anesth Analg 2004;98:1479–1485.
- Reina MA, López García A, de Andrés JA: Descrição anatômica de uma perfuração natural presente na pia-máter lombar humana [em espanhol]. Rev Esp Anestesiol Reanim 1998;45:4–7.
- Luyendijk W: A plica mediana dorsalis da dura-máter e sua relação com a peridurografia lombar. Neurorradiologia 1976;11:147-149.
- Blomberg R: A banda de tecido conjuntivo dorsomediano no espaço epidural lombar de humanos: um estudo anatômico usando epiduroscopia em casos de autópsia. Anesth Analg 1986;65:747–752.
- Reina MA, Pulido P, Castedo J, Villanueva MC, López A, De Sola R: Características e distribuição da gordura epidural [em espanhol]. Rev Esp Anestesiol Reanim 2006;53: 315–324.
- Reina MA, Pulido P, Castedo J, Villanueva MC, López A, De Andrés JA: A gordura epidural em diferentes doenças. Contribuições da ressonância magnética e possíveis implicações na raquianestesia e peridural [em espanhol]. Rev Esp Anestesiol Reanim 2007;54:173–178.
- Reina MA, López A, Benito-Leon J, Pulido P, María F: Hematoma intracraniano e espinhal, uma complicação rara da anestesia peridural e espinhal [em espanhol]. Rev Esp Anestesiol Reanim 2004;51:28–39.
- Reina MA, López A, Maches F, De Andrés JA: Origem do hematoma subdural espinhal [em espanhol]. Rev Esp Anestesiol Reanim 2004;51:240–246.
- Reina MA, Villanueva MC, Machés F, Carrera A, López A, De Andrés JA: Ultraestrutura do manguito da raiz do nervo espinhal humano na coluna lombar. Anesth Analg 2008;106:339–344.
- Reina MA, De Andrés J, Machés F, López A: Novos insights de manguitos de raiz espinhal humana. In van Zundert A: Highlights in Pain, Therapy and Regional Anesthesia, 16ª ed. Permanyer, 2007, pp 163-173.
- Reina MA, Villanueva MC, López A, De Andrés JA: Gordura dentro da bainha dural das raízes nervosas lombares em humanos [em espanhol]. Rev Esp Anestesiol Reanim 2007;54:169–172.
- Reina MA, López A, De Andrés JA: Tecido adiposo nos nervos periféricos. Estudo do nervo ciático humano [em espanhol]. Rev Esp Anestesiol Reanim 2002;49:397–402.
- Reina MA, Machés F, Pulido P, López A, De Andrés JA: Ultraestrutura das meninges espinhais humanas. Em Aldrete A: Aracnoidite. Alfil Ed, 2010, pp 29-246.
- Rainha MA. Atlas de Anatomia Funcional para Anestesia Regional e Medicina da Dor. Estrutura Humana, Ultraestrutura e Imagens de Reconstrução 3D. Springer, 2015, pp 705-748.
- Reina MA, De Andrés JA, López A: Anestesia subaracnóidea e peridural. Em Raj P: Textbook of Regional Anesthesia. Churchill Livingston, 2002, pp 307–324.
- Reina MA, De Andrés JA, López García A: Anatomia na raquianestesia [em espanhol]. Em Torres LM (ed). Manual de Anestesia e Manejo da Dor. Aran Ed, 2001, pp 1135-1155.
- Selander D, Sjöstrand J: Disseminação longitudinal de anestésicos locais injetados intraneuralmente. Um estudo experimental da distribuição neural inicial após injeções intraneurais. Acta Anesthesiol Scand 1978;22:622–634.
Dicas NYSORA
- A forma do saco dural é cilíndrica e sua espessura é variável.
- A dura-máter é permeável e ocupa 90% da espessura do saco dural.
- A camada aracnóide é semipermeável e governa a passagem de substâncias.
- As lesões dura-aracnóideas podem diferir dependendo do tipo de agulha espinhal.
- As agulhas de ponta de lápis produzem uma lesão mais destrutiva, enquanto as agulhas cortantes produzem uma lesão em forma de U, embora os tamanhos de ambas sejam semelhantes.
- A aracnóide trabecular cobre as raízes nervosas e forma as bainhas aracnóides.
- A pia-máter tem fenestrações ao nível do cone medular.
- A distribuição da gordura epidural é variável ao longo do canal espinhal, mas é consistente em diferentes níveis vertebrais.
- O volume de gordura epidural está aumentado na lipomatose epidural, distribuído assimetricamente na cifoescoliose e ausente na estenose.
- O “espaço subdural” é de fato ocupado por tecido delicado composto por células neuroteliais especializadas. A ruptura do compartimento subdural dá origem ao que conhecemos como espaço subdural.
- Nos manguitos radiculares, existe um componente celular que rege a difusão de substâncias. Os manguitos de raiz também contêm grande número de adipócitos em sua espessura.