Steve Roberts
INTRODUÇÃO
A anestesia regional é uma parte essencial da prática anestésica pediátrica moderna, trazendo muitas vantagens significativas para o paciente e para o hospital.tabela 1). No entanto, apesar de um forte corpo de evidências destacando as vantagens da anestesia regional, foi apenas relativamente recentemente que a anestesia regional começou a se tornar mais comum na prática anestésica. Grandes estudos prospectivos da Sociedade Francesa de Anestesiologistas Pediátricos (ADARPEF) não demonstraram risco aumentado para crianças com bloqueios realizados sob anestesia geral. No entanto, as complicações foram quatro vezes maiores em crianças com menos de 6 meses em comparação com aquelas com mais de 6 meses.
Historicamente, pensava-se que os neonatos necessitavam de pouca ou nenhuma analgesia. No entanto, a analgesia inadequada no neonato pode causar alterações biocomportamentais que podem modular respostas futuras à dor na infância. Como consequência, técnicas avançadas de anestesia regional (por exemplo, analgesia epidural) têm se tornado cada vez mais utilizadas em crianças de todas as idades. Curiosamente, os estudos ADARPEF identificaram que agora há uma tendência de afastamento dos bloqueios neuroaxiais centrais em direção a técnicas de cateter de nervo periférico. Essa mudança pode ter sido influenciada pelos avanços na cirurgia minimamente invasiva e pela administração mais previsível de técnicas de cateter periférico na prática moderna de anestesia regional.
Todas as técnicas anestésicas regionais podem ser realizadas com segurança na população pediátrica com treinamento adequado e equipamentos modernos.
TABELA 1. Vantagens da anestesia regional em crianças.
| Benefícios para o paciente | Analgesia superior: Resulta em paciente e pais/cuidadores mais calmos. |
| MAC reduzido: risco reduzido de GA mais profunda, emergência mais suave, retorno mais precoce do apetite. | |
| Neurotoxicidade: Este problema potencial é dependente da dose de GA; portanto, uma exposição reduzida ao MAC pode ser benéfica. | |
| Estabilidade hemodinâmica: Até os 8 anos de idade, os CNBs raramente causam hipotensão significativa. | |
| Necessidade reduzida de suporte ventilatório pós-operatório: Particularmente em recém-nascidos e lactentes submetidos a cirurgia abdominal superior e torácica. | |
| Obtunds a resposta ao estresse hormonal. | |
| Redução da perda de sangue intraoperatória: Demonstrada durante o reparo de hipospádia, reparo de fenda e amigdalectomia. | |
| Função GI melhorada: Peristaltismo melhor mantido; melhor perfusão esplâncnica em casos de ECN e gastrosquise | |
| Evita a necessidade de AG: Prematuros submetidos a AG correm risco de apneia pós-operatória. | |
| Benefícios hospitalares | Mais fácil de amamentar: crianças sem dor são menos trabalhosas para cuidar. |
| MAC reduzido: Descarga rápida da recuperação do primeiro estágio. | |
| Necessidade reduzida de suporte ventilatório pós-operatório: Isso é particularmente benéfico quando há suporte limitado da UTIP. | |
| Tempo de permanência reduzido. |
DIFERENÇAS ANATÔMICAS ENTRE CRIANÇAS E ADULTOS
Com relação à anatomia, fisiologia e farmacologia, os adolescentes podem ser considerados “pequenos adultos”; entretanto, neonatos e lactentes precisam de consideração especial. Anatomicamente, a principal diferença está na coluna e em seu conteúdo; este tópico é descrito com mais detalhes em Peridural Pediátrica e Anestesia e Analgesia. Fisiologicamente, há uma série de diferenças encontradas no desenvolvimento do sistema nervoso pediátrico quando comparado aos adultos. A mielinização é incompleta ao nascimento e o processo pode levar 12 anos para ser concluído; consequentemente, concentrações mais baixas de anestésico local podem ser efetivamente utilizadas na população pediátrica, reduzindo também o risco de toxicidade. Embora as vias nociceptivas sejam fundamentalmente as mesmas em crianças e em adultos, existem diferenças que podem resultar em crianças com maior dor do que em adultos. Em crianças, o campo receptivo de um neurônio pode ser maior, levando a uma má localização da dor. As vias inibitórias descendentes são imaturas, e isso pode permitir entradas nociceptivas não moduladas para as vias ascendentes da dor espinhal. As imaturidades fisiológicas do fígado neonatal em associação com um débito cardíaco relativamente alto produzem diferenças farmacológicas que se combinam para aumentar o risco de toxicidade anestésica local em neonatos.
FARMACOLOGIA DE ANESTÉSICOS LOCAIS EM PACIENTES PEDIÁTRICOS
Existem dois grupos principais de anestésicos locais usados em anestesia regional pediátrica: os aminoésteres e as aminoamidas. (Uma discussão detalhada dessas drogas pode ser encontrada em Farmacologia Clínica de Anestésicos Locais.) Há relativamente pouca farmacocinética dos anestésicos locais em crianças, e especialmente em neonatos, é limitada; infelizmente, é essa faixa etária que está em maior risco de toxicidade de drogas anestésicas locais.
Anestésicos Locais Tipo Aminoamida
O grupo de anestésicos locais mais utilizado na prática pediátrica são os aminoamidas: lidocaína, bupivacaína, ropivacaína e levobupivacaína. Os anestésicos locais aminoamida sofrem metabolismo hepático. No entanto, o fígado neonatal é imaturo, com os sistemas de citocromos amadurecendo em taxas variadas: o CYP3A4 nos primeiros 9 meses de vida comparado ao CYP1A2, que pode levar até 8 anos de idade para amadurecer. O volume de distribuição no estado de equilíbrio em lactentes é maior do que em adultos. Os compartimentos de líquidos mudam drasticamente com a idade, 80% do peso corporal consiste em água em um recém-nascido prematuro, 75% em um recém-nascido a termo, 65% em um bebê e 60% em crianças mais velhas. À medida que a idade aumenta, o líquido intracelular aumenta de 20% do peso corporal em recém-nascidos prematuros para os 30% observados em adultos; dentro deste período de tempo, os fluidos extracelulares são reduzidos pela metade. Os anestésicos locais são solúveis em água; portanto, as mudanças relacionadas à idade na composição do compartimento de fluidos são significativas. Os lactentes têm níveis mais baixos de proteínas de ligação ao anestésico local (p. ex., alfa-1-glicoproteína ácida e albumina), o que leva a um aumento da fração de anestésico local não ligado e, portanto, a um risco maior de toxicidade. Porém, nas primeiras 48 horas de pós-operatório, há aumento da alfa-1-glicoproteína ácida que pode atuar na proteção do neonato. A depuração dessas drogas está diminuída naqueles com menos de 3 meses de idade, atingindo gradualmente os níveis adultos aos 8 meses de idade. Consequentemente, as meias-vidas de eliminação dos anestésicos locais são mais longas em recém-nascidos e lactentes em comparação com adultos.
Bupivacaína
A bupivacaína é um isômero com l- e d-enantiômero, o d-enantiômero causando a maioria dos efeitos adversos observados em humanos. Dado que a bupivacaína é o mais tóxico dos anestésicos locais aminoamidas, deve-se considerar o uso de uma alternativa mais segura, principalmente para neonatos e quando técnicas de infusão contínua por meio de cateteres permanentes são administradas. A farmacocinética e a farmacodinâmica da bupivacaína estão bem documentadas na literatura. A concentração preferida para crianças é de 0.25% para bloqueios de nervos periféricos e 0.1% para infusões contínuas. Crianças mais velhas podem tolerar uma dose maior de solução anestésica local (0.4 mg/kg/h) em comparação com recém-nascidos e lactentes (0.2 mg/kg/h). A dosagem de bupivacaína é limitada a 2–4 mg/kg para injeção de dose única e 0.2–0.4 mg/kg para infusão contínua.
Ropivacaína
A ropivacaína é um anestésico local amida mais recente que está sendo usado com mais frequência em cirurgia pediátrica. É um l-enantiômero com menos efeitos colaterais cardiovasculares e no sistema nervoso central em comparação com a bupivacaína. A ropivacaína tem propriedades vasoconstritoras discretas que podem explicar o Tmax mais longo quando administrado caudalmente em comparação com a bupivacaína. Dados farmacocinéticos estão disponíveis em crianças sobre o uso de ropivacaína em infusões contínuas, bem como para injeções de injeção única. Ensaios pediátricos demonstraram uma duração de ação mais longa com ropivacaína do que com mepivacaína quando usada para bloqueio de nervos periféricos. Deve-se ter cautela ao usar ropivacaína também em crianças, pois foram relatados casos de toxicidade cardiovascular.
Levobupivacaína
A levobupivacaína é um l-enantiômero mais recente com risco potencialmente menor de toxicidade cardiovascular grave. Os dados farmacocinéticos estão disponíveis em crianças e o intervalo de dosagem é semelhante ao da bupivacaína. Experimentos em animais mostraram que a levobupivacaína causa menos depressão miocárdica e menor incidência de indução de arritmias fatais em comparação com a bupivacaína. Embora este medicamento ofereça ao médico a opção de um medicamento menos cardiotóxico, deve-se ter cautela.
Anestésicos Locais Tipo Éster
Devido à sua curta duração de ação e propensão a causar reações alérgicas, os aminoésteres (p. ex., procaína, 2-cloroprocaína, tetracaína) são o grupo menos utilizado de anestésicos locais. Ao contrário dos anestésicos locais aminoamidas, os aminoésteres são metabolizados pelas colinesterases plasmáticas. Como resultado, o metabolismo dos anestésicos locais do tipo éster depende dos níveis plasmáticos de colinesterase. Assim, em populações com níveis plasmáticos de colinesterase diminuídos, como neonatos e lactentes, o nível plasmático desses medicamentos pode estar aumentado, levando potencialmente a níveis tóxicos do medicamento. A presença de colinesterase plasmática também limita a duração da ação dessas drogas, levando a uma atividade encurtada. Os anestésicos locais de éster mais comuns usados em lactentes e crianças são a cloroprocaína e a tetracaína. Esses medicamentos são ocasionalmente usados em crianças como adjuvante à raquianestesia em recém-nascidos prematuros submetidos à raquianestesia ou como a única solução anestésica para analgesia caudal. A tetracaína tem sido relatada em raquianestesia, especialmente em prematuros, como único anestésico para correção de hérnia inguinal. A 2-cloroprocaína tem sido usada extensivamente em crianças para analgesia no espaço neuroaxial central.
DOSAGEM DE ANESTÉSICOS LOCAIS EM PACIENTES PEDIÁTRICOS
A maioria das doses de medicamentos em pacientes pediátricos é baseada no peso do paciente (tabela 2), embora seja frequentemente debatido se o peso corporal total ou a massa corporal magra são mais apropriados para cálculos de drogas. No entanto, isso pode não ser aplicável às considerações anestésicas locais; estudos feitos em lactentes submetidos à raquianestesia encontraram uma necessidade maior de solução anestésica local (pesada) em comparação com seus equivalentes adultos usando bupivacaína ou tetracaína.
TABELA 2. Doses máximas recomendadas e duração aproximada de ação de agentes anestésicos locais comumente usados.
| Anestesia local | Aula | Dose Máxima (mg/kg)a | Duração da ação (min) | Infusão (mg/kg/h) |
|---|---|---|---|---|
| Procaína | Éster | 10 | 60-90 | - |
| 2-cloroprocaína | Éster | 20 | 30-60 | - |
| Tetracaína | Éster | 1.5 | 180-600 | - |
| Lidocaína | Amide | 5 | 90-200 | - |
| Bupivacaína | Amide | 2.5 | 180-600 | 0.2-0.4 |
| Ropivacaína | Amide | 2.5 | 180-600 | 0.2-0.5 |
| Levobupivacaína | Amide | 2.5 | 180-600 | 0.2-0.5 |
A concentração do anestésico local administrado também deve ser cuidadosamente considerada. Uma concentração mais baixa de anestésico local de ação prolongada (por exemplo, levobupivacaína a 0.25%) é frequentemente usada porque a criança também está recebendo anestesia geral; portanto, o bloqueio é usado apenas para analgesia. No entanto, em certos cenários, concentrações mais baixas ou mais altas de anestésico local devem ser administradas. Concentrações mais baixas (por exemplo, levobupivacaína a 0.125%) são úteis para diminuir o risco de toxicidade em neonatos e são menos propensas a mascarar a síndrome compartimental ou retardar a deambulação. Concentrações mais altas de anestésico local (por exemplo, levobupivacaína a 0.5%) devem ser consideradas quando um bloqueio motor profundo for desejável (por exemplo, cirurgia de transferência de tendão do membro inferior em crianças com paralisia cerebral.
TOXICIDADE DE DROGAS ANESTÉSICAS LOCAIS
A toxicidade dos anestésicos locais em crianças inclui toxicidade cardiovascular e do sistema nervoso central.tabela 3) e reações alérgicas a soluções anestésicas locais de éster. As diferenças farmacocinéticas já discutidas, juntamente com a imaturidade da barreira hematoencefálica, podem tornar mais provável a toxicidade do sistema nervoso central em neonatos. No entanto, a coadministração de anestesia geral pode mascarar os primeiros sinais e sintomas de toxicidade sistêmica. A dose de anestésico local para crianças é sempre calculada com base em miligramas por quilograma, em vez de volumes previstos como na anestesia regional para adultos. Embora se reconheça que, em pacientes pediátricos, os bebês apresentam maior risco de toxicidade sistêmica, cautela deve ser a norma para crianças de todas as idades, pois concentrações mais altas de alguns anestésicos locais foram registradas em adolescentes em comparação com adultos. Níveis plasmáticos tóxicos também foram relatados após doses seguras de anestésico local usadas para bloqueios caudal e ilioinguinal, portanto, a dose mínima eficaz é recomendada.
TABELA 3. Toxicidade sistêmica da solução anestésica local.
| Sistema nervoso centrala |
| Tontura e tontura |
| Distúrbios visuais e auditivos |
| Espasmos musculares e tremores |
| Convulsões generalizadas |
| Cardiovascular |
| Efeitos cardíacos diretos |
| Fase rápida deprimida de repolarização das fibras de Purkinje |
| Disparo espontâneo deprimido do nó sinoatrial |
| Efeito inotrópico negativo no músculo cardíaco |
| Influxo de cálcio alterado, levando à diminuição da contratilidade miocárdica |
| Efeitos sobre o tônus vascular |
| Baixas concentrações: vasoconstrição |
| Altas concentrações: vasodilatação |
| Aumento da resistência vascular pulmonar |
Curiosamente, Weintraud et al. descobriram que os bloqueios ilioinguinais guiados por US resultaram em concentrações plasmáticas mais altas quando comparados às técnicas baseadas em pontos de referência. Isso pode ser devido a uma maior área de superfície de absorção criada pela colocação do anestésico local precisamente em um plano fascial em comparação com os múltiplos depósitos dentro do músculo que geralmente ocorrem com um método baseado em pontos de referência.
Dicas NYSORA
Prevenção da toxicidade sistêmica na população pediátrica
- Escolha um medicamento menos tóxico (por exemplo, levobupivacaína ou ropivacaína).
- Não exceda a dose máxima (em recém-nascidos, pode ser prudente reduzir pela metade a dose máxima).
- Injete pequenas alíquotas e aspire repetidamente.
- A US permite o uso de doses mais baixas de medicamentos e a visualização da injeção.
- Cuidado com doses repetidas e limite as infusões em recém-nascidos a 48 horas.
- Uma dose de teste contendo epinefrina pode ser usada para identificar a injeção intravascular, mas é limitada pelo tipo de anestesia geral administrada.
- Independentemente da técnica utilizada, todas as crianças que recebem qualquer solução anestésica local, particularmente quando administradas em infusões contínuas, devem ser monitoradas continuamente quanto a efeitos adversos.
Dicas NYSORA
Gerenciando a Toxicidade Anestésica Local
Na prática pediátrica, os sinais e sintomas de alerta precoce de toxicidade podem ser mascarados pela administração concomitante de anestesia geral. Isso significa que o primeiro sinal pode ser arritmia ou colapso cardiovascular. Considere o seguinte ao gerenciar a toxicidade do anestésico local:
- Pare a injeção de anestésico local.
- Instituir suporte básico de vida e pedir assistência.
- Proteja as vias aéreas, ventile com oxigênio a 100% e obtenha acesso intravenoso.
- As convulsões podem ser tratadas com um benzodiazepínico ou agente de indução anestésica.
- Se ocorrer parada cardíaca, iniciar suporte avançado de vida.
- Observe que as arritmias são frequentemente refratárias e, portanto, a ressuscitação deve ser prolongada.
- Administração de lipídios. A Association of Anesthetists of Great Britain and Ireland publicou um protocolo simples a ser seguido (Figura 1).
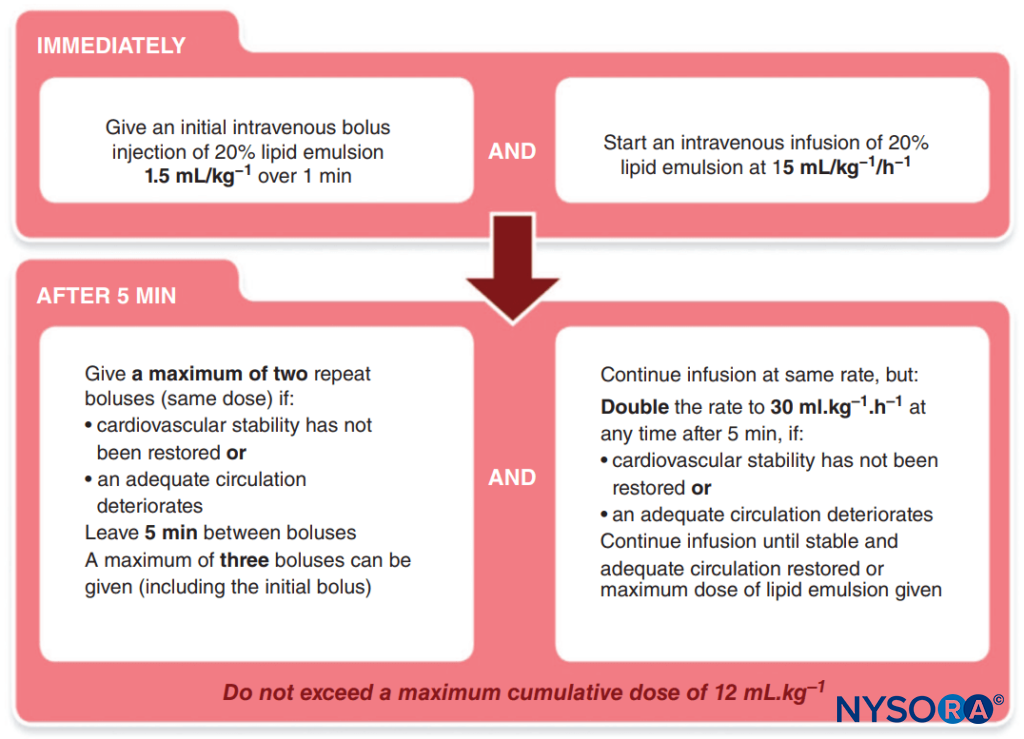
FIGURA 1. Protocolo da Associação de Anestesistas da Grã-Bretanha e Irlanda (AAGBI) para Toxicidade Anestésica Local.
ANESTESIA TÓPICA
É importante discutir o uso de anestesia tópica em crianças porque é comumente usada na prática clínica para fornecer analgesia para colocação de cateter intravenoso, punção lombar e outros procedimentos invasivos (por exemplo, circuncisão em neonatos). As preparações mais comuns incluem lidocaína, tetracaína, benzocaína e prilocaína. A solução anestésica tópica penetra através da pele para proporcionar analgesia. As três preparações mais comuns disponíveis incluem mistura eutética de anestésicos locais (EMLA), LMX-4 (solução lipossomal de lidocaína a 4%) e Ametop (gel de ametocaína a 4%). EMLA contém lidocaína e prilocaína e deve ser aplicado pelo menos uma hora antes da canulação. Sua duração de ação é de apenas 30 a 60 minutos, embora possa ser deixada por 4 a 5 horas. O LMX-4 requer apenas 30 minutos para fazer efeito e também pode ser deixado por 4 a 5 horas. Ametop requer 45 minutos para fazer efeito e deve ser removido dentro de uma hora após a aplicação; sua duração de efeito é de até 3 horas, pois se liga a proteínas do estrato córneo. Ametop é vasodilatador, o que pode ajudar na canulação. No entanto, Ametop pode causar eritema e edema, que podem obscurecer as veias.
Dicas NYSORA
A seguir estão as considerações para crianças submetidas à anestesia regional:
- A anestesia regional é mais comumente realizada com o paciente sob anestesia geral.
- A dose de anestésico local usada é muito menor do que para adultos e é calculada em miligramas por quilograma).
- Use um anestésico local na concentração efetiva mais baixa.
- Se houver expectativa de dor moderada ou intensa, fisioterapia intensa no pós-operatório ou histórico de dor crônica, considere o uso de uma técnica de cateter.
- Muito menos complicações da anestesia regional são relatadas em crianças do que em adultos.
- Sempre obtenha o consentimento ou consentimento do paciente se a criança for mais velha.
- Sempre explique a parestesia pós-operatória aos pacientes.
AVALIAÇÃO PRÉ-OPERATÓRIA
A visita pré-operatória é uma oportunidade para avaliar e preparar o paciente e a família para a cirurgia proposta e a técnica anestésica. É importante que o anestesiologista entenda a cirurgia pretendida para que possa ser tomada a decisão de realizar uma técnica de anestesia regional de injeção única ou contínua. Geralmente, o bloqueio mais periférico deve ser escolhido, pois normalmente tem o menor risco e menos efeitos colaterais e, portanto, terá maior aceitação pelo paciente e pelos pais ou cuidadores. A técnica de cateter é recomendada para cirurgias moderadas a grandes, procedimentos que exigirão fisioterapia pós-operatória prolongada e para crianças com dor crônica. Também é importante garantir que haverá pessoal de enfermagem treinado para manejar as técnicas anestésicas regionais contínuas.
O anestesiologista deve buscar possíveis contraindicações (por exemplo, comorbidades) para uma determinada técnica anestésica regional. Um histórico completo de dor deve ser obtido, procurando especificamente por um histórico de dor crônica ou espasticidade muscular. Crianças com necessidades especiais podem ser particularmente desafiadoras, e o anestesiologista precisa saber como a criança lida e expressa a dor. O exame anestésico pré-operatório padrão deve incluir um exame do local de inserção do bloco proposto para identificar coisas como dificuldades anatômicas (por exemplo, escoliose) e infecção local. Em crianças com doença neurológica, seu déficit neurológico pré-operatório deve ser documentado. O anestesiologista deve explicar à criança e aos pais/cuidadores as vantagens, efeitos colaterais e potenciais complicações do plano anestésico proposto; é prudente também discutir um “plano B” caso a técnica proposta falhe. Estratégias analgésicas alternativas devem ser discutidas para que o consentimento informado possa ser dado. Em particular, as parestesias pós-operatórias da técnica regional devem ser explicadas às crianças em termos que elas possam entender, pois muitas vezes essa é uma experiência com a qual elas têm dificuldade de lidar. Se for utilizada uma técnica de anestesia regional contínua, assegure à criança que a remoção do cateter não será dolorosa. Os pais ou cuidadores geralmente dão consentimento para um procedimento para seu filho. No entanto, se a criança tem a capacidade cognitiva de discernir o certo do errado, sugere-se que também obtenha o consentimento da criança para uma técnica regional. Há um debate sobre quando ou o que essa idade pode ser. Se uma criança se recusar a realizar um procedimento regional apesar da insistência dos pais ou cuidadores, é importante que o anestesiologista forneça uma modalidade alternativa de alívio da dor.
A pré-medicação analgésica com paracetamol (acetaminofeno) e um anti-inflamatório não esteroidal (AINE) deve ser considerada, especialmente quando se sabe que o bloqueio não proporcionará analgesia total (p. As instruções pós-operatórias devem ser dadas no pré-operatório e reforçadas no pós-operatório na alta.
ANESTESIA REGIONAL: ACORDADO OU DORMINDO?
Se é melhor que o paciente esteja acordado ou dormindo durante a anestesia regional tem sido uma questão controversa em adultos, e esse debate já permeou o campo da prática da anestesia regional pediátrica. Colocar um bloqueio regional em uma criança acordada é difícil devido à incapacidade da criança de cooperar, bem como à incapacidade cognitiva da criança de se relacionar com sintomas como parestesia ou dor. Portanto, é melhor fornecer à criança uma técnica regional sob sedação profunda ou após a indução da anestesia geral; essa prática tem sido o consenso dos anestesiologistas pediátricos nos EUA e no exterior há algum tempo.
No entanto, existem dois cenários em que as técnicas regionais acordadas são usadas em crianças. Primeiro, pensava-se que evitando a anestesia geral em prematuros submetidos a pequenas cirurgias, a incidência de apnéia pós-operatória poderia ser reduzida. Este é provavelmente um problema menor agora que os pulmões neonatais prematuros estão mais protegidos e com a disponibilidade de novos agentes inalatórios que proporcionam uma emergência mais rápida.
Em segundo lugar, a criança mais madura pode ser considerada adequada para uma técnica regional acordada quando for submetida a uma pequena cirurgia, se preferir, ou quando uma anestesia geral for considerada muito arriscada (por exemplo, biópsia de linfonodo em um adolescente com massa mediastinal). Para pacientes mais velhos, é essencial preparar a criança e os pais ou cuidadores para toda a visita ao centro cirúrgico, não apenas para a inserção do bloco. A inserção do bloco pode ser mais confortável aplicando um creme anestésico tópico (EMLA tem a melhor penetração) sobre o local de injeção proposto. Durante a visita à sala de cirurgia, a criança deve ser apoiada e distraída por uma enfermeira ou especialista em brincadeiras. A criança também pode achar o uso de um DVD ou MP3 player uma distração útil. Pode ser necessário o uso de óxido nitroso (Entonox) ou doses ansiolíticas de propofol ou remifentanil para facilitar os procedimentos. Marhofer et ai. demonstraram que, no cenário de trauma pediátrico, os bloqueios de plexo braquial são inseridos mais confortavelmente com US do que com estimulação nervosa. Em hospitais pediátricos, a equipe da sala de cirurgia e o cirurgião devem ser lembrados de que o paciente estará acordado e que os medicamentos e equipamentos necessários para converter para anestesia geral devem estar prontos.
GESTÃO DE BLOCOS PERIOPERATIVOS
Algumas regras simples precisam ser seguidas ao realizar qualquer técnica anestésica regional em crianças. Um assistente qualificado deve estar presente em todos os momentos, e esse indivíduo deve entender os princípios básicos da anestesia regional, em particular a necessidade de aspirar regularmente antes da injeção, a necessidade de alertar o anestesiologista sobre a resistência à injeção. Além disso, o assistente deve ser capaz de fazer ajustes básicos no estimulador de nervos periféricos (PNS) e nas máquinas de US.
A criança deve ter uma via aérea segura, acesso intravenoso e monitoramento completo antes de iniciar o bloqueio. Como parte da Lista de Verificação de Segurança Cirúrgica da Organização Mundial da Saúde (OMS), o consentimento e o lado da cirurgia são verificados e, pouco antes da inserção do bloco, o local deve ser novamente confirmado com o assistente do anestesiologista.
A criança, o aparelho de US (quando utilizado), o equipamento e o anestesiologista devem ser posicionados ergonomicamente.
Há algum debate sobre os padrões mínimos de assepsia para anestesia regional. Para técnicas de injeção única, basta esfregar as mãos, usar luvas estéreis, aplicar uma solução alcoólica na pele do paciente e cobrir a sonda de US. Para técnicas de cateter, uma técnica asséptica mais rigorosa é recomendada. Ao realizar qualquer técnica de cateter, é útil ao cobrir a criança ter uma grande área de anatomia visível; isso permite ao anestesiologista espaço suficiente para realizar um mapeamento/scout scan e também uma melhor visualização e, portanto, apreciação da anatomia do paciente (particularmente importante ao colocar peridurais em crianças com escoliose). Pode ser benéfico tunelizar o cateter, pois isso auxilia na fixação e, em alguns casos, pode diminuir o risco de infecção (por exemplo, com um cateter caudal, o cateter pode ser tunelizado para longe da área da fralda.
Não existe uma dose de teste ideal; portanto, sugere-se aspiração repetida e frequente durante a injeção. Quando não se espera que o bloqueio cubra todos os aspectos da dor cirúrgica (por exemplo, um bloqueio da bainha do reto para piloromiotomia), deve-se considerar a administração de paracetamol por via intravenosa e/ou um AINE por reto para auxiliar na analgesia. Outros adjuvantes podem ser benéficos (por exemplo, sulfato de magnésio intraoperatório 50 mg/kg pode diminuir os espasmos musculares pós-operatórios em pacientes com paralisia cerebral submetidos à cirurgia de membros inferiores).
É opinião do autor que, sempre que possível, a eficácia da técnica anestésica regional não deve ser obscurecida pela administração de opióides ou óxido nitroso. É importante na avaliação intraoperatória do bloqueio que quaisquer alterações na frequência cardíaca e pressão arterial sejam observadas e relacionadas aos procedimentos cirúrgicos específicos do momento. Isso permite o planejamento de bloqueios de resgate ao final do procedimento. Mesmo com bloqueios bem-sucedidos, podem ocorrer respostas cardiovasculares ocasionais a estímulos cirúrgicos, pois os bloqueios geralmente são realizados com menor concentração de anestésico local (p. pressão arterial ocorrerá após os primeiros 0.25 a 30 minutos.
O grau de estabilidade cardiovascular intraoperatória ajuda o anestesiologista a decidir se qualquer sofrimento do paciente durante o primeiro estágio da recuperação é devido à dor ou a outra causa (por exemplo, delírio ao despertar). chateado, deve-se presumir que o paciente está com dor, e isso deve ser tratado rapidamente com a administração de um opiáceo de ação rápida (por exemplo, fentanil).
CUIDADOS PÓS-OPERATÓRIOS
Aconselhamento pós-operatório referente à proteção da área anestesiada deve ser dado verbalmente no pré-operatório e repetido no pós-operatório, e instruções escritas também devem ser dadas à família. A família e a criança devem ser avisadas sobre fraqueza muscular e sensação diminuída. Slings devem ser fornecidos a pacientes pediátricos com bloqueios de membros superiores. Crianças ambulatórias com bloqueios de membros inferiores devem ter os meios para se mobilizar e viajar para casa. Toda instituição deve ter diretrizes para cuidados de enfermagem em pacientes internados e monitoramento de técnicas anestésicas regionais, e a equipe deve receber educação regular sobre o manejo de bloqueios regionais no pós-operatório e cuidados com a extremidade anestesiada. Geralmente é mais econômico e seguro colocar os pacientes que recebem anestesia regional e analgesia em enfermarias específicas. (Para obter mais informações sobre este tópico, consulte Manejo da Dor Aguda e Crônica em Crianças.)
TREINAMENTO
O treinamento de anestesiologistas em anestesia regional pediátrica e anatomia é essencial para sua implementação bem-sucedida e segura. Sempre que possível, cada departamento deve fornecer uma abordagem estruturada para ensinar os bloqueios simples comuns: bainha caudal, peniana, femoral, axilar, ilioinguinal e reto. O treinamento deve incluir técnicas de escaneamento e agulhamento de US. Uma vez que as habilidades básicas de agulhamento de US tenham sido aprendidas em fantasmas e habilidades de escaneamento desenvolvidas em voluntários adultos, essas habilidades podem ser transferidas para o ambiente clínico. Geralmente, essas técnicas são mais fáceis e mais seguras executadas primeiro em pacientes mais velhos.
Dicas NYSORA
Sempre que possível, cada departamento deve fornecer uma abordagem estruturada para ensinar os bloqueios comuns: bainha caudal, peniana, femoral, axilar, ilioinguinal e reto.
RESUMO
A anestesia regional melhora a experiência pós-operatória de crianças e pais ou cuidadores e facilita o uso eficiente de instalações hospitalares e espera-se que o uso de anestesia regional em crianças continue a crescer em popularidade. As técnicas anestésicas regionais devem fornecer o equilíbrio correto entre riscos e benefícios para as crianças e a cirurgia de hoje. A US está permitindo que uma maior variedade de bloqueios periféricos seja mais segura e confiável para uso em crianças. A tecnologia é importante, mas não substitui uma sólida compreensão da anatomia e um alto padrão de prática geral de segurança.
REFERÊNCIAS
- Giaufre E, Dalens B, Gombert A: Epidemiologia e morbidade da anestesia regional em crianças: Uma pesquisa prospectiva de um ano da Sociedade Francesa de Anestesiologistas Pediátricos. Anesth Analg 1996;83:904–912.
- Ecoffey C, Lacroix F, Giaufre E et al: Epidemiologia e morbidade da anestesia regional em crianças: uma pesquisa prospectiva de acompanhamento de um ano da Sociedade Francesa de Anestesiologistas Pediátricos (ADARPEF). Pediatra Anesth 2010;20:1061–1069.
- Taddio A, Katz J, Ilersich AL, Koren G: Efeito da circuncisão neonatal na resposta à dor durante a vacinação de rotina subsequente [ver comentários]. Lancet 1997;349:599-503.
- Peutrell JM, Mather SJ: Anestesia Regional em Bebês e Crianças. Oxford: Oxford University Press, 1997.
- Suresh S, Wheeler M: Anestesia regional pediátrica prática. Anesthesiol Clin North Am 2002;20:83–113.
- Fitzgerald M, Walker SM: Manejo da dor infantil: uma abordagem neurobiológica do desenvolvimento. Nat Clin Pract Neurol 2009;5:35–50.
- Mazoit JX, Dalens BJ: Farmacocinética de anestésicos locais em bebês e crianças. Clin Pharmacokinet 2004;43:17–32.
- Besunder JB, Reed MD, Blumer JL: Princípios de biodisposição de drogas no recém-nascido. Uma avaliação crítica da interface farmacocinética-farmacodinâmica (Parte I). Clin Pharmacokinet 1988;14: 189-216.
- Besunder JB, Reed MD, Blumer JL: Princípios de biodisposição de drogas no recém-nascido. Uma avaliação crítica da interface farmacocinética-farmacodinâmica (Parte II). Clin Pharmacokinet 1988;14: 261-286.
- Mazoit JX, Denson DD, Samii K: Farmacocinética da bupivacaína após anestesia caudal em lactentes. Anestesiologia 1988;68:387–391.
- Ecoffey C, Desparmet J, Maury M, et al: Bupivacaína em crianças: farmacocinética após anestesia caudal. Anestesiologia 1985;63: 447-448.
- Murat I, Montay G, Delleur MM, et al: Bupivacaína farmacocinética durante anestesia peridural em crianças. Eur J Anesthesiol 1988;5: 113–120.
- Berde CB: Toxicidade de anestésicos locais em lactentes e crianças. [Análise]. J Pediatr 1993;122(Pt 2):S14–S20.
- Petitjeans F, Mion G, Puidupin M, et al: Taquicardia e convulsões induzidas por injeção intravascular acidental de ropivacaína durante o bloqueio ciático. Acta Anesthesiol Scand 2002;46:616–617.
- Ivani G, Mereto N, Lampugnani E, et al: Ropivacaína em cirurgia pediátrica: resultados preliminares. Pediatra Anaesth 1998;8:127–129.
- Ivani G, Mazzarello G, Lampugnani E, DeNegri P, Torre M, Lonnqvist PA: Ropivacaína para bloqueios centrais em crianças. Anestesia 1998;53(Suppl 2): 74–76.
- Ala-Kokko TI, Partanen A, Karinen J, et al: Farmacocinética de 0.2% de ropivacaína e 0.2% de bupivacaína após bloqueios caudais em crianças. Acta Anesthesiol Scand 2000;44:1099–1102.
- Dalens B, Ecoffey C, Joly A, et al: Farmacocinética e efeito analgésico da ropivacaína após bloqueio do nervo ilioinguinal/iliohipogástrico em crianças. Pediatra Anaesth 2001;11:415–420.
- Fernandez-Guisasola J, Andueza A, Burgos E, et al: Uma comparação de 0.5% de ropivacaína e 1% de mepivacaína para bloqueio do nervo ciático na fossa poplítea. Acta Anesthesiol Scand 2001;45:967–970.
- Ivani G, DeNegri P, Lonnqvist PA, et al: Uma comparação de três diferentes concentrações de levobupivacaína para bloqueio caudal em crianças (tabela). Anesth Analg 2003;97:368–371.
- Lerman J, Nolan J, Eyres R, et al: Eficácia, segurança e farmacocinética da levobupivacaína com e sem fentanil após infusão epidural contínua em crianças: um estudo multicêntrico. Anestesiologia 2003;99: 1166–1174.
- Ala-Kokko TI, Raiha E, Karinen J, et al: Farmacocinética da levobupivacaína a 0.5% após bloqueio do nervo ilioinguinal-iliohipogástrico em crianças. Acta Anesthesiol Scand 2005;49:397–400.
- Foster RH, Markham A: Levobupivacaína: uma revisão de sua farmacologia e uso como anestésico local. Drogas 2000;59:551–579.
- Mather LE, Huang YF, Veering B, Pryor ME: farmacocinética sistêmica e regional de enantiômeros de levobupivacaína e bupivacaína em ovelhas. Anesth Analg 1998;86:805–811.
- Tobias JD, O'Dell N: Cloroprocaína para anestesia epidural em bebês e crianças. AANA J 1995;63:131–135.
- Raj PP, Ohlweiler D, Hitt BA, Denson DD: Cinética de ésteres anestésicos locais e os efeitos de drogas adjuvantes na hidrólise de 2-cloroprocaína. Anestesiologia 1980;53:307–314.
- Tobias JD, Rasmussen GE, Holcomb GW III, et al: Anestesia caudal contínua com cloroprocaína como adjuvante à anestesia geral em neonatos. Can J Anaesth 1996;43:69–72.
- Crowhust JA: Deficiência de colinesterase. Anaesth Intensive Care 1983;11:7–9.
- Kuhnert BR, Philipson EH, Pimental R, Kuhnert PM: Bloqueio peridural prolongado com cloroprocaína em paciente pós-parto com pseudocolinesterase anormal. Anestesiologia 1982;56:477–478.
- Monedero P, Hess P: Bloqueio peridural alto com cloroprocaína em parturiente com baixa atividade de pseudocolinesterase. Can J Anaesth 2001;48:318–319.
- Kuhnert BR, Kuhnert PM, Prochaska AL, Gross TL: Níveis plasmáticos de 2-cloroprocaína em pacientes obstétricas e seus neonatos após anestesia peridural. Anestesiologia 1980;53:21–25.
- Henderson K, Sethna NF, Berde CB: Anestesia caudal contínua para correção de hérnia inguinal em recém-nascidos prematuros. J Clin Anesth 1993;5: 129–133.
- Krane EJ, Haberkern CM, Jacobson LE: Apneia pós-operatória, bradicardia e dessaturação de oxigênio em recém-nascidos prematuros: comparação prospectiva de anestesia espinhal e geral. Anesth Analg 1995;80: 7–13.
- Henderson K, Sethna NF, Berde CB: Anestesia caudal contínua para correção de hérnia inguinal em recém-nascidos prematuros. J Clin Anesth 1993; 5:129–133.
- Suresh S, Cote CJ: Anestésicos locais para bebês e crianças. Em Yaffe SJ, Aranda JV (eds): Farmacologia Neonatal e Pediátrica, Princípios Terapêuticos na Prática, 3ª ed. Filadélfia: Lippincott Williams & Wilkins, 2004.
- Frumiento C, Abajian JC, Vane DW: Raquianestesia para prematuros submetidos à correção de hérnia inguinal. Arch Surg 2000;135:445–451.
- Kasten GW, Martin ST: Toxicidade cardiovascular da bupivacaína: comparação do tratamento com bretílio e lidocaína. Anesth Analg 1985;64:911–916.
- Murat I, Esteve C, Montay G, et al: Farmacocinética e efeitos cardiovasculares da bupivacaína durante a anestesia peridural em crianças com distrofia muscular de Duchenne. Anestesiologia 1987;67:249–252.
- Graf BM: A cardiotoxicidade dos anestésicos locais: o lugar da ropivacaína. Curr Top Med Chem 2001;1:207–214.
- Bergman BD, Hebl JR, Kent J, Horlocker TT: Complicações neurológicas de 405 cateteres axilares contínuos consecutivos (tabela). Anesth Analg 2003;96:247–252.
- Berde CB: Convulsões associadas à anestesia regional pediátrica [comentário editorial] [ver comentários]. Anesth Analg 1992;75:164–166.
- Weintraud M, Lundblad M, Kettner SC et al: Ultrassom versus técnica baseada em pontos de referência para bloqueio do nervo ilioinguinal-iliohipogástrico em crianças: as implicações nos níveis plasmáticos de ropivacaína. Anesth Analg 2009;108:1488–1492.
- Ludot H, Tharin JY, Belouadah M, et al: Ressuscitação bem-sucedida após arritmia vebtricular induzida por ropivacaína e lidocaína após bloqueio do plexo lombar posterior em uma criança. Anesth Analg 2008;106: 1572–1574.
- Acharya AB, Bustani PC, Phillips JD, et al: Ensaio controlado randomizado de mistura eutética de creme anestésico local para punção venosa em prematuros saudáveis. Arch Dis Child Fetal Neonatal Ed 1998;78:F138–F142.
- Benini F, Johnston CC, Faucher D, Aranda JV: Anestesia tópica durante a circuncisão em recém-nascidos. JAMA 1993; 270:850-853.
- Gourrier E, Karoubi P, el Hanache A, et al: Uso de creme EMLA em um departamento de neonatologia. Pain 1996;68:431–434.
- Eichenfield LF, Funk A, Fallon-Friedlander S, Cunningham BB: Um estudo clínico para avaliar a eficácia de ELA-Max (lidocaína lipossomal a 4%) em comparação com mistura eutética de creme anestésico local para redução da dor de punção venosa em crianças. Pediatria 2002;109:1093–1099.
- Jain A, Rutter N: Gel tópico de ametocaína no recém-nascido: em quanto tempo funciona e quanto tempo dura? Arch Dis Child Fetal Neonatal Ed 2000:83:F211–214.
- Tait AR, Voepel-Lewis T, Malviya S: Eles entendem? (Parte II): assentimento de crianças participantes de pesquisa clínica em anestesia e cirurgia. Anestesiologia 2003;98:609–614.
- Krane EJ, Dalens BJ, Murat I, Murrell D: A segurança das epidurais colocadas durante a anestesia geral. Reg Anesth Pain Med 1998;23:433–438.
- Marhofer P, Sitzwohl C, GreherM, Kapral S: Orientação por ultrassom para anestesia infraclavicular do plexo braquial em crianças. Anestesia 2004;59:642–646.

