Jean Butterworth IV
INTRODUCTION
L'anesthésie et l'analgésie locales et régionales semblent connaître une renaissance, à en juger par la participation aux réunions spécialisées et l'augmentation substantielle des activités de recherche, comme en témoigne le nombre croissant de publications scientifiques. Contrairement à l'anesthésie générale, dans laquelle le mécanisme moléculaire reste l'objet de spéculations, le site auquel les anesthésiques locaux (AL) se lient pour produire des blocs nerveux a été cloné et muté. Ce chapitre se concentre sur les mécanismes de anesthésie et toxicité, d'autant plus que la connaissance de ces mécanismes aidera le clinicien à réaliser une anesthésie régionale plus sûre et plus efficace.
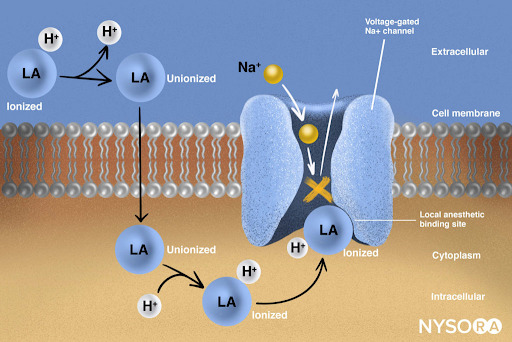
Extrait du Compendium of Regional Anesthesia: Mécanisme d'action des anesthésiques locaux. Les anesthésiques locaux agissent en se liant à la sous-unité α des canaux Na + voltage-dépendants, empêchant ainsi la génération et la conduction de l'influx nerveux. Par la suite, les ions Na + ne peuvent pas pénétrer dans la cellule, ce qui arrête la transmission de l'onde de dépolarisation qui progresse le long du nerf. La fraction des molécules d'anesthésique local est sous forme ionisée. Les molécules anesthésiques locales passent d'ionisées à syndiquées en une fraction de seconde.
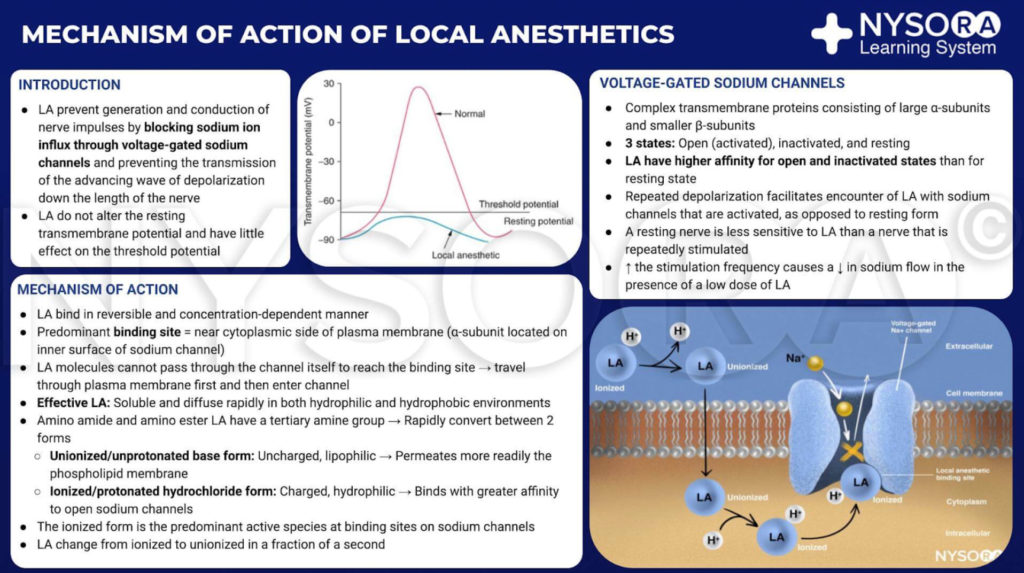
Extrait du Compendium of Regional Anesthesia: Mécanisme d'action de l'infographie des anesthésiques locaux.
PRÉHISTOIRE ET HISTOIRE
Les Incas considéraient la coca comme un cadeau du fils du dieu soleil et limitaient son utilisation à la « croûte supérieure » de la société. Ils ont reconnu et utilisé les propriétés médicinales de la cocaïne bien avant que le composé ne soit introduit en Europe pour que ses propriétés soient « découvertes ». Les Incas traitaient parfois les maux de tête persistants avec la trépanation, et la coca était parfois utilisée pour faciliter cette procédure. L'anesthésie locale a été réalisée en demandant à l'opérateur de mâcher des feuilles de coca et d'appliquer la pulpe macérée sur la peau et les bords de la plaie tout en utilisant un couteau tumi pour percer l'os. Au XVIe siècle, après avoir perturbé la société inca, les conquistadors ont commencé à payer les ouvriers avec de la pâte de cocaïne.
Les ouvriers roulaient généralement les feuilles de cocaïne en boules (appelées cocadas), liées entre elles par du guano ou de la fécule de maïs. Ces cocadas ont libéré la cocaïne à base libre en raison de l'alcalinité du guano et de la pratique de mâcher les cocadas avec de la cendre ou de la chaux (ces composés alcalins augmentent le pH, favorisant la forme de cocaïne à base libre par rapport au sel de chlorhydrate chargé positivement) . Cette pratique marque probablement la naissance de la cocaïne « free-base » et est l'antécédent historique de la cocaïne « rock » ou « crack » si souvent consommée dans les sociétés occidentales. La cocaïne a été ramenée à Vienne par un explorateur/médecin nommé Scherzer. À Vienne, le chimiste Albert Niemann a isolé et cristallisé du chlorhydrate de cocaïne pur en 1860. La société Merck a distribué des lots de cet agent aux médecins à des fins d'investigation. Sigmund Freud était le plus éminent de ces expérimentateurs de cocaïne. Freud passe en revue son travail expérimental dans une monographie consacrée à la cocaïne, Über Coca. Freud et Carl Koller (un stagiaire en ophtalmologie) ont pris de la cocaïne par voie orale et ont remarqué que la drogue rendait leur langue insensible. Koller et Joseph Gartner ont commencé une série d'expériences utilisant de la cocaïne pour produire une anesthésie topique de la conjonctive.
La naissance de l'anesthésie locale et régionale date de 1884, lorsque Koller et Gartner ont rapporté leur succès à produire une anesthésie topique à la cocaïne de l'œil chez la grenouille, le lapin, le chien et l'homme. L'utilisation de l'anesthésie locale s'est rapidement répandue dans le monde entier. Le chirurgien américain William Halsted de l'hôpital Roosevelt de New York a déclaré avoir utilisé de la cocaïne pour produire bloc nerveux mandibulaire en 1884 et de produire un bloc du plexus brachial moins d'un an plus tard. Ces blocs ont été réalisés en exposant chirurgicalement les nerfs, puis en les injectant sous vision directe. Leonard Corning a injecté de la cocaïne près de la colonne vertébrale des chiens, produisant ce qui était probablement le premier épidurale en 1885. La rachianesthésie à la cocaïne a été pratiquée pour la première fois en 1898 par August Bier. Cocaïne anesthésie rachidienne a été utilisé pour traiter la douleur cancéreuse en 1898. L'anesthésie péridurale caudale a été introduite en 1902 par Sicard et Cathelin. Bière décrite anesthésie régionale intraveineuse en 1909. En 1911, Hirschel rapporta les trois premières anesthésies percutanées du plexus brachial. Fidel Pages a rapporté avoir utilisé l'anesthésie péridurale pour la chirurgie abdominale en 1921. La cocaïne a rapidement été incorporée dans de nombreux autres produits, y compris la formulation originale de Coca-Cola conçue par Pemberton en 1886. Les toniques au vin et autres médicaments «brevets» de l'époque contenaient couramment de la cocaïne (Figure 1). Cette pratique a pris fin lorsque la cocaïne a été réglementée par le précurseur de la Food and Drug Administration (FDA) au début des années 1900.

FIGURE 1. Exemples de produits qui incorporaient de la cocaïne avant qu'elle ne devienne une substance contrôlée. Les vins enrichis en cocaïne étaient particulièrement appréciés comme « toniques ». (Utilisé avec la permission de Addiction Research Unit, University of Buffalo.)
CHIMIE MÉDICALE
La cocaïne et tous les autres AL contiennent un cycle aromatique et une amine aux extrémités opposées de la molécule, séparés par une chaîne hydrocarbonée, et soit une liaison ester soit une liaison amide (Figure 2). La cocaïne, l'ester archétypique, est le seul AL naturel. La procaïne, le premier ester synthétique LA, a été introduite en 1904 par Einhorn. L'introduction de l'amide LA lidocaïne en 1948 a été transformatrice. La lidocaïne est rapidement devenue utilisée pour toutes les formes d'anesthésie régionale. D'autres AL amides basés sur la structure de la lidocaïne (prilocaïne, étidocaïne) sont ensuite apparus. Une série apparentée d'amides LA à base de 2',6'-pipécoloxylidide a été introduite (mépivacaïne, bupivacaïne, ropivacaïne et lévobupivacaïne). La ropivacaïne et la lévobupivacaïne sont les seuls AL à énantiomère unique (isomère optique unique) disponibles dans le commerce. Les deux sont des énantiomères S(–), évitant la toxicité cardiaque accrue associée aux mélanges racémiques et aux isomères R(+) (ceci est discuté dans une section ultérieure). Tous les autres LA existent sous forme de racémates ou n'ont pas de carbones asymétriques.
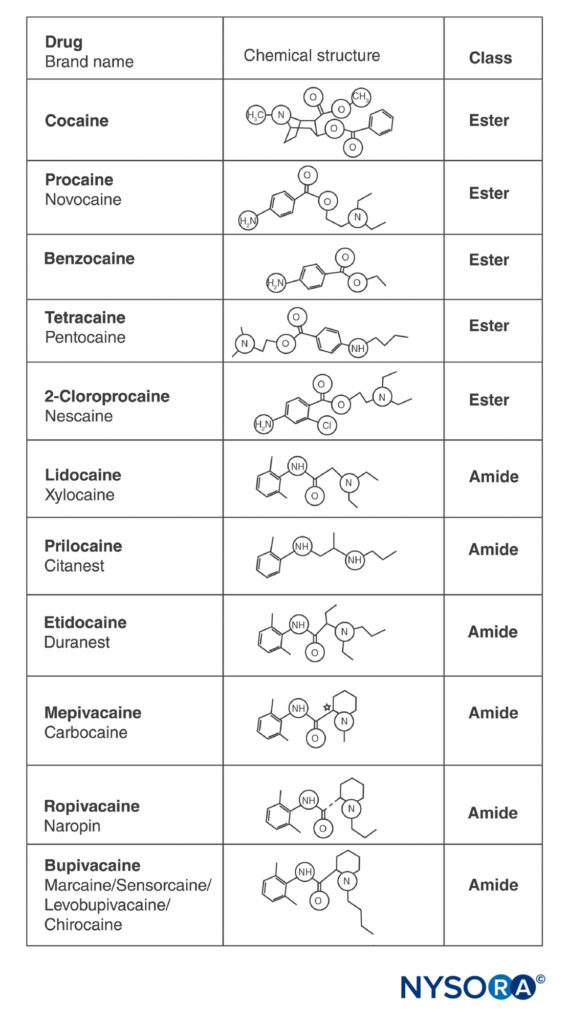
FIGURE 2. Structures des anesthésiques locaux couramment utilisés.
Conseils NYSORA
- Tous les AL contiennent un cycle aromatique et une amine aux extrémités opposées de la molécule, séparés par une chaîne hydrocarbonée, et soit une liaison ester soit une liaison amide.
BIOPHYSIQUE DES CANAUX DE SODIUM VOLTAGE-GATES ET ANESTHÉSIQUES LOCAUX
Les études des mécanismes d'action des LA sur les nerfs périphériques sont des études d'interactions entre les LA et les canaux Na voltage-dépendants car les canaux Na contiennent le site de liaison LA. Les canaux Na sont des protéines membranaires intégrales qui initient et propagent les potentiels d'action dans axones, dendrites et tissus musculaires ; initier et maintenir des oscillations potentielles membranaires dans des cellules cardiaques et cérébrales spécialisées ; et façonner et filtrer les entrées synaptiques. Les canaux Na partagent des caractéristiques structurelles avec d'autres canaux ioniques voltage-dépendants similaires qui existent sous forme de tétramères, chacun avec six segments hélicoïdaux transmembranaires (par exemple, les canaux Ca et K voltage-dépendants). Les canaux Na contiennent une sous-unité α plus grande et une ou deux sous-unités β plus petites, selon l'espèce et le tissu d'origine. La sous-unité α, le site de la conduction ionique et de la liaison LA, a quatre domaines homologues, chacun avec six segments α-hélicoïdaux traversant la membrane (Figure 3). La surface externe de la sous-unité α est fortement glycosylée, ce qui sert à orienter correctement le canal dans la membrane plasmique (Figure 4). Les invertébrés n'ont qu'un ou deux gènes de la sous-unité α du canal Na, et le rôle physiologique normal de ces canaux n'est pas clair (les animaux survivent lorsque les canaux ne sont pas présents).
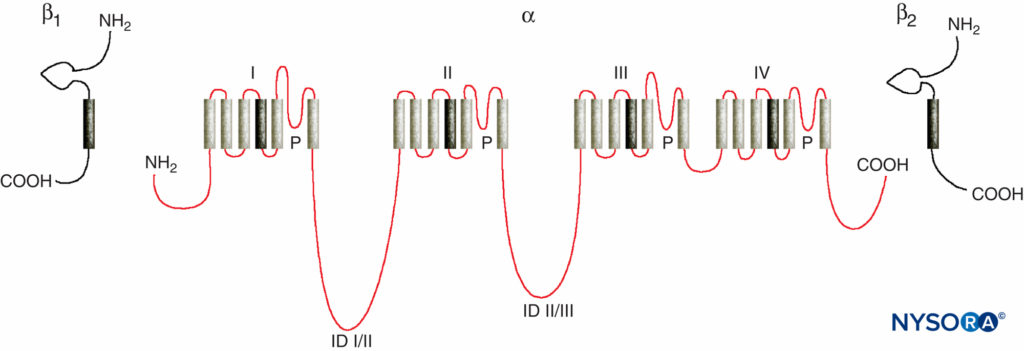
FIGURE 3. Structure « cartoon » des sous-unités du canal Na. Notez que la sous-unité α a quatre domaines qui contiennent chacun six segments membranaires. (Reproduit avec la permission de Plummer NW, Meisler MH : Evolution and diversity of mammalian sodium channel genes. Genomics. 1999 Apr 15;57(2):323-331.)
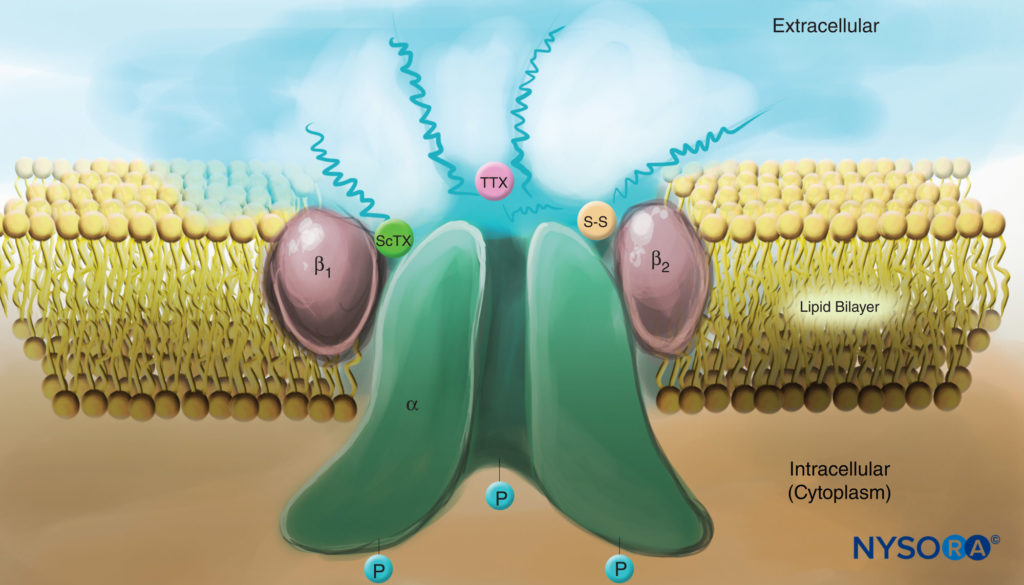
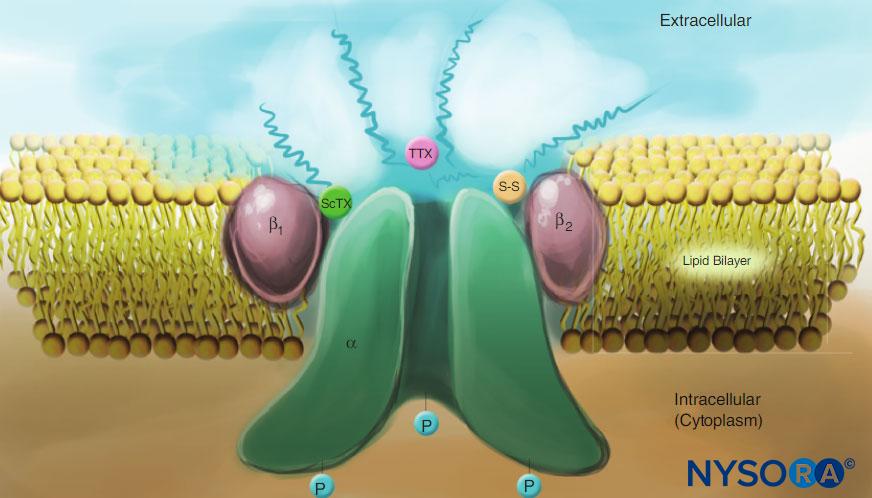
FIGURE 4. Caricature d'un canal Na dans la membrane plasmique. Notez que les trois sous-unités sont fortement glycosylées du côté extracellulaire (voir les lignes « sinueuses »). Contrairement aux anesthésiques locaux, notez que les toxines de scorpion (ScTX) et la tétrodotoxine (TTX) ont des sites de liaison sur la surface externe du canal. Notez également que le côté cytoplasmique du canal est phosphorylé. (Reproduit avec l'autorisation de Catterall WA : Biologie cellulaire et moléculaire des canaux sodiques voltage-dépendants. Physiol Rev. 1992 Oct ; 72(4 Suppl) : S15-S48.)
TABLE 1. Canal Na voltage-dépendant — isoformes neurales.
| Nav 1.1 | Nav 1.2 | Nav 1.3 | Nav 1.6 | Nav 1.7 | Nav 1.8 | Nav 1.9 | |
|---|---|---|---|---|---|---|---|
| Chromosome | 2 | 2 | 2 | 12 | 2 | 3 | 3 |
| Si identifié | CNS, DRG | SNC | CNS régulé à la hausse, après une blessure | DRG (grands et petits), CNS, Ranvier | DRG (grand et petit) | DRG (petit) | DRG (petit) |
| Inactivation | Rapide | Rapide | Rapide | Rapide | Rapide | Lent | Lent |
| TTX | Des livraisons | Des livraisons | Des livraisons | Des livraisons | Des livraisons | Insensible | Insensible |
Source : Adapté avec la permission de Novakovic SD, Eglen RM, Hunter JC : Régulation de la distribution des canaux Na+ dans le système nerveux. Tendances Neurosci. août 2001;24(8):473-478.
Les humains, en revanche, ont neuf gènes actifs de la sous-unité α du canal Na sur quatre chromosomes, avec une expression spécifique des cellules et une localisation des produits géniques.10 Le Nav gène 1.4 (par convention, les généticiens se réfèrent aux isoformes du canal Na voltage-dépendant comme Nav 1.x) fournit des canaux au muscle squelettique, et le Nav Le gène 1.5 fournit des canaux au muscle cardiaque, laissant sept Nav isoformes dans le tissu neural (Tableau 1). Des gènes définis contribuent à des formes de canal Na spécifiques à chacun des axones non myélinisés, des nœuds de Ranvier dans les axones moteurs et des petits nocicepteurs ganglionnaires de la racine dorsale. Alors que toutes les sous-unités α du canal Na se lient aux LA de la même manière, leur affinité pour la liaison des neurotoxines varie. Les mutations des sous-unités α et β du canal Na entraînent des maladies musculaires, cardiaques et neurales. Par exemple, les mutations héritées de Nav 1.5 ont été associés au syndrome du QT long congénital, au syndrome de Bruruda et à d'autres maladies du système de conduction. Il a été démontré que certains Nav les isoformes prolifèrent dans les modèles animaux de douleur chronique. L'existence de Na spécifiquev les produits de la sous-unité α du gène offrent la possibilité séduisante que des inhibiteurs puissent un jour être développés pour chaque Na spécifiquev forme de sous-unité α. De tels développements, déjà en cours pour certaines isoformes de Nav, pourraient révolutionner le traitement de la douleur chronique. Le blocage des impulsions dans une fibre nerveuse nécessite qu'une longueur définie de nerf devienne inexcitable (pour empêcher l'impulsion de "sauter" le segment bloqué). Ainsi, à mesure que la concentration de LA augmente, il doit être appliqué sur une longueur plus courte du nerf pour empêcher la conduction des impulsions, comme le montre Figure 5. La conduction normale et la manière dont les AL inhibent la conduction diffèrent entre les fibres nerveuses myélinisées et non myélinisées. La conduction dans les fibres myélinisées procède par sauts d'un nœud de Ranvier à l'autre, un processus appelé conduction saltatoire. Pour bloquer les impulsions dans les fibres nerveuses myélinisées, il est généralement nécessaire que les AL inhibent les canaux dans trois nœuds de Ranvier successifs (Figure 6). Les fibres non myélinisées, dépourvues du mécanisme saltatoire, conduisent beaucoup plus lentement que les fibres myélinisées. Les fibres amyéliniques sont relativement résistantes aux AL, malgré leur plus petit diamètre, en raison de la dispersion des canaux Na à travers leurs membranes plasmiques. Ces différences entre les fibres nerveuses surviennent au cours du développement lorsque les canaux Na commencent à se regrouper au niveau des nœuds de Ranvier dans les axones myélinisés. Le regroupement nodal des canaux, essentiel pour la transmission de signaux à grande vitesse, est initié par les cellules de Schwann dans le système nerveux périphérique et par les oligodendrocytes dans le système nerveux central (SNC). Les canaux Na peuvent exister dans au moins trois conformations natives : "au repos", "ouvertes" et "inactivées", décrites pour la première fois par Hodgkin et Huxley. Lors d'un potentiel d'action, les canaux Na neuronaux s'ouvrent brièvement, permettant aux ions Na extracellulaires de s'écouler dans la cellule, dépolarisant la membrane plasmique. Après seulement quelques millisecondes, les canaux Na s'inactivent (après quoi le courant Na cesse). Les canaux Na reviennent à la conformation de repos avec repolarisation membranaire. Le processus par lequel les canaux passent des formes conductrices aux formes non conductrices est appelé déclenchement. Le déclenchement est supposé résulter des mouvements des dipôles en réponse aux changements de potentiel. Le processus par lequel les canaux voltage-dépendants fonctionnent implique probablement des mouvements de capteurs de tension en forme de palette dans le périmètre extérieur du canal (Figure 7). La vitesse des processus de déclenchement diffère entre Nav Formes de la sous-unité α : les formes musculaires et nerveuses squelettiques s'ouvrent plus rapidement que les formes cardiaques.
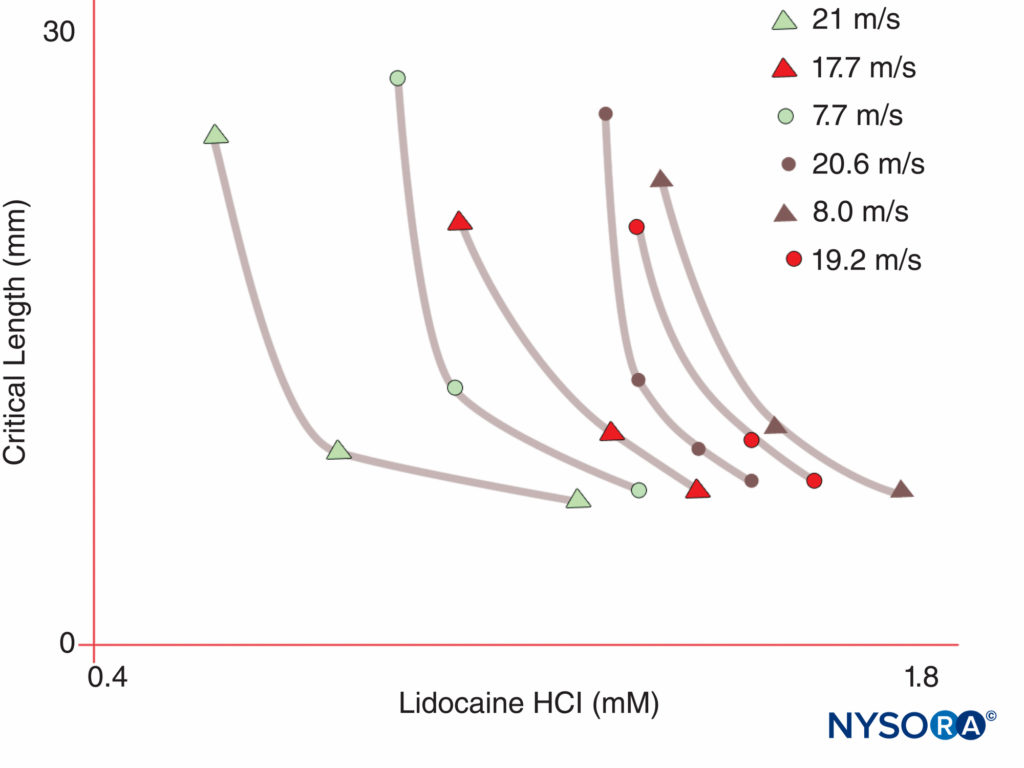
FIGURE 5. Notez que la concentration d'anesthésique local nécessaire pour produire un bloc nerveux diminue à mesure que la longueur du nerf exposé à l'anesthésique local augmente. (Reproduit avec la permission de Raymond SA, Steffensen SC, Gugino LD, et al : Le rôle de la longueur du nerf exposé aux anesthésiques locaux dans l'action de blocage des impulsions. Anesth Analg. 1989 May ;68(5):563-570.)
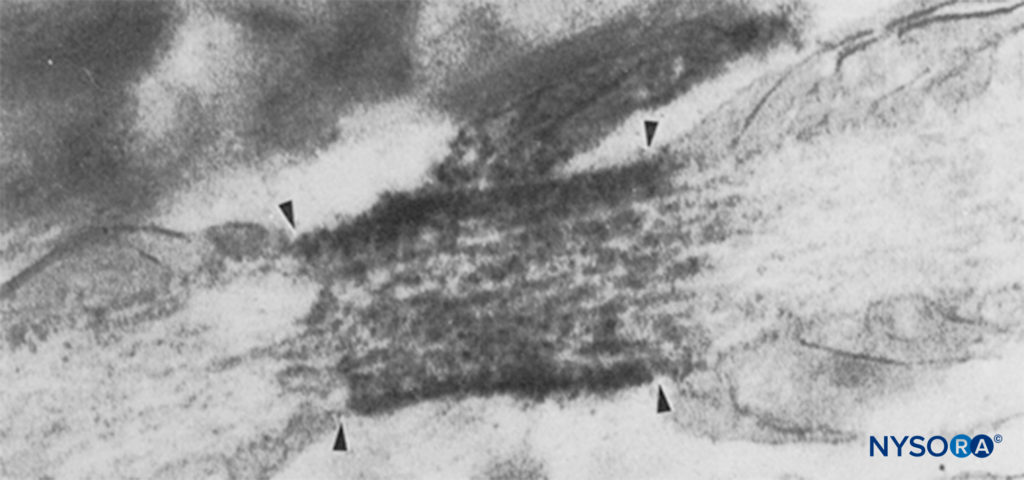
FIGURE 6. Micrographie électronique d'un noeud de Ranvier. Les canaux Na ont été immunomarqués et apparaissent sous forme de granules denses dans les quatre flèches. La région paranodale est indiquée par "pn" et un astrocyte est indiqué par "as". (Reproduit avec la permission de Black JA, Friedman B, Waxman SG, et al : Localisation immuno-ultrastructurale des canaux sodiques aux nœuds de Ranvier et des astro-cytes périnodaux dans le nerf optique du rat. Proc R Soc Lond B Biol Sci. 1989 Oct 23 ; 238 (1290):39-51.)
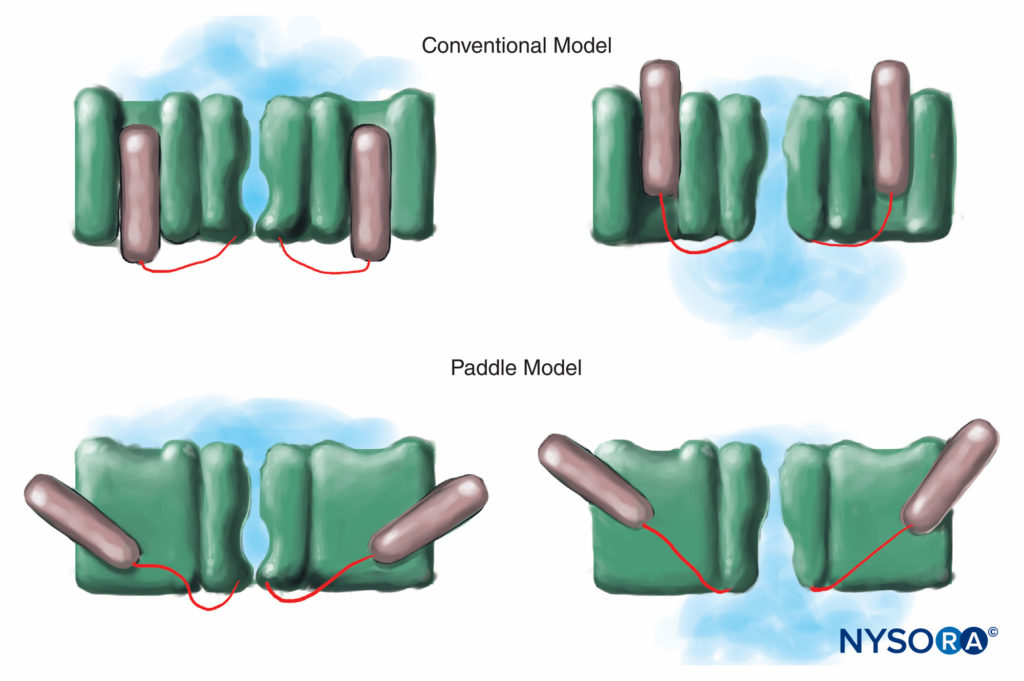
FIGURE 7. Dans le modèle conventionnel de déclenchement de tension, la partie de détection de tension du canal glisse "dans et hors" de la membrane. Des études plus récentes de diffraction des rayons X du canal K suggèrent qu'un mécanisme plus approprié est celui de structures en forme de palette glissant en diagonale à travers la membrane plasmique. (Reproduit avec la permission de Arhem P : Détection de tension dans les canaux ioniques : un mystère vieux de 50 ans résolu ? Lancet. 2004 avril 10 ;363(9416):1221-1223.)
L'anesthésie se produit lorsque les LA se lient aux canaux Na et inhibent la perméabilité au Na qui sous-tend les potentiels d'action. Notre compréhension des mécanismes LA a été affinée par plusieurs observations clés. Taylor a confirmé que les AL inhibent sélectivement les canaux Na dans les nerfs. Strichartz a d'abord observé un bloc dépendant de l'utilisation avec les LA, montrant l'importance de l'ouverture du canal pour la liaison des LA. La dépendance à l'utilisation (ou à la fréquence) décrit comment l'inhibition LA des courants de Na augmente avec les dépolarisations répétitives ("utilisation"). Des trains répétitifs de dépolarisations augmentent la probabilité qu'un LA rencontre un canal Na ouvert ou inactivé, les deux formes ayant une plus grande affinité LA que les canaux au repos (Figure 8). Ainsi, le potentiel de membrane influence à la fois la conformation du canal Na et l'affinité du canal Na pour les AL. Le bloc dépendant de l'utilisation semble important pour le fonctionnement des AL en tant qu'antiarythmiques et peut également sous-tendre l'efficacité des concentrations réduites d'AL dans la gestion de la douleur. Enfin, en utilisant la mutagenèse dirigée, Ragsdale et Wang ont localisé la liaison de LA à des acides aminés spécifiques dans D4S6 de Nav 1.2 et Nav 1.4. Certains isomères optiques LA confèrent une plus grande sécurité apparente que leur énantiomère opposé. Par exemple, sous voltage clamp, l'isomère R(+)-bupivacaïne inhibe plus puissamment les courants cardiaques Na que l'isomère S(–)-bupivacaïne (lévobupivacaïne) (Figure 9). De nombreux autres types de produits chimiques se lieront et inhiberont également les canaux Na, notamment les anesthésiques généraux, les inhibiteurs de la substance P, les agonistes α2-adrénergiques, les antidépresseurs tricycliques et les toxines nerveuses. Les toxines nerveuses font actuellement l'objet de tests sur les animaux et les humains en tant que substituts possibles des AL.
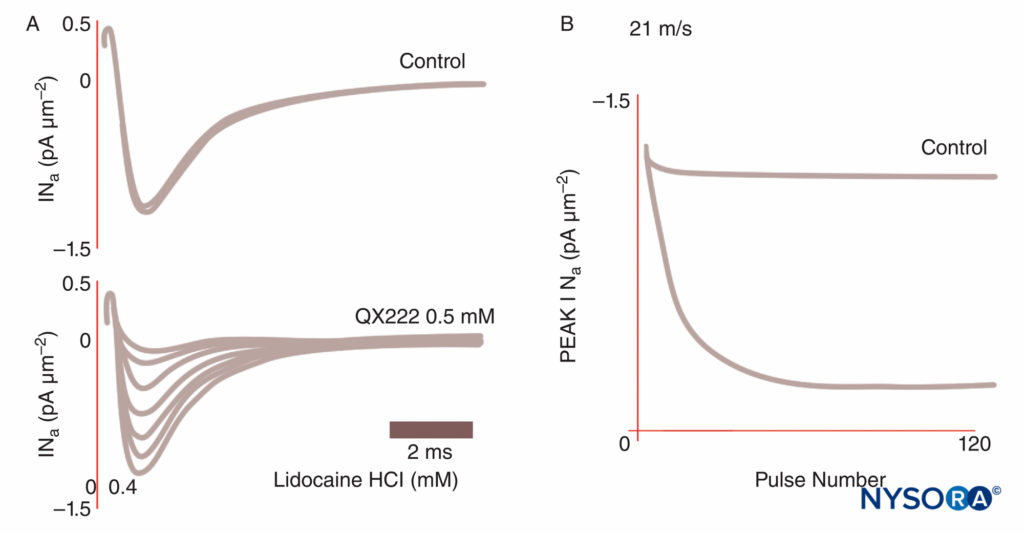
FIGURE 8. Blocage dépendant de l'utilisation des courants de Na dans les fibres de Purkinje. Dans des conditions de contrôle, chacune d'un train d'impulsions se traduit par des tracés de courant identiques. En présence de l'anesthésique local QX222, la première impulsion a à peu près la même amplitude que dans les conditions de contrôle. Chaque impulsion suivante est plus petite (pic réduit INa), reflétant un bloc cumulatif de canaux Na, jusqu'à ce qu'un nadir soit atteint. (Reproduit avec la permission de Hanck DA, Makielski JC, Sheets MF: Kinetic effects of quaterary lidocaine block of heart sodium channels: a gating current study. J Gen Physiol. 1994 Jan;103(1):19-43.)
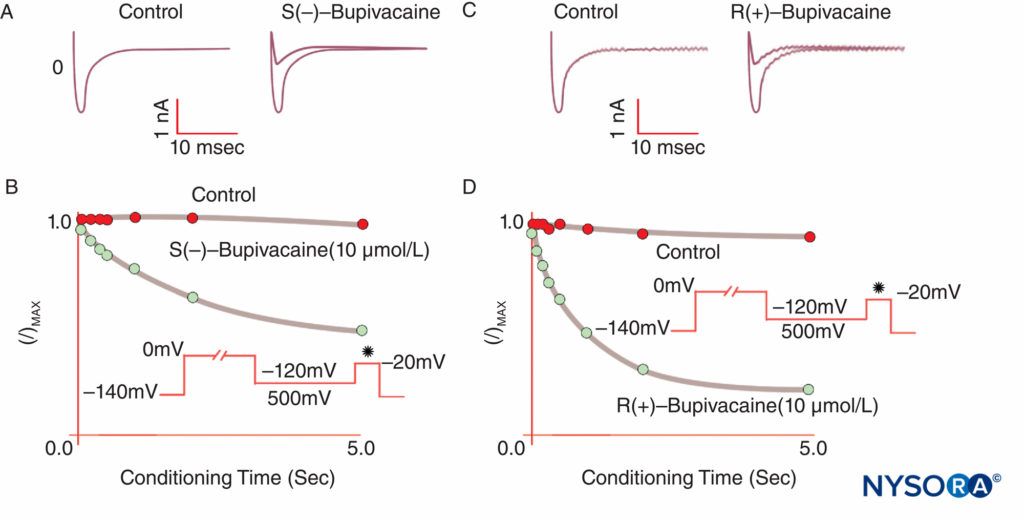
FIGURE 9. Puissance réduite de la S(–) bupivacaïne par rapport à la R(+)-bupivacaïne pour inhiber les courants cardiaques de Na sous voltage clamp. Après une dépolarisation « conditionnée » standard de longueurs variables, l'isomère S(–) produit moins de réduction de I/Imax que l'isomère R(+). (Reproduit avec la permission de Valenzuela C, Snyders DJ, Bennett PB, et al : Blocage stéréosélectif des canaux sodiques cardiaques par la bupivacaïne dans les myocytes ventriculaires de cobaye. Circulation. 1995 Nov 15 ;92(10):3014-3024.)
PHARMACODYNAMIQUE DES ANESTHÉSIQUES LOCAUX
Dans la pratique clinique, les AL sont généralement décrits par leur puissance, leur durée d'action, leur vitesse d'apparition et leur tendance au blocage nerveux sensoriel différentiel. Ces propriétés ne sont pas triées indépendamment.
Puissance et durée
Le pouvoir bloquant les nerfs des AL augmente avec l'augmentation du poids moléculaire et l'augmentation de la solubilité dans les lipides. Les LA plus grandes et plus lipophiles pénètrent plus facilement dans les membranes nerveuses et se lient aux canaux Na avec une plus grande affinité. Par exemple, l'étidocaïne et la bupivacaïne ont une plus grande solubilité et puissance dans les lipides que la lidocaïne et la mépivacaïne, auxquelles elles sont étroitement apparentées chimiquement.
Conseils NYSORA
- Le pouvoir bloquant les nerfs des AL augmente avec l'augmentation du poids moléculaire et l'augmentation de la solubilité dans les lipides.
Les LA plus solubles dans les lipides sont relativement insolubles dans l'eau, fortement liées aux protéines dans le sang, moins facilement éliminées par la circulation sanguine des membranes nerveuses et plus lentement «éliminées» des nerfs isolés in vitro. Ainsi, une solubilité accrue des lipides est associée à une liaison accrue des protéines dans le sang, à une puissance accrue et à une durée d'action plus longue. L'étendue et la durée de l'anesthésie peuvent être corrélées avec le contenu LA des nerfs dans les expérimentations animales. Chez les animaux, des blocs de plus grande profondeur et de plus longue durée proviennent de volumes plus petits d'AL plus concentré, par rapport à des volumes plus importants d'AL moins concentré.
Vitesse d'apparition
De nombreux manuels et articles de synthèse affirment que le début de l'anesthésie dans les nerfs isolés ralentit avec l'augmentation de la solubilité des lipides LA et l'augmentation du pKa (Tableau 2). À n'importe quel pH, le pourcentage de molécules d'AL présentes sous la forme non chargée, largement responsable de la perméabilité membranaire, diminue avec l'augmentation du pKa. des autres LA. Enfin, le taux d'apparition de LA est associé au taux de diffusion aqueuse, qui diminue avec l'augmentation du poids moléculaire.
TABLE 2. Des caractéristiques anesthésiques locales qui tendent à se trier.
Physique et chimique
- Augmenter la solubilité des lipides
- Liaison accrue aux protéines
Pharmacologique et toxicologique
- Augmentation de la puissance
- Augmenter le temps d'apparition
- Augmentation de la durée d'action
- Tendance croissante à la toxicité systémique sévère
- En général, tous ont tendance à trier ensemble
Bloc nerveux sensoriel différentiel
L'anesthésie régionale et la gestion de la douleur seraient transformées par un LA qui inhiberait sélectivement la transmission de la douleur tout en laissant les autres fonctions intactes. Cependant, une anesthésie sensorielle suffisante pour une incision cutanée ne peut généralement pas être obtenue sans déficience motrice. Comme cela a été démontré pour la première fois par Gasser et Erlanger en 1929, tous les AL bloqueront les fibres plus petites (de diamètre) à des concentrations inférieures à celles nécessaires pour bloquer les fibres plus grosses du même type. En tant que groupe, les fibres non myélinisées sont résistantes aux LA par rapport aux fibres A-δ myélinisées plus grandes. La bupivacaïne et la ropivacaïne sont relativement sélectives pour les fibres sensorielles. La bupivacaïne produit un déclenchement plus rapide du bloc sensitif que moteur, tandis que la mépivacaïne, une substance chimique étroitement apparentée, ne présente aucun déclenchement différentiel pendant les blocs nerveux médians (Figure 10). Une véritable anesthésie différentielle peut être possible lorsque des antagonistes sélectifs des isoformes de Nav deviennent disponibles. Certaines isoformes de Nav se sont avérées prévalentes dans les ganglions de la racine dorsale et (comme indiqué précédemment) les populations relatives de diverses isoformes de Nav peuvent changer en réponse à divers états de douleur.
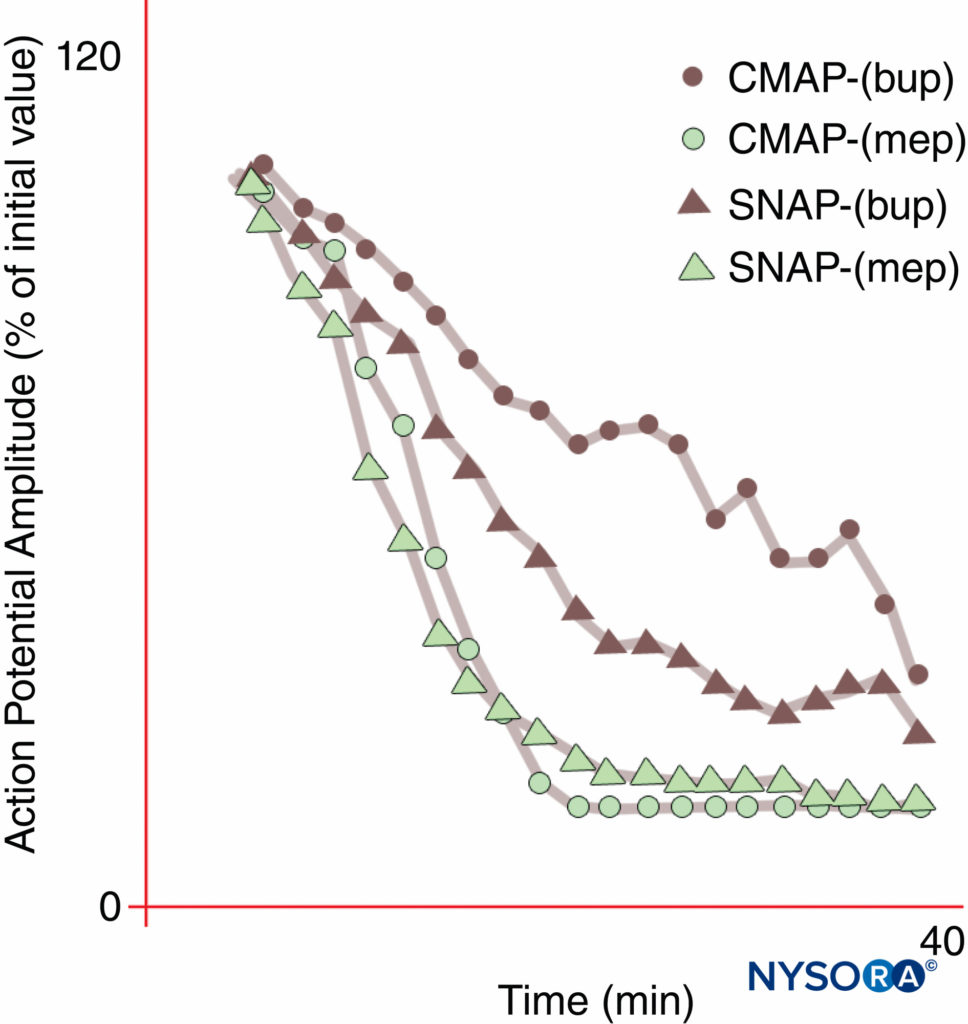
FIGURE 10. Apparition différentielle du bloc du nerf médian avec la bupivacaïne 0.3 % (bup), mais pas avec la mépivacaïne 1 % (mep). Notez que le potentiel d'action moteur composé (CMAP) est moins inhibé que le potentiel d'action nerveux sensoriel (SNAP) lors de l'apparition du bloc de bupivacaïne chez ces sujets volontaires normaux. A l'état d'équilibre (20 min), CMAP et SNAP sont inhibés de manière comparable. D'autre part, la mépivacaïne a produit une inhibition plus rapide à la fois du CMAP et du SNAP, et il n'y a pas eu d'apparition différentielle de bloc. (Reproduit avec la permission de Butterworth J, Ririe DG, Thompson RB, et al : apparition différentielle du bloc nerveux médian : comparaison aléatoire en double aveugle de la mépivacaïne et de la bupivacaïne chez des volontaires sains. Br J Anaesth. 1998 oct ; 81(4) : 515-521.)
Autres facteurs influant sur l'activité anesthésique locale
De nombreux facteurs influencent la capacité d'un LA donné à produire une anesthésie régionale adéquate, notamment la dose, le site d'administration, additifs, température et grossesse. À mesure que la dose d'AL augmente, la probabilité de succès et la durée de l'anesthésie augmentent, tandis que le délai d'apparition et la tendance au bloc différentiel diminuent. En général, le début le plus rapide et la durée la plus courte de l'anesthésie se produisent avec des injections rachidiennes ou sous-cutanées ; un début plus lent et une durée plus longue sont obtenus avec des blocs de plexus.
Conseils NYSORA
- L'efficacité d'un LA donné est influencée par la dose, le site d'administration, les additifs, la température et les modifications de la susceptibilité neurale, comme observé pendant la grossesse.
L'épinéphrine est fréquemment ajoutée aux solutions d'AL pour provoquer une vasoconstriction et servir de marqueur pour l'injection intravasculaire. L'épinéphrine et d'autres α1-agonistes augmentent la durée de l'AL en grande partie en prolongeant et en augmentant les concentrations intraneurales d'AL. Le débit sanguin n'est diminué que brièvement et le bloc persistera longtemps après la dissipation de l'effet α1-adrénergique sur le débit sanguin. D'autres ajouts d'AL populaires incluent la clonidine, le NaHCO3, les opioïdes, la dexaméthasone et l'hyaluronidase. Les anesthésiques locaux non chargés ont une plus grande puissance apparente à un pH basique, où une fraction accrue de molécules LA est non chargée, qu'à un pH plus acide (Figure 11). Les bases LA non chargées diffusent plus facilement à travers les gaines nerveuses et les membranes que les LA chargées, accélérant le début de l'anesthésie. Certaines études cliniques ont montré que l'ajout de bicarbonate de sodium avait une action incohérente lors d'un bloc nerveux clinique ; cependant, toutes les études n'ont pas démontré un début plus rapide de l'anesthésie. On pourrait s'attendre à ce que le bicarbonate produise son plus grand effet lorsqu'il est ajouté à des solutions LA auxquelles l'épinéphrine a été ajoutée par le fabricant. Ces solutions sont plus acides que les solutions d'AL « ordinaires » (sans épinéphrine) pour augmenter la durée de conservation. Le bicarbonate raccourcit la durée de la lidocaïne chez les animaux. Curieusement, une fois que les LA ont accès au côté cytoplasmique du canal Na, les ions H+ potentialisent le blocage dépendant de l'utilisation. Une prolongation marquée de l'anesthésie locale peut être obtenue en incorporant des AL dans des liposomes, comme cela a été fait avec la bupivacaïne dans la formulation de certains.
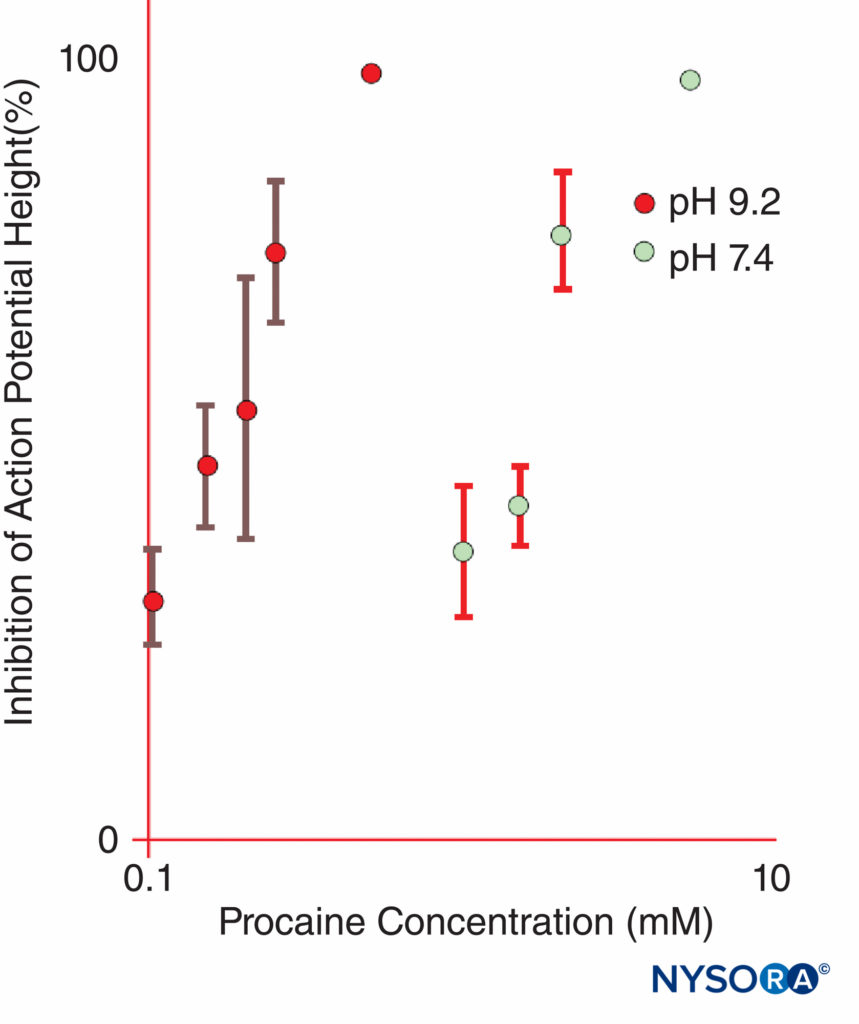
FIGURE 11. La puissance de la procaïne à inhiber les potentiels d'action composés dans les nerfs sciatiques de grenouille isolés est considérablement augmentée à pH 9.2 par rapport à pH 7.4. (Reproduit avec la permission de Butterworth JF, Lief PA, Strichartz GR : L'activité anesthésique locale dépendante du pH du diéthylaminoéthanol, un métabolite de la procaïne. Anesthésiologie. 1988 avril ;68(4):501-506.)
Conseils NYSORA
- La grossesse augmente la susceptibilité neuronale aux AL.
Les femmes enceintes et les animaux enceintes démontrent une sensibilité neurale accrue aux AL. De plus, la propagation de l'anesthésie neuraxiale augmente probablement pendant la grossesse en raison de la diminution du volume de liquide céphalo-rachidien thoraco-lombaire.
CONCENTRATIONS SANGUINES ET PHARMACOCINÉTIQUE
Les concentrations maximales d'AL varient selon le site d'injection (Figure 12). Avec la même dose d'AL, blocs intercostaux produisent systématiquement des concentrations maximales d'AL plus élevées que épidurale ou des blocs de plexus. Comme d'autres l'ont récemment discuté, parler de doses « maximales » d'AL n'a guère de sens, sauf en référence à une procédure de bloc nerveux spécifique, car les pics sanguins varient considérablement selon le site du bloc. Dans le sang, tous les LA sont partiellement liés aux protéines, principalement à la glycoprotéine α1-acide et secondairement à l'albumine.
L'affinité pour la glycoprotéine acide α1 est en corrélation avec l'hydrophobicité des LA et diminue avec la protonation (acidité). L'étendue de la liaison aux protéines est influencée par la concentration de la glycoprotéine acide α1. La liaison aux protéines et la concentration en protéines diminuent pendant la grossesse. Au cours d'une perfusion à plus long terme d'AL et d'associations d'opioïdes LA, les concentrations de protéines liant l'AL augmentent progressivement. devrait démontrer Toxicité LA après de plus petites doses de bolus intraveineux.
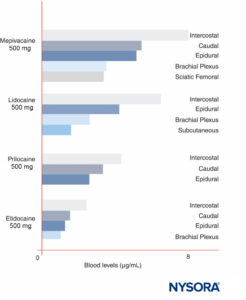
FIGURE 12. Concentrations sanguines maximales d'anesthésiques locaux après diverses formes d'anesthésie régionale. Notez que les blocs intercostaux entraînent systématiquement les plus grandes concentrations d'anesthésique local dans le sang, que les blocs du plexus entraînent les concentrations d'anesthésique local les plus faibles dans le sang et que les techniques épidurales/caudales se situent entre les deux. (Reproduit avec la permission de Covino BG, Vassallo HG : Anesthésiques locaux : Mécanismes d'action et utilisation clinique. Grune & Stratton ; 1976.)
Conseils NYSORA
- Les recommandations sur les doses maximales d'AL que l'on trouve couramment dans les textes de pharmacologie ne sont pas très utiles dans la pratique de l'anesthésie régionale clinique.
- Les concentrations sériques d'AL dépendent de la technique d'injection, du lieu d'injection et de l'ajout d'additifs à l'AL.
- Toute recommandation sur la dose maximale sans danger d'AL ne peut être valable qu'en référence à une procédure spécifique de bloc nerveux.
Les esters subissent une hydrolyse rapide dans le sang, catalysée par des estérases non spécifiques. La procaïne et la benzocaïne sont métabolisées en acide para-aminobenzoïque (PABA), l'espèce sous-jacente à l'anaphylaxie à ces agents. Des doses plus élevées de benzocaïne, généralement pour l'anesthésie topique pour l'endoscopie, peuvent entraîner des niveaux de méthémoglobinémie potentiellement mortels. Les amides subissent un métabolisme dans le foie. La lidocaïne subit une N-déal-kylation oxydative (par les cytochromes CYP 1A2 et CYP 3A4 en monoéthyl glycine xylidide et glycine xylidide). La bupivacaïne, la ropivacaïne, la mépivacaïne et l'étidocaïne subissent également une N-désalkylation et une hydroxylation. La prilocaïne est hydrolysée en o-toluidine, l'agent responsable de la méthémoglobinémie. On peut s'attendre à ce que des doses de prilocaïne aussi faibles que 400 mg chez des adultes en forme produisent des concentrations de méthémoglobinémie suffisamment élevées pour provoquer une cyanose clinique. La clairance de l'amide LA dépend fortement du débit sanguin hépatique, de l'extraction hépatique et de la fonction enzymatique; par conséquent, la clairance de l'amide LA est réduite par des facteurs qui diminuent le flux sanguin hépatique, tels que les récepteurs β-adrénergiques ou les inhibiteurs des récepteurs H2, et par insuffisance cardiaque ou hépatique. L'élimination des AL amides est modifiée pendant la grossesse en raison de l'augmentation du débit cardiaque, du débit sanguin hépatique et de la clairance, ainsi que de la diminution mentionnée précédemment de la liaison aux protéines. L'insuffisance rénale a tendance à augmenter le volume de distribution des AL amides et à augmenter l'accumulation de sous-produits métaboliques des AL esters et amides. Théoriquement, le déficit en cholinestérase et les inhibiteurs de la cholinestérase devraient augmenter le risque de toxicité systémique des LA à base d'esters ; cependant, il n'y a pas de rapports cliniques de confirmation. Certains médicaments inhibent divers cytochromes responsables du métabolisme des LA; cependant, l'importance des inhibiteurs du cytochrome varie en fonction de l'espèce LA spécifique. Les β-bloquants et les inhibiteurs des récepteurs H2 inhibent le CYP 2D6, ce qui peut contribuer à réduire le métabolisme de l'amide LA. L'itraconazole n'a aucun effet sur le débit sanguin hépatique, mais inhibe l'élimination du CYP 3A4 et de la bupivacaïne de 20 % à 25 %. La ropivacaïne est hydroxylée par le CYP 1A2 et métabolisée en 2′,6′-pipécoloxylidide par le CYP 3A4. L'inhibition du CYP 1A2 par la fluvoxamine réduit la clairance de la ropivacaïne de 70 %. En revanche, la co-administration avec des inhibiteurs puissants du CYP 3A4 (kétoconazole, itraconazole) n'a qu'un faible effet sur la clairance de la ropivacaïne.
EFFETS SECONDAIRES DIRECTS TOXIQUES
C'est une hypothèse courante, mais erronée, que toutes les actions LA, y compris les effets secondaires toxiques, résultent de l'interaction avec les canaux Na voltage-dépendants. Il existe de nombreuses preuves que les LA se lieront à de nombreuses autres cibles en dehors des canaux Na, y compris les canaux K et Ca voltage-dépendants, les canaux KATP, les enzymes, les récepteurs N-méthyl-D-aspartate, les récepteurs β-adrénergiques, la modulation médiée par la protéine G. des canaux K et Ca et des récepteurs nicotiniques de l'acétylcholine. La liaison de LA à l'un ou à tous ces autres sites pourrait sous-tendre la production de LA de spinal or analgésie péridurale et pourrait contribuer à des effets secondaires toxiques.
Effets secondaires du système nerveux central
La toxicité des anesthésiques locaux sur le SNC résulte du blocage sélectif de l'inhibition des voies excitatrices dans le SNC, produisant une séquence stéréotypée de signes et de symptômes à mesure que la concentration de LA dans le sang augmente progressivement (Tableau 3). Avec des doses accrues d'AL, des convulsions peuvent survenir dans l'amygdale. Avec un dosage supplémentaire d'AL, l'excitation du SNC évolue vers une dépression du SNC et un éventuel arrêt respiratoire. Les AL plus puissants (au niveau du bloc nerveux) produisent des convulsions à des concentrations sanguines plus faibles et à des doses plus faibles que les AL moins puissants. Dans les études animales, l'acidose métabolique et respiratoire a diminué la dose convulsive de lidocaïne.
TABLE 3. Progression des signes et symptômes de toxicité à mesure que la dose (ou la concentration) d'anesthésique local augmente progressivement.
- Vertigo
- Acouphènes
- Sentiments inquiétants
- Engourdissement circummoral
- bavardage
- Trépidations
- secousses myocloniques
- Convulsions
- Coma
- Collapsus cardiovasculaire
Toxicité cardiovasculaire
Dans les expériences de laboratoire, la plupart des LA ne produiront pas de toxicité cardiovasculaire (CV) tant que la concentration sanguine ne dépassera pas trois fois celle nécessaire pour produire des crises; cependant, il existe des rapports cliniques de toxicité simultanée sur le SNC et sur le CV avec la bupivacaïne (Tableau 4). Chez le chien, les doses supraconvulsivantes de bupivacaïne produisent plus souvent des arythmies que les doses supraconvulsivantes de ropivacaïne et de lidocaïne. Les AL produisent des signes CV d'excitation du SNC (augmentation de la fréquence cardiaque, de la pression artérielle et du débit cardiaque) à des concentrations plus faibles que celles associées à la dépression cardiaque. L'hypocapnie réduit les changements induits par la ropivacaïne dans les segments ST et la contractilité ventriculaire gauche.
Conseils NYSORA
- Dans les expériences de laboratoire, la plupart des LA ne produiront pas de toxicité CV tant que la concentration sanguine ne dépassera pas trois fois celle nécessaire pour produire des crises.
TABLE 4. Doses convulsives versus létales d'anesthésiques locaux chez le chien.
| Lidocaïne | Bupivacaïne | Tétracaïne | |
|---|---|---|---|
| Dose produisant des convulsions chez tous les animaux (mg/kg) | 22 | 5 | 4 |
| Dose produisant la létalité chez tous les animaux (mg/kg) | 76 | 20 | 27 |
Les anesthésiques locaux se lient et inhibent les canaux Na cardiaques (Nav 1.5 isoforme). La bupivacaïne se lie plus avidement et plus longtemps que la lidocaïne aux canaux Na cardiaques. Comme indiqué précédemment, certains isomères optiques R(+) lient les canaux Na cardiaques plus avidement que les isomères optiques S(–). Ces observations de laboratoire ont conduit au développement clinique de la lévobupivacaïne et de la ropivacaïne. Les anesthésiques locaux inhibent la conduction dans le cœur avec le même ordre de puissance que pour le bloc nerveux. Les anesthésiques locaux produisent une dépression myocardique dose-dépendante, peut-être à cause d'une interférence avec les mécanismes de signalisation du Ca dans le muscle cardiaque. Ces anesthésiques se lient et inhibent les canaux Ca et K cardiaques voltage-dépendants à des concentrations supérieures à celles auxquelles la liaison aux canaux Na est maximale. Les AL se lient aux récepteurs β-adrénergiques et inhibent la formation d'adénosine monophosphate cyclique (AMP) stimulée par l'épinéphrine. Chez le rat, l'ordre de classement de la toxicité cardiaque semble être bupivacaïne > lévobupivacaïne > ropivacaïne. Chez le chien, la lidocaïne était la moins puissante, et la bupivacaïne et la lévobupivacaïne étaient plus puissantes que la ropivacaïne pour inhiber la fonction ventriculaire gauche, telle qu'évaluée par échocardiographie (Tableau 5). Chez le chien, la stimulation électrique programmée et la réanimation à l'épinéphrine ont provoqué plus d'arythmies après l'administration de bupivacaïne et de lévobupivacaïne qu'après l'administration de lidocaïne ou de ropivacaïne. Le mécanisme par lequel la toxicité CV est produite peut dépendre de l'AL qui a été administré. Lorsque les AL étaient administrés jusqu'au point d'hypotension extrême, les chiens recevant de la lidocaïne pouvaient être réanimés mais nécessitaient une perfusion continue d'épinéphrine pour contrer la dépression myocardique induite par les AL. À l'inverse, de nombreux chiens recevant de la bupivacaïne ou de la lévobupivacaïne jusqu'au point d'hypotension extrême n'ont pas pu être réanimés. Après la bupivacaïne, la lévobupivacaïne ou la ropivacaïne, les chiens qui pouvaient être défibrillés n'avaient souvent pas besoin de traitement supplémentaire. De même, chez les porcs, en comparant la lidocaïne à la bupivacaïne, le rapport de puissance pour la dépression myocardique était de 1:4, alors qu'il était de 1:16 pour l'arythmogenèse. Les AL produisent une dilatation du muscle lisse vasculaire à des concentrations cliniques. La cocaïne est le seul LA qui produit systématiquement une vasoconstriction locale.
Réactions allergiques
Conseils NYSORA
- Les véritables réactions immunologiques aux AL sont rares.
- L'anaphylaxie véritable semble plus fréquente avec les LA d'ester qui sont métabolisés directement en PABA que les autres AL.
- Les injections intraveineuses accidentelles d'AL sont parfois diagnostiquées à tort comme des réactions allergiques.
- Certains patients peuvent réagir aux conservateurs, tels que le méthylparabène, inclus dans les AL.
Les véritables réactions immunologiques aux AL sont rares. Les injections intraveineuses accidentelles d'AL sont parfois diagnostiquées à tort comme des réactions allergiques. L'anaphylaxie véritable semble plus fréquente avec les AL esters qui sont métabolisés directement en PABA qu'avec les autres AL. Certains patients peuvent réagir aux conservateurs, tels que le méthylparaben, inclus avec les AL. Plusieurs études ont montré que les patients adressés pour évaluation d'une allergie apparente à l'AL, même après avoir présenté des signes ou des symptômes d'anaphylaxie, ne démontrent presque jamais une véritable allergie à l'AL qui leur a été administré. En revanche, les tests cutanés LA ont une excellente valeur prédictive négative. En d'autres termes, 97% des patients qui ne répondent pas aux tests cutanés LA n'auront pas non plus de réaction allergique au LA dans un cadre clinique.
TABLE 5. Effets des anesthésiques locaux sur les indices de la fonction myocardique mesurés chez le chien.
| Anesthésie locale | LVEDP (CE50 pour base 125 %) (mcg/ml) | dP/dtmax (CE50 pour base 65 %) (mcg/ml) | %FS (CE50 pour base 65 %) (mcg/ml) |
|---|---|---|---|
| Bupivacaïne | 2.2 (1.2 – 4.4) | 2.3 (1.7 – 3.1) | 2.1 (1.47 – 3.08) |
| Lévobupivacaïne | 1.7 (0.9 – 3.1) | 2.4 (1.9 – 3.1) | 1.3 (0.9 – 1.8) |
| Ropivacaïne | 4.0 (2.1 – 7.5)un/sup> | 4.0 (3.1 – 5.2)b | 3.0 (2.1 – 4.2)un/sup> |
| Lidocaïne | 6.8 (3.0 – 15.4)c | 8.0 (5.7 – 11.0)d | 5.5 (3.5 – 8.7)d |
Effets neurotoxiques
Au cours des années 1980, la 2-chloroprocaïne (alors formulée avec du métabisulfite de sodium à un pH relativement acide) provoquait occasionnellement le syndrome de la queue de cheval suite à une injection intrathécale accidentelle à forte dose lors d'une tentative d'administration péridurale. La question de savoir si la "toxine" est la 2-chloroprocaïne ou le métabisulfite de sodium reste incertaine : la 2-chloroprocaïne est actuellement testée comme substitut de la lidocaïne dans la rachianesthésie humaine, et une série de publications suggèrent qu'elle pourrait être sûre et efficace. Dans le même temps, d'autres chercheurs ont lié les réactions neurotoxiques chez les animaux à de fortes doses de 2-chloroprocaïne plutôt qu'au métabisulfite. Il existe également une controverse sur les symptômes neurologiques transitoires et les déficits sacrés persistants après une rachianesthésie à la lidocaïne. Les rapports et la controverse ont persuadé de nombreux médecins d'abandonner la rachianesthésie à la lidocaïne. Contrairement aux autres solutions d'AL spinales, la lido-caïne 5% interrompt définitivement la conduction lorsqu'elle est appliquée sur des nerfs isolés ou sur des neurones isolés. Cela peut être le résultat d'augmentations du calcium intracellulaire induites par la lidocaïne et ne semble pas impliquer le blocage du canal Na. Bien qu'il soit impossible de "prouver l'innocuité", plusieurs études suggèrent que la chloroprocaïne ou la mépivacaïne peuvent remplacer la lidocaïne pour les rachianesthésies brèves.
Traitement de la toxicité anesthésique locale
Le traitement des effets indésirables LA dépend de leur gravité. Les réactions mineures peuvent être autorisées à se terminer spontanément. Les convulsions induites par les AL doivent être gérées en maintenant une voie aérienne dégagée et en fournissant de l'oxygène. Les convulsions peuvent être arrêtées avec du midazolam intraveineux (0.05–0.10 mg/kg) ou du propofol (0.5–1.5 mg/kg) ou une dose paralysante de succinylcholine (0.5–1 mg/kg), suivie d'une ventilation avec un ballon et masque (ou intubation trachéale). LA dépression CV se manifestant par une hypotension modérée, peut être traitée par perfusion de liquides intraveineux et de vasopresseurs (phényléphrine 0.5–5 μg/kg/min, noradrénaline 0.02–0.2 μg/kg/min ou vasopressine 40 μg IV). En cas d'insuffisance myocardique, l'épinéphrine (bolus IV de 1 à 5 μg/kg) peut être nécessaire. Lorsque la toxicité évolue vers un arrêt cardiaque, les lignes directrices pour le traitement de la toxicité de l'AL telles que développées par l'American Society of Regional Anesthesia and Pain Medicine (ASRA) sont raisonnables, et certainement préférables aux schémas de réanimation chaotiques identifiés dans une enquête nationale avant la publication de la ligne directrice. Il est logique que l'amiodarone soit substituée à la lidocaïne et, sur la base d'expérimentations animales multiples, que des doses plus petites et progressives d'épinéphrine soient utilisées initialement plutôt que des bolus de 1 mg. Des expériences sur des animaux et des rapports cliniques démontrent la capacité remarquable de la perfusion de lipides à ressusciter un arrêt cardiaque induit par la bupivacaïne (Figure 13). Compte tenu du statut presque non toxique de la perfusion de lipides, on ne peut pas présenter d'argument convaincant pour refuser cette thérapie à un patient nécessitant une réanimation suite à une intoxication à l'AL. En cas de bupivacaïne non réactive, une toxicité cardiaque doit être envisagée. Il semble que la menace de la toxicité systémique sévère des anesthésiques locaux soit en déclin, que ce soit en raison d'un meilleur traitement ou de changements dans les techniques. Une minorité dira que le risque a été exagéré dès le départ, du moins entre des mains expérimentées. De nombreux praticiens pensent que le guidage échographique pendant les blocs nerveux périphériques a conduit à des pratiques plus sûres et à moins de risques. Bien que ce point de vue reste controversé, il existe des études qui soutiennent cette croyance.
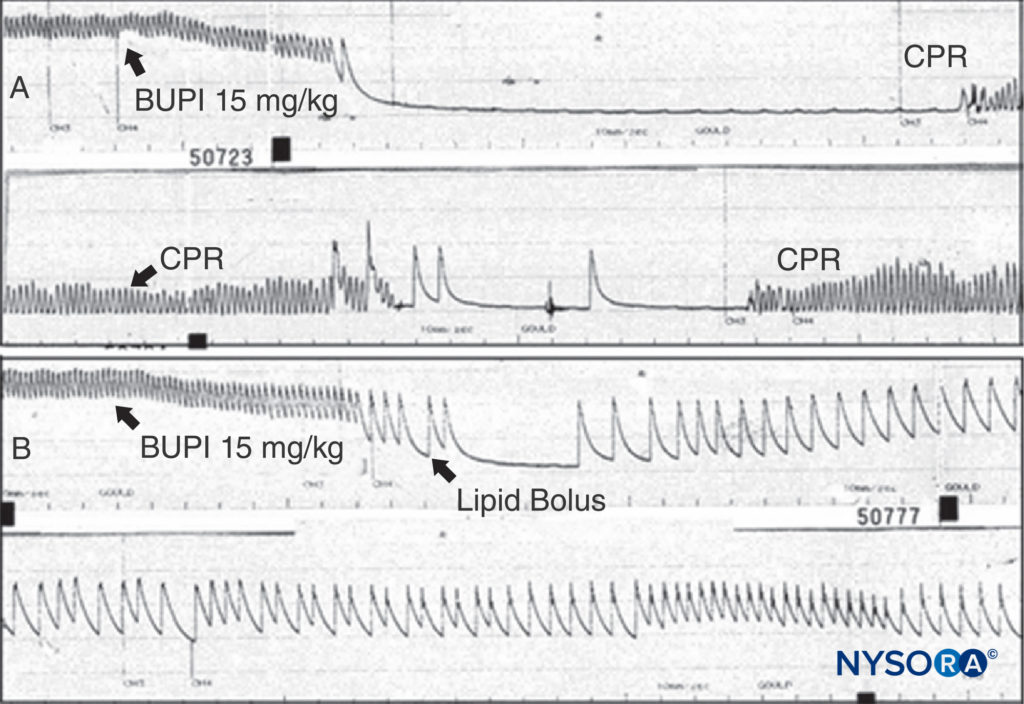
FIGURE 13. A : Un rat anesthésié reçoit de la bupivacaïne 15 mg/kg comme indiqué. La pression artérielle diminue rapidement jusqu'à l'arrêt cardiaque. Une réanimation cardiorespiratoire (RCP) est administrée, mais aucune pression artérielle n'est observée lorsque la RCP est interrompue. B : La même expérience est menée, mais un bolus de lipide est administré ; notez que la pression artérielle n'est jamais perdue (malgré l'utilisation de la même dose de bupivacaïne) et qu'il ne s'ensuit pas d'arrêt cardiaque. (Reproduit avec la permission de Weinberg G: Current concepts in resuscitation of patients with local anesthetic hearttoxicity. Reg Anesth Pain Med. 2002 Nov-Dec;27(6):568-575.)
EN RÉSUMÉ
Après plus d'un siècle d'utilisation en médecine occidentale, les LA restent des outils importants pour le médecin du XXIe siècle. Les blocs nerveux périphériques sont presque certainement le résultat de l'inhibition LA des canaux Na voltage-dépendants dans les membranes neuronales. Les mécanismes de l'anesthésie rachidienne et péridurale restent incomplètement définis. La dose appropriée et sûre d'AL varie selon la procédure de bloc nerveux spécifique. Les mécanismes par lesquels différents LA produisent une toxicité CV varient probablement : les agents les plus puissants (p. ex., la bupivacaïne) peuvent produire des arythmies par l'action d'un canal Na, tandis que les agents moins puissants (p. ex., la lidocaïne) peuvent produire une dépression myocardique par d'autres voies. Les craintes concernant la toxicité systémique des LA se sont atténuées avec des LA plus sûres, des pratiques d'anesthésie régionale plus sûres et des traitements améliorés. Des efforts renouvelés sont déployés pour produire des formulations d'anesthésiques locaux à libération retardée applicables sur le plan clinique afin de prolonger la durée des AL actuellement disponibles.
Références
- Vandam LD : Quelques aspects de l'histoire de l'anesthésie locale. Dans Strichartz GR (ed): Anesthésiques locaux: Manuel de pharmacologie expérimentale. Springer-Verlag, 1987, pp 1–19.
- Calatayud J, Gonzalez A : Histoire du développement et de l'évolution de l'anesthésie locale depuis la feuille de coca. Anesthésiologie 2003 ;98 :1503–1508.
- Strichartz GR : Anesthésiques locaux : Manuel de pharmacologie expérimentale. Springer-Verlag, 1987.
- de Jong RH : Anesthésiques locaux. Mosby-Year Book, 1994.
- Clés TE : L'histoire de l'anesthésie chirurgicale. Wood Library, Musée d'anesthésiologie, 1996.
- Butterworth JF IV, Strichartz GR : Mécanismes moléculaires de l'anesthésie locale : Une revue. Anesthésiologie 1990 ; 72 : 711–734.
- Tetzlaff J : Pharmacologie clinique des anesthésiques locaux. Butterworth-Heinemann, 2000.
- Ahern CA, Payandeh J, Bosmans F, Chanda B. Le guide de l'auto-stoppeur de la galaxie des canaux sodiques voltage-dépendants. J Gen Physiol. 2016 ;147 : 1–24.
- de Lera Ruiz M, Kraus RL. Canaux sodiques voltage-dépendants : structure, fonction, pharmacologie et indications cliniques. J Med Chem. 2015;58:7093–7118.
- Lopreato GF, Lu Y, Southwell A, et al : Évolution et divergence des gènes du canal sodique chez les vertébrés. Proc Natl Acad Sci USA 2001; 98:7588–7592.
- Savio-Galmiberti E. Gollob MH, Darbar D : Canaux sodiques voltage-dépendants : biophysique, pharmacologie et canalopathies associées. Avant Pharmacol 2012;3:1–19
- Chen-Izu Y, Shaw RM, Pitt GS, et al. Fonction, régulation, structure, trafic et séquestration du canal Na+. J Physiol. 2015;593:1347–1360
- Hille B : Canaux ioniques des membranes excitables, 3e éd. Sinauer, 2001.
- Jiang Y, Lee A, Chen J, et al : structure aux rayons X d'un canal K + dépendant de la tension. Nature 2003;423:33–41.
- Freites JA, Tobias DJ. Détection de tension dans les membranes : des courants macroscopiques aux mouvements moléculaires. J Membre Biol. 2015;248:419–430.
- Taylor RE. Effet de la procaïne sur les propriétés électriques de la membrane axonale du calmar. Am J Physiol 1959;196:1070–1078.
- Strichartz GR. L'inhibition des courants de sodium dans le nerf myélinisé par des dérivés quaternaires de la lidocaïne. J Gen Physiol. 1973 ; 62 : 37–57.
- Ragsdale DS, McPhee JC, Scheuer T, et al : Déterminants moléculaires du blocage dépendant de l'état des canaux Na+ par les anesthésiques locaux. Sciences 1994;265 :1724–1728.
- Wang GK, Quan C, Wang S : Un récepteur anesthésique local commun pour la benzocaïne et l'étidocaïne dans les canaux mu1 Na+ voltage-dépendants. Pflugers Arch 1998;435:293–302.
- Sudoh Y, Cahoon EE, Gerner P, et al : antidépresseurs tricycliques comme anesthésiques locaux à action prolongée. Douleur 2003 ; 103 : 49–55.
- Kohane DS, Lu NT, Gokgol-Kline AC, et al : Les propriétés anesthésiques locales et la toxicité des homologues de la saxitonine pour le blocage du nerf sciatique du rat in vivo. Reg Anesth Pain Med 2000;25:52–59.
- Butterworth JF IV, Strichartz GR : Les agonistes alpha 2-adrénergiques clonidine et guanfacine produisent un blocage tonique et phasique de la conduction dans les fibres du nerf sciatique du rat. Anesth Analg 1993;76:295–301.
- Sanchez V, Arthur GR, Strichartz GR : Propriétés fondamentales des anesthésiques locaux. I. La dépendance de l'ionisation de la lidocaïne et de la partition octanol:tampon sur le solvant et la température. Anesth Analg 1987;66 : 159–165.
- Strichartz GR, Sanchez V, Arthur GR, et al : Propriétés fondamentales des anesthésiques locaux. II. Coefficients de partage octanol:tampon mesurés et valeurs de pKa des médicaments utilisés en clinique. Anesth Analg 1990;71:158–170.
- Popitz-Bergez FA, Leeson S, Strichartz GR, et al : Relation entre le déficit fonctionnel et l'anesthésie locale intraneurale pendant le bloc nerveux périphérique. Une étude sur le nerf sciatique du rat. Anesthésiologie 1995;83 :583–592.
- Sinnott CJ, Cogswell LP III, Johnson A, et al : sur le mécanisme par lequel l'épinéphrine potentialise le bloc nerveux périphérique de la lidocaïne. Anesthésiologie 2003 ;98 : 181–188.
- Nakamura T, Popitz-Bergez F, Birknes J, et al : Le rôle critique de la concentration pour le bloc de lidocaïne du nerf périphérique in vivo : Études de la fonction et de l'absorption de médicaments chez le rat. Anesthésiologie 2003;99 : 1189–1197.
- Brouneus F, Karami K, Beronius P, et al : propriétés de transport diffusives de certains anesthésiques locaux applicables à la formulation iontophorétique des médicaments. Int J Pharm 2001;218:57–62.
- Gissen AJ, Covino BG, Gregus J : Sensibilités différentielles des fibres nerveuses des mammifères aux agents anesthésiques locaux. Anesthésiologie 1980 ; 53 : 467–474.
- Raymond SA, Gissen AJ : Mécanismes du bloc nerveux différentiel. In Strichartz GR (ed): Manuel de pharmacologie expérimentale: Anesthésiques locaux. Springer-Verlag, 1987, pp 95–164.
- Butterworth J, Ririe DG, Thompson RB, et al : Apparition différentielle du bloc nerveux médian : comparaison randomisée en double aveugle de la mépivacaïne et de la bupivacaïne chez des volontaires sains. Br J Anaesth 1998; 81:515–521.
- Novakovic SD, Eglen RM, Hunter JC : Régulation de la distribution des canaux Na+ dans le système nerveux. Tendances Neurosci 2001;24:473–478.
- Covino BG, Vasallo HG : Anesthésiques locaux. Grune et Stratton, 1976.
- Kohane DS, Lu NT, Cairns BE, et al : effets des agonistes et antagonistes adrénergiques sur le bloc nerveux induit par la tétrodotoxine. Reg Anesth Pain Med 2001;26:239–245.
- Butterworth JF IV, Lief PA, Strichartz GR : L'activité anesthésique locale dépendante du pH du diéthylaminoéthanol, un métabolite de la procaïne. Anesthésiologie 1988;68:501–506.
- Fagraeus L, Urban BJ, Bromage PR : Propagation de l'analgésie péridurale en début de grossesse. Anesthésiologie 1983 ; 58 : 184–187.
- Butterworth JF IV, Walker FO, Lysak SZ : La grossesse augmente la sensibilité du nerf médian à la lidocaïne. Anesthésiologie 1990 ; 72 : 962–965.
- Popitz-Bergez FA, Leeson S, Thalhammer JG, et al : absorption intraneurale de lidocaïne par rapport aux différences analgésiques entre rats gravides et non gravides. Reg Anesth 1997;22:363–371.
- Scott DB, Jebson PJ, Braid DP, et al : facteurs affectant les taux plasmatiques de lidocaïne et de prilocaïne. Br J Anaesth 1972;44:1040–1049.
- Rosenberg PH, Veering BTh, Urmey WF : Doses maximales recommandées d'anesthésiques locaux : un concept multifactoriel. Reg Anesth Pain Med 2004;29:564–575.
- Taheri S, Cogswell LP III, Gent A, et al : Facteurs hydrophobes et ioniques dans la liaison des anesthésiques locaux à la variante majeure de la glycoprotéine acide alpha1 humaine. J Pharmacol Exp Ther 2003;304:71–80.
- Fragneto RY, Bader AM, Rosinia F, et al : Mesures de la liaison protéique de la lidocaïne tout au long de la grossesse. Anesth Analg 1994;79 : 295–297.
- Thomas JM, Schug SA : Progrès récents dans la pharmacocinétique des anesthésiques locaux. Énantiomères amides à longue durée d'action et infusions continues. Clin Pharmacokinet 1999;36:67–83.
- Rothstein P, Arthur GR, Feldman HS, et al : bupivacaïne pour les blocs nerveux intercostaux chez les enfants : concentrations sanguines et pharmacocinétique. Anesth Analg 1986;65:625–632.
- Bokesch PM, Castaneda AR, Ziemer G, et al : L'influence d'un shunt cardiaque de droite à gauche sur la pharmacocinétique de la lidocaïne. Anesthésiologie 1987 ; 67:739–744.
- Palkama VJ, Neuvonen PJ, Olkkola KT : Effet de l'itraconazole sur la pharmacocinétique des énantiomères de la bupivacaïne chez des volontaires sains. Br J Anaesth 1999;83:659–661.
- Oda Y, Furuichi K, Tanaka K, et al : Métabolisme d'un nouvel anesthésique local, la ropivacaïne, par le cytochrome hépatique humain P450. Anesthésiologie 1995 ; 82 : 214–220.
- Ekstrom G, Gunnarsson UB : La ropivacaïne, un nouvel anesthésique local de type amide, est métabolisée par les cytochromes P450 1A et 3A dans les microsomes hépatiques humains. Drug Metab Dispos 1996;24:955–961.
- Hirota K, Browne T, Appadu BL, et al : Les anesthésiques locaux interagissent-ils avec les sites de liaison de la dihydropyridine sur les canaux neuronaux Ca2+ de type L ? Br J Anaesth 1997;78:185–188.
- Olschewski A, Olschewski H, Brau ME, et al : Effet de la bupivacaïne sur les canaux potassiques dépendants de l'ATP dans les cardiomyocytes de rat. Br J Anaesth 1999;82:435–438.
- Sugimoto M, Uchida I, Fukami S, et al : les effets dépendants des sous-unités alpha et gamma des anesthésiques locaux sur les récepteurs GABA(A) recombinants. Eur J Pharmacol 2000;401:329–337.
- Englesson S, Grevsten S: L'influence des changements acido-basiques sur la toxicité du système nerveux central des agents anesthésiques locaux. II. Acta Anaesthesiol Scand 1974;18:88–103.
- Feldman HS, Arthur GR, Covino BG : Toxicité systémique comparative des doses convulsivantes et supraconvulsivantes de ropivacaïne, bupivacaïne et lidocaïne intraveineuses chez le chien conscient. Anesth Analg 1989;69 : 794–801.
- Porter JM, Markos F, Snow HM, et al : effets des changements de pH respiratoire et métabolique et de l'hypoxie sur la cardiotoxicité induite par la ropivacaïne chez le chien. Br J Anaesth 2000;84:92–94.
- Chernoff DM : Analyse cinétique de l'inhibition phasique des courants sodiques neuronaux par la lidocaïne et la bupivacaïne. Biophys J 1990;58:53–68.
- Feldman HS, Covino BM, Sage DJ : Effets directs chronotropes et inotropes des agents anesthésiques locaux dans les oreillettes isolées de cobaye. Reg Anesth 1982;7:149–156.
- Reiz S, Nath S : Cardiotoxicité des agents anesthésiques locaux. Br J Anaesth 1986;58:736–746.
- McCaslin PP, Butterworth J : La bupivacaïne supprime les oscillations [Ca(2+)](i) dans les cardiomyocytes de rat nouveau-né avec une augmentation de K+ extracellulaire et est inversée avec une augmentation de Mg(2+) extracellulaire. Anesth Analg 2000;91:82–88.
- Butterworth JF IV, Brownlow RC, Leith JP, et al : la bupivacaïne inhibe la production de monophosphate d'adénosine-3′,5′-cyclique. Un facteur contributif possible à la toxicité cardiovasculaire. Anesthésiologie 1993;79:88–95.
- Butterworth J, James RL, Grimes J : Relations structure-affinité et stéréospécificité de plusieurs séries homologues d'anesthésiques locaux pour le récepteur bêta2-adrénergique. Anesth Analg 1997;85:336–342.
- Ohmura S, Kawada M, Ohta T, et al : Toxicité systémique et réanimation chez des rats infusés à la bupivacaïne, à la lévobupivacaïne ou à la ropivacaïne. Anesth Analg 2001;93:743–748.
- Dony P, Dewinde V, Vanderick B, et al : la toxicité comparative de la ropivacaïne et de la bupivacaïne à des doses équipotentes chez le rat. Anesth Analg 2000;91:1489–1492.
- Chang DH, Ladd LA, Copeland S, et al : Effets cardiaques directs de la bupivacaïne intracoronaire, de la lévobupivacaïne et de la ropivacaïne chez le mouton. Br J Pharmacol 2001;132:649–658.
- Groban L, Deal DD, Vernon JC, et al : Arythmies ventriculaires avec ou sans stimulation électrique programmée après un surdosage progressif avec de la lidocaïne, de la bupivacaïne, de la lévobupivacaïne et de la ropivacaïne. Anesth Analg 2000;91:1103–1111.
- Groban L, Deal DD, Vernon JC, et al : réanimation cardiaque après un surdosage progressif avec de la lidocaïne, de la bupivacaïne, de la lévobupivacaïne et de la ropivacaïne chez des chiens anesthésiés. Anesth Analg 2001;92:37–43.
- Groban L, Deal DD, Vernon JC, et al : La stéréosélectivité ou la structure de l'anesthésique local prédit-elle la dépression myocardique chez les chiens anesthésiés ? Reg Anesth Pain Med 2002;27:460–468.
- Nath S, Haggmark S, Johansson G, et al : Dépresseur différentiel et cardiotoxicité électrophysiologique des anesthésiques locaux : une étude expérimentale avec une référence particulière à la lidocaïne et à la bupivacaïne. Anesth Analg 1986;65:1263–1270.
- Carpenter RL, Kopacz DJ, Mackey DC : Précision des mesures de débit capillaire Doppler au laser pour prédire la perte de sang par incisions cutanées chez les porcs. Anesth Analg 1989;68:308–311.
- deShazo RD, Nelson HS: Une approche du patient ayant des antécédents d'hypersensibilité anesthésique locale: Expérience avec 90 patients. J Allergy Clin Immunol 1979;63:387–394.
- Berkun Y, Ben-Zvi A, Levy Y, et al : Évaluation des réactions indésirables aux anesthésiques locaux : Expérience avec 236 patients. Ann Allergy Asthma Immunol 2003;91:342–345.
- Gissen AJ, Datta S, Lambert D : La controverse sur la chloroprocaïne. I. Une hypothèse pour expliquer les complications neurales de la péridurale à la chloroprocaïne. Reg Anesth 1984;9:124–134.
- Gissen AJ, Datta S, Lambert D : La controverse sur la chloroprocaïne. II. La chloroprocaïne est-elle neurotoxique ? Reg Anesth 1984;9:135–145.
- Winnie AP, Nader AM : La prophétie de Santayana s'est accomplie. Reg Anesth Pain Med 2001;26:558–564.
- Kouri ME, Kopacz DJ : Spinal 2-chloroprocaïne : une comparaison avec la lidocaïne chez des volontaires. Anesth Analg 2004;98:75–80.
- Taniguchi M, Bollen AW, Drasner K : Bisulfite de sodium : bouc émissaire de la neurotoxicité de la chloroprocaïne ? Anesthésiologie 2004 ; 100 : 85–91.
- Lambert LA, Lambert DH, Strichartz GR : Bloc de conduction irréversible dans un nerf isolé par de fortes concentrations d'anesthésiques locaux. Anesthésiologie 1994;80:1082–1093.
- Gold MS, Reichling DB, Hampl KF, et al : Toxicité de la lidocaïne dans les neurones afférents primaires du rat. J Pharmacol Exp Ther 1998;285:413–421.
- Neal JM, Bernards CM, Butterworth JF 4th, et al. Avis de pratique de l'ASRA sur la toxicité systémique des anesthésiques locaux. Reg Anesth Douleur Med. 2010;35 : 152–61
- Corcoran W, Butterworth J, Weller RS et al. Toxicité cardiaque induite par l'anesthésie locale : une enquête sur les stratégies de pratique contemporaines dans les départements d'anesthésiologie universitaires. Anesth Analg. 2006;103:1322–6
- El-Boghdadly K, Chin KJ. Toxicité systémique des anesthésiques locaux : développement professionnel continu. Can J Anesth. 2016;63:330–349
- Krismer AC, Hogan QH, Wenzel V, et al : L'efficacité de l'épinéphrine ou de la vasopressine pour la réanimation pendant l'anesthésie péridurale. Anesth Analg 2001;93:734–742.
- Mayr VD, Raedler C, Wenzel V, et al : une comparaison de l'épinéphrine et de la vasopressine dans un modèle porcin d'arrêt cardiaque après une injection intraveineuse rapide de bupivacaïne. Anesth Analg 2004;98:1426–1431.
- Weinberg GL, VadeBoncouer T, Ramaraju GA, et al : le prétraitement ou la réanimation avec une perfusion de lipides modifie la dose-réponse à l'asystole induite par la bupivacaïne chez le rat. Anesthésiologie 1998;88 :1071–1075.
- Weinberg G, Ripper R, Feinstein DL, et al : la perfusion d'émulsion lipidique sauve les chiens de la toxicité cardiaque induite par la bupivacaïne. Reg Anesth Pain Med 2003;28:198–202.
- Fettiplace MR, Weinberg G. Passé, présent et futur de la thérapie de réanimation lipidique. JPEN J Parenter Enteral Nutr. 2015 ; 39 (1 supplément) : 72S-83S.
- Soltesz EG, van Pelt F, Byrne JG : Pontage cardiopulmonaire émergent pour la cardiotoxicité de la bupivacaïne. J Cardiothorac Vasc Anesth 2003;17 : 357–358.
- Vasques F, Behr AU, Weinberg G, et al. Examen des cas de toxicité systémique des anesthésiques locaux depuis la publication des recommandations de l'American Society of Regional Anesthesia : à qui de droit. Reg Anesth Douleur Med. 2015;40:698–705.
- Liu SS, Ortolan S, Sandoval MV, Curren J, Fields KG, Memtsoudis SG, YaDeau JT. Arrêt cardiaque et convulsions causées par la toxicité systémique des anesthésiques locaux après des blocs nerveux périphériques : devons-nous encore craindre le faucheur ? Reg Anesth Douleur Med. 2016;4:5–21.
- Barrington MJ, Kluger R. Le guidage échographique réduit le risque de toxicité systémique anesthésique locale après un bloc nerveux périphérique. Reg Anesth Douleur Med. 2013;38:289–299.
- Neal JM, Brull R, Horn JL, et al. La deuxième société américaine d'anesthésie régionale et de médecine de la douleur Évaluation de la médecine factuelle de l'anesthésie régionale guidée par ultrasons : résumé. Reg Anesth Douleur Med. 2016;41:181–194