Erika Cvetko, Marija Meznarič et Tatjana Stopar Pintaric
INTRODUCTION
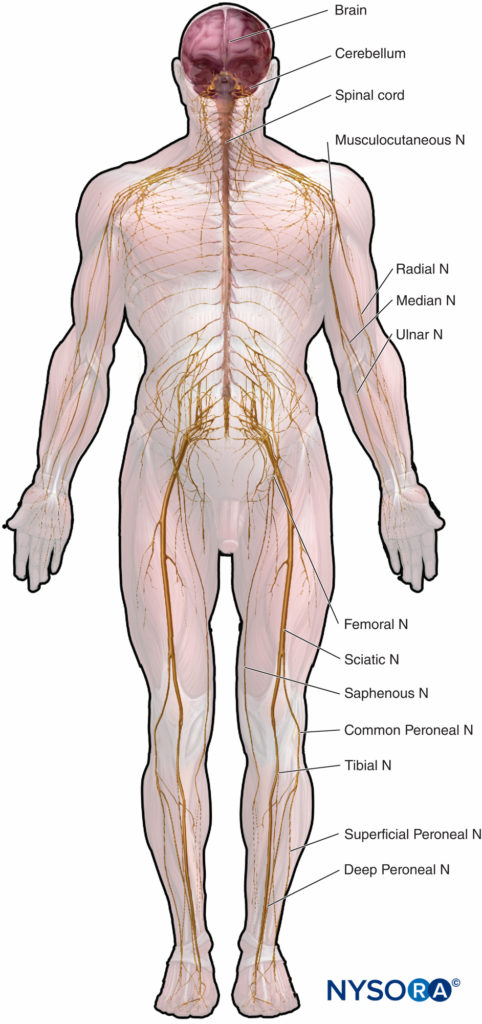
L'anatomie microscopique qui met l'accent sur les relations structure-fonction est importante pour la pratique clinique de l'anesthésie régionale. Ce chapitre fournit une base pour comprendre la structure, la classification et l'organisation des nerfs périphériques et un aperçu de la façon dont les caractéristiques des nerfs périphériques (Figure 1) concernent la pratique clinique de l'anesthésie régionale.
ORGANISATION DU SYSTÈME NERVEUX PÉRIPHÉRIQUE
Le système nerveux permet au corps de répondre aux changements continus de son environnement externe et interne. Il contrôle et intègre les activités fonctionnelles des organes et des systèmes d'organes.
Les cellules du système nerveux sont constituées de neurones et de névroglie. Les neurones transmettent les impulsions nerveuses vers et depuis le système nerveux central (SNC), intégrant ainsi les fonctions motrices et sensorielles. Les cellules neurogliales soutiennent et protègent les neurones. Dans le SNC, la myéline est produite par les oligodendrocytes et dans le système nerveux périphérique (SNP) par les cellules de Schwann. Bien que les cellules de Schwann et les oligodendrocytes soient responsables de la myélinisation des axones, ils ont des propriétés morphologiques et moléculaires distinctes et des origines embryonnaires différentes, respectivement la crête neurale et le tube neural.
Le SNP est constitué de nerfs périphériques (craniospinaux, somatiques, autonomes) avec leurs ganglions associés et les investissements du tissu conjonctif. Tous se situent à la périphérie de la couverture piale du SNC.
Les nerfs périphériques contiennent des faisceaux de fibres nerveuses constitués d'axones. Dans les fibres nerveuses périphériques, les axones sont enveloppés par des cellules de Schwann, qui peuvent ou non former de la myéline autour des axones, selon leur diamètre. Les fibres nerveuses sont regroupées en faisceaux de nombres variables. La taille, le nombre et la configuration des fascicules varient dans différents nerfs et à différents niveaux le long de leurs trajets. Généralement, leur nombre augmente et leur taille diminue à une certaine distance à proximité du point de ramification.
NEURONES
Un neurone est l'unité structurelle et fonctionnelle du système nerveux. Il comprend le corps cellulaire, les dendrites et l'axone.
Le corps cellulaire (périkarion) est la région dilatée du neurone qui contient un gros noyau euchromatique avec un nucléole proéminent et un cytoplasme périnucléaire environnant (Figure 2). Le cytoplasme périnucléaire contient un réticulum endoplasmique abondant à surface rugueuse et des ribosomes libres. En microscopie optique, le réticulum endoplasmique rugueux avec des rosettes de ribosomes libres apparaît sous forme de petits corps, appelés corps de Nissl. Le cytoplasme périnucléaire contient de nombreuses mitochondries, un grand appareil de Golgi périnucléaire, des liposomes, des microtubules, des neurofilaments, des vésicules de transport et des inclusions. La présence du noyau euchromatique, du grand nucléole, de l'appareil de Golgi proéminent et des corps de Nissl indique le niveau élevé d'activité anabolique nécessaire pour maintenir ces grandes cellules.
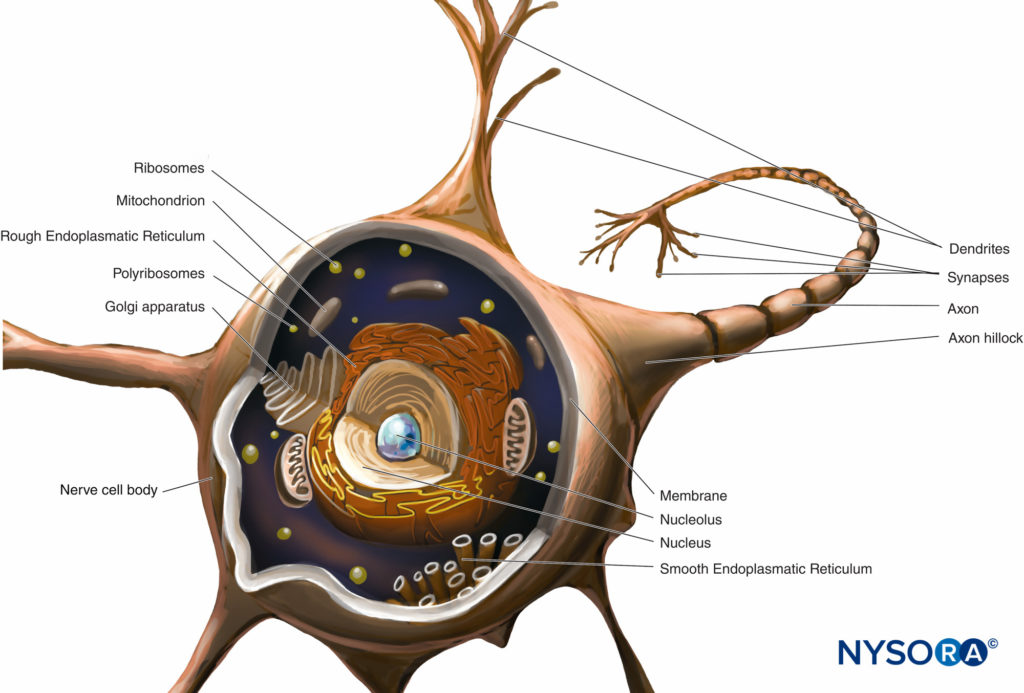
FIGURE 2. Schéma d'un neurone multipolaire. Le corps de la cellule nerveuse, les dendrites et la partie proximale de l'axone se trouvent dans le SNC. Les axones sortant du SNC en aval des foramens intervertébraux ou des foramens du crâne constituent la partie principale du SNP.
Dendrites sont des élaborations de la membrane plasmique réceptive du neurone. La plupart des neurones possèdent plusieurs dendrites qui proviennent généralement du corps cellulaire sous forme de troncs courts simples qui se ramifient en branches plus petites qui se rétrécissent aux extrémités. Les schémas de ramification des dendrites sont caractéristiques de chaque type de neurone. La base de la dendrite contient les mêmes organites que le corps cellulaire, à l'exception de l'appareil de Golgi. De nombreux organites deviennent clairsemés ou absents vers l'extrémité distale de la dendrite. La ramification des dendrites donne plusieurs terminaux synaptiques et permet à un neurone de recevoir et d'intégrer plusieurs impulsions.
L'axone provient du corps cellulaire en un seul processus mince, beaucoup plus long que les dendrites. Son épaisseur est directement liée à la vitesse de conduction, qui augmente avec le diamètre axonal. Certains axones possèdent des branches collatérales. La partie de l'axone entre le corps cellulaire et le début de la gaine de myéline est le segment initial. A l'extrémité de l'axone, les ramifications peuvent former de nombreuses petites branches. Le cytoplasme axonal est appelé axoplasme.
Presque toutes les molécules de protéines structurelles et fonctionnelles sont synthétisées dans le corps cellulaire et sont transportées vers des emplacements distants à l'intérieur d'un neurone dans un processus connu sous le nom de transport axonal. Crucial pour les relations trophiques au sein de l'axone, le transport axonal sert de mode de communication intracellulaire transportant des molécules et des informations le long des microtubules et des filaments intermédiaires du corps cellulaire neuronal à l'axone terminal (transport antérograde) ou de l'axone terminal au corps cellulaire neuronal. (transport rétrograde). Les neurones communiquent avec d'autres neurones et avec les cellules effectrices en synapses. Ces jonctions spéciales entre les neurones et les cellules effectrices facilitent la transmission de l'influx nerveux d'un neurone (présynaptique) à un autre neurone (postsynaptique) ou des axones aux cellules effectrices (cibles), telles que les cellules musculaires et glandulaires.
Les neurones ont une plus grande variation de taille et de forme que tout autre groupe de cellules dans le corps. Ils sont classés morphologiquement en trois grands types selon leur forme et l'agencement de leurs prolongements. Le type de neurone le plus courant, multipolaire, possède un seul axone avec divers arrangements de dendrites multiples émanant du corps cellulaire. La majorité des neurones multipolaires (Figure 2 et Figure 3) sont des motoneurones. Un deuxième type de neurone, unipolaire ou pseudo-unipolaire (Figure 3), ne possède qu'un seul processus, l'axone émanant du corps cellulaire et s'ouvrant dans les branches périphériques et centrales peu après avoir quitté le corps cellulaire. La branche centrale entre dans le SNC, tandis que la branche périphérique se dirige vers son récepteur correspondant dans le corps. Chacune des deux branches est morphologiquement axonale et peut propager l'influx nerveux, bien que la partie très distale de la branche périphérique s'arborise, indiquant sa fonction réceptrice. La majorité des neurones unipolaires sont des neurones sensoriels, dont les corps cellulaires sont situés dans les ganglions de la racine dorsale des nerfs rachidiens et dans les ganglions sensoriels des nerfs crâniens. Le troisième type de neurone, bipolaire, possède deux processus émanant du corps cellulaire : une seule dendrite et un seul axone. Ils ne peuvent être trouvés que dans certains nerfs crâniens.
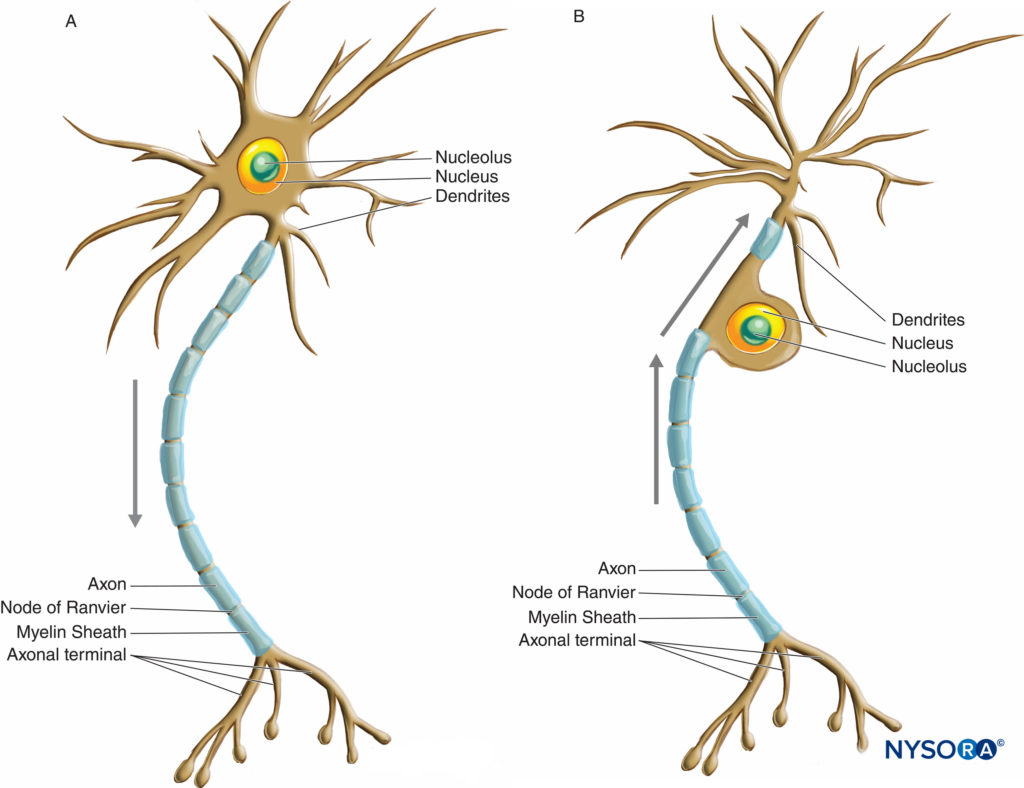
FIGURE 3. Schéma illustrant un neurone multipolaire (A) et unipolaire ou pseudo-unipolaire (B). Les flèches indiquent le sens de propagation de l'influx nerveux.
Fonctionnellement, le système nerveux a somatique et autonome Composants. Les fibres nerveuses innervant les tissus dérivés des somites (muscles et peau) sont qualifiées de somatiques ; les fibres nerveuses innervant les dérivés endodermiques ou mésodermiques (organes internes) sont viscérales. Le système nerveux somatique contrôle les fonctions qui sont sous contrôle volontaire conscient à l'exception de l'arc réflexe. Il assure l'innervation sensorielle et motrice de toutes les parties du corps à l'exception des viscères, des muscles lisses, du muscle cardiaque et des glandes. Le système nerveux autonome fournit une innervation involontaire efférente aux muscles et aux glandes lisses et cardiaques. Il assure également l'innervation sensorielle afférente des viscères (douleur et réflexes autonomes).
Axones efférents
Les axones efférents proviennent du système nerveux somatique ou autonome. Les neurones somatiques efférents (moteurs) innervent le muscle squelettique et ont des corps cellulaires situés dans les noyaux moteurs somatiques du tronc cérébral (nerfs crâniens) ou dans les cornes ventrales de la moelle épinière (nerfs spinaux).
Les neurones efférents viscéraux préganglionnaires de la partie sympathique du système nerveux autonome proviennent de la colonne intermédiolatérale de la moelle épinière entre les niveaux T1 et L2 et synapse sur paravertébral or prévertébral ganglions (préaortiques). Les nerfs périphériques contiennent donc à la fois des fibres sympathiques préganglionnaires et postganglionnaires. Les neurones efférents viscéraux préganglionnaires de la partie parasympathique du système nerveux autonome proviennent des noyaux parasympathiques du tronc cérébral (partie crânienne du système nerveux parasympathique) ou de la moelle épinière sacrée entre les segments S2 et S4 (partie sacrée du système nerveux parasympathique). Seules les fibres parasympathiques préganglionnaires voyagent le long des nerfs périphériques pour se synapser sur les ganglions intramuraux dans la paroi des organes cibles.
Axones afférents
Les axones afférents sont somatiques ou viscéraux et ont des corps cellulaires soit dans les ganglions de la racine dorsale des nerfs rachidiens, soit dans les ganglions sensoriels des nerfs crâniens. Les neurones somatiques afférents (sensoriels) transmettent les impulsions des récepteurs du toucher, de la température ou de la douleur (nocicepteurs) situés dans la paroi corporelle (peau) et des propriocepteurs des muscles squelettiques et des articulations. Les neurones afférents viscéraux transmettent les informations des viscères (intérocepteurs et nocicepteurs). Les axones afférents viscéraux voyagent le long des fibres efférentes viscérales et traversent les branches communicantes et les racines dorsales des nerfs rachidiens ou le long du nerf vague pour entrer dans le SNC.
CELLULES DE SCHWANN
Les axones des nerfs périphériques sont recouverts de cellules de Schwann. Leur gaine de myéline (plasmlemme modifié) sépare les axones de l'endonèvre. Les cellules de Schwann sont réparties le long des axones en chaînes longitudinales en fonction de la myélinisation le long de l'axone. La différenciation coordonnée des axones et de leurs cellules myélinisantes nécessite une communication étroite entre les neurones et la glie. Les signaux fournis par les axones régulent la prolifération, la survie et la différenciation des cellules gliales. D'autre part, les signaux gliaux réciproques affectent le cytosquelette axonal et le transport et sont nécessaires à la survie axonale et régénération. Les cellules de Schwann ont également une fonction de guidage pour la croissance des axones, indiquant que la glie fait plus que fournir un soutien à l'axone.
Les phénotypes des cellules de Schwann sont caractérisés par des morphologies distinctes et l'expression différentielle des protéines de la myéline, des molécules d'adhésion cellulaire, des récepteurs, des enzymes, des protéines des filaments intermédiaires, des canaux ioniques et des protéines de la matrice extracellulaire. Toutes les cellules de Schwann sont entourées d'une lame basale, dont les molécules de la matrice extracellulaire, telles que la laminine, régulent les aspects clés du développement des cellules de Schwann.
CLASSIFICATION DES FIBRES NERVEUSES
Les fibres nerveuses sont classées en fonction du diamètre axonal, de la vitesse de conduction, du type de récepteur et de l'épaisseur de la gaine de myéline (lampe de table 1). La vitesse de conduction est liée au diamètre axonal; c'est-à-dire que plus la fibre est grande, plus la conduction sera rapide.
TABLE 1. Classification des fibres nerveuses périphériques selon le diamètre axonal, la vitesse de conduction, le type de récepteur et l'épaisseur de la gaine de myéline (myélinisation).
| Axonale Diamètre : (µm) | Conduction Vitesse (M / s) | Fibres efférentes | Fibres afférentesa (Des récepteurs cutanés) | Fibres afférentes du squelette Muscles, tendons et articulations | Myélinisation |
|---|---|---|---|---|---|
| 12-20 | 60-120 30-70 | Aα (aux fibres musculaires extrafusales) | Aα (provenant de mécanorécepteurs à adaptation rapide) | Ia (des fuseaux musculaires) Ib (des organes tendineux de Golgi) | Fortement myélinisé |
| 6-12 | 25-70 | Aβ (provenant de mécanorécepteurs à adaptation lente) | II (des propriocepteurs articulaires) | Myélinisé | |
| 3-8 | 15-30 | Aγ (aux fibres musculaires intrafusales) | Myélinisé | ||
| 1-6 | 12-30 | Aδ (provenant des nocicepteurs thermiques et mécaniques et des thermorécepteurs-froid uniquement) | III (des propriocepteurs articulaires et des nocicepteurs articulaires) | Finement myélinisé | |
| 1-3 | 3-15 | B (viscéral préganglionnaire) | Myélinisé | ||
| 0.2-1.5 | 0.5-2 | C (viscéral postganglionnaire) | C (provenant des nocicepteurs mécaniques et des thermorécepteurs - froids et chauds, nocicepteurs polymodaux) | IV (des nocicepteurs articulaires) | Non myélinisé |
aLes fibres afférentes viscérales (provenant des intérocepteurs) sont classées en fibres Aδ et C.
Identifier: Modifié avec la permission de Cramer GD, Darby S : Anatomie de base et clinique de la colonne vertébrale, de la moelle épinière et du SNA, 2e éd. Philadelphie : Elsevier/Mosby ; 2005.
Conseils NYSORA
Plus la fibre est grosse, plus l'anesthésique local doit être concentré pour affecter le bloc neural.
FIBRES NERVEUSES MYÉLINISÉES
Les fibres nerveuses myélinisées sont gainées de myéline, plasmalemme très étendu et modifié des cellules de Schwann (Figures 4 et 5). La formation de myéline commence par l'extension du cytoplasme des cellules de Schwann et le développement du mésaxon interne, qui s'enroule plusieurs fois autour de l'axone. Pendant le processus d'emballage, le cytoplasme est presque extrudé entre le plasmalemme. Les faces extracellulaires apposées du plasmalemme deviennent «la ligne dense principale» et les faces cytoplasmiques apposées forment une «ligne intrapériodique» de myéline. La structure moléculaire proposée de la myéline correspond au concept de plasmalemme en tant que bicouche lipidique avec des protéines membranaires intégrales et périphériques attachées au côté extracellulaire ou cytoplasmique du plasmalemme. Contrairement à la plupart des membranes biologiques, la myéline a un rapport élevé de lipides sur protéines (70% à 85% de lipides, 15% à 30% de protéines), ces dernières servant de protéines structurelles, d'enzymes, de canaux de tension et de transducteurs de signal.
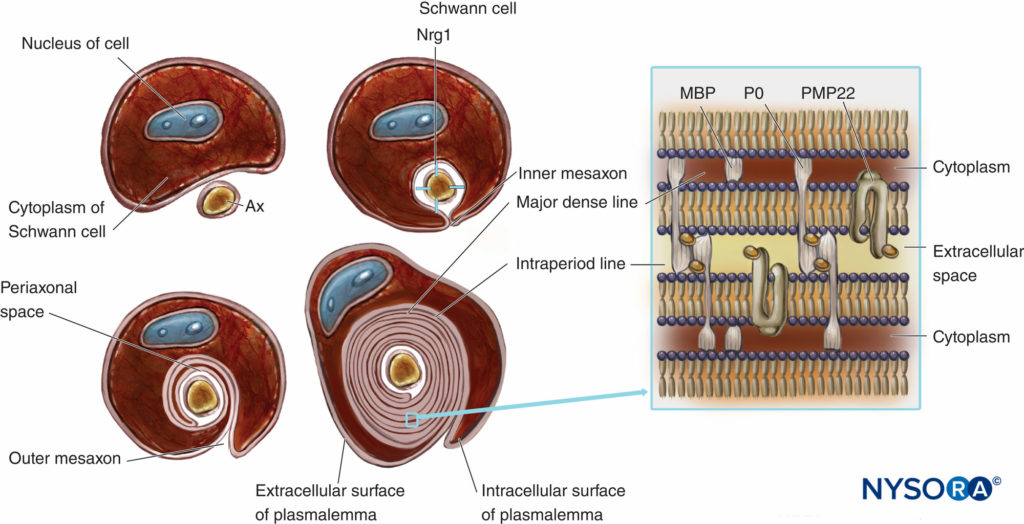
FIGURE 4. Présentation schématique de la formation de la myéline et schéma simplifié de son organisation moléculaire. Pour simplifier, la lame basale des cellules de Schwann n'est pas dessinée. Nrg1 = neuréguline ; MPB = protéine basique de la myéline ; P0 = protéine zéro ; PMP22 = protéine membranaire périphérique de 22 kDa ; Ax = axone. (Modifié avec la permission de Ross M, Pawlina W : Histology : A Text and Atlas With Correlated Cell and Molecular Biology, 6e éd. Philadelphie : Wolters Kluwer ; Lippincott Williams & Wilkins ; 2011.)
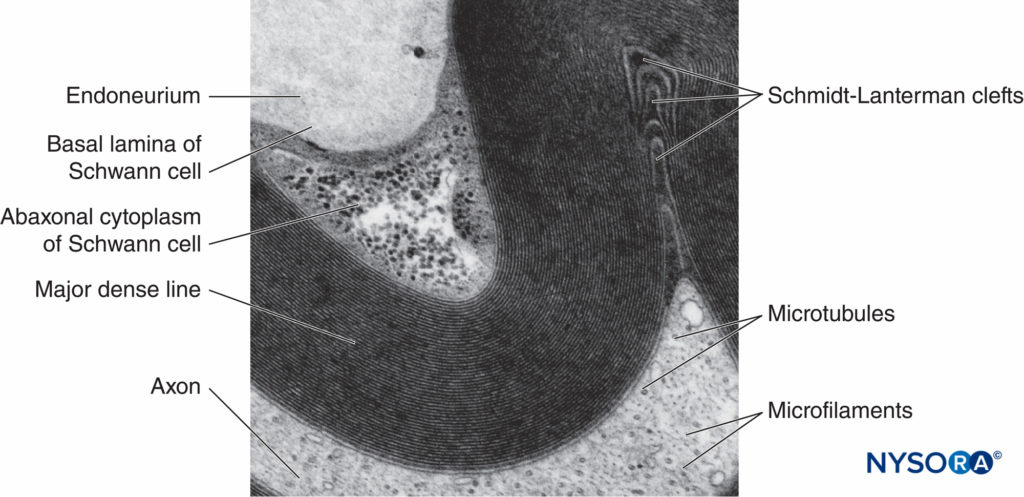
FIGURE 5. Micrographie électronique de la fibre myélinisée. La myéline est visualisée comme une série de lignes sombres et moins sombres alternées. Biopsie du nerf sural humain.
La gaine de myéline enveloppe l'axone en segments. Les zones de l'axone recouvertes de lamelles concentriques de myéline et d'une seule cellule de Schwann productrice de myéline sont appelées entre-nœuds et gamme de longueur de 200 à 1000 µm. Les interruptions, qui se produisent dans la gaine de myéline à intervalles réguliers le long des axones et exposent l'axone, sont appelées nœuds de Ranvier (Figure 6). Chaque nœud indique une interface entre les gaines de myéline de deux cellules de Schwann différentes situées le long de l'axone.
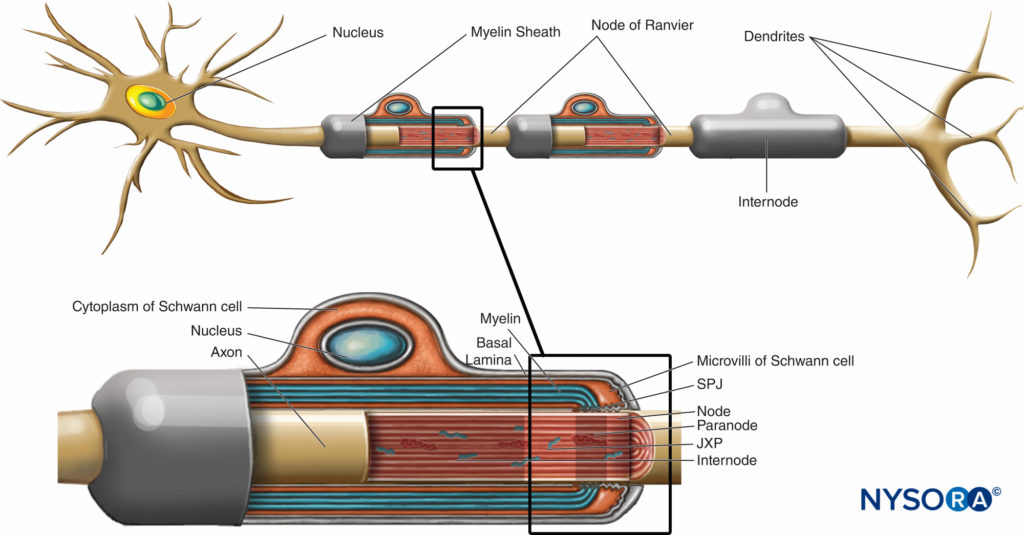
FIGURE 6. Domaines distincts de la région nodale. La région occupée par des protéines distinctes situées dans l'axolemme nodal est schématiquement représentée en noir sur l'axone. SPJ = cloisonnées comme des jonctions ; JXP = juxtaparanode. (Modifié avec la permission de Poliak S, Peles E. The local differentiation of myelinated axones at nodes of Ranvier. Nat Rev Neurosci. 2003 Dec;4(12):968-980.)
La région nodale et ses environs peuvent être subdivisés en plusieurs domaines (Figure 6) qui contiennent un ensemble unique de canaux ioniques, de molécules d'adhésion cellulaire et de protéines adaptatrices cytoplasmiques. Dans le SNP, le nœud est en contact avec les microvillosités des cellules de Schwann et recouvert par sa lame basale (Figure 6). Une caractéristique importante de la nodal l'axolemme est sa haute densité de Na voltage-dépendant+ Voies par rapport à la juxtaparanodal axolemme , qui contient généralement une densité élevée de K+ Les canaux. Na+ potentialisent l'influx nerveux de manière saltatoire (Figure 7) le long des fibres myélinisées. Lorsque la membrane au niveau du nœud est excitée, le circuit local généré ne peut pas traverser la gaine de myéline à haute résistance. Il s'écoule donc et dépolarise la membrane au niveau du nœud suivant, qui peut être à 1 mm ou plus. La faible capacité de la gaine signifie que peu d'énergie est nécessaire pour dépolariser la membrane restante entre les nœuds, ce qui entraîne une vitesse accrue de propagation du circuit local.
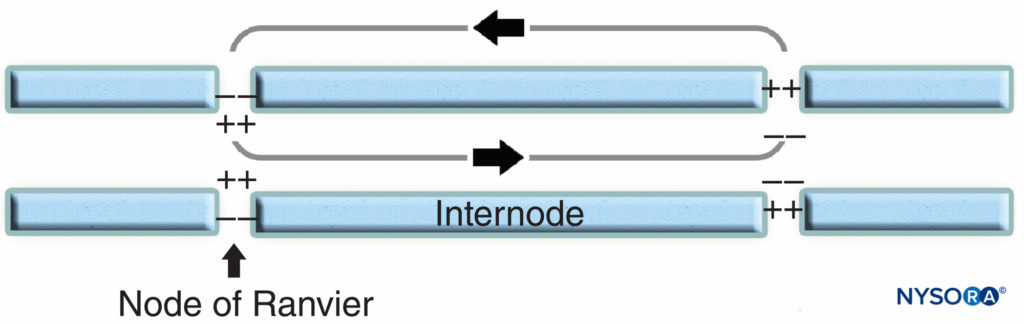
FIGURE 7. Conduction saltatoire dans la fibre nerveuse myélinisée. Les canaux Na+, situés au niveau de l'axolemme nodal, potentialisent l'influx nerveux de manière saltatoire le long de la fibre nerveuse myélinisée.
La myélinisation est un exemple de communication de cellule à cellule dans laquelle les axones interagissent avec les cellules de Schwann. Le nombre de couches de myéline est déterminé par l'axone et non par la cellule de Schwann. L'épaisseur de la gaine de myéline est régulée par un facteur de croissance appelé neuréguline 1 (Nrg1). La compaction de la gaine de myéline est associée à l'expression de protéines transmembranaires spécifiques de la myéline telles que la protéine 0 (P0), une protéine de myéline périphérique de 22 kilodaltons (PMP22) et une protéine basique de la myéline (MBP). L'absence de protéines qui régulent la formation de la gaine de myéline pourrait entraîner une hypomyélinisation ou une dismyélinisation sévère chez l'homme et les animaux de laboratoire.
FIBRES NERVEUSES NON MYÉLINISÉES
Les axones non myélinisés sont également enveloppés par les cellules de Schwann et leur lame basale. Une cellule de Schwann individuelle peut engainer un ou plusieurs axones non myélinisés (Figures 8 et 9). Les fibres non myélinisées prédominent dans les nerfs rachidiens cutanés humains, où le rapport moyen entre la densité des fibres non myélinisées et myélinisées est de 3.7: 1. Dans les fibres non myélinisées, la vitesse de conduction est proportionnelle à la racine carrée du diamètre de la fibre et est beaucoup plus lente que la conduction saltatoire dans les fibres myélinisées (Tableau 1).
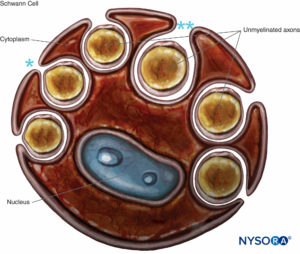
FIGURE 8. Cellule de Schwann qui engloutit plusieurs axones non myélinisés. Les lèvres du sillon du cytoplasme peuvent être fermées (*), formant le mésaxon, ou peuvent être ouvertes (**). La lame basale de la cellule de Schwann n'est pas dessinée.
INVESTISSEMENTS DU TISSU CONJONCTIF DES NERFS PÉRIPHÉRIQUES
Dans un nerf périphérique, les fibres nerveuses et leurs cellules de Schwann de soutien sont maintenues ensemble par du tissu conjonctif organisé en trois composants distincts qui ont des caractéristiques morphologiques et fonctionnelles spécifiques. L'épinèvre forme le tissu conjonctif le plus externe du nerf périphérique, le périnèvre entoure chaque fascicule nerveux séparément, tandis que les fibres nerveuses individuelles sont intégrées dans l'endonèvre. (Figures 10 à 13).
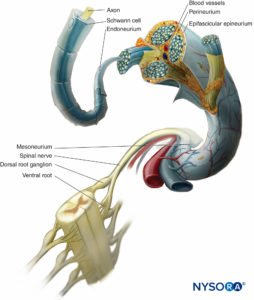
FIGURE 10. Les investissements conjonctifs du nerf périphérique. Le schéma montre la disposition du nerf périphérique. Un segment du nerf spinal est agrandi pour montrer la relation des fibres nerveuses avec le tissu conjonctif environnant (endonèvre, périnèvre et épinèvre).
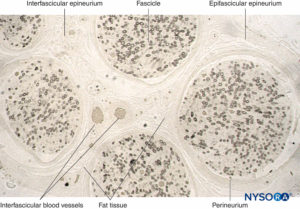
FIGURE 11. Coupe semi-fine du nerf sural humain fixé dans du tétroxyde d'osmium. Les gaines de myéline sont conservées et colorées en noir.
Le périnèvre entoure le faisceau nerveux. Des stries de tissu conjonctif proviennent de l'épinèvre épifasciculaire à l'intérieur du nerf comme
épinèvre interfasciculaire. Le tissu adipeux et les vaisseaux sanguins sont localisés dans l'épinèvre interfasciculaire.
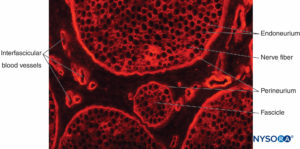
FIGURE 12. Coupe transversale du nerf sciatique de porc. Coloration immunohistochimique du collagène. Les vaisseaux sanguins parcourent le
épinèvre interfasciculaire, qui remplit l'espace autour du périnèvre et des fascicules.
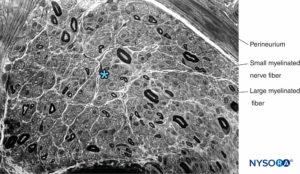
FIGURE 13. Section semi-fine du nerf sural humain colorée par le violet de crésyle. Neuropathie axonale avec perte prédominante des grosses fibres myélinisées. * Espace intrafasciculaire entre les fibres myélinisées (occupé par l'endonèvre, les noyaux des cellules de Schwann et les fibres non myélinisées).
Épinèvre
L'épinèvre est une condensation d'un tissu conjonctif aréolaire lâche qui entoure un nerf périphérique et lie ses fascicules en un faisceau commun (Figure 10 et Figure 11).
L'épinèvre qui s'étend entre les fascicules est l'épinèvre interfasciculaire ou interne, tandis que l'épinèvre qui entoure tout le tronc nerveux est l'épinèvre épifasciculaire ou externe. appelé l'épinèvre comprend 30 % à 75 % de la section transversale du nerf mais varie le long du nerf. C'est le plus épais là où il est continu avec la dure-mère recouvrant le SNC et plus abondant dans les nerfs adjacents aux articulations, où les nerfs sont soumis à une pression. La sensibilité aux lésions par compression est donc susceptible d'être plus élevée dans les nerfs unifasciculaires que dans les nerfs multifasciculaires car ces derniers ont une plus grande quantité d'épinèvre. Au fur et à mesure que le nerf périphérique se divise et que le nombre de faisceaux diminue, l'épinèvre s'amincit progressivement et finit par disparaître autour des nerfs monofasciculaires.
L'épinèvre contient du collagène, des fibroblastes, des mastocytes et des cellules graisseuses. Les faisceaux de collagène ont une orientation longitudinale prédominante ; cependant, une étude au microscope électronique a révélé que le collagène épineural en faisceaux de 10 à 20 µm de largeur est disposé obliquement autour de la circonférence du nerf. Des fibres élastiques sont également présentes, notamment adjacentes au périnèvre, qui sont principalement orientés longitudinalement. Les fibres de collagène et élastiques sont alignées et orientées pour prévenir les dommages causés par un étirement excessif du faisceau nerveux, ce qui suggère que l'épinèvre est conçu pour s'adapter à l'étirement.
L'épinèvre humain est constitué principalement de collagène de type I et de type III, le type I prédominant. Le diamètre des fibrilles de collagène est en moyenne de 60 à 110 nm.
Le tissu adipeux à l'intérieur d'un nerf entoure les faisceaux et forme des gaines adipeuses qui séparent les faisceaux les uns des autres. L'épaisseur des gaines adipeuses varie d'un faisceau à l'autre et est plus importante dans les gros troncs nerveux, soulignant sa fonction protectrice en amortissant les faisceaux contre les dommages par compression. La perte de graisse épineurale peut présenter un facteur de risque de paralysie causée par la pression chez les patients émaciés et alités. En revanche, un excès de tissu adipeux peut également retarder la diffusion de l'anesthésique local injecté à proximité d'un nerf, interférant ainsi avec le bloc anesthésique. L'épinèvre est en continuité avec le tissu conjonctif appelé adventice ou mésonèvre qui entoure le nerf lors de son passage à travers, sous ou entre le fascia musculaire, servant (1) de conduit pour l'anesthésique local injecté, (2) de voie permettant le glissement nerveux, et (3) une couche de protection contre les traumatismes nerveux. Parce que leur attache est lâche, les nerfs sont relativement mobiles sauf lorsqu'ils sont attachés en entrant dans des vaisseaux ou en sortant des branches nerveuses.
Périnèvre
Le périnèvre est un tissu conjonctif spécialisé entourant les faisceaux nerveux individuels (Chiffres 10 et 12). Cette couche cellulaire protectrice est plus fine que l'épinèvre et sépare l'endonèvre de l'épinèvre. Le périnèvre est constitué de couches alternées de cellules polygonales aplaties, que l'on pense être dérivées de fibroblastes, et de tissu conjonctif collagène, dont la formation est contrôlée par les cellules de Schwann. Les cellules polygonales aplaties, qui constituent les lamelles, sont spécialisées pour fonctionner comme une barrière de diffusion. Le nombre de lamelles varie, en fonction principalement du diamètre du fascicule ; plus le fascicule est grand, plus le nombre de lamelles est grand. Dans les troncs nerveux des mammifères, le périnèvre contient 15 à 20 couches de cellules. Les cellules contiguës de chaque couche s'interdigitent le long de vastes jonctions serrées. Les cellules peuvent se ramifier et donner lieu à des processus et contribuer aux lamelles adjacentes. Chaque couche de cellules, entourée par la lame basale, peut atteindre une épaisseur allant jusqu'à 0.5 µm dans les nerfs humains.
Les fibres de collagène proviennent d'un arrangement en forme de réseau, dans lequel les faisceaux sont circulaires, longitudinaux et obliques. La couche cellulaire périneurale la plus interne adhère à une couche limite distincte de fibres de collagène densément tissées et de fibroblastes sous-périneuraux qui relie mécaniquement le périnèvre au contenu endoneural. Les fibres de collagène sont principalement de type III, bien que des fibres de collagène de type I soient également présentes. Le diamètre des fibrilles de collagène est nettement inférieur à celui des fibrilles épineurales, avec une moyenne de 52 nm dans le nerf sural du rat. La lame basale des cellules polygonales est composée de collagènes IV et V, de fibronectine, de protéoglycane héparane sulfate, et la laminine. La présence omniprésente de vésicules pinocytotiques riches en enzymes phosphorylantes sous-tend l'hypothèse selon laquelle le périnèvre fonctionne comme une barrière de diffusion métaboliquement active, jouant un rôle essentiel dans le maintien du milieu osmotique et de la pression du fluide dans l'endonèvre. Par exemple, dans l'une de nos études, les cellules inflammatoires accumulées entre les faisceaux nerveux chez les porcelets après exposition du nerf au gel à ultrasons n'ont pas pénétré dans le périnèvre. En raison de sa structure cellulaire étroitement adhérente et de son collagène orienté plus longitudinalement, le périnèvre est moins tolérant à l'allongement que l'épinèvre. Chez le lapin, la défaillance mécanique lors de l'élongation coïncidait avec une rupture du périnèvre alors que l'épinèvre restait intact. L'intégrité de la barrière de diffusion a été maintenue après 2 heures d'allongement de 15 %, tandis qu'un allongement de 27 % a provoqué une perturbation périneurale aiguë.
Endonèvre
L'endonèvre comprend du tissu conjonctif intrafasciculaire lâche qui n'inclut pas les cloisons périneurales qui subdivisent les fascicules et entourent les cellules de Schwann (Figure 12). Environ 40 à 50 % de l'espace intrafasciculaire est occupé par des éléments non neuronaux (c'est-à-dire autres que les axones et les cellules de Schwann), dont le fluide endoneurial et la matrice de tissu conjonctif occupent 20 à 30 %. Il existe des variations substantielles entre les nerfs de différentes espèces et groupes d'âge.
L'endonèvre est composé de fibres de collagène (produites par les cellules de Schwann sous-jacentes et les fibroblastes); les composants cellulaires baignent dans le liquide endoneurial, contenu dans d'importants espaces intrafasciculaires. Les fibres nerveuses ont tendance à être regroupées en petits faisceaux avec des fentes intermédiaires. La pression du liquide endoneural est légèrement supérieure à celle de l'épinèvre environnant. On pense que ce gradient de pression minimise la contamination endoneurale par des substances toxiques extérieures au faisceau nerveux.
Les fibrilles de collagène endoneurales sont plus petites que celles de l'épinèvre et ont un diamètre compris entre 30 et 65 nm chez l'homme. Les fibrilles sont parallèles aux fibres nerveuses et les entourent, les liant en faisceaux ou en faisceaux. Ils montrent des condensations autour des capillaires et des fibres nerveuses. Près de l'extrémité distale de l'axone, l'endonèvre est réduit à quelques fibres réticulaires entourant la lame basale des cellules de Schwann. Les collagènes de types I, II et III sont présents dans l'endonèvre.
Les constituants cellulaires de l'endonèvre sont les fibroblastes, les cellules endothéliales des capillaires, les mastocytes et les macrophages. Les mastocytes sont présents en nombre variable, étant particulièrement nombreux le long des vaisseaux sanguins. Les macrophages représentent 2 % à 4 % des noyaux intrafasciculaires dans le nerf périphérique du rat et sont les principales cellules présentatrices d'antigène du nerf périphérique. Ils récupèrent les protéines extracellulaires et les présentent aux cellules T émergeant de la circulation. Les macrophages assurent la surveillance immunologique et participent à la réparation des tissus nerveux. Suite à une lésion nerveuse, ils prolifèrent et phagocytent activement les débris de myéline.
La matrice extracellulaire est riche en glycoprotéines, glycosaminoglycanes et protéoglycanes. Les mieux caractérisés d'entre eux comprennent la glycoprotéine fibronectine, la ténascine C, la trombospondine et les protéoglycanes de sulfate de chondroïtine versicane et décorine. L'expression de ces molécules change après une lésion nerveuse, elles sont donc potentiellement pertinentes lors de la régénération nerveuse.
D'un point de vue hydrodynamique, les différents tissus qui composent un nerf périphérique peuvent être divisés en tissu conjonctif lâche, à haute compliance et expansible de l'épinèvre et en fascicules et faisceaux fasciculaires à faible compliance et perturbables, densément emballés dans le périnèvre. Ces différences anatomiques entre les tissus conjonctifs et les fascicules ou leurs faisceaux expliquent pourquoi une injection dans les fascicules nécessite plus de force (pression) qu'une injection dans le tissu conjonctif lâche de l'épinèvre.
Conseils NYSORA
- Le périnèvre est un tissu dur et résistant, qui a tendance à s'échapper lentement en avançant une aiguille émoussée à biseau court pendant la procédure de bloc nerveux.
- Une force (pression) plus élevée est nécessaire pour une injection dans un fascicule peu conforme par opposition à l'épinèvre hautement conforme.
- Dans les régions interscalène et supraclaviculaire du plexus brachial, les nerfs sont plus denses et
- oligofasciculaires, tandis que plus distalement, ils sont polyfasciculaires avec une plus grande quantité de tissu stromal.
- Les nerfs multifasciculaires sont moins sensibles aux blessures que les nerfs unifasciculaires en raison d'un diamètre fasciculaire réduit et d'une protection épineuriale accrue.
- L'abondance de tissu épineurial lâche permet d'expliquer pourquoi la plupart des injections intraneurales (intraneurales, mais extrafasciculaires) n'entraînent pas de lésion nerveuse manifeste.
LA RÉGION DE LA TRANSITION CENTRE-PÉRIPHÉRIQUE
La transition entre le SNC et le SNP dans les racines nerveuses crâniennes et spinales est appelée la central-périphérique région de transition or SNC-PNS frontière (Figure 14). Il représente un changement brutal du type de myéline, des éléments de soutien et de la vascularisation. Les principaux composants gliaux du SNC sont les astrocytes et les oligodendrocytes, tandis que dans le SNP, les principaux composants sont les cellules de Schwann. Les racines nerveuses des nerfs rachidiens baignent dans le liquide céphalo-rachidien. La région de transition est la longueur de la radicelle qui contient à la fois le tissu nerveux central et périphérique. Les détails de transition distinguant l'engainement des racines vertébrales avec les méninges et les investissements du tissu conjonctif des nerfs périphériques n'ont pas été entièrement clarifiés. Leurs arrangements structurels sont cependant bien documentés dans les études au microscope électronique.
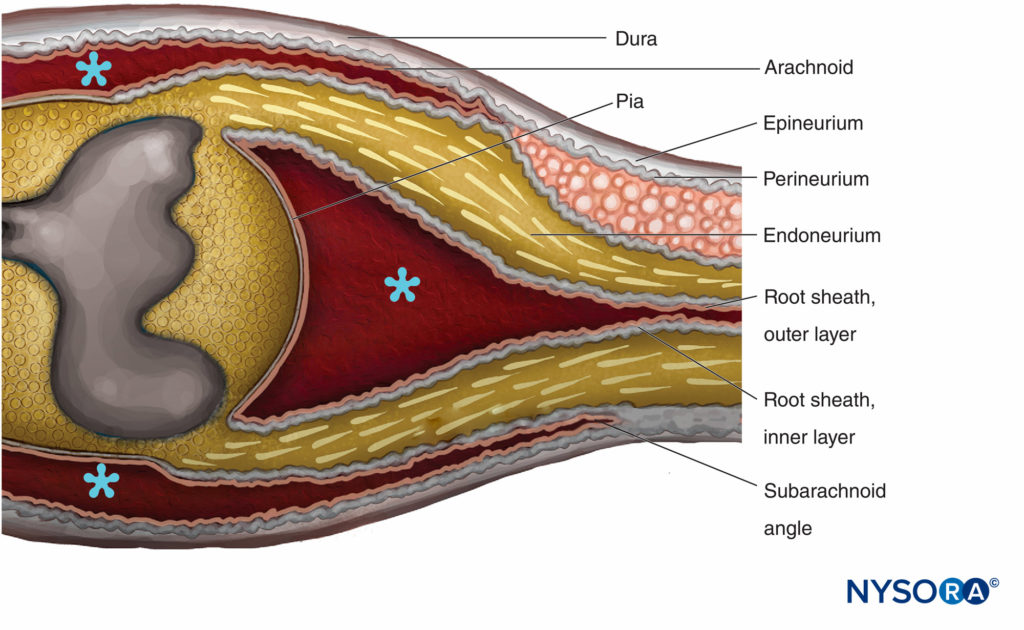
FIGURE 14. Région de transition centre-périphérie. L'épinèvre devient continu avec la dure-mère. L'arachnoïde est réfléchi sur les racines à l'angle sous-arachnoïdien et devient continu avec la couche externe de la gaine radiculaire. À la jonction avec la moelle épinière, la couche externe devient continue avec la pie-mère. Le périnèvre se divise en deux couches au niveau de l'angle sous-arachnoïdien : la couche externe se sépare de la racine nerveuse et s'étend entre la dure-mère et l'arachnoïde ; la couche interne est adhérente aux racines spinales et constitue la couche interne de la gaine radiculaire. Le ganglion spinal est incrusté dans le périnèvre. * Espace sous-arachnoïdien. (Reproduit avec la permission de Haller FR, Low FN. La structure fine de la gaine de la racine nerveuse périphérique dans l'espace sous-arachnoïdien chez le rat et d'autres animaux de laboratoire. Am J Anat. 1971 May;131(1):1-19.
Les composants cellulaires de l'endonèvre dans les racines spinales ressemblent à ceux des nerfs périphériques. La quantité de collagène est sensiblement moindre et ne s'organise pas en gaines autour des fibres nerveuses. La région dans laquelle les racines vertébrales s'attachent à la moelle épinière est caractérisée par une transition irrégulière du nerf périphérique au SNC, la zone d'Ober-steiner-Redlich où les cellules de Schwann sont remplacées par des oligodendrocytes. La partie centrale de la racine est limitée à sa périphérie par une glie marginale, composée d'astrocytes recouverts de lame basale.
Les racines vertébrales traversent l'espace sous-arachnoïdien recouvert d'une gaine racinaire multicellulaire et pénètrent dans la dure-mère à l'angle sous-arachnoïdien (Figure 14). À l'extérieur de l'angle sous-arachnoïdien, les racines nerveuses possèdent un épinèvre, un périnèvre et un endoneurium comme dans les troncs nerveux périphériques. L'épinèvre est le prolongement de la dure-mère rachidienne, tandis que l'endonèvre se développe en aval de la jonction des racines avec le tissu nerveux central. Le périnèvre enveloppe les ganglions rachidiens et en est proximal. Il est divisé dans les couches externes qui passent entre la dure-mère et l'arachnoïde pour former le «mésothélium dural», tandis que les couches internes du périnèvre continuent sur les racines en tant que «couche interne de la gaine racinaire».
La gaine radiculaire est composée de lamelles cellulaires et fibreuses divisées en deux couches. La couche externe est constituée de cellules faiblement associées bordant l'espace sous-arachnoïdien. Là où les racines s'attachent à la moelle épinière, les cellules de la couche externe de la gaine racinaire deviennent continues avec la pie. À l'angle sous-arachnoïdien, la couche externe est réfléchie vers les investissements méningés externes de la moelle épinière (arachnoïde attachée à la couche interne de la dure-mère rachidienne). La couche interne de la gaine radiculaire est constituée de cellules aplaties qui sont étroitement associées les unes aux autres, sont investies par intermittence d'une lame basale et ressemblent au périnèvre mais ne peuvent pas être classées comme cellules périneurales. Il devient périphériquement en continuité avec le périnèvre.
L'espace sous-arachnoïdien débouche dans un évidement latéral qui s'étend entre les racines ventrale et dorsale et peut constituer un communication entre les espaces sous-arachnoïdien et endoneurial. Cette communication est cliniquement pertinente car elle permet à l'inflammation de se propager de l'espace sous-arachnoïdien à l'endonèvre en cas de polyradiculonévrite.
Conseils NYSORA
- L'injection d'anesthésique local dans la coiffe épineuriale lors de la réalisation de blocs interscalènes ou du plexus lombaire peut entraîner une rachianesthésie due à l'extension de la coiffe durale au-delà du foramen intervertébral.
- Pendant l'exécution du bloc du plexus lombaire, la propagation épidurale de l'anesthésique local est observée en particulier lorsqu'une pression d'injection élevée (force) est utilisée pendant le processus d'injection.
ALIMENTATION VASCULAIRE DES NERFS PÉRIPHÉRIQUES
Le nerf périphérique est une structure bien vascularisée, alimenté par des vaisseaux provenant des grosses artères et veines voisines ainsi que des vaisseaux sanguins musculaires et périostaux adjacents plus petits (Figure 12). Les nerfs périphériques ont deux systèmes vasculaires distincts et fonctionnellement indépendants : un système extrinsèque (vaisseaux nutritifs régionaux et vaisseaux épineuraux) et un système intrinsèque (microvaisseaux dans l'endonèvre). Il existe de riches anastomoses entre les deux systèmes, entraînant un chevauchement considérable entre les territoires des artères segmentaires.
L'épinèvre est caractérisé par un plexus vasculaire à prédominance longitudinale. Les artérioles transpérineurales, de 10 à 25 µm de diamètre, passent de l'épinèvre à l'endonèvre à travers des manchons de tissu périneural. Leur trajet à travers le périnèvre est oblique, ce qui les rend potentiellement sensibles aux changements de pression intra- ou extrafasciculaire. Les vaisseaux épineuriaux et périneuraux ont un riche plexus périvasculaire de nerfs peptidergiques, sérotoninergiques et adrénergiques qui jouent un rôle important dans le contrôle neurogène du flux sanguin endoneurial.
Le système vasculaire endoneurial est connu pour ses dissemblances anatomiques par rapport à un lit capillaire conventionnel, bien que, physiologiquement, il remplisse des fonctions métaboliques similaires. Les artérioles transpérineurales perdent progressivement leur enveloppe musculaire continue et deviennent des capillaires postartériolaires. Les capillaires endoneuraux ont un diamètre et des distances intercapillaires atypiquement plus grands que ceux de nombreux autres tissus. Une telle angioarchitecture suggère une capacité d'échange plus faible. Les artérioles endoneurales ont une couche musculaire lisse peu développée et donc une capacité d'autorégulation limitée. La densité des microvaisseaux endoneuraux varie considérablement dans les nerfs périphériques ; ces variations sont en corrélation avec la susceptibilité à la neuropathie ischémique. Ce modèle unique de vaisseaux, associé au débit sanguin basal élevé par rapport aux exigences métaboliques du nerf, confère un degré élevé de résistance à l'ischémie, de sorte qu'un dysfonctionnement nerveux ne se produit pas pendant l'ischémie aiguë jusqu'à ce que le débit sanguin soit presque nul. La principale caractéristique du système neurovasculaire périphérique est sa flexibilité. Les nerfs périphériques peuvent être mobilisés chirurgicalement, sectionnant leurs vaisseaux nourriciers sans conséquences cliniques, à un degré surprenant. Cependant, la distribution de la circulation dans l'endonèvre est extrêmement sensible aux manipulations physiques et chimiques.
Conseils NYSORA
- Les nerfs périphériques sont relativement résistants à l'ischémie car le dysfonctionnement nerveux ne peut survenir que lorsque le flux sanguin est presque nul.
- Les anesthésiques locaux ont la capacité de resserrer le système vasculaire et de diminuer le flux sanguin vers les nerfs.
MODIFICATIONS LIÉES À L'ÂGE DANS LES NERFS PÉRIPHÉRIQUES
Un SNP âgé intact est caractérisé par plusieurs changements structurels, fonctionnels et biochimiques importants, qui ont été documentés dans les fibres myélinisées et non myélinisées. Chez les personnes âgées, la densité des fibres myélinisées diminue. Une relation régulière entre la longueur internodale et le diamètre des fibres devient moins précise avec le vieillissement. Ceci est associé à la démyélinisation et à la remyélinisation segmentaires et à la dégénérescence et à la régénération axonales cliniquement évidentes sous forme de neuropathie périphérique légère.
Dans les fibres non myélinisées, des changements régressifs attribués au vieillissement ont été rapportés. Dans les complexes de fibres amyéliniques des nerfs vieillissants, la proportion de bandes de cellules de Schwann dépourvues d'axones augmente (appelées poches de collagène ; voir Figure 9). Un changement précoce lié à l'âge semble être le bourgeonnement des processus cellulaires de Schwann en de nombreuses langues aplaties, qui se produisent généralement en groupes. L'indice périneural (rapport de l'épaisseur du périnèvre au diamètre du fascicule) a tendance à augmenter avec l'âge, reflétant très probablement la perte de fibres nerveuses liée à l'âge.
Le vieillissement est associé à une diminution du nombre de capillaires endoneuraux et à une augmentation de l'épaisseur des parois capillaires et du périnèvre. Le taux de régénération axonale devient plus lent à mesure que la densité et le nombre d'axones en régénération diminuent. Le vieillissement altère également la germination terminale des axones régénérés et la germination collatérale des axones adjacents intacts, limitant davantage la réinnervation de la cible et la récupération fonctionnelle.
La cause des changements liés au vieillissement est incertaine. Il n'est pas encore établi s'ils sont le résultat du vieillissement neuronal, entraînant une dégénérescence axonale distale et une démyélinisation secondaire, ou des facteurs locaux au niveau des nerfs, comme l'ischémie ou les conséquences de traumatismes mineurs répétés. Néanmoins, les modifications liées à l'âge des nerfs périphériques résultent probablement de l'effet cumulatif et tout au long de la vie de divers facteurs pathogènes modifiés par des déterminants génétiques et d'une diminution progressive de la capacité de régénération.
Conseils NYSORA
- En raison de la dégénérescence nerveuse liée à l'âge, moins d'anesthésique local à une concentration plus faible peut être nécessaire pour le bloc nerveux.
- Les modifications du nerf périphérique liées à l'âge peuvent être responsables des images échographiques généralement plus médiocres des nerfs périphériques chez les personnes âgées par rapport aux sujets plus jeunes.
RÉPONSE DU NERF PÉRIPHÉRIQUE À LA BLESSURE
Les lésions des nerfs périphériques entraînent une perte des fonctions motrices, sensorielles et autonomes dans les segments dénervés du corps en raison de l'interruption des axones, de la dégénérescence des fibres nerveuses distales et de la mort éventuelle des neurones axotomisés. Les déficits fonctionnels causés par les lésions nerveuses peuvent être compensés par la réinnervation des cibles dénervées en régénérant les axones blessés ou par la ramification collatérale des axones non endommagés et le remodelage des circuits du système nerveux liés aux fonctions perdues. La régénération nerveuse est possible si les extrémités coupées restent proches l'une de l'autre sinon, la régénération peut ne pas être complète ou réussie.
Après une blessure, le neurone tente de réparer les dommages, de régénérer le processus et de restaurer la fonction en déclenchant une série d'événements structurels et métaboliques appelés réaction axonale. Les réactions au traumatisme sont localisées dans trois régions du neurone : au site de la lésion (modifications locales), distale au site de la lésion (modifications antérogrades) et proximale au site de la lésion (modifications rétrogrades). La réaction locale à une blessure implique l'élimination des débris par les cellules neurogliales. La partie de l'axone distale d'une blessure subit une dégénérescence et est phagocytée. La partie proximale de l'axone lésé subit une dégénérescence suivie de la germination d'un nouvel axone dont la croissance est dirigée par les cellules de Schwann.
Conseils NYSORA
- Le seuil de stimulation électrique pour une réponse motrice du nerf sciatique est augmenté chez les patients atteints de gangrène du pied diabétique, ce qui peut affecter l'identification nerveuse.
- De nombreuses lésions nerveuses post-opératoires surviennent dans des nerfs présentant une pathologie préexistante.
RÉSUMÉ
La connaissance que l'anatomie neurale est unique à différents sites anatomiques est essentielle pour une pratique sûre et efficace de l'anesthésie régionale. Comprendre la structure nerveuse périphérique et son implication tout en utilisant des moniteurs de pointe, y compris l'échographie, la stimulation nerveuse et la surveillance de la pression d'injection, est utile pour minimiser le risque de blessure du patient.
Références
- Jessen KR, Mirsky R : L'origine et le développement des cellules gliales dans les nerfs périphériques. Nat Rev Neurosci 2005;6(9):671–682.
- Williams P: Grey s Anatomy, 38e éd. Churchill Livingstone, 1995.
- Gartner L, Hiatt J : Manuel d'histologie en couleur, 2e éd. Saunders, 2001.
- Ross M, Pawlina W: Histologie: Un texte et un atlas avec une biologie cellulaire et moléculaire corrélée, 6e éd. Wolters Kluwer Lippincott Williams & Wilkins, 2011.
- Thomas P, Berthold C, Ochoa J : Anatomie microscopique du système nerveux périphérique. Dans Dyck P, Thomas P (eds): La neuropathie périphérique, 3e éd. Saunders, 1993, p. 28–91.
- Brushart T : Réparation nerveuse. Presse universitaire d'Oxford, 2011.
- Palay SL, Sotelo C, Peters A, Orkand PM : La butte axonale et le segment initial. J Cell Biol 1968;38(1):193–201.
- Poliak S, Peles E : La différenciation locale des axones myélinisés aux nœuds de Ranvier. Nat Rev Neurosci 2003;4(12):968–980.
- Colognato H, Baron W, Avellana-Adalid V, et al : les intégrines du SNC modifient la signalisation du facteur de croissance pour favoriser la survie dépendante de la cible. Nat Cell Biol 2002;4(11):833–841.
- Fernandez PA, Tang DG, Cheng L, Prochiantz A, Mudge AW, Raff MC : Preuve que la neuréguline dérivée des axones favorise la survie des oligodendrocytes dans le nerf optique du rat en développement. Neuron 2000;28(1):81–90.
- de Waegh SM, Lee VM, Brady ST. Modulation locale de la phosphorylation des neurofilaments, du calibre axonal et du transport axonal lent par la myélinisation des cellules de Schwann. Cellule 1992;68(3):451–463.
- Griffiths I, Klugmann M, Anderson T, et al : gonflements axonaux et dégénérescence chez des souris dépourvues du principal protéolipide de la myéline. Sciences 1998;280(5369):1610–1613.
- Lappe-Siefke C, Goebbels S, Gravel M, et al : la perturbation de Cnp1 découple les fonctions oligodendrogliales dans le support axonal et la myélinisation. Nat Genet 2003;33(3):366–374.
- Nadim W, Anderson PN, Turmaine M : Le rôle des cellules de Schwann et des tubes de la lame basale dans la régénération des axones à travers de longues longueurs de greffons nerveux gelés. Neuropathol Appl Neurobiol 1990;16(5): 411–421.
- Noakes PG, Bennett MR : La croissance des axones dans les muscles en développement du membre antérieur du poussin est précédée par des cellules qui se colorent avec des anticorps anti-cellules de Schwann. J Comp Neurol 1987;259(3):330–347.
- Court FA, Wrabetz L, Feltri ML : Lamine basale : les cellules de Schwann s'enroulent au rythme de l'espace-temps. Curr Opin Neurobiol 2006;16(5):501–507.
- Darby S, Frysztak R : Neuroanatomie de la moelle épinière. Dans Cramer GD, Darby S (eds): Anatomie fondamentale et clinique de la colonne vertébrale, de la moelle épinière et du SNA, 2e éd. Elsevier Mosby, 2005, pp 339–410.
- Morell P, Quarles R : Architecture moléculaire de la myéline. Dans Siegel G, Agranoff B, Albers R (eds): Basic Neurochemistry: Molecular, Cellular and Medical Aspects, 6e éd. Lippincott-Raven, 1999, pp 51–71.
- Ritchie JM, Rogart RB : Densité des canaux sodiques dans les fibres nerveuses myélinisées des mammifères et nature de la membrane axonale sous la gaine de myéline. Proc Natl Acad Sci USA 1977;74(1):211–215.
- Wang H, Kunkel DD, Martin TM, Schwartzkroin PA, Tempel BL : Canaux K+ hétéromultimériques dans les régions terminales et juxtaparanodales des neurones. Nature 1993;365(6441):75–79.
- Thaxton C, Pillai AM, Pribisko AL, Dupree JL, Bhat MA : les nœuds de Ranvier agissent comme des barrières pour limiter l'invasion des domaines paranodaux flanquants dans les axones myélinisés. Neuron 2011;69(2):244–257.
- Waxman SG, Ritchie JM : Dissection moléculaire de l'axone myélinisé. Ann Neurol 1993;33(2):121–136.
- Ochoa J, Mair WG : Le nerf sural normal chez l'homme. I. Ultrastructure et nombre de fibres et de cellules. Acta Neuropathol 1969;13(3):197–216.
- Millesi H, Terzis J : Nomenclature en chirurgie des nerfs périphériques. Dans Terzis J (ed): Microreconstruction des lésions nerveuses. Saunders, 1987, pp 3–13.
- Sala-Blanch X, Vandepitte C, Laur JJ, et al : Un examen pratique des injections périneurales par rapport aux injections intraneurales : un appel à une nomenclature standard. Int Anesthesiol Clin 2011;49(4):1–12.
- Sunderland S, Bradley KC : Le périnèvre des nerfs périphériques. Anat Rec 1952;113(2):125–141.
- Sunderland S : Les tissus conjonctifs des nerfs périphériques. Cerveau 1965;88(4):841–854.
- Ushiki T, Ide C : Organisation tridimensionnelle des fibrilles de collagène dans le nerf sciatique du rat, révélée par microscopie électronique à transmission et à balayage. Cell Tissue Res 1990;260(1):175–184.
- Thomas PK. Le tissu conjonctif du nerf périphérique : une étude au microscope électronique. J Anat 1963;97:35–44.
- Thomas PK, Bhagat S : L'effet de l'extraction du contenu intrafasciculaire des troncs nerveux périphériques sur la structure périneurale. Acta Neuropathol 1978;43(1–2):135–141.
- Lorimier P, Mezin P, Labat Moleur F, Pinel N, Peyrol S, Stoebner P : Localisation ultrastructurale des principaux composants de la matrice extracellulaire dans le nerf de rat normal. J Histochem Cytochem 1992;40(6):859–868.
- Reina MA, Lopez A, De Andres JA : [Tissu adipeux dans les nerfs périphériques. Etude du nerf sciatique humain]. Rev Esp Anestesiol Reanim 2002;49(8):397–402.
- Mirsky R, Parmantier E, McMahon AP, Jessen KR : le hérisson du désert dérivé des cellules de Schwann signale la formation de la gaine nerveuse. Ann NY Acad Sci 1999;883:196–202.
- Shanthaveerappa TR, Bourne GH : Épithélium périneural : Un nouveau concept de son rôle dans l'intégrité du système nerveux périphérique. Sciences 1966;154(3755):1464–1467.
- Lehmann HJ : [Structure et fonction de la barrière de diffusion périneurale]. Zellforsch Mikrosk Anat 1957;46(2):232–241.
- Eldridge CF, Sanes JR, Chiu AY, Bunge RP, Cornbrooks CJ : Protéoglycane sulfate d'héparane associé à la lame basale dans le SNP du rat : Caractérisation et localisation à l'aide d'anticorps monoclonaux. J Neurocytol 1986;15(1):37–51.
- Paetau A, Mellstrom K, Vaheri A, Haltia M: Distribution d'une protéine majeure du tissu conjonctif, la fibronectine, dans le tissu nerveux humain normal et néoplasique. Acta Neuropathol 1980;51(1):47–51.
- Stopar-Pintaric T, Cvetko E, Strbec M, et al : Modifications inflammatoires intraneurales et périneurales chez les porcelets après injection de gel à ultrasons, d'endotoxine, de NaCl à 0.9 % ou d'insertion d'aiguille sans injection. Anaesth Analg 2014;115:1–6.
- Rydevik BL, Kwan MK, Myers RR, et al : Une étude in vitro mécanique et histologique de l'étirement aigu sur le nerf tibial du lapin. J Orthop Res 1990;8(5):694–701.
- Olsson Y : Microenvironnement du système nerveux périphérique dans des conditions normales et pathologiques. Crit Rev Neurobiol 1990;5(3): 265–311.
- Jacobs JM, Love S : Morphologie qualitative et quantitative du nerf sural humain à différents âges. Cerveau 1985;108(Pt 4):897–924.
- Powell HC, Myers RR, Costello ML, Lampert PW : pression du fluide endoneurial dans la dégénérescence wallérienne. Ann Neurol 1979;5(6):550–557.
- Gamble HJ, Eames RA. Une étude au microscope électronique des tissus conjonctifs du nerf périphérique humain. J Anat 1964;98:655–663.
- Salonen V, Roytta M, Peltonen J : Les effets de la section nerveuse sur les gaines de fibrilles de collagène endoneurial. Acta Neuropathol 1987;74(1):13–21.
- 45. Oldfors A : Macrophages dans les nerfs périphériques. Une étude histochimique ultrastructurale et enzymatique chez le rat. Acta Neuropathol 1980;49(1): 43–49.
- 46. Braunewell KH, Martini R, LeBaron R, et al : Régulation à la hausse d'un épitope de sulfate de chondroïtine lors de la régénération du nerf sciatique de souris : preuve que les molécules immunoréactives sont liées aux protéoglycanes de sulfate de chondroïtine décorine et versicane. Eur J Neurosci 1995;7(4): 792–804.
- Kapur E, Vuckovic I, Dilberovic F, et al : résultats neurologiques et histologiques après des injections intraneurales de lidocaïne dans les nerfs sciatiques canins. Acta Anaesthesiol Scand 2007;51(1):101–107.
- Jeng CL, Rosenblatt MA : Injections intraneurales et anesthésie régionale : le connu et l'inconnu. Minerva Anestesiol 2011;77(1):54–58.
- Orebaugh SL, Mukalel JJ, Krediet AC, et al : injection de racine de plexus brachial dans un modèle de cadavre humain : distribution de l'injectat et effets sur le neuraxis. Reg Anesth Pain Med 2012;37(5):525–529.
- Moayeri N, Bigeleisen PE, Groen GJ : Architecture quantitative du plexus brachial et des compartiments environnants, et leur signification possible pour les blocs du plexus. Anesthésiologie 2008;108(2):299–304.
- Sala Blanch X, Lopez AM, Carazo J, et al : injection intraneurale pendant le blocage du nerf sciatique guidé par un stimulateur nerveux au niveau de la fosse poplitée. Br J Anaesth 2009;102(6):855–861.
- Berthold CH, Carlstedt T. Observations sur la morphologie à la transition entre le système nerveux périphérique et le système nerveux central chez le chat. III. Fibres myélinisées dans les radicelles dorsales S1. Acta Physiol Scand Suppl 1977;446:43–60.
- Andres KH : [La structure fine de la région olfactive des animaux macrosmatiques]. Zellforsch Mikrosk Anat 1966;69:140–154.
- Haller FR, Low FN : La structure fine de la gaine de la racine nerveuse périphérique dans l'espace sous-arachnoïdien chez le rat et d'autres animaux de laboratoire. Am J Anat 1971;131(1):11–19.
- Himango WA, Low FN : La structure fine d'un évidement latéral de l'espace sous-arachnoïdien chez le rat. Anat Rec 1971;171(1):1–19.
- McCabe JS, Low FN : L'angle sous-arachnoïdien : une zone de transition dans le nerf périphérique. Anat Rec 1969;164(1):15–33.
- Waggener JD, Beggs J : Les revêtements membraneux des tissus neuraux : une étude en microscopie électronique. J Neuropathol Exp Neurol 1967;26(3): 412–426.
- Pease DC, Schultz RL : microscopie électronique des méninges crâniennes de rat. Am J Anat 1958;102(2):301–321.
- Nabeshima S, Reese TS, Landis DM, Brightman MW : Jonctions dans les méninges et la glie marginale. J Comp Neurol 1975;164(2):127–169.
- Evans PJ, Lloyd JW, Wood GJ : Injection intrathécale accidentelle de bupivacaïne et de dextran. Anesthésie 1981;36(7):685–687.
- Gadsden JC, Lindenmuth DM, Hadzic A, Xu D, Somasundarum L, Flisinski KA : Le bloc du plexus lombaire utilisant une injection à haute pression entraîne une propagation controlatérale et péridurale. Anesthésiologie 2008;109(4):683–688.
- Lundborg G. Microcirculation intraneurale. Orthop Clin North Am 1988;19(1):1–12.
- McManis PG, Schmelzer JD, Zollman PJ, Low PA : Flux sanguin et autorégulation dans les ganglions somatiques et autonomes. Comparaison avec le nerf sciatique. Brain 1997;120(Pt 3):445–449.
- Beggs J, Johnson PC, Olafsen A, Watkins CJ, Cleary C : artérioles transpérineurales dans le nerf sural humain. J Neuropathol Exp Neurol 1991;50(6): 704–718.
- Bell MA, Weddell AG : Une étude morphométrique des vaisseaux intrafasciculaires du nerf sciatique de mammifère. Nerf musculaire 1984;7(7):524–534.
- Smith DR, Kobrine AI, Rizzoli HV : Flux sanguin dans les nerfs périphériques. Débits normaux et après coupure. J Neurol Sci 1977;33(3): 341–346.
- Kozu H, Tamura E, Parry GJ : L'apport sanguin endoneurial aux nerfs périphériques n'est pas uniforme. J Neurol Sci 1992;111(2):204–208.
- Perez-Castro R, Patel S, Garavito-Aguilar ZV, et al : cytotoxicité des anesthésiques locaux dans les cellules neuronales humaines. Anesth Analg 2009;108(3):997–1007.
- Drac H, Babiuch M, Wisniewska W : Modifications morphologiques et biochimiques des nerfs périphériques avec le vieillissement. Neurotol Pol 1991;29(1–2–): 49–67.
- Lehmann J : [Modifications liées à l'âge dans les nerfs périphériques]. Zentralbl Allg Pathol 1986;131(3):219–227.
- Arnold N, Harriman DG : L'incidence des anomalies dans les nerfs périphériques humains témoins étudiés par dissection d'un seul axone. J Neurol Neurosurg Psychiatry 1970;33(1):55–61.
- Tohgi H, Tsukagoshi H, Toyokura Y : Changements quantitatifs avec l'âge dans les nerfs suraux normaux. Acta Neuropathol 1977;38(3):213–220.
- Vizoso AD : La relation entre la longueur internodale et la croissance des nerfs humains. J Anat 1950;84(4):342–353.
- Ochoa J, Mair WG : Le nerf sural normal chez l'homme. II. Modifications des axones et des cellules de Schwann dues au vieillissement. Acta Neuropathol 1969;13(3): 217–239.
- Ochoa J : Reconnaissance de la maladie des fibres amyéliniques : critères morphologiques. Nerf musculaire 1978;1(5):375–387.
- Kovacic U, Sketelj J, Bajrovic FF : Chapitre 26 : Différences liées à l'âge dans la réinnervation après une lésion nerveuse périphérique. Int Rev Neurobiol 2009;87:465–482.
- Li X, Karmakar MK, Lee A, Kwok WH, Critchley LA, Gin T : Évaluation quantitative de l'intensité de l'écho du nerf médian et des muscles fléchisseurs de l'avant-bras chez les jeunes et les personnes âgées. Br J Radiol 2012;85(1014):e140–e145.
- Navarro X, Vivo M, Valero-Cabre A : Plasticité neurale après lésion nerveuse périphérique et régénération. Prog Neurobiol 2007;82(4):163–201.
- Keyl C, Held T, Albiez G, Schmack A, Wiesenack C : Augmentation du seuil de stimulation nerveuse électrique du nerf sciatique chez les patients atteints de gangrène du pied diabétique : une étude prospective de cohorte parallèle. Eur J Anaesthesiol 2013;30(7):435–440.
- Borgeat A, Ekatodramis G, Kalberer F, Benz C : Complications aiguës et non aiguës associées au bloc interscalène et à la chirurgie de l'épaule : une étude prospective. Anesthésiologie 2001;95(4):875–880.