Kenneth D. Candido, Anthony R. Tharian et Alon P. Winnie
INTRODUCTION
La technique de l'anesthésie régionale intraveineuse (IVRA), ou "bloc de Bier", a été introduite pour la première fois en 1908 par le chirurgien allemand August Bier. Un bloc de Bier consiste essentiellement à injecter des solutions anesthésiques locales dans le système veineux d'un membre supérieur ou inférieur exsanguiné par compression ou gravité et isolé au moyen d'un garrot de la circulation centrale. Dans la technique originale de Bier, la procaïne anesthésique locale à des concentrations de 0.25% à 0.5% était injectée à travers une canule intraveineuse, qui avait été placée entre deux bandages Esmarch utilisés comme garrots pour diviser le bras en composants proximaux et distaux. Après l'injection de l'anesthésique local, Bier a noté deux types d'anesthésie distincts : un début quasi immédiat d'anesthésie « directe » entre les deux garrots puis, après un délai de 5 à 7 minutes, une anesthésie « indirecte » distale par rapport au garrot placé distalement. tourniquet. En pratiquant des dissections du système veineux du membre supérieur sur des cadavres après injection de bleu de méthylène, Bier a pu déterminer que l'anesthésie directe était le résultat d'une anesthésie locale baignant les terminaisons nerveuses nues dans les tissus, alors que l'anesthésie indirecte était très probablement due à l'anesthésie locale étant transportée vers la substance des nerfs via le vasa nervorum, où se produit un bloc de conduction typique. La conclusion de Bier était que deux mécanismes d'anesthésie étaient associés à cette technique : le bloc d'infiltration périphérique et le bloc de conduction. La technique, telle que décrite à l'origine par Bier, reste essentiellement inchangée dans la pratique moderne au cours des 106 dernières années, à l'exception de l'introduction de la préparation à double garrot de type pneumatique utilisée dans la pratique clinique actuelle (Figure 1).
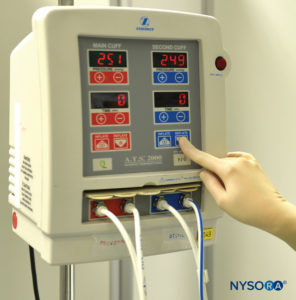
FIGURE 1.Système de garrot pneumatique double pour une utilisation en anesthésie régionale intraveineuse du membre supérieur ou inférieur.
Un bloc Bier peut être utilisé pour de brèves interventions chirurgicales ou des manipulations du membre supérieur ou inférieur. Cependant, la technique a trouvé sa plus grande acceptation pour une utilisation pour le membre supérieur car les problèmes de garrot et d'autres problèmes de sécurité semblent survenir plus fréquemment lorsque l'IVRA est utilisée sur les membres inférieurs. Le bloc de Bier est également une procédure qui s'est avérée utile comme traitement d'appoint pour les patients souffrant de syndromes douloureux régionaux complexes (SDRC) (anciennement connus sous le nom de dystrophie sympathique réflexe, avec douleur maintenue par le système sympathique) comme alternative aux blocs ganglionnaires sympathiques répétés. À cet égard, il a été démontré que l'IVRA diminue l'inflammation neurogène, un phénomène possiblement associé au SDRC, avec peu d'altération de la fonction sensorielle, du moins lorsque la mépivacaïne est l'anesthésique local choisi pour le bloc. La sensibilité au froid est significativement diminuée 10 à 30 minutes après le bloc, même avec une diminution de la température cutanée du côté bloqué.
La sympathectomie chimique utilisant IVRA avec des agents tels que la guanéthidine ou le brétylium peut durer jusqu'à 5 jours, par rapport aux blocs anesthésiques locaux, qui fournissent généralement une analgésie ne durant que quelques heures. Des tests sensoriels quantitatifs (QSART, test quantitatif de réflexe axonal sudomoteur) avant et après de tels blocs ont démontré qu'il est possible de prédire quels patients ressentiront un soulagement durable de la douleur en utilisant des blocs de guanéthidine IVRA après une blessure traumatique ou une intervention chirurgicale.
Bien que l'IVRA soit une méthode sûre et efficace d'administration d'anesthésiques locaux pour le bloc des extrémités à la fois pour la chirurgie et pour le contrôle de la douleur, une grande enquête publiée a noté que la plupart des résidents en anesthésie de troisième année (CA-3) avaient effectué moins de 10 de ces blocs pendant toute la durée de leur traitement. leur formation.
ANATOMIE
La seule anatomie pertinente est la localisation et la distribution des veines de la main, de la fosse antécubitale et de la région du pied et de la cheville.
INDICATIONS
Membre supérieur
L'anesthésie régionale intraveineuse utilisant un anesthésique local, le plus souvent de la lidocaïne 0.5 % à 1 % (prilocaïne 1 % en Europe), est appropriée pour la chirurgie et la manipulation des extrémités nécessitant une anesthésie d'une durée allant jusqu'à 1 heure. Il est particulièrement adapté aux opérations périphériques des tissus mous telles que la ganglionectomie, la libération du canal carpien, la chirurgie de la contracture de Dupuytren ou la réduction des fractures. Cependant, la nécessité d'exsanguiner le membre à l'aide d'un bandage d'Esmarch, manœuvre potentiellement douloureuse, peut interdire la réalisation de certaines interventions avec cette technique (Figure 2 et Figure 3).
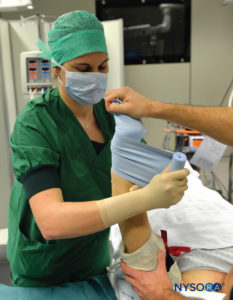
FIGURE 2.Début du processus d'exsanguination du membre supérieur gauche surélevé à l'aide d'un bandage Esmarch étroitement enroulé de la main distale au membre supérieur proximal à la base du garrot distal.
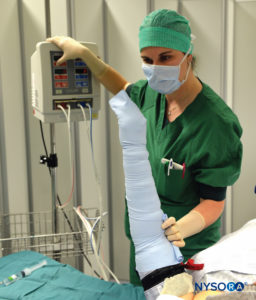
FIGURE 3. En gardant le bandage d'Esmarch bien enroulé, les garrots d'abord distaux, puis proximaux sont à 50-100 mm Hg au-dessus de la pression artérielle systolique.
De même, les manipulations des nerfs cubital, médian ou radial peuvent provoquer des paresthésies, pouvant nécessiter l'utilisation d'analgésiques parentéraux adjuvants ou de sédatifs. Une nouvelle utilisation de l'IVRA consiste à anesthésier la main avant d'injecter la toxine botulique A (BTX-A) pour le traitement de l'hyperhidrose. La BTX-A réduit significativement la production de sueur, mesurée par le test de Minor et quantifiée par l'analyse au cornéomètre, mais l'injection est douloureuse sauf si la main est préalablement anesthésiée ; L'IVRA s'est avérée appropriée à cette fin. Selon une étude récente, il n'y avait aucune différence dans le degré et la durée de l'analgésie entre l'IVRA et le bloc ganglionnaire stellaire (SGB) en utilisant une combinaison de 70 mg de lidocaïne et 30 μg de clonidine chez les patients atteints de SDRC de type 1 affectant les membres supérieurs. L'étude a conclu que l'IVRA était préférable à la SGB dans ce contexte en raison de son risque moindre d'effets secondaires indésirables et de son exécution plus facile que la SGB.
L'IVRA du membre supérieur a été utilisée occasionnellement pour l'analgésie/anesthésie prolongée (c'est-à-dire les interventions chirurgicales qui devraient durer plus d'une heure), avec une période obligatoire de dégonflage du garrot d'au moins 1 minute avant de rétablir l'état anesthésié.
Membre inférieur
L'anesthésie régionale intraveineuse peut être utilisée pour de brèves interventions chirurgicales du membre inférieur d'une manière analogue à celle décrite pour la chirurgie du membre supérieur. Les procédures chirurgicales qui peuvent être complétées en utilisant cette approche comprennent l'excision d'une masse; réparation nerveuse numérique; chirurgie des fractures/luxations phalangiennes ; et excision naviculaire accessoire. Toute intervention orthopédique du pied, de la cheville ou du membre inférieur distal nécessitant environ 45 minutes ou moins peut se prêter à cette modalité.
Bien que l'IVRA ait été associée à une incidence accrue de syndrome du compartiment lors du traitement des fractures de la diaphyse tibiale et a donc été jugée contre-indiquée dans de tels cas, une étude chez des volontaires n'a montré aucune différence significative des pressions tissulaires avant et après le gonflage du garrot quel que soit le volume de solution saline utilisé (≤1.5 ml/kg) ou en fonction de le temps suivant l'injection de solution saline pendant le gonflage du garrot. Les auteurs ont conclu que, dans le membre atraumatique normal, l'IVRA simulée utilisant une solution saline normale (NS) n'augmente pas la pression tissulaire dans le compartiment antérieur de la jambe.
Pédiatrie
L'anesthésie régionale intraveineuse a été un choix acceptable chez certains patients pédiatriques pour la réduction des fractures du membre supérieur. Une étude rétrospective comparant l'IVRA et la sédation consciente pour la réduction des fractures pédiatriques de l'avant-bras a révélé que l'IVRA était une méthode sûre, efficace et rentable pour réduire les fractures pédiatriques de l'avant-bras. Il y avait 600 patients dans le groupe IVRA et 645 patients dans le groupe sédation consciente. Aucun patient n'a présenté de syndrome de loge ou n'a eu besoin d'être réadmis suite à l'application d'un plâtre. Une intervention sur leur plâtre en raison d'une étanchéité a été nécessaire chez 28 patients (4.34 %) dans le groupe sédation procédurale et 13 patients (2.16 %) dans le groupe IVRA.
CONTRE-INDICATIONS
La seule contre-indication absolue à l'IVRA est le refus du patient. Les contre-indications relatives comprennent les suivantes :
• Blessures par écrasement d'un membre
• Incapacité à localiser les veines périphériques
• Infections cutanées locales
• Cellulite
• Fractures composées
• Patients ayant des antécédents convaincants d'allergie aux anesthésiques locaux
• Patients souffrant de lésions vasculaires graves aux extrémités
• Shunts artério-veineux vasculaires préexistants et patients chez qui un garrot n'est pas adapté (c.-à-d. patients atteints d'une maladie vasculaire périphérique grave)
• Drépanocytose
• Une intervention chirurgicale planifiée pendant > 1 heure n'est généralement pas une bonne indication pour une anesthésie régionale IV en raison de la survenue d'une douleur liée au garrot.

Tiré du Compendium of Regional Anesthesia : Anesthésie régionale intraveineuse (IVRA, bloc de Bier) : infographie sur le mécanisme d'action, les indications et les contre-indications.
LES MEILLEURS ÉQUIPEMENTS
Figure 1 à Figure 8 montrer l'équipement utilisé dans l'IVRA
1. Agents anesthésiques locaux : chlorhydrate de lidocaïne, 0.25 % à 0.1 % (l'alternative est la prilocaïne, 0.5 %)
2. Un garrot en caoutchouc (drain Penrose) de 12 à 18 po de longueur (30 à 45 cm) et 7/8 po. large (2.3 cm) à utiliser avant de placer la canule intraveineuse
3. Un extracathéter intraveineux de calibre 20 ou 22 (cathéter sur aiguille) (Figure 5)
4. Une poche de 500 mL ou 1 L de solution intraveineuse connectée à un ensemble de perfusion (vs. un verrou hep) à connecter à la canule intraveineuse pour maintenir sa perméabilité jusqu'à ce que la solution anesthésique soit injectée dans l'extrémité isolée (peut remplacer un port intraveineux à rinçage salin à la place)
5. Moniteurs standard de l'American Society of Anesthesiologists (ASA) (électrocardiographe, tension artérielle, oxymètre de pouls)
6. Matériel de réanimation (cathéter intraveineux, solution cristalloïde et set de perfusion pour le membre supérieur controlatéral) (pour le membre supérieur IVRA)
7. Deux garrots pneumatiques de taille appropriée pour l'extrémité sélectionnée (Chiffres 6 et 9)
8. Un bandage Esmarch de 60 po de longueur (152 cm) et de 4 po de largeur (10 cm) pour exsanguiner le bras (Chiffres 2, 3, et 7)
9. Ensemble préparatoire de peau stérile
10. Une seringue Luer lock de 30 ou 50 mL
11. Une tasse à mesurer graduée pour le mélange de la solution, de préférence d'une capacité de 100 ml
12. Ruban adhésif, différentes tailles
En savoir plus sur Équipement pour l'anesthésie régionale.
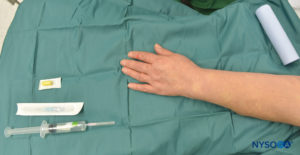
FIGURE 4. L'équipement pour IVRA se compose d'un bandage Esmarch, de flacons d'anesthésique local, d'un garrot en caoutchouc, d'un extracathéter intraveineux (IV) (cathéter sur aiguille), de tampons alcoolisés et d'une seringue pour prélever l'anesthésique local.
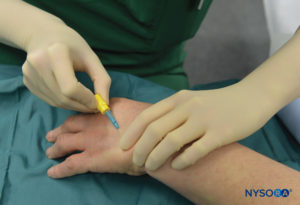
FIGURE 5.Canule intraveineuse et Hep-Lock placés dans une veine distale de la main en préparation pour IVRA.
PRÉPARATION DES PATIENTS
Le patient est allongé en position couchée dorsale tant que la veine sélectionnée pour le placement est facilement accessible. Le matériel de réanimation est vérifié et les garrots pneumatiques sont testés et préparés pour être utilisés. Pour la chirurgie du coude, l'aiguille sera placée dans l'avant-bras ou la fosse antécubitale. Pour les procédures sur la main ou l'avant-bras, il est préférable de choisir une veine dans le dos de la main (Figure 5).
Pour les procédures des membres inférieurs, une veine sur le pied, la cheville ou la jambe inférieure est choisie. Après avoir obtenu un accès intraveineux dans une extrémité non opérée (alternativement, un accès veineux central peut être sécurisé), un ensemble complet de moniteurs ASA est appliqué et les signes vitaux de base sont évalués. Si le patient ressent une douleur intense, de petites aliquotes d'analgésiques intraveineux peuvent maintenant être administrées (c'est-à-dire du fentanyl 1–2 μg/kg) pour faciliter le processus d'exsanguination. Étant donné que la coopération totale du patient n'est pas essentielle pour réussir, de petites doses de benzodiazépine hydrosoluble (c.-à-d., midazolam 15-25 μg/kg) peuvent également être administrées pour l'anxiolyse. Un avantage important du choix d'une benzodiazépine est la suppression de la réponse convulsivante associée à la toxicité de l'anesthésique local, une préoccupation valable chez le patient subissant une IVRA en raison du grand volume de l'agent directement administré dans le système vasculaire.
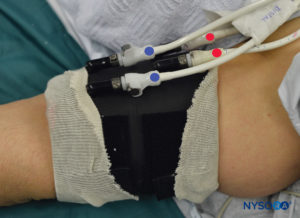
FIGURE 6. Garrot clairement étiqueté proximal (ROUGE) et distal (BLEU) du système de double garrot. Le garrot est toujours gonflé dans l'ordre suivant : Distal, Proximal. Une fois la fonctionnalité vérifiée, le garrot distal (BLEU) est dégonflé.
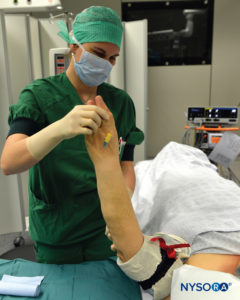
FIGURE 7. Élévation de l'extrémité pour permettre l'exsanguination passive.
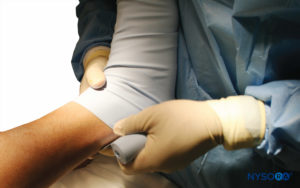
FIGURE 8. Le membre inférieur droit surélevé est enveloppé d'un bandage d'Esmarch étroitement enroulé jusqu'au garrot.
TECHNIQUE

Tiré du Compendium of Regional Anesthesia : Anesthésie régionale intraveineuse (IVRA, Bier block) : Technique infographique.
IVRA du membre supérieur
Voici la technique d'IVRA pour les procédures des membres supérieurs :
1. Un cathéter en plastique à demeure est inséré dans une veine périphérique le plus distalement possible sous des précautions aseptiques strictes (Figure 5).
2. Un double garrot pneumatique est placé sur le brassard proximal haut sur le haut du bras (Chiffres 6 et 7). Alors que, par convention, les garrots sont placés sur la zone du biceps, une étude a révélé que la dose de lidocaïne pouvait être presque divisée par deux lorsque le garrot était placé dans l'avant-bras au lieu du haut du bras. Vingt patients subissant des chirurgies de l'avant-bras et de la main ont reçu l'IVRA avec une combinaison de lidocaïne 1.5 mg/kg et de kétorolac 0.15 mg/kg avec un garrot placé sur l'avant-bras. 20 autres patients subissant des procédures similaires ont reçu IVRA avec le double de la dose des mêmes médicaments et avec le garrot placé sur la partie supérieure du bras. L'anesthésie chirurgicale a été jugée excellente chez les 20 patients du groupe garrot du bras supérieur, alors qu'elle a été jugée excellente chez 19/20 patients du groupe garrot de l'avant-bras. L'apparition ainsi que la régression du bloc sensoriel étaient similaires dans les deux groupes. Une étude récente comparant le placement d'un garrot sur l'avant-bras (n = 28) avec 8 mL de lidocaïne à 2 % et 10 mg de kétorolac et le placement d'un garrot sur le bras (n = 28) avec 15 mL de lidocaïne à 2 % et 20 mg de kétorolac a révélé que les patients dans l'avant-bras Le groupe du garrot a connu moins d'inconfort, moins d'interventions de sédation et une plus grande probabilité de contourner l'unité de soins post-anesthésiques (USPA) par rapport au groupe avec le garrot du haut du bras.
3. Le bras entier est élevé pour permettre l'exsanguination passive (Figure 7), et un bandage en caoutchouc d'Esmarch est enroulé autour du bras en spirale du bout des doigts de la main à la manchette distale du double garrot pour exsanguiner le bras (Chiffres 2 et 3).
4. L'artère axillaire est digitalement occluse, et tandis que la pression est maintenue dessus, le brassard pneumatique proximal est gonflé à 50–100 mm Hg au-dessus de la pression artérielle systolique, après quoi le bandage d'Esmarch est retiré.
5. Après le gonflage de la coiffe proximale et le retrait du bandage d'Esmarch, 30 à 50 ml de chlorhydrate de lidocaïne à 0.5 % sont injectés via le cathéter en plastique à demeure, le volume dépendant de la taille du bras étant anesthésié.
6. Au niveau de la table de procédure, la canule intraveineuse dans l'extrémité chirurgicale est retirée et une pression est rapidement appliquée sur le site à l'aide de gaze stérile.
7. Environ 25 à 30 minutes après le début de l'anesthésie ou lorsqu'un patient se plaint d'une douleur liée au garrot, la manchette distale est gonflée et la manchette proximale est dégonflée pour minimiser le développement de la douleur du garrot.
IVRA des membres inférieurs
La seule différence significative dans l'IVRA pour les membres supérieurs et inférieurs est que la technique IVRA pour le membre inférieur nécessite des volumes relativement plus importants de solutions anesthésiques locales en raison de la disparité de taille évidente entre les membres supérieurs et inférieurs. Cela est nécessaire pour remplir plus complètement le plus grand compartiment vasculaire du membre inférieur, de la canule intraveineuse distale au garrot proximal (100 ml contre 50 ml).
CONSIDÉRATIONS PHARMACOLOGIQUES
Considérations sur l'anesthésie locale
La lidocaïne est l'anesthésique local prototype utilisé pour l'IVRA aux États-Unis. En Europe, cependant, la prilocaïne peut être plus couramment utilisée et a en fait fait l'objet de la plupart des essais cliniques. Des tentatives ont été faites pour maximiser l'efficacité de la lidocaïne tout en minimisant les effets secondaires ou toxicité du mandataire. L'alcalinisation de la lidocaïne à 0.5 % (utilisant du bicarbonate de sodium à 1.4 %) pour l'IVRA a été étudiée chez 31 patients. Les auteurs n'ont trouvé aucun avantage clinique à la pratique de l'alcalinisation de la lidocaïne en ce qui concerne le bloc sensoriel, le bloc moteur ou l'apparition de douleurs postopératoires. Lorsque la lidocaïne a été comparée à la 2-chloroprocaïne alcalinisée et non alcalinisée, toutes deux utilisées à des concentrations de 0.5 % et utilisées exclusivement pour la chirurgie de la main, la chloroprocaïne alcalinisée s'est comportée de la même manière que la lidocaïne, mais la chloroprocaïne ordinaire n'a offert aucun avantage et a produit plus d'effets secondaires que ceux observés avec la lidocaïne.
Une autre étude comparant l'IVRA avec la lidocaïne à faible concentration/volume élevé (concentration de 0.5 % de 30 à 50 mL de lidocaïne) et la lidocaïne à concentration plus élevée/faible volume (concentration de 2 % de 12 à 15 mL de lidocaïne) chez des patients subissant une chirurgie du membre supérieur ont montré un début plus rapide et une régression retardée du bloc sensoriel dans le groupe à concentration plus élevée/faible volume. Il n'y avait pas de différences significatives dans les données hémodynamiques telles que la pression artérielle systolique et diastolique, la pression artérielle moyenne et la fréquence cardiaque entre les deux groupes.
La lidocaïne a été comparée à la ropivacaïne pour l'IVRA des membres supérieurs dans deux études distinctes. Deux doses de ropivacaïne (1.2 et 1.8 mg/kg) ont été comparées à une dose de lidocaïne (3.0 mg/kg) chez 15 volontaires. La récupération du bloc sensitif et moteur après la libération du garrot a été la plus lente avec le groupe à forte dose de ropivacaïne. Un plus grand nombre de patients du groupe lidocaïne (5 sur 5) ont présenté des étourdissements après la libération du garrot, contre seulement 1 dans le groupe ropivacaïne à forte dose. Dans la seconde étude, 51 patients ont été randomisés pour recevoir soit de la ropivacaïne 0.375 %, soit de la lidocaïne 0.5 % dans un volume de 0.4 mL/kg jusqu'à 25 mL. L'analgésie postopératoire mesurée à la première demande d'analgésiques était supérieure dans le groupe ropivacaïne.
La progression du bloc sensoriel dans la main suite à une IVRA avec 20 ml de ropivacaïne à 0.3 % et un double garrot placé dans l'avant-bras a été étudiée chez 10 volontaires sains. L'anesthésique local a été injecté par un cathéter intraveineux de calibre 22 placé dans une veine proéminente sur le dos de la main après exsanguination de la main à l'aide d'un bandage Esmarch et gonflage séquentiel du garrot distal à 150 mm Hg ou 20 mm Hg au-dessus du sang systolique pression (la plus élevée) et le garrot proximal à 250 mm Hg. Le garrot distal a ensuite été dégonflé et le bandage d'Esmarch a été retiré. Les valeurs de base pour la sensation de froid et de toucher ont été déterminées avant le bloc, et les valeurs mises à jour ont été obtenues de manière répétée et continue, en commençant 5 minutes après l'injection d'anesthésique local et en continuant jusqu'à ce que la perte de sensation soit obtenue dans toutes les zones. Il y a eu une perte presque immédiate de la perception du froid suivie d'une propagation retardée et inégale de la perte de la sensation tactile. La propagation initiale de l'anesthésie a été notée à la fois de manière proximale et distale dans le dos de la main, puis a progressé jusqu'au bout des doigts, avec une propagation proximale retardée sur la surface palmaire de la main jusqu'au poignet.
La prilocaïne a été comparée à la lidocaïne, ainsi qu'à d'autres anesthésiques locaux utilisés pour l'IVRA. Lors de l'évaluation de l'apparition d'un bloc sensoriel et moteur, 40 mL de prilocaïne à 0.5 % (100 mg) ont été comparés au même volume et à la même concentration de chloroprocaïne chez 10 volontaires subissant une IVRA. L'apparition du bloc moteur ne différait pas entre les groupes et la sensation était récupérée presque aussi bien. Cependant, la récupération de la fonction motrice était plus courte dans le groupe prilocaïne, et plus de patients chloroprocaïnes ont montré des signes d'irritation veineuse ou d'urticaire antécubital pendant 30 à 45 minutes après le dégonflage du garrot. Les modifications de la fréquence cardiaque étaient également plus notables dans le groupe chloroprocaïne. Le même groupe d'enquêteurs a élargi son étude pour inclure 60 patients, 30 dans chacun des groupes respectifs détaillés précédemment. Maintenant, les enquêteurs ont découvert que la récupération complète du bloc sensoriel était plus rapide dans le groupe prilocaïne (7.1 contre 9.8 minutes). Sinon, l'incidence des effets secondaires est restée plus élevée dans le groupe chloroprocaïne.
Ensuite, ces chercheurs ont comparé la prilocaïne à 0.5 % avec la même concentration d'articaïne (un anesthésique local de type amide amide plus récent qui contient du thiophène et est pharmacologiquement similaire à la mépivacaïne) pour l'IVRA des membres supérieurs. L'articaïne, un anesthésique local puissant avec un faible degré de toxicité en raison de son métabolisme rapide avec les estérases, a été considérée comme une alternative appropriée à la prilocaïne. Dix volontaires ont participé à cette comparaison croisée en double aveugle des deux agents.
Ils n'ont trouvé aucune différence significative entre les deux en ce qui concerne le début de l'anesthésie ou du bloc moteur ou la récupération des fonctions sensorielles ou motrices. Cependant, 80 % des sujets ont présenté des éruptions cutanées après avoir reçu de l'articaïne, contre 20 % dans le groupe prilocaïne.
Lorsque la prilocaïne à 0.5 % a été comparée aux mêmes concentrations d'articaïne ou de lidocaïne dans trois groupes de 10 patients chacun pour l'IVRA, il a été constaté que l'apparition du bloc sensoriel était significativement plus courte dans le groupe de l'articaïne, qui présentait également les concentrations plasmatiques maximales les plus faibles de anesthésie locale après libération du garrot. La prilocaïne pure à 1 % a été comparée au même anesthésique local associé à quatre additifs différents pour l'IVRA : la bupivacaïne à 0.25 %, la clonidine à 150 μg, le sufentanil à 25 μg ou le ténoxicam à 20 mg. Le groupe sufentanil ajouté a démontré l'apparition la plus rapide du bloc sensoriel ; les scores de douleur postopératoire ont été améliorés par l'ajout de clonidine ou de ténoxicam. Sinon, il n'y avait pas de différences significatives entre les cinq groupes en ce qui concerne le début et la durée du bloc sensoriel. Contrairement à la situation constatée pour la lidocaïne avec ajout de bicarbonate comme adjuvant, l'ajout de bicarbonate à la prilocaïne semble raccourcir le délai d'apparition et prolonger la durée de l'anesthésie pendant l'IVRA.
L'utilisation de la mépivacaïne pour l'IVRA a été étudiée. Seize patients ont été évalués en utilisant 1.4 mg/kg dans un total de 40 ml pour IVRA par rapport aux blocs salins effectués chez les mêmes individus sur le bras controlatéral. L'occlusion artérielle a été maintenue pendant 20 minutes. L'hyperémie réactive a été atténuée dans le bras traité par la mépivacaïne pendant la période d'évaluation de 60 minutes, indiquant que la mépivacaïne est un vasoconstricteur puissant ayant une longue durée d'action. Cette découverte a des implications pour l'utilisation de la mépivacaïne chez les personnes dont la circulation sanguine des membres supérieurs est compromise ou atteintes de SDRC, pour lesquelles elle ne devrait probablement pas être considérée comme l'anesthésique local de choix.
Le même groupe d'étude a évalué les effets de la mépivacaïne IVRA sur la douleur brûlante induite par la capsaïcine intracutanée et sur le flux sanguin microvasculaire cutané, mesuré par Doppler imagerie de perfusion. L'hyperémie réactive était moindre dans le bras traité à la mépivacaïne 10 minutes après la libération du garrot, et la zone de la poussée était plus petite après la capsaïcine dans les bras traités à la mépivacaïne. Les auteurs ont conclu que la mépivacaïne IVRA n'avait aucun effet sur la fonction sensorielle post-IVRA des fibres afférentes minces, mais diminuait différemment la propagation de la poussée induite par la capsaïcine.
Conseils NYSORA
• La lidocaïne est le médicament prototype utilisé pour l'IVRA aux États-Unis ; la prilocaïne est préférée en Europe.
• L'alcalinisation de la lidocaïne confère un avantage minime, voire nul, à la lidocaïne commerciale pour l'IVRA.
• Les puissantes propriétés vasoconstrictrices de la mépivacaïne nuisent à son attrait général en tant qu'agent principal de l'IVRA.
Compléments aux anesthésiques locaux pour IVRA
Une revue systématique de la littérature a été entreprise pour évaluer l'utilisation des compléments aux anesthésiques locaux pour IVRA. Vingt-neuf études remplissaient les critères d'être randomisées, en double aveugle et contrôlées. Les données sur 1217 30 sujets de l'étude ont été examinées et les agents étudiés comprenaient des opioïdes (fentanyl, sufentanil, mépéridine et morphine) ; clonidine; myorelaxants (atracurium, pancuronium, mivacurium); le tramadol; anti-inflammatoires non stéroïdiens (AINS) (kétorolac, ténoxicam, acétylsalicylate) ; alcalinisation au bicarbonate de sodium; l'ajout de potassium; et les changements de température. Les auteurs ont trouvé des preuves solides à l'appui de l'utilisation des AINS en général et du kétorolac en particulier pour améliorer l'analgésie postopératoire et prolonger la tolérance au garrot pendant l'IVRA. Les opioïdes se sont mal comportés lorsqu'ils étaient utilisés pour l'IVRA, seule la mépéridine à des doses de XNUMX mg ou plus montrant des avantages postopératoires substantiels au détriment des nausées, des vomissements et des étourdissements après la déflation. Les relaxants musculaires ont amélioré le bloc moteur postopératoire et ont été bénéfiques dans la réduction des fractures dans lesquelles la relaxation musculaire est impérative pour de bons résultats.
Agonistes Alpha2 (Clonidine et Dexmedetomidine)
La clonidine a été ajoutée à la fois à la prilocaïne et à la lidocaïne en complément de l'IVRA pour la chirurgie des extrémités. Lorsque 2 μg/kg ont été ajoutés à la prilocaïne à 0.5 % de manière randomisée en double aveugle chez 56 patients subissant une chirurgie du membre supérieur, il n'y avait aucune différence entre les groupes concernant l'apparition ou la durée du bloc sensoriel ou moteur. Les patients qui avaient reçu de la clonidine ont eu une réduction significative de la pression artérielle après la libération du garrot (24 % à 48 %), tandis que les fréquences cardiaques sont restées inchangées.
Les auteurs ont conclu que la clonidine était d'un bénéfice limité en complément des anesthésiques locaux.35 L'ajout de clonidine à la prilocaïne a considérablement supprimé la douleur du garrot, mais n'a pas modifié la douleur postopératoire après le dégonflage du garrot.
Il a été constaté que la clonidine n'apportait aucun avantage mesurable lorsqu'elle était ajoutée à la lidocaïne pour l'IVRA chez les patients subissant une libération du canal carpien.
De manière appropriée, la dexmédétomidine est huit fois plus sélective envers les récepteurs α-adrénergiques que la clonidine. En tant que tel, il a été utilisé dans l'IVRA pour déterminer s'il pourrait faire avancer certaines des découvertes bénéfiques notées avec ce dernier agent. Trente patients subissant une chirurgie de la main sous IVRA ont reçu 0.5 % de lidocaïne seule ou de la lidocaïne plus dexmédétomidine 0.5 μg/kg.
Le groupe dexmédétomidine a montré un début plus rapide de bloc sensitif et moteur ; récupération prolongée du bloc sensoriel et moteur ; tolérance prolongée pour le garrot; et une meilleure qualité de l'analgésie par rapport au groupe qui n'a reçu qu'une anesthésie locale.
Un temps d'apparition du bloc sensoriel raccourci; temps de récupération des blocs sensoriels et moteurs prolongés ; durée prolongée de l'analgésie pour le garrot ; et une analgésie postopératoire prolongée ont été notées chez des patients subissant une IVRA avec dexmédétomidine dans une autre étude randomisée en double aveugle comparant les effets du lornoxicam ou de la dexmédétomidine dans une IVRA avec la prilocaïne chez des patients subissant une chirurgie de la main ou de l'avant-bras. Dans cette étude, l'IVRA a été obtenue avec 2 % de prilocaïne à 3 mg/kg dans le groupe témoin (n = 25), 2 % de prilocaïne à 3 mg/kg plus dexmédétomidine 0.5 μg/kg dans le groupe dexmédétomidine (n = 25), et prilocaïne 2 % à 3 mg/kg plus lornoxicam 8 mg dans le groupe lornoxicam (n = 25). Dans chaque groupe, les médicaments ont été dilués avec une solution saline normale à 0.9 % jusqu'à un volume total de 40 ml.
Une étude plus récente comparant les effets de la dexmédétomidine lorsqu'elle est ajoutée à la lidocaïne pour l'IVRA et lorsqu'elle est administrée par voie parentérale comme prémédication avant l'IVRA a révélé que ces deux groupes présentaient une amélioration similaire de la qualité de l'anesthésie et de l'analgésie périopératoire. Cette étude a été réalisée sur des patients subissant une libération du canal carpien randomisés en trois groupes.
IVRA a été fait en utilisant 40 mL de lidocaïne à 0.5 %. Une dose unique de dexmédétomidine 0.5 μg/kg et de solution placebo (solution saline) dans un volume total de 20 ml a été administrée au groupe P (n = 15) et au groupe S (n = 15), respectivement, avant l'IVRA. La dexmédétomidine à raison de 0.5 μg/kg a été ajoutée à la lidocaïne dans le groupe A (n = 15) pendant l'IVRA. Le temps d'apparition et de récupération du bloc sensoriel et moteur, l'échelle visuelle analogique peropératoire-postopératoire (EVA), le score de sédation de Ramsay (RSS), les besoins en analgésiques, les variables hémodynamiques et les effets secondaires ont été notés. Un temps d'apparition et de récupération du bloc sensoriel significativement raccourci dans les groupes P et A, un temps d'apparition du bloc moteur raccourci dans le groupe P et une diminution des scores EVA peropératoires et des besoins en analgésiques dans les groupes P et A ont été constatés. Le RSS peropératoire dans le groupe P et le RSS postopératoire dans les groupes P et A étaient plus élevés que dans le groupe S. La fréquence cardiaque peropératoire et postopératoire et la pression artérielle moyenne postopératoire (MAP) du groupe P étaient significativement plus faibles que dans les groupes A et S, respectivement.
Les opioïdes
Étant donné que l'on a découvert l'existence de récepteurs opiacés dans le système nerveux périphérique et qu'il a été démontré que les opioïdes peuvent produire une analgésie efficace et de longue durée lorsqu'ils sont injectés conjointement avec des anesthésiques locaux pour le bloc du plexus brachial, plusieurs chercheurs ont tenté de réduire le potentiel de toxicité d'origine locale. IVRA anesthésique seul en ajoutant des opioïdes pour réduire la concentration de lidocaïne. Bien qu'il n'ait pas été prouvé que l'ajout de fentanyl à la lidocaïne pour l'IVRA entraîne une amélioration de l'analgésie tout en réduisant les risques, l'ajout de fentanyl à la dose de 200 μg à la prilocaïne 0.5 % a entraîné une analgésie plus complète que chez les patients ayant reçu 100 μg ajouté, ou lorsque la prilocaïne ordinaire a été utilisée pour l'IVRA. Les nausées postopératoires et les effets secondaires sur le système nerveux central étaient plus élevés dans les groupes recevant du fentanyl ajouté par rapport à ceux ayant reçu une anesthésie locale seule. Deux autres études, cependant, ont révélé que l'ajout d'opioïdes à la prilocaïne n'améliorait pas le succès de la technique. Des recherches plus approfondies sur les effets de l'ajout d'opioïdes à la prilocaïne pour l'IVRA pourraient finalement résoudre cet écart.
Certains chercheurs ont découvert que l'ajout d'opioïdes et de relaxants musculaires à la lidocaïne à 0.25 % fournit la même analgésie et la même relaxation musculaire que celles fournies par la lidocaïne à 0.5 % seule, tout en réduisant la probabilité de toxicité systémique. Les adjuvants ajoutés à la lidocaïne comprennent le fentanyl 50 μg plus pancuronium 0.5 mg, le fentanyl plus rocuronium, le fentanyl plus D-tubocurarine et le fentanyl plus vécuronium. Dans chaque cas, les auteurs ont signalé des conditions de fonctionnement exceptionnelles et, comme la concentration de lidocaïne a pu être réduite à 0.20 % (c'est-à-dire plus de la moitié de la normale utilisée), le risque de toxicité systémique a été au moins divisé par deux.
Lorsque la mépéridine 0.25 %, 40 mL (100 mg), a été utilisée comme agent solitaire pour l'IVRA, un bloc moteur complet a été produit, tout aussi efficace que celui produit par la lidocaïne. L'apparition du bloc moteur était aussi rapide ou plus rapide que l'apparition du bloc sensoriel chez chacun des 15 patients de ce groupe d'étude. Cependant, par rapport à la lidocaïne ordinaire dans cette étude, il y avait une incidence plus élevée d'étourdissements, de nausées et de douleurs au site d'injection.
Tramadol
Le tramadol a été évalué pour une utilisation dans l'IVRA du membre supérieur. Soixante volontaires répartis en quatre groupes de 15 patients chacun ont reçu une IVRA avec 40 mL de tramadol 0.25 % (100 mg), une solution saline normale à 0.9 %, de la lidocaïne à 0.5 % ou de la lidocaïne plus tramadol à 0.25 %. L'apparition et la récupération du bloc sensoriel et moteur étaient similaires entre le tramadol et le sérum physiologique normal. Cependant, l'ajout de tramadol à la lidocaïne a entraîné une apparition plus rapide du bloc sensoriel au détriment d'une augmentation des éruptions cutanées et des sensations de brûlure douloureuses à l'injection. placer. La conclusion des auteurs était que le tramadol seul ne possède pas d'effets anesthésiques locaux mais pourrait modifier les effets s'il était ajouté à un anesthésique local tel que la lidocaïne.
Dans une autre étude comparant 0.5 % de lidocaïne avec et sans 50 mg de tramadol pour l'IVRA des membres supérieurs, le groupe tramadol ajouté a ressenti moins de douleur au garrot que le groupe local uniquement, mais comme dans l'étude mentionnée précédemment, il y a eu plusieurs cas d'urticaire cutanée. dans le groupe tramadol mais pas dans le groupe lidocaïne seule. Le tramadol (100 mg) ajouté à la lidocaïne pour l'IVRA pour l'anesthésie des membres supérieurs a agi de la même manière que le sufentanil (25 μg) ou la clonidine (1 μg/kg) ajouté à l'anesthésie locale en ce qui concerne les données hémodynamiques peropératoires, le temps de récupération du bloc sensoriel, l'apparition et la récupération du bloc moteur, des scores de sédation et de la douleur postopératoire.61 En résumé, le tramadol est inefficace en tant qu'agent seul pour l'IVRA, mais peut conférer certains avantages lorsqu'il est ajouté à la lidocaïne. Cet avantage, cependant, peut être compensé par l'incidence significative des effets secondaires dermatologiques du tramadol administré par voie intraveineuse dans un membre exsanguiné.
Relaxants Musculaires
Une petite dose de myorelaxant non dépolarisant peut être choisie en complément de l'anesthésique local administré pour l'IVRA ; cependant, comme la D-tubocurarine libère de l'histamine même à des doses judicieuses, il est probablement préférable d'éviter complètement cet agent. L'atracurium a été ajouté à la lidocaïne dans le but d'améliorer la relaxation musculaire pendant l'IVRA, en particulier lors de la réduction des fractures et des luxations des membres supérieurs. L'ajout de 3 mg d'atracurium à la lidocaïne pour IVRA a entraîné une diminution du temps d'apparition de l'analgésie dans la main, mais pas au niveau du garrot. Il n'y avait aucun avantage supplémentaire à ajouter cet agent ou à ajouter de l'alfentanil à la lidocaïne dans la même étude. Une étude utilisant 2 mg d'atracurium ajoutés à 40 mL de lidocaïne à 0.5 % pour IVRA pour la chirurgie de la main chez 40 patients randomisés dans l'un des deux groupes a révélé que l'ajout d'atracurium offrait un plus grand degré de relaxation musculaire, une réduction plus facile des fractures et de meilleures conditions opératoires, ainsi que moins de douleur après la chirurgie.
La néostigmine
La néostigmine a été suggérée comme coanalgésique lorsqu'elle est utilisée pour épidurale et intrathécal l'analgésie et l'anesthésie, mais les preuves de ses bienfaits sur le système nerveux périphérique font défaut. Dans deux études, l'une utilisant la néostigmine ajoutée à la lidocaïne et l'autre utilisant l'adjuvant ajouté à la prilocaïne, les résultats ont été contradictoires. Lorsque la néostigmine (1 mg) a été ajoutée à 0.5 % de lidocaïne pour l'IVRA dans une étude de 54 volontaires randomisés dans l'un des trois groupes d'étude, il a été constaté que l'ajout de l'adjuvant n'apportait aucun avantage en termes d'analgésie ou d'anesthésie par rapport aux témoins. Lorsque la moitié de la dose de néostigmine (0.5 mg) a été ajoutée à la prilocaïne (3 mg/kg) pour l'IVRA chez 30 patients randomisés dans l'un des deux groupes de traitement, il a été constaté que le groupe adjuvant présentait un blocage sensoriel et moteur raccourci. fois, des temps de récupération des blocs sensoriels et moteurs prolongés, une meilleure qualité de l'anesthésie et un délai prolongé jusqu'au premier besoin d'analgésique par rapport au groupe prilocaïne ordinaire.
Une étude plus récente examinant l'effet de l'ajout de 0.5 mg de néostigmine à 40 ml de lidocaïne à 0.5 % pour l'IVRA chez des patients subissant des chirurgies électives ou d'urgence de l'avant-bras et de la main randomisées en deux groupes, avec 1 ml de solution saline isotonique ajoutée à 40 ml de solution à 0.5 % la lidocaïne dans le groupe témoin, ont noté des temps d'apparition du bloc sensoriel et moteur significativement plus courts et des temps de récupération plus longs dans le groupe néostigmine par rapport au groupe témoin. La qualité de l'anesthésie peropératoire et la fréquence des douleurs du garrot étaient similaires dans les deux groupes. Il semble que les résultats contradictoires avec deux doses différentes de néostigmine ajoutées à la lidocaïne pour l'IVRA devront être confirmés par des travaux supplémentaires incorporant des échantillons de patients plus importants pour résoudre l'écart dans les deux petites études mentionnées précédemment.
Agents anti-inflammatoires non stéroïdiens
D'autres tentatives pour améliorer l'IVRA avec la lidocaïne ont inclus l'utilisation d'AINS pour supprimer la douleur du garrot tout en améliorant l'analgésie postopératoire. Bien que le kétorolac ait montré une certaine efficacité, d'autres AINS ne se sont pas comportés aussi favorablement. Le kétorolac a été étudié comme adjuvant à la lidocaïne en utilisant soit un avant-bras, soit un garrot au bras chez des patients subissant une chirurgie de la main ou de l'avant-bras. Dans cette étude, les patients ont été randomisés en deux groupes : le groupe UA, composé de 20 patients subissant une IVRA avec un garrot au bras ; et le groupe FA, composé de 20 patients subissant une IVRA avec un garrot à l'avant-bras. Les patients du groupe garrot au bras ont reçu l'IVRA avec 0.5 % de lidocaïne à la dose de 3 mg/kg plus kétorolac 0.3 mg/kg. L'IVRA dans le groupe garrot de l'avant-bras a été établie avec 0.5 % de lidocaïne à 0.15 mg/kg plus kétorolac à 0.15 mg/kg. Il n'y avait pas de différence statistiquement significative dans l'apparition et la durée du bloc sensoriel et la nécessité d'une supplémentation analgésique entre les deux groupes. Les scores de douleur postopératoire étaient également similaires entre les deux groupes. Les auteurs ont conclu que le garrot d'avant-bras IVRA avec 0.5 % de lidocaïne à une dose de 1.5 mg/kg plus kétorolac 0.15 mg/kg est une option sûre et cliniquement viable qui fournit une anesthésie et une analgésie périopératoires similaires à celles fournies par le garrot IVRA de bras supérieur avec 0.5 % lidocaïne à la dose de 3 mg/kg plus kétorolac 0.3 mg/kg, tout en réduisant de moitié la dose de lidocaïne et de kétorolac.
Un autre AINS, le ténoxicam, a été ajouté à la prilocaïne dans une étude portant sur 45 patients au total. Une dose de 20 mg d'AINS a été utilisée chez les patients subissant une IVRA pour la réduction des fractures de Colles, les patients étant divisés en trois groupes. Un groupe n'a reçu qu'une anesthésie locale ; un a reçu local plus ténoxicam ; et un groupe a eu IVRA avec anesthésie locale seulement plus un AINS intraveineux. Dans ce dernier groupe, le ténoxicam (20 mg) a été injecté dans le bras controlatéral, opposé au bras IVRA. Le groupe recevant l'AINS ajouté à l'anesthésique local présentait une analgésie supérieure et des scores de douleur inférieurs à ceux des deux autres groupes de patients.
Une étude plus récente comparant les effets analgésiques peropératoires et postopératoires du lornoxicam et du fentanyl lorsqu'ils sont ajoutés à la lidocaïne pour l'IVRA chez des patients subissant une chirurgie de la main a montré une augmentation du temps de récupération du bloc sensoriel et du premier besoin d'analgésique dans le groupe lornoxicam, sans augmentation de l'incidence des effets secondaires, par rapport au groupe lidocaïne seule et au groupe lidocaïne avec fentanyl. Dans cette étude, un total de 45 patients ont été randomisés en trois groupes. Les patients du groupe 1 ont reçu 3 mg/kg de lidocaïne à 2 % (40 mL) ; le groupe 2 a reçu 3 mg/kg de lidocaïne, 38 mL plus lornoxicam 2 mL (4 mg/mL) ; et le groupe 3 a reçu 3 mg/kg de lidocaïne, 38 mL plus 2 mL de fentanyl (0.05 mg/mL). Cette étude a également conclu que l'ajout de fentanyl à la lidocaïne IVRA (groupe 3) semblait être supérieur à la lidocaïne IVRA (groupe 1) et au lornoxicam ajouté à la lidocaïne IVRA (groupe 2) pour diminuer la douleur du garrot ; cependant, cela s'est fait au détriment de l'augmentation des effets secondaires comme les démangeaisons.
Le dexkétoprofène est un autre AINS qui a été étudié en complément de la lidocaïne pour l'IVRA. Dans cette étude prospective, randomisée et contrôlée par placebo, les patients devant subir une chirurgie élective des tissus mous de la main ou de l'avant-bras ont été divisés au hasard en trois groupes. Les 45 patients ont tous reçu de la lidocaïne à 0.5 % en IVRA. Le dexkétoprofène 50 mg a été administré par voie intraveineuse ou ajouté à la solution IVRA, et le groupe témoin a reçu un volume égal de solution saline à la fois par voie intraveineuse et dans le cadre de l'IVRA. Les temps d'apparition du bloc sensoriel et moteur, le temps de récupération et la consommation d'analgésiques postopératoires ont été enregistrés. Par rapport aux témoins, l'ajout de dexkétoprofène à la solution d'IVRA a entraîné une apparition plus rapide du bloc sensoriel et moteur, un temps de récupération plus long, une diminution des scores de douleur per- et postopératoire et une diminution des besoins analgésiques postopératoires. La formulation pharmacologique du dexkétoprofène utilisée dans cette étude contenait de l'éthanol comme excipient. Les auteurs ont déclaré que l'effet neurolytique de l'éthanol peut avoir contribué au développement plus rapide du bloc sensoriel et moteur et à des temps de récupération plus longs dans le groupe IVRA de cette étude.
Autres agents spécifiques : corticostéroïdes
Les propriétés anti-inflammatoires des stéroïdes de type glucocorticoïdes ont été évaluées lorsque ces agents ont été ajoutés à des anesthésiques locaux pour IVRA chez des patients atteints de polyarthrite rhumatoïde (PR). Dans une étude randomisée, en double aveugle, croisée et contrôlée par placebo, 20 patients atteints de PR ont reçu soit 50 mg de méthylprednisolone dans de la mépivacaïne à 0.25 %, soit de la mépivacaïne seule pour le membre supérieur IVRA. L'autre extrémité a reçu le traitement inverse. Une semaine plus tard, les mêmes médicaments ont été injectés dans les extrémités controlatérales, respectivement. Cinquante pour cent des patients ont rapporté une amélioration subjective à 1 et 6 semaines ; les paramètres objectifs tels que la force de préhension n'ont pas changé jusqu'à l'évaluation de 6 semaines, date à laquelle une augmentation significative a été notée, tout comme la réduction du diastasis de préhension et de la douleur provoquée par le mouvement. Ce rapport suggère que les corticostéroïdes administrés par IVRA peuvent fournir une analgésie soutenue chez certaines personnes souffrant de PR.
Le stéroïde IVRA a également été utilisé comme traitement d'appoint du SDRC de type 1. La méthylprednisolone (40 mg) a été ajoutée à la lidocaïne pour l'IVRA de manière randomisée, en double aveugle et contrôlée par placebo chez 22 patients. Les traitements ont été appliqués une fois par semaine, jusqu'à trois séances de blocs. Les enquêteurs n'ont trouvé aucun avantage à ajouter le stéroïde au local en ce qui concerne l'amélioration de la sévérité de la douleur ou le raccourcissement de l'évolution de la maladie. Fait intéressant, une série de cas impliquant 168 patients atteints de SDRC de type 1 du membre supérieur traités par IVRA utilisant 25 ml de lidocaïne à 0.5% et 125 mg de méthylprednisolone dilués dans 10 ml de solution saline normale et suivis sur une période de 5 ans a rapporté une absence complète de la douleur chez 92 % des patients à la fin de la période de suivi. L'IVRA a été réalisée avec le garrot maintenu gonflé pendant 20 minutes, période pendant laquelle l'extrémité affectée a été manipulée dans le but d'augmenter l'amplitude des mouvements. Le garrot a ensuite été progressivement dégonflé pour éviter une entrée rapide des agents injectés dans la circulation.
Le même processus était répété une ou deux fois par semaine selon l'intensité et la persistance des symptômes du patient, et entre les séances, les patients étaient maintenus sous une thérapie physique douce, qui n'était ni prolongée ni stressante. Une moyenne de 4.8 séances a été nécessaire pour soulager les symptômes et fournir une extrémité fonctionnelle. Les auteurs ont attribué les résultats cliniques au stade précoce du SDRC de type 1 au début du traitement et à l'augmentation de la dose de méthylprednisolone par rapport aux études précédentes.
L'acétaminophène
En raison de ses effets analgésiques connus, l'acétaminophène (APAP) (paracétamol) a été étudié comme adjuvant aux anesthésiques locaux chez les patients subissant une chirurgie de la main sous IVRA. Soixante patients subissant une chirurgie de la main ont été randomisés en trois groupes. Tous les groupes ont reçu de la lidocaïne IVRA (3 mg/kg) diluée avec une solution saline normale jusqu'à un volume total de 40 mL. Le groupe 1 a reçu de la lidocaïne IVRA plus une solution saline intraveineuse. Le groupe 2 a reçu de la lidocaïne IVRA et un mélange APAP (300 mg) plus une solution saline intraveineuse ; et le groupe 3 a reçu de la lidocaïne IVRA plus de l'APAP intraveineux (300 mg). Le temps d'apparition du bloc sensoriel et moteur, la douleur du garrot et l'utilisation d'analgésiques ont été évalués pendant la chirurgie. Après le dégonflage du garrot, les scores VAS à 1, 2, 4, 6, 12 et 24 heures ; le délai avant le premier besoin d'analgésique ; consommation totale d'analgésiques dans les 24 premières heures ; et les effets secondaires ont été notés. Il n'y avait pas de différence significative dans l'apparition des blocs sensoriels entre les trois groupes ; cependant, la durée du bloc sensoriel était significativement plus longue dans le groupe 2. Le temps d'apparition du bloc moteur était plus court et la durée du bloc moteur était plus longue dans le groupe 2. La douleur du garrot a été réduite et la qualité des scores d'anesthésie telle que rapportée par l'anesthésiste, qui était en aveugle au médicament à l'étude, était également significativement plus élevé dans le groupe 2. Il n'y avait pas de diminution démontrable des scores de douleur postopératoire entre les trois groupes. Les auteurs ont souligné le dosage arbitraire d'APAP (300 mg) comme une lacune de l'étude. D'autres études de dosage sont nécessaires pour optimiser le dosage du paracétamol lorsqu'il est utilisé comme adjuvant à la lidocaïne pour l'IVRA.
Une autre étude évaluant l'effet de l'APAP, lorsqu'il est ajouté à la lidocaïne dans l'IVRA, sur le temps d'apparition du bloc sensoriel et moteur, la douleur du garrot et l'analgésie postopératoire a trouvé un temps d'apparition du bloc sensoriel plus court ; délai d'apparition de la douleur du garrot retardé ; et une réduction des scores de douleur postopératoire et de la consommation d'analgésiques. La posologie de l'acétaminophène était identique à celle de l'étude précédente (lidocaïne à 0.5 % diluée avec 300 mg d'APAP intraveineux jusqu'à un volume total de 40 mL). Le groupe témoin a reçu 0.5 % de lidocaïne diluée avec 0.9 % de solution saline normale jusqu'à un volume total de 40 ml. L'heure d'apparition et la durée du bloc moteur n'ont pas été évaluées dans cette étude. Pour tenter d'expliquer le temps d'apparition plus rapide du bloc sensoriel dans le groupe lidocaïne-acétaminophène, les auteurs ont étudié le pH du mélange de lidocaïneacétaminophène et ont constaté que la valeur du pH de ce mélange était de 5.88, ce qui était inférieur au pH de la lidocaïne. –mélange salin normal, qui était de 6.16. Cela contredit le fait que plus le pH de l'anesthésique local est élevé, plus la pénétration nerveuse est importante et donc l'apparition plus rapide du bloc neural. Dans cette étude, les auteurs ont attribué l'apparition plus rapide du bloc sensoriel à d'éventuels effets antinociceptifs de l'APAP au niveau des sites périphériques.
Nitroglycérine
L'effet de la nitroglycérine (NTG), lorsqu'elle est ajoutée à la lidocaïne pour l'IVRA, a été étudié dans une étude prospective, randomisée, en double aveugle.76 Trente patients subissant une chirurgie de la main ont été répartis au hasard en deux groupes. Le groupe témoin (groupe C, n = 15) a reçu une dose totale de 40 mL avec 3 mg/kg de lidocaïne diluée avec une solution saline normale, et le groupe NTG (groupe NTG, n = 15) a reçu 200 μg NTG supplémentaires. Temps d'apparition des blocages sensoriels et moteurs raccourcis ; temps de récupération des blocs sensoriels et moteurs prolongés ; diminution de la douleur du garrot ; et une amélioration de la qualité de l'anesthésie ont été notées dans le groupe NTG. Les besoins en analgésiques postopératoires ont également été significativement diminués dans le groupe NTG. Les auteurs ont attribué le temps d'apparition plus court du bloc sensoriel et moteur aux effets vasodilatateurs du NTG qui favorise la distribution de l'anesthésique local aux nerfs. Certains des autres mécanismes qui peuvent contribuer à l'amélioration de l'analgésie avec le NTG peuvent inclure le métabolisme du NTG en oxyde nitrique, qui à son tour provoque une augmentation de la concentration intracellulaire de guanosine monophosphate cyclique, qui produit
modulation de la douleur dans le système nerveux central et périphérique. Il a également été démontré que les générateurs d'oxyde nitrique induisent des effets anti-inflammatoires et une analgésie en bloquant l'hyperalgésie et la composante neurogène de l'œdème inflammatoire par application topique.
Midazolam
Il a été démontré que le midazolam accélère l'apparition du bloc sensoriel et moteur et améliore l'analgésie postopératoire lorsqu'il est ajouté à la bupivacaïne pour le bloc du plexus brachial. Il a été démontré que le midazolam avait des effets analgésiques médiés par les récepteurs GABA (acide γ-aminobutyrique) dans la moelle épinière dans des études animales. Des récepteurs GABA ont également été trouvés dans les nerfs périphériques. Il a également été démontré que le midazolam réduit l'activité des fibres A-delta et C.
Dans une étude conçue pour évaluer l'effet du midazolam lorsqu'il est ajouté à la lidocaïne pour l'IVRA, 40 patients subissant une chirurgie de la main ont été répartis au hasard en deux groupes. Le groupe témoin a reçu 3 mg/kg de lidocaïne diluée à 2 % avec une solution saline jusqu'à un volume total de 40 ml, et le groupe midazolam a reçu 50 μg/kg supplémentaires de midazolam. Il n'y avait pas de différences statistiquement significatives dans les temps d'apparition et de récupération du bloc sensoriel et moteur entre les deux groupes. Cependant, un score d'évaluation subjective de la douleur à l'aide de l'échelle d'évaluation numérique (NRS) pour la douleur du garrot a été significativement diminué dans le groupe midazolam. La qualité de l'anesthésie évaluée par le patient et le chirurgien était également significativement meilleure dans le groupe midazolam.
Les scores de douleur NRS postopératoires étaient également significativement plus faibles dans le groupe midazolam pendant les 2 premières heures postopératoires.
Cependant, les scores de sédation postopératoire étaient également plus élevés dans le groupe midazolam. Les auteurs ont indiqué que l'amélioration de l'analgésie postopératoire après le dégonflage du garrot peut s'expliquer par l'effet systémique du midazolam en plus de l'effet analgésique périphérique.
Une autre étude a impliqué 60 patients subissant une chirurgie de la main randomisés en deux groupes, le groupe témoin et le groupe midazolam recevant l'IVRA avec un dosage exactement identique de lidocaïne et de midazolam comme dans l'étude précédente. Cette étude a montré des temps d'apparition des blocs sensoriels et moteurs raccourcis et des temps de récupération des blocs sensoriels et moteurs prolongés en plus de la diminution des scores de douleur au garrot et des scores de douleur postopératoire. Les résultats contradictoires en ce qui concerne les temps d'apparition des blocs sensoriels et moteurs peuvent justifier d'autres études avec des échantillons plus importants pour résoudre l'écart. À l'heure actuelle, tout ce que l'on peut dire, c'est que le midazolam semble être prometteur en tant que complément à l'anesthésique local lorsqu'il est utilisé pour l'IVRA des membres supérieurs.
La kétamine
La kétamine est un puissant analgésique dont le principal mécanisme d'action est l'antagonisme des récepteurs du glutamate N-méthyl-D-aspartate (NMDA) qui jouent un rôle crucial dans le mécanisme de traitement de la douleur au niveau de la moelle épinière. Des études animales ont indiqué la présence de récepteurs NMDA dans les nerfs périphériques. Il a également été démontré que la kétamine produit un blocage transitoire des canaux sodiques et potassiques des nerfs périphériques. La présence possible de récepteurs NMDA dans les nerfs périphériques ainsi que la capacité de la kétamine à bloquer localement les canaux sodiques indiquent un site d'action périphérique possible pour la kétamine, en plus de ses sites d'action centraux bien établis.
La kétamine a été étudiée en tant qu'adjuvant de la lidocaïne IVRA chez les patients subissant une chirurgie de la main et son efficacité dans le contrôle de la douleur peropératoire du garrot, de l'analgésie postopératoire et des effets secondaires a été comparée à la même dose de kétamine administrée par voie systémique. Dans cette étude de contrôle systémique randomisée, en double aveugle, 40 patients subissant une chirurgie ambulatoire de la main ont été randomisés en deux groupes. Dans le groupe « IVRA », 0.1 mg/kg de kétamine dans 1 mL de solution saline normale ont été ajoutés à la lidocaïne IVRA, et 1 mL de solution saline normale a été administré via une ligne intraveineuse périphérique. Dans le groupe « systémique », 1 ml de solution saline normale a été ajouté à la seringue IVRA et 0.1 mg/kg de kétamine dans 1 ml de solution saline normale ont été administrés via une ligne intraveineuse périphérique. Les deux groupes ont reçu 40 mL de lidocaïne à 0.5 % pour IVRA.
L'étude n'a trouvé aucune différence entre les groupes dans les paramètres d'étude mentionnés, et les auteurs ont conclu que la kétamine IVRA et la kétamine intraveineuse systémique étaient indiscernables en termes de douleur au garrot peropératoire et de consommation d'analgésique postopératoire. La vitesse d'apparition et la durée du bloc sensitif et moteur n'ont pas été mesurées dans cette étude. Une autre étude comparant l'efficacité de la kétamine et de la clonidine lorsqu'elles sont ajoutées séparément à 40 mL de lidocaïne à 0.5 % pour l'IVRA chez des patients subissant une chirurgie de la main ou de l'avant-bras a révélé une apparition retardée de la douleur liée au garrot et une diminution de la consommation d'analgésiques dans ces deux groupes par rapport au groupe témoin. recevant 40 mL de lidocaïne à 0.5 % additionnée de solution saline. La kétamine a eu un effet plus puissant sur les paramètres de l'étude par rapport à la clonidine. Dans cette étude portant sur 45 patients randomisés en trois groupes, l'IVRA a été réalisée en utilisant 40 ml de lidocaïne à 0.5 % et de solution saline, 1 μg/kg de clonidine ou 0.1 mg/kg de kétamine.
Traitements IVRA spécifiques pour le SDRC
Les agents bloquants ou antagonistes adrénergiques, en particulier ceux efficaces au niveau du récepteur α, se sont révélés prometteurs dans le traitement du SDRC, en particulier lorsque ces agents sont utilisés pour l'IVRA. D'autres adjuvants adrénergiques libèrent puis empêchent par la suite la recapture de noradrénaline au niveau de la jonction neurovasculaire. Leur utilisation dans le SDRC est intuitive car la physiopathologie de la maladie est suspectée d'inclure le récepteur α et d'être médiée par la noradrénaline. Cependant, il existe une controverse importante à ce sujet, en particulier lorsque la recherche actuelle est comparée aux résultats d'études menées il y a près de 40 ans. La guanéthidine, la réserpine et le brétylium ont tous été évalués pour IVRA pour SDRC. Lorsque 15 mg de guanéthidine ont été ajoutés à 0.5% de prilocaïne dans un groupe de 57 patients atteints de SDRC du membre supérieur et de la main, la guanéthidine ne s'est pas avérée plus efficace que la solution saline normale dans le traitement de l'allodynie et de la douleur brûlante du SDRC à la suite de fractures du radius distal.
Ces résultats ont corroboré les travaux effectués dans une étude multicentrique randomisée en double aveugle 7 ans plus tôt. Soixante patients atteints de dystrophie sympathique réflexe (DSR)/causalgie ont reçu quatre blocs IVRA à des intervalles de 4 jours avec soit de la guanéthidine soit un placebo dans de la lidocaïne à 0.5 %. À long terme, aucune différence n'a été notée entre le groupe placebo et le groupe guanéthidine, et seulement 35 % des patients dans l'ensemble de tous les groupes ont eu une résolution de leur problème.
Le brétylium a également été utilisé dans le SDRC. Dans un essai contrôlé randomisé, la lidocaïne à 0.5 % a été comparée au même anesthésique local auquel du brétylium 1.5 mg/kg a été ajouté. Une diminution de la douleur de 30 % ou plus était considérée comme significative. Le groupe local au brétylium a eu un soulagement de la douleur pendant 20 ± 17.5 jours, contrairement au groupe à la lidocaïne seule, dans lequel l'analgésie a persisté pendant seulement 2.7 ± 3.7 jours. Le brétylium était de loin supérieur à l'anesthésique local seul dans le traitement du SDRC dans cette étude.
L'anesthésie régionale intraveineuse avec du brétylium a été utilisée pour démontrer qu'une réduction du tonus sympathique des muscles de l'avant-bras en exercice augmenterait le flux sanguin, réduirait l'acidose musculaire et atténuerait les réponses réflexes. L'IVRA avec brétylium a augmenté le flux sanguin ainsi que la consommation d'oxygène dans l'avant-bras en exercice, bien que la teneur veineuse en potassium et en ions hydrogène ait été élevée pendant la phase d'exercice, ce qui implique que les effets réflexes n'étaient pas affectés par le bloc de brétylium.
COMPLICATIONS
Les complications dues à l'IVRA peuvent être classées comme étant liées aux médicaments ou à l'équipement (c.-à-d. le garrot). Les complications liées aux médicaments dépendent des agents, y compris les anesthésiques locaux et les adjuvants, administrés directement dans le système vasculaire. Les complications liées à l'équipement comprennent tous les dispositifs et techniques utilisés pour isoler l'espace vasculaire de la circulation systémique. Un dégonflage accidentel ou involontaire du brassard, une défaillance du brassard, une augmentation soudaine de la pression veineuse dans le tissu occlus à un niveau supérieur à la pression du brassard et une circulation interosseuse intacte peuvent tous contribuer aux complications de l'IVRA.
La lidocaïne est l'anesthésique local le plus couramment utilisé pour l'IVRA et est donc l'agent pour lequel la plupart des complications ont été signalées. Heureusement, la lidocaïne ne s'accumule pas dans une grande mesure au niveau des canaux sodiques à des concentrations plasmatiques thérapeutiques, et comme elle se lie rapidement au canal et s'en dissocie rapidement, les accumulations toxiques du médicament au niveau du canal sont atypiques.97,98 Des concentrations plasmatiques excessives de lidocaïne , comme ceux associés aux bolus intraveineux de fortes doses avec un système de garrot défectueux, entraînent une vasodilatation périphérique et une diminution de la contractilité cardiaque, généralement considérées cliniquement comme une hypotension. Le début habituel de l'IVRA utilisant la lidocaïne à des concentrations de 0.5 % est rapide (environ 4.5 ± 0.3 minutes), et la fin de l'anesthésie une fois le garrot dégonflé est également rapide (5.8 ± 0.5 minutes).99 Habituellement, il n'y a aucun signe ou des symptômes de toxicité cardiovasculaire ou du système nerveux central si le garrot est dégonflé au moins 30 minutes après l'injection du médicament dans le système veineux, bien que des acouphènes aient été observés au cours des périodes post-dégonflage de 20 et 27 secondes après les temps de gonflage standard.
Cependant, une recherche documentaire dans PubMed® de l'American National Library of Medicine, dans Embase® et dans MEDLINE®, couvrant la période de 1950 à 2007, a révélé 24 cas de convulsions, des convulsions se produisant dans 12 cas alors que le brassard était encore gonflé. et dans 9 cas après dégonflage du brassard. L'information n'était pas disponible dans trois cas. Des convulsions survenant pendant le gonflage du garrot ont été signalées avec une pression du garrot dépassant la pression artérielle systolique initiale de 150 mm Hg. Des convulsions survenant après le dégonflage du garrot ont été signalées avec des durées de garrot aussi longues que 60 minutes et avec un retard pouvant aller jusqu'à 10 minutes après le dégonflage du garrot. La dose la plus faible d'anesthésique local associée à une crise était de 1.4 mg/kg pour la lidocaïne, 4 mg/kg pour la prilocaïne et 1.3 mg/kg pour la bupivacaïne.
Bien qu'environ 70 % de la dose de lidocaïne administrée reste dans les tissus du membre isolé après le dégonflage du garrot, les 30 % restants pénètrent dans la circulation systémique au cours des 45 minutes qui suivent. Beaucoup plus de médicament est libéré des tissus du membre isolé dans la circulation après le dégonflage du garrot si le membre est exercé par inadvertance, soulignant l'importance de maintenir l'extrémité préalablement anesthésiée au repos pendant un certain temps immédiatement après le dégonflage du garrot.
L'autre anesthésique local couramment utilisé pour l'IVRA, la prilocaïne, est associée à la formation de méthémoglobine (MetHb), qui se produit environ 4 à 8 heures après son administration. Heureusement, aucune méthémoglobinémie significative n'a été signalée lorsque la prilocaïne a été utilisée pour l'IVRA. La prilocaïne (0.5 %) administrée pour l'IVRA a un début d'analgésie d'environ 11 minutes (± 6.8 minutes), et la fin de l'analgésie après le dégonflage du garrot est en moyenne de 7.2 minutes (± 4.6 minutes).25 L'utilisation de cet agent pour l'IVRA semble être extraordinairement sécuritaire. En effet, dans une enquête portant sur 45,000 102 blocs de prilocaïne IVRA, il n'y a eu aucun effet secondaire grave et aucun décès en utilisant ce médicament via cette technique.XNUMX En termes d'efficacité, la prilocaïne semble être équivalente à la lidocaïne lorsqu'elle est utilisée pour IVRA.
Lorsque des opioïdes sont administrés en association avec des anesthésiques locaux pour IVRA dans le but de prolonger l'analgésie après le dégonflage du brassard, des effets secondaires occasionnels généralement attribués aux opioïdes administrés par voie systémique peuvent être notés après le dégonflage du brassard. Ceux-ci incluent des nausées, des vomissements et une sédation légère.
Lorsque des médicaments bloquants neurovasculaires sont administrés en conjonction avec des anesthésiques locaux pour améliorer les conditions chirurgicales chez les patients subissant une réduction de fracture, il n'y a eu aucun rapport de complications liées à ces adjuvants.
Conseils NYSORA
• Un système de garrot intact est essentiel pour la réussite et la sécurité de l'IVRA.
• Le dégonflage involontaire du garrot ou la présence d'une communication vasculaire, même avec un garrot intact et fonctionnel, peut entraîner une toxicité systémique sévère.
• Lorsque les procédures chirurgicales durent moins de 30 minutes, le dégonflage et le gonflage intermittents du brassard peuvent effectivement prolonger le temps nécessaire pour atteindre les concentrations artérielles maximales de l'anesthésique local, mais peuvent ne pas être entièrement fiables pour minimiser la toxicité due à la libération d'anesthésique local dans la circulation.
• Le garrot ne doit pas être dégonflé avant qu'au moins 30 minutes ne se soient écoulées depuis l'injection de l'anesthésique local (et des adjuvants, le cas échéant) dans le système veineux isolé.
De plus, le garrot lui-même peut être une source de complications car il peut provoquer des douleurs et des malaises ischémiques.
L'hypertension systémique peut résulter d'un gonflage soutenu ou prolongé du garrot. La mauvaise utilisation ou le dysfonctionnement de l'équipement est une source importante et évitable de complications dues à cette technique. Même un garrot intact et entièrement fonctionnel peut être associé à une fuite de médicaments administrés d'une extrémité supposée isolée dans la circulation systémique.
L'IVRA du membre inférieur a une incidence de près de 100 % de fuite d'anesthésique local sous le garrot, contre une incidence d'environ 25 % pour le bloc du membre supérieur. Corollaire de ce phénomène de fuite, l'utilisation de l'IVRA pour l'analgésie des membres inférieurs s'accompagne d'une incidence élevée de bloc de mauvaise qualité (près de 40 % dans une étude prospective). Le médicament peut s'écouler au-delà d'un ballonnet apparemment parfaitement fonctionnel et accéder à la circulation systémique via la circulation interosseuse, qui n'est pas affectée par l'occlusion des muscles, des tissus mous et des canaux vasculaires qui y sont associés. Ce facteur est reconnu depuis près de 50 ans, mais il ne semble pas être significatif dans la production de complications dues à l'IVRA.
Le dégonflage du garrot après IVRA est associé à des signes et symptômes de toxicité anesthésique locale systémique, allant des événements bénins liés au système nerveux central, tels que les acouphènes et les engourdissements péribuccaux, aux convulsions et enfin au collapsus cardiovasculaire dévastateur. Ceux-ci sont en corrélation avec les concentrations d'anesthésique local dans le sang artériel et non avec les concentrations veineuses.
Une autre complication due à l'IVRA est la douleur du garrot, qui survient souvent si un dispositif pneumatique double n'est pas utilisé (Figure 1 et Figure 9). Nous recommandons l'utilisation d'un tel garrot pour toute procédure réalisée à l'aide d'IVRA qui devrait durer plus de 30 minutes. Cependant, même lorsque ces directives sont suivies, des événements indésirables se produisent après le dégonflage du garrot après un intervalle de temps « sûr ». De très rares rapports isolés de complications neurologiques, y compris des dommages aux nerfs médian, cubital et musculo-cutané, sont associés à l'IVRA. La cause de ces complications semble être la pression directe du garrot appliquée sur ces nerfs, qui présentent par la suite des modifications histologiques ressemblant à des lésions par écrasement. Il est recommandé que la durée du garrot ne dépasse pas 2 heures pour réduire le risque de lésions capillaires et musculaires secondaires à une acidose tissulaire.
Syndrome des loges peut survenir rarement après l'IVRA, en particulier lorsque l'IVRA est utilisée pour la réduction des fractures des membres inférieurs des os longs, et peut être due à la fois au volume important d'anesthésique local injecté pour effectuer l'analgésie et à une exsanguination inadéquate ou incomplète du membre avant d'effectuer la bloquer. Il existe un rapport de cas de cette complication suite à l'injection par inadvertance d'une solution saline hypertonique alors qu'un anesthésique local devait être injecté.
Une patiente enceinte de 33 ans subissant une IVRA pour une libération endoscopique du canal carpien a présenté un épisode sévère de sensation de membre fantôme après l'injection de l'anesthésique local.
Les symptômes ont disparu lors de la dissipation de l'IVRA. Il existe un rapport sur la nécessité dévastatrice de l'amputation du bras chez un patient de 28 ans dont les artères radiale et ulnaire se sont thrombosées suite à l'IVRA après un bref temps d'occlusion du garrot. Que cela résulte d'une injection intra-artérielle insoupçonnée de médicament, une erreur d'administration du médicament , ou peut-être qu'une réaction médicamenteuse idiosyncratique est purement spéculative. Trois cas, dont la mort ou des lésions cérébrales permanentes associées à l'IVRA, ont été signalés dans le projet de réclamations fermées de l'ASA pour les années 1980 à 1999. Les détails de ces cas ne sont pas connus.
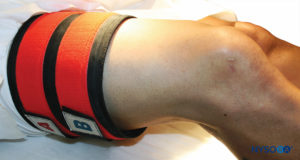
FIGURE 9.Le système de double garrot est placé sur la partie proximale de la cuisse droite, en préparation de l'IVRA du membre inférieur droit.
Toxicité anesthésique locale
Bien que la lidocaïne soit l'agent anesthésique local le plus couramment utilisé pour l'IVRA aux États-Unis, en Europe, la prilocaïne à 0.5 % est plus couramment choisie. La prilocaïne, cependant, est métabolisée en orthotoluidine, un composé oxydant capable de convertir l'hémoglobine en MetHb. Ceci n'est généralement préoccupant que lorsque la dose de prilocaïne dépasse 600 mg, ce qui, même pour les IVRA des membres inférieurs dans lesquels des volumes aussi importants que 100 mL sont utilisés, ne devrait pas être atteint (c'est-à-dire 100 mL × 0.5 % de prilocaïne = 500 mg) .
Conseils NYSORA
• La méthémoglobinémie sévère est une urgence médicale nécessitant une reconnaissance rapide et un traitement approprié.
• Une bonne anamnèse et un niveau élevé de suspicion sont nécessaires pour poser le diagnostic.
• Pour la méthémoglobinémie due à l'exposition aux médicaments, le traitement traditionnel de première ligne consiste en l'infusion de bleu de méthylène (BM).
• Le dextrose doit être administré car la principale source de NADH (nicotinamide adénine dinucléotide réduit [hydrogéné]) dans les globules rouges est le catabolisme du sucre par glycolyse. Le dextrose est également nécessaire pour former du NADPH (phosphate de NAD réduit [hydrogéné]) via le shunt d'hexose monophosphate, qui est nécessaire pour que MB soit efficace.
• La dose de MB est de 1 à 2 mg/kg IV en 5 minutes (la dose totale ne doit pas dépasser 7–8 mg/kg).
• MB peut causer de la dyspnée, des douleurs thoraciques ou une hémolyse.
• MB fournit un transporteur d'électrons artificiel pour la réduction de MetHb via la voie dépendante du NADPH. La réponse est rapide ; la dose peut être répétée dans
1 heure si le taux de MetHb est toujours élevé 1 heure après la perfusion initiale.
• Une méthémoglobinémie de rebond peut survenir jusqu'à 18 heures après l'administration de MB en raison de l'absorption prolongée d'agents lipophiles (benzocaïne) à partir du tissu adipeux. Il est raisonnable d'effectuer des mesures en série des niveaux de MetHb après un traitement avec MB. MB ne doit pas être administré aux patients présentant un déficit en glucose-6-phosphate déshydrogénase (G6PD) car la réduction de MetHb par MB dépend du NADPH généré par G6PD (hémolyse). Un traitement alternatif pour ces patients est l'acide ascorbique (2 mg/kg).
• La transfusion sanguine ou l'exsanguinotransfusion peut être utile chez les patients en état de choc. L'oxygène hyperbare a été utilisé avec un succès anecdotique dans les cas graves.
Le dégonflage du garrot après la chirurgie est une étape critique pour minimiser la possibilité de toxicité associé à l'IVRA. Premièrement, il est absolument obligatoire que le garrot ne soit dégonflé que si au moins 30 minutes se sont écoulées depuis l'injection de l'anesthésique local, même si la durée de la chirurgie ou de la manipulation a été brève. Si la chirurgie est brève et que le patient doit récupérer dans la salle de réveil, il est acceptable de pincer le garrot distal pendant qu'il est gonflé, de retirer le patient de la zone d'opération (avec le garrot gonflé) et de transférer le patient dans un cadre de soins surveillés. Cependant, personne ne doit retirer le garrot serré à aucun moment avant que la période de 30 minutes commençant par l'injection de la solution anesthésique locale ne se soit écoulée. À ce moment-là, le patient doit être surveillé en permanence pendant au moins 15 minutes après le desserrage du garrot dans la salle de réveil. Au moins un cas d'arrêt cardiaque a été signalé lorsque le garrot a été relâché peu après l'injection d'anesthésique local, où la durée de la chirurgie était extrêmement courte.
Deuxièmement, il est absolument essentiel que le dégonflage du garrot soit effectué de manière « cyclique » comme suit : le brassard est dégonflé (après un minimum de 30 minutes) et est immédiatement regonflé. Le patient est observé ou interrogé attentivement pour détecter l'apparition de symptômes associés à la toxicité de l'anesthésique local, tels que des acouphènes, des étourdissements, un goût métallique dans la bouche, etc. Évidemment, des signes de stimulation du système nerveux central peuvent également représenter une toxicité anesthésique locale et doivent également être recherchés. S'il n'y a pas de tels signes ou symptômes après environ 1 minute, le brassard est à nouveau dégonflé et à nouveau immédiatement regonflé pendant une période d'environ 1 à 2 minutes, le patient étant observé et interrogé sur la toxicité systémique de l'anesthésique local. Si aucun n'apparaît à ce moment-là, le garrot peut être dégonflé en toute sécurité et retiré de l'extrémité. La sécurité d'un tel cycle de dégonflage/regonflage est qu'à chaque dégonflage, seule une petite fraction de l'anesthésique local administré (et non lié) est autorisée à entrer dans la circulation systémique, ce qui minimise la possibilité d'une augmentation soudaine et soutenue du taux sanguin de l'anesthésique local.
RÉSUMÉ
L'anesthésie régionale intraveineuse est un complément précieux à l'arsenal des cliniciens dans toute spécialité traitant du patient gravement blessé. La simplicité de la technique et la sécurité relative (si le strict respect du protocole précédemment cité est maintenu) en font une alternative intéressante à bloc du plexus brachial (pour chirurgie ou manipulation du membre supérieur) et spinal or bloc péridural (pour la chirurgie ou la manipulation des membres inférieurs). Le simple fait de pouvoir identifier et accéder à une veine périphérique et d'appliquer un garrot pneumatique en fait l'une des modalités de bloc régional les plus « conviviales » en pratique clinique. Il n'est pas nécessaire d'être facile avec un stimulateur nerveux périphérique ou d'interpréter des images obtenues à partir d'un appareil à ultrasons. L'un des seuls inconvénients potentiels associés à l'IVRA est la durée limitée de l'anesthésie/analgésie associée à son utilisation. Une incapacité relative à prolonger l'analgésie longtemps dans la période post-opératoire nuit à son utilité. Pour ces occasions, l'insertion et l'entretien continus du cathéter au moyen d'une anesthésie du plexus garantissent une alternative attrayante.
Références
- Bier A : Uber einen neun weg local anesthesia an den gliedmassen zuerzeugen. Arch Klin Chir 1908;86:1007–1016.
- Bier A : Sur une nouvelle méthode d'anesthésie locale. Muench Med Wschir 1909; 56:589.
- Bier A : Concernant l'anesthésie veineuse. Berl Klin Wschr 1909;46 : 477–489.
- Bier A : Sur l'anesthésie locale avec une référence particulière à l'anesthésie veineuse. Édimbourg Med J 19105 : 103–123.
- Morrison J : Anesthésie locale intraveineuse. Br J Surg 1930–1931;18:641–647.
- Herreros L : Anesthésie régionale par voie intraveineuse. Anesthésiologie 1946 ; 7 : 558–560.
- Holmes CMcK : Analgésie régionale intraveineuse. Lancet 1963 ; 1 : 245–247.
- Kalman S, Svenson H, Lisander B, et al : Changements sensoriels quantitatifs chez l'homme après un bloc régional intraveineux avec de la mépivacaïne. Reg Anesth Pain Med 1999;24:236–241.
- Wahren L, Torebjork E, Nystorm B : Tests sensoriels quantitatifs avant et après le bloc régional de guanéthidine chez les patients souffrant de névralgie de la main. Douleur 1991 ; 46 : 23–30.
- Smith M, Sprung J, Zura A, et al : Une enquête sur l'exposition aux techniques d'anesthésie régionale dans les programmes de résidence en anesthésie américaine. Reg Anesth Pain Med 1999;24:11–16.
- Blaheta H, Vollert B, Zuder D, et al : L'anesthésie régionale intraveineuse (bloc de Bier) pour le traitement par la toxine botulique de l'hyperhidrose palmaire est sûre et efficace. Dermatol Surg 2002;28:666–671.
- Bosdotter Enroth S, Rystedt A, Covaciu L, et al : Anesthésie régionale intraveineuse bilatérale de l'avant-bras avec de la prilocaïne pour le traitement par la toxine botulique de l'hyperhidrose palmaire. J Am Acad Dermatol 2010 ; 63 (3): 466–474.
- Nascimento MSA, Klamt JG et Prado WA : Le bloc régional intraveineux est similaire au bloc ganglionnaire sympathique pour la gestion de la douleur chez les patients atteints du syndrome douloureux régional complexe de type 1. Braz J Med Biol Res 2010 ; 43(12):1239–1244.
- Glickman L, Mackinnon S, Rao T, et al : Anesthésie régionale intraveineuse continue. J Hand Surg 1992;17:82–86.
- Mabee J, Shean C, Orlinsky M, et al : les effets du bloc IVRA simulé de Bier sur la pression tissulaire intracompartimentale. Acta Anaesthesiol Scand 1997;41:208–213.
- Aarons CE, Fernandez MD, Willsey M, Peterson B, Key C, Fabregas J : Anesthésie régionale et moulage par bloc de Bier pour les fractures de l'avant-bras : sécurité dans les services d'urgence pédiatriques. J Pediatr Orthop 2014;34:45–49.
- Singh R, Bhagawat A, Bhadoria P, Kohli A : IVRA de l'avant-bras, utilisant 0.5 % de lidocaïne à une dose de 1.5 mg/kg avec du kétorolac 0.15 mg/kg pour les chirurgies de la main et du poignet. Minerva Anestesiol 2010;76:109–114.
- Chiao FB, Chen J, Lesser JB, Resta-Flarer F, Bennett H : Le garrot d'avant-bras à brassard unique en anesthésie régionale intraveineuse entraîne moins de douleur et moins de besoins en sédation que le garrot de bras supérieur. Br J Anaesth 2013;111(2):271–275.
- Benlabed M, Jullien P, Guelmi K, et al : Alkanisation de la lidocaïne à 0.5 % pour l'anesthésie régionale intraveineuse. Reg Anesth 1990;15:59–60.
- Lavin P, Henderson C, Vaghadia H : 2-chlorprocaïne non alcalinisée et alcalinisée par rapport à la lidocaïne pour l'anesthésie régionale intraveineuse lors d'une chirurgie ambulatoire de la main. Can J Anaesth 1999;46:939–945.
- Ulus A, Gurses E, Oztrurk I, Serin S : Évaluation comparative de deux volumes différents de lidocaïne en anesthésie régionale intraveineuse. Med SciMonit 2013;19:978–983.
- Chan V, Weisbrod M, Kaszas Z, et al : Comparaison de la ropivacaïne et de la lidocaïne pour l'anesthésie régionale intraveineuse chez des volontaires : une étude préliminaire sur l'efficacité anesthésique et le taux sanguin. Anesthésiologie 1999;90 : 1602–1608.
- Peng P, Coleman M, McCartney C, et al : comparaison de l'effet anesthésique entre 0.375 % de ropivacaïne et 0.5 % de lidocaïne dans l'anesthésie régionale intraveineuse de l'avant-bras. Reg Anesth Pain Med 2002;27;595–599.
- Horn JL, Cordo P, Kunster D, et al : Progression de l'anesthésie régionale intraveineuse de l'avant-bras avec la ropivacaïne. Reg Anesth Pain Med 2011;36(2): 177-180.
- Pitkanen M, Suzuki N, Rosenberg P : Anesthésie régionale intraveineuse avec 0.5 % de prilocaïne ou 0.5 % de chlorprocaïne. Une comparaison en double aveugle chez des volontaires. Anesthésie 1992 ; 47 : 618–619.
- Pitkanen M, Kytta J, Rosenberg P : Comparaison de la 2-chloroprocaïne et de la prilocaïne pour l'anesthésie régionale intraveineuse du bras : une étude clinique. Anesthésie 1993 ; 48 : 1091–1093.
- Pitkanen M, Xu M, Haasio J, et al : comparaison de 0.5 % d'articaïne avec 0.5 % de prilocaïne dans l'anesthésie régionale intraveineuse du bras : une étude croisée chez des volontaires. Reg Anesth Pain Med 1999;24:131–135.
- Simon M, Gielen M, Albernik N, et al : Anesthésie régionale intraveineuse avec 0.5 % d'articaïne, 0.5 % de lidocaïne ou 0.5 % de prilocaïne. Une étude clinique randomisée en double aveugle. Reg Anesth 1997;22:29–34.
- Hoffman V, Vercauteren M, Van Steenberge A, et al : anesthésie régionale intraveineuse. Évaluation de quatre additifs différents à la prilocaïne. Acta Anaesthesiol Belg 1997;48:71–76.
- Armstrong P, Brockway M, Wildsmith J : Alcalinisation de la prilocaïne pour l'anesthésie régionale intraveineuse. Anesthésie 1990 ; 45 : 11–13.
- Solak M, Akturk G, Erciyes N, et al : l'ajout de bicarbonate de sodium à la solution de prilocaïne pendant l'anesthésie régionale IV. Acta Anesthesiol Scand 1991;35:572–574.
- Kalman S, Bjorn K, Tholen E, et al : la mépivacaïne en tant que bloc régional intraveineux interfère avec l'hyperémie réactive et diminue le flux sanguin à l'état d'équilibre. Reg Anesth 1997;22:552–556.
- Kalman S, Liderfalk C, Wardell K, et al : effet différentiel sur la vasodilatation et la douleur après la capsaïcine intradermique chez l'homme pendant la décomposition de l'anesthésie régionale intraveineuse avec la mépivacaïne. Reg Anesth Pain Med 1998;23:402–408.
- Choyce A, Peng P: Une revue systématique des adjuvants pour l'anesthésie régionale intraveineuse pour les interventions chirurgicales. Can J Anaesth 2002;49 : 32–45.
- Kleinschmidt S, Stockl W, Wilhelm W, et al : L'ajout de clonidine à la prilocaïne pour l'anesthésie régionale intraveineuse. Eur J Anaesthesiol 1997;14:40–46.
- Cucchia G, Chasot-Di Dio V, et al : effet de l'ajout de clonidine à l'anesthésique local pendant le bloc Bier sur l'analgésie pré- et postopératoire. Br J Anaesth 1997;78(Suppl 1):78–79.
- Ivie CS, Viscomi CM, Adams DC, Friend AF, Murphy TR, Parker CJ : La clonidine en complément de l'anesthésie régionale intraveineuse : étude de dosage randomisée, en double aveugle et contrôlée par placebo. Clin anesthésique Pharmacol 2011;27(3):323–327.
- Memis D, Turan A, Karamanlioglu B, et al : Ajout de dexmédétomidine à la lidocaïne pour l'anesthésie régionale intraveineuse. Anesth Analg 2004;98 : 835–840.
- Kol IO, Ozturk H, Kaygusuz K, Gursoy S, Comert B, Mimaroglu C : Ajout de dexmédétomidine ou de lornoxicam à la prilocaïne dans l'anesthésie régionale intraveineuse pour la chirurgie de la main ou de l'avant-bras : une étude contrôlée randomisée. Clin Drug Investig 2009;29(2):121–129.
- Mirzak A, Gul R, Erkutlu I, Alptekin M, Oner U : Prémédication avec dexmédétomidine seule ou avec 0.5 % de lidocaïne pour IVRA. J Surg Res 2010;164(2):242–247.
- Fields H, Emson P, Leigh B, et al : plusieurs sites récepteurs aux opiacés sur les fibres afférentes primaires. Nature 1980;284:351–353.
- Young W, Wamsley J, Zarbin M, et al : les récepteurs opioïdes subissent un flux axonal. Sciences 1980;210:76–78.
- Boogaerts J, Balatoni E, Lafont N, et al : Utilization des morphiniques dans les blocs nerveux périphériques. Congrès Ser Ars Medicina 1985;3:143–150.
- Gobeaux D, Landais A : Utilisation de deux morphiniques dans les blocs du plexus brachial. J Can Anesth 1988;36:437–440.
- Gobeaux D, Landais A, Bexon G, et al : Adjonction de fentanyl la lidocaïne adrénaline pour le blocage du plexus brachial. J Can Anesth 1987;35:195–199.
- Viel E, Eledjam J, de la Coussaye J, et al : bloc du plexus brachial avec des opioïdes pour le soulagement de la douleur postopératoire : comparaison entre la buprénorphine et la morphine. Reg Anesth 1989;14:274–278.
- Candido K, Khan M, Raja D, et al : bloc du plexus brachial pour le soulagement de la douleur postopératoire. Reg Anesth 2000;25:23.
- Arhtur J, Mian T, Heavner J, et al : fentanyl et lidocaïne contre lidocaïne pour le bloc de Bier. Reg Anesth 1992;17:223–227.
- Bobart V, Hartmannsgruber M, Atanassoff P, et al : Analgésie/anesthésie après fentanyl plus lidocaïne par rapport à la lidocaïne ordinaire pour l'anesthésie régionale intraveineuse. Anesth Analg 1998:86:S-3.
- Pitkanen M, Rosenberg P, Pere P, et al : mélange de fentanyl-prilocaïne pour l'anesthésie régionale intraveineuse chez les patients subissant une intervention chirurgicale. Anesthésie 1992 ; 47 : 395–398.
- Armstrong P, Power I, Wildsmith J : Ajout de fentanyl à la prilocaïne pour l'anesthésie régionale intraveineuse. Anesthésie 1991 ; 46 : 278–280.
- Gupta A, Begntsson M, Bjornsson A, et al : Absence d'effet analgésique périphérique de la morphine à faible dose pendant l'anesthésie régionale intraveineuse. Reg Anesth 1993;18:250–253.
- Abdulla W, Fadhil N : Une nouvelle approche de l'anesthésie régionale intraveineuse. Anesth Analg 1992;75:597–601.
- Sztark F, Thicoipe M, Favarel-Garriques J, et al : L'utilisation de 0.25 % de lidocaïne avec du fentnayl et du pancuronium pour l'anesthésie régionale intraveineuse. Anesth Analg 1997;84:777–779.
- Subxedar D, Gevirtz C, Malik V, et al : Anesthésie régionale intraveineuse : évaluation prospective de la lidocaïne à 0.25 % avec du fentanyl et du rocuronium. Reg Anesth 1997;22:41.
- Thapar P, Skerman J : Évaluation de la lidocaïne à 0.2 % avec du fentanyl et de la D-tubocurarine pour l'anesthésie régionale intraveineuse. Reg Anesth 1997; 84 : S342.
- Santhosh MC, Rohini BP, Roopa S, Raghavendra PR : étude de la lidocaïne à 0.5 % seule et de la combinaison de la lidocaïne à 0.25 % avec du fentanyl et du vécuronium dans l'anesthésie régionale intraveineuse pour les chirurgies des membres supérieurs. Rev Bras Anestesiol 2013;63(3):254–257.
- Acalovschi I, Cristea T : Anesthésie régionale intraveineuse à la mépéridine. Anesth Analg 1995;81:539–543.
- Acalovschi I, Cristea T, Margarit S, et al : Tramadol ajouté à la lidocaïne pour l'anesthésie régionale intraveineuse. Anesth Analg 2001;92:209–214.
- Tan S, Pay L, Chan S : Anesthésie régionale intraveineuse utilisant de la lignocaïne et du tramadol. Ann Acad Med Singapour 2001;30:516–519.
- Alayurt S, Memis D, Pamucku Z : L'ajout de sufentanil, de tramadol ou de clonidine à la lidocaïne pour l'anesthésie régionale intraveineuse. Anaesth Intensive Care 2004;32:22–27.
- Kurt N, Kurt I, Aygunes B, et al : effets de l'ajout d'alfentanil ou d'atracurium à une solution de lidocaïne pour l'anesthésie régionale intraveineuse. Eur J Anaesthesiol 2002;19:522–525.
- Elhakim M, Sadek R : Ajout d'atracurium à la lidocaïne pour l'anesthésie régionale intraveineuse. Acta Anaesthesiol Scand 1994;38:542–544.
- McCartney C, Brill S, Rawson R, et al : Aucun avantage anesthésique ou analgésique de la néostigmine 1 mg ajoutée à l'anesthésie régionale intraveineuse avec de la lidocaïne à 0.5 % pour la chirurgie de la main. Reg Anesth Pain Med 2003;28:414–417.
- Turan A, Karamanlyoglu B, Memis D, et al : anesthésie régionale intraveineuse utilisant la prilocaïne et la néostigmine. Anesth Analg 2002;95 : 1419–1422.
- Sethi D, Wason R : Anesthésie régionale intraveineuse utilisant de la lidocaïne et de la néostigmine pour la chirurgie du membre supérieur. J Clin Anesth 2010;22(5): 324–328.
- Singh R, Bhagwat A, Bhadoria P, Kohli A : IVRA de l'avant-bras, utilisant 0.5 % de lidocaïne à une dose de 1.5 mg/kg avec du kétorolac 0.15 mg/kg pour les chirurgies de la main et du poignet. Minerva Anestesiol 2010;76(2):109–114.
- Jones N, Pugh S : L'ajout de ténoxicam à la prilocaïne pour l'anesthésie régionale intraveineuse. Anesthésie 1996 ; 51 : 446–448.
- Sertoz N, Kocaoglu N, Ayanoglu HO : comparaison du lornoxicam et du fentanyl lorsqu'ils sont ajoutés à la lidocaïne dans l'anesthésie régionale intraveineuse. Rev Bras Anestesiol 2013;63(4):311–316.
- Yurtlu S, Hanci V, Kargi E, Erdogan G, et al : L'effet analgésique du dexkétoprofène lorsqu'il est ajouté à la lidocaïne pour l'anesthésie régionale intraveineuse : une étude prospective, randomisée et contrôlée par placebo. J Int Med Res 2011;39(5):1923–1931.
- Bengtsson A, Bengtsson M, Nilsson I, et al : effets de l'administration régionale intraveineuse de méthylprednisolone plus mépivacaïne dans la polyarthrite rhumatoïde. Scand J Rheumatol 1998;27:277–280.
- Taskaynatan M, Ozgul A, Tan A, et al : Bloc de bière avec méthylprednisolone et lidocaïne dans le SDRC de type 1 : Une étude randomisée, en double aveugle et contrôlée par placebo. Reg Anesth Pain Med 2004;29:408–412.
- Varitimidis SE, Papatheodorou LK, Dailiana ZH, Poultsides L, Malizos KN : Syndrome douloureux régional complexe de type I à la suite d'un traumatisme ou d'une intervention chirurgicale au membre supérieur : prise en charge par anesthésie régionale intraveineuse, à l'aide de lidocaïne et de méthylprednisolone. J Hand Surg Eur 2011;36(9):771–777.
- Sen H, Kulachi Y, Bicerer E, Ozkan S, Dagli G, Turan A : L'effet analgésique du paracétamol lorsqu'il est ajouté à la lidocaïne pour l'anesthésie régionale intraveineuse. Anesth Analg 2009;109(4):1327–1330.
- Ko MJ, Lee JH, Cheong SH, et al : Comparaison des effets de l'acétaminophène au kétorolac lorsqu'il est ajouté à la lidocaïne pour l'anesthésie régionale intraveineuse. Coréen J Anesthesiol 2010;58(4):357–361.
- Sen S, Ugur B, Aydin ON, et al : L'effet analgésique de la nitroglycérine ajoutée à la lidocaïne sur l'anesthésie régionale intraveineuse. Anesth Analg 2006;102(3):916–920.
- Lauretti GR, Perez MV, Reis MP, Pereira NL : Évaluation en double aveugle de la nitroglycérine transdermique comme adjuvant à la morphine orale pour la gestion de la douleur cancéreuse. J Clin Anesth 2002 :14 :83-86).
- Lauretti GR, de Olivera R, Reis MP, et al : la nitroglycérine transdermique améliore l'analgésie postopératoire du sufentanil spinal après une chirurgie orthopédique. Anesthésiologie 1999 ; 90 : 734–739.
- Ferreira SH, Lorenzette BB, Faccioli LH : blocage de l'hyperalgésie et de l'œdème neurogène par application topique de NTG. Eur J Pharmacol 1992;217:207–209.
- Jaro K, Batra YK, Panda NB : Le bloc du plexus brachial avec du midazolam et de la bupivacaïne améliore l'analgésie. Can J Anaesth 2005;52:822–826.
- Laig N, Khan MN, Arif M, Khan S : Midazolam avec bupivacaïne pour améliorer la qualité de l'analgésie dans le bloc du plexus brachial pour les chirurgies des membres supérieurs. J Coll Physicians Surg Pak 2008;18:674–678.
- Nishiyama T, Tamai H, Hanaoka K : concentrations sériques et dans le liquide céphalo-rachidien de midazolam après administration péridurale chez le chien. Anesth Analg 2003;96:159–162.
- Bhisitkul RB, Villa JE, Kocsis JD : Les récepteurs GABA axonaux sont présents de manière sélective dans les fibres sensorielles normales et régénérées des nerfs périphériques du rat. Exp Brain Res 1987:66:659–663.
- Brown DA, Marsh S : Récepteurs GABA axonaux dans les troncs nerveux périphériques des mammifères. Brain Res 1978;156:187–191.
- Cairns BE, Sessle BJ, Hu JW : L'activation des récepteurs GABA-A périphériques inhibe l'activité des muscles de la mâchoire évoquée par l'articulation temporo-mandibulaire. J Neurophysiol 1999;81:1966–1969.
- Kontinen VK, Dickenson AH : Effets du midazolam dans le modèle de ligature du nerf spinal de la douleur neuropathique chez le rat. Douleur 2000 ;85 : 425–431.
- Farouk S, Aly AJ : Qualité de l'analgésie à la lidocaïne avec et sans midazolam pour l'anesthésie régionale intraveineuse. J Anesth 2010;24(6): 864–868.
- Kashefi P, Montazeri K, Honarmand A, Safavi M, Hosseini HM : L'effet analgésique du midazolam lorsqu'il est ajouté à la lidocaïne pour l'anesthésie régionale intraveineuse. J Res Med Sci 2011;16(9):1139–1148.
- Carlton SM, Hargett GL, Coggeshall RE : Localisation et activation des récepteurs du glutamate dans les axones ummyélinisés de la peau glabre du rat. Neurosci Lett 1995;197:25–28.
- Brau ME, Sander F, Vogel W, Hempelmann G : Mécanismes de blocage de la kétamine et de ses énantiomères dans le nerf périphérique démyélinisé par voie enzymatique, comme l'ont révélé des expériences à canal unique. Anesthésiologie 1997 ;86 : 394–404.
- Viscomi CM, Friend C, Parker C, Murphy T, Yarnell M : La kétamine comme adjuvant dans l'anesthésie régionale intraveineuse à la lidocaïne : Un essai contrôlé systémique randomisé, en double aveugle. Reg Anesth Pain Med 2009;34(2): 130–133.
- Georgias NK, Maidatsi PG, Kyriakidis AM, et al : Clonidine versus kétamine pour prévenir la douleur du garrot lors d'une anesthésie régionale intraveineuse avec de la lidocaïne. Reg Anesth Pain Med 2001;26(6):512–517.
- Livingstone J, Atkins R : Bloc intraveineux régional de guanéthidine dans le traitement du syndrome douloureux régional complexe post-traumatique 1 (algodystrophie) de la main. J Bone Joint Surg Br 2002;84:380–386.
- Ramamurthy S, Hoffman J : guanéthidine régionale intraveineuse dans le traitement de la dystrophie/causalgie sympathique réflexe. Une étude randomisée en double aveugle. Groupe d'étude sur la guanéthidine. Anesth Analg 1995;81 : 718–723.
- Hord A, Rooks M, Stephens B, et al : brétylium régional intraveineux et lidocaïne pour le traitement de la dystrophie sympathique réflexe : une étude randomisée en double aveugle. Anesth Analg 1992;74:818–821.
- Lee F, Shoemaker J, McQuillan P, et al : Effets du bloc Bier de l'avant-bras avec du brétylium sur les réponses hémodynamiques et métaboliques à la poignée. Am J Physiol Heart Circ 2000;279:H586–H593.
- Bader A, Concepcion M, Hurley R, et al : Comparaison de la lidocaïne et de la prilocaïne pour l'anesthésie régionale intraveineuse. Anesthésiologie 1988;69 : 409–412.
- Tucker G, Boas R : Aspects pharmacocinétiques de l'anesthésie intraveineuse. Anesthésiologie 1971;34 :538–549.
- Ware R : Anesthésie régionale intraveineuse à la bupivacaïne. Une comparaison en double aveugle avec la lidocaïne. Anesthésie 1979 ; 34 : 231–235.
- Smith C, Steinhaus J, Haynes C : La sécurité et l'efficacité de l'anesthésie régionale intraveineuse. South Med J 1968;61:1057–1060.
- Guay J: Événements indésirables associés à l'anesthésie régionale intraveineuse (Bier Block): Une revue systématique des complications. J Clin Anesth 2009;21 : 585–594.
- Bartholomew K, Sloan J : Prilocaine pour le bloc de Bier : À quel point la sécurité est-elle sûre ? Arch Emerg Med 1990;7:189–195.
- Sukhani R, Garcia C, Munhall R, et al : Disposition de la lidocaïne après une anesthésie régionale intraveineuse avec différentes techniques de déflation Anesth Analg 1989 ; 68 : 633–637.
- Mazze R, Dunbar R : Concentrations plasmatiques de lidocaïne après caudale, péridurale lombaire, bloc axillaire et anesthésie régionale intraveineuse. Anesthésiologie 1966 ; 27 : 574–579.
- Dunbar R, Mazze R : Anesthésie régionale intraveineuse : Expérience avec 779 cas. Anesth Analg 1967;46:806–813.
- Davies J, Walford A : Anesthésie régionale intraveineuse pour la chirurgie du pied. Acta Anaesthesiol Scand 1986;30:145–147.
- Kim D, Shuman C, Sadr B : Anesthésie régionale intraveineuse pour la chirurgie ambulatoire du pied et de la cheville. Une étude prospective. Orthopédie 1993:16 ; 1109-1113.
- Cotev S, Robin G : Études expérimentales sur l'anesthésie régionale intraveineuse à l'aide de lidocaïne radioactive. Br J Anaesth 1966;38:936–940.
- Hargrove R, Hoyle J, Parker J : Niveaux sanguins de lidocaïne après analgésie régionale intraveineuse. Anesthésie 1996 ; 21 : 37–41.
- Larsen U, Hommelgaard P : paralysie du garrot pneumatique après anesthésie régionale intraveineuse. Anesthésie 1987 ; 42 : 526–528.
- Shaw-Wilgis E : Observations sur les effets de l'ischémie du garrot. J Bone Joint Surg 1971;1104:190.
- Mabee J, Bostwick T, Burke M : syndrome du compartiment iatrogène dû à l'injection de solution saline hypertonique dans le bloc de Bier. J Emerg Med 1994;12 : 473-476.
- Quigley J, Popich G, Lanz U : Syndrome de compartiment de l'avant-bras et de la main : à propos d'un cas. Clin Orthop 1981;161:247–251.
- Hastings H 2nd, Misamore G : Syndrome de loge résultant d'une anesthésie régionale intraveineuse. J Hand Surg 1987;12:559–562.
- Dominguez E: Sensation pénible du membre fantôme du membre supérieur pendant l'anesthésie régionale intraveineuse. Reg Anesth Pain Med 2001;26:72–74.
- Luce E, Mangubat E : Perte d'une main et d'un avant-bras suite à un bloc de Bier : à propos d'un cas. J Hand Surg 1983;8:280–283.
- Lee LA, Posner K, Domino KB, et al : Blessures associées à l'anesthésie régionale dans les années 1980 et 1990. Une analyse des réclamations fermées. Anesthésiologie 2004 ; 101 : 143–152.
- Kennedy B, Duthie A, Parbrook G, Carr T : Anesthésie régionale intraveineuse : une évaluation. Br Med J 1965;5440:954–957.

