Vivian HY Ip et Ban CH Tsui
INTRODUCTION
L'anesthésie régionale est devenue monnaie courante dans de nombreuses pratiques dans le monde en raison des preuves croissantes des avantages pour les patients, tels qu'une réduction des complications pulmonaires et thromboemboliques, une réduction de la consommation d'opioïdes, ainsi qu'une réduction de la douleur et du délai de sortie et une meilleure qualité de vie dans l'immédiat. période postopératoire. La popularité croissante de l'anesthésie régionale a entraîné des progrès dans les techniques et l'équipement. La pratique a évolué de l'utilisation de la paresthésie pour la localisation nerveuse à la stimulation nerveuse électrique et, actuellement, à l'échographie. Ce chapitre donne un aperçu du matériel disponible dans la pratique des blocs nerveux périphériques. Il décrit également l'équipement nécessaire aux différentes étapes de la procédure d'anesthésie régionale pour s'assurer qu'elle se déroule de manière efficace et sûre. La pratique de l'anesthésie régionale comprend l'équipement, les protocoles et les compétences nécessaires pour garantir que le bloc se déroule de la manière la plus fluide et la plus sûre possible, avant, pendant et après l'administration du bloc.
Bloc RÉGIONAL PRÉPARATION ET CONFIGURATION
Zone et Surveillance
Un environnement calme avec tous les équipements nécessaires pour réaliser des régionales anesthésie, ainsi que les médicaments et équipements de réanimation à portée de main, sont d'une importance capitale. Un emplacement idéal est une salle d'induction où le patient peut être surveillé, prémédiqué et le bloc régional effectué avant son transfert au bloc opératoire. Une zone de bloc désignée peut être utilisée pour fournir un environnement de procédure approprié et surveillé tout en optimisant l'efficacité de la salle d'opération.
Lors de l'exécution du bloc, un assistant formé à l'anesthésie régionale doit être présent pour préparer et manipuler le matériel et aider à l'injectat. L'assistant doit également être formé à la pratique de la réanimation si cela s'avère nécessaire.
Quel que soit l'endroit où le bloc est effectué, il est essentiel que tout l'équipement, les médicaments et la surveillance soient facilement disponibles. La meilleure façon de rassembler tout le matériel et les médicaments nécessaires est la mise en place d'un chariot de stockage (Figure 1), qui doivent être bien étiquetés et les fournitures facilement identifiables.
Conseils NYSORA
- Un chariot d'équipement doit contenir tous les médicaments, aiguilles et cathéters nécessaires à l'anesthésie régionale ainsi que les médicaments et l'équipement de réanimation.

FIGURE 1. Chariot de stockage d'équipement avec identification claire des fournitures et des médicaments.
Équipement général de la zone de bloc
Les articles couramment utilisés doivent être stockés dans le chariot de stockage et remplis si nécessaire. Le chariot de stockage doit contenir les éléments suivants :
- Solution stérile de préparation de la peau, éponges/gaze, champ opératoire, stylo marqueur, règle pour l'identification des repères, gel à ultrasons, aiguilles hypodermiques pour l'infiltration cutanée et l'aspiration de dextrose à 5 % (dextrose à 5 % dans l'eau, D5W).
- Une sélection de sédatifs, par exemple, le midazolam (0.5 à 3 mg IV) et des opioïdes à courte durée d'action tels que le fentanyl (50 à 100 μg IV) et le propofol (20 à 100 mg IV) pour les blocs nerveux qui sont plus inconfortables et nécessitent une sédation plus profonde (p. ex., bloc de cheville).
- Anesthésiques locaux et solution saline normale pour la dilution du médicament si nécessaire. Les anesthésiques locaux sont idéalement stockés dans un compartiment séparé des médicaments intraveineux pour éviter les erreurs médicamenteuses.
- Canules intraveineuses. Tous les patients doivent avoir une canule intraveineuse insérée en cas de toxicité anesthésique locale.
- Pansements pour canules intraveineuses, pansements transparents pour recouvrir le transducteur à ultrasons utilisé dans les blocs nerveux à un seul coup, housse de transducteur, gel et pansements pour l'insertion du cathéter du bloc nerveux.
Médicaments d'urgence et matériel de réanimation
L'utilisation de l'échographie permet la visualisation de l'injectat et par conséquent, elle a considérablement réduit, mais pas éliminé, le risque de toxicité systémique anesthésique locale sévère (LAST). Cependant, le matériel de réanimation et les médicaments doivent toujours être immédiatement disponibles dans la zone de bloc.
Matériel de réanimation
- Alimentation en oxygène, voies respiratoires nasales et masques O2
- Voies respiratoires buccales de différentes tailles, masques laryngés et sondes endotrachéales
- Laryngoscopes (lames Macintosh et Miller)
- Dispositif de ventilation sac-masque
- Succion
- Sélection de canules intraveineuses de différentes tailles
- Défibrillateur
Médicaments de réanimation et doses suggérées par voie intraveineuse
- Atropine (300 à 600 µg).
- Épinéphrine (10–100 μg).
- Suxaméthonium (40–100 mg).
- Éphédrine (5–15 mg).
- Phényléphrine (100–200 μg).
- Glycopyrrolate (200 à 400 µg).
- Intralipidique® 20 % (1.5 ml/kg en 1 à 2 minutes en bolus initial, qui peut être répété deux à trois fois en cas d'asystole persistante. Après le bolus, une perfusion peut être démarrée à 0.25 ml/kg/min pendant 30 à 60 minutes ; augmenter le débit de perfusion en cas d'hypotension réfractaire). Idéalement, Intralipid doit être conservé dans un récipient avec un protocole d'utilisation et du matériel pour prélever le médicament.
Conseils NYSORA
- Pendant le bloc nerveux périphérique guidé par échographie, la visualisation de la propagation de l'injectat peut minimiser le risque d'injection intravasculaire. La dose entière d'anesthésique local ne doit jamais être injectée sans voir la propagation de l'injectat à l'échographie, car cela suggère une injection intraveineuse
Documentation
Une liste de contrôle pré-blocage est primordiale pour garantir la bonne exécution du bloc au site approprié sur le corps du patient et comprend la documentation des conditions préopératoires (par exemple, les déficits neurologiques et les comorbidités pertinents) et la discussion des risques et des avantages et l'obtention d'un consentement approprié. Dans la plupart des pays, des protocoles de documentation médicale standardisés ont été établis pour l'induction et le maintien de l'anesthésie générale. Cette documentation comprend des informations sur la pression artérielle, la fréquence cardiaque, l'oxygénation et des détails sur les procédures courantes telles que le maintien de l'état des voies respiratoires et la réalisation d'une intubation endotrachéale. De même, il existe des directives standard similaires pour documenter l'anesthésie neuraxiale, y compris des informations sur le niveau du bloc ; dispositions relatives à la stérilité ; matériel et technique utilisés; l'incidence de liquide céphalo-rachidien, de sang ou de paresthésie ; et l'injection d'anesthésique local. En revanche, il n'existe pas de telles directives pour documenter les blocs nerveux périphériques, même s'ils sont utilisés de manière routinière dans la pratique clinique et possèdent les mêmes implications médico-légales que l'anesthésie générale et neuraxiale. Une limitation de l'absence d'un protocole de documentation pour les blocs nerveux périphériques est le manque relatif d'informations disponibles pour ceux qui souhaitent examiner rétrospectivement une procédure régionale pour l'assurance qualité, la recherche ou des raisons juridiques. Un exemple de documentation de bloc est vu dans Figure 2.
Plus d'informations sur la surveillance et la documentation des PNB sont traitées dans "Surveillance, documentation et consentement pour les procédures d'anesthésie régionale" .
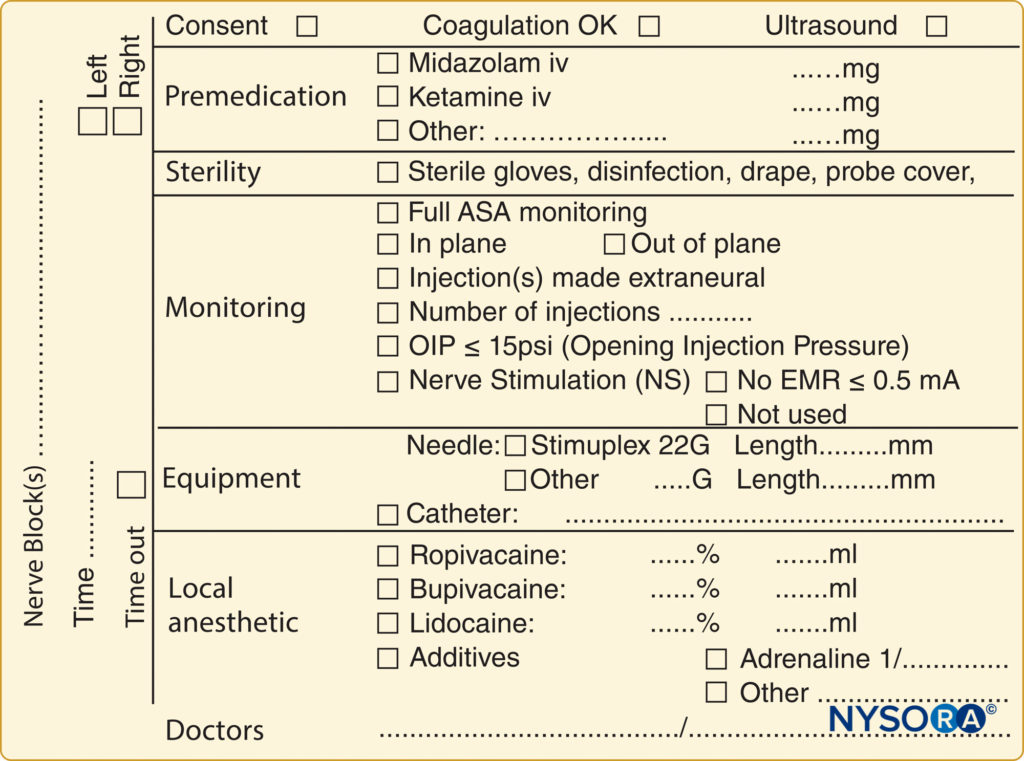
FIGURE 2. Un exemple de documentation en bloc telle qu'utilisée au NYSORA-Europe CREER (Center for Research, Education and Enhanced Recovery) à ZOL (Ziekenhuis Oost-Limburg, Genk, Belgique).
ÉQUIPEMENT POUR L'INDUCTION DE L'ANESTHÉSIE RÉGIONALE
Aiguilles pour blocs nerveux à un seul coup
Actuellement, il existe de nombreux types différents d'aiguilles pour bloc nerveux périphérique sur le marché. Les aiguilles isolées sont couramment utilisées avec la stimulation nerveuse. Avec l'introduction des ultrasons, les aiguilles échogènes ont été largement utilisées pour une meilleure visualisation. Les aiguilles disponibles dans le commerce pour les blocs nerveux à injection unique sont généralement livrées avec un tube d'extension pré-attaché pour faciliter l'aspiration et l'injection de D5W ou d'anesthésiques locaux et comportent une fixation femelle pour la connexion à un stimulateur nerveux. Il convient de noter que le verrou Luer pour le tube attaché peut parfois être lâche, ce qui peut entraîner une fuite d'anesthésique local injecté ainsi que d'air lors de l'aspiration.
Conception à pointe d'aiguille
Les lésions nerveuses peuvent être causées par une pénétration nerveuse directe ou un contact violent aiguille-nerf. Le biseau de l'aiguille peut avoir un impact sur l'étendue des dommages lors de l'insertion de l'aiguille à proximité d'un nerf. Aiguilles à biseau court (Figure 3) peut avoir l'avantage de réduire les lésions nerveuses causées par la coupure ou la pénétration du nerf, alors que les aiguilles à biseau long (14°) se sont avérées plus susceptibles de pénétrer dans le périnèvre et de provoquer des lésions fasciculaires qu'une aiguille à biseau court (45°) aiguille, surtout lorsqu'elle est orientée transversalement aux fibres nerveuses. En revanche, les aiguilles à biseau court peuvent causer des lésions plus importantes en cas de pénétration nerveuse ou fasciculaire. Les aiguilles émoussées et non coupantes et les aiguilles Tuohy offrent une meilleure rétroaction et une sensation améliorée pour le "pop" qui se produit lors de la perforation à travers le fascia. Cependant, une aiguille trop émoussée peut entraver la ponction du fascia, entraînant une pression appliquée plus élevée et potentiellement un «dépassement» après la perforation du fascia. Les aiguilles à pointe de crayon et de Tuohy peuvent également provoquer une inflammation post-traumatique plus importante, des dommages à la myéline et un hématome intraneural.
Les blocs neuraxiaux peuvent être réalisés avec des aiguilles de différents styles de pointe. Malgré leur description comme atraumatiques, les aiguilles de Whitacre ou de Sprotte (Figure 4) peut être traumatique pour les tissus à l'entrée, avec déchirure et perturbation grave des fibres de collagène (voir "Anatomie ultrastructurale des méninges spinales et des structures associées"). Cela contraste avec l'aiguille de Quincke, une aiguille dite coupante (Figure 4), également utilisé pour les blocs neuraxiaux. Néanmoins, le consensus général est que les blocs neuraxiaux réalisés avec une aiguille atraumatique sont associés à un moindre risque de céphalée post-ponction durale.

FIGURE 4. Différentes aiguilles pour la rachianesthésie : Whitacre (en haut), Sprotte (au milieu) et Quincke (en bas).
Longueur d'aiguille
Le choix de la longueur de l'aiguille dépend du bloc spécifique. Par exemple, les blocs plus profonds, tels que le bloc du nerf sciatique, nécessiteront des aiguilles plus longues (par exemple, 100 à 120 mm). L'utilisation des ultrasons peut aider à déterminer la distance de la trajectoire vers le nerf cible. Une aiguille trop courte n'atteindra pas le site cible, tandis qu'une aiguille longue peut être difficile à manœuvrer et peut être avancée trop profondément. Les aiguilles doivent avoir des marques de profondeur (Figure 5) pour le contrôle de la profondeur de pénétration dans le tissu. La bonne longueur d'aiguille (la plus courte possible) permettra une meilleure manipulation et manipulation.

FIGURE 5. Aiguille de bloc nerveux montrant des marques centimétriques qui peuvent être utilisées comme exemple pour surveiller la profondeur de pénétration. Des réflecteurs de pierre angulaire pour faciliter la visualisation sous ultrasons peuvent également être vus à l'extrémité distale.
Jauge à aiguille
En général, les aiguilles isolées de calibre 22 sont probablement utilisées le plus souvent pour les blocs nerveux périphériques à un seul coup. Avec la taille de l'aiguille, un équilibre doit être recherché entre le confort du patient et la flexion de l'aiguille lorsqu'elle perfore la peau. Étant donné que les aiguilles plus longues ont tendance à se plier plus facilement pendant l'avancement et sont plus difficiles à diriger pendant les blocages profonds, une aiguille de plus gros calibre peut être nécessaire, car les aiguilles de plus petit calibre manquent de rigidité et se plient plus facilement. Les aiguilles de plus gros calibre doivent être utilisées avec prudence, car elles sont associées à une gravité accrue des lésions tissulaires et des hématomes, tandis que les aiguilles de plus petit calibre comportent le risque plus sérieux d'insertion intrafasciculaire de la pointe. De plus, la résistance a tendance à être augmentée lors de l'injection avec des aiguilles de plus petit calibre, et il faut également plus de temps pour que le sang soit aspiré si la pointe est intravasculaire.
Aiguilles échogènes
Depuis l'introduction des blocs nerveux périphériques guidés par ultrasons, on s'est efforcé de fabriquer des aiguilles avec une meilleure visibilité aux ultrasons. Les aiguilles échogènes réfléchissent les faisceaux d'ultrasons à travers une variété de mécanismes, y compris un revêtement spécial qui emprisonne les micro–bulles d'air, les rainures près de la pointe de l'aiguille ou les « points » échogènes créés par les réflecteurs de la « pierre angulaire » (voir l'extrémité distale de l'aiguille dans Figure 5). Les aiguilles à échogénicité améliorée peuvent réduire le temps de visualisation pendant les procédures guidées par ultrasons. Une aiguille échogène, avec ou sans direction du faisceau ultrasonore, est mieux visualisée par rapport à une aiguille non échogène à des angles d'insertion de 60° à 70°. En revanche, l'aiguille non échogène avec direction du faisceau était plus visible à un angle d'insertion de 40° par rapport à l'aiguille échogène.
Assemblages de cathéters continus
La perfusion continue d'anesthésique local s'est avérée efficace pour fournir une analgésie postopératoire à long terme dans une variété de contextes. Les cathéters à blocs nerveux périphériques permettent également le titrage des médicaments en petites doses aliquotes. L'équipement pour les blocs nerveux périphériques continus est décrit en détail dans "Équipement pour blocs nerveux périphériques continus“. Les assemblages de cathéter sur aiguille ont gagné en popularité pour fournir une anesthésie et une analgésie régionales continues et sont brièvement abordés dans ce chapitre.
Historiquement, il a été bien reconnu que les cathéters périneuraux sont associés à des fuites et à des migrations. Cependant, la conception du système cathéter sur aiguille peut réduire ces obstacles et a renouvelé l'intérêt pour les techniques régionales continues. La différence entre cet assemblage et les assemblages cathéter-aiguille traditionnels réside également dans la position de l'aiguille par rapport au cathéter, qu'elle soit à l'intérieur ou autour du cathéter (Figure 6). Avec les ensembles cathéter traversant l'aiguille, un espace est laissé entre la peau et le cathéter lors du retrait de l'aiguille. Au contraire, le retrait de l'aiguille dans l'ensemble cathéter sur aiguille n'affecte pas l'ajustement serré du cathéter dans la peau car l'aiguille est logée à l'intérieur du cathéter.
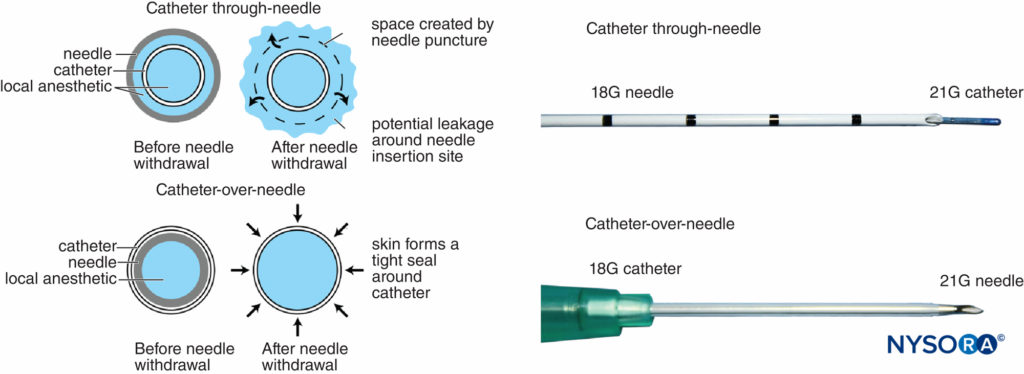
FIGURE 6. À gauche, schéma montrant la différence entre les conceptions traditionnelles cathéter à travers l'aiguille (en haut) et cathéter sur l'aiguille (en bas) en ce qui concerne le risque de fuite à partir du site de ponction cutanée. Dans le premier cas, le diamètre du trou de l'aiguille est plus grand que le diamètre du cathéter, laissant de la place pour que l'anesthésique local fuie lorsqu'il est injecté. Dans ce dernier, le trou de ponction est plus petit que le diamètre du cathéter, permettant au cathéter d'être maintenu fermement par la peau environnante. A droite, différentes extrémités distales des assemblages cathéter-aiguille (en haut) et cathéter sur aiguille (en bas).
Il existe quelques variantes de ce design qui sont commercialisées par différentes marques. Par exemple, la conception de Contiplex (B-Braun Medical, Melsungen, Allemagne) présente le cathéter sur aiguille comme une seule unité (Figure 7).

FIGURE 7. R : L'ensemble cathéter sur aiguille Contiplex (B-Braun Medical, Melsungen, Allemagne), qui comprend une longue aiguille recouverte par le cathéter et un clip qui peut être déplacé sur la longueur de l'aiguille pour une manipulation aisée de l'unité. B : Composants du cathéter sur aiguille B. Braun : aiguille avec rallonges pour stimulation nerveuse et injection (en haut) et cathéter avec repères centimétriques (en bas).
Une autre variante est le kit E-Cath récemment introduit (Pajunk MEDIZINTECHNOLOGIE GmbH, Geisingen, Allemagne) avec une conception «cathéter dans le cathéter», qui comprend deux composants, la gaine de cathéter externe et le cathéter interne flexible, qui créent une unité non pliable (Figure 8). Le dispositif initial ressemble à une canule intraveineuse, avec une aiguille à l'intérieur du cathéter externe, qui est insérée à proximité du nerf cible sous guidage échographique. L'extrémité distale de l'aiguille dépasse pour sa propriété conductrice électrique. Une fois en place, l'aiguille est retirée de l'unité, laissant le cathéter externe in situ, et un cathéter interne est inséré dans le cathéter externe pour remplacer l'aiguille et est verrouillé Luer en place pour l'injection (Figure 8). Le cathéter interne remplace littéralement l'aiguille et la pointe du cathéter interne se trouve essentiellement à l'emplacement exact où se trouvait la pointe de l'aiguille avant le retrait de l'aiguille.
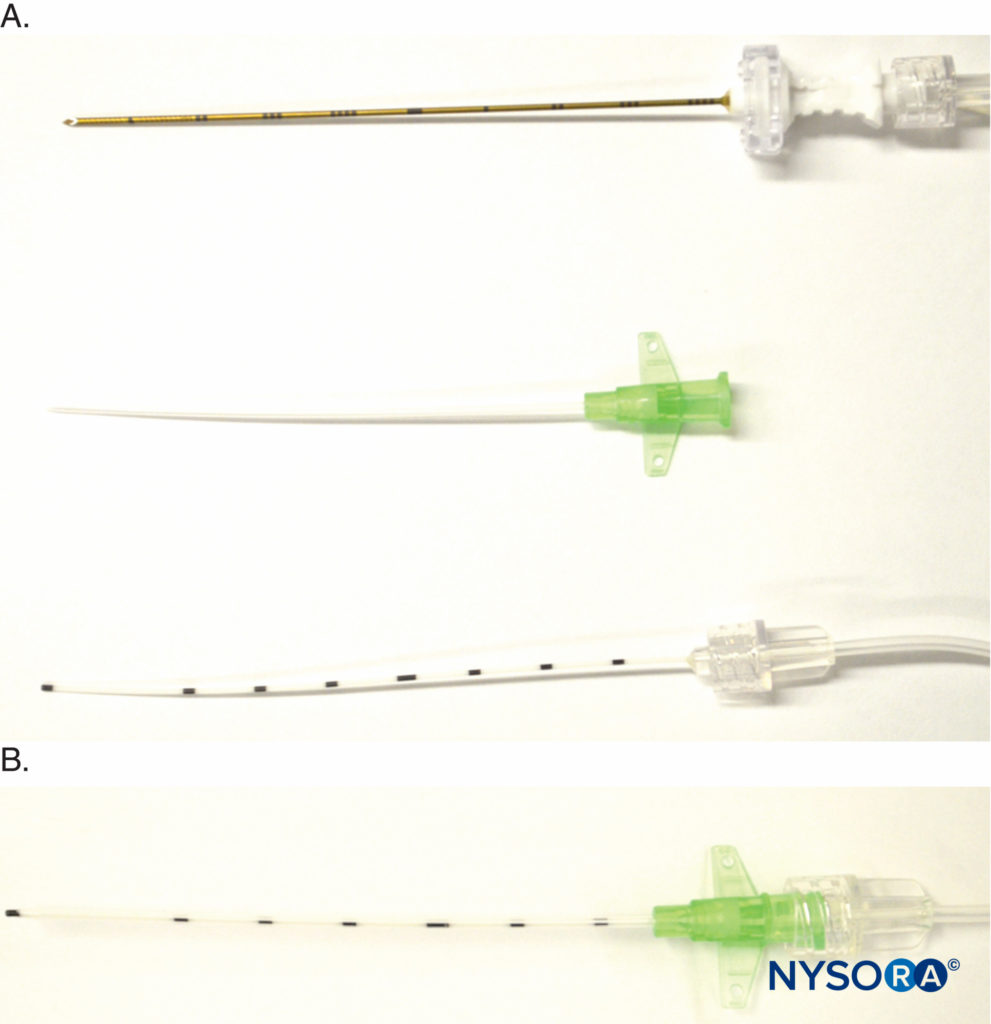
FIGURE 8. Détail de E-Cath (Pajunk MEDIZINTECHNOLOGIE GmbH, Geisingen, Allemagne composants de cathéter sur aiguille. A : En haut, aiguille avec tubulure d'extension pour stimulateur nerveux et un ensemble d'administration de liquide ; au milieu, le cathéter est placé sur l'aiguille pour créer un seul unité qui est insérée près du nerf cible ; en bas, le cathéter interne est inséré dans le cathéter externe après le retrait de l'aiguille une fois que l'unité cathéter sur aiguille est à la position souhaitée. B : Luer lock qui maintient ensemble les cathéters interne et externe.
Plusieurs avantages de la conception cathéter sur aiguille incluent le potentiel :
- Simple à utiliser avec une technique d'insertion par rapport à celle d'un bloc nerveux à un seul coup
- Moins de fuites depuis le site d'insertion du cathéter, par exemple lors d'une chirurgie de l'épaule lorsque le patient est en position assise avec un risque de contamination du champ opératoire
- Moins de risque de rupture de l'adhésif du pansement
- Moins de marches et moins de risque de délogement
- Visualisation facile du cathéter, en particulier de la pointe du cathéter
Dispositifs de localisation nerveuseStimulateurs nerveux périphériques
Les stimulateurs nerveux périphériques étaient le principal dispositif de recherche de nerfs dans les décennies précédant l'utilisation généralisée du guidage par ultrasons. L'utilisation combinée des ultrasons et de la stimulation nerveuse crée une méthode plus objective pour obtenir des blocs précis et sûrs tout en permettant la surveillance et la visualisation de l'aiguille de bloc et des cibles en temps réel. Avec l'introduction de l'échographie, le rôle des stimulateurs nerveux est passé de la recherche nerveuse à la surveillance du contact aiguille-nerf ou du placement intraneural de la pointe de l'aiguille. De plus, la stimulation nerveuse peut être utilisée comme technique de confirmation et guide pour placer des cathéters épiduraux à l'aide du test de stimulation épidurale électrique (Tsui). Les principales propriétés des stimulateurs nerveux disponibles dans le commerce sont brièvement décrites ci-dessous (Figure 9).
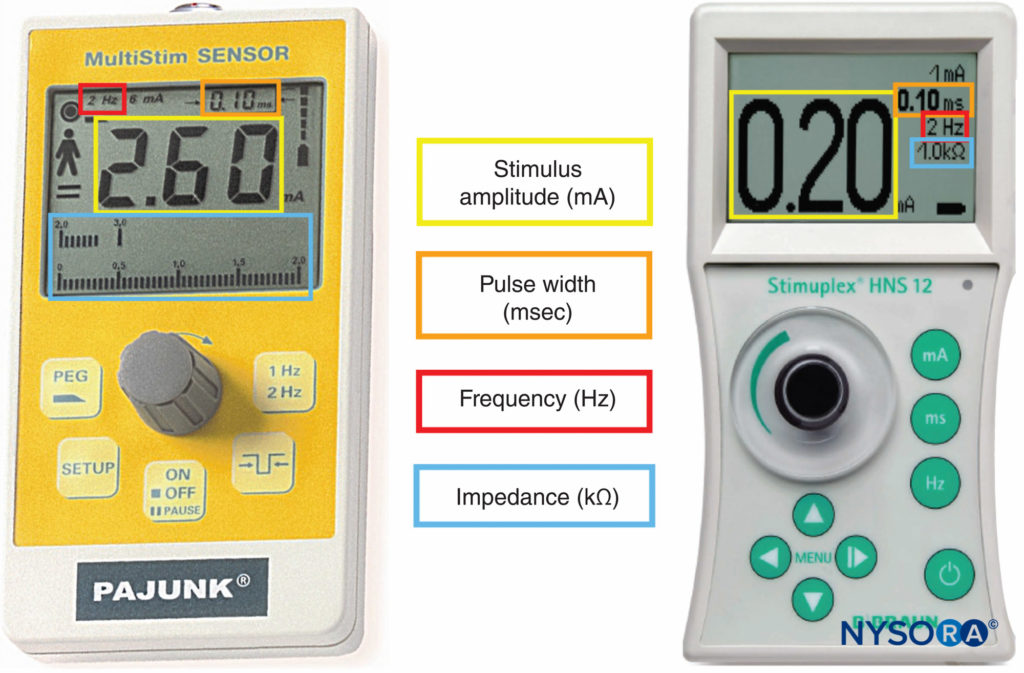
FIGURE 9. Stimulateurs nerveux périphériques permettant de mesurer l'amplitude du stimulus, la largeur d'impulsion, la fréquence et l'impédance électrique.
Sortie et affichage à courant constant
La plupart des modèles modernes fournissent désormais un courant constant et la sortie de courant peut être réglée en fréquence, en largeur d'impulsion et en milliampères de courant (mA). Le principal avantage d'un stimulateur nerveux à sortie de courant constant est sa capacité à délivrer une sortie de courant stable en présence de résistances variées.
Ecran
Un affichage numérique clair avec une précision à deux décimales est une caractéristique importante du stimulateur nerveux électrique. Cet affichage doit indiquer le courant réel délivré au patient et pas simplement le réglage du courant cible. Certains stimulateurs nerveux sont équipés de plages de sortie basse (jusqu'à 6 mA) et haute (jusqu'à 80 mA). La plage inférieure est principalement utilisée pour alerter en cas de placement potentiel d'une aiguille intraneurale, tandis que la plage supérieure est principalement utilisée pour le test de stimulation péridurale (1 à 10 mA).
Largeur d'impulsion variable
Des largeurs d'impulsion courtes (c'est-à-dire 0.04 ms) sont un meilleur indicateur de la distance entre l'aiguille et le nerf, sur la base des changements de courant. En revanche, avec de longues largeurs d'impulsion (c'est-à-dire 1 ms), il y a peu de différence dans le courant nécessaire pour stimuler le nerf, que l'aiguille stimulante soit en contact direct avec le nerf ou à 1 cm. À une largeur d'impulsion de 0.04 ms, il existe une grande différence dans le courant de stimulation requis lors de la comparaison d'un contact direct avec le nerf par rapport à une distance de 1 cm.
La largeur d'impulsion joue également un rôle dans l'utilisation réussie du test de stimulation épidurale électrique. La largeur d'impulsion appropriée doit être utilisée pour différentes applications du test, qu'il s'agisse d'un bloc périphérique ou neuraxial. Tableau 1 résume la largeur d'impulsion appropriée pour différentes applications.
TABLE 1. Largeurs d'impulsion pour différentes applications pendant le bloc nerveux périphérique et le bloc neuraxial.
| Largeur d'impulsion | Candidature | Plage de seuil typique |
|---|---|---|
| 0.1 ms | Nerf périphérique moteur | Éviter < 0.3 mA |
| 0.2 ms | Espace épiduralEspace intrathécal | 1–15 mA < 1 mA |
| 1 ms | Espace péridural | 6 mA |
Polarité clairement marquée des électrodes
La polarité de l'aiguille affectera sa capacité à stimuler le nerf à un courant donné et doit être clairement indiquée. La cathode (noire) est choisie comme électrode de stimulation car elle est trois à quatre fois plus efficace que l'anode pour dépolariser la membrane nerveuse.
Fréquence d'impulsion variable
La plupart des nouveaux stimulateurs ont une option pour changer la fréquence à laquelle l'impulsion électrique est délivrée. Bien que certains stimulateurs nerveux périphériques disponibles dans le commerce puissent permettre un réglage de la fréquence jusqu'à 5 Hz, la fréquence optimale de l'impulsion électrique se situe entre 0.5 et 4 Hz. La plupart des utilisateurs sélectionnent une fréquence de 2 Hz. Lors de l'utilisation d'une fréquence inférieure, telle que 1 Hz (un stimulus par seconde), l'aiguille doit être avancée lentement pour éviter de manquer le nerf entre les stimulations.
Indicateurs de déconnexion et de dysfonctionnement
La déconnexion et le dysfonctionnement des stimulateurs nerveux doivent être facilement détectables, et une indication de l'alimentation de la batterie est essentielle. La plupart des stimulateurs nerveux utilisent un changement de tonalité ou de lumière pour avertir lorsque le circuit n'est pas complet et si le courant d'impulsion ne peut pas être délivré. La valeur du changement de tonalité/lumière lors de la déconnexion du circuit a été démontrée récemment avec une nouvelle utilisation d'un stimulateur nerveux périphérique pour guider une aiguille isolée avec une pointe non isolée dans la lumière trachéale pour la topisation des voies respiratoires. Le changement de tonalité/lumière indiquait si la pointe était en contact avec les tissus (circuit fermé) ou suspendue dans la trachée remplie d'air (circuit ouvert) (Figure 10).
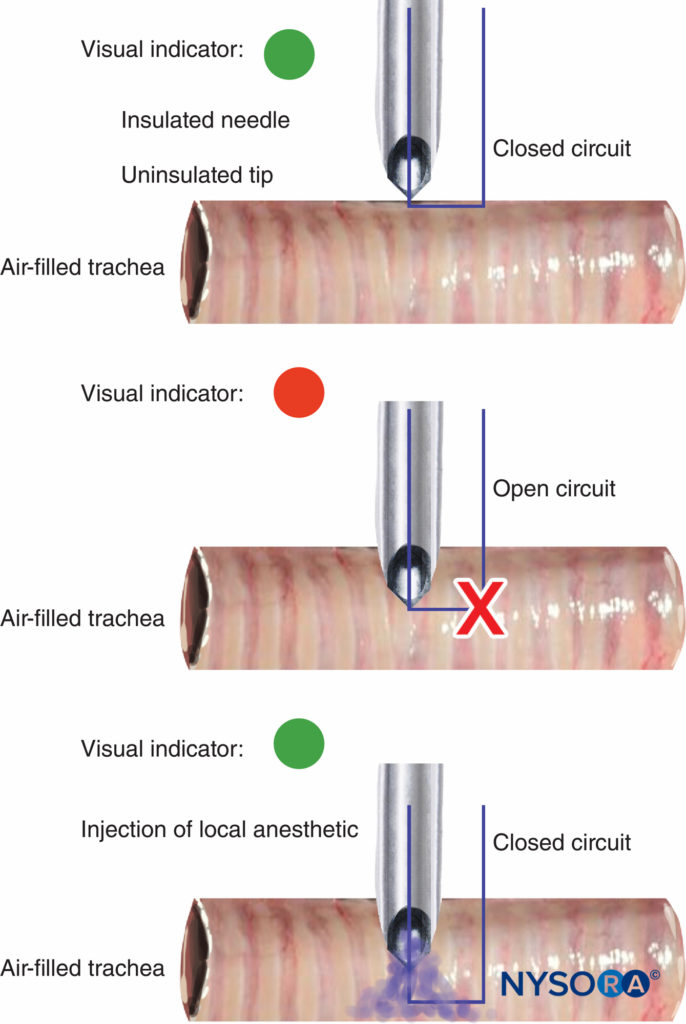
FIGURE 10. Modification du signal lumineux et tonal du stimulateur nerveux périphérique à l'entrée de la pointe de l'aiguille non isolée dans la lumière trachéale pendant la mise au point des voies respiratoires (haut et milieu). Avec l'injection d'anesthésique local, le courant électrique est fermé, provoquant un autre changement de signal lumineux/tonal (en bas).
Impédance électrique
Certains stimulateurs nerveux modernes affichent l'impédance totale entre la pointe de l'aiguille et l'électrode de masse. L'importance de cette propriété dans la surveillance du placement intraneural de la pointe de l'aiguille est discutée dans la section sur les dispositifs de surveillance dans ce chapitre.
Autres accessoires
Une sonde peut être utilisée pour effectuer un guidage percutané des électrodes pendant la cartographie des nerfs de surface (Figure 11). Une petite télécommande manuelle ou une pédale permet à un seul opérateur de régler la sortie de courant d'un stimulateur nerveux sans assistant, bien que cela soit rarement utilisé en clinique (Figure 12).

FIGURE 12. Dispositifs télécommandés à la main (à gauche) et au pied (à droite) pour régler la sortie de courant du stimulateur nerveux.
Ultrason
L'introduction de la technologie des ultrasons a révolutionné le domaine de l'anesthésie régionale, permettant de visualiser en temps réel les structures nerveuses, les aiguilles et autres objets sous-cutanés. L'échographie peut sans aucun doute améliorer la sécurité et la facilité d'exécution des blocs nerveux ; cependant, cela dépend en grande partie de l'opérateur.
Il existe un certain nombre d'appareils à ultrasons portables disponibles dans le commerce qui conviennent à l'anesthésie régionale (Figure 13). Ces machines peuvent être transportées facilement, et la qualité et la résolution d'image sont équivalentes ou similaires à celles des machines à ultrasons fixes. Le transducteur (ou sonde) est l'élément le plus important de l'échographe ; des transducteurs de différentes empreintes et plans de faisceau sont disponibles, permettant à l'utilisateur de scanner la plupart des surfaces sur des individus de divers habitus corporels. La qualité des appareils à ultrasons s'améliore constamment, avec de meilleures options ergonomiques et une facilité d'utilisation, une résolution plus élevée avec des transducteurs améliorés, une portabilité améliorée et une réduction des coûts.
Dispositifs de surveillance Surveillance du patient
Il est important d'appliquer une surveillance de routine aux patients subissant une anesthésie régionale avec ou sans sédation. La toxicité d'un surdosage d'anesthésique local, d'une injection intravasculaire et d'une sursédation sont des complications potentielles de l'anesthésie régionale. Il convient donc d'être vigilant quant au suivi des patients. Il faut également savoir que la toxicité de l'anesthésique local peut survenir dans la première demi-heure après l'injection du médicament en raison du pic de concentration plasmatique (généralement 20 à 30 minutes). La toxicité systémique des anesthésiques locaux est discutée en détail ailleurs.
La surveillance générale du patient comprend l'examen des éléments suivants :
- Électrocardiogramme.
- Tension artérielle non invasive.
- Oxymétrie de pouls.
- Pour la ventilation : L'adéquation de la ventilation pour une anesthésie locorégionale sans sédation peut être réalisée par un suivi clinique qualitatif. Cependant, pour les patients qui ont besoin d'une sédation, la capnographie doit être utilisée sauf si elle est exclue par le patient, la procédure ou l'équipement.
Surveillance de la paresthésie par injection intraneurale
Avant l'introduction de la technologie de stimulation nerveuse, la paresthésie était le seul moyen de localisation nerveuse. Cependant, de nouvelles preuves suggèrent qu'une paresthésie douloureuse peut entraîner des symptômes neurologiques persistants et une neuropathie. Ainsi, la plupart des cliniciens abandonnent non seulement la recherche de paresthésie, mais aussi, avec des patients éveillés ou légèrement sous sédation, utilisent la paresthésie comme signal pour avertir de la proximité aiguille-nerf.
Stimulation nerveuse électrique
Le rôle du stimulateur nerveux a évolué depuis l'introduction des ultrasons. Dans la plupart des cas, la stimulation nerveuse n'est plus utilisée comme outil principal pour la localisation nerveuse, mais est plutôt utilisée pour la surveillance afin de minimiser l'injection intraneurale. Les stimulateurs nerveux permettent à l'utilisateur de surveiller deux propriétés électrophysiologiques pendant l'exécution du bloc nerveux : le seuil de stimulation nerveuse et l'impédance électrique.
- Seuil de stimulation nerveuse : Un seuil de stimulation nerveuse inférieur à 0.2 mA peut suggérer une localisation intraneurale de la pointe de l'aiguille ou un contact aiguille-nerf. Lorsqu'elle est utilisée seule, la stimulation nerveuse manque de sensibilité et doit donc être utilisée en conjonction avec d'autres mesures de surveillance, comme décrit dans cette section. L'observation d'une réponse motrice signifie une proximité aiguille-nerf avec un courant de seuil bas ; cependant, un manque de réponse motrice à un seuil de 0.2 mA ou moins avec une largeur d'impulsion de 0.1 ms n'exclut pas toujours le placement de l'aiguille intraneurale.
- Impédance électrique : De nombreux stimulateurs nerveux modernes sont capables de mesurer l'impédance. Dans un circuit électrique, le courant continu (DC) est le flux de charge électrique dans une seule direction, tandis que le courant alternatif (AC) décrit le flux de charge électrique qui inverse périodiquement la direction. Dans la stimulation nerveuse, le DC pulsé est utilisé. Étant donné que le CC pulsé partage les caractéristiques des formes d'onde CA et CC, la résistance électrique du circuit de stimulation nerveuse est souvent appelée impédance. L'impédance est très sensible à la composition des tissus et varie en fonction de la teneur en eau des tissus. Parce qu'il existe une variation de la teneur en eau et en lipides entre les espaces intraneuraux et extraneuraux, le premier ayant une quantité considérablement plus élevée de lipides non conducteurs et une teneur en eau inférieure, une différence significative d'impédance intraneurale et extraneurale a été démontrée. Une étude récente chez des patients adultes a également montré qu'une augmentation de l'impédance supérieure à 4.3 % peut indiquer la mise en place d'une aiguille intraneurale. De plus, la discrimination entre le tissu nerveux et d'autres types de tissus a été améliorée en combinant plusieurs variables d'impédance à plusieurs fréquences de mesure pour augmenter la précision. L'impédance électrique change également lors de l'injection intravasculaire et périneurale de D5W. Un changement d'impédance peut donc mettre en garde contre l'injection dans un endroit qui pourrait potentiellement causer des lésions nerveuses ou d'autres séquelles.
Conseils NYSORA
- Un changement soudain d'impédance peut indiquer que l'aiguille pénètre dans différents tissus.
Imagerie par ultrasons
Avec la popularité croissante du guidage échographique pour les blocs nerveux périphériques, il y a eu un malentendu courant selon lequel l'échographie peut aider à éviter l'injection intraneurale. Pour améliorer la marge de sécurité, la pointe de l'aiguille doit être visualisée à tout moment pendant l'avancement de l'aiguille lors d'une approche dans le plan ; cependant, cela peut être difficile, même entre des mains expérimentées. De plus, il existe une courbe d'apprentissage importante associée à l'utilisation des ultrasons en anesthésie régionale, à la fois avec des approches dans le plan et hors du plan. Lorsqu'une approche hors du plan est utilisée, la tige de l'aiguille pourrait être confondue avec la pointe, qui serait plus en aval du faisceau d'ultrasons. Lors de l'injection, le gonflement des nerfs à la suite d'une injection intraneurale peut également être difficile à noter en temps réel. De plus, au moment où un gonflement nerveux est remarqué, il peut être trop tard pour prévenir une lésion nerveuse car il ne faut qu'un volume minuscule d'anesthésique local pour rompre le périnèvre lorsque l'aiguille est placée intrafasciculaire. Enfin, la résolution échographique actuelle n'est pas suffisamment élevée pour reconnaître l'injection intrafasciculaire, l'événement le plus grave en termes de lésions nerveuses. Ainsi, des lésions nerveuses avec blocs nerveux périphériques malgré l'utilisation d'ultrasons continuent d'être signalées. Le taux de paresthésie ou d'engourdissement résiduel après un bloc nerveux périphérique guidé par échographie est estimé entre 0.18 % et 16 %. Par conséquent, l'échographie ne doit pas être utilisée comme seul dispositif de guidage, mais doit plutôt être utilisée en conjonction avec d'autres modalités de surveillance afin de minimiser le risque d'injection intraneurale.
Surveillance de la pression d'injection
La surveillance de la pression d'injection peut aider à distinguer l'emplacement de la pointe de l'aiguille dans le tissu périneural du contact aiguille-nerf ou du placement de l'aiguille intrafasciculaire (c'est-à-dire, périneural vs intraneural-intrafasciculaire). même avec de petits volumes, peut être un contributeur majeur aux lésions mécaniques du tissu neurologique pendant les blocs nerveux périphériques. La justification et la base des lésions nerveuses causées par l'injection à haute pression sont probablement une combinaison de lésions mécaniques résultant d'une rupture du périnèvre, entraînant une interférence avec la microcirculation endoneurale, et de lésions chimiques dues à la neurotoxicité des anesthésiques locaux.
À l'aide de modèles canins, il a été démontré qu'une pression d'injection élevée (> 20 psi) peut entraîner des lésions neurologiques persistantes indiquant une injection intrafasciculaire. Cependant, toutes les injections intraneurales n'entraînent pas une pression d'injection élevée et un déficit neurologique ultérieur. Cela pourrait être dû à une injection extrafasciculaire intraneurale ou à la pointe biseautée de l'aiguille qui n'est pas complètement à l'intérieur du nerf. Dans ces cas, l'injectat peut pousser le nerf à l'écart, évitant une injection à haute pression. Néanmoins, l'injection intraneurale n'est généralement pas recommandée. Il a également été démontré que le contact et le déplacement forcés de l'aiguille et du nerf provoquent des modifications inflammatoires des nerfs. Étant donné qu'une étude récente a démontré qu'une pression d'injection d'ouverture élevée (≥ 15 psi) - la pression qui doit être surmontée avant que l'injection puisse commencer - peut indiquer le placement de l'aiguille intraneurale, il est important de surveiller attentivement la pression d'injection lors de l'injection d'anesthésique local. De plus, une pression d'injection élevée peut également provoquer une propagation neuraxiale indésirable lors de certains blocs régionaux proches du neuraxis, par exemple, un bloc du plexus lombaire ou un bloc du plexus brachial.
Conseils NYSORA
- Il a été suggéré que la pression d'injection d'ouverture doit être maintenue en dessous de 15 psi pour améliorer la sécurité. La pression d'ouverture ne dépend pas de la taille de l'aiguille, du type d'aiguille, de la vitesse d'injection et de la taille de la seringue.
Les méthodes de surveillance de la pression d'injection comprennent les éléments suivants : la sensation de la seringue, le manomètre de pression en ligne et la technique d'injection d'air comprimé (CAIT).
- Sensation de seringue. Traditionnellement dans la pratique clinique, une technique subjective de « sensation de seringue » a été utilisée pour évaluer la résistance à l'injection d'anesthésique local et est effectuée par l'anesthésiste ou l'assistant pendant que l'anesthésiste maintient la position correcte de l'aiguille. Inutile de dire que cette approche subjective n'est pas fiable et dépend de l'opérateur. Différentes longueurs d'aiguille, diamètres et types de seringues affectent également la sensation.
- Manomètre de pression en ligne. Dispositifs objectifs jetables disponibles dans le commerce pour mesurer la pression d'injection, tels que BSmart™ (B-Braun Medical, Melsungen, Allemagne) (Figure 14), affiche en continu la pression pendant l'injection, permettant aux cliniciens de quantifier les informations de pression d'injection, qui peuvent être documentées. Le manomètre est codé par couleur de sorte que lorsque la pression est de 20 psi ou plus, l'indicateur sera rouge pour avertir l'opérateur. Le moniteur de pression en ligne est placé à proximité de l'aiguille et aligné avec le tube non extensible. L'autre extrémité du moniteur de pression est fixée directement à la seringue. Le principe est le même que celui des capteurs de pression en ligne dans des appareils tels que les pousse-seringues pour la surveillance continue de la pression. Le principe de base derrière l'utilisation d'un moniteur de pression d'injection est qu'une certaine quantité de pression d'injection (pression d'ouverture) doit être atteinte avant que l'injection (le débit de l'anesthésique) puisse commencer. La pression d'ouverture critique nécessaire pour injecter l'anesthésique local lorsque l'aiguille est en contact avec le nerf ou est intrafasciculaire a été estimée dans plusieurs études à plus de 15 psi. Par conséquent, si l'injection est interrompue avant que la pression d'ouverture ne soit atteinte et que le flux d'anesthésique soit initié, l'injection dans une interaction aiguille-nerf vulnérable peut être évitée.
- Technique d'injection d'air comprimé. C'est l'application clinique de la loi de Boyle (Pression × Volume = Constante). A température constante, un volume fixe de gaz (air) varie en sens inverse de la pression ; par exemple, si le volume du gaz est réduit de 50 %, la pression sera augmentée de 1 atmosphère à 2 atmosphères. Cette technique, conçue par Tsui, consiste à aspirer une quantité d'air définie au-dessus d'un volume d'injectat dans une seringue. Lors de l'injection, le volume d'air est comprimé et maintenu à un certain pourcentage (Figure 15).
À 50 % de compression d'air, la pression d'injection était de 760 mm Hg ou moins, bien en dessous du seuil de moins de 25 psi (1293 mm Hg). CAIT est un moyen simple et pratique de normaliser les pressions d'injection d'anesthésique local en temps réel, garantissant que la pression d'injection est constamment inférieure au seuil et minimisant le risque de lésion nerveuse cliniquement significative. Cette méthode réduit également inévitablement la vitesse d'injection, ce qui diminue à son tour le risque d'injection intrafasciculaire ou de siphonnage de l'anesthésique local vers des plans tissulaires indésirables. Les pressions générées par le CAIT restent également stables tout au long de la période d'injection, contrairement à la technique de sensation à la seringue, qui produit des pics de pression élevés. Cela est probablement dû à l'effet "d'amortissement" du volume d'air, qui atténue la haute pression initiale.

FIGURE 14. Dispositif de surveillance de la pression en ligne jetable disponible dans le commerce pour surveiller la pression d'injection pendant le bloc nerveux périphérique (BSmart, BBraun Medical, Melsungen, GE).
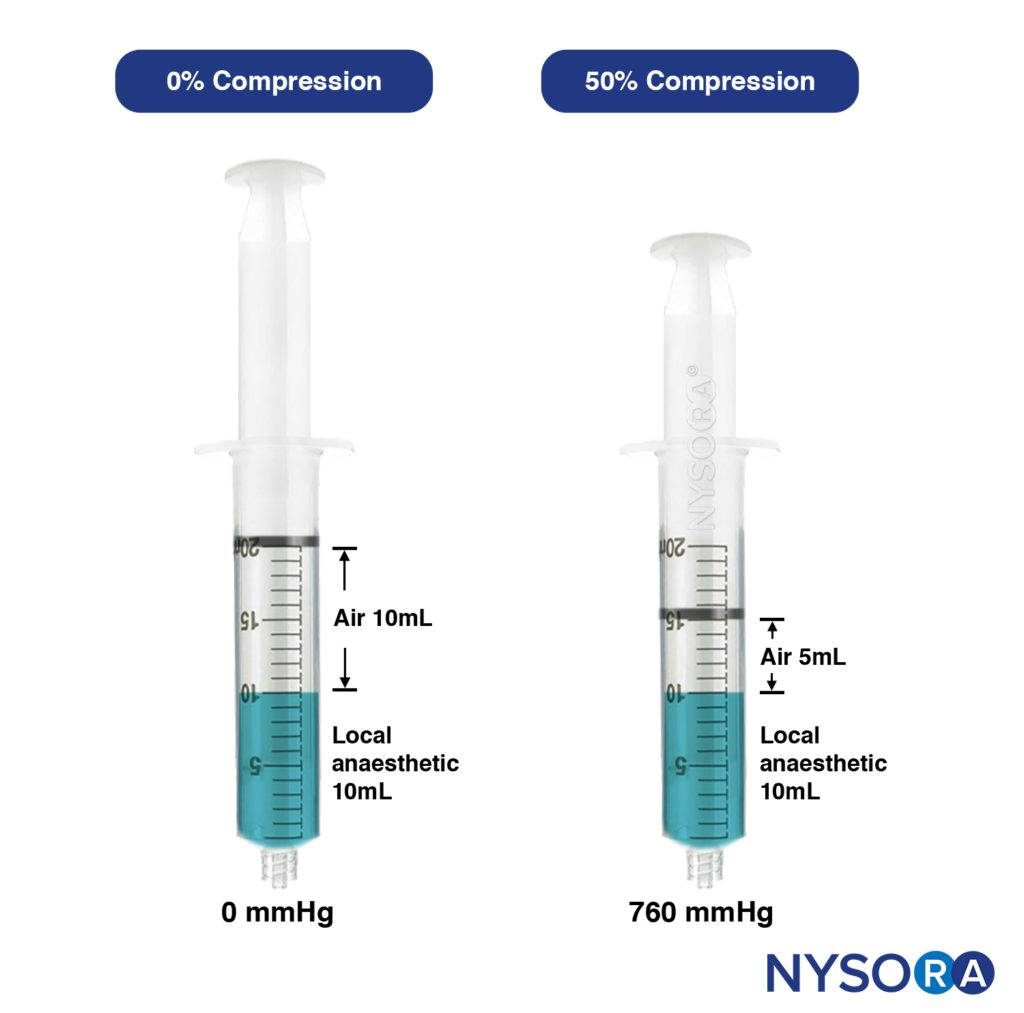
FIGURE 15. Seringue gauche : non comprimée, contenant 10 ml d'air et 10 ml d'anesthésique local. Seringue droite : L'air comprimé à 50 % entraîne une pression exercée de 760 mmHg (environ 15 psi).
Conseils NYSORA
- À l'ère des blocs nerveux périphériques guidés par ultrasons, il est important de ne pas négliger la valeur du stimulateur nerveux et de la surveillance de la pression d'injection pour minimiser le risque de lésion nerveuse.
- Il est important d'utiliser une combinaison de moniteurs pour minimiser le risque d'injection intraneurale, intrafasciculaire et de traumatisme du nerf aiguille.
EQUIPEMENT POUR LA GESTION POSTblock
Outils d'évaluation de bloc
Divers outils et techniques sont disponibles pour suivre l'évolution d'un bloc régional (Figure 16). Idéalement, l'outil ou le dispositif de surveillance devrait être aussi objectif que possible, mais en raison des différences physiologiques entre les personnes recevant un bloc, c'est rarement le cas. À ce jour, il n'y a pas de consensus sur la méthode la plus efficace. Néanmoins, la plupart des outils de surveillance des blocs offrent généralement une interprétation acceptable du moment où l'anesthésie chirurgicale est réalisée. De même, les outils et les échelles utilisés pour évaluer le bloc sensoriel et moteur varient considérablement et offrent une rétroaction subjective sur le degré auquel un bloc nerveux atteint son objectif souhaité. Généralement, des échelles ou des scores de douleur sont utilisés pour indiquer le niveau de confort d'un patient; comme pour les outils de surveillance des blocs, ces échelles et scores fournissent un moyen plus objectif et reproductible d'évaluer la sévérité de la douleur.

FIGURE 16. Sélection d'équipements de surveillance des blocs nerveux, y compris des dispositifs pour mesurer le seuil de perception actuel (en haut à gauche), des monofilaments et des tampons d'alcool pour la perception sensorielle (en bas à gauche), un dispositif de balayage infrarouge (en bas à droite) et des transducteurs de force avec capacité de collecte de données sans fil (en haut droit).
Tests sensoriels (dermatome)
Les outils d'évaluation du bloc régional sont basés sur l'hypothèse que le patient ne sera pas en mesure de percevoir un stimulus sur la zone bloquée. Ces stimuli sont généralement basés sur la température (glace, tampon imbibé d'alcool), mais un filament gradué peut également être utilisé pour mesurer la diminution et le retour de la sensation cutanée. Dans le cas des blocs tronc/neuraxiaux, ces méthodes peuvent aider à déterminer et à suivre la propagation du bloc en observant quels derma-tomes réagissent au stimulus.
Enregistrement de température/infrarouge
Récemment, l'imagerie thermique infrarouge a également été testée comme moyen de surveiller la progression des blocs. Ce test est basé sur le fait que la température cutanée des doigts augmente après un bloc du plexus brachial. Les études ont montré que la thermographie infrarouge des doigts avait une valeur prédictive positive élevée pour le succès du bloc après une anesthésie du plexus brachial.
Seuil de perception actuel
Le seuil de perception du courant (CPT) est un moyen d'appliquer un courant électrique via une électrode percutanée connectée à un générateur de courant spécialisé (par exemple, Neurometer) pour tester le niveau sensoriel. Cette méthode a été utilisée pour quantifier les degrés de neuropathie dans des conditions telles que le diabète sucré. Récemment, la reproductibilité de cette méthode a été testée chez des volontaires avec des résultats acceptables en utilisant un stimulateur nerveux périphérique commun. Dans cette étude, un stimulateur nerveux périphérique (voir la discussion précédente) a été utilisé pour appliquer un stimulus électrique à la zone bloquée ; si le courant requis pour provoquer une réponse sensorielle était supérieur au fil du temps au courant de base (pré-bloc ou région non bloquée), il s'agissait d'un indicateur de progression du bloc. En effet, une étude ultérieure a démontré que le CPT peut être un outil objectif et fiable pour surveiller l'apparition d'un bloc dans des scénarios cliniques.
Évaluation de la douleur
Il existe de nombreuses échelles d'évaluation de la douleur validées, les plus populaires étant les variations sur l'échelle de 0 à 10, où 0 indique "aucune douleur du tout" et 10 indique "la pire douleur de tous les temps". L'échelle d'évaluation numérique (NRS) et l'échelle visuelle analogique (EVA) sont deux exemples de ce type. D'autres échelles d'évaluation de la douleur, telles que l'échelle d'évaluation de la douleur de la défense et des vétérans (DVPRS), comportent des notes sur la façon dont la douleur affecte la vie quotidienne qui peuvent être utilisées pour définir plus précisément la gravité de la douleur. Le DVPRS propose également des dessins animés faciaux qui peuvent être utilisés pour obtenir des commentaires sur la gravité de la douleur de la part de personnes ayant une capacité de communication limitée. Pour les patients âgés, la liste de contrôle d'évaluation de la douleur pour les personnes âgées ayant une capacité limitée à communiquer (PACSLAC) peut être utilisée pour évaluer la douleur chez les personnes atteintes de démence ou de troubles cognitifs et qui ont des difficultés à communiquer. Pour les enfants, il existe une variété d'échelles de douleur qui peuvent être utilisées pour différents groupes d'âge et capacités de communication.
Évaluation du bloc moteur
L'outil d'évaluation motrice le plus courant est le score de Bromage, une échelle de 4 points allant de 0 (mouvement complet) à 3 (blocage complet/aucun mouvement). Le score de Bromage original a été appliqué pour les cas de bloc du membre inférieur mais peut également être adapté à l'évaluation du bloc du membre supérieur. Une autre méthode plus objective qui peut évaluer l'apparition et la récupération d'un bloc nerveux est le test de force. Ceci peut être réalisé avec un transducteur de force portable : le patient est invité à exercer une force contre le transducteur avec le membre ou la partie du corps qui a été bloqué (par exemple, extension du coude pour évaluer la fonction du nerf radial).
Certains transducteurs de force modernes sont équipés d'une clé de bus série universel (USB) qui, avec un ordinateur portable, permet de collecter des données de force sans fil en temps réel (Figure 16).
Entretien de l'anesthésie régionale
La pratique de l'anesthésie régionale s'est appuyée sur des pompes à perfusion pour fournir une administration continue d'anesthésique local à travers un cathéter périneural. Cette méthode reste la méthode la plus populaire d'anesthésie régionale continue, mais de nouveaux développements dans la technologie et la pratique ont permis une flexibilité dans l'analgésie postopératoire. Les méthodes conventionnelles pour les blocs nerveux continus sont discutées plus en détail dans "Blocs nerveux périphériques continus : solutions anesthésiques locales et stratégies de perfusion" et "Équipement pour blocs nerveux périphériques continus"; les nouveaux développements sont brièvement abordés ici.
Bolus intermittent
En plus du régime traditionnel de perfusion continue, il est devenu de plus en plus populaire d'utiliser un bolus intermittent pour la gestion continue du bloc nerveux périphérique. Grâce à sa capacité à cibler les structures nerveuses avec précision, la technologie cathéter sur aiguille (voir la discussion précédente) réduit considérablement le risque de migration ou de délogement du cathéter. Un avantage des bolus intermittents est que le risque de toxicité de l'anesthésique local est également réduit car l'administration constante d'anesthésique local est évitée et la dose totale est généralement réduite. Un régime de bolus intermittent peut être réalisé par une approche contrôlée par le patient ou préprogrammée.
Conseils NYSORA
- Il faut envisager et sélectionner des pompes qui permettent l'administration de bolus intermittents ainsi qu'une perfusion continue.
- Étant donné que les pompes à perfusion seront entretenues et transportées par le patient si elles sont mobiles, la pompe doit être portable et facile à utiliser.
Progrès futurs
Récemment, la perspective passionnante de contrôler la perfusion d'anesthésique local par télécommande a été décrite. Dans ce système, les pompes étaient réglées pour s'adapter aux besoins du patient en fonction des réponses aux questions concernant leur contrôle de la douleur et, dans le cas où les paramètres devaient être modifiés, les praticiens pouvaient accéder à distance aux informations de la pompe via un serveur sécurisé, évitant ainsi la nécessité pour une infirmière ou un médecin d'être physiquement présent.
CONCLUSION
Grâce aux améliorations de la technologie et de l'équipement, l'anesthésie régionale est passée d'un «art» pratiqué par quelques-uns à une «science» qui, avec une formation et une expérience adéquates, peut être pratiquée par beaucoup. Indépendamment de qui effectue le bloc ou de l'endroit où il est effectué, plusieurs directives clés doivent être suivies pour garantir une anesthésie régionale sûre et efficace. Il est essentiel qu'il y ait une zone désignée pour effectuer les blocs nerveux et que tous les médicaments et équipements soient facilement disponibles. Une documentation minutieuse de la procédure en bloc devrait être la norme de chaque établissement. Une surveillance adéquate du patient est essentielle et doit inclure une surveillance standard de l'ASA ainsi qu'une surveillance objective du stimulateur nerveux par ultrasons et de la pression d'injection pour aider à prévenir les lésions nerveuses. L'utilisation d'un équipement approprié, y compris la longueur et le calibre d'aiguille appropriés, se traduira par un aiguilletage plus facile et plus précis. Si un bloc continu est souhaité, de nouveaux ensembles cathéter sur aiguille peuvent aider à atténuer les problèmes des conceptions traditionnelles de cathéter à travers l'aiguille, et les développements récents dans les méthodes d'administration d'anesthésique local à long terme, y compris le bolus intermittent et la télécommande, représentent des options précieuses .
En résumé, la pratique actuelle de l'anesthésie régionale dépend de nombreux outils, méthodes et équipements de surveillance. Bien qu'il faille du temps pour acquérir une compétence adéquate avec certaines de ces méthodes et outils, ils sont essentiels pour garantir que le bloc régional est effectué de la manière la plus sûre et la plus efficace possible à chaque étape de la procédure.
Références
- van Lier F, van der Geest PJ, Hoeks SE, et al : L'analgésie péridurale est associée à de meilleurs résultats pour la santé des patients chirurgicaux atteints de maladie pulmonaire obstructive chronique. Anesthésiologie 2011 ;115 : 315–3121.
- Davies J, Fernando R : Effet de la ropivacaïne sur la fonction plaquettaire. Anesthésie 2001;56:709–710.
- Richman JM, Liu SS, Courpas G, et al : Le bloc nerveux périphérique continu offre-t-il un meilleur contrôle de la douleur que les opioïdes ? Une méta-analyse. Anesth Analg 2006;102:248–257.
- Salviz EA, Xu D, Frulla A, et al : bloc interscalénique continu chez les patients subissant une chirurgie ambulatoire de réparation de la coiffe des rotateurs : un essai prospectif randomisé. Anesth Analg 2013;117:1485–1492.
- Sites BD, Taenzer AH, Herrick MD, et al : Incidence de la toxicité systémique des anesthésiques locaux et des symptômes neurologiques postopératoires associés à 12,668 2012 blocs nerveux guidés par échographie : Une analyse d'un registre clinique prospectif. Reg Anesth Pain Med 37;5(478):482–XNUMX.
- Cave G, Harvey M : Émulsion lipidique intraveineuse comme antidote au-delà de la toxicité des anesthésiques locaux : une revue systématique. Acad Emerg Med 2009;16:815–824.
- Weinberg G, Ripper R, Feinstein DL, Hoffman W : L'infusion d'émulsion lipidique sauve les chiens de la toxicité cardiaque induite par la bupivacaïne. Reg Anesth Pain Med 2003;28:198–202.
- Weinberg, G : Régimes de traitement. 2015. http://www.lipidrescue.org/.
- Abbal B, Choquet O, Gourari A, et al : Amélioration de l'acuité visuelle avec des aiguilles échogènes dans le bloc du plexus brachial axillaire guidé par échographie : Une étude randomisée, comparative, à l'insu de l'observateur. Minerva Anestesiol 2015;81:369–378.
- Selander D, Dhuner KG, Lundborg G : lésion nerveuse périphérique due aux aiguilles d'injection utilisées pour l'anesthésie régionale. Une étude expérimentale des effets aigus du traumatisme causé par la pointe d'une aiguille. Acta Anaesthesiol Scand 1977;21:182–188.
- Selander D : lésion nerveuse périphérique causée par des aiguilles d'injection. Br J Anaesth 1993;71:323–325.
- Selander DE : Conférence Labat 2006. Anesthésie régionale : Aspects, réflexions et une éthique honnête ; sur les biseaux d'aiguille et les lésions nerveuses, et les maux de dos après une rachianesthésie. Reg Anesth Pain Med 2007;32:341–350.
- Mackinnon SE, Hudson AR, Llamas F, et al : Lésion nerveuse périphérique par injection de chymopapaïne. J Neurosurg 1984;61:1–8.
- Steinfeldt T, Graf J, Schneider J, et al : Conséquences histologiques du contact aiguille-nerf suite à une stimulation nerveuse dans un modèle de porc. Anesthesiol Res Pract 2011;2011:591851.
- Steinfeldt T, Werner T, Nimphius W, et al : analyse histologique après ponction du nerf périphérique avec une pointe de crayon ou une aiguille de Tuohy. Anesth Analg 2011;112:465–470.
- Reina MA, de Leon-Casasola OA, Lopez A, et al : Une étude in vitro des lésions durales produites par des aiguilles Quincke et Whitacre de calibre 25 évaluées par microscopie électronique à balayage. Reg Anesth Pain Med 2000;25:393–402.
- Castrillo A, Tabernero C, Garcia-Olmos LM, et al : Céphalée post-ponction durale : impact du type d'aiguille, un essai randomisé. Spine J 2015;15:1571–1576.
- Hammond ER, Wang Z, Bhulani N, et al : type d'aiguille et risque de céphalée post-ponction lombaire dans la clinique de neurologie ambulatoire. J Neurol Sci 2011;306:24–28.
- Uppal V, Sondekoppam RV, Ganapathy S : Effet de la direction du faisceau sur la visibilité des aiguilles échogènes et non échogènes : une étude en laboratoire. Can J Anaesth 2014;61:909–915.
- Ip VH, Tsui BC : L'assemblage cathéter sur aiguille facilite l'administration d'un deuxième bolus anesthésique local pour prolonger le bloc du plexus brachial supraclaviculaire sans étapes de cathétérisme fastidieuses : une étude contrôlée randomisée. Can J Anaesth 2013;60:692–699.
- Tsui BC, Tsui J : moins de fuites et de délogement avec un cathéter sur aiguille par rapport à une approche cathéter à travers l'aiguille pour le bloc nerveux périphérique : une étude ex vivo. Can J Anaesth 2012;59:655–661.
- Ip VH, Rockley MC, Tsui BC : L'ensemble cathéter sur aiguille offre une plus grande stabilité et moins de fuites par rapport à l'homologue traditionnel dans les blocs nerveux interscalènes continus : une étude randomisée en aveugle du patient. Can J Anaesth 2013;60:1272–1273.
- Ip V, Bouliane M, Tsui B : Contamination potentielle du site opératoire causée par une fuite d'un cathéter interscalénique avec le patient en position assise : à propos d'un cas. Can J Anaesth 2012;59:1125–1129.
- Tsui BC, Ip VH : La méthode cathéter sur aiguille réduit le risque de luxation périneurale du cathéter. Br J Anaesth 2014;112:759–760.
- Ip V, Tsui B. La sécurité d'une technique de cathéter interscalène sur aiguille. Anesthésie 2013 ; 68 : 774–775.
- Tsui BC, Gupta S, Finucane B : Confirmation du placement du cathéter épidural par stimulation nerveuse. Can J Anaesth 1998;45:640–644.
- Green JS, Tsui BC : Utilisation d'un stimulateur nerveux pour faciliter la ponction de la membrane cricothyroïdienne lors de la mise à jour difficile des voies respiratoires. Can J Anaesth 2015;62:1126–1127.
- Becker DE, Reed KL : Fondements de la pharmacologie anesthésique locale. Anesth Prog 2006 ; 53 : 98-108.
- Bigeleisen PE, Moayeri N, Groen GJ : Seuils de stimulation extraneurale versus intraneurale pendant le bloc supraclaviculaire guidé par échographie. Anesthésiologie 2009 ; 110 : 1235–1243.
- Robards C, Hadzic A, Somasundaram L, et al : injection intraneurale avec stimulation à faible courant pendant le bloc du nerf sciatique poplité. Anesth Analg 2009;109:673-677.
- Chan VW, Brull R, McCartney CJ, et al : Une étude échographique et histologique de l'injection intraneurale et de la stimulation électrique chez les porcs. Anesth Analg 2007;104:1281–1284, tableaux.
- Byrne K, Tsui BC : Concepts pratiques en stimulation nerveuse : impédance et autres progrès récents. Int Anesthesiol Clin 2011;49:81–90.
- Tsui BC, Pillay JJ, Chu KT, Dillane D : Impédance électrique pour distinguer le placement intraneural de l'aiguille extraneurale dans les nerfs porcins pendant l'exposition directe et le guidage par ultrasons. Anesthésiologie 2008 ; 109 : 479–483.
- Bardou P, Merle JC, Woillard JB, et al : Impédance électrique pour détecter une ponction nerveuse accidentelle lors de blocs nerveux périphériques guidés par ultrasons. Can J Anaesth 2013;60:253–258.
- Kalvoy H, Sauter AR : détection du placement d'aiguilles intraneurales avec surveillance de la bioimpédance à fréquences multiples : une nouvelle méthode. J Clin Monit Comput 2106;30(2):185–192.
- Chin J, Tsui BC : Aucun changement d'impédance lors de l'injection intravasculaire de D5W. Can J Anaesth 2010;57:559–564.
- Cohen JM, Gray AT : Déficits fonctionnels après injection intraneurale lors d'un bloc interscalénique. Reg Anesth Pain Med 2010;35:397–399.
- Reiss W, Kurapati S, Shariat A, Hadzic A : Lésion nerveuse compliquant le bloc du plexus brachial supraclaviculaire guidé par ultrasons/électrostimulation. Reg Anesth Pain Med 2010;35:400–401.
- Hara K, Sakura S, Yokokawa N, Tadenuma S : Incidence et effets de l'injection intraneurale involontaire pendant le bloc du nerf sciatique sous-glutéal guidé par échographie. Reg Anesth Pain Med 2012;37:289–293.
- Sites BD, Taenzer AH, Herrick MD, et al : Incidence de la toxicité systémique des anesthésiques locaux et des symptômes neurologiques postopératoires associés à 12,668 2012 blocs nerveux guidés par échographie : Une analyse d'un registre clinique prospectif. Reg Anesth Pain Med 37;478:482–XNUMX.
- Liu SS, YaDeau JT, Shaw PM, et al : Incidence des injections intraneurales non intentionnelles et des complications neurologiques postopératoires avec des blocs nerveux interscalènes et supraclaviculaires guidés par échographie. Anesthésie 2011 ; 66 : 168–174.
- Widmer B, Lustig S, Scholes CJ, et al : Incidence et gravité des complications dues aux blocs nerveux fémoraux pratiqués pour la chirurgie du genou. Genou 2013;20:181–185.
- Bilbao Ares A, Sabate A, Porteiro L, et al: Étude observationnelle prospective dans un hôpital universitaire. Rev Esp Anestesiol Reanim 2013;60:384–391.
- Brull R, Hadzic A, Reina MA, Barrington MJ : physiopathologie et étiologie des lésions nerveuses consécutives à un bloc nerveux périphérique. Reg Anesth Pain Med 2015;40(5):479–490.
- Neal JM, Barrington MJ, Brull R, et al : deuxième avis de pratique de l'ASRA sur les complications neurologiques associées à l'anesthésie régionale et à la médecine de la douleur : résumé 2015. Reg Anesth Pain Med 2015 ;40(5):401–430.
- 46. Gadsden J, Latmore M, Levine DM, Robinson A : Une pression d'injection d'ouverture élevée est associée au contact aiguille-nerf et aiguille-fascia pendant le bloc du nerf fémoral. Reg Anesth Pain Med 2016;41(1):50–55.
- Gadsden JC, Choi JJ, Lin E, Robinson A : La pression d'injection d'ouverture détecte systématiquement le contact aiguille-nerf pendant le bloc du plexus brachial interscalénique guidé par échographie. Anesthésiologie 2014;120(5):1246–1253.
- Hadzic A, Dilberovic F, Shah S, et al : la combinaison d'une injection intraneurale et d'une pression d'injection élevée entraîne des lésions fasciculaires et des déficits neurologiques chez le chien. Reg Anesth Pain Med 2004;29:417–423.
- Kapur E, Vuckovic I, Dilberovic F, et al : résultats neurologiques et histologiques après des injections intraneurales de lidocaïne dans les nerfs sciatiques canins. Acta Anaesthesiol Scand 2007;51:101–107.
- Gentili F, Hudson A, Kline DG, Hunter D : Blessure par injection de nerf périphérique : une étude expérimentale. Neurochirurgie 1979;4:244–253.
- Gentili F, Hudson AR, Hunter D, Kline DG : Blessure par injection nerveuse avec des agents anesthésiques locaux : une étude au microscope optique et électronique, au microscope fluorescent et à la peroxydase de raifort. Neurochirurgie 1980;6:263–272.
- Myers RR, Kalichman MW, Reisner LS, Powell HC. Neurotoxicité des anesthésiques locaux : altération de la perméabilité périneurale, œdème et lésion des fibres nerveuses. Anesthésiologie 1986 ; 64 : 29–35.
- Selander D, Brattsand R, Lundborg G, et al : Anesthésiques locaux : importance du mode d'application, de la concentration et de l'adrénaline pour l'apparition des lésions nerveuses. Une étude expérimentale de la dégénérescence axonale et des dommages de la barrière après injection intrafasciculaire ou application topique de bupivacaïne (Marcain). Acta Anaesthesiol Scand 1979;23:127–136.
- Bigeleisen PE : La ponction nerveuse et l'injection intraneurale apparente pendant le bloc axillaire guidé par échographie n'entraînent pas invariablement de lésions neurologiques. Anesthésiologie 2006 ; 105 : 779–783.
- Steinfeldt T, Wiesmann T, Nimphius W, et al : l'hématome périneural peut entraîner une inflammation des nerfs et des lésions de la myéline. Reg Anesth Pain Med 2014;39(6):513–519.
- Steinfeldt T, Poeschl S, Nimphius W, et al : Avancement forcé de l'aiguille pendant le contact aiguille-nerf dans un modèle porcin : résultat histologique. Anesth Analg 2011;113(2):417–420.
- Gadsden JC, Lindenmuth DM, Hadzic A, et al : le bloc du plexus lombaire utilisant une injection à haute pression entraîne une propagation controlatérale et péridurale. Anesthésiologie 2008 ; 109 : 683–688.
- Orebaugh SL, Mukalel JJ, Krediet AC, et al : Injection de la racine du plexus brachial dans un modèle de cadavre humain : distribution de l'injectat et effets sur le neuraxis. Reg Anesth Pain Med 2012;37:525–529.
- Claudio R, Hadzic A, Shih H, et al : Pressions d'injection par les anesthésistes lors d'un bloc nerveux périphérique simulé. Reg Anesth Pain Med 2004;29(3):201–205.
- Theron PS1, Mackay Z, Gonzalez JG, Donaldson N, Blanco R. Un modèle animal de « sensation de seringue » pendant un bloc nerveux périphérique. Reg Anesth Pain Med 2009;34(4):330–332.
- Tsui BC, Li LX, Pillay JJ : Technique d'injection d'air comprimé pour normaliser les pressions d'injection des blocs. Can J Anaesth 2006;53 : 1098–1102.
- Asghar S, Bjerregaard LS, Lundstrom LH, et al : Thermographie infrarouge distale et température de la peau après un bloc du plexus brachial interscalénique guidé par échographie : une étude observationnelle prospective. Eur J Anaesthesiol 2014;31:626–634.
- Asghar S, Lundstrom LH, Bjerregaard LS, Lange KH : Bloc sous-claviculaire latéral guidé par ultrasons évalué par thermographie infrarouge et température cutanée distale. Acta Anesthesiol Scand 2014;58:867–874.
- Masson EA, Veves A, Fernando D, Boulton AJ : Seuils de perception actuels : Une nouvelle méthode rapide et reproductible pour l'évaluation de la neuropathie périphérique dans le diabète sucré. Diabetologia 1989;32:724–728.
- Matsutomo R, Takebayashi K, Aso Y : Évaluation de la neuropathie périphérique à l'aide de la mesure du seuil de perception actuel avec le neuromètre chez les patients atteints de diabète sucré de type 2. J Int Med Res 2005 ; 33:442–453.
- Nather A, Keng LW, Aziz Z, et al : évaluation de la neuropathie sensorielle chez les patients souffrant de problèmes de pied diabétique. Diabet Foot Cheville 2011;2:6367. doi:10.3402/dfa.v2i0.6367
- Tsui BC, Shakespeare TJ, Leung DH, et al : Reproductibilité du seuil de perception actuel avec le Neurometer((R)) par rapport au stimulateur nerveux périphérique Stimpod NMS450 chez des volontaires sains : une étude observationnelle. Can J Anaesth 2013;60:753–760.
- Gaudreault F, Drolet P, Fallaha M, Varin F : La fiabilité du seuil de perception actuel chez les volontaires et son applicabilité en milieu clinique. Anesth Analg 2015;120:678–683.
- Huskisson EC : échelles visuelles analogiques. Dans Melczak R (éd.) : mesure et évaluation de la douleur. Raven Press, 1983, pp 33–37.
- Buckenmaier CC III, Galloway KT, Polomano RC, et al : validation préliminaire de l'échelle d'évaluation de la douleur de la défense et des vétérans (DVPRS) dans une population militaire. Pain Med 2013;14:110–123.
- Fuchs-Lacelle S, Hadjistavropoulos T : Élaboration et validation préliminaire de la liste de contrôle d'évaluation de la douleur pour les personnes âgées à capacité de communication limitée (PACSLAC). Pain Management Nurs 2004;5:37–49.
- Bromage PR. Analgésie péridurale. Saunders, 1978.
- Byeon GJ, Shin SW, Yoon JU, et al : Méthodes de perfusion pour le bloc continu du plexus brachial interscalène pour le contrôle de la douleur postopératoire après réparation arthroscopique de la coiffe des rotateurs. Coréen J Pain 2015;28:210–216.
- Patkar CS, Vora K, Patel H, et al : une comparaison de la perfusion continue et de l'administration intermittente en bolus de 0.1 % de ropivacaïne avec 0.0002 % de fentanyl pour l'analgésie du travail épidural. J Anaesthesiol Clin Pharmacol 2015;31:234–238.
- Spencer AO, Tsui BC : Bolus intermittent via un cathéter nerveux sous-claviculaire utilisant une technique de cathéter sur aiguille chez un patient pédiatrique. Can J Anaesth 2014;61:684–685.
- Macaire P, Nadhari M, Greiss H, et al : Contrôle à distance par Internet des réglages de la pompe pour les blocs nerveux périphériques continus postopératoires : Une étude de faisabilité chez 59 patients. Ann Fr Anesth Reanim 2014;33:e1–e7.




