Colin JL McCartney et Stephen Choi
INTRODUCTION
Les blocs nerveux périphériques offrent de nombreux avantages aux patients, notamment un meilleur contrôle de la douleur et une réduction des effets secondaires liés à l'anesthésie générale. Pour optimiser le soulagement de la douleur tout en réduisant la dose totale d'anesthésique local, il serait utile d'ajouter un médicament qui accélère l'apparition et prolonge le blocage sensoriel ou l'effet analgésique. L'amélioration de nos connaissances sur les mécanismes de la douleur du système nerveux périphérique (SNP) nous permet de développer des méthodes de prolongation de l'analgésie tout en réduisant les effets indésirables à médiation centrale et périphérique. Au cours des 20 dernières années, un certain nombre de médicaments ont été testés, et plusieurs se sont avérés cliniquement utiles lorsqu'ils sont ajoutés à un anesthésique local pour un bloc nerveux périphérique ou lorsqu'ils sont utilisés pour une infiltration locale ou une analgésie intra-articulaire. Ces médicaments sont appelés adjuvants analgésiques. Ce chapitre examine la justification et les preuves actuelles de l'utilisation d'adjuvants analgésiques et résume les meilleures stratégies pour optimiser le contrôle de la douleur et réduire les effets indésirables après une intervention chirurgicale sous bloc nerveux périphérique, infiltration locale ou injection de médicaments dans l'espace intra-articulaire.
JUSTIFICATION DE L'UTILISATION
La transmission de la douleur dans le SNC et le SNP implique une gamme complexe de neurotransmetteurs et de voies qui ne sont pas facilement bloquées par un seul type de médicament ou une seule technique. L'implication de plusieurs classes de neurotransmetteurs au site de la lésion, au nerf périphérique, à la corne dorsale de la moelle épinière et aux sites supraspinaux est responsable de la transmission de la nociception. L'utilisation d'agonistes au niveau des récepteurs inhibiteurs et d'antagonistes au niveau des récepteurs excitateurs permet une approche « multimodale » avec optimisation du contrôle de la douleur et réduction des effets indésirables. En 1645, Descartes proposa un mécanisme de transmission de la douleur, suggérant qu'une impulsion périphérique de douleur était transmise directement de la périphérie au cerveau par un système "câblé" sans aucune modulation intermédiaire (Figure 1).
Cette théorie de la transmission de la douleur était largement considérée comme vraie jusqu'à il y a 40 ans. En 1965, Melzack et Wall ont proposé leur théorie révolutionnaire du contrôle de la porte de la douleur qui suggérait que la douleur pouvait être modulée ou « fermée » à un certain nombre de points de la voie de la douleur. Des recherches ultérieures ont identifié la corne dorsale (lame II) de la moelle épinière comme un site important de modulation potentielle, et les traitements ultérieurs de la douleur aiguë et chronique ont utilisé ces connaissances à bon escient. Des traitements tels que l'utilisation d'opioïdes spinaux et la stimulation nerveuse électrique transcutanée (TENS) ont été développés à la lumière de ces connaissances. La théorie de la porte a également changé de nombreuses stratégies de gestion de la douleur (souvent infructueuses), passant de techniques où nous avons essayé d'éliminer les voies de la douleur chimiquement ou chirurgicalement à des techniques de modulation plus récentes par lesquelles nous tentons d'inhiber les influences excitatrices et d'améliorer les influences inhibitrices dans la voie de la douleur. Au cours des dernières décennies, des avancées importantes ont également eu lieu dans nos connaissances sur la façon dont la douleur est générée et transmise du SNP au système nerveux central (SNC). La modulation de la douleur dans le SNP implique également de nombreux transmetteurs et mécanismes qui à la fois excitent et inhibent les voies nociceptives. Dans le SNP, dans des conditions physiologiques normales, des signaux nociceptifs sont produits lorsque les fibres A-α et C sont stimulées par la chaleur, la pression ou plusieurs produits chimiques produits par des lésions tissulaires et une inflammation (potassium, histamine, bradykinine, prostaglandines, adénosine triphosphate [ATP]) . Les signaux nociceptifs sont transmis aux couches superficielles de la lame II de la corne dorsale de la moelle épinière, où ils sont modulés à la fois au niveau présynaptique et post-synaptique et également par des voies de contrôle descendantes excitatrices et inhibitrices du tronc cérébral (Figure 2). Les signaux qui réussissent à franchir cette porte voyagent vers le tronc cérébral et le thalamus avant d'atteindre le cortex cérébral pour produire un stimulus douloureux. Des médiateurs chimiques dans un large éventail sont produits dans le SNP et ont des influences à la fois excitatrices et inhibitrices sur la transmission nerveuse sensorielle périphérique dans les phases aiguë et chronique de la lésion (Figure 3). Ceux-ci peuvent activer directement le nerf (ATP, glutamate, 5-hydroxytryptamine [5-HT], histamine, bradykinine) ; améliorer la dépolarisation en sensibilisant le nerf à d'autres stimuli (prostaglandines, prostacycline et cytokines telles que les interleukines); ou assurer un rôle régulateur sur le neurone sensoriel, les cellules inflammatoires et les fibres sympathiques (bradykinine, tachykinine et facteur de croissance nerveuse).
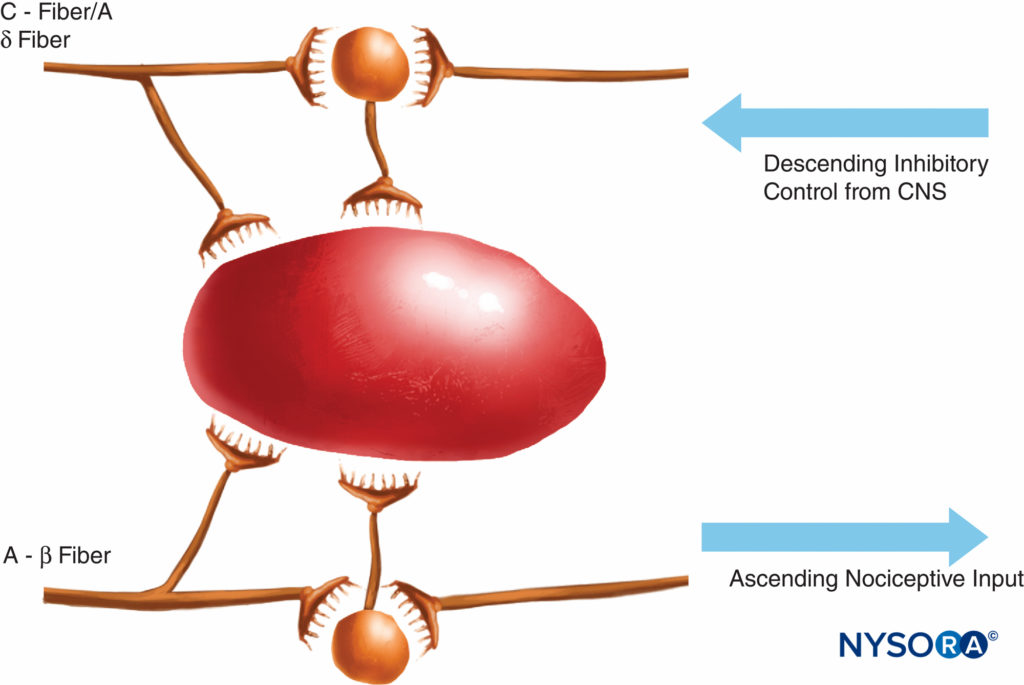
FIGURE 2. La théorie de la porte a proposé que les petites fibres (C) activaient les systèmes excitateurs (neurone noir) qui excitaient ensuite les cellules de sortie ; ces dernières cellules avaient leur activité contrôlée par l'équilibre des inhibitions médiées par les grandes fibres (A-β) (médiées par les opioïdes endogènes) et également par les systèmes de contrôle descendants du système nerveux central (médiés par la noradrénaline et la sérotonine).
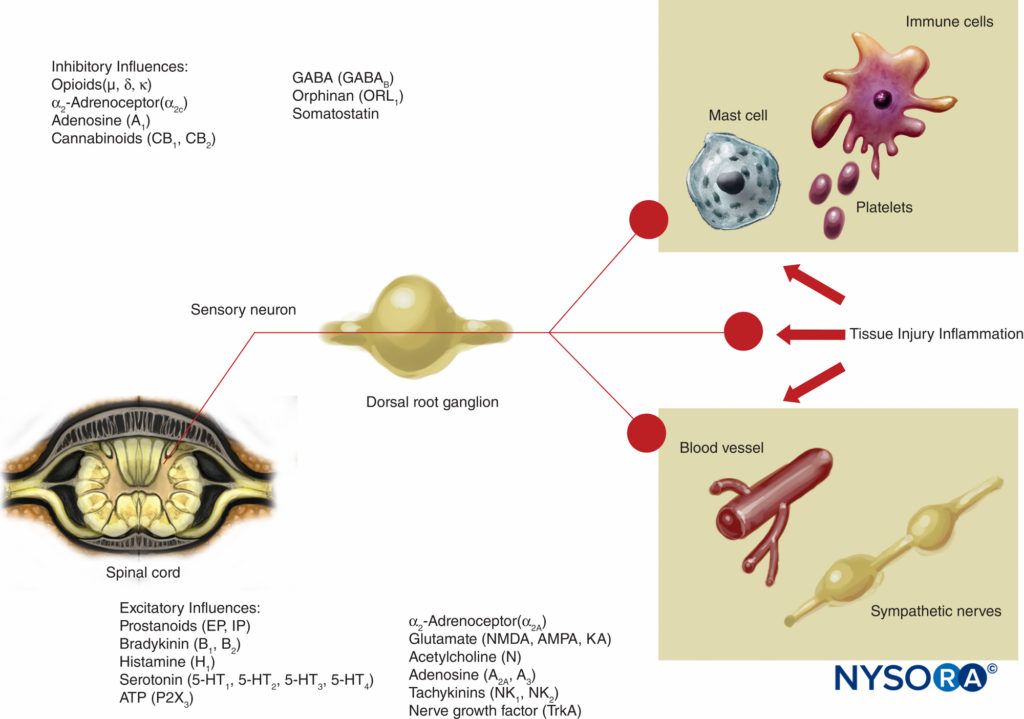
FIGURE 3. Influences excitatrices et inhibitrices sur l'activité des nerfs périphériques par les médiateurs libérés par les lésions tissulaires et l'inflammation et par une variété d'agents agissant sur les neurorécepteurs. AMPA = acide α-amino-3-hydroxy-5-méthylisoxazole-4-propionique ; KA = acide kaïnique ; NMDA = N-méthyl-d-aspartate; NK = neurokinine ; TrkA = récepteur kinase A de la tropomyosine.
JUSTIFICATION DE L'UTILISATION D'ADJUVANTS ANALGÉSIQUES
Comme indiqué précédemment, la transmission de la douleur dans le SNC et le SNP implique un ensemble complexe de neurotransmetteurs et de voies qui ne sont pas facilement bloqués par un seul type de médicament ou une seule technique. Un certain nombre de médicaments dans l'arsenal thérapeutique de l'anesthésiste, y compris les opioïdes, les anti-inflammatoires non stéroïdiens (AINS), les α2-agonistes, la dexaméthasone et les antagonistes du N-méthyl-aspartate (NMDA), ont une activité sur ces sites d'action et peuvent être bénéfiques si appliquées dans le PNS. Fait important, aucun n'a démontré de neurotoxicité à des concentrations cliniquement pertinentes.
Ces connaissances peuvent aider l'anesthésiste régional de plusieurs façons :
- Dans la sélection d'adjuvants aux anesthésiques locaux pour accélérer l'apparition, prolonger l'effet et réduire la dose totale requise.
- Suggérer des agents qui peuvent améliorer l'analgésie postopératoire sans prolonger les effets indésirables des anesthésiques locaux.
- Suggérer des agents qui agissent principalement au niveau des sites périphériques sans effets centraux, optimisant ainsi l'analgésie tout en minimisant les effets secondaires sur le SNC.
ANALGÉSIQUES OPIOÏDES
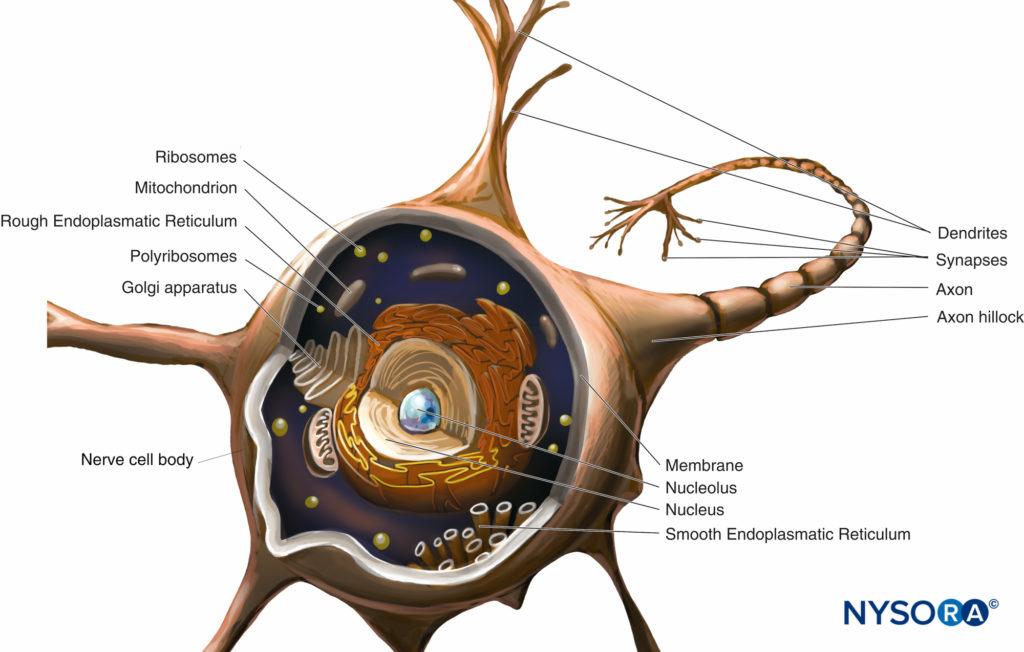
Au cours de l'inflammation, les récepteurs opioïdes sont exprimés dans les fibres sensorielles périphériques et les cellules immunitaires ; de plus, des opioïdes endogènes sont libérés de ces cellules et équilibrent l'état nociceptif accru produit par l'inflammation. De plus en plus de travaux suggèrent une relation intime entre les opioïdes endogènes et le système immunitaire. Christoph Stein et ses collègues à Berlin ont réalisé un certain nombre d'études pionnières décrivant la capacité du système immunitaire à délivrer des opioïdes endogènes et la capacité de l'inflammation à stimuler le mouvement des récepteurs opioïdes vers le site de la blessure, permettant ainsi l'antinociception. Cependant, ces changements ne se produisent pas immédiatement après la blessure et peuvent prendre jusqu'à 96 heures pour se produire. Les récepteurs opioïdes et les neuropeptides (p. ex., la substance P) sont synthétisés dans le ganglion de la racine dorsale et transportés le long des microtubules intra-axonaux dans les processus centraux et périphériques du neurone afférent primaire (Figure 4). Aux extrémités, les récepteurs opioïdes sont incorporés dans la membrane neuronale et deviennent des récepteurs fonctionnels. Lors de l'activation par des opioïdes exogènes ou endogènes (libérés par les cellules immunitaires), les récepteurs opioïdes se couplent aux protéines G inhibitrices. Cela conduit à une suppression directe ou indirecte (par la diminution de l'adénosine monophosphate cyclique) des courants Ca2+ ou Na+ et à une atténuation subséquente de la libération de substance P.
La perméabilité du périnèvre est augmentée dans les tissus enflammés, améliorant la capacité des opioïdes à atteindre les récepteurs cibles. De nombreuses études ont appliqué des opioïdes dans le SNP aux nerfs périphériques ou à l'espace intra-articulaire. Bien que de nombreuses études aient revendiqué un avantage analgésique des opioïdes appliqués par voie périphérique, peu d'études ont incorporé un groupe témoin avec un opioïde appliqué de manière systémique à des fins de comparaison. Sans inclusion d'un contrôle, il est impossible d'interpréter si l'opioïde périphérique a un véritable effet périphérique ou s'il est plutôt transporté vers le SNC pour induire une analgésie. Une véritable analgésie opioïde à médiation périphérique peut être bénéfique si elle est associée à une analgésie améliorée ou à une réduction des effets indésirables par rapport à l'administration systémique. Si l'effet est médiatisé de manière centrale, il n'y a pas d'avantage clair par rapport à l'administration systémique.
Opioïdes périneuraux
Les récepteurs opioïdes identifiés sur les fibres afférentes primaires sont transportés du ganglion de la racine dorsale au site de l'inflammation ; cependant, pendant qu'ils subissent un transport axonal, ils peuvent ne pas être facilement atteints par les agonistes opioïdes. Cela peut expliquer la raison pour laquelle deux revues systématiques récentes publiées en 1997 et 2000 ont trouvé peu de preuves du bénéfice de l'ajout d'opioïdes aux anesthésiques locaux dans le bloc nerveux périphérique. Un tableau actualisé des études examinant l'administration périneuronale d'opioïdes (excluant la buprénorphine et le tramadol) montre que le bénéfice antalgique reste équivoque (Tableau 1). En outre, Peng et Choyce ont examiné l'utilisation des opioïdes dans l'anesthésie régionale intraveineuse (IVRA) avec des conclusions décevantes similaires.
TABLE 1. Résultats des études examinant l'effet des opioïdes périneuronaux/périneuraux (à l'exclusion du tramadol et de la buprénorphine).
| Total des études | Résultats globaux | Résultats du contrôle systémique |
|---|---|---|
| 19 études | 10 favorable | 7 contrôle systémique : 5 favorables ; 2 négatifs |
| 9 négatif | 12 pas de contrôle systémique : 5 favorable; 7 négatifs. |
Malgré ces résultats décevants, les deux agonistes opioïdes ayant démontré une efficacité analgésique en administration périneuronale sont la buprénorphine et le tramadol. La buprénorphine est un agoniste partiel des récepteurs µ avec une très grande affinité pour le récepteur par rapport au fentanyl (24 fois) ou à la morphine (50 fois). De plus, il a une solubilité intermédiaire dans les lipides, ce qui lui permet de traverser la membrane neurale. Candido et ses collègues ont ajouté 0.3 mg de buprénorphine (un agoniste opioïde partiel) à une combinaison de mépivacaïne et de tétracaïne dans le bloc axillaire et ont constaté une augmentation de près de 100 % de la durée de l'analgésie par rapport à l'administration d'un bloc axillaire plus la même dose de buprénorphine intramusculaire avec pas d'augmentation significative des effets indésirables. Cela confirme l'effet analgésique périphérique de la buprénorphine et les résultats antérieurs de deux études qui ont examiné la buprénorphine sans groupe de contrôle systémique. Les études portant sur la buprénorphine sont présentées plus en détail dans Tableau 2.
TABLE 2. Études examinant la buprénorphine comme adjuvant analgésique avec des anesthésiques locaux.
| Auteur/Date | Les patients/ Groupes | Type de bloc | doser | Anesthésie locale | Systémique Control | Résultats |
|---|---|---|---|---|---|---|
| Viel 1989 | 20/2 | Supraclaviculaire | 3 XNUMX mcg/kg | Bupivacaïne 0.5 % 40 mL | Non | Analgésie prolongée par rapport au groupe morphine (35 vs 18.25 h) ; pas de différence de bloc sensoriel. |
| Bassin 1997 | 89/4 | Supraclaviculaire | 3 µg/kg | Bupivacaïne 0.5 % Lidocaïne 1% | Non | Analgésie prolongée par rapport au groupe témoin (20 vs 11.5 h) |
| Candid 2001 | 40/2 | Supraclaviculaire | 0.3 mg | Mépivacaïne 1% Tétracaïne 0.2 % | Non | Analgésie prolongée par rapport au groupe témoin (17.4 vs 5.3 h) |
| Candid 2002 | 60/3 | Axillaire | 0.3 mg | Mépivacaïne 1% | Oui | La durée moyenne de l'analgésie postopératoire était de 22.3 h dans le groupe axillaire vs 12.5 h dans le groupe IM et 6.6 h dans le groupe placebo. |
| Tétracaïne 0.2 % | IM |
Le tramadol est un agoniste opioïde faible avec une certaine sélectivité pour le récepteur µ qui inhibe également la recapture de la noradrénaline et stimule la libération de sérotonine dans l'espace intrathécal. La norépinéphrine et la sérotonine sont des transmetteurs de la voie de contrôle descendante dans la moelle épinière et améliorent l'analgésie. Kapral et ses collègues ont utilisé une dose de 100 mg de tramadol comme adjuvant à la mépivacaïne dans le bloc du plexus brachial axillaire. Ils ont divisé 60 patients en trois groupes : un groupe a reçu de la mépivacaïne à 1 % avec 2 mL de solution saline, le deuxième groupe a reçu de la mépivacaïne à 1 % avec 100 mg de tramadol et le troisième groupe a reçu de la mépivacaïne à 1 % avec 2 mL de solution saline et 100 mg de tramadol par voie intraveineuse. Cette étude a démontré une durée accrue du bloc moteur et sensoriel dans le groupe tramadol axillaire qui a significativement (p < 01) survécu à la fois à un groupe intraveineux et à un groupe placebo. Robaux et ses collègues ont ensuite réalisé une étude dose-réponse avec un placebo et des doses de 40, 100 et 200 mg de tramadol ajoutées à une dose fixe de mépivacaïne à 1.5 % dans un bloc axillaire et ont constaté que la dose de 200 mg offrait la meilleure analgésie. sans augmentation des effets indésirables. Alemanno et ses collègues ont utilisé une dose de 1.5 mg/kg de tramadol comme adjuvant à 0.5 % de lévobupivacaïne (0.5 mL/kg) pour le bloc interscalénique. Ici, 120 patients ont été divisés en trois groupes : un groupe a reçu un anesthésique local seul, le deuxième groupe a reçu un anesthésique local avec du tramadol systémique et le troisième groupe a reçu un anesthésique local avec du tramadol périneural. Alors que les deux groupes recevant du tramadol ont connu une analgésie prolongée par rapport au placebo, le groupe recevant du tramadol périneural a connu une analgésie prolongée par rapport au tramadol systémique (14.5 contre 10.1 heures ; p < 001).
Opioïdes intra-articulaires et autres voies d'administration périphériques
Les agonistes opioïdes administrés dans les tissus enflammés se lieront aux récepteurs opioïdes sur les terminaux sensoriels et induiront une analgésie. Des études animales ont indiqué que ces récepteurs opioïdes périphériques sont exprimés 96 heures après la lésion inflammatoire initiale. L'administration intra-articulaire d'opioïdes ne produira donc une analgésie que chez les patients présentant une inflammation préexistante. Kalso et ses collaborateurs ont examiné systématiquement le rôle des opioïdes intra-articulaires en 1997 et ont établi qu'il existait des preuves d'un bénéfice prolongé de la morphine intra-articulaire sans effets indésirables significatifs à des doses de 1 à 5 mg. Aucune dose-réponse n'a été détectée. Des articles récents ont soutenu cette découverte et ont montré les avantages de la morphine intra-articulaire, du tramadol, de la buprénorphine et du sufentanil. Cependant, une revue systématique des effets de la morphine intra-articulaire n'a démontré qu'un léger effet analgésique [échelle visuelle analogique de réduction de la douleur (EVA) de 12 à 17 mm], mais n'a pas pu exclure que l'effet soit médié par l'absorption systémique.
ALPHA2-AGONISTES ET CLONIDINE
La clonidine est un α2-agoniste avec certains effets α1-stimulateurs. Il a traditionnellement été utilisé comme agent antihypertenseur et a été noté pour avoir des effets sédatifs et analgésiques pendant de nombreuses années. Plus récemment, il a été déterminé que des récepteurs α2 existent dans la corne dorsale de la moelle épinière et que la stimulation de ces récepteurs produit des effets analgésiques en inhibant la libération présynaptique de transmetteurs excitateurs, notamment la substance P et le glutamate. La clonidine intrathécale médie l'analgésie en augmentant les niveaux d'acétylcholine, qui à son tour stimule les récepteurs muscariniques. L'excitation muscarinique augmente les niveaux d'acide γ-amino butyrique sur la fibre afférente primaire, inhibant la libération du glutamate, un neurotransmetteur excitateur. La clonidine injectée à proximité des nerfs périphériques avec ou sans médicaments anesthésiques locaux semble médier l'analgésie de plusieurs façons. La clonidine a des propriétés anesthésiques locales et des potentiels d'action composés inhibés de manière tonique des fibres C supérieures aux fibres A-α dans le nerf sciatique du rat et était comparable à la lidocaïne dans sa capacité à inhiber les fibres C dans le nerf vague du lapin. La clonidine a également un effet pharmacocinétique sur la redistribution de l'anesthésique local par l'intermédiaire d'un effet vasoconstricteur au niveau du récepteur α1. Des modèles animaux récents ont démontré et soutenu des travaux antérieurs selon lesquels la clonidine facilite principalement le blocage nerveux périphérique par le biais d'un courant cationique activé par hyperpolarisation et que cet effet est indépendant de tout effet vasoconstricteur. Un ajout plus récent à la sélection des α2-agonistes est la dexmédétomidine, qui est sélective pour le récepteur α2 et qui est actuellement principalement étudiée comme agent sédatif dans les unités de soins intensifs. On peut s'attendre à ce que la dexmédétomidine produise non seulement une analgésie plus profonde, mais également des effets indésirables plus importants en raison de la sélectivité d'action. La stimulation du récepteur α2 produit une hypotension, une bradycardie et une sédation à des doses plus élevées, et ces effets peuvent l'emporter sur les avantages analgésiques produits par l'utilisation de ces agents.
Application périneuronale
Plus de 30 études chez l'homme ont maintenant examiné l'effet de la clonidine sur les anesthésiques locaux dans le bloc nerveux périphérique. Il existe de bonnes preuves issues de ces études que la clonidine à des doses allant jusqu'à 1.5 µg/kg prolonge le blocage sensoriel et l'analgésie lorsqu'elle est administrée avec des anesthésiques locaux pour le bloc nerveux périphérique. Cela confirme l'opinion initiale de Murphy et ses collègues selon laquelle la clonidine est un adjuvant bénéfique lorsqu'elle est ajoutée au bloc nerveux périphérique et que l'effet est très probablement médié dans le SNP. Bien qu'un certain nombre d'études aient examiné l'effet de la clonidine ajoutée au bloc nerveux périphérique, seules quelques-unes ont contrôlé un effet systémique. Singelyn et ses collaborateurs ont évalué 30 patients recevant un bloc du plexus brachial axillaire avec 40 mL de mépivacaïne à 1 % plus épinéphrine 5 µg/mL. Les patients ont été randomisés en trois groupes et ont reçu (1) un anesthésique local seul, (2) un anesthésique local plus 150 µg de clonidine administrés par voie sous-cutanée, ou (3) 150 µg de clonidine dans le bloc du plexus brachial avec un anesthésique local. La clonidine ajoutée au bloc du plexus brachial axillaire a doublé l'apparition de la douleur, sans effets indésirables par rapport au contrôle systémique. Hutschala et ses collaborateurs ont récemment démontré l'effet analgésique périphérique de la clonidine chez des volontaires lorsqu'elle est ajoutée à un bloc du plexus brachial avec 0.25 % de bupivacaïne.
Cependant, d'autres études récentes n'ont démontré aucun avantage global de l'ajout de clonidine aux anesthésiques locaux à action prolongée tels que la bupivacaïne et la ropivacaïne. Plus récemment, une méta-analyse de Popping et ses collègues a estimé que la clonidine prolongeait l'analgésie postopératoire, le bloc sensoriel et le bloc moteur de 122, 74 et 141 minutes, respectivement. La clonidine, cependant, a également augmenté la probabilité d'hypotension (rapport de cotes [OR] 3.61), d'évanouissement (OR 5.07), de sédation (OR 2.28) et de bradycardie (OR 3.09). Aucune réponse à la dose n'a été observée entre 30 et 300 µg, la majorité recevant 150 µg. L'ajout de clonidine à des blocs nerveux périphériques continus n'est pas bénéfique. Ilfeld et ses collègues ont démontré dans deux études que 0.1 et 0.2 µg/mL de clonidine ajoutés à une perfusion continue de ropivacaïne à 0.2 % n'ont pas réussi à réduire les scores de douleur ou l'utilisation d'analgésiques oraux après une chirurgie du membre supérieur. La dexmédétomidine, comme postulé précédemment, produit en effet un effet plus profond sur l'analgésie lorsqu'elle est appliquée par voie périneurale en conjonction avec des anesthésiques locaux. Quatre études ont récemment examiné cela, et une méta-analyse a suggéré que la dexmédétomidine prolonge les effets analgésiques des blocs du plexus brachial de 284 minutes. Fait intéressant, malgré les préoccupations initiales selon lesquelles la dexmédétomidine pourrait avoir des effets hémodynamiques plus importants que la clonidine, cela ne semble pas être le cas.
Anesthésie régionale intraveineuse
L'anesthésie régionale intraveineuse est une technique d'anesthésie régionale simple et utile, en particulier pour les interventions mineures des membres supérieurs périphériques, qui est limitée par la tolérance au garrot et une mauvaise analgésie postopératoire. La clonidine a été démontrée dans un certain nombre d'études pour améliorer le temps d'apparition et la tolérance peropératoire du garrot. Une seule étude a démontré une amélioration de l'analgésie postopératoire dans la période postopératoire précoce par rapport au placebo. Reuben et ses collaborateurs ont randomisé 45 patients pour recevoir 40 mL de lidocaïne à 0.5 % avec de la clonidine 1 µg/kg, de la lidocaïne seule avec de la clonidine intraveineuse et de la lidocaïne seule avec une solution saline intraveineuse. Les patients qui ont reçu de la clonidine avec de la lidocaïne ont ressenti beaucoup moins de douleur et ont demandé moins d'analgésiques que les patients des deux autres groupes. Des doses plus élevées de clonidine (150 µg) produisaient significativement plus de sédation et d'incidence d'hypotension. À ce jour, une seule étude a utilisé la dexmédétomidine dans l'IVRA. Memis et ses collègues ont ajouté 0.5 µg/kg de dexmédétomidine à 0.5 % de lidocaïne et ont démontré une réduction du délai d'apparition et une amélioration de l'analgésie postopératoire par rapport au placebo, sans effets indésirables significatifs.
Techniques intra-articulaires
L'effet intra-articulaire de la clonidine a été examiné lorsqu'elle est administrée avec et sans anesthésie locale et s'est avérée avoir des effets bénéfiques sur l'analgésie postopératoire. On peut s'attendre à ce que l'ajout de morphine et de clonidine ait des effets additifs. Deux études ont examiné cette question, l'une démontrant une amélioration de l'analgésie et l'autre aucune différence. Des essais précliniques ont démontré que, comme pour les opioïdes, l'analgésie médiée par la clonidine est renforcée par l'inflammation, bien qu'à l'heure actuelle le mécanisme ne soit pas évident.
DEXAMÉTHASONE
La dexaméthasone est un corticostéroïde synthétique puissant avec environ sept fois la puissance anti-inflammatoire de la prednisolone et très peu d'activité minéralocorticoïde. La demi-vie est d'environ 36 à 54 heures dans le cadre périopératoire. L'efficacité de la dexaméthasone comme antiémétique postopératoire (4 à 10 mg par voie intraveineuse) a été confirmée par plus de 60 essais contrôlés randomisés, avec une méta-analyse récente estimant l'OR à 0.31 et un nombre nécessaire à traiter (NNT) à 3.7. Compte tenu de ses propriétés anti-inflammatoires systémiques, les effets analgésiques d'une seule dose intraveineuse préopératoire de dexaméthasone ont été étudiés dans plus de 24 essais randomisés avec des effets modestes jusqu'à 24 heures. Cette méta-analyse, publiée en 2011, a inclus 2751 patients et a estimé que les scores de l'échelle d'évaluation verbale de la douleur (VRS) étaient réduits à un maximum de 0.64 point jusqu'à 24 heures après l'administration de dexaméthasone. Avant ces revues, des études in vitro et murines de l'action pharmacologique spécifique de la dexaméthasone ont donné lieu à plusieurs nouvelles applications en plus de l'administration systémique.
Application périneurale
On pense que les corticostéroïdes périneuraux exercent leur effet par plusieurs mécanismes, notamment en atténuant la libération de médiateurs inflammatoires, en réduisant la décharge neuronale ectopique et en inhibant la décharge médiée par le canal potassique des fibres nociceptives C. Il est largement admis que la dexaméthasone améliore la qualité et la durée du bloc nerveux périphérique lorsqu'elle est administrée en association avec des anesthésiques locaux. La Food and Drug Administration (FDA) des États-Unis (ou tout autre organisme de réglementation), cependant, n'approuve pas la dexaméthasone pour l'administration périneurale. Néanmoins, plusieurs études ont évalué les effets de l'association de la dexaméthasone (4 à 10 mg) avec un anesthésique local pour les blocs nerveux périphériques. Les blocs nerveux périphériques des membres supérieurs et inférieurs réalisés avec de la dexaméthasone ont démontré une prolongation de l'analgésie ou du bloc sensitif/moteur allant d'environ 50 % à 75 % au-delà de celle réalisée avec un anesthésique local seul. Une seule étude à ce jour a comparé la dexaméthasone périneurale à la dexaméthasone systémique dans le cadre des blocs nerveux périphériques. Cette étude a randomisé des patients pour un bloc interscalénique du plexus brachial avec un placebo ou 8 mg de dexaméthasone périneurale ou systémique. Les auteurs ont démontré un allongement du bloc dans les deux groupes de dexaméthasone de 12 heures à environ 20 et 22 heures pour l'administration systémique et périneurale, respectivement, et ont conclu que l'administration systémique et périneurale de dexaméthasone étaient équivalentes. Une étude plus approfondie est nécessaire pour comparer les effets de la dexaméthasone périneurale et systémique avant de pouvoir tirer des conclusions définitives. Les inquiétudes concernant les complications liées à la dexaméthasone, telles que les effets sur la glycémie et la neurotoxicité du conservateur utilisé dans les flacons multidoses, n'ont pas été apparentes dans la pratique. En particulier, une dose unique de dexaméthasone, qu'elle soit administrée par voie périneurale ou systémique, n'a pas augmenté la glycémie à un degré cliniquement significatif. Des études murines sur le bisulfite de sodium n'ont démontré aucune neurotoxicité avec l'administration intrathécale.
Anesthésie régionale intraveineuse
Bigat et ses collègues ont étudié les effets de l'ajout de dexaméthasone à la lidocaïne IVRA dans un essai randomisé. Soixante-quinze patients ont été randomisés pour recevoir de la lidocaïne avec un placebo, 8 mg de dexaméthasone avec de la lidocaïne ou 8 mg de dexaméthasone systémique. Dans cette étude, la dexaméthasone systémique n'a exercé aucun effet sur l'efficacité de l'IVRA, tandis que la lidocaïne plus la dexaméthasone ont démontré des caractéristiques de blocage améliorées.
ANTAGONISTES DES RÉCEPTEURS N-MÉTHYL-ASPARTATE
Dans la corne dorsale de la moelle épinière à la fois ionotropique [N-méthyl-aspartate (NMDA)], acide α-amino-3-hydroxy-5-méthylisoxazole-4-propionique (AMPA), acide kaïnique (KA) et métabotropique les récepteurs du glutamate sont impliqués dans la signalisation nociceptive et la sensibilisation centrale dans les états de douleur chronique. Récemment, plusieurs récepteurs du glutamate ont été trouvés dans les terminaisons nerveuses périphériques et peuvent contribuer à la signalisation périphérique de la douleur. L'injection du glutamate, un agoniste des récepteurs NMDA, dans le muscle masséter provoque des douleurs chez les rats et les humains. L'injection ultérieure d'antagonistes des récepteurs NMDA tels que la kétamine et le dextrométhorphane atténue la douleur.
Un certain nombre d'études ont examiné l'effet des antagonistes du NMDA dans la production d'analgésie à médiation périphérique chez les patients. Tverskoy et ses collègues ont infiltré de la bupivacaïne avec de la kétamine à 0.3 % ou un placebo chez des patients souffrant d'herniorraphie inguinale et ont découvert que la kétamine améliorait de manière significative les actions anesthésiques et analgésiques d'un anesthésique local administré pour une anesthésie par infiltration. La kétamine a été utilisée comme seul anesthésique dans l'IVRA, mais les patients ont subi des effets indésirables excessifs lors du dégonflage du garrot. D'autres travailleurs ont ajouté de la kétamine (0.1 mg/mL) ou de la clonidine (1 µg/kg) à la lidocaïne pour l'IVRA. Les patients du groupe kétamine avaient le meilleur contrôle de la douleur, bien que la clonidine et la kétamine réduisaient de manière significative la consommation d'analgésiques par rapport à la lidocaïne seule, avec de légers effets secondaires psychomimétiques dans le groupe kétamine. Deux études ont examiné l'utilisation de la kétamine intra-articulaire. Dal et ses collègues ont randomisé les patients pour recevoir de la kétamine intra-articulaire (0.5 mg/kg), de la néostigmine, de la bupivacaïne ou un placebo. Les patients recevant les trois médicaments ont présenté des améliorations similaires de l'analgésie avec la flexion du genou par rapport au placebo ; cependant, le groupe kétamine avait la plus longue durée d'analgésie. Brill et ses collègues ont réalisé une étude dose-réponse utilisant jusqu'à 1 mg/kg de kétamine intra-articulaire après une arthroscopie du genou et ont constaté que le bénéfice analgésique ne se produisait que dans la première heure après la chirurgie par rapport au placebo. Le magnésium a des effets bloquants NMDA et bloque le canal ionique sur le récepteur NMDA pendant les états physiologiques normaux. Un apport nociceptif persistant dans la corne dorsale de la moelle épinière élimine le magnésium, permettant un afflux de calcium et des changements intracellulaires conduisant à des états douloureux persistants. Turan et al ont exploité ce potentiel analgésique dans le SNP en ajoutant 1.5 g de magnésium à de la lidocaïne à 0.5 % pour IVRA. Le magnésium a réduit le temps d'apparition et prolongé de manière significative l'effet analgésique jusqu'à 6 heures après la chirurgie sans différence d'effets indésirables. Dans l'ensemble, les antagonistes du NMDA pourraient avoir un potentiel important pour produire une analgésie à médiation périphérique à l'avenir, bien que les agents actuellement disponibles (à l'exception du magnésium dans l'IVRA) aient des effets limités et, à des doses plus élevées, produisent des effets indésirables excessifs.
INHIBITION DE LA CYCLOOXYGENASE
Les prostaglandines sensibilisent les terminaisons nerveuses périphériques aux effets des médiateurs chimiques endogènes libérés lors d'une lésion tissulaire. Les AINS inhibent la production de prostaglandines grâce à leur effet bien connu d'inhibition de la cyclooxygénase (COX). L'application d'AINS directement dans le SNP semblerait donc logique comme moyen de réduire la douleur par un mécanisme périphérique.
Anesthésie régionale intraveineuse
Un certain nombre d'auteurs ont ajouté du kétorolac à l'IVRA à des doses de 5 à 60 mg, produisant une amélioration de la tolérance au garrot peropératoire et de l'analgésie postopératoire. Steinberg et ses collègues ont réalisé une étude dose-réponse avec le kétorolac dans l'IVRA en utilisant un placebo, des doses de 5, 10, 15, 20, 30 et 60 mg de kétorolac. Il a été constaté que 20 mg était la dose idéale, des doses plus faibles produisant moins d'analgésie et des doses plus élevées n'étant pas plus efficaces. L'acide lysine acétylsalicylique 90 mg (équivalent à 50 mg d'acide acétylsalicylique) a été ajouté à la prilocaïne pour IVRA avec prolongation de l'analgésie postopératoire.
Administration intra-articulaire
L'utilisation de kétorolac seul, avec un anesthésique local ou un anesthésique local et de la morphine, n'est pas plus efficace qu'un anesthésique local seul lorsqu'il est administré dans l'espace intra-articulaire. En savoir plus sur Infiltration intra-articulaire et périarticulaire des anesthésiques locaux.
Infiltration
Le kétorolac a été infiltré avec succès à une dose de 30 à 60 mg après réparation d'une hernie, donnant un effet similaire à une infiltration avec de la bupivacaïne. Cependant, l'infiltration locale ne s'est pas avérée plus efficace que l'administration systémique.
ANALGÉSIE CHOLINERGIQUE
Les récepteurs muscariniques médient l'analgésie dans la corne dorsale de la moelle épinière, et la néostigmine a produit une analgésie lorsqu'elle est administrée à la fois dans l'espace intrathécal et épidural. La néostigmine a également été appliquée dans le SNP dans un certain nombre d'études, avec des résultats généralement décevants. Van Elstraete et ses collègues et Bone et ses collègues ont ajouté 500 µg de néostigmine à l'anesthésique local dans le bloc du plexus brachial axillaire. Une étude n'a démontré aucune différence, et l'autre n'a trouvé qu'une réduction significative de la douleur à 24 heures, sans différence à d'autres moments. La néostigmine ajoutée à l'anesthésique local pour IVRA a également été décevante. Turan et ses collègues ont ajouté 500 µg de néostigmine à la prilocaïne à 0.5 % et ont constaté une amélioration de l'apparition et de la compensation des blocs sensoriels et moteurs avec un délai prolongé jusqu'à la première demande d'analgésique. Cependant, McCartney et ses collègues ont réalisé une étude similaire en utilisant de la néostigmine 1 mg ajoutée à de la lidocaïne 0.5 %, sans aucune différence entre les groupes. Dans l'ensemble, la néostigmine apparaît décevante en tant qu'adjuvant analgésique pour le bloc nerveux périphérique ou IVRA. Cependant, la néostigmine a été utilisée avec succès comme adjuvant analgésique pour une utilisation intra-articulaire après une arthroscopie du genou. Yang et ses collègues ont réalisé une étude dose-réponse et ont trouvé que 500 µg étaient les plus efficaces, ce qui était plus efficace que 2 mg de morphine intra-articulaire. L'efficacité de la voie antalgique cholinergique intra-articulaire comparée aux mauvais résultats de l'application périneuronale pourrait être liée à la présence de la réponse inflammatoire dans l'espace intra-articulaire, augmentant l'efficacité antalgique de l'acétylcholine par un mécanisme encore à définir .
RÉSUMÉ
Les blocs nerveux périphériques offrent des avantages anesthésiques et analgésiques significatifs à nos patients. Des adjuvants analgésiques tels que des opioïdes, des α2-agonistes, des antagonistes des récepteurs NMDA et d'autres agents peuvent être ajoutés aux anesthésiques locaux à la fois pour faciliter l'apparition et pour prolonger les effets anesthésiques et analgésiques par des mécanismes existant dans le SNP. Plusieurs agents sont efficaces lorsqu'ils sont administrés dans l'espace périneuronal ou intra-articulaire et lorsqu'ils sont administrés en IVRA ou en infiltration locale (Tableau 3). La taille d'effet de chaque adjuvant particulier est variable, la dexaméthasone produisant la plus grande taille d'effet. Notre connaissance évolutive des mécanismes nociceptifs dans le SNP permettra de développer de nouvelles techniques à l'avenir pour améliorer encore la gestion de la douleur.
TABLE 3. Meilleurs adjuvants antalgiques du système nerveux périphérique par voie d'administration.
| Itinéraire | Agent et dose |
|---|---|
| Périneuronal/périneural | Dexaméthasone 4–10 mg ; buprénorphine 0.3 mg; clonidine 1–2 μg/kg ; tramadol 200mg |
| IVRA | Dexmédétomidine 0.5 μg/kg ; magnésium 1.5 g |
| Intra-articulaire | Clonidine 150 μg ; morphine 5mg |
| Infiltration locale | Kétamine 3 mg/mL |
NB: Plusieurs études rédigées par le Dr S. Reuben qui ont depuis été rétractées ont été référencées dans l'édition précédente de ce texte. Ces références ont été supprimées. Toutes les références restantes dans lesquelles le Dr Reuben a été impliqué qui n'ont pas été rétractées sont toujours référencées.
Références
- Kehlet H, Dahl JB : La valeur de « l'analgésie multimodale » ou « équilibrée » dans le traitement de la douleur postopératoire. Anesth Analg 1993;77:1048–1056.
- Raja SN, Meyer RA, Ringkamp M, et al : mécanismes neuronaux périphériques de la nociception. Dans Wall PD, Melzack R (eds): Textbook of Pain, 4e éd. Churchill-Livingstone, 1999, pp 11–57.
- Dickenson AH : La théorie du contrôle de porte de la douleur résiste à l'épreuve du temps. Br J Anaesth 2002;88:755–757.
- Millan MJ : L'induction de la douleur : Une revue intégrative. Prog Neurobiol 1999;57:1–164.
- Sawynok J: Analgésiques topiques et à action périphérique. Pharmacol Rev 2003;55:1–20.
- Williams BA, Hough KA, Tsui BY, Ibinson JW, Gold MS, Gebhart GF : Neurotoxicité des adjuvants utilisés dans l'anesthésie et l'analgésie périneurales par rapport à la ropivacaïne. Reg Anesth Pain Med 2011; 36(3): 225–230.
- Likar R, Mousa SA, Philippitsch G, et al : l'augmentation du nombre de cellules inflammatoires exprimant des opioïdes n'affecte pas l'analgésie morphinique intra-articulaire. Br J Anaesth 2004;93:375–380.
- Brack A, Rittner HL, Machelska H, et al : Contrôle de la douleur inflammatoire par le recrutement médié par la chimiokine de cellules polymorphonucléaires contenant des opioïdes. Douleur 2004 ; 112 : 229–238.
- Machelska H, Cabot PJ, Mousa SA, et al : Contrôle de la douleur dans l'inflammation régie par les sélectines. Nat Med 1998;4:1425–1428.
- Stein C, Schafer M, Machelska H : Attaquer la douleur à sa source : Nouvelles perspectives sur les opioïdes. Nat Med 2003;9:1003–1008.
- Mousa SA, Zhang Q, Sitte N, et al : les cellules mémoire contenant des bêta-endorphines et les récepteurs mu-opioïdes sont transportés vers les tissus périphériques enflammés. J Neuroimmunol 200;115:71–78.
- Picard PR, Tramer MR, McQuay HJ, et al : Efficacité analgésique des opioïdes périphériques (tous sauf intra-articulaires) : une revue systématique qualitative d'essais contrôlés randomisés. Douleur 1997 ; 72 : 309–318.
- Murphy DB, McCartney CJ, Chan VW : nouveaux adjuvants analgésiques pour le bloc du plexus brachial : une revue systématique. Anesth Analg 2000;90 : 1122–1128.
- Fanelli G, Casati A, Magistris L, et al : le fentanyl n'améliore pas les caractéristiques de bloc nerveux de l'anesthésie du plexus brachial axillaire réalisée avec de la ropivacaïne. Acta Anaesthesiol Scand 2001;45:590–594.
- Karakaya D, Buyukgoz F, Baris S, et al : L'ajout de fentanyl à la bupivacaïne prolonge l'anesthésie et l'analgésie dans le bloc du plexus brachial axillaire. Reg Anesth Pain Med 2001;26:434–438.
- Likar R, Koppert W, Blatnig H, et al : Efficacité de l'analgésie périphérique à la morphine dans les tissus enflammés, non enflammés et périneuraux des patients en chirurgie dentaire. J Pain Symptom Manage 2001;21:330–337.
- Nishikawa K, Kanaya N, Nakayama M, et al : le fentanyl améliore l'analgésie mais prolonge l'apparition du bloc du plexus brachial axillaire par un mécanisme périphérique. Anesth Analg 2000;91:384–387.
- Choyce A, Peng P: Une revue systématique des adjuvants pour l'anesthésie régionale intraveineuse pour les interventions chirurgicales. Can J Anaesth 2002;49 : 32–45.
- Gutstein H, Akil H : Analgésiques opioïdes. Dans Hardman J, Limbird L (eds): Goodman & Gilman's The Pharmacologic Basis of Therapeutics, 10e éd. McGraw-Hill, 2001, p 601.
- Lanz E, Simko G, Theiss D, et al : Buprénorphine péridurale - Une étude en double aveugle sur l'analgésie postopératoire et les effets secondaires. Anesth Analg 1984;63:593–598.
- Candido KD, Winnie AP, Ghaleb AH, et al : la buprénorphine ajoutée à l'anesthésique local pour le bloc du plexus brachial axillaire prolonge l'analgésie postopératoire. Reg Anesth Pain Med 2002;27:162–167.
- Candido KD, Franco CD, Khan MA, et al : buprénorphine ajoutée à l'anesthésique local pour le bloc du plexus brachial afin de fournir une analgésie postopératoire chez les patients ambulatoires. Reg Anesth Pain Med 2001;26:352–356.
- Viel EJ, Eledjam JJ, De La Coussaye JE, et al : bloc du plexus brachial avec des opioïdes pour le soulagement de la douleur postopératoire : comparaison entre la buprénorphine et la morphine. Reg Anesth 1989;14:274–278.
- Bazin JE, Massoni C, Bruelle P, et al : L'ajout d'opioïdes aux anesthésiques locaux dans le bloc du plexus brachial : Les effets comparatifs de la morphine, de la buprénorphine et du sufentanil. Anesthésie 1997 ; 52 : 858–862.
- Alhashemi JA, Kaki AM : Effet de l'administration intrathécale de tramadol sur la douleur postopératoire après résection transurétrale de la prostate. Br J Anaesth 2003;91:536–540.
- Kapral S, Gollmann G, Waltl B, et al : le tramadol ajouté à la mépivacaïne prolonge la durée d'un bloc du plexus brachial axillaire. Anesth Analg 1999;88:853–856.
- Robaux S, Blunt C, Viel E, et al : le tramadol ajouté à 1.5 % de mépivacaïne pour le bloc du plexus brachial axillaire améliore l'analgésie postopératoire en fonction de la dose. Anesth Analg 2004;98:1172–1177.
- Alemmano F, Ghisi D, Fanelli A, et al : Tramodol et lévobupivacaïne à 0.5 % pour le bloc interscalène à injection unique. Minerva Anestesiol 2013;78(3): 291–296.
- Kalso E, Tramer MR, Carroll D, et al : Soulagement de la douleur de la morphine intra-articulaire après une chirurgie du genou : Une revue systématique qualitative. Douleur 1997 ; 71 : 127–134.
- Brandsson S, Karlsson J, Morberg P, et al : morphine intra-articulaire après reconstruction arthroscopique du LCA : une étude en double aveugle contrôlée par placebo de 40 patients. Acta Orthop Scand 2000;71:280–285.
- Rasmussen S, Larsen AS, Thomsen ST, et al : les glucocorticoïdes intra-articulaires, la bupivacaïne et la morphine réduisent la douleur, la réponse inflammatoire et la convalescence après une méniscectomie arthroscopique. Douleur 1998 ; 78 : 131–134.
- Alagol A, Calpur OU, Kaya G, et al : L'utilisation du tramadol intra-articulaire pour l'analgésie postopératoire après une chirurgie arthroscopique du genou : une comparaison de différentes doses intra-articulaires et intraveineuses. Knee Surg Sports Traumatol Arthrosc 2004; 12: 184–188.
- Varrassi G, Marinangeli F, Ciccozzi A, et al : buprénorphine intra-articulaire après arthroscopie du genou. Une étude randomisée, prospective, en double aveugle. Acta Anaesthesiol Scand 1999;43:51–55.
- Vranken JH, Vissers KC, de Jongh R, et al : l'administration intra-articulaire de sufentanil facilite la récupération après une arthroscopie du genou en ambulatoire. Anesth Analg 2001;92:625–628.
- Gupta A, Bodin L, Holmstrom B, Berggren : Une revue systématique des effets analgésiques périphériques de la morphine intra-articulaire. Anesth Analg 2001;93(3):761–770.
- Unnerstall JR, Kopajtic TA, Kuhar MJ : Distribution des sites de liaison des agonistes alpha 2 dans le système nerveux central du rat et de l'homme : analyse de certains corrélats anatomiques fonctionnels des effets pharmacologiques de la clonidine et des agents adrénergiques apparentés. Brain Res 1984;319:69–101.
- Kuraishi Y, Hirota N, Sato Y, et al : Inhibition noradrénergique de la libération de substance P par les afférences primaires dans la corne dorsale de la colonne vertébrale du lapin. Brain Res 1985;359:177–182.
- Fleetwood-Walker SM, Mitchell R, Hope PJ, et al : un récepteur alpha 2 assure la médiation de l'inhibition sélective par la noradrénaline des réponses nociceptives des neurones de la corne dorsale identifiés. Brain Res 1985;334:243–254.
- Baba H, Kohno T, Okamoto M, et al : facilitation muscarinique de la libération de GABA dans la substantia gelatinosa de la corne dorsale de la colonne vertébrale du rat. J Physiol 1998;508:83–93.
- Butterworth JF 5th, Strichartz GR : Les agonistes alpha 2-adrénergiques clonidine et guanfacine produisent un blocage tonique et phasique de la conduction dans les fibres du nerf sciatique du rat. Anesth Analg 1993;76:295–301.
- Gaumann DM, Brunet PC, Jirounek P : La clonidine améliore les effets de la lidocaïne sur le potentiel d'action de la fibre C. Anesth Analg 1992;74:719–725.
- Eisenach JC, Gebhart GF : amitriptyline intrathécale. Interactions antinociceptives avec la morphine intraveineuse et la clonidine intrathécale, la néostigmine et la carbamylcholine chez le rat. Anesthésiologie 1995;83 : 1036–1045.
- Kroin JS, Buvanendran A, Beck DR, et al : la prolongation par la clonidine de l'analgésie à la lidocaïne après un bloc du nerf sciatique chez le rat est médiée par le courant cationique activé par l'hyperpolarisation, et non par les récepteurs alpha-adrénergiques. Anesthésiologie 2004 ; 101 : 488–494.
- Singelyn FJ, Dangoisse M, Bartholomee S, et al : L'ajout de clonidine à la mépivacaïne prolonge la durée de l'anesthésie et de l'analgésie après un bloc du plexus brachial axillaire. Reg Anesth 1992;17:148–150.
- Hutschala D, Mascher H, Schmetterer L, et al : la clonidine ajoutée à la bupivacaïne améliore et prolonge l'analgésie après un bloc du plexus brachial via un mécanisme local chez des volontaires sains. Eur J Anaesthesiol 2004; 21:198–204.
- Culebras X, Van Gessel E, Hoffmeyer P, et al : la clonidine associée à un anesthésique local à longue durée d'action ne prolonge pas l'analgésie postopératoire après un bloc du plexus brachial, mais induit des modifications hémodynamiques. Anesth Analg 2001;92:199–204.
- Popping DM, Elia N, Marret E, Wenk M, Tramer MR. Clonidine en tant qu'adjuvant aux anesthésiques locaux pour les blocs des nerfs périphériques et du plexus : une méta-analyse d'essais randomisés. Anesthésiologie 2009 ;111(2) : 406–415.
- Ilfeld BM, Morey TE, Enneking FK : Perfusion périneurale infraclaviculaire continue avec clonidine et ropivacaïne par rapport à la ropivacaïne seule : étude randomisée, en double aveugle et contrôlée. Anesth Analg 2003;97:706–712.
- Ilfeld BM, Morey TE, Thannikary LJ, et al : Clonidine ajoutée à une perfusion périneurale continue de ropivacaïne interscalène pour améliorer l'analgésie postopératoire : une étude randomisée, en double aveugle et contrôlée. Anesth Analg 2005;100:1172–1178.
- Abdallah FW, Brull R : Effets facilitateurs de la dexmédétomidine périneurale sur le bloc nerveux neuraxial et périphérique : une revue systématique et une méta-analyse. Br J Anaesth 2013;110(6):915–925.
- Alayurt S, Memis D, Pamukcu Z : L'ajout de sufentanil, de tramadol ou de clonidine à la lidocaïne pour l'anesthésie régionale intraveineuse. Anaesth Intensive Care 2004;32:22–27.
- Gentili M, Bernard JM, Bonnet F : L'ajout de clonidine à la lidocaïne pour l'anesthésie régionale intraveineuse prévient la douleur du garrot. Anesth Analg 1999;88:1327–1330.
- Reuben SS, Steinberg RB, Klatt JL, et al : Anesthésie régionale intraveineuse utilisant de la lidocaïne et de la clonidine. Anesthésiologie 1999;91 :654–658.
- Lurie SD, Reuben SS, Gibson CS, et al : effet de la clonidine sur la douleur du garrot des membres supérieurs chez des volontaires sains. Reg Anesth Pain Med 2000;25:502–505.
- Memis D, Turan A, Karamanlioglu B, et al : Ajout de dexmédétomidine à la lidocaïne pour l'anesthésie régionale intraveineuse. Anesth Analg 2004;98:835–840.
- Joshi W, Reuben SS, Kilaru PR, et al : Analgésie postopératoire pour une chirurgie arthroscopique du genou en ambulatoire avec de la clonidine intra-articulaire et/ou de la morphine. Anesth Analg 2000;90:1102–1106.
- Tan PH, Buerkle H, Cheng JT, et al : comparaison parallèle en double aveugle de plusieurs doses d'apraclonidine, de clonidine et de placebo administrées par voie intra-articulaire à des patients subissant une chirurgie arthroscopique du genou. Clin J Pain 2004;20:256–260.
- Gentili M, Juhel A, Bonnet F : Effet analgésique périphérique de la clonidine intra-articulaire. Douleur 1996 ; 64 : 593–596.
- Gentili M, Houssel P, Osman M, et al : La morphine intra-articulaire et la clonidine produisent une analgésie comparable mais la combinaison n'est pas plus efficace. Br J Anaesth 1997;79:660–661.
- Buerkle H, Schapsmeier M, Bantel C, et al : action antinociceptive thermique et mécanique de la clonidine administrée par la colonne vertébrale par rapport à la périphérie dans le modèle d'articulation du genou enflammée chez le rat. Br J Anaesth 1999;83:436–441.
- Stéroïdes corticaux surrénaliens. Dans Faits et comparaisons sur les médicaments, 5e éd. Faits et comparaisons, 1997, pp 122–128.
- De Oliveira GS Jr, Castro-Alves LJ, Ahmad S, Kendall MC, McCarthy RJ : La dexaméthasone pour prévenir les nausées et vomissements postopératoires : une méta-analyse mise à jour d'essais contrôlés randomisés. Anesth Analg 2013;116(1):58–74.
- De Oliveira GS Jr, Almeida MD, Benzon HT, McCarthy RJ : dexaméthasone systémique à dose unique périopératoire pour la douleur postopératoire : une méta-analyse d'essais contrôlés randomisés. Anesthésiologie 2011 ;115(3) : 575–588.
- Attardi B, Takimoto K, Gealy R, Severns C, Levitan ES : Régulation à la hausse induite par les glucocorticoïdes d'un ARNm du canal K+ hypophysaire in vitro et in vivo. Canaux des récepteurs 1993 ; 1 : 287–293.
- Eker HE, Cok OY, Aribogan A, Arslan G : Prise en charge de la douleur neuropathique avec la méthylprednisolone au site de la lésion nerveuse. Pain Med 2012;13:443–451.
- Johansson A, Hao J, Sjolund B : L'application locale de corticostéroïdes bloque la transmission dans les fibres C nociceptives normales. Acta Anaesthesiol Scand 1990;34:335–338.
- Cummings KC 3rd, Napierkowski DE, Parra-Sanchez I, et al : Effet de la dexaméthasone sur la durée des blocs nerveux interscalènes avec la ropivacaïne ou la bupivacaïne. Br J Anaesth 2011;107:446–453.
- Fredrickson MJ, Danesh-Clough TK, White R : Dexaméthasone adjuvante pour les blocs sciatiques et de la cheville à la bupivacaïne : résultats de 2 essais randomisés contrôlés par placebo. Reg Anesth Pain Med 2013;38(4):300–307.
- Movafegh A, Razazian M, Hajimaohamadi F, Meysamie A : la dexaméthasone ajoutée à la lidocaïne prolonge le bloc du plexus brachial axillaire. Anesth Analg 2006;102:263–267.
- Parrington SJ, O'Donnell D, Chan VW, et al : la dexaméthasone ajoutée à la mépivacaïne prolonge la durée de l'analgésie après un bloc du plexus brachial supraclaviculaire. Reg Anesth Pain Med 2010;35:422–426.
- Tandoc MN, Fan L, Kolesnikov S, Kruglov A, Nader ND : la dexaméthasone adjuvante avec de la bupivacaïne prolonge la durée du bloc interscalène : un essai prospectif randomisé. J Anesth 2011;25:704–709.
- Vieira PA, Pulai I, Tsao GC, Manikantan P, Keller B, Connelly NR. La dexaméthasone associée à la bupivacaïne augmente la durée de l'analgésie dans le bloc du plexus brachial interscalénique guidé par échographie. Eur J Anaesthesiol 2010;27:285–288.
- Desmet M, Braems H, Reynvoet M, et al : la dexaméthasone IV et périneurale sont équivalentes pour augmenter la durée analgésique d'un bloc interscalène à injection unique avec de la ropivacaïne pour la chirurgie de l'épaule : une étude prospective, randomisée et contrôlée par placebo. Frère J Anaesth 2013 ; 111(3):445–452. Epub avant impression.
- Thangaswamy CR, Rewari V, Trikha A, Dehran M, Chandralekha : Dexaméthasone avant hystérectomie laparoscopique totale : Une étude dose-réponse contrôlée randomisée. J Anesth 2010;24:24–30.
- Worni M, Schudel HH, Seifert E, et al : Essai contrôlé randomisé sur une dose unique de stéroïdes avant la thyroïdectomie pour une maladie bénigne afin d'améliorer les nausées, la douleur et la fonction vocale postopératoires. Ann Surg 2008;248 : 1060–1066.
- Taniguchi M, Bollen AW, Drasner K. Bisulfite de sodium : bouc émissaire de la neurotoxicité de la chloroprocaïne ? Anesthésiologie 2004;100(1):85–91.
- Bigat Z, Boztug N, Hadimioglu N, Cete N, Coskunfirat N, Ertok E : La dexaméthasone améliore-t-elle la qualité de l'anesthésie et de l'analgésie régionales intraveineuses ? Une étude clinique randomisée et contrôlée. Anesth Analg 2006;102(2):605–609.
- Coderre TJ, Katz J, Vaccarino AL, et al : Contribution de la neuroplasticité centrale à la douleur pathologique : Examen des preuves cliniques et expérimentales. Douleur 1993 ; 52 : 259–285.
- Price DD, Mao J, Mayer DJ : Mécanismes neuronaux centraux des états douloureux normaux et anormaux. Dans Fields HL, Liebskind JC (éd.) : Progrès dans la recherche et la gestion de la douleur. Presse IASP, 1994 ; 61–84.
- Dickenson AH, Chapman V, Green GM : La pharmacologie des événements médiés par les acides aminés excitateurs et inhibiteurs dans la transmission et la modulation de la douleur dans la moelle épinière. Gen Pharmacol 1997;28 : 633–638.
- Alfredson H, Forsgren S, Thorsen K, et al : récepteurs du glutamate NMDAR1 localisés sur les nerfs des tendons d'Achille humains. Implications pour le traitement? Knee Surg Sports Traumatol Arthrosc 2001;9:123–126.
- Cairns BE, Hu JW, Arendt-Nielsen L, et al : Différences liées au sexe dans la douleur humaine et la décharge afférente chez le rat évoquées par l'injection de glutamate dans le muscle masséter. J Neurophysiol 2001;86:782–791.
- Svensson P, Cairns BE, Wang K, et al : L'injection de facteur de croissance nerveuse dans le muscle masséter humain évoque une allodynie et une hyperalgésie mécaniques de longue durée. Douleur 2003 ; 104 : 241–247.
- Cairns BE, Svensson P, Wang K, et al : L'activation des récepteurs NMDA périphériques contribue à la douleur humaine et aux décharges afférentes du rat évoquées par l'injection de glutamate dans le muscle masséter. J Neurophysiol 2003;90:2098–2105.
- Tverskoy M, Oren M, Vaskovich M, et al : la kétamine améliore les effets anesthésiques et analgésiques locaux de la bupivacaïne par un mécanisme périphérique : une étude chez des patients postopératoires. Neurosci Lett 1996;215:5–8.
- Amiot JF, Bouju P, Palacci JH, et al : Anesthésie régionale intraveineuse à la kétamine. Anesthésie 1985;40 :899–901.
- Gorgias NK, Maidatsi PG, Kyriakidis AM, et al : Clonidine versus kétamine pour prévenir la douleur du garrot pendant l'anesthésie régionale intraveineuse avec de la lidocaïne. Reg Anesth Pain Med 2001;26:512–517.
- Dal D, Tetik O, Altunkaya H, et al : L'efficacité de la kétamine intra-articulaire pour l'analgésie postopératoire en chirurgie arthroscopique ambulatoire. Arthroscopie 2004 ;20 : 300–305.
- Brill S, McCartney CJ, Sawyer R, et al : Analgésie intra-articulaire à la kétamine après une arthroscopie du genou : une étude de recherche de dose. Pain Clin 2005;17 : 25–29.
- Turan A, Memis D, Karamanlioglu B, et al : Anesthésie régionale intraveineuse utilisant de la lidocaïne et du magnésium. Anesth Analg 2005;100 : 1189–1192.
- Reuben SS, Steinberg RB, Kreitzer JM, et al : Anesthésie régionale intraveineuse utilisant de la lidocaïne et du kétorolac. Anesth Analg 1995;81 : 110–113.
- Steinberg RB, Reuben SS, Gardner G : La relation dose-réponse du kétorolac en tant que composant de l'anesthésie régionale intraveineuse avec la lidocaïne. Anesth Analg 1998;86:791–793.
- Corpataux JB, Van Gessel EF, Donald FA, et al : effet sur l'analgésie postopératoire de l'acétylsalicylate de lysine à petite dose ajouté à la prilocaïne pendant l'anesthésie régionale intraveineuse. Anesth Analg 1997;84:1081–1085.
- Reuben SS, Duprat KM : Comparaison de l'infiltration de la plaie avec le kétorolac par rapport à l'anesthésie régionale intraveineuse avec le kétorolac pour l'analgésie postopératoire après une chirurgie ambulatoire de la main. Reg Anesth 1996;21:565–568.
- Ben-David B, Katz E, Gaitini L, et al : comparaison de l'IM et de l'infiltration locale de kétorolac avec et sans anesthésie locale. Br J Anaesth 1995;75:409–412.
- Connelly NR, Reuben SS, Albert M, et al : Utilisation du kétorolac pré-incisionnel chez les patients atteints d'hernie : site intraveineux par rapport au site chirurgical. Reg Anesth 1997; 22:229–232.
- Bosek V, Cox CE : Comparaison de l'effet analgésique du kétorolac administré localement et systémiquement chez les patientes ayant subi une mastectomie. Ann Surg Oncol 1996;3:62–66.
- Van Elstraete AC, Pastureau F, Lebrun T, et al : néostigmine ajoutée au bloc du plexus axillaire à la lidocaïne pour l'analgésie postopératoire. Eur J Anaesthesiol 2001;18:257–260.
- Bone HG, Van Aken H, Booke M, et al : Amélioration de l'anesthésie par bloc du plexus brachial axillaire par coadministration de néostigmine. Reg Anesth Pain Med 1999;24:405–410.
- Turan A, Karamanlyoglu B, Memis D, et al : anesthésie régionale intraveineuse utilisant la prilocaïne et la néostigmine. Anesth Analg 2002;95(5): 1419–1422.
- McCartney CJ, Brill S, Rawson R, et al : Aucun avantage anesthésique ou analgésique de la néostigmine 1 mg ajoutée à l'anesthésie régionale intraveineuse avec de la lidocaïne à 0.5 % pour la chirurgie de la main. Reg Anesth Pain Med 2003;28 : 414–417.
- Yang LC, Chen LM, Wang CJ, et al : Analgésie postopératoire par néostigmine intra-articulaire chez les patients subissant une arthroscopie du genou. Anesthésiologie 1998 ;88 : 334–339.
- Gentili M, Enel D, Szymskiewicz O, et al : Analgésie postopératoire par clonidine intra-articulaire et néostigmine chez des patients subissant une arthroscopie du genou. Reg Anesth Pain Med 2001;26:342–347.
Colin JL McCartney et Stephen Choi