Malikah Latmore, Matthew Levine et Jeff Gadsden
INTRODUCTION
Les patients atteints d'une maladie systémique concomitante peuvent présenter un risque plus élevé de complications périopératoires spécifiques liées à la chirurgie et à l'anesthésie. L'anesthésie régionale est souvent considérée comme étant particulièrement bénéfique pour les patients. Cependant, les changements physiologiques qui se produisent avec certaines techniques d'anesthésie régionale doivent être compris et considérés dans le contexte de la physiopathologie d'un patient individuel afin que la technique utilisée procure un bénéfice maximal au patient et réduise le risque de complications. Ce chapitre se concentre sur la physiopathologie des maladies systémiques fréquemment rencontrées par l'anesthésiste régional et discute de l'interaction entre les techniques courantes d'anesthésie régionale et la maladie du patient.
MALADIE PULMONAIRE
Les patients chirurgicaux présentant une insuffisance pulmonaire concomitante sont à risque de complications pulmonaires peropératoires ou postopératoires, quelle que soit la technique d'anesthésie. Un nombre croissant de preuves suggèrent que l'anesthésie régionale peut être associée à de meilleurs résultats pulmonaires par rapport à l'anesthésie générale. Cependant, le bloc anesthésique régional peut comporter des risques chez certains patients. Une compréhension approfondie de la physiologie respiratoire et des implications des techniques d'anesthésie régionale est essentielle à l'utilisation sûre et efficace de l'anesthésie régionale chez ces patients.
Anesthésie péridurale et rachidienne
La plupart des effets pulmonaires de l'anesthésie neuraxiale sont dus au blocage moteur de la musculature intercostale et abdominale. Si une absorption systémique importante d'anesthésique local se produit, une dépression respiratoire myonurale centrale et directe peut également être observée, bien que cela joue un rôle mineur dans l'ensemble. Étant donné que l'anesthésie neuraxiale produit un bloc "différentiel" de fibres motrices, sensorielles et autonomes, le degré d'altération de la fonction respiratoire dépend de l'étendue relative du bloc moteur segmentaire. L'utilisation de concentrations diluées d'anesthésique local péridural peut fournir un blocage sensoriel adéquat aussi haut que les niveaux cervicaux, tout en épargnant la fonction motrice des muscles respiratoires dans les segments somatiques inférieurs. La paralysie diaphragmatique (bloc du nerf phrénique, C3-C5) en l'absence de rachianesthésie totale ne se produit pas avec le bloc neuraxial, car même un bloc sensoriel aussi élevé que C3 ne produira un bloc moteur qu'à environ T1 à T3. L'apnée suivant une anesthésie neuraxiale haute est très probablement précipitée par une hypoperfusion du tronc cérébral à la suite d'une hypotension et il est peu probable qu'elle soit liée à un bloc du nerf phrénique. La respiration spontanée revient après une réanimation volumique adéquate et/ou un traitement vasopresseur.
Conseils NYSORA
- L'apnée associée à une rachianesthésie haute est le plus souvent liée à une hypotension et une hypoperfusion du tronc cérébral, plutôt qu'à un bloc moteur des racines nerveuses irriguant le nerf phrénique (C3–5).
- Soutenir la ventilation tout en maintenant la pression artérielle avec des liquides et un traitement vasopresseur est la stratégie de réanimation clé.
Avec un niveau élevé d'anesthésie péridurale ou rachidienne, la musculature de la paroi thoracique et les muscles intercostaux peuvent être altérés. Cela peut même entraîner une altération du mouvement de la paroi thoracique pendant la respiration spontanée. Au cours d'une anesthésie neuraxiale haute, la paroi thoracique la plus souple est rétractée pendant l'inspiration et peut en fait afficher un mouvement paradoxal de la cage thoracique. Certains, cependant, ont découvert que le blocage péridural aux niveaux sensoriels de T6 ou même de T1 peut augmenter la contribution de l'expansion de la paroi thoracique au volume courant. Cela peut s'expliquer par un bloc moteur incomplet des muscles intercostaux hauts ou par le rôle compensateur joué par les muscles « accessoires » de la respiration, comme les scalènes antérieur et moyen.
L'anesthésie péridurale lombaire n'affecte pas la ventilation minute au repos, le volume courant ou la fréquence respiratoire. De même, la capacité résiduelle fonctionnelle (CRF) et la capacité de fermeture semblent être relativement inchangées pendant l'anesthésie péridurale lombaire. Tests de la fonction respiratoire dépendant de l'effort, tels que le volume expiratoire maximal en une seconde (FEV1), la capacité vitale forcée et le débit expiratoire de pointe, présentent des diminutions modestes dans le cadre du bloc épidural lombaire, reflétant la dépendance de ces indices sur la musculature intercostale et abdominale. Cette diminution de la fonction pulmonaire augmente proportionnellement au fur et à mesure que le bloc progresse de façon céphalique des régions lombaires inférieures vers supérieures.
L'anesthésie péridurale thoracique n'a aucun effet sur la ventilation minute, le volume courant ou la fréquence respiratoire, mais entraîne une légère diminution de la capacité vitale (VC), VEMS1, la capacité pulmonaire totale et le débit moyen expiratoire maximal (Tableau 1). Même une anesthésie péridurale cervicale basse/thoracique haute (C4-T9) chez les patientes atteintes d'une maladie pulmonaire obstructive chronique (MPOC) sévère subissant une chirurgie mammaire ne produit qu'une très légère diminution du VEMS1. Une étude volontaire a révélé qu'une anesthésie épidurale thoracique élevée (niveau sensoriel T1) entraînait une augmentation de la CRF d'environ 15 % sans modification du volume courant ou de la fréquence respiratoire. Ce résultat quelque peu surprenant peut s'expliquer par deux mécanismes proposés par les chercheurs. Premièrement, la plupart des volontaires ont présenté une diminution du volume sanguin intrathoracique, un phénomène physiologique confirmé par Arndt et ses collègues. Deuxièmement, l'étude a également révélé que la position de fin d'expiration du diaphragme était décalée caudalement, ce qui peut être lié à une augmentation relative de l'activité tonique diaphragmatique ou à une réduction de la pression intra-abdominale.
TABLE 1. L'eet de l'anesthésie péridurale sur les volumes et la mécanique des respirateurs.
| VC | TLC | FRC | VT | RR | MV | FEV1 | CVF | PEF | |
|---|---|---|---|---|---|---|---|---|---|
| LEA | ↔ | ↔ | ↔ | ↔ | ↔ | ↔ | ↓ | ↓ | ↓ |
| TEA | ↓ | ↓ | ↑ | ↔ | ↔ | ↔ | ↓ | ↓ | ↓ |
L'anesthésie péridurale cervicale réduit la CV et le VEMS1 à un degré similaire à celui des péridurales thoraciques hautes qui s'étendent aux niveaux cervicaux inférieurs. Des études sur des patients en bonne santé ont démontré une réduction de 15 à 30 % de la CV et du VEMS1 avec des péridurales cervicales (bloc sensoriel à C2) qui variaient selon le niveau et la concentration d'anesthésique local.
La réponse ventilatoire à l'hypercapnie et à l'hypoxie est préservée avec l'anesthésie neuraxiale. Les pressions partielles d'oxygène (Po2) et de dioxyde de carbone (Pco2) sont essentiellement inchangées pendant l'anesthésie péridurale ou rachidienne. De plus, le tonus bronchomoteur n'est pas altéré de manière significative, malgré les préoccupations théoriques de bronchoconstriction secondaire à la sympatholyse. En effet, l'anesthésie péridurale a été utilisée avec succès chez les patients à haut risque atteints de MPOC et d'asthme subissant des opérations abdominales.
Il a été démontré que l'anesthésie neuraxiale dans un certain nombre de contextes entraîne une réduction des complications pulmonaires postopératoires par rapport à l'anesthésie générale. Perlas et ses collègues ont signalé une association entre la rachianesthésie et une mortalité inférieure à 30 jours. Les raisons sous-jacentes sont probablement multifactorielles, en partie dues à une analgésie supérieure, à une diminution de l'atteinte diaphragmatique, à une réponse au stress altérée et à une diminution de l'incidence de l'hypoxémie postopératoire. L'anesthésie péridurale offre un contrôle supérieur de la douleur par rapport à l'anesthésie générale avec des opioïdes postopératoires pour la chirurgie abdominale et thoracique, ce qui conduit à une attelle réduite, un mécanisme de toux plus efficace et des volumes pulmonaires postopératoires préservés, y compris la FRC et la VC. Une étude comparant directement l'anesthésie péridurale et générale chez les patients à haut risque a conclu que les résultats globaux, y compris la nécessité d'une ventilation postopératoire prolongée, étaient améliorés avec la technique régionale. Un autre essai portant sur des patients subissant une chirurgie vasculaire des membres inférieurs a rapporté une réduction de plus de 50 % de l'incidence de l'insuffisance respiratoire dans le groupe randomisé pour l'anesthésie péridurale.
Les patients subissant une réparation de fractures de la hanche bénéficient également d'une anesthésie régionale. Neumann et al. ont comparé l'anesthésie neuraxiale à l'anesthésie générale pour la réparation des fractures de la hanche chez plus de 18,000 25 patients et ont constaté une réduction de 141 % des complications pulmonaires chez ceux qui ont reçu des techniques neuraxiales. Une méta-analyse de 9000 essais randomisés (incluant plus de 55 patients) comparant l'anesthésie régionale et générale pour la chirurgie de la hanche a montré une réduction du risque d'embolie pulmonaire, de pneumonie et de dépression respiratoire de 39 %, 59 % et XNUMX %, respectivement, avec le anesthésie régionale. Fait intéressant, ces résultats sont restés inchangés, que l'anesthésie neuraxiale ait été poursuivie ou non dans la période postopératoire, illustrant que l'effet bénéfique de l'anesthésie péridurale et rachidienne sur la physiologie pulmonaire se produit, au moins en partie, au moment de l'insulte chirurgicale.
Bloc du plexus brachial
En l'absence de complications rares telles que le pneumothorax, toute altération de la mécanique respiratoire observée avec le bloc du plexus brachial est principalement due au bloc du nerf phrénique et à la paralysie hémidiaphragmatique (Figure 1). Il a été démontré que cela se produit chez 100 % des patients recevant un bloc interscalénique lorsqu'il est effectué sans guidage échographique et en utilisant entre 34 et 52 mL d'anesthésique local. Lorsqu'une parésie diaphragmatique se produit, il y a une réduction associée de 27 % de la CVF et du VEMS1. Bien que la signification clinique de cette réduction chez les patients en bonne santé ne soit pas entièrement claire, il peut être utile de stratifier les risques des patients sur le point de subir des blocs interscalènes comme on le ferait pour un patient subissant une résection pulmonaire. En d'autres termes, posez la question : « Ce patient tolérera-t-il un VEMS périopératoire ?1 réduction de 27 % ? »
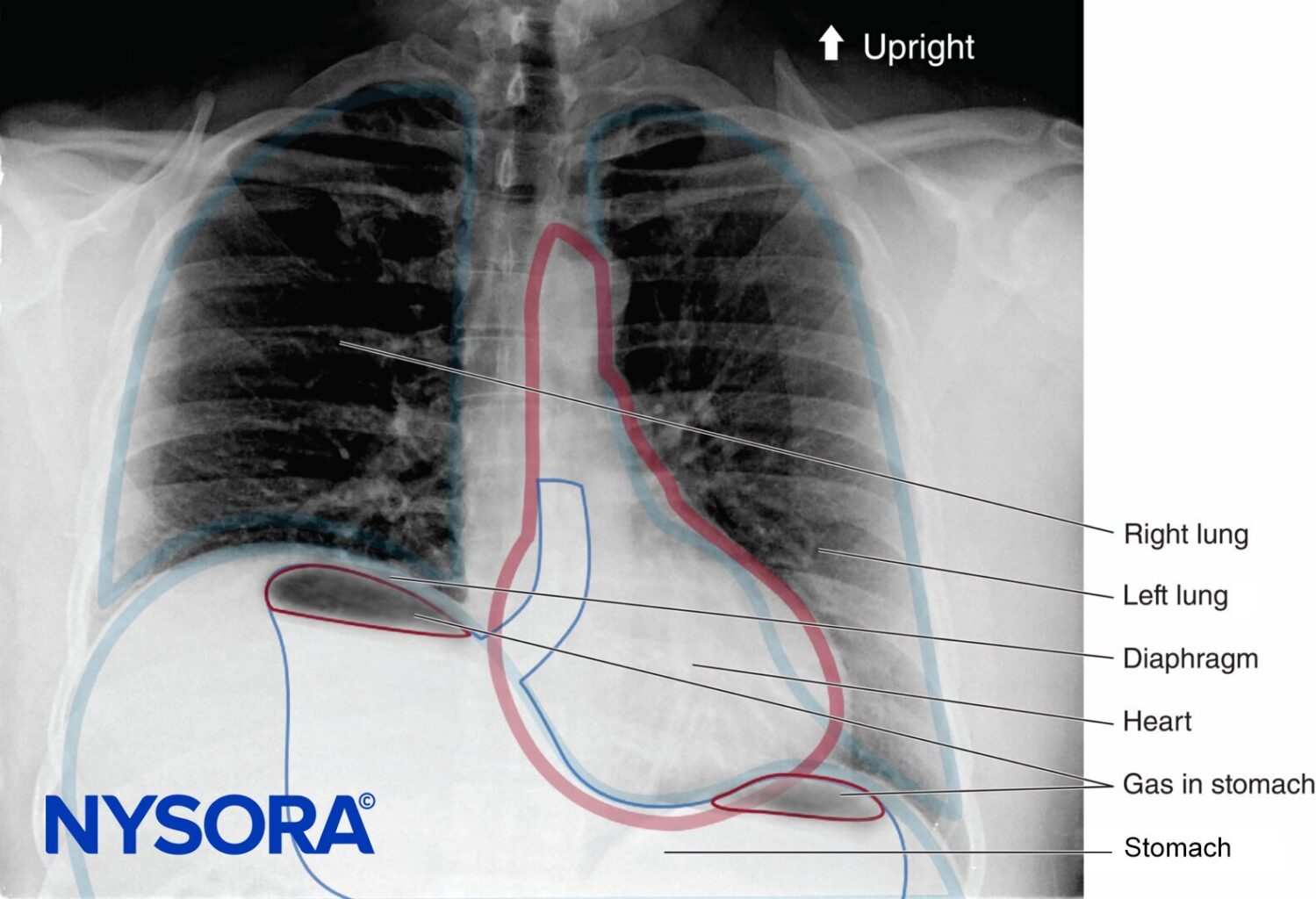
FIGURE 48-1. Radiographie thoracique debout d'un patient ayant subi un bloc du plexus brachial interscalénique droit. Notez l’hémidiaphragme droit surélevé.
Certains chercheurs ont tenté de réduire l'incidence de la paralysie du nerf phrénique en diminuant le volume d'anesthésique local. Cependant, Sinha et al. n'ont trouvé aucune réduction de l'incidence de la parésie hémidiaphragmatique (mesurée par ultrasons) lorsque le volume de ropivacaïne 0.5 % était réduit de 20 mL à 10 mL. D'autres ont rapporté que la réduction du volume à 5 mL diminue l'incidence de 45 % à 50 % et entraîne une diminution significative du VEMS.1 et le débit expiratoire de pointe (PEF). De faibles volumes d'anesthésique local ne garantissent pas la préservation de la fonction du nerf phrénique. Une atteinte respiratoire cliniquement significative nécessitant une intubation trachéale a été rapportée à la suite d'un bloc interscalénique du plexus brachial utilisant un volume de 3 mL de mépivacaïne à 2 %.
Conseils NYSORA
- Le bloc interscalénique avec de faibles volumes (≤ 5 ml) d'anesthésique local peut réduire, mais pas éliminer, le risque de bloc phrénique et de parésie diaphragmatique.
- Par conséquent, le bloc interscalénique du plexus brachial doit être évité chez les patients qui ne peuvent pas tolérer une diminution de 25 % de la fonction respiratoire.
Le risque de bloc nerveux phrénique diminue à mesure que l'on se déplace plus distalement le long du plexus. L'approche axillaire du plexus brachial n'a aucun effet sur la fonction du diaphragme et représente un bon choix pour les patients ayant une réserve pulmonaire marginale (c'est-à-dire ne pouvant tolérer une réduction de 27 % de la fonction pulmonaire). D'autre part, le bloc supraclaviculaire a été traditionnellement associé à une incidence de 50 % à 67 % de paralysie hémidiaphragmatique, bien que des études récentes aient montré qu'avec le guidage échographique, l'incidence peut être aussi faible que zéro. L'abord sous-claviculaire est probablement suffisamment éloigné du trajet du nerf phrénique pour épargner le diaphragme,40,41 bien qu'il existe des rapports de cas d'atteinte du nerf phrénique.42,43 Ces divergences sont probablement liées aux différents abords du bloc sous-claviculaire, par exemple le « bloc coracoïde » est réalisé avec un site de ponction relativement latéral ou distal, alors que le bloc sous-claviculaire vertical débute à une localisation plus médiale. Il peut également y avoir des variations anatomiques dans le parcours du nerf phrénique, comme un nerf phrénique accessoire, ce qui le rendrait plus susceptible de se bloquer à des niveaux plus distaux du plexus brachial.44
Bien que les blocs sous-claviculaires ou axillaires puissent être souhaitables pour leurs profils d'épargne pulmonaire relatifs, ils présentent l'inconvénient de fournir une anesthésie incomplète pour l'épaule et nécessitent un degré d'expertise plus élevé pour être réalisés. Cependant, des solutions créatives ont été employées pour contourner ce problème. Martinez et ses collègues ont combiné un bloc sous-claviculaire avec un bloc nerveux supra-scapulaire pour une chirurgie urgente de la tête humérale chez un patient souffrant d'asthme aigu et d'un VEMS de base1 de 1.13 L (prévision de 32 %). L'association des blocs axillaires et suprascapulaires a également été proposée comme alternative au bloc interscalénique. Par conséquent, une sélection soigneusement réfléchie de blocs nerveux périphériques peut fournir une anesthésie complète du membre supérieur tout en évitant les complications respiratoires chez les patients atteints de maladie pulmonaire.
Les blocs continus du plexus brachial avec des cathéters périneuraux peuvent prolonger les avantages du bloc du plexus dans la période postopératoire et réduire la douleur postopératoire, les besoins en opioïdes oraux et leurs effets secondaires, ainsi que les troubles du sommeil après une chirurgie de l'épaule. Cependant, il y a eu des rapports de complications attribuées à la parésie prolongée du nerf phrénique qui peuvent survenir avec cette technique. Ceux-ci ont inclus des douleurs thoraciques, une atélectasie, un épanchement pleural et une dyspnée. Ceci est particulièrement préoccupant car de nombreux patients rentrent chez eux avec des cathéters et peuvent ne pas avoir accès à une intervention rapide si ces complications surviennent. D'autre part, le degré d'insuffisance respiratoire cliniquement significative avec bloc interscalénique continu varie selon les patients et, en fait, le bloc interscalénique peut être bien toléré, en particulier si l'on utilise des concentrations relativement diluées d'anesthésique local qui ne fournissent qu'un bloc nerveux phrénique partiel. Maurer et associés ont rapporté le cas d'un patient sans maladie pulmonaire préexistante qui a subi une arthroplastie bilatérale de l'épaule sous bloc interscalénique continu bilatéral combiné et anesthésie générale. L'analgésie postopératoire a été maintenue à l'hôpital pendant 72 heures via les cathéters en utilisant des perfusions de 7 mL/h de ropivacaïne à 0.2 % pour chaque côté (total 14 mL/h). Malgré une réduction postopératoire marquée de la CVF (60 %) par rapport au départ ainsi que des preuves échographiques d'une atteinte diaphragmatique, le patient a eu une évolution postopératoire sans incident (avec une excellente analgésie) et une bonne récupération. Cet exemple anecdotique illustre que la signification clinique de la parésie phrénique chez les patients ayant une bonne fonction respiratoire est discutable. Quoi qu'il en soit, l'utilisation de techniques continues du plexus brachial doit être soigneusement envisagée chez les patients présentant une maladie pulmonaire préexistante, en particulier s'ils doivent être renvoyés chez eux avec les cathéters in situ. D'autres complications pouvant avoir des implications pulmonaires comprennent la migration interpleurale, péridurale ou même intrathécale du cathéter et l'irritation du nerf phrénique.
Conseils NYSORA
- Les conséquences cliniques de la phrénique chez les patients ayant une fonction respiratoire normale sont généralement asymptomatiques ou légères.
- L'utilisation de techniques continues du plexus brachial doit être soigneusement envisagée chez les patients présentant une maladie pulmonaire significative préexistante.
- Lorsque cela est indiqué, le cathéter peut être bolus avec une petite quantité d'anesthésique local à courte durée d'action (par exemple, 2 % de chloro-procaïne 5 ml) pour évaluer l'effet sur la fonction respiratoire avant d'utiliser des anesthésiques locaux à longue durée d'action.
- Chez les patients symptomatiques porteurs d'une sonde à demeure, une injection de NaCl à 0.9 % peut raccourcir la durée du bloc phrénique (et du plexus brachial) (« lavage »).
Blocs nerveux paravertébraux et intercostaux
Plusieurs études ont étudié les effets des blocs paravertébraux et intercostaux sur la fonction pulmonaire chez les patients présentant des fractures des côtes ou ceux subissant une thoracotomie. Il a été démontré que le blocage intercostal améliore la saturation artérielle en oxygène (Sao2) et le débit expiratoire de pointe (PEFR) chez les patients souffrant de fractures costales traumatiques associées à une douleur intense. En plus d'une fonction pulmonaire améliorée, certaines études ont révélé une amélioration significative du contrôle de la douleur et une réduction de la durée du séjour à l'hôpital après la pose d'un cathéter intercostal. De même, Kar-makar et ses co-chercheurs ont découvert qu'un bloc paravertébral continu sur une période de quatre jours chez des patients présentant plusieurs côtes fracturées entraînait une amélioration significative de la fréquence respiratoire, FVC, PEFR, Sao2, et le rapport de la pression partielle d'oxygène à la fraction d'oxygène inspiré ( Pao2:Fio2). Ces résultats sont probablement liés à l'effet favorable de l'analgésie sur les efforts respiratoires du patient et à l'amélioration de la mécanique respiratoire, facilitant le sevrage de l'assistance respiratoire et le retour aux activités de la vie quotidienne chez des patients autrement en détresse à cause de leurs blessures.
Les blocs paravertébraux sont efficaces pour la gestion de la douleur après thoracotomie et peuvent améliorer de manière significative la spirométrie postopératoire. Une revue de 55 essais contrôlés randomisés de techniques analgésiques après thoracotomie postérolatérale a révélé que le bloc paravertébral était la méthode qui préservait le mieux la fonction pulmonaire par rapport à l'analgésie intercostale ou péridurale. Les résultats combinés ont montré une préservation moyenne d'environ 75 % de la fonction pulmonaire préopératoire lorsque l'analgésie paravertébrale était utilisée contre 55 % pour l'analgésie intercostale et péridurale. De plus, Davies et al ont montré que même lorsqu'une analgésie comparable était obtenue avec un bloc paravertébral et une péridurale thoracique, le profil d'effets secondaires avec un bloc paravertébral était significativement meilleur, entraînant moins de complications pulmonaires et moins d'hypotension, de nausées et de rétention urinaire. On ne sait pas pourquoi le bloc paravertébral pourrait entraîner une amélioration du PEFR et de la SaO2 par rapport à l'analgésie péridurale dans cette étude et d'autres, mais cela peut être lié à l'utilisation accrue d'opioïdes, à une incidence plus élevée de nausées et de vomissements et à la présence de muscle intercostal bilatéral blocage (et donc une diminution de la mobilité de la paroi thoracique) dans les cohortes péridurales.
Conseils NYSORA
- Le bloc paravertébral ou intercostal offre une excellente analgésie après une fracture costale et une thoracotomie.
- Ces blocs entraînent également une amélioration de la spirométrie et des résultats pulmonaires.
Complications pulmonaires non liées au bloc de conduction
Les complications pulmonaires liées à l'utilisation des techniques d'anesthésie régionale se répartissent en deux catégories. Les premiers sont ceux liés directement ou indirectement aux changements physiologiques qui se produisent avec le bloc lui-même. Les exemples incluent l'atélectasie et la pneumonie résultant d'une incapacité à mobiliser les sécrétions. La deuxième catégorie comprend ceux qui sont indépendants de l'effet du bloc, et bien qu'il y ait des rapports sporadiques de complications rares telles que l'hémorragie pulmonaire et le chylothorax, le plus courant d'entre eux est le pneumothorax. Sans surprise, les pneumothorax surviennent le plus souvent lorsque le site de ponction recouvre la plèvre, et en particulier lors de la réalisation de blocs supraclaviculaires et intercostaux. L'incidence globale signalée est faible, mais les chiffres réels sont probablement sous-déclarés, car de nombreuses ponctions pleurales entraîneront de petits pneumothorax qui se résorbent spontanément. Les raffinements des techniques infraclaviculaires publiées précédemment sur la base d'études IRM et l'utilisation généralisée du guidage échographique peuvent conférer une sécurité supplémentaire à ces procédures, bien qu'il soit important de noter que des pneumothorax ont été signalés avec des techniques guidées par ultrasons, soulignant le fait que le guidage échographique est un système imparfait. moyens de prévenir les événements indésirables.
MALADIE RÉNALE
La dysfonction rénale est couramment présente dans la population chirurgicale. Les lésions rénales aiguës périopératoires représentent environ 50 % de tous les patients nécessitant une hémodialyse aiguë aux États-Unis. Les patients atteints d'insuffisance rénale chronique se présentent fréquemment pour des procédures telles que la création de shunts vasculaires et la revascularisation des membres inférieurs. Les techniques d'anesthésie régionale sont souvent des options idéales pour anesthésier ces patients et ces procédures.
Effet de l'anesthésie régionale sur la fonction rénale
Le traitement des patients à risque de dysfonction rénale périopératoire doit reposer sur deux principes : éviter les agents néphrotoxiques et maintenir la perfusion rénale. Les anesthésiques locaux ne possèdent pas de propriétés néphrotoxiques en soi et, en fait, il a été démontré que la co-administration de procaïne atténue certains des effets néphrotoxiques du cisplatine chez le rat. L'effet de l'hypotension induite par l'anesthésie sur le débit sanguin rénal est plus pertinent. Les reins sont capables d'autorégulation sur une grande variété de pressions artérielles moyennes (environ 80 à 180 mmHg) et maintiennent le débit de filtration glomérulaire (DFG) par des modifications autonomes de la résistance vasculaire rénale. En dessous de la soi-disant limite inférieure d'autorégulation, le rein commence à arrêter ses processus physiologiques dépendants de l'énergie, et le DFG et le débit urinaire chutent en conséquence. En fin de compte, si rien n'est fait, une ischémie rénale se développe, en particulier dans la médullaire rénale sensible. Bien que l'anesthésie neuraxiale et la sympathectomie concomitante puissent réduire la pression artérielle moyenne (PAM), le débit sanguin rénal est souvent préservé. On pense que cela reflète une augmentation du volume systolique ventriculaire gauche en réponse à la baisse de la résistance vasculaire systémique (RVS). Rooke et ses collègues ont étudié les réponses hémodynamiques et la perfusion des organes abdominaux (mesurées par scintigraphie) chez 15 patients subissant une rachianesthésie à la lidocaïne avec un bloc sensoriel allant de T1 à T10. Alors que la PAM et la RVS ont chuté en moyenne de 33 % et 26 %, respectivement, le volume sanguin dans les reins a augmenté d'environ 10 %. Cependant, il peut y avoir des limites au degré de compensation offert par le débit cardiaque. Une étude utilisant un modèle de primate a montré que bien que le débit sanguin rénal ait été peu affecté par la rachianesthésie T10, il était significativement réduit par un bloc sensoriel T1. Cette découverte illustre à nouveau que les niveaux d'anesthésie neuraxiale lombaire et bas-thoracique chez les patients atteints de maladie rénale sont bien tolérés physiologiquement et que des changements significatifs ne commencent à se manifester que lorsque des niveaux plus élevés sont atteints.
Le système rénine-angiotensine, qui est initié dans le rein en réponse à une réduction de la perfusion rénale, joue un rôle important dans l'homéostasie de la pression artérielle. Il sert de mécanisme humoral complémentaire aux systèmes nerveux sympathiques. Hopf et ses collègues ont mené une étude pour déterminer si l'anesthésie péridurale thoracique supprimait la réponse de la rénine à l'hypotension induite. Les concentrations plasmatiques de rénine et de vasoprésine ont été mesurées avant, pendant et après une provocation hypotensive au nitroprussiate chez des patients avec et sans anesthésie péridurale thoracique (niveaux sensoriels T1 à T11). Avec un système nerveux sympathique intact (c'est-à-dire sans péridurale), les niveaux de rénine plasmatique ont doublé en réponse à la provocation hypotensive d'une durée de 15 minutes. En revanche, il n'y avait pas de changement dans la concentration de rénine lorsque l'hypotension était induite à la même PAM dans la cohorte péridurale. Cela suggère que les fibres sympathiques jouent un rôle clé dans le système rénine-angiotensine et que l'anesthésie péridurale thoracique interfère avec l'intégrité fonctionnelle de ce système.
Conseils NYSORA
- Niveaux lombaire et bas-thoracique de l'anesthésie neuraxiale significativement de l'hémodynamique rénale.
Pour des raisons évidentes, la fonction rénale postopératoire est au premier plan des préoccupations lors de l'administration d'anesthésie chez les receveurs d'une transplantation rénale. Plusieurs études ont examiné l'effet de l'anesthésie générale par rapport à l'anesthésie régionale (ou péridurale/générale combinée) sur la fonction rénale postopératoire dans ce contexte. Bien qu'il ait été démontré que l'anesthésie régionale réduisait la réponse au stress à la chirurgie de transplantation rénale et améliorait le contrôle de la douleur postopératoire, il n'a pas été démontré que la technique anesthésique avait un effet sur le résultat de la greffe chez les populations adultes ou pédiatriques. De plus, le choix de la technique d'anesthésie pour les donneurs vivants s'est avéré indépendant du résultat de la greffe du receveur. D'autres données sur les résultats non liés à la transplantation, y compris celles de la grande méta-analyse de Rodgers et al., indiquent que l'anesthésie régionale est associée à un risque plus faible d'insuffisance rénale postopératoire que l'anesthésie générale. Cependant, les auteurs ont averti que les intervalles de confiance étaient larges et compatibles à la fois avec un effet nul et une réduction des risques de deux tiers. Dans l'ensemble, il semble qu'une anesthésie régionale bien conduite n'affecte pas négativement la fonction rénale périopératoire ou les résultats rénaux par rapport à l'anesthésie générale.
Considérations relatives à l'anesthésie régionale en cas d'insuffisance rénale chronique
Les patients atteints d'insuffisance rénale chronique manifestent souvent un grand nombre de changements physiopathologiques qui peuvent influencer les soins d'anesthésie régionale. Ceux-ci peuvent inclure la présence d'une acidose métabolique à trou anionique, des troubles électrolytiques tels que l'hyperkaliémie et des coagulopathies dues à un dysfonctionnement plaquettaire induit par l'urémie. Les concentrations plasmatiques d'anesthésique local à la suite d'un bloc nerveux périphérique sont souvent suffisamment élevées pour provoquer une toxicité du système nerveux central (SNC) ou cardiaque chez n'importe quel patient, même en l'absence d'injection intravasculaire évidente. Ceci est probablement lié à la dose lors de la réalisation de "blocs à volume élevé" tels que les blocs du plexus. Certains auteurs ont recommandé que les posologies soient ajustées chez les patients atteints d'insuffisance rénale chronique sur la base d'observations de toxicité présumées être liées à une acidose ou à une hyperkaliémie concomitantes. En effet, des preuves expérimentales suggèrent que l'acidémie diminue la liaison protéique de la bupivacaïne, augmentant ainsi la fraction libre et le risque de toxicité. De plus, il a été démontré que l'hyperkaliémie (5.4 contre 2.7 mEq/L) chez le chien ne nécessite que la moitié de la dose de bupivacaïne pour induire une cardiotoxicité. Fait intéressant, le niveau de potassium n'a eu aucun effet sur chez les mêmes animaux. Il s'agit d'une découverte inquiétante, car elle suggère que la soi-disant marge de sécurité des niveaux plasmatiques entre le SNC et la toxicité cardiaque, qui est déjà relativement étroite avec la bupivacaïne, est encore moins fiable en présence d'hyperkaliémie.
Conseils NYSORA
- L'acidémie et l'hyperkaliémie diminuent la liaison protéique de la bupivacaïne, augmentant ainsi la fraction libre et le risque de toxicité.
- Les patients atteints d'urémie peuvent avoir des taux plasmatiques plus élevés d'anesthésique local après un bloc nerveux périphérique.
Même en l'absence de troubles acido-basiques ou électrolytiques, les taux plasmatiques d'anesthésiques locaux après un bloc nerveux périphérique sont souvent plus élevés chez les patients atteints d'insuffisance rénale chronique. La raison n'est pas entièrement claire, mais peut être liée à une augmentation du débit sanguin (et donc de l'absorption au site d'injection) en raison de la circulation hyperdynamique souvent observée chez les patients urémiques. D'autre part, les taux de glycoprotéine acide a1 (AAG) sont augmentés dans l'urémie et peuvent avoir un effet protecteur en liant davantage d'anesthésique local dans la circulation sanguine. Les niveaux accrus d'AAG entraînent également à la fois une fraction libre réduite disponible pour le métabolisme hépatique et un volume de distribution réduit. Ces deux conséquences pharmacocinétiques semblent s'équilibrer si bien que la demi-vie sérique n'est pas significativement modifiée. L'hémodialyse est inefficace pour éliminer la lidocaïne du plasma et ne peut donc pas être invoquée pour traiter la toxicité. Cependant, l'émulsion lipidique a été utilisée avec succès pour traiter la toxicité systémique cardiovasculaire et neurologique chez les patients souffrant d'insuffisance rénale.
Aucune différence significative n'existe entre les patients insuffisants rénaux chroniques et les patients sains en ce qui concerne la latence, la durée ou la qualité du bloc nerveux périphérique. Dans une étude sur la rachianesthésie chez des patients souffrant d'insuffisance rénale chronique par rapport à des patients en bonne santé, Orko et ses collaborateurs ont constaté que la qualité du bloc était similaire, mais que le temps d'apparition et la durée du bloc étaient réduits chez les patients souffrant d'urémie. Les auteurs ont postulé un espace intrathécal de volume contracté chez les patients urémiques comme mécanisme d'apparition plus rapide, mais la cause réelle reste incertaine. La durée plus courte du bloc sensoriel peut à nouveau être liée à une meilleure absorption dans le cadre d'une circulation hyperdynamique. La coagulopathie urémique est caractérisée par un défaut d'agrégation plaquettaire probablement dû à un effet toxique des substances urémiques sur la liaison du fibrinogène au récepteur de la glycoprotéine plaquettaire IIb/IIIa. Cela se manifeste souvent par des saignements cliniquement appréciables, et au moins un cas d'hématome sous-arachnoïdien entraînant une paraplégie après une rachianesthésie chez un patient souffrant d'insuffisance rénale chronique a été publié. Les patients sous hémodialyse nécessitent une anticoagulation intermittente et peuvent se présenter au bloc opératoire avec un état de coagulation incertain. Des précautions doivent être prises pour délimiter l'héparine ou d'autres régimes anticoagulants. Malgré ce dysfonctionnement plaquettaire, les patients urémiques sont plus à risque d'événements thrombotiques. Un cas d'hypoxie suite à un bloc du plexus brachial chez un patient urémique s'est ensuite révélé secondaire à une embolie pulmonaire. Les auteurs du rapport ont suggéré qu'un mécanisme probable était le délogement d'un thrombus préexistant du bras proximal, facilité par la manipulation liée au bloc et la vasodilatation du membre supérieur.
Plusieurs études ont comparé les techniques anesthésiques pour la création de fistules artério-veineuses, une procédure courante chez les patients atteints d'insuffisance rénale terminale et bien adaptée au bloc du plexus brachial. Certains chercheurs ont conclu qu'il existe peu de différence dans les résultats entre l'anesthésie générale, locale et du plexus brachial pour cette opération. Mouquet et ses collègues ont spécifiquement étudié les effets de ces trois techniques sur le flux sanguin de l'artère brachiale et ont conclu que l'anesthésie générale et le blocage du plexus brachial amélioraient le flux sanguin à travers la fistule pendant la chirurgie, contrairement à l'infiltration locale. Plusieurs études ultérieures ont montré une augmentation du diamètre des veines, des taux accrus de formation de fistules natives, une augmentation du flux sanguin de la fistule et un temps de maturation plus court lorsque l'anesthésie régionale est utilisée, par rapport à l'anesthésie générale ou locale.
MALADIE HÉPATIQUE
Les lésions ou dysfonctionnements hépatiques peuvent aller d'une « transaminite » légère et asymptomatique à une insuffisance hépatique franche. Il existe de nombreuses causes de maladie hépatique, à la fois acquises et congénitales, mais toutes se manifestent par une défaillance de la fonction des cellules parenchymateuses (c'est-à-dire une hépatite aiguë et chronique, une cirrhose) ou une cholestase. Les considérations relatives à l'anesthésie régionale chez les patients atteints d'une maladie du foie comprennent le potentiel d'altération de la disposition et du métabolisme des anesthésiques locaux, l'effet de l'anesthésie régionale sur la perfusion hépatique et une éventuelle coagulopathie liée à un dysfonctionnement hépatique.
Pharmacocinétique des anesthésiques locaux dans les maladies du foie
Les anesthésiques locaux amides sont métabolisés dans les microsomes hépatiques par le système du cytochrome P450. Une diminution de la fonction microsomale, comme on peut le voir dans les maladies hépatiques aiguës ou chroniques, peut entraîner une réduction de la biotransformation et de la clairance de ces médicaments, exposant le patient à un risque de toxicité anesthésique locale. Comme avec d'autres médicaments qui sont métabolisés dans le foie, le taux d'extraction hépatique détermine l'importance relative de la perfusion hépatique par rapport à l'activité enzymatique intrinsèque dans la clairance globale du médicament. Par exemple, la bupivacaïne a un faible taux d'extraction (c'est-à-dire que sa clairance est plus sensible aux altérations de l'activité des enzymes hépatiques), tandis que l'étidocaïne présente un taux d'extraction relativement élevé et dépend d'une perfusion hépatique adéquate pour sa clairance. La lidocaïne a un taux d'extraction hépatique intermédiaire et dépend donc à la fois de la perfusion et de l'activité enzymatique. Une maladie hépatique sévère telle que la cirrhose peut affecter à la fois la perfusion hépatique et la fonction enzymatique intrinsèque. Dans ce scénario, la clairance de tous les anesthésiques locaux à base d'amide, quel que soit leur taux d'extraction, est susceptible d'être réduite. Étant donné que le volume de distribution des anesthésiques locaux (et de nombreux autres médicaments) est augmenté dans les maladies hépatiques, les concentrations plasmatiques réelles peuvent ne pas différer significativement de celles des patients en bonne santé avec une dose unique, malgré la diminution de la clairance. La distribution altérée peut être liée à une diminution des taux plasmatiques d'AAG, qui sont réduits proportionnellement à la gravité de la maladie hépatique. Cliniquement, il semble que les blocs nerveux périphériques à dose unique avec des anesthésiques locaux amides ne nécessitent probablement pas d'ajustement posologique dans cette population, alors que des perfusions continues ou des bolus répétés ont le potentiel de s'accumuler à des niveaux toxiques. Ceci est étayé par une étude comparant les taux plasmatiques de lévobupivacaïne chez des patients subissant une résection hépatique ou une chirurgie colorectale qui ont reçu de la lévobupivacaïne péridurale par bolus répétés. Les patients du groupe de résection hépatique présentaient des taux plasmatiques significativement plus élevés, ce qui était corrélé à la clairance du vert d'indocyanine (une mesure de la fonction hépatique) et à la concentration plasmatique de bilirubine.
Le système enzymatique du cytochrome P450 est sujet à induction ou inhibition par une variété de médicaments et de nutriments alimentaires. Cela peut jouer un rôle dans le métabolisme ultérieur des anesthésiques locaux amides. Par exemple, les substances qui inhibent les enzymes microsomales, telles que la cimétidine ou le jus de pamplemousse, peuvent entraîner une accumulation d'anesthésique local, augmentant le risque de toxicité, en particulier dans le cadre d'un dysfonctionnement hépatique préexistant.
Les anesthésiques locaux à base d'ester sont éliminés par les cholinestérases plasmatiques dans le sang et le foie. Une maladie hépatique grave peut entraîner une diminution des taux de cholinestérase et entraîner des demi-vies plasmatiques prolongées d'esters tels que la procaïne. D'autre part, les estérases des globules rouges restent intactes pendant une maladie hépatique et sont capables de fournir une certaine fonction hydrolytique. Étant donné que la cholinestérase plasmatique est extrêmement efficace, il est peu probable qu'un déficit enzymatique secondaire à une maladie hépatique puisse altérer l'hydrolyse des anesthésiques locaux de type ester à un degré suffisant pour provoquer une toxicité.
Conseils NYSORA
- La pharmacocinétique des anesthésiques locaux chez les patients atteints d'une maladie du foie peut être complexe en raison de la diminution de la production de protéines et du métabolisme des médicaments.
- Les blocs nerveux périphériques à injection unique avec des anesthésiques locaux de type amide ne nécessitent probablement pas d'ajustement posologique chez les patients atteints de maladie hépatique.
Effet de l'anesthésie régionale sur le flux sanguin hépatique
L'apport sanguin hépatique est unique en ce sens qu'il repose à la fois sur le retour veineux porte et sur le débit sanguin de l'artère hépatique, qui représentent respectivement environ 75 % et 25 % du débit total. La régulation du débit sanguin hépatique est complexe. Le système porte est passif et non sujet à l'autorégulation, alors que l'artère hépatique peut augmenter ou diminuer sa contribution au débit en réponse aux altérations du débit veineux porte. L'artère hépatique s'autorégule également en réponse à la MAP, à peu près de la même manière que les vaisseaux cérébraux ou rénaux, mais peut s'appuyer sur une réponse sympathique intacte.
Il a été démontré que l'anesthésie générale provoque une diminution du débit sanguin hépatique, ce qui peut entraîner une ischémie et un dysfonctionnement hépatique postopératoire. On en sait moins sur les effets de l'anesthésie régionale sur la perfusion hépatique. Grietz et al. ont effectué une péridurale élevée (niveau de bloc T1 à T4) chez 16 chiens et ont examiné l'effet sur l'hémodynamique systémique et hépatique. La PAM et le débit veineux portal étaient tous deux réduits par rapport aux valeurs témoins, de 52 % et 26 %, respectivement. En revanche, le débit de l'artère hépatique était inchangé, probablement lié à une réduction de la résistance de l'artère hépatique de 51 %. De plus, l'absorption hépatique d'oxygène a été préservée grâce à une augmentation de l'extraction d'oxygène. Une autre étude menée par Vagts et ses collègues a révélé que l'anesthésie péridurale thoracique chez les porcs anesthésiés était associée à une diminution de la pression artérielle moyenne et du débit sanguin de l'artère hépatique, mais aucun changement dans l'apport ou l'absorption d'oxygène hépatique ou la pression partielle d'oxygène dans les tissus par rapport aux porcs recevant une anesthésie générale seule. Pris ensemble, ces résultats devraient rassurer le clinicien sur le fait qu'une anesthésie neuraxiale élevée peut être bien tolérée en ce qui concerne l'oxygénation hépatique, malgré une réduction modeste de la PAM. Des précautions doivent être prises pour maintenir le débit cardiaque et la pression de perfusion pendant l'anesthésie afin d'assurer une perfusion adéquate de tous les organes vitaux.
Coagulopathie hépatique
La maladie hépatique sévère est associée à des anomalies du système de coagulation. La cause est multifactorielle et peut inclure la diminution de la synthèse des protéines procoagulantes, une altération de la clairance des facteurs de coagulation activés, une carence nutritionnelle (p. ex., vitamine K, folate), la synthèse de fibrinogène fonctionnellement anormal, une splénomégalie secondaire à une hypertension portale (thrombocytopénie séquestrante), une défauts plaquettaires et suppression de la moelle osseuse de la thrombopoïèse (p. ex., par l'alcool, une infection par le virus de l'hépatite). En raison de la complexité potentielle de la coagulopathie, il peut être nécessaire d'effectuer des tests de laboratoire supplémentaires tels que des tests de facteur de coagulation et de fibrinogène pour délimiter complètement la nature du problème. Les déficits en facteurs de coagulation peuvent être traités par une supplémentation en vitamine K par transfusion de plasma frais congelé, ou les deux. Une transfusion de plaquettes peut être nécessaire en cas de thrombocytopénie. D'autres thérapies telles que le facteur VIIa recombinant ont également été utilisées pour corriger les saignements associés à une insuffisance hépatique.
Étant donné que les facteurs de coagulation dépendants de la vitamine K sont plus sensibles aux maladies hépatocellulaires, le temps de prothrombine (TP) et le rapport international normalisé (INR) sont souvent utilisés comme marqueurs de l'intégrité du système de coagulation. Cependant, la valeur prédictive du PT/INR sur l'hémorragie lors d'interventions au chevet telles que la ponction lombaire ou la pose d'un cathéter central s'est avérée faible. En tant que tel, il est important de peser soigneusement les risques et les avantages d'une technique d'anesthésie neuraxiale chez un patient suspecté de coagulopathie induite par le foie.
Bien qu'un INR inférieur à 1.5 "devrait être associé à une hémostase normale" selon les directives consensuelles de l'American Society of Regional Anesthesia and Pain Medicine (ASRA) sur l'anticoagulation, cette déclaration s'applique principalement à l'anticoagulation induite par la warfarine et peut ne pas être un indicateur fiable de la probabilité d'hémorragie problématique en cas d'insuffisance hépatique. L'analgésie péridurale est fréquemment utilisée pendant et après une résection hépatique majeure, bien qu'il y ait des problèmes de sécurité car le dérangement postopératoire des paramètres de coagulation est courant ; cependant, aucun cas d'hématome épidural n'a été signalé dans ce contexte. Les risques associés à la réalisation de blocs nerveux périphériques chez les patients présentant des paramètres de coagulation anormaux sont moins clairs. Évidemment, le risque de saignement est augmenté avec des techniques dans lesquelles l'aiguille est placée à proximité d'un vaisseau sanguin majeur. Un examen attentif des risques et des avantages doit être effectué lors de l'examen du bloc du plexus lombaire chez les patients coagulopathiques, car une hémorragie rétropéritonéale dans cet espace peut être étendue et non évidente jusqu'à ce que le patient soit en état de choc. De même, des précautions doivent être prises lors de la réalisation de blocs à proximité de vaisseaux sanguins incompressibles (par exemple, l'artère sous-clavière en cas de bloc sous-claviculaire) chez les patients présentant une anomalie de la coagulation. Les risques de l'anesthésie régionale dans le cadre d'un trouble sont développés dans "Anesthésie régionale chez les personnes gravement malades" .
Conseils NYSORA
- Les blocs profonds, tels que les blocs sciatique antérieur ou du plexus lombaire, doivent être pratiqués avec une attention particulière chez les patients atteints de coagulopathie.
- De même, les blocs à proximité de vaisseaux sanguins non compressibles, tels que l'artère dans la fosse, doivent être soigneusement pris en compte.
DIABÈTE SUCRÉ
Le diabète est une maladie multisystémique caractérisée par une intolérance aux glucides et une dérégulation de l'insuline qui a de nombreuses implications pour l'anesthésiste régional. Outre les problèmes anesthésiques habituels, tels que la présence de maladies coronariennes, cérébrovasculaires et rénales, les diabétiques ont une incidence élevée de neuropathie périphérique préexistante, ce qui a des implications sur la performance et le succès du bloc et pose un risque de complications neurologiques. D'autres considérations sont l'effet de l'anesthésie régionale sur l'homéostasie du glucose et le risque accru d'infection chez les patients diabétiques.
Neuropathie périphérique chez les diabétiques
La neuropathie diabétique est l'une des maladies neurologiques les plus courantes, affectant jusqu'à 100 % des patients diabétiques atteints d'une maladie de longue date. Les patients peuvent être asymptomatiques, mais chez les patients affectés, les symptômes sont généralement décrits comme des paresthésies, une perte sensorielle ou une douleur neuropathique. On pense que le mécanisme de la neuropathie diabétique est lié soit à un effet métabolique et osmotique direct de l'hyperglycémie chronique sur les neurones, soit à une atteinte microvasculaire entraînant une ischémie nerveuse.
La réalisation de blocs nerveux chez les patients atteints de neuropathie périphérique est controversée. Kalichman et Calcutt ont étudié l'histologie du nerf sciatique chez des rats après un bloc avec de la lidocaïne et ont trouvé significativement plus d'œdème nerveux dans les nerfs des rats diabétiques par rapport aux témoins sains. La raison de l'œdème est probablement multifactorielle et peut inclure la présence d'une barrière hémato-nerveuse altérée ou une diminution de l'absorption d'anesthésique local, entraînant une plus longue durée de bain nerveux. Une augmentation de la pression du liquide endoneural due à un œdème peut resserrer les petits vaisseaux transpérineuraux, précipitant une ischémie dans un nerf déjà compromis. Cela peut se traduire par une incidence accrue de paresthésies postopératoires après des blocs nerveux, y compris des blocs neuraxiaux, chez les diabétiques. Al-Nasser a rapporté un cas de paresthésies et de douleurs bilatérales prolongées (> 8 semaines) des membres inférieurs après une analgésie péridurale lombaire avec 0.2 % de ropivacaïne chez un patient diabétique subissant une prostatectomie radicale. Les études électromyographiques postopératoires ont montré une neuropathie sensorielle étendue des membres supérieurs et inférieurs, indiquant que le patient, bien qu'asymptomatique, avait une neuropathie préexistante qui pourrait l'avoir prédisposé à cette complication rare. Des études ont démontré une durée prolongée du bloc sensoriel et moteur après un bloc du nerf sciatique chez les diabétiques par rapport aux non diabétiques et que la durée du bloc augmente à mesure que le contrôle glycémique se détériore (tel que mesuré par les taux d'hémoglobine glycosylée). Une étude chez des rats diabétiques a montré une prolongation similaire de l'effet anesthésique local qui a été inversé par 2 semaines de traitement à l'insuline mais non affecté par 6 heures d'insuline, ce qui suggère que la sensibilité accrue aux anesthésiques locaux est médiée par des modifications chroniques du système nerveux par opposition à la glycémie actuelle. Il n'est pas clair si cette sensibilité accrue aux anesthésiques locaux représente un risque accru de complications neurologiques. La prévalence réelle des complications neurologiques chez les diabétiques recevant des blocs nerveux est inconnue mais est probablement assez faible. Le diabète est une maladie courante, et les rapports de complications neurologiques dans la littérature sont rares, ce qui suggère que dans la grande majorité des cas, la récupération des blocs nerveux périphériques se déroule sans incident.
Les patients diabétiques doivent également être considérés comme présentant un risque accru de complications infectieuses de l'anesthésie régionale en raison de la suppression immunitaire qui se produit à la suite de la maladie. Le diabète a été impliqué comme facteur de risque d'infection à la suite d'un bloc périphérique et neuraxial. Bien qu'il ne soit pas clair dans quelle mesure le diabète augmente réellement le risque d'infection, il semble sage d'être extrêmement vigilant avec les précautions de contrôle des infections chez ces patients.
L'effet de la neuropathie diabétique sur l'électrolocalisation des nerfs lors de l'utilisation d'un stimulateur nerveux est un autre sujet de controverse. Les patients atteints de diabète de longue date peuvent avoir besoin d'une intensité de courant un peu plus élevée pour produire une réponse motrice. Alors que les études de conduction nerveuse chez les diabétiques atteints de neuropathie montrent systématiquement une réduction de la vitesse et de l'amplitude de conduction pour les nerfs moteurs et sensoriels, cela n'a pas tendance à être le cas dans la pratique clinique réelle, car la plupart des patients diabétiques ont des seuils d'intensité de courant similaires à ceux des non-diabétiques. patients diabétiques sans neuropathie.
Conseils NYSORA
- Les patients diabétiques sont sujets à une neuropathie métabolique qui altère la conduction nerveuse.
- Un courant stimulant de plus grande intensité n'est nécessaire qu'occasionnellement pour obtenir des contractions musculaires visibles lors de l'utilisation d'un stimulateur nerveux pour électrolocaliser les nerfs.
Effet de l'anesthésie régionale sur l'homéostasie du glucose
Il est bien connu que la chirurgie réalisée en association avec une anesthésie générale provoque une réponse contre-régulatrice qui augmente significativement les taux plasmatiques de glucose, ainsi que les taux de cortisol et de catécholamines. Cette soi-disant réponse au stress a longtemps été considérée comme un mécanisme de défense homéostatique qui est important dans l'adaptation d'un organisme à des stimuli nocifs, fournissant des substrats pour l'énergie en cas de besoin. Cependant, des périodes prolongées d'hyperglycémie peuvent avoir des effets délétères sur les patients, avec des preuves à l'appui d'une augmentation des taux de mortalité, de la durée du séjour à l'hôpital et de l'incidence des infections nosocomiales. L'hyperglycémie peut être particulièrement dangereuse chez les patients qui ont subi un traumatisme.
Il a été démontré que l'anesthésie régionale améliore la réponse hyperglycémique à la chirurgie et peut donc jouer un rôle dans ce phénomène protecteur. Un test de tolérance au glucose peropératoire a entraîné des niveaux de glucose plasmatique nettement élevés chez les patients recevant une anesthésie générale par rapport à une anesthésie épidurale pour des procédures telles que l'herniorraphie inguinale et l'hystérectomie. De même, l'hystérectomie abdominale pratiquée sous rachianesthésie est associée à des taux de glucose intra- et postopératoires inférieurs à ceux de la neuroleptanesthésie. Le bloc rétrobulbaire réduit la réponse au stress hyperglycémique à la chirurgie de la cataracte et de la boucle sclérale.
L'homéostasie du glucose est complexe et plusieurs facteurs contribuent probablement à l'action salutaire de l'anesthésie régionale sur le contrôle glycémique. Ceux-ci peuvent inclure l'inhibition de la gluconéogenèse hépatique ainsi que l'inhibition des réponses des catécholamines et du cortisol à la chirurgie. De plus, "l'absence d'anesthésie générale" peut être un facteur causal du contrôle glycémique, car il a été démontré que des agents volatils tels que l'halothane et l'enflurane altèrent la tolérance au glucose chez les chiens. Il semble clair, d'après les données disponibles, que pour améliorer les résultats d'une intervention chirurgicale majeure, les anesthésiologistes doivent empêcher autant que possible les apports nociceptifs d'atteindre les systèmes nerveux central et neuroendocrinien. L'utilisation de l'anesthésie régionale peut facilement faciliter cet objectif et peut être particulièrement pertinente pour les diabétiques "fragiles" chez qui un contrôle glycémique serré est difficile dans le meilleur des cas.
NEUROPATHIE THYROÏDIENNE
Le diabète et l'urémie sont les neuropathies métaboliques les plus courantes ; cependant, plusieurs autres neuropathies moins courantes ont également des implications pour l'anesthésiste régional. Celles-ci comprennent les neuropathies résultant de l'utilisation de certains médicaments ou de l'exposition à des toxines et celles liées aux maladies du tissu conjonctif, auto-immunes et vasculaires. L'une des causes les plus fréquentes de neuropathie métabolique est celle associée à une hypothyroïdie manifeste. La neuropathie thyroïdienne est un phénomène largement sensoriel mal compris mais présent chez environ 40% des patients diagnostiqués avec une hypothyroïdie. Il est le plus évident dans le myxœdème franc, mais des études de conduction nerveuse ont montré des preuves d'altération de la vitesse dans l'hypothyroïdie subclinique. La neuropathie thyroïdienne est plus susceptible de se présenter comme un piégeage des nerfs périphériques, en particulier du nerf médian, et ces patients sont fréquemment référés pour une décompression du canal carpien. Le piégeage du huitième nerf crânien conduisant à la surdité est également courant. Les patients peuvent se plaindre de dysesthésies dans un schéma de gants et de bas, ainsi que de douleurs lancinantes évoquant une compression des racines nerveuses. Les réflexes tendineux profonds « accrochés » (réponse réflexe rapide avec un retour retardé au tonus normal) sont une caractéristique de l'hypothyroïdie et sont probablement liés à la fois à la neuropathie et à la myopathie. Pathologiquement, les nerfs affectés présentent un dépôt mucineux et, dans les cas avancés, une démyélinisation segmentaire avec perte de grosses fibres nerveuses myélinisées.
Peu de données existent sur l'effet qu'une neuropathie thyroïdienne préexistante peut avoir sur la prise en charge de l'anesthésie régionale dans cette population. Une conséquence potentielle de la réalisation d'une anesthésie régionale chez les patients présentant un piégeage nerveux est ce que l'on a appelé le « syndrome de double écrasement ». Cela fait référence à la susceptibilité accrue des nerfs aux blessures ou à la déficience à un endroit anatomique lorsqu'ils sont déjà comprimés ou autrement blessés à un autre endroit séparé. Un exemple classique est le patient présentant des symptômes du syndrome du canal carpien après un traumatisme ou une blessure apparemment mineur au nerf médian, qui se révèle plus tard avoir une compression de la racine nerveuse C6. Bien qu'à l'origine décrit en termes de blessure mécanique, il a été reconnu que des facteurs métaboliques et pharmacologiques peuvent contribuer au syndrome de double écrasement, y compris l'hypothyroïdie. Ainsi, il se peut que les patients atteints de neuropathie thyroïdienne courent un risque accru de lésions neurologiques lorsqu'ils reçoivent des blocs d'anesthésie régionale, car un traumatisme mineur à l'aiguille d'un nerf sensible peut entraîner des déficits neurologiques fonctionnels. Bien que cela reste spéculatif à l'heure actuelle, cette possibilité renforce la nécessité d'une histoire détaillée et d'une documentation du déficit neurologique préexistant chez les patients atteints d'hypothyroïdie et d'un examen attentif des techniques chez ces patients. Enfin, si elle est suspectée, il a été démontré que la neuropathie thyroïdienne peut être corrigée dans de nombreux cas par un traitement rapide avec une thérapie de remplacement de la thyroïde, ce qui peut entraîner cette complication.
OBÉSITÉ
L'obésité est un problème de plus en plus répandu, les taux d'obésité dans le monde ayant doublé depuis 1980. Au cours des 20 dernières années, il y a eu une augmentation spectaculaire de l'obésité aux États-Unis, avec 35 % des adultes et 17 % des enfants et des adolescents répondant aux critères de l'obésité en 2012. En plus des considérations anesthésiques habituelles pour les patients souffrant d'obésité morbide, telles que la présence de diverses comorbidités cardio-pulmonaires, gastro-intestinales et endocriniennes, l'abondance de tissu supplémentaire peut présenter un défi pour les anesthésistes régionaux. Il a été démontré que l'obésité altère la capacité des anesthésistes à identifier correctement les espaces intervertébraux lombaires. Les résultats sont également affectés chez les patients en surpoids. Dans une étude portant sur plus de 9000 30 blocs mixtes dans un seul établissement, les patients ayant un indice de masse corporelle (IMC) supérieur à 2 kg/m1.62 étaient 25 fois plus susceptibles de subir un échec de bloc régional que ceux ayant un IMC inférieur à 2 kg/mXNUMX. mXNUMX. Sans surprise, les enquêteurs ont cité la difficulté d'identification des points de repère, le positionnement du patient et la longueur insuffisante de l'aiguille utilisée comme principaux obstacles à la réussite du placement du bloc. Ces résultats sont étayés par une étude sur les blocs axillaires utilisant le guidage par stimulateur nerveux, où l'obésité était associée à un temps d'exécution du bloc plus long, à une diminution du taux de réussite, à une augmentation du taux de complications et à une diminution de la satisfaction des patients. Malgré ces difficultés relatives, les taux de réussite des blocs chez les patients obèses étaient élevés et les taux de complications graves étaient faibles. L'anesthésie régionale reste une option intéressante pour les patients obèses car elle peut réduire l'incidence des complications cardio-pulmonaires et respiratoires par rapport à celles rencontrées lors d'une anesthésie générale.
Conseils NYSORA
- Les patients obèses sont plus susceptibles de subir un échec de bloc régional que les patients dont l'IMC se situe dans la plage normale.
- Cela s'explique par des repères de surface ou échographiques difficiles, des difficultés de positionnement du patient.
Les patients obèses semblent bénéficier des blocs anesthésiques régionaux guidés par l'image. La fluoroscopie a été utilisée dans la mise en place de cathéters axillaires du plexus brachial, dans la réalisation de blocs du nerf sciatique et comme aide pour faciliter l'anesthésie rachidienne chez les patients souffrant d'obésité morbide. Cependant, son utilisation est limitée par la nécessité de relier l'anatomie neurale à des structures qui semblent radiodenses, telles que des os, des aiguilles ou des vaisseaux injectés de contraste.
L'échographie peut être particulièrement utile chez les patients obèses dont les repères de surface sont obscurcis, bien qu'un excès de tissu adipeux puisse rendre l'examen échographique lui-même plus difficile en raison de l'atténuation du faisceau d'ultrasons. Cette difficulté peut être en partie surmontée en diminuant la fréquence du transducteur pour augmenter la profondeur de pénétration, bien que la résolution de l'image soit réduite (Figure 2). Lorsque les nerfs médian et sciatique ont été scannés chez des volontaires de poids normal et obèses, Marhofer et al. ont conclu que la visualisation des nerfs périphériques superficiels est indépendante de l'IMC, alors que les nerfs plus profonds sont plus difficiles à visualiser chez les sujets obèses. Des études menées chez des parturientes obèses et chez des patientes non obstétriques présentant des repères anatomiques de surface difficiles ont vérifié l'utilité de l'échographie dans l'identification de l'espace épidural et d'autres structures vertébrales avant la réalisation d'un bloc neuraxial. À ce jour, peu d'études ont comparé les blocs nerveux périphériques guidés par échographie aux techniques guidées par repère ou par stimulateur nerveux dans la population obèse ; cependant, l'échographie semble être une modalité utile pour ce groupe de patients potentiellement difficile.
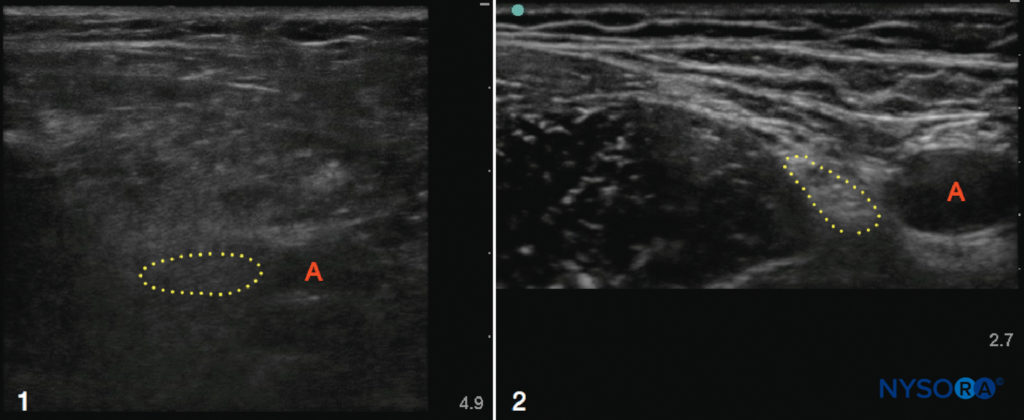
FIGURE 2. Échographies des régions fémorales chez un patient obèse (1) et un patient mince (2). Notez la profondeur accrue requise pour imager l'artère (A) et le nerf (contour en pointillé) dans l'exemple obèse, ainsi que la mauvaise qualité de résolution globale due à l'excès de tissu adipeux. En revanche, les nerfs, les artères, les muscles et les plans fasciaux chez le patient mince sont nets et bien définis.
L'obésité peut avoir un effet sur le dosage des médicaments pour la colonne vertébrale, bien que la question soit quelque peu controversée. Une notion courante est que l'augmentation de la masse abdominale entraîne une compression du volume intrathécal par engorgement des plexus épiduraux, entraînant une hauteur de bloc accrue et potentiellement dangereuse pendant la rachianesthésie. Ceci est étayé par des données corrélant la hauteur du bloc avec le poids du patient lors d'une rachianesthésie standardisée pour cystoscopie. En effet, certains auteurs ont préconisé d'envisager une rachianesthésie « à faible dose » chez les obèses morbides, en raison de fortes variations dans leurs besoins posologiques. Chez une parturiente en surpoids extrême (IMC = 66 kg/m2), la césarienne a été réalisée avec succès avec une dose spinale de 5 mg de bupivacaïne comme seul agent anesthésique. Cependant, le poids du patient n'est pas nécessairement en corrélation avec le degré de compression du sac thécal, et de nombreux chercheurs ont fait valoir que le poids seul n'est pas un prédicteur fiable de la hauteur du bloc pendant la rachianesthésie. Une étude de recherche de dose de bupivacaïne hyperbare chez des patients subissant une arthroplastie du genou n'a trouvé aucune différence dans la dose nécessaire pour obtenir un bloc à T12 entre les patients obèses et non obèses, mais a trouvé une durée légèrement plus longue du bloc et une incidence réduite de la douleur du garrot dans le groupe obèse . Cependant, aucun patient du groupe obèse n'avait un IMC supérieur à 40, de sorte que ces résultats peuvent ne pas refléter la population souffrant d'obésité morbide. Il est probablement raisonnable d'aborder le dosage rachidien des patients souffrant d'obésité morbide avec une certaine prudence et, si possible, d'ajuster progressivement la dose d'anesthésique.
Références
- Duggan M, Kavanagh BP : Modifications périopératoires de la fonction respiratoire. Best Pract Res Clin Anaesthesiol 2010;24:145–155.
- Cuschieri RJ, Morran CG, Howie JC, McArdle CS : douleur postopératoire et complications pulmonaires : comparaison de trois régimes analgésiques. Br J Surg 1985;72:495–498.
- Ballantyne JC, Carr DB, deFerranti S, Suarez T, Lau J, Chalmers TC, Angelillo IF, Mosteller F : Les effets comparatifs des thérapies analgésiques postopératoires sur les résultats pulmonaires : méta-analyses cumulatives d'essais contrôlés randomisés. Anesth Analg 1998;86:598–612.
- Slinger P, Shennib H, Wilson S : fonction pulmonaire post-thoracotomie : une comparaison des perfusions de mépéridine épidurales et intraveineuses. J Cardiothorac Vasc Anesth 1995;9:128–134.
- Lier F van, Geest PJ van der, Hoeks SE, et al : L'analgésie péridurale est associée à de meilleurs résultats pour la santé des patients chirurgicaux atteints de maladie pulmonaire obstructive chronique. Anesthésiologie 2011 ;115 : 315–321.
- Neuman MD, Silber JH, Elkassabany NM, Ludwig JM, Fleisher LA : Efficacité comparative de l'anesthésie régionale par rapport à l'anesthésie générale pour la chirurgie des fractures de la hanche chez l'adulte. Anesthésiologie 2012 ; 117 : 72–92.
- Cousins MJ, Veering B. Bloc neural épidural. Dans : Cousins MJ, Bridenbaugh PO, Carr DB, Horlocker TT (eds), Cousins and Bridenbaugh's Neural block in Clinical Anesthesia and Pain Medicine, 4e éd. Philadelphie : Lippincott Williams & Wilkins, 2008.
- Michalek P, David I, Adamec M, Janousek L : Anesthésie péridurale cervicale pour une procédure combinée du cou et des membres supérieurs : une étude pilote. Anesth Analg 2004;99:1833–1836, table des matières.
- Eisele J, Trenchard D, Burki N, Guz A : L'effet du blocage de la paroi thoracique sur la sensation et le contrôle respiratoires chez l'homme. Clin Sci 1968;35:23–33.
- Kochi T, Sako S, Nishino T, Mizuguchi T : Effet de l'anesthésie extradurale thoracique élevée sur la réponse ventilatoire à l'hypercapnie chez des volontaires normaux. Br J Anaesth 1989;62:362–367.
- Yamakage M, Namiki A, Tsuchida H, Iwasaki H : Modifications du schéma ventilatoire et de la saturation artérielle en oxygène pendant la rachianesthésie chez l'homme. Acta Anaesthesiol Scand 1992;36:569–571.
- Warner DO, Warner MA, Ritman EL : fonction de la paroi thoracique humaine pendant l'anesthésie péridurale. Anesthésiologie 1996 ; 85 : 761–773.
- Troyer A De, Kelly S : Action des muscles accessoires du cou sur la cage thoracique chez le chien. J Appl Physiol Respir Environ Exerc Physiol 1984;56:326–332.
- Labaille T, Clergue F, Samii K, Ecoffey C, Berdeaux A : Réponse ventilatoire au CO2 après lidocaïne intraveineuse et péridurale. Anesthésiologie 1985 ; 63 : 179–183.
- Sakura S, Saito Y, Kosaka Y : Effet de l'anesthésie péridurale lombaire sur la réponse ventilatoire à l'hypercapnie chez les patients jeunes et âgés. J Clin Anesth 1993;5:109–113.
- Sakura S, Y Saito, Y Kosaka : Les effets de l'anesthésie péridurale sur la réponse ventilatoire à l'hypercapnie et à l'hypoxie chez les patients âgés. Anesth Analg 1996;82:306–311.
- McCarthy GS : L'effet de l'analgésie extradurale thoracique sur la distribution des gaz pulmonaires, la capacité résiduelle fonctionnelle et la fermeture des voies respiratoires. Br J Anaesth 1976;48:243–248.
- Lundh R, Hedenstierna G, Johansson H : Relations ventilation-perfusion pendant l'analgésie péridurale. Acta Anaesthesiol Scand 1983;27 : 410–416.
- Reber A, Bein T, Högman M, Khan ZP, Nilsson S, Hedenstierna G : Aération pulmonaire et échange gazeux pulmonaire pendant l'anesthésie péridurale lombaire et en position de lithotomie chez les patients âgés. Anesthésie 1998 ; 53 : 854–861.
- Moir DD : Fonction ventilatoire pendant l'analgésie péridurale. Br J Anaesth 1963;35:3–7.
- Groeben H, Schäfer B, Pavlakovic G, Silvanus MT, Peters J : Fonction pulmonaire sous anesthésie épidurale segmentaire thoracique haute avec ropivacaïne ou bupivacaïne chez les patients atteints de maladie pulmonaire obstructive sévère subissant une chirurgie mammaire. Anesthésiologie 2002;96 : 536–541.
- Arndt JO, Höck A, Stanton-Hicks M, Stühmeier KD : Anesthésie péridurale et distribution du sang chez les humains en décubitus dorsal. Anesthésiologie 1985 ; 63 : 616–623.
- Capdevila X, Biboulet P, Rubenovitch J, Serre-Cousine O, Peray P, Deschodt J, Athis F d': Les effets de l'anesthésie péridurale cervicale avec bupivacaïne sur la fonction pulmonaire chez les patients conscients. Anesth Analg 1998;86:1033–1038.
- Kolker AR, Hirsch CJ, Gingold BS, Stamatos JM, Wallack MK : Utilisation de l'anesthésie péridurale et de la ventilation spontanée pendant les procédures transabdominales du côlon et du rectum chez certains groupes de patients à haut risque. Dis Colon Rectum 1997;40:339–343. Technique d'anesthésie et mortalité après arthroplastie totale de la hanche ou du genou : une étude de cohorte rétrospective, appariée au score de propension. Perlas A, Chan VW, Beattie S. Anesthésiologie. 2016 Oct;125(4):724–31.
- Liu S, Carpenter RL, Neal JM : Anesthésie péridurale et analgésie. Leur rôle dans les résultats postopératoires. Anesthésiologie 1995;82 : 1474–1506.
- Rodgers A, Walker N, Schug S, et al : Réduction de la mortalité et de la morbidité postopératoires avec anesthésie péridurale ou rachidienne : résultats d'un aperçu des essais randomisés. BMJ 2000;321:1493.
- Wahba WM, Don HF, Craig DB : Analgésie épidurale post-opératoire : effets sur les volumes pulmonaires. Can Anaesth Soc J 1975;22:519–527.
- Yeager MP, Glass DD, Neff RK, Brinck-Johnsen T : Anesthésie péridurale et analgésie chez les patients chirurgicaux à haut risque. Anesthésiologie 1987;66 : 729–736.
- Christopherson R, Beattie C, Frank SM, et al : morbidité périopératoire chez les patients randomisés pour une anesthésie péridurale ou générale pour une chirurgie vasculaire des membres inférieurs. Groupe d'étude d'essai d'anesthésie randomisée sur l'ischémie périopératoire. Anesthésiologie 1993 ; 79 : 422–434.
- Urmey WF, Talts KH, Sharrock NE : Incidence à 1991 % de la parésie hémidiaphragmatique associée à une anesthésie du plexus brachial interscalène diagnostiquée par échographie. Anesth Analg 72;498 : 503–XNUMX.
- Urmey WF, McDonald M : Parésie hémidiaphragmatique pendant le bloc interscalénique du plexus brachial : effets sur la fonction pulmonaire et la mécanique de la paroi thoracique. Anesth Analg 1992;74:352–357.
- Sinha SK, Abrams JH, Barnett JT, et al : La diminution du volume d'anesthésie locale de 20 à 10 mL pour le bloc interscalène guidé par échographie au niveau du cricoïde ne réduit pas l'incidence de la parésie hémidiaphragmatique. Reg Anesth Pain Med 2011;36:17–20.
- Lee JH, Cho SH, Kim SH, et al : Ropivacaïne pour le bloc interscalénique guidé par échographie : 5 mL fournissent une analgésie similaire mais moins de paralysie du nerf phrénique que 10 mL. Can J Anaesth 2011;58:1001–1006.
- Riazi S, Carmichael N, Awad I, Holtby RM, McCartney CJL : Effet du volume d'anesthésie locale (20 vs 5 ml) sur l'efficacité et les conséquences respiratoires du bloc du plexus brachial interscalène guidé par échographie. Br J Anaesth 2008;101:549–556.
- Koscielniak-Nielsen ZJ : Parésie hémidiaphragmatique après supplémentation interscalénique d'un bloc axillaire insuffisant avec 3 mL de mépivacaïne à 2 %. Acta Anaesthesiol Scand 2000;44:1160–1162.
- Knoblanche GE: L'incidence et l'étiologie du bloc nerveux phrénique associé au bloc supraclaviculaire du plexus brachial. Anaesth Intensive Care 1979;7:346–349.
- Mak PH, Irwin MG, Ooi CG, Chow BF : Incidence de la paralysie diaphragmatique après un bloc du plexus brachial supraclaviculaire et son effet sur la fonction pulmonaire. Anesthésie 2001 ; 56 : 352–356.
- Neal JM, Moore JM, Kopacz DJ, Liu SS, Kramer DJ, Plorde JJ : Analyse quantitative des fonctions respiratoires, motrices et sensorielles après bloc supraclaviculaire. Anesth Analg 1998;86:1239–1244.
- Renes SH, Spoormans HH, Gielen MJ, Rettig HC, Geffen GJ van : La parésie hémidiaphragmatique peut être évitée dans le bloc du plexus brachial supraclaviculaire guidé par échographie. Reg Anesth Pain Med 2009;34 : 595–599.
- Rodríguez J, Bárcena M, Rodríguez V, Aneiros F, Alvarez J : Effets du bloc du plexus brachial infraclaviculaire sur la fonction respiratoire et l'étendue du bloc. Reg Anesth Pain Med 1998;23:564–568.
- Dullenkopf A, Blumenthal S, Theodorou P, Roos J, Perschak H, Borgeat A : Excursion diaphragmatique et fonction respiratoire après la technique Raj modifiée du bloc du plexus infraclaviculaire. Reg Anesth Pain Med 2004;29:110–114.
- Gentili ME, Deleuze A, Estèbe JP, Lebourg M, Ecoffey C : Insuffisance respiratoire sévère après bloc sous-claviculaire avec ropivacaïne 0.75 % : à propos d'un cas. J Clin Anesth 2002;14:459–461.
- Yang CW, Jung SM, Kwon HU, Kang PS, Cho CK, Choi HJ : Parésie hémidiaphragmatique transitoire après bloc sous-claviculaire sagittal latéral guidé par échographie. J Clin Anesth 2013;25:496–498.
- Bigeleisen PE : Variations anatomiques du nerf phrénique et son implication clinique dans le bloc sus-claviculaire. Br J Anaesth 2003; 91:916–917.
- Verelst P, Zundert A van : impact respiratoire des stratégies analgésiques pour la chirurgie de l'épaule. Reg Anesth Pain Med 2013;38:50–53.
- Martínez J, Sala-Blanch X, Ramos I, Gomar C : Bloc combiné du plexus infraclaviculaire avec bloc nerveux suprascapulaire pour la chirurgie de la tête humérale chez un patient souffrant d'insuffisance respiratoire : une approche alternative. Anesthésiologie 2003 ; 98 : 784–785.
- Ilfeld BM, Morey TE, Wright TW, Chidgey LK, Enneking FK : Bloc continu du plexus brachial interscalénique pour le contrôle de la douleur postopératoire à domicile : une étude randomisée, en double aveugle et contrôlée par placebo. Anesthésie. Analg. 2003 ; 96:1089–1095, table des matières
- Mariano ER, Afra R, Loland VJ, et al : Bloc continu du plexus brachial interscalénique via une approche postérieure guidée par échographie : une étude randomisée, à triple insu et contrôlée par placebo. Anesth Analg 2009;108:1688–1694.
- Souron V, Reiland Y, Delaunay L : Épanchement pleural et douleur thoracique après bloc interscalénique continu du plexus brachial. Reg Anesth Pain Med 2003;28:535–538.
- Sardesai AM, Chakrabarti AJ, Denny NM : Effondrement du lobe inférieur pendant une anesthésie locale continue du plexus brachial interscalène à domicile. Reg Anesth Pain Med 2004;29:65–68.
- Ilfeld BM, Morey TE, Wright TW, Chidgey LK, Enneking FK : Perfusion périneurale interscalène de ropivacaïne : comparaison de deux schémas posologiques pour l'analgésie postopératoire. Reg Anesth Pain Med 2004;29 : 9–16.
- Borgeat A, Perschak H, Bird P, Hodler J, Gerber C : Analgésie interscalénique contrôlée par le patient avec de la ropivacaïne à 0.2 % par rapport à l'analgésie intraveineuse contrôlée par le patient après une chirurgie majeure de l'épaule : effets sur la fonction diaphragmatique et respiratoire. Anesthésiologie 2000 ; 92 : 102–108.
- Ilfeld BM, Le LT, Ramjohn J, et al: Les effets de la concentration et de la dose d'anesthésique local sur les blocs nerveux sous-claviculaires continus: une étude contrôlée multicentrique, randomisée, masquée par un observateur. Anesth Analg 2009;108:345–350.
- Maurer K, Ekatodramis G, Hodler J, Rentsch K, Perschak H, Borgeat A : bloc interscalène continu bilatéral du plexus brachial pour l'analgésie après arthroplastie bilatérale de l'épaule. Anesthésiologie 2002;96 :762–764.
- Salinas FV : Emplacement, emplacement, emplacement : blocs nerveux périphériques continus et cathéters stimulants. Reg Anesth Pain Med 2003;28:79–82.
- Souron V, Reiland Y, Traverse A De, Delaunay L, Lafosse L : Migration interpleurale d'un cathéter interscalène. Anesth Analg 2003;97:1200–1201.
- Faust A, Fournier R, Hagon O, Hoffmeyer P, Gamulin Z : Déficit sensoriel et moteur partiel du membre inférieur ipsilatéral après bloc interscalénique continu du plexus brachial. Anesth Analg 2006;102:288–290.
- Osinowo OA, Zahrani M, Softah A : Effet du bloc nerveux intercostal avec 0.5 % de bupivacaïne sur le débit expiratoire de pointe et la saturation artérielle en oxygène dans les fractures des côtes. J Trauma 2004;56:345–347.
- Truitt MS, Murry J, Amos J, et al : Bloc nerveux intercostal continu pour les fractures de côtes : prêt pour les heures de grande écoute ? J Trauma 2011;71:1548–1552; débat 1552.
- Karmakar MK, Critchley LAH, Ho AM-H, Gin T, Lee TW, Yim APC : Perfusion paravertébrale thoracique continue de bupivacaïne pour la gestion de la douleur chez les patients ayant plusieurs côtes fracturées. Chest 2003;123 : 424–431.
- Murata H, Salviz EA, Chen S, Vandepitte C, Hadzic A : rapport de cas : bloc paravertébral thoracique continu guidé par échographie pour la gestion ambulatoire de la douleur aiguë des fractures costales unilatérales à plusieurs niveaux. Anesth Analg 2013;116:255–257.
- Buckley M, Edwards H, Buckenmaier CC 3rd, Plunkett AR : Blocage continu du nerf paravertébral thoracique chez un résident en anesthésie travaillant - lorsque les opioïdes ne sont pas une option. Mil Med 2011;176:578–580.
- Richardson J, Sabanathan S, Shah R : Fonction pulmonaire spirométrique post-thoracotomie : l'effet de l'analgésie. Une critique. J Cardiovasc Surg (Turin) 1999;40:445–456.
- Davies RG, Myles PS, Graham JM : Une comparaison de l'efficacité analgésique et des effets secondaires du bloc paravertébral vs épidural pour la thoracotomie - une revue systématique et une méta-analyse d'essais randomisés. Br J Anaesth 2006;96:418–426.
- Richardson J, Sabanathan S, Jones J, Shah RD, Cheema S, Mearns AJ : Une comparaison prospective et randomisée de la bupivacaïne péridurale ou paravertébrale équilibrée préopératoire et continue sur la douleur post-thoracotomie, la fonction pulmonaire et les réponses au stress. Br J Anaesth 1999;83 : 387–392.
- Thomas PW, Sanders DJ, Berrisford RG : Hémorragie pulmonaire après bloc paravertébral percutané. Br J Anaesth 1999; 83:668–669.
- Fine PG, Bubela C : Chylothorax après bloc du plexus coeliaque. Anesthésiologie 1985 ; 63 : 454–456.
- Shanti CM, Carlin AM, Tyburski JG : Incidence du pneumothorax par bloc nerveux intercostal pour l'analgésie dans les fractures des côtes. J Trauma 2001;51 : 536–539.
- Naja Z, Lönnqvist PA : bloc nerveux paravertébral somatique. Incidence des échecs de bloc et des complications. Anesthésie 2001 ; 56 : 1184–1188.
- Borgeat A, Ekatodramis G, Kalberer F, Benz C : Complications aiguës et non aiguës associées au bloc interscalénique et à la chirurgie de l'épaule : une étude prospective. Anesthésiologie 2001;95 :875–880.
- Brown DL, Cahill DR, Bridenbaugh LD : Bloc nerveux supraclaviculaire : analyse anatomique d'une méthode de prévention du pneumothorax. Anesth Analg 1993;76:530–534.
- Bhatia A, Lai J, Chan VWS, Brull R : rapport de cas : pneumothorax en tant que complication de l'approche supraclaviculaire guidée par échographie pour le bloc du plexus brachial. Anesth Analg 2010;111:817–819.
- Klaastad Ø, Smith HJ, Smedby O, et al : Un nouveau bloc du plexus brachial infraclaviculaire : la technique latérale et sagittale, développée par des études d'imagerie par résonance magnétique. Anesth Analg 2004;98:252–256, table des matières.
- Chan VWS, Perlas A, Rawson R, Odukoya O : Bloc du plexus brachial supraclaviculaire guidé par ultrasons. Anesth Analg 2003;97:1514–1517.
- Perlas A, Lobo G, Lo N, Brull R, Chan VWS, Karkhanis R : Bloc supraclaviculaire guidé par échographie : résultats de 510 cas consécutifs. Reg Anesth Pain Med 2009;34:171–176.
- Gauss A, Tugtekin I, Georgieff M, Dinse-Lambracht A, Keipke D, Gorsewski G : Incidence du pneumothorax cliniquement symptomatique dans le bloc du plexus brachial infraclaviculaire et supraclaviculaire guidé par échographie. Anesthésie 2014 ; 69 : 327–336.
- Fenoglio C, Boicelli CA, Ottone M, Addario C, Chiari P, Viale M : effet protecteur du chlorhydrate de procaïne sur les altérations induites par le cisplatine dans les reins de rat. Médicaments anticancéreux 2002;13:1043–1054.
- Navar LG : Autorégulation rénale : perspectives des études sur les reins entiers et les néphrons uniques. Am J Physiol 1978;234:F357–F370.
- Suleiman MY, Passannante AN, Onder RL, Greene-Helms WF, Perretta SG : Altération du flux sanguin rénal pendant l'anesthésie péridurale chez des sujets normaux. Anesth Analg 1997;84:1076–1080.
- Rooke GA, Freund PR, Jacobson AF : réponse hémodynamique et modification du volume sanguin des organes pendant la rachianesthésie chez les hommes âgés atteints de maladie cardiaque. Anesth Analg 1997;85:99–105.
- Sivarajan M, Amory DW, Lindbloom LE, Schwettmann RS : Changements systémiques et régionaux du flux sanguin pendant la rachianesthésie chez le singe rhésus. Anesthésiologie 1975;43:78–88.
- Hopf HB, Schlaghecke R, Peters J : Le bloc neural sympathique par anesthésie péridurale thoracique supprime la libération de rénine en réponse à l'hypotension artérielle. Anesthésiologie 1994;80:992–999 ; discussion 27A–28A.
- Hadimioglu N, Ulugol H, Akbas H, Coskunfirat N, Ertug Z, Dinckan A : La combinaison de l'anesthésie péridurale et de l'anesthésie générale atténue la réponse au stress à la chirurgie de transplantation rénale. Transplant Proc 2012;44 : 2949–2954.
- Ricaurte L, Vargas J, Lozano E, Díaz L, Groupe de transplantation d'organes : anesthésie et transplantation rénale. Transplant Proc 2013;45:1386–1391.
- Sener M, Torgay A, Akpek E, et al : anesthésie régionale versus générale pour la néphrectomie du donneur : effets sur la fonction du greffon. procédure de transplantation 2004 ; 36:2954–2958.
- Gould DB, Aldrete JA : cardiotoxicité de la bupivacaïne chez un patient souffrant d'insuffisance rénale. Acta Anesthesiol Scand 1983 ; 27:18–21.
- Lucas LF, Tsueda K : Dépression cardiovasculaire après bloc du plexus brachial chez deux patients diabétiques insuffisants rénaux. Anesthésiologie 1990 ; 73 : 1032–1035.
- Coyle DE, Denson DD, Thompson GA, Myers JA, Arthur GR, Bridenbaugh PO : L'influence de l'acide lactique sur la liaison aux protéines sériques de la bupivacaïne : différences d'espèces. Anesthésiologie 1984 ; 61 : 127–133.
- Avery P, Redon D, Schaenzer G, Rusy B : L'influence du potassium sérique sur la toxicité cérébrale et cardiaque de la bupivacaïne et de la lidocaïne. Anesthésiologie 1984 ; 61 : 134–138.
- Pere P, Salonen M, Jokinen M, Rosenberg PH, Neuvonen PJ, Haasio J : Pharmacocinétique de la ropivacaïne chez les patients urémiques et non urémiques après bloc axillaire du plexus brachial. Anesth Analg 2003;96:563–569, table des matières.
- Rodríguez J, Quintela O, López-Rivadulla M, Bárcena M, Diz C, Alvarez J : doses élevées de mépivacaïne pour le bloc du plexus brachial chez les patients atteints d'insuffisance rénale chronique en phase terminale. Une étude pilote. Eur J Anaesthesiol 2001;18:171–176.
-
Mostert JW, Evers JL, Hobika GH, Moore RH, Kenny GM, Murphy GP : La réponse hémodynamique à l'insuffisance rénale chronique telle qu'étudiée dans l'état azotémique. Br J Anaesth 1970;42:397–411.
-
Vasson MP, Baguet JC, Arveiller MR, Bargnoux PJ, Giroud JP, Raichvarg D : Glycoprotéine acide alpha-1 sérique et urinaire dans l'insuffisance rénale chronique. Nephron 1993;65:299–303.
-
Mather LE, Thomas J : liaison de la bupivacaïne aux fractions protéiques plasmatiques. J Pharm Pharmacol 1978;30:653–654.
-
Vaziri ND, Saiki JK, Hughes W : Dégagement de la lidocaïne par hémodialyse. South Med J 1979;72:1567–1568.
-
Shih YH, Chen CH, Wang YM, Liu K : inversion réussie de la bradycardie jonctionnelle sévère induite par la bupivacaïne et la lidocaïne par émulsion lipidique après un bloc du plexus brachial sous-claviculaire chez un patient urémique. Acta Anesthésiol Taïwan 2011;49:72–74.
-
Lange DB, Schwartz D, DaRoza G, Gair R : Utilisation d'une émulsion lipidique intraveineuse pour inverser la toxicité du système nerveux central d'une surdose d'anesthésique local iatrogène chez un patient sous dialyse péritonéale. Ann Pharmacother 2012;46:e37.
-
Rice AS, Pither CE, Tucker GT : Concentrations plasmatiques de bupivacaïne après bloc supraclaviculaire du plexus brachial chez des patients atteints d'insuffisance rénale chronique. Anesthésie 1991 ; 46 : 354–357.
-
McEllistrem RF, Schell J, O'Malley K, O'Toole D, Cunningham AJ : bloc du plexus brachial interscalénique avec de la lidocaïne dans l'insuffisance rénale chronique - une étude pharmacocinétique. Can J Anaesth 1989;36:59–63.
-
Orko R, Pitkänen M, Rosenberg PH : Anesthésie sous-arachnoïdienne avec 0.75 % de bupivacaïne chez les patients souffrant d'insuffisance rénale chronique. Br J Anaesth 1986;58:605–609.
-
Gawaz MP, Dobos G, Späth M, Schollmeyer P, Gurland HJ, Mujais SK : Fonction altérée de la glycoprotéine membranaire plaquettaire IIb-IIIa dans l'insuffisance rénale terminale. J Am Soc Nephrol 1994;5:36–46.
-
Grejda S, Ellis K, Arino P : Paraplégie suite à une rachianesthésie chez un patient souffrant d'insuffisance rénale chronique. Reg Anesth 1989;14:155–157.
-
Boccardo P, Remuzzi G, Galbusera M : Dysfonctionnement plaquettaire dans l'insuffisance rénale. Semin Thromb Hemost 2004;30:579–589.
-
Rose M, Ness TJ : Hypoxie suite à un bloc interscalénique. Reg Anesth Pain Med 2002;27:94–96.
-
Alsalti RA, el-Dawlatly AA, al-Salman M, et al : Fistule artério-veineuse chez les patients insuffisants rénaux chroniques : comparaison entre trois techniques d'anesthésie différentes. Moyen-Orient J Anaesthesiol 1999;15:305–314.
-
Solomonson MD, Johnson ME, Ilstrup D : Facteurs de risque chez les patients subissant une intervention chirurgicale pour créer une fistule artério-veineuse. Anesth Analg 1994;79:694–700.
-
Elsharawy MA, Al-Metwalli R : L'anesthésie régionale influence-t-elle le résultat précoce de la fistule artério-veineuse du bras ? Saudi J Kidney Dis Transpl 2010;21:1048–1052.
-
Mouquet C, Bitker MO, Bailliart O, et al : Anesthésie pour la création d'une fistule de l'avant-bras chez les patients atteints d'insuffisance rénale terminale. Anesthésiologie 1989;70:909–914.
-
Malinzak EB, Gan TJ : Anesthésie régionale pour la chirurgie d'accès vasculaire. Anesth Analg 2009;109:976–980.
-
Schenk WG : Améliorer l'accès à la dialyse : l'anesthésie régionale améliore la prévalence de la fistule artério-veineuse. Am Surg 2010;76:938–942.
-
Sahin L, Gul R, Mizrak A, et al : Le bloc du plexus brachial infraclaviculaire guidé par ultrasons améliore le flux sanguin postopératoire dans les fistules artério-veineuses. J Vasc Surg 2011;54:749–753.
-
Rahimzadeh P, Safari S, Faiz SHR, Alavian SM : Anesthésie pour les patients atteints d'une maladie du foie. Hepat Mon 2014;14:e19881.
-
Tucker GT, Mather LE : Pharmacocinétique clinique des anesthésiques locaux. Clin Pharmacokinet 1979;4:241–278.
-
Tucker GT, Mather LE : Pharmacologie des agents anesthésiques locaux. Pharmacocinétique des anesthésiques locaux. Br J Anaesth 1975;47suppl : 213–224.
-
Rosenberg PH, Veering BT, Urmey WF : Doses maximales recommandées d'anesthésiques locaux : un concept multifactoriel. Reg Anesth Pain Med 2004; 29:564–575 ; débat 524.
-
Magorian T, Wood P, Caldwell J, et al : la pharmacocinétique et les effets neuromusculaires du bromure de rocuronium chez les patients atteints d'une maladie du foie. Anesth Analg 1995;80:754–759.
-
Servin F, Cockshott ID, Farinotti R, Haberer JP, Winckler C, Desmonts JM : Pharmacocinétique des perfusions de propofol chez les patients atteints de cirrhose. Br J Anaesth 1990;65:177–183.
-
Jokinen MJ, Neuvonen PJ, Lindgren L, et al : Pharmacocinétique de la ropivacaïne chez les patients atteints d'une maladie hépatique chronique en phase terminale. Anesthésiologie 2007 ; 106 : 43–55.
-
Barry M, Keeling PW, Weir D, Feely J : Gravité de la cirrhose et relation entre la concentration de glycoprotéine acide alpha 1 et la liaison aux protéines plasmatiques de la lidocaïne. Clin Pharmacol Ther 1990;47:366–370.
-
Thomson PD, Melmon KL, Richardson JA, et al : pharmacocinétique de la lidocaïne dans l'insuffisance cardiaque avancée, les maladies du foie et l'insuffisance rénale chez l'homme. Ann Intern Med 1973;78:499–508.
-
Lauprecht AE, Wenger FA, El Fadil O, Walz MK, Groeben H : concentrations plasmatiques de lévobupivacaïne après une résection hépatique majeure. J Anesth 2011;25:369–375.
-
Naguib M, Magboul MM, Samarkandi AH, Attia M : Effets indésirables et interactions médicamenteuses associés à l'anesthésie locale et régionale. Drug Saf 1998;18:221–250.
-
Reidenberg MM, James M, Dring LG : Le taux d'hydrolyse de la procaïne dans le sérum des sujets normaux et des patients malades. Clin Pharmacol Ther 1972;13:279–284.
-
Calvo R, Carlos R, Erill S : Effets de la maladie et de l'acétazolamide sur l'hydrolyse de la procaïne par les enzymes des globules rouges. Clin Pharmacol Ther 1980;27:179–183.
-
Lautt WW, Greenway CV : Revue conceptuelle du lit vasculaire hépatique. Hépatologie 1987;7:952–963.
-
Lautt WW, Macedo MP : Circulation hépatique et toxicologie. Drug Metab Rev 1997;29:369–395.
-
Gelman S : Anesthésie générale et circulation hépatique. Can J Physiol Pharmacol 1987;65:1762–1779.
-
Greitz T, Andreen M, Irestedt L : Hémodynamique et consommation d'oxygène chez le chien pendant un bloc épidural élevé avec une référence particulière à la région splanchnique. Acta Anaesthesiol Scand 1983;27:211–217.
-
Vagts DA, Iber T, Puccini M, et al : Les effets de l'anesthésie péridurale thoracique sur la perfusion hépatique et l'oxygénation chez les porcs sains pendant l'anesthésie générale et le stress chirurgical. Anesth Analg 2003;97:1824–1832.
-
Kelly DA, Tuddenham EG : Problèmes hémostatiques dans les maladies du foie. Gut 1986;27:339–349.
-
Shami VM, Caldwell SH, Hespenheide EE, Arseneau KO, Bickston SJ, Macik BG : Facteur VII activé recombinant pour la coagulopathie dans l'insuffisance hépatique fulminante par rapport à la thérapie conventionnelle. Liver Transpl 2003;9:138–143.
-
Dzik WH : Prédire l'hémorragie à l'aide de tests de dépistage de la coagulation préopératoire. Curr Hematol Rep 2004;3:324–330.
-
Horlocker TT, Wedel DJ, Rowlingson JC, et al : Anesthésie régionale chez le patient recevant un traitement antithrombotique ou thrombolytique : American Society of Regional Anesthesia and Pain Medicine Evidence-Based Guidelines (Third Edition). Reg Anesth Pain Med 2010;35:64–101.
-
Tzimas P, Prout J, Papadopoulos G, Mallett SV : Anesthésie péridurale et analgésie pour la résection hépatique. Anesthésie 2013 ; 68 : 628–635.
-
Coursin DB, Connery LE, Ketzler JT : Problèmes de gestion du diabète et de l'hyperglycémie périopératoires. Crit Care Med 2004;32:S116–S125.
-
Greene DA, Stevens MJ, Feldman EL : Neuropathie diabétique : portée du syndrome. Am J Med 1999;107:2S–8S.
-
Downs CA, Faulkner MS : Stress toxique, inflammation et symptomatologie des complications chroniques du diabète. Monde J Diabète 2015;6 : 554–565.
-
Kalichman MW, Calcutt NA : bloc de conduction induit par un anesthésique local et lésion des fibres nerveuses chez des rats diabétiques à la streptozotocine. Anesthésiologie 1992 ; 77 : 941–947.
-
Al-Nasser B : Effets toxiques de l'analgésie péridurale avec la ropivacaïne 0.2 % chez un patient diabétique. J Clin Anesth 2004;16:220–223.
-
Cuvillon P, Reubrecht V, Zoric L, et al : Comparaison de la durée du bloc du nerf sciatique sous-glutéal chez les patients diabétiques de type 2 et non diabétiques. Br J Anaesth 2013;110:823–830.
-
Sertoz N, Deniz MN, Ayanoglu HO : Relation entre le taux d'hémoglobine glycosylée et la performance du bloc du nerf sciatique chez les patients diabétiques. Foot Cheville Int 2013;34:85–90.
-
Kroin JS, Buvanendran A, Tuman KJ, Kerns JM : effet du contrôle glycémique aigu ou continu sur la durée du bloc du nerf sciatique anesthésique local chez les rats diabétiques. Reg Anesth Pain Med 2012;37:595–600.
-
Gronwald C, Vowinkel T, Hahnenkamp K : Procédures d'anesthésie régionale chez les patients immunodéprimés : risque d'infection. Curr Opin Anaesthesiol 2011;24:698–704.
-
Sites BD, Gallagher J, Sparks M : Le bloc poplité échoguidé démontre une réponse motrice atypique à la stimulation nerveuse chez 2 patients atteints de diabète sucré. Reg Anesth Pain Med 2003;28:479–482.
-
Keyl C, Held T, Albiez G, Schmack A, Wiesenack C : augmentation du seuil de stimulation nerveuse électrique du nerf sciatique chez les patients atteints de gangrène du pied diabétique : une étude de cohorte parallèle prospective. Eur J Anaesthesiol 2013;30:435–440.
-
Partanen J, Niskanen L, Lehtinen J, Mervaala E, Siitonen O, Uusitupa M : Histoire naturelle de la neuropathie périphérique chez les patients atteints de diabète sucré non insulino-dépendant. N Engl J Med 1995;333:89–94.
-
Krinsley JS : Effet d'un protocole de gestion intensive du glucose sur la mortalité des patients adultes gravement malades. Mayo Clin Proc 2004;79 : 992–1000.
- Falciglia M, Freyberg RW, Almenoff PL, D'Alessio DA, Render ML : La mortalité liée à l'hyperglycémie chez les patients gravement malades varie selon le diagnostic d'admission. Crit Care Med 2009;37:3001–3009.
- Sung J, Bochicchio GV, Joshi M, Bochicchio K, Tracy K, Scalea TM : L'hyperglycémie à l'admission est prédictive des résultats chez les patients traumatisés gravement malades. J Trauma 2005;59:80–83.
- Jensen CH, Berthelsen P, Kühl C, Kehlet H : Effet de l'analgésie péridurale sur la tolérance au glucose pendant la chirurgie. Acta Anaesthesiol Scand 1980;24 : 472–474.
- Houghton A, Hickey JB, Ross SA, Dupre J : Tolérance au glucose pendant l'anesthésie et la chirurgie. Comparaison de l'anesthésie générale et extradurale. Br J Anaesth 1978;50:495–499.
- Møller IW, Hjortsø E, Krantz T, Wandall E, Kehlet H : L'effet modificateur de la rachianesthésie sur la réponse corticosurrénalienne et hyperglycémique intra- et postopératoire à la chirurgie. Acta Anaesthesiol Scand 1984;28:266–269.
- Barker JP, Robinson PN, Vafidis GC, Hart GR, Sapsed-Byrne S, Hall GM : L'analgésie locale empêche le cortisol et les réponses glycémiques à la chirurgie de la cataracte. Br J Anaesth 1990;64:442–445.
- Vogt G, Heiden M, Lösche CC, Lipfert P : Un bloc rétrobulbaire préopératoire chez les patients subissant un flambage scléral réduit la douleur, la réponse au stress endogène et améliore la vigilance. Reg Anesth Pain Med 2003;28 : 521–527.
- Milosavljevic SB, Pavlovic AP, Trpkovic SV, Ilić AN, Sekulic AD : Influence de l'anesthésie rachidienne et générale sur la réponse métabolique, hormonale et hémodynamique chez les patients chirurgicaux électifs. Med SciMonit 2014;20:1833–1840.
- Camu F : Intolérance aux glucides pendant l'anesthésie à l'halothane chez le chien. Acta Anaesthesiol Belg 1973;24:177–188.
- Richardson J, Jones J, Atkinson R : L'effet du bloc paravertébral thoracique sur les potentiels évoqués somatosensoriels intercostaux. Anesth Analg 1998;87:373–376.
- Mendell JR, Sahenk Z : Pratique clinique. Neuropathie sensorielle douloureuse. N Engl J Med 2003;348:1243–1255.
- Duyff RF, Bosch J Van den, Laman DM, Loon BJ van, Linssen WH : Découvertes neuromusculaires dans le dysfonctionnement thyroïdien : une étude prospective clinique et électrodiagnostique. J Neurol Neurosurg Psychiatr 2000;68 : 750–755.
- Misiunas A, Niepomniszcze H, Ravera B, Faraj G, Faure E : Neuropathie périphérique dans l'hypothyroïdie subclinique. Thyroïde 1995;5:283–286.
- Khedr EM, El Toony LF, Tarkhan MN, Abdella G : Altérations du système nerveux périphérique et central dans l'hypothyroïdie : résultats électrophysiologiques. Neuropsychobiologie 2000;41:88–94.
- Shirabe T, Tawara S, Terao A, Araki S : Polyneuropathie myxœdémateuse : une étude au microscope optique et électronique du nerf périphérique et du muscle. J Neurol Neurosurg Psychiatr 1975;38:241–247.
- Upton AR, McComas AJ : Le double écrasement dans les syndromes de piégeage nerveux. Lancet 1973 ; 2 : 359–362.
- Hebl JR, Horlocker TT, Pritchard DJ : Plexopathie brachiale diffuse après bloc interscalénique chez un patient recevant une chimiothérapie au cisplatine : le syndrome de double écrasement pharmacologique. Anesth Analg 2001;92:249–251.
- Schenker M, Kraftsik R, Glauser L, Kuntzer T, Bogousslavsky J, Barakat-Walter I : L'hormone thyroïdienne réduit la perte de neurones sensoriels axotomisés dans les ganglions de la racine dorsale après une transection du nerf sciatique chez le rat adulte. Exp Neurol 2003;184:225–236.
- Norcross-Nechay K, Richards GE, Cavallo A : Les potentiels évoqués montrent des anomalies précoces et retardées chez les enfants atteints d'hypothyroïdie congénitale. Neuropediatrics 1989;20:158–163.
- Organisation mondiale de la santé. Obésité et surpoids. Mis à jour en janvier 2015. http://www.who.int/mediacentre/factsheets/fs311/en/.
- Centres pour le Contrôle et la Prévention des catastrophes. Obésité et surpoids pour les professionnels : données et statistiques ; les faits. Mis à jour le 14 septembre 2015. http://www.cdc.gov/obesity/data/facts.html.
- Broadbent CR, Maxwell WB, Ferrie R, Wilson DJ, Gawne-Cain M, Russell R : Capacité des anesthésistes à identifier un espace lombaire marqué. Anesthésie 2000 ; 55 : 1122–1126.
- Nielsen KC, Guller U, Steele SM, Klein SM, Greengrass RA, Pietrobon R : Influence de l'obésité sur l'anesthésie régionale chirurgicale en milieu ambulatoire : une analyse de 9,038 2005 blocs. Anesthésiologie 102 ; 181 : 187–XNUMX.
- Hanouz JL, Grandin W, Lesage A, Oriot G, Bonnieux D, Gérard JL : Bloc du plexus brachial axillaire par injections multiples : influence de l'obésité sur le taux d'échec et l'incidence des complications aiguës. Anesth Analg 2010; 111:230–233.
- Pham-Dang C, Meunier JF, Poirier P, et al : Une nouvelle approche axillaire pour le bloc continu du plexus brachial. Une étude clinique et anatomique. Anesth Analg 1995;81:686–693.
- Tan WS, Spigos DG : bloc du nerf sciatique sous guidage fluoroscopique. Cardiovasc Intervent Radiol 1986; 9:59–60.
- Eidelman A, Shulman MS, Novak GM : Imagerie fluoroscopique pour la rachianesthésie techniquement difficile. J Clin Anesth 2005;17:69–71.
- Brodsky JB, Mariano ER : Anesthésie régionale chez le patient obèse : repères perdus et guidage échographique en évolution. Best Pract Res Clin Anaesthesiol 2011;25:61–72.
- Al-Nasser B : Revue du bloc interscalénique pour l'analgésie postopératoire après chirurgie de l'épaule chez les patients obèses. Acta Anesthesiol Taïwan 2012 ; 50:29–34.
- Marhofer P, Pilz-Lubsczyk B, Lönnqvist PA, Fleischmann E : Anesthésie régionale périphérique guidée par ultrasons : une étude de faisabilité chez les femmes obèses par rapport aux femmes de poids normal. Int J Obes (Londres) 2014;38:451–455.
- Wallace DH, Currie JM, Gilstrap LC, Santos R : Orientation échographique indirecte pour l'anesthésie péridurale chez les patientes enceintes obèses. Reg Anesth 1992;17:233–236.
- Grau T, Leipold RW, Horter J, Conradi R, Martin E, Motsch J : L'espace épidural lombaire pendant la grossesse : visualisation par échographie. Br J Anaesth 2001;86:798–804.
- Chin KJ, Perlas A, Chan V, Brown-Shreves D, Koshkin A, Vaishnav V : L'imagerie par ultrasons facilite la rachianesthésie chez les adultes présentant des repères anatomiques de surface difficiles. Anesthésiologie 2011 ; 115 : 94–101.
- McCulloch WJ, Littlewood DG : Influence de l'obésité sur l'analgésie rachidienne avec la bupivacaïne isobare à 0.5 %. Br J Anaesth 1986;58:610–614.
- Reyes M, Pan PH : Rachianesthésie à très faible dose pour césarienne chez une patiente prééclamptique obèse morbide et ses implications potentielles. Int J Obstet Anesth 2004;13:99–102.
- Norris MC : Variables patientes et propagation sous-arachnoïdienne de la bupivacaïne hyperbare chez la parturiente à terme. Anesthésiologie 1990 ; 72 : 478–482.
- Greene NM : distribution des solutions anesthésiques locales dans l'espace sous-arachnoïdien. Anesth Analg 1985;64:715–730.
- Stienstra R, Greene NM : Facteurs affectant la propagation sous-arachnoïdienne des solutions anesthésiques locales. Reg Anesth 1991;16:1–6.
- Kim WH, Lee JH, Ko JS, et al : L'effet de l'indice de masse corporelle sur la rachianesthésie pour l'arthroplastie totale du genou : une étude dose-réponse. Anaesth Intensive Care 2012;40:410–416.

