Marina Gitman, Michael Fettiplace et Guy Weinberg
INTRODUCTION
L'introduction de la cocaïne comme première anesthésie locale (LA) à la fin du XIXe siècle a rapidement été accompagnée de rapports sur sa toxicité systémique. Les symptômes de toxicité étaient fréquemment décrits comme des convulsions ou une insuffisance respiratoire, mais certains cas comprenaient également des comptes rendus d'effets cardiaques indésirables. Souvent létale, la toxicité systémique des anesthésiques locaux (LAST) était traitée avec de la caféine, de l'ammoniac ou même de l'éther hypodermique. Le développement de la procaïne en 1904 n'a pas résolu le problème de la toxicité systémique, et le Comité pour l'étude des effets toxiques des anesthésiques locaux a publié un rapport de 43 cas mortels liés à l'utilisation des AL. L'identification des facteurs contributifs, l'accent mis sur la prévention et l'élimination presque complète de la cocaïne de la pratique clinique ont contribué à réduire l'incidence du LAST pendant près de 50 ans.
Cependant, la synthèse d'AL liposolubles à longue durée d'action tels que la bupivacaïne à la fin des années 1950 avec des rapports associés ultérieurs de LAST a entraîné le retour de LAST létal. Ceux-ci comprenaient de multiples cas de décès fœtal associés à des blocs nerveux paracervicaux, une fibrillation ventriculaire après une bloc nerveux interscalénique, et ce qui est considéré comme le cas « sentinelle » d'un jeune homme victime d'un arrêt cardiaque suite à un blocage du nerf caudal. Les décennies suivantes ont été marquées par des récits isolés décrivant un problème commun : la mort cardiovasculaire (CV) associée au LAST qui était particulièrement résistant aux mesures de réanimation disponibles, telles que les vasopresseurs (par exemple, l'épinéphrine) et la défibrillation.
MÉCANISME DE LA TOXICITÉ DES ANESTHÉSIQUES LOCAUX
Les anesthésiques locaux sont généralement sûrs et efficaces lorsqu'ils sont limités au site de traitement, comme une infiltration tissulaire, près d'un nerf ou d'un plexus de nerfs. Cependant, si une grande quantité d'AL atteint la circulation systémique, des taux sanguins et tissulaires suprathérapeutiques peuvent entraîner une toxicité. Ce transit dans le sang peut être dû à une injection intravasculaire accidentelle ou à une absorption vasculaire par propagation locale. Au site cible, les LA réduisent le flux d'ions sodium à travers les canaux sodium voltage-dépendants en combinant une barrière énergétique accrue et un encombrement stérique. Ce bloc nerveux se produit du côté intracellulaire et nécessite que les LA se déplacent d'abord à travers la bicouche lipidique. Les AL bloquent également les canaux calciques nerveux et d'autres canaux à des concentrations similaires. À des concentrations plus faibles, les AL bloquent la signalisation de la protéine kinase induite par le facteur de nécrose tumorale α. À des concentrations plus élevées, les AL peuvent inhiber d'autres canaux, enzymes et récepteurs, y compris la translocase carnitine-acylcarnitine dans les mitochondries.
En savoir plus sur le mécanisme d'action des anesthésiques locaux
Bien qu'il n'y ait pas de consensus clair, la toxicité cardiaque est probablement causée par la combinaison d'un dysfonctionnement électrophysiologique et contractile. Par rapport aux autres LA d'usage clinique courant, la bupivacaïne est plus lipophile et a une plus grande affinité pour les canaux sodiques voltage-dépendants. Ces qualités peuvent contribuer à son profil cardiotoxique. Il convient de noter qu'une toxicité peut survenir à des concentrations sériques inférieures à celles attendues car les LA s'accumulent dans les mitochondries et le tissu cardiaque dans un rapport d'environ 6: 1 (ou plus) par rapport au plasma.
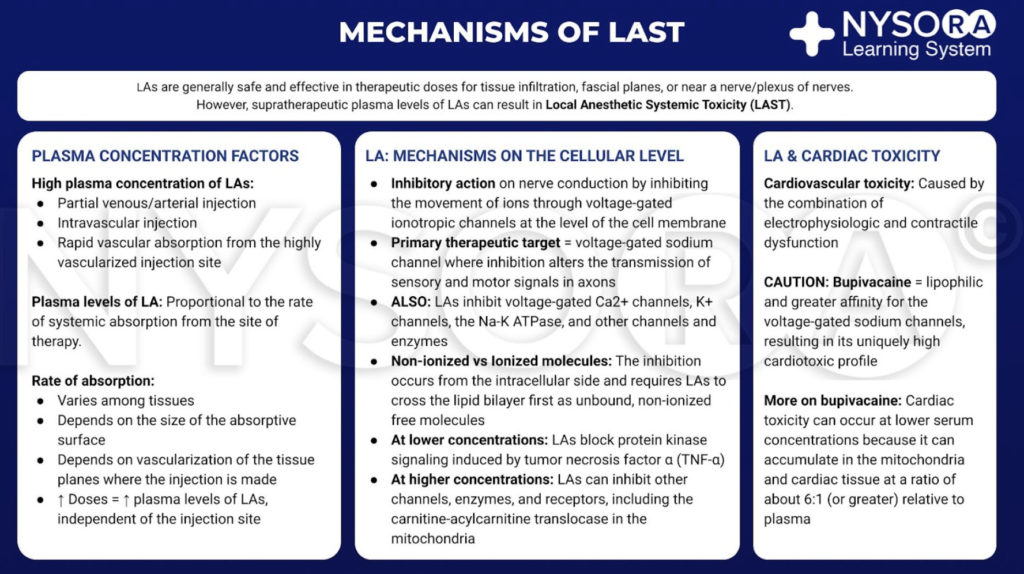
Extrait du Compendium of Regional Anesthesia: Mécanismes de l'infographie sur la toxicité systémique des anesthésiques locaux.
DIAGNOSTIC ET FACTEURS CONTRIBUANTS
La présentation typique du LAST commence généralement par des symptômes et des signes prodromiques, tels qu'un engourdissement périoral, des acouphènes, une agitation, une dysarthrie et une confusion. Celles-ci peuvent être suivies de troubles plus graves du système nerveux central (SNC) tels que des convulsions et un coma. Des troubles CV peuvent également survenir, se manifestant initialement par une hypertension et une tachycardie, puis une bradycardie et une hypotension, avec une progression vers des complications plus graves, notamment des arythmies ventriculaires et une asystole. La majorité des événements indésirables surviennent dans la minute qui suit l'injection d'AL, mais tous les cas ne suivent pas ce schéma. La toxicité peut avoir un début retardé de plus d'une heure après l'injection et peut se manifester par un dysfonctionnement CV isolé ou par une combinaison de signes du SNC et CV sans progression classique.
Les variables qui augmentent le risque de toxicité comprennent le type d'AL et la dose, le site d'injection, les comorbidités du patient, les extrêmes d'âge et la petite taille ou la masse musculaire limitée. La lipophilicité d'un LA est associée à la toxicité. Les AL plus lipophiles comme la bupivacaïne ont un risque accru de toxicité par rapport aux AL moins lipophiles comme la mépivacaïne et la lidocaïne.
Une dose totale plus élevée et le rapport dose-poids du médicament peuvent potentiellement augmenter la possibilité de LAST. En particulier, le muscle squelettique agit comme un dépôt pour l'AL absorbé systémiquement, ce qui peut expliquer le risque clinique de LAST chez les patients de petite taille dont la masse musculaire est sensiblement inférieure à la normale. En conséquence, les blocs nerveux et les anesthésiques périduraux qui nécessitent des doses plus importantes comportent un risque inhérent pour ces patients. Par exemple, des blocs nerveux bilatéraux dans le plan transverse de l'abdomen réalisés avec jusqu'à 40 ml de ropivacaïne à 0.5 % peuvent entraîner une incidence accrue de toxicité locale.
Enfin et surtout, le site d'injection contribue également au risque de propagation vasculaire du médicament. L'enseignement classique selon lequel l'absorption vasculaire des AL est la plus élevée avec blocs nerveux intercostaux suivie par épidurale et les injections du plexus brachial correspondent aux données cliniques démontrant que l'incidence la plus élevée de LAST survient avec blocs nerveux paravertébraux, suivi des blocs nerveux du membre supérieur et du tronc/membre inférieur.
Les facteurs de risque dépendant du patient comprennent le dysfonctionnement des organes, le taux sérique des protéines de liaison et l'âge. Préexistant maladie cardiaque peut rendre les patients plus sujets aux effets dépresseurs arythmogènes et myocardiques des AL. Une extrême prudence est recommandée pour les personnes souffrant d'insuffisance cardiaque décompensée, d'une pathologie valvulaire grave ou d'une fonction ventriculaire déprimée. Un dysfonctionnement hépatique ou rénal peut entraîner une diminution du métabolisme et de la clairance et une augmentation du taux de médicament en circulation. De plus, une insuffisance hépatique/rénale, une malnutrition ou tout autre processus pathologique entraînant une diminution du taux sérique d'albumine peut augmenter indirectement le taux de médicament libre pour une dose donnée.
Les patients aux extrêmes d'âge sont plus sensibles à la toxicité, une découverte qui peut être liée à un certain nombre de facteurs. La personnes âgées sont plus susceptibles d'avoir un dysfonctionnement organique, ce qui contribuera à la toxicité. De plus, les patients âgés et pédiatriques peuvent avoir une masse musculaire réduite et, en tant que tels, sont plus susceptibles de recevoir une dose plus élevée de médicament pour leur poids. La plupart des enfants sont anesthésiés lorsqu'un bloc nerveux est placé, de sorte que les premiers symptômes seront manqués, et un trouble du SNC/cardiaque plus grave pourrait être le premier signe de toxicité.

Tiré du Compendium of Regional Anesthesia: Symptômes, diagnostic et traitement de l'infographie sur la toxicité systémique des anesthésiques locaux.
OCCURRENCE DE TOXICITÉ
L'anesthésie neuraxiale et les blocs nerveux périphériques (PNB) sont les procédures les plus couramment réalisées nécessitant l'utilisation d'AL. Le faible volume de médicament requis pour le dosage intrathécal pose rarement un problème. Cependant, le volume élevé requis pour anesthésie péridurale et les PNB augmentent le risque de LAST. Les données actuellement disponibles indiquent que l'incidence du LAST associé aux PNB a diminué de 1.6-2/1000 dans les années 1990 à 0.08-0.98/1000 entre 2003 et 2013. En fait, une étude récente n'a observé aucun cas de LAST avec plus de 9000 PNB sur une période de 6 ans. De même, l'incidence de LAST avec anesthésie péridurale a diminué de 9.75/1000 au début des années 1980 à 0.1-1.2/1000 dans les années 1990 et est restée à 0.1/1000 en 2003.
Alors que les grandes études de population se limitent principalement aux péridurales et aux PNB, il existe de nombreux rapports décrivant le LAST avec d'autres types d'anesthésie locale. Par exemple, avec la popularité récente d'un bloc nerveux dans le plan transverse de l'abdomen pour les procédures abdominales, il y a eu plusieurs cas de LAST après que ces blocs nerveux aient été réalisés pour des césariennes.
Une toxicité neurologique a également été décrite après l'utilisation topique d'AL, que les anesthésistes utilisent fréquemment avant l'instrumentation des voies respiratoires pour intubation éveillée. Ceci est probablement sous-déclaré car les symptômes neurologiques peuvent être légers (engourdissement périoral, acouphènes, agitation) et masqués par une sédation préopératoire qui précède l'induction de l'anesthésie générale qui suit immédiatement l'intubation éveillée.
Les causes occasionnelles de LAST en dehors de la portée habituelle d'un anesthésiste comprennent blocs nerveux rétrobulbaires pour la chirurgie ophtalmologique et blocs nerveux alvéolaires inférieurs pour les procédures dentaires. La toxicité d'un bloc nerveux rétrobulbaire est causée par la propagation sous-arachnoïdienne de l'anesthésique provoquant une anesthésie du tronc cérébral; qui peuvent se manifester par une altération de l'état mental, de l'apnée et des convulsions. Les rapports spécifiques de LAST après blocs nerveux alvéolaires inférieurs sont rares, mais il s'agit clairement d'un risque potentiel. La zone richement vasculaire de l'espace ptérygomandibulaire augmente le risque de placement d'une aiguille intravasculaire, qui peut atteindre 15.3 % même chez les chirurgiens buccaux expérimentés. Enfin, il y a une augmentation récente de l'utilisation des blocs nerveux régionaux dans les salles d'urgence et des rapports correspondants de LAST dans la salle d'urgence, mais l'ampleur de ce problème est actuellement inconnue.
TRAITEMENT
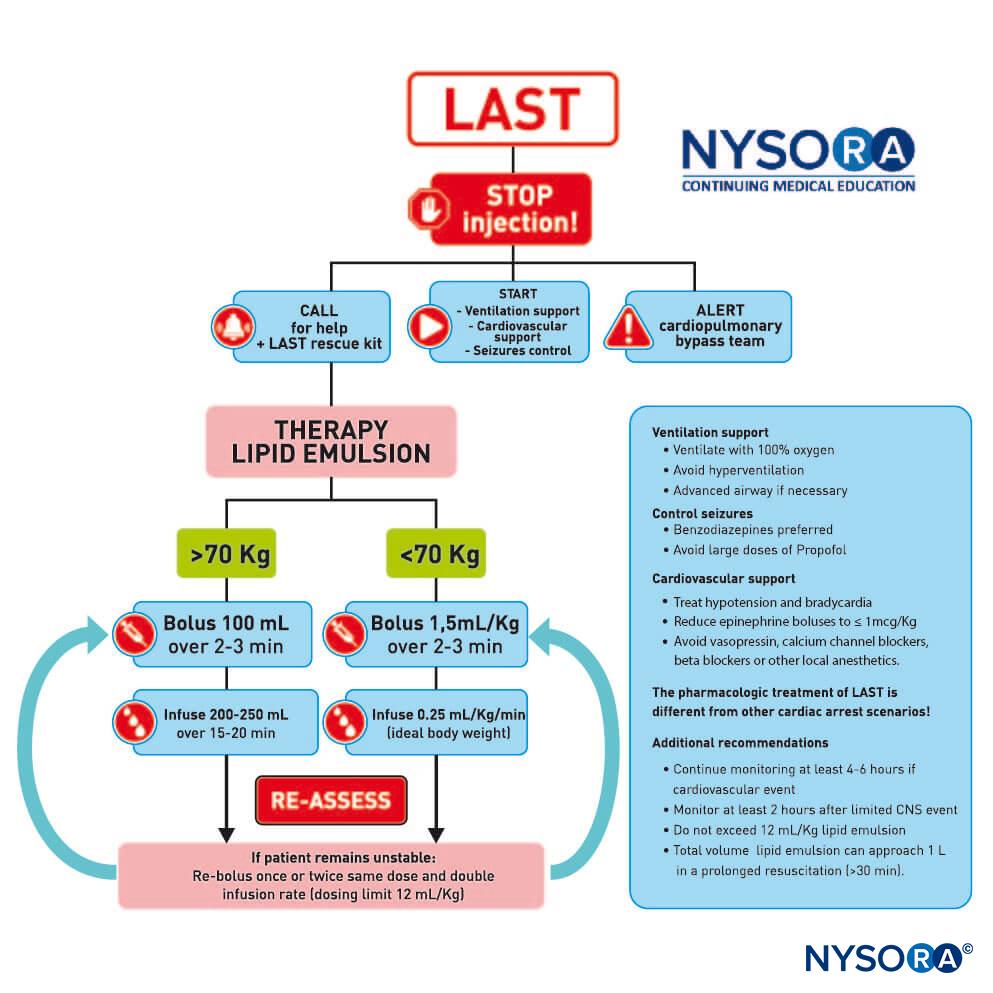
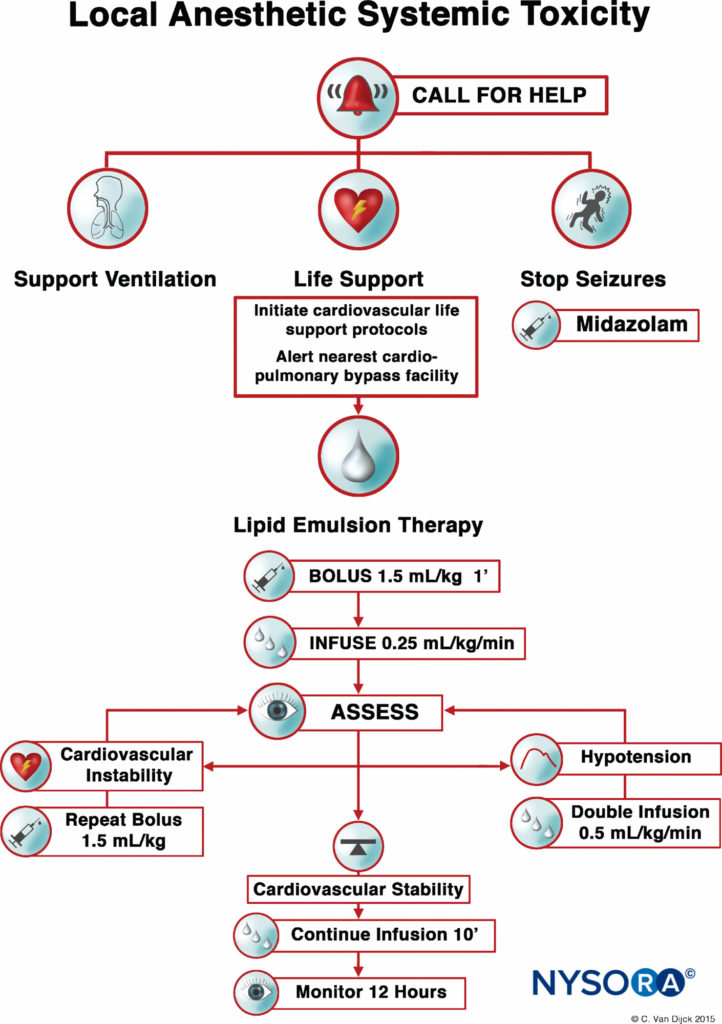
Actuellement, les trois piliers du traitement LAST consistent en la gestion des crises, l'assistance cardiaque avancée (ACLS) et l'administration rapide d'une émulsion lipidique à 20 %. Pour les patients hémodynamiquement stables présentant une activité convulsive isolée, des benzodiazépines intraveineuses peuvent être utilisées. De petites doses de propofol sont considérées par certains comme une alternative acceptable pour le contrôle des crises, mais peuvent aggraver le dysfonctionnement cardiaque qui peut se développer avec le LAST. L'oxygène supplémentaire est approprié pour tout patient présentant des signes de LAST, mais pour les patients souffrant d'apnée, d'arythmies hémodynamiquement instables ou d'arrêt cardiaque, une gestion immédiate et plus agressive des voies respiratoires ou une assistance circulatoire est nécessaire. Les objectifs sont de maintenir une ventilation pulmonaire et une perfusion adéquate des organes avec du sang bien oxygéné et d'éviter une acidose supplémentaire jusqu'au début du traitement par émulsion lipidique.
Avant l'introduction de la réanimation par émulsion lipidique, le traitement de la toxicité cardiaque sévère était limité à l'ACLS et à la circulation extracorporelle. L'utilisation de vasopresseurs pendant la réanimation a potentiellement aggravé l'acidose et les arythmies. La circulation extracorporelle avait été utilisée dans certains cas ; malheureusement, tous les hôpitaux n'ont pas cette capacité. L'idée qu'une substance riche en lipides a le potentiel d'inverser les effets de certains médicaments a commencé dans les années 1960, lorsque plusieurs expérimentations animales ont démontré que l'administration intraveineuse d'une émulsion d'huile diminuait la durée d'action du thiopental ou diminuait la fraction libre de chlorpromazine dans du sang. Par hasard, en 1997, le cas de LAST chez une jeune femme atteinte d'acidémie isovalérique et de carence en carnitine a inspiré une série d'expérimentations animales. La carnitine est nécessaire au transport des acides gras dans les mitochondries pour la β-oxydation, et l'accumulation d'acylcarnitines cytoplasmiques (par exemple, pendant l'ischémie myocardique) est associée à des arythmies. Ainsi, Weinberg et al ont émis l'hypothèse que la surcharge des cellules avec des acides gras exogènes en infusant une émulsion lipidique exacerberait la toxicité des LA. Étonnamment, c'est le contraire qui a été constaté. L'infusion d'une émulsion grasse a diminué et même inversé la toxicité des LA.
En 2006, la première réanimation réussie d'un patient humain avec une émulsion lipidique a été rapportée. Depuis lors, de nombreux rapports cliniques ont décrit une inversion efficace de LAST chez les adultes et les enfants. Le traitement de la toxicité avec une émulsion lipidique intraveineuse a été appelé thérapie de réanimation lipidique (LRT). Le mécanisme de la LRT est multimodèle en action, les lipides exerçant à la fois un effet de piégeage (anciennement connu sous le nom de « puits lipidique ») et un effet cardiotonique direct.
L'effet de piégeage est modéré par la capacité de l'émulsion lipidique à absorber les fractions lipophiles et à les transférer autour du sang vers les sites de stockage et de détoxification. Cela procure un effet de « navette lipidique ». Cependant, l'effet de piégeage n'est pas suffisant pour expliquer la récupération rapide. Un deuxième effet se produit par lequel, dans les modèles de laboratoire, l'infusion de l'émulsion lipidique augmente le débit cardiaque grâce à une combinaison d'effets de volume et de cardiotonique direct pour améliorer le débit cardiaque une fois que la concentration cardiaque du médicament tombe en dessous des seuils de blocage des canaux ioniques. Une émulsion lipidique à 20 % est efficace dans le traitement du LAST causé par la bupivacaïne ainsi que d'autres AL moins solubles, comme la ropivacaïne, la mépivacaïne et la lidocaïne.
La DL50 de l'émulsion lipidique (dose létale médiane) testée dans un modèle de rat s'est avérée bien supérieure aux doses utilisées pour le sauvetage des lipides chez l'homme. Les effets secondaires potentiels comprennent l'interférence avec les mesures de laboratoire clinique (hémoglobine, méthémoglobine, électrolytes, excès de base); réactions allergiques; nausées/vomissements ; dyspnée; et des douleurs thoraciques. Néanmoins, les effets secondaires réels signalés se limitent au bronchospasme, à l'hyperamylasémie et à l'interférence des mesures de laboratoire.
La transaminite, l'hépatosplénomégalie et la contamination bactérienne sont généralement associées à l'utilisation prolongée d'une émulsion lipidique et ne jouent aucun rôle dans l'administration à court terme de LAST. Bien que l'utilisation de volumes élevés d'émulsion lipidique (en particulier 30 %) chez les nouveau-nés prématurés et de faible poids à la naissance ait été associée à la mort par accumulation de graisse dans les poumons, il existe des rapports de cas chez les nouveau-nés, les tout-petits et les enfants plus âgés d'inversion réussie du médicament. surdosage (bupivacaïne et non-AL) en utilisant les régimes standard recommandés de 20 % de lipides. Enfin, comme mentionné, il faut faire preuve de prudence avec l'utilisation du propofol dans ce contexte : il ne remplace pas une émulsion lipidique. La teneur en lipides des doses sédatives ou anticonvulsives standard de propofol est insuffisante pour exercer un effet bénéfique en cas de surdosage ; cependant, le propofol peut compromettre la stabilité du CV.
Après que de nombreux rapports de cas aient validé le rôle du LRT comme traitement efficace du LAST, l'American Society of Regional Anesthesia and Pain Medicine (ASRA) a publié un avis de pratique en 2010 suivi en 2012 d'une liste de contrôle pour la gestion du LAST (Figure 1). Les lignes directrices soulignent l'importance de la réanimation cardiopulmonaire immédiate et fournissent un algorithme détaillé pour le dosage et l'administration de l'émulsion lipidique.
L'utilisation opportune de la LRT, dès les premiers signes de toxicité, peut améliorer les efforts de réanimation et diminuer la quantité de vasopresseurs utilisés. Comme pour toute urgence vitale, il est essentiel de sécuriser l'accès intraveineux ; cependant, l'administration intraosseuse d'émulsion lipidique est une alternative possible si l'accès intraveineux s'avère problématique.
PRÉVENTION
Comme toujours, le meilleur traitement est la prévention. Cela est particulièrement vrai pour LAST. L'efficacité et la disponibilité de la LRT ne diminuent pas la morbidité potentielle même en cas de traitement réussi. La présence d'une « solution miracle » n'enlève pas la nécessité d'être prudent. Pour cette raison, l'utilisation d'ultrasons, de marqueurs intravasculaires, d'injections progressives avec aspiration, de médicaments moins toxiques et de la dose efficace la plus faible est recommandée.
Conseils NYSORA
- Il existe une plus grande probabilité de toxicité systémique de l'AL chez les patients de petite taille (petite masse musculaire), ceux d'âge extrême et les patients présentant une maladie cardiaque préexistante ou une carence en carnitine.
- Environ la moitié des cas de LAST sont atypiques, sans convulsions (autres symptômes du système nerveux central), uniquement une toxicité CV ou une apparition retardée.
- L'incidence de la toxicité augmente avec les injections à proximité de zones richement vasculaires. Il est le plus élevé avec les injections paravertébrales, suivies des PNB des membres supérieurs et inférieurs.
- La prévention de la morbidité liée au LAST nécessite l'optimisation d'un système complet d'anesthésie régionale : sélection du patient, choix du bloc nerveux, médicament et dose, surveillance complète et utilisation de l'USGRA lorsque cela est possible, et préparation au LAST en disposant d'un kit et en s'entraînant avec simulation.
- La prévention comprend également la sensibilisation et l'éducation de nos collègues non anesthésiologistes sur l'utilisation appropriée des LA et les risques, y compris la gestion des LAST.
L'échographie offre plusieurs avantages potentiels. Il permet une visualisation directe de la propagation injectable du médicament, la détection d'une injection intravasculaire involontaire et l'utilisation de plus petits volumes d'AL. De plus, il existe des preuves que l'utilisation de l'échographie pour les PNB peut réduire l'incidence du LAST.
Un marqueur intravasculaire tel que 10 à 15 μg d'épinéphrine a une sensibilité raisonnable (bien qu'imparfaite) et une valeur prédictive positive et peut être administré avec une dose test. Une augmentation de la fréquence cardiaque de 10 battements/minute ou plus ou une augmentation de la pression artérielle systolique de 15 mm Hg ou plus suggère une injection intravasculaire. L'injection progressive d'AL (généralement 3 à 5 ml) et l'aspiration fréquente ont été régulièrement recommandées et, associées à l'utilisation de la dose test, peuvent avoir contribué à la diminution de l'incidence des LAST observées avec les péridurales.
Enfin, l'utilisation de la dose efficace la plus faible offre une marge de sécurité supplémentaire. Il est également raisonnable d'ajuster une dose à la baisse pour les patients reconnus comme ayant une condition qui pourrait augmenter leur susceptibilité au LAST. Cela semble quelque peu redondant si l'on utilise toujours la moindre dose nécessaire pour tout bloc nerveux. La prudence est de mise. Aucune de ces mesures n'est en elle-même précise ou parfaite ; par conséquent, il est essentiel de ne pas compter sur une seule étape de prévention, mais d'en intégrer plusieurs plus le bon sens pour faire passer la sécurité des patients au premier plan.
SENSIBILISATION ET ÉDUCATION
Les anesthésistes utilisent les LA tous les jours dans divers lieux de pratique et pour une grande variété de procédures. Ainsi, chaque site où les LA sont utilisés à des doses potentiellement toxiques doit être équipé d'un matériel de réanimation de base et d'une émulsion lipidique à 20 %. De plus, la liste de contrôle ASRA pour le traitement du LAST peut aider à guider le processus de traitement. Il a été démontré qu'un outil électronique d'aide à la décision améliore le respect des directives lors de la simulation de la gestion du LAST et peut être bénéfique dans les cas réels. Enfin, l'éducation des prestataires non anesthésistes est cruciale pour les sensibiliser à la fois au risque de LAST et à son traitement. Les patients pourraient être sauvés si de tels événements très rares sont correctement diagnostiqués et gérés par des non-anesthésistes ou d'autres parmi les non-initiés qui, autrement, resteront ignorants du risque. L'éducation diffère selon les institutions et les départements, mais il existe une connaissance sous-optimale du dosage LA, des précautions de sécurité et du traitement de LAST parmi d'autres spécialités. Pour cette raison, la liste de contrôle ASRA et l'outil électronique d'aide à la décision peuvent être précieux pour les médecins en cas de toxicité LA.
Références
- Drasner K : Toxicité systémique des anesthésiques locaux. Une perspective historique. Reg Anesth Pain Med 2010;35:162–166.
- Mayer E: Les effets toxiques suite à l'utilisation d'anesthésiques locaux: une analyse des rapports de quarante-trois décès soumis au Comité pour l'étude des effets toxiques des anesthésiques locaux de l'American Medical Association, et les recommandations du comité. JAMA 1924;82:875–876.
- Edde RR, Deutsch S : Arrêt cardiaque après bloc interscalénique du plexus brachial. Anesth Analg 1977;56:446–447.
- Prentiss JE : Arrêt cardiaque suite à une anesthésie caudale. Anesthésiologie 1979 ; 50 : 51–53.
- Clarkson CW, Hondeghem LM : Mécanisme de la dépression à la bupivacaïne de la conduction cardiaque : blocage rapide des canaux sodiques pendant le potentiel d'action avec récupération lente du blocage pendant la diastole. Anesthésiologie 1985 ; 62 : 396–405.
- Coyle DE, Sperelakis N: La bupivacaïne et la lidocaïne bloquent les potentiels d'action lente médiés par le calcium dans le muscle ventriculaire du cobaye. J Pharmacol Exp Ther 1987;242:1001–1005.
- Piegeler T, Votta-Velis, Bakhshi FR, et al : Protection de la barrière endothéliale par des anesthésiques locaux : la ropivacaïne et la lidocaïne bloquent l'activation de la cellule endothéliale induite par le facteur de nécrose tumorale a. Anesthésiologie 2014 ;120 : 1414–1428.
- Weinberg GL, Palmer JW, VadeBoncouer, et al : la bupivacaïne inhibe l'échange d'acylcarnitine dans les mitochondries cardiaques. Anesthésiologie 2000;92 : 523–528.
- Wolfe JW, Butterworth JF : Toxicité systémique des anesthésiques locaux : mise à jour sur les mécanismes et le traitement. Curr Opin Anesthesiol 2011;24:561–566.
- Albright EA : Arrêt cardiaque suite à une anesthésie régionale avec de l'étidocaïne ou de la bupivacaïne. Anesthésiologie 1979 ; 51 : 285–287.
- Heavner JE : Toxicité cardiaque des anesthésiques locaux dans le modèle de cœur isolé intact : une revue. Reg Anesth Pain Med 2002;27:545–555.
- Hiller N, Mirtschink P, Merkel C, et al : L'accumulation myocardique de bupivacaïne et de ropivacaïne est associée à des effets réversibles sur les mitochondries et à une réduction de la fonction myocardique. Anesth Analg 2013; 116: 83-92.
- Fettiplace MR, Pichurko A, Ripper R, et al : La dépression cardiaque induite par la cocaïne ou le cocaéthylène est soulagée par l'émulsion lipidique plus efficacement que par la sulfobutyléther-B-cyclodextrine. Acad Emerg Med 2015;22:508–517.
- Di Gregorio, Neal JM, Rosenquist RW, et al : Présentation clinique de la toxicité systémique des anesthésiques locaux. Un examen des cas publiés, 1979-2009. Reg Anesth Pain Med 2010;35:181–187.
- Pertrar S : L'anesthésie locale totale administrée fait partie intégrante du syndrome de toxicité systémique de l'anesthésique local. Anesthésiologie 2014 ;121 : 1130–1131.
- Barrington MJ, Kluger R : Le guidage échographique réduit le risque de toxicité systémique anesthésique locale après un blocage des nerfs périphériques. Reg Anesth Pain Med 2013;38:289–299.
- Eng HC, Ghosh SM, Chin KJ : Utilisation pratique des anesthésiques locaux dans anesthésie régionale. Curr Opin Anesthesiol 2015;27:382–387.
- Calenda E, Baste JM, Hajjej R, et al : Concentration plasmatique toxique de ropivacaïne après un bloc paravertébral chez un patient souffrant d'hypoalbuminémie sévère. J Clin Anesth 2014;26:149–151.
- Fagenholz PJ, Bowler GM, Carnochan FM, et al : Local systémique toxicité anesthésique du bloc paravertébral thoracique continu. Br J Anaesth 2012;109:260–262.
- Lonnqvist PA : Toxicité des anesthésiques locaux : une perspective pédiatrique. Paediatr Anaesth 2012;22:39–43.
- Auroy Y, Narchi P, Messiah A, et al : Complications graves liées à l'anesthésie locorégionale : résultats d'une enquête prospective en France. Anesthésiologie 1997 ;87 : 447–486.
- Auroy Y, Benhamou D, Barques L, et al : Complications majeures de l'anesthésie locorégionale en France : la permanence SOS Anesthésie Régionale. Anesthésiologie 2002 ;97 :1274–1280.
- Brown, Ransom DM, Hall JA, et al : Anesthésie régionale et locale toxicité systémique induite par l'anesthésie : fréquence des crises et modifications cardiovasculaires associées. Anesth Analg 1995;81:321–328.
- Barrington MJ, Watts SA, Gledhill SR, et al : résultats préliminaires de l'Australian Regional Anesthesia Collaboration. Un audit prospectif de plus de 7000 blocs nerveux et plexus périphériques pour complications neurologiques et autres. Reg Anesth Pain Med 2009;34:534–541.
- Sites BD, Taenzer AH, Herrick MD, et al : incidence de la toxicité systémique des anesthésiques locaux et des symptômes neurologiques postopératoires associés à 12,668 2012 blocs nerveux guidés par échographie. Une analyse d'un registre clinique prospectif. Reg Anesth Pain Med 37;478:482–XNUMX.
- Orebaugh SL, Kentor ML, Williams BA : Effets indésirables associés avec nerf périphérique guidé par stimulateur nerveux et guidé par ultrasons blocs par des stagiaires encadrés : mise à jour d'une base de données mono-site. Reg Anesth Pain Med 2012;37:577–582.
- Tanaka K, Watanabe R, Harada T, et al : Application extensive de l'anesthésie péridurale et de l'analgésie dans un hôpital universitaire : incidence des complications liées à la technique. Reg Anesth 1993;18:34–38.
- Kenepp NB, Gutsche BB : injections intravasculaires par inadvertance pendant l'anesthésie épidurale lombaire. Anesthésiologie 1981 ; 54 : 172–173.
- Griffiths JD, Le NV, Grant S, et al : Toxicité anesthésique locale symptomatique et concentrations plasmatiques de ropivacaïne après bloc plan transversus abdominis pour césarienne. Br J Anaesth 2013;110:996–1000.
- Weiss E, Jolly C, Dumoulin JL, et al : Convulsions chez 2 patientes après des blocs transversaux abdominaux bilatéraux guidés par échographie pour une césarienne. Reg Anesth Pain Med 2014;39:248–251.
- Giordano D, Panini A, Pernice C, et al : Toxicité neurologique de la lidocaïne pendant l'intubation éveillée chez un patient présentant un abcès de la base de la langue. Rapport de cas. Am J Otoralyngol 2014;35:62–65.
- Gunja N, Varshney K : Anesthésie du tronc cérébral après bloc rétrobulbaire : une cause rare de coma se présentant aux urgences. Emerg Med Australas 2006;18:83–85.
- Dahle JM, Iserson KV : traitement ED de l'anesthésie du tronc cérébral après
bloc rétrobulbaire. Am J Emerg Med 2007;25:105–106. - Tatum PL, Defalque RJ : Injection sous-arachnoïdienne lors d'un bloc rétrobulbaire : à propos d'un cas. Am Assoc Nurse Anesth J 1994;62:49–52.
- Zenous AT, Ebrahimi H, Mahdipour M, et al : L'incidence de entrée intravasculaire de l'aiguille lors de l'injection d'un bloc nerveux alvéolaire inférieur.J Dent Res Dent Clin Prospects 2008;2:38–41.
- Hahn C, Nagdev A : bloc du plexus brachial supraclaviculaire guidé par échographie Doppler couleur pour prévenir l'injection vasculaire. West J Emerg Med 2014;15:703–705.
- Monti M, Monti A, Borgognoni F, et al : Traitement par thérapie lipidique pour réanimer un patient souffrant de toxicité due aux anesthésiques locaux. Soins d'urgence J 2014;10:41–44.
- Harvey M, Cave G, Chanwai G, et al : réanimation réussie d'un collapsus cardiovasculaire induit par la bupivacaïne avec une émulsion lipidique intraveineuse après un bloc nerveux fémoral dans un service d'urgence. Emerg Med Australas 2014;23:209–214.
- Weinberg GL : Traitement de la toxicité systémique des anesthésiques locaux. Reg Anesth Pain Med 2010;35:188–193.
- Soltesz EG, van Pelt F, Byrne JG, et al : Pontage ardiopulmonaire émergent pour la cardiotoxicité de la bupivacaïne. J Cardiothorc Vasc Anesth 2003;17 : 357–358.
- Russell RL, Westfall BA : Atténuation de la dépression barbiturique. Anesth Analg 1962;41:582–585.
- Krieglstein J, Meffert A, Niemeyer DH : Influence des graisses émulsifiées sur la disponibilité de la chlorpromazine dans le sang de lapin. Experientia 1974;30 : 924–926.
- Corr PB, Yamada KA : Modifications métaboliques sélectionnées dans le cœur ischémique et leurs contributions à l'arythmogenèse. Herz 1995;20:156–168.
- Weinberg GL, Laurito CE, Geldner P, et al : Dysrythmies ventriculaires malignes chez un patient atteint d'académie isovalérique recevant une anesthésie générale et locale pour une lipectomie par aspiration. J Clin Anesth 1997;9:668–670.
- Weinberg GL, Ripper R, Murphy P, et al : la perfusion de lipides accélère l'élimination de la bupivacaïne et la récupération de la toxicité de la bupivacaïne dans le cœur de rat isolé. Reg Anesth Pain Med 2006;31:296–303.
- Rosenblatt MA, Abel M, Fischer GW, et al : Utilisation réussie d'une émulsion lipidique à 20 % pour réanimer un patient après un arrêt cardiaque présumé lié à la bupivacaïne. Anesthésiologie 2006 ; 105 : 217–218.
- Cave G, Harvey M, Willers J, et al : rapport LIPAEMIC : résultats de l'utilisation clinique de l'émulsion lipidique intraveineuse dans la toxicité des médicaments signalés à un registre des lipides en ligne. J Med Toxicol 2014;10:133–142.
- Presley JD, Chyka PA : Émulsion lipidique intraveineuse pour inverser la toxicité aiguë des médicaments chez les patients pédiatriques. Ann Pharmacother 2013;47:735–743.
- Fettiplace MR, Weinberg G : Passé, présent et futur de la thérapie de réanimation lipidique. JPEN J Parent Enteral Nutr 2015;39(1 Suppl):72S–83S, 2015.
- Wagner M, Zausiq YA, Ruf S, et al : le sauvetage des lipides inverse le blocage induit par la bupivacaïne du courant Na+ rapide (INa) dans les cardiomyocytes du ventricule gauche du rat. Anesthésiologie 2014 ;120 : 724–736.
- Mazoit JX, Le Guen R, Beloeil H, et al : Liaison des anesthésiques locaux de longue durée aux émulsions lipidiques. Anesthésiologie 2009 ;110 : 380–386.
- Kuo IK, Akpa BS : Validité du puits lipidique en tant que mécanisme d'inversion de la toxicité systémique des anesthésiques locaux. Anesthésiologie 2013 ;118 :1350–1361.
- Fettiplace MR, Ripper R, Lis K, et al : Effets cardiotoniques rapides de la perfusion d'émulsion lipidique. Crit Care Med 2013;41:e156–e162.
- Fettiplace MR, Akpa BS, Ripper R, et al : Réanimation avec émulsion lipidique : la récupération dose-dépendante de la pharmacotoxicité cardiaque nécessite un effet cardiotonique. Anesthésiologie 2014 ;120 :915–925.
- Ozcan MS, Weinberg G : Mise à jour sur l'utilisation des émulsions lipidiques dans la toxicité systémique des anesthésiques locaux : un accent sur l'efficacité différentielle et l'émulsion lipidique dans le cadre d'une assistance cardiaque avancée. Int Anesthesiol Clin 2011;49:91–103.
- Hiller DB, DiGrigorio G, Kelly K, et al : Sécurité de la perfusion d'émulsion lipidique à volume élevé. Une première approximation de la DL50 chez le rat. Reg Anesth Pain Med 2010;35:140–144.
- Ozcan MS, Weinberg G : Émulsion lipidique intraveineuse pour le traitement de la toxicité médicamenteuse. J Intensive Care Med 2014;29:59–70.
- Brull SJ : Émulsion lipidique pour le traitement de la toxicité des anesthésiques locaux : implications pour la sécurité des patients. Anesth Analg 2008;106:1337–1339.
- Neal JM, Bernards CM, Butterworth JF 4th, et al : Avis de pratique de l'ASRA sur la toxicité systémique des anesthésiques locaux. Reg Anesth Pain Med 2010; 35: 152-161.
- Neal JM, Mulroy MF, Weinberg GL : American Society of Regional
Liste de contrôle d'anesthésie et de médecine de la douleur pour la gestion de l'anesthésie locale
toxicité systémique : version 2012. Reg Anesth Pain Med 2012;37:16–18. - Fettiplace MR, Ripper R, Lis K, et al : Émulsion lipidique intraosseuse : une alternative efficace à l'administration intraveineuse en situation d'urgence. Crit Care Med 2014;42:157–160.
- Neal JM : Anesthésie régionale échoguidée et sécurité des patients. Reg Anesth Pain Med 2010;35:S59–S67.
- Orebaugh SL, Williams BA, Vallejo M, et al : résultats indésirables associés aux blocs nerveux périphériques à base de stimulateur avec ou sans visualisation par ultrasons. Reg Anesth Pain Med 2009;34:251–255.
- Salinas FV, Hanson NA : Médecine factuelle pour l'anesthésie régionale guidée par ultrasons. Anesthesiol Clin 2014;32:771–787.
- Mulroy MF, Hejtmanek MR : Prévention de l'anesthésie locale systémique
toxicité. Reg Anesth Pain Med 2010;35:177–180. - Neal JM : Toxicité systémique des anesthésiques locaux. Améliorer la sécurité des patients une étape à la fois. Reg Anesth Pain Med 2013;38:259–261.
- Neal JM, Hsiung Rl, Mulroy MF, et al : la liste de contrôle ASRA améliore les performances des stagiaires lors d'un épisode simulé de toxicité systémique anesthésique locale. Reg Anesth Pain Med 212;37:8–15.
- McEvoy MD, Hand WR, Stoll WD, et al : Le respect des directives pour la gestion de la toxicité systémique des anesthésiques locaux est amélioré par un outil électronique d'aide à la décision et un « lecteur » désigné. Reg Anesth Pain Med 2014;392:299–305.
- Sagir A, Goyal R : Une évaluation de la sensibilisation à la toxicité systémique des anesthésiques locaux chez les résidents de troisième cycle multispécialités. J. Anesth 2015 ; 29:299–302.
Marina Gitman, Michael Fettiplace et Guy Weinberg