Christiana C. Burt, Sanford M. Littwin, Jolaade Adebayo, Navin A. Mallavaram et Daniel M. Thys
INTRODUCTION
La décision d'utiliser l'anesthésie régionale dépend de nombreux facteurs. Les caractéristiques du patient, le type de chirurgie proposé et les risques anesthésiques potentiels auront tous un impact sur le choix de l'anesthésique et la gestion périopératoire. Chez les patients atteints de maladies cardiovasculaires, les techniques d'anesthésie régionale (seules ou associées à une anesthésie générale) peuvent offrir les avantages périopératoires potentiels d'une atténuation de la réponse au stress, d'une sympathectomie cardiaque, d'une extubation plus précoce, d'un séjour hospitalier plus court et d'une analgésie postopératoire intense. Cependant, la décision d'utiliser l'anesthésie régionale doit être prise avec prudence dans certaines circonstances. L'objectif de ce chapitre est de donner un aperçu des effets physiologiques des différentes techniques d'anesthésie régionale sur le système cardiovasculaire, d'examiner le rôle de l'anesthésie régionale en chirurgie cardiaque et en chirurgie non cardiaque et de donner un aperçu des besoins physiologiques des patients présentant différentes types de maladies cardiaques et vasculaires.
LES EFFETS CARDIO-VASCULAIRES DE L'ANESTHÉSIE RÉGIONALE
Anesthésie péridurale thoracique
L'anesthésie péridurale thoracique haute (TEA) de T1 à T5 bloque les fibres sympathiques afférentes et efférentes cardiaques avec une perte de commande chronotrope et inotrope vers le myocarde et une perception réduite de la douleur cardiaque. Chez des volontaires sains, il existe des preuves que le bloc épidural thoracique réduit contractilité ventriculaire gauche mesurée par échocardiographie transoesophagienne et que cet effet est présent dans le bloc épidural thoracique haut mais pas dans le bloc épidural thoracique bas, ce qui est cohérent avec une perte de commande inotrope vers le myocarde avec un bloc épidural haut. Pendant l'exercice, il a été rapporté que le TEA n'affecte pas la consommation d'oxygène (VO2) mais réduit la pression artérielle systémique par rapport aux sujets témoins. Une autre étude a comparé les effets cardiovasculaires de la bupivacaïne à 0.5 % administrée par voie péridurale thoracique aux effets lorsqu'elle était administrée par voie intramusculaire et n'a trouvé aucune différence significative et a postulé si les effets de l'anesthésie péridurale pouvaient en partie être dus à des effets systémiques. Cependant, leurs conclusions sont limitées par le faible nombre (9) de sujets inscrits.
Plusieurs études ont documenté les effets du TEA sur la fonction cardiovasculaire chez les patients souffrant de maladies cardiaques. Dans une petite étude de 10 patients programmés pour une thoracotomie, un TEA avec un niveau analgésique moyen de C7 à T5 n'a eu que des effets mineurs sur le système cardiovasculaire. Chez les patients atteints de maladie coronarienne grave et d'angine de poitrine instable, Blomberg et al ont observé que le TEA soulageait la douleur thoracique. Il a également diminué de manière significative la fréquence cardiaque et les pressions artérielles systoliques, artérielles pulmonaires et capillaires pulmonaires sans aucun changement significatif de la pression de perfusion coronarienne, du débit cardiaque, du volume d'éjection systolique ou des résistances vasculaires systémiques ou pulmonaires. Les enquêteurs ont également découvert que le TEA pouvait augmenter le diamètre des artères coronaires épicardiques sténosées chez les patients atteints de maladie coronarienne sans provoquer de dilatation des artérioles coronaires.
En peropératoire, lors de la chirurgie de l'anévrisme de l'aorte abdominale, Reinhart et al ont observé un index cardiaque et un apport d'O2 (QO2) plus faibles chez les patients recevant de l'ATE et une anesthésie générale (AG) que chez ceux recevant l'AG seul ; VO2 était similaire. Ils ont également signalé que le rapport offre-demande d'oxygène (QO2/VO2) était inférieur dans le groupe TEA tout au long de la période périopératoire et d'environ 30 % en dessous des valeurs de référence au début de la récupération. Les auteurs ont attribué l'adaptation réduite du débit cardiaque aux besoins tissulaires en O2 pendant le TEA aux effets inotropes et chronotropes négatifs du bloc sympathique. Chez les patients prenant des médicaments bloquants β-adrénergiques chroniques, il a été rapporté que le TEA induisait une diminution modérée de la pression artérielle moyenne et de la pression de perfusion coronarienne, mais sans produire d'effets cardiovasculaires cliniquement significatifs.
À l'inverse, des améliorations des paramètres de la fonction cardiaque ont été rapportées, en particulier dans l'amélioration de la fonction ventriculaire gauche régionale lors d'un pontage coronarien. Cela a été attribué à l'effet sympathectomie cardiaque de la péridurale thoracique. Une étude distincte évaluant la fonction systolique et diastolique du ventricule gauche chez des patients atteints de maladie coronarienne a révélé que le TEA induisait une amélioration significative de la fonction diastolique du ventricule gauche, alors que les indices de la fonction systolique ne changeaient pas (Figure 1).
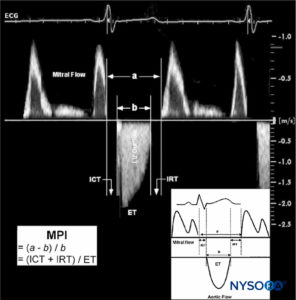
FIGURE 1. Estimation de l'indice de performance myocardique (MPI ; Tei index). Le MPI est calculé à partir de deux intervalles de temps comme a–b/b. Intervalle a : de l'arrêt au début suivant du flux mitral. Intervalle b : du début à l'arrêt du flux aortique. Les intervalles de temps a et b sont indiqués en millisecondes. Un exemple typique de mesure du MPI à l'aide de l'enregistrement Doppler ECG des profils de vitesse d'écoulement mitral et aortique est démontré. À des fins d'illustration, les tracés Doppler originaux de l'afflux mitral et de l'écoulement ventriculaire gauche (LV) sont tracés ensemble. ET, temps d'éjection de la sortie VG ; ICT, temps de contraction isovolumique ; IRT, temps de relaxation isovolumique. (Reproduit avec la permission de Schmidt C, Hinder F, Van Aken H, et al : L'effet de l'anesthésie épidurale thoracique élevée sur la fonction ventriculaire gauche systolique et diastolique chez les patients atteints de maladie coronarienne. Anesth Analg. 2005 juin ; 100(6) : 1561-1569.)
Les changements hémodynamiques pendant la laryngoscopie et l'intubation peuvent augmenter le risque d'ischémie chez certains patients atteints de maladie cardiaque. Liker et al. ont rapporté que les patients qui recevaient de l'AET en plus de l'AG présentaient des augmentations plus faibles de la pression artérielle moyenne et de la fréquence cardiaque pendant la laryngoscopie et l'intubation trachéale que ceux qui recevaient uniquement l'AG ; ceci suggérerait que le TEA offre une protection hémodynamique lors de ces manœuvres.
L'effet de la TEA sur la stabilité hémodynamique pendant la chirurgie aortique abdominale ouverte a été étudié, avec des résultats d'effets minimes sur l'index cardiaque (IC) et la pression capillaire pulmonaire (PCWP) rapportés pendant le clampage aortique dans un groupe qui a reçu GA avec TEA par opposition aux effets néfastes (diminution de l'IC et augmentation de la PCWP) observés dans le groupe qui n'a reçu que l'AG. On ne sait pas si ce résultat entraîne une différence de morbidité ou de mortalité, certains groupes ne signalant aucune différence de résultat et un signalant des effets néfastes dans le groupe péridural avec une ischémie myocardique de rebond observée à la fin de la péridurale.
Le TEA a été rapporté comme étant bénéfique chez les patients souffrant d'obésité morbide subissant un pontage gastrique avec un meilleur soulagement de la douleur postopératoire, mais aucune conclusion ferme concernant la fonction cardiovasculaire autre qu'une réduction significative de la RVS et du shunt intrapulmonaire par rapport à l'AG.
L'effet clinique de la sympathectomie cardiaque et de la vasodilatation périphérique causée par l'ATE semble varier d'une population de patients à l'autre. Le niveau de bloc sympathique qui suit un TEA dépend en partie du degré de tonus sympathique avant le bloc, ce qui peut expliquer certains des différents effets sur le système cardiovasculaire rapportés par différentes études. De plus, l'effet sur la fonction cardiaque dépendra de la nature exacte de la maladie cardiovasculaire du patient. Ceci est exploré plus en détail plus loin dans ce chapitre.
Anesthésie péridurale lombaire
L'anesthésie péridurale lombaire (LEA) entraîne principalement une baisse de la résistance vasculaire systémique via une vasodilatation périphérique, sans les effets de la sympathectomie cardiaque qui se produisent avec un TEA élevé. L'influence de l'AEL sans sympathectomie cardiaque sur la fonction ventriculaire gauche globale et régionale a été étudiée avant la chirurgie chez des sujets sains et chez des patients souffrant d'angor léger stable lié à l'effort.19 Dans les deux groupes, un bloc épidural a été réalisé avec 10 ml de bupivacaïne à 0.5 %. L'angiographie radionucléide a été utilisée pour déterminer le débit cardiaque, la fraction d'éjection ventriculaire gauche et les volumes télésystolique et télédiastolique et pour analyser le mouvement de la paroi ventriculaire gauche. Tout au long de la procédure, les patients ayant des antécédents d'angor n'ont présenté ni douleur thoracique ni signe électrocardiographique d'ischémie myocardique. Au contrôle, la fraction d'éjection ventriculaire gauche (FEVG) et le rapport pression-volume systolique (SPVR) étaient plus faibles chez les patients angineux. Ces patients présentaient également des signes de dysfonctionnement ventriculaire gauche régional. Le bloc péridural sans charge volumique a entraîné de légères améliorations de la FEVG et de la fonction régionale. De tels changements n'ont pas été observés chez les patients normaux. Après la charge volumique, les améliorations de la fonction ventriculaire se sont atténuées. Ces observations ont amené les auteurs à conclure que l'anesthésie péridurale lombaire peut améliorer la fonction ventriculaire globale et régionale chez les patients souffrant d'angor à condition que la charge volumique soit limitée.
Chez les patients hypertendus, il a été démontré que LEA provoque des diminutions de la pression artérielle moyenne avec des diminutions associées de la résistance vasculaire systémique et du débit cardiaque.
L'importance d'un bon soulagement de la douleur dans la réduction des épisodes ischémiques a été étudiée chez les patients âgés subissant une chirurgie pour une fracture de la hanche avec une réduction des épisodes ischémiques montrée dans les groupes ayant reçu une analgésie péridurale continue en préopératoire. De plus, l'anesthésie épidurale lombaire peut réduire le risque de complications thrombotiques artérielles chez les patients subissant une revascularisation des membres inférieurs, et cela peut être le résultat de la prévention de l'inhibition postopératoire de la fibrinolyse. Cependant, d'autres études ne rapportent aucune différence de morbi-mortalité majeure chez les patients à haut risque cardiaque subissant une chirurgie vasculaire périphérique avec ou sans péridurale lombaire.
L'utilisation réussie de l'anesthésie péridurale lombaire a été rapportée chez des patientes obstétricales atteintes de divers types de maladies cardiaques.
Anesthésie intrathécale
L'anesthésie intrathécale utilisant des agents anesthésiques locaux et/ou des opioïdes a été étudiée dans le contexte de la chirurgie cardiaque et non cardiaque. On peut s'attendre à ce que l'anesthésie intrathécale produise une vasodilatation profonde ainsi qu'un bloc moteur et sensoriel en dessous du niveau d'action. La réponse hémodynamique à la rachianesthésie lombaire utilisant de la bupivacaïne hyperbare à dose unique ou de la lidocaïne avec de la morphine a été évaluée chez des patients en chirurgie cardiaque. Il a été observé que l'induction de l'AG produisait une diminution de la pression artérielle moyenne et que l'ajout d'une rachianesthésie produisait une diminution de la fréquence cardiaque. La fréquence cardiaque et la pression artérielle moyenne n'ont pas changé avec la sternotomie (suggérant une analgésie de bonne qualité).
Dans les populations mixtes (certaines avec une cardiopathie ischémique documentée, d'autres sans), aucune différence n'a été trouvée dans les épisodes d'ischémie myocardique entre les patients recevant une anesthésie générale et les patients recevant une rachianesthésie pour une chirurgie transurétrale, bien qu'il y ait eu un taux relativement élevé d'ischémie silencieuse dans les deux groupes dans les deux études. Une étude intéressante portant sur l'hémodynamique et les marqueurs de l'ischémie myocardique chez des patients atteints de maladie coronarienne subissant une chirurgie élective de la hanche a révélé que, bien que le nombre de patients ayant subi des épisodes de dépression du segment ST ne diffère pas entre ceux qui ont reçu une rachianesthésie progressive, une rachianesthésie à un seul coup sous anesthésie générale ou sous anesthésie générale, 56 % des patients hypotendus ont développé une dépression du segment ST contre seulement 10 % des patients normotensifs (P < 0.003). L'incidence de l'hypotension et de l'ischémie myocardique était la plus faible dans le groupe recevant une rachianesthésie progressive.
Divers chercheurs ont rapporté les effets de différentes doses d'anesthésique local intrathécal en une seule injection rachidienne. Il a été rapporté qu'une dose de 7.5 mg de bupivacaïne hyperbare en association avec 5 mcg de sufentanil produit une anesthésie fiable pour la réparation des fractures de la hanche chez les patients âgés présentant peu d'épisodes d'hypotension et peu besoin d'un soutien vasopresseur de la pression artérielle. D'autres chercheurs ont rapporté que 4 mg de bupivacaïne avec 20 mcg de fentanyl étaient efficaces dans la même population.
Il n'a pas été démontré de manière fiable que l'anesthésie intrathécale ait un effet sur la réponse au stress à la chirurgie en termes de taux de catécholamines sériques et de cortisol sérique. Certaines études ont rapporté une réponse au stress plus faible pendant la chirurgie de pontage aorto-coronarien (PAC) chez les patients qui ont reçu de la bupivacaïne intrathécale en plus de l'anesthésie générale par rapport à ceux qui ont reçu une anesthésie générale et des opioïdes intraveineux (Figure 2), alors que d'autres auteurs n'ont rapporté aucune atténuation de la réponse au stress.
L'opioïde intrathécal en plus de l'AG a été étudié pour la chirurgie aortique abdominale élective. L'ajout d'opioïde intrathécal a fourni une analgésie plus intense par rapport à l'ACP pendant les 24 premières heures postopératoires, mais il n'y avait pas de différence entre les groupes dans l'incidence des complications cardiovasculaires, respiratoires et rénales majeures combinées ou de la mortalité.
Un groupe de patients jugés à haut risque d'ischémie myocardique postopératoire subissant soit une arthroplastie de hanche élective soit une chirurgie vasculaire périphérique a été randomisé pour recevoir soit une rachianesthésie soit une anesthésie générale. Il n'y avait pas de différence significative entre les groupes dans l'incidence de l'ischémie myocardique pendant ou après la chirurgie.
Un certain nombre de rapports de cas ont rendu compte de l'utilité de la rachianesthésie chez les patientes obstétricales atteintes de diverses maladies cardiaques. Velickovic et al. utilisé avec succès la rachianesthésie continue pour deux patients atteints de cardiomyopathie péripartum récurrente présentant une insuffisance cardiaque congestive pour une césarienne urgente. Chez un patient, une colonne vertébrale continue a non seulement fourni une anesthésie adéquate, mais a également nettement réduit les symptômes du patient. D'autres ont rapporté un succès similaire avec la rachianesthésie chez des patientes obstétricales atteintes de cardiomyopathie obstructive hypertrophique, de sténose pulmonaire sévère et de maladie coronarienne.
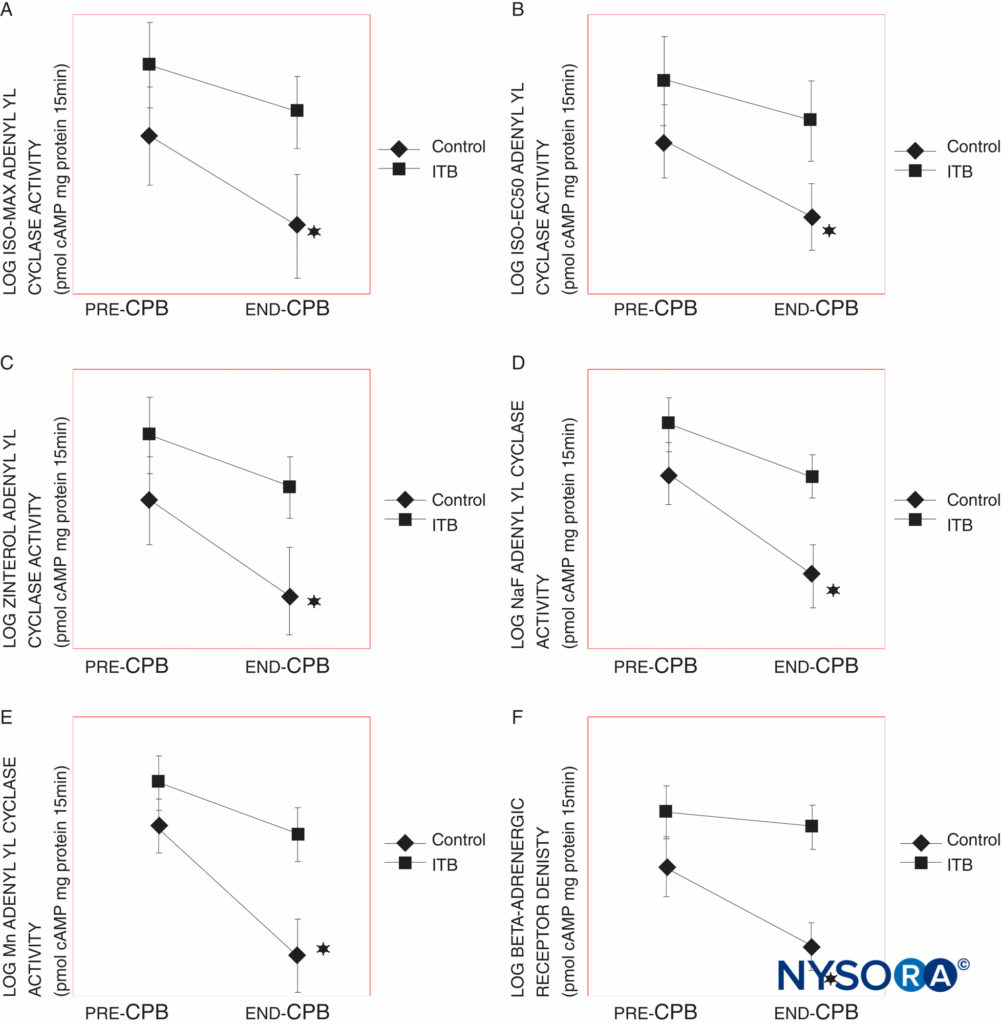
FIGURE 2. A : isprotéronol maximal (ISO MAX), B : 50 % d'isoprotérénol maximal (ISO EC50), C : zinterol, D : stimulé par le fluorure de sodium (NaF) et E : stimulé par le manganèse (Mn) -récepteur adrénergique (AR) , tel que mesuré par l'activité de l'adénylyl cyclase dans les groupes de contrôle et de bupivacaïne intrathécale (ITB) avec des temps de pontage cardiopulmonaire (PCB) de 61 à 120 min. Le groupe témoin montre une baisse significative de l'activité de l'adénylyl cyclase dans chacune de ces mesures, contrairement au groupe ITB. F : densité AR dans les groupes témoins et ITB avec des temps CPB de 61 à 120 min. Le groupe témoin montre une baisse significative de la densité AR à P 0.02. L'activité de l'adénylyl cyclase et la densité AR (AR Bmax) sont exprimées en picomoles d'adénosine monophosphate cyclique par milligramme de protéine par 15 min et en femtomoles par milligramme de protéine, respectivement. Les données ont été transformées en log. Les résultats sont exprimés en moyenne SEM (*P < 0.05, ‡P < 0.005).
Blocs thoraciques (paravertébraux et intercostaux)
L'étendue d'une seule injection paravertébrale percutanée a été étudiée chez 6 patients souffrant de douleurs chroniques de la paroi thoracique. Il a été montré qu'un grand bloc somatique et sympathique unilatéral pouvait être obtenu. Aucun changement postural significatif de la pression artérielle n'a été observé, mais il y avait une diminution légère mais significative de la fréquence cardiaque en décubitus dorsal. Bien qu'il ait été démontré que les blocs paravertébraux peuvent se propager à l'espace épidural, une revue systématique et une méta-analyse ont conclu que le bloc paravertébral provoque moins d'hypotension que le bloc épidural après thoracotomie.
Il existe des preuves anecdotiques que les blocs paravertébraux peuvent être bénéfiques chez les patients atteints de cardiopathie ischémique. Ho et al. ont rapporté la résolution peropératoire de la dépression du segment ST après un PVB thoracique droit, bien qu'il soit possible que cela se soit résolu spontanément sans PVB.
Les blocs nerveux intercostaux ont également été signalés comme étant sûrs sans conséquences hémodynamiques indésirables avec une approche assistée par ultrasons pour bloquer les nerfs intercostaux dans la ligne médio-axillaire pour la chirurgie non reconstructive du sein et de l'aisselle.
Anesthésie régionale des membres supérieurs et maladies cardiaques
Bloc du plexus cervical
Plusieurs études ont étudié la différence de résultat après endartériectomie carotidienne (CEA) entre l'anesthésie générale (AG) et l'anesthésie régionale (RA) sous forme de bloc du plexus cervical profond et/ou superficiel. Comme pour les autres types de chirurgie vasculaire, les patients atteints d'EC sont plus susceptibles d'être hypertendus, diabétiques et à risque accru de morbidité cardiaque. Dans le cadre de cette chirurgie, il existe cependant d'autres causes d'instabilité hémodynamique en plus des effets de la douleur, notamment la stimulation et la sensibilité des barorécepteurs et une régulation altérée de la pression artérielle suite à un accident vasculaire cérébral (AVC). Bien qu'une plus grande stabilité hémodynamique et une réduction des complications cardiovasculaires aient ont été rapportés avec l'utilisation du bloc du plexus cervical par rapport à l'AG seul, et une méta-analyse comprenant des études prospectives et rétrospectives a rapporté une réduction de l'incidence des accidents vasculaires cérébraux, des infarctus du myocarde (IM) et des décès avec l'utilisation du bloc du plexus cervical sans AG, ces résultats étaient potentiellement confondus par un biais lié à l'utilisation de l'AG chez les patients à haut risque. Un récent essai multicentrique, randomisé, prospectif et contrôlé (General Anesthetic versus Local Anesthetic for Carotid Surgery [GALA]), qui comprenait plus de 3500 patients assignés au hasard à une chirurgie sous AG ou RA, n'a montré aucune différence en termes d'AVC, d'IM ou de décès dans le 30 premiers jours après la chirurgie (entre autres résultats). Il est possible, cependant, que les patients les plus à risque n'aient pas été inclus dans l'étude et que l'étude n'ait pas abordé la question de savoir s'il existe une différence entre l'AG ou la PR dans les groupes de patients à haut risque.
Bloc du plexus brachial
La plupart de la littérature étudiant les conséquences physiologiques du bloc interscalénique du plexus brachial (BPB) s'est concentrée sur son effet sur le nerf phrénique et la fonction ventilatoire. Une conclusion raisonnable de la littérature sur les effets hémodynamiques semblerait être que des effets hémodynamiques significatifs se produisent à la suite de l'absorption intravasculaire de l'anesthésique local plutôt que du bloc lui-même. La BPB interscalène continue réalisée avec 1.25 mg/kg de bupivacaïne à 0.5 % chez 24 patients, suivie d'une perfusion de bupivacaïne à 0.25 % à une dose de 0.25 mg/kg/h, n'a entraîné aucun problème hémodynamique après 30 minutes et à une concentration indétectable. de bupivacaïne plasmatique libre après 24 heures de perfusion. La BPB interscalène seule pour la chirurgie de l'épaule s'est avérée plus stable sur le plan hémodynamique que la BPB interscalène associée à l'AG, avec une diminution significative de la pression artérielle moyenne (PAM) lorsque le patient était déplacé en position assise avec bloc et AG ; la fréquence cardiaque est restée stable dans les deux groupes. L'ajout de clonidine au BPB interscalène semble avoir des effets hémodynamiques, Culebras rapportant qu'une dose de 150 mcg ajoutée à 40 ml de bupivacaïne à 0.5 % a entraîné une réduction de la fréquence cardiaque et de la pression artérielle mais n'a pas prolongé la durée de l'analgésie. L'hypotension et la bradycardie ont également été signalées comme étant plus fréquentes avec une dose de 2 mcg/kg de clonidine par rapport à une dose de 1 mcg/kg de clonidine ajoutée à 30 ml de bupivacaïne à 0.5 %.
Anesthésie régionale des membres inférieurs et maladies cardiaques
Les blocs nerveux périphériques des membres inférieurs sont associés à des troubles hémodynamiques minimes. Fanelli et al. ont comparé les changements hémodynamiques induits par la rachianesthésie unilatérale aux changements induits par le bloc combiné du nerf sciatique-fémoral chez 20 patients ASA I-II subissant une chirurgie orthopédique élective avec garrot. Les deux groupes avaient une anesthésie adéquate pour la chirurgie. Le groupe bloc nerf sciatique-fémoral combiné (obtenu avec 7 mg/kg de mépivacaïne à 2 %) n'a entraîné aucun changement hémodynamique significatif, tandis que le groupe sous rachianesthésie (8 mg de bupivacaïne hyperbare à 0.5 % administrée par voie intrathécale) a présenté des différences légères mais significatives de PAM , index cardiaque et volume d'éjection systolique.
Il existe plusieurs rapports de cas détaillant l'utilisation réussie des blocs nerveux périphériques des membres inférieurs chez les patients à haut risque. Chia et al. ont présenté les avantages pratiques d'un bloc combiné du nerf sciatique-fémoral chez un homme de 56 ans atteint d'un sepsis sévère et d'un infarctus du myocarde récent nécessitant une amputation urgente au-dessus du genou. Ho et al. ont rapporté l'utilisation d'un bloc combiné du plexus lombaire paravertébral et du nerf sciatique parasacré pour la réduction d'une fracture de la hanche chez un patient âgé présentant une sténose aortique sévère. Tanaka et al. ont décrit l'utilisation d'un bloc de compartiment psoas (PCB) chez une femme de 72 ans souffrant d'insuffisance cardiaque sévère due à une myocardite rhumatoïde qui a nécessité une réduction ouverte d'une fracture du col fémoral gauche (trochantérienne). Avec le patient en position latérale avec le côté fracturé vers le haut, le bloc a été réalisé à L3/4' à l'aide d'une aiguille Tuohy de calibre 22 pour injecter 10 ml de solution saline normale et 20 ml de mépivacaïne à 2 %. Aucune complication n'a été signalée. Rizzo et al. ont utilisé une anesthésie régionale pour anesthésier un homme de 32 ans souffrant du syndrome d'Eisenmenger avec un ventricule de type gauche uniquement, qui avait besoin d'une extirpation du ménisque par chirurgie arthroscopique. Les investigateurs ont utilisé des blocs des nerfs sciatiques, fémoraux et latéraux cutanés de la cuisse avec de la ropivacaïne sans complications.
ANESTHESIE REGIONALE ET CHIRURGIE CARDIAQUE
Plusieurs auteurs ont examiné la relation entre l'anesthésie régionale et les résultats en chirurgie cardiaque. Une sélection de la littérature traitant de l'anesthésie péridurale thoracique est résumée dans Tableau 1, et un résumé de la littérature portant sur l'anesthésie intrathécale est résumé dans Tableau 2. Une conclusion constante de la littérature est que la qualité globale du soulagement de la douleur semble être meilleure avec l'anesthésie régionale par rapport à la morphine intraveineuse. Certaines études rapportent également une réduction de l'incidence de la fibrillation auriculaire et d'autres dysrythmies supra-ventriculaires avec l'anesthésie régionale par rapport à la morphine intraveineuse. D'autres conclusions concernant les résultats en termes de morbidité et de mortalité des patients avec ou sans anesthésie régionale ne sont pas claires, ce qui est probablement lié à la nature de la chirurgie elle-même et à la plus grande influence de celle-ci sur des paramètres tels que la fonction cardiaque et les dysrythmies.
TABLE 1. Études portant sur l'anesthésie péridurale thoracique en chirurgie cardiaque.
| Auteur | Année | Population étudiée | Type de technique | Conclusion |
|---|---|---|---|---|
| Richter et al75 | 2002 | 37 patients souffrant d'angor réfractaire | TEA | Diminution de la fréquence des crises d'angor et de l'apport de nitroglycérine. Augmentation de la qualité de vie autoévaluée. |
| Olausson et al76 | 1997 | 40 patients atteints d'angor instable réfractaire sévère | TEA vs traitement anti-angineux standard | Réduction de l'incidence de l'ischémie myocardique. Durée plus courte des épisodes ischémiques dans le groupe TEA. |
| Salvi et al.77 | 2004 | 106 patients sous OPCAB | THÉ + AG | Le TEA avec GA est une technique réalisable pour l'OPCAB avec une analgésie postopératoire intense. |
| Kesler et al78 | 2005 | 90 patients sous OPCAB | THÉ (30) vs THÉ + GA (30) vs GA (30) | GA + TEA était la technique la plus complète, offrant une bonne stabilité hémodynamique et une analgésie postopératoire fiable. |
| Stritesky et al79 | 2004 | 129 patients subissant une chirurgie cardiaque avec pompe marche-arrêt éveillée | TEA | 10 conversions en AG en peropératoire. TEA a permis une récupération rapide après une chirurgie cardiaque. |
| Hansdottir et coll.68 | 2006 | 97 patients subissant une chirurgie cardiaque élective | GA + THÉ (48) vs GA + morphine IV (49) | Délai d'extubation plus court (2.3 h vs 7.3 h) dans le groupe TEA. Aucune différence dans l'analgésie postopératoire, le volume pulmonaire, le degré de déambulation, la morbidité cardiaque, les résultats neurologiques, la durée du séjour en soins intensifs ou la durée du séjour à l'hôpital (LOS). |
| Kesler et al80 | 2002 | 20 patients sous OPCAB | TEA | 3 ont nécessité une conversion en GA. Degré élevé de satisfaction des patients signalés. |
| Anderson et al81 | 2002 | 10 patients subissant un OPCAB par thoracotomie antérieure gauche | TEA | 1 conversion requise en GA ; 2 brèves périodes de ventilation assistée nécessaires. Haut degré de satisfaction des patients. |
| Noiseaux et al82 | 2008 | 15 patients sous OPCAB | TEA + NB fémoral | 3 conversion requise en GA ; 5 expérimentés AF postopératoire. |
| Barrington et coll.83 | 2005 | 120 patients subissant un PAC | GA vs GA + THÉ | Pas de différence de troponine T en postopératoire. Le groupe TEA avait une meilleure analgésie et un temps réduit jusqu'à l'extubation. |
| Kendall et al84 | 2004 | 30 patients sous OPCAB | Propofol vs isoflurane vs isoflurane + TEA | Pas de différence de troponine T moyenne à 24 heures postopératoires. |
| Loïck et al85 | 1999 | 70 patients subissant un PAC | GA + TEA vs GA + clonidine IV vs groupe contrôle | TEA + GA a eu un effet bénéfique sur la réponse au stress périopératoire et a diminué l'ischémie myocardique postopératoire telle que mesurée par la troponine T. |
| Fillinger et al86 | 2002 | 60 patients subissant une chirurgie cardiaque avec pontage (ECR prospectif) | Opioïde GA + IV vs GA + TEA | Aucune différence dans le temps jusqu'à l'extubation, la durée du séjour en USI, la durée du séjour à l'hôpital, le contrôle de la douleur, le cortisol libre urinaire, le taux de complications cardiopulmonaires ou le total des frais hospitaliers. |
| Scott et coll.87 | 2001 | 420 patients subissant un PAC (ECR prospectif) | GA vs GA + THÉ | Le groupe TEA a présenté moins de dysrythmie supraventriculaire, un meilleur volume pulmonaire inspiratoire maximal, une extubation plus précoce, moins d'infection des voies respiratoires, moins de confusion aiguë, moins d'insuffisance rénale aiguë et aucune complication neurologique associée au TEA. |
| Turfrey et al88 | 1997 | 218 patients subissant un PAC (rétrospective) | GA vs GA + THÉ | Le groupe TEA a connu moins de dysrythmie, une tendance à la réduction des complications respiratoires, un temps réduit jusqu'à l'extubation et aucune complication neurologique grave liée à l'utilisation du TEA. |
| Karagoz et al89 | 2003 | 137 patients subissant un PAC | THÉ seul | 5 convertis en GA ; pas de mortalité; DS moyenne à l'hôpital 1 jour. |
| Liu SS et al.90 | 2004 | Méta-analyse : TEA : 15 essais, 1178 17 patients subissant un PAC ; IT : 668 essais, XNUMX patients subissant un pontage coronarien et un pontage coronarien avec valve. | TEA vs GAIT morphine vs GA | Aucune différence de mortalité ou d'IM avec l'analgésie neuraxiale centrale par rapport à l'AG, mais une extubation trachéale plus rapide et une diminution des complications respiratoires, des troubles du rythme cardiaque et des scores de douleur avec l'analgésie neuraxiale. |
| Hemerling et al91 | 2004 | 30 patients subissant AVR, AVR + CABG, réparation de l'aorte ascendante et réparation du FOP | THÉ + AG | Tous les patients extubés dans les 15 minutes suivant la fin de la chirurgie ; pas de complications liées au TEA. |
| Klococovnik et al92 | 2004 | Rapport de cas : 1 patient subissant un RVA mini-invasif éveillé | THÉ seul | L'opération s'est déroulée sans incident; sortie le jour 2 ; aucune complication dans les 30 jours. |
| Slin'ko93 | 2000 | 55 enfants âgés de 1 à 14 ans subissant une chirurgie cardiaque par circulation extracorporelle | TEA utilisant de la lidocaïne et du fentanyl + GA vs TEA utilisant de la lidocaïne et de la clonidine + GA | La réponse au stress endocrinien a diminué dans le groupe lidocaïne-clonidine par rapport au groupe lidocaïne-fentanyl. |
| Peterson et al94 | 2000 | 220 enfants subissant une chirurgie cardiaque (examen rétrospectif) | GA + TEA vs GA + LEA vs GA + caudale vs GA + IT | Extubation au bloc opératoire réalisée pour 89% des patients. Taux plus faible d'événements indésirables après l'utilisation de TEA par rapport aux autres. |
| Marteau et al95 | 2000 | 50 enfants opérés à cœur ouvert (rétrospective) | GA + THÉ contre GA + IT | Aucune différence significative dans l'incidence des modifications cliniquement significatives des signes vitaux, de la désaturation en O2, de l'hypercapnie ou des vomissements. |
| Royse et coll.96 | 2003 | 76 patients subissant un pontage coronarien avec pontage cardiopulmonaire (prospectif) | GA + THÉ (37) vs GA + morphine IV (39) | Le groupe TEA a ressenti beaucoup moins de douleur les jours 1 à 2 après l'opération, une extubation plus précoce, une meilleure coopération avec la physiothérapie et un risque réduit de dépression et de stress post-traumatique. |
| Liem et coll.97 | 1992 | 54 patients subissant un PAC non compliqué (rétrospective) | GA + TEA (27) vs GA + IV opioïde | Le groupe TEA a connu une meilleure gestion de la douleur peropératoire et postopératoire et un réveil et une extubation plus précoces. |
| Hemerling et al98 | 2004 | 100 patients sous OPCAB (audit prospectif) | GA + TEA vs GA + IV opioïde | L'extubation immédiate est possible en utilisant soit de l'ATE, soit un opioïde IV pour soulager la douleur. Le TEA entraîne des scores de douleur inférieurs à ceux de la morphine PCA. |
| Bois et coll.99 | 1997 | 124 patients subissant une chirurgie aortique (prospectif) | GA + TEA vs GA + IV opioïde | Le groupe TEA a connu un meilleur contrôle de la douleur postopératoire. Aucune différence dans l'incidence de l'ischémie myocardique précoce. |
| Ho et al100 | 2002 | 244 patients subissant un PAC (enquête rétrospective sur les douleurs persistantes) | GA + TEA vs GA + IV opioïde | Aucune différence dans la fréquence ou l'intensité de la douleur persistante postopératoire. |
| Jensen et al101 | 2004 | 49 patients subissant une chirurgie valvulaire cardiaque | GA + TEA (35) vs GA + IV opioïde (14) | Le TEA a fourni une excellente analgésie dans les périodes péri- et postopératoires. Aucun effet protecteur sur les douleurs chroniques post-sternotomie. |
| Pasteur et al64 | 2003 | 714 patients subissant un pontage coronarien avec circulation extracorporelle (observation prospective) | AG + THÉ | TEA inséré dans la salle d'opération juste avant la chirurgie. Protocole de gestion suivi. Aucun hématome épidural détecté. |
| Sanchez et al102 | 1998 | 558 patients subissant un PAC | AG + THÉ | TEA inséré la veille de la chirurgie et laissé en place pendant 5 jours. Aucun hématome neuraxial documenté. |
De nombreuses études examinant le délai d'extubation après une chirurgie cardiaque l'ont fait dans les jours précédant la généralisation des protocoles accélérés et, en tant que tels, sont moins applicables à la majorité de la pratique aujourd'hui. Cela dit, l'anesthésie régionale a sans aucun doute eu un rôle à jouer dans les débuts de l'accélération cardiaque et le fait encore dans de nombreux centres, avec un risque apparemment faible de complications. Cependant, c'est le risque potentiel de complications neuraxiales face à une héparinisation systémique complète et le manque de données concluantes sur les mesures concrètes des résultats pour les patients qui ont entraîné un débat continu et des pratiques différentes d'un centre à l'autre en ce qui concerne l'utilisation de l'anesthésie neuraxiale en cardiologie. opération. Ceci est illustré par une enquête auprès de 892 anesthésiologistes cardiaques, dans laquelle seulement 68 (7.6%) ont déclaré l'utilisation de techniques rachidiennes.
Le moment de l'insertion et du retrait du cathéter péridural en chirurgie cardiaque est encore controversé. Certains cliniciens insèrent la péridurale 60 à 90 minutes avant l'héparinisation dans le pontage aortocoronarien sans pompe (OPCAB), mais l'insèrent un jour avant la chirurgie dans les cas de pontage cardiopulmonaire planifié. Cette méthode repose vraisemblablement sur un succès élevé de l'OPCAB et un faible taux de conversion en pontage cardiopulmonaire peropératoire. Cependant, cela soulève également une question quant à l'utilisation efficace des ressources, car l'insertion d'une péridurale la veille de la chirurgie nécessitera, dans la plupart des cas, une hospitalisation la veille de la chirurgie. L'insertion en salle d'opération sans hématome épidural signalé a également été décrite. Le retrait du cathéter péridural après la chirurgie nécessite une normalisation de la coagulation pendant un certain temps. Chez les patients nécessitant une anticoagulation post-chirurgie cardiaque, cette pratique augmente le risque de séquelles thromboemboliques.
TABLE 2. Études portant sur l'anesthésie intrathécale en chirurgie cardiaque.
| Auteur | Année | Population étudiée | Type de technique | Conclusion |
|---|---|---|---|---|
| Vanstrum et al103 | 1988 | 30 patients subissant un PAC (prospectif, randomisé) | AG + 0.5 mg de morphine IT (16) vs AG + placebo (14) | Le groupe IT morphine a eu besoin de moins de morphine IV et moins de nitroprussiate de sodium. Aucune différence dans les scores de douleur. |
| Vanstrum et al103 | 1994 | 18 patients subissant un PAC (série de cas) | GA + IT bupivacaïne et morphine | Pas de changement de fréquence cardiaque ou de PAM avec sternotomie. Les besoins antalgiques postopératoires étaient minimes. |
| Bettex et al104 | 2002 | 24 patients subissant une chirurgie cardiaque élective (prospectif, randomisé) | Sufentanil GA + IT et morphine vs sufentanil GA + IV | Le groupe du sufentanil et de la morphine IT a connu une extubation plus précoce, un besoin réduit d'opioïdes intraveineux après l'opération et une capacité inspiratoire maximale postopératoire améliorée. |
| Mehta et al105 | 2004 | 100 patients subissant un OPCAB électif (prospectif, randomisé) | GA + IT morphine 8 mcg/kg vs GA + placebo | Le groupe IT morphine a connu une meilleure analgésie postopératoire, une meilleure fonction pulmonaire mesurée par spirométrie et une extubation plus précoce. |
| Fitzpatrick et al106 | 1988 | 44 patients subissant un PAC | GA + morphine IT 1 mg (15), GA + morphine IT 2 mg (15) vs GA + morphine IV | es groupes de morphine IT ont rapporté des scores de douleur inférieurs, ont eu besoin de moins de morphine IV supplémentaire et avaient de meilleurs DEP. La PaCO2 moyenne était significativement plus élevée chez les patients ayant reçu 2 mg de morphine IT. |
| Latham et al107 | 2000 | 40 patients subissant un PAC électif ou une chirurgie valvulaire | Rémifentanil GA + IV + morphine IT vs sufentanil GA + IV | Aucune différence entre les régimes en termes de stabilité hémodynamique ou de profil de récupération. |
| Alhashemi et al108 | 2000 | 50 patients subissant un PAC électif (prospectif) | AG + 250 mcg morphine IT vs AG + 500 mcg morphine IT vs AG + placebo | Le groupe morphine IT a connu une diminution des besoins postopératoires en morphine IV et aucun effet cliniquement pertinent sur le temps d'extubation. L'étude suggère que 250 mcg de morphine IT est la dose optimale pour fournir une analgésie significative sans retarder l'extubation. |
| Chaney et al109 | 1997 | 40 patients subissant une chirurgie cardiaque (prospectif, randomisé) | GA + IT morphine 10 mcg/kg (19) vs GA + IT placebo (21) | Aucune différence significative dans l'utilisation postopératoire de la morphine IV. 3 patients sous morphine IT ont présenté une dépression ventilatoire prolongée et une extubation retardée. |
| Finkel et coll.110 | 2003 | 30 enfants de 7 mois à 13 ans opérés à cœur ouvert | GA + IT tétracaïne hyperbare avec morphine | Tous les groupes d'âge ont bien toléré la technique sur le plan hémodynamique. |
| Pirat et autres111 | 2002 | 30 enfants âgés de 6 mois à 6 ans subissant une chirurgie cardiaque (prospectif, randomisé) | GA + fentanyl IT (10) vs GA + fentanyl IV (10) vs GA + fentanyl IT et IV combinés | Le groupe combiné était le seul groupe à connaître des augmentations non significatives de la fréquence cardiaque et de la PAM de la pré-chirurgie à la post-sternotomie. Une seule injection IT de fentanyl 2 mcg/kg n'a offert aucun avantage par rapport au fentanyl IV en ce qui concerne la stabilité hémodynamique et la réduction de la réponse au stress. |
| Williams et al112 | 1997 | 15 enfants subissant une réparation de PDA (série) | IT tétracaïne | 2 patients ont nécessité une supplémentation en isoflurane. Changements minimes de la pression artérielle notés. |
| Chaney et al36 | 1996 | 60 patients subissant un PAC (prospectif, randomisé) | GA + IT morphine vs GA + IT placebo | Aucune différence significative dans les taux périopératoires d'épinéphrine et de noradrénaline. Le groupe morphine IT a nécessité significativement moins de morphine IV postopératoire. |
| Hall et coll.37 | 2000 | 25 patients subissant un PAC (prospectif) | Morphine GA + IT vs morphine GA + IV | La morphine IT a partiellement atténué la réponse au stress postopératoire (mesurée par les taux de cortisol et d'épinéphrine plasmatique). |
| Zarate et al113 | 2000 | 20 patients subissant un PAC électif ou un remplacement valvulaire | GA + IT morphine + rémifentanil vs GA + sufentanil | Le rémifentanil associé à la morphine IT a fourni un meilleur contrôle de la douleur après une chirurgie cardiaque par rapport à une technique à base de sufentanil. |
| Boulanger et al114 | 2002 | 62 patients subissant une chirurgie cardiaque élective | GA + morphine IT + PCA vs GA + placebo IT + PCA vs GA + morphine SC | Le groupe informatique a connu une tendance à des durées d'extubation plus longues. Scores de douleur comparables dans les 3 groupes. |
Une revue systématique et une méta-analyse de 12 cohortes publiées, comprenant plus de 14,000 1 patients, ont suggéré que le risque maximal de lésion neurologique transitoire suite à l'utilisation de la péridurale thoracique était de 1700 sur XNUMX XNUMX pour la chirurgie cardiaque et vasculaire. Aucun cas d'hématome épidural ou de lésion neurologique permanente n'a été signalé dans cette analyse, bien qu'il existe des rapports de cas dans la littérature.
Comme pour toutes les techniques régionales, il existe une possibilité d'échec. Hansdottir et al. ont rapporté un taux d'échec d'insertion de 5.2 % (3 sur 52) et un taux d'échec de 12.7 % (7 sur 55) des cathéters placés.
L'utilisation de l'anesthésie neuraxiale sous forme d'anesthésie péridurale et rachidienne en chirurgie cardiaque est controversée. Une analyse intéressante a suggéré que pour chaque épisode de complication neurologique, l'utilisation de l'anesthésie neuraxiale préviendrait 20 infarctus du myocarde et 76 épisodes de fibrillation auriculaire. Que ce soit un compromis acceptable est la question clé. Cependant, les blocs paravertébraux et intercostaux ne comportent pas les mêmes risques que l'anesthésie neuraxiale et peuvent constituer des compléments utiles à l'analgésie postopératoire (Tableau 3).
TABLE 3.
| Auteur | Année | Population étudiée | Type de technique | Conclusion |
|---|---|---|---|---|
| Canto et al115 | 2003 | 111 patients subissant une chirurgie cardiaque élective utilisant un pontage CP (série de cas) | GA + 2 cathéters paravertébraux | Bonne stabilité hémodynamique, bonne analgésie postopératoire, délais d'extubation trachéale courts. |
| Exadaktylos et coll.116 | 2004 | 9 patients sous MIDCAB (série de cas) | GA + blocs nerveux intercostaux homolatéraux préopératoires | Tous ont été extubés dans les 15 minutes et ont connu une bonne analgésie. |
| McDonald et coll.117 | 2005 | 17 patients subissant une chirurgie cardiaque par sternotomie médiane (prospectif, randomisé) | AG + bloc parasternal vs AG + placebo | Le groupe bloc parasternal avec lévobupicaïne a utilisé significativement moins de morphine dans les 4 premières heures postopératoires ; aucun patient n'a eu besoin d'analgésique de secours. |
| Behnke et al118 | 2002 | 43 patients subissant MIDCAB (prospectif, randomisé) | GA + ICB vs GA + PCA | Le groupe ICB a connu un meilleur soulagement de la douleur. |
| Dowling et al119 | 2003 | 35 patients subissant un PAC (prospectif, randomisé) | AG + ICB bilatéral avec ropivacaïne (16) vs AG + ICB bilatéral avec solution saline (19) | Le groupe ICB avec ropivacaïne a rapporté des scores de douleur significativement plus faibles et a connu une diminution de la durée de séjour à l'hôpital. |
| Dhole et al120 | 2001 | 41 patients subissant MIDCAB (prospectif, randomisé) | GA + TEA vs GA + cathéter paravertébral gauche | Aucune différence significative dans les scores de douleur ou le besoin d'analgésie supplémentaire. L'IC était plus élevé dans le groupe TEA. Le groupe PVB avait des fréquences respiratoires plus faibles. |
LE PATIENT AVEC UNE MALADIE CARDIAQUE SE PRÉSENTANT POUR UNE CHIRURGIE NON CARDIAQUE
La maladie cardiaque est un terme général qui couvre un large éventail de pathologies. Pour décider d'utiliser ou non une anesthésie régionale, il est essentiel de tenir compte du type et de la gravité de la maladie cardiaque pour prédire la réponse probable ou possible à un anesthésique régional. Tableau 4 énumère les recommandations pour les affections cardiaques actives pour lesquelles il est recommandé que le patient subisse une évaluation et un traitement avant une chirurgie non cardiaque.
TABLE 4. Affections cardiaques actives pour lesquelles le patient doit subir une évaluation et un traitement avant une chirurgie non cardiaque (classe 1, niveau de preuve : B).
| État | Exemples |
|---|---|
| Syndromes coronariens instables | Angor instable ou sévère (CCS classe III ou IV) IM récent (7 à 30 jours) |
| Insuffisance cardiaque décompensée | NYHA classe IV Aggravation ou apparition d'une insuffisance cardiaque |
| Troubles du rythme importants | Bloc auriculo-ventriculaire de haut grade Bloc auriculo-ventriculaire Mobitz II Bloc auriculo-ventriculaire du troisième degré Dysrythmies ventriculaires symptomatiques Arythmies supraventriculaires avec fréquence ventriculaire non contrôlée (FC > 100 au repos) Bradycardie symptomatique Tachycardie ventriculaire nouvellement reconnue |
| Maladie valvulaire sévère | Rétrécissement aortique sévère (gradient de pression moyen > 40 mm Hg, surface valvulaire aortique < 1 cm2 ou symptomatique) Sténose mitrale symptomatique (dyspnée progressive à l'effort, présyncope à l'effort ou insuffisance cardiaque) |
Le patient souffrant d'hypertension/d'hypertrophie ventriculaire gauche
L'hypertension artérielle sévère et de longue date n'est pas seulement associée à un changement de la courbe d'autorégulation pour de nombreux lits vasculaires, mais entraîne également fréquemment une hypertrophie concentrique du ventricule gauche (VG) en raison d'une augmentation de la résistance vasculaire systémique (RVS) et d'une surcharge de pression de longue date. le LV. Les chutes soudaines de la RVS doivent être évitées chez ces patients, car ces chutes peuvent non seulement compromettre la perfusion coronarienne et la perfusion sous-endocardique du VG, mais peuvent également précipiter l'obstruction des voies de sortie du VG en raison du mouvement antérieur systolique (SAM) de la valve mitrale ou de l'obstruction ventriculaire de la cavité médiane.
La diastole est la période du cycle cardiaque où le VG est perfusé via les artères coronaires et où la cavité VG se détend et se remplit. En général, la tachycardie est mal tolérée par les cœurs hypertrophiés en raison d'un travail myocardique accru, d'un besoin en oxygène et d'un temps diastolique réduit, ce qui réduit à la fois le débit cardiaque via le remplissage du VG et la perfusion coronarienne, augmentant encore le risque d'ischémie myocardique. De plus, l'hypertrophie du VG est généralement associée à un degré de dysfonctionnement diastolique, ce qui rend encore plus important le maintien du rythme sinusal (si possible) et l'évitement de la tachycardie.
Une technique régionale peut être très utile pour éviter la tachycardie due à la douleur. Une technique localisée qui minimise la vasodilatation peut être préférable aux techniques neuraxiales centrales, bien qu'un titrage soigneux de celles-ci puisse éviter l'instabilité hémodynamique.
Le patient atteint de cardiopathie ischémique
La cardiopathie ischémique est synonyme de maladie coronarienne. L'American College of Cardiology Foundation (ACCF) a publié des lignes directrices sur le diagnostic et la prise en charge des patients atteints d'une cardiopathie ischémique stable connue, y compris les indications d'investigation et de revascularisation70. maladie de l'artère coronaire. En 2010, l'ACCF et l'American Heart Association (AHA) ont publié des lignes directrices sur la meilleure façon d'estimer le risque cardiovasculaire chez les adultes asymptomatiques en utilisant une combinaison d'anamnèse, d'examen et d'investigation. Des conseils sont également disponibles sur la prise en charge périopératoire des patients atteints de cardiopathie ischémique se présentant pour une chirurgie non cardiaque.
Les patients atteints de cardiopathie ischémique peuvent présenter une série de complications, notamment un infarctus du myocarde, des troubles du rythme, une insuffisance cardiaque, une détérioration de la fonction ventriculaire et une mort subite. La cardiopathie ischémique peut également coexister avec d'autres pathologies cardiaques, notamment les lésions valvulaires et les cardiomyopathies. La prise en charge d'un patient individuel dépendra de la combinaison de ces problèmes et de la lésion prédominante. La relation entre l'hypotension et une augmentation de l'ischémie myocardique chez les patients atteints d'une maladie coronarienne connue a été démontrée dans une population de patients âgés subissant une chirurgie de la hanche. En termes généraux, un patient présentant des sténoses coronariennes connues et dont le cœur fonctionne normalement bénéficiera d'efforts pour maintenir la précharge (remplissage), prévenir une vasodilatation excessive (provoquant une réduction de la RVS) et prévenir la tachycardie, qui augmenterait besoin en oxygène du myocarde tout en réduisant le temps disponible pour la perfusion coronarienne. Un patient atteint d'une maladie coronarienne et d'une fonction systolique VG médiocre (définie comme une fraction d'éjection < 30 %) peut être difficile, car la réduction de la résistance vasculaire systémique réduira la résistance à l'écoulement et augmentera la fraction d'éjection, mais cela ne doit pas se faire au détriment de la coronaropathie. pression de perfusion artérielle. Dans cette circonstance, une titration prudente de l'anesthésie neuraxiale centrale et un volume réduit d'anesthésique local total sont conseillés.
Le patient atteint de cardiopathie valvulaireMaladie valvulaire régurgitante
En général, la maladie valvulaire régurgitante est améliorée symptomatiquement par la vasodilatation périphérique et aggravée par la vasoconstriction périphérique. Le bloc neuraxial central et le bloc neuraxial périphérique ont donc tendance à être bien tolérés sur le plan cardiovasculaire et sont idéaux pour prévenir une aggravation de la fraction régurgitante à la suite d'une vasoconstriction périphérique causée par la douleur et l'anxiété. Des précautions doivent cependant être prises chez les patients présentant une maladie coronarienne concomitante ou une maladie valvulaire sténosée.
Maladie valvulaire sténosée
Les sténoses des valves aortique et mitrale sont beaucoup plus fréquentes dans la population adulte que les sténoses des valves tricuspide ou pulmonaire. Bien qu'il soit recommandé qu'un patient présentant une sténose aortique sévère ou une sténose mitrale symptomatique soit référé pour examen et prise en charge avant de subir une chirurgie non cardiaque, il peut y avoir des situations d'urgence lorsque cela n'est pas possible.
La sténose de la valve aortique entraîne une obstruction fixe à l'écoulement systolique du VG et entraîne généralement une hypertrophie concentrique du VG. Les diminutions soudaines de la RVS doivent être évitées car de telles diminutions peuvent compromettre la perfusion coronarienne. Comme pour les patients présentant une hypertrophie VG d'autres causes, le maintien de l'état de remplissage et l'évitement de la tachycardie et des arythmies rapides sont souhaitables.
La sténose mitrale entraîne une obstruction fixe à l'afflux VG. Une attention particulière doit être portée au maintien de l'état de remplissage et de la précharge, mais sans excès, car de gros bolus de liquide peuvent entraîner un œdème pulmonaire. Une titration prudente de l'anesthésie régionale avec un seuil bas pour la surveillance invasive est souhaitable.
Le patient adulte atteint d'une cardiopathie congénitale
Le terme cardiopathie congénitale couvre un éventail extrêmement large d'affections, allant de lésions acyanotiques relativement simples à une pathologie cyanotique complexe nécessitant une intervention chirurgicale complexe. Au fur et à mesure que les techniques chirurgicales cardiaques congénitales pédiatriques ont progressé au cours des dernières décennies, de plus en plus d'enfants atteints de cardiopathie congénitale survivent jusqu'à l'âge adulte et se présentent pour une chirurgie non cardiaque où l'utilisation d'une anesthésie régionale peut être utilisée. Idéalement, un patient atteint d'une cardiopathie congénitale complexe devrait être pris en charge dans un établissement spécialisé avec le soutien de cliniciens et de personnel qui connaissent le patient, son état et son état de santé actuel. Bien que ce ne soit pas l'objectif de ce chapitre pour fournir un examen complet de chaque type de cardiopathie congénitale, il existe un certain nombre de questions générales qui doivent être prises en considération lors de la planification de l'utilisation de l'anesthésie régionale chez ces patients :
- Anatomie anormale, y compris les altérations résultant d'une intervention chirurgicale antérieure (Tableau 5)
- La présence d'anticoagulation
- Fonction cardiaque, y compris la présence de troubles du rythme
- Dépendance de la circulation pulmonaire au retour veineux passif sans assistance ventriculaire droite (physiologie de Fontan ou hémi-Fontan)
- L'effet probable sur la stabilité cardiovasculaire d'une réduction de la résistance vasculaire systémique
- La nécessité d'une surveillance supplémentaire peropératoire et postopératoire (le site d'insertion de la surveillance invasive nécessitera une connaissance de l'anatomie anormale, y compris les veines thrombosées et les shunts artériels)
Les causes les plus courantes de faible débit cardiaque chez un patient présentant une physiologie de Fontan sont une précharge inadéquate, une résistance vasculaire pulmonaire élevée, un dysfonctionnement ventriculaire et des dysrythmies. L'utilisation de l'anesthésie régionale peut être très utile chez ces patients, car l'anesthésie générale avec ventilation à pression positive comporte ses propres risques. Une douleur postopératoire mal contrôlée et un effort respiratoire insuffisant peuvent entraîner des complications potentiellement mortelles.
TABLE 5. Pertinence anesthésique d'une intervention chirurgicale antérieure dans les cardiopathies congénitales de l'adulte.
| Lésion anatomique/Correction chirurgicale | Brève description de la lésion | Pertinence anesthésique |
|---|---|---|
| shunt Blalock-Taussig | De l'artère sous-clavière à l'artère pulmonaire | Éviter la mesure de la pression artérielle (invasive et non invasive) dans le bras affecté. |
| Glenn bidirectionnel (hémi-Fontan) | connexion chirurgicale de la veine cave supérieure (SVC) à l'artère pulmonaire | Le flux sanguin dans la circulation pulmonaire dépend du retour veineux et de la résistance vasculaire pulmonaire. |
| Connexion cavo-pulmonaire totale (type Fontan) | Connexion chirurgicale de la VCS et de la veine cave inférieure (VCI) à l'artère pulmonaire | Le débit sanguin dans la circulation pulmonaire dépend totalement du retour veineux et de la résistance vasculaire pulmonaire. |
Les modifications apportées à la technique d'anesthésie régionale chez les patients atteints d'une cardiopathie congénitale complexe comprennent les éléments suivants :
- Envisager une réduction de la dose totale d'anesthésique local administrée, en particulier chez les patients présentant une fonction cardiaque déficiente ou des antécédents de troubles du rythme.
- Utiliser une titration lente ou éviter la sédation narcotique ou anxiolytique chez les patients présentant une physiologie Fontan ou hémi-Fontan. Il est impératif d'éviter l'hypoxie et l'hypercapnie en raison du risque de précipitation d'une augmentation aiguë de la résistance vasculaire pulmonaire et de la réduction correspondante du débit cardiaque.
- Éviter une réduction brutale des résistances vasculaires systémiques chez le patient présentant une physiologie Fontan ou hémi-Fontan. Titrez soigneusement le bloc neuraxial central avec une administration de liquide appropriée et une surveillance étroite.
RÉSUMÉ
L'anesthésie locorégionale, de par sa capacité à procurer une analgésie intense et dans certains cas à éviter l'anesthésie générale, joue un rôle essentiel dans la prise en charge des patients atteints de maladies cardiovasculaires subissant une intervention chirurgicale. La méthode proposée doit tenir compte non seulement du type de chirurgie entreprise, mais également de la combinaison de problèmes présents chez chaque patient. De manière générale, les patients présentant une faible fraction d'éjection et des lésions valvulaires régurgitantes répondent bien à la vasodilatation périphérique, tant qu'une précharge et une perfusion coronarienne adéquates sont maintenues. Les patients présentant des lésions valvulaires sténosées, une sténose coronarienne sévère ne se prêtant pas (ou ne pouvant être pratiquée en urgence) à une revascularisation préopératoire et/ou une hypertrophie ventriculaire gauche peuvent encore bénéficier grandement de l'anesthésie régionale en évitant une augmentation du travail myocardique et de la demande en oxygène causée par douleur et tachycardie. Cependant, la prudence est requise chez ces patients, car une réduction soudaine ou excessive de la résistance vasculaire périphérique, en particulier avec un bloc neuraxial central, peut précipiter une baisse de la perfusion myocardique et/ou une baisse de la précharge et du débit cardiaque avec des conséquences graves. Chez ces patients, la décision d'utiliser l'anesthésie régionale doit être prise avec prudence et entreprise avec une surveillance appropriée. Comme dans toutes les autres circonstances dans lesquelles une anesthésie locorégionale est proposée, une attention doit être portée à l'anticoagulation, en pesant les risques thromboemboliques potentiels de l'arrêt de l'anticoagulation par rapport aux bénéfices potentiels. Des blocs périphériques majeurs habilement exécutés pour l'extrémité distale (par exemple, amputation, débridement des extrémités, etc.) peuvent sauver la vie des patients atteints de maladies cardiovasculaires graves, par exemple.
Références
- Veering BT, Cousins MJ : Effets cardiovasculaires et pulmonaires de l'anesthésie péridurale. Anaesth Intensive Care 2000;28:620–635.
- Goertz AW et al : Influence de l'anesthésie péridurale thoracique élevée sur la contractilité ventriculaire gauche évaluée à l'aide de la relation pression-longueur télésystolique. Acta Anaesthesiol Scand 1993;37:38–44.
- Niimi Y et al : évaluation échocardiographique de la fonction ventriculaire gauche globale pendant une anesthésie péridurale thoracique haute. J Clin Anesth 1997; 9:118–124.
- Ottesen S: L'influence de l'analgésie péridurale thoracique sur la circulation au repos et pendant l'exercice physique chez l'homme. Acta Anaesthesiol Scand 1978;22:537–547.
- Wattwil M et al : Modifications circulatoires au cours de l'anesthésie péridurale thoracique haute - influence du bloc sympathique et de l'effet systémique de l'anesthésique local. Acta Anaesthesiol Scand 1985;29:849–855.
- Hasenbos M et al : L'influence de l'analgésie péridurale thoracique élevée sur le système cardiovasculaire. Acta Anaesthesiol Belg 1988;39:49–54.
- Blomberg S, Emanuelsson H, Ricksten SE : Anesthésie épidurale thoracique et hémodynamique centrale chez les patients souffrant d'angine de poitrine instable. Anesth Analg 1989;69:558–562.
- Blomberg S et al : Effets de l'anesthésie péridurale thoracique sur les artères coronaires et les artérioles chez les patients atteints de maladie coronarienne. Anesthésiologie 1990 ; 73 : 840–847.
- Reinhart K et al : Effets de l'anesthésie péridurale thoracique sur la fonction hémodynamique systémique et la relation systémique entre l'offre et la demande d'oxygène. Anesth Analg 1989;69:360–369.
- Stenseth R et al : L'influence de l'analgésie épidurale thoracique seule et en combinaison avec l'anesthésie générale sur la fonction cardiovasculaire et le métabolisme myocardique chez les patients recevant des bêta-bloquants. Anesth Analg 1993;77:463–468.
- Berendes E et al : La sympathectomie cardiaque réversible par anesthésie péridurale thoracique haute améliore la fonction ventriculaire gauche régionale chez les patients subissant un pontage coronarien : un essai randomisé. Arch Surg 2003;138:1283–1290; débat 1291.
- Schmidt C et al : L'effet de l'anesthésie péridurale thoracique élevée sur la fonction ventriculaire gauche systolique et diastolique chez les patients atteints de maladie coronarienne. Anesth Analg 2005;100:1561–1569.
- Licker M, Farinelli C, Klopfenstein CE : Réflexes cardiovasculaires lors de l'induction de l'anesthésie et de l'intubation trachéale chez les patients âgés : l'influence de l'anesthésie péridurale thoracique. J Clin Anesth 1995;7 : 281–287.
- Her C et al : anesthésie péridurale et générale combinée pour la chirurgie de l'aorte abdominale. J Cardiothorac Anesth 1990;4:552–557.
- Norris EJ et al : essai randomisé à double insu comparant des combinaisons alternatives d'anesthésie peropératoire et d'analgésie postopératoire dans la chirurgie de l'aorte abdominale. Anesthésiologie 2001 ;95 :1054–1067.
- Davies MJ et al : anesthésie péridurale et générale combinée par rapport à l'anesthésie générale pour la chirurgie de l'aorte abdominale : un essai prospectif randomisé. Anaesth Intensive Care 1993;21:790–794.
- Garnett RL et al : Ischémie périopératoire en chirurgie aortique : anesthésie péridurale/générale combinée et analgésie péridurale vs anesthésie générale et analgésie iv. Can J Anaesth 1996;43:769–777.
- Gelman S et al : péridurale thoracique vs anesthésie équilibrée dans l'obésité morbide : une étude hémodynamique peropératoire et postopératoire. Anesth Analg 1980;59:902–908.
- Baron JF et al : fonction globale et régionale du ventricule gauche pendant l'anesthésie péridurale lombaire chez les patients avec et sans angine de poitrine. Influence de la charge volumique. Anesthésiologie 1987 ; 66 : 621–627.
- Dagnino J, Prys-Roberts C : Études de l'anesthésie en relation avec l'hypertension. VI : Réponses cardiovasculaires au bloc extradural de patients hypertendus traités et non traités. Br J Anaesth 1984;56:1065–1073.
- Scheinin H et al : La perfusion péridurale de bupivacaïne et de fentanyl réduit l'ischémie myocardique périopératoire chez les patients âgés souffrant d'une fracture de la hanche - un essai contrôlé randomisé. Acta Anesthesiol Scand 2000 ; 44:1061–1070.
- Matot I et al : Événements cardiaques préopératoires chez des patients âgés avec une fracture de la hanche randomisés pour recevoir une analgésie péridurale ou conventionnelle. Anesthésiologie 2003;98:156–163.
- Perler BA et al : L'influence de la méthode d'anesthésie sur la perméabilité du pontage infra-inguinal : un examen plus approfondi. Am Surg 1995;61:784–789.
- Christopherson R et al : morbidité périopératoire chez les patients randomisés pour recevoir une anesthésie péridurale ou générale pour une chirurgie vasculaire des membres inférieurs. Groupe d'étude d'essai d'anesthésie randomisée sur l'ischémie périopératoire. Anesthésiologie 1993 ; 79 : 422–434.
- Rosenfeld BA et al : Les effets de différents schémas anesthésiques sur la fibrinolyse et le développement d'une thrombose artérielle postopératoire. Groupe d'étude d'essai d'anesthésie randomisée sur l'ischémie périopératoire. Anesthésiologie 1993 ; 79 : 435–443.
- Bode RH Jr et al : résultat cardiaque après une chirurgie vasculaire périphérique. Comparaison de l'anesthésie générale et régionale. Anesthésiologie 1996 ; 84:3–13.
- Cohen MC et al : Types d'anesthésie et résultats cardiovasculaires chez les patients atteints d'insuffisance cardiaque congestive subissant une chirurgie vasculaire. Congestion Heart Fail 1999;5:248–253.
- Goldszmidt E et al : Gestion anesthésique d'une cohorte consécutive de femmes atteintes de maladies cardiaques pour le travail et l'accouchement. Int J Obstet Anesth 2010;19:266–272.
- Kowalewski RJ et al : Anesthésie pour pontage aortocoronarien complété par de la bupivacaïne sous-arachnoïdienne et de la morphine : un rapport de 18 cas. Can J Anaesth 1994;41:1189–1195.
- Windsor A et al : Ischémie myocardique silencieuse chez les patients subissant une prostatectomie transurétrale. Une étude pour évaluer la notation des risques et la technique d'anesthésie avec des résultats. Anesthésie 1996 ; 51 : 728–732.
- Edwards ND et al : Ischémie myocardique périopératoire chez les patients subissant une chirurgie transurétrale : une étude pilote comparant l'anesthésie générale à l'anesthésie rachidienne. Br J Anaesth 1995;74:368–372.
- Juelsgaard P et al : Ischémie myocardique périopératoire chez les patients subissant une chirurgie pour une fracture de la hanche randomisés pour une anesthésie rachidienne progressive, rachidienne à dose unique ou générale. Eur J Anaesthesiol 1998;15 : 656–663.
- Olofsson C et al : la bupivacaïne à faible dose avec du sufentanil prévient l'hypotension après une rachianesthésie pour la réparation de la hanche chez les patients âgés. Acta Anesthesiol Scand 2004;48:1240–1244.
- Ben-David B et al : Anesthésie rachidienne à minidose de bupivacaïne-fentanyl pour la réparation chirurgicale d'une fracture de la hanche chez les personnes âgées. Anesthésiologie 2000 ; 92 : 6–10.
- Lee TW et al : anesthésie rachidienne élevée pour la chirurgie cardiaque : effets sur la fonction des récepteurs bêta-adrénergiques, la réponse au stress et l'hémodynamique. Anesthésiologie 2003;98:499–510.
- Chaney MA et al : morphine intrathécale à forte dose pour le pontage coronarien. Anesth Analg 1996;83:215–222.
- Hall R et al : La morphine intrathécale modifie-t-elle la réponse au stress après un pontage coronarien ? Can J Anaesth 2000; 47:463–466.
- Fleron MH et al : Une comparaison des opioïdes intrathécales et de l'analgésie intraveineuse pour l'incidence des complications cardiovasculaires, respiratoires et rénales après une chirurgie de l'aorte abdominale. Anesth Analg 2003;97 : 2–12, table des matières.
- Backlund M et al : Facteurs associés à l'ischémie myocardique postopératoire chez les patients âgés subissant une chirurgie non cardiaque majeure. Eur J Anaesthesiol 1999;16:826–833.
- Velickovic IA, Leicht CH : Cardiomyopathie péripartum et césarienne : rapport de deux cas et revue de la littérature. Arch Gynecol Obstet 2004;270:307–310.
- Velickovic IA, Leicht CH : rachianesthésie continue pour césarienne chez une parturiente atteinte de cardiomyopathie péripartum sévère récurrente. Int J Obstet Anesth 2004;13:40–43.
- Okutomi T et al : Analgésie rachidienne continue pour le travail et l'accouchement chez une parturiente atteinte de cardiomyopathie obstructive hypertrophique. Acta Anaesthesiol Scand 2002;46:329–331.
- Ransom DM, Leicht CH : Analgésie rachidienne continue avec du sufentanil pour le travail et l'accouchement chez une parturiente présentant une sténose pulmonaire sévère. Anesth Analg 1995;80:418–421.
- Honig O et al : [Césarienne avec rachianesthésie continue chez une patiente à haut risque cardiopulmonaire]. Anesthésiste 1998;47:685–689.
- Cheema SP et al : Une étude thermographique de l'analgésie paravertébrale. Anesthésie 1995 ; 50 : 118–121.
- Purcell-Jones G, Pither CE, Justins DM : Bloc du nerf somatique paravertébral : une étude clinique, radiographique et tomodensitométrique chez des patients souffrant de douleur chronique. Anesth Analg 1989;68:32–39.
- Davies RG, Myles PS, Graham JM : Une comparaison de l'efficacité analgésique et des effets secondaires du bloc paravertébral vs épidural pour la thoracotomie - une revue systématique et une méta-analyse d'essais randomisés. Br J Anaesth 2006;96:418–426.
- Ho AM et al : La résolution des dépressions du segment ST après un bloc paravertébral thoracique haut droit pendant une anesthésie générale. Anesth Analg 2002;95:227–228, table des matières.
- Dieguez Garcia P et al : [Approche assistée par ultrasons pour bloquer les nerfs intercostaux dans la ligne médio-axillaire pour la chirurgie non reconstructive du sein et de l'aisselle]. Rev Esp Anestesiol Reanim 2013;60:365–370.
- Sternbach Y et al : Avantages hémodynamiques de l'anesthésie régionale pour l'endartériectomie carotidienne. J Vasc Surg 2002;35:333–339.
- Guay J : Anesthésie régionale ou générale pour endartériectomie carotidienne ? Données probantes tirées d'études prospectives et rétrospectives publiées. J Cardiothorac Vasc Anesth 2007;21:127–132.
- Groupe, GTC et al : Anesthésie générale versus anesthésie locale pour la chirurgie carotidienne (GALA) : un essai contrôlé randomisé multicentrique. Lancet 2008;372:2132–2142.
- Tuominen M et al : Bloc continu du plexus brachial interscalénique : efficacité clinique, problèmes techniques et concentrations plasmatiques de bupivacaïne. Acta Anaesthesiol Scand 1989;33:84–88.
- Ozzeybek D et al : Comparaison des effets hémodynamiques du bloc interscalénique combiné à l'anesthésie générale et du bloc interscalénique seul pour la chirurgie de l'épaule. J Int Med Res 2003;31:428–433.
- Culebras X et al : la clonidine associée à un anesthésique local à longue durée d'action ne prolonge pas l'analgésie postopératoire après un bloc du plexus brachial, mais induit des modifications hémodynamiques. Anesth Analg 2001;92:199–204.
- Kohli S et al : Bloc du plexus brachial : Comparaison de deux doses différentes de clonidine ajoutées à la bupivacaïne. J Anaesthesiol Clin Pharmacol 2013;29:491–495.
- Fanelli G et al : Effets cardiovasculaires de deux techniques d'anesthésie régionale différentes pour la chirurgie unilatérale des jambes. Acta Anaesthesiol Scand 1998;42:80–84.
- Chia N, Low TC, Poon KH : Les blocs nerveux périphériques pour la chirurgie des membres inférieurs : une technique d'anesthésie de choix pour les patients ayant récemment subi un infarctus du myocarde ? Singapour Med J 2002;43:583–586.
- Ho AM, Karmakar MK : Bloc combiné du plexus lombaire paravertébral et du nerf sciatique parasacral pour la réduction d'une fracture de la hanche chez un patient présentant une sténose aortique sévère. Can J Anaesth 2002;49:946–950.
- Tanaka Y, Negoro T : [Bloc du compartiment du psoas pour la chirurgie de la fracture du col fémoral (trochantérien) chez un patient souffrant d'insuffisance cardiaque sévère due à une myocardite rhumatoïde]. Masui 2000;49:1133–1135.
- Rizzo D et al : Bloc nerveux sciatique, fémoral et cutané pour méniscectomie arthroscopique chez un patient atteint du syndrome d'Eisenmerger. Rapport de cas]. Minerva Anestesiol 1999;65:733–736.
- Goldstein S et al : Une enquête sur les techniques rachidiennes et épidurales en chirurgie cardiaque adulte. J Cardiothorac Vasc Anesth 2001;15:158–168.
- Mehta Y, Arora D : Avantages et risques de l'analgésie péridurale en chirurgie cardiaque. J Cardiothorac Vasc Anesth 2014;28:1057–1063.
- Pastor MC et al : Analgésie péridurale thoracique dans le cadre d'un pontage aortocoronarien : sept ans d'expérience. J Cardiothorac Vasc Anesth 2003; 17:154–159.
- Ruppen W et al : Incidence de l'hématome épidural et des lésions neurologiques chez les patients cardiovasculaires avec analgésie/anesthésie épidurale : examen systématique et méta-analyse. BMC Anesthesiol 2006;6:10.
- Rosen DA et al : Un hématome épidural chez un patient adolescent après une chirurgie cardiaque. Anesth Analg 2004;98:966–969, table des matières.
- Berman M et al : Innocuité et efficacité de l'aprotinine et de l'acide tranexamique dans la chirurgie d'endartériectomie pulmonaire avec hypothermie : examen de 200 patients. Ann Thorac Surg 2010;90:1432–1436.
- Hansdottir V et al : péridurale thoracique versus analgésie intraveineuse contrôlée par le patient après une chirurgie cardiaque : un essai contrôlé randomisé sur la durée du séjour à l'hôpital et la qualité de récupération perçue par le patient. Anesthésiologie 2006 ; 104 : 142–151.
- Djaiani G, Fedorko L, Beattie WS : L'anesthésie régionale en chirurgie cardiaque : un ami ou un ennemi ? Semin Cardiothorac Vasc Anesth 2005;9 : 87–104.
- Fihn SD et al : 2012 ACCF/AHA/ACP/AATS/PCNA/SCAI/STS Guideline for the diagnostic and management of patients with stable ischemic heart disease : un rapport de l'American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines, et l'American College of Physicians, l'American Association for Thoracic Surgery, la Preventive Cardiovascular Nurses Association, la Society for Cardiovascular Angiography and Interventions et la Society of Thoracic Surgeons. J Am Coll Cardiol 2012;60 : e44–e164.
- Greenland P et al : 2010 ACCF/AHA guideline for assessment of cardiovasculaire risk in asymptomatique adultes : un rapport de l'American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2010;56:e50–103.
- Fleisher LA et al : Mise à jour des lignes directrices ACC/AHA 2006 sur l'évaluation cardiovasculaire périopératoire pour la chirurgie non cardiaque : mise à jour ciblée sur la thérapie bêta-bloquante périopératoire - un rapport de l'American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Update les lignes directrices de 2002 sur l'évaluation cardiovasculaire périopératoire pour la chirurgie non cardiaque). Anesth Analg 2007;104:15–26.
- Fleisher LA et al : 2009 Mise à jour ciblée de l'ACCF/AHA sur le bloc bêta périopératoire incorporée dans les directives ACC/AHA 2007 sur l'évaluation cardiovasculaire périopératoire et les soins pour la chirurgie non cardiaque : un rapport de l'American College of Cardiology Foundation/American Heart Association Task Force on Practice des lignes directrices. Diffusion 2009 ; 120:e169–e276.
- Eagle SS, Daves SM : L'adulte avec la physiologie de Fontan : approche systématique de la gestion périopératoire pour la chirurgie non cardiaque. J Cardiothorac Vasc Anesth 2011;25:320–334.
- Richter A et al : Effet de l'analgésie péridurale thoracique sur l'angine de poitrine réfractaire : auto-traitement à domicile à long terme. J Cardiothorac Vasc Anesth 2002;16:679–684.
- Olausson K et al : effets anti-ischémiques et anti-angineux de l'anesthésie péridurale thoracique par rapport à ceux de la thérapie médicale conventionnelle dans le traitement de l'angine de poitrine instable réfractaire sévère. Circulation 1997;96:2178–2182.
- Salvi L et al : Anesthésie épidurale thoracique haute pour la chirurgie de pontage coronarien hors pompe. J Cardiothorac Vasc Anesth 2004;18:256–262.
- Kessler P et al : Comparaison de trois techniques d'anesthésie pour le pontage aortocoronarien hors pompe : anesthésie générale, anesthésie péridurale générale et thoracique haute combinée, ou anesthésie péridurale thoracique haute seule. J Cardiothorac Vasc Anesth 2005;19:32–39.
- Stritesky M et al : Chirurgie cardiaque à la pompe chez un patient conscient utilisant une anesthésie péridurale thoracique - une méthode ultra rapide. Bratisl Lek Listy 2004;105:51–55.
- Kessler P et al : Anesthésie épidurale thoracique haute pour pontage aortocoronarien utilisant deux approches chirurgicales différentes chez des patients conscients. Anesth Analg 2002;95:791–797, table des matières.
- Anderson MB et al : Anesthésie péridurale thoracique pour la chirurgie cardiaque par thoracotomie antérieure gauche chez le patient conscient. Forum de chirurgie cardiaque 2002 ; 5: 105–108.
- Noiseux N et al : Pontage aortocoronarien chez le patient éveillé associant péridurale thoracique haute et bloc nerveux fémoral : première série de 15 patients. Br J Anaesth 2008;100:184–189.
- Barrington MJ et al : L'anesthésie péridurale pour le pontage aortocoronarien par rapport à l'anesthésie générale seule ne réduit pas les marqueurs biochimiques des lésions myocardiques. Anesth Analg 2005;100 : 921–928.
- Kendall JB et al : Une étude pilote prospective, randomisée et en simple aveugle pour déterminer l'effet de la technique d'anesthésie sur la libération de troponine T après une chirurgie coronarienne sans pompe. Anesthésie 2004 ; 59 : 545–549.
- Loick HM et al : L'anesthésie péridurale thoracique élevée, mais pas la clonidine, atténue la réponse au stress périopératoire par sympatholyse et réduit la libération de troponine T chez les patients subissant un pontage aortocoronarien. Anesth Analg 1999;88:701–709.
- Fillinger MP et al : Anesthésie péridurale et analgésie : effets sur la récupération après une chirurgie cardiaque. J Cardiothorac Vasc Anesth 2002;16:15–20.
- Scott NB et al : Une étude prospective randomisée des avantages potentiels de l'anesthésie péridurale thoracique et de l'analgésie chez les patients subissant un pontage coronarien. Anesth Analg 2001;93:528–535.
- Turfrey DJ et al : Anesthésie péridurale thoracique pour la chirurgie de pontage aortocoronarien. Effets sur les complications postopératoires. Anesthésie 1997 ; 52 : 1090–1095.
- Karagoz HY et al : Pontage aortocoronarien chez le patient éveillé : trois ans d'expérience chez 137 patients. J Thorac Cardiovasc Chirurgie 2003 ; 125:1401–1404.
- Liu SS, Block BM, Wu CL : Effets de l'analgésie neuraxiale centrale périopératoire sur les résultats après un pontage coronarien : une méta-analyse. Anesthésiologie 2004 ; 101 : 153–161.
- Hemmerling TM et al : Extubation immédiate après chirurgie de la valve aortique sous anesthésie péridurale thoracique haute. Forum sur la chirurgie cardiaque 2004 ; 7:16–20.
- Klokocovnik T et al : Remplacement mini-invasif de la valve aortique sous anesthésie péridurale thoracique chez un patient conscient : rapport de cas. Forum sur la chirurgie cardiaque 2004; 7: E196–E197.
- Slin'ko SK : Etat du système sympatho-surrénalien et hémodynamique chez l'enfant lors d'une chirurgie de cardiopathie congénitale sous anesthésie péridurale thoracique haute à la lidocaïne-cloféline. Anestéziol Réanimatol 2000 ; 1:10–13.
- Peterson KL et al : Un rapport de deux cent vingt cas d'anesthésie régionale en chirurgie cardiaque pédiatrique. Anesth Analg 2000;90:1014–1019.
- Hammer GB, Ngo K, Macario A : Un examen rétrospectif de l'anesthésie régionale et générale chez les enfants subissant une chirurgie à cœur ouvert. Anesth Analg 2000;90:1020–1024.
- Royse C et al : essai prospectif randomisé sur l'analgésie épidurale thoracique haute pour le pontage coronarien. Ann Thorac Surg 2003;75 : 93–100.
- Liem TH et al : Greffe de pontage aortocoronarien utilisant deux techniques anesthésiques différentes : Partie 2 : Résultat postopératoire. J Cardiothorac Vasc Anesth 1992;6:156–161.
- Hemmerling TM et al: Anesthésie ultra-rapide dans le pontage aortocoronarien hors pompe: un audit prospectif comparant l'anesthésie à base d'opioïdes à l'anesthésie péridurale thoracique. Can J Anaesth 2004;51 : 163–168.
- Bois S et al : L'analgésie péridurale et l'analgésie intraveineuse contrôlée par le patient entraînent des taux similaires d'ischémie myocardique postopératoire après une chirurgie aortique. Anesth Analg 1997;85:1233–1239.
- Ho SC et al : Douleur persistante après une chirurgie cardiaque : un audit des thérapies d'analgésie péridurale thoracique élevée et d'opioïdes primaires. Anesth Analg 2002;95:820–823, table des matières.
- Jensen, MK, Andersen C : La douleur chronique post-sternotomie après un remplacement valvulaire cardiaque peut-elle être réduite en utilisant l'analgésie péridurale thoracique ? Acta Anaesthesiol Scand 2004;48:871–874.
- Sanchez R, Nygard E : Anesthésie péridurale en chirurgie cardiaque : y a-t-il un risque accru ? J Cardiothorac Vasc Anesth 1998;12:170–173.
- Vanstrum GS, Bjornson KM, Ilko R : Effets postopératoires de la morphine intrathécale dans le pontage coronarien. Anesth Analg 1988;67 : 261–267.
- Bettex DA et al : le sufentanil-morphine intrathécal raccourcit la durée de l'intubation et améliore l'analgésie en chirurgie cardiaque accélérée. Can J Anaesth 2002;49:711–717.
- Mehta Y et al : Morphine rachidienne (sous-arachnoïdienne) pour le pontage coronarien hors pompe. Forum sur la chirurgie cardiaque 2004;7:E205–E210.
- Fitzpatrick GJ, Moriarty DC : La morphine intrathécale dans la prise en charge de la douleur après une chirurgie cardiaque. Une comparaison avec la morphine iv Br J Anaesth 1988;60:639–644
- Latham P et al : Anesthésie cardiaque accélérée : une comparaison du rémifentanil plus de la morphine intrathécale avec du sufentanil dans un anesthésique à base de desflurane. J Cardiothorac Vasc Anesth 2000;14:645–651.
- Alhashemi JA et al : Effet de l'administration de morphine sous-arachnoïdienne sur le temps d'extubation après un pontage coronarien. J Cardiothorac Vasc Anesth 2000;14:639–644.
- Chaney MA et al : morphine intrathécale pour le pontage coronarien et l'extubation précoce. Anesth Analg 1997;84:241–248.
- Finkel JC, Boltz MG, Conran AM : Changements hémodynamiques au cours de la rachianesthésie haute chez les enfants ayant subi une chirurgie à cœur ouvert. Paediatr Anaesth 2003;13:48–52.
- Pirat A, Akpek E, Arslan G : Fentanyl intrathécal versus IV en anesthésie cardiaque pédiatrique. Anesth Analg 2002;95:1207–1214, table des matières.
- Williams RK, Abajian JC : anesthésie rachidienne haute pour la réparation de la persistance du canal artériel chez les nouveau-nés. Paediatr Anaesth 1997;7:205–209.
- Zarate E et al : Anesthésie cardiaque accélérée : utilisation du rémifentanil associé à de la morphine intrathécale comme alternative au sufentanil pendant l'anesthésie au desflurane. Anesth Analg 2000;91:283–287.
- Boulanger A et al : Morphine intrathécale après chirurgie cardiaque. Ann Pharmacother 2002;36:1337–1343.
- Canto M et al : Bloc paravertébral bilatéral pour la chirurgie cardiaque conventionnelle. Anesthésie 2003 ; 58 : 365–370.
- Exadaktylos AK et al : bloc nerveux intercostal préopératoire pour un pontage coronarien mini-invasif : un schéma anesthésique standardisé pour une émergence rapide et une extubation précoce. Cardiovasc JS Afr 2004;15:178–181.
- McDonald SB et al : Bloc parasternal et infiltration d'anesthésique local avec de la lévobupivacaïne après une chirurgie cardiaque avec du desflurane : l'effet sur la douleur postopératoire, la fonction pulmonaire et les temps d'extubation trachéale. Anesth Analg 2005;100:25–32.
- Behnke H et al : [Traitement de la douleur postopératoire dans le cadre d'un pontage artériel coronaire direct mini-invasif. Analgésie intraveineuse opioïde contrôlée par le patient versus bloc intercostal]. Anesthésiste 2002 ; 51 : 175–179.
- Dowling R et al : Amélioration du contrôle de la douleur après une chirurgie cardiaque : résultats d'un essai clinique randomisé en double aveugle. J Thorac Cardiovasc Chirurgie 2003 ; 126:1271–1278.
- Dhole S et al : Comparaison des blocs périduraux et paravertébraux thoraciques continus pour l'analgésie postopératoire après un pontage coronarien direct mini-invasif. J Cardiothorac Vasc Anesth 2001; 15:288–292

