1.歴史
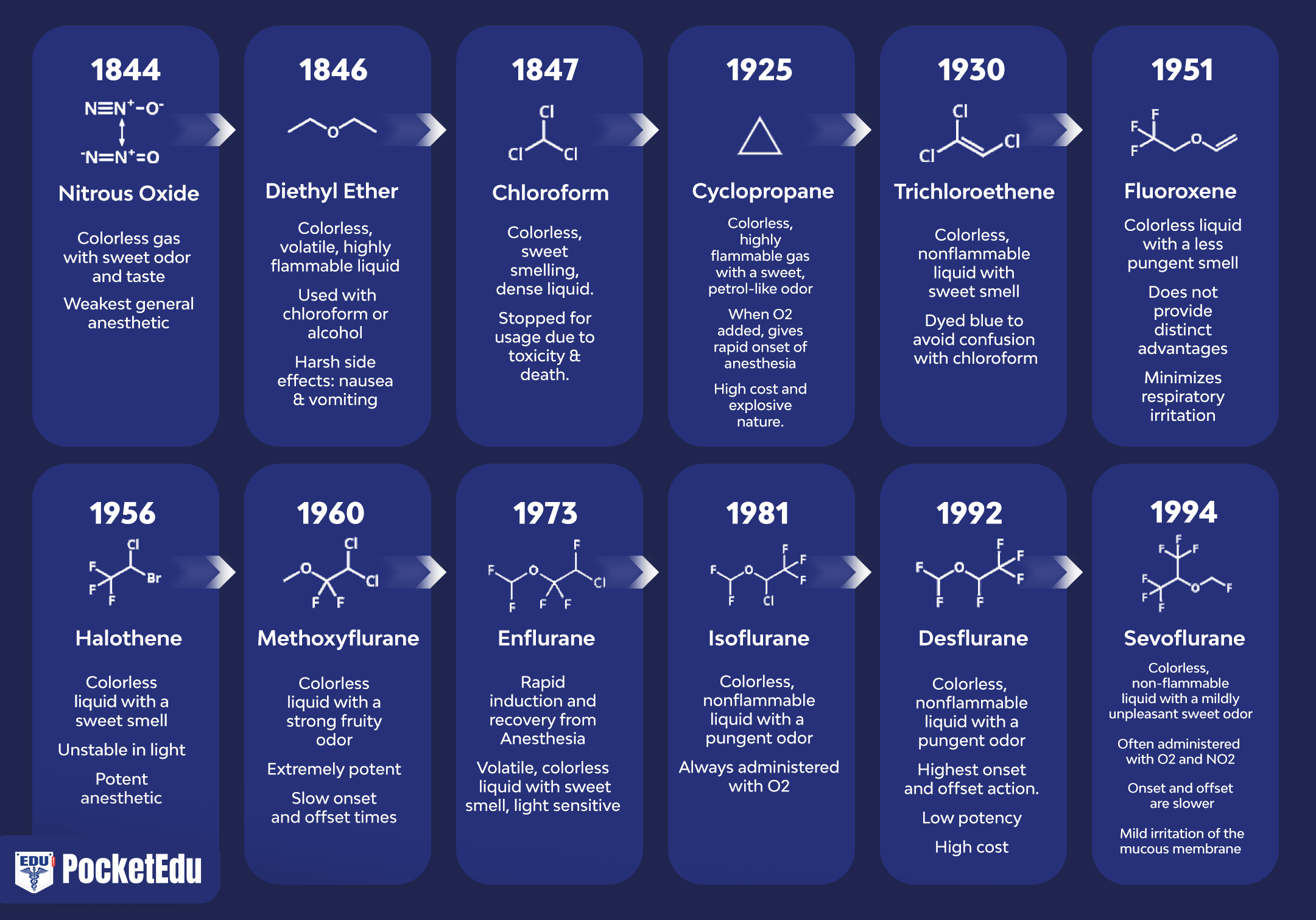
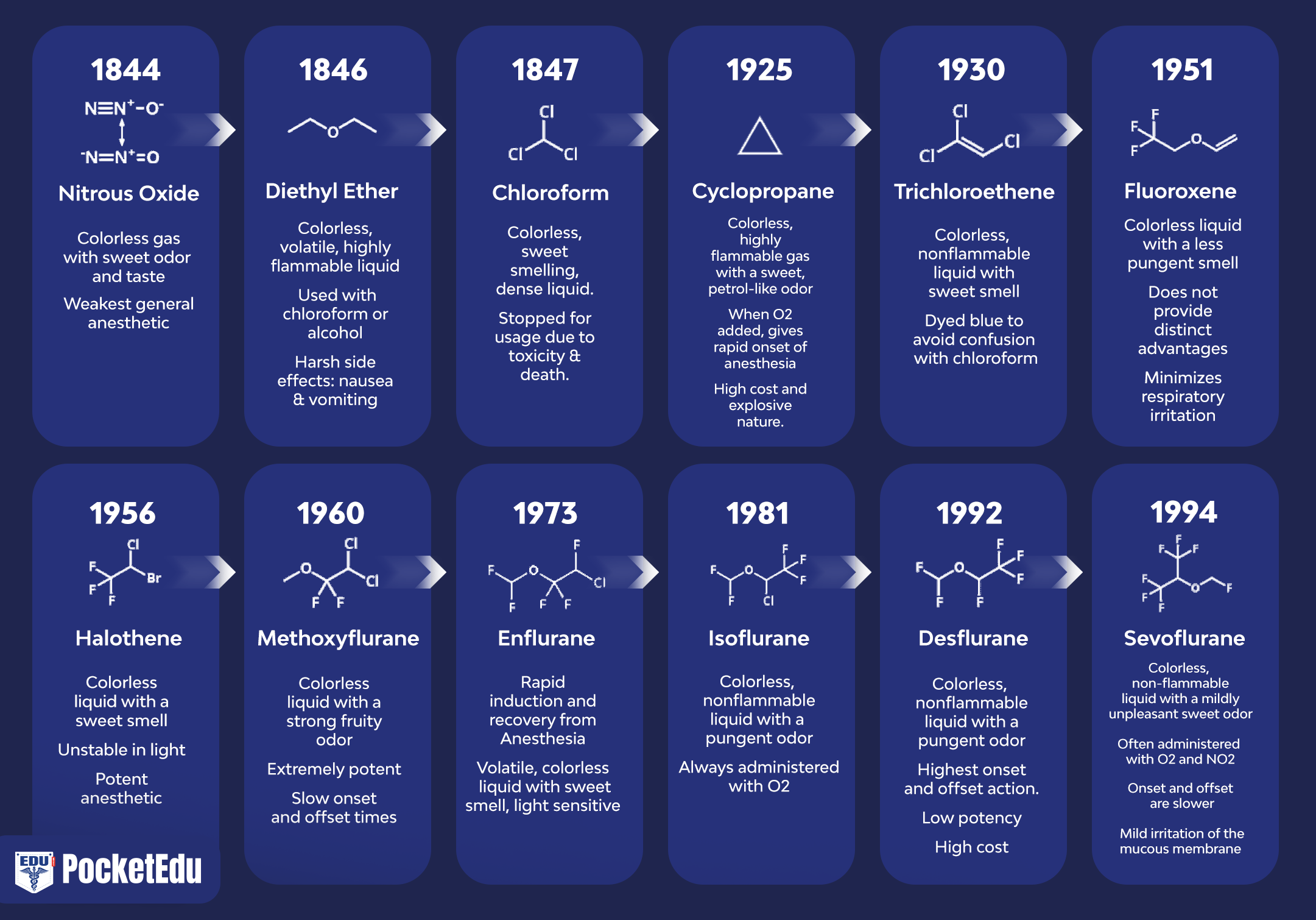
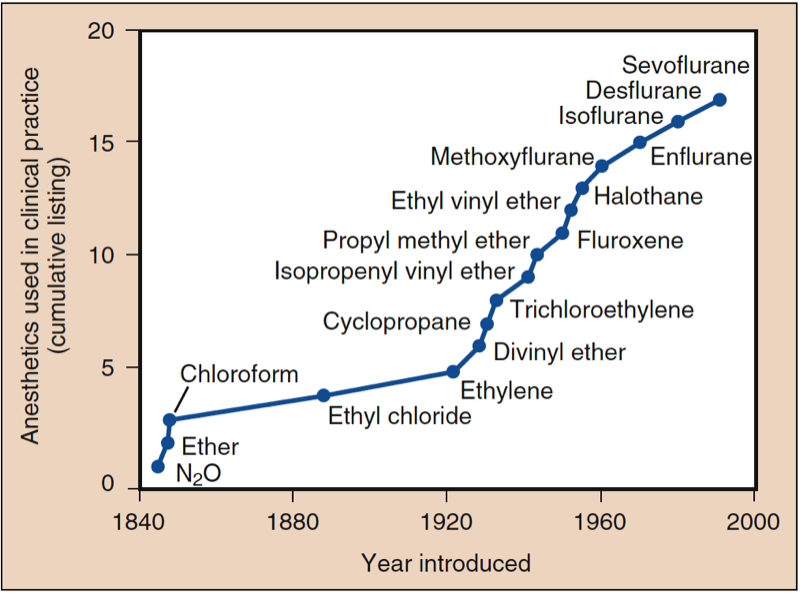
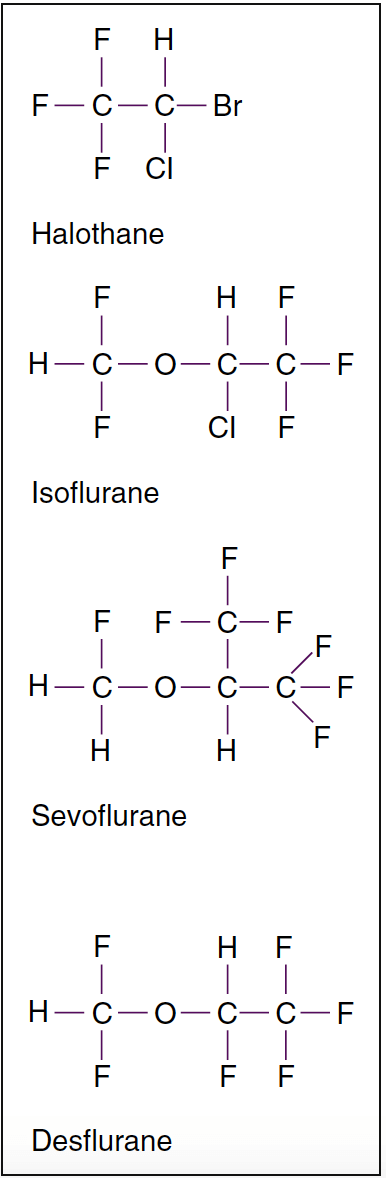
吸入麻酔の発見は、米国と英国の臨床医と科学者の貢献を反映しています (図 1) (1)。 現代の麻酔で最も一般的に使用される吸入麻酔薬には、揮発性液体 (すなわち、ハロタン、エンフルラン、イソフルラン、デスフルラン、およびセボフルラン) と単一ガス (すなわち、亜酸化窒素) が含まれます (図 2 および 3)。 ハロタン、エンフルラン、イソフルランはもはや一般的に使用されていません。 しかし、これらの吸入麻酔薬はどれも「理想的な」吸入麻酔薬のすべての基準を満たしておらず、化学的特性は薬物間で異なります。

- 図 1. 臨床で使用される麻酔薬。 麻酔の歴史は、亜酸化窒素 (N2O)、エーテル、およびクロロホルムの導入から始まりました。 1950 年以降、エチル ビニル エーテルを除いて、導入されたすべての薬物にフッ素が含まれています。 ハロタンから導入されたすべての麻酔薬は不燃性でした。 (Eger EI. Desflurane (Suprane): A Compendium and Reference. Nutley, NJ: Anaquest; 1993:1 より許可を得て使用。)

- 図 2. 強力な揮発性麻酔薬の分子構造。 ハロゲン化揮発性麻酔薬は、室温で液体です。 揮発性麻酔薬の中で、ハロタンはアルカン誘導体であり、他のすべてはメチルエチルエーテルの誘導体です。 イソフルランはエンフルランの化学異性体です。

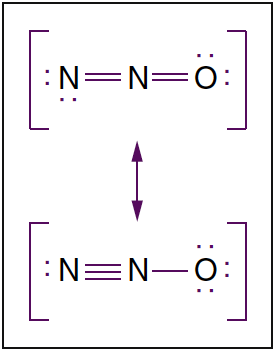
- 図 3. 亜酸化窒素の分子構造。 亜酸化窒素は、XNUMX つの共鳴構造に存在する直鎖状の分子です。 ドットは非結合電子を表します。
2. 最初の吸入麻酔薬
亜酸化窒素
亜酸化窒素ガスは、1772 年に英国の化学者、作家、そしてユニテリアン大臣のジョセフ プリーストリーによって初めて合成されました。 42 年後、Humphry Davy 卿は歯科鎮痛のために亜酸化窒素を投与しました。 彼は亜酸化窒素が手術の痛みを和らげるために使用されるのではないかと疑っていましたが、それは 29 年後、Horace Wells という名前の 1842 歳の歯科医が亜酸化窒素を自分自身に投与し、それが彼の痛みを和らげることを発見するまで使用されませんでした. 具体的には、彼は XNUMX 年にコネチカット州ハートフォードで開催された公開展示会で、亜酸化窒素の催眠効果と鎮痛効果に気づきました。翌日、ウェルズ自身が仲間の歯科医による抜歯を受けました。 ウェルズは抜歯の痛みを最小限に抑え、その後亜酸化窒素合成の方法を学び、自分の患者が利用できるようにしました. XNUMX 年後、彼はマサチューセッツ総合病院で亜酸化窒素投与を使用した無痛の歯科手術のデモンストレーションを手配しました。 完全に成功したわけではなく、このデモンストレーションの結果、ウェルズは信用を失いました。
ジエチルエーテル
ボストンの歯科医であるウィリアム・モートンは、エーテルがその酩酊効果のために呼吸される「エーテル戯れ」の間に、ジエチルエーテルが亜酸化窒素と同様の効果を有することに気付きました. ウェルズのように、モートンは歯科診療にエーテルを適用し、16 年 1846 月 1842 日 (「エーテルの日」) にマサチューセッツ総合病院でその麻酔特性を実証しました。 ウェルズの大失敗とは対照的に、モートンのデモは熱狂的に受け止められた。 成功したエーテル麻酔薬の結果はすぐに、Boston Medical and Surgical Journal に掲載されました。 クロフォード・ロングはモートンより 4 年前の XNUMX 年に患者にジエチル エーテルを投与したが、彼は自分の研究を公表しなかったため、伝統的にモートンはジエチル エーテルの麻酔能力を発見したとされてきた。
クロロホルム
スコットランドのエジンバラ出身の産科医である James Simpson は、クロロホルムを開発しましたが、これは、ジエチル エーテルで見られる長引く誘導、可燃性、および術後の吐き気を共有しませんでした。 クロロホルムはすぐに英国で吸入麻酔薬として人気を博しましたが、北米ではジエチルエーテルが医療行為を支配していました. 残念なことに、クロロホルムは、それ以外は健康な患者の原因不明の術中死亡や、肝毒性の多数の症例に関連していました.
3. 1920 年から 1940 年までの吸入麻酔薬
1920 年から 1940 年の間に、エチレン、シクロプロパン、およびジビニル エーテルが麻酔薬として使用されるようになりました。手術の結論。 しかし、それぞれに深刻な欠点がありました。 多くは可燃性 (すなわち、ジエチル エーテル、ジビニル エーテル、エチレン、およびシクロプロパン) でしたが、他のものは塩素で完全にハロゲン化され、毒性がありました (すなわち、クロロホルム、塩化エチル、およびトリクロロエチレン)。
4. フッ素化学と最新の吸入麻酔薬
最初の原子兵器を製造する努力から開発されたフッ素化学の技術は、現代の吸入麻酔薬を合成する方法を提供するという偶然の、社会的に有益な目的を見出しました(2,3)。 最新の吸入麻酔薬は、部分的または完全にフッ素でハロゲン化されています (図 2 を参照)。 フッ素化により、安定性が向上し、毒性が低下します。
ハロタン
ハロタンは 1956 年に臨床に導入され、広く使用されるようになりました。 古い麻酔薬と比較して、不燃性、心地よい匂い、臓器への毒性が少なく、エーテルよりもはるかに速い麻酔の導入と覚醒を可能にする薬物動態特性など、いくつかの利点がありました。 残念なことに、4 年間の商用利用の後、ハロタン麻酔後の劇症肝壊死の報告が、肝障害の他の原因が明らかでない患者に現れ始めました。 予測不可能な肝臓障害の問題は、他の揮発性麻酔薬の探索を刺激しました。 ハロタンはまた、カテコールアミンの不整脈作用に対して心筋を敏感にします。
メトキシフルラン
メトキシフルランは 1960 年に初めて臨床現場に導入されました。導入から最初の XNUMX 年以内に、メトキシフルラン麻酔による腎不全の報告が現れ、この麻酔薬の代謝に起因する無機フッ化物による用量依存性腎毒性を確認する研究につながりました。
エンフルラン
エンフルランは 1972 年に臨床診療に導入されました。ハロタンとは異なり、心臓をカテコールアミンに過敏にさせず、肝毒性との関連もありませんでした。 しかし、エンフルランは無機フッ化物に代謝され、特に高濃度で低炭酸ガス血症の存在下で投与された場合、脳波 (EEG) で発作活動の証拠を引き起こす可能性があります。
イソフルラン
イソフルランは 1980 年に臨床に導入され、臨床で広く使用されました。 心不整脈とは関係がありませんでした。 ハロタンやエンフルランほど容易に代謝されないため、イソフルランは毒性が低いと関連していました。 イソフルランは、その前任者と比較して、外科的麻酔のより迅速な開始とより迅速な覚醒を可能にしました。
セボフルランとデスフルラン
セボフルランとデスフルランはフッ素のみでハロゲン化されており、それぞれ 1960 年代後半と 1970 年代に初めて合成されました (2,3)。 どちらも高価で合成が難しいため、すぐに商業利用を検討することはありませんでした。 1980 年代に、外来患者の設定で行われる麻酔薬の割合が増加し、フッ素だけでハロゲン化された薬は血液や組織に溶けにくく、覚醒と回復を早めることができるという新たな認識に照らして、それらの開発が再考されました。
5. 作用機序
吸入麻酔薬がどのように麻酔状態を作り出すかという問題は、中枢神経系内の作用部位、相互作用する分子、およびこの生物学的相互作用の性質を含む、生物学的組織の多くのレベルで対処される可能性があります。 これらの質問に答えるには、麻酔効果を測定する能力が必要です (4)。 吸入麻酔薬は、ほぼ 160 年間、外科的麻酔を提供するために使用されてきましたが、麻酔状態を構成するものについて、受け入れられている単一の定義はありません。 実験目的のために、外科的刺激に応答した不動の運用上の定義と、術中のイベントに対する記憶喪失が有用であることが証明されています。
測定可能な特性
すべての吸入麻酔薬の測定可能で普遍的な特性には、不動の生成と健忘効果が含まれます。 不動性は、患者の 50% で外科的切開への動きを抑制するために必要な麻酔薬の最小肺胞濃度 (MAC) によって測定されます (2,5)。 しかし、記憶喪失または意識の存在を保証することは困難です。 鎮痛は麻酔状態の一部ですが、物覚えのない不動の患者では測定できません。 痛みの代替測定 (すなわち、心拍数または全身動脈血圧の上昇) は、吸入麻酔薬が痛みを伴う刺激の知覚を抑制しないことを示唆しています。 一部の吸入麻酔薬は、低濃度で痛覚過敏 (痛みを増強する) 効果があります。 骨格筋の弛緩は、骨格筋の緊張を高める亜酸化窒素によって証明されるように、吸入麻酔薬の一般的ではあるが普遍的ではない中心的な効果です。
不動
強力な吸入麻酔薬は、大部分が脊髄への作用によって不動をもたらします。これは、除脳動物の MAC の測定によって証明されています (6)。 げっ歯類での研究は、亜酸化窒素が中脳水道周囲灰白質脳幹に由来するノルアドレナリン作動性経路を下行性に活性化し、脊髄後角の侵害受容入力を阻害することを示唆しています(7,8)。
記憶処理効果
扁桃体、海馬、皮質などの脊椎上構造は、麻酔薬の健忘効果の標的となる可能性が非常に高いと考えられています。
中枢神経系の抑制とイオンチャネル
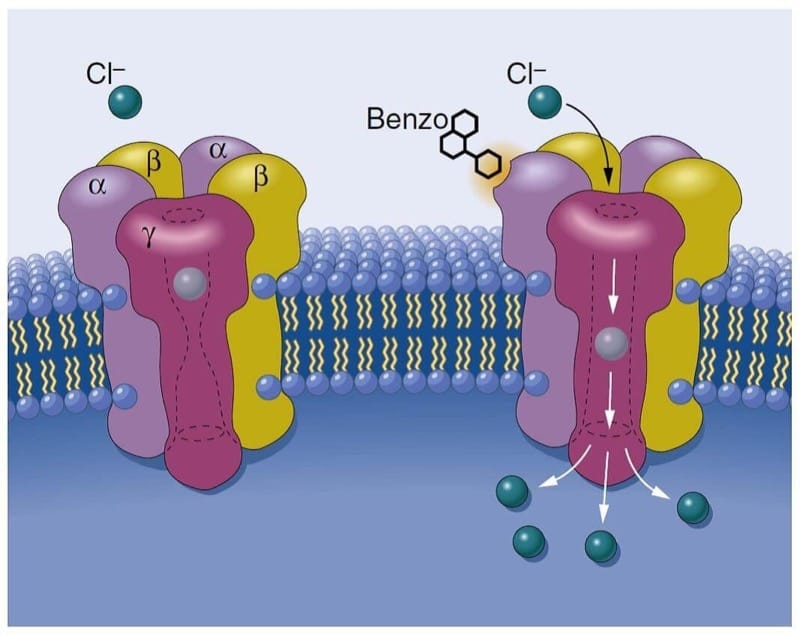
吸入麻酔薬は、神経系の電気的挙動を支配するイオンチャネルに作用することにより、中枢神経系の抑制を引き起こします (4)。 吸入麻酔薬は、おそらく抑制性イオン チャネルの機能を高め、興奮性イオン チャネルの機能を遮断することによって麻酔を生み出します。 抑制性イオン チャネルの機能を強化すると、ニューロンの過分極につながります。 過分極は、塩化物陰イオンが γ-アミノ酪酸 A (GABAA) 受容体またはグリシン受容体を介してニューロンに入る場合、またはカリウム イオン チャネルを介してニューロンからカリウム カチオンが流出する場合に生じます。 興奮性イオン チャネルの機能を遮断すると、ニューロンへの正電荷の通過 (すなわち、N-メチル-D-アスパラギン酸 [NMDA] 受容体またはナトリウム チャネルを介したナトリウム イオンの通過) が妨げられ、ニューロンの脱分極が防止されます。 麻酔薬は神経伝達物質の放出にも影響を与える可能性があり、この効果は、神経伝達物質の放出を調節するイオンチャネルによって部分的に媒介される可能性があります。
6. 物性
分子構造
現代の吸入麻酔薬は、亜酸化窒素を除いてハロゲン化炭化水素です。 ハロタンは、イソフルラン、セボフルラン、およびデスフルランに存在するエーテル部分を欠いており、心室性不整脈を引き起こす能力を説明しています。 イソフルランとデスフルランの違いは、フッ素が XNUMX つの塩素原子に置換されていることだけです。 フッ素置換により、代謝に対する安定性と耐性が向上します。
蒸気圧と送達
亜酸化窒素は、周囲温度では気体として存在しますが、高圧では液体になります。 残りの吸入麻酔薬は周囲温度で液体です。
可変バイパス気化器
ハロタン、セボフルラン、およびイソフルランは、可変バイパス気化器 (Tec 4、5、および 7、北米の Draeger 19.n および 20.n) によって供給されます。 可変バイパス 気化器には、流入する新鮮なガスの XNUMX つのストリームが含まれています。 サンプを通過するガスの流れは、麻酔薬の飽和蒸気圧によって支配されるように、麻酔薬で飽和されます。 揮発性麻酔薬は、飽和蒸気圧よりもはるかに低い分圧で臨床的に有用な麻酔を生成するため、サンプを出るガスは、麻酔薬と接触していないガスで希釈する必要があります。 気化器を出るガス中の麻酔薬の濃度は、サンプ チャネルとバイパス チャネルを通るフレッシュ ガスの相対流量 (すなわち、分割比) によって決まります。 臨床医が気化器のダイヤルまたは電子制御を調整すると、気化器から出る麻酔薬の出力濃度が制御されます。 可変バイパス気化器は温度補償されており、幅広い温度範囲で一定の出力を維持し、蒸気圧の違いに応じて個々の麻酔薬ごとに調整されています。 麻酔薬の蒸気がバイパス チャネルに入ると、気化器を傾けたり過剰に充填したりすると、麻酔薬の過剰投与につながる可能性があります。
Datex-Ohmeda Aladin Cassette Vaporizer は、Datex-Ohmeda Anesthesia Delivery Unit (ADU) マシンで使用されている単一の電子制御式気化器であり、そのバイパスは ADU 内に収容されており、サンプは交換可能な、磁気的にコード化されたカセット内に配置されており、ハロタンを供給します。エンフルラン、イソフルラン、セボフルラン、デスフルラン。 Aladin は、中央処理装置 (CPU) の活動を介して出力濃度を調整する手段として可変バイパスを利用します。 CPU は、濃度設定、流量計、内部圧力および温度センサーを含む複数のソースから入力を受け取り、気化チャンバーの出口にある流量制御バルブを調整します。 デスフルラン投与中に室温が 22.8°C を超えた場合に発生する、カセット (サンプ) 内の圧力がバイパス チャンバー内の圧力を超えると、一方向逆止弁が閉じるように設計されており、麻酔飽和ガスが逆流して血管内に逆流するのを防ぎます。その後の麻酔薬の過剰摂取を伴うADU。
加熱気化器
海面でのデスフルランの蒸気圧は 700° C で 20 mm Hg (室温でほぼ沸騰状態) であり、可変バイパス気化器による送達では予測できない濃度が生じる可能性があります。 このため、デスフルランガスを 6 気圧に加熱する特別に設計された気化器 (Tec 2、Datex-Ohmeda) を使用して、麻酔提供者による濃度ダイヤルの調整に対応するデスフルラン蒸気を正確に計量および送達します。 可変バイパス気化器とは対照的に、Tec 6 からのデスフルランの出力濃度は、気圧の範囲全体で一定です (9)。 したがって、高地では、特定の Tec 6 気化器設定および出力 (体積パーセント) 濃度でのデスフルランの分圧は、海面よりも低くなり、高地を考慮して調整を行わない限り、麻酔薬の投与量不足につながります。必要な気化器設定 = (海面での望ましい気化器設定 × 760 mm Hg)/局所気圧 (mm Hg) (10)。 可変バイパス 気化器では、その逆 (より大きな出力) が発生する可能性があります。 ただし、麻酔作用の薬理学的に関連する定量的パラメーターは分圧であり、体積パーセントではありません。 したがって、気化器からの麻酔のより大きな出力は、同じ気化器の設定でより高い高度で発生しますが、供給される分圧と麻酔効果は、気化器の設定に関連して両方の場所で同様になります。
経済および環境への配慮
フレッシュガスの流量は、使用される揮発性液体の量に直接影響し、その結果、麻酔薬の供給コストに影響します。 より高いフレッシュ ガス フロー (分時換気量以上) により、再呼吸が最小限に抑えられ、吸気と中枢神経系 (CNS) の分圧がより速く平衡化されます。 ただし、非再呼吸フローの使用は、環境への麻酔薬の損失を伴うため、限られた時間、通常は麻酔導入時、または軽い鎮静と切迫した外科的刺激の状況でのみ使用する必要があります。 吸入麻酔薬の放出が全体的な温室効果ガス排出と気候変動に与える影響についての認識と懸念が高まっています。 潜在的な環境への影響は、各麻酔薬の固有の赤外線吸収スペクトルと同様に、大気中の生涯ガスに起因すると思われます。 吸入麻酔薬の大気寿命はかなり異なります (亜酸化窒素、デスフルラン、セボフルラン、およびイソフルランは、それぞれ推定 114 年、10 年、3.6 年、および 1.2 年です)。 個々の赤外線吸収スペクトルは異なり、デスフルランは、最も低いセボフルランと比較した場合、二酸化炭素相当の影響が相対的に最大です。 全体的な気候変動に対する吸入麻酔薬の影響は依然として論争の的となっていますが、いくつかの点が考慮に値します。 まず、低フレッシュ ガス フロー (0.5 ~ 1 L/分) を使用すると、コストと環境への放出が相殺されます。 第二に、麻酔薬を回収して再利用するシステムの開発は、環境への影響をさらに制限し、お金を節約する可能性を秘めています (11)。
安定性
代謝または二酸化炭素吸収剤との相互作用 (特に乾燥した場合) による麻酔薬の分解により、潜在的に有毒な化合物がいくつか生成されます (11)。
代謝と分解
メトキシフルランは無機フッ化物を生成し、これは過去の長期麻酔後の散発的な腎毒性 (すなわち、高腎不全) の原因でした。 セボフルランの分解から生成される化合物 A (すなわち、フルオロメチル-2,2-ジフルオロ-1-[トリフルオロメチル] ビニル エーテル)、およびハロタンから生成される同様の化合物は、長期暴露後に動物に対して腎毒性を示します。 ヒトでは、セボフルランと低フレッシュガスフロー (1 L/分) による長時間の麻酔により、一過性のタンパク尿、酵素尿、および糖尿を引き起こすのに十分な化合物 A への暴露が生じますが、血清クレアチニン濃度の上昇または長期的な有害作用の証拠はありません。腎機能について。 それにもかかわらず、セボフルランの添付文書では、低フレッシュガスフロー (<2 L/min) をセボフルラン麻酔の 2 MAC 時間 (すなわち、MAC 濃度 × 投与時間) 未満に制限することを推奨しています。
二酸化炭素吸収剤と発熱反応
二酸化炭素吸収剤への暴露による揮発性麻酔薬の分解量に影響を与える変数には、吸収剤の状態 (すなわち、水和と温度) と化学組成、フレッシュ ガスの流量、分時換気量、そして最も重要な麻酔薬自体が含まれます (12)。 . デスフルランとイソフルランは水和二酸化炭素吸収剤中で 60°C を超える温度まで非常に安定していますが、水酸化ナトリウムと水酸化カリウムを含む従来の二酸化炭素吸収剤を完全に乾燥させると、温度に関係なくすべての揮発性麻酔薬から分解と一酸化炭素の生成が起こります。 高いフレッシュガス流量 (特に通常の分時換気量を超えるもの) は吸収剤の乾燥を加速し、乾燥は劣化の加速につながります。 分解は発熱プロセスであるため、吸収剤の温度が劇的に上昇する場合があります。
乾燥した二酸化炭素吸収剤と揮発性麻酔薬 (特にセボフルラン) の相互作用から生じる発熱反応により、吸収剤キャニスター内が非常に高温になることがあります (13,14)。 温度が上昇すると、キャニスターまたは麻酔回路で爆発や火災が発生する可能性があります。 発熱反応による火災や爆発の遠隔リスクは、二酸化炭素吸収剤の十分な水分補給を確実に維持する手段を採用することで完全に回避できます (つまり、吸収剤を定期的に交換する、無人麻酔器でフレッシュガスフローを下げるかオフにする、フレッシュガスを制限する)。麻酔中のガス流量、および吸収剤の水和について疑問がある場合は、それを変更します)。 一価の塩基(水酸化ナトリウムや水酸化カリウムなど)が減少した、または存在しない市販の二酸化炭素吸収剤は、吸収剤の水和状態に関係なく、揮発性麻酔薬にさらされても大幅な分解を受けません。
7. 吸入麻酔薬の相対効力
吸入麻酔薬間の相対的効力は、外科的切開に反応して患者の 50% の動きを抑制するのに必要な用量によって最も一般的に説明されます (5)。 この用量 (用量反応曲線上の 10 点) を MAC と呼びます。 MAC の標準偏差は約 95% であるため、患者の 1.2% は吸入麻酔薬の 99 MAC での切開に反応して動くべきではなく、患者の 1.3% は吸入麻酔薬の XNUMX MAC での切開に反応して動くべきではありません。 . MAC はいくつかの変数の影響を受けますが、性別や手術時間、麻酔の影響を受けません。
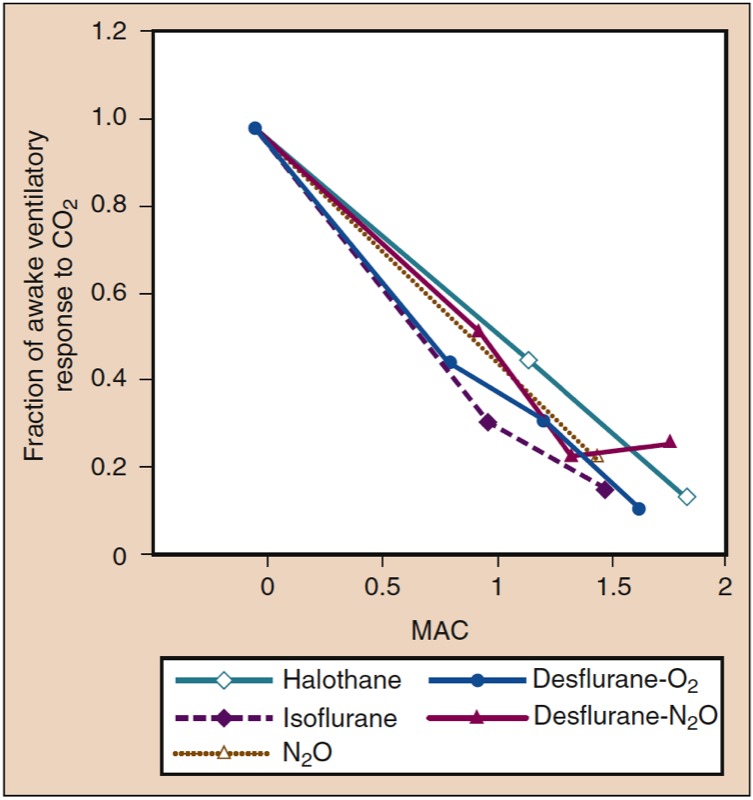
MAC により、麻酔薬間で効力を比較できます。 1.15% イソフルランは、同様の年齢と体温の患者の外科的切開に反応する動きを防ぐことにおいて、6% デスフルランと同等の効力を持っています。 驚くべきことに、異なる吸入麻酔薬の MAC 値は相加的です。 例えば、0.5 MAC のイソフルランと一緒に投与された 0.5 MAC の亜酸化窒素は、切開に反応した動きを防止する点で、吸入麻酔薬の 1 MAC と同じ効果があります (脊髄レベルでの反射反応の麻酔誘発抑制を反映しています) ( 6)。 外科的切開に反応する動きを防ぐために必要な脳の麻酔薬の濃度は、MAC よりも大きくなる可能性があります。
記憶喪失を引き起こすのに必要な麻酔薬の投与量は、おそらく MAC よりも変動しやすい。 言語刺激の想起を妨げるイソフルランの肺胞濃度は、ボランティアの 0.20% で 50 MAC、0.40% で 95 MAC でした (15)。 したがって、用量反応の標準正規分布を仮定すると、リコールを防止する最小濃度の標準偏差は、平均値の約半分 (0.1 MAC) になります。 標準的な正常曲線を参照すると、最も高い麻酔薬を必要とする 1 人に 100,000 人の被験者が必要とする濃度は、平均よりも 4.27 標準偏差 (SD) 高い (つまり、0.627 MAC より大きい) ことで、言語刺激の想起を防ぐことができると計算できます。 ただし、この値を手術の文脈に当てはめるには注意が必要です。これは、言葉による刺激とは対照的に、痛みの想起を防ぐために必要な用量がかなり大きくなる可能性があるためです (16)。 外科的切開に対する運動反応 (MAC に反映される) を防止するために必要な濃度と、意識を抑制して想起を防止するために必要な濃度の比率は、個々の強力な吸入麻酔薬の間でわずかに異なり、強力な吸入麻酔薬全体と亜酸化窒素との間で大幅に異なります。 イソフルランを与えられた志願者は、0.45 MAC のイソフルランでは記憶を示さなかったが、0.6 MAC の亜酸化窒素で記憶が起こった (17)。
8. 吸入麻酔薬の薬物動態
吸入麻酔薬の薬物動態は、肺胞から体循環への取り込み (吸収)、体内での分布、および肺による最終的な排出または主に肝臓での代謝を説明します。 吸入麻酔薬の吸気分圧 (PI) (気相を参照する場合の濃度 [%] と同じ) を制御することにより、麻酔薬が麻酔器からその作用部位に送達されるように勾配が作成されます。脳。 吸入麻酔の主な目的は、麻酔薬の一定かつ最適な脳分圧 (Pbr) を達成することです。
脳と他のすべての組織は、動脈血 (Pa) によってそれらに配信される吸入麻酔薬の分圧と平衡します。 同様に、血液は麻酔薬の肺胞分圧 (PA) と平衡します。
パ ⇄ パ ⇄ Pbr
一定かつ最適な PA を維持することは、Pbr を制御するための間接的ではあるが有用な方法になります。 吸入麻酔薬の PA はその Pbr を反映しており、PA が麻酔深度の指標、麻酔からの導入と回復の速度の反映、および同等の効力の尺度として使用される理由です (「相対効力」の下の前述の説明を参照)。吸入麻酔薬」)。 PA と Pbr を決定する要因を理解することで、麻酔プロバイダーは、脳に送達される吸入麻酔薬の用量を巧みに制御および調整することができます。
肺胞分圧を決定する要因
吸入麻酔薬の PA および最終的には Pbr は、肺胞への入力 (送達) から、肺胞から肺動脈血への薬物の取り込み (損失) を差し引いて決定されます。 吸入麻酔薬の入力は、PI、肺胞換気 (˙VA)、および麻酔呼吸システムの特性によって異なります。 吸入麻酔薬の取り込みは、溶解度、心拍出量 (CO)、および肺胞と静脈の分圧差 (PA − Pv) に依存します。 これら XNUMX つの要因が同時に作用して、PA が決定されます。 吸入麻酔薬の代謝および経皮的損失は、麻酔の導入および維持中のPAに大きな影響を与えません。
インスパイア麻酔分圧
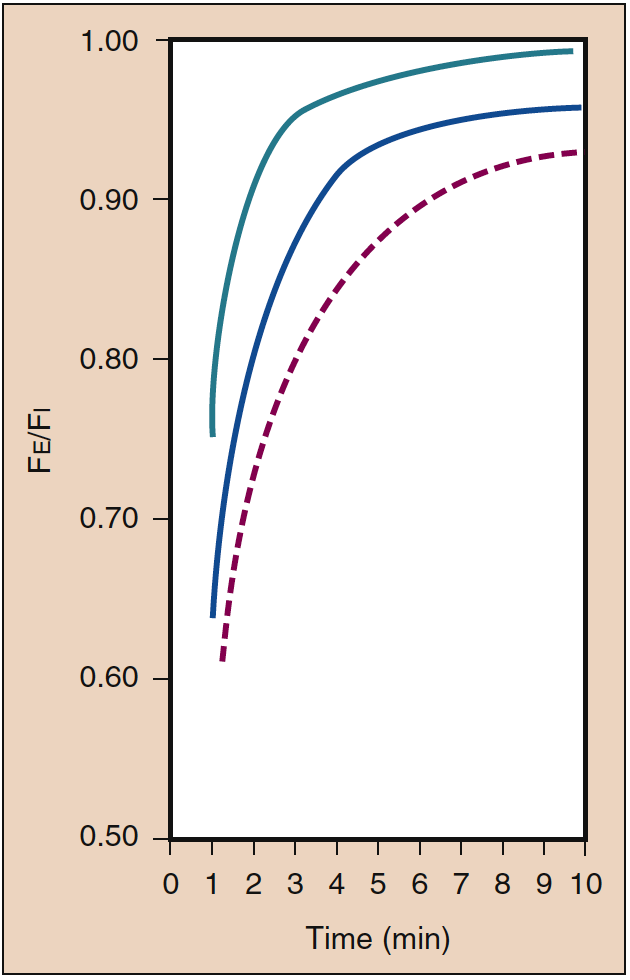
吸入麻酔薬の初回投与時には、高い PI が必要です。 この初期の高い PI (つまり入力) は、血中への取り込みの影響を相殺し、PA の増加率に反映されるように麻酔の導入を加速します。 この PI の効果は、集中効果として知られています。 臨床的には、濃縮効果を生み出すのに必要な濃度範囲は、おそらく亜酸化窒素でのみ可能です (図 4) (19)。

- 図 4. 吸気濃度 (%) (Fi) が肺胞 (呼気終末) 濃度 (Fe) の増加率に与える影響は、濃度効果として知られています。 線は、85% (緑)、50% (青)、および 10% (赤の破線) の濃度を示します。 (Eger EI より。肺胞濃度の上昇率に対する吸入麻酔薬濃度の効果。Anesthesiology.1963;24:153-157、許可を得て使用。)
時間が経つにつれて、血液への取り込みが減少するため、麻酔薬の取り込みの減少に合わせて PI を減らす必要があります。 麻酔プロバイダーが一定かつ最適な Pbr を維持するという目標を達成する場合、PI を時間の経過に伴う取り込みの減少に合わせて減少させることが重要です。 たとえば、PI が時間とともに一定に維持された場合 (入力定数)、PA (および Pbr によって反映される麻酔の深さ) は、血液への麻酔薬の取り込みが時間とともに減少するにつれて、徐々に増加します。
セカンドガスエフェクト
10 番目のガス効果は、濃度効果とは無関係に発生する明確な現象です。 2 つのガス (第 2 ガス) の大量摂取が、同時に投与されるコンパニオン ガス (第 XNUMX ガス) の PA の増加率を加速する能力は、第 XNUMX ガス効果として知られています。 例えば、亜酸化窒素の最初の大量の取り込みは、揮発性麻酔薬や酸素などのコンパニオン ガスの取り込みを加速します。 亜酸化窒素投与の初期段階に伴う PaOXNUMX の一時的な増加 (約 XNUMX%) は、酸素に対する亜酸化窒素の XNUMX 番目のガス効果を反映しています。 この PaOXNUMX の増加は、肺胞過酸素化と呼ばれています。 すべての吸入ガス (すなわち、第 XNUMX ガスと第 XNUMX ガス) の気管流入の増加と、第 XNUMX ガスの大量の取り込みによる、より小さな肺容積への第 XNUMX ガスの濃度 (すなわち、濃縮効果) が、第 XNUMX ガスの説明です。効果。 XNUMX 番目のガス効果は、証明された薬物動態の原則に基づいていますが、その臨床的重要性は疑わしいものです。
肺胞換気
増加した˙VA は、PI と同様に、吸入麻酔薬の入力を促進して、血液への取り込みを相殺します。 正味の効果は、PA の増加率と麻酔導入の速度がより速くなることです。 予想通り、低換気は逆効果で、麻酔の導入を遅らせるように作用します。
過換気と静脈還流の減少をもたらす肺の制御された換気は、入力の増加 (すなわち、˙VA の増加) と取り込みの減少 (すなわち、CO の減少) により、PA の増加率を加速します。 その結果、肺の制御換気中に麻酔薬の過剰摂取のリスクが高まる可能性があり、肺の換気が自発換気から制御換気に変更された場合、現在と同様の PA を維持するために揮発性麻酔薬の PI を下げることが適切である可能性があります。自発換気中。
過換気のもう 2 つの影響は、関連する PaCOXNUMX の減少による脳血流の減少です。 おそらく、PAの増加率に対する麻酔薬の入力の増加の影響は、脳への麻酔薬の送達の減少によって相殺されるでしょう。 理論的には、冠状動脈の血流は変化しないままである可能性があり、麻酔薬の入力が増加すると心筋の機能低下が生じ、脳血流の減少は中枢神経系の機能低下の同時発症を防ぎます。
麻酔呼吸システム
PA の増加率に影響を与える麻酔呼吸システムの特性には、システムの容積、システムのゴムまたはプラスチック部品への吸入麻酔薬の溶解度、および麻酔器からのガス流入が含まれます。 麻酔呼吸システムのボリュームは、PA の達成を遅らせるためのバッファーとして機能します。 麻酔器からの大量のガス流入は、この緩衝効果を無効にします。 麻酔呼吸システムの構成要素における吸入麻酔薬の溶解性は、最初に PA が増加する速度を遅くします。 麻酔の終わりに、麻酔呼吸システムの分圧勾配が逆転すると、麻酔薬が溶出し、PA が減少する速度が遅くなります。
血液および組織における吸入麻酔薬の溶解度は、分配係数によって示されます。 分配係数は、吸入された麻酔薬が平衡状態 (分圧が同じ場合) で 10 つの相間でどのように分配されるかを表す分配比です。 たとえば、血液とガスの分配係数が 10 の場合、吸入された麻酔薬の濃度は、血液中は 1、肺胞ガス中は 37 であり、これら XNUMX つの相の麻酔薬の分圧が同じであることを意味します。 分配係数は温度に依存します。 例えば、液体の温度が低下すると、液体中の気体の溶解度が増加します。 特に明記しない限り、分配係数は XNUMX°C で与えられます。
血液ガス分配係数
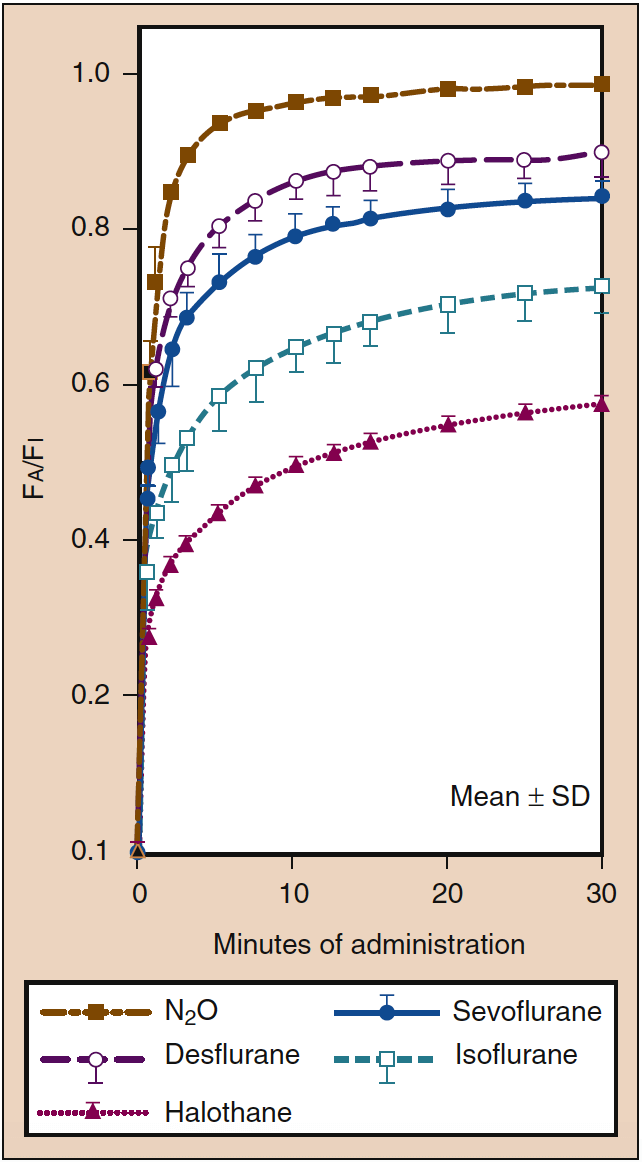
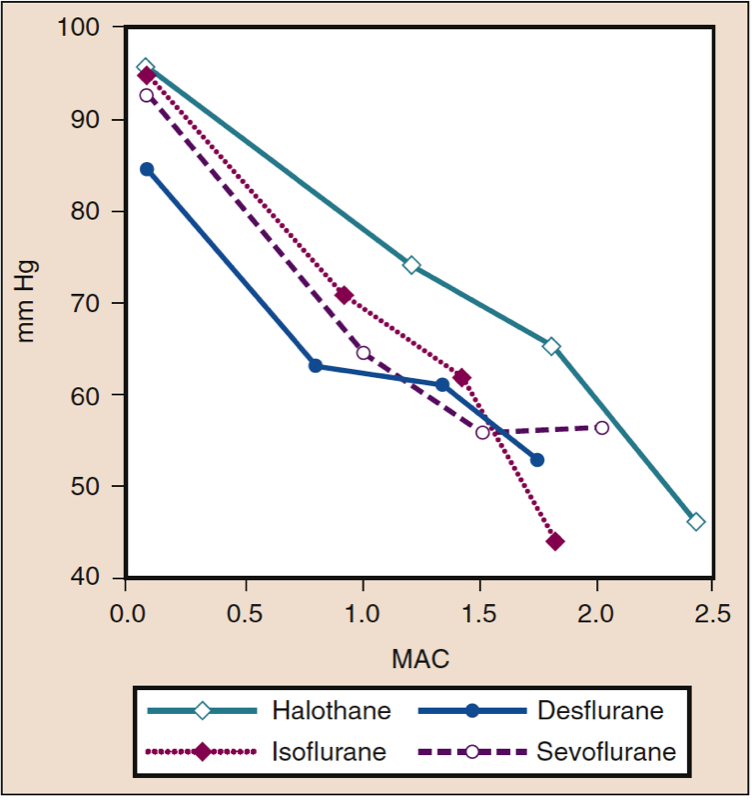
血中溶解度が高いということは、気相との平衡に達する前に、大量の吸入麻酔薬が血中に溶解する (つまり、取り込まれる) 必要があることを意味します。 血液は薬理学的に不活性なリザーバーと見なすことができ、そのサイズは血液中の麻酔薬の溶解度によって決まります。 血液ガス分配係数が高い場合、Pa が PA と平衡になる前に、大量の麻酔薬が血液中に溶解する必要があります (図 5) (18)。 臨床的には、高い血液溶解度が PA の上昇率に及ぼす影響は、PI を上昇させることである程度相殺することができます。 血中溶解度が低い場合、PA と Pa および Pbr の増加率が急速になるように、平衡に達する前に最小限の量の麻酔薬を血中に溶解させる必要があります (図 5 を参照) (20)。

- 図 5. 血液ガス分配係数は、肺胞濃度 (Fa) が一定の吸気濃度 (Fi) に向かって増加する速度の主な決定要因です。 麻酔の導入速度は、Fa の増加速度と平行しています。 同様の血中溶解度にもかかわらず (表 1 を参照)、Fa の増加率は、デスフルラン (紫色の破線) またはセボフルラン (青色の実線) よりも亜酸化窒素 (茶色がかった金色の破線) の方が急速です。亜酸化窒素に対する濃度効果 (図 4 を参照)。 デスフルランとセボフルランの組織溶解度が大きいことも、亜酸化窒素と比較して、これらの薬物の Fa の増加速度が遅いことに寄与している可能性があります。 SD、標準偏差。 (Yasuda N, Lockhart SH, Eger EI II, et al. Comparison of kinetics of sevoflurane and isoflurane in human. Anesth Analg. 1991;72:316-324より許可を得て使用。)
組織血液分配係数
組織血液分配係数は、Pa と組織の平衡化に必要な時間を決定します (表 1を参照)。 この時間は、各組織の時定数 (つまり、組織内で溶解できる吸入麻酔薬の量を組織血流で割った値) を計算することによって予測できます。 イソフルランなどの揮発性麻酔薬の脳血液分配係数は、約 3 ~ 4 分の時定数になります。 Pa と脳を含む任意の組織の完全な平衡には、少なくとも 10 つの時定数が必要です。 これは、Pbr が類似していると仮定する前に、この揮発性麻酔薬の PA を 15 ~ 2 分間一定に維持する根拠です。 亜酸化窒素、デスフルラン、セボフルランなどの溶解性の低い麻酔薬の時定数は約 6 分で、完全な平衡は約 XNUMX 分で達成されます (つまり、XNUMX つの時定数)。
組織間拡散による麻酔の移動
麻酔薬の取り込みの一部は、さまざまな組織への血流によってではなく、内臓間の界面など、麻酔薬に対する親和性の低い組織から高い組織への移行 (すなわち、除脂肪組織から脂肪組織への移行) によって発生する可能性があるという証拠が増えています。大網脂肪(「状況に応じたハーフタイム」を参照)。 体格の大きい人 (21) と動物 (22) は、おそらく除脂肪表面積が大きいほど、セボフルランとイソフルランの摂取量が多いことを示しています。 臨床的に現実的な期間 (12 ~ 24 時間未満) の麻酔中の血流によるバルク脂肪への移動は、バルク脂肪コンパートメントが受け取る比較的小さな血流とその比較的大きなサイズを考えると、これらの違いを説明する可能性は低い.
亜酸化窒素とメチオニン合成酵素の不活性化
亜酸化窒素は、ビタミン B12 と葉酸代謝を調節する酵素であるメチオニン合成酵素を不活性化することで、麻酔薬の中でも独特です。 酵素の不活性化の影響は、多くの患者では微妙または無症状である可能性がありますが、根底にある重篤な疾患または既存のビタミン B12 欠乏症を患っている患者は、神経学的または血液学的後遺症に苦しむ可能性があります。 メチオニンへの変換に機能的なメチオニンシンターゼを必要とするホモシステインは、血中濃度が上昇すると冠動脈イベントの危険性が高くなります (23)。 頸動脈内膜切除術中に亜酸化窒素を投与された患者は、亜酸化窒素を投与されていない患者と比較して、ホモシステインレベルと心筋虚血エピソードの頻度が有意に上昇した(24)。
閉鎖ガス空間への亜酸化窒素の移送
亜酸化窒素の血液ガス分配係数 (0.46) は、窒素 (34) の 0.014 倍です。 この異なる溶解度は、亜酸化窒素が血液から空気で満たされた空洞に入る速度が、窒素が空洞から血液に入る速度の 34 倍の速さであることを意味します。 この亜酸化窒素の優先的な移動の結果として、空気で満たされた空洞の容積または圧力が増加します。 コンプライアントな壁に囲まれた空気で満たされた腔への亜酸化窒素の侵入(例、腸内ガス、気胸、肺水疱、空気塞栓症)は、ガス空間を拡張させる。 逆に、コンプライアントな壁(例、中耳、脳室、テント上硬膜下腔)に囲まれた空気で満たされた腔に亜酸化窒素が入ると、圧力が上昇する。
空気で満たされた空洞内の容積または圧力の増加の大きさは、亜酸化窒素の PA、空気で満たされた空洞への血流、および亜酸化窒素の投与期間によって影響を受けます。 動物モデルでは、75% の亜酸化窒素を吸入すると、10 分間で気胸の容積が 25 倍になります (50)。 閉鎖性気胸の存在は、亜酸化窒素の投与に対する禁忌です。 胸部外傷(肋骨骨折など)の既往歴のある患者に亜酸化窒素を投与している間の肺コンプライアンスの低下は、以前は認識されていなかった気胸が亜酸化窒素によって誘発されて拡大したことを反映している可能性があります。 同様に、静脈空気塞栓症に関連する気泡は、亜酸化窒素にさらされると急速に膨張します。 気胸または気泡の急速な拡大(すなわち、静脈空気塞栓症)とは対照的に、亜酸化窒素によって生成される腸ガス量の増加はゆっくりです。 腹腔内手術を受ける患者に亜酸化窒素を投与するかどうかという問題は、手術が短時間の場合にはほとんど重要ではありません。 しかし、亜酸化窒素の吸入濃度を 25% に制限することは、術前に腸ガス量が増加している場合 (腸閉塞など) には賢明な推奨事項となる場合があります。 このガイドラインに従えば、長時間の手術中でも、腸のガス量はせいぜい XNUMX 倍になります (XNUMX)。
心拍出量
CO は、多かれ少なかれ肺胞から麻酔薬を運び去ることによって、肺動脈血への取り込みに影響を与え、したがって PA に影響を与えます。 COが高い(例えば、不安によって誘発される)と、吸収がより速くなり、PAの増加速度および麻酔の導入が遅くなる。 低CO(例えば、ショック)は、入力に対抗する血液への取り込みが少ないため、PAの増加速度を速める。 一般的な臨床的印象は、ショック状態の患者の麻酔導入が迅速であるというものです。
シャント
右から左への心臓内または肺内シャントは、麻酔の導入速度を遅くします。 この減速は、換気された肺胞から来る血液中の麻酔薬の分圧に対する、麻酔薬を含まないシャントされた血液の希釈効果を反映しています。 同様のメカニズムが、右から左へのシャントの存在下での PaO2 の減少に関与しています。
左から右へのシャント(例,動静脈瘻,揮発性麻酔薬による皮膚血流の増加)は,肺を通過した静脈血よりも高い分圧の麻酔薬を含む静脈血を肺に送る結果となる。組織。 その結果、左から右への組織シャントは、Pa に対する右から左へのシャントの希釈効果を相殺します。Pa の増加率に対する左から右へのシャントの効果は、次の場合にのみ検出可能です。右から左へのシャントが同時に存在します。 同様に、右から左へのシャントの希釈効果は、左から右へのシャントがない場合に最大になります。 すべての要因を考慮すると、右から左へのシャントの影響が臨床的に明らかになる可能性は低いと思われます。
無駄な換気
非灌流肺胞の換気は、Pa に対する希釈効果が生じないため、麻酔導入速度に影響を与えません。 無駄な換気の主な影響は、PA と吸入麻酔薬の Pa に差が生じることです。 同様のメカニズムが、呼気終末の PCO2 と PaCO2 の間でよく観察される違いの原因です。
肺胞と静脈の分圧差
PA – Pv は、吸入麻酔薬の組織への取り込みを反映しています。 高度に灌流された組織 (すなわち、脳、心臓、腎臓、および肝臓) は、体重の 10% 未満を占めますが、CO の約 75% を受け取ります。その結果、これらの高度に灌流された組織は、Pa と急速に平衡化します。一定 (吸入麻酔薬の場合は 6 ~ 12 分) の場合、戻り静脈血の約 75% が PA と同じ分圧になります (つまり、狭い PA - Pv)。 このため、肺胞からの揮発性麻酔薬の取り込みは 6 ~ 12 分後に大幅に減少し、これは PI - PA 差の縮小に反映されます。 この時間の後、揮発性麻酔薬の吸入濃度を下げて、取り込みが減少した場合でも一定の PA を維持する必要があります。
麻酔からの回復
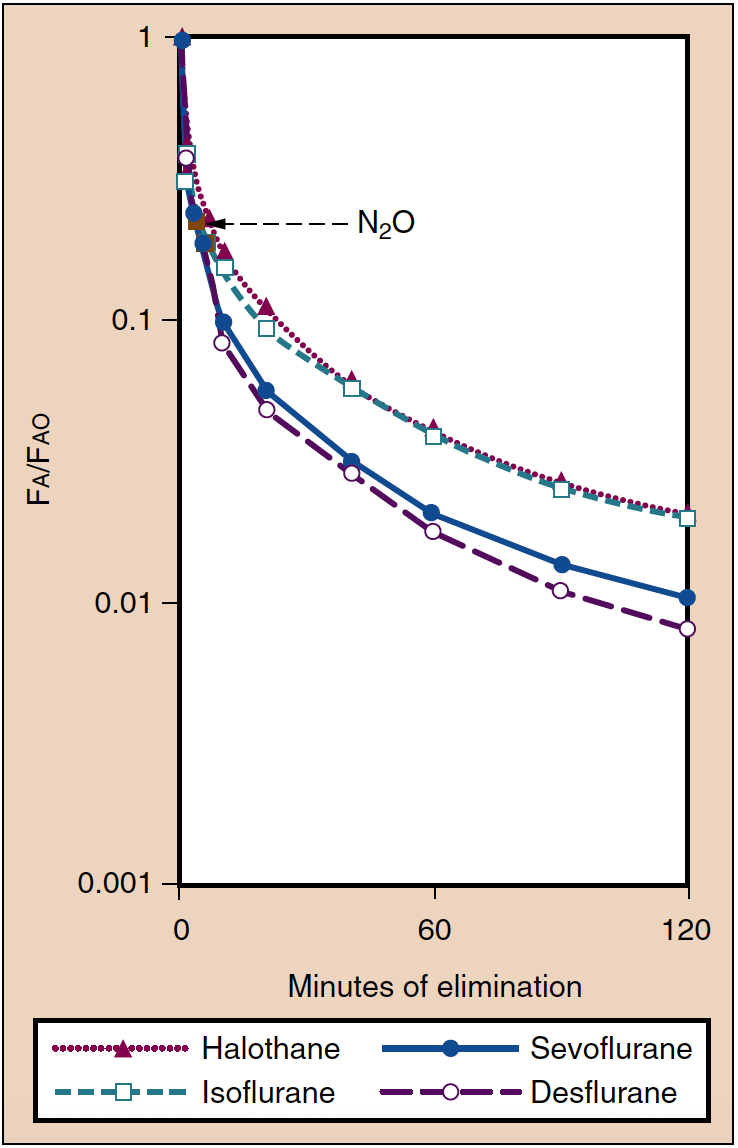
麻酔からの回復は、PA が時間とともに減少する速度として定義できます (図 6) (20)。 多くの点で、回復は麻酔導入の逆です。 たとえば、˙VA、溶解度、および CO は、PA が減少する速度を決定します。 麻酔薬の投与を中止した後、肺の換気によって麻酔薬の除去が行われます。 肺胞分圧が低下すると、麻酔薬が組織 (脳を含む) から肺胞に移されます。 低換気または麻酔薬の再呼吸を可能にするほど低いフレッシュガスフローの使用は、麻酔薬を組織 (脳を含む) に戻し、患者の回復を遅らせます。

- 図 6. 吸入麻酔薬の除去は、麻酔終了時の濃度 (Fao) と比較した肺胞濃度 (Fa) の減少によって反映されます。 麻酔からの覚醒は、これらの曲線と平行しています。 (Yasuda N, Lockhart SH, Eger EI II, et al. Comparison of kinetics of sevoflurane and isoflurane in human. Anesth Analg. 1991;72:316-324より許可を得て使用。)
回復は麻酔導入とどう違うのですか?
麻酔からの回復は、回復に対する濃度の影響がないこと (PI が XNUMX 未満になることはありません)、回復開始時の麻酔薬の可変組織濃度、および速度に対する代謝の潜在的な重要性に関して、麻酔の導入とは異なります。 PAの減少の。
組織濃度
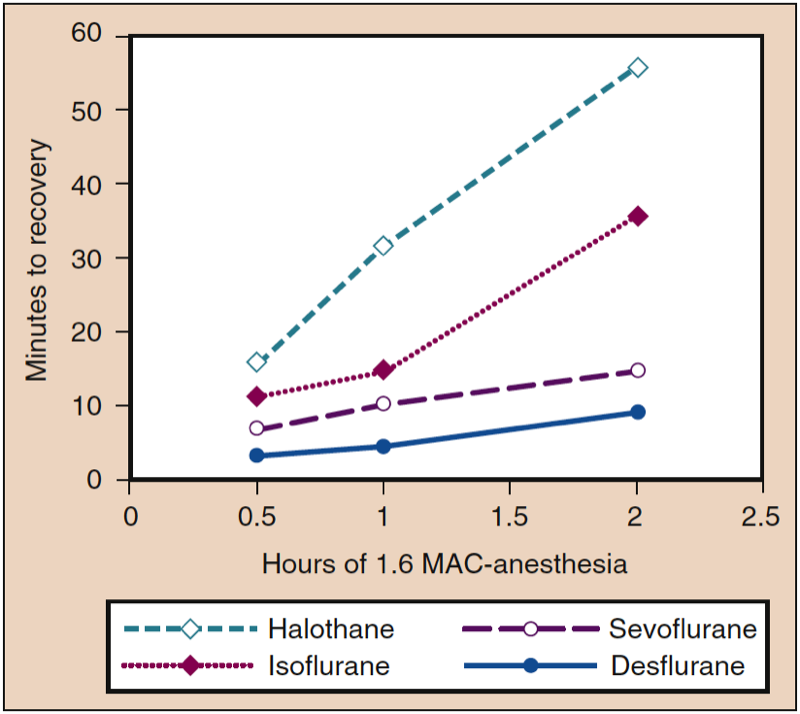
吸入麻酔薬の組織濃度は、麻酔終了時に PI をゼロまたはゼロ付近に減少させることによって分圧勾配が逆転したときに、PA を維持するためのリザーバーとして機能します。 組織保管の影響は、麻酔の持続時間とさまざまな組織コンパートメントでの麻酔薬の溶解度によって異なります。 例えば、溶解性麻酔薬(イソフルランなど)の場合、麻酔時間に比例して回復までの時間が長くなりますが、溶解性が低い麻酔薬(セボフルラン、デスフルランなど)では、回復時間に対する投与期間の影響は最小限です(図 7) (1)。 麻酔終了時の異なる組織における麻酔薬の可変濃度は、すべての組織が最初に同じゼロ濃度の麻酔薬を有する場合の麻酔導入とは対照的です。

- 図 7. 一定用量の麻酔薬 (1.6 MAC) 中の麻酔持続時間の増加は、回復までの時間 (すなわち、動物モデルにおける運動協調) の増加と関連しており、最大の増加は血液量が多い場合に発生します。・水溶性麻酔薬。 MAC、最小肺胞濃度。 (Eger EI II. Desflurane (Suprane): A Compendium and Reference. Nutley, NJ: Anaquest; 1993:1-11 より許可を得て使用。)
麻酔の導入と麻酔からの回復の重要な違いは、麻酔終了時の PA の減少率に対する代謝の潜在的な影響です。 この点で、代謝は、脂溶性の高いメトキシフルランの PA の減少率の主要な決定要因です。 代謝と˙VA は、ハロタンの PA の減少率において等しく重要ですが、脂溶性の低いイソフルラン、デスフルラン、およびセボフルランの PA の減少率は、主に˙VA に起因します (26)。
状況に応じたハーフタイム
吸入麻酔薬の除去の薬物動態は、投与の長さ (「状況」) と、吸入麻酔薬の血液および組織への溶解度に依存します。 静脈麻酔薬と同様に、コンピューター シミュレーションを使用して、揮発性麻酔薬の状況に応じた減少時間 (中枢神経系の麻酔薬濃度が目的の開始点から与えられたものの一部に減少するのに必要な時間) を決定することができます。 動的モデリングは、体内の各組織コンパートメント (血液、血管が豊富なグループ、筋肉、脂肪など) の存在、各コンパートメントの相対的なサイズ、各コンパートメントが受ける血流の比例、および各コンパートメントの溶解度に基づいています。コンパートメントを構成する組織の特定の麻酔薬。 麻酔薬の投与中、平衡とは、組織濃度が肺胞濃度とほぼ同じになるまで、麻酔薬の継続的な摂取を意味します。 肺胞と、血流の多い小さな (体重の 10% 未満) コンパートメント (すなわち、心臓、腎臓、脳) との間の麻酔薬濃度の平衡は、比較的短い時間 (10 ~ 15 分) 内に発生します。 逆に、麻酔薬の摂取が続くため、血流量の比例が小さい大きなコンパートメント (つまり、骨格筋とバルク脂肪) での麻酔薬の平衡化は、より長い時間 (時間) にわたって発生します。 イソフルラン、デスフルラン、およびセボフルランの麻酔薬濃度が 50% 低下するのに必要な時間は 5 分未満であり、麻酔時間が長くなっても大幅に増加することはありません (27)。 おそらく、これは消去の初期段階を反映したものであり、これは主に ˙VA の関数です。 他の減少時間 (≥80%) の決定は、特に麻酔持続時間が長くなるにつれて、さまざまな吸入麻酔薬間の大きな違いを明らかにします (図 8)。 シミュレーションは、組織間拡散によって除脂肪組織から脂肪組織に移行する麻酔薬を考慮していないため、特に溶解性の高い麻酔薬の場合、麻酔の吸収を過小評価する可能性があります。

- 図 8. ハロタン、イソフルラン、デスフルラン、およびセボフルランの増加濃度 (MAC) が健康なボランティアに投与された場合の平均動脈圧 (mm Hg) への影響。 MAC、最小肺胞濃度。 (Cahalan MK. Hemodynamic Effects of Inhaled Anesthetics. Review Courses. Cleveland: International Anesthesia Research Society; 1996:14-18 より許可を得て使用。)
少量の麻酔薬 (患者が指示に従うのに必要な量よりも少ない量) を除いて、すべての麻酔薬を除去してから、患者が効果的に飲み込んだり呼吸したりする能力などの調整された保護機能を回復する必要があります。 より長い麻酔とより溶解性の高い麻酔薬 (デスフルランと比較してセボフルラン) を与えられた外科患者は、目覚めてから効果的に飲み込む能力を取り戻すまでにより長い時間間隔を必要としました (22)。 低濃度のセボフルランとイソフルランを与えられた覚醒している被験者は、咽頭の協調障害 (28) と化学的換気ドライブの減少 (29) を示します。
拡散性低酸素症
患者が室内空気の吸入を許可されている場合、亜酸化窒素投与の終了時に拡散性低酸素症が発生する可能性があります。 このガスの吸入が中止されたとき、血液から肺胞への亜酸化窒素の最初の大量流出により、PAO2 が非常に希釈され、PaO2 が減少する可能性があります。 拡散性低酸素症の発生は、亜酸化窒素投与の終了時に患者の肺を酸素で満たすことによって防止されます。
ICUにおける鎮静のための吸入麻酔薬使用の実現可能性
AnaConDa (Anaesthetic Conserving Device、Sedana Medical AB、ウプサラ、スウェーデン) は、集中治療室 (ICU) での吸入麻酔薬 (イソフルラン、セボフルラン) の送達を容易にするツールです。 液体麻酔薬は、シリンジ ポンプを介して、気管内チューブと Y ピースの間の呼吸回路に取り付けられたチャンバーに供給されます。 注射器は非常に遅い速度で液体麻酔薬をチャンバー内の多孔質プラスチック棒に送り込みます。そこで液体は蒸発し、回路の吸気肢から流れる新鮮なガスと混合します。 吐き出されたガスは、吐き出された麻酔薬の約 90% を吸収して再生する活性炭フィルターを通過します。 後続の吸気フローはチャコール フィルターを通過し、そこで吸収された麻酔薬がフレッシュ ガスと再混合されます。
ICU の手術後の患者のために手術室の外で強力な吸入麻酔薬を使用することへの関心が高まっており、そうすることが実現可能であり、おそらく有利であるという証拠がますます蓄積されています (30,31)。 ただし、ICU 設定で吸入麻酔薬を使用する際の課題には、気管チューブと回路の間に麻酔薬送達デバイスが介在することによるデッド スペースと呼吸仕事量の増加が含まれます。 頻繁な気管チューブ吸引中の環境への麻酔薬の損失。 吸入麻酔薬の送達に関する十分な知識と技術的専門知識を備えた適切な機器と介護者の利用可能性に疑問があります。
9. 器官系への影響
循環器への影響
吸入麻酔薬の等濃度は、特に人間のボランティアの麻酔維持中に、同様の循環効果をもたらします。 ただし、手術を受ける患者は、健康なボランティアとは異なる反応を示す場合があります。 たとえば、併存疾患、極端な年齢、最適でない血管内容積の状態、外科的刺激の存在、併用薬などの要因は、健康なボランティアから得られたデータに基づいて期待される反応を変更、減衰、または誇張する可能性があります。
麻酔維持中の反応
平均動脈圧
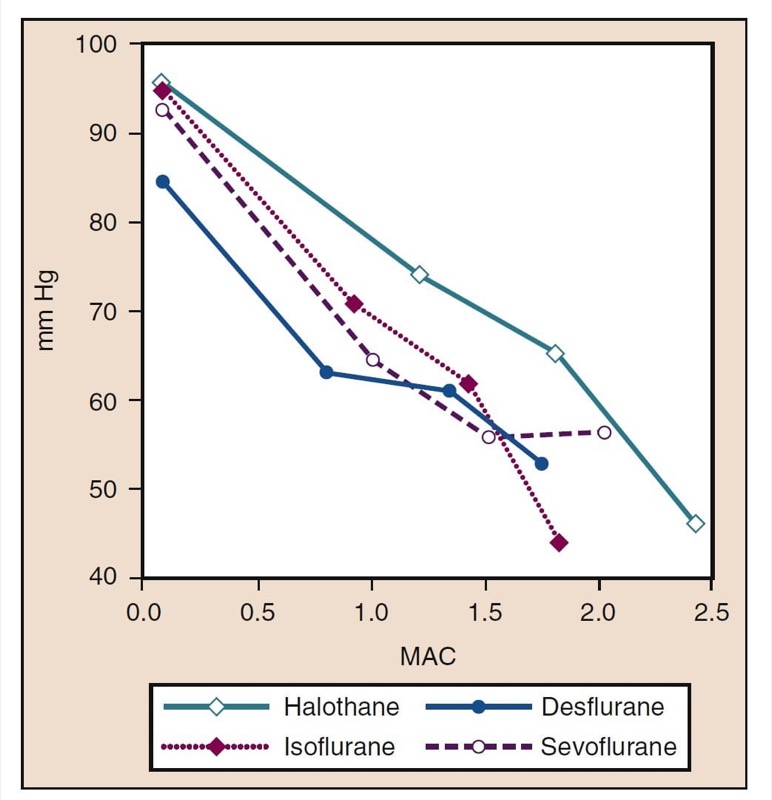
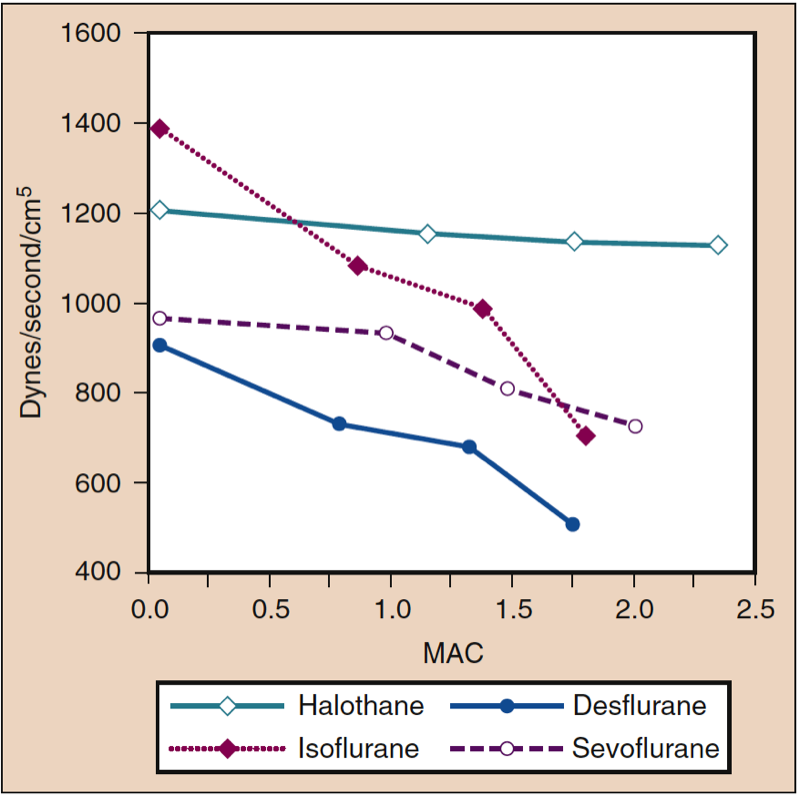
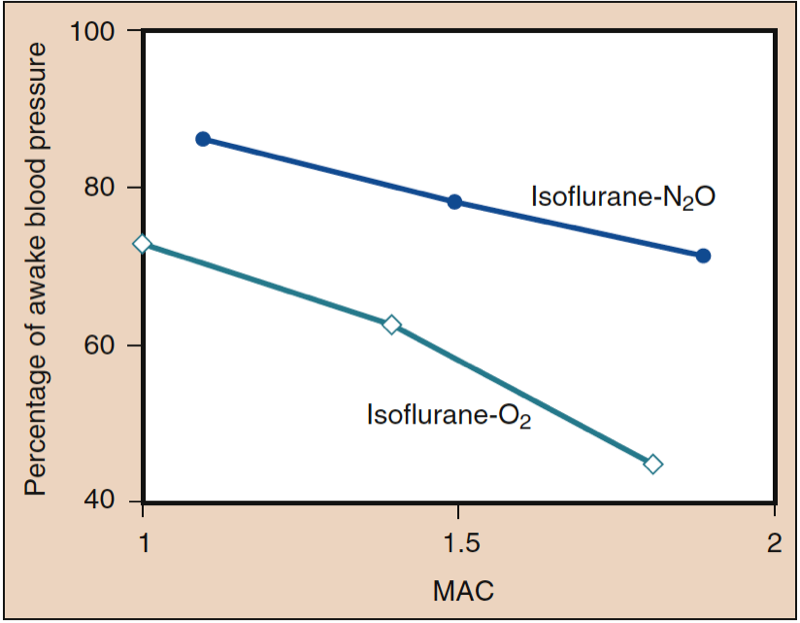
平均動脈圧 (MAP) は、デスフルラン、セボフルラン、イソフルラン、ハロタン、およびエンフルランの濃度の増加に伴い、用量依存的に低下します (図 8 を参照) (17,18)。 ハロタンを除いて、MAP の減少は、主に全身血管抵抗 (SVR) の減少と CO の減少を反映しています (図 9 および 10) (32,33、11)。 対照的に、ハロセンは CO を減少させることによって部分的または完全に MAP を減少させますが、SVR は比較的変化しません。 これらの調査結果は、心肺バイパス灌流を受けている間にデスフルラン、セボフルラン、およびイソフルランを投与された患者の SVR の測定値によって裏付けられています。 揮発性薬物の一部を亜酸化窒素で置換することにより、SVR の用量依存的な減少を最小限に抑えることができます (図 34) (XNUMX)。 亜酸化窒素は、他の吸入麻酔薬とは対照的に、MAP を変化させないか、わずかに増加させます。

- 図 8 ハロタン、イソフルラン、デスフルラン、およびセボフルランの増加濃度 (MAC) が、健康なボランティアに投与された場合の平均動脈圧 (mm Hg) に及ぼす影響。 MAC、最小肺胞濃度。 (Cahalan MK. Hemodynamic Effects of Inhaled Anesthetics. Review Courses. Cleveland: International Anesthesia Research Society; 1996:14-18 より許可を得て使用。)

- 図 9. ハロタン、イソフルラン、デスフルラン、およびセボフルランの増加濃度 (MAC) が、健康なボランティアに投与されたときの全身血管抵抗 (dynes/sec/cm5) に及ぼす影響。 MAC、最小肺胞濃度。 (Cahalan MK. Hemodynamic Effects of Inhaled Anesthetics. Review Courses. Cleveland: International Anesthesia Research Society; 1996:14-18 より許可を得て使用。)

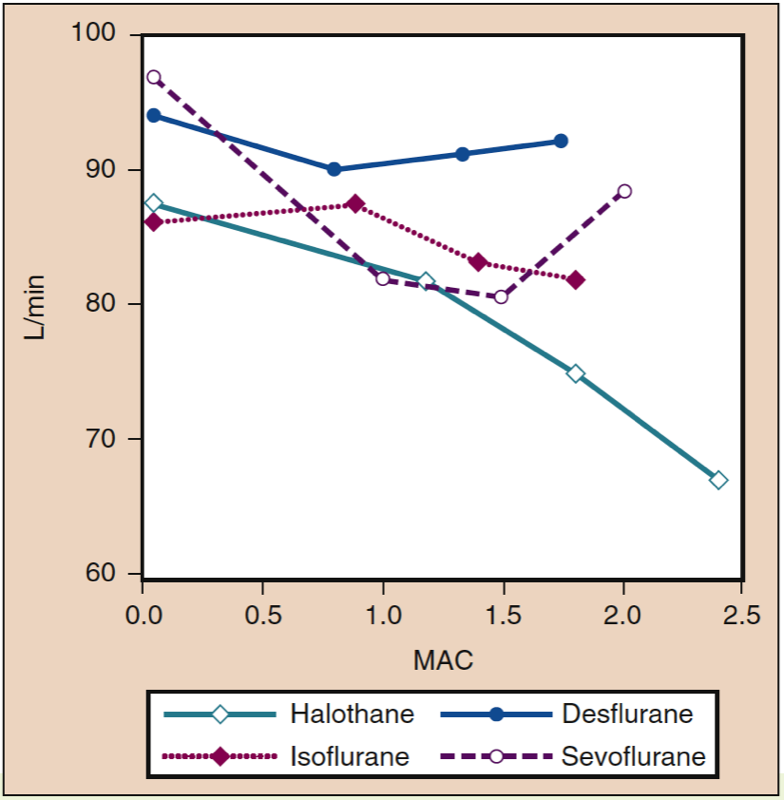
- 図 10. ハロタン、イソフルラン、デスフルラン、およびセボフルランの増加濃度 (MAC) が健康なボランティアに投与された場合の心係数 (L/min) への影響。 MAC、最小肺胞濃度。 (Cahalan MK. Hemodynamic Effects of Inhaled Anesthetics. Review Courses. Cleveland: International Anesthesia Research Society; 1996:14-18 より許可を得て使用。)

- 図 11. イソフルランの一部を亜酸化窒素に置き換えると、同じ用量の揮発性麻酔薬のみを使用した場合よりも全身血圧の低下が少なくなります。 MAC、最小肺胞濃度。 (Eger EI II. Isoflurane (Forane): A Compendium and Reference. Madison, WI: Ohio Medical Products; 1985:1-110 より許可を得て使用。)
心拍数
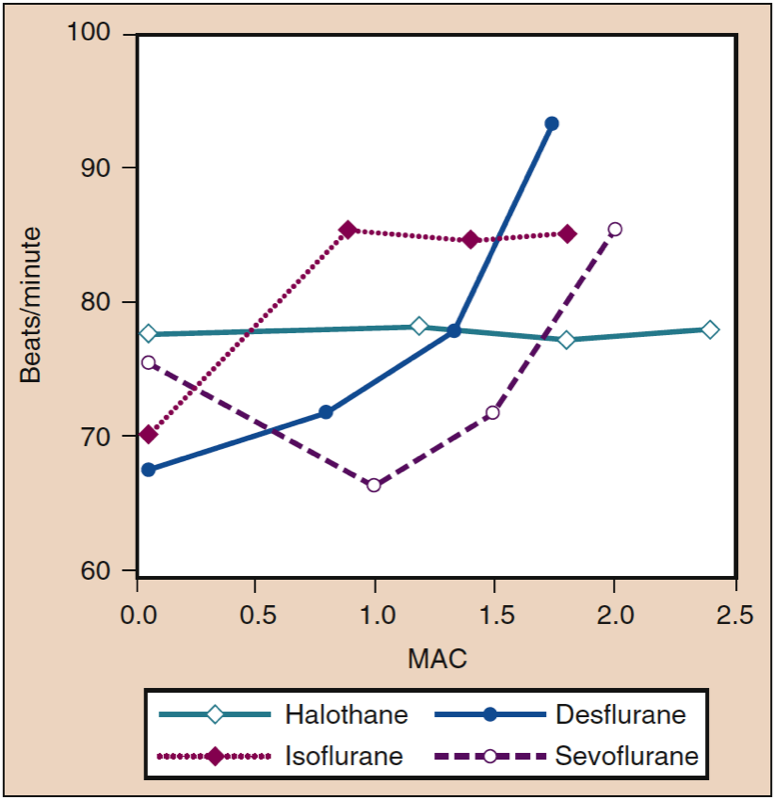
イソフルラン、デスフルラン、およびセボフルランの送達濃度を段階的に増加させると、濃度は異なりますが、患者とボランティアの心拍数が増加します (図 12) (33)。 0.25 MAC という低濃度でも、イソフルランは用量依存的に直線的に心拍数を増加させます。 デスフルラン濃度が 1 MAC 未満の場合、心拍数の増加は最小限です。 デスフルラン濃度が 1 MAC を超えると、心拍数は線量に応じて直線的に加速します。 デスフルランやイソフルランとは対照的に、セボフルランの存在下での心拍数は、濃度が 1.5 MAC を超えるまで増加しません (35)。 しかし、8% セボフルランによる誘導 (すなわち、36 回の呼吸による誘導) は、制御された過換気を受けている小児および成人患者の両方で頻脈を引き起こします。 この頻脈は、てんかん様の脳活動に関連する交感神経系の刺激に起因する可能性があります (XNUMX)。

- 図 12. ハロタン、イソフルラン、デスフルラン、およびセボフルランの増加濃度 (MAC) が健康なボランティアに投与された場合の心拍数 (拍/分) への影響。 MAC、最小肺胞濃度。 (Cahalan MK. Hemodynamic Effects of Inhaled Anesthetics. Review Courses. Cleveland: International Anesthesia Research Society; 1996:14-18 より許可を得て使用。)
デスフルランが循環を刺激する傾向 (すなわち、MAP と心拍数を増加させる) は、β-アドレナリン遮断薬 (エスモロール)、オピオイド (フェンタニル) の投与、および麻酔維持中の時間の経過 (10 ~ 15 分) によって弱まります ( 「急速な濃度上昇に伴う循環への影響」も参照してください)。 1 MAC を超えるデスフルラン濃度で見られる用量に関連した心拍数の増加は、亜酸化窒素によるデスフルランの一部の置換によって減衰されません。 イソフルラン、セボフルラン、およびデスフルランは、ハロタンと同様に、圧受容器の反応を濃度依存的に減少させます。 デスフルランで見られる 1 MAC を超える心拍数の一時的な増加は、MAP の減少に対する反射圧受容体活性反応ではなく、交感神経系の刺激に起因します (37)。
心臓指数
心係数は、健康な若年成人において広範囲の濃度で、デスフルラン、セボフルラン、またはイソフルランの投与による影響を最小限に抑えます (図 10 を参照) (32)。 経食道心エコー検査データは、デスフルランが覚醒時の測定値と比較して、駆出率と円周短縮の左心室速度のわずかな増加をもたらすことを示しています。
急激な濃度上昇による循環への影響
1 MAC 未満の濃度では、デスフルランは心拍数または MAP を増加させません。 しかし、吸気デスフルラン濃度が 1 MAC を超えて急激に上昇すると、オピオイド、アドレナリン遮断薬、またはその他の鎮痛補助剤が存在しない場合、一時的な循環刺激が引き起こされます (図 13) (38)。 程度は低いですが、イソフルランには心拍数と血圧の上昇を誘発する同様の能力があります。 デスフルランとイソフルランの急激な濃度上昇に伴う血行動態刺激に伴い、血漿エピネフリンとノルエピネフリン濃度の上昇、および交感神経系の活動が起こります。 吸気セボフルラン濃度が 1 MAC から 1.5 MAC に急激に増加すると、心拍数がわずかに減少します。

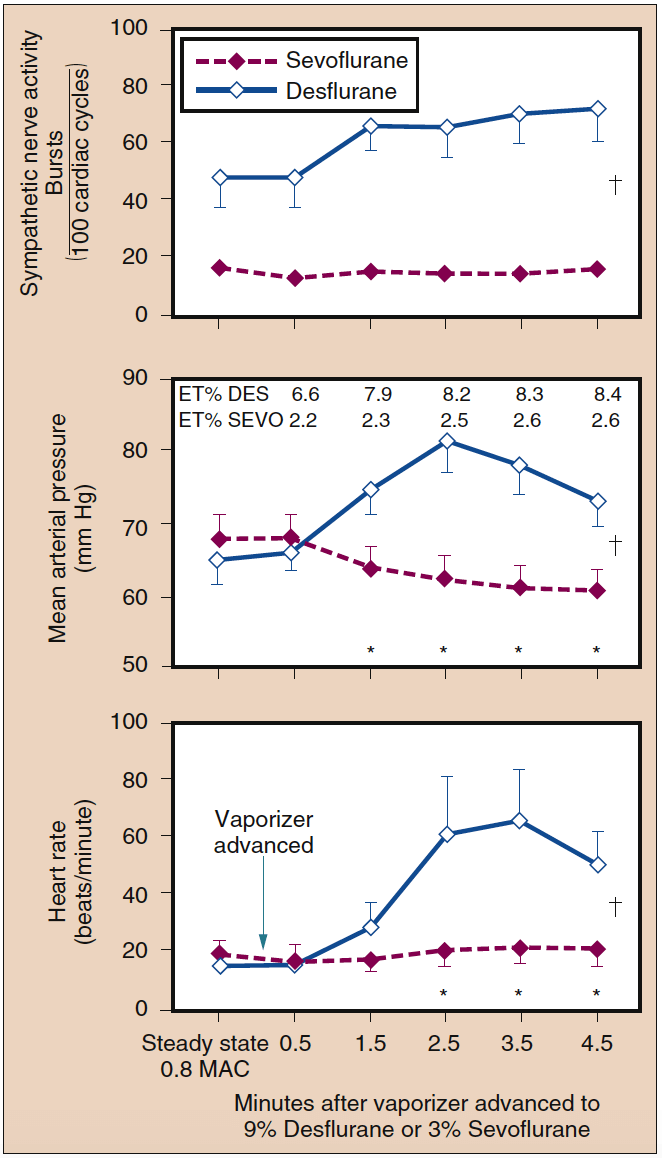
- 図 13. セボフルランの吸気濃度を 0.8 MAC から 3% に急激に増加させても、交感神経活動、平均動脈圧、または心拍数は変化しませんでした。 逆に、デスフルランの吸気濃度が 0.8 MAC から 9% に急激に増加すると、交感神経活動、平均動脈圧、および心拍数が大幅に増加しました (平均 ± SE; *p < 0.05)。 ET、呼気終末。 MAC、最小肺胞濃度。 (Ebert TJ、Muzi M、Lopatka CW. Neurocirculatory response to sevoflurane in human: a comparison to desflurane. Anesthesiology. 1995;83:88-95 より許可を得て使用。)
呼気終末デスフルラン濃度が 4 分以内に 8% から 1% に段階的に増加すると、心拍数と血圧がベースラインより 4 倍になる可能性があります。 少量のオピオイド、クロニジン、またはエスモロールを投与すると、デスフルラン濃度の段階的な増加に対する心拍数と血圧の反応が大幅に減衰します。 呼気終末デスフルラン濃度が 8 分後に 30% から 2% に急激に増加することを繰り返すと、心拍数と MAP の変化が最小限になり、これらの循環変化を媒介する受容体が刺激の繰り返しに適応することが示唆されます。 セボフルラン、ハロタン、またはエンフルランの濃度が 13 MAC まで急激に上昇しても、循環刺激は見られません (図 38 を参照) (XNUMX)。
セボフルランとハロタンは、刺激がないため、麻酔を誘発するために吸入によって頻繁に投与されます。 セボフルランではなくハロタンを使用した子供の麻酔導入は、心筋収縮性を低下させます。 成人では、1 MAC のセボフルランまたは 67% 亜酸化窒素を含むハロタンで麻酔を維持すると、心筋の収縮性が低下します。 成人では、制御された換気が使用されている場合、セボフルランは心拍数を一時的に増加させる可能性があります。
亜酸化窒素および酸素と 100% 酸素による投与
デスフルラン、イソフルラン、およびセボフルランを亜酸化窒素および酸素とともに投与すると、用量依存的に MAP、SVR、心係数、および左心室 11 回拍出仕事量指数 (LVSWI) が減少しますが、心拍数、肺動脈圧、および中心静脈圧はこれは、各揮発性麻酔薬が酸素のみで投与されたという所見と一致しています (図 32,33 を参照) (34)。 直接比較すると、MAP、SVR、心係数、および LVSWI がより顕著に減少し、ほぼ同等の MAC 倍数で亜酸化窒素ではなく酸素でデスフルランを投与すると、心拍数がより速くなり、CO がより大きくなることが明らかになった (XNUMX)。
心筋伝導と不整脈原性
イソフルラン、セボフルラン、およびデスフルランは、心臓を期外収縮期外収縮にさせません (39)。 対照的に、ハロセンは、特にカテコールアミンの存在下で、心筋を時期尚早の心室性期外収縮に対して敏感にします。 この関係は、高炭酸症で誇張されます。 吸入麻酔薬は、有効な不応期を延長することにより、心筋虚血中の心室性不整脈をおそらく抑制します。
吸入麻酔薬の選択は、迷走神経刺激に起因する反射性徐脈律動の発生に影響を与えます。 セボフルランで麻酔された子供は、ハロセンと比較して、眼筋の外科的牽引に反応して心拍数が低下したり、洞結節が停止したりするエピソードが少なくなります。
QT間隔
吸入麻酔薬は、心電図の QT 間隔を延長します (40)。 QT間隔を延長する各麻酔薬の相対的な傾向は系統的に比較されていませんが、既知の先天性QT延長症候群(LQTS)の患者ではセボフルランを避けるべきです。 セボフルランとプロポフォール麻酔薬は子供の QT 間隔延長を引き起こしますが、どちらの麻酔薬も、活動電位のフェーズ 2 と 3 の間の心筋細胞の不均一な再分極率の尺度である再分極の経壁分散を増加させません (41)。 感受性のある患者におけるセボフルランやその他の吸入麻酔薬による QT 延長の臨床的意義は不明です。 LQTS 患者では、β-アドレナリン遮断が治療の主力です。 LQTS が既知の患者は、β-アドレナリン遮断薬を同時に投与されている場合、すべての最新の吸入麻酔薬で安全に麻酔されています。 ハロタンによる麻酔を受けている患者に悪性の術中不整脈が多数発生しており、その後、未診断の LQTS が原因であるとされ、β 遮断薬を投与された患者はいなかった (40)。
冠動脈疾患の患者
冠動脈バイパス手術を受けている患者、または冠動脈疾患のリスクがある患者を対象とした多数の研究では、吸入麻酔 (デスフルラン) と静脈内投与 (フェンタニルまたはスフェンタニル) 麻酔技術を受けたグループ間、またはいずれかの麻酔技術を受けたグループ間の転帰の違いを示すことができませんでした。吸入麻酔薬と他の麻酔薬との比較 (すなわち、デスフルランとイソフルラン、またはセボフルランとイソフルラン) (42)。 小径の冠動脈を拡張するイソフルランの能力が、冠状動脈の血管拡張の結果として敏感な解剖学的構造を持つ患者が局所心筋虚血を発症する可能性がある冠動脈盗を引き起こす可能性があるという懸念は有効ではありませんでした. 代わりに、揮発性麻酔薬は心臓に保護効果を発揮し、心筋損傷の領域を制限し、虚血性傷害にさらされた後の機能を維持します。
麻酔プレコンディショニング
心筋虚血に対する揮発性麻酔薬の保護効果の説明は、麻酔薬のプレコンディショニングと呼ばれ、心筋の酸素需給比の好ましい変化によっては説明されません。 証拠は、揮発性麻酔薬が局所灌流が損なわれた状況で心筋に保護効果を及ぼすことを示唆しています。 冠動脈バイパス移植 (CABG) 手術を受けた患者では、0.2~1 MAC のデスフルランまたはセボフルランによる維持により、プロポフォールを投与された患者と比較して異常に増加したトロポニン レベルの発生率が減少しました (43)。 CABG 手術の全期間にわたってセボフルランを投与した場合と、バイパス前またはバイパス後に投与した場合では、バイパス前またはバイパス後の期間のみにセボフルランを投与した場合と比較して、術後の心筋梗塞の頻度が低くなり、バイパス前またはバイパス後の投与では、心筋梗塞のリスクが小さくなりました。プロポフォール麻酔で(44)。
虚血プレコンディショニングのメカニズム
虚血プレコンディショニングは、すべての種のすべての組織に存在する基本的な保護メカニズムです。 化学的プレコンディショニングでは、虚血の単一または複数の短いエピソードへの曝露は、その後の長期の虚血性傷害を伴う可逆的または不可逆的な損傷に対する心筋の保護効果を与えることができます。 心筋が保護されている間、短い虚血エピソードの後に 1 つの異なる期間があります。 最初の期間は、コンディショニング エピソードの 2 ~ 24 時間後に発生し、その後消失します。 3 番目の期間では、利益は 45 時間後に再表示され、XNUMX 日間続くことがあります。 ミトコンドリアのアデノシン三リン酸 (ATP) 感受性カリウム チャネル (KATP) の開口部は、G タンパク質共役受容体へのさまざまなリガンドの結合に起因する保護活性を付与する重要なイベントです。 揮発性麻酔薬は、虚血性プレコンディショニングを強化するか、直接心筋保護を提供し、KATP チャネルはその保護効果において中心的な役割を果たします (XNUMX)。
換気効果
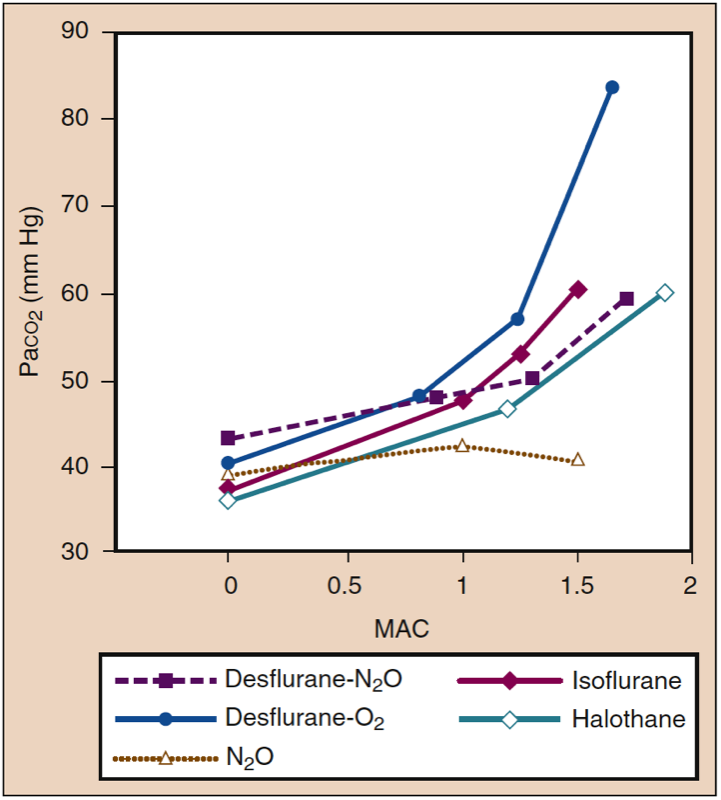
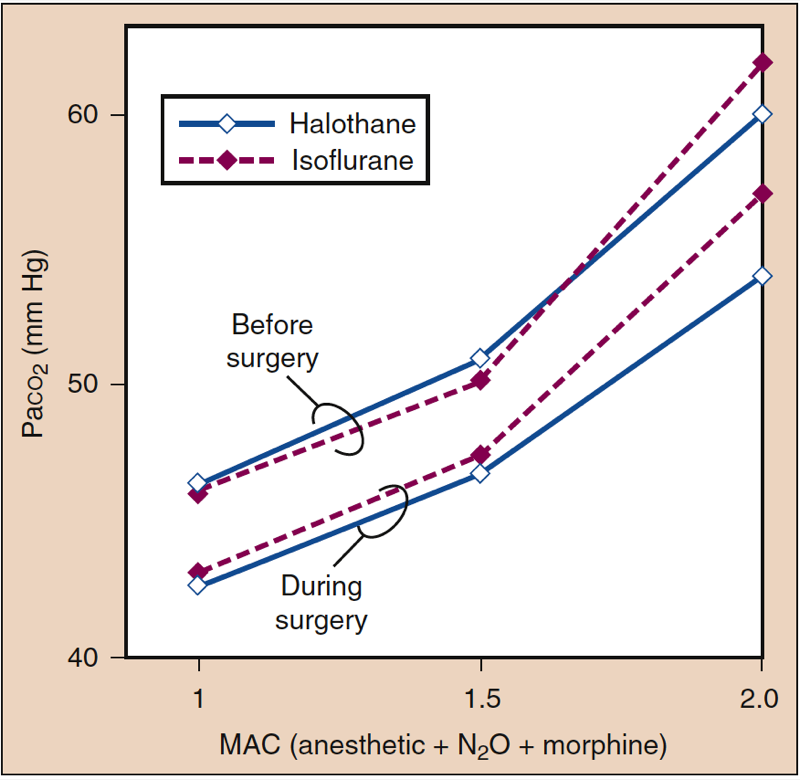
吸入麻酔薬は、麻酔薬の濃度が高くなるにつれて、呼吸の頻度を増やし、一回換気量を減らします。 分時換気量は比較的保たれますが、一回換気量の減少により、肺胞換気に比べて死腔換気の割合が相対的に高くなります。 ガス交換は麻酔レベルが深くなるほど効率が低下し、PaCO2 は麻酔薬の濃度に比例して増加します (図 14) (1)。 効果は、特定の MAC 倍数での強力な麻酔薬間で類似しています。 同等量の揮発性麻酔薬を亜酸化窒素 (60%) に置き換えると、より深い麻酔レベルでの PaCO2 の増加が軽減される可能性があります。

- 図 14. 吸入麻酔薬は、薬物特異的かつ用量依存的に Paco2 を増加させます。 MAC、最小肺胞濃度。 (Eger EI II. Desflurane (Suprane): A Compendium and Reference. Nutley, NJ: Anaquest; 1993:1-119 より許可を得て使用。)
デスフルラン (およびその他の揮発性麻酔薬) を吸入しているボランティアと患者は、二酸化炭素の反応性が用量依存的に鈍くなり、酸素中の 1.7 MAC のデスフルランを受けた被験者に無呼吸を引き起こします (図 15) (1)。 ボランティアと比較して、吸入麻酔薬による換気の鈍化は、呼吸に対する手術の刺激効果を反映して、手術を受ける患者ではそれほど顕著ではない可能性があります (図 16) (1)。 揮発性麻酔薬はすべて、動脈の低酸素血症によって引き起こされる換気刺激を鈍くします(46)。

- 図 15. すべての吸入麻酔薬は、二酸化炭素に対する換気応答を用量依存的に同様に減少させます。 MAC、最小肺胞濃度。 (Eger EI II. Desflurane (Suprane): A Compendium and Reference. Nutley, NJ: Ana quest; 1993:1-119 より許可を得て使用。)

- 図 16. イソフルランまたはハロタン投与中の安静時の Paco2 (mm Hg) に対する外科的刺激の影響。 MAC、最小肺胞濃度。 (Eger EI II. Desflurane (Suprane): A Compendium and Reference. Nutley, NJ: Anaquest; 1993:1-119 より許可を得て使用。)
胸壁の変化
吸入麻酔薬は、換気力学に影響を与える可能性がある胸壁の構造変化に寄与します。 横隔膜の頭側変位および胸郭の内側変位は、呼気筋活動の強化から生じ、最終的な結果は機能的残気量の減少に寄与します。 無気肺は、肺の従属領域で優先的に発生し、自発換気が許可されている場合により多く発生します。
低酸素性肺血管収縮
吸入麻酔薬は肺血流を変化させますが、低酸素肺血管収縮の阻害は最小限です。 例えば、動脈酸素化は、イソフルラン対デスフルラン麻酔およびセボフルラン対プロポフォール麻酔で片肺換気を受けている患者で類似している(47)。
気道抵抗
気管支収縮がない場合、吸入麻酔薬の気管支拡張効果は小さい。 ボランティアでは、イソフルラン、ハロタン、およびセボフルランが気管挿管後の呼吸全身抵抗を減少させますが、亜酸化窒素とチオペンタールは減少しません。 非喫煙者では、セボフルランによるわずかな減少と比較して、気管挿管およびデスフルラン麻酔後の気道抵抗は変化を示さないが、喫煙者は気管挿管およびデスフルラン麻酔後の気道抵抗の軽度で一時的な増加を示す(48)。 気道抵抗の変化の一部またはすべては、ガス密度の変化によって媒介される可能性があります。
気道刺激作用
吸入麻酔薬は、気道を刺激する能力 (つまり、刺激性) が異なります。 セボフルラン、ハロタン、および亜酸化窒素は刺激性がなく、幅広い濃度範囲で刺激を最小限に抑えるか、まったく引き起こしません。 デスフルランとイソフルランは刺激性があり、1 MAC を超える濃度で気道を刺激する可能性があります。特に、刺激性の知覚を低下させる静脈内投与薬 (オピオイド、鎮静催眠薬など) がない場合はそうです。
セボフルランまたはハロセンは、麻酔の吸入導入が必要な場合に最も頻繁に選択されます。 しかし、デスフルランおよびイソフルランは、セボフルランまたはプロポフォールと比較して、気道刺激(例、咳、息止め、喉頭痙攣、動脈酸素飽和度低下)の発生率が高くないラリンジアルマスク気道によって手術患者に投与することができる。 1 MAC を超える濃度 (すなわち、非刺激性濃度) を必要としない (49)。
中枢神経系への影響
脳血流
揮発性麻酔薬なしで投与された亜酸化窒素は、脳血管拡張を引き起こし、脳血流を増加させます。 脳の酸素代謝率 (CMRO2) はわずかに増加します。 オピオイド、バルビツレート、またはプロポフォール (ただしケタミンは除く) の同時投与は、これらの効果を相殺します (50)。 吸入麻酔薬は、PaCO2 の変化に対する脳血管の反応をなくすことはありません (51)。
ハロタン、イソフルラン、セボフルラン、デスフルランは CMRO2 を減少させます。 正常炭酸ガスのヒトでは、これらの揮発性麻酔薬は 0.6 MAC を超える濃度で脳血管拡張を引き起こします。 脳血流に対する二相性の用量依存効果があります。 0.5 MAC では、CMRO2 の減少により血管拡張が抑制され、脳血流が大幅に変化しなくなります。 1 MAC を超える濃度では、特に全身血圧が覚醒レベルに維持されている場合、血管拡張効果が優勢になり、脳血流が増加します。 脳血流の増加は、イソフルラン、セボフルラン、またはデスフルランと比較して、ハロタンの方が相対的に大きい。
頭蓋内圧
1 MAC を超える用量ではすべての揮発性麻酔薬で頭蓋内圧が上昇し、1 MAC 未満の濃度では自己調節 (すなわち、覚醒している患者の全身動脈圧の広い範囲にわたって脳血流を正常化する適応メカニズム) が損なわれます。 イソフルランまたはデスフルランの 1 MAC を投与されたテント上腫瘍の開頭術を受けている患者は、脳灌流圧の低下と酸素に対する動静脈酸素差を示しますが、頭蓋内圧の変化はありません (52)。 しかし、デスフルラン、イソフルラン、またはセボフルランの 1 MAC を投与された下垂体腫瘍切除を受けている患者は、頭蓋内圧のわずかな上昇と脳血流の減少を示します。 50% の亜酸化窒素と 0.5 MAC のデスフルランまたはイソフルランを投与された脳神経外科患者は、亜酸化窒素を含まない 1 MAC のデスフルランまたはイソフルランを投与された患者よりも明らかに脳が弛緩します。 吸入麻酔薬は、PaCO2 の変化に対する脳血管の反応をなくすことはありません (51)。
誘発電位
すべての揮発性麻酔薬と亜酸化窒素は、用量依存的に振幅を抑制し、体性感覚誘発電位の潜時を増加させます。 誘発電位は、揮発性麻酔薬単独で 1 MAC で、または 0.5% 亜酸化窒素で投与された 50 MAC 以上で消失する可能性があります。 低濃度の揮発性麻酔薬 (0.2 ~ 0.3 MAC) は、運動誘発電位モニタリングの信頼性を低下させる可能性がありますが、影響はマルチパルス刺激の使用によって部分的に克服できます (53)。
脳波効果
揮発性麻酔薬は、脳波に特徴的な用量依存性の変化を引き起こします。 覚醒状態からの麻酔深度の増加は、振幅と同期性の増加によって特徴付けられます。 電気的無音の期間は、深さが増すにつれて時間の大部分を占め始めます (つまり、バースト抑制)。 この等電パターンは、1.5 ~ 2.0 MAC の範囲内の EEG で優勢です。
セボフルランとエンフルランは、特に高濃度で、または制御された過換気が開始された場合に、EEG でのてんかん様活動と関連している可能性があります。 セボフルラン誘導中の子供で発作様活動が報告されていますが、これらの観察の臨床的意味は明らかではありません (54)。
神経筋効果
揮発性麻酔薬は、用量に応じた骨格筋の弛緩を引き起こし、神経筋遮断薬の活性を高めます。 ロクロニウムの弛緩効果の増強は、セボフルランまたはイソフルランよりもデスフルランによる麻酔でより強力ですが、すべての揮発性麻酔薬は静脈内麻酔薬(例、プロポフォール + フェンタニル)と比較して骨格筋の弛緩を増強します。 揮発性麻酔薬の排除により、神経筋ブロックからの回復が促進されます。 0.25 MAC へのデスフルラン濃度の減少は、イソフルラン濃度の等効力の減少よりもベクロニウム投与後の神経筋ブロックの逆転を促進します。
悪性高熱症
悪性高熱症 (MH) は、生命を脅かす麻酔の合併症であり続けています。 これは、揮発性麻酔薬、特にハロセンおよび/またはスクシニルコリンの投与によって引き起こされる、骨格筋代謝の増加という遺伝性疾患です。 すべての強力な吸入揮発性麻酔薬も MH を誘発する可能性がありますが、デスフルラン、セボフルラン、およびおそらくイソフルランを使用した研究では、ハロタンよりもリスクが低いことが示唆されています。 男性は、女性よりも臨床的 MH エピソードを発症しやすいようです (55,56)。 小児集団は、すべての MH 反応の 52.1% を占めています (57,58)。 MH の徴候は代謝の増加に関連しており、頻脈、呼気終末二酸化炭素レベルの増加、筋肉のこわばり、体温の上昇などがあります。
最近の MH の症例は、診断意識の向上、終末呼気二酸化炭素による早期発見、強力な麻酔薬の使用の減少、および MH の劇症エピソードを軽減する薬物の投与により、それほど重症ではありません。
管理の重要な側面には、揮発性麻酔薬とサクシニルコリンの中止、静脈内ダントロレンの即時投与、高カリウム血症などの生命を脅かす可能性のある電解質異常の治療が含まれます。 米国悪性高熱症協会 (MHAUS) は、その Web サイトで詳細な治療に関する推奨事項を提供しています。 MHAUS はまた、緊急時のアドバイスのために 24 時間対応のホットラインを維持しています (米国では 1-800-644-9737、米国外では 001-209-417-3722)。
肝臓への影響
麻酔後の肝障害は、重度(免疫介在性)または軽度に分類されます(59)。
免疫介在性肝障害
ハロタン、イソフルラン、セボフルラン、またはデスフルランによる麻酔の後、重度の肝障害が生じることがあります。 この重篤な形態は、死に至るか、または肝移植を必要とする可能性のある大規模な肝壊死を伴います。 この重度の損傷のメカニズムは免疫学的であり、揮発性麻酔薬への事前の曝露が必要です。 ハロタン、イソフルラン、およびデスフルランはすべて、シトクロム P-450 酵素による酸化的代謝を受けて、トリフルオロ酢酸塩を生成します。 トリフルオロ酢酸塩は、肝細胞タンパク質に共有結合することができます。 トリフルオロアセチル肝細胞部分はハプテンとして作用することができ、体はそれを異物として認識し、免疫系がそれに対して抗体を形成します。 その後、トリフルオロ酢酸を生成する可能性のある麻酔薬にさらされると、免疫反応が引き起こされ、重度の肝壊死に至る可能性があります(60)。 セボフルランはヘキサフルオロイソプロパノールに代謝され、この化合物はトリフルオロ酢酸と同等の抗原性挙動を持たない (61)。
軽度の肝障害
ハロタンの投与後、臨床的に軽度の肝障害が起こることがあります。 このより一般的なエンティティの主な特徴は、血清トランスアミナーゼ レベルの適度な上昇です。 この軽度の肝臓障害は、ハロタンの還元的代謝によって媒介されると考えられており、肝臓血流の同時減少とそれに伴う肝臓への酸素供給の減少の後に発生する可能性が高くなります.
麻酔関連の肝機能障害の既往歴
揮発性麻酔薬は、以前に吸入麻酔後に原因不明の肝機能障害の症状を経験した患者には投与されないことが多いが、揮発性麻酔薬は、麻酔とは無関係の既存の肝疾患を有する患者にはおそらく有害ではない.
腎臓への影響
メトキシフルランは、臨床現場に導入された最初の不燃性揮発性麻酔薬でした。 その使用は腎障害に関連していました。 その後の調査は、特にO-脱メチル化による無機フッ化物とジクロロ酢酸への広範な代謝がおそらく損傷の原因であることを示唆しています. しかし、他の強力な吸入麻酔薬、特にセボフルランの代謝によるフッ化物生成は、腎障害との関連を示していません(62)。
10. 今日の質問
- 特別に設計された気化器による投与が必要なデスフルランの物理的特性は何ですか? デスフルラン気化器の出力は高地によってどのように影響を受けますか?
- 「二酸化炭素当量」と大気寿命の点で、環境に最大の影響を与える吸入麻酔薬はどれですか?
- 記憶喪失を引き起こすのに必要な吸入麻酔薬の投与量は、外科的切開による動きを防ぐのに必要な投与量とどのように比較されますか? 外科的切開の MAC の標準偏差は? 吸入麻酔薬の必要量を増加または減少させる薬は何ですか?
- 吸入麻酔薬を投与する場合、麻酔薬の肺胞分圧を決定する XNUMX つの要因は何ですか?
- 吸入麻酔薬からの回復中、麻酔分圧の低下に最も影響を与える要因は何ですか?
- イソフルランやセボフルランと比較して、デスフルランの濃度が急速に上昇した場合の循環への影響は何ですか? これらの影響を最小限に抑えるにはどうすればよいでしょうか?