オピオイドは、麻酔学、クリティカルケア、および疼痛管理の実践において不可欠な役割を果たします。 これらの重要な薬物を安全かつ効果的に使用するには、基礎科学と臨床的側面の両方を含むオピオイドの薬理学を正しく理解することが重要です。 この章では、周術期に使用される静脈内オピオイド受容体アゴニストにほぼ独占的に焦点を当てます。
1. 基本的な薬理学
構造活性
麻酔学における臨床的関心のオピオイドは、多くの構造的特徴を共有しています。 モルヒネはベンジルイソキノリンアルカロイドです(図1)。 多くの一般的に使用される半合成オピオイドは、モルヒネ分子の単純な修飾によって作成されます。 たとえば、コデインはモルヒネの 3-メチル誘導体です。 同様に、ヒドロモルホン、ヒドロコドン、およびオキシコドンも、モルヒネの比較的単純な修飾によって合成されます。 モルヒネ分子骨格のより複雑な変化は、ナルブフィンなどのアゴニストとアンタゴニストの混合物、さらにはナロキソンなどの完全なアンタゴニストをもたらします。
オピオイドのフェンタニル系は、メペリジンと化学的に関連しています。 メペリジンは、最初の完全合成オピオイドであり、プロトタイプの臨床フェニルピペリジンと見なすことができます (図 1 を参照)。 フェンタニルは、基本的なフェニルピペリジン構造の単純な修飾です。 アルフェンタニルやスフェンタニルなどの他の一般的に使用されるフェンタニル同族体は、同じフェニルピペリジン骨格のやや複雑なバージョンです。
オピオイドは多くの物理化学的特徴を共有していますが、いくつかの個々の薬物には独自の特徴があります。 一般に、オピオイドは溶解度の高い弱塩基であり、タンパク質と強く結合し、生理的 pH で大部分がイオン化されます。 オピオイドの物理化学的特性は、その臨床行動に影響を与えます。 例えば、アルフェンタニルやレミフェンタニルなどの比較的非結合の非イオン化分子は、ボーラス注射後に効果がピークに達するまでの待ち時間が短くなります。
メカニズム
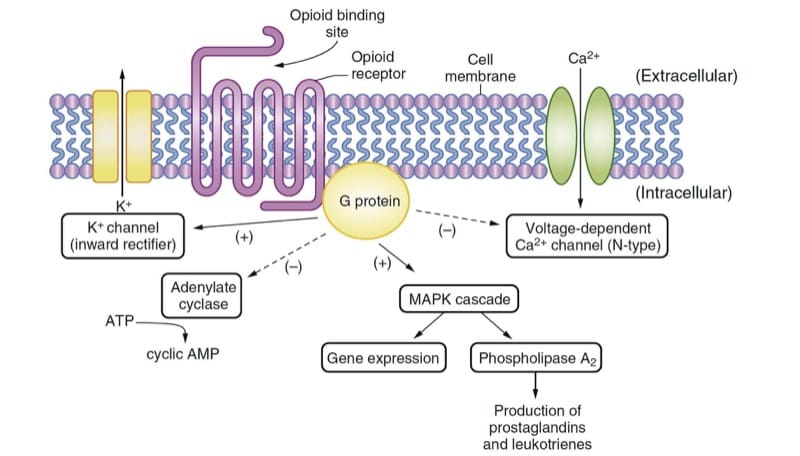
オピオイドは、オピオイド受容体と相互作用することによって主な薬理学的効果を生み出します。オピオイド受容体は、生物学で広く見られる受容体の G タンパク質共役ファミリーに典型的です (例えば、β-アドレナリン作動性、ドーパミン作動性など)。 培養細胞におけるクローン化されたオピオイド受容体の発現は、オピオイド受容体によって活性化される細胞内シグナル伝達メカニズムの分析を容易にしました。 1); これらの効果は、最終的に細胞の過分極とニューロンの興奮性の低下に至ります。
分子生物学の手法を使用して、μ、κ、およびδの 1 つの古典的なオピオイド受容体が特定されています。 最近では、1 番目のオピオイド受容体である ORL2 (NOP としても知られる) も特定されていますが、その機能は古典的なオピオイド受容体の機能とはまったく異なります。 これらのオピオイド受容体のそれぞれは、一般的に採用されている実験的バイオアッセイ、関連する内因性リガンド、アゴニストとアンタゴニストのセット、および受容体が作動したときのさまざまな生理学的効果を持っています。 オピオイド受容体サブタイプ (例えば、μ2 μXNUMX) の存在が提案されていますが、分子生物学の手法からは、それらに異なる遺伝子が存在することは明らかではありません。 オピオイド受容体の翻訳後修飾は確かに発生し、オピオイド受容体サブタイプに関する矛盾するデータの原因となる可能性があります.(XNUMX)
オピオイドは複数の部位で治療効果を発揮します。 それらは、脊髄後角の一次感覚ニューロンからのサブスタンス P の放出を阻害し、脳への痛みの伝達を軽減します。 脳幹におけるオピオイド作用は、下行抑制経路を介して脊髄後角における侵害受容伝達を調節します。 オピオイドは、前脳の作用を通じて、痛みに対する情動反応を変化させると考えられています。 (3) さらに、モルヒネはヒトの脳の「報酬構造」にシグナル変化を誘発します。
遺伝子改変マウスでの研究は、オピオイド受容体の機能に関する重要な情報をもたらしました。 μ オピオイド受容体ノックアウト マウスでは、モルヒネによる鎮痛効果、報酬効果、離脱効果が見られません (5,6)。

- 図2 オピオイドの作用機序。 内因性リガンドまたは薬物は、オピオイド受容体に結合して G タンパク質を活性化し、主に阻害的な複数の効果をもたらします。 アデニル酸シクラーゼと電位依存性 Ca2+ チャネルの活性が抑制されます。 内向き整流性 K+ チャネルとマイトジェン活性化プロテインキナーゼ (MAPK) カスケードが活性化されます。 AMP、アデノシン一リン酸。 ATP、アデノシン三リン酸。
定期的な周術期の臨床使用で静脈内投与されたオピオイドは、多くの代謝経路によって変換され、排泄されます。 一般に、オピオイドは肝臓のミクロソーム系によって代謝されますが、一部のオピオイドでは肝臓での抱合とその後の腎臓による排泄が重要です。 特定のオピオイドについては、関与する特定の代謝経路が、活性代謝物(例、モルヒネ、メペリジン)または超短期間の作用(例、レミフェンタニル)に関して重要な臨床的意味を持っています。 他のオピオイドについては、代謝経路の遺伝的変異が臨床効果を劇的に変化させる可能性があります(コデインなど)。 これらのニュアンスについては、個々の薬物に焦点を当てた後続のセクションで取り上げます。
2. 臨床薬理学
薬物動態
薬物動態の違いは、周術期麻酔の実践におけるオピオイドの合理的な選択と投与の主な根拠です。 主要な薬物動態学的挙動は、(1) ボーラス注射後のピーク効果部位濃度までの潜伏時間 (すなわち、ボーラスフロントエンド動態)、(2) ボーラス注射後の臨床的に関連する濃度減衰までの時間 (すなわち、ボーラスバックエンド動態) です。 )、(3)持続注入を開始した後の定常状態の濃度までの時間(すなわち、注入のフロントエンド動態)、および(4)持続注入を停止した後、臨床的に関連する濃度低下までの時間(すなわち、注入のバックエンド)エンドキネティクス)。
オピオイドの薬物動態の概念を臨床麻酔学に適用するには、いくつかの基本原則を認識する必要があります。 第一に、薬物動態変数の表は臨床的価値が限られています。 薬物動態の挙動を理解するには、コンピュータ シミュレーションが最適です。 第二に、ボーラス注射または持続注入によって投与されるオピオイドは、別々に検討する必要があります。 (8) 第三に、薬物動態情報は、臨床的に有用であるために、濃度-効果関係および薬物相互作用 (すなわち、薬力学) に関する知識と統合されなければなりません。
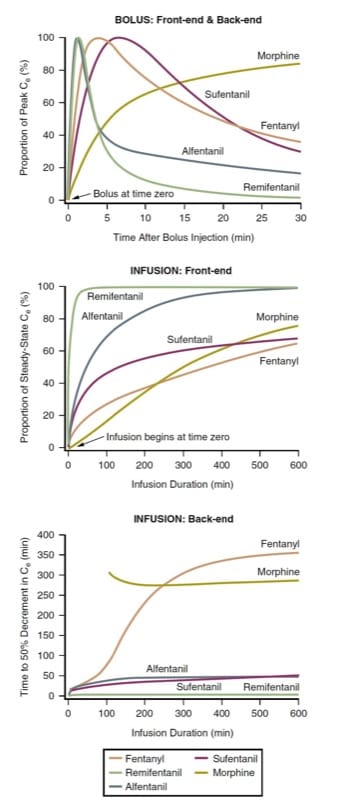
さまざまな静脈内オピオイドの効果がピークに達するまでの時間とボーラス注射後の効果の相殺 (すなわち、ボーラスのフロントエンドの動態とボーラスのバックエンドの動態) は、ボーラス投与後の効果部位濃度の時間経過を予測することによって定義できます。 . オピオイドは効力 (したがって必要な投与量) の点で異なるため、比較のために、効果部位の濃度を各薬物のピーク濃度のパーセントに正規化する必要があります。 モルヒネ、フェンタニル、スフェンタニル、アルフェンタニル、およびレミフェンタニルを術中に最も一般的に使用されるオピオイドとして考慮すると、薬物動態シミュレーションは、ボーラス投与後のピーク効果までの潜伏期間に関してオピオイドがどのように異なるかを示しています (図 3、上のパネル)。 (9-12)
ボーラス注射のシミュレーション (図 3、上のパネルを参照) には、臨床的な意味があります。 たとえば、オピオイド効果の急速な発現が望ましい場合、モルヒネは適切な選択ではない可能性があります。 同様に、臨床目標が短期間のオピオイド効果とその後の急速な消散である場合、レミフェンタニルまたはアルフェンタニルが好まれる可能性があります。 フェンタニルのピーク濃度に達する前に、レミフェンタニルの濃度が非常に大幅に低下したことに注意してください. このシミュレーションは、フェンタニルの初期動態が、患者管理鎮痛 (PCA) に適した薬物である理由を示しています (麻酔後の回復と周術期の疼痛管理の章も参照してください)。 モルヒネとは対照的に、フェンタニル ボーラスの効果のピークは、典型的な PCA ロックアウト期間が経過する前に現れるため、「用量スタッキング」の問題が緩和されます (「周術期の疼痛管理」の章も参照)。
効果がピークに達するまでの待ち時間は、プラズマと効果部位が平衡に達する速度 (つまり、ke0 パラメーター) によって決まります。 平衡化がより迅速な薬物は、「拡散性」画分(すなわち、イオン化されておらず結合していない薬物の割合)が高く、脂溶性が高い。 しかし、遅効性オピオイドでさえ、非常に大量の用量で明らかな急速な発症を引き起こす可能性があります(ピーク濃度が遅くなったとしても、効果部位の薬物レベルが治療以上に達するため).
この単純な定速注入のシミュレーションには、明らかな臨床的意味があります。 第一に、最終的な定常状態濃度のかなりの部分に到達するのに必要な時間は、術中使用の状況では非常に長いです。 より迅速にほぼ定常状態に到達するには、注入を開始 (または増加) する前にボーラスを投与する必要があります。 レミフェンタニルは、おそらくこの一般規則の部分的な例外を表しています。 また、オピオイド濃度は注入開始後何時間もの間上昇します。 言い換えれば、注入速度が何時間も同じだったとしても、濃度は通常増加しています! レミフェンタニルがほぼ定常状態に比較的早く到達することは、完全静脈麻酔 (TIVA) の一般的な薬剤として登場した理由の XNUMX つであることは確かです。
持続注入を開始した後の定常状態までの時間も、薬物動態シミュレーションによって最もよく調べられます。 ボーラス投与と同じプロトタイプを使用して、薬物動態シミュレーション (図 3、中央のパネル) は、定常状態の効果部位濃度 (つまり、注入フロントエンドの動態) を達成するのに必要な時間を示しています。
定常状態の注入を停止した後の効果が相殺されるまでの時間は、状況依存のハーフタイム (CSHT) シミュレーションによって最もよく表されます。定常状態の注入では、CSHT は薬物の薬物動態学的挙動を正規化する手段であり、薬物効果の予測オフセットに関して合理的な比較を行うことができます。 したがって、CSHT は「注入のバックエンド」動態に焦点を当てています。
(図 3) の下のパネルは、一般的に使用されるオピオイドの CSHT シミュレーションです。 ほとんどの薬物では、CSHT は時間とともに変化します。 したがって、短時間の注入では、さまざまな薬物の予測される最終反応速度論に大きな違いはありません (レミフェンタニルは、この一般規則の顕著な例外です)。 注入時間が長くなるにつれて、CSHT は分化し始め、薬物選択の合理的な根拠を提供します。 第二に、オピオイド効果の望ましい持続時間に応じて、短時間作用型または長時間作用型の薬物を選択できます。 最後に、これらの曲線の形状は、必要な濃度低下の程度によって異なります。 言い換えると、濃度が 20% または 80% 減少するのに必要な時間を表す曲線 (たとえば、20% または 80% 減少時間のシミュレーション) はまったく異なります (8)。したがって、適用される麻酔技術によって異なります。 、CSHTシミュレーションは必ずしも臨床的に関連するシミュレーションではありません(つまり、50%の減少は臨床目標ではないかもしれません). また、モルヒネの CSHT シミュレーションは、活性代謝物を考慮していません (「個々のオピオイドの固有の特徴」の下の個々の薬物に関する後述の説明を参照してください)。

- 図3 オピオイドの薬物動態。 文献の薬物動態パラメーターを使用したモルヒネ、フェンタニル、アルフェンタニル、スフェンタニル、およびレミフェンタニルのボーラス注射または持続注入による投与後のフロントエンドおよびバックエンドの薬物動態挙動を示すシミュレーション (詳細については本文を参照)。 (9-12,45)
薬物力学
ほとんどの点で、μ-アゴニスト オピオイドは、重要な薬物動態の違いを伴う薬力学的同等と見なすことができます。 つまり、治療効果と副作用の両方が本質的に同じです。 鎮痛剤としての有効性と換気抑制を引き起こす傾向は、互いに区別がつきません。 ヒスタミン放出などの非オピオイド受容体メカニズムには、薬力学的な違いが存在します。
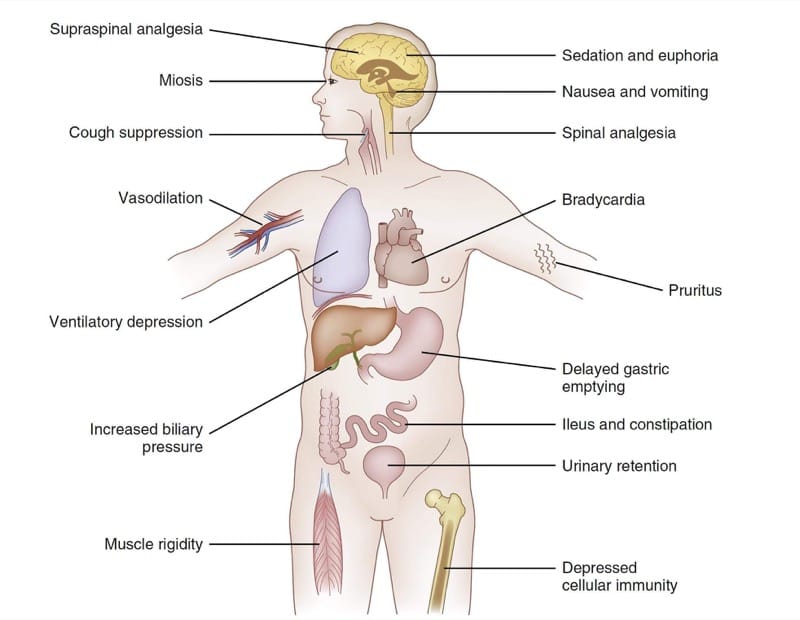
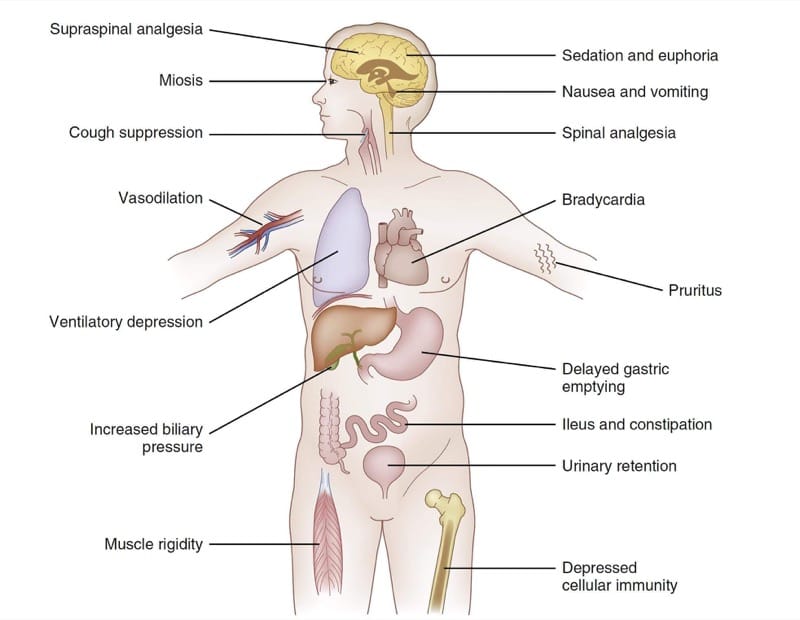
神経系は全身の機能に大きく影響するため、多くの臓器系でオピオイドμ-アゴニストの薬力学的効果が観察されます。 図 4 は、フェンタニル同族体の主な薬力学的効果をまとめたものです。 臨床状況と治療の臨床目標に応じて、これらの広範な効果の一部は、治療的または有害と見なすことができます. たとえば、一部の臨床設定では、μ-アゴニストによって生成される鎮静が治療の目標と見なされる場合があります。 他の人では、眠気は明らかに悪影響と考えられます.

- 図 4 オピオイドの薬力学。 フェンタニル同族体の選択された効果の要約表 (詳細については本文を参照)。
治療効果
痛みの軽減は、オピオイド鎮痛薬の主要な治療効果です。 脊髄および脳の μ 受容体に作用するオピオイドは、末梢からの侵害受容トラフィックを減衰させることと、痛みを伴う刺激に対する情動反応を中枢で変化させることの両方によって鎮痛を提供します。
μ-アゴニストは、ゆっくりと伝導する無髄 C 線維によって伝達される「第二の痛み」の治療に最も効果的です。 それらは、「最初の痛み」の感覚 (小さな有髄 A デルタ線維によって伝達される) および神経因性疼痛の治療にはあまり効果的ではありません。 (局所麻酔薬のような薬物とは対照的に) オピオイド誘発性鎮痛のユニークな側面は、他の感覚モダリティ (例えば、触覚、温度など) が影響を受けないことです。
周術期(確かに術中)に、μ-アゴニストによって引き起こされる眠気も標的効果の XNUMX つです。 脳は、μ-アゴニストの鎮静作用の解剖学的基質です。 μ-アゴニストは用量を増やすと、最終的に眠気と睡眠を引き起こします (痛みの軽減は、術前と術後の両方で不快な患者の睡眠の促進に寄与することは間違いありません)。 十分な用量で、μ-アゴニストは脳波で顕著なデルタ波活動を生成します。これは、自然な睡眠中に観察されるパターンに似ています。
もちろん、μ-アゴニストは、睡眠をもたらさない用量で痛みを大幅に緩和することができます。 これは、外来患者の疼痛の治療におけるそれらの使用の臨床的根拠です。 しかし、追加用量の投与は最終的に眠気を引き起こし(結果として、追加用量を要求できなくなる)、PCA 装置の安全性にとって不可欠な科学的基盤です(周術期の疼痛管理の章も参照)。 しかし、オピオイドを大量に使用しても無反応や健忘症を確実に引き起こすわけではないため、オピオイドを単独で使用した場合、完全な麻酔薬と見なすことはできません。
オピオイドはまた、髄質の咳中枢を介して咳反射を抑制します。 咳反射の減弱により、咳や留置された気管内チューブに対する「バッキング」が起こりにくくなると考えられます。
副作用

換気の抑制は、μ 作動薬に関連する主な副作用です。 気道が確保され、換気が術中に制御されている場合、オピオイドによる換気の低下はほとんど問題になりません。 しかし、オピオイドによる術後の呼吸抑制は、脳損傷や死亡につながる可能性があります。
μ-アゴニストは、髄質の換気制御中枢で、動脈血二酸化炭素濃度に対する換気反応を変化させます。 換気の低下はμ受容体によって媒介されます。 μ受容体ノックアウトマウスは、モルヒネによる呼吸抑制を示さない(14)。
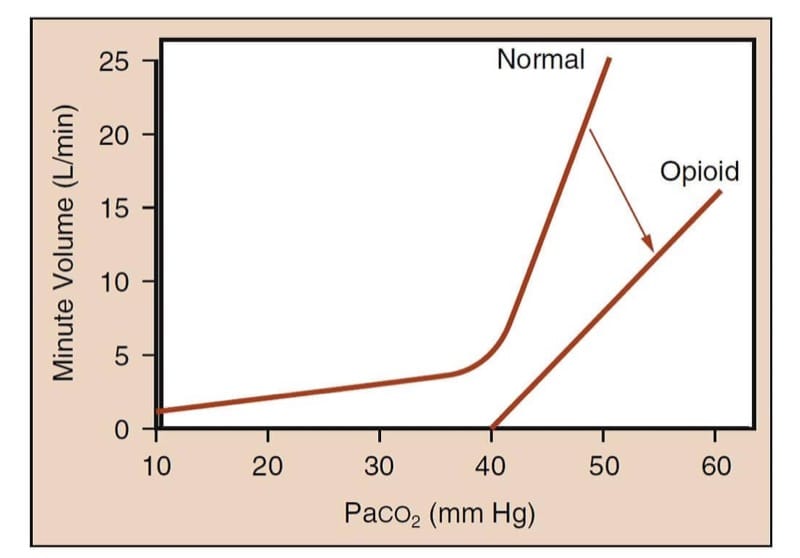
薬を服用していないヒトでは、動脈血二酸化炭素分圧の増加は分時換気量を著しく増加させます (図 5)。 オピオイド鎮痛薬の影響下で、曲線は平らになり、特定の二酸化炭素分圧に対して右にシフトし、分時体積が小さいことを反映しています.(15) さらに重要なことに、通常の曲線の「ホッケースティック」形状が失われます。 ; つまり、オピオイドの存在下で患者が呼吸できない二酸化炭素分圧 (すなわち、「無呼吸閾値」) が存在する可能性があります。

- 図 5 オピオイド誘発性換気抑制研究の方法論。 この方法は、Paco2 と分時換気量の関係を特徴付けます。 「正常」と記された曲線は、覚醒しているヒトの Paco2 レベルの上昇に対する分時換気量の予想される反応を表しています。 CO2 テンションが上昇するにつれて、分時体積が劇的に増加することに注意してください。 「オピオイド」と表示された曲線は、オピオイド投与後の CO2 レベルの上昇に対する分時換気量の鈍化した反応を表しています。 曲線の勾配が減少し、曲線がもはや「ホッケースティック」の形をしていないことに注意してください。 これは、生理的な Paco2 レベルでは、十分な量のオピオイドを投与されている患者は、無呼吸または重度の低換気である可能性があることを意味します。 (Gross JB より引用。息を吸うと刺激を受け、息を吸わないと . . . 失効する: オピオイド誘発性換気抑制に関する新しい洞察. Anesthesiology. 2003;99:767-770、許可を得て使用) .)
換気低下の臨床徴候は、中程度のオピオイド用量では非常に微妙です。 オピオイド鎮痛療法を受けている術後の患者は、意識がはっきりしていても、分時換気量が大幅に減少している可能性があります。 呼吸数(一回換気量のわずかな増加を伴うことが多い)も低下します。 オピオイド濃度が上昇するにつれて、呼吸数と一回換気量が徐々に減少し、最終的に不規則な換気リズムに至り、完全な無呼吸に至ります。
多くの要因が、オピオイド誘発性換気抑制のリスクを高める可能性があります。 明らかな危険因子には、オピオイドの大量投与、高齢、他の中枢神経系(CNS)抑制薬の併用、腎不全(モルヒネの場合)などがあります。 自然な睡眠は、オピオイドの換気抑制効果も高めます(16)。
オピオイドは、さまざまなメカニズムによって心血管の生理機能を変化させる可能性があります。 しかし、他の多くの麻酔薬(例、プロポフォール、揮発性麻酔薬)と比較すると、オピオイド、特にフェンタニル同族体の心血管への影響は比較的わずかです(モルヒネとメペリジンは例外です。個々の薬については次のセクションを参照してください)。
フェンタニル同族体は、脳幹の迷走神経緊張を直接増加させることによって徐脈を引き起こします。これは、迷走神経核へのナロキソンのマイクロインジェクションまたは末梢迷走神経切除術によって実験的にブロックすることができます. (17,18)
オピオイドはまた、脳幹の血管運動中枢を抑制し、血管への直接的な影響により血管拡張を引き起こします。 このアクションにより、プリロードとアフターロードの両方が減少します。 動脈血圧の低下は、うっ血性心不全や高血圧の患者など、交感神経緊張が亢進している患者でより顕著です。 オピオイドの臨床用量は、心筋の収縮性を目に見えて変えることはありません。
オピオイドは、通常、フェンタニル同族体の大量のボーラス用量の急速な投与から、筋肉の硬直を誘発する可能性があります。 この硬直は、声帯の硬直と閉鎖のために、麻酔の導入中にバッグとマスクを介した換気をほとんど不可能にすることさえあります.誘発された筋肉の硬直は不明ですが、神経筋遮断薬の投与によって排除できるため、筋肉への直接的な作用ではありません.
μ-アゴニストによって誘発される瞳孔の収縮は、進行中のオピオイド効果を示す有用な診断サインである可能性があります。 オピオイドは、動眼神経のエディンガー・ウェストファール核を刺激して、縮瞳を引き起こします。 少量のオピオイドでさえ、この反応を誘発し、効果に対する耐性はほとんど生じません. したがって、縮瞳は、オピオイド耐性患者でさえ、オピオイド曝露の非特異的な指標ではあるが、有用である. オピオイドによる瞳孔収縮は、ナロキソンで可逆的です。
オピオイドは胃腸の生理機能に重要な影響を与えます。 オピオイド受容体は、腸の腸神経叢全体に位置しています。 オピオイドによるこれらの受容体の刺激は、胃腸平滑筋の持続性収縮を引き起こし、それによって協調的な蠕動収縮を減少させます。 臨床的には、この収縮により、術前にオピオイド療法を受けている患者の胃排出が遅れ、おそらく胃の容積が大きくなります。 術後、患者はオピオイド誘発性イレウスを発症する可能性があり、適切な栄養の回復と退院が遅れる可能性があります。 この深刻な問題の延長は、長期のオピオイド療法に伴う慢性便秘です。
同様の効果は、豊富なμ受容体を有する胆道系でも観察されます。 μ-アゴニストは、胆嚢平滑筋の収縮とオッディ括約筋のけいれんを引き起こす可能性があり、胆嚢と胆管の手術中に偽陽性の胆管造影を引き起こす可能性があります。 これらの効果は完全にナロキソンで可逆的であり、グルカゴン治療によって部分的に逆転させることができます.
泌尿器への影響は最小限ですが、オピオイドは膀胱排尿筋の緊張を低下させ、尿道括約筋の緊張を高めることにより、尿閉を引き起こすことがあります。 これらの効果は、部分的に中枢性に媒介されますが、尿生殖路にオピオイド受容体が広範囲に存在することを考えると、末梢効果もある可能性が高いです. 、特にオピオイドが髄腔内または硬膜外に投与される場合。
オピオイドは細胞性免疫を低下させます。 たとえば、モルヒネと内因性オピオイド β-エンドルフィンは、他の免疫学的効果の中でも特に、活性化 T 細胞におけるインターロイキン 2 の転写を阻害します (23)。それらの免疫調節効果の。 オピオイドによる細胞性免疫の障害はよく理解されていませんが、創傷治癒の障害、周術期の感染症、および癌の再発が有害な転帰となる可能性があります。
薬物相互作用
薬物相互作用は、薬物動態 (すなわち、XNUMX つの薬物が他の薬物の濃度に影響を与える場合) または薬力学 (すなわち、XNUMX つの薬物が他の薬物の効果に影響を与える場合) の XNUMX つのメカニズムに基づくことができます。 麻酔の実践では、意図しない薬物動態学的相互作用が発生することがありますが、薬力学的相互作用は事実上すべての麻酔薬で発生し、多くの場合、設計によって生成されます。
オピオイドの臨床薬理学における最も一般的な薬物動態学的相互作用は、静脈内オピオイドがプロポフォールと組み合わされたときに観察されます。 おそらく、プロポフォールによって引き起こされる血行動態の変化と薬物動態プロセスへの影響のために、プロポフォールの持続注入と組み合わせて投与すると、オピオイド濃度が高くなる可能性があります.(24)
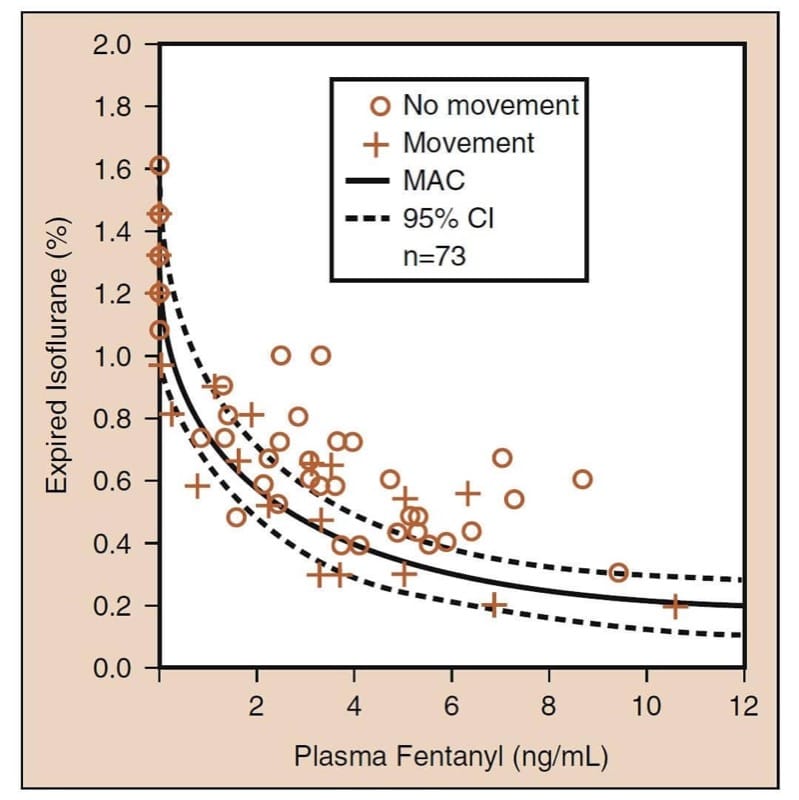
オピオイドが関与する最も重要な薬力学的薬物相互作用は、オピオイドが鎮静剤と組み合わされたときに発生する相乗的相互作用です。 (25) 揮発性麻酔薬と組み合わせると、オピオイドは揮発性麻酔薬の最小肺胞濃度 (MAC) を低下させます (図 6)。 「オピオイド-MAC 減少」データを注意深く調べると、いくつかの臨床的に重要な概念が明らかになります (図 6 を参照)。 まず、オピオイドは相乗的に MAC を低下させます。 第 75 に、MAC の削減はかなりのものです (26% 以上)。 第 XNUMX に、ほとんどの MAC 低下は中程度のオピオイド レベルで発生します (つまり、中程度のオピオイド用量でも MAC が大幅に低下します)。 第 XNUMX に、MAC の減少は完全ではありません (つまり、オピオイドは完全な麻酔薬ではありません)。 オピオイドを追加しても、他の麻酔薬の必要性を完全になくすことはできません。 第 XNUMX に、MAC を達成する催眠薬とオピオイドの組み合わせは無数にあります (これは、臨床医が麻酔薬と手術の目標に基づいて最適な組み合わせを選択しなければならないことを意味します)。 これらの概念はすべて、TIVA でオピオイドをプロポフォールと組み合わせて使用する場合にも当てはまります。 (XNUMX)

- 図 6 オピオイドによる揮発性麻酔薬の最小肺胞濃度 (MAC) の低下: イソフルランとフェンタニルのプロトタイプの例。 実線の曲線は MAC です。 点線の曲線は 95% 信頼区間 (CI) です (詳細は本文を参照)。 (McEwan AI、Smith C、Dyar Oらのフェンタニルによるイソフルランの最小肺胞濃度の低下から適応。Anesthesiology.1993;78:864-869、許可を得て使用。)
特別な人口
肝不全
肝臓はほとんどのオピオイドの生体内変化を主に担う代謝器官ですが、肝不全は通常、オピオイドの薬物動態に大きな影響を与えるほど深刻ではありません。 もちろん、同所性肝移植の無肝期は、この一般規則の顕著な例外です (臓器移植の章も参照してください)。 継続的な薬物投与により、患者に肝臓がない場合、肝代謝に依存するオピオイドの濃度が上昇します。 肝臓の部分切除後でも、モルヒネ グルクロニドとモルヒネの比率の増加が起こり、モルヒネ代謝速度の低下が示されます (27)。 .(28)
重度の肝疾患患者のオピオイド療法では、薬力学的な考慮事項が重要になる場合があります。 進行中の肝性脳症の患者は、オピオイドの鎮静効果に対して特に脆弱です。 結果として、この薬剤クラスは、この患者集団では注意して使用する必要があります。
腎不全
腎不全は、モルヒネおよびメペリジンに関して臨床的に重要な意味を持ちます(個々の薬剤に関する以下の説明を参照)。 フェンタニル同族体の場合、腎不全の臨床的重要性はそれほど顕著ではありません。 レミフェンタニルの代謝は腎臓病の影響を受けません。 (29)
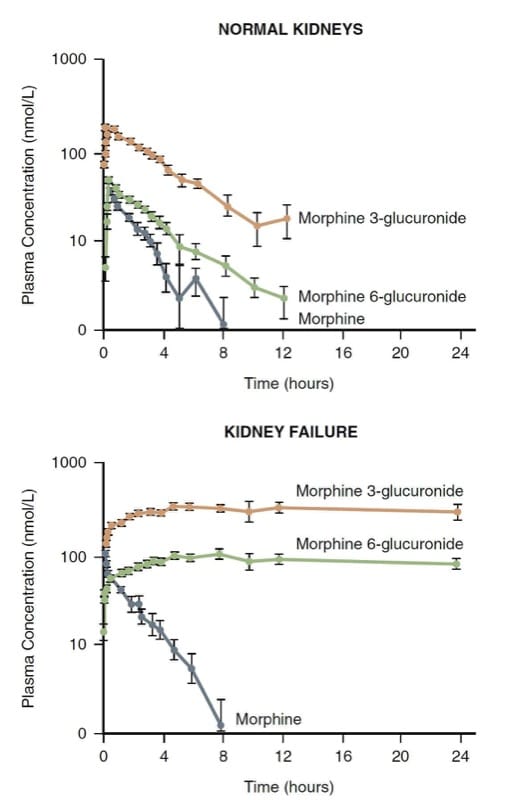
モルヒネは主に肝臓での抱合によって代謝されます。 結果として生じる水溶性グルクロニド (すなわち、モルヒネ 3-グルクロニドおよびモルヒネ 6-グルクロニド - M3G および M6G) は、腎臓を介して排泄されます。 腎臓はモルヒネの抱合にも関与しており、M3G および M6G への変換の半分程度を占める可能性があります。
M3G は不活性ですが、M6G はモルヒネに匹敵する効力を持つ鎮痛剤です。 腎不全患者では、非常に高いレベルの M6G と生命を脅かす呼吸抑制が発生する可能性があります (図 7)。 (30) したがって、モルヒネは、腎クリアランス機構が著しく変化した患者では良い選択ではないかもしれません。
メペリジンの臨床薬理学も、腎不全によって大きく変化します。 主な代謝産物であるノルメペリジンは、不安や振戦からミオクローヌスや率直な発作に至るまで、鎮痛作用と興奮性の中枢神経系作用を持っています。 活性代謝物は腎排泄の対象となるため、ノルメペリジンの蓄積による CNS 毒性は、腎不全患者では特に懸念されます。 メペリジンのこの欠点により、多くの病院のフォーミュラリーがその使用を制限したり、フォーミュラリーから完全に削除したりしています.

- 図 7 正常なボランティアと腎不全患者におけるモルヒネとその代謝物の薬物動態。 腎不全における代謝産物の有意な蓄積に注意してください。 (Osborne R, Joel S, Grebenik K, et al. The pharmacokinetics of morphine and morphine glucuronides in Kidney Failure. Clin Pharmacol Ther. 1993;54:158-167 より転載、許可を得て使用。)
性別
性別は、オピオイドの薬理学に重要な影響を与える可能性があります。 モルヒネは、男性よりも女性の方が強力であり、女性では作用の開始が遅い.(31) これらの違いのいくつかは、周期性腺ホルモンおよび心理社会的要因に関連している可能性がある.
年数
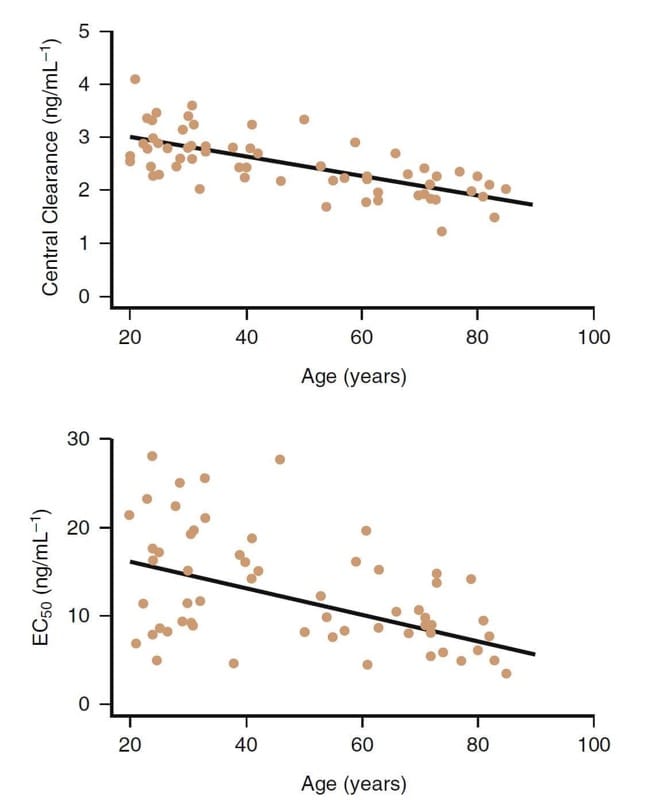
加齢は明らかに、オピオイドの臨床薬理学に影響を与える重要な要因です。 例えば、フェンタニル同族体は年配の患者でより強力です (図 8)。
高齢になると、薬物動態の変化も影響しますが、薬力学的な違いが主に、高齢の患者 (> 65 歳) における必要用量の減少の原因となっています。 高齢患者では、レミフェンタニルの用量を少なくとも 50% 以上減らす必要があります。 同様の減量は、他のオピオイドについても賢明です。

- 図 8 レミフェンタニルの臨床薬理に対する年齢の影響。 かなりのばらつきがありますが、一般に、高齢の被験者は中心クリアランスが低く、効力が高くなります(つまり、EC50 が低くなります)32。
肥満
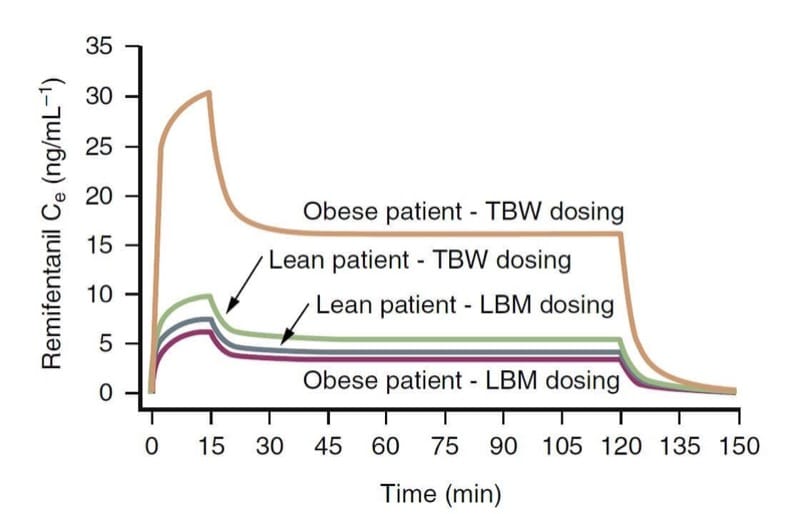
体重は、オピオイドの臨床薬理学に影響を与える重要な要因である可能性があります。 オピオイドの薬物動態変数、特にクリアランスは、総体重 (TBW) よりも除脂肪体重 (LBM) に密接に関連しています。 実際には、これは、同じ目標濃度を達成するために、病的肥満患者が痩せた患者よりも多くの投与量を必要とすることを意味しますが、TBW によって示唆されるほどではありません. (34)
例えば、薬物動態シミュレーション (図 9) で示されているように、TBW ベースの投与スキームは、LBM に基づく投与計算よりもはるかに大きなレミフェンタニル効果部位濃度をもたらします (35) 対照的に、TBW および LBM 投与スキームは、やせた患者と同様の濃度。 これらの概念は、他のオピオイドにも当てはまる可能性があります。

- 図 9 肥満および痩せた患者の総体重 (TBW) または除脂肪体重 (LBM) に基づいてレミフェンタニル投与量を計算した結果を示す薬物動態シミュレーション (1 μg/kg のボーラス注射に続いて 0.5 μg/kg の注入) /min で 15 分間、0.25 μg/kg/min でさらに 105 分間)。 肥満患者における TBW ベースの投与は、劇的に高い濃度になることに注意してください。 (イーガン TD、ホイジンガ B、グプタ SK らのレミフェンタニルの薬物動態、肥満患者と痩せた患者から改作。Anesthesiology. 1998;89:562-573、許可を得て使用。)
個々のオピオイドのユニークな特徴
コデイン
コデインは、術中に一般的に使用されることはありませんが、それに関連する薬理ゲノミクスのニュアンスがよく特徴付けられているため、オピオイドの中でも特に重要です。 コデインは実際にはプロドラッグです。 モルヒネが活性化合物です。 コデインは、肝臓ミクロソームアイソフォーム CYP2D6 によって媒介される代謝プロセスである O-脱メチル化によって (部分的に) 代謝され、モルヒネになります。白人集団) または CYP36D2 が阻害されている患者 (キニジンを服用している患者など) は、たとえモルヒネに対して正常な反応を示すとしても、コデインの恩恵を受けるとは予想されません。 (6)
モルヒネ
モルヒネは、すべての新規参入者が比較されるプロトタイプのオピオイドです。 合成オピオイドが自然のモルヒネよりも効果的に痛みをコントロールするという証拠はありません。 ヒスタミンの放出とモルヒネに伴う低血圧がなければ、術中に最も一般的に使用されるオピオイドとしてフェンタニルがモルヒネに取って代わることはなかったかもしれません。
モルヒネはゆっくりと発症します。 モルヒネの pKa により、モルヒネは生理的 pH でほぼ完全にイオン化されます。 この特性とその低い脂溶性が、モルヒネのピーク効果までの潜伏期間の延長を説明しています。 モルヒネは中枢神経系にゆっくりと浸透します。 この機能には、それに関連する利点と欠点の両方があります。 効果がピークに達するまでの潜伏期間が長いということは、モルヒネは、より即効性のオピオイドと比較して、典型的な鎮痛薬のボーラス注射後に急性呼吸抑制を引き起こす可能性がおそらく低いことを意味します。 一方、開始時間が遅いということは、臨床医がおそらく、重度の痛みを経験している患者に複数のモルヒネを不適切に「積み重ねる」可能性が高いことを意味し、毒性の「オーバーシュート」の可能性を生み出します.(39)
モルヒネの活性代謝物である M6G には、重要な臨床的意味があります。 M6G への変換は、モルヒネの代謝の 10% にすぎませんが、M6G は、正常な腎機能を持つ患者でも、特に長期間使用すると、モルヒネの鎮痛効果に寄与する可能性があります。 モルヒネの肝臓抽出率が高いため、経口投与されたモルヒネのバイオアベイラビリティは、非経口注射後よりも大幅に低くなります。 経口投与されたモルヒネに対する肝臓の初回通過効果により、M6G レベルが高くなります。 実際、モルヒネが経口投与された場合、M6G は主要な活性化合物である可能性があります.(40) 前のセクション「腎不全」で述べたように、透析患者における M6G の潜在的な毒性レベルへの蓄積は、この活性代謝物のもう XNUMX つの重要な意味です。
フェンタニル
フェンタニルは、現代の麻酔の実践で使用される最も重要なオピオイドかもしれません。 元のフェンタニル同族体として、その臨床応用は十分に定着しており、非常に多様です。 フェンタニルは、さまざまな方法で送達できます。 静脈内経路に加えて、フェンタニルは、経皮、経粘膜、経鼻、および経肺経路によって送達することができます。
クエン酸フェンタニル (OTFC) の経口経粘膜送達は、同じ用量を飲み込んだ場合よりも、より高いピークレベルに早く到達します。 (41) 初回通過効果を回避すると、実質的により大きなバイオアベイラビリティが得られます。 OTFC は非侵襲的で発症が早いため、オピオイド耐性がん患者の突出痛の治療法として成功しており、多くの場合、経皮フェンタニルパッチと組み合わせて使用されます (第 40 章も参照)。
アルフェンタニル
アルフェンタニルは、ほぼ独占的に持続注入によって投与された最初のオピオイドでした。 終末半減期が比較的短いため、アルフェンタニルは当初、持続注入の終了後に効果が急速に相殺されると予測されていた. 42) しかし、アルフェンタニルは、その「拡散性画分」が高いため、単回ボーラス注射後は実際には短時間作用型の薬物です。 それはすぐに効果部位濃度のピークに達し、その後減少し始めます (「薬物動態」の前の説明を参照してください)。 アルフェンタニルは、薬物が投与方法 (すなわち、ボーラスと持続注入) に応じて異なる薬物動態プロファイルをどのように示すことができるかを示しています。 アルフェンタニルは、フェンタニルやスフェンタニル以上に、アルフェンタニルの生体内変化に関与する主要な酵素である肝 CYP8A3 の個人差が大きいため、予測不可能な肝代謝を示します。
スフェンタニル
スフェンタニルの際立った特徴は、麻酔の実践で一般的に使用される最も強力なオピオイドであることです。 それはオピオイド受容体でより本質的に有効であるため、使用される絶対用量は、他の効力の弱い薬物と比較してはるかに少なくなります (例えば、モルヒネ用量の 1000 分の XNUMX)。
レミフェンタニル
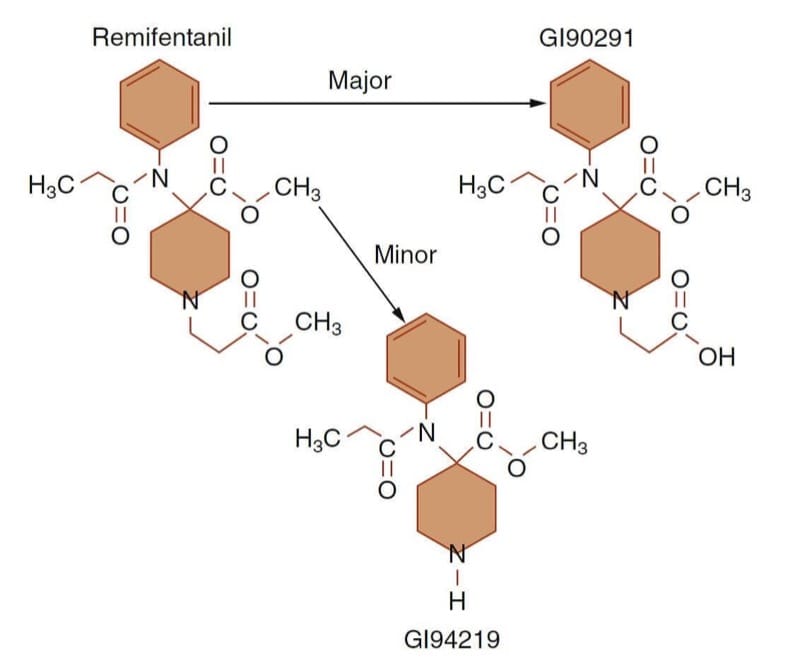
レミフェンタニルは、特殊な構造-活性 (または構造-代謝) 関係を持つ分子を設計することによって、特定の臨床目標を達成する方法のプロトタイプ例です。 エステル加水分解の際にμ受容体アゴニスト活性を失うことにより、非常に短時間作用型のオピオイドが得られます(図10)。 (43) レミフェンタニルの開発を駆り立てた満たされていない必要性は、急速に変化する麻酔や手術の状況で患者の動的なニーズを満たすために、必要に応じて薬物を増減できるように、迅速な開始とオフセットを備えたオピオイドを使用することでした。
レミフェンタニルの CSHT は、現在市販されているフェンタニル同族体に比べて約 5 分程度と短い。 (44) 薬力学的に、レミフェンタニルは、アルフェンタニルと同様の効果がピークに達するまでの短い潜時と、フェンタニルよりもわずかに弱い力価を示します。 (45)
現代の麻酔実践におけるレミフェンタニルの役割は、現在では比較的十分に確立されています。 レミフェンタニルはおそらく、その応答性の高い薬物動態プロファイルを有利に利用できる場合に最適です (例: 迅速な回復が望ましい場合、麻酔薬の必要量が急速に変動する場合、オピオイドの滴定が予測不可能または困難な場合、またはオピオイドに重大な危険がある場合)。 (46) レミフェンタニルの最も一般的な臨床応用は、プロポフォールと組み合わせた TIVA の提供です。 また、オピオイド効果の非常に短いパルスとその後の迅速な回復が必要な場合(例、監視下の麻酔管理中の局所麻酔薬注射の準備)にも、一般的に静脈内ボーラスで投与されます(外来麻酔の章を参照)。

- Fig.10 レミフェンタニルの代謝経路。 レミフェンタニルの代謝の大部分は、非特異的な血漿および組織のエステラーゼによる不活性な酸代謝産物 (GI90291) への脱エステル化 (すなわち、エステル加水分解) によるものです。 (イーガン TD、ホイジンガ B、グプタ SK らのレミフェンタニルの薬物動態、肥満患者と痩せた患者から改作。Anesthesiology. 1998;89:562-573、許可を得て使用。)
オピオイド アゴニスト-アンタゴニストおよび純粋なアンタゴニスト
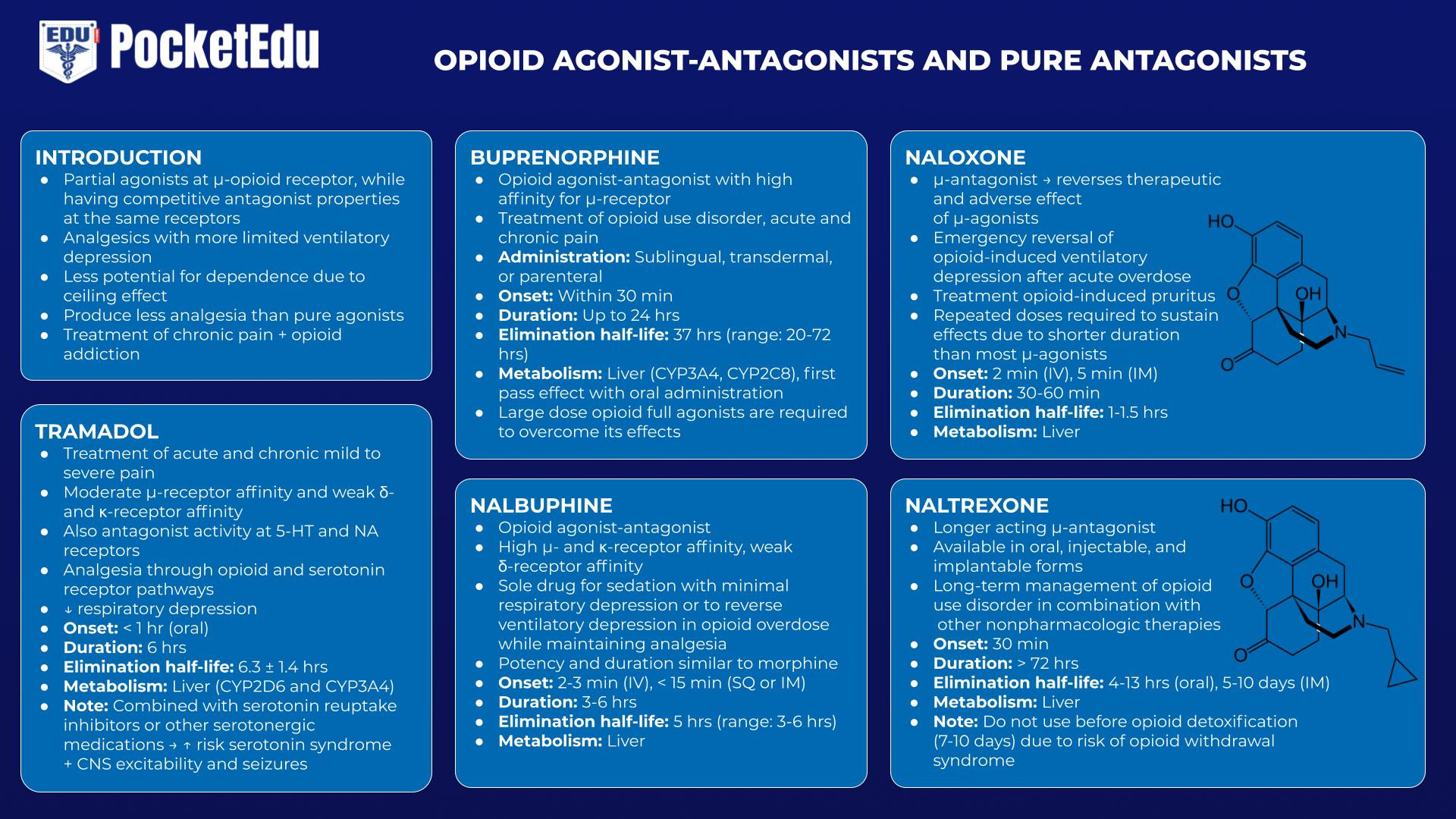
オピオイドアゴニスト-アンタゴニストは、μ受容体で部分アゴニストとして作用し、同じ受容体で競合的アンタゴニスト特性を持ちます。 これらの薬物は、純粋なアゴニストと比較して鎮痛作用が少ない「天井効果」を示すため、換気抑制がより制限され、依存の可能性がより低い鎮痛薬として機能します。 乱用の可能性が低いことは、これらの薬物の開発の根底にある満たされていない主要なニーズでした。 このカテゴリーの薬は、慢性疼痛の治療やオピオイド中毒の治療に使用されます。 これらの薬物は、進行中の完全アゴニスト活性の存在下で投与された場合 (例えば、モルヒネや他の純粋なアゴニストの後に投与された場合)、ある程度の競合的拮抗作用を引き起こします。 ナロキソンがプロトタイプである純粋なオピオイド拮抗薬は、アゴニスト活性を欠いているオピオイド受容体の完全な競合的拮抗薬です。 これらの純粋な拮抗薬は、急性オピオイド過剰摂取および慢性乱用の管理に使用されます。
トラマドール
トラマドールは、中程度の μ 受容体親和性と弱い κ および δ 受容体親和性を持つ中枢性鎮痛薬です。 特に、トラマドールは、5-ヒドロキシトリプタミン (5-HT) およびニコチン性アセチルコリン (NA) 受容体に対するアンタゴニスト活性も持っています。 オピオイドとセロトニン受容体経路の両方を介して鎮痛を提供する一方で、トラマドールは呼吸抑制のリスクを軽減します。 しかし、セロトニン再取り込み阻害薬や他のセロトニン作動薬と併用すると、セロトニン症候群や中枢神経系興奮性および発作のリスクが伴います.(47)
ブプレノルフィン
ブプレノルフィンは、μ受容体に高い親和性を持つオピオイドアゴニスト/アンタゴニストです。 舌下、経皮、または非経口で投与できますが、経口投与では広範な初回通過肝代謝を受けます。 慢性疼痛の治療には中程度の用量を使用できますが、慢性疼痛の治療に使用される高用量は、他のオピオイドの効果に拮抗する可能性があり、慢性疼痛に対する急性の治療を困難にします. それは非常に高い親和性でオピオイド受容体に結合し、その排泄半減期は 20 ~ 72 時間の範囲にあるため、その効果を克服するには大量のオピオイド完全アゴニストが必要です (48)。
ナルブフィン
また、オピオイドアゴニスト-アンタゴニストであるナルブフィンは、モルヒネと同様の効力と作用持続時間を有します。 呼吸抑制を最小限に抑えた鎮静のための唯一の薬として、また鎮痛効果を維持しながらオピオイドの過剰摂取による換気抑制を回復させる薬として使用できます。 (49)
ナロキソン/ナルトレキソン
ナロキソンは、μ-アゴニストの治療効果と副作用の両方を逆転させる注射可能なμ-アンタゴニストです。(50) ナロキソンの最も一般的な適応症は、急性過剰摂取後のオピオイド誘発性換気抑制の緊急回復です。 この点でのその重要な役割は、ナロキソンが世界保健機関の「必須医薬品リスト」に含まれるに値します。 ナロキソンは、麻酔からの覚醒時に十分な換気努力を回復し、それによって気管の抜管を促進するために、はるかに少ない用量で使用されることがあります. オピオイド誘発性そう痒症の治療 (必要な用量は少量のみ) は、もう XNUMX つの一般的な治療用途です。
ナロキソンは、オピオイドに関連する換気抑制を逆転させるのに非常に効果的ですが、急性禁断症状、吐き気、嘔吐、頻脈、高血圧、発作、肺水腫など、多くの有害な影響があります.ほとんどのμ-アゴニストよりも作用が短いことは、投与スケジュールを決定する際の重要なポイントです。 効果を持続させるためには、反復投与が必要になる場合があります。
米国でのオピオイド乱用の流行に対応して、オピオイドの過剰摂取が発生した場合に素人が緊急に使用することを目的とした新しい送達システムが開発されました。 これらには、点鼻薬や自動注射製剤が含まれます.(52,53)
ナルトレキソンは長時間作用型のオピオイド μ 拮抗薬であり、経口、注射、埋め込み型で利用でき、他の非薬物療法と組み合わせてオピオイド中毒者の長期管理に使用されます。 (54)
3. 臨床応用
オピオイドは、麻酔実践のほぼすべての分野で重要な役割を果たしています。 術後疼痛の治療では、オピオイドが最も重要ですが、周術期医療の他のほとんどの状況では、オピオイドは他の薬物と組み合わせて使用される治療補助薬です。
一般的な臨床適応症
術後の鎮痛は、麻酔の実践におけるオピオイド療法の長期にわたる適応症です。 現代では、PCA デバイスを介したオピオイド投与がおそらく最も一般的な投与方法です。 近年、オピオイドは、有効性と安全性を高めるために、非ステロイド系抗炎症薬 (NSAID) などのさまざまな他の鎮痛薬と術後に併用されることが増えています。
国際的に、麻酔の実践におけるオピオイドの最も一般的な臨床適応は、平衡麻酔として知られるようになったものへの使用です。 このおそらく見当違いの用語は、複数の薬物 (揮発性麻酔薬、神経筋遮断薬、鎮静催眠薬、オピオイドなど) を低用量で使用して麻酔状態を作り出すことを暗示しています。 この手法では、オピオイドは主に MAC を減少させる能力のために使用されます。 このバランスの取れた麻酔アプローチの根底にある基本的な仮定は、組み合わせて使用される薬物が、単剤療法としてより多くの用量で使用される個々の薬物 (すなわち、揮発性麻酔薬) の欠点を軽減するということです。
「大量オピオイド麻酔」は、もともと開心術の初期にモルヒネについて記述された技術であり(55)、後にフェンタニル同族体に関連付けられた技術であり(56)、臨床麻酔におけるオピオイドの別の一般的な用途です。 このアプローチの最初の科学的根拠は、臨床医が揮発性麻酔薬の濃度を最小限に抑えるために大量のオピオイドを投与することで、心血管系がすでに損なわれている患者の直接的な心筋機能低下やその他の有害な血行動態への影響を回避できるというものでした。 さらに、フェンタニルは、心筋虚血患者に役立つ可能性のある相対的な徐脈を引き起こすことがよくあります。 一般的な概念は依然として適用されていますが、現在使用されているオピオイドの用量はより少なくなっています。 オピオイドは、心臓保護 (すなわち、プレコンディショニング) の観点から考えられる有益な効果のためにも投与されます。
TIVA は、最近開発され、麻酔実践におけるオピオイドの適応症としてますます人気が高まっています。 この技術は、全身麻酔を提供するために静脈内薬剤に完全に依存しています。 最も一般的には、レミフェンタニルまたはアルフェンタニルの持続注入がプロポフォール注入と組み合わされます。 オピオイドと鎮静剤の両方が、多くの場合、目標制御注入 (TCI) 対応ポンプによって送達されます。 この技術の明らかな利点は、おそらくとりわけ、吐き気や嘔吐が少なくなり、しばしば多幸感が得られるなど、術後早期の患者の健康状態が向上することです。 (57)
合理的な薬剤の選択と投与
合理的なオピオイド選択の科学的根拠を明確にする上で、薬物動態学的考察は非常に重要です。 実際、μ-アゴニスト (オピオイド) は、薬力学的に重要な違いがあると見なすことができます。臨床医がそれを達成するのに最も適したオピオイド (薬剤経済上の懸念などの明らかな制約の範囲内)。
適切なオピオイドを選択する際に対処すべき重要な問題は、どのくらいの速さで目的のオピオイド効果を達成する必要があるか? オピオイド効果はどのくらい持続しなければなりませんか? オピオイド誘発性の換気抑制または鎮静が迅速に消失することは、どの程度重要ですか? 麻酔中にオピオイド効果のレベルを迅速に増減させる能力は重要ですか? 術後にオピオイド治療を必要とする重大な痛みはありますか? これらの質問はすべて、オピオイド効果の最適な時間的プロファイルに関連しています。 これらの質問に対する答えは、薬物動態の概念を適用することによって解決されます。
例えば、オピオイド効果の短いパルスとそれに続く迅速な回復が必要な場合(例えば、球後ブロックの鎮痛を提供するため)、レミフェンタニルまたはアルフェンタニルのボーラスが好ましいかもしれません。 術後にかなりの痛みがある場合や、気管に挿管したままの場合など、オピオイド効果の長期持続が望まれる場合は、フェンタニル注入が賢明な選択です。 手術終了後すぐに患者が覚醒し、意識がはっきりしていなければならない場合(例えば、外科医が手術直後に手術室で神経学的検査を行うことを望んでいる開頭術)、レミフェンタニル注入が有利であるかもしれません。
合理的な投与戦略の策定には、薬物動態の原則の適切な適用も必要です。 あらゆる投薬スキームの重要な目標は、オピオイド効果の定常状態レベルに到達し、維持することです。 今日では、作用部位で定常状態の濃度を達成するために、オピオイドは頻繁に持続注入によって投与されます。 これは、臨床医が関心のあるオピオイドの適切な薬物動態モデルに精通している必要がある TCI 技術の使用によってますます達成されます。 これらのシステムが利用できない場合、臨床医は、タイムリーにほぼ定常状態になるために、注入の前にボーラスを行う必要があることを覚えておく必要があります。
4. 新たな展開
オピオイドとがんの再発
癌の再発に対するオピオイド療法の影響については議論の余地があります。 オピオイド (特にモルヒネ) の免疫抑制効果と血管新生への影響が動物および in vitro 研究で実証されているため、これらの薬物が癌の再発と生存に及ぼす影響に対する懸念が浮上しています。 標準的な術後オピオイド鎮痛を受けた患者のがん再発率と代替技術(硬膜外疼痛管理など)を受けた患者のがん再発率を比較したいくつかの初期のレトロスペクティブ データは、オピオイド療法群でより頻繁ながん再発率を示唆した。 他の研究では、相反する結果が見つかりました。 34,000 年から 1996 年までの 2008 人を超える乳がん患者のレトロスペクティブ レビューでは、オピオイド療法とがんの再発との間に関連性がないことが示されました。 (59) 同様に、術後フェンタニルの静脈内投与またはモルヒネによる術後硬膜外投与を受けた肝細胞癌患者 819 人のレトロスペクティブ レビューでは、無再発生存率に影響は見られませんでした。 (60)
しかし、他の研究では、オピオイド節約技術によっていくつかの改善された結果が示唆されています。 984 年から 2006 年までの 2011 人の非小細胞肺がん患者のレビューでは、オピオイドを控えた疼痛管理戦略で生存率が改善し、無病生存期間が延長したことがわかりました。 (61) したがって、癌再発における周術期オピオイド療法の役割は、依然として議論の余地がある。 進行中の試験により、腫瘍患者の治療における麻酔関連の臨床的意思決定がさらに洗練されます。
オピオイド乱用の流行
処方オピオイドの乱用と転用に関連する死亡は、米国および他の地域で急増しています。 (62) 死亡者数に加えて、処方箋および違法なオピオイド乱用のこの蔓延したパターンにより、オピオイド乱用治療施設への入院が大幅に急増しました。 (63) この傾向は、一部の患者を中毒の素因とする可能性がある慢性疼痛状態に対するオピオイド処方慣行に少なくとも部分的に起因している可能性があります。 (64,65)
流行は非常に危機的なレベルに達したため、米国の連邦および州政府当局は法律を制定し、問題の研究、予防、および治療を支援するための資金を確保しました. (66,67) オピオイド処方箋を満たす患者のための国家承認の薬局ベースのナロキソン調剤 (医師の処方箋なし) は、そのような法律によってサポートされている取り組みの注目すべき例です。 (68) さらに、専門家団体と疾病管理予防センター (CDC) は、オピオイド処方に関する新しいガイドラインを作成しました。 (69) これは現在、公の場での激しい議論と医学的調査の領域です。
5. 今日の質問
- 患者は、術後患者管理鎮痛 (PCA) を必要とします。 薬物動態の観点から、PCA で使用する場合、モルヒネと比較してフェンタニルの相対的な利点は何ですか?
- オピオイドの持続注入のオフセット時間を記述するのに最も適している薬物動態パラメータはどれですか?
- 分時換気量と二酸化炭素に対する換気反応に対するオピオイドの影響は何ですか?
- 腎不全はモルヒネとメペリジンの薬物動態にどのように影響しますか?
- モルヒネによる術後呼吸抑制の患者に、静脈内ナロキソンが投与されます。 ナロキソンの潜在的な副作用は何ですか?
- 術中に使用するオピオイドを選択する際に対処すべき重要な質問は何ですか?