James C.Watson
INTRODUZIONE
Il danno neurologico successivo all'anestesia regionale è una complicanza rara, ma temuta, che crea alti livelli di ansia nel paziente e nell'anestesista. La maggior parte dei deficit sarà sensoriale predominante e limitata in durata e gravità e può essere gestita con rassicurazione e follow-up appropriato.
È fondamentale distinguere questi casi dalle rare complicanze che richiedono l'imaging emergente, la consultazione neurologica o neurochirurgica o il trattamento. Questa sezione si concentra sul riconoscimento delle complicanze neurologiche postoperatorie, sul riconoscimento degli ostacoli al loro riconoscimento e valutazione e su un approccio clinico efficiente e strutturato alle complicanze neurologiche post-anestesia.
OSTACOLI AL RICONOSCIMENTO DEL DANNO NEUROLOGICO POSTOPERATORIO
Deficit neurologici nel contesto postoperatorio possono derivare da procedure anestetiche perioperatorie, fattori chirurgici o lesioni iatrogene, compressione nervosa che si verifica in sala operatoria o durante il recupero postoperatorio, o riconoscimento di una malattia neurologica preesistente, ma precedentemente non apprezzata. Sebbene il riconoscimento di una complicanza neurologica immediatamente dopo l'intervento implichi fortemente una complicanza perioperatoria (chirurgica, anestetica o di posizionamento), esistono molti ostacoli al riconoscimento precoce delle complicanze neurologiche perioperatorie. La sedazione o l'analgesia postoperatoria possono mascherare la complicanza.
Dati i sintomi neurologici attesi nel postoperatorio dopo l'anestesia regionale, i pazienti e gli operatori sanitari possono presumere che i sintomi del paziente siano correlati al blocco. I pazienti quindi non si lamentano di sintomi che potrebbero non essere correlati al blocco e gli operatori sanitari potrebbero non riuscire a perseguire i sintomi segnalati perché presumono che siano correlati al blocco, quando in realtà possono essere distinti nella distribuzione dal deficit neurologico atteso.
I pazienti inoltre non sono consapevoli di cosa aspettarsi dopo l'intervento e possono presumere che i sintomi postoperatori siano normali. Le medicazioni chirurgiche, i drenaggi, i gessi e le restrizioni dell'attività postoperatoria limitano il livello di attività del paziente nel postoperatorio in modo tale che un deficit neurologico postoperatorio può non essere riconosciuto fino a quando non possono essere ripristinati livelli di attività più normali.
Infine, i pazienti spesso vedono il periodo postoperatorio come una singola epoca (la sfocatura perioperatoria) invece che come singoli giorni in cui il riconoscimento preciso dell'insorgenza dei sintomi sarebbe stato utile per mettere a punto la diagnosi differenziale riguardo alla causa di una complicanza neurologica postoperatoria. In uno studio prospettico sulla neuropatia ulnare postoperatoria, alcuni pazienti in follow-up hanno riferito che i loro sintomi erano stati rilevati "immediatamente" dopo l'intervento chirurgico, mentre le valutazioni prospettiche avevano chiaramente documentato un'insorgenza di segni e sintomi oltre 48 ore dopo l'intervento, scagionando quindi il operatori chirurgici e di anestesia e che implicano una complicanza di convalescenza postoperatoria.
Date queste barriere, durante il ricovero procedurale sono stati registrati solo il 77%-90% delle complicanze della lesione del nervo sensitivo e del nervo sensitivo a seguito di artroplastica totale dell'anca e del ginocchio. Gli studi che includono solo lesioni neurologiche precoci (meno di 20 ore dopo l'intervento) probabilmente sottostimano il rischio.
Al contrario, le lesioni riconosciute in ritardo spesso hanno (o forse hanno più probabilmente) cause non anestetiche/correlate all'intervento chirurgico, incluse infezioni, infiammazioni postoperatorie e conseguenze dell'immobilizzazione o della compressione nel periodo di recupero. La frequenza della neuropatia ulnare nelle coorti chirurgiche più di 2 giorni dopo l'intervento, ad esempio, è simile alla frequenza nei pazienti medici ricoverati in ospedale per la stessa durata. Queste complicazioni non anestetiche/operatorie sono spesso evidenti in quanto si verificano in una distribuzione distinta dal sito chirurgico o anestetico, ma quando non lo fanno, confondono ulteriormente il quadro clinico.
OSTACOLI ALLA VALUTAZIONE NEUROLOGICA DI UNA COMPLICAZIONE NEUROLOGICA POSTOPERATORIA
La valutazione neurologica di una complicanza neurologica postoperatoria identificata è limitata da molti degli stessi fattori che interferiscono con il riconoscimento. Medicazioni, getti, drenaggi e restrizioni di attività limitano la capacità di eseguire un esame neurologico completo e quindi la capacità di localizzare una lesione nervosa. I test elettrofisiologici hanno le stesse limitazioni nell'essere in grado di accedere adeguatamente a muscoli e nervi che possono essere discriminatori per la localizzazione. La sala operatoria e in particolare gli approcci anestetici e chirurgici regionali ai vari problemi sono generalmente estranei alla maggior parte dei neurologi, e come tali possono non essere consapevoli di quali strutture fossero più a rischio o quale meccanismo di lesione potrebbe essere più probabile da una data tecnica chirurgica o anestetica . In molte istituzioni, la registrazione dell'anestetico potrebbe non essere disponibile per il neurologo consulente o, se disponibile, formattata in modo da rendere difficile l'estrazione di informazioni utilizzabili per il non anestesista. Un'utile consultazione neurologica è facilitata da una discussione diretta e franca tra i servizi di anestesia, chirurgia e neurologia.
Meccanismi di lesione
I potenziali meccanismi del danno neurologico correlato all'anestesia sono stati precedentemente articolati; tuttavia, il meccanismo della lesione è pertinente alla preparazione e alla prognosi. La documentazione e il riconoscimento di una malattia neurologica preesistente è importante, in quanto può spiegare segni neurologici di falsa localizzazione evidenti durante la valutazione di un'apparente lesione nervosa postoperatoria. Ad esempio, l'iperreflessia e un segno di Babinski da stenosi spinale cervicale preesistente possono suggerire erroneamente un'eziologia del sistema nervoso centrale in un paziente con una lesione del nervo periferico (PNI). Una malattia neurologica preesistente, sebbene a volte insufficiente da sola a causare sintomi clinici, limita la riserva neurologica di un nervo, il che significa che è più suscettibile allo sviluppo di deficit clinici da una seconda lesione. Ciò ha dimostrato di essere particolarmente rilevante nelle lesioni nervose post-anestesia, che sono più comuni nei nervi a rischio (fenomeno del doppio schiacciamento).
Allo stesso modo squilibri metabolici che sono frequentemente associati alla neuropatia periferica, come il diabete mellito, possono aver causato PNI non riconosciuto precedentemente insufficiente a causare sintomi clinici, ma sufficiente a diminuire la riserva neurologica e mettere a rischio un nervo periferico da un secondo colpo. Questo probabilmente spiega la frequente associazione del diabete come fattore di rischio per le complicanze neurologiche post-anestesia regionale. Malattie sistemiche preesistenti associate a compromissione neurogena (diabete con neuropatia, per esempio) probabilmente compromettono anche il potenziale di guarigione dopo un PNI.
Le lesioni vascolari sono la più catastrofica delle possibili complicanze post-anestesia. Le lesioni vascolari ischemiche possono essere correlate a un fenomeno embolico, trauma diretto o vasocostrizione dell'arteria di Adamkiewicz che causa una sindrome dell'arteria spinale anteriore (ASAS) o da ischemia spartiacque correlata a ipotensione o vasocostrizione. In particolare, il flusso sanguigno del midollo spinale è autoregolato e l'ipotensione dovrebbe essere estrema (pressione arteriosa media < 50 mmHg) o verificarsi in un contesto di alterata autoregolazione per causare un evento ischemico del midollo spinale spartiacque. La formazione di ematomi è fondamentale da riconoscere, poiché è curabile; è devastante se non riconosciuto. L'anticoagulazione o una diatesi emorragica predispongono al rischio di ematomi ed esistono raccomandazioni di consenso per l'uso di antiaggreganti e anticoagulanti nel contesto dell'anestesia regionale.
I processi infettivi possono causare danno neurologico per coinvolgimento diffuso (meningite o poliradicolopatia) o per formazione e compressione di ascessi (ascesso epidurale). I processi infettivi sono ovviamente curabili, ma potenzialmente devastanti se non riconosciuti.
Il danno neurogeno diretto (midollo spinale o nervo periferico) da trauma da ago o catetere, tossicità da anestetico locale o trauma chirurgico è variabile in termini di gravità e prognosi. Purtroppo, una volta che si è verificato, c'è poco da fare per intervenire o migliorarne la storia naturale e le probabilità di guarigione.
Alcune lesioni dei nervi periferici non sono correlate all'intervento anestetico o chirurgico, sebbene l'anestesista o il chirurgo siano spesso erroneamente incolpati. Ad esempio, ci sarebbe un'appropriata preoccupazione per una complicanza neuroassiale in un paziente con catetere epidurale che si sveglia con un piede cadente, ma un'attenta valutazione può mostrare una semplice neuropatia compressiva peroneale alla testa del perone non correlata al catetere epidurale. Inoltre, mentre le neuropatie compressive possono verificarsi in sala operatoria, si verificano comunemente durante il ricovero postoperatorio e il periodo di convalescenza. Allo stesso modo, c'è stato un crescente riconoscimento che alcune neuropatie postchirurgiche sono correlate a una risposta infiammatoria inappropriata diretta al sistema nervoso periferico. Questi sono importanti da riconoscere in quanto non sono correlati a uno specifico intervento anestetico o chirurgico e sono potenzialmente curabili.
Complicazioni neuroassiali
Le complicanze neuroassiali delle tecniche anestetiche comprendono l'ematoma epidurale (EH), l'ascesso epidurale spinale (SEA), l'ASAS e il trauma diretto del midollo. Fortunatamente, questi sono molto rari (EH, da 2 su 100,000 a 1 su 140,000-220,000 tecniche neuroassiali; SEA, da 1 su 40,000 a 1 su 100,000 anestetici neuroassiali), ma possono essere neurologicamente devastanti se non riconosciuti. Con tutte le complicanze neuroassiali, più tempo ci vuole per diagnosticare e trattare, peggiore è la prognosi. Pertanto, a meno che il deficit neurologico non sia chiaramente limitato alla distribuzione di un nervo periferico suscettibile alla compressione (nervo ulnare o peroneo), nel contesto di una complicanza neurologica postoperatoria che si verifica in seguito all'anestesia neuroassiale, il paziente necessita di neuroimaging avanzato della colonna vertebrale emergente.
La risonanza magnetica (MRI) è la modalità di imaging di scelta data la sua capacità di localizzare il catetere (se un intervento con catetere epidurale), differenziare le strutture dei tessuti molli, definire l'impingement neurogeno delle strutture adiacenti (corda o radice[e]) e identificare preesistenti , ma pertinenti, comorbidità (come la stenosi spinale). La tomografia computerizzata (TC) della colonna vertebrale è sufficiente per identificare lesioni che occupano spazio come EH o ascessi che richiedono un intervento neurochirurgico emergente ma manca della sensibilità discriminatoria dei tessuti molli della risonanza magnetica. Pertanto, la TC non sarebbe in grado di identificare una lesione intrinseca del midollo spinale come ASAS o trauma diretto dell'ago. Se la risonanza magnetica non è immediatamente disponibile al riconoscimento di una complicanza post-anestesia a seguito di un intervento neuroassiale, è necessario eseguire la TC della colonna vertebrale. Escluderà un'emergenza neurochirurgica (SEA o EH), ma se la TC è negativa senza risolvere i deficit neurologici, la risonanza magnetica dovrebbe essere organizzata il prima possibile per valutare un processo cordonale intrinseco anche se richiede il trasferimento in una struttura con risorse più immediate .
Consigli NYSORA
- Nel contesto dell'anestesia neuroassiale, qualsiasi preoccupazione per la disfunzione del midollo spinale richiede neuroimaging emergente.
- La risonanza magnetica è la modalità di imaging preferita. Tuttavia, l'imaging non dovrebbe essere ritardato per organizzare la risonanza magnetica o per ottenere una consulenza neurologica. La mielografia TC o TC è accettabile come imaging iniziale per escludere una lesione compressiva.
L'ematoma epidurale nel contesto dell'anestesia neuroassiale si presenta generalmente in modo più fulminante (il 75% presenta deficit che massimizzano nell'arco delle 24 ore) rispetto a quando l'EH è correlato all'anticoagulazione o a cause sconosciute. Tuttavia, il 25% presenta un'evoluzione dei sintomi più lenta e, come tale, l'assenza di una presentazione fulminante non dovrebbe rassicurare il team di anestesia. L'imaging emergente dovrebbe essere perseguito per qualsiasi deficit neurologico inspiegabile dopo l'intervento neuroassiale.
Tipicamente, EH è preannunciato da dolore spinale localizzato al momento dell'inizio del sanguinamento; tuttavia, l'anestesia o gli analgesici spesso mascherano questo. I pazienti progrediscono da vaghi sintomi sensoriali al di sotto della sede dell'ematoma a una densa perdita sensoriale al di sotto di questo livello (un livello sensoriale) che può essere identificata con il raffreddore (tampone alcolico) o con una puntura di spillo. Una paralisi flaccida degli arti inferiori si sviluppa in concomitanza quando i deficit sensoriali diventano più gravi e due terzi dei pazienti sviluppano intestino e vescica neurogeni come complicanza tardiva.
I fattori di rischio includono l'anticoagulazione (più comune), l'uso di antiaggreganti piastrinici, la diatesi emorragica, un'operazione di emergenza, l'anestesia epidurale o spinale tecnicamente impegnativa e l'età avanzata. I fattori di rischio per l'ascesso epidurale spinale includono diabete, immunosoppressione, cancro sistemico, infezioni preesistenti, abuso di droghe per via endovenosa, alcolismo, traumi e durata prolungata del mantenimento del catetere epidurale. Come l'EH, il dolore spinale localizzato è spesso il primo segno di SEA, ma questo è spesso mascherato dall'analgesia postoperatoria.
Seguono febbre e marcatori infiammatori sierologici elevati, ma nei pazienti immunosoppressi questi segni potrebbero non svilupparsi. Il primo segno neurologico è solitamente l'irritazione della radice in un pattern di dolore radicolare distinto. I deficit neurologici, inclusi il livello sensoriale, la paraparesi e l'intestino e la vescica neurogeni, si sviluppano con il tempo al di sotto del livello della SEA, sebbene una percentuale inferiore rispetto all'EH progredisca verso una paralisi franca prima della diagnosi.
La SEA può anche seminare le leptomeningi, causando meningite franca, con tali pazienti che mostrano segni di sedazione, confusione, mal di testa, rigidità nucale, sensibilità alla luce e possibilmente convulsioni.
La sindrome dell'arteria spinale anteriore deriva da una complicazione che coinvolge l'arteria spinale anteriore causando ischemia ai due terzi anteriori del midollo spinale. Ciò è stato segnalato più comunemente con interventi sul dolore neuroassiale, in particolare iniezioni di steroidi epidurali transforaminali, ma potrebbe plausibilmente verificarsi con procedure paravertebrali o procedure anestetiche neuroassiali durante le quali l'ago viene posizionato lateralmente nello spazio interlaminare. I meccanismi includono l'embolizzazione (particolato di steroidi, cemento per vertebroplastica o detriti aterosclerotici), dissezione, vasospasmo o trauma diretto all'arteria di Adamkiewicz nella colonna toracolombare o alle arterie vertebrali, ascendenti o cervicali profonde nella colonna cervicale. I pazienti si presentano fulminante e progrediscono rapidamente verso la para- o tetraplegia, con un livello sensoriale limitato alle modalità del dolore e della temperatura (disfunzione del tratto spinotalamico) con relativo risparmio delle colonne posteriori (propriocezione). Alla fine si svilupperanno iperreflessia e spasticità, ma nella fase iperacuta lo shock spinale provoca areflessia e un tono flaccido.
Il trauma da ago diretto al midollo spinale con anestesia neuroassiale può essere la più difficile delle complicanze neuroassiali da riconoscere. L'inserimento dell'ago nel cavo senza iniezione potrebbe non causare dolore. Mentre ci si aspetta dolore con un aumento della pressione intramidollare con l'iniezione nel midollo, questo potrebbe non essere evidente in un paziente sedato. Inoltre, le parestesie non sono rare con gli anestetici epidurali correttamente eseguiti, quindi la loro sola presenza non indica un trauma del cordone ombelicale. I dati ASA sulle dichiarazioni chiuse indicano che questi sono più comuni nelle procedure del rachide cervicale (compresi gli interventi sul dolore) e sono comunemente associati a morbilità o mortalità maggiori. Le manifestazioni cliniche e la prognosi del trauma da ago diretto al midollo sono variabili a seconda del sito della lesione e se è stata eseguita un'iniezione.
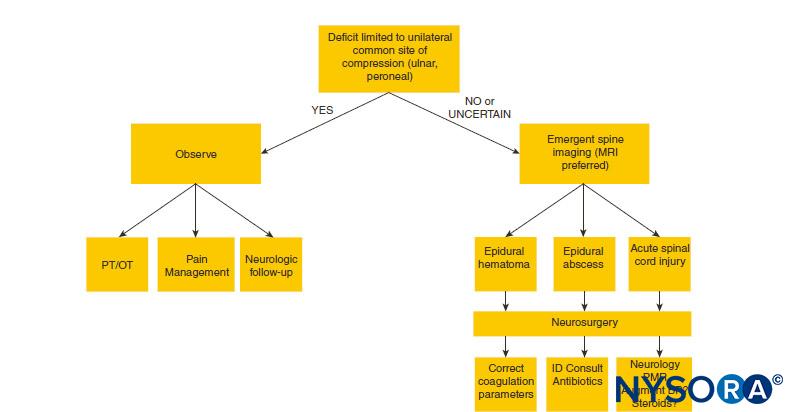
Un algoritmo diagnostico per la valutazione delle complicanze neurologiche dell'anestesia postneurassiale è presentato in Figure 1 .
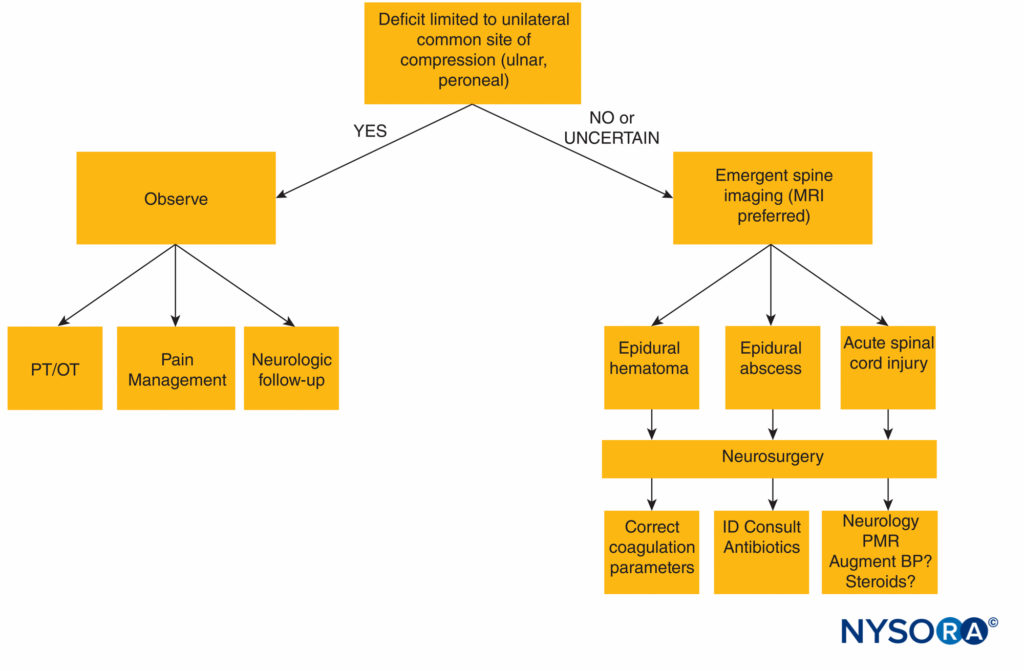
FIGURA 1. Algoritmo diagnostico per deficit neurologico dopo anestesia neuroassiale. PA = pressione sanguigna; MRI = risonanza magnetica; OT = terapia occupazionale; PT = terapia fisica; ID = malattia infettiva, PMR = polimialgia reumatica.
TRATTAMENTO E PROGNOSI DELLE COMPLICANZE NEUROLOGICHE DELLE PROCEDURE NEURASSIALI
La prognosi a seguito di una complicanza neurologica dell'anestesia neuroassiale può essere disastrosa: il 5.5% dei pazienti con EH e il 15% con SEA muoiono. Per EH e SEA, il riconoscimento e l'intervento precoci migliorano l'esito funzionale neurologico. Per EH, di quelli evacuati entro 8–12 ore, il 40%–66% guarisce completamente, mentre quando l'evacuazione avviene più di 12 ore dopo la presentazione, più della metà dei pazienti non presenta miglioramenti o gravi deficit neurologici residui. Per la SEA, il recupero funzionale è significativamente migliorato in quelli trattati in modo definitivo prima della paralisi o in quelli con paralisi da meno di 36 ore. È improbabile che i pazienti con paralisi per più di 48 ore al momento dell'evacuazione si riprendano. Di tutti i pazienti con SEA, quasi un terzo rimane paralizzato. La gravità del deficit neurologico al momento dell'evacuazione predice l'esito, con deficit più gravi all'evacuazione che hanno una minore probabilità di un buon recupero. Pertanto, per EH o SEA, l'obiettivo dovrebbe essere l'evacuazione chirurgica il prima possibile dopo la diagnosi e la consulenza neurochirurgica dovrebbe essere ottenuta immediatamente anche se richiede il trasferimento in una struttura con accesso più immediato ai servizi neurochirurgici.
Consigli NYSORA
- La diagnosi di una lesione compressiva (EH o SEA) all'interno o vicino alla nevassi richiede una consulenza neurochirurgica emergente per prendere in considerazione la decompressione.
- Gli esiti delle lesioni compressive (EH o SEA) dipendono dalla gravità del danno neurologico e dalla durata dei sintomi al momento della decompressione neurochirurgica. Il recupero neurologico è migliorato con la decompressione precoce (<8-12 ore dall'esordio dei sintomi in EH e < 36 ore dall'esordio dei sintomi per SEA) e con deficit neurologici preoperatori più lievi.
A differenza di EH e SEA, per i quali l'intervento precoce può migliorare l'esito neurologico, non esiste un trattamento provato per ASAS o per trauma diretto del midollo. Quasi due terzi con ASAS non migliorano, migliorano minimamente o muoiono. Quelli che sopravvivono spesso richiedono aiuti all'andatura o una sedia a rotelle per deficit motori e sensoriali e sono lasciati con deficit neurogeni dell'intestino e della funzionalità della vescica.
I corticosteroidi sono frequentemente utilizzati nel contesto di lesioni traumatiche acute del midollo spinale. Il trattamento è con metilprednisolone alla dose di 30 mg/kg in 15 minuti entro 8 ore dalla lesione, seguito da un'infusione di mantenimento di 5.4 mg/kg/ora per ulteriori 23 ore, come mostrato nella meta-analisi e nella revisione Cochrane per migliorare i risultati motori a 1 anno dopo l'infortunio. Altri hanno messo in dubbio la validità di questa pratica o l'affermazione che abbia un profilo di effetti collaterali benigni e quindi hanno concluso che l'evidenza è insufficiente per raccomandare i corticosteroidi come linea guida standard per il trattamento della lesione acuta del midollo spinale. Gli steroidi sono comunemente somministrati empiricamente intraoperatoriamente con dosaggio variabile nel contesto di presunti danni neurologici. Il ruolo dei corticosteroidi nel contesto delle complicanze neuroassiali dell'anestesia regionale è sconosciuto. Considerazioni sul loro uso non dimostrato in questo contesto includono che la complicanza neurologica postoperatoria potrebbe essere stata ritardata nel riconoscimento, mentre i dati di supporto per la lesione traumatica del midollo spinale sono nella fase iperacuta immediatamente successiva alla lesione. Inoltre, i corticosteroidi possono aumentare il rischio di infezioni postoperatorie o di compromettere la guarigione delle ferite.
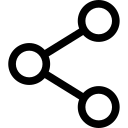
Lesione del nervo periferico
Ci sono molteplici fattori di rischio per PNI nel contesto dell'anestesia regionale (Tabella 1). Questi includono le caratteristiche del paziente che rendono le procedure anestetiche regionali più impegnative (indice di massa corporea) o portano a una riserva neurogena limitata, mettendo i nervi a rischio di un secondo insulto perioperatorio (sindrome del doppio schiacciamento), così come i fattori perioperatori.
TABELLA 1. Fattori di rischio associati alla lesione perioperatoria del nervo periferico.
| Caratteristiche del paziente | Caratteristiche perioperatorie |
|---|---|
| - malattia neurologica reesistentea | - Parestesie con posizionamento dell'ago |
| - Diabete | - Dolore con l'iniezione |
| - Fumatore | - Tempo di laccio emostatico prolungato |
| - Estremi dell'indice di massa corporea (BMI). | - Posizionamento: compressione o allungamento |
| - Anziano | - Paziente sedato durante il blocco regionale |
| - Degenza prolungata |
Ci sono tre passaggi per valutare una lesione del nervo periferico (PNI) post-anestesia o operativa. (1) Esiste un processo attivo (ematoma o sindrome compartimentale) che causa un danno neurologico che può essere trattato? (2) Il PNI è correlato chirurgicamente? (3) Localizzare il deficit neurologico.
Analogamente alle complicanze neuroassiali, una complicanza emorragica (ematoma perineurale o retroperitoneale) dovrebbe essere presa in considerazione nei pazienti i cui interventi perioperatori sono stati eseguiti o mantenuti durante la terapia con anticoagulanti o antiaggreganti piastrinici, nel contesto di trombocitopenia o diatesi emorragica, o se la procedura è stata eseguita in stretta vicinanza a strutture vascolari (soprattutto se l'anestesia regionale è stata eseguita senza guida ecografica). Se considerato, è necessario perseguire l'imaging urgente (TC o ecografia). Se identificati, i parametri della coagulazione devono essere corretti e, se grave, deve essere presa in considerazione l'evacuazione chirurgica.
La seconda questione da considerare è se il deficit sia iatrogeno, ma correlato chirurgicamente. In uno studio su 1614 blocchi ascellari, le variabili chirurgiche sono state ritenute responsabili dell'89% dei PNI identificati, più comunemente correlati a traumi diretti o stiramenti. Di PNIs gravi e sufficientemente duraturi da richiedere l'esplorazione del nervo periferico, il 17% era per neuropatie indotte iatrogenamente, di cui il 94% era originariamente ferito durante l'intervento. L'équipe chirurgica sarebbe a conoscenza di suture, clip o strumenti sospetti posizionati intraoperatoriamente, se qualsiasi nervo rilevante per i sintomi del paziente fosse direttamente a rischio intraoperatorio di traumi diretti o transezioni, se fosse necessaria una trazione eccessiva o se fossero sollevati problemi intraoperatori in merito a strutture vascolari, emodinamica o monitoraggio intraoperatorio. Casi con gravi deficit neurologici e preoccupazione per una potenziale complicanza chirurgica possono richiedere un'esplorazione chirurgica urgente. La cura del paziente è facilitata da una discussione diretta e non incriminante tra il team di anestesia e quello chirurgico.
La fase finale della valutazione è la localizzazione e la caratterizzazione del PNI. Questo aiuterà a stratificare quali pazienti possono essere rassicurati e semplicemente seguiti e quali pazienti meritano una consultazione neurologica precoce e un ulteriore lavoro. La localizzazione è importante poiché la PNI è spesso in una distribuzione distinta da quella in cui è stato eseguito l'anestetico regionale periferico.
Sebbene ciò possa scagionare l'anestesista, richiede comunque un'ulteriore valutazione e disposizioni per un follow-up appropriato. Se i sintomi clinici sono di natura sensoriale (due terzi dei PNI) e limitati alla distribuzione in cui è stato eseguito il blocco o l'infusione, la prognosi è eccellente e i pazienti possono essere rassicurati sul fatto che questi sintomi dovrebbero risolversi nel giro di giorni o settimane. Dovrebbe essere organizzato un follow-up appropriato per garantire la risoluzione dei sintomi. Nel raro caso in cui i sintomi persistono al follow-up diverse settimane dopo l'esordio dei sintomi, dovrebbe essere presa in considerazione un'ulteriore valutazione neurologica ed elettrofisiologica.
Se i sintomi sono in un territorio distinto dalla distribuzione del blocco, si dovrebbe determinare se i reperti clinici sono limitati a un nervo vulnerabile alla compressione in sala operatoria (più comunemente, nervo ulnare al gomito e nervo peroneo al testa fibulare). Se i sintomi sono limitati a questa distribuzione, allora il presunto meccanismo di lesione è la neuroaprassia, per cui vi è una disfunzione localizzata della guaina mielinica, solitamente da compressione. Anche se associati a debolezza, questi di solito migliorano in un periodo di giorni o settimane e possono essere gestiti con rassicurazione e follow-up programmato per indirizzare un'ulteriore valutazione se i sintomi o i deficit persistono. Gli studi di conduzione nervosa (NCS) possono identificare il blocco di conduzione che indica la neuroaprassia in un sito comune di compressione nel periodo postoperatorio acuto e possono essere utili per confermare la mononeuropatia compressiva se vi è incertezza clinica nell'immediato periodo postoperatorio.
Oltre a ciò, l'elettrofisiologia è di utilità limitata nell'immediato postoperatorio (vedi la sezione sul ruolo dell'elettrofisiologia).
Se i segni e i sintomi clinici sono limitati a una singola distribuzione nervosa (mononeuropatia) ma gravi (definiti come un deficit neurologico che causa limitazioni funzionali), motori predominanti o in progressione, è appropriata una valutazione neurologica precoce (in ospedale), così come la considerazione di cause attive curabili (ematoma, sindrome compartimentale, neuropatia infiammatoria) o di una complicanza chirurgica. Se il PNI non può essere localizzato in un singolo territorio nervoso ed è diffuso o multifocale (o semplicemente difficile da localizzare), è appropriata una valutazione neurologica precoce, soprattutto se associata a compromissione funzionale o segni e sintomi progressivi (Tabella 2).
TABELLA 2. Indicazioni per la consultazione neurologica precoce per PNI.
| • I deficit sono • Acuto • Funzionalmente limitante • Progressivo • Multifocali di difficile localizzazione |
| • Compromissione neurologica inspiegabile al di fuori della regione del blocco o della regione di compressione comune |
| • Dolore intenso associato (sproporzionato al tipico decorso postoperatorio)a |
| • Intervento del ritorno al basale neurologico dopo l'intervento chirurgico prima dello sviluppo della PNIa |
Figure 2 delinea un approccio algoritmico alle lesioni dei nervi periferici in seguito ad anestesia regionale.
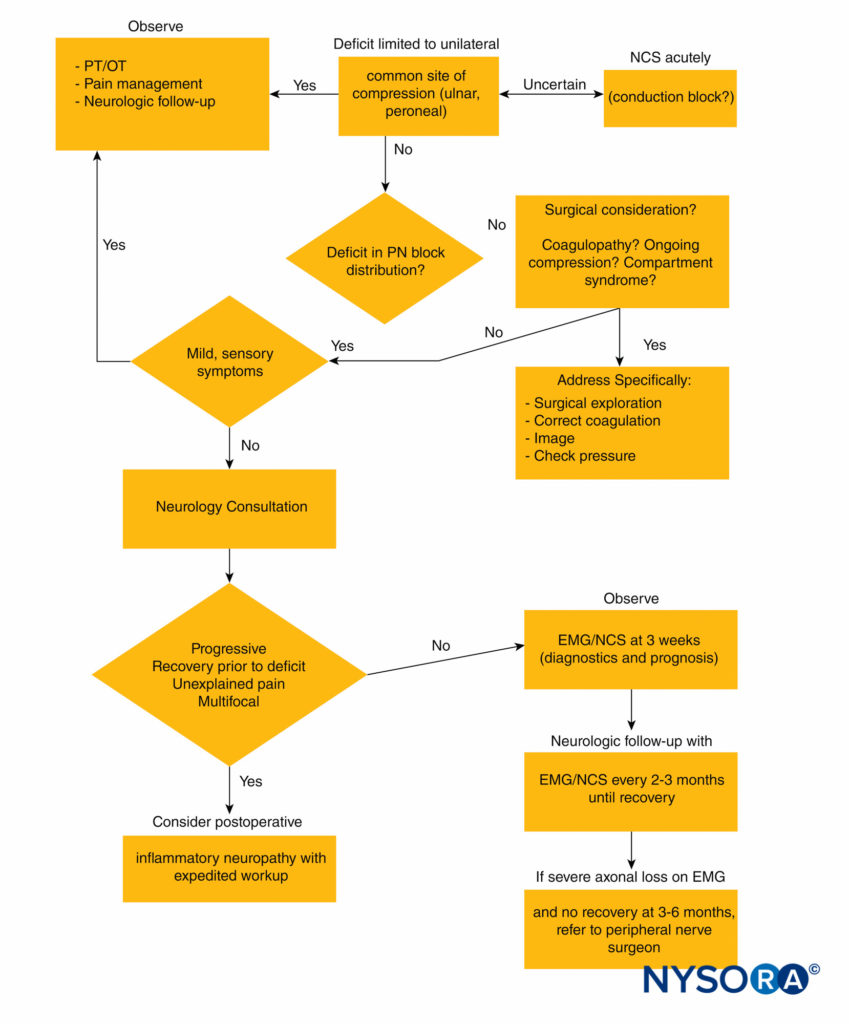
FIGURA 2. Algoritmo diagnostico per la lesione del nervo periferico dopo anestesia regionale. EMG = elettromiografia; NCS = studi di conduzione nervosa; OT = terapia occupazionale; PN = nervo periferico; PT = terapia fisica.
Perla clinica
- Una volta escluso un processo attivo che richiede un intervento urgente per rimuovere qualcosa che causa un danno in corso, sfortunatamente non c'è altro da fare che possa influenzare materialmente l'esito funzionale neurologico del paziente.
Neuropatie infiammatorie postchirurgiche
Esiste una letteratura in evoluzione sui deficit dei nervi periferici postoperatori derivanti da una risposta immunitaria infiammatoria innescata dal fattore di stress della chirurgia o dell'anestesia che prende di mira in modo inappropriato i nervi del sistema nervoso periferico. Le neuropatie infiammatorie postchirurgiche sono il più delle volte multifocali o diffuse all'interno di un arto, ma sono state segnalate anche mononeuropatie. Più comunemente, sono riconosciuti in una distribuzione distinta dall'intervento chirurgico o dall'anestetico regionale, ma possono verificarsi all'interno della stessa distribuzione, il che rende difficile distinguerli da una complicanza chirurgica diretta o da un anestetico regionale. L'esordio temporale dei sintomi neurologici può essere utile per distinguere una neuropatia infiammatoria post-chirurgica da altre cause di PNI.
Classicamente, le neuropatie infiammatorie come la sindrome di Parsonage-Turner (plessopatia brachiale idiopatica), la neuropatia del radicolo-plesso lombosacrale diabetico o non diabetico o la neuropatia infiammatoria post-chirurgica hanno un forte dolore all'esordio, che si sviluppa da ore a settimane dopo un fattore di stress (intervento chirurgico, anestesia, vaccinazione, malattia) . Il dolore è solitamente scarsamente localizzato ma spesso colpisce l'arto prossimale più che l'arto distale. Sebbene possa essere confuso con una radicolopatia, il dolore alla schiena o al collo è assente o limitato e, nel contesto di una complicanza postoperatoria, meccanicamente improbabile. La debolezza si svilupperà successivamente, anche se a volte non viene apprezzata fino a quando il dolore non inizia a migliorare. La debolezza è di distribuzione variabile ma di solito multifocale all'interno dell'arto. Deficit sensoriali accompagnano la debolezza motoria, ma clinicamente il dolore e la debolezza predominano nel quadro clinico e vi sono notevoli limitazioni funzionali legate ad entrambi.
Nei casi che si verificano durante il ricovero postoperatorio, l'analgesia perioperatoria e l'anestesia regionale (in particolare i cateteri per infusione) rendono difficile il riconoscimento dell'insorgenza dolorosa di una neuropatia infiammatoria. Un segnale contestuale di una causa infiammatoria di PNI nell'immediato periodo perioperatorio sarebbe un dolore postoperatorio grave e refrattario inspiegabile, distinto da quello tipicamente atteso o un periodo di buon controllo del dolore seguito dall'emergere di dolore agli arti grave e inspiegabile. Allo stesso modo, un forte dolore in una regione distinta dall'intervento chirurgico o dall'anestetico regionale che progredisce in deficit neurologici suggerirebbe la possibilità di una neuropatia infiammatoria post-chirurgica, così come i sintomi neurologici che emergono, in un arto doloroso, dopo un periodo di documentato ritorno alla funzione neurologica di base postoperatorio. Quando le caratteristiche cliniche sollevano la possibilità di una neuropatia infiammatoria post-chirurgica, è appropriato un consulto neurologico precoce (Tabella 2).
Perla clinica
- Segnali clinici di una possibile neuropatia infiammatoria postoperatoria includono dolore postoperatorio atipico, inspiegabile e refrattario; dolore agli arti grave e disfunzione neurologica emergente dopo un periodo di documentato ritorno alla funzione neurologica di base nel postoperatorio; e deficit neurologici postoperatori progressivi multifocali o difficili da localizzare.
La causa delle neuropatie infiammatorie postchirurgiche è sconosciuta, ma la biopsia dei nervi colpiti nei casi postoperatori ha dimostrato un'infiammazione linfocitica perivascolare coerente con una microvasculite. C'è una significativa perdita assonale con questa forma di PNI e, in quanto tale, il recupero è prolungato. Il processo è solitamente monofasico e la prognosi funzionale è stata segnalata come buona (il 90% ha un buon recupero funzionale entro 3 anni nella sindrome di Parsonage-Turner).
Tuttavia, i pazienti i cui deficit di picco sono gravi o localizzati distalmente possono avere un recupero incompleto. Data l'eziologia infiammatoria patologicamente provata, i corticosteroidi sono meccanicisticamente un razionale come potenziale trattamento (e spesso utilizzati nella pratica), ma non sono stati valutati in studi randomizzati controllati.
Il ruolo dell'elettrofisiologia nella valutazione delle lesioni nervose postoperatorie
Gli studi elettrofisiologici consistono in NCS ed elettromiografia (EMG). Le NCS sono test elettrofisiologici mediante i quali viene stimolato un nervo motorio periferico, sensoriale o misto e viene effettuata una registrazione della risposta motoria o sensoriale. I valori normali sono stati stabiliti utilizzando tecniche standard per definire le anomalie dell'ampiezza della risposta (corrispondente alla perdita assonale) e della velocità di trasmissione lungo un nervo (velocità di conduzione e latenza distale, corrispondente alla demielinizzazione). L'EMG è un test elettrofisiologico in base al quale un piccolo ago di registrazione concentrico (comunemente calibro 26) viene inserito nei muscoli innervati da diverse radici spinali, percorsi attraverso il plesso e nervi periferici per identificare i cambiamenti elettrici caratteristici dei disturbi della trasmissione neurogena, miopatica o neuromuscolare. Pertinente alla PNI, valutando diversi muscoli innervati da diversi nervi periferici, l'EMG può aiutare a localizzare il sito di una lesione nervosa, nonché valutare la gravità della lesione e se si sta verificando il recupero. EMG e NCS sono complementari tra loro e vengono quasi sempre eseguiti insieme e nella pratica comune vengono indicati collettivamente semplicemente come EMG.
Le lesioni nervose (di qualsiasi fonte) possono essere classificate e queste categorie sono importanti dal punto di vista prognostico (Tabella 3). La maggior parte dei PNI perioperatori è correlata alla compressione o alla disfunzione transitoria della mielina in un'area focale del nervo (neuraprassia) senza alcun danno sottostante all'assone nervoso. La neuroaprassia è evidente sulla NCS, quasi immediatamente dopo la lesione e l'insorgenza dei sintomi, come blocco di conduzione: vi è una normale conduzione nervosa distale al sito della lesione e una conduzione anormale prossimale e attraverso il sito della lesione. Pertanto, la NCS può essere utilizzata nel periodo perioperatorio acuto per identificare i pazienti con una neuropatia da compressione comune (di solito ulnare o peroneo) identificando il blocco di conduzione in un sito comune di compressione. Poiché i fasci sensoriali dei nervi sono più suscettibili alle lesioni rispetto ai fasci motori, la maggior parte delle neuropatie da compressione perioperatorie sono a predominanza sensoriale. I pazienti con sintomi prevalentemente sensoriali o evidenza di neuroaprassia (blocco di conduzione) su NCS hanno una prognosi eccellente, con un recupero completo atteso da giorni a un paio di mesi.
TABELLA 3. Classificazione delle lesioni nervose.62
| Patologia | Elettrofisiologia | Prognosi | |
|---|---|---|---|
| neuroaprassia | Disordine mielinico localizzato - Assoni intatti Sensoriali > motori | Blocco di conduzione o rallentamento focale | Ottimo |
| assonotmesi | Integrità assonale e trasporto alterato → Degenerazione walleriana - Tubo endoneurale integro | NCS: bassa ampiezza/motore assente e risposte sensoriali EMG: denervazione | Recupero lento |
| neurotmesi | Strati di tessuto assonale e connettivo (tubo neurale) distrutti | Simile all'assonotmesi, ma senza reinnervazione su studi seriali | Nessun recupero |
Quando il PNI deriva da una compressione più grave o di maggiore durata, da un trauma diretto al nervo (ago, bisturi, sutura, punto metallico o cauterio) o da un'ischemia, la lesione colpisce non solo la guaina mielinica ma anche gli assoni all'interno del nervo . Quando l'assone è danneggiato, il flusso assoplasmatico viene interrotto in modo tale che l'assone non può essere mantenuto e degenererà (degenerazione walleriana). Poiché la degenerazione walleriana si verifica nell'arco di poche settimane dopo la lesione del nervo assonale, i suoi effetti sui test elettrofisiologici non sono evidenti nel periodo perioperatorio acuto e l'entità (gravità) della lesione assonale non può essere determinata in modo acuto con i test elettrodiagnostici. Pertanto, nei casi di PNI funzionalmente significativi che non sono puramente sensoriali o localizzati in un singolo territorio nervoso, il ruolo dei test elettrofisiologici nel periodo perioperatorio acuto è limitato. Potrebbe essere utilizzato per identificare una lesione neurogena preesistente, ma gli effetti elettrofisiologici della lesione assonale acuta del PNI non saranno definitivamente identificabili fino a circa 2 o 3 settimane dopo la lesione. Pertanto, la localizzazione elettrofisiologica definitiva di un PNI e la determinazione della gravità della lesione non possono essere determinate elettrofisiologicamente nell'immediato periodo perioperatorio e possono essere eseguite solo da 2 a 3 settimane dopo la lesione. È importante sottolineare che, sebbene i test elettrofisiologici localizzino una lesione, ne definiscano la gravità e forniscano informazioni prognostiche, non chiariscono la causa della lesione.
Consigli NYSORA
- Studi elettrodiagnostici (EMG e NCS) possono aiutare a confermare la neuroaprassia con blocco della conduzione o definire una malattia preesistente se eseguita in modo acuto.
- La perdita assonale (prognostica) e l'entità di una lesione neurogena perioperatoria saranno meglio chiarite da studi elettrodiagnostici eseguiti 3 settimane dopo la lesione.
La prognosi è molto meno favorevole quando c'è un danno assonale significativo e degenerazione rispetto a quando c'è solo evidenza di neuroaprassia. La lesione assonale può essere classificata a seconda che la lesione sia solo per l'assone (assonotmesi) o che anche gli strati di tessuto connettivo attorno all'assone (il tubo neurale) siano stati danneggiati (neurotmesi), come nella transezione. Gli assoni dei nervi periferici si rigenereranno attraverso il tubo neurale ai loro bersagli originali di innervazione se il tubo neurale è intatto (assonotmesi), ma non nella neurotmesi. Un singolo studio EMG (qui usato collettivamente per fare riferimento a NCS ed EMG) non può differenziare queste categorizzazioni di danno assonale (neanche altri test clinici o di imaging non possono). Tuttavia, nell'assonotmesi, studi seriali eseguiti ogni 2-3 mesi mostreranno la rigenerazione assonale e la reinnervazione nei muscoli adiacenti all'area della lesione inizialmente e procedendo distalmente nel tempo. L'evidenza elettrodiagnostica di reinnervazione e recupero sarà evidente prima del recupero clinico. Nei casi di danno assonale più grave (neurotmesi), non si vedrà alcun recupero negli studi seriali. Quando ciò si verifica, i pazienti devono essere indirizzati a un neurochirurgo dei nervi periferici per le opzioni chirurgiche. Il miglioramento funzionale è migliorato se l'intervento chirurgico si verifica prima di 6-9 mesi dopo il momento della lesione.
Perla clinica
- Le lesioni nervose che non si risolvono 3-5 mesi dopo la valutazione neurologica iniziale dovrebbero indurre a prendere in considerazione la consultazione con un neurochirurgo dei nervi periferici.
CONCLUSIONE
Le lesioni perioperatorie del sistema nervoso centrale o periferico dovute a fattori anestetici o chirurgici sono fortunatamente rare e la maggior parte sono sensoriali predominanti e transitori. Le complicanze neurologiche nel contesto dell'anestesia neuroassiale richiedono una valutazione urgente poiché il ritardo nella diagnosi di EH, ascesso epidurale o lesione del midollo spinale contribuisce alla morbilità a lungo termine. Nel contesto delle lesioni dei nervi periferici, dovrebbe essere presa in considerazione una valutazione neurologica precoce quando i deficit sono gravi, progressivi o difficili da localizzare.
Sfortunatamente, una volta che un processo attivo è stato escluso come causa di un danno neurologico perioperatorio, non c'è nulla che si possa fare per migliorare l'esito neurologico. Tuttavia, la percezione del paziente di una lesione neurologica perioperatoria può essere gestita fornendo un'adeguata educazione del paziente, gestione del dolore, assistenza funzionale attraverso la terapia fisica e occupazionale e un follow-up programmato con consulto neurologico ed elettrofisiologico, se appropriato. Tutti questi dovrebbero essere in atto prima del licenziamento per un paziente con una lesione nervosa perioperatoria significativa. Per i pazienti con solo sintomi sensoriali, dovrebbe essere organizzato un follow-up clinico per garantire la risoluzione dei sintomi.
BIBLIOGRAFIA
- Horlocker TT, Wedel DJ, Rowlingson JC, et al: Anestesia regionale nel paziente che riceve una terapia antitrombotica o trombolitica: American Society of Regional Anesthesia and Pain Medicine Evidence-Based Guidelines (terza edizione). Reg Anesth Pain Med 2010;35(1):64–101.
- Brull R, McCartney CJ, Chan VW, El-Beheiry H: Complicanze neurologiche dopo l'anestesia regionale: stime contemporanee del rischio. Anesth Analg 2007;104(4):965–974.
- Moen V, Dahlgren N, Irestedt L: Gravi complicazioni neurologiche dopo blocchi neuroassiali centrali in Svezia 1990–1999. Anestesiologia 2004;101(4):950–959.
- Warner MA, Warner DO, Matsumoto JY, Harper CM, Schroeder DR, Maxson PM: neuropatia ulnare nei pazienti chirurgici. Anestesiologia 1999;90(1):54–59.
- Jacob AK, Mantilla CB, Sviggum HP, Schroeder DR, Pagnano MW, Hebl JR: Lesione nervosa perioperatoria dopo artroplastica totale dell'anca: rischio di anestesia regionale durante uno studio di coorte di 20 anni. Anestesiologia 2011;115(6):1172–1178.
- Jacob AK, Mantilla CB, Sviggum HP, Schroeder DR, Pagnano MW, Hebl JR: Lesione nervosa perioperatoria dopo artroplastica totale del ginocchio: rischio di anestesia regionale durante uno studio di coorte di 20 anni. Anestesiologia
2011;114(2):311–317. - Welch MB, Brummett CM, Welch TD, et al: Lesioni dei nervi periferici perioperatori: uno studio retrospettivo di 380,680 casi durante un periodo di 10 anni presso una singola istituzione. Anestesiologia 2009;111(3):490–497.
- Warner MA, Warner DO, Harper CM, Schroeder DR, Maxson PM: neuropatia ulnare nei pazienti medici. Anestesiologia 2000;92(2): 613–615.
- Fredrickson MJ, Kilfoyle DH: Analisi delle complicanze neurologiche di 1000 blocchi nervosi periferici guidati da ultrasuoni per chirurgia ortopedica elettiva: uno studio prospettico. Anestesia 2009;64(8):836–844.
- Neal JM: Anatomia e fisiopatologia della lesione del midollo spinale associata all'anestesia regionale e alla medicina del dolore. Reg Anesth Pain Med 2008;33(5):423–434.
- Hebl JR, Horlocker TT, Sorenson EJ, Schroeder DR: l'anestesia regionale non aumenta il rischio di neuropatia postoperatoria nei pazienti sottoposti a trasposizione del nervo ulnare. Anesth Analg 2001;93(6):
1606–1611, sommario. - Neal JM, Bernards CM, Hadzic A, et al: consulenza pratica ASRA sulle complicanze neurologiche nell'anestesia regionale e nella medicina del dolore. Reg Anesth Pain Med 2008;33(5):404–415.
- Staff NP, Engelstad J, Klein CJ, et al: neuropatia infiammatoria post-chirurgica. Cervello 2010;133(10):2866–2880.
- Li SL, Wang DX, Ma D: Ematoma epidurale dopo blocco neuroassiale: un rapporto retrospettivo dalla Cina. Anesth Analg 2010;111(5):1322–1324.
- Ruppen W, Derry S, McQuay H, Moore RA: Incidenza di ematoma epidurale, infezione e danno neurologico in pazienti ostetrici con analgesia/anestesia epidurale. Anestesiologia 2006;105(2):394–399.
- Renck H: Complicazioni neurologiche dei blocchi nervosi centrali. Acta Anaesthesiol Scand 1995;39(7):859–868.
- Aromaa U, Lahdensuu M, Cozanitis DA: Gravi complicazioni associate ad anestesie epidurali e spinali in Finlandia 1987-1993. Uno studio basato sulle richieste di risarcimento dei pazienti [vedi commento]. Acta anestesiolo
Scand 1997;41(4):445–452. - Cook TM, Counsell D, Wildsmith JA: Principali complicazioni del blocco neuroassiale centrale: rapporto sul terzo progetto di audit nazionale del Royal College of Anaesthetists. Fr. J Anaesth 2009;102(2):179–190.
- Hebl JR, Niesen AD: Complicazioni infettive dell'anestesia regionale. Curr Opin Anaesthesiol 2011;24(5):573–580.
- Boukobza M, Haddar D, Boissonet M, Merland JJ: Ematoma subdurale spinale: uno studio su tre casi. Clin Radiol 2001;56(6):475–480.
- Boukobza M, Guichard JP, Boissonet M, et al: Ematoma epidurale spinale: rapporto di 11 casi e revisione della letteratura. Neuroradiologia 1994;36(6):456–459.
- Braun P, Kazmi K, Nogues-Melendez P, Mas-Estelles F, Aparici-Robles F: risultati della risonanza magnetica negli ematomi subdurali ed epidurali spinali. Eur J Radiol 2007;64(1):119–125.
- Ackland HM, Cameron PA, Varma DK, et al: Risonanza magnetica della colonna cervicale in pazienti con trauma in stato di allerta e neurologicamente intatti con dolorabilità persistente della linea mediana e risultati negativi della tomografia computerizzata.
Ann Emerg Med 2011;58(6):521–530. - Boye S, Schumacher J: Diagnosi di ematoma del canale vertebrale mediante mielografia e tomografia computerizzata a spirale in un paziente con un defibrillatore cardioverter impiantabile che controindica la risonanza magnetica. Fr. J Anaesth 2009;103(1):137–138.
- Kreppel D, Antoniadis G, Seeling W: Ematoma spinale: un'indagine sulla letteratura con meta-analisi di 613 pazienti. Neurochirurgia Rev 2003;26(1):1–49.
- Vandermeulen EP, Van Aken H, Vermylen J: anticoagulanti e anestesia spinaleepidurale. Anesth Analg 1994;79(6):1165–1177.
- Consulenza pratica per la prevenzione, la diagnosi e la gestione delle complicanze infettive associate alle tecniche neuroassiali: un rapporto dell'American Society of Anesthesiologists Task Force on Infectious
Complicanze associate alle tecniche neuroassiali. Anestesiologia 2010;112(3):530–545. - Rigamonti D, Liem L, Wolf AL, et al: Ascesso epidurale nel rachide cervicale. Monte Sinai J Med 1994;61(4):357–362.
- Reihsaus E, Waldbaur H, Seeling W: Ascesso epidurale spinale: una meta-analisi di 915 pazienti. Neurochirurgia Rev 2000;23(4):175–204; discussione 205.
- Silver JR, Buxton PH: Ictus spinale. Cervello 1974;97(3):539–550.
- Mutch JA, Johansson JE: occlusione dell'arteria di Adamkiewicz dopo artroplastica dell'anca e del ginocchio. J Artroplastica 2011;26(3):e505–e508.
- Charles YP, Barbe B, Beaujeux R, Boujan F, Steib JP: Rilevanza della posizione anatomica dell'arteria Adamkiewicz nella chirurgia della colonna vertebrale. Surg Radiol Anat 2011;33(1):3–9.
- Singh U, Silver JR, Welply NC: infarto ipotensivo del midollo spinale. Paraplegia 1994;32(5):314–322.
- Tsai YD, Liliang PC, Chen HJ, Lu K, Liang CL, Wang KW: Sindrome dell'arteria spinale anteriore dopo vertebroplastica: un caso clinico. Colonna vertebrale (Phila Pa 1976) 2010;35(4):E134–E136.
- Huntoon MA: Anatomia dei forami intervertebrali cervicali: arterie vulnerabili e lesioni neurologiche ischemiche dopo iniezioni epidurali transforaminali. Dolore 2005;117(1–2):104–111.
- Horlocker TT, McGregor DG, Matsushige DK, Schroeder DR, Besse JA: Una revisione retrospettiva di 4767 anestetici spinali consecutivi: complicazioni del sistema nervoso centrale. Gruppo di risultati perioperatori. Anesth
Analg 1997;84(3):578–584. - Rathmell JP, Michna E, Fitzgibbon DR, Stephens LS, Posner KL, Domino KB: lesioni e responsabilità associate alle procedure cervicali per il dolore cronico. Anestesiologia 2011;114(4):918–926.
- Lawton MT, Porter RW, Heiserman JE, Jacobowitz R, Sonntag VK, Dickman CA: Gestione chirurgica dell'ematoma epidurale spinale: relazione tra tempismo chirurgico e esito neurologico. J Neurosurg 1995;83(1):1–7.
- Cheshire WP, Santos CC, Massey EW, Howard JF Jr: Infarto del midollo spinale: eziologia ed esito. Neurologia 1996;47(2):321–330.
- Salvador de la Barrera S, Barca-Buyo A, Montoto-Marques A, Ferreiro- Velasco ME, Cidoncha-Dans M, Rodriguez-Sotillo A: Infarto del midollo spinale: prognosi e guarigione in una serie di 36 pazienti. Midollo spinale
2001;39(10):520–525. - Kumral E, Polat F, Gulluoglu H, Uzunkopru C, Tuncel R, Alpaydin S: Ictus ischemico spinale: risultati clinici e radiologici e risultati a breve termine. Eur J Neurol 2011;18(2):232–239.
- Bracken MB: steroidi per lesioni acute del midollo spinale. Sistema di database Cochrane Rev 2012;1:CD001046.
- Bracken MB, Shepard MJ, Collins WF, et al: uno studio randomizzato e controllato di metilprednisolone o naloxone nel trattamento della lesione acuta del midollo spinale. Risultati del secondo studio nazionale sulle lesioni del midollo spinale acuto. N Inglese J Med 1990;322(20):1405–1411.
- Bracken MB, Shepard MJ, Holford TR, et al: somministrazione di metilprednisolone per 24 o 48 ore o tirilazad mesilato per 48 ore nel trattamento della lesione acuta del midollo spinale. Risultati della Terza Nazionale
Studio controllato randomizzato per lesione acuta del midollo spinale. Studio nazionale sulle lesioni del midollo spinale acuto. JAMA 1997;277(20):1597–1604. - Markandaya M, Stein DM, Menaker J: Opzioni di trattamento acuto per le lesioni del midollo spinale. Curr Treat Options Neurol 2012 Feb 3. [Epub prima della stampa]
- Terapia farmacologica dopo lesione acuta del midollo spinale cervicale. Neurochirurgia 2002;50(3 Suppl):S63–S72.
- Sayer FT, Kronvall E, Nilsson OG: Trattamento con metilprednisolone nella lesione acuta del midollo spinale: il mito sfidato attraverso un'analisi strutturata della letteratura pubblicata. Colonna vertebrale J 2006;6(3):335–343.
- Short DJ, El Masry WS, Jones PW: metilprednisolone ad alte dosi nella gestione della lesione acuta del midollo spinale: una revisione sistematica da una prospettiva clinica. Midollo spinale 2000;38(5):273–286.
- Selander D, Brattsand R, Lundborg G, Nordborg C, Olsson Y: Anestetici locali: importanza della modalità di applicazione, concentrazione e adrenalina per la comparsa delle lesioni nervose. Uno studio sperimentale di
degenerazione assonale e danno della barriera dopo iniezione intrafascicolare o applicazione topica di bupivacaina (Marcain). Acta Anaesthesiol Scand 1979;23(2):127–136. - Lundborg G, Dahlin LB: Anatomia, funzione e fisiopatologia dei nervi periferici e compressione nervosa. Hand Clin 1996;12(2): 185–193.
- Kalichman MW, Calcutt NA: blocco di conduzione indotto da anestetico locale e danno alle fibre nervose nei ratti diabetici con streptozotocina. Anestesiologia 1992;77(5):941–947.
- Winfree CJ, Kline DG: lesioni nervose da posizionamento intraoperatorie. Surg Neurol 2005;63(1):5–18; discussione 18.
- Horlocker TT, Kufner RP, Bishop AT, Maxson PM, Schroeder DR: il rischio di parestesie persistenti non aumenta con il blocco ascellare ripetuto. Anesth Analg 1999;88(2):382–387.
- Kretschmer T, Heinen CW, Antoniadis G, Richter HP, Konig RW: lesioni nervose iatrogene. Neurochirurgia Clinica N Am 2009;20(1):73–90, vii.
- Borgeat A, Ekatodramis G, Kalberer F, Benz C: Complicanze acute e non acute associate al blocco interscalenico e alla chirurgia della spalla: uno studio prospettico. Anestesiologia 2001;95(4):875–880.
- Urban MK, Urquhart B: Valutazione dell'anestesia del plesso brachiale per la chirurgia dell'arto superiore. Reg Anesth 1994;19(3):175–182.
- Ben-David B: Complicazioni del blocco periferico. Anesthesiol Clin Nord America 2002;20(3):695–707.
- Ahn KS, Kopp SL, Watson JC, Scott KP, Trousdale RT, Hebl JR: neuropatia infiammatoria postchirurgica. Reg Anesth Pain Med 2011;36(4): 403–405.
- Laughlin RS, Dyck PJ, Watson JC, et al: neuropatia infiammatoria omolaterale dopo chirurgia dell'anca. Mayo Clin Proc 2014;89:454–461.
- van Alfen N, van Engelen BG: Lo spettro clinico dell'amiotrofia nevralgica in 246 casi. Cervello 2006;129(Pt 2):438–450.
- Dyck PJ, Windebank AJ: neuropatie del radicoloplesso lombosacrale diabetico e non diabetico: nuove intuizioni sulla fisiopatologia e sul trattamento. Nervo muscolare 2002;25(4):477–491.
- Sunderland S: L'anatomia e la fisiologia della lesione nervosa. Nervo muscolare 1990;13(9):771–784.
- Robinson LR: Lesione traumatica ai nervi periferici. Nervo muscolare 2000;23(6):863–873.
- Aminoff MJ: test elettrofisiologici per la diagnosi delle lesioni dei nervi periferici. Anestesiologia 2004;100(5):1298–1303.
- Gilchrist JM, Sachs GM: studi elettrodiagnostici nella gestione e prognosi dei disturbi neuromuscolari. Nervo muscolare 2004;29(2): 165–190.
- Kandenwein JA, Kretschmer T, Engelhardt M, Richter HP, Antoniadis G: Interventi chirurgici per lesioni traumatiche del plesso brachiale: uno studio retrospettivo di 134 casi. J Neurosurg 2005; 103 (4): 614–621.