Steven L. Orebaugh e Kyle R. Kirkham
INTRODUZIONE
L'ecografia (US) come mezzo per guidare il blocco nervoso periferico (PNB) è stata esplorata per la prima volta dagli anestesisti dell'Università di Vienna a metà degli anni '1990. Sebbene i radiologi avessero utilizzato la tecnologia a ultrasuoni per guidare gli aghi per la biopsia, l'applicazione di questa modalità di imaging per PNB era nuova a quel tempo. È stata dimostrata l'utilità degli ultrasuoni per facilitare una vasta gamma di tecniche di anestesia regionale, inclusi il plesso brachiale e i blocchi femorali. Un decennio dopo, i colleghi dell'Università di Toronto, in Canada, iniziarono ad abbracciare questa tecnologia, dimostrandone ulteriormente l'utilità e descrivendo in dettaglio la sonoanatomia del plesso brachiale. Nel frattempo si sono verificati numerosi progressi tecnologici, tra cui piattaforme ecografiche più piccole e mobili, una migliore risoluzione e software di riconoscimento dell'ago, che hanno portato tutti cumulativamente a una maggiore utilità degli ultrasuoni al posto letto da parte degli anestesisti.
VANTAGGI DELLA GUIDA A ULTRASUONI
Le tecniche basate sull'anatomia di superficie precedentemente utilizzate, come la stimolazione nervosa, la palpazione dei punti di riferimento, i "clic" fasciali, le parestesie e gli approcci transarteriosi, non consentivano il monitoraggio della disposizione dell'anestetico locale iniettato. La guida ecografica, tuttavia, offre una serie di importanti vantaggi pratici per il blocco nervoso. L'ecografia consente la visualizzazione dell'anatomia della regione di interesse. Ciò consente una guida più informata per il percorso dell'ago verso il bersaglio evitando strutture che potrebbero essere danneggiate dall'ago. L'ecografia consente anche la visualizzazione della punta dell'ago mentre passa attraverso i tessuti, confermando l'allineamento con il percorso previsto, riducendo ancora una volta la probabilità di traumi accidentali dell'ago a strutture non intenzionali. Forse la cosa più importante, l'imaging a ultrasuoni in tempo reale consente la visualizzazione continua dell'erogazione della soluzione di anestetico locale per garantire una distribuzione corretta, con la possibilità di regolare la posizione della punta dell'ago secondo necessità per ottimizzare la distribuzione dell'anestetico locale.
Introduzione della guida ecografica in ambito regionale anestesia ha portato al perfezionamento di molte tecniche di blocco nervoso, a un uso più ampio della PNB e a una maggiore accettazione da parte dei colleghi chirurghi e dei pazienti.
ULTRASUONI ED ECOANATOMIA
Il PNB ecoguidato può essere suddiviso in due aspetti fondamentali: le strutture di imaging nel piano di sezione, incluso il nervo bersaglio, e la guida dell'ago. La comprensione e il riconoscimento di strutture anatomiche tridimensionali su un'immagine bidimensionale richiede una formazione nella tecnologia e nel riconoscimento del pattern sononatomico (Tabella 1).
TABELLA 1. Ottimizzazione della visualizzazione sonoanatomica.
| Scegliere trasduttore/frequenza appropriati Comprendere le relazioni anatomiche sottostanti Applicare vari gradi di pressione con il trasduttore Allineare il trasduttore con il bersaglio nervoso sottostante Ruota il trasduttore per ottimizzare l'immagine Inclinare il trasduttore per ottimizzare l'immagine |
Poiché il riconoscimento anatomico rimane essenziale per posizionare i blocchi, anche con una guida visiva in tempo reale, le linee guida della società specializzata per la formazione di residenti e borsisti continuano a sottolineare l'importanza della dissezione anatomica e della formazione anatomica grossolana come componente intrinseca dell'apprendimento dell'anestesia regionale ecoguidata (UGRA). In uno studio condotto su una rotazione dell'anestesia regionale di 1 mese, i residenti hanno dimostrato un riconoscimento notevolmente migliorato delle strutture rilevanti nei siti di diversi PNB diversi, utilizzando l'imaging a ultrasuoni. In una valutazione dell'istruzione a blocchi interscalenici guidati da ultrasuoni, i residenti hanno dimostrato una maggiore efficienza del riconoscimento della sonoanatomia man mano che la loro esperienza nel corso della rotazione aumentava.
Anche metodi di formazione più innovativi hanno mostrato risultati promettenti. È stato dimostrato che l'integrazione di un programma anatomico nel software di una macchina ad ultrasuoni al posto letto migliora i punteggi di una prova scritta di anatomia. Dopo l'esposizione a una presentazione di anatomia multimediale, i residenti e gli anestesisti di comunità hanno dimostrato una maggiore conoscenza dell'anatomia degli ultrasuoni in un post-test, sebbene non siano stati in grado di migliorare i punteggi di un esame pratico della sonoanatomia su modelli dal vivo. Tuttavia, il legame ottimale tra conoscenza anatomica e riconoscimento di pattern anatomici bidimensionali su ultrasuoni non è stato ancora adeguatamente esplorato.
Alcuni principi di base dell'ottimizzazione di un'immagine ecografica sono applicabili a tutti i blocchi nervosi. Ad esempio, l'ecografia richiede una comprensione della meccanica e dell'ergonomia. I principianti sono soggetti a errori quali affaticamento della sonda, inversione dell'orientamento della sonda e preparazione inadeguata dell'attrezzatura. Per ottimizzare l'immagine ecografica è stata consigliata la PARTE mnemonica (pressione, allineamento, rotazione, inclinazione). La pressione è necessaria per ridurre al minimo la distanza dal bersaglio e comprimere i tessuti adiposi sottocutanei sottostanti. L'allineamento si riferisce al posizionamento del trasduttore in una posizione sopra l'estremità (o tronco) in cui ci si aspetta che il nervo sottostante si trovi nel campo visivo. La rotazione consente di ottimizzare la vista della struttura target. L'inclinazione aiuta a portare la faccia della sonda in una disposizione perpendicolare con il target sottostante per massimizzare il numero di echi di ritorno e quindi fornire l'immagine migliore (Figure 1 ). Una discussione approfondita sull'ottimizzazione dell'imaging a ultrasuoni è discussa in "Ottimizzazione di un'immagine ecografica".
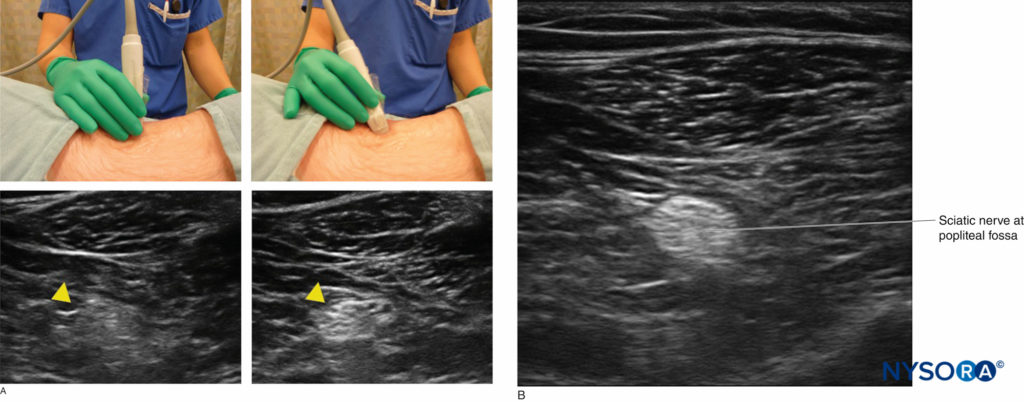
FIGURA 1. È necessaria una regolazione fine dell'inclinazione della sonda per ottimizzare il ritorno dell'eco dalla struttura target e migliorare la risoluzione dell'immagine (le punte di freccia gialle indicano il nervo sciatico nella fossa poplitea).
Consigli NYSORA
- Per ottimizzare l'immagine ecografica è stata consigliata la PARTE mnemonica: pressione, allineamento, rotazione, inclinazione.
- Il riconoscimento e la comprensione della sonoanatomia richiede la conoscenza dell'anatomia tridimensionale sottostante.
- La visualizzazione ottimale del nervo bersaglio richiede un'adeguata pressione del trasduttore, l'allineamento con il nervo e la rotazione e l'inclinazione della sonda per mettere a punto l'immagine.
OTTIMIZZAZIONE DELL'IMMAGINE DEL NERVO E DELL'AGO CON SCENARI CLINICI A ULTRASUONI
L'imaging del nervo può essere eseguito in posizione dell'asse corto (faccia della sonda perpendicolare all'asse del nervo) o dell'asse lungo (faccia della sonda parallela all'asse del nervo) (Figure 2 ).
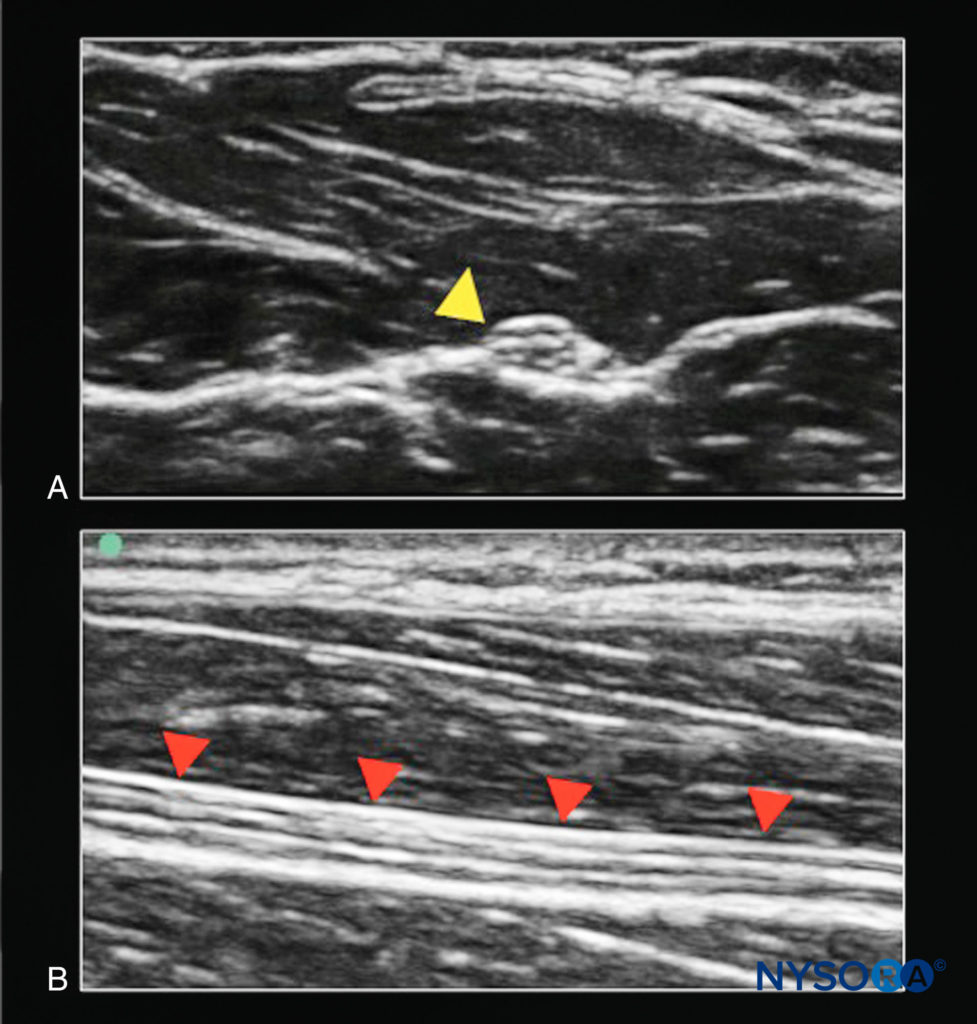
FIGURA 2. Il nervo mediano. A: Sezione trasversale (struttura bersaglio fuori piano rispetto al raggio di ultrasuoni; punta di freccia gialla). B: Sezione longitudinale (struttura bersaglio in piano al fascio di ultrasuoni; punte di freccia rosse).
Spesso è più facile riconoscere l'elemento neurale rotondo, spesso iperecogeno, con l'imaging dell'asse corto, soprattutto per un principiante. Poiché la maggior parte dei blocchi nervosi sono condotti alle estremità, questo orientamento si traduce in una posizione del trasduttore trasversale, attraverso l'asse lungo del braccio o della gamba. In generale, la comprensione del decorso dei nervi, basata sulla conoscenza dell'anatomia macroscopica, consente di allineare e ruotare il trasduttore perpendicolarmente al decorso del nervo regolando successivamente l'inclinazione come descritto in precedenza per ottimizzare l'immagine.
Una volta identificati il nervo e l'anatomia circostante, è possibile scegliere un percorso dell'ago in modo che venga ripreso in piano (ago parallelo all'asse lungo della sonda) o fuori piano (ago perpendicolare all'asse lungo della sonda) rispetto al fascio di ultrasuoni. Sebbene nessuno dei due metodi si sia dimostrato superiore né per il successo del blocco né per la sicurezza del paziente, l'approccio preferito può variare in base a considerazioni anatomiche o tecniche. Tuttavia, con l'imaging in piano, è possibile mantenere un'immagine dell'intero ago, inclusa la punta, anche se può essere difficile mantenere l'ago interamente nel piano di visualizzazione del trasduttore. Questo metodo è particolarmente utile durante l'istruzione, poiché il supervisore ha una visualizzazione continua della punta dell'ago mentre avanza attraverso i tessuti.
Durante l'imaging fuori piano, l'osservatore è in grado di vedere solo la sezione trasversale dell'ago, che appare come un piccolo punto iperecogeno, su qualsiasi piano per tutta la sua lunghezza, per cui è molto più difficile distinguere la punta dall'asta .
Tuttavia, guidare la punta dell'ago verso il bersaglio mantenendo l'intero ago nel piano di imaging può essere difficile (Tabella 2).
TABELLA 2. Ottimizzazione dell'imaging dell'ago con gli ultrasuoni.
| Utilizzare un angolo di avvicinamento poco profondo, se possibile "Tacco" il trasduttore per rendere la faccia più parallela l'ago Ruotare il trasduttore per assicurarsi che l'intero ago sia visibile Inclinare il trasduttore secondo necessità Scegli un ago "ecogeno". Applicare il software di riconoscimento dell'ago, se disponibile L'"idrolocalizzazione" può aiutare ad accertare la posizione della punta dell'ago |
Adeguata regolazione dell'altezza del letto e posizionamento ergonomico degli ultrasuoni in modo che gli occhi dell'operatore possano spostarsi facilmente e rapidamente dall'immagine al campo (Figure 3 ), in cui è possibile garantire l'allineamento dell'ago con l'asse lungo della sonda, è vantaggioso. È sorprendentemente facile per il trasduttore allontanarsi dal piano dell'ago mentre la vista è fissata sullo schermo a ultrasuoni. Ciò è più probabile se l'operatore ha la sonda e l'ago allineati perpendicolarmente al proprio asse di visualizzazione, invece di allineare l'ago e la sonda con l'asse di visualizzazione.
In uno studio su studenti di medicina alle prime armi che imparavano le basi dell'UGRA, Speer et al hanno scoperto che i soggetti richiedevano meno tempo per localizzare il bersaglio ed erano più in grado di mantenere l'ago visualizzato in piano sull'immagine ecografica, quando occhi, ago, sonda e lo schermo di visualizzazione erano allineati. Le guide dell'ago possono anche consentire una migliore imaging dell'ago durante l'avvicinamento al bersaglio, sebbene sia stato svolto più lavoro nell'accesso vascolare. Uno svantaggio delle guide dell'ago è che limitano il movimento dell'ago su un piano, il che potrebbe non essere sempre desiderabile.
I nervi in asse corto hanno un aspetto che è in una certa misura determinato dalla loro vicinanza al neuroassi. Sebbene nella maggior parte delle aree i nervi siano rotondi, possono apparire fusiformi, come il nervo muscolocutaneo nel braccio prossimale, o di forma ovale, come il nervo sciatico nella regione infraglutea. In stretta associazione con la colonna vertebrale, i nervi e le radici nervose sono costituiti principalmente da tessuto neurale, con un minimo di tessuto connettivo. Poiché il tessuto neurale appare ipoecogeno all'ecografia, mentre il tessuto connettivo tra i fascicoli è iperecogeno, i nervi vicino alla nevassi appaiono come noduli scuri.
Man mano che i nervi scorrono perifericamente, il numero dei fascicoli aumenta, sebbene diminuiscano di dimensioni, mentre aumenta anche la quantità di tessuto connettivo. Questi cambiamenti portano a un aspetto a "nido d'ape" sempre più complesso sugli ultrasuoni nella visualizzazione dell'asse corto (Figure 4 ). Sfortunatamente, a causa dei limiti tecnologici delle attuali macchine a ultrasuoni, il numero e la disposizione dei fascicoli all'interno di un nervo periferico potrebbero non essere rappresentati accuratamente.
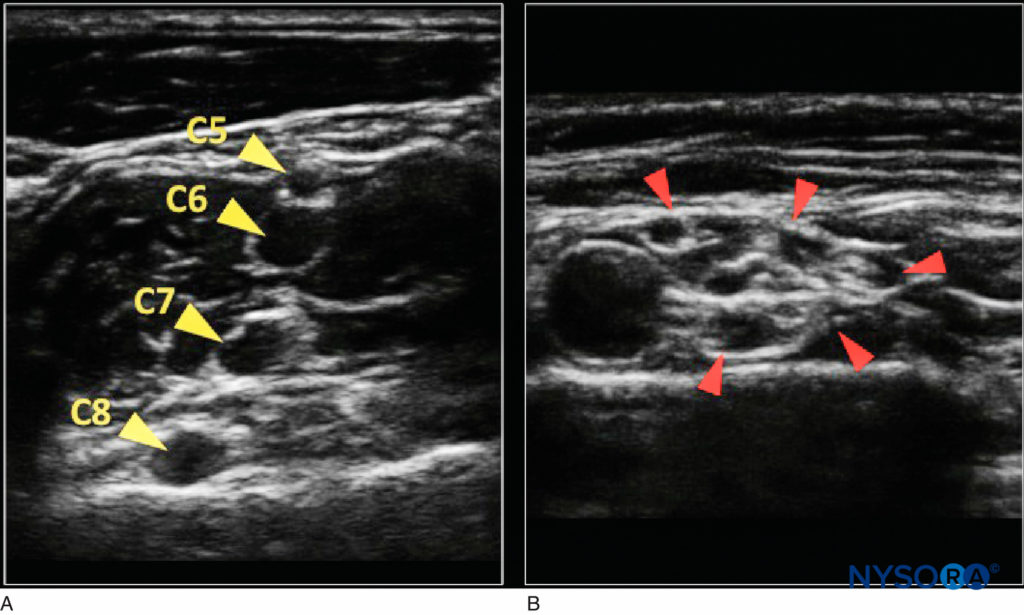
FIGURA 4. A: Aspetto del nervo prossimale nel solco interscalenico (le frecce gialle indicano le radici nervose) con poco tessuto connettivo ecogeno. B: Più distale nella fossa sopraclavicolare (le frecce rosse indicano i tronchi del plesso brachiale) con aspetto “a nido d'ape”.
Mentre diversi tessuti hanno aspetti caratteristici agli ultrasuoni, il nervo potrebbe non essere facilmente distinto dal tendine quando entrambi sono visti in asse corto. Tuttavia, utilizzando la conoscenza dell'anatomia, l'operatore può seguire il corso della struttura caudale-cefalo per determinare la natura della struttura rappresentata. I tendini alla fine scompariranno nel muscolo di origine o si inseriranno nelle ossa. Un buon esempio è il nervo mediano al polso, dove è difficile distinguere la struttura neurale dai numerosi tendini nel tunnel carpale, rispetto al centro dell'avambraccio, dove il nervo è visivamente molto più distinto, poiché è situato tra due strati di muscolo, senza tendini circostanti (Figure 5
).
Un aspetto importante della preparazione per un blocco è ottenere il piano di imaging preferito durante la pianificazione del percorso per il percorso dell'ago. L'operatore deve assicurarsi che non vi siano strutture vulnerabili nel percorso previsto, come un vaso sanguigno, la pleura o strutture sensibili come il periostio.
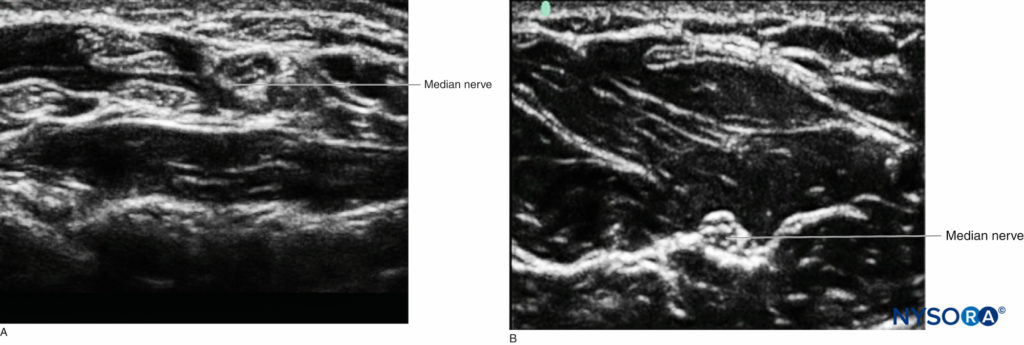
FIGURA 5. A: Il nervo mediano al polso tra molti tendini all'interno del tunnel carpale. B: Il nervo mediano più prossimale nell'avambraccio circondato da muscoli.
Questo processo viene definito "scansione preblocco", che può contribuire alla sicurezza del paziente e bloccare il successo. Oltre all'imaging bidimensionale, l'impostazione color Doppler dovrebbe essere utilizzata per identificare piccoli vasi, che possono essere facilmente confusi con le strutture nervose (in particolare le radici) se osservati in asse corto (Figure 6 ).
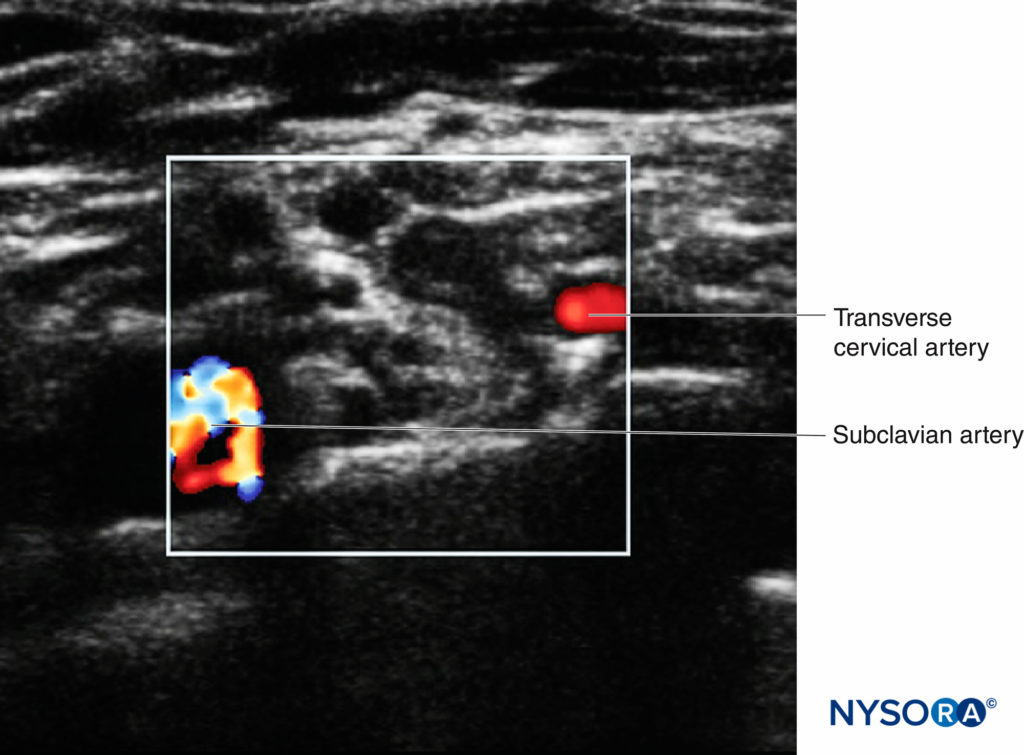
FIGURA 6. Il plesso brachiale sopraclavicolare con la vascolarizzazione circostante. L'arteria succlavia è indicata dall'area multicolore, con l'arteria cervicale trasversale indicata dall'area rossa.
Per mantenere la visuale della punta dell'ago e dello stelo, possono essere utilizzate diverse tecniche. Più l'ago è parallelo alla superficie della sonda, più echi vengono ritrasmessi al trasduttore, ottenendo un'immagine superiore. Ciò può essere ottenuto facendo rientrare delicatamente la pelle nel sito di inserimento dell'ago o spostando il sito di inserimento più lontano dalla sonda, ottenendo un angolo di inserimento meno acuto (Figure 7 ). La limitazione di questo approccio è che potrebbe essere necessario un ago più lungo e più tessuto viene attraversato lungo il percorso verso il bersaglio.
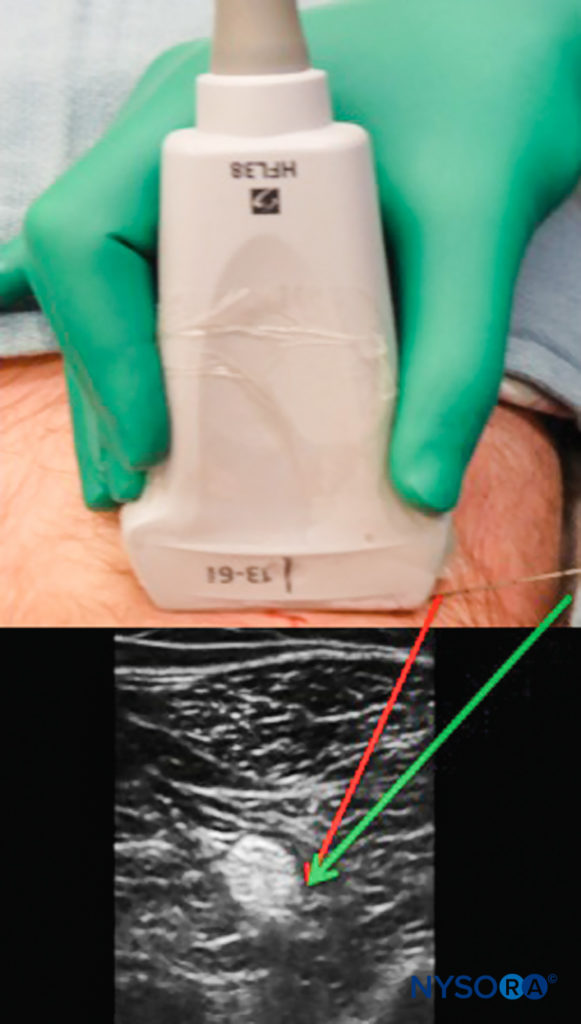
FIGURA 7. L'inserimento dell'ago direttamente accanto alla sonda ecografica può causare una visualizzazione difficile. L'inserimento a distanza dalla sonda consente un approccio meno profondo, consentendo un ritorno dell'eco più forte e una migliore visualizzazione dell'ago (freccia verde) sebbene attraversi un percorso tissutale più lungo.
Un'altra tecnica, denominata sbandamento, consiste nel premere sul bordo del trasduttore opposto al lato di inserimento dell'ago, il che si traduce in un allineamento più parallelo della superficie della sonda con l'ago. Inoltre, l'ago stesso può essere strutturalmente modificato per aumentarne l'ecogenicità; le versioni disponibili in commercio di questi "aghi ecogeni" di solito sono state incise sulla superficie dell'asta con tratteggi incrociati per creare un maggiore grado di dispersione del fascio di ultrasuoni.
Come notato, le guide dell'ago possono essere utilizzate per migliorare l'imaging dell'ago, sebbene a scapito del vincolo del movimento. Sono stati creati anche sistemi di guida laser per migliorare l'allineamento, con un discreto successo. Un nuovo metodo alternativo per il posizionamento mirato dell'ago e la somministrazione di anestetico locale utilizza un sistema di guida GPS, che può essere particolarmente utile quando l'imaging è reso difficile da angoli ripidi dell'ago. Il software proprietario per la localizzazione dell'ago ad angoli ripidi utilizza l'imaging composto spaziale, che combina immagini di diversi angoli di insonazione. Ciò si traduce in una migliore imaging dell'ago con aghi a blocco sia standard che ecogeni. Infine, la localizzazione della punta dell'ago può essere ottenuta con "idrolocalizzazione", in cui vengono iniettati piccoli volumi di soluzione di destrosio o anestetico locale per visualizzare la diffusione all'interno dei tessuti, che in genere rivela la posizione della punta dell'ago.
Consigli NYSORA
• Diverse tecniche diverse sono utili per mantenere la visualizzazione dell'ago con l'imaging ecografico, compreso l'uso di un angolo di approccio poco profondo, il "spostamento" del trasduttore, aghi ecogeni disponibili in commercio e misure fisiche come la rotazione e l'inclinazione del trasduttore.
• Inoltre, è possibile utilizzare l'idrolocalizzazione con una piccola iniezione di fluido per facilitare la localizzazione dell'ago in situazioni difficili.
• L'ago deve essere fatto avanzare con visualizzazione continua per evitare lesioni alle strutture anatomiche.
• Una scansione preblocco, compreso l'uso della funzione color Doppler, aiuta a pianificare il percorso dell'ago.
• Il passaggio della punta dell'ago attraverso i piani fasciali che aderiscono a un nervo dovrebbe essere condotto in modo tangenziale per evitare di impalare il nervo quando la fascia “rilascia” l'ago.
GUIDA SICURA DELL'AGO CON ULTRASUONI
Nell'avanzare la punta dell'ago verso il nervo mirato con l'imaging in piano, si dovrebbe essere cauti e deliberati, cercando di mantenere l'ago sempre in piano (Tabella 3). La punta dell'ago in piano è caratterizzata da un doppio ritorno di eco generato dalla superficie smussata.
TABELLA 3. Consigli di sicurezza durante i blocchi nervosi guidati da ultrasuoni.
| Eseguire una "scansione preblocco" per accertare l'anatomia Utilizzare l'impostazione color Doppler per identificare i vasi sanguigni Non far avanzare l'ago se la punta non è localizzata L'"idrodissezione" può essere utilizzata per delineare l'anatomia Quando si spinge attraverso la fascia verso un nervo, avvicinarsi tangenzialmente Passa attraverso la fascia lentamente, in attesa di un "pop" o improvviso rilasciare Riottimizza l'immagine della punta dell'ago dopo il passaggio fascia In caso di dubbio sull'interfaccia ago-nervo, delicatamente spostare l'ago per accertarsi che il nervo non lo faccia muoviti con esso (indicando che la punta è incorporata all'interno epinevrio) |
L'ecografia viene riflessa sia dalla parete superficiale che da quella profonda dell'ago, determinando un aspetto a gradino che può essere distinto dal singolo ritorno dello stelo dell'ago. Un leggero movimento di scorrimento della sonda a ultrasuoni può aiutare a confermare la posizione della punta mentre il raggio cammina su e giù per l'asta dell'ago.
Comunemente, si incontrano piani fasciali che resistono all'avanzamento dell'ago. Questi strati duri di tessuto connettivo possono essere visti come "tenda" quando la punta spinge contro di essi, cedendo improvvisamente e tornando alla loro posizione originale. Questo brusco cambiamento può avere due conseguenze: in primo luogo, l'ago può avanzare rapidamente e inavvertitamente oltre l'intento dell'operatore (a meno che ciò non sia previsto); in secondo luogo, l'ago potrebbe spostarsi fuori piano. A questo punto, il movimento in avanti dell'ago dovrebbe essere interrotto fino a quando l'immagine in piano non sarà nuovamente ottimizzata. È comune che tali piani fasciali si trovino appena superficiali o adiacenti al bersaglio nervoso, come nel solco interscalenico, nel fascio neurovascolare ascellare o nel nervo femorale. Questo movimento può effettivamente portare l'ago a spingersi in avanti e ad incontrare il nervo se non è previsto il cedimento improvviso del piano fasciale. Per questo motivo, si raccomanda di avvicinare i nervi tangenzialmente, proiettando l'avanzamento dell'ago in modo che la sua punta si trovi adiacente al nervo, ma non puntando al suo centro.
La resistenza incontrata da questi piani facciali duri può anche reindirizzare inavvertitamente un ago quando viene avvicinato con un angolo poco profondo. Aumentare temporaneamente l'angolo dell'ago può consentire un passaggio più facile e controllato. Sfortunatamente, la guida ecografica non sempre produce immagini nitide che consentano di distinguere il tessuto nervoso dal tessuto circostante. In tali situazioni, quando l'ago è avanzato, è possibile utilizzare l'"idrodissezione" (iniezione deliberata di fluido nei piani dei tessuti) per separare le strutture, consentendo una migliore chiarezza nell'imaging, con destrosio o soluzione di anestetico locale.
Inoltre, è possibile osservare il comportamento dei tessuti mentre l'ago viene avanzato per aiutare a localizzare la punta dell'ago in relazione al tessuto neurale.
Mentre una volta si riteneva che il contatto con un nervo con la punta dell'ago avrebbe probabilmente provocato parestesia, e, in effetti, questa era considerata una tecnica di localizzazione del nervo appropriata, ora sappiamo che la parestesia non viene provocata in modo coerente con il contatto con il nervo dell'ago. Ciò sottolinea la necessità di localizzare accuratamente la punta dell'ago con l'imaging a ultrasuoni e di utilizzare un monitoraggio aggiuntivo durante i PNB per rilevare relazioni pericolose tra ago e nervo, come la stimolazione nervosa e il monitoraggio della pressione di iniezione.
Consigli NYSORA
- La deposizione della soluzione di anestetico locale deve essere ottimizzata sfruttando i piani fasciali o le guaine che possono contenere o incanalare il farmaco attorno al nervo
e longitudinalmente lungo il suo corso. - Per i nervi senza tale contenimento fasciale locale, la soluzione deve essere iniettata in modo circonferenziale per accelerare l'insorgenza del blocco.
UTILIZZO DELLA STIMOLAZIONE DEL NERVO PERIFERICO CON ULTRASUONI
Lo stimolatore dei nervi periferici (PNS) è stato per diversi decenni uno strumento standard nella localizzazione dei nervi durante le PNB, con un alto grado di successo e un basso tasso di complicanze. Tuttavia, l'adozione diffusa di ecografia ha messo in discussione il suo ruolo attuale nella PNB. Oltre un decennio fa, Perlas e colleghi hanno valutato la sensibilità dei nervi periferici degli arti superiori alla stimolazione dei nervi periferici durante l'imaging ecografico del contatto tra ago e nervo. Gli autori hanno riferito che, nonostante la visualizzazione della punta dell'ago che incideva la superficie del nervo, con lo stimolatore impostato per erogare una corrente di 0.5 mA o meno, non si verificava alcuna stimolazione motoria nel 25% dei casi.
Sono stati condotti diversi studi, con una varietà di blocchi diversi, per valutare l'utilità di questo strumento di localizzazione in associazione con UGRA. Sia per il blocco sopraclavicolare, per il blocco ascellare o per il blocco femorale, gli autori hanno dimostrato che l'aggiunta dello stimolatore nervoso come strumento di localizzazione del nervo durante il PNB ecoguidato non ha contribuito al successo.
Inoltre, Robards et al hanno scoperto che l'assenza di una risposta motoria al SNP tra 0.2 e 0.5 mA durante il blocco popliteo non escludeva sempre il posizionamento dell'ago all'interno del nervo e che la stimolazione potrebbe effettivamente portare a una manipolazione non necessaria dell'ago nel nervo.
Tuttavia, lo stimolatore può essere utile in aggiunta all'UGRA per ragioni diverse dalla garanzia dell'efficacia del blocco. Poiché è stato ben stabilito che una soglia di stimolazione nervosa inferiore a 0.2 mA indica un'elevata probabilità di posizionamento della punta dell'ago all'interno del nervo, lo stimolatore può essere utilizzato durante l'UGRA come monitor di sicurezza. Lo stimolatore nervoso è particolarmente necessario durante il blocco ecoguidato dei nervi profondi o quando l'immagine ecografica è meno precisa del desiderato. In questo contesto, una risposta motoria evocata potrebbe mettere in guardia contro l'iniezione intrafascicolare di anestetico locale.
Inoltre, in alcune circostanze, può essere desiderabile identificare diversi nervi con maggiore precisione, come durante il blocco ascellare, per il quale il SNP serve a delineare i nervi in base alla loro risposta motoria specifica alla stimolazione elettrica. Potrebbero esserci, in alcune posizioni anatomiche, strutture neurali che possono essere difficili da identificare mediante la sola visualizzazione, sia che siano l'obiettivo del blocco o che si desideri semplicemente evitarle con l'ago; in questi casi, un PNS può essere prezioso per fornire questa identificazione.
Infine, ci sono nervi che non si prestano facilmente alla visualizzazione degli ultrasuoni, principalmente a causa della profondità o dell'interferenza ossea con la trasmissione degli ultrasuoni. L'esempio più comune di ciò è l'approccio posteriore al plesso lombare, in cui gli ultrasuoni possono essere utilizzati per identificare le strutture ossee locali per guidare il blocco, ma per il quale il SNP rimane un valido strumento per guidare la punta dell'ago in prossimità del nervi del plesso.
Nel complesso, una pletora di dati indica che l'uso di routine di uno stimolatore nervoso durante i blocchi nervosi guidati da ultrasuoni fornisce informazioni sulla sicurezza clinicamente rilevanti che possono influenzare il processo decisionale clinico e influenzare positivamente la sicurezza del paziente.
Tuttavia, lo scopo principale dell'uso di routine suggerito della stimolazione nervosa con UGRA è per il monitoraggio della sicurezza, piuttosto che per la localizzazione del nervo (Figure 8
). In questa capacità, lo stimolatore nervoso può essere semplicemente impostato a 0.5 mA (0.1 ms), 2 Hz, senza modificare l'intensità della corrente durante tutta la procedura.
Sebbene la risposta motoria non venga ricercata, il verificarsi della risposta motoria dovrebbe richiedere la cessazione dell'avanzamento dell'ago e un leggero ritiro dell'ago poiché una risposta motoria a questa impostazione di erogazione corrente indica quasi sempre il contatto ago-nervo o il posizionamento dell'ago intraneurale.
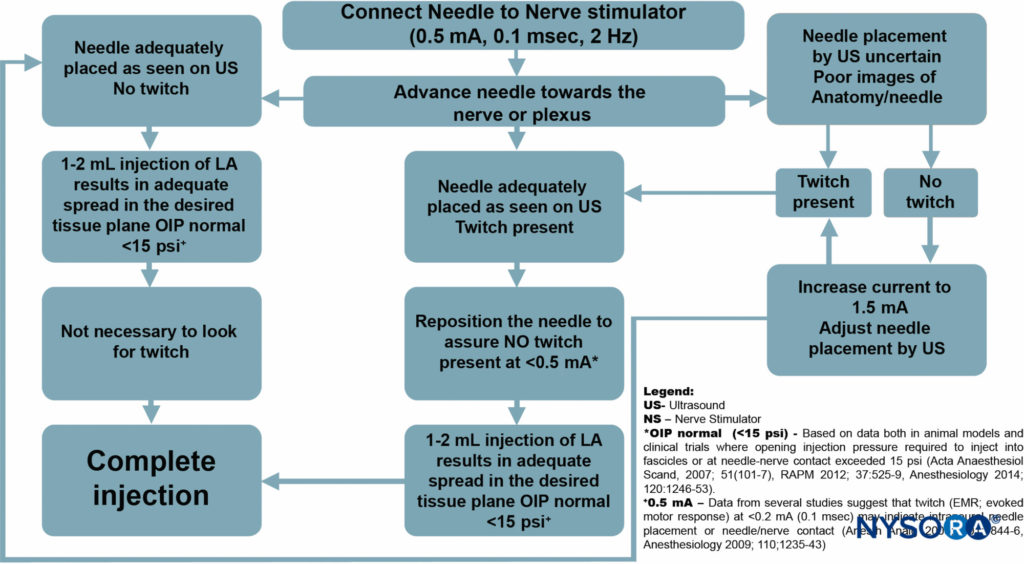
FIGURA 8. Algoritmo: lo scopo principale dell'uso di routine suggerito della stimolazione nervosa con UGRA è il monitoraggio della sicurezza, piuttosto che la localizzazione del nervo.
OTTIMIZZAZIONE DELLA EROGAZIONE DI ANESTETICO LOCALE VICINO AL NERVO BERSAGLIO
Dopo un accurato posizionamento dell'ago vicino al nervo bersaglio e dopo aver accertato che l'aspirazione è negativa per il posizionamento dell'ago intravascolare, viene eseguita l'iniezione dell'anestetico locale nel piano tissutale che contiene il nervo o i nervi da anestetizzare (Tabella 4).
TABELLA 4. Ottimizzazione della deposizione di anestetico locale.
| Iniettare la soluzione di anestetico locale in piccole aliquote Osservare il dolore o l'alta pressione durante l'iniezione Assicurarsi che si osservi la diffusione del fluido sulla punta dell'ago durante l'iniezione Aspirare tra le iniezioni Prestare attenzione all'intervento dei piani fasciali che potrebbero sequestrarsi o canalizzare la soluzione Evitare la deposizione di anestetico locale nei muscoli Per i nervi solitari alle estremità, cerca di creare una "ciambella" o "alone" attorno al nervo Per i nervi all'interno di un recinto fasciale, cerca di "riempire" il confini fasciali con solutiona |
Brull et al hanno valutato l'idea di lunga data che la soluzione di anestetico locale dovrebbe essere diretta in modo circonferenziale attorno al nervo visibile, con il cambiamento della posizione dell'ago se necessario, rispetto al semplice consentire alla soluzione di accumularsi lungo un aspetto del nervo con una posizione dell'ago.
Hanno scoperto che il blocco risultante si è formato il 33% più rapidamente con il primo rispetto al secondo. Mentre la creazione di una "ciambella" o "aureola" attorno al nervo può essere suggerita come raccomandazione generale, alcuni nervi, in virtù della loro situazione anatomica, potrebbero non richiedere tale posizionamento circonferenziale deliberato. Questo è tipicamente dettato dalla posizione e dalla configurazione dei piani fasciali sovrastanti o circostanti, come nel solco interscaleno e nel triangolo femorale. La somministrazione ottimale di anestetico locale attorno a ciascun nervo è descritta nelle successive sezioni UGRA specifiche.
L'imaging in tempo reale dell'iniezione di anestetico locale consente di valutare la corretta disposizione del fluido. La fase di iniezione deve essere eseguita con piccole aliquote di anestetico locale (3-5 ml), lasciando trascorrere un breve periodo tra ciascuna, per consentire la manifestazione di eventuali sintomi di tossicità sistemica dell'anestetico locale (LAST) prima di continuare a somministrare il farmaco, come raccomandato dalle linee guida dell'American Society of Regional Anesthesia and Pain Medicine (ASRA).
Inoltre, la somministrazione di ciascuna aliquota deve essere preceduta dall'aspirazione e deve progredire prestando attenzione alle pressioni di apertura dell'iniezione o ai disturbi del dolore o della parestesia nella distribuzione del nervo bersaglio.
Sebbene sia stato dimostrato che gli ultrasuoni producono una minore probabilità di posizionamento dell'ago intravascolare, può ancora verificarsi l'iniezione intravascolare con LAST. È quindi indispensabile essere consapevoli della posizione dei vasi, che hanno una pressione di distensione così bassa che la normale pressione sulla superficie del corpo con un trasduttore cancella completamente il loro lume. Pertanto, è utile eseguire lo screening per la presenza di vasi utilizzando il color Doppler durante la scansione pre-blocco. Tuttavia, i piccoli vasi possono non essere rilevati e la funzione Doppler si deteriora a profondità maggiori.
Pertanto, è imperativo osservare l'immagine ecografica durante l'iniezione per evidenziare la diffusione del tessuto dalla soluzione di anestetico locale sulla punta dell'ago. La mancata visualizzazione di tale diffusione suggerisce che la punta dell'ago è fuori piano o si trova nel lume di un vaso.
Il posizionamento dell'ago errante è stato descritto sia nei vasi che nei nervi. Moayeri et al in uno studio basato su cadavere, hanno dimostrato che l'imaging ecografico è sensibile all'iniezione nel nervo periferico, con un minimo di 0.5 ml che causa prove visibili di distensione del nervo. Tale visualizzazione consente il ritiro immediato dell'ago, che può ridurre la possibilità di lesioni nervose, rispetto all'iniezione di un grande volume di anestetico locale.
CONCLUSIONE
L'ecografia ha rivoluzionato il campo dell'anestesia regionale. L'applicazione efficace di questa tecnologia richiede la comprensione dell'anatomia bidimensionale, l'imaging ottimale dei nervi e delle strutture anatomiche, un'accurata guida dell'ago in tempo reale e la precisa somministrazione di anestetico locale. La combinazione di questi elementi garantisce che il massimo beneficio possa essere derivato da questa potente modalità di imaging, garantendo un elevato successo del blocco nervoso e una migliore sicurezza del paziente, in particolare per quanto riguarda LAST.
BIBLIOGRAFIA
- Kapral S, Krafft P, Eibenberger K, et al: Approccio sopraclavicolare ecoguidato per l'anestesia regionale del plesso brachiale. Anesth Analg 1994;78:507–513.
- Marhofer P, Schrogendofer K, Koinig H, et al: La guida ultrasonografica migliora il blocco sensoriale e il tempo di insorgenza dei blocchi tre in uno. Anesth Analg 1997;85:854–857.
- Marhofer P, Schrogendofer K, Wallner T, et al: La guida ultrasonografica riduce la quantità di anestetico locale per i blocchi 3 in 1. Reg Anesth Antidolorifico 1998;23:584–588.
- Perlas A, Chan VW, Simons M: esame e localizzazione del plesso brachiale mediante ultrasuoni e stimolazione elettrica. Anestesiologia 2003;99:429–435.
- Grey AT: Anestesia regionale ecoguidata. Anestesiologia 2006; 104:368–373.
- Manickam BP, Perlas A, Chan VW, et al: Il ruolo di un'indagine sistematica pre-procedura nell'anestesia regionale ecoguidata. Reg Anesth Antidolorifico 2008;33:566–570.
- Siti BD, Brull R: Guida ecografica nell'anestesia regionale periferica: filosofia, medicina basata sull'evidenza e tecniche. Curr Opin Anesth 2006; 19:630–639.
- Siti BD, Chan VW, Neal JM, et al: La Società Americana di Anestesia Regionale e Medicina del Dolore e le Raccomandazioni del Comitato Congiunto della Società Europea di Anestesia Regionale e Terapia del Dolore per l'istruzione e la formazione in anestesia regionale ecoguidata. Reg Anesth Pain Med 2010;35(Suppl 1):S74–80.
- Orebaugh SL, Bigeleisen PE, Kentor ML: Impatto di una rotazione dell'anestesia regionale sull'identificazione ecografica delle strutture anatomiche da parte dei residenti in anestesiologia. Acta Anaesth Scand 2009;53:364–368.
- Orebaugh SL, Williams BA, Kentor ML, et al: Blocco interscalenico utilizzando la guida ecografica: impatto dell'esperienza sulle prestazioni dei residenti. Acta Anaesth Scand 2009;53:1268–1274.
- Adhikary SD, Hadzic A, McQuillan PM: Simulatore per l'insegnamento della coordinazione occhio-mano durante l'anestesia regionale ecoguidata. Fr. J Anaesth 2013;111(5):844–845.
- Wegener JT, van Doorn T, Eshuis JH, et al: Valore di un tutorial elettronico per l'interpretazione delle immagini nell'anestesia regionale ecoguidata. Reg Anesth Antidolorifico 2013;38:44–49.
- Woodworth GE, Chen EM, Horn JL, et al: Efficacia del video e della simulazione basati su computer nella formazione in anestesia regionale guidata da ultrasuoni. J Clin Anesth 2014;26:212–221.
- Siti BD, Spence BC, Gallagher JD, et al: Caratterizzazione del comportamento da principiante associato all'apprendimento dell'anestesia regionale periferica ecoguidata. Reg Anesth Antidolorifico 2007;32:107–115.
- Siti BD, Spence BC, Gallagher J, et al: L'anestesia regionale incontra gli ultrasuoni: una specialità in transizione. ACTA Anestes Scand 2008;52:456–466.
- Speer M, McLennan N, Nixon C: imaging ecografico in piano per principianti. Reg Anesth Antidolorifico 2013;38:350–352.
- Ball RD, Scouras NE, Orebaugh S, et al: studio di simulazione osservazionale randomizzato e prospettico che confronta le tecniche ecografiche guidate dall'ago e quelle a mano libera dei residenti per l'accesso al catetere venoso centrale. Fr. J Anaesth 2012; 108:72–79.
- Schafhalter-Zoppoth I, Grey AT: Il nervo muscolocutaneo: aspetto a ultrasuoni per il blocco del nervo periferico. Reg Anesth Antidolorifico 2005;30:385–390.
- Moayeri N, van Geffen GJ, Bruhn J, et al: Correlazione tra ultrasuoni, anatomia trasversale e istologia del nervo sciatico. Reg Anesth Antidolorifico 2010;35:442–449.
- Bonnel F: Anatomia microscopica del plesso brachiale umano adulto: una base anatomica e istologica per la microchirurgia. Microchirurgia 1984;5:107–118.
- van Geffen GJ, Moayeri N, Bruhn J, et al: Correlazione tra ecografia, anatomia della sezione trasversale e istologia del plesso brachiale. Reg Anesth Antidolorifico 2009;34:490–497.
- Moayeri N, Bigeleisen PE, Groen GJ: Architettura quantitativa del plesso brachiale e dei compartimenti circostanti e loro possibile significato per i blocchi del plesso. Anestesiologia 2008;108:299–304.
- Sylvestri E, Martinoli C, Derchi LE, et al: Ecostruttura dei nervi periferici: correlazioni tra US e risultati istologici e criteri per differenziare i tendini. Radiologia 1995; 197: 291–296.
- McCartney CJ, Xu D, Constantinescu C, et al: Esame ecografico dei nervi periferici nell'avambraccio. Reg Anesth Antidolorifico 2007;32:434–439.
- Siti BD, Brull R, Chan VW, et al: Artefatti ed errori di trabocchetto associati all'anestesia regionale ecoguidata. Reg Anesth Antidolorifico 2007;32:419–433.
- Chin KJ, Perlas A, Chan VW, et al: Visualizzazione dell'ago nell'anestesia regionale ecoguidata: sfide e soluzioni. Reg Anesth Antidolorifico 2008;33:532–544.
- Hebard S, Hocking G: La tecnologia ecogenica può migliorare la visibilità dell'ago durante l'anestesia regionale ecoguidata. Reg Anesth Antidolorifico 2011;36:185–189.
- Rettig HC, Gielen MJ: tecnica a mano libera o dispositivo meccanico di guida dell'ago? [lettera] Reg Anesth Pain Med 2009;34:608–609.
- Tsui, BC: Facilitare l'allineamento dell'ago in piano rispetto a un raggio di ultrasuoni utilizzando un'unità laser portatile. Reg Anesth Antidolorifico 2007;32:84–88.
- Wong SW, Niazi AU, Chin KJ, et al: Anestesia spinale guidata da ultrasuoni in tempo reale utilizzando il sistema di tracciamento dell'ago SonixGPS. Can J Anaesth 2013;60:50–53.
- Wiesmann T, Borntrager A, Zoremba M, et al: tecnologia di imaging composto e design dell'ago ecogenico. Reg Anesth Antidolorifico 2013; 38:452–455.
- Soong J, Schafhalter-Zoppoth I, Gray AT: L'importanza dell'angolo del trasduttore per la visibilità ecografica del nervo femorale. Reg Anesth Antidolorifico 2005;30:505.
- Alakkad H, Chin KJ: L'importanza di una buona tecnica di needling nel blocco ascellare ecoguidato. Reg Anesth 2013;38(2):166.
- Bigeleisen PE1, Moayeri N, Groen GJ. Soglie di stimolazione extraneurale rispetto a quella intraneurale durante il blocco sopraclavicolare ecoguidato. Anestesiologia. 2009;110:1235–43.
- Hadzic A, Dilberovic F, Shah S, Kulenovic A, Kapur E, Zaciragic A, Cosovic E, Vuckovic I, Divanovic KA, Mornjakovic Z, Thys DM, Santos AC. La combinazione di iniezione intraneurale e alta pressione di iniezione porta a lesioni fascicolari e deficit neurologici nei cani. Reg Anesth Antidolorifico 2004;29:417–23.
- Auroy Y, Benhamou D, Bargues L: Principali complicazioni dell'anestesia regionale in Francia. Anestesiologia 2002;97:1274–1280.
- Perlas A, Niazi A, McCartney C, et al: La sensibilità della risposta motoria alla stimolazione nervosa e parestesia per la localizzazione del nervo valutata dagli ultrasuoni. Reg Anesth Antidolorifico 2006;31:445–450.
- Beach ML, Sites BD, Gallagher JD: L'uso di uno stimolatore nervoso non migliora l'efficacia del blocco sopraclavicolare ecoguidato. J Clin Anesth 2006; 18:580–584.
- Chan VW, Perlas A, McCartney CJ, et al: La guida ecografica migliora il tasso di successo del blocco del plesso ascellare brachiale. Can J Anaesth 2007;54:176–182.
- Siti BD, Beach ML, Chinn CD, et al: un confronto tra perdita sensoriale e motoria dopo un blocco del nervo femorale condotto con ultrasuoni rispetto a ultrasuoni e stimolazione nervosa. Reg Anesth Antidolorifico 2009;34:508–513.
- Robards C, Hadzic A, Somasundraram L, et al: Iniezione intraneurale con stimolazione a bassa corrente durante il blocco del nervo sciatico popliteo. Anesth Anal
2009; 109: 673-677. - Sigenthaler A, Moriggl B, Mlekusch S, et al: Blocco nervoso soprascapolare ecoguidato: descrizione di un nuovo approccio sopraclavicolare. Reg Anesth Antidolorifico 2012;37:325–328.
- Hanson NA, Auyong DB: Identificazione ecografica sistematica dei nervi scapolare dorsale e toracico lungo durante il blocco interscalenico. Reg Anesth Antidolorifico 2013;38:54–57.
- Karmakar MK, Ho AM, Li X, et al: blocco del plesso lombare ecoguidato attraverso la finestra acustica del tridente ecografico lombare. Fr. J Anaesth 2008; 100:533–537.
- Gadsden J, Latmore M, Levine DM, Robinson A: Un'elevata pressione di iniezione di apertura è associata al contatto ago-nervo e ago-fascia durante il blocco del nervo femorale. Reg Anesth Pain Med 2016;41(1):50–55.
- Gadsden JC, Choi JJ, Lin E, Robinson A: La pressione di iniezione di apertura rileva costantemente il contatto ago-nervo durante il blocco del plesso brachiale interscalenico guidato da ultrasuoni. Anestesiologia 2014;120(5):1246–1253.
- Brull R, MacFarlane AJ, Parrington SJ, et al: l'iniezione circonferenziale è vantaggiosa per il blocco del nervo sciatico popliteo ecoguidato? Reg Anesth Antidolorifico 2011;36:266–270.
- Spence BC, Beach ML, Gallagher JD, et al: Blocchi interscalenici guidati da ultrasuoni: capire dove iniettare l'anestetico locale. Anestesia 2011;66(6):509–514.
- Neal JM, Bernards CM, Butterworth JF, et al: consulenza pratica ASRA su
tossicità sistemica da anestetico locale. Reg Anesth Antidolorifico 2010;35:350–352. - Abrahams MS, Aziz MF, Fu RF, et al: guida ecografica rispetto alla neurostimolazione elettrica per il blocco del nervo periferico: una revisione sistematica e una meta-analisi di studi randomizzati controllati. Anaesth 2009; 102: 408–417.
- Zetlaoui PJ, Labbe JP, Benhamou D: La guida ecografica per il blocco del plesso ascellare non impedisce l'iniezione intravascolare [lettera]. Anestesiologia 2008;109:761.
- VadeBancouer TR, Weinberg GL, Oswald S, et al: rilevamento precoce dell'iniezione intravascolare durante brachiale sopraclavicolare ecoguidato
blocco del plesso. Reg Anesth Antidolorifico 2008;33:278–279. - Liu SS, YaDeau JT, Shaw PM, et al: Incidenza di iniezione intraneurale non intenzionale e complicanze neurologiche postoperatorie con blocchi nervosi interscalenici e sopraclavicolari guidati da ultrasuoni. Anestesia 2011;66:1365–2044.
- Hara K, Sakura S, Yokokawa N, et al: incidenza ed effetti dell'iniezione intraneurale non intenzionale durante il blocco del nervo sciatico sottogluteale ecoguidato. Reg Anesth Antidolorifico 2012;37:289–293.
- Krediet AC, Moayer N, Bleys RL, et al: Intraneurale o extraneurale: accuratezza diagnostica o valutazione ecografica della localizzazione dell'iniezione a basso volume. Reg Anesth Antidolorifico 2014;39:409–413.