Michael J. Barrington, Richard Brull, Miguel A. Reina e Admir Hadzic
INTRODUZIONE
Questa sezione esamina vari fattori che possono contribuire alle complicanze neurologiche dopo i blocchi dei nervi periferici (PNB) e suggerisce principi di pratica e implicazioni delle modalità di monitoraggio per mitigare il rischio di complicanze neurologiche.
CONSIDERAZIONI SULL'ANATOMIA DEL NERVO PERIFERICO CORRELATO AL BLOCCO DEL NERVO
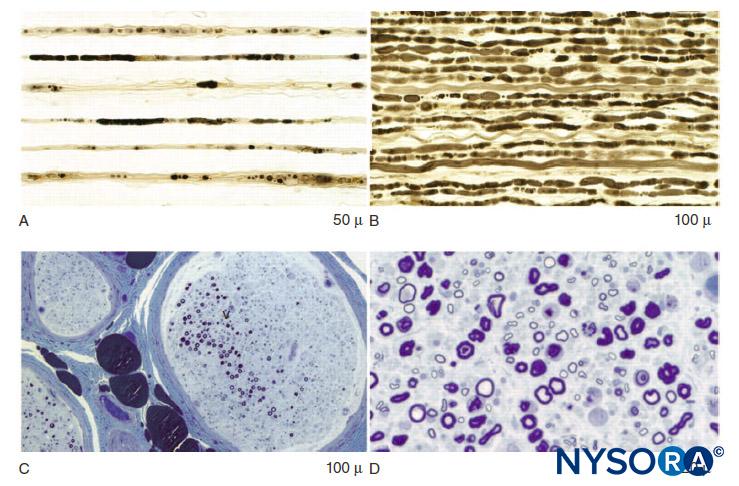
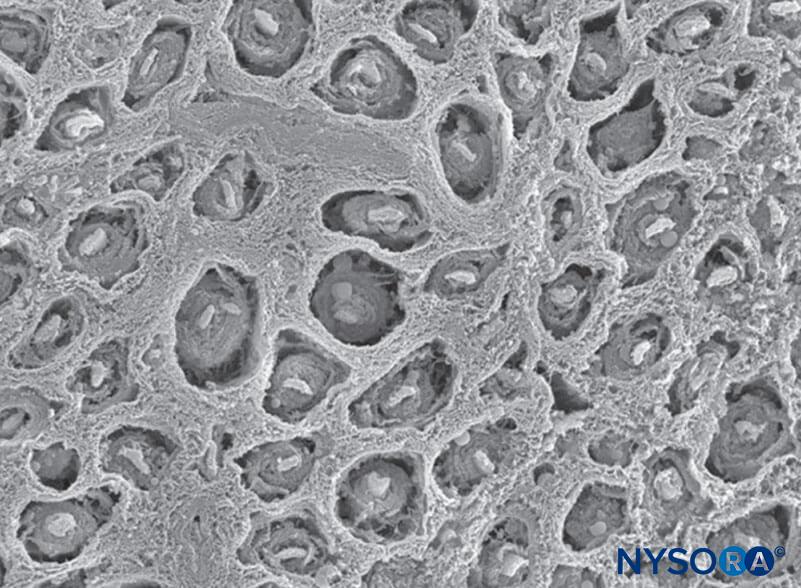
Un nervo è un organo distinto che comprende tessuto neurale, uno specifico stroma del tessuto connettivo e un apporto di sangue designato (Figure 1 ). Le cellule nervose, o neuroni, sono composte da un corpo cellulare, dendriti e un assone.
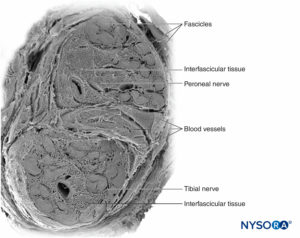
FIGURA 1. Nervo sciatico umano. Microscopia elettronica a scansione. (Riprodotto con il permesso di Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
L'assone è un'estensione citoplasmatica del neurone che trasmette segnali elettrici lungo la sua lunghezza dal corpo cellulare prossimalmente a ovunque da pochi millimetri fino a quasi 1 m distalmente. La maggior parte dei nervi periferici può trasmettere sia segnali motori afferenti che segnali sensoriali efferenti.
Nel sistema nervoso periferico, la stragrande maggioranza degli assoni è mielinizzata, caratterizzata da una guaina di cellule di Schwann che racchiudono l'assone in uno strato di mielina (Figure 2 ). Le cellule di Schwann sono interrotte in spazi interposti, noti come nodi di Ranvier, dove avviene il processo di depolarizzazione e ripolarizzazione durante la propagazione salatoria del potenziale d'azione. Insieme alla sua guaina mielinica, ciascun assone è legato da un sottile strato di tessuto connettivo chiamato endoneurio (Figure 3 ) e poi chiamata fibra nervosa.
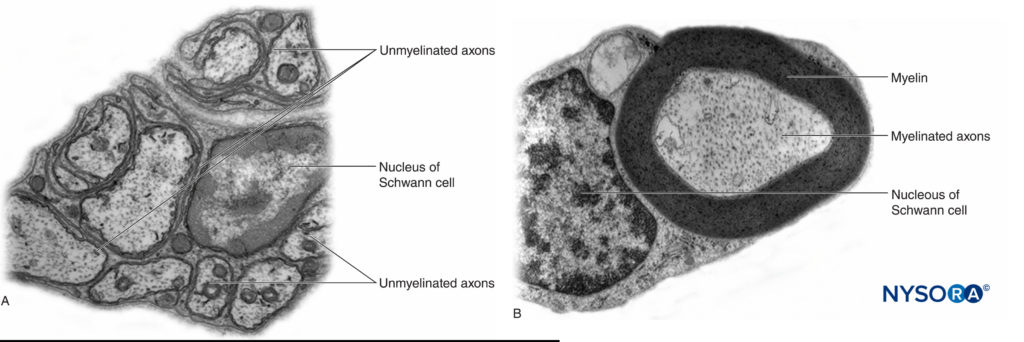
FIGURA 2. A: Assone amielinico di una radichetta nervosa umana. B: Assone mielinizzato di un nervo sciatico umano. Microscopia elettronica a trasmissione. (Riprodotto con il permesso di Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
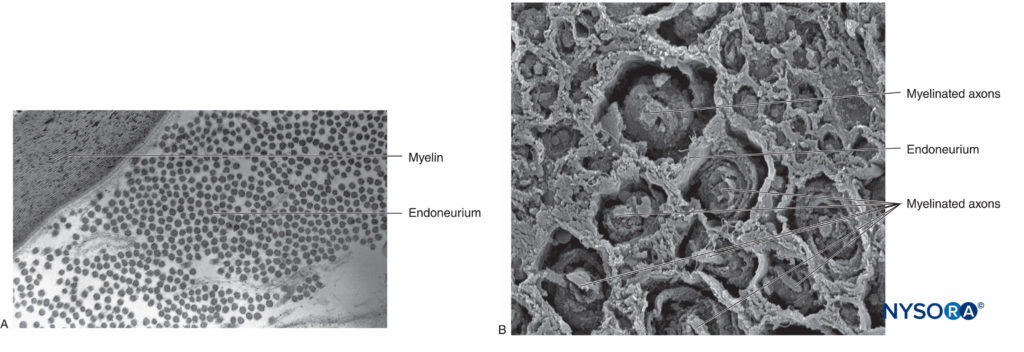
FIGURA 3. Endoneurio. Assoni mielinizzati avvolti da endoneurio ottenuto da un nervo sciatico umano. R: Microscopia elettronica a trasmissione. (Riprodotto con il permesso di Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.) B: Microscopia elettronica a scansione. (Riprodotto con il permesso di Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
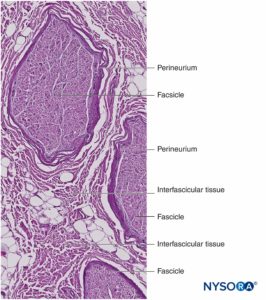
Le fibre nervose sono organizzate in gruppi chiamati fasci (Figure 4 ). All'interno di ciascun fascicolo, le fibre nervose formano un plesso intraneurale in cui gli assoni assumono diverse posizioni lungo il loro percorso (Figure 5 ). In prossimità delle articolazioni i fascicoli sono più sottili e numerosi e tendono ad essere circondati da una maggiore quantità di tessuto connettivo, il che riduce la vulnerabilità dei fascicoli agli insulti come pressione e stiramento.
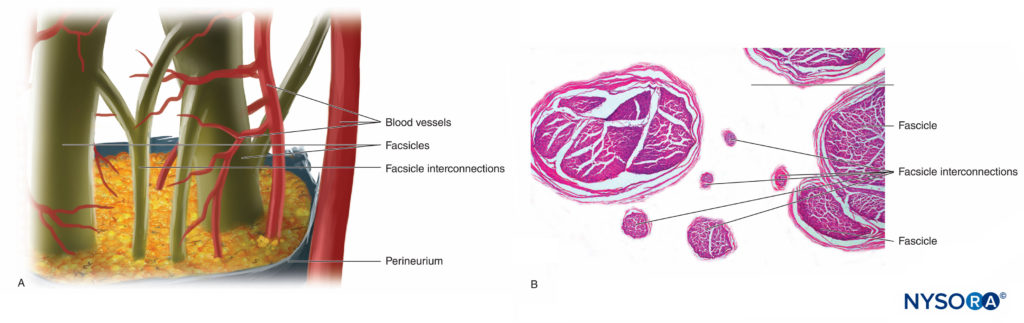
FIGURA 5. Plesso intraneurale. R: Diagramma. B: Fascicoli e fascicoli di interconnessione. (B, Riprodotto con il permesso di Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
Ogni fascicolo è circondato da perineurio costituito da strati continui e concentrici da 8 a 18 cellule (Figure 6 ). Lo spessore del perineurio è tipicamente compreso tra 7 e 20 μm. Gli strati di cellule perineurali forniscono una barriera per la diffusione di sostanze dentro e fuori i fascicoli. Lo spazio tra le cellule perineurali è composto da sostanze amorfe fondamentali, fibre di collagene e fibroblasti. Queste fibre di collagene possono essere allineate in diverse direzioni, ma prevalentemente lungo l'asse longitudinale del fascicolo (Figure 6 ). Il perineurio consente un certo movimento degli assoni all'interno di un fascicolo e mantiene la pressione intrafascicolare fungendo da efficace barriera fisica contro lesioni meccaniche e chimiche. Allo stesso modo, il perineurio funge da importante barriera alla diffusione, prevenendo l'esposizione degli assoni a sostanze potenzialmente nocive, come gli anestetici locali.
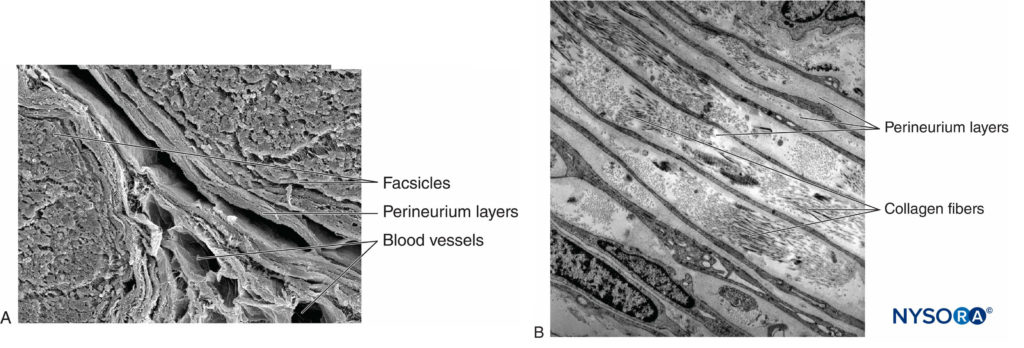
FIGURA 6. Perineurio. Strati perineurali del nervo sciatico umano. R: Microscopia elettronica a trasmissione. (Riprodotto con il permesso di Reina MA, López A, Villanueva MC, et al: La barriera sangue-nervo nei nervi periferici. Rev Esp Anestesiol Reanim. 2003 Feb;50(2):80-86.) B: Microscopia elettronica a scansione. (Riprodotto con il permesso di Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
Gruppi di fascicoli sono legati insieme da un epinevrio, il più spesso dei tre strati di tessuto connettivo che racchiudono gruppi di fascicoli insieme al loro tessuto di supporto interfascicolare e adipociti (Figure 1 ). L'epinevrio è composto principalmente da fibre di collagene e un piccolo numero di vasi sanguigni (Figure 7 ). Le fibre di collagene dell'epinevrio sono simili per dimensioni e aspetto alle fibre di collagene della dura o delle maniche durali. L'epinevrio conferisce al nervo il suo caratteristico aspetto esterno all'ecografia (cioè appare come una struttura discreta).
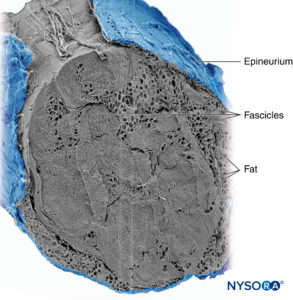
FIGURA 7. Epinevrio. Nervo tibiale umano: dettaglio di fascicoli, tessuto interfascicolare ed epinevrio. Microscopia elettronica a scansione. (Riprodotto con il permesso di Reina
MA, Arriazu R, Collier CB, et al: Microscopia elettronica dei nervi periferici umani di rilevanza clinica per la pratica del nervo
blocchi. Una revisione strutturale e ultrastrutturale basata su dati sperimentali e di laboratorio originali. Rev Esp Anestesiolo Reanim. 2013 dicembre;60(10):552–562.)
I nervi periferici hanno due sistemi vascolari indipendenti ma interconnessi. Il sistema estrinseco è costituito da arterie, arteriole e vene che si trovano all'interno dell'epinevrio, mentre il sistema vascolare intrinseco comprende un gruppo di capillari longitudinali che corrono all'interno dei fascicoli e dell'endoneurio (Figure 8 ). L'anastomosi tra i due sistemi vascolari è formata da vasi (Figure 1 ) che hanno origine nell'epinevrio e attraversano il perinevrio. La lesione a questi vasi può portare a una serie di complicazioni, dall'ischemia all'infiammazione dovuta all'ematoma.
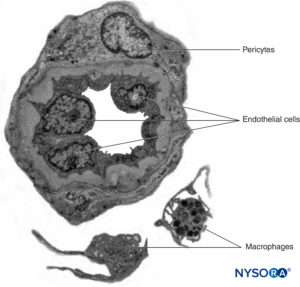
FIGURA 8. Capillari continui endoneurali. Microscopia elettronica a trasmissione. (Riprodotto con il permesso di Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
Le radici nervose hanno una resistenza alla trazione e un'elasticità inferiori rispetto agli assoni e ai loro elementi di supporto nei tronchi nervosi periferici. Gli assoni inclusi nelle radici del nervo spinale non sono circondati da un perineurio o da un'altra struttura con effetto barriera. Più distalmente (p. es., nervi spinali e tronchi/divisioni del plesso), i fascicoli hanno un proprio perineurio protettivo (Figure 9, 10 e 11) e hanno una disposizione plessiforme che contribuisce alla loro resistenza alla trazione. I tronchi nervosi all'interno dei letti di tessuto, i fascicoli all'interno dei tronchi nervosi e gli assoni all'interno dei fascicoli hanno un andamento leggermente ondulato, con conseguente relativa lunghezza in eccesso. Inoltre, i nervi sono spesso attaccati in modo lasco dal loro epinevrio alle strutture adiacenti. Esiste una rete non specializzata di tessuto connettivo areolare (fasciale profondo) che riempie lo spazio tra strutture specializzate come nervi, muscoli e vasi (Figure 12 ). Questo tessuto collega liberamente queste strutture in modo che sia consentito il movimento l'una sull'altra. Questo movimento si riduce quando i nervi sono legati entrando in vasi sanguigni, rami o altri punti di riferimento.
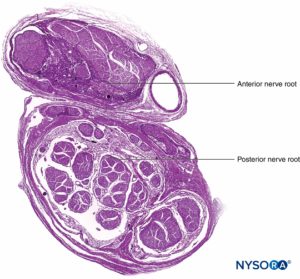
FIGURA 9. Radice del nervo ventrale e dorsale. Sezione trasversale alla cuffia della settima radice nervosa tra sacco durale e ganglio della radice dorsale. (Usato con il permesso di MA Reina.)
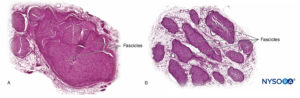
FIGURA 10. Radice nervosa. Sezione trasversale al ganglio della radice dorsale esterna della cuffia della settima radice nervosa. A: Esterno fino a 2 mm. B: esterno a 5 mm. (Usato con il permesso di MA Reina.)
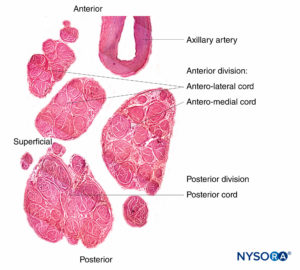
FIGURA 11. Cordoni del plesso brachiale. Cordone anteromediale, cordone anterolaterale e cordone posteriore. Dettagli di fascicoli e tessuto interfascicolare all'interno delle corde. (Riprodotto con il permesso di Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
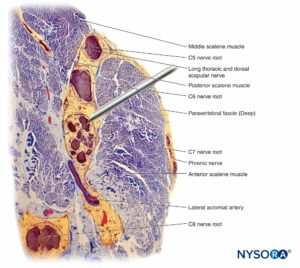
FIGURA 12. Interazione dell'ago del blocco e del plesso brachiale interscalenico. Il posizionamento dell'ago nei fasci (come mostrato qui) provoca lesioni fascicolari. Ulteriori lesioni possono essere commesse quando un'iniezione viene effettuata attraverso un ago posizionato intrafascicolare. Osservare la differenza di dimensioni tra ago e fascicoli. (Riprodotto con il permesso di Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
Per una rassegna più completa, cfr Tessuti connettivi dei nervi periferici.
Consigli NYSORA
La perdita di tono muscolare, come accade durante l'anestesia, espone teoricamente gli elementi neurali alle forze di trazione. Tuttavia, ci sono anche caratteristiche anatomiche che proteggono dalla trazione laterale o dalle lesioni da stiramento. Ad esempio, nell'impostazione dei blocchi del plesso brachiale interscalenico, le radici del quarto, quinto e sesto nervo spinale sono alloggiate nella grondaia dei processi trasversali e sono quindi relativamente protette da queste forze. Le radici dorsali e ventrali dei nervi spinali sono ulteriormente protette dalla trazione laterale incuneando un cono di dura che circonda il complesso nervo radice-nervo spinale nel forame intervertebrale.
FISIOLOGIA DELLA LESIONI DEL NERVO PERIFERICO
Gravità della lesione del nervo periferico
I principali determinanti della prognosi della lesione del nervo periferico (PNI) sono la gravità della lesione e l'integrità residua degli assoni. La gravità della PNI è generalmente classificata in base al grado relativo di rottura assonale. Si ritiene tradizionalmente che le lesioni assonali prossimali (cioè vicine al corpo cellulare) siano più gravi delle lesioni assonali distali (cioè più vicine al bersaglio dell'innervazione) poiché la probabilità di innervazione e recupero sembra variare indirettamente con la distanza tra la posizione di la lesione assonale e il tessuto bersaglio.
Le due classificazioni anatomiche più comunemente utilizzate sono le classificazioni Seddon e Sunderland (Tabella 1). La classificazione più comunemente utilizzata nella pratica clinica è la classificazione Seddon a tre livelli, che include (da lieve a grave) neuroprassia, assonotmesi e neurotmesi. La neuroprassia si riferisce al danno alla guaina mielinica tipicamente associato allo stiramento o alla compressione dei nervi in cui gli assoni e gli elementi di supporto (endoneurio, perinevrio ed epinevrio) rimangono intatti. La prognosi per una lesione neuroprassica è favorevole, con il completo recupero della funzione che si verifica entro settimane o mesi.
TABELLA 1. Classificazione delle lesioni nervose.
| Seddon3 | Sunderland4 | Processi | Prognosi |
|---|---|---|---|
| neuroprassia | 1 | Danno mielinico Rallentamento e blocco della conduzione | Buone |
| assonotmesi | 2 | Perdita di continuità assonale; endoneurio intatto Nessuna conduzione | Discreto |
| neurotmesi | 3 | Perdita di continuità assonale ed endoneurale; perineurio intatto Nessuna conduzione | povero |
| 4 | Perdita di continuità assonale, endoneurale e perineuriale; epinevrio intatto Nessuna conduzione | ||
| 5 | Transazione nervosa completa Nessuna conduzione |
Consigli NYSORA
La maggior parte dei sintomi neurologici postoperatori associati all'anestesia regionale tendono a seguire un modello neuroprassico di lesione e guarigione.
L'assonotmesi si riferisce a lesioni assonali associate a impalamento fascicolare, schiacciamento dei nervi o lesioni tossiche, con danno all'endoneurio e possibilmente al perineurio (Figure 13 ). Il recupero dopo la perdita assonale può essere prolungato e variabile, a seconda dell'entità (parziale o completa) della rottura del perineurio e della distanza dalla sede della lesione al muscolo corrispondente.
Infine, la neurotmesi si riferisce alla completa transezione del nervo, inclusi gli assoni, l'endoneurio, il perinevrio e il tessuto connettivo epinevriale. In genere richiede un intervento chirurgico. La prognosi è spesso infausta.
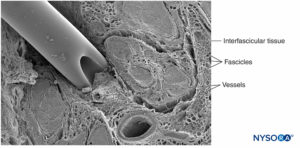
FIGURA 13. Nervo tibiale umano. Puntura in vitro del nervo con ago per neurostimolazione. Microscopia elettronica a scansione. (Riprodotto con il permesso di Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
Meccanismi di lesione
Il meccanismo del PNI correlato all'uso dei PNB rientra in una delle tre grandi categorie: danno meccanico e da iniezione (traumatico), vascolare (ischemico) e chimico (neurotossicità). La maggior parte delle informazioni sulla lesione da iniezione del nervo periferico sono ottenute dalla ricerca sperimentale su modelli animali. Poiché tale ricerca non è possibile negli esseri umani, i meccanismi della PNI non sono completamente compresi. Questo perché i modelli animali variano in modo significativo nelle specie utilizzate, nei nervi iniettati e nei protocolli di studio, rendendo difficile estrapolare prontamente tali dati alla pratica clinica effettiva.
Lesioni meccaniche e da iniezione
Le lesioni meccaniche o traumatiche comprendono lesioni da compressione, stiramento, lacerazione o iniezione. La compressione o l'intrappolamento dei nervi può produrre un blocco di conduzione e, se prolungata, una demielinizzazione focale di alcuni assoni. Il trauma dell'ago e altri insulti meccanici ai nervi determinano un aumento della produzione di neuropeptidi e dell'attività del corno dorsale. La compressione del nervo correlata all'ago può derivare da un forte contatto ago-nervo da un ago in avvicinamento o da un'iniezione all'interno del nervo stesso. È stato ipotizzato che un'iniezione intraneurale possa portare a un'elevata pressione intraneurale sostenuta, che, quando si supera la pressione di occlusione capillare, può portare a ischemia nervosa e potenzialmente lesioni.
Iniezioni involontarie di antibiotici, steroidi, collagene bovino, tossina botulinica e anestetici locali nei nervi periferici sono state tutte associate a deficit neurologici deleteri. In un modello cadavere di iniezione intraneurale deliberata del nervo sciatico, la punta dell'ago ha interrotto il 3% degli assoni. Sebbene un certo grado di lesione assonale possa potenzialmente verificarsi anche in assenza di lesione al perineurio, l'effettiva sede anatomica della lesione (p. es., l'iniezione) è fondamentale dal punto di vista prognostico. Una delle cause principali della PNI correlata al blocco è l'iniezione di anestetico locale in un fascicolo, che causa traumi diretti dell'ago e dell'iniezione, rottura del perineurio e perdita dell'ambiente protettivo all'interno del fascicolo con conseguente mielina e degenerazione assonale. Lesioni da stiramento dei nervi possono verificarsi quando i nervi o i plessi sono posti in una posizione fisiologica non fisiologica o esagerata. Infine, la lesione meccanica da lacerazione si verifica quando il nervo viene ferito da un ago, con la possibilità di un recupero spontaneo molto improbabile dopo la transezione completa. Tabella 2 indica le raccomandazioni basate sull'evidenza per ridurre il rischio di PNI correlati al blocco.
TABELLA 2. Raccomandazioni basate sull'evidenza per ridurre il rischio di PNI correlato al blocco.
| L'inserimento intraneurale dell'ago potrebbe non portare sempre a lesioni nervose. |
| Il posizionamento e l'iniezione intrafascicolare dell'ago devono essere evitati. |
| Né la presenza né l'assenza di parestesie durante l'avanzamento dell'ago o all'iniezione di anestetico locale sono del tutto predittive di danno nervoso. |
| L'induzione di un forte dolore durante l'avanzamento dell'ago o durante l'iniezione di anestetico locale dovrebbe indurre la cessazione dell'iniezione. |
| La presenza di una risposta motoria evocata a una corrente inferiore a 0.5 (0.1 ms) indica un'intima relazione ago-nervo, contatto ago-nervo o posizionamento dell'ago intraneurale. Queste informazioni sono utili nel processo decisionale clinico. |
| Il monitoraggio della pressione di iniezione può rilevare l'iniezione in uno spazio tissutale scarsamente conforme, come un fascicolo nervoso. |
| Gli ultrasuoni possono rilevare l'iniezione intraneurale, sebbene tale rilevamento possa avvenire troppo tardi per prevenire lesioni poiché una piccola quantità di iniettato è sufficiente per rompere il fascicolo. |
| L'attuale tecnologia a ultrasuoni non ha una risoluzione adeguata per distinguere tra un'iniezione interfascicolare e un'iniezione intrafascicolare. |
| Immagini adeguate dell'interfaccia ago-nervo non sono ottenute in modo coerente da tutti gli operatori e in tutti i pazienti. |
Lesione vascolare
Il danno alla vascolarizzazione del nervo durante i blocchi nervosi può provocare ischemia locale o diffusa e si verifica quando vi è una lesione vascolare diretta, un'occlusione acuta delle arterie da cui derivano i vasa nervorum o un'emorragia all'interno di una guaina nervosa. La circolazione epinevriale è una componente critica della circolazione neurale complessiva e la sua rimozione riduce l'afflusso di sangue ai nervi del 50%. Nella maggior parte dei casi, nessun singolo vaso domina il pattern su un'intera lunghezza del nervo; tuttavia, il nervo sciatico è un'eccezione a questa regola, ricevendo il suo principale apporto arterioso nella regione glutea dall'arteria comitans nervi ischiadici.
Consigli NYSORA
L'apporto vascolare del nervo sciatico è meno abbondante dell'apporto della maggior parte degli altri nervi periferici. Ciò potrebbe spiegare l'osservazione clinica relativa al motivo per cui l'aggiunta di adrenalina all'anestetico locale sembra prolungare il blocco sciatico significativamente più a lungo rispetto alla maggior parte degli altri PNB.
I nervi con un'abbondanza di tessuto connettivo possono essere meno suscettibili alla compressione perché le forze esterne non vengono trasmesse direttamente ai vasi epinevriali. Gli anestetici locali e i coadiuvanti riducono potenzialmente il flusso sanguigno neurale in modo dipendente dall'agente e dalla concentrazione. L'adrenalina ha il potenziale per causare vasocostrizione locale, ma il suo ruolo nel causare ischemia e lesioni nervose è controverso. Il trauma da iniezione può compromettere ulteriormente il flusso sanguigno. L'ischemia neurale può verificarsi anche in seguito all'interruzione del microcircolo intrafascicolare, a pressioni di iniezione elevate, lacci emostatici e altri insulti compressivi. Fattori riguardanti la puntura involontaria del vaso, con conseguente formazione di un ematoma interno o esterno che può comprimere meccanicamente i fascicoli dall'interno o dall'esterno della guaina nervosa e causare infiammazione del nervo, sono stati implicati nel danno neurologico.
Lesioni chimiche
La lesione chimica del nervo deriva dalla tossicità tissutale delle soluzioni iniettate (p. es., anestetici locali, alcol o fenolo) o dei suoi additivi. La soluzione tossica può essere iniettata direttamente nel nervo o nei tessuti adiacenti, provocando una reazione infiammatoria acuta o una fibrosi cronica che coinvolge indirettamente il nervo. Gran parte della ricerca sulla neurotossicità degli anestetici locali è stata condotta in modelli in vitro, in particolare con applicazione intratecale.
Ci sono prove che quasi tutti gli anestetici locali possono avere effetti miotossici, neurotossici e citotossici in vari tessuti in determinate condizioni; tuttavia, gli anestetici locali variano nel loro potenziale neurotossico. Diversi studi hanno dimostrato che gli anestetici locali possono portare alla frammentazione del DNA e interrompere il potenziale di membrana nei mitocondri, con conseguente disaccoppiamento della fosforilazione ossidativa, che può provocare apoptosi. Esiste anche una correlazione diretta tra la concentrazione dell'anestetico locale e la durata dell'esposizione al nervo, con la morte delle cellule di Schwann, l'infiltrazione di macrofagi e il danno mielinico. Alcuni anestetici locali hanno un effetto vasocostrittore intrinseco che può ridurre il flusso sanguigno ai nervi, causando potenzialmente ischemia e lesioni.
Tuttavia, la difficoltà intrinseca nell'estrapolare questi studi di laboratorio alla pratica clinica dei moderni PNB è che vi è una sostanziale diminuzione della concentrazione di anestetici locali nel momento in cui raggiunge gli assoni.
Il sito di applicazione dell'anestetico locale (extraneurale, intraneurale, interfascicolare, intrafascicolare) (Figure 12, 14 e 15) può essere il principale determinante del verificarsi di neurotossicità, soprattutto se la concentrazione è elevata e la durata dell'esposizione prolungata. La maggior parte delle sostanze chimiche, compresi tutti gli anestetici locali, iniettate per via intrafascicolare provocano gravi lesioni fascicolari, mentre le stesse sostanze iniettate per via intraneurale ma interfascicolare causano meno lesioni o nessuna lesione rilevabile. In effetti, la penetrazione dell'ago in un nervo può causare danni minimi se non è combinata con l'iniezione di anestetico locale all'interno del fascicolo nervoso.
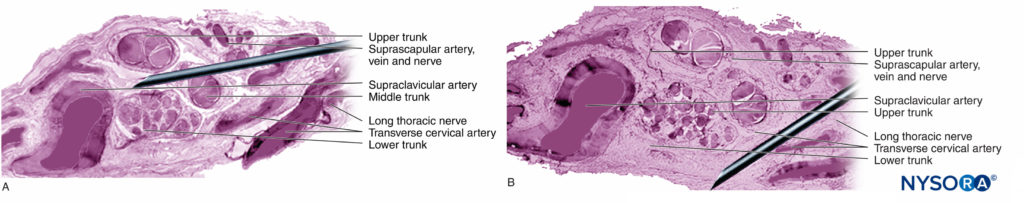
FIGURA 14. Sovrapposizione dell'ago nel plesso brachiale sopraclaveare. Se l'ago della neurostimolazione perfora il nervo, rispetto alle immagini statiche, l'ago danneggia i fascicoli. Approcci diversi sono mostrati in A. e B. (riprodotto con il permesso di Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
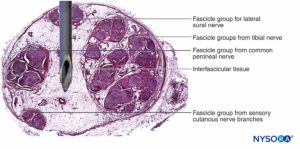
FIGURA 15. Sovrapposizione dell'ago nel nervo sciatico, approccio posteriore. Se l'ago della neurostimolazione perfora il nervo, in base alle immagini statiche, l'ago ferisce i fascicoli. Osservare la differenza di dimensioni tra ago e fascicoli. Se c'è una grande quantità di tessuto interfascicolare, come accade all'interno del nervo sciatico, il rischio di lesioni fascicolari è ridotto. (Riprodotto con il permesso di Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
In un modello di roditore, Whitlock ha dimostrato che l'iniezione intrafascicolare di ropivacaina allo 0.75% provocava gravi anomalie istologiche, tra cui demielinizzazione, degenerazione assonale e degenerazione walleriana. Tuttavia, anche l'iniezione extrafascicolare di ropivacaina allo 0.75% ha provocato un danno assonale, sebbene di gravità ridotta. Farber e colleghi hanno recentemente riferito che tutti gli anestetici locali comunemente usati (bupivacaina, lidocaina e ropivacaina) hanno prodotto lesioni nervose quando iniettati per via intrafascicolare. Nel loro studio, il grado di lesione è diminuito con l'aumentare della distanza dal sito di iniezione. Da notare, anche la somministrazione di soluzione salina intrafascicolare ha provocato un danno intermedio ai nervi, indicando un livello di lesione di base associato all'iniezione di qualsiasi agente in un nervo.
Consigli NYSORA
Mentre l'importanza clinica della neurotossicità rimane controversa, la posizione della punta dell'ago durante l'iniezione dell'anestetico locale gioca un ruolo cruciale nel determinare la probabilità e la gravità della lesione nervosa.
Lesione infiammatoria
I meccanismi infiammatori della PNI vengono sempre più riconosciuti come un meccanismo importante nel deficit neurologico post-PNB. Risposte infiammatorie aspecifiche che colpiscono i nervi periferici possono verificarsi sia a distanza dal sito dell'intervento chirurgico che all'interno dell'arto operatorio, dove può essere difficile distinguere da altre cause di PNI. Meccanismi infiammatori sono stati proposti come responsabili di lesioni persistenti del nervo frenico a seguito di blocco interscalenico per chirurgia della spalla (Figure 12 ). Kaufman e colleghi hanno riportato una serie di 14 pazienti con paralisi diaframmatica cronica a seguito di blocco interscalenico.
Durante l'esplorazione chirurgica, aderenze, ispessimento fasciale, alterazioni vascolari e tessuto cicatriziale (presente in 10 su 14 pazienti) che coinvolgono il nervo frenico suggerivano un'infiammazione cronica ed erano coerenti con la neuropatia da compressione. Ricerche recenti hanno suggerito che l'iniezione intratecale e intraneurale di gel per ultrasuoni può anche portare a un'infiammazione nei nervi subaracnoidei e periferici, rispettivamente.
EZIOLOGIA DELLA LESIONI NERVOSE A SEGUITO DI BLOCCO DEL NERVO PERIFERICO
Fattori anestetici
Diversi studi hanno riportato che il tipo di anestesia (regionale vs generale) non sembra influenzare l'incidenza di PNI. L'Università del Michigan ha eseguito un'analisi retrospettiva del PNI e non ha identificato il PNB come fattore di rischio indipendente per PNI nelle loro serie. Tre studi epidemiologici della Mayo Clinic hanno riportato che l'anestesia regionale non aumenta il rischio di PNI dopo l'artroplastica totale del ginocchio (TKA), l'artroplastica totale dell'anca (THA) e l'artroplastica totale della spalla. La letteratura chirurgica recente ha suggerito che il rischio di danno neurologico postoperatorio associato al PNB potrebbe essere superiore a quello riportato nella letteratura sull'anestesia. Discutiamo di diversi fattori tecnici relativi al PNB che possono aumentare il rischio di PNI.
Iniezione intraneurale
L'evitamento di traumi intenzionali ai nervi, inclusa l'iniezione intraneurale, è probabilmente un principio chiave di sicurezza dell'anestesia regionale. Tuttavia, nella pratica clinica può verificarsi un'iniezione intraneurale senza dare luogo a segni evidenti di danno nervoso. In effetti, l'iniezione epinevrale intraneurale (ma probabilmente extrafascicolare) non intenzionale può essere più comune di quanto precedentemente riconosciuto. I presunti rischi dell'iniezione intraneurale sono stati contestati da Bigeleisen e colleghi, i quali hanno riferito che la puntura del nervo e l'apparente iniezione intraneurale durante il blocco del plesso brachiale ascellare in pazienti sani non hanno portato a lesioni neurologiche. Uno studio più ampio di Liu ha reclutato 257 pazienti giovani e sani con blocco interscalenico o sopraclavicolare ecoguidato per la chirurgia della spalla. L'incidenza dell'iniezione intraneurale non intenzionale era del 17% senza che si verificasse alcuna PNI. Tuttavia, l'esperienza clinica è limitata e le dimensioni del campione degli studi attuali sono inadeguate per catturare eventi rari, come le lesioni nervose. Al contrario, in un caso clinico di Cohen, la PNI si è verificata a seguito di iniezione intraneurale durante il blocco interscalenico ecoguidato.
Sfortunatamente, i rapporti sull'iniezione intraneurale non ci informano sui siti di iniezione in relazione ai fascicoli. Distinguere l'epineurio esterno di un nervo periferico dai tessuti circostanti utilizzando l'imaging a ultrasuoni è impegnativo.
Orebaugh ha eseguito finte iniezioni interscaleniche (anche se con piccoli volumi) in un modello di cadavere. L'imaging a ultrasuoni non è in grado di differenziare i componenti neurali extrafascicolari e intrafascicolari nell'intervallo di posizioni in cui viene eseguito il PNB. Inoltre, un'iniezione adiacente all'epineurio esterno può generare un alone simile nell'aspetto a un'iniezione intraneurale, rendendo difficile distinguere il posizionamento dell'ago pericoloso da quello non pericoloso. È importante sottolineare che solo una piccola quantità di anestetico locale (p. es., 0.1–0.5 ml) è sufficiente per la rottura del fascicolo e del suo perineurio.
Consigli NYSORA
Fare affidamento sull'osservazione del gonfiore dei nervi sugli ultrasuoni durante i PNB come metodo di monitoraggio è inadeguato per il rilevamento dell'iniezione intrafascicolare e la prevenzione delle lesioni.
I dati sperimentali e clinici più recenti suggeriscono che la PNI dall'iniezione di anestetico locale nel nervo si verifica e rimane un vero pericolo clinico. Le sequele di tale lesione possono essere di lunga durata e richiedere un intervento chirurgico.
PNB prossimale contro distale e rischio di danno neurologico
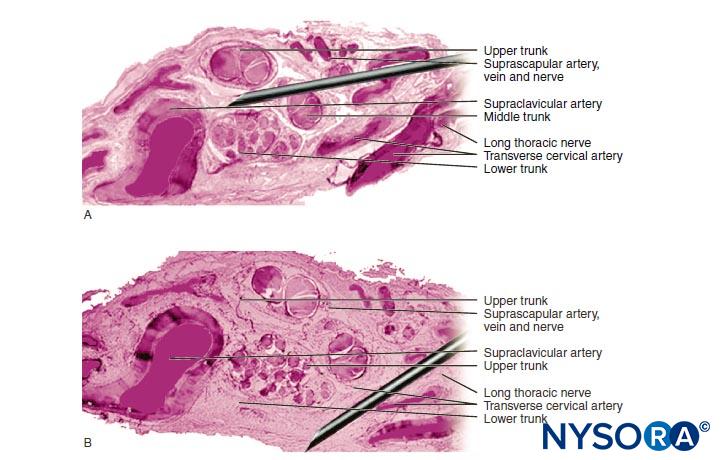
Le iniezioni di PNB in siti più prossimali (cioè radici del plesso brachiale vs nervi periferici del plesso brachiale) (Figure 9, 10 e 11) possono essere a maggior rischio di lesioni nervose rispetto ai siti distali di PNB. Ciò è probabilmente dovuto alle differenze nell'architettura neurale, principalmente al rapporto tra tessuto neurale e tessuto non neurale (connettivo) (Figure 16 ). Clinicamente, l'iniezione intraneurale nel tessuto connettivo extrafascicolare all'interno dell'epineurio può non provocare lesioni nervose. Ciò è coerente con il lavoro sperimentale che ha correlato l'iniezione intrafascicolare alla lesione da iniezione del nervo periferico.
L'organizzazione strutturale del nervo periferico fornisce informazioni sul rischio relativo di lesioni meccaniche tra nervi diversi o anche in posizioni diverse all'interno dello stesso nervo (Figure 16 ). Poiché l'epinevrio è in genere uno strato più duro rispetto al tessuto adiposo circostante, i nervi tendono a essere "spinti via" da un ago che avanza, piuttosto che penetrati.
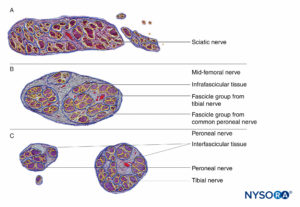
FIGURA 16. Sezione trasversale del nervo sciatico nella regione sottoglutea (A), nella regione medio-femorale (B) e nei nervi tibiale e peroneale nella regione poplitea (C). (Riprodotto con il permesso di Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
Allo stesso modo, quando l'epinevrio viene penetrato da un ago, è molto più probabile che la punta dell'ago e l'iniezione entrino nel tessuto adiposo interfascicolare rispetto ai fascicoli (Figure 15 ). Il tessuto adiposo all'interno dell'epinevrio consente ai fascicoli di sfuggire all'avanzamento dell'ago; tuttavia, questa protezione può essere minata da un brusco avanzamento dell'ago o da un forte contatto ago-nervo. I nervi caratterizzati da fascicoli fitti e un elevato contenuto di tessuto da fascicolare a connettivo possono essere maggiormente a rischio di danno meccanico del nervo rispetto a quelli caratterizzati da un contenuto di tessuto da fascicolare a connettivo inferiore.
Incidenze relativamente elevate di sequele neurologiche transitorie sono riportate dopo il blocco interscalenico, dove c'è un rapporto 1:1 tra tessuto neurale e non neurale (Figure 12 ). Diversi studi hanno documentato un'incidenza piuttosto elevata di sintomi neurologici dopo il blocco del plesso brachiale, ma senza gravi sequele. In altri studi, c'era un basso numero assoluto di complicanze neurologiche correlate al PNB degli arti superiori, rendendo problematico qualsiasi confronto dei risultati nei siti prossimali con quelli distali.
I tassi di lesioni a seguito di PNB degli arti inferiori sono stati riportati come 0.41% (intervallo di confidenza 95% [CI], 0.02–9.96) nella regione glutea, rispetto allo 0.24% (IC 95%, 0.10–0.61) nella regione poplitea, indicando no differenza significativa. È possibile che molti dei sintomi neurologici riportati dai pazienti dopo l'intervento di PNB siano infiammatori e dovuti al contatto ago-nervo o all'iniezione forzata, portando a un'infiammazione intraneurale, che porta a sintomi, come dimostrato da Steinfeldt. Pertanto, la saggezza nell'insegnamento di Selander secondo cui "i nervi dovrebbero essere maneggiati con cura" rimane rilevante.
Tipo ago
Le caratteristiche della punta dell'ago influenzano la probabilità di penetrazione fascicolare e lesioni nervose. Gli aghi a smusso lungo hanno maggiori probabilità di perforare ed entrare nel fascicolo rispetto agli aghi a smusso corto; tuttavia, gli aghi a smusso corto sembrano causare più danni in caso di penetrazione fascicolare (Figure 17 ). La gravità della lesione nervosa dopo la perforazione del nervo dell'ago è anche legata al diametro dell'ago; tuttavia, non esiste tale differenza per quanto riguarda l'entità dell'infiammazione dopo un trauma del nervo dell'ago.
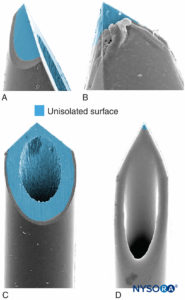
FIGURA 17. Presentata è la neurostimolazione calibro 21, ago periferico di tipo A (A e B) e di tipo D (C e D). Microscopia elettronica a scansione. (Riprodotto con il permesso di Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
L'effetto della progettazione dell'ago sulla probabilità e sulla gravità della lesione del nervo meccanico è stato ampiamente dibattuto. Non sorprende che il trauma meccanico dell'ago e l'iniezione intraneurale siano meccanismi chiave nel danno iatrogeno del nervo, come con l'anestesia regionale. Ad esempio, nell'ambito dell'anestesia neuroassiale, le lesioni durali prodotte da diversi tipi di aghi variano notevolmente nella morfologia; un ago Whitacre produce un'apertura più traumatica, con lacerazione e grave rottura delle fibre di collagene, rispetto a un ago stile Quincke. Allo stesso modo, la probabilità e l'entità della lesione meccanica ai fasci nervosi dopo l'iniezione intraneurale durante il PNB dipendono anche dal design della punta dell'ago. Sembra intuitivo che i tipi di aghi a smusso corto abbiano meno probabilità di penetrare negli strati protettivi del tessuto connettivo dei nervi periferici (epinevrio, perinevrio). In effetti, Selander e colleghi hanno documentato che un ago con una smussatura di 45° ha molte meno probabilità di penetrare nel perineurio e infliggere lesioni fascicolari rispetto a un ago con una smussatura di 15°. Tuttavia, se un fascicolo nervoso viene impalato accidentalmente durante una procedura di blocco nervoso, le lesioni indotte dagli aghi a smusso corto possono essere più gravi e richiedere più tempo per la riparazione rispetto a quelle indotte dagli aghi a smusso lungo.
Fattori chirurgici
Requisiti di posizionamento chirurgico
Complicazioni neurologiche possono verificarsi in seguito al posizionamento per esigenze chirurgiche. I meccanismi di lesione dei nervi correlati alla chirurgia includono trazione, transezione, compressione, contusione, ischemia e allungamento. Indipendentemente dal meccanismo, il percorso finale della lesione nervosa può includere i seguenti fattori: interruzione fisica dei vasi sanguigni intraneurali che causa ischemia o emorragia a chiazze; pressioni venose intraneurali elevate; edema endoneurale; compromissione del flusso assoplasmatico; Danno alle cellule di Schwann; spostamento della mielina; degenerazione assonale; e degenerazione walleriana. Durante l'intervento chirurgico, i pazienti vengono posti in posizioni che altrimenti non tollererebbero se non anestetizzati. Inoltre, le forze fisiche richieste durante l'intervento chirurgico (p. es., posizionamento di protesi) possono essere eccessive, potenzialmente sollecitando strutture anatomiche lontane dal sito chirurgico, inclusa la colonna vertebrale.
In un'analisi dei reclami chiusi, 9 su 53 lesioni del plesso brachiale correlate all'anestetico erano correlate al posizionamento intraoperatorio (bretelle a testa in giù [tre affermazioni], braccio del paziente sospeso su una sbarra [due affermazioni] e altre posizioni errate [ quattro rivendicazioni]). Solo due affermazioni erano relative a una tecnica di anestesia regionale.
Effetti del laccio emostatico pneumatico
Il gonfiaggio del laccio emostatico provoca danni ai nervi per deformazione meccanica o ischemia. Le caratteristiche principali della neuropatia del laccio emostatico includono debolezza o paralisi, diminuzione del tatto, delle vibrazioni e del senso della posizione e sensi preservati di calore, freddo e dolore. In un modello sperimentale, la compressione del laccio emostatico ha provocato un aumento della permeabilità vascolare, edema intraneurale e degenerazione del nervo sciatico.
Ad esempio, la compressione del laccio emostatico durante un intervento chirurgico di meniscectomia può portare alla denervazione del nervo femorale e al recupero funzionale ritardato. Come metodi per prevenire la neuropatia del laccio emostatico sono stati proposti lacci emostatici più ampi, che utilizzano pressioni del bracciale inferiori e limitando la durata del gonfiaggio.
Neuropatia infiammatoria postchirurgica
I pazienti con neuropatia infiammatoria post-chirurgica presentano tipicamente una neuropatia che è ritardata nell'esordio e lontana dall'intervento chirurgico. Le neuropatie sono focali e multifocali con dolore e debolezza. È responsabile un meccanismo infiammatorio-immunitario e vi sono prove di degenerazione assonale e infiammazione mediata dai linfociti.
Consigli NYSORA
Non tutti gli episodi di PNI sono di origine meccanica.
Fattori del paziente
Neuropatia preesistente
Nei pazienti che si presentano all'intervento chirurgico può essere presente un deficit neurologico preoperatorio o una compromissione neurale, sia per intrappolamento nervoso che per ragioni metaboliche, ischemiche, tossiche, ereditarie e demielinizzanti. Molte di queste condizioni neurologiche preesistenti sono subcliniche, ma possono essere associate ad un aumentato rischio di PNI nel postoperatorio. Ad esempio, la spondilosi cervicale spesso trascurata, ma comune, può provocare un'apertura ruvida e irregolare del forame intervertebrale.
Il complesso nervo spinale-radice nervosa diventa soggetto a traumi ripetuti, con conseguente fibrosi che riduce la sua mobilità. Il complesso nervo spinale-radice nervosa è di conseguenza ad aumentato rischio di lesioni da trazione durante il movimento e il posizionamento degli arti superiori. Il nervo ulnare può rimanere intrappolato nel tunnel cubitale al gomito o al polso. I fattori di rischio per la neuropatia ulnare perioperatoria includono il sesso maschile, gli estremi dell'habitus corporeo e il ricovero prolungato.
Le neuropatie diabetiche sono comuni e rappresentano un'ampia gamma di entità cliniche comunemente risultanti in polineuropatia sensoriale simmetrica distale. Le neuropatie diabetiche asimmetriche comprendono la neuropatia motoria prossimale acuta o subacuta (spesso dolorosa), la neuropatia cranica, la neuropatia del tronco o toraco-addominale (spesso dolorosa) e la neuropatia da intrappolamento degli arti. La radicolopatia lombare diabetica può presentarsi con dolore che si irradia dalla schiena agli arti inferiori e lieve debolezza.
Potrebbe esserci una neuropatia diffusa con elettromiografia anormale dei muscoli paraspinali e dei muscoli innervati dal plesso sacrale, dai nervi glutei, femorali e sciatici. I pazienti anziani con diabete possono avere un coinvolgimento prossimale e distale combinato, ponendo questi pazienti ad aumentato rischio di PNI. Le fibre nervose diabetiche possono essere più suscettibili agli effetti tossici degli anestetici locali a causa dell'ipossia ischemica cronica e perché i nervi sono esposti a concentrazioni maggiori di anestetici locali correlate alla diminuzione del flusso sanguigno. L'insorgenza di PNI dopo blocco neuroassiale in pazienti con neuropatia diabetica è stata segnalata come maggiore (0.4%; IC 95%, 0.1%–1.3%) rispetto alla popolazione generale; tuttavia, la sua vera rilevanza clinica è controversa poiché molti di questi pazienti sono tra i maggiori beneficiari di PNB.
Allo stesso modo, non è noto il rischio effettivo di PNB nel contesto di gravi malattie vascolari periferiche, vasculite, fumo di sigaretta e ipertensione. Indipendentemente da ciò, i pazienti con queste condizioni potrebbero essere più vulnerabili a ulteriori insulti ischemici durante il periodo perioperatorio, in modo simile ai pazienti con neuropatie indotte da alcol e cisplatino. I pazienti con sclerosi multipla e neuropatia ereditaria possono avere una compromissione neurale preoperatoria subclinica all'interno del sistema nervoso periferico.
Stenosi del canale lombare
La stenosi del canale spinale lombare può esagerare una lesione periferica, influenzando negativamente il recupero fisico. La stenosi del canale spinale è un fattore di rischio per la paralisi peroneale comune a seguito di THA e può essere significativa nei casi di paraplegia o sindrome della cauda equina dopo anestesia epidurale. Hebl ha documentato deficit neurologici nuovi o progressivi a seguito di anestesia neuroassiale in pazienti con stenosi del canale spinale preesistente o malattia del disco lombare. Complessivamente, 10 (1.1%, IC 95% 0.5%–2.0%) pazienti hanno sviluppato nuovi deficit o peggioramento di sintomi preesistenti. La frequenza delle complicanze era maggiore nei pazienti che avevano radicolopatia compressiva o diagnosi neuroassiali centrali multiple. Tuttavia, è probabile che vi fossero molteplici fattori eziologici perché i deficit spesso erano correlati con il lato della patologia preesistente o della procedura chirurgica. Un riepilogo dei fattori anatomici, anestetici, chirurgici e del paziente che contribuiscono alla PNI è elencato in Tabella 3.
TABELLA 3. Riepilogo dei fattori anatomici, anestetici, chirurgici e del paziente che contribuiscono alla lesione nervosa perioperatoria.
| Fattore potenzialmente contribuente o rilevante per PNI | Commento | |
|---|---|---|
| anatomico | Morfologia interna del nervo, compreso il tessuto connettivo che sostiene i fascicoli e gli assoni1,63 | Il tessuto epinevriale può offrire protezione da traumi diretti e compressione esterna |
| Fattori anatomici grossolani: posizione, decorso, relazioni, attaccamenti e mobilità relativa dei nervi1 | - | |
| Strutture specifiche sono a rischio | Esempi: nervo ulnare al gomito,76,99 CPN 81,100,101 | |
| Anestetico | Tipo di anestesia | EA e GA ma non PNB erano associati a PNI.47 PNB non associato a PNI a seguito di TKA,48 TA,49 o TSA.50 |
| Arto insensibile | Mette i nervi a rischio di compressione o allungamento76 | |
| Sito del PNB: prossimale ad aumentato rischio rispetto al PNB distale | Non supportato da evidenze cliniche | |
| Livello di sedazione durante il blocco nervoso | Continua ad essere controverso. Tuttavia, con il monitoraggio obiettivo della relazione ago-nervo e della disposizione dell'iniettato (US, stimolazione nervosa, monitoraggio della pressione di iniezione di apertura), è probabile che questo problema diventi muto. Per l'ultima raccomandazione pubblicata, consultare l'Advisory della pratica ASRA | |
| Trauma meccanico da ago, catetere o iniezione | - | |
| Tossicità diretta dell'anestetico locale | Dipende dal tempo e dalla concentrazione; rischio con esposizione intrafascicolare maggiore di quella extrafascicolare6,15 | |
| Ischemia neurale | Secondario alla compressione,76 vasocostrittori,19,20 iniezione intrafascicolare,54 laccio82,103 | |
| Laser Chirurgia | Trauma: contusione, compressione, retrazione, trazione, transezione | |
| Posizionamento perioperatorio76 | ||
| Laccio emostatico: durata del gonfiaggio e pressione81,104 Gonfiore, calchi in gesso Procedure specifiche hanno un profilo di rischio unico95 | Associato a marcati deficit clinici80 e alterazioni patologiche all'EMG84 I rischi di PNI a seguito di TKA,48 THA,49 e TSA50 erano rispettivamente dello 0.79%, 0.72% e 2.2% |
|
| pazienti | La compromissione neurale preoperatoria aumenta teoricamente il rischio di PNI | L'eziologia include cause di intrappolamento, metaboliche, ischemiche, tossiche,93 ereditarie e demielinizzanti94 |
| Stenosi del canale lombare | Può essere un fattore di rischio significativo dopo il blocco neuroassiale96,98 | |
| Altro (Eolico) | Meccanismo infiammatorio | Causa non meccanica fisicamente e temporalmente lontana dal PNB43 |
MONITORAGGIO DELLA DISTANZA AGO-NERVO DURANTE PNBS E PREVENZIONE DELLE COMPLICANZE
Sebbene il rischio di contatto ago-nervo, posizionamento dell'ago intraneurale e iniezione intraneurale sia stato recentemente messo in discussione in piccole serie cliniche in cui non si sono verificate lesioni evidenti, continuano a essere segnalate lesioni nervose correlate al PNB. Il team di Susan MacKinnon ha recentemente messo in guardia contro l'iniezione intraneurale intenzionale sulla base dei loro risultati di neurotossicità a seguito di iniezioni intrafascicolari di anestetici locali.
Questa pubblicazione in una delle principali riviste specializzate (Anestesia e Analgesia) metteva in guardia contro le recenti raccomandazioni di alcuni fornitori secondo cui l'iniezione intraneurale è priva di rischi e, in effetti, può essere utile per la qualità del blocco.
È importante notare che l'avvertimento del team di MacKinnon deriva da decenni di pratica clinica della chirurgia di riparazione dei nervi periferici e da oltre 350 pubblicazioni scientifiche sull'argomento. Sebbene l'incidenza delle lesioni nervose correlate al PNB sia relativamente rara, sono tra le complicanze invalidanti più comuni legate alla somministrazione dell'anestesia e sono probabilmente sottostimate in letteratura a causa delle implicazioni medicolegali e istituzionali legate alla reputazione. L'impatto potenzialmente devastante di una grave lesione nervosa sulla qualità della vita del paziente richiede un approccio sistematico per mitigare il rischio attraverso la standardizzazione delle tecniche di iniezione.
Elicitazione meccanica delle parestesie
L'associazione tra l'elicitazione meccanica delle parestesie e la conseguente PNI è stata oggetto di dibattito per molto tempo. Mentre alcuni ampi studi osservazionali hanno effettivamente implicato l'elicitazione di parestesie come fattore di rischio per PNI, tale associazione non è stata supportata da altri. Inoltre, l'insorgenza di parestesie non è un segno sensibile del contatto ago-nervo, poiché solo il 38% dei pazienti ha manifestato parestesie durante la visualizzazione in tempo reale del contatto ago-nervo.
Pertanto, l'assenza di parestesie durante l'esecuzione di un blocco nervoso non esclude in modo affidabile il contatto ago-nervo, e sono state riportate lesioni nervose sia in pazienti che hanno manifestato parestesie gravi sia in quelli che non hanno manifestato parestesie durante la procedura PNB. Indipendentemente da ciò, una grave parestesia o dolore all'avanzamento o all'iniezione dell'ago può indicare il posizionamento dell'ago intraneurale e, quando presente, deve indurre la cessazione dell'iniezione e il riposizionamento dell'ago.
Non è stato studiato se e come l'uso della sedazione profonda influenzi la percezione e l'interpretazione da parte dei pazienti della parestesia come sintomo. Allo stesso modo, i PNB ecoguidati spesso comportavano iniezioni multiple di aliquote di anestetico locale in diverse aree anatomiche. Non è noto come la diffusione dell'anestetico locale durante le tecniche di iniezione multipla e l'incipiente blocco sensoriale che si verifica durante la procedura possano avere un impatto sul valore della parestesia come monitor di sicurezza.
Stimolazione del nervo periferico
La risposta motoria alla stimolazione del nervo periferico si basa sulla legge di Coulomb, per cui è necessaria un'intensità di corrente inferiore (mA; o, più correttamente, energia elettrica) per suscitare una risposta motoria o sensoriale quando la punta dell'ago si avvicina al nervo.
L'importanza di evitare l'iniezione quando la risposta motoria è ottenuta da un'intensità di corrente molto bassa (<0.2 mA) e dal rischio di lesioni nervose è stata segnalata per la prima volta da Voelckel e colleghi. La lesione istologica del nervo si è verificata nel 50% dei suini quando la risposta motoria è stata ottenuta a meno di 0.2 mA, rispetto a nessun cambiamento istologico a 0.3–0.5 mA. È stato dimostrato che la presenza di una risposta motoria a meno di 0.2 mA è un indicatore specifico ma non sensibile del posizionamento dell'ago intraneurale sia negli animali che nell'uomo.
La stimolazione del nervo periferico come tecnica di localizzazione del nervo è caratterizzata da una sensibilità relativamente bassa ma da un'elevata specificità per prevedere la relativa vicinanza ago-nervo, suggerendo che tale risposta riflette effettivamente la distanza ago-assone. Sia i dati sperimentali che i rapporti clinici hanno dimostrato che una risposta motoria evocata potrebbe non essere provocata in modo affidabile quando l'ago viene posizionato nelle immediate vicinanze del nervo o anche per via intraneurale. Tuttavia, la stessa ricerca ha indicato che quando una risposta motoria viene suscitata a bassa intensità di corrente (p. es., < 0.5 mA, 0.1 ms), la punta dell'ago è invariabilmente posizionata sul nervo o all'interno del nervo. È importante sottolineare che la stimolazione del nervo periferico ha resistito alla prova del tempo, come evidenziato dai più grandi set di dati pubblicati relativi al PNI, che si basavano tutti principalmente sulla stimolazione del nervo periferico per ottenere un PNB sicuro e di successo.
Apertura del monitoraggio della pressione di iniezione
L'associazione tra alte pressioni di iniezione e iniezione intrafascicolare è stata descritta per la prima volta nel 1979 da Selander e successivamente studiata in diversi modelli animali. In un modello di cane, un'iniezione intrafascicolare intenzionale è stata associata sia a un'elevata pressione di apertura dell'iniezione (≥25 psi) che a una corrispondente lesione nervosa clinica e istologica. Al contrario, le iniezioni extrafascicolari non erano associate a pressioni di iniezione elevate oa lesioni nervose. In un altro studio su un modello di cane, anche un'elevata pressione di iniezione (≥20 psi) è stata associata all'iniezione intrafascicolare nonché a lesioni nervose cliniche e istologiche, mentre l'iniezione intraneurale ma interfascicolare era associata a una bassa pressione di iniezione (<10 psi) e nessuna neurologia o conseguenze istologiche. Durante l'iniezione intraneurale nei nervi mediani dei suini, Lupu e colleghi non sono stati in grado di rilevare una correlazione significativa tra la pressione massima generata e la lesione nervosa clinica o istologica. In questo studio, le pressioni di iniezione di picco erano ben al di sotto di 25 psi, ma 7 campioni di nervi su 10 avevano evidenza di danno assonale all'esame istologico. In un caso, si è verificato un danno assonale a seguito di una pressione di iniezione massima di soli 2.2 psi. È importante sottolineare che i deficit funzionali misurati fino a 7 giorni dopo l'insulto erano assenti in tutti i 10 suini studiati. Più recentemente, nel primo studio di questo tipo su tessuto umano, Orebaugh e colleghi hanno riferito che il 100% delle iniezioni direttamente nelle radici del plesso brachiale di cadaveri umani freschi ha provocato pressioni di iniezione elevate (> 30 psi), con un'occorrenza di diffusione dell'iniezione nello spazio epidurale. È importante sottolineare che l'analisi delle curve della pressione di iniezione raggiunta ha indicato che tutte le iniezioni nelle radici del plesso brachiale erano associate a pressioni superiori a 15 psi.
Dati simili sulla relazione pressione di iniezione-nervo sono stati riportati da Krol et al nei nervi periferici. In uno studio sul monitoraggio della pressione durante le iniezioni di PNB del nervo mediano, radiale e ulnare in cadaveri umani freschi, gli autori hanno riportato differenze significative tra le pressioni di iniezione intraneurale e perineurale. Le pressioni di iniezione intraneurale hanno mostrato una bassa specificità ma un'elevata sensibilità con il posizionamento dell'ago intraneurale.
Diversi studi hanno utilizzato la pressione di iniezione come strumento di monitoraggio per l'iniezione intraneurale (intraepineurale) durante il blocco del nervo sciatico senza complicazioni. Robards e colleghi hanno studiato 24 pazienti, ciascuno dei quali ha ricevuto un'iniezione all'interno del nervo sciatico a livello della fossa poplitea. Pressioni di iniezione inferiori a 20 psi sono state registrate in 20 pazienti, mentre pressioni di iniezione superiori a 20 psi sono state osservate nei restanti 4 pazienti, provocando la cessazione dell'iniezione; nessuno dei pazienti ha sofferto di disfunzioni neurologiche, suggerendo che le iniezioni avvenute per via intraneurale fossero extrafascicolari.
In uno studio sulle soglie di stimolazione intraneurale durante i blocchi del plesso brachiale sopraclaveare ecoguidati, Bigeleisen e colleghi hanno riportato che una combinazione di alta resistenza all'iniezione, bassa stimolazione di corrente e dolore all'iniezione coincideva in due pazienti con un posizionamento dell'ago intraneurale che richiedeva il riposizionamento dell'ago prima completare l'iniezione senza complicazioni.
Oltre al rischio di danno neurologico, pressioni di iniezione elevate possono portare a molti altri effetti indesiderati o gravi complicazioni. Ad esempio, Gadsden e colleghi hanno riferito che un'elevata pressione di iniezione durante il blocco del plesso lombare comporta un rischio di diffusione epidurale (Figure 18 e 19). In questo studio, pressioni di iniezione superiori a 20 psi durante il blocco del plesso lombare hanno portato a un rischio inaccettabile di blocco epidurale di alto livello, in alcuni pazienti fino al livello di T3, rendendo necessaria la conclusione anticipata dello studio per motivi di sicurezza.
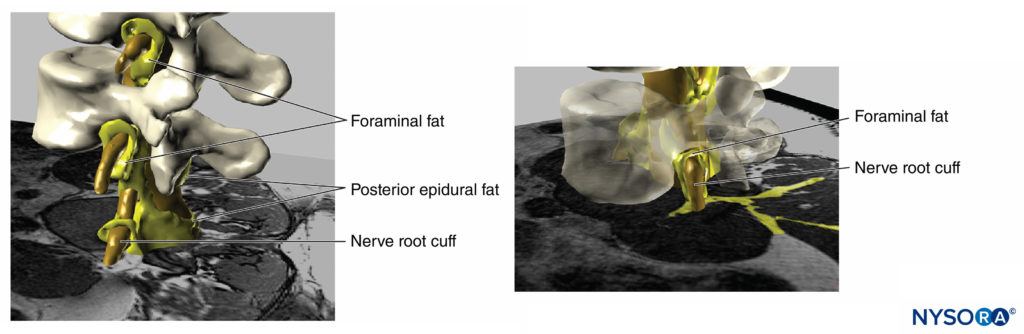
FIGURA 18. Ricostruzione tridimensionale dell'immagine MRI di vertebre, sacco durale, grasso epidurale e tessuto adiposo foraminale. Le aree dipinte di giallo rappresentano le interconnessioni tra i tessuti adiposi che possono fungere da potenziali percorsi di diffusione per le soluzioni iniettate. (Usato con il permesso di MA Reina.)
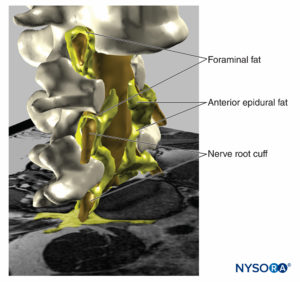
FIGURA 19. Ricostruzione tridimensionale di vertebre, sacco durale, grasso epidurale e grasso foraminale da immagini di risonanza magnetica di un paziente. Possiamo vedere il potenziale percorso attraverso il grasso dal grasso epidurale, grasso foraminale, ad altri compartimenti adiposi, poiché il grasso avvolge le radici nervose all'esterno del canale foraminale della colonna vertebrale o il grasso che si trova tra le fasce muscolari. Sono stati rimossi due corpi vertebrali, consentendo la visualizzazione del grasso epidurale nello spazio epidurale anteriore. (Usato con il permesso di MA Reina.)
Più recentemente, Gautier et al hanno riferito che un'elevata pressione di iniezione durante l'iniezione interscalenica può portare a una sostanziale diffusione epidurale dell'iniettato. Il rapporto di Gautier ha offerto una spiegazione per la precipitosa morte respiratoria e cardiovascolare occasionalmente segnalata immediatamente dopo il blocco interscalano, oltre a suggerire che la forza/pressione di iniezione dovrebbe essere monitorata durante il processo di iniezione. La valutazione della pressione di iniezione (resistenza) durante il PNB è di crescente interesse per medici e ricercatori. Ciò non sorprende, dato che l'iniezione in fasci nervosi densamente compressi richiede più forza per iniziare un'iniezione (pressione di apertura) rispetto alle iniezioni perineurali o intraneurali-interfascicolari nel tessuto connettivo perineurale o perifascicolare lasso (Figure 12, 14 e 15).
Nel tentativo di standardizzare il monitoraggio e la documentazione delle procedure di blocco nervoso, un gruppo di esperti nordamericani ha suggerito di documentare la resistenza all'iniezione come uno degli elementi della nota clinica standard. Tuttavia, due gruppi indipendenti hanno scoperto che l'accuratezza del medico nella misurazione della pressione di iniezione o del tessuto iniettato è limitata quando si utilizza una tecnica soggettiva di sensazione della siringa, mettendo così in dubbio l'affidabilità delle valutazioni soggettive. Nel frattempo, sono stati raccomandati diversi mezzi per monitorare le pressioni di iniezione.
Presi insieme, i dati fino ad oggi suggeriscono che un'elevata pressione di iniezione di apertura può rilevare un'iniezione intrafascicolare, ma non un'iniezione interfascicolare intraneurale. Nel primo studio sui pazienti, Gadsden e colleghi hanno dimostrato che la pressione di iniezione di apertura con la punta dell'ago a 1 mm di distanza dalle radici nervose del plesso brachiale interscalenico era costantemente inferiore a 15 psi (pressione di picco media 8.2 ± 2.4 psi). Al contrario, la pressione di apertura dell'iniezione durante il contatto ago-nervo era di 15 psi o più (pressione di picco media 20.9 ± 3.7 psi) in 35 su 36 iniezioni. In questo studio, l'interruzione dell'iniezione quando la pressione di iniezione di apertura ha raggiunto 15 psi ha impedito in modo affidabile l'inizio dell'iniezione nel 97% dei casi di contatti ago-nervo. Inoltre, l'iniezione ad alta apertura può correlare bene con altri indici di contatto ago-nervo, come la stimolazione a bassa corrente e la parestesia all'iniezione.
In uno studio di follow-up, Gadsden et al hanno utilizzato una metodologia simile per determinare se un'elevata pressione di apertura può anche rilevare il contatto ago-nervo nei nervi periferici, come il nervo femorale. I ricercatori hanno riferito che un'elevata pressione di iniezione di apertura rilevava costantemente (97%) il contatto ago-nervo e impediva un'iniezione contro il nervo o i fasci femorali. Inoltre, la loro ricerca ha suggerito che un'elevata pressione di iniezione di apertura può rilevare l'inserimento dell'ago in un piano tissutale sbagliato. In questo rapporto, l'impossibilità di iniettare anestetico locale con pressione di iniezione di apertura inferiore a 15 psi ha rilevato il 100% dei casi di posizionamento dell'ago sull'aspetto sbagliato della fascia iliaca.
Sono necessarie ulteriori ricerche per determinare i vantaggi clinici del monitoraggio di routine della pressione di iniezione e gli effettivi valori di pressione di iniezione di apertura "sicuri" per varie procedure di blocco nervoso. Indipendentemente da ciò, esistono dati sufficienti per suggerire che il monitoraggio della pressione di iniezione di apertura durante i blocchi del nervo interscalenico e femorale aggiunge ulteriori informazioni critiche sulla sicurezza che possono influenzare il processo decisionale clinico. Il monitoraggio della pressione di iniezione può rivelarsi molto utile per il suo valore predittivo negativo per la lesione del nervo funzionale, poiché in letteratura non sono stati riportati casi di neuropatia clinicamente significativa con basse pressioni di iniezione. Sulla base dei dati disponibili, evitare l'elevata resistenza e una pressione di iniezione di apertura superiore a 15 psi sembra essere una strategia prudente. Per lo meno, questo perché durante le iniezioni di blocchi nervosi, le iniezioni nel tessuto connettivo perineurale lasso non dovrebbero mai richiedere più di 15 psi; pertanto, quando viene raggiunta la pressione di apertura di 15 psi prima che avvenga effettivamente l'iniezione, l'operatore ha l'opportunità di riposizionare l'ago lontano dal nervo prima dell'iniezione nello spazio tissutale sbagliato o in parti vulnerabili del nervo (fascicoli, contatto ago-nervo) .
Impedenza elettrica
Il monitoraggio dell'impedenza elettrica misura la resistenza al flusso di una corrente alternata in un circuito elettrico e potrebbe essere aggiunto agli stimolatori nervosi esistenti. L'impedenza elettrica è sensibile ai cambiamenti nella composizione dei tessuti, in particolare nel contenuto di acqua. In un modello di nervo sciatico di maiale, Tsui e colleghi hanno dimostrato che i nervi hanno una maggiore impedenza elettrica rispetto al muscolo circostante e al fluido interstiziale a causa del loro basso contenuto di acqua e di lipidi. Hanno scoperto che l'impedenza elettrica aumentava bruscamente all'ingresso nel compartimento intraneurale rispetto al compartimento extraneurale. Non è stato possibile determinare il valore assoluto al quale si è verificato il posizionamento dell'ago intraneurale a causa della sostanziale varianza all'interno dei dati.
Sebbene il monitoraggio dell'impedenza elettrica sembri promettente per rilevare il posizionamento della punta dell'ago intraneurale, implica necessariamente che la puntura del nervo deve avvenire prima che venga rilevato un cambiamento nell'impedenza. Ci sono anche prove ragionevolmente forti che la misurazione dell'impedenza elettrica può differenziare il posizionamento intravascolare di un ago da quello perineurale quando il 5% di destrosio in acqua viene iniettato prima dell'esecuzione del blocco. Sulla base dei dati attualmente disponibili, il monitoraggio dell'impedenza può differenziare tra determinati tessuti, come i muscoli e il tessuto adiposo/connettivo. Tuttavia, la variabilità delle misurazioni dell'impedenza tra nervi diversi o anche gli stessi nervi in posizioni diverse richiede ulteriori ricerche prima di poter formulare qualsiasi raccomandazione sulla potenziale applicabilità clinica di questa modalità.
Ultrasuono
Sebbene gli ultrasuoni possano rilevare l'iniezione intraneurale, l'uso diffuso della guida ecografica non ha ridotto il tasso di PNI. Negli animali, gli ultrasuoni sono abbastanza sensibili da rilevare solo 1 ml di iniettato; tuttavia, una quantità molto minore di iniettato è sufficiente per ferire i fascicoli.
Indipendentemente da ciò, nessuno studio animale o umano fino ad oggi ha dimostrato in modo definitivo un'associazione tra la visualizzazione ecografica in tempo reale dell'iniezione intraneurale di anestetico locale e la conseguente lesione nervosa funzionale (o altrimenti clinicamente importante). Una ragione potrebbe essere che la risoluzione delle attuali macchine a ultrasuoni prodotte non è sufficientemente alta per differenziare l'iniezione intrafascicolare potenzialmente pericolosa dall'iniezione nel compartimento extrafascicolare potenzialmente più tollerante.
Inoltre, la capacità di interpretare tali immagini dipende fortemente dall'utente e la capacità di ottenere immagini di qualità ad alta definizione varia tra i pazienti. L'uso della guida ecografica ha sostanzialmente facilitato l'insegnamento e reso popolare l'utilizzo dei PNB diminuendo l'incidenza della tossicità sistemica degli anestetici locali. Tuttavia, negli studi fino ad oggi, gli ultrasuoni non hanno ridotto l'incidenza di PNI. Ulteriori informazioni su ultrasuoni e monitoraggio sono trattate in Monitoraggio, documentazione e consenso per le procedure di anestesia regionale.
Consigli NYSORA
I principali meccanismi della lesione mediata da PNB includono trauma meccanico, ischemia, tossicità da anestetico locale e infiammazione. La principale fonte di complicanze neurologiche mediate da PNB è probabilmente la lesione fascicolare meccanica o l'iniezione di anestetico locale in un fascicolo, che causa la mielina e la degenerazione assonale.
SOMMARIO
Le complicanze neurologiche associate al PNB sono multifattoriali e associate a una serie di processi perioperatori e fattori del paziente, anestetici e chirurgici. L'anatomia dei nervi periferici è variabile per posizione, struttura e suscettibilità alle lesioni. I principali meccanismi della lesione mediata da PNB includono trauma meccanico, ischemia, tossicità da anestetico locale e infiammazione. La principale fonte di complicanze neurologiche mediate da PNB è probabilmente la lesione fascicolare meccanica o l'iniezione di anestetico locale in un fascicolo, che causa la mielina e la degenerazione assonale. Le incidenze riportate di complicanze neurologiche a seguito di PNB variano in modo significativo e l'interpretazione della letteratura è difficile a causa delle varie metodologie di studio, comprese le differenze negli esiti neurologici acquisiti. Fortunatamente, la maggior parte dei deficit neurologici postoperatori sembra risolversi nel tempo e l'incidenza di gravi complicanze neurologiche a lungo termine attribuibili al PNB è relativamente rara.
L'evitamento di traumi intenzionali ai nervi, inclusa l'iniezione intraneurale, è un principio chiave di sicurezza dell'anestesia regionale. In questo momento, ci sono prove che il monitoraggio obiettivo del posizionamento e dell'iniezione dell'ago, come ultrasuoni, stimolazione nervosa e pressione di apertura dell'iniezione, può aiutare a rilevare il contatto ago-nervo e il posizionamento dell'ago intraneurale. Sebbene, come con molti altri monitor nella pratica clinica (p. es., pulsossimetria), non ci siano prove che questi monitor possano ridurre l'incidenza di complicanze neurologiche, ci sono dati che suggeriscono che la loro combinazione dovrebbe conferire ulteriore sicurezza durante i PNB. Un'attenta selezione del paziente, l'uso combinato di più di una tecnica o monitoraggio di localizzazione del nervo, evitando l'iniezione con la pressione di apertura dell'iniezione e limitando il numero di passaggi dell'ago e iniezioni ove appropriato ridurrà ulteriormente il rischio e renderà la pratica dei PNB meno un'arte di una scienza.
BIBLIOGRAFIA
- Sunderland S: lesioni nervose e loro riparazione: una valutazione critica. Churchill Livingstone, 1991.
- Boezaart AP: Quella che chiamiamo rosa con qualsiasi altro nome avrebbe un odore altrettanto dolce e le sue spine farebbero altrettanto male. Reg Anesth Antidolorifico 2009;34:3–7.
- Seddon HJ: Una classificazione delle lesioni nervose. Fr Med J 1942;2: 237–239.
- Sunderland S: una classificazione delle lesioni dei nervi periferici che producono perdita di funzione. Cervello 1951;74:491–516.
- Brull R, McCartney CJ, Chan VW, El-Beheiry H: Complicanze neurologiche dopo l'anestesia regionale: stime contemporanee del rischio. Anesth Analg 2007;104:965–974.
- Hogan QH: Fisiopatologia della lesione del nervo periferico durante l'anestesia regionale. Reg Anesth Antidolorifico 2008;33:435–441.
- Burnett MG, Zager EL: Fisiopatologia della lesione del nervo periferico: una breve rassegna. Focus sulla neurochirurgia 2004;16:E1.
- Steinfeldt T, Poeschl S, Nimphius W, et al: Avanzamento forzato dell'ago durante il contatto ago-nervo in un modello suino: esito istologico. Anesth Analg 2011;113:417–420.
- Kerns JM: La microstruttura dei nervi periferici. Techn Reg Anesth Pain Manag 2008;12:127–133.
- Gentili F, Hudson AR, Kline D, Hunter D: Primi cambiamenti a seguito di lesioni da iniezione dei nervi periferici. Can J Surg 1980;23:177–182.
- Whitlock EL, Brenner MJ, Fox IK, Moradzadeh A, Hunter DA, Mackinnon SE: lesione da iniezione del nervo periferico indotta da ropivacaina nel modello di roditore. Anesth Analg 2010;111:214–220.
- Mackinnon SE, Hudson AR, Gentili F, Kline DG, Hunter D: Lesione da iniezione del nervo periferico con agenti steroidei. Plast Reconstr Surg 1982; 69:482–490.
- Gentili F, Hudson AR, Hunter D: Aspetti clinici e sperimentali delle lesioni da iniezione dei nervi periferici. Può J Neurol Sci 1980;7:143–151.
- Sala-Blanch X, Ribalta T, Rivas E, et al: Lesione strutturale del nervo sciatico umano dopo l'inserimento dell'ago intraneurale. Reg Anesth Antidolorifico 2009;34:201–205.
- Gentili F, Hudson A, Kline DG, Hunter D: lesione da iniezione del nervo periferico: uno studio sperimentale. Neurochirurgia 1979;4:244–253.
- Hadzic A, Dilberovic F, Shah S, et al: La combinazione di iniezione intraneurale e alta pressione di iniezione porta a lesioni fascicolari e deficit neurologici nei cani. Reg Anesth Antidolorifico 2004;29:417–423.
- Selander D, Edshage S, Wolff T: parestesie o nessuna parestesia? Lesioni nervose dopo blocchi ascellari. Acta Anaesthesiol Scand 1979;23:27–33.
- Selander D, Sjostrand J: diffusione longitudinale di anestetici locali iniettati per via intraneurale. Uno studio sperimentale della distribuzione neurale iniziale dopo iniezioni intraneurali. Acta Anaesthesiol Scand 1978;22: 622–634.
- Myers RR, Heckman HM: Effetti dell'anestesia locale sul flusso sanguigno del nervo: studi sull'uso della lidocaina con e senza epinefrina. Anestesiologia 1989;71:757–762.
- Partridge BL: Gli effetti degli anestetici locali e dell'epinefrina sul flusso sanguigno del nervo sciatico di ratto. Anestesiologia 1991;75:243–250.
- Rodriguez J, Taboada M, Garcia F, Bermudez M, Amor M, Alvarez J: Ematoma intraneurale dopo blocco femorale guidato dalla stimolazione nervosa in un paziente con deficit del fattore XI: caso clinico. J Clin Anesth 2011;23:
234-237. - Ben-David B, Stahl S: blocco ascellare complicato da ematoma e lesione del nervo radiale. Reg Anesth Antidolorifico 1999;24:264–266.
- Mackinnon SE, Hudson AR, Llamas F, Dellon AL, Kline DG, Hunter DA: lesione del nervo periferico mediante iniezione di chimopapaina. J Neurochirurgia 1984;61:1–8.
- Topuz K, Kutlay M, Simsek H, Atabey C, Demircan M, Senol Guney M: Protocollo di trattamento chirurgico precoce per la lesione del nervo sciatico dovuta all'iniezione, uno studio retrospettivo. Br J Neurosurg 2011;25:509–515.
- Amaniti E, Drampa F, Kouzi-Koliakos K, et al: Miotossicità da ropivacaina dopo una singola iniezione intramuscolare nei ratti. Eur J Anaesthesiol 2006;23: 130–135.
- Beyzadeoglu T, Torun Kose G, Ekinci ID, Bekler H, Yilmaz C: citotossicità degli anestetici locali alla cartilagine articolare dei ratti: uno studio sperimentale. Acta Orthop Traumatol Turc 2012;46:201–207.
- Cereda CM, Tofoli GR, Maturana LG, et al: neurotossicità locale e valutazione della miotossicità dei complessi ciclodestrina di bupivacaina e ropivacaina. Anesth Analg 2012;115:1234–1241.
- Dragoo JL, Braun HJ, Kim HJ, Phan HD, Golish SR: la condrotossicità in vitro degli anestetici locali a dose singola. Am J Sports Med 2012;40:794–799.
- Mishra P, Stringer MD: Lesione del nervo sciatico da iniezione intramuscolare: un problema persistente e globale. Int J Clin Pract 2010;64:1573–1579.
- Nouette-Gaulain K, Dadure C, Morau D, et al: Tossicità muscolare indotta dalla bupivacaina dipendente dall'età durante il blocco nervoso periferico continuo nei ratti. Anestesiologia 2009;111:1120–1127.
- Padera R, Bellas E, Tse JY, Hao D, Kohane DS: miotossicità locale da rilascio prolungato di bupivacaina da microparticelle. Anestesiologia 2008;108:921–928.
- Small SP: prevenzione della lesione del nervo sciatico da iniezioni intramuscolari: revisione della letteratura. J Adv Nurs 2004;47:287–296.
- Zink W, Sinner B, Zausig Y, Graf BM: [Miotossicità degli anestetici locali: mito sperimentale o verità clinica?]. Anestesista 2007;56:118–127.
- Perez-Castro R, Patel S, Garavito-Aguilar ZV et al: Citotossicità degli anestetici locali nelle cellule neuronali umane. Anesth Analg 2009;108:997–1007.
- Radwan IA, Saito S, Goto F: La neurotossicità degli anestetici locali sui neuroni in crescita: uno studio comparativo su lidocaina, bupivacaina, mepivacaina e ropivacaina. Anesth Analg 2002;94:319–324, indice.
- Farber SJ, Saheb-Al-Zamani M, Zieske L, et al: Lesione del nervo periferico dopo iniezione di anestetico locale. Anesth Analg 2013;117:731–739.
- Lirk P, Haller I, Myers RR, et al: Mitigazione degli effetti neurotossici diretti della lidocaina e dell'amitriptilina mediante l'inibizione della proteina chinasi attivata dal mitogeno p38 in vitro e in vivo. Anestesiologia 2006;104:1266–1273.
- Yang S, Abrahams MS, Hurn PD, Grafe MR, Kirsch JR: La tossicità delle cellule di Schwann dell'anestetico locale dipende dal tempo e dalla concentrazione. Reg Anesth Antidolorifico 2011;36:444–451.
- Kalichman MW: Meccanismi fisiologici mediante i quali gli anestetici locali possono causare lesioni ai nervi e al midollo spinale. Reg Anesth 1993; 18:448–452.
- Gentili F, Hudson AR, Hunter D, Kline DG: danno da iniezione del nervo con agenti anestetici locali: uno studio al microscopio ottico ed elettronico, al microscopio fluorescente e alla perossidasi di rafano. Neurochirurgia 1980;6:263–272.
- Farber SJ, Saheb-Al-Zamani M, Zieske L, et al: Lesione del nervo periferico dopo iniezione di anestetico locale. Anesth Analg 2013;117:731–739.
- Ahn KS, Kopp SL, Watson JC, Scott KP, Trousdale RT, Hebl JR: neuropatia infiammatoria postchirurgica. Reg Anesth Pain Med 2011;36: 403–405.
- Staff NP, Engelstad J, Klein CJ, et al: neuropatia infiammatoria post-chirurgica. Cervello 2010;133:2866–2880.
- Kaufman MR, Elkwood AI, Rose MI, et al: Trattamento chirurgico della paralisi permanente del diaframma dopo il blocco del nervo interscaleno per la chirurgia della spalla. Anestesiologia 2013;119:484–487.
- Pintaric TS, Cvetko E, Strbenc M, Mis K, Podpecan O, Mars T, Hadzic A. Cambiamenti infiammatori intraneurali e perineurali nei suinetti dopo l'iniezione di gel per ultrasuoni, endotossina, NaCl 0.9% o inserimento dell'ago senza iniezione. Anesth Analg 2014;118(4):869–873.
- Pintaric TS, Hadzic A, Strbenc M, Podpecan O, Podbregar M, Cvetko E. Risposta infiammatoria dopo l'iniezione di gel acquoso nello spazio subaracnoideo nei suinetti. Reg Anesth Pain Med 2013;38(2):100–105.
- Welch MB, Brummett CM, Welch TD, et al: Lesioni dei nervi periferici perioperatori: uno studio retrospettivo di 380,680 casi durante un periodo di 10 anni presso una singola istituzione. Anestesiologia 2009;111:490–497.
- Jacob AK, Mantilla CB, Sviggum HP, Schroeder DR, Pagnano MW,
Hebl JR: Lesione nervosa perioperatoria dopo artroplastica totale del ginocchio: rischio di anestesia regionale durante uno studio di coorte di 20 anni. Anestesiologia 2011;114: 311–317. - Jacob AK, Mantilla CB, Sviggum HP, Schroeder DR, Pagnano MW,
Hebl JR: Lesione nervosa perioperatoria dopo artroplastica totale dell'anca: rischio di anestesia regionale durante uno studio di coorte di 20 anni. Anestesiologia 2011;115: 1172–1178. - Sviggum HP, Jacob AK, Mantilla CB, Schroeder DR, Sperling JW,
Hebl JR: Lesione nervosa perioperatoria dopo artroplastica totale della spalla: valutazione del rischio dopo anestesia regionale. Reg Anesth Antidolorifico 2012;37:490–494. - Lenters TR, Davies J, Matsen FA 3°: I tipi e la gravità delle complicanze associate all'anestesia con blocco del plesso brachiale interscalenico: prove locali e nazionali. J spalla gomito Surg 2007;
16: 379-387. - Widmer B, Lustig S, Scholes CJ, et al: incidenza e gravità delle complicanze dovute ai blocchi del nervo femorale eseguiti per la chirurgia del ginocchio. Ginocchio 2013;20:181–185.
- Hogan QH: Rivisitazione della funzione del nervo frenico dopo il blocco interscalenico: ora, la visione lunga. Anestesiologia 2013;119:250–252.
- Gadsden J, Gratenstein K, Hadzic A: Iniezione intraneurale e danno ai nervi periferici. Int Anesthesiol Clin 2010;48:107–115.
- Liu SS, YaDeau JT, Shaw PM, Wilfred S, Shetty T, Gordon M: Incidenza di iniezione intraneurale non intenzionale e complicanze neurologiche postoperatorie con blocchi nervosi interscalenici e sopraclavicolari ecoguidati. Anestesia 2011;66:168–174.
- Bigeleisen PE: la puntura del nervo e l'apparente iniezione intraneurale durante il blocco ascellare ecoguidato non provocano invariabilmente lesioni neurologiche. Anestesiologia 2006;105:779–783.
- Bigeleisen PE, Moayeri N, Groen GJ: soglie di stimolazione extraneurali rispetto a quelle intraneurali durante il blocco sopraclavicolare ecoguidato. Anestesiologia 2009;110:1235–1243.
- Sala Blanch X, Lopez AM, Carazo J, et al: Iniezione intraneurale durante il blocco del nervo sciatico guidato da stimolatore nervoso nella fossa poplitea. Fr. J Anaesth 2009;102:855–861.
- Cohen JM, Gray AT: Deficit funzionali dopo iniezione intraneurale durante il blocco interscalenico. Reg Anesth Antidolorifico 2010;35:397–399.
- Orebaugh SL, McFadden K, Skorupan H, Bigeleisen PE: iniezione subepineurial nel posizionamento della punta dell'ago interscalenico ecoguidato. Reg Anesth Antidolorifico 2010;35:450–454.
- Altermatt FR, Cummings TJ, Auten KM, Baldwin MF, Belknap SW, Reynolds JD: aspetto ecografico delle iniezioni intraneurali nel modello suino. Reg Anesth Antidolorifico 2010;35:203–206.
- Moayeri N, Bigeleisen PE, Groen GJ: Architettura quantitativa del plesso brachiale e dei compartimenti circostanti e loro possibile significato per i blocchi del plesso. Anestesiologia 2008;108:299–304.
- Moayeri N, Groen GJ: Le differenze nell'architettura quantitativa del nervo sciatico possono spiegare le differenze nella potenziale vulnerabilità alla lesione del nervo, nel tempo di insorgenza e nel volume anestetico minimo efficace. Anestesiologia 2009;111:1128–1134.
- Borgeat A, Ekatodramis G, Kalberer F, Benz C: Complicanze acute e non acute associate al blocco interscalenico e alla chirurgia della spalla: uno studio prospettico. Anestesiologia 2001;95:875–880.
- Candido KD, Sukhani R, Doty R Jr, et al: sequele neurologiche dopo il blocco del plesso brachiale interscalenico per la chirurgia della spalla/parte superiore del braccio: l'associazione di fattori paziente, anestetico e chirurgico all'incidenza e al decorso clinico. Anesth Analg 2005;100:1489–1495, indice.
- Bilbao Ares A, Sabate A, Porteiro L, Ibanez B, Koo M, Pi A: [Complicazioni neurologiche associate al blocco interscalenico e sopraclavicolare ecoguidato nella chirurgia elettiva della spalla e del braccio. Studio osservazionale prospettico in un ospedale universitario.]. Rev. Esp Anestesiol Reanim 2013;60:384–391.
- Auroy Y, Benhamou D, Bargues L, et al: Principali complicazioni dell'anestesia regionale in Francia: il servizio SOS Regional Anesthesia Hotline. Anestesiologia 2002;97:1274–1280.
- Barrington MJ, Watts SA, Gledhill SR, et al: Risultati preliminari dell'Australasian Regional Anesthesia Collaboration: un audit prospettico di oltre 7000 blocchi del nervo periferico e del plesso per complicazioni neurologiche e di altro tipo. Reg Anesth Antidolorifico 2009;34:534–541.
- Fanelli G, Casati A, Garancini P, Torri G: stimolatore nervoso e tecnica di iniezione multipla per blocco degli arti superiori e inferiori: tasso di fallimento, accettazione del paziente e complicanze neurologiche. Gruppo di studio sull'anestesia regionale. Anesth Analg 1999;88:847–852.
- Selander D, Dhuner KG, Lundborg G: danno del nervo periferico dovuto ad aghi per iniezione utilizzati per l'anestesia regionale. Uno studio sperimentale sugli effetti acuti del trauma da ago. Acta Anaesthesiol Scand 1977;21:182–188.
- Steinfeldt T, Nimphius W, Werner T, et al: Lesione nervosa da perforazione del nervo dell'ago in anestesia regionale: le dimensioni contano? Fr. J Anaesth 2010;104:245–253.
- Steinfeldt T, Werner T, Nimphius W, et al: Analisi istologica dopo la puntura del nervo periferico con punta di matita o punta dell'ago Tuohy. Anesth Analg 2011;112:465–470.
- Reina MA, de Leon-Casasola OA, Lopez A, De Andres J, Martin S, Mora M: uno studio in vitro di lesioni durali prodotte da aghi Quincke e Whitacre calibro 25 valutati mediante microscopia elettronica a scansione. Reg Anesth Pain Med 2000;25:393–402.
- Selander D: lesione del nervo periferico causata da aghi per iniezione. Fr. J Anaesth 1993;71:323–325.
- Selander DE: Lezione Labat 2006. Anestesia regionale: aspetti, pensieri e un po' di etica onesta; su smussi dell'ago e lesioni nervose e mal di schiena dopo l'anestesia spinale. Reg Anesth Antidolorifico 2007;32:341–350.
- Winfree CJ, Kline DG: lesioni nervose da posizionamento intraoperatorie. Surg Neurol 2005;63:5–18; discussione 18.
- Kroll DA, Caplan RA, Posner K, Ward RJ, Cheney FW: lesione al nervo
associato all'anestesia. Anestesiologia 1990;73:202–207. - Jankowski CJ, Keegan MT, Bolton CF, Harrison BA: Neuropatia dopo blocco del plesso ascellare brachiale: è il laccio emostatico? Anestesiologia 2003;99:1230–1232.
- Kornbluth ID, Freedman MK, Sher L, Frederick RW: paralisi del nervo femorale e safenico dopo l'uso del laccio emostatico: un caso clinico. Arch Phys Med Rehabil 2003;84:909–911.
- Maguina P, Jean-Pierre F, Grevious MA, Malk AS: paralisi del ramo interosseo posteriore dopo l'applicazione del laccio emostatico pneumatico per la chirurgia della mano. Plast Reconstr Surg 2008;122:97e–99e.
- Barner KC, Landau ME, Campbell WW: Una revisione della lesione del nervo perioperatorio agli arti inferiori: parte I. J Clin Neuromuscul Dis 2002; 4: 95–99.
- Nitz AJ, Dobner JJ, Matulionis DH: valutazione strutturale del nervo sciatico del ratto dopo la compressione del laccio emostatico e la manipolazione vascolare. Anat Rec 1989;225:67–76.
- Dobner JJ, Nitz AJ: paralisi del laccio emostatico postmeniscectomia e sequele funzionali. Am J Sports Med 1982;10:211–214.
- Weingarden SI, Louis DL, Waylonis GW: cambiamenti elettromiografici nei pazienti postmeniscectomia. Ruolo del laccio emostatico pneumatico. JAMA 1979;241:1248–1250.
- Fabre T, Piton C, Andre D, Lasseur E, Durandeau A: intrappolamento del nervo peroneo. J Bone Joint Surg Am 1998;80:47–53.
- Prielipp RC, Warner MA: Lesione nervosa perioperatoria: un grido silenzioso? Anestesiologia 2009;111:464–466.
- Warner MA, Warner ME, Martin JT: neuropatia ulnare. Incidenza, esito e fattori di rischio in pazienti sedati o anestetizzati. Anestesiologia 1994;81:1332–1340.
- Morales-Vidal S, Morgan C, McCoyd M, Hornik A: neuropatia periferica diabetica e gestione del dolore neuropatico periferico diabetico. Postgrad Med 2012; 124: 145–153.
- Kalichman MW, Calcutt NA: blocco di conduzione indotto da anestetico locale e danno delle fibre nervose nei ratti diabetici con streptozotocina. Anestesiologia 1992;77:941–947.
- Hebl JR, Kopp SL, Schroeder DR, Horlocker TT: Complicanze neurologiche dopo anestesia o analgesia neuroassiale in pazienti con neuropatia sensomotoria periferica preesistente o polineuropatia diabetica. Anesth Analg 2006;103:1294–1299.
- Neal JM, Bernards CM, Hadzic A, et al: ASRA Practice Advisory on Neurologic Complications in Regional Anesthesia and Pain Medicine. Reg Anesth Antidolorifico 2008;33:404–415.
- Mellion M, Gilchrist JM, de la Monte S: Neuropatia periferica correlata all'alcol: nutrizionale, tossica o entrambe? Nervo muscolare 2011;43: 309–316.
- Hebl JR, Horlocker TT, Pritchard DJ: plessopatia brachiale diffusa dopo blocco interscalenico in un paziente sottoposto a chemioterapia con cisplatino: la sindrome farmacologica del doppio schiacciamento. Anesth Analg 2001;92:249–251.
- Hebl JR: Anestesia regionale ecoguidata e prevenzione del danno neurologico: realtà o finzione? Anestesiologia 2008;108:186–188.
- Uskova AA, Plakseychuk A, Chelly JE: Il ruolo della chirurgia nelle lesioni nervose postoperatorie dopo la sostituzione totale dell'anca. J Clin Anesth 2010;22: 285–293.
- Moen V, Dahlgren N, Irestedt L: Gravi complicazioni neurologiche dopo blocchi neuroassiali centrali in Svezia 1990–1999. Anestesiologia 2004;101:950–959.
- Kubina P, Gupta A, Oscarsson A, Axelsson K, Bengtsson M: Due casi di sindrome della cauda equina dopo anestesia spinale-epidurale. Reg Anesth 1997;22:447–450.
- Hebl JR, Horlocker TT, Kopp SL, Schroeder DR: blocco neuroassiale in pazienti con stenosi spinale preesistente, malattia del disco lombare o precedente intervento chirurgico alla colonna vertebrale: efficacia e complicanze neurologiche. Anesth Anal
2010; 111: 1511-1519. - Barner KC, Landau ME, Campbell WW: Una revisione della lesione nervosa perioperatoria agli arti superiori. J Clin Neuromuscul Dis 2003;4: 117–123.
- Sunderland S: La relativa suscettibilità alla lesione delle divisioni poplitee mediale e laterale del nervo sciatico. Br J Surg 1953;41:300–302.
- Sunderland S: Il nervo sciatico e le sue divisioni tibiale e peroneale comune. Caratteristiche anatomiche e fisiologiche. Nervi e lesioni nervose, Churchill Livingstone, 1978, pp 924–966.
- Bernards CM, Hadzic A, Suresh S, Neal JM: Anestesia regionale in pazienti anestetizzati o fortemente sedati. Reg Anesth Pain Med 2008;33: 449–460.
- Nitz AJ, Dobner JJ, Matulionis DH: applicazione del laccio emostatico pneumatico e integrità del nervo: funzione motoria ed elettrofisiologia. Esp Neurol 1986;94:264–279.
- Horlocker TT, Cabanela ME, Wedel DJ: L'analgesia epidurale postoperatoria aumenta il rischio di paralisi del nervo peroneo dopo l'artroplastica totale del ginocchio? Anesth Analg 1994;79:495–500.
- Sala-Blanch X, Lopez AM, Carazo J, et al: Iniezione intraneurale durante il blocco del nervo sciatico guidato da stimolatore nervoso nella fossa poplitea. Fr. J Anaesth 2009;102:855–861.
- Jeng CL, Rosenblatt MA: Iniezioni intraneurali e anestesia regionale: il noto e l'ignoto. Minerva Anestesio 2011;77:54–58.
- Moore DC: "Niente parestesie, niente anestesia", lo stimolatore nervoso o nessuno dei due? Reg Anesth 1997;22:388–390.
- Auroy Y, Narchi P, Messiah A, Litt L, Rouvier B, Samii K: Complicanze gravi legate all'anestesia regionale: risultati di un'indagine prospettica in Francia. Anestesiologia 1997;87:479–486.
- Winchell SW, Wolfe R: L'incidenza della neuropatia dopo i blocchi nervosi dell'arto superiore. Reg Anesth Pain Med 1985;10:12–15.
- Urban MK, Urquhart B: Valutazione dell'anestesia del plesso brachiale per la chirurgia dell'arto superiore. Reg Anesth 1994;19:175–182.
- Liguori GA, Zayas VM, YaDeau JT, et al: Tecniche di localizzazione dei nervi per il blocco del plesso brachiale interscalenico: un confronto prospettico e randomizzato di parestesia meccanica rispetto alla stimolazione elettrica. Anesth Analg 2006;103:761–767.
- Perlas A, Niazi A, McCartney C, Chan V, Xu D, Abbas S: La sensibilità della risposta motoria alla stimolazione nervosa e parestesia per la localizzazione del nervo valutata dagli ultrasuoni. Antidolorifico Reg Anesth
2006; 31: 445-450. - Klein SM, Melton MS, Grill WM, Nielsen KC: stimolazione del nervo periferico in anestesia regionale. Reg Anesth Pain Med 2012;37: 383–392.
- Voelckel WG, Klima G, Krismer AC, et al: Segni di infiammazione dopo il blocco del nervo sciatico nei suini. Anesth Analg 2005;101:1844–1846.
- Chan VW, Brull R, McCartney CJ, Xu D, Abbas S, Shannon P: uno studio ecografico e istologico dell'iniezione intraneurale e della stimolazione elettrica nei suini. Anesth Analg 2007;104:1281–1284, indice.
- Tsai TP, Vuckovic I, Dilberovic F, et al: L'intensità della corrente stimolante potrebbe non essere un indicatore affidabile del posizionamento dell'ago intraneurale. Reg Anesth Antidolorifico 2008;33:207–210.
- Robards C, Hadzic A, Somasundaram L, et al: Iniezione intraneurale con stimolazione a bassa corrente durante il blocco del nervo sciatico popliteo. Anesth Analg 2009;109:673–677.
- Reiss W, Kurapati S, Shariat A, Hadzic A: danno nervoso che complica il blocco del plesso brachiale sopraclavicolare guidato da ultrasuoni/elettrostimolazione. Reg Anesth Antidolorifico 2010;35:400–401.
- Urmey WF, Stanton J: Incapacità di suscitare costantemente una risposta motoria in seguito a parestesie sensoriali durante la somministrazione di blocchi interscalenici. Anestesiologia 2002;96:552–554.
- Watts SA: Complicanze neurologiche a lungo termine associate alla chirurgia e al blocco dei nervi periferici: esiti dopo 1065 blocchi consecutivi. Terapia intensiva di Anaesth 2007;35:24–31.
- Orebaugh SL, Williams BA, Vallejo M, Kentor ML: esiti avversi associati a blocchi nervosi periferici basati su stimolatore con rispetto a senza visualizzazione ecografica. Reg Anesth Pain Med 2009;34: 251–255.
- Selander D, Brattsand R, Lundborg G, Nordborg C, Olsson Y: Anestetici locali: importanza della modalità di applicazione, concentrazione e adrenalina per la comparsa delle lesioni nervose. Uno studio sperimentale sulla degenerazione assonale e sul danno della barriera dopo iniezione intrafascicolare o applicazione topica di bupivacaina (Marcain). Acta Anaesthesiol Scand 1979;23:127–136.
- Kapur E, Vuckovic I, Dilberovic F, et al: Esito neurologico e istologico dopo iniezioni intraneurali di lidocaina nei nervi sciatici canini. Acta Anaesthesiol Scand 2007;51:101–107.
- Lupu CM, Kiehl TR, Chan VW, El-Beheiry H, Madden M, Brull R: L'espansione del nervo osservata sugli ultrasuoni predice una lesione nervosa istologica ma non funzionale dopo l'iniezione intraneurale nei suini. Reg Anesth Antidolorifico 2010;35:132–139.
- Orebaugh SL, Mukalel JJ, Krediet AC, et al: Iniezione della radice del plesso brachiale in un modello di cadavere umano: distribuzione dell'iniezione ed effetti sulla nevassi. Reg Anesth Antidolorifico 2012;37:525–529.
- Andrzej Krol, Matthew Szarko, Arber Vala, Jose De Andres: monitoraggio della pressione delle iniezioni intraneurali e perineurali nei nervi mediano, radiale e ulnare; Lezioni da uno studio su cadavere. Anesth Antidolorifico. 2015 giugno;5(3):e22723. DOI: 10.5812/aapm.22723.
- Sala-Blanch X, de Riva N, Carrera A, Lopez AM, Prats A, Hadzic A: il blocco sciatico popliteo ecoguidato con una singola iniezione nella divisione sciatica provoca un'insorgenza del blocco più rapida rispetto alla tecnica classica dello stimolatore nervoso. Anesth Analg 2012;114:1121–1127.
- Sala-Blanch X, Lopez AM, Pomes J, Valls-Sole J, Garcia AI, Hadzic A: nessuna evidenza clinica o elettrofisiologica di danno nervoso dopo iniezione intraneurale durante blocco popliteo sciatico. Anestesiologia 2011;115:589–595.
- Gadsden JC, Lindenmuth DM, Hadzic A, Xu D, Somasundarum L, Flisinski KA: il blocco del plesso lombare mediante iniezione ad alta pressione porta alla diffusione controlaterale ed epidurale. Anestesiologia 2008;109:683–688.
- Tsui BC, Li LX, Pillay JJ: tecnica di iniezione di aria compressa per standardizzare le pressioni di iniezione a blocchi. Can J Anaesth 2006;53:1098–1102.
- Siegmueller C, Ramessur S: un modo semplice a basso costo per misurare la pressione di iniezione durante il blocco del nervo periferico. Anestesia 2011;66:956.
- Gerancher JC, Viscusi ER, Liguori GA, et al: Sviluppo di un modulo di nota sulla procedura di blocco del nervo periferico standardizzato. Reg Anesth Antidolorifico 2005;30:67–71.
- Claudio R, Hadzic A, Shih H, et al: Pressioni di iniezione da parte degli anestesisti durante il blocco nervoso periferico simulato. Reg Anesth Pain Med 2004;29: 201–205.
- Theron PS, Mackay Z, Gonzalez JG, Donaldson N, Blanco R: un modello animale di "sensazione di siringa" durante il blocco nervoso periferico. Reg Anesth Antidolorifico 2009;34:330–332.
- Ip VH, Tsui BC: Concetti pratici nel monitoraggio delle pressioni di iniezione durante i blocchi nervosi periferici. Int Anesthesiol Clin 2011;49: 67–80.
- Gadsden JC, Choi JJ, Lin E, Robinson A: La pressione di iniezione di apertura rileva costantemente il contatto ago-nervo durante il blocco del plesso brachiale interscalenico guidato da ultrasuoni. Anestesiologia 2014;120: 1246–1253.
- Tsui BC, Pillay JJ, Chu KT, Dillane D: Impedenza elettrica per distinguere il posizionamento dell'ago intraneurale da quello extraneurale nei nervi suini durante l'esposizione diretta e la guida ecografica. Anestesiologia 2008;109:479–483.
- Byrne K, Tsui BC: Concetti pratici sulla stimolazione nervosa: impedenza e altri recenti progressi. Int Anesthesiol Clin 2011;49:81–90.
- Sauter AR, Dodgson MS, Kalvoy H, Grimnes S, Stubhaug A, Klaastad Ø: la soglia di corrente per la stimolazione nervosa dipende dall'impedenza elettrica del tessuto: uno studio sulla stimolazione elettrica del nervo mediano guidata da ultrasuoni. Anesth Analg 2009;108:1338–1343.
- Siti BD, Spence BC, Gallagher JD, Wiley CW, Bertrand ML, Blike GT: Caratterizzazione del comportamento da principiante associato all'apprendimento dell'anestesia regionale periferica ecoguidata. Reg Anesth Pain Med 2007;32: 107–115.
- Siti BD, Taenzer AH, Herrick MD, et al: Incidenza della tossicità sistemica dell'anestetico locale e sintomi neurologici postoperatori associati a 12,668 blocchi nervosi ecoguidati: un'analisi da un registro clinico prospettico. Reg Anesth Antidolorifico 2012;37:478–482.