Ariana Nelson, Honorio T. Benzon e Rasha S. Jabri
INTRODUZIONE
L'ematoma spinale epidurale (SEH) è un accumulo di sangue nel tessuto areolare lasso tra le vertebre e la dura del canale spinale. Tipicamente, l'ematoma è asintomatico, ma in rari casi comprime il midollo spinale, con conseguenze neurologiche potenzialmente devastanti. Questi sintomi includono disturbi sensoriali, incontinenza intestinale e vescicale, debolezza motoria o, nei casi più gravi, paralisi completa degli arti colpiti. Questa entità clinica fu descritta per la prima volta nella letteratura medica nel 1682 come ematoma spinale con apoplessia spinale nella Histoire de l'Academie Royale des Science (Volume 2; GJ Duverney). Quasi 200 anni dopo, nel 1869, su Lancet fu pubblicato un rapporto sulla prima diagnosi clinica di SEH.
Le SEH possono essere di natura spontanea o possono verificarsi nel contesto di una procedura invasiva, come la puntura lombare, anestesia neuroassiale, o chirurgia della colonna vertebrale. È più probabile che l'ematoma sia sintomatico nelle regioni cervicale e toracica, dato il canale spinale ristretto in quest'area rispetto al maggiore spazio disponibile per la compensazione del volume nella regione lombare e in particolare nella regione della cauda equina.
EMATOMA EPIDURALE SPINALE
Incidenza
La SEH sintomatica rappresenta meno dell'1% di tutte le lesioni spinali che occupano spazio4 e colpisce solo 1 persona su 1 milione all'anno. Le SEH derivano da una miriade di eziologie, ma il più delle volte da una procedura eseguita all'interno o vicino allo spazio epidurale. Ad esempio, la presenza di SEH può essere trovata nell'imaging postoperatorio nel 33-100% dei pazienti dopo un intervento chirurgico alla colonna vertebrale, ma i pazienti raramente mostrano deficit neurologici. Una revisione sistematica del 2010 ha rilevato un'incidenza calcolata complessiva di SEH sintomatica dopo un intervento chirurgico alla colonna vertebrale dello 0.2%, con calcoli di studio individuali compresi tra 0% e 1.0%. Pertanto, l'incidenza di SEH è regolarmente citata come incidenza di SEH sintomatica; d'ora in poi in questo capitolo è implicito il termine qualificante sintomatico.
L'incidenza di SEH dopo l'anestesia neuroassiale è stata storicamente stimata in meno di 1 su 150,000 posizionamenti epidurali e meno di 1 su 220,000 anestetici spinali. Tuttavia, secondo recenti studi epidemiologici, l'incidenza potrebbe essere in aumento. Questa stima è stata confermata da uno studio svedese su larga scala che ha riscontrato un'incidenza di SEH dopo blocco epidurale di 1:18,000, cifra che risulta dalla media di un'incidenza ostetrica di 1:200,000 e un'incidenza notevolmente elevata di 1:3600 calcolata in una popolazione di donne anziane sottoposte ad artroplastica di ginocchio. Un altro studio ha mostrato un'incidenza complessiva di SEH di 1:4741 che aumentava a 1:1000 se la popolazione valutata fosse ristretta per includere solo le donne anziane sottoposte a chirurgia degli arti inferiori.
Questa grande disparità può essere attribuita alla presenza o assenza di fattori di rischio in queste popolazioni di pazienti incongruenti. La gravidanza induce uno stato relativamente ipercoagulante e le pazienti ostetriche sono anche più giovani con uno spazio epidurale più ampio e conforme rispetto alle pazienti anziane. La minore incidenza di SEH nelle pazienti ostetriche è stata confermata in un recente studio in cui non sono stati rilevati casi di SEH in 709,837 pazienti valutati nel periodo peripartum. Questo studio ha rilevato un'incidenza di 1:9000 (intervallo di confidenza 95% [CI]: 1:20,189–1:4330) nei pazienti che hanno ricevuto posizionamenti epidurali perioperatori.
Fattori di rischio
L'aumento dell'età comporta un aumento del rischio di SEH. La riduzione delle dimensioni dello spazio epidurale con l'età è stata segnalata per la prima volta nel 1967 in uno studio sulla diffusione dell'anestetico locale.
Questo può essere estrapolato per tenere conto della maggiore incidenza di SEH negli anziani perché un volume equivalente di sangue causerà un aumento della pressione nello spazio epidurale più piccolo di un paziente anziano rispetto a una controparte più giovane. Non è stata segnalata alcuna predilezione razziale, ma la SEH è più frequente nelle femmine. Ciò potrebbe essere potenzialmente spiegato dalla maggiore prevalenza di osteoporosi nelle pazienti di sesso femminile, che causa deformità o fratture vertebrali e ingrossamento dei corpi vertebrali, con conseguente restringimento del canale spinale. Il restringimento osteoporotico dello spazio epidurale potrebbe quindi spiegare sia il sesso che le predilezioni di età della SEH e può contribuire a una probabilità maggiore di 50 volte di SEH dopo l'anestesia epidurale per l'artroplastica del ginocchio rispetto all'analgesia del travaglio epidurale. Tuttavia, la tromboprofilassi è una necessità nella popolazione chirurgica ortopedica, che può anche contribuire alla loro incidenza relativamente più alta di SEH rispetto ai pazienti ostetrici, che non richiedono una profilassi di routine contro la trombosi venosa profonda.
Infatti, il fattore di rischio più importante per SEH è la presenza di un disturbo fisiologico o iatrogeno del sistema della coagulazione, come malattie del fegato, alcolismo, trombocitopenia o anticoagulanti farmacologici. Un recente studio retrospettivo ha anche identificato un aumento significativo della SEH dopo chirurgia della colonna vertebrale in pazienti con gruppi sanguigni Rh+, perdita ematica intraoperatoria maggiore di 1 L, livello di emoglobina inferiore a 10 g/dL e un rapporto normalizzato internazionale maggiore di 2.0 nei primi 48 ore. La terapia anticoagulante in associazione con l'analgesia neuroassiale, nonché la durata e l'intensità dell'anticoagulazione sono stati identificati come i fattori di rischio più significativi per l'ematoma epidurale. Circa da un quarto a un terzo di tutti i casi di SEH sono associati alla terapia anticoagulante. In un'ampia revisione di ogni caso di SEH associato all'anestesia neuroassiale, l'87% dei pazienti presentava un'anomalia ematologica o una procedura complicata da difficoltà tecniche. I casi di ematoma spontaneo sono rari, ma quando si verificano sono spesso associati a anticoagulanti, trombolisi, discrasie ematiche, coagulopatie, trombocitopenia, neoplasie, malformazioni vascolari o emangiomi vertebrali.
La diminuzione del peso del paziente, che può esagerare la risposta anticoagulante, rappresenta una preoccupazione teorica per la tendenza al sanguinamento ed è stata suggerita come spiegazione dell'aumento del rischio nelle donne e negli anziani. Tuttavia, in Svezia, una dose ridotta specifica per genere di eparina a basso peso molecolare per la profilassi contro la trombosi venosa profonda non ha dimostrato di migliorare l'aumentata incidenza ben descritta di SEH nelle donne. La terapia trombolitica comporta il maggior rischio di complicanze emorragiche e le procedure neuroassiali devono essere diligentemente evitate nei pazienti che hanno subito recentemente una trombolisi. Impara di più riguardo Anestesia neuroassiale e blocchi nervosi periferici in pazienti in trattamento con anticoagulanti.
Perla clinica
- Studi recenti sull'incidenza del rischio di ematoma spinale in pazienti senza fattori di rischio manifesti hanno mostrato un aumento a 1:18,000 dopo l'epidurale e 1:3600, anche 1:1000, nei pazienti anziani sottoposti a chirurgia degli arti inferiori.
Eziologia e localizzazione dell'ematoma
I fattori proposti che causano SEH includono traumi, anticoagulanti, trombolisi, puntura lombare, anestesia epidurale o spinale, procedure o interventi chirurgici alla colonna vertebrale interventistica, coagulopatia o diatesi emorragica, malattia epatica con ipertensione portale, malformazione vascolare, ernia del disco, malattia di Paget delle ossa vertebrali , Manovra di Valsalva e ipertensione. Le cause più importanti di SEH spontanea sono i disturbi della coagulazione, che possono essere acquisiti (p. es., terapia anticoagulante, neoplasie) o congeniti (p. es., emofilia). Le malformazioni vascolari sono raramente responsabili di ematomi epidurali spontanei; solo il 4% in una serie di 158 casi e il 6.5% in una serie di 199 casi erano dovuti a malformazioni vascolari. Fattori predisponenti meno comuni includono lupus eritematoso sistemico, spondilite anchilosante, artrite reumatoide, malattia di Paget, ernia del disco e ipertensione.
Il plesso venoso dorsale è la fonte di emorragia più comunemente implicata perché questo plesso è privo di valvole e consente l'inversione del flusso sanguigno durante l'aumento della pressione intravascolare dall'attività fisica. Queste vene mancano di protezione poiché sono circondate solo da tessuto areolare lasso e sono quindi vulnerabili ad aumenti improvvisi della pressione intra-addominale o intratoracica, che portano a rottura ed emorragia. Il plesso venoso epidurale è più prominente nella colonna vertebrale toracica e la SEH spontanea si verifica più spesso nella regione toracica e cervicotoracica, seguita dall'area toracolombare. SEH è tipicamente posteriore o posterolaterale al sacco tecale (Figure 1 ) perché la salda aderenza del sacco durale al legamento longitudinale posteriore nella parte ventrale del canale spinale impedisce l'accumulo di ematoma. L'aspetto dorsale della regione toracica o lombare è comunemente coinvolto e l'espansione è tipicamente limitata a pochi livelli vertebrali.
Nelle donne in gravidanza, è stato proposto che l'aumento della pressione venosa dovuto all'allargamento dell'utero, in associazione con i cambiamenti emodinamici della gravidanza, possa predisporre alla rottura di una parete patologica del plesso venoso epidurale preesistente. Sebbene una fonte venosa sia la più ampiamente accettata, il dibattito continua su una potenziale fonte arteriosa di SEH, con i sostenitori di questa teoria che affermano che la pressione sanguigna venosa è inferiore alla pressione intratecale; pertanto, sebbene il flusso in avanti sia possibile nello spazio epidurale a bassa pressione, il sangue venoso non potrebbe causare la compressione del midollo spinale.
Consigli NYSORA
- L'emorragia nel canale spinale si verifica più comunemente nello spazio epidurale a causa del prominente plesso venoso epidurale.
- La SEH può essere spontanea o può seguire un trauma minore, come una puntura lombare o un'anestesia neuroassiale.
- SEH si verifica principalmente nei pazienti anticoagulati o trombocitopenici.
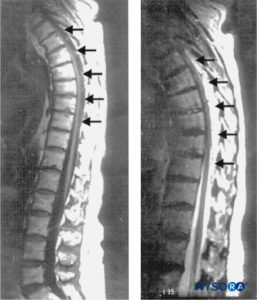
FIGURA 1. Immagini di risonanza magnetica sagittale della colonna toracolombare. Un grande ematoma epidurale complesso che si estende da T3 a T10 attraverso T11 è visto con caratteristiche di segnale ipo e isodenso su un'immagine pesata in T1 (a sinistra; frecce) e caratteristiche di segnale iperintenso su un'immagine pesata in T2 (a destra; frecce). Al centro dell'ematoma, il midollo spinale confina con l'aspetto posteriore della vertebrale toracica
corpi (a sinistra). Non si osservano anomalie del segnale del cavo stesso. (Riprodotto con il permesso di Schwarz SK, Wong CL,
McDonald WN: Recupero spontaneo da un ematoma epidurale spinale con presentazione atipica in un non-agenario. Può J Anaesth. 2004 giugno-luglio;51(6):557–561.)
Anamnesi ed esame obiettivo
Classicamente, il sintomo di presentazione della SEH è il dolore alla schiena assiale acuto che si irradia ai dermatomi corrispondenti e si evolve in deficit neurologico focale con segni di compressione della radice nervosa o del midollo spinale. Il dolore è generalmente descritto come un mal di schiena grave, localizzato e costante, con o senza una componente radicolare che può simulare un'ernia del disco, specialmente nella colonna lombare.
Il mal di schiena è amplificato dalle percussioni sulla colonna vertebrale, nonché da manovre che aumentano la pressione intraspinale, come tosse, starnuti o sforzi. Tuttavia, un'analisi del 2010 ha dimostrato che la debolezza degli arti inferiori è il segno di presentazione più comune, sebbene il mal di schiena sia ancora un sintomo precoce comune. I sintomi associati possono includere intorpidimento, debolezza e incontinenza urinaria o fecale. L'insorgenza del dolore è occasionalmente correlata a uno sforzo minore, come il sollevamento, la tosse, gli starnuti o le manovre di Valsalva, sebbene nella maggior parte dei casi l'insorgenza del dolore sia spontanea.
A seconda del livello e delle dimensioni dell'ematoma, i reperti fisici possono includere debolezza unilaterale o bilaterale, deficit sensoriali con parestesie radicolari unilaterali o bilaterali, varie alterazioni dei riflessi tendinei profondi e alterazioni del tono della vescica o dello sfintere anale. Segni di disfunzione del midollo spinale e della radice nervosa compaiono rapidamente e possono evolvere in paraparesi o, nelle posizioni toraciche o cervicali elevate, quadriparesi. Nei casi di SEH correlata ad anestesia neuroassiale o puntura lombare, la presenza di sintomi neurologici postoperatori nuovi o progressivi dovrebbe avvisare il medico di un possibile ematoma epidurale.
Consigli NYSORA
- Il paziente può presentare un dolore alla schiena grave, localizzato e costante con o senza una componente radicolare che può simulare un'ernia del disco.
- I sintomi associati possono includere debolezza, intorpidimento e incontinenza urinaria o fecale.
- Il ritorno del deficit sensoriale o motorio diverse ore dopo l'esaurimento del blocco spinale o epidurale (con o senza mal di schiena) è altamente patognomonico e dovrebbe essere considerato e trattato come ematoma spinale o epidurale fino a prova contraria.
- Il recupero neurologico dopo la gestione conservativa è stato riportato in pazienti con mal di schiena e debolezza alle gambe senza paralisi.
- Il recupero neurologico può verificarsi se l'intervento chirurgico e la decompressione vengono eseguiti entro 36 ore da un deficit motorio completo ed entro 48 ore da un deficit parziale.
Diagnosi
Come notato in precedenza, i risultati clinici della SEH di solito includono mal di schiena e deficit motori/sensoriali che possono evolvere rapidamente in paraplegia, tetraplegia o disfunzione autonomica.
Un ematoma epidurale si presenta normalmente entro le prime 24-48 ore dopo una procedura. Qualsiasi sintomo neurologico nuovo o progressivo giustifica una valutazione clinica immediata e un iter diagnostico per escludere qualsiasi lesione che occupa spazio, compreso l'ematoma epidurale. Un deficit neurologico che si verifica in presenza di analgesia epidurale impone l'immediata interruzione dell'infusione, con il catetere lasciato in posizione, per escludere qualsiasi contributo dell'anestetico locale.
Se l'infusione epidurale è la causa della manifestazione neurologica, si noterà un ritorno della funzione sensoriale e motoria. In caso contrario, è necessario ottenere un trattamento immediato e studi di imaging radiografico e una consultazione con un chirurgo della colonna vertebrale per escludere una lesione epidurale in evoluzione.
In un paziente che presenta dolore alla schiena assiale acuto con progressione di deficit neurologici, è necessaria una valutazione immediata per la presenza di entità patologiche associate alla radice nervosa e alla compressione del midollo spinale per differenziare lesioni varie che simulano SEH. La presentazione clinica di un paziente con sospetto ematoma epidurale può assomigliare alla presentazione per ascesso epidurale, malattia del midollo spinale, neoplasia o ernia del disco acuta. La diagnosi differenziale dei sintomi neurologici postoperatori nuovi o progressivi comprende la neuroprassia chirurgica, il blocco neuroassiale prolungato o esagerato, la sindrome dell'arteria spinale anteriore, l'esacerbazione di un disturbo neurologico preesistente e la presentazione di una condizione neurologica precedentemente non diagnosticata.
Un esame emocromocitometrico completo con piastrine deve essere ordinato per valutare l'entità del sanguinamento e per determinare la presenza di infezione. Il tempo di protrombina e il tempo di tromboplastina parziale attivata determinano la presenza di diatesi emorragica.
Una rapida valutazione radiologica è essenziale per ridurre al minimo il ritardo nel trattamento della SEH. Attualmente, la risonanza magnetica (MRI) è il metodo di imaging diagnostico di scelta per le emergenze spinali perché consente una valutazione rapida e non invasiva della colonna vertebrale e del midollo spinale su tutti i piani. La risonanza magnetica spinale può delineare la posizione di un ematoma epidurale e identificare una malformazione vascolare associata; fornirà anche informazioni sull'estensione dell'ematoma e sul grado di compressione del cordone ombelicale. La risonanza magnetica può anche aiutare nella valutazione dell'età dell'ematoma (Figure 1 ).
Le caratteristiche cronologiche di una risonanza magnetica di SEH sono simili a quelle osservate con emorragia intracranica. Nella fase iperacuta (prime 6 ore), la SEH appare isointensa rispetto al midollo spinale nelle immagini pesate in T1 e lievemente iperintensa ed eterogenea nelle immagini pesate in T2, per la presenza di ossiemoglobina intracellulare. Nella fase acuta (7-72 ore), l'ematoma è ancora isointenso nelle immagini pesate in T1 e diventa ipointenso nelle immagini pesate in T2. Ciò è dovuto alla presenza di deossiemoglobina intracellulare, che provoca l'accorciamento di T2. All'aumentare della concentrazione di metaemoglobina, l'ematoma diventa iperintenso e omogeneo nelle immagini pesate in T1 e T2. L'arteriografia a risonanza magnetica (MRA) con gadolinio può definire ulteriormente l'estensione di una malformazione artero-venosa.
La tomografia computerizzata (TC) convenzionale ha il potenziale per diagnosticare un ematoma epidurale, ma può dare risultati falsi negativi se l'ematoma è isodenso al sacco tecale o al midollo spinale e la qualità dell'immagine è influenzata da artefatti spesso osservati nella regione toracica superiore. La TC spinale può essere non diagnostica nella colonna vertebrale toracica, dove la risoluzione è più scarsa rispetto alla colonna lombare e cervicale a causa dell'elevato contrasto tra il parenchima polmonare e l'osso vertebrale. L'angiografia convenzionale può essere necessaria per dimostrare in modo definitivo la presenza di un'alformazione vascolare.
La mielografia, e successivamente la mielografia TC, erano in precedenza le modalità principali per la diagnosi dell'ematoma epidurale. In combinazione con la TC spinale, la mielografia mostrerà SEH come una lesione intraspinale biconvessa e iperdensa con una densità equivalente al sangue. Sebbene ciò possa dimostrare una lesione epidurale con blocco spinale parziale o completo, i risultati non sono specifici. Inoltre, la mielografia è invasiva e può peggiorare lo stato clinico del paziente. Inoltre, sebbene possa mostrare segni di compressione con visualizzazione di blocco di contrasto aspecifico o compressione convessa extradurale, la mielografia non è in grado di determinare la natura e la reale estensione della lesione. Queste tecniche sono ora utilizzate raramente negli Stati Uniti poiché la risonanza magnetica è diventata la misura diagnostica gold standard.
Prevenzione, trattamento e prognosi
La puntura lombare o l'anestesia epidurale devono essere evitate nei soggetti che sono in terapia anticoagulante, hanno ricevuto una terapia trombolitica o si sospetta che abbiano una diatesi emorragica. Gli anestesisti sono invitati ad essere aggiornati sulla loro conoscenza dei protocolli anticoagulanti, dei nuovi farmaci anticoagulanti e delle attuali raccomandazioni delle linee guida. La decisione di eseguire il blocco neuroassiale e la tempistica di rimozione del catetere in un paziente in terapia antitrombotica deve essere presa su base individuale, soppesando i rischi di ematoma spinale con i benefici dell'anestesia regionale per un paziente specifico. L'American Society of Regional Anesthesia e la European and Scandinavian Society of Anesthesiologists hanno pubblicato dichiarazioni di consenso sull'anestesia neuroassiale e sull'anticoagulazione, che forniscono una fonte aggiornata per le linee guida nel processo decisionale nell'esecuzione dell'anestesia neuroassiale in un paziente a rischio fattori (vedi Anestesia neuroassiale e blocchi nervosi periferici in pazienti in trattamento con anticoagulanti).
Al contrario, non esistono linee guida per quanto riguarda l'anticoagulazione nei pazienti chirurgici. Recenti studi retrospettivi sull'incidenza dell'ematoma postoperatorio dopo un intervento chirurgico alla colonna vertebrale hanno concluso che forse i pazienti dovrebbero ricevere una profilassi per la trombosi venosa profonda poiché ciò non sembra avere un impatto sulla probabilità di formazione di SEH. Tuttavia, sono necessari ulteriori studi prospettici prima dell'istituzione diffusa della tromboprofilassi dopo l'intervento chirurgico alla colonna vertebrale, date le conseguenze devastanti della SEH. Case report hanno descritto una gestione conservativa di successo dell'ematoma epidurale. Il trattamento non chirurgico con buon esito è stato riportato principalmente negli ematomi localizzati a livello della cauda equina e in quelli con lieve deficit neurologico. Sembra che il recupero completo possa verificarsi con una gestione conservativa quando il paziente riferisce dolore alla schiena e debolezza o intorpidimento delle gambe ma non mostra una paralisi delle gambe. L'inversione delle anomalie della coagulazione, l'attenta osservazione dei deficit neurologici e, in rari casi, la somministrazione di steroidi possono ottenere un buon risultato senza intervento chirurgico. Viene mostrato un approccio pratico alla gestione del sospetto ematoma epidurale Figure 2 .
La decompressione chirurgica urgente è il trattamento di scelta per la SEH che causa una compromissione acuta della funzione del midollo spinale. La laminectomia è seguita dall'evacuazione dell'ematoma, dalla coagulazione dei siti di sanguinamento e dall'ispezione della dura madre. La dura viene quindi tesa all'osso e, occasionalmente, vengono impiegati drenaggi epidurali per un massimo di 24 ore. Sebbene storicamente l'efficacia dei drenaggi sia stata controversa, dati recenti suggeriscono che i drenaggi subfasciali riducono significativamente la formazione di SEH. Il recupero dopo una paralisi prolungata senza intervento chirurgico è raro e la consultazione chirurgica per prendere in considerazione la laminectomia decompressiva d'emergenza deve essere ottenuta il prima possibile. Il tasso di mortalità globale è dell'8%. In definitiva, il team chirurgico deve decidere di osservare o operare caso per caso. I fattori critici per il recupero dopo SEH sono il livello di deficit neurologico preoperatorio e l'intervallo operatorio. La prognosi per il recupero neurologico dipende principalmente dallo stato neurologico preoperatorio del paziente e dalla durata della disfunzione neurologica. La prognosi è peggiore quando c'è un ritardo tra la lesione e l'intervento chirurgico.
In precedenza, il completo recupero neurologico era considerato improbabile se erano trascorse più di 8 ore tra lo sviluppo della paralisi e l'intervento chirurgico. Tuttavia, altri autori hanno notato il recupero quando l'intervento chirurgico viene eseguito entro 12 ore dalla paralisi.
Questo lasso di tempo raccomandato per l'intervento è stato ulteriormente delineato dalla recente scoperta che il recupero può essere ottenuto quando l'intervento chirurgico viene eseguito entro 48 ore da un deficit motorio incompleto ed entro 36 ore da un deficit motorio completo (Tabella 1). È interessante notare che è stato riportato il recupero funzionale dopo 72 ore di sintomi. Sebbene sia rassicurante che il recupero funzionale possa verificarsi dopo tali intervalli, la valutazione dei sintomi del paziente e la risonanza magnetica di emergenza richiedono tempo. Pertanto, la consultazione con un chirurgo della colonna vertebrale in merito alla potenziale evacuazione emergente dell'ematoma dovrebbe essere ottenuta il prima possibile.
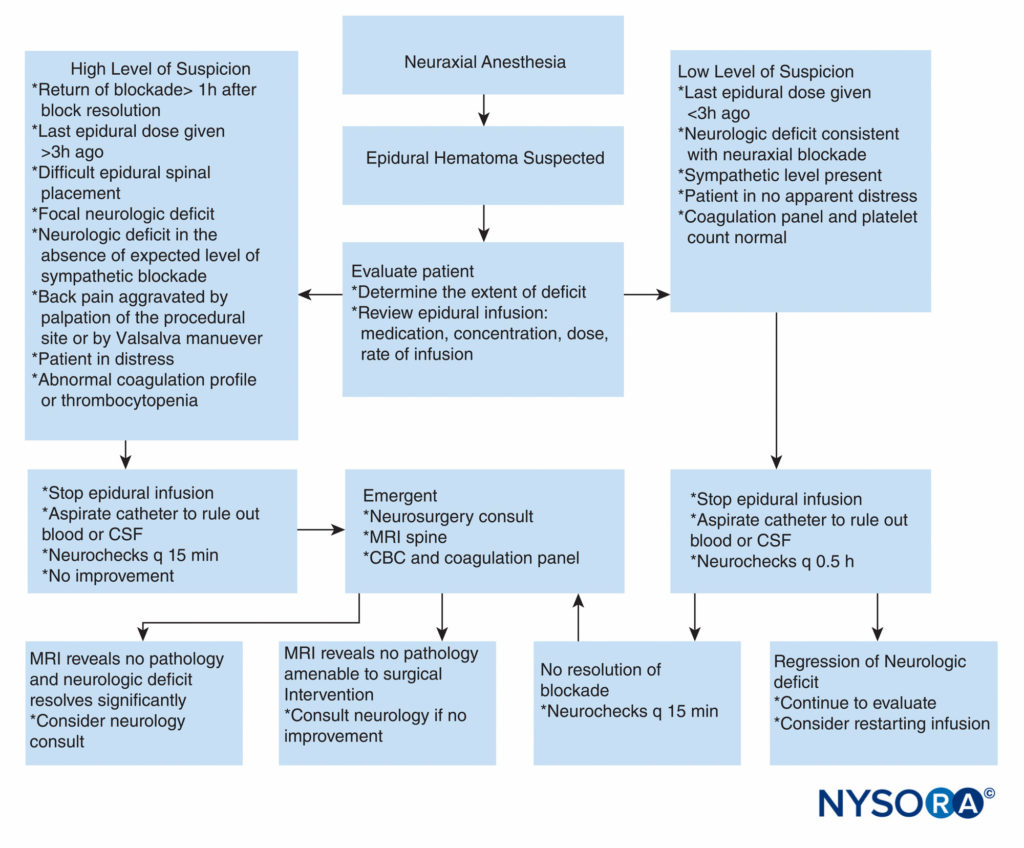
FIGURA 2. Approccio pratico al processo decisionale nel workup e nel trattamento di un paziente con sospetto ematoma epidurale. CBC = emocromo completo; CSF = liquido cerebrospinale; MRI = risonanza magnetica; q = ogni.
TABELLA 1. Recupero neurologico in relazione ai tempi dell'intervento chirurgico.
| Autore | Intervallo tra paralisi e guarigione |
|---|---|
| wulf68 | 8 ore 36 ore di un completo deficit motorio |
| Lawton et al48 | 12 ore 48 ore di un incompleto deficit motorio |
| Groen e Van Alphen69 |
Ematoma epidurale spinale: riassunto
L'ematoma epidurale spinale è una rara fonte di deterioramento neurologico e può causare disturbi autonomici, sensoriali e motori di varia entità a seconda della posizione e delle dimensioni dell'emorragia. La SEH può essere acuta o cronica, spontanea, post-traumatica o iatrogena. I fattori di rischio noti includono una procedura neuroassiale tecnicamente difficile, la presenza di coagulopatia intrinseca o acquisita, il sesso femminile e l'età avanzata. I potenziali fattori di rischio, come evidenziato da dati incoerenti in letteratura, includono bassi livelli di emoglobina, presenza di anticorpi Rh+ e anomalie anatomiche del midollo spinale. Dato che la SEH è una causa rara ma potenzialmente reversibile di compressione del midollo spinale, è essenziale che la diagnosi venga fatta senza indugio per consentire il pieno recupero. L'ematoma spinale può verificarsi anche in assenza di fattori di rischio identificabili; pertanto, gli operatori sanitari devono mantenere un alto indice di sospetto e vigilanza nel monitoraggio di nuovi sintomi neurologici.
Sebbene la risonanza magnetica non possa essere eseguita con la rapidità di una TC, è la modalità diagnostica di scelta perché è sia sensibile che specifica. La rapida individuazione del deterioramento neurologico è fondamentale per l'imaging diagnostico precoce e per un pronto intervento. È rassicurante notare che il recupero può avvenire senza intervento chirurgico in assenza di paralisi. Quando si verifica la paralisi, la decompressione chirurgica del midollo spinale e delle radici nervose può portare a un pieno recupero funzionale se eseguita entro un intervallo ragionevolmente rapido. Se l'intervento è ritardato, le sequele permanenti di SEH possono includere deficit sensoriali, paraplegia, spasticità, dolore neuropatico e disfunzione dello sfintere urinario o anale.
EMATOMA PERIFERICO DOPO BLOCCO NERVOSO
L'ematoma nello spazio epidurale è certamente la sequela emorragica più devastante dell'anestesia regionale neuroassiale o periferica, ma l'ematoma può verificarsi anche nella periferia dopo blocco nervoso singolo o continuo. I fattori di rischio più comuni sembrano essere la difficoltà procedurale e la concomitante terapia anticoagulante o antipiastrinica. Questa complicanza è estremamente rara, con meno di 30 casi di ematoma dopo blocco del nervo periferico (PNB) riportati in letteratura fino ad oggi, e le conseguenze sono anche meno gravi rispetto a SEH dato che l'emorragia si verifica in uno spazio periferico comprimibile.
Contrariamente alla SEH, il sintomo di presentazione dell'ematoma dopo PNB è raramente una disfunzione neurologica ma più tipicamente lividi visibili (Figure 3 ), dolorabilità locale, diminuzione dell'emoglobina/ematocrito o ipotensione relativa dovuta alla perdita di sangue. Questo non vuol dire che la natura conforme dello spazio periferico precluda morbilità e mortalità significative, poiché è stato riportato un caso di decesso del paziente secondario a emorragia retroperitoneale dopo blocco simpatico lombare nel contesto della terapia antipiastrinica. Il paziente è stato trovato durante l'autopsia per aver perso 3 L di sangue nel suo spazio retroperitoneale, il che parla della minaccia occulta presentata dalla periferia compiacente. In effetti, sono stati segnalati molti altri casi in cui i pazienti hanno sofferto di una morbilità significativa a causa dell'ematoma PNB, inclusa la degenza ospedaliera prolungata, la necessità di trasfusioni o l'insufficienza renale acuta.
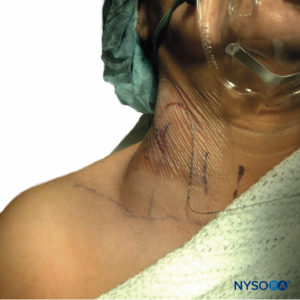
FIGURA 3. Ematoma del collo in un paziente in cui la vena giugulare esterna è stata perforata con un ago tipo Tuohy calibro 18 durante l'inserimento di un catetere nel solco interscalenico. L'ematoma mostrato era autonomo ed è stato trattato in modo conservativo con compressione locale.
Dato che in ogni caso riportato in letteratura il deficit neurologico, se presente, si era risolto entro 1 anno, sembra che la fonte di morbilità più preoccupante sia la perdita di sangue nell'ematoma. Tuttavia, a causa della natura rara di questa complicanza, è difficile per gli esperti formulare raccomandazioni su questa procedura nel contesto dell'anticoagulazione. Questa difficoltà è esacerbata dall'esistenza di casi clinici in cui si è verificato un ematoma nonostante i professionisti abbiano seguito le linee guida dell'American Society of Regional Anesthesia and Pain Medicine (ASRA). Inoltre, sono stati segnalati casi di ematomi spontanei che si sono verificati in pazienti in trattamento con enoxaparina o eparina tre volte al giorno. Nel loro insieme, questi fatti hanno portato a linee guida alquanto contrastanti in diversi paesi. Ad esempio, la Società tedesca di anestesiologia e terapia intensiva ha emesso raccomandazioni sulla cessazione dell'anticoagulazione prima del PNB, ma la Società austriaca afferma che i PNB distali, come i blocchi sciatici o ascellari, possono essere eseguiti in un paziente anticoagulato.
Le linee guida ASRA affermano che le raccomandazioni relative alle tecniche neuroassiali dovrebbero essere applicate ai blocchi del plesso profondo e ai PNB. Pertanto, i pazienti che ricevono anticoagulanti non sono candidati per queste tecniche anestetiche, ma alcuni ricercatori hanno suggerito che con l'avvento della guida ecografica, questi pazienti anticoagulanti potrebbero subire in sicurezza il blocco dei nervi periferici. Inoltre, gli studi hanno mostrato non solo una ridotta incidenza di puntura vascolare con l'uso degli ultrasuoni, ma anche una diminuzione del tasso di tossicità dell'anestetico locale. Questa opzione ha il potenziale per migliorare la sicurezza del paziente, dato che i pazienti in terapia anticoagulante hanno spesso fattori di rischio per l'anestesia generale e trarrebbero vantaggio dall'evitare le fluttuazioni risultanti nell'emodinamica e nello stato dei fluidi.
Una TAC è attualmente la tecnica di imaging più comune per la diagnosi del sangue nei tessuti periferici, in particolare lo spazio retroperitoneale. Tuttavia, gli ultrasuoni sono stati utilizzati per dimostrare la presenza di ematoma sottocapsulare renale93 e potrebbe potenzialmente essere una tecnica diagnostica più facilmente accessibile rispetto alla TC nelle regioni del corpo suscettibili di questo metodo di visualizzazione. L'uso crescente degli ultrasuoni nel posizionamento iniziale dei PNB potrebbe facilitare la diagnosi di casi sospetti di ematoma post-blocco poiché l'apparecchiatura a ultrasuoni sarà prontamente disponibile.
Sebbene la diagnosi tempestiva sia l'ideale, il trattamento successivo dell'ematoma dopo PNB è in genere una gestione in attesa. Un'équipe chirurgica viene normalmente consultata, le trasfusioni di sangue vengono ordinate secondo necessità e il drenaggio chirurgico viene preso in considerazione solo nei pazienti critici o in rapido deterioramento. Alcuni casi clinici di ematoma psoas si sono risolti senza evacuazione chirurgica dell'ematoma e i pazienti hanno riacquistato il loro stato sensoriale e motorio da pochi giorni a 4 mesi dopo la diagnosi. Per quanto riguarda gli ematomi concomitanti con il catetere nervoso periferico, anche questi sono spesso autolimitanti, ma ci sono segnalazioni in cui è stato eseguito il drenaggio chirurgico.
Data la scarsità di dati disponibili sull'emorragia dopo PNB o blocco nervoso continuo, può essere difficile determinare con precisione la superiorità di una certa tecnica anestetica per un paziente specifico. Gli anestesisti dovrebbero individualizzare la loro decisione in base all'idoneità dei PNB nei pazienti in terapia con anticoagulanti e, come sempre, discutere in dettaglio i rischi ei benefici del blocco con il paziente e il chirurgo. Se viene eseguito un blocco, il paziente deve essere attentamente osservato nel periodo perioperatorio per segni e sintomi di ematoma periferico.
BIBLIOGRAFIA
- Plagne R: L'ematoma extradurale rachidien non traumatique (ematoma epidurale spontaneo) [dissertazione]. Clermont-Ferrand, Francia: Università di Clermont-Ferrand, 1961.
- Jackson R: Caso di apoplessia spinale. Lancet 1869;2:538–539.
- Holtas S, Heiling M, Lonntoft M: Ematoma epidurale spinale spontaneo: risultati all'imaging RM e correlazione clinica. Radiologia 1996;199: 409–413.
- Alexiadou-Rudolf C, Ernestus R, Nanassis K, et al: Ematomi epidurali spinali acuti non traumatici. Colonna vertebrale 1998;23:1810–1813.
- Tekkok IH, Cataltepe O, Tata K, et al: Ematoma extradurale dopo anestesia extradurale continua. Fr. J. Anaesth 1991; 67:112–115.
- Hejazi N, Thaper PY, Hassler W: Nove casi di ematoma epidurale spinale non traumatico. Neurol Med Chir 1998;38:718–723.
- Sokolowski MJ, Garvey TA, Perl J, et al: Studio prospettico dell'ematoma epidurale lombare postoperatorio. Colonna vertebrale 2008;33:108–113.
- Glotzbecker MP, Bono CM, Wood KB, Harris M: Ematoma epidurale spinale postoperatorio: una revisione sistematica. Colonna vertebrale 2010;35:E413–E420.
- Tryba M: Anestesia regionale epidurale ed eparina a basso peso molecolare: pro [in tedesco]. Anasthesiol Intensivmed Notfallmed Schmerzther 1993;28:179–181.
- Horlocker T: Complicazioni dell'anestesia regionale e gestione del dolore acuto. Anesthesiol Clin 2011;29:257–278.
- Moen V, Dahlgren N, Irestedt L: Gravi complicazioni neurologiche dopo blocchi neuroassiali centrali in Svezia nel 1990-1999. Anestesiologia 2004;101:950–959.
- Popping DM, Zahn PK, Van Aken HK, Dasch B, Boche R, Pogatzki-Zahn EM: Efficacia e sicurezza della gestione del dolore postoperatorio: un'indagine su 18,925 pazienti consecutivi tra il 1998 e il 2006 (2a revisione): un'analisi del database di dati. Fr. J Anaesth 2008;101:832–840.
- Horlocker T, Kopp S: Ematoma epidurale dopo blocco epidurale negli Stati Uniti: non è più solo eparina a basso peso molecolare dopo chirurgia ortopedica. Anesth Analg 2013;116:1195–1197.
- Bateman BT, Mhyre JM, Ehrenfeld J, et al: Il rischio e gli esiti degli ematomi epidurali dopo il cateterismo epidurale perioperatorio e ostetrico: un rapporto dal consorzio di ricerca di gruppo sugli esiti perioperatori multicentrici. Anesth Analg 2013;116:1380–1385.
- Usubiaga JE, WJ, Usabiaga LE: pressione epidurale e sua relazione con la diffusione di soluzioni anestetiche nello spazio epidurale. Anesth Analg 1967;46:440–446.
- Cummings SR, Nevitt MC, Browner WS, et al: Gruppo di ricerca sullo studio delle fratture osteoporotiche: fattori di rischio per la frattura dell'anca nelle donne bianche. N Inglese J Med 1995;332:767–773.
- Hasserius R, Johnell O, Nilsson BE, et al: i pazienti con frattura dell'anca hanno più deformità vertebrali rispetto ai soggetti negli studi basati sulla popolazione. Osso 2003; 32:180–184.
- Awad JK, Kebaish KM, Donigan J, Cohen DB, Kostuik JP: Analisi dei fattori di rischio per lo sviluppo dell'ematoma epidurale spinale post-operatorio. J Bone Joint Surg Br 2005;87:1248–1252.
- Horlocker TT, Wedel DJ: blocco neuroassiale ed eparina a basso peso molecolare: bilanciamento dell'analgesia perioperatoria e della tromboprofilassi. Reg Anesth 1998;23:164–177.
- Johnston RA: La gestione della compressione acuta del midollo spinale. J Neurol Neurochirurgia Psichiatra 1993;56:1046–1054.
- Wysowski DK, Talarico L, Bacsanyi J, et al: ematoma spinale ed epidurale ed eparina a basso peso molecolare. N Inglese J Med 1998;338: 1774–1775.
- Vandermeulen E, Van Aken H, Vermylen J: Anticoagulanti e anestesia spinalepidurale. Anesth Analg 1994;79:1165–1177.
- Dickman CA, Shedd SA, Spetzler RF: Ematoma epidurale spinale associato ad anestesia epidurale: complicanze dell'eparinizzazione sistemica in pazienti sottoposti a terapia trombolitica vascolare periferica. Anestesiologia 1990;72:947–950.
- Mattle H, Sieb JP, Rohner M, et al: ematomi spinali epidurali e subdurali non traumatici. Neurologia 1987;37:1351–1356.
- Levine MN, Goldhaber SZ, Gore JM, et al: Complicanze emorragiche della terapia trombolitica nel trattamento dell'infarto miocardico e del tromboembolismo venoso. Petto 1995;108 (Suppl 4):291S–301S.
- Graziani N, Bouillot P, Figarella-Bragner D, et al: Angiomi cavernosi e malformazioni artero-venose dello spazio epidurale spinale: relazione di 11 casi. Neurochirurgia 1994;35:856–864.
- Harik S, Raichle M, Reis D: Ematoma epidurale spinale a remissione spontanea in un paziente in terapia con anticoagulanti. N Inglese J Med 1971;284: 1355–1357.
- Zuccarello M, Scanarini M, D'Avella, et al: Ematoma spinale extradurale spontaneo durante la terapia anticoagulante. Surg Neurol 1980;14:411–413.
- Chen C, Fang W, Chen C, et al: Ematomi epidurali spinali spontanei con remissione e recidiva ripetute. Neuroradiologia 1997;39:737–740.
- Groen R, Ponssen H: L'ematoma epidurale spinale spontaneo: uno studio dell'eziologia. J Neurolog Sci 1990;98:121–138.
- Packer N, Cummins B: Emorragia epidurale spontanea: un'emergenza chirurgica. Lancet 1978;1:356–358.
- Hebl JR, Horlocker TT, Kopp SL, Schroeder DR: blocco neuroassiale in pazienti con stenosi spinale preesistente, malattia del disco lombare o precedente intervento chirurgico alla colonna vertebrale: efficacia e complicanze neurologiche. Anesth Analg 2010;111:1511–1519.
- Joseph A, Vinen J: Ematoma epidurale spinale acuto. J Emerg Med 1993;11:437–441.
- Beatty RM, Winston KR: ematoma epidurale cervicale spontaneo. Una considerazione di eziologia. J Neurochirurgia 1984;61:143–148.
- Pan G, Kulkarni M, MacDougall DJ, et al: Ematoma epidurale traumatico del rachide cervicale: diagnosi con risonanza magnetica. J Neurochirurgia 1988;68:798–801.
- Foo D, Rossier A: Stato neurologico preoperatorio nel predire l'esito chirurgico degli ematomi epidurali spinali. Surg Neurol 1981; 15: 389–340.
- David S, Salluzzo RF, Bartfield JM, et al: Hamatoma epidurale cervicotoracico spontaneo a seguito di Valsalva prolungato secondario a suonare la tromba. Am J Emerg Med 1997; 15:73–75.
- Fukui M, Swarnkar A, Williams R: Ematomi epidurali spinali spontanei acuti. Am J Neuroradiol 1999;20:1365–1372.
- Joseph A, Vinen J: Ematoma epidurale spinale acuto. J Emerg Med 1993;11:437–441.
- Bidzinski J: Ematoma epidurale spinale spontaneo durante la gravidanza. J Neurochirurgia 1966;24:1017–1018.
- Carroll S, Malhotra R, Eustace D, et al: Ematoma spinale extradurale spontaneo durante la gravidanza. J Matern Fetal Med 1997;6:218–219.
- Stoll AS, Sanchez M: Ematoma epidurale dopo blocco epidurale: implicazioni per il suo utilizzo nella gestione del dolore. Surg Neurol 2002;57:235–240.
- Bruyn GW, Bosma NJ: ematoma extradurale spinale. In Vinken PJ, Bruyn GW (a cura di): Manuale di neurologia clinica. Olanda settentrionale, 1976, pp 1–30.
- Horlocker T, Wedel DJ, Rowlingson JC, et al: Anestesia regionale nel paziente che riceve una terapia antitrombotica o trombolitica: linee guida basate sull'evidenza della Società americana di anestesia regionale e medicina del dolore (terza edizione). Reg Anesth Antidolorifico 2010;35:64–101.
- Matsume M, Shimoda M, Shibuya N: ematoma epidurale cervicale spontaneo. Surg Neurol 1987;28:381–384.
- Lonjon M, Paquis P, Chanalet S, et al: Ematoma spinale epidurale non traumatico: relazione di quattro casi e revisione della letteratura. Neurochirurgia 1997;41:483–487.
- Cwik J: Considerazioni postoperatorie sull'anestesia neuroassiale. Anesthesiol Clin 2012;30:433–443.
- Lawton M, Porter R, Heiserman J, et al: Gestione chirurgica dell'ematoma epidurale spinale: relazione tra tempistica chirurgica e esito neurologico. J Neurochirurgia 1995;83:1–7.
- Avrahami E, Tadmor R, Ram Z, et al: dimostrazione MR di ematoma epidurale acuto spontaneo della colonna vertebrale toracica. Neuroradiologia 1989;31:89–92.
- Mattle H, Sieb J, Rohner M, et al: ematomi spinali epidurali e subdurali non traumatici. Neurologia 1987;37:1351–1356.
- Beatty RM, Winston KR: ematoma epidurale cervicale spontaneo. Una considerazione di eziologia. J Neurochirurgia 1984;61:143–148.
- Cooper DW: Ematoma epidurale spinale spontaneo. Caso clinico. J Neurochirurgia 1967;26:343–345.
- Uribe JM, Moza K, Jimenez O, Green B, Levi AD: ematomi epidurali spinali postoperatori ritardati. Colonna vertebrale J 2003;3:125–129.
- Gogarten W, Vandermeulen E, Van Aken H, Kozek S, Llau JV, Samama CM; Società Europea di Anestesiologia: Anestesia regionale e agenti antitrombotici: raccomandazioni della Società Europea di Anestesiologia. Eur J Anaesthesiol 2010;27:999–1015.
- Breivik H, Bang U, Jalonen J, Vigfusson G, Alahuhta S, Lagerkranser M: linee guida nordiche per i blocchi neuroassiali nell'emostasi disturbata della Scandinavian Society of Anesthesiology and Intensive Care Medicine. Acta Anaesthesiol Scand 2010;54:16–41.
- Jacobs LJ, Woods BI, Chen AF, Lunardini DJ, Holh JB, Lee JY: La sicurezza della chemioprofilassi tromboembolica in pazienti con trauma spinale che richiedono stabilizzazione chirurgica. Colonna vertebrale 2013;38:E1041–7.
- Pahapill PA, Lownie SP: trattamento conservativo dell'ematoma epidurale spinale spontaneo acuto. Can J Anaesth 1998;25:159–163.
- Schwarz SK, Wong CL, McDonald WN: Recupero spontaneo da un ematoma epidurale spinale con presentazione atipica in un non-agenario. Can J Anesth 2004;51:557–561.
- Benzon HT, Snitzer J, Hoxie S, Pollina R, Nelson A: Revisione di casi clinici di ematoma spinale. Presentato all'incontro annuale dell'American Society of Anesthesiologists, Washington, DC, 16 ottobre 2012.
- Tailor J, Dunn IF, Smith E: Gestione conservativa dell'ematoma epidurale spinale spontaneo associato alla terapia anticoagulante orale in un bambino. Childs Nerv Syst 2006;22:1643–1645.
- Connoly SE, Winfree CJ, McCormick PC: gestione dell'ematoma epidurale spinale dopo attivatore del plasminogeno tissutale. Un caso clinico. Colonna vertebrale 1996;21:1694–1698.
- Lopez AG, Lara JMP, Hidalgo RH, Gonzalo PE; Ematoma spinale epidurale dopo terapia trombolitica per infarto miocardico acuto. Ortopedia 1999;22:987–988.
- Marzai H, Eminoglu M, Orguc S: i drenaggi sono utili per la chirurgia del disco lombare? Uno studio clinico randomizzato prospettico. J Disordino Spinale Tech 2006;19:171–177.
- Hejazi N, Thaper PY, Hassler W: Nove casi di ematoma epidurale spinale non traumatico. Neurol Med Chir 1998;38:718–723.
- Wolfgang P, Klaus M: Ematoma spinale non correlato a precedente intervento chirurgico: analisi di 15 casi consecutivi trattati in un unico istituto in un periodo di 10 anni. Colonna vertebrale 2004;24:555–561.
- Rohde V, Küker W, Reines MHT, et al: trattamento microchirurgico degli ematomi epidurali spinali spontanei e non spontanei: esito neurologico in relazione all'eziologia. Acta Neurochir 2000; 142: 787–793.
- Wulf H: Anestesia epidurale ed ematoma spinale. Can J Anaesth 1996;43:1260–1271.
- Mukerji N, Todd N. Ematoma epidurale spinale; fattori che influenzano il risultato. Br J Neurosurg 2013;27:712–717.
- Groen RT, Van Alphen HA: Trattamento chirurgico degli ematomi epidurali spinali spontanei: uno studio dei fattori che determinano l'esito postoperatorio. Neurochirurgia 1996;39:494–508.
- Enomato T, Maki Y, Nakagawa K, et al: Ematoma epidurale spinale spontaneo: relazione di un caso. Neurol Surg 1980;8:875–880.
- Klein SM, D'Ercole F, Greengrass RA, et al: Enoxaparina associata a ematoma psoas e plessopatia lombare dopo blocco del plesso lombare. Anestesiologia 1997;87:1576–1579.
- Weller RS, Gerancher JC, Crews JC, et al: ematoma retroperitoneale esteso senza deficit neurologico in due pazienti che hanno subito un blocco del plesso lombare e sono stati successivamente anticoagulati. Anestesiologia 2003;98:581–583.
- Maier C, Gleim M, Weiss T, Stachetzki U, Nicolas V, Zenz M: Grave sanguinamento dopo blocco simpatizzante lombare in due pazienti in terapia con inibitori irreversibili dell'aggregazione piastrinica. Anestesiologia 2002;97:740–743.
- Poivert C, Malinovsky JM: ematoma della coscia dopo blocco del nervo sciatico e fondaparinux. Ann padre Anesth Reanim 2012;31:484–485.
- Ferraro LH, Tardelli MA, Yamashita AM, Cardone JD, Kishi JM: blocchi del nervo sciatico e femorale ecoguidati in un paziente anticoagulato. Rapporti di casi. Rev Bras Anestesiol 2010;60:422–428.
- Clendenen SR, Robards CB, Wang RD, Greengrass RA: blocco interscalenico continuo associato a ematoma del collo e sepsi postoperatoria. Anesth Analg 2010;110:1236–1238.
- Johr M: Una complicazione del blocco continuo del nervo femorale. Reg Anaesth (tedesco) 1987; 10:37–38.
- Neuberger M, Breithbarth J, Reisig F, Lang D, Buttner J: Complicazioni ed eventi avversi in anestesia regionale periferica continua. Risultati delle indagini su 3,491 cateteri [in tedesco]. Anestesista 2006;55: 33–40.
- Wiegel M, Gottschaldt U, Hennebach R, Hirschberg T, Reske A: Complicazioni ed effetti avversi associati a blocchi nervosi periferici continui nei pazienti ortopedici. Anesth Analg 2007;104: 1578–1582.
- Enneking FK, Chan V, Greger J, Hadzic A, Lang SA, Horlocker TT: blocco nervoso periferico degli arti inferiori: elementi essenziali della nostra attuale comprensione. Reg Anesth Antidolorifico 2005;30:4–35.
- Antonelli D, Fares L, Anene C: Enoxaparina associata a enormi ematomi della parete addominale: una relazione di due casi. Am Chirurgo 2000;66:797–800.
- Dickinson LD, Miller L, Patel CP, et al: L'enoxaparina aumenta l'incidenza di emorragia intracranica postoperatoria quando iniziata prima dell'intervento per la profilassi della trombosi venosa profonda con tumori cerebrali. Neurochirurgia 1998;43:1074–1081.
- Ho KJ, Gawley SD, Young MR: Psoas ematoma e neuropatia femorale associati alla terapia con enoxaparina. Int J Clin Pract 2003;57:553–554.
- Houde JP, Steinberg G: emorragia intraepatica dopo l'uso di eparina a basso peso molecolare per l'artroplastica totale dell'anca. J Artroplastica 1999;14:372–374.
- King CS, Holley AB, Jackson JL, et al: dosaggio di eparina due volte contro tre volte al giorno per la profilassi del tromboembolismo nella popolazione generale: una metaanalisi. Cassa 2007;131:507–516.
- Kozek-Langenecker SA, Fries D, Gutl M, et al: Anestesia locoregionale e coagulazione negli inibitori. Raccomandazioni della Task Force sulla coagulazione perioperatoria della Società austriaca di anestesiologia e terapia intensiva [in tedesco]. Anestesista 2005;54:476–484.
- Abrahams MS, Aziz MF, Fu RF, Horn JL: guida ecografica rispetto alla neurostimolazione elettrica per il blocco del nervo periferico: una revisione sistematica e una meta-analisi di studi randomizzati controllati. Fr. J Anaesth 2009;102:408–417.
- Barrington MJ, Watts SA, Gledhill RA, et al: Risultati preliminari dell'Australasian Regional Anesthesia Collaboration: un audit prospettico di oltre 7000 blocchi dei nervi e del plesso periferici per complicazioni neurologiche e di altro tipo. Reg Anesth Antidolorifico 2009;34:534–541.
- Siti BD, Taenzer AH, Herrick MD, et al: incidenza di tossicità sistemica locale e sintomi neurologici postoperatori associati a 12,668 blocchi nervosi guidati da ultrasuoni. Un'analisi da un registro clinico prospettico. Reg Anesth Antidolorifico 2012;37:478–482.
- Orebaugh SL, Mentor ML, Williams BA: esiti avversi associati a blocchi nervosi periferici guidati da stimolatori nervosi e guidati da ultrasuoni da tirocinanti supervisionati: aggiornamento di un database a sito singolo. Reg Anesth Antidolorifico 2012;37:577–582.
- Barrington MJ, Kluger R: La guida ecografica riduce il rischio di tossicità da anestetico locale in seguito al blocco dei nervi periferici. Reg Anesth Antidolorifico 2013;38:289–299.
- Monib S, Ritchie A, Thabet E: ematoma retroperitoneale idiopatico. J Surg Tech Caso Rep 2011;3:49–51.
- Aida S, Takahashi H, Shimoji K: ematoma sottocapsulare renale dopo blocco del plesso lombare. Anestesiologia 1996;84:452–455.

