Daquan Xu
INTRODUCTION
L'application échographique permet une visualisation non invasive des structures tissulaires. Les images ultrasonores en temps réel sont des images intégrées résultant de la réflexion des surfaces d'organes et de la diffusion au sein de tissus hétérogènes. L'échographie est une procédure interactive impliquant l'opérateur, le patient et les instruments à ultrasons. Bien que la physique derrière la génération, la propagation, la détection et la transformation des ultrasons en informations pratiques soit plutôt complexe, son application clinique est beaucoup plus simple. Parce que l'imagerie par ultrasons s'est considérablement améliorée au cours de la dernière décennie, elle peut fournir aux anesthésiologistes la possibilité de visualiser directement le nerf cible et les structures anatomiques pertinentes. Un bloc nerveux guidé par ultrasons est un domaine de croissance critique pour les nouvelles applications de la technologie des ultrasons et est devenu un élément essentiel de l'anesthésie régionale. Comprendre la physique des ultrasons de base présentée dans cette section sera utile aux anesthésiologistes pour sélectionner correctement le transducteur, régler le système à ultrasons, puis obtenir une imagerie satisfaisante.
HISTOIRE DES ULTRASONS
En 1880, les physiciens français Pierre Curie et son frère aîné, Paul-Jacques Curie, ont découvert l'effet piézoélectrique dans certains cristaux. Paul Langevin, élève de Pierre Curie, a mis au point des matériaux piézoélectriques, capables de générer et de recevoir des vibrations mécaniques à haute fréquence (donc ultradu son). Pendant la Première Guerre mondiale, les ultrasons ont été introduits dans la marine comme moyen de détecter les sous-marins ennemis. Dans le domaine médical, cependant, l'échographie a d'abord été utilisée à des fins thérapeutiques plutôt que diagnostiques. À la fin des années 1920, Paul Langevin a découvert que les ultrasons de haute puissance pouvaient générer de la chaleur dans les os et perturber les tissus animaux. En conséquence, tout au long des années 1950, les ultrasons ont été utilisés pour traiter les patients atteints de la maladie de Ménière, de la maladie de Parkinson et de l'arthrite rhumatismale. Les applications diagnostiques de l'échographie ont commencé grâce à la collaboration de médecins et d'ingénieurs en sonar (télémétrie de navigation sonore). En 1942, Karl Dussik, un neuropsychiatre, et son frère, Friederich Dussik, un physicien, ont décrit l'échographie comme un outil de diagnostic médical pour visualiser les tissus néoplasiques dans le cerveau et les ventricules cérébraux. Cependant, les limites de l'instrumentation à ultrasons à l'époque ont empêché le développement d'applications cliniques jusqu'au milieu des années 1960. Le B-scanner en temps réel a été développé en 1965 et a été introduit pour la première fois en obstétrique. En 1976, les premiers échographes couplés à des mesures Doppler sont commercialisés. En ce qui concerne l'anesthésie régionale, dès 1978, La Grange et ses collègues ont été les premiers anesthésiologistes à publier un rapport de série de cas sur l'application de l'échographie au bloc nerveux périphérique. Ils ont simplement utilisé un transducteur Doppler pour localiser l'artère sous-clavière et ont réalisé un bloc supraclaviculaire du plexus brachial chez 61 patients (Figures 1A et 1B). Selon certaines informations, le guidage Doppler a conduit à un taux de réussite élevé du bloc (98 %) et à l'absence de complications telles que pneumothorax, paralysie du nerf phrénique, hématome, convulsion, bloc du nerf laryngé récurrent et rachianesthésie. En 1989, Ting et Sivagnanaratnam ont rapporté l'utilisation de l'échographie en mode B pour démontrer l'anatomie de l'aisselle et pour observer la propagation des anesthésiques locaux pendant le bloc du plexus brachial axillaire.
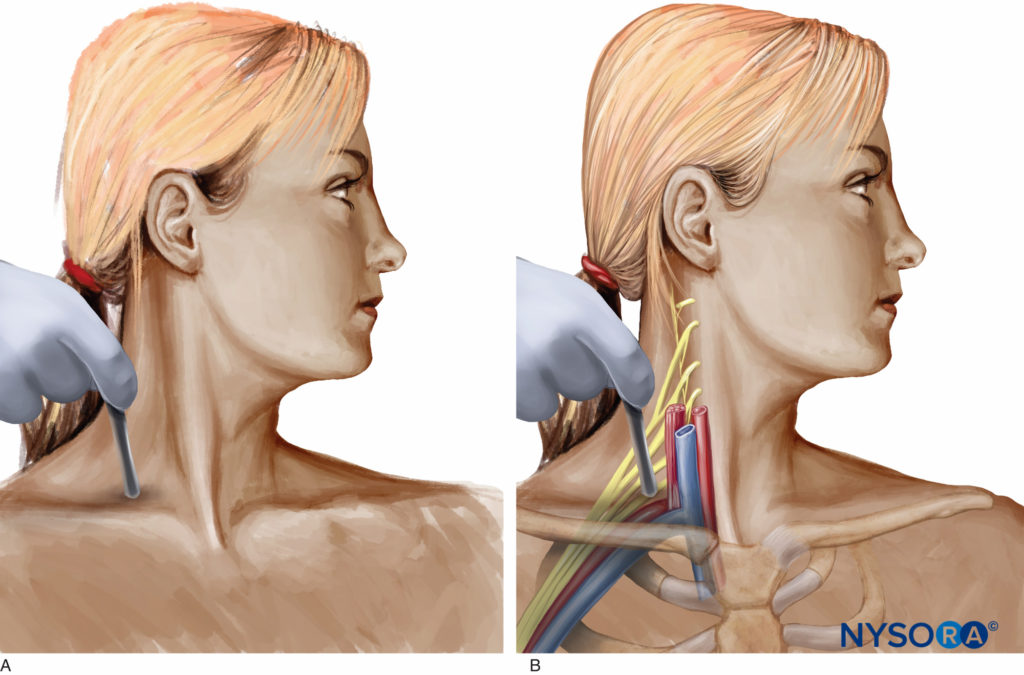
Figure 1. A : Application précoce de l'échographie Doppler par LaGrange pour réaliser un bloc brachial sus-claviculaire. B : Relation du plexus brachial des nerfs et de l'artère sous-clavière.
En 1994, Stephan Kapral et ses collègues ont systématiquement exploré le plexus brachial avec une échographie en mode B. Depuis lors, plusieurs équipes dans le monde ont travaillé sans relâche pour définir et améliorer l'application de l'imagerie ultrasonore en anesthésie régionale. Le bloc nerveux guidé par ultrasons est actuellement utilisé en routine dans la pratique de l'anesthésie régionale dans de nombreux centres à travers le monde.
Voici un résumé des faits rapides sur l'échographie :
- 1880 : Pierre et Jacques Curie découvrent l'effet piézoélectrique dans les cristaux.
- 1915 : Les ultrasons sont utilisés par la marine pour détecter les sous-marins.
- Années 1920 : Paul Langevin découvre que les ultrasons de haute puissance peuvent générer de la chaleur dans les tissus osseux et perturber les tissus animaux.
- 1942 : Les frères Dussik décrivent l'utilisation des ultrasons comme outil de diagnostic.
- Années 1950 : L'échographie est utilisée pour traiter les patients atteints de la maladie de Ménière, de la maladie de Parkinson et de l'arthrite rhumatismale.
- 1965 : Le B-scan en temps réel est développé et introduit en obstétrique.
- 1978 : La Grange publie la première série de cas d'application des ultrasons pour le placement des aiguilles pour les blocs nerveux.
- 1989 : Ting et Sivagnanaratnam utilisent l'échographie pour démontrer l'anatomie de l'aisselle et pour observer la propagation des anesthésiques locaux lors d'un bloc axillaire.
- 1994 : Steven Kapral et ses collègues ont exploré le bloc du plexus brachial en utilisant l'échographie en mode B.
Définition de l'échographie
Le son se propage sous la forme d'une onde longitudinale mécanique dans laquelle le mouvement de va-et-vient des particules est parallèle à la direction de propagation des ondes. Les ultrasons sont des sons à haute fréquence et font référence à des vibrations mécaniques supérieures à 20 kHz. L'oreille humaine peut entendre des sons avec des fréquences comprises entre 20 Hz et 20 kHz. Les éléphants peuvent générer et détecter des sons avec des fréquences inférieures à 20 Hz pour les communications longue distance ; les chauves-souris et les dauphins produisent des sons dans la gamme de 20 à 100 kHz pour une navigation précise (Figures 2A et 2B). Les fréquences ultrasonores couramment utilisées pour le diagnostic médical sont comprises entre 2 et 15 MHz. Cependant, les sons avec des fréquences supérieures à 100 kHz ne se produisent pas naturellement ; seuls les appareils développés par l'homme peuvent à la fois générer et détecter ces fréquences, ou ultrasons.
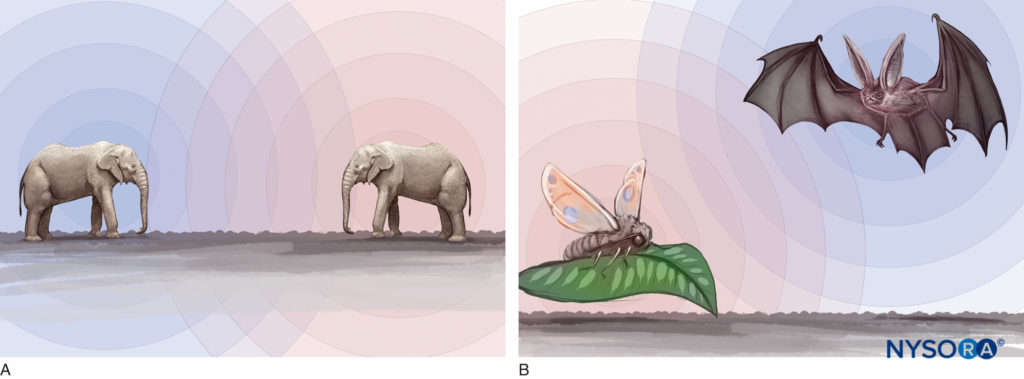
Figure 2. R : Les éléphants peuvent générer et détecter le son de fréquences inférieures à 20 Hz pour les communications longue distance. B : Les chauves-souris et les dauphins produisent des sons dans la gamme de 20 à 100 kHz pour la navigation et l'orientation spatiale.
Effet piézoélectrique
Les ondes ultrasonores peuvent être générées par des matériaux à effet piézoélectrique. L'effet piézoélectrique est un phénomène présenté par la génération d'une charge électrique en réponse à une force mécanique (compression ou étirement) appliquée sur certains matériaux. A l'inverse, une déformation mécanique peut se produire lorsqu'un champ électrique est appliqué à un tel matériau, également appelé effet piézoélectrique (Figure 3). Les matériaux naturels et artificiels, y compris les cristaux de quartz et les matériaux céramiques, peuvent présenter des propriétés piézoélectriques. Récemment, le titanate de zirconate de plomb a été utilisé comme matériau piézoélectrique pour l'imagerie médicale. Des matériaux piézoélectriques sans plomb sont également en cours de développement. Les matériaux piézoélectriques individuels produisent une petite quantité d'énergie. Cependant, en empilant des éléments piézoélectriques en couches dans un transducteur, le transducteur peut convertir plus efficacement l'énergie électrique en oscillations mécaniques. Ces oscillations mécaniques sont ensuite converties en énergie électrique.
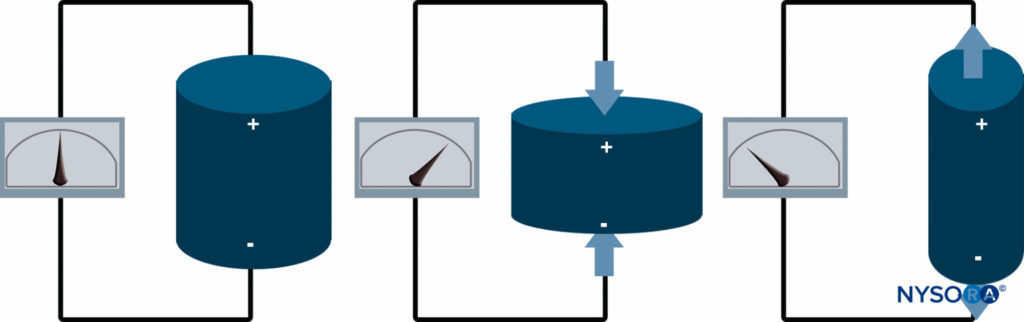
Figure 3. L'effet piézoélectrique. La déformation mécanique et l'oscillation conséquente causée par un champ électrique appliqué à certains matériaux peuvent produire un son de haute fréquence.
Terminologie des ultrasons
Période est le temps nécessaire à une onde sonore pour terminer un cycle ; l'unité de mesure de la période est la microseconde (µs). Longueur des ondes est la longueur de l'espace sur lequel un cycle se produit ; elle est égale à la distance parcourue du début à la fin d'un cycle. Fréquence est le nombre de cycles répétés par seconde et mesuré en hertz (Hz). Vitesse acoustique est la vitesse à laquelle une onde sonore se propage dans un milieu. Elle est égale à la fréquence multipliée par la longueur d'onde. La rapidité c est déterminé par la densité ρ et la rigidité κ du milieu (c = (κ/ρ)1/2). Densité est la concentration d'un milieu. Rigidité est la résistance d'un matériau à la compression. La vitesse de propagation augmente si la rigidité est augmentée ou si la densité est diminuée.
La vitesse de propagation moyenne dans les tissus mous est de 1540 m/s (varie de 1400 à 1640 m/s). Cependant, les ultrasons ne peuvent pas pénétrer les tissus pulmonaires ou osseux. Impédance acoustique z est le degré de difficulté démontré par une onde sonore transmise à travers un milieu; elle est égale à la densité ρ multipliée par la vitesse acoustique c (z = ρc). Elle augmente si la vitesse de propagation ou la densité du milieu est augmentée. Coefficient d'atténuation est le paramètre utilisé pour estimer la décrémentation de l'amplitude des ultrasons dans certains milieux en fonction de la fréquence des ultrasons. Le coefficient d'atténuation augmente avec l'augmentation de la fréquence ; par conséquent, une conséquence pratique de l'atténuation est que la pénétration diminue à mesure que la fréquence augmente (Figure 4).
Les ondes ultrasonores ont un effet d'auto-focalisation, qui fait référence au rétrécissement naturel du faisceau ultrasonore à une certaine distance de déplacement dans le champ ultrasonore. C'est un niveau de transition entre champ proche et champ lointain. La largeur du faisceau au niveau de la transition est égale à la moitié du diamètre du transducteur. A la distance de deux fois la longueur du champ proche, la largeur du faisceau atteint le diamètre du transducteur. L'effet d'auto-focalisation amplifie les signaux ultrasonores en augmentant la pression acoustique.
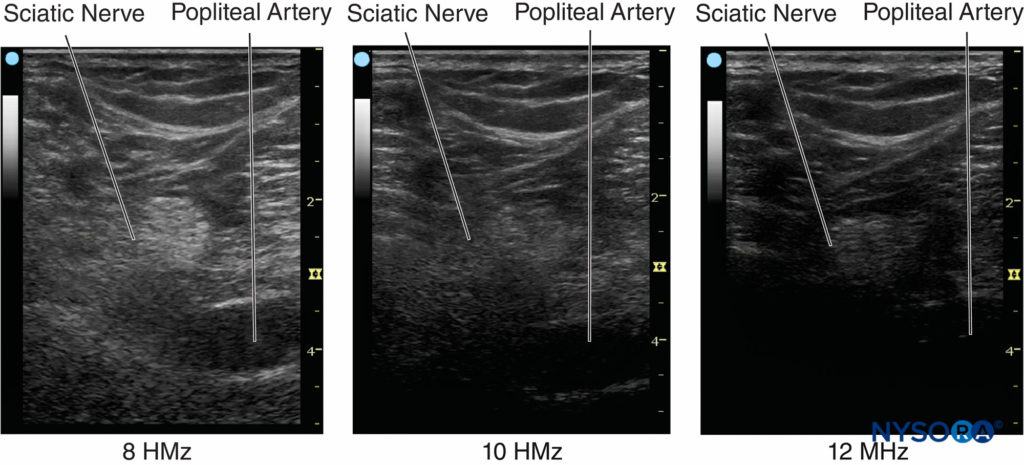
Figure 4. L'amplitude des ultrasons diminue dans certains milieux en fonction de la fréquence des ultrasons, phénomène appelé coefficient d'atténuation. (Adapté avec la permission de Hadzic A : Hadzic's Peripheral Nerve Blocks and Anatomy for Ultrasound-Guided Regional Anesthesia, 2e éd. New York : McGraw-Hill, Inc ; 2011.)
En imagerie ultrasonore, il existe deux aspects de la résolution spatiale : axiale et latérale. Résolution axiale est la séparation minimale des plans au-dessus et au-dessous le long de l'axe du faisceau. Elle est déterminée par la longueur d'impulsion spatiale, qui est égale au produit de la longueur d'onde et du nombre de cycles dans une impulsion. Il peut être présenté dans la formule suivante :
Résolution axiale = Longueur d'onde λ × Nombre de cycles par impulsion n 2
Le nombre de cycles dans une impulsion est déterminé par les caractéristiques d'amortissement du transducteur. Le nombre de cycles dans une impulsion est généralement fixé entre 2 et 4 par le fabricant des appareils à ultrasons. Par exemple, si un transducteur à ultrasons de 2 MHz est théoriquement utilisé pour effectuer le balayage, la résolution axiale serait comprise entre 0.8 et 1.6 mm, ce qui rend impossible la visualisation d'une aiguille de calibre 21. Pour une vitesse acoustique constante, les ultrasons à haute fréquence peuvent détecter des objets plus petits et fournir une image avec une meilleure résolution. La résolution axiale des échographes actuels est comprise entre 0.05 et 0.5 mm. Figure 5 affiche des images à différentes résolutions lorsqu'un objet de 0.5 mm de diamètre est visualisé avec trois réglages de fréquence différents.
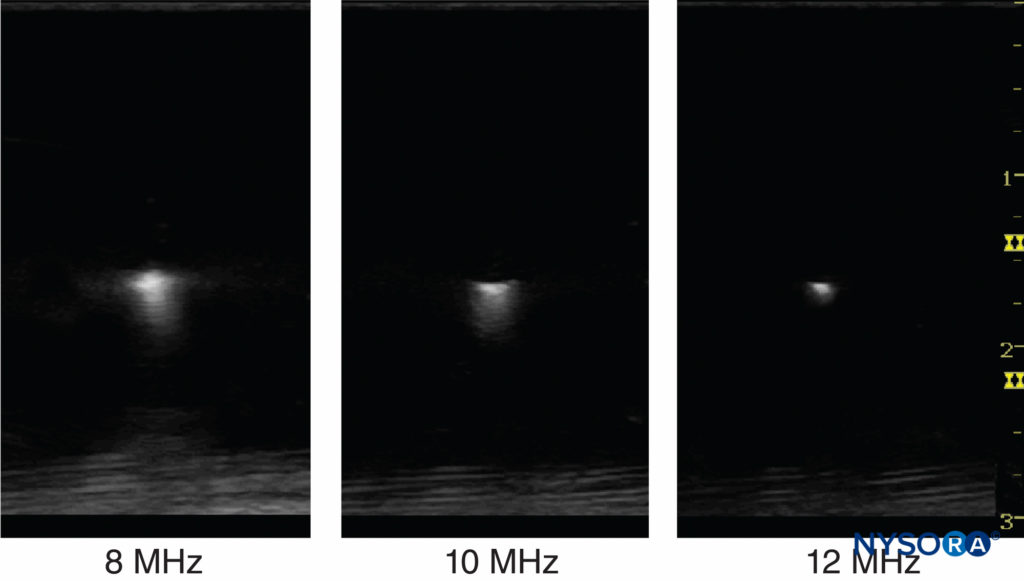
Figure 5. La fréquence des ultrasons affecte la résolution de l'objet imagé. La résolution peut être améliorée en augmentant la fréquence et en réduisant la largeur du faisceau en focalisant. (Reproduit avec la permission de Hadzic A : Hadzic's Peripheral Nerve Blocks and Anatomy for Ultrasound-Guided Regional Anesthesia, 2e éd. New York : McGraw-Hill, Inc ; 2011.)
Résolution latérale est un autre paramètre de netteté pour décrire la distance côte à côte minimale entre deux objets. Elle est déterminée à la fois par la fréquence des ultrasons et la largeur du faisceau. Les fréquences plus élevées ont une focalisation plus étroite et offrent une meilleure résolution axiale et latérale. La résolution latérale peut également être améliorée en ajustant la mise au point pour réduire la largeur du faisceau.
Résolution temporelle est également important pour observer un objet en mouvement tel que les vaisseaux sanguins et le cœur. Comme un film ou une vidéo de dessin animé, l'œil humain exige que l'image soit mise à jour à une fréquence d'environ 25 fois par seconde ou plus pour qu'une image ultrasonore apparaisse continue. Cependant, la résolution de l'image sera compromise par l'augmentation de la fréquence d'images. L'optimisation du rapport entre la résolution et la fréquence d'images est essentielle pour fournir la meilleure image possible.
INTERACTIONS DES ULTRASONS AVEC LES TISSUS
Lorsque l'onde ultrasonore se déplace à travers les tissus, elle est sujette à un certain nombre d'interactions. Les caractéristiques les plus importantes sont les suivantes :
- Réflexion
- Dispersion
- Absorption
Lorsque les ultrasons rencontrent des frontières entre différents milieux, une partie des ultrasons est réfléchie et l'autre partie est transmise. Les directions réfléchie et transmise sont données par l'angle de réflexion θr et l'angle de transmission θt, respectivement (Figure 6).
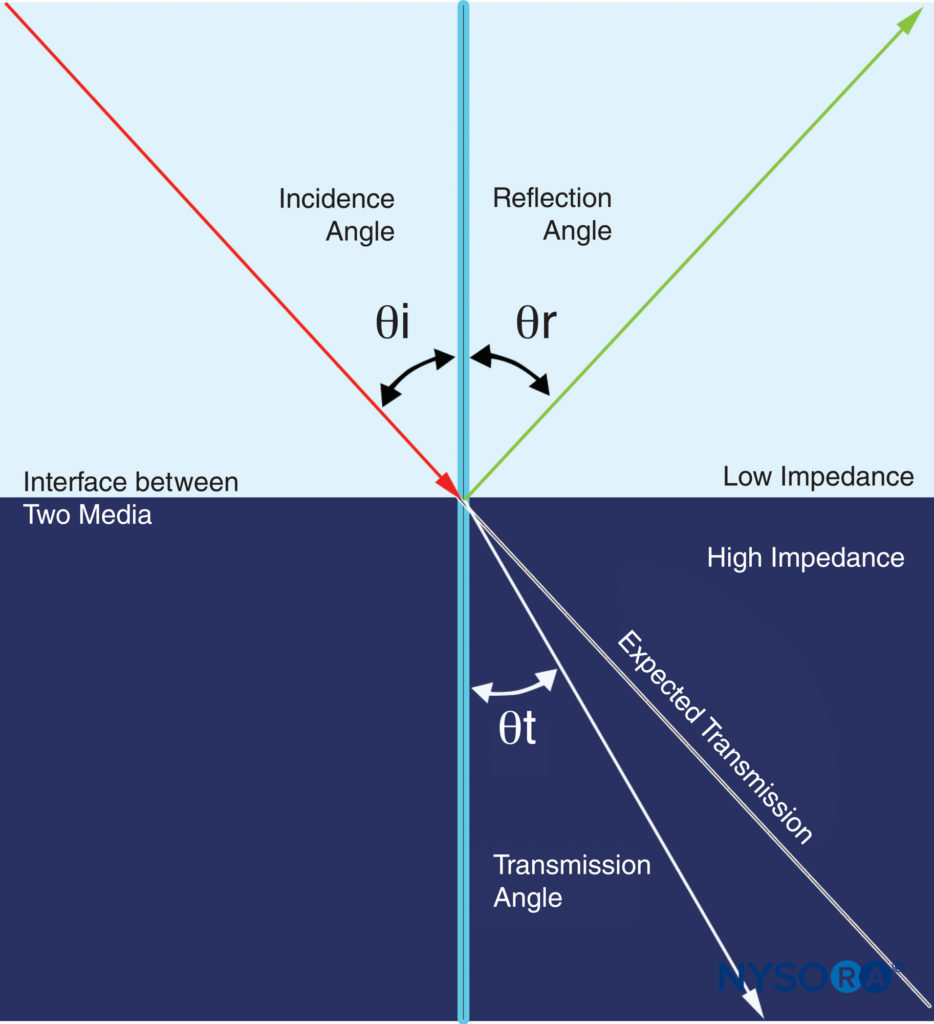
Figure 6. L'interaction des ondes ultrasonores à travers les milieux dans lesquels elles voyagent est complexe. Lorsque les ultrasons rencontrent des limites entre différents milieux, une partie des ultrasons est réfléchie et une partie est transmise. Les directions réfléchie et transmise dépendent des angles respectifs de réflexion et de transmission. (Adapté avec la permission de Hadzic A : Hadzic's Peripheral Nerve Blocks and Anatomy for Ultrasound-Guided Regional Anesthesia, 2e éd. New York : McGraw-Hill, Inc ; 2011.)
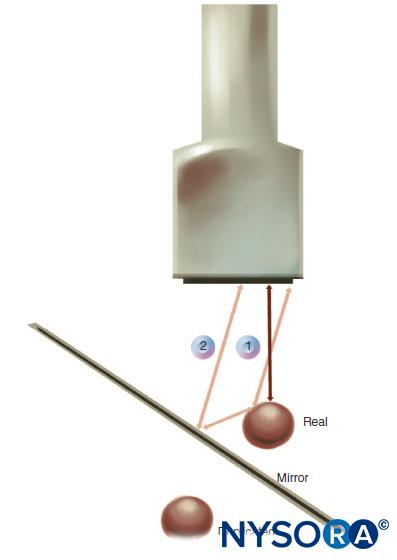
Réfection des ondes sonores est similaire à la réflexion optique. Une partie de son énergie est renvoyée dans le milieu dont elle est issue. Dans une vraie réflexion, l'angle de réflexion θr doit être égal à l'angle d'incidence θi. L'intensité de la réflexion d'une interface est variable et dépend de la différence d'impédances entre deux milieux affinifs et de l'angle d'incidence à la frontière. Si les impédances des médias sont égales, il n'y a pas de réflexion (pas d'écho). S'il y a une différence significative entre les impédances des médias, il y aura une réflexion presque complète. Par exemple, une interface entre les tissus mous et les poumons ou les os implique un changement considérable de l'impédance acoustique et crée de forts échos. Cette intensité de réflexion dépend également fortement de l'angle. Concrètement, cela signifie que le transducteur à ultrasons doit être placé perpendiculairement au nerf cible pour le visualiser clairement. Un changement de direction du son lors du franchissement de la frontière entre deux médias est appelé réfraction. Si la vitesse de propagation à travers le deuxième milieu est plus lente que celle à travers le premier milieu, l'angle de réfraction est plus petit que l'angle d'incidence. La réfraction peut provoquer l'artefact qui se produit sous les gros vaisseaux sur l'image.
Pendant l'échographie, un milieu de couplage doit être utilisé entre le transducteur et la peau pour chasser l'air de l'interface transducteur-peau. Une variété de gels et d'huiles sont appliqués à cette fin. De plus, ils peuvent agir comme lubrifiants, permettant une performance de balayage fluide. La plupart des interfaces numérisées sont quelque peu irrégulières et courbes. Si les dimensions limites sont nettement inférieures à la longueur d'onde ou non lisses, les ondes réfléchies seront diffusées.
Diffusion est la redirection du son dans toutes les directions par des surfaces rugueuses ou par des milieux hétérogènes (Figure 7).
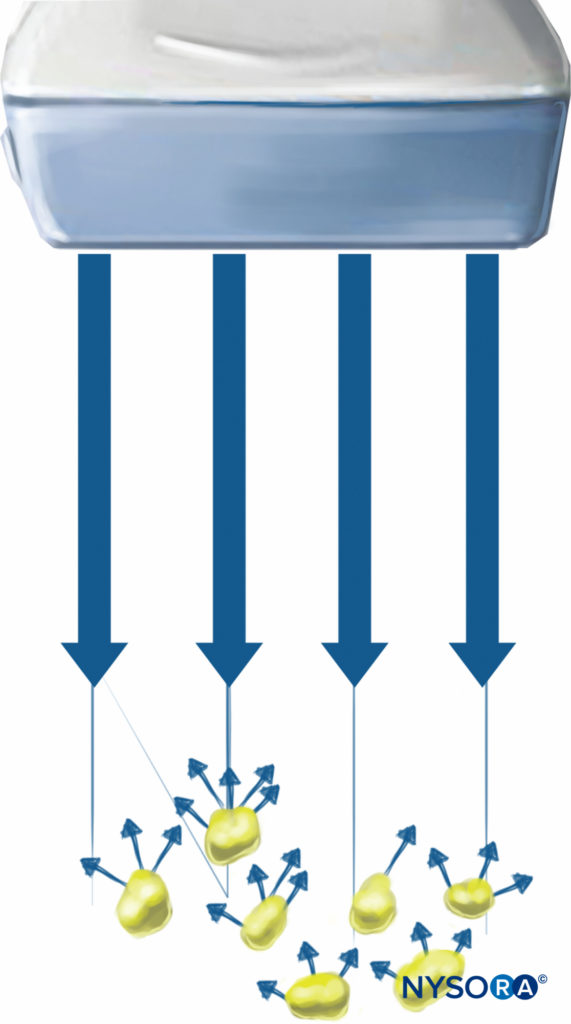
Figure 7. La diffusion est la redirection des ultrasons dans n'importe quelle direction causée par des surfaces rugueuses ou par des milieux hétérogènes. (Adapté avec la permission de Hadzic A : Hadzic's Peripheral Nerve Blocks and Anatomy for Ultrasound-Guided Regional Anesthesia, 2e éd. New York : McGraw-Hill, Inc ; 2011.)
Normalement, l'intensité de diffusion est bien inférieure aux intensités de réflexion de type miroir et est relativement indépendante de la direction de l'onde sonore incidente; par conséquent, la visualisation du nerf cible n'est pas significativement influencée par une autre diffusion à proximité.
Absorption est défini comme la conversion directe de l'énergie sonore en chaleur. En d'autres termes, l'échographie génère de la chaleur dans les tissus. Les hautes fréquences sont absorbées plus rapidement que les basses fréquences. Cependant, une fréquence de balayage plus élevée donne une meilleure résolution axiale. Si la pénétration des ultrasons n'est pas suffisante pour visualiser les structures d'intérêt, une fréquence inférieure est sélectionnée pour augmenter la pénétration. L'utilisation de longueurs d'onde plus longues (fréquence plus basse) entraîne une résolution plus faible car la résolution de l'imagerie ultrasonore est proportionnelle à la longueur d'onde de l'onde d'imagerie. Les fréquences entre 6 et 12 MHz donnent généralement une résolution adéquate pour l'imagerie dans le bloc nerveux périphérique, tandis que les fréquences entre 2 et 5 MHz sont généralement nécessaires pour l'imagerie des structures neuraxiales. Les fréquences inférieures à 2 MHz ou supérieures à 15 MHz sont rarement utilisées en raison d'une résolution insuffisante ou d'une profondeur de pénétration insuffisante dans la plupart des applications cliniques.
MODES D'IMAGE ULTRASONS
Mode A
Le mode A est le plus ancien technique d'échographie et a été inventé en 1930. Le transducteur envoie une seule impulsion d'ultrasons dans le milieu. Par conséquent, une image échographique unidimensionnelle la plus simple est créée sur laquelle une série de pics verticaux est générée après que les faisceaux ultrasonores rencontrent la limite des différents tissus. La distance entre les pointes faisant écho (Figure 8) peut être calculé en divisant la vitesse des ultrasons dans le tissu (1540 m/s) par la moitié du temps écoulé, mais il fournit peu d'informations sur la relation spatiale des structures imagées. Par conséquent, l'échographie en mode A n'est pas applicable à l'anesthésie régionale.
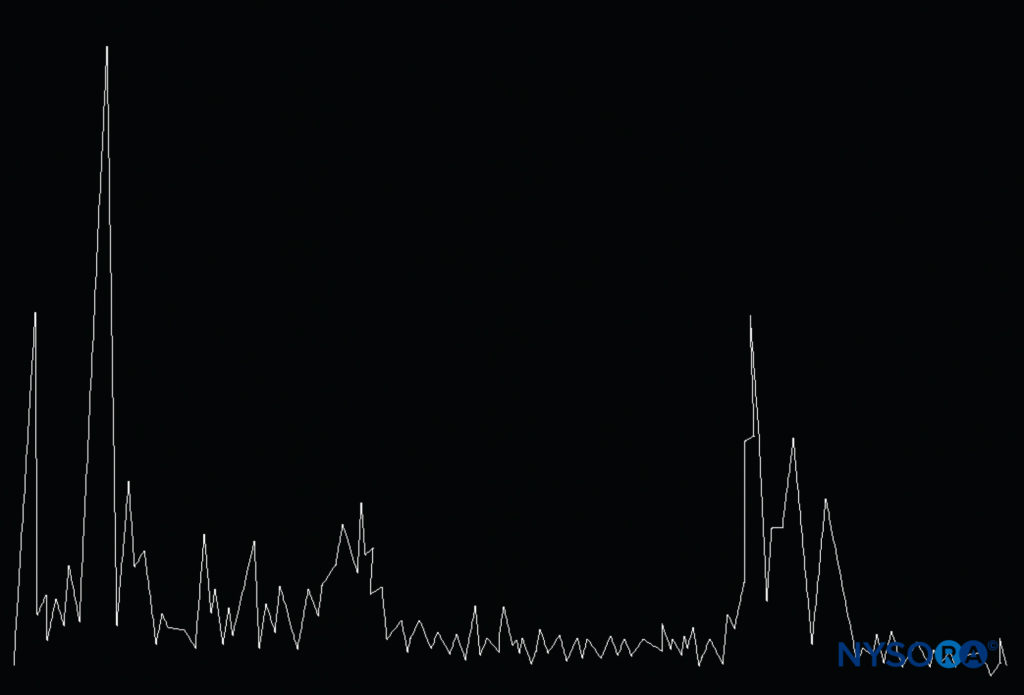
Figure 8. Le mode A des ultrasons consiste en une image ultrasonore unidimensionnelle affichée sous la forme d'une série de pics verticaux correspondant à la profondeur des structures rencontrées par les ultrasons dans différents tissus. (Reproduit avec la permission de Hadzic A : Hadzic's Peripheral Nerve Blocks and Anatomy for Ultrasound-Guided Regional Anesthesia, 2e éd. New York : McGrawHill, Inc ; 2011.)
Mode B
Le mode B est une image bidimensionnelle (2D) de la zone qui est balayée simultanément par un réseau linéaire de 100 à 300 éléments piézoélectriques plutôt qu'un seul comme en mode A (Figure 9). L'amplitude de l'écho d'une série de balayages A est convertie en points de luminosité différente dans l'imagerie en mode B. Les directions horizontale et verticale représentent les distances réelles dans les tissus, tandis que l'intensité de l'échelle de gris indique la force de l'écho (Figure 10). Le mode B peut fournir une image d'une coupe transversale à travers la zone d'intérêt, et c'est le mode principal actuellement utilisé en anesthésie régionale.
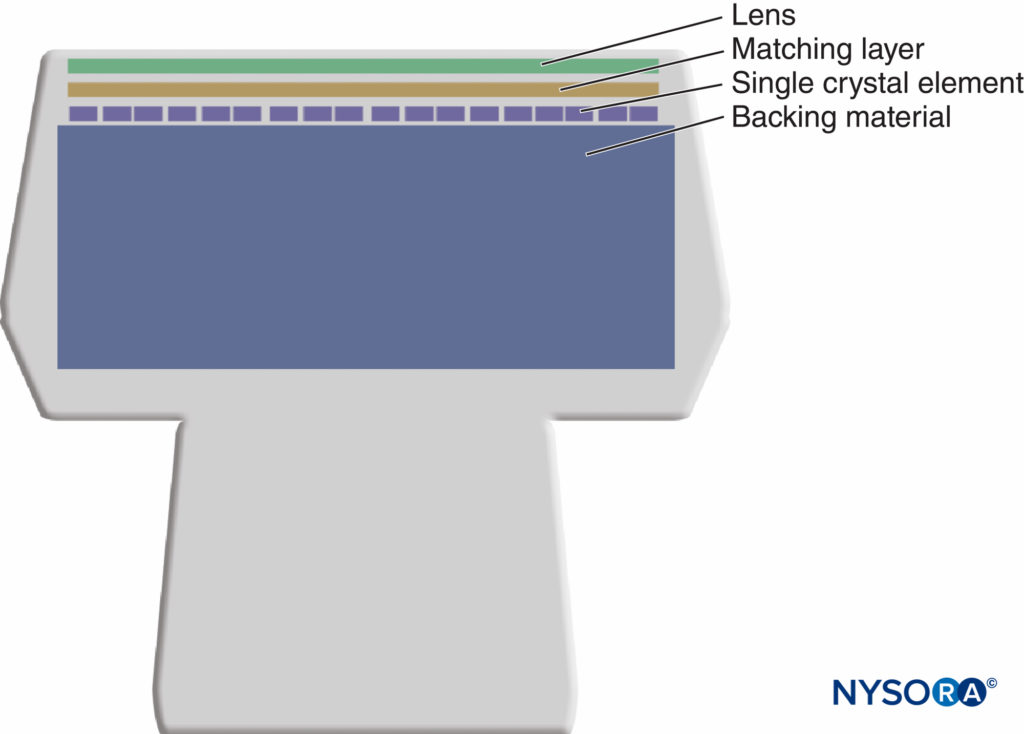
Figure 9. Le transducteur en mode B intègre des éléments piézoélectriques numériques connectés électriquement en parallèle.
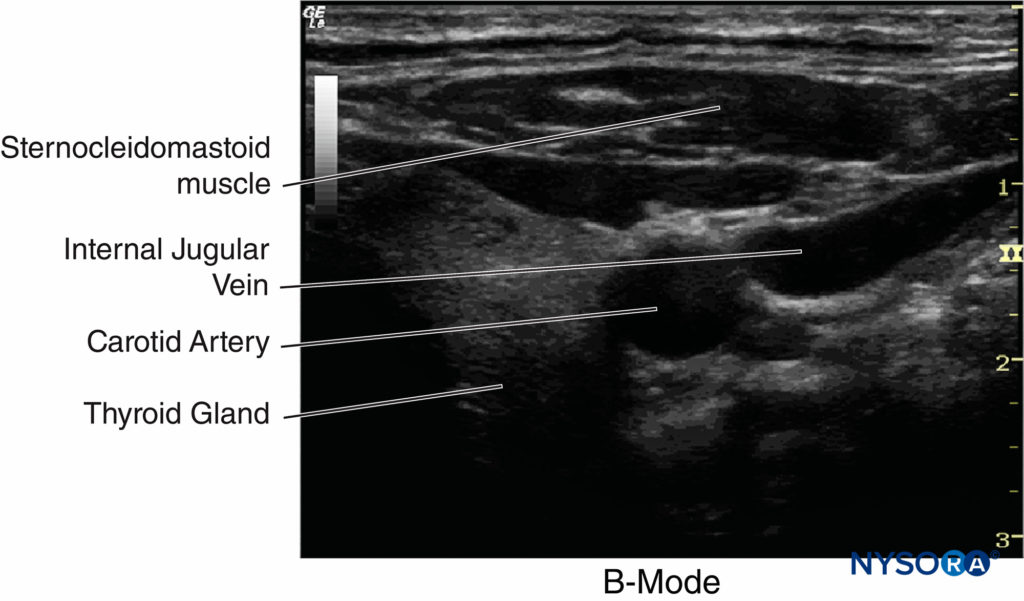
Figure 10. Un exemple d'imagerie en mode B. Les directions horizontale et verticale représentent les distances et les tissus, tandis que l'intensité de l'échelle de gris indique la force de l'écho. (Adapté avec la permission de Hadzic A : Hadzic's Peripheral Nerve Blocks and Anatomy for Ultrasound-Guided Regional Anesthesia, 2e éd. New York : McGraw-Hill, Inc ; 2011.)
Mode Doppler
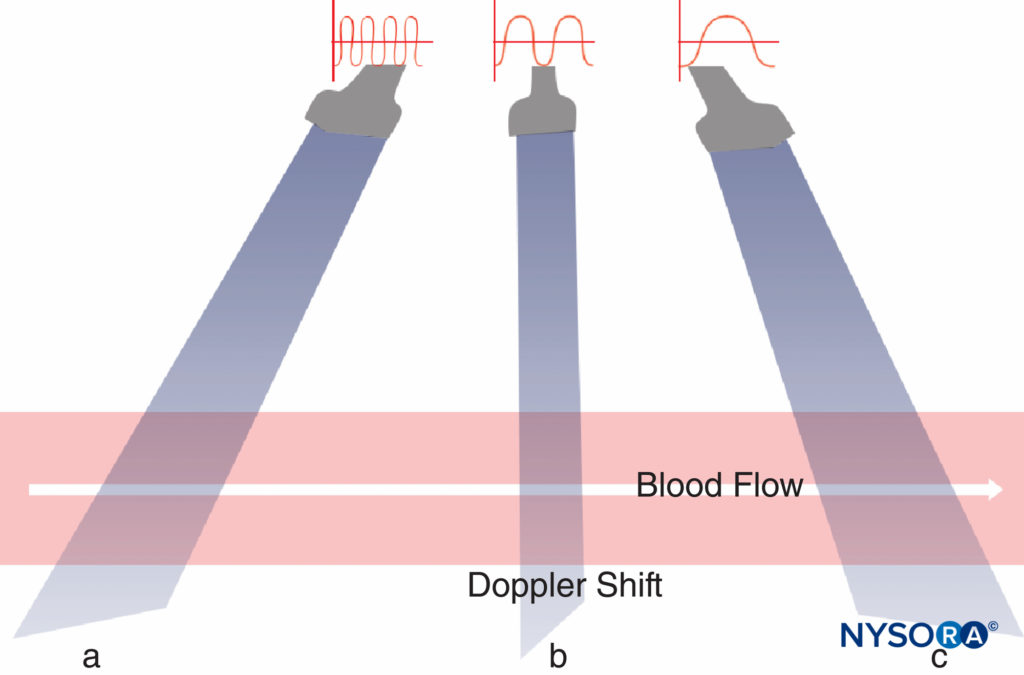
L'effet Doppler est basé sur les travaux du physicien autrichien Johann Christian Doppler. Le terme décrit un changement de fréquence ou de longueur d'onde d'une onde sonore résultant d'un mouvement relatif entre la source sonore et le récepteur sonore. En d'autres termes, à une position stationnaire, la fréquence sonore est constante. Si la source sonore se déplace vers le récepteur sonore, les ondes sonores doivent être comprimées et un son plus aigu se produit (décalage Doppler positif); si la source sonore s'éloigne du récepteur, les ondes sonores doivent être étirées et le son reçu a une hauteur plus faible (décalage Doppler négatif) (Figure 11). L'amplitude du décalage Doppler dépend de l'angle d'incidence entre les directions du faisceau ultrasonore émis et les réflecteurs mobiles. Avec un angle de 90°, il n'y a pas de décalage Doppler. Si l'angle est de 0° ou 180°, le plus grand décalage Doppler peut être détecté. Dans les milieux médicaux, les décalages Doppler se situent généralement dans la plage audible.

Figure 11. L'effet Doppler. Lorsqu'une source sonore s'éloigne du récepteur, le son reçu a un ton plus bas et vice versa. (Adapté avec la permission de Hadzic A : Hadzic's Peripheral Nerve Blocks and Anatomy for Ultrasound-Guided Regional Anesthesia, 2e éd. New York : McGraw-Hill, Inc ; 2011.)
Le Doppler couleur produit une carte codée par couleur des décalages Doppler superposés sur une image échographique en mode B. La direction du flux sanguin dépend du fait que le mouvement se rapproche ou s'éloigne du transducteur. Sélectionnées par convention, les couleurs rouge et bleue fournissent des informations sur la direction et la vitesse du flux sanguin. Selon la carte des couleurs (barre de couleurs) dans le coin supérieur gauche de la figure (Figure 12), la couleur rouge en haut de la barre indique le flux venant vers la sonde à ultrasons, et la couleur bleue en bas de la barre indique le flux s'éloignant de la sonde.
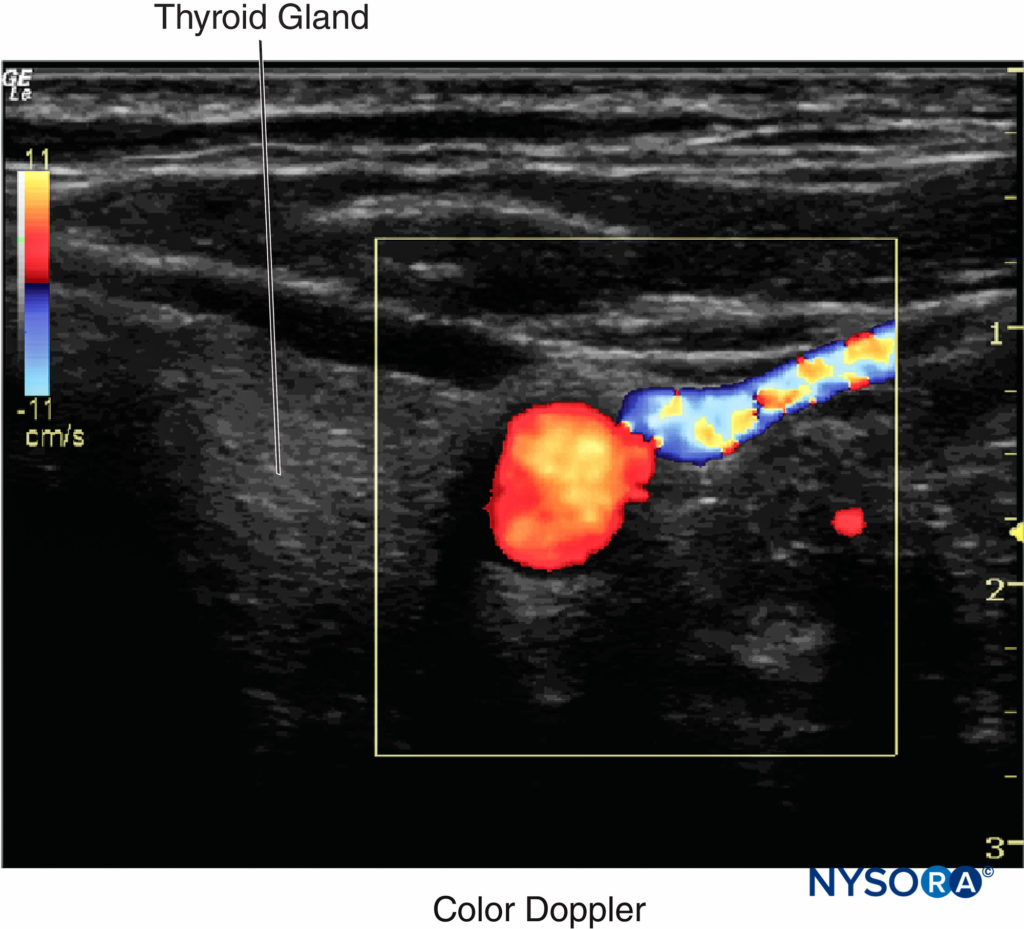
Figure 12 Le Doppler couleur produit une carte codée par couleur des formes Doppler superposées sur une image échographique en mode B. Sélectionnées par convention, les couleurs rouge et bleue fournissent des informations sur la direction et la vitesse du flux sanguin. (Adapté avec la permission de Hadzic A : Hadzic's Peripheral Nerve Blocks and Anatomy for Ultrasound-Guided Regional Anesthesia, 2e éd. New York : McGraw-Hill, Inc ; 2011.)
Dans les blocs nerveux périphériques guidés par échographie, le mode Doppler couleur est utilisé pour détecter la présence et la nature des vaisseaux sanguins (artère vs veine) dans la zone d'intérêt. Lorsque la direction du faisceau ultrasonore change, la couleur du flux artériel passe du bleu au rouge, ou inversement, selon la convention utilisée (Figures 13, 14A, 14B et 14C). Le Doppler puissance est jusqu'à cinq fois plus sensible à la détection du flux sanguin que le Doppler couleur, et il dépend moins de l'angle de balayage. Ainsi, le Doppler puissance peut être utilisé pour identifier les plus petits vaisseaux sanguins de manière plus fiable. L'inconvénient est que le Doppler puissance ne fournit aucune information sur la direction et la vitesse du flux sanguin (Figure 15).
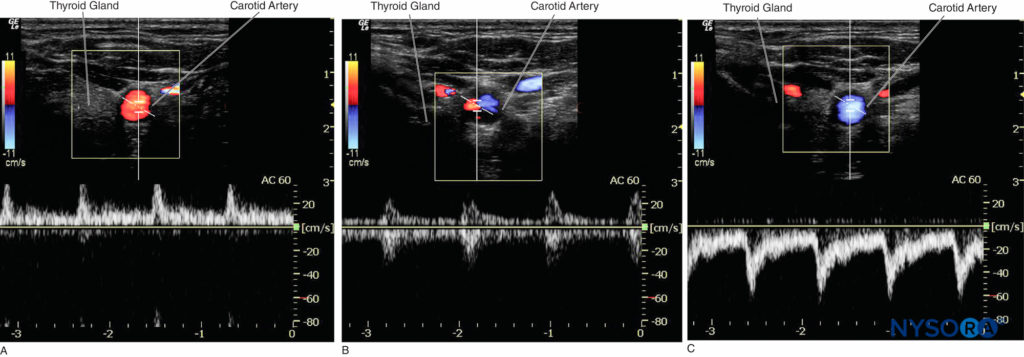
Figure 14. A : L'artère carotide affiche une couleur rouge lorsque le sang s'écoule vers le transducteur. B : L'artère carotide affiche une couleur ambiguë à un angle Doppler de 90 ° ; la forme d'onde égale peut être vue des deux côtés de la ligne de base. C : L'artère carotide affiche une couleur bleue lorsque le sang s'écoule du transducteur.
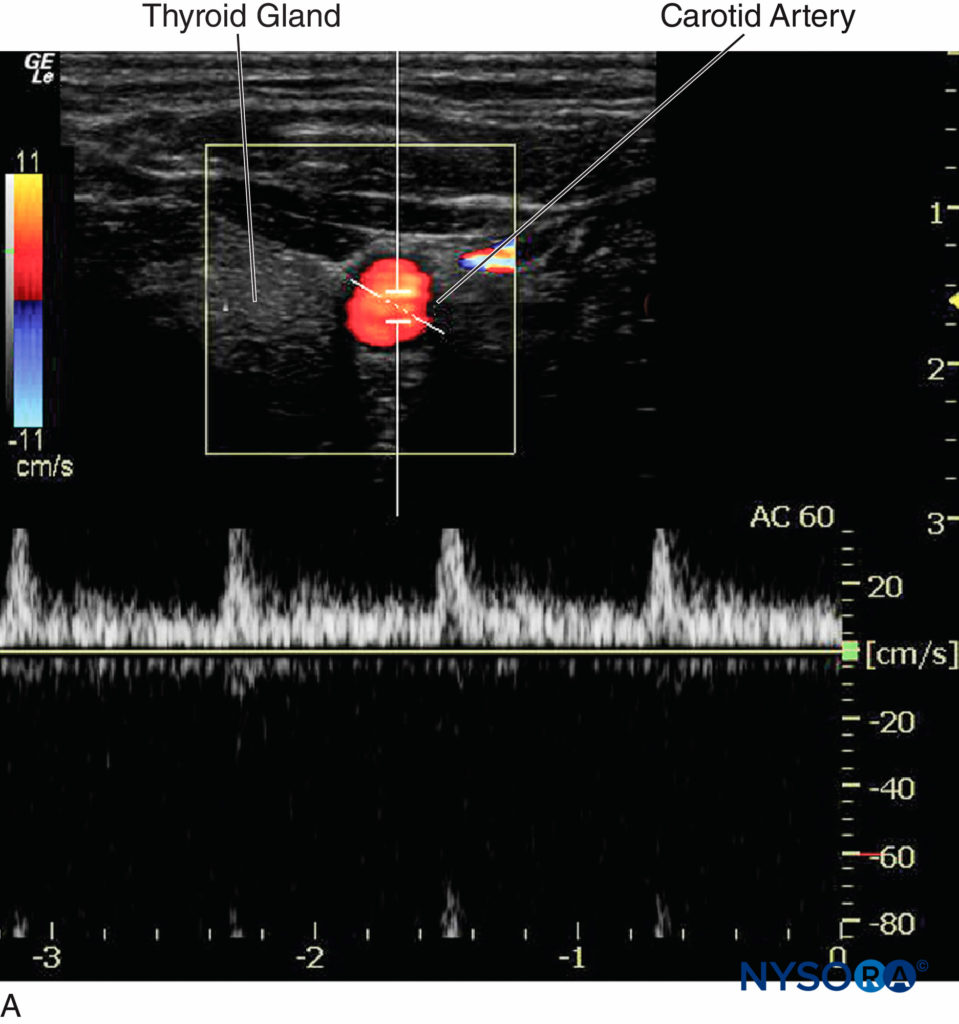
Figure 15. Bien que le Doppler puissance puisse être utile pour identifier les petits vaisseaux sanguins, l'inconvénient est qu'il ne fournit pas d'informations sur la direction et la vitesse du flux sanguin. (Adapté avec la permission de Hadzic A : Hadzic's Peripheral Nerve Blocks and Anatomy for Ultrasound-Guided Regional Anesthesia, 2e éd. New York : McGraw-Hill, Inc ; 2011.)
M-Mode
Un faisceau unique dans un balayage ultrasonore peut être utilisé pour produire une image avec un signal de mouvement, où le mouvement d'une structure telle qu'une valvule cardiaque peut être représenté d'une manière ondulatoire. Le mode M est largement utilisé dans l'imagerie cardiaque et cardiaque fœtale ; cependant, son utilisation actuelle en anesthésie régionale est négligeable (Figure 16).
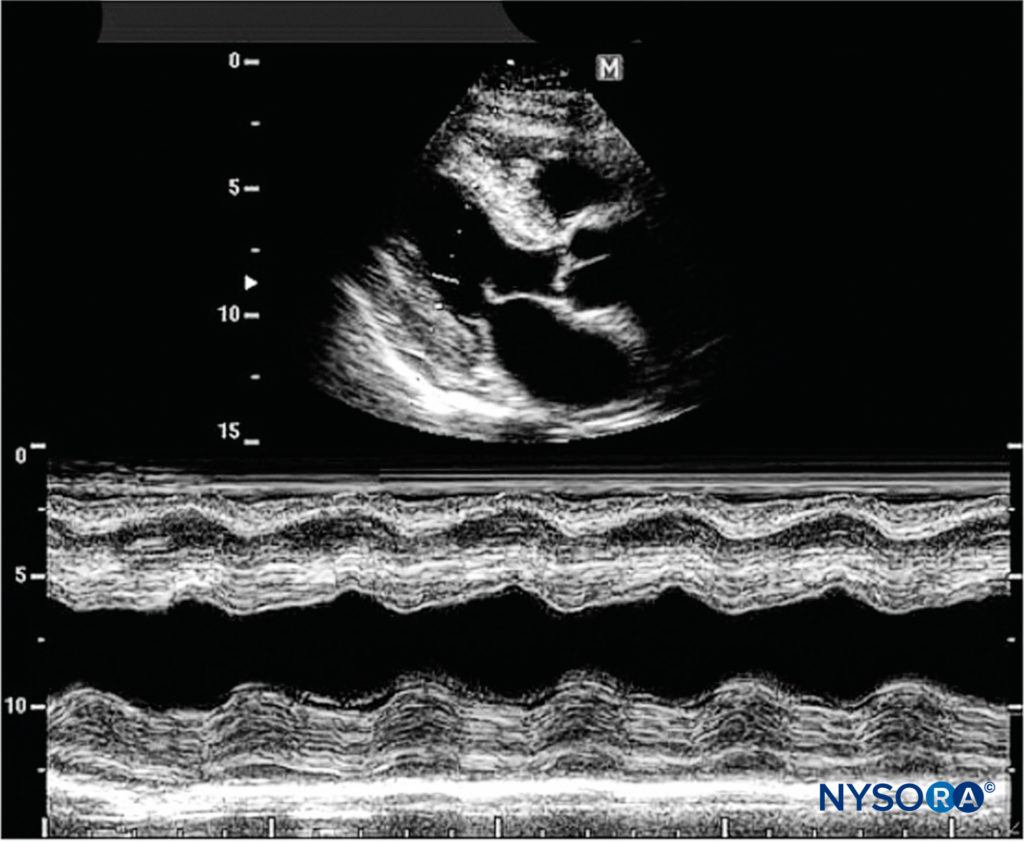
Figure 16. Le mode M consiste en un seul faisceau utilisé pour produire une image avec un signal de mouvement. Le mouvement d'une structure peut être représenté dans une matière ondulatoire. (Reproduit avec la permission de Hadzic A : Hadzic's Peripheral Nerve Blocks and Anatomy for Ultrasound-Guided Regional Anesthesia, 2e éd. New York : McGraw-Hill, Inc ; 2011.)
INSTRUMENTS À ULTRASONS
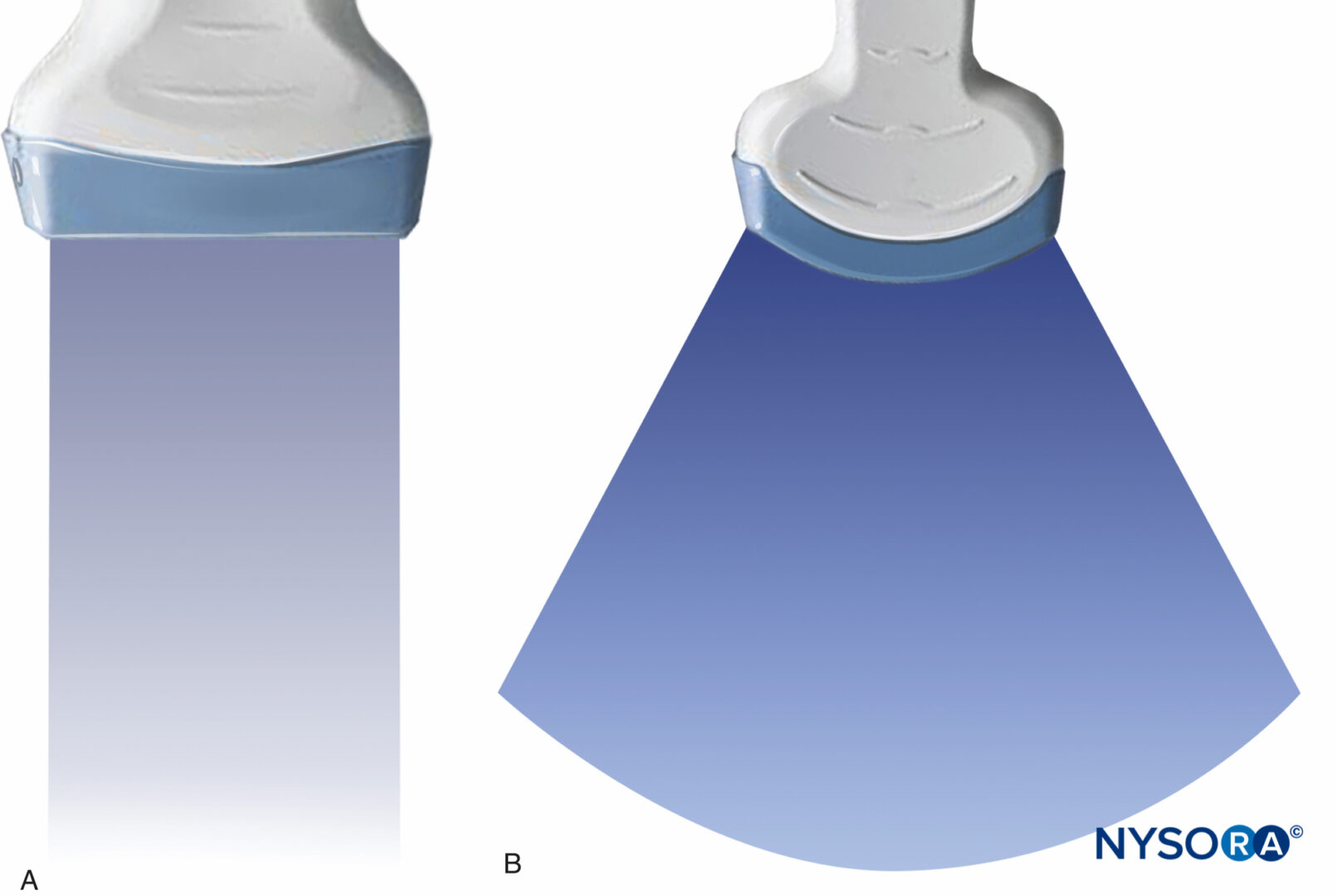
Les appareils à ultrasons convertissent les échos reçus par le transducteur en points visibles, qui forment l'image anatomique sur un écran à ultrasons. La luminosité de chaque point correspond à la force de l'écho, produisant ce que l'on appelle une image en niveaux de gris. Deux types de transducteurs de balayage sont utilisés en anesthésie régionale : linéaire et courbe. Un transducteur linéaire peut produire des lignes de balayage parallèles et un affichage rectangulaire, appelé balayage linéaire, tandis qu'un transducteur incurvé produit un balayage curviligne et une image en forme d'arc (Figures 17A et 17B). En balayage clinique, même une très fine couche d'air entre le transducteur et la peau peut refléter la quasi-totalité des ultrasons, empêchant toute pénétration dans les tissus. Par conséquent, un milieu de couplage, généralement un gel aqueux, est appliqué entre les surfaces du transducteur et la peau pour éliminer la couche d'air.
Les appareils à ultrasons actuellement utilisés en anesthésie régionale fournissent une image 2D, ou « coupe ». Des machines capables de produire des images en trois dimensions (3D) ont récemment été développées. Théoriquement, l'imagerie 3D devrait aider à comprendre la relation entre les structures anatomiques et la propagation des anesthésiques locaux. Il existe trois principaux types d'imagerie échographique 3D : (1) La 3D à main levée est basée sur un ensemble d'images échographiques en coupe transversale 2D acquises à partir d'un échographiste balayant le transducteur sur une région d'intérêt (Figures 18A et 18B). (2) Volume 3D fournit des images volumétriques 3D à l'aide d'un transducteur 3D dédié. Les éléments transducteurs balayent automatiquement la région d'intérêt pendant le balayage ; l'échographiste n'est pas tenu d'effectuer des mouvements de la main (Figure 18C). (3) La 3D en temps réel prend plusieurs images sous différents angles, permettant à l'échographiste de voir le modèle 3D se déplacer en temps réel. Cependant, la résolution spatiale typique de l'imagerie 3D est d'environ 0.34 à 0.5 mm. À l'heure actuelle, les systèmes d'imagerie 3D manquent encore de la résolution et de la simplicité des images 2D, de sorte que leur utilisation pratique en anesthésie régionale est limitée.
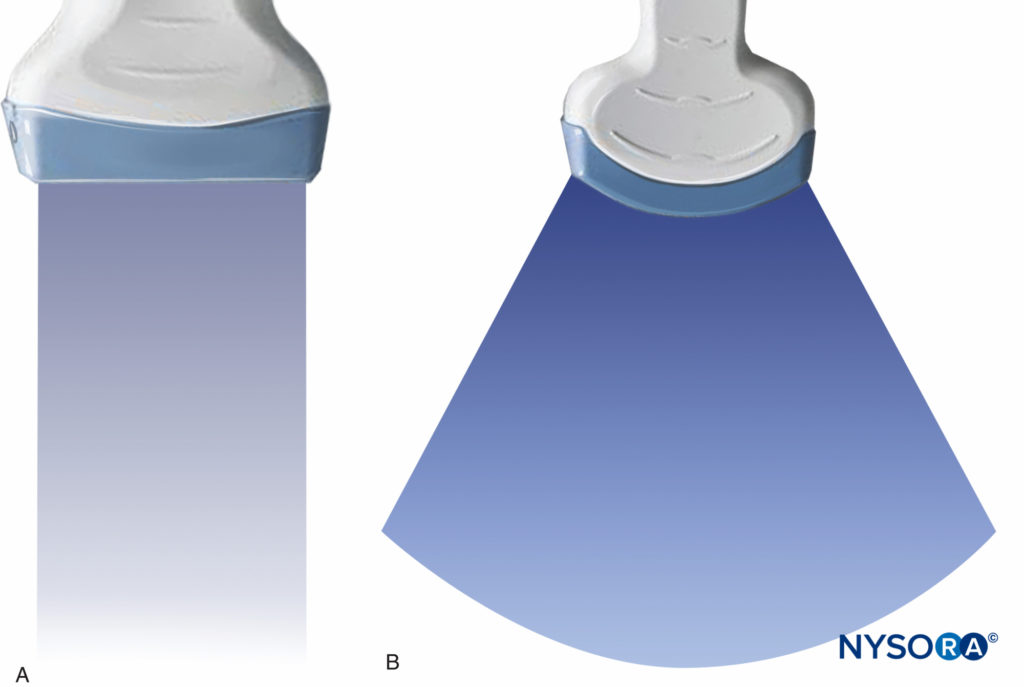
Figure 17. A : Champ de balayage rectangulaire donné par un transducteur linéaire. B : Champ de balayage en forme d'arc donné par un transducteur incurvé. (Adapté avec la permission de Hadzic A : Hadzic's Peripheral Nerve Blocks and Anatomy for Ultrasound-Guided Regional Anesthesia, 2e éd. New York : McGraw-Hill, Inc ; 2011.)
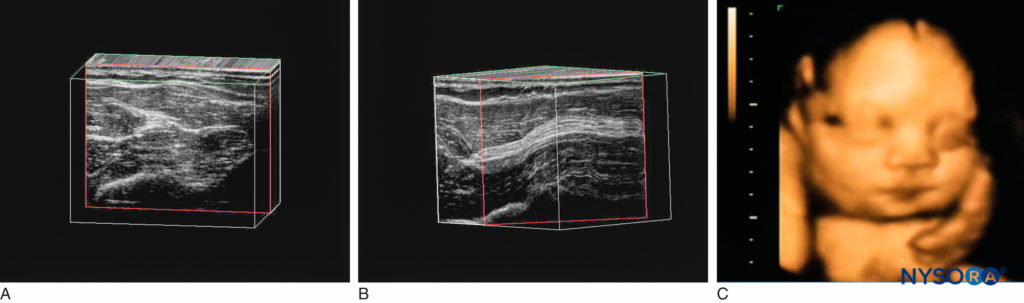
Figure 18. A : Imagerie 3D à main levée. Un transducteur linéaire produit des lignes de balayage parallèles et un affichage rectangulaire ; balayage linéaire. B : Imagerie 3D à main levée. Un transducteur incurvé à « réseau de phase » produit un balayage curviligne et une image en forme d'arche. C : Visage fœtal vu en imagerie 3D volumique. (Reproduit avec la permission de Hadzic A : Hadzic's Peripheral Nerve Blocks and Anatomy for Ultrasound-Guided Regional Anesthesia, 2e éd. New York : McGraw-Hill, Inc ; 2011.)
RÉMUNÉRATION DE GAIN DE TEMPS
Les échos présentent une diminution constante de l'amplitude avec l'augmentation de la profondeur. Cela se produit pour deux raisons : premièrement, chaque réflexion successive supprime une certaine quantité d'énergie de l'impulsion, diminuant la génération d'échos ultérieurs. Deuxièmement, les tissus absorbent les ultrasons, il y a donc une perte constante d'énergie lorsque l'impulsion ultrasonore se propage à travers les tissus. Cela peut être corrigé en manipulant les fonctions de compensation de gain de temps (TGC) et de compression. Gain est le rapport de la puissance électrique de sortie à celle d'entrée ; il contrôle la luminosité de l'image. Le gain est généralement mesuré en décibels (dB). L'augmentation du gain amplifie non seulement les signaux de retour, mais également le bruit de fond dans le système de la même manière. TGC est une amplification dépendante du temps. La fonction TGC peut être utilisée pour augmenter l'amplitude des signaux entrants provenant de différentes profondeurs de tissus.
La disposition des commandes TGC varie d'une machine à l'autre. Une conception populaire est un ensemble de boutons coulissants. Chaque bouton du jeu de curseurs contrôle le gain pour une profondeur spécifique, ce qui permet une échelle de gain bien équilibrée sur l'image (Figures 19A, 19B et 19C).
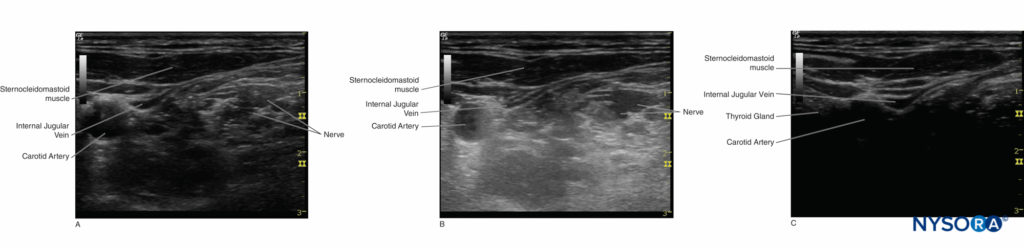
Figure 19: A, B et C : L'effet des paramètres de compensation de gain de temps. La compensation de gain temporel est une fonction qui permet une amplification dépendante du temps (profondeur) des signaux revenant de différentes profondeurs. (Adapté avec la permission de Hadzic A : Hadzic's Peripheral Nerve Blocks and Anatomy for Ultrasound-Guided Regional Anesthesia, 2e éd. New York : McGraw-Hill, Inc ; 2011.)
Amplification est la conversion des petites tensions reçues du transducteur en plus grandes qui conviennent pour un traitement et un stockage ultérieurs. Il existe deux processus d'amplification considérés pour augmenter l'amplitude des échos ultrasonores : l'amplification linéaire et non linéaire. Actuellement, le système d'imagerie par ultrasons avec amplificateurs linéaires est couramment utilisé dans les applications de diagnostic médical. Cependant, la force des échos s'atténue de manière exponentielle à mesure que la distance entre le transducteur et le réflecteur augmente. Les instruments d'imagerie à ultrasons équipés d'amplificateurs logarithmiques peuvent afficher des signaux d'écho avec une plage dynamique plus large qu'un amplificateur linéaire et améliorer remarquablement la sensibilité pour une petite amplitude d'échos sur l'écran.
Dynamique est la plage d'amplitudes du plus grand au plus petit des signaux d'écho qu'un système à ultrasons peut détecter. La plage dynamique plus large/élevée présente un plus grand nombre de niveaux de gris et crée une image plus douce ; l'image avec une plage dynamique plus étroite/inférieure apparaît avec plus de contraste (Figures 20A et 20B). Une plage dynamique inférieure à 50 dB ou supérieure à 100 dB est probablement trop faible ou trop élevée en termes de visualisation du nerf périphérique. La compression est le processus de diminution des différences entre les amplitudes d'écho-tension les plus petites et les plus grandes; la compression optimale est comprise entre 2 et 4 pour une échelle maximale égale à 6.
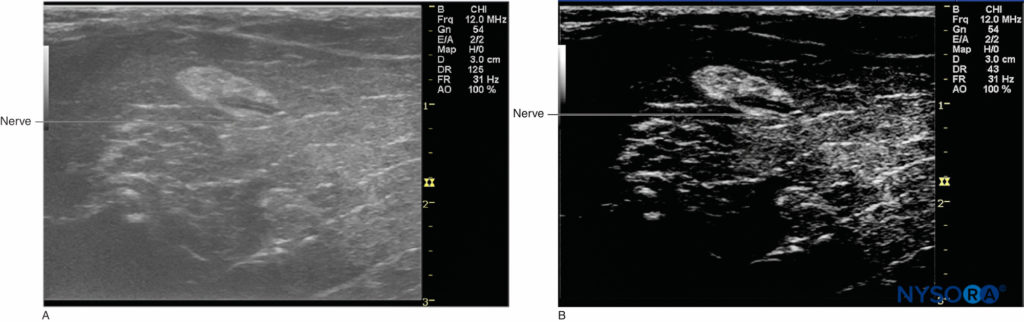
Figure 20.:A: Une image plus douce fournie par une plage dynamique plus élevée. B : Une image avec plus de contraste grâce à une plage dynamique plus faible.
FOCUS
Comme indiqué précédemment, il est courant d'utiliser des moyens électroniques pour rétrécir la largeur du faisceau à une certaine profondeur et obtenir un effet de focalisation similaire à celui obtenu à l'aide d'une lentille convexe (Figure 21). Il existe deux types de focalisation : annulaire et linéaire. Celles-ci sont illustrées dans Figures 22A et 22B, Respectivement.
Le réglage de la mise au point améliore la résolution spatiale sur le plan d'intérêt car la largeur du faisceau est convergée. Cependant, la réduction de la largeur du faisceau à la profondeur sélectionnée est obtenue au prix d'une dégradation de la largeur du faisceau à d'autres profondeurs, ce qui entraîne des images plus médiocres en dessous de la zone focale.
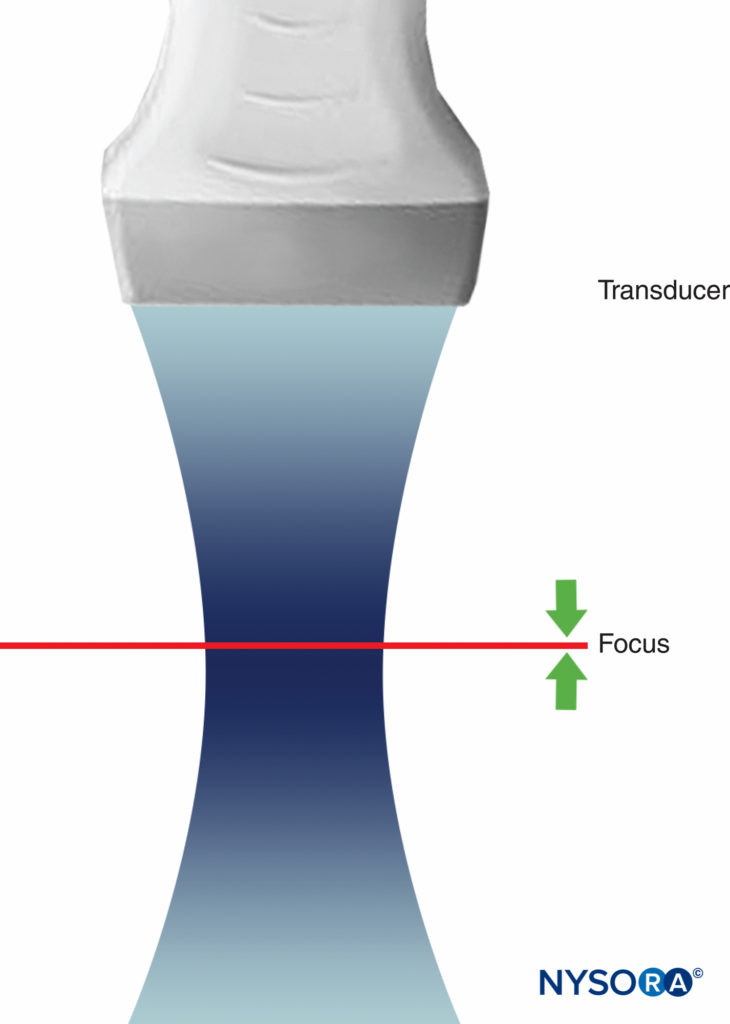
Figure 21: Une démonstration de l'effet de mise au point. Un moyen électronique peut être utilisé pour rétrécir la largeur du faisceau à une profondeur spécifique, ce qui entraîne l'effet de focalisation et une plus grande résolution à une profondeur choisie. (Adapté avec la permission de Hadzic A : Hadzic's Peripheral Nerve Blocks and Anatomy for Ultrasound-Guided Regional Anesthesia, 2e éd. New York : McGraw-Hill, Inc ; 2011.)
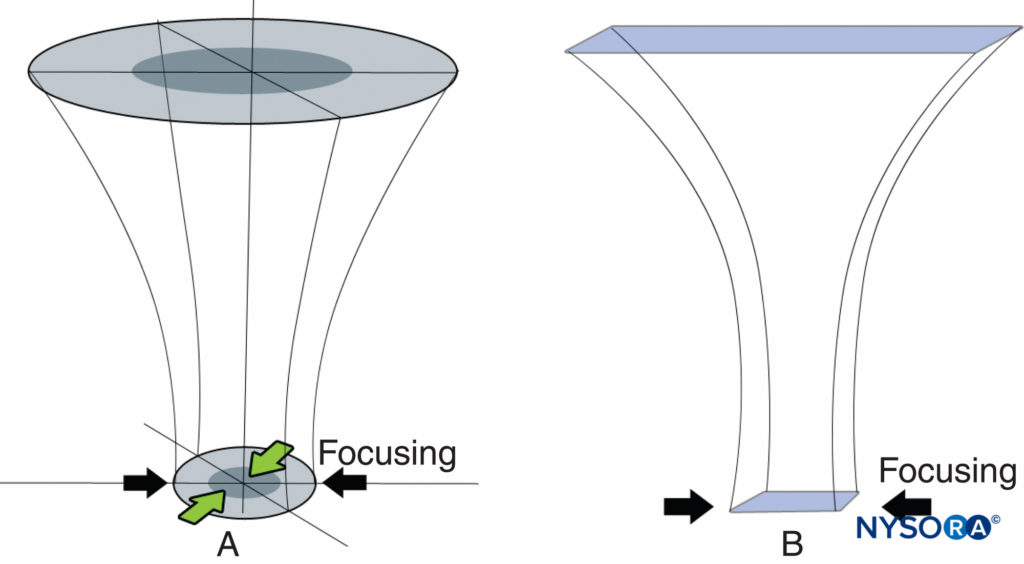
Figure 22: A: La focalisation annulaire est une focalisation électronique de toutes les directions dans le plan de balayage donnée par un transducteur annulaire qui contient plusieurs éléments annulaires disposés concentriquement. B : La mise au point linéaire est une mise au point électronique appliquée le long des deux côtés latéraux du plan de balayage.
BIOEFFET ET SÉCURITÉ
Les mécanismes d'action par lesquels une application d'ultrasons pourrait produire un effet biologique peuvent être conceptuellement classés en deux aspects : chauffage et mécanique. En réalité, ces deux effets sont rarement séparables sauf pour la lithotripsie extracorporelle, l'application thérapeutique des seuls bioeffets mécaniques. La génération de chaleur augmente à mesure que l'intensité ou la fréquence des ultrasons augmente. Pour des conditions d'exposition similaires, l'augmentation de température attendue dans les os est significativement plus élevée que dans les tissus mous. Dans des expériences in vivo, des ultrasons de haute intensité (habituellement > 2 W/cm2) est utilisé pour évaluer l'effet biologique nocif; elle est 5 à 20 fois supérieure aux intensités thérapeutiques (0.08–0.5 W/cm2) et 8 à 100 fois supérieures aux intensités diagnostiques (mode flux couleur 0.25 W/cm2, Balayage en mode B 0.02 W/cm2). Des rapports sur des modèles animaux (souris et rats) suggèrent que l'application d'ultrasons peut entraîner un certain nombre d'effets indésirables, tels qu'une réduction du poids fœtal, une mortalité post-partum, des anomalies fœtales, des lésions tissulaires, une paralysie des membres postérieurs, une stase du flux sanguin et une régression tumorale. D'autres effets indésirables signalés chez la souris sont des anomalies du développement des lymphocytes B, de la réponse ovulatoire et de la tératogénicité.
En général, les tissus adultes sont plus tolérants à l'augmentation de la température que les tissus fœtaux et néonataux. Un échographe moderne affiche deux indices standards : thermique et mécanique. L'indice thermique (TI) est défini comme la puissance de sortie acoustique du transducteur divisée par la puissance estimée nécessaire pour augmenter la température des tissus de 1°C. L'indice mécanique (MI) est égal à la pression de raréfaction maximale divisée par la racine carrée de la fréquence centrale de la largeur de bande des impulsions. TI et MI indiquent la probabilité relative de risque thermique et mécanique in vivo, respectivement. Un TI ou un MI supérieur à 1.0 est dangereux.
L'effet biologique dû aux ultrasons dépend également du temps d'exposition des tissus. Les chercheurs utilisent généralement des souris gravides pour les exposer aux ultrasons avec une intensité minimale de 1 W/cm2 pendant 60 à 420 minutes pour évaluer les événements indésirables dépendant du temps qui se produisent chez les fœtus de rongeurs. Heureusement, le bloc nerveux guidé par échographie ne nécessite l'utilisation que de faibles valeurs de TI et de MI sur le patient pendant une courte période de temps. Sur la base des résultats d'études expérimentales in vitro et in vivo à ce jour, rien ne prouve que l'utilisation de l'échographie diagnostique dans la pratique clinique de routine soit associée à des risques biologiques.
Références
- Curie J, Curie P : Développement par pression de l'électricité polaire dans les cristaux hémièdres à faces inclinées. CR Acad Sci (Paris) 1880;91:294.
- Langevin P : brevet français n° 505,703 17. Déposé le 1917 septembre 5. Publié le 1920 août XNUMX.
- Thompson J : Guerre sans restriction des sous-marins : La Royal Navy perd presque la guerre. Dans le livre de l'Imperial War Museum sur la guerre en mer 1914–18. Pan Books, 2006, chapitre 10.
- Langévin MP : Lés ondes ultrasonores. Rev Gen Elect 1928;23:626.
- Ensminger D, Bond LJ : Ultrasons : fondamentaux, technologies et applications, 3e éd. Groupe François, 2012.
- Dussik KT : Sur la possibilité d'utiliser les ultrasons comme aide au diagnostic. Neurol Psychiat 1942;174:153–168.
- Dussik KT, Dussik F, Wyt L. Auf dem Wege Zur Hyperphonographie des Gehirnes. Med Wochenschr 1947 ; 97 : 425-429.
- Kossoff G, Robinson DE, Garrett WJ : Techniques de visualisation bidimensionnelle par ultrasons. IEEE Trans Sonics Ultrason 1965;SU12: 31–37
- Thompson HE, Holmes JH, Gottesfeld KR, Taylor ES : Développement fœtal tel que déterminé par les techniques d'écho d'impulsion à ultrasons. Am J Obstet Gynecol 1965;92:44–53.
- Enregistrement de la marque fédérale américaine déposée pour ECHO-DOPPLER par Advanced Technology Laboratories Inc. Appareil à ultrasons pour la médecine diagnostique. Numéro de série de la marque 73085203. 26 avril 1976.
- La Grange PDP, Foster PA, Pretorius LK : Application du détecteur de débit sanguin à ultrasons Doppler dans le bloc supraclaviculaire du plexus brachial. Br J Anesth 1978;50:965–967.
- Ting PL, Sivagnanaratnam V : Etude échographique de la propagation de l'anesthésique local lors d'un bloc axillaire du plexus brachial. Br J Anesth 1978; 63:326–329.
- Kapral S, Krafft P, Eibenberger K, Fitzgerald R, Gosch M, Weinstabl C : approche supraclaviculaire guidée par ultrasons pour l'anesthésie régionale du plexus brachial. Anesth Analg 1994;78:507–513.
- Sokolov SY, inventeur : Moyens pour indiquer les défauts des matériaux. Brevet américain 2164125. 1937.
- White DN : Johann Christian Doppler et son effet - Une brève histoire. Ultrason Med Biol 1982;8(6):583–591.
- O'Brien WD Jr. Effets biologiques chez les animaux de laboratoire. Dans Effets biologiques des ultrasons. Churchill Livingstone, 1985, 77–84.
- Kerry BG, Robertson VJ, Duck FA : Un examen des ultrasons thérapeutiques : effets biophysiques. Phys Ther 2001;81:1351–1358.
- American Institute of Ultrasound in Medicine, National Electrical Manufacturers Association : Standard for Real-Time Display of Thermal and Mechanical Acoustic Output Indices on Diagnostic Ultrasound Equipment, Révision 2. American Institute of Ultrasound in Medicine et National Electrical Manufacturers Association, 2004.
- British Medical Ultrasound Society : Lignes directrices pour l'utilisation sécuritaire de l'équipement d'échographie diagnostique. Échographie 2010 mai 18: 52–59.
- Ang ES Jr, Gluncic V, Duque A, Schafer ME, Rakic P : L'exposition prénatale aux ondes ultrasonores a un impact sur la migration neuronale chez la souris. Proc Natl Acad Sci USA 2006;103(34):12903–12910.