Jeff Gadden
INTRODUCTION
L'incidence des complications de l'anesthésie générale a considérablement diminué au cours des dernières décennies, en grande partie grâce aux progrès de la surveillance de la fonction respiratoire et cardiovasculaire lors de l'administration de l'anesthésie. L'utilisation de moniteurs objectifs tels que l'oxymétrie de pouls, la capnographie, l'électrocardiographie, etc., permet aux praticiens d'identifier en temps opportun les paramètres physiologiques changeants, d'intervenir rapidement et de manière appropriée et d'orienter leurs décisions thérapeutiques.
La pratique de l'anesthésie régionale a traditionnellement souffert d'un manque de moniteurs objectifs qui aident le praticien à surveiller plus objectivement la relation aiguille-nerf et à prévenir les lésions neurologiques. La pratique des blocs nerveux périphériques s'appuyait traditionnellement sur des points finaux subjectifs pour évaluer le risque potentiel pour le patient. Ceci est en train de changer, cependant, avec l'introduction et l'adoption de méthodes standardisées permettant d'effectuer en toute sécurité des blocs nerveux périphériques avec le risque minimal possible pour le patient. Par exemple, au lieu de se fier à la sensation de «clics», de «clics» et de «rayures» pour identifier la position de la pointe de l'aiguille, les praticiens peuvent désormais surveiller l'interaction au niveau des couches aiguille-fascial à l'aide de l'échographie. De même, la quantification de l'intensité minimale du courant et de la résistance à l'injection peut être utilisée pour recueillir des données supplémentaires utiles dans la prise de décision clinique afin de minimiser le risque de placement de l'aiguille dans un plan tissulaire indésirable, par voie intravasculaire ou dans des structures anatomiques vulnérables par voie intraneurale. Les progrès récents en matière de surveillance peuvent donc réduire les trois complications les plus redoutées du bloc nerveux périphérique : lésions nerveuses, toxicité anesthésique locale, et des dommages accidentels aux structures adjacentes ("mésaventure de l'aiguille").
Le suivi objectif et la justification de son utilisation sont abordés dans la première partie de cette section. Cette dernière section se concentre sur la documentation des procédures de bloc nerveux, qui est la conservation logique des informations objectives obtenues par les moniteurs. Une documentation objective et solide de la façon dont un bloc nerveux a été effectué a des implications médico-légales évidentes et fournit une base de données utile pour guider les progrès en matière de sécurité et d'efficacité.
MONITORING
Moyens disponibles pour surveiller les relations aiguille-nerf
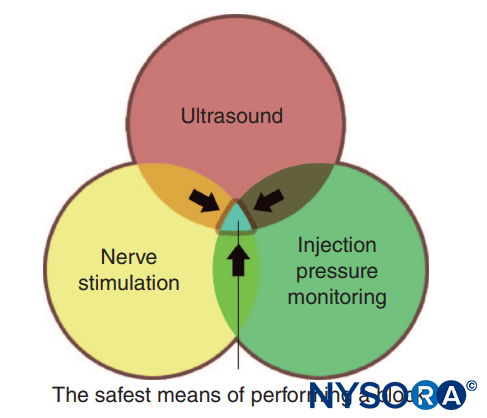
Les moniteurs, tels qu'utilisés dans la pratique médicale, sont des appareils qui évaluent un état physiologique spécifique et avertissent le clinicien d'un dommage imminent. Les moniteurs dont il est question dans ce chapitre comprennent ceux destinés à la stimulation nerveuse, à l'échographie et à la surveillance de la pression d'injection. Chacun d'eux a son propre ensemble distinct d'avantages et de limites et chacun est mieux utilisé de manière additive et complémentaire (Figure 1) afin de minimiser le risque de blessure pour le patient, plutôt que de se fier uniquement aux informations fournies par un seul moniteur. Il existe suffisamment d'informations factuelles indiquant que la combinaison des trois moniteurs est susceptible de produire le processus le plus sûr possible lors de la pratique des blocs nerveux périphériques.
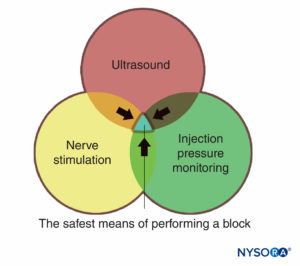
FIGURE 1. Trois modes de surveillance des blocs nerveux périphériques pour les blessures du patient. La zone de chevauchement des trois (zone bleue) représente le moyen le plus sûr d'effectuer un blocage.
Un autre moniteur pharmacologique que de nombreux cliniciens utilisent régulièrement est l'utilisation d'épinéphrine dans l'anesthésique local. Il existe certaines preuves à l'appui de cette pratique comme moyen d'améliorer la sécurité de la plupart des patients pendant les blocs nerveux périphériques. Premièrement, il agit comme un marqueur de l'absorption intravasculaire. L'injection intraveineuse de 10 à 15 μg d'épinéphrine augmente de manière fiable la pression artérielle systolique de plus de 15 mmHg, même chez les patients sous sédation ou les patients traités avec des β-bloquants. La reconnaissance de cette augmentation peut permettre une détection précoce de l'injection intravasculaire et permet au clinicien d'arrêter rapidement l'injection et d'aiguiser la vigilance pour les signes de toxicité systémique. Deuxièmement, l'épinéphrine diminue le niveau plasmatique maximal de l'anesthésique local, ce qui réduit le risque de toxicité systémique. Les inquiétudes concernant les effets vasculaires de l'épinéphrine, la vasoconstriction et l'ischémie nerveuse n'ont pas été étayées et, en fait, des concentrations de 2.5 μg/mL (1:400,000 XNUMX) ont été associées à une augmentation du flux sanguin nerveux, probablement en raison de la prédominance du β -effet du médicament. Par conséquent, l'épinéphrine peut améliorer la sécurité lors de l'administration de doses plus importantes d'anesthésiques locaux sans risque documenté d'ischémie des membres et de décès neurologique.
Il convient de noter que l'utilisation du guidage échographique pendant les blocs nerveux périphériques a considérablement réduit le risque de toxicité systémique sévère des anesthésiques locaux pour plusieurs raisons. Cela est probablement dû au fait que le guidage échographique a permis de réduire le volume et la dose d'anesthésique local pour accomplir la plupart des procédures de bloc nerveux en surveillant sa propagation. De plus, l'observation du trajet de l'aiguille à l'échographie, l'évitement du placement intravasculaire et la confirmation de la propagation de l'anesthésique local dans les tissus contribuent tous à une plus grande sécurité avec l'anesthésie régionale guidée par ultrasons.
Stimulation nerveuse
La neurostimulation a largement remplacé la paresthésie comme principal moyen de localisation nerveuse dans les années 1980. Cependant, son utilité en tant que méthode de localisation précise des nerfs a été récemment contestée par les données de plusieurs études qui ont démontré que la réponse motrice évoquée (EMR) peut être absente malgré le contact intime aiguille-nerf, comme le confirme l'échographie. En effet, dans un certain nombre de contacts aiguille-nerf ou même de placement d'aiguille intraneurale, une intensité de courant étonnamment élevée peut être nécessaire pour déclencher un EMR. Par exemple, dans certains cas, un EMR ne peut être obtenu qu'avec une intensité de courant relative supérieure à 1 mA, même avec le placement d'une aiguille intraneurale comme on le voit à l'échographie.
Il y a probablement plusieurs facteurs qui contribuent à l'explication de ce phénomène. Le facteur le plus important est très probablement le shunt du courant électrique le long du chemin de moindre résistance (impédance). En d'autres termes, même lorsque l'aiguille est à proximité immédiate du nerf, le courant électrique peut ne pas nécessairement choisir de se diriger vers le nerf mais plutôt suivre le chemin de moindre résistance pour sortir par l'électrode cutanée. Un facteur supplémentaire peut inclure la distribution non uniforme des fibres motrices et sensorielles dans le nerf composé.
Cela ne signifie toutefois pas que la stimulation électrique des nerfs périphériques est obsolète à l'ère du guidage par ultrasons. Par exemple, les données de plusieurs études animales et humaines suggèrent que la présence d'une réponse motrice à un courant très faible (c'est-à-dire < 0.2 mA) est associée au placement intraneural de la pointe de l'aiguille et à l'inflammation intraneurale après une injection dans cette condition (Tableau 1). Voelckel et al. ont rapporté que lorsqu'un anesthésique local était injecté à des courants compris entre 0.3 et 0.5 mA, le tissu nerveux résultant ne présentait aucun signe de processus inflammatoire, alors que des injections à moins de 0.2 mA entraînaient une infiltration lymphocytaire et granulocytaire dans 50% des nerfs. Tsai et al. effectué une étude similaire portant sur l'effet de la distance au nerf sur le courant requis ; alors qu'une gamme de courants a été enregistrée pour une variété de distances, les seuls cas dans lesquels la réponse motrice a été obtenue à moins de 0.2 mA étaient lorsque la pointe de l'aiguille était placée de manière intraneurale.
TABLE 1. Résumé des études récentes sur le courant de stimulation nerveuse et la position de la pointe de l'aiguille.
| Étude | Sujet | Méthode | Résultats |
|---|---|---|---|
| Voelckel et coll. (2005)11 | Porcs (n = 10) | • Blocs du nerf sciatique postérieur réalisés bilatéralement • Deux groupes- Injection après EMR à 0.3-0.5 mA- Injection après EMR à < 0.2 mA • 6 heures après l'injection, nerfs sciatiques prélevés pour analyse histologique | • Apparence normale et saine des nerfs dans le groupe à courant élevé • 50 % des nerfs du groupe à faible courant ont montré des signes de lymphocytes et de granulocytes polymorphes sous-, péri-. et intraneuralement • Un spécimen dans le groupe à faible courant a montré une rupture grossière du périnèvre et de plusieurs fibres nerveuses |
| Tsai et coll. (2008)12 | Porcs (n = 20) | • Anesthésie générale • Nerfs sciatiques exposés bilatéralement • Courant appliqué avec une aiguille à différentes distances de 2 cm à intraneural • Deux observateurs aveugles se sont mis d'accord sur le courant minimal requis pour obtenir une contraction du sabot • 40 tentatives à chaque distance | • Les secousses du nerf sciatique ne peuvent être obtenues qu'à 0.1 cm ou moins • Large gamme de courants requis pour obtenir la réponse du moteur • Ce n'est qu'en intraneural qu'une réponse motrice a résulté d'un courant < 0.2 mA |
| Bigeleisen et coll. (2009)13 | Patients pour chirurgie main/poignet (n = 55) | • Bloc supraclaviculaire • Courant minimum (mA) enregistré- Avec l'aiguille à l'extérieur du tronc nerveux (mais en contact avec le nerf)- À l'intérieur du tronc • Position "intraneurale" confirmée par échographie avec injection de 5 mL d'anesthésique local | • Seuil de courant minimal médian à l'extérieur du nerf 0.60 mA ± 0.37 mA • Le seuil de courant minimal médian à l'extérieur du nerf était de 0.30 ± 0.19 mA • Aucun EMR observé à tout moment avec < 0.2 mA lorsque l'aiguille est placée à l'extérieur du nerf |
| Wiesmann et al (2014)14 | Porcs (n = 6) | • Modèle de plexus brachial ouvert • Stimulation à trois positions : intraneurale, contact aiguille-nerf et à 1 mm du nerf • 3 durées d'impulsion testées (0.1, 0.3 et 1 ms) | • L'intensité du courant ne permet pas de faire la distinction entre le contact intraneural et le contact aiguille-nerf • Réponse motrice < 0.2 mA (indépendamment de la durée de l'impulsion) indique un contact intraneural ou aiguille-nerf |
Bigeleisen et al. ont étudié 55 patients devant subir une chirurgie du membre supérieur et ayant reçu des blocs du plexus brachial sus-claviculaire échoguidés. Les auteurs se sont attachés à déterminer le seuil de courant minimum pour la réponse motrice à l'intérieur et à l'extérieur du premier tronc rencontré. Ils ont rapporté que le seuil de stimulation minimum médian était de 0.60 mA à l'extérieur du nerf et de 0.3 mA à l'intérieur du nerf. Cependant, l'EMR n'a pas été observé avec des courants de stimulation de 0.2 mA ou moins à l'extérieur du nerf, alors que 36 % des patients avaient une contraction de l'EMR à des courants inférieurs à 0.2 mA avec le placement de l'aiguille intraneurale. Pour affiner davantage cette relation, Wiesmann et ses collègues ont appliqué un courant électrique au plexus brachial de porcs à trois positions différentes (intraneurale, avec l'aiguille en contact avec l'épinèvre et à 1 mm du nerf) tout en faisant varier la durée de l'impulsion (0.1, 0.3 , et 1.0 ms). Le courant de seuil minimum pour provoquer une réponse motrice était identique entre les positions de contact intraneural et aiguille-nerf, et les deux étaient significativement inférieurs à la position à 1 mm. La durée d'impulsion n'a eu aucun effet sur le courant de seuil minimal. Ces auteurs ont conclu qu'une réponse motrice à moins de 0.2 mA (quelle que soit la durée de l'impulsion) indiquait un contact intraneural ou aiguille-nerf. Ceci est important car il a été établi que, même en l'absence de ponction de l'épinèvre, même un contact énergique aiguille-nerf (épinèvre) entraîne une inflammation et un potentiel de lésion nerveuse.
Prises ensemble, les données disponibles suggèrent que la sensibilité d'un « courant faible » pour déclencher un EMR dans une relation aiguille-nerf potentiellement dangereuse (placement intraneural/épineurial) est d'environ 75 %. Cependant, la spécificité de l'EMR lorsqu'il est présent à moins de 0.5 mA se rapproche de 100 %. En d'autres termes, une réponse motrice est provoquée par un courant de stimulation de faible intensité (par exemple, < 0.2 mA selon Voelckel et al), la pointe est toujours intraneurale ou intimement liée à l'épinèvre. Par conséquent, l'utilité du stimulateur nerveux est évidente : l'apparition inattendue d'un REM à 0.5 mA indique une relation aiguille-nerf dangereuse (par exemple, un contact aiguille-nerf) et peut permettre à l'opérateur d'arrêter l'avancement de l'aiguille avant que l'aiguille ne pénètre dans le nerf .
Il est universellement admis que l'injection d'anesthésique local dans le nerf comporte un facteur de risque de lésion nerveuse ; par conséquent, le dépôt extraneural d'anesthésique local constitue une pratique plus sûre. Bien qu'incontestablement utile, l'échographie est loin d'être un moniteur infaillible de la relation aiguille-nerf. Étant donné que l'injection dans un fascicule comporte un risque élevé de blessure, l'ajout d'une surveillance électrique de la position de la pointe de l'aiguille est utile pour la sécurité, en particulier chez les patients présentant une anatomie échographique difficile lorsque l'imagerie s'avère difficile ou que la qualité d'une image est médiocre. Si un EMR est déclenché à des courants inférieurs à 0.5 mA, cela indique une relation intime aiguille-nerf qui devrait inciter un léger retrait de l'aiguille et une injection prudente tout en évitant une pression d'injection d'ouverture supérieure à 15 psi. Dans l'ensemble, la stimulation nerveuse ajoute peu au coût d'une procédure de bloc nerveux, en termes de temps ou de coût, et peut également servir de confirmation fonctionnelle utile de l'image anatomique affichée sur l'écran échographique (par exemple, "Est-ce que le nerf médian ou ulnaire ?"). Pour ces raisons, la stimulation nerveuse doit être utilisée systématiquement en conjonction avec l'échographie comme un précieux moniteur supplémentaire de la position de la pointe de l'aiguille. En savoir plus sur Stimulateurs nerveux électriques et localisation des nerfs périphériques.
Échographie
L'échographie a révolutionné la pratique de l'anesthésie régionale et a permis une évolution substantielle de la sous-spécialité d'un art pratiqué par quelques-uns à une science plus reproductible. Les avantages sont que les ultrasons permettent de voir l'aiguille en temps réel et donc de guider rapidement et plus précisément l'aiguille vers la cible. L'échographie permet également une injection supplémentaire lorsque la première tentative n'est pas adéquate et dépose avec précision l'injectat dans les espaces tissulaires pour un bloc nerveux reproductible. De plus, l'échographie permet d'effectuer un bloc nerveux même chez les patients paralysés, les amputés qui n'ont pas de membre pour un DME, etc.
L'échographie a le potentiel d'améliorer la sécurité des blocs nerveux périphériques pour un certain nombre de raisons. Les structures adjacentes importantes peuvent être vues et évitées. Le regain de popularité du bloc supraclaviculaire en témoigne. Avant l'échographie, ce bloc très efficace était relativement impopulaire comme moyen d'anesthésier le plexus brachial de peur de provoquer un pneumothorax, en raison de la proximité du plexus et de la vue du placement de l'aiguille sur la plèvre et la cavité thoracique. Cependant, parce que le plexus brachial, et plus important encore la côte, la plèvre et l'artère sous-clavière peuvent être identifiés à l'échographie, le bloc supraclaviculaire est devenu courant dans la pratique clinique. Quoi qu'il en soit, l'échographie ne doit pas être considérée comme infaillible car des complications, y compris le pneumothorax, surviennent toujours avec le guidage échographique. De même, il existe des rapports de placement d'aiguilles intravasculaires et intraneurales observés par (et malgré l'utilisation de) l'échographie.
Un avantage important du dépistage par ultrasons est la capacité de déterminer la distance entre la peau et la cible. Ceci, associé à des aiguilles qui ont des marques de profondeur gravées sur le côté, confère une marge de sécurité supplémentaire en avertissant le clinicien d'une «distance d'arrêt», ou d'une profondeur au-delà de laquelle le clinicien doit arrêter d'avancer l'aiguille vers des tissus plus profonds et réévaluer. Un autre avantage important que l'échographie est la capacité de voir la distribution de l'anesthésique local en temps réel. (Figure 2). Si l'expansion tissulaire correspondante n'est pas observée au début de l'injection, la pointe de l'aiguille peut ne pas être à l'endroit où elle est supposée être, et le clinicien peut arrêter l'injection et réévaluer l'emplacement de la pointe de l'aiguille. Ceci est particulièrement important dans les zones vasculaires, car l'absence de propagation de l'anesthésique local peut signaler le placement de l'aiguille intravasculaire. D'autre part, la surveillance échographique peut être utilisée pour diagnostiquer le placement intra-artériel de la pointe de l'aiguille lorsqu'un « rougissement » échogène est noté dans la lumière de l'artère, diminuant le risque de toxicité systémique.
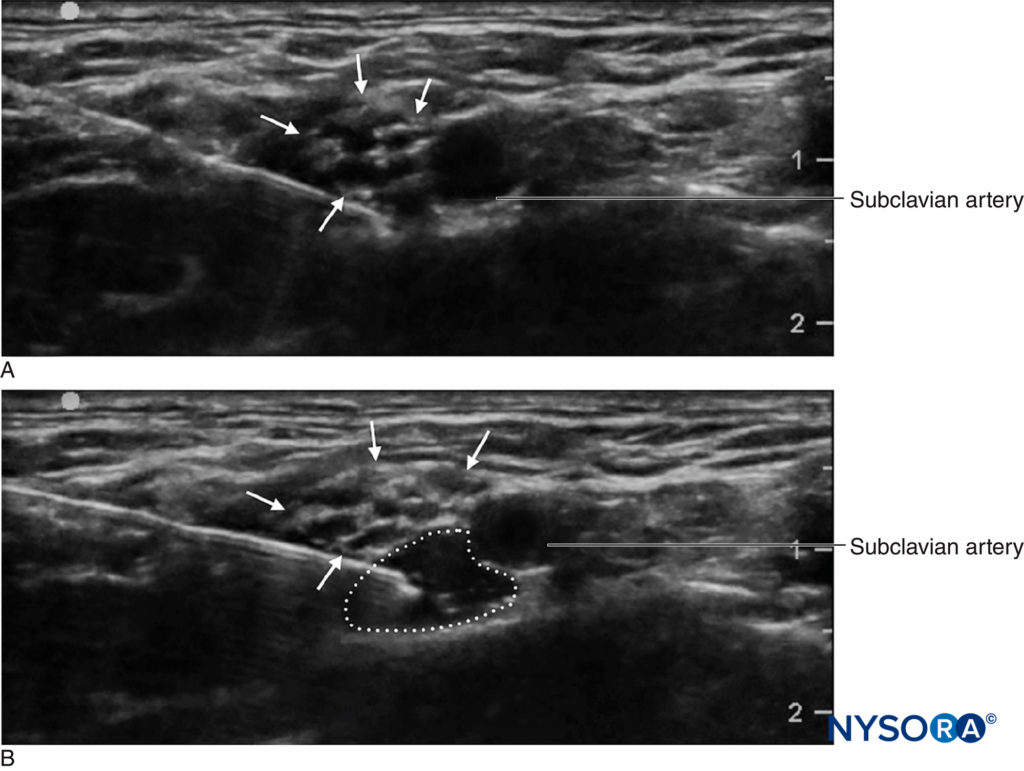
FIGURE 2. Bloc du plexus brachial supraclaviculaire montrant le plexus (flèches) adjacent à l'artère sous-clavière (SA). A Avant et B après dépôt de 10 mL d'anesthésique local (contour pointillé).
L'échographie semble diminuer le risque de toxicité systémique anesthésique locale (LAST). Dans une analyse d'un grand registre multicentrique de blocs nerveux périphériques (> 25,000 65 blocs nerveux périphériques), le risque de LAST a été réduit de plus de 10 % grâce à l'utilisation du guidage échographique. Le mécanisme proposé par les auteurs était la capacité de réduire considérablement les volumes et les doses d'anesthésique local nécessaires pour accomplir le bloc régional. En effet, la diminution de la dose et du volume d'anesthésique local nécessaire au succès de l'anesthésie régionale a été une tendance constante au cours de la dernière décennie. De nombreux rapports ont documenté des réductions substantielles du volume requis pour effectuer un bloc équivalent par rapport aux techniques d'anesthésie régionale pré-échoguidées. Par exemple, les blocs du plexus brachial peuvent être réalisés avec aussi peu que moins de 7 ml d'anesthésique local, sans sacrifier l'efficacité de l'anesthésie ou de l'analgésie. Même si la totalité du volume d'injectat est administrée par voie intraveineuse par accident, un LAST sévère résultant, par exemple, d'un volume de 0.5 mL de ropivacaïne à XNUMX % chez un adulte de taille moyenne est peu probable. blocs n'a pas diminué le risque ou l'incidence de lésions nerveuses.
Cette observation décevante a été documentée dans plusieurs rapports et est probablement multifactorielle. La capacité à discerner la relation aiguille-nerf dépend de l'utilisateur et de l'anatomie. En fait, des études ont démontré que les praticiens peuvent manquer environ jusqu'à une injection intraneurale sur six. Deuxièmement, la résolution actuelle de la machine à ultrasons peut ne pas être adéquate pour discerner entre un emplacement de pointe d'aiguille extrafasciculaire intraversus. Cette différence est cruciale, car une injection intraneurale (mais extrafasciculaire) n'est probablement pas associée à une blessure, alors que l'injection à l'intérieur des fascicules eux-mêmes produit des dommages cliniques et histologiques. Surtout, on ne peut pas se fier au gonflement du nerf comme avertissement d'une injection intraneurale, car une fois que cela est noté à l'échographie, il peut être trop tard pour prévenir les blessures. En effet, même une infime quantité d'anesthésique local produira des dommages si elle est injectée dans le fascicule, mais de si petites quantités d'anesthésique local (par exemple, 0.1 à 0.5 ml) peuvent ne pas être détectées par ultrasons. Par conséquent, se fier à la confirmation visuelle de l'expansion des tissus peut entraîner des dommages avant que l'expansion ne soit détectée à l'écran.
Surveillance de la pression d'injection
Une injection de lidocaïne alors que la pointe de l'aiguille était en position intrafasciculaire dans les nerfs sciatiques canins était associée à une pression d'ouverture élevée (> 20 psi), suivie d'un retour de la pression d'injection à la normale (c'est-à-dire < 5 psi) après la rupture fasciculaire. En revanche, les injections extrafasciculaires périneurales et intraneurales ont donné de faibles pressions d'ouverture et d'injection. Les membres dans lesquels des injections de nerf sciatique étaient associées à des pressions d'injection d'ouverture élevées présentaient des signes cliniques de neuropathie (fonte musculaire, faiblesse) ainsi que des signes histologiques de lésion neurologique (inflammation, perturbation de l'architecture nerveuse). L'implication est que l'injection dans un compartiment à faible compliance, comme dans les fascicules liés au périnèvre, nécessite une pression d'injection d'ouverture élevée avant que l'injection puisse être initiée.
La position intraneurale de la pointe de l'aiguille est également associée à des pressions d'injection d'ouverture élevées dans les cadavres humains. Orebaugh et al ont placé des aiguilles dans les racines cervicales cadavériques à l'aide d'ultrasons et ont quantifié la pression au cours d'une injection de 5 ml de ropivacaïne et d'encre sur 15 s. Contrairement aux aiguilles témoins placées à l'extérieur des racines (pression de pointe < 20 psi), les injections intraneurales ont entraîné une pression de pointe moyenne de 49 psi (plage de 37 à 66 psi). De même, Krol et al ont effectué des injections guidées par ultrasons par voie intraneurale et périneurale dans des nerfs plus distaux de cadavres humains frais (nerfs médian, ulnaire et radial) et ont également signalé que la pression d'injection d'ouverture était supérieure à 15 psi intraneurale, tandis que les pressions d'injection d'ouverture extraneurale étaient inférieurs à 10 psi.
Dans une étude clinique portant sur 16 patients subissant une chirurgie de l'épaule, le contact aiguille-nerf pendant le bloc interscalénique du plexus brachial était associé à une injection d'ouverture supérieure à 15 psi. En fait, au contact aiguille-nerf et juste avant l'entrée de l'aiguille dans les racines du plexus brachial, le flux d'injectat n'a pas pu commencer à des pressions inférieures à 15 psi. L'arrêt d'une injection lorsque la pression d'injection d'ouverture requise pour commencer une injection a atteint 15 psi a permis d'éviter l'injection dans cette position dangereuse chez 97 % des sujets. En revanche, une position de l'aiguille à 1 mm du nerf était associée à l'initiation de l'écoulement à des pressions d'ouverture inférieures à 15 psi. Par conséquent, en tant que moniteur de contact aiguille-nerf, une pression d'injection d'ouverture supérieure à 15 psi était beaucoup plus sensible qu'un courant de seuil minimum de 0.5 ou 0.2 mA ou l'apparition de paresthésie.
Ces données suggèrent que lorsque la pression dans le système approche les 15 psi sans la possibilité de commencer l'écoulement de l'injectat, cette pression d'injection d'ouverture élevée peut signaler une relation dangereuse aiguille-nerf ou un placement de l'aiguille dans le mauvais plan tissulaire. Par conséquent, l'injection doit être interrompue et la position de l'aiguille réévaluée.
Comment surveiller la pression d'injection ? L'utilisation du "toucher" pour éviter une pression d'injection élevée n'est malheureusement pas fiable. Des études sur des praticiens expérimentés aveuglés par la pression d'injection et invités à effectuer une simulation d'injection à l'aide d'un équipement standard ont révélé de grandes variations de la pression appliquée, certaines dépassant largement les seuils de sécurité établis. De même, les anesthésistes ont obtenu de mauvais résultats lorsqu'on leur a demandé de faire la distinction entre l'injection intraneurale et l'injection dans d'autres tissus, tels que les muscles ou les tendons, dans un modèle animal. Par conséquent, la seule surveillance significative et reproductible consiste à utiliser une méthode objective et quantifiable de surveillance de la pression d'injection d'ouverture.
Alors que la pratique de la surveillance de la pression d'injection pendant les blocs nerveux périphériques est relativement nouvelle, il existe plusieurs options de surveillance. Tsui et al ont décrit une "technique d'injection d'air comprimé" par laquelle 10 ml d'air sont aspirés dans la seringue avec l'anesthésique local. En tenant la seringue à la verticale, un seuil maximal de 1 atm (ou 14.7 psi) peut être évité en ne laissant que la partie gazeuse du contenu de la seringue se comprimer à la moitié de son volume d'origine, soit 5 ml (Figure 3). Ceci est basé sur la loi de Boyle, qui stipule que la pression × le volume doivent être constants. Une pression de 20 psi ou moins est considérée comme un seuil sûr pour initier l'injection pendant les blocs nerveux périphériques. La loi de Boyle a également été utilisée dans un autre appareil simple utilisant un robinet à quatre voies et une seringue de 1 ml remplie d'air. Si, au début de l'injection, le ménisque liquide atteint le point médian dans la seringue de 1 ml (c'est-à-dire 0.5 ml), cela indique un doublement de la pression dans le système (c'est-à-dire une autre atmosphère ou 14.7 psi). Ce sont des moyens à la fois peu coûteux et disponibles partout pour limiter la pression d'injection pendant les blocs nerveux périphériques. Les limitations pratiques incluent la nécessité de tenir la seringue en position verticale ou de fermer périodiquement le robinet d'arrêt de la seringue de 1 ml lors de l'aspiration afin que l'air ne puisse pas pénétrer dans la tubulure d'injection.
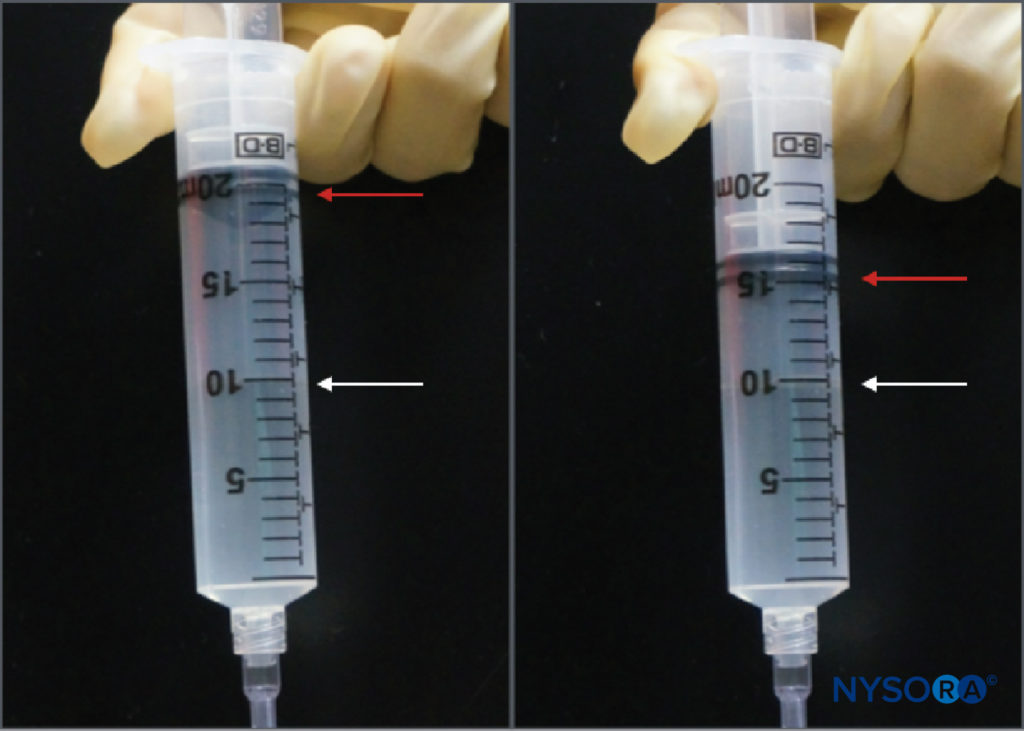
FIGURE 3. La technique d'injection d'air comprimé. Une bulle d'air de 10 ml est placée dans la seringue d'anesthésique local, qui est ensuite inversée. La compression de cette bulle dans un système fermé à la moitié de son volume d'origine (c'est-à-dire 5 ml) augmentera la pression dans le système de 1 atm (14.7 psi).
Une autre option pour surveiller la pression d'injection est l'utilisation de manomètres de pression jetables en ligne spécialement fabriqués à cet effet. Ces dispositifs relient la seringue et le tube de l'aiguille et, via un piston à ressort, permettent au clinicien de surveiller en permanence la pression dans le système seringue-tube-aiguille. Sur la tige du piston se trouvent des marques délimitant trois seuils de pression différents : moins de 15 psi, 15–20 psi et plus de 20 psi (Figure 4). Un avantage de cette méthode est la facilité avec laquelle un assistant qui effectue l'injection peut lire et communiquer les pressions atteintes. Cette méthode permet également une documentation objective de la pression d'injection lors d'une procédure de bloc nerveux périphérique. Il est important de noter que la pression d'ouverture (pression à laquelle le débit commence) est indépendante de la taille de la seringue, du tube et de l'aiguille ou de la vitesse d'injection (loi de Pascal) (Figure 5). Alors qu'une plus grande pression peut être générée par une seringue plus petite et qu'une pression d'injection plus élevée peut être atteinte par une injection rapide, la pression d'ouverture à laquelle le débit commence est la même et indépendante de ces variables pour les tailles courantes de seringue-tuyau-aiguille (c'est-à-dire 18– calibre 25). Lorsque l'injection commence, cependant, ces facteurs influenceront la pression d'injection atteinte. Par conséquent, une vitesse d'injection lente et régulière est suggérée pour toutes les procédures de bloc nerveux (10 à 15 mL/min). La pression d'injection d'ouverture devient pertinente à chaque repositionnement de l'aiguille et injection consécutive. La surveillance de la pression peut être un moniteur de sécurité utile dans plusieurs autres aspects des blocs nerveux périphériques. Dans une étude portant sur des patients recevant des blocs du plexus lombaire randomisés entre des pressions basses (<15 psi) et élevées (>20 psi), Gadsden et al ont démontré que 60 % des patients du groupe à haute pression ont subi un bloc épidural bilatéral.
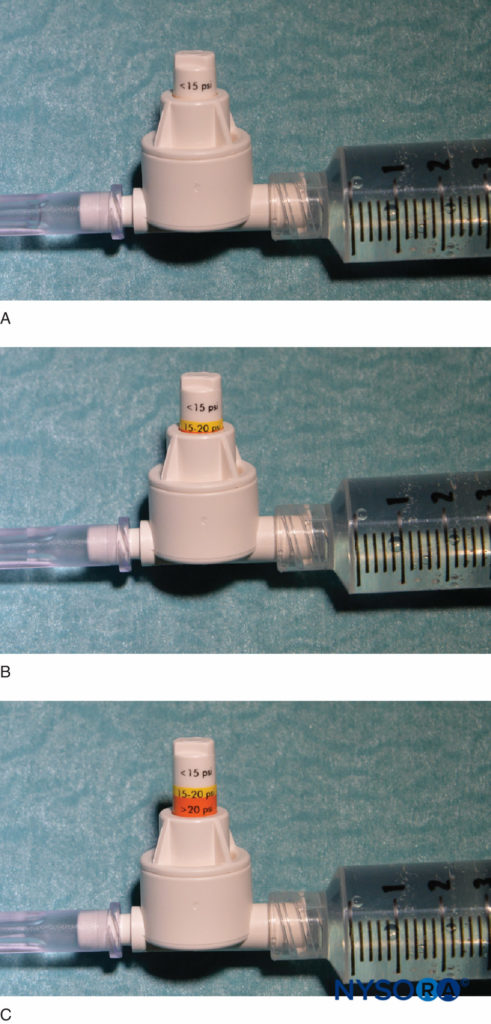
FIGURE 4. Un exemple de manomètre de pression en ligne disponible dans le commerce (B-Smart, B. Braun Medical, Bethlehem, PA). Comme on le voit dans A–C, respectivement, le moniteur affiche les plages de pression en couleur sur le piston mobile : 0–15 psi (blanc), 15–20 psi (jaune) et plus de 20 psi (orange). En utilisation clinique, la pression d'injection d'ouverture exacte (OIP) est moins importante que la prévention du dépassement de la plage d'OIP associée à une lésion fasciculaire (> 15 psi). Pratiquement, cela est évité en interrompant l'injection avec l'apparition de n'importe quelle couleur sur le piston tout au long du cycle d'injection (>15 psi). Il est important de noter que la pression d'ouverture (pression à laquelle le débit commence) est indépendante de la taille de la seringue, du tube et de l'aiguille ou de la vitesse d'injection (loi de Pascal).
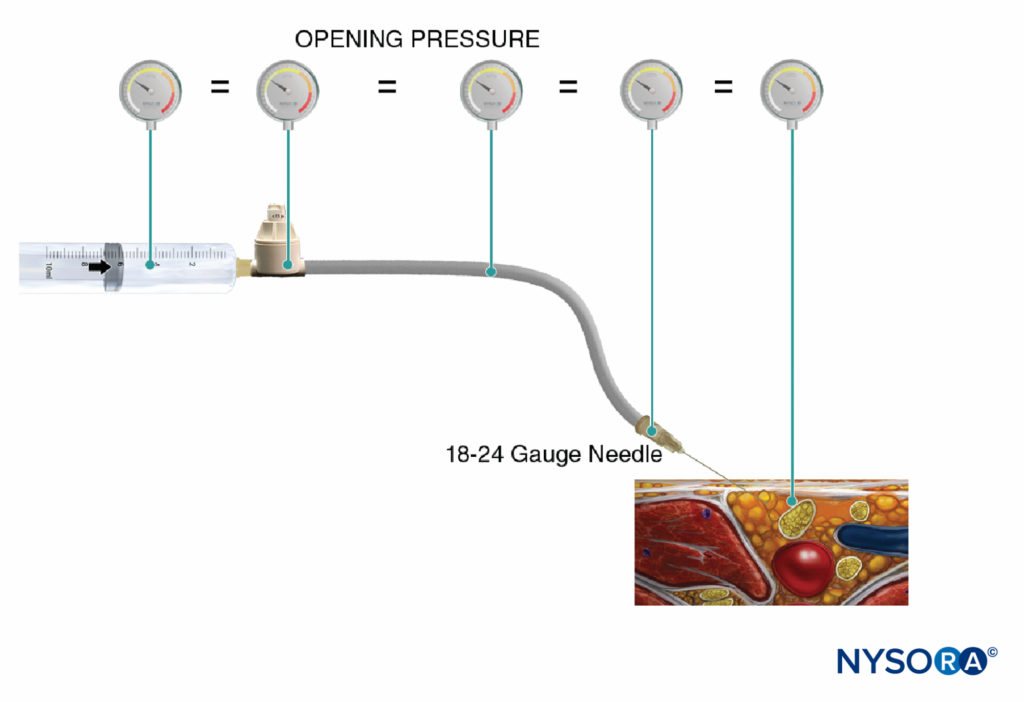
FIGURE 5. La pression d'injection d'ouverture (pression à laquelle le débit commence) est indépendante de la taille de la seringue, du tube et de l'aiguille ou de la vitesse d'injection, et elle est égale dans tout le système d'injection (loi de Pascal).
De plus, 50 % des patients du même groupe ont développé un bloc péridural dans la distribution thoracique, alors qu'aucun patient du groupe basse pression n'a présenté de bloc bilatéral ou péridural. De même, Gautier et al ont démontré que lorsque les volontaires étaient randomisés entre des pressions basses (<15 psi) versus élevées (>20 psi) pendant le bloc interscalénique du plexus brachial, une propagation épidurale cervicale se produisait dans 11 % des injections à haute pression (vs 0 % dans le groupe basse pression). De plus, tous les sujets ont demandé que l'injection soit interrompue dans les conditions de haute pression en raison d'un inconfort, mais pas pendant l'injection à basse pression. Ces données suggèrent que la surveillance de la pression d'injection à l'ouverture est importante pour plusieurs aspects de la sécurité et du confort du patient lors de la pratique des blocs nerveux périphériques.
Résumé
L'anesthésie régionale a fait une transition de l'art à la science, à mesure que des moyens plus rigoureux et précis de localisation des nerfs sont développés. Le même processus doit être attendu pour la surveillance du bloc périphérique. L'utilisation de la neurostimulation, de l'échographie et de la surveillance de la pression d'injection fournit un ensemble complémentaire de données objectives qui peuvent guider les cliniciens pour effectuer les blocs les plus sûrs possibles.
Figure 6 est un organigramme décrivant comment ces moniteurs sont utilisés dans notre pratique.
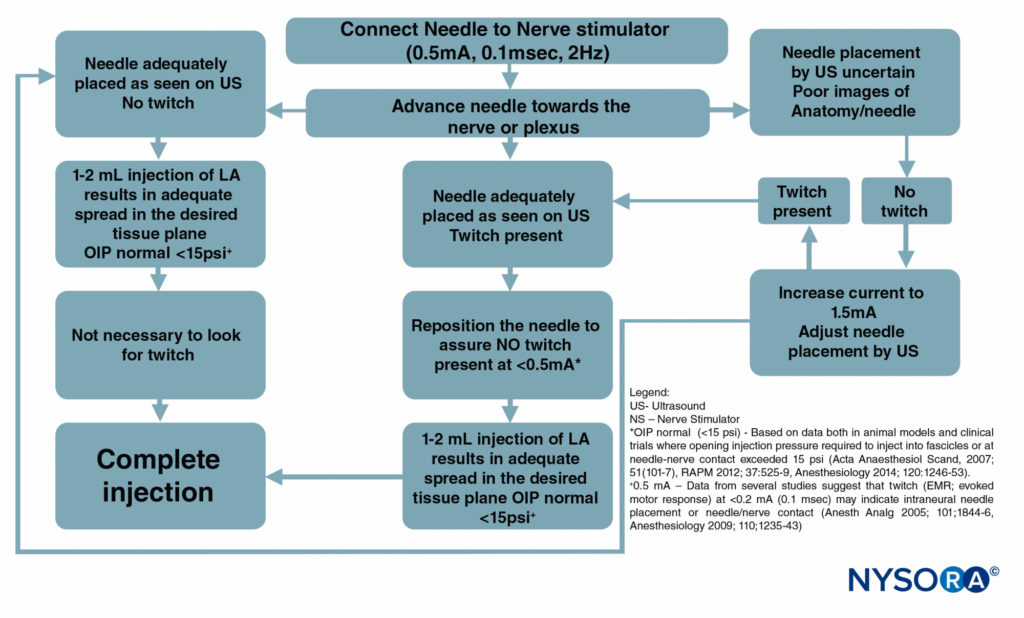
FIGURE 6. Un organigramme décrivant l'ordre de surveillance correcte des procédures de bloc nerveux en combinant l'échographie (US), la stimulation nerveuse (NS) et la surveillance de la pression d'injection. LA = anesthésie locale.
DOCUMENTATION
Remarques sur la procédure de bloc
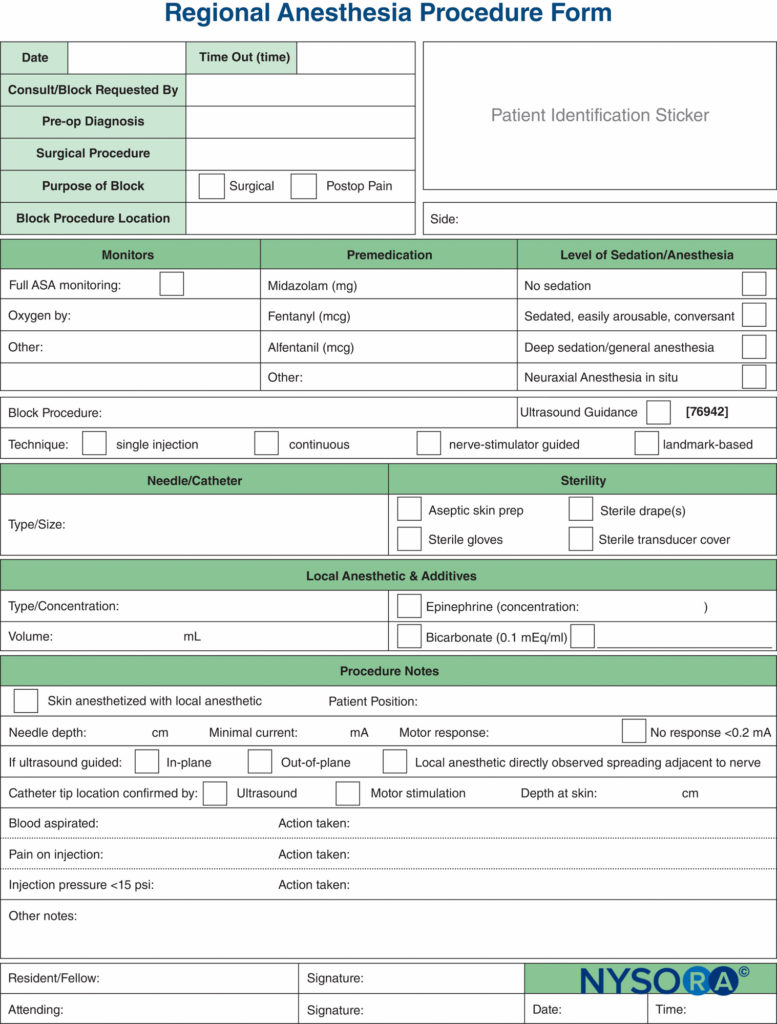
La documentation des procédures de bloc nerveux a pris du retard par rapport à la documentation de l'anesthésie générale, et elle est souvent reléguée à quelques lignes griffonnées dans le coin du dossier d'anesthésie. La pression croissante des sources juridiques, de facturation et réglementaires a provoqué un effort pour améliorer la documentation des blocs nerveux périphériques. Des exemples d'un formulaire de documentation de bloc nerveux périphérique qui intègre tous les éléments de surveillance mentionnés précédemment dans ce chapitre sont présentés dans Chiffres 7 et 8. Ceux-ci peuvent être adoptés et modifiés en fonction des pratiques individuelles. Les formulaires comportent un certain nombre de caractéristiques qui devraient être prises en compte par les établissements qui tentent de formuler leur propre note de procédure. Il s'agit notamment des éléments suivants :
Les dossiers papier sont de plus en plus remplacés par des systèmes de tenue de dossiers médicaux électroniques. La documentation des blocs est simple avec des systèmes informatisés tels que ceux-ci, car les variables de bloc peuvent être sélectionnées rapidement dans une liste en indiquant les éléments de documentation pertinents, tandis que tous les éléments narratifs peuvent être rapidement saisis à l'aide d'un clavier (Figure 8). La lisibilité et la capacité à corriger les erreurs sont des avantages de la note e-block.

FIGURE 8. Capture d'écran d'une page de documentation en bloc tirée d'un dossier médical électronique.
Un autre aspect utile de la documentation du bloc nerveux périphérique est l'enregistrement d'une image échographique ou d'un clip vidéo, à stocker soit sous forme de copie papier dans le dossier du patient, soit sous forme de copie numérique dans le dossier de santé électronique (DSE) ou sur un disque dur sécurisé séparé. Il s'agit non seulement d'une bonne pratique d'un point de vue médico-légal, mais également d'une étape obligatoire qui doit être franchie si le clinicien souhaite facturer l'utilisation du guidage échographique. Toutes les copies papier doivent comporter une étiquette d'identification du patient, la date enregistrée et tout résultat pertinent mis en évidence avec un marqueur, tel qu'un anesthésique local se propageant autour du nerf. Des exemples supplémentaires de documentation très pratique des procédures essentielles de bloc nerveux et d'anesthésie rachidienne sont présentés dans Chiffres 9 et 10, Respectivement.
| Caractéristiques utiles d'une note de procédure de bloc nerveux périphérique | Exemple |
|---|---|
| Éléments qui guident le praticien pour répondre à une norme de soins donnée | Un espace pour indiquer l'utilisation d'épinéphrine dans la solution anesthésique locale ou si aucune n'a été utilisée, pourquoi pas |
| Un compromis entre efficacité et capacité à individualiser | Informations enregistrées à l'aide de cases à cocher et d'espaces de ligne vierges |
| Documentation pour se prémunir contre les défis médico-légaux courants | Le praticien doit indiquer le niveau de conscience du patient |
| Documentation de conformité avec les organismes de réglementation (par exemple, Commission mixte) | Les cases à cocher indiquent la latéralité |
| Éléments pour faciliter une facturation réussie | Langue requise par de nombreuses compagnies d'assurance indiquant le bloc spécifiquement demandé par le chirurgien |
| Documentation des cliniciens impliqués et à quel titre | La personne traitante était-elle la personne qui effectuait le blocage ou dirigeait-elle médicalement un résident ? |
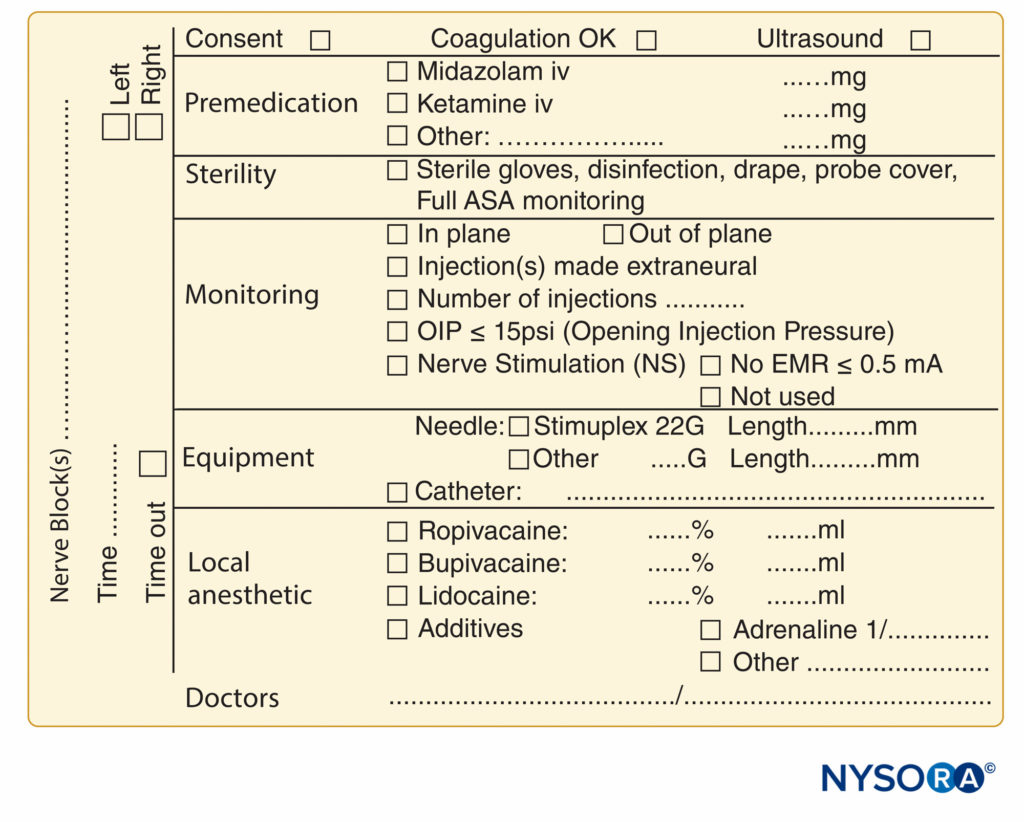
FIGURE 9. Éléments essentiels de la documentation des procédures de bloc nerveux périphérique utilisées au NYSORA-Europe CREER (Center for Research, Education, and Enhanced Recovery From Orthopaedic Surgery) au ZOL (Ziekenhuis Oost-Limburg), Genk, Belgique.
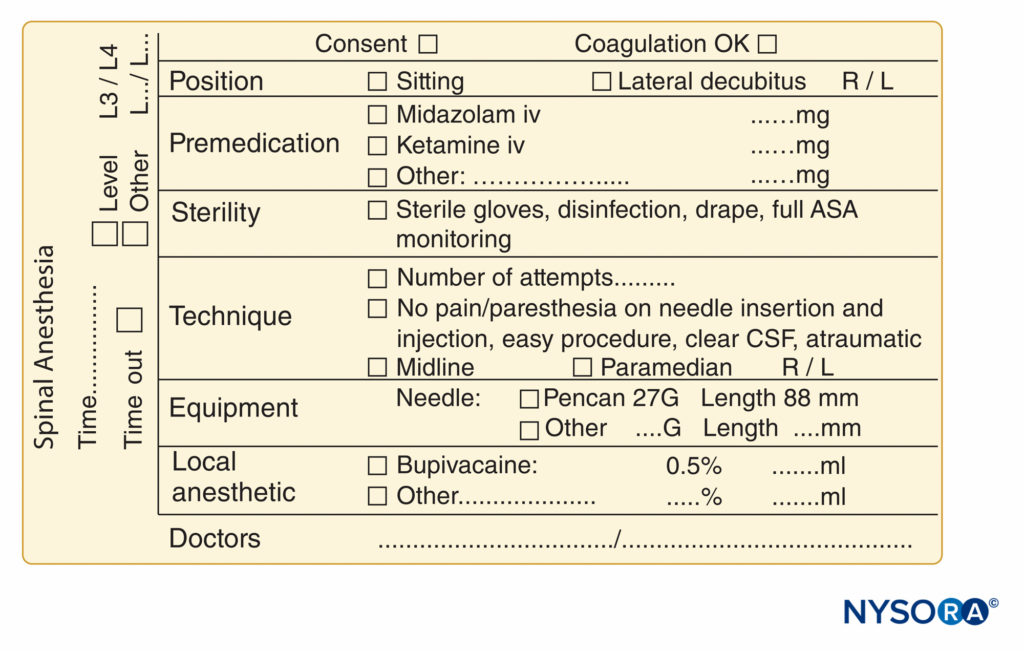
FIGURE 10. Éléments essentiels de la documentation des procédures d'anesthésie rachidienne utilisées au NYSORA-Europe CREER (Center for Research, Education, and Enhanced Recovery From Orthopaedic Surgery) au ZOL (Ziekenhuis Oost-Limburg), Genk, Belgique.
Consentement éclairé
La documentation du consentement éclairé est un aspect important de la pratique de l'anesthésie régionale. Les modèles de pratique varient considérablement sur cette question, et le consentement écrit spécifique pour les procédures de bloc nerveux n'est souvent pas obtenu. Cependant, la documentation écrite de ce processus peut être importante pour un certain nombre de raisons :
- Les patients sont souvent distraits et anxieux le jour de la chirurgie (lorsque de nombreux consentements sont obtenus) et peuvent ne pas se souvenir des détails d'une discussion avec leur anesthésiste. Des études ont montré qu'un enregistrement écrit du processus de consentement éclairé améliore le rappel des risques et des avantages par le patient.
- Un consentement écrit établit qu'une discussion sur les risques et les avantages a eu lieu entre le patient et le médecin.
- Un document spécifique pour l'anesthésie locorégionale peut être adapté pour inclure tous les risques courants et graves ; cela permet au médecin de les expliquer au patient de manière routinière et de réduire le risque d'omettre des risques importants.
Les conseils suivants peuvent être utilisés pour optimiser le processus de consentement :
| Suggestions pour améliorer le processus de consentement. |
|---|
| Soit bref. Une explication simple et courte aide à rappeler les risques et les avantages plus que de longs paragraphes. |
| Inclure non seulement les risques graves et majeurs, mais également les avantages et les résultats attendus de la procédure d'anesthésie régionale proposée. Il est difficile pour les patients de faire un choix éclairé si seuls les risques sont discutés. |
| Utiliser le processus de consentement comme moyen d'éduquer le patient simultanément. |
| Offrir une copie du formulaire au patient. Il a été démontré que cela facilite le rappel des informations relatives au consentement. |
Références
- Buhre W, Rossaint R : Prise en charge et surveillance périopératoires en anesthésie. Lancet 2003;362:1839–1846.
- Guinard JP, Mulroy MF, Carpenter RL, Knopes KD : Doses d'essai : teneur optimale en épinéphrine avec et sans bloc bêta-adrénergique aigu. Anesthésiologie 1990 ; 73 : 386–392.
- Tanaka M, Sato M, Kimura T, Nishikawa T : L'efficacité de la dose test intravasculaire simulée chez les patients sous sédation. Anesth Analg 2001;93 : 1612–1617, table des matières.
- Karmakar MK, Ho AM-H, Law BK, Wong ASY, Shafer SL, Gin T : Pharmacocinétique artérielle et veineuse de la ropivacaïne avec et sans épinéphrine après bloc paravertébral thoracique. Anesthésiologie 2005 ; 103 : 704–711.
- Van Obbergh LJ, Roelants FA, Veyckemans F, Verbeeck RK : Chez les enfants, l'ajout d'épinéphrine modifie la pharmacocinétique de la ropivacaïne injectée par voie caudale. Can J Anaesth 2003;50:593–598.
- Neal JM : Effets de l'épinéphrine dans les anesthésiques locaux sur les systèmes nerveux central et périphérique : neurotoxicité et flux sanguin neural. Reg Anesth Pain Med 2003;28:124–134.
- Sites BD, Taenzer AH, Herrick MD, et al : Incidence de la toxicité systémique des anesthésiques locaux et des symptômes neurologiques postopératoires associés à 12,668 2012 blocs nerveux guidés par échographie : une analyse d'un registre clinique prospectif. Reg Anesth Pain Med 37;5(478):482–XNUMX.
- Perlas A, Niazi A, McCartney C, Chan V, Xu D, Abbas S : la sensibilité de la réponse motrice à la stimulation nerveuse et à la paresthésie pour la localisation nerveuse, évaluée par ultrasons. Reg Anesth Pain Med 2006;31:445–450.
- Chan VWS, Brull R, McCartney CJL, Xu D, Abbas S, Shannon P : Une étude échographique et histologique de l'injection intraneurale et de la stimulation électrique chez le porc. Anesth Analg 2007;104:1281–1284, table des matières.
- Robards C, Hadzic A, Somasundaram L, et al : injection intraneurale avec stimulation à faible courant pendant le bloc du nerf sciatique poplité. Anesth Analg 2009;109:673–677.
- Voelckel WG, Klima G, Krismer AC, et al : Signes d'inflammation après bloc du nerf sciatique chez les porcs. Anesth Analg 2005;101:1844–1846.
- Tsai TP, Vuckovic I, Dilberovic F, et al : l'intensité du courant de stimulation peut ne pas être un indicateur fiable du placement de l'aiguille intraneurale. Reg Anesth Pain Med 2008;33:207–210.
- Bigeleisen PE, Moayeri N, Groen GJ : Seuils de stimulation extraneurale versus intraneurale pendant le bloc supraclaviculaire guidé par échographie. Anesthésiologie 2009 ; 110 : 1235–1243.
- Wiesmann T, Bornträger A, Vassiliou T, et al : l'intensité de courant minimale pour provoquer une réponse motrice évoquée ne peut pas discerner entre le contact aiguille-nerf et l'insertion intraneurale de l'aiguille. Anesth Analg 2014;118:681–686.
- Steinfeldt T, Graf J, Schneider J, et al : Conséquences histologiques du contact aiguille-nerf suite à une stimulation nerveuse dans un modèle de porc. Anesthesiol Res Pract 2011;2011:591851.
- Steinfeldt T, Poeschl S, Nimphius W, et al : Avancement forcé de l'aiguille pendant le contact aiguille-nerf dans un modèle porcin : résultat histologique. Anesth Analg 2011;113:417–420.
- Gadsden J, Latmore M, Levine DM, Robinson A : Une pression d'injection d'ouverture élevée est associée au contact aiguille-nerf et aiguille-fascia pendant le bloc du nerf fémoral. Reg Anesth Pain Med 2016;41(1):50–55.
- Hogan QH : Physiopathologie des lésions nerveuses périphériques au cours de l'anesthésie régionale. Reg Anesth Pain Med 2008;33:435–441.
- Whitlock EL, Brenner MJ, Fox IK, Moradzadeh A, Hunter DA, Mackinnon SE : blessure par injection de nerf périphérique induite par la ropivacaïne dans le modèle de rongeur. Anesth Analg 2010;111(1):214–220.
- Sala-Blanch X, Ribalta T, Rivas E, et al : lésion structurelle du nerf sciatique humain après l'insertion d'une aiguille intraneurale. Reg Anesth Pain Med 2009;34:201–205.
- Hadzic A, Dilberovic F, Shah S, et al : la combinaison d'une injection intraneurale et d'une pression d'injection élevée entraîne des lésions fasciculaires et des déficits neurologiques chez le chien. Reg Anesth Pain Med 2004;29:417–423.
- Gauss A, Tugtekin I, Georgieff M, Dinse-Lambracht A, Keipke D, Gorsewski G : Incidence du pneumothorax cliniquement symptomatique dans le bloc du plexus brachial infraclaviculaire et supraclaviculaire guidé par échographie. Anesthésie 2014 ; 69 : 327–336.
- Russon K, Blanco R : Injection intraneurale accidentelle dans le nerf musculo-cutané visualisée par échographie. Anesth Analg 2007;105:1504–1505, table des matières.
- Schafhalter-Zoppoth I, Zeitz ID, Gray AT : empalement involontaire du nerf fémoral et injection intraneurale visualisée par échographie. Anesth Analg 2004;99:627–628.
- Loubert C, Williams SR, Hélie F, Arcand G : Complication lors d'un bloc régional échoguidé : injection intravasculaire accidentelle d'anesthésique local. Anesthésiologie 2008 ; 108 : 759–760.
- Vadeboncouer T, Weinberg G, Oswald S, Angelov F : Détection précoce d'une injection intravasculaire lors d'un bloc du plexus brachial supraclaviculaire guidé par échographie. Reg Anesth Pain Med 2008;33:278–279.
- Martínez Navas A, DE LA Tabla González RO : La technique guidée par ultrasons a permis la détection précoce d'une injection intravasculaire lors d'un bloc du plexus brachial sous-claviculaire. Acta Anaesthesiol Scand 2009;53:968–970.
- Barrington MJ, Kluger R : Le guidage échographique réduit le risque de toxicité systémique anesthésique locale après un bloc nerveux périphérique. Reg Anesth Pain Med 2013;38:289–297.
- Orebaugh SL, Kentor ML, Williams BA : Résultats indésirables associés aux blocs nerveux périphériques guidés par un stimulateur nerveux et guidés par ultrasons par des stagiaires supervisés : mise à jour d'une base de données à site unique. Reg Anesth Pain Med 2012;37:577–582.
- Casati A, Baciarello M, Di Cianni S, et al : Effets du guidage échographique sur le volume anesthésique efficace minimum requis pour bloquer le nerf fémoral. Br J Anaesth 2007;98:823–827.
- Sandhu NS, Bahniwal CS, Capan LM : Faisabilité d'un bloc sous-claviculaire avec un volume réduit de lidocaïne sous guidage échographique. J Ultrasound Med 2006;25:51–56.
- Vandepitte C, Gautier P, Xu D, Salviz EA, Hadzic A : Volume effectif de ropivacaïne 0.75 % à travers un cathéter requis pour le bloc interscalénique du plexus brachial. Anesthésiologie 2013 ;118 : 863–867.
- Riazi S, Carmichael N, Awad I, Holtby RM, McCartney CJL : Effet du volume d'anesthésie locale (20 vs 5 ml) sur l'efficacité et les conséquences respiratoires du bloc du plexus brachial interscalène guidé par échographie. Br J Anaesth 2008;101:549–556.
- O'Donnell B, Riordan J, Ahmad I, Iohom G : Rapports succincts : une évaluation clinique des caractéristiques du bloc à l'aide d'un millilitre de lidocaïne à 2 % dans un bloc du plexus brachial axillaire guidé par échographie. Anesth Analg 2010;111:808–810.
- Krediet AC, Moayeri N, Bleys RLAW, Groen GJ : intraneural ou extraneural : précision diagnostique de l'évaluation échographique pour localiser l'injection à faible volume. Reg Anesth Pain Med 2014;39:409–413.
- Liu SS, YaDeau JT, Shaw PM, Wilfred S, Shetty T, Gordon M : Incidence des injections intraneurales involontaires et des complications neurologiques postopératoires avec blocs nerveux interscalènes et supraclaviculaires guidés par échographie. Anesthésie 2011 ; 66 : 168–174.
- Hara K, Sakura S, Yokokawa N, Tadenuma S : Incidence et effets de l'injection intraneurale involontaire pendant le bloc du nerf sciatique sous-glutéal guidé par échographie. Reg Anesth Pain Med 2012;37:289–293.
- Bigeleisen PE : La ponction nerveuse et l'injection intraneurale apparente pendant le bloc axillaire guidé par échographie n'entraînent pas invariablement de lésions neurologiques. Anesthésiologie 2006 ; 105 : 779–783.
- Selander D, Dhunér KG, Lundborg G : Lésion nerveuse périphérique due aux aiguilles d'injection utilisées pour l'anesthésie régionale. Une étude expérimentale des effets aigus du traumatisme causé par la pointe d'une aiguille. Acta Anaesthesiol Scand 1977;21:182–188.
- Orebaugh SL, Mukalel JJ, Krediet AC, et al : Injection de la racine du plexus brachial dans un modèle de cadavre humain : distribution de l'injectat et effets sur le neuraxis. Reg Anesth Pain Med 2012;37:525–529.
- Krol A, Szarko M, Vala A, De Andres J : Surveillance de la pression des injections intraneurales et périneurales dans les nerfs médian, radial et ulnaire : leçons d'une étude cadavérique. Anesth Pain Med 2015;5:e22723.
- Gadsden JC, Choi JJ, Lin E, Robinson A : La pression d'injection d'ouverture détecte systématiquement le contact aiguille-nerf pendant le bloc du plexus brachial interscalène guidé par échographie. Anesthésiologie 2014 ;120 : 1246–1253.
- Claudio R, Hadzic A, Shih H, et al : Pressions d'injection par les anesthésistes lors d'un bloc nerveux périphérique simulé. Reg Anesth Pain Med 2004;29:201–205.
- Theron PS, Mackay Z, Gonzalez JG, Donaldson N, Blanco R : Un modèle animal de « sensation de seringue » pendant un bloc nerveux périphérique. Reg Anesth Pain Med 2009;34:330–332.
- Tsui BCH, Knezevich MP, Pillay JJ : Pressions d'injection réduites à l'aide d'une technique d'injection d'air comprimé (CAIT) : une étude in vitro. Reg Anesth Pain Med 2008;33:168–173.
- Patil J, Ankireddy H, Wilkes A, Williams D, Lim M : Un manomètre improvisé pour les injections régionales de bloc nerveux/anesthésie : une étude initiale. J Clin Monit Comput 2015. doi:10.1007/s10877-015-9701-z.
- Gadsden JC, Lindenmuth DM, Hadzic A, Xu D, Somasundarum L, Flisinski KA : Le bloc du plexus lombaire utilisant une injection à haute pression entraîne une propagation controlatérale et péridurale. Anesthésiologie 2008 ;109 : 683–688.
- Gautier P, Vandepitte C, Schaub I, et al : La disposition du radiocontraste dans l'espace interscalène chez des volontaires sains. Anesth Analg 2015;120:1138–1141.
- Gerancher JC, Grice SC, Dewan DM, Eisenach J : Une évaluation du consentement éclairé avant l'analgésie péridurale pour le travail et l'accouchement. Int J Obstet Anesth 2000;9:168–173.