Erika Cvetko, Marija Meznarič y Tatjana Stopar Pintaric
INTRODUCCIÓN
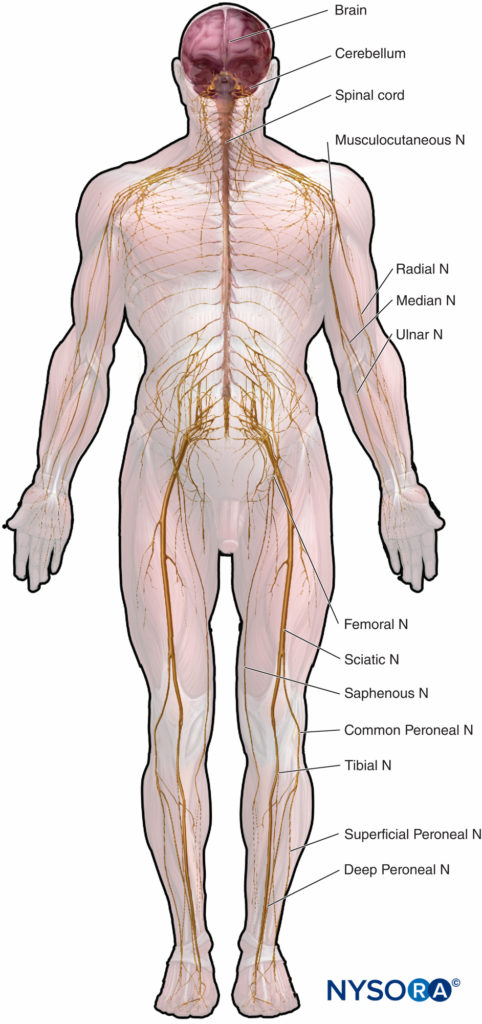
La anatomía microscópica que enfatiza las relaciones estructura-función es importante para la práctica clínica de la anestesia regional. Este capítulo proporciona la base para la comprensión de la estructura, clasificación y organización de los nervios periféricos y una idea de cómo las características de los nervios periféricos (Figura 1) se relacionan con la práctica clínica de la anestesia regional.
ORGANIZACIÓN DEL SISTEMA NERVIOSO PERIFÉRICO
El sistema nervioso permite que el cuerpo responda a cambios continuos en sus entornos externo e interno. Controla e integra las actividades funcionales de los órganos y sistemas de órganos.
Las células del sistema nervioso consisten en neuronas y neuroglia. Las neuronas transmiten impulsos nerviosos hacia y desde el sistema nervioso central (SNC), integrando así funciones motoras y sensoriales. Las células neurogliales apoyan y protegen las neuronas. En el SNC, la mielina es producida por los oligodendrocitos y en el sistema nervioso periférico (SNP) por las células de Schwann. Aunque tanto las células de Schwann como los oligodendrocitos están a cargo de la mielinización del axón, tienen propiedades morfológicas y moleculares distintas y diferentes orígenes embrionarios, la cresta neural y el tubo neural, respectivamente.
El SNP consta de nervios periféricos (craneoespinal, somático, autónomo) con sus ganglios asociados y revestimientos de tejido conjuntivo. Todos se encuentran en la periferia de la cubierta pial del SNC.
Los nervios periféricos contienen fascículos de fibras nerviosas que consisten en axones. En las fibras nerviosas periféricas, los axones están envueltos por células de Schwann, que pueden o no formar mielina alrededor de los axones, dependiendo de su diámetro. Las fibras nerviosas se agrupan en fascículos de número variable. El tamaño, el número y el patrón de los fascículos varían en diferentes nervios y en diferentes niveles a lo largo de sus trayectos. Generalmente, su número aumenta y su tamaño disminuye a cierta distancia próxima al punto de ramificación.
NEURONAS
Una neurona es la unidad estructural y funcional del sistema nervioso. Incluye el cuerpo celular, las dendritas y el axón.
el cuerpo celular (pericario) Es la región dilatada de la neurona que contiene un gran núcleo eucromático con un nucléolo prominente y citoplasma perinuclear circundante.Figura 2). El citoplasma perinuclear contiene abundante retículo endoplásmico de superficie rugosa y ribosomas libres. Al microscopio óptico, el retículo endoplásmico rugoso con rosetas de ribosomas libres aparece como cuerpos pequeños, llamados cuerpos de Nissl. El citoplasma perinuclear contiene numerosas mitocondrias, un gran aparato de Golgi perinuclear, liposomas, microtúbulos, neurofilamentos, vesículas de transporte e inclusiones. La presencia del núcleo eucromático, nucléolo grande, aparato de Golgi prominente y cuerpos de Nissl indica el alto nivel de actividad anabólica necesaria para mantener estas células grandes.
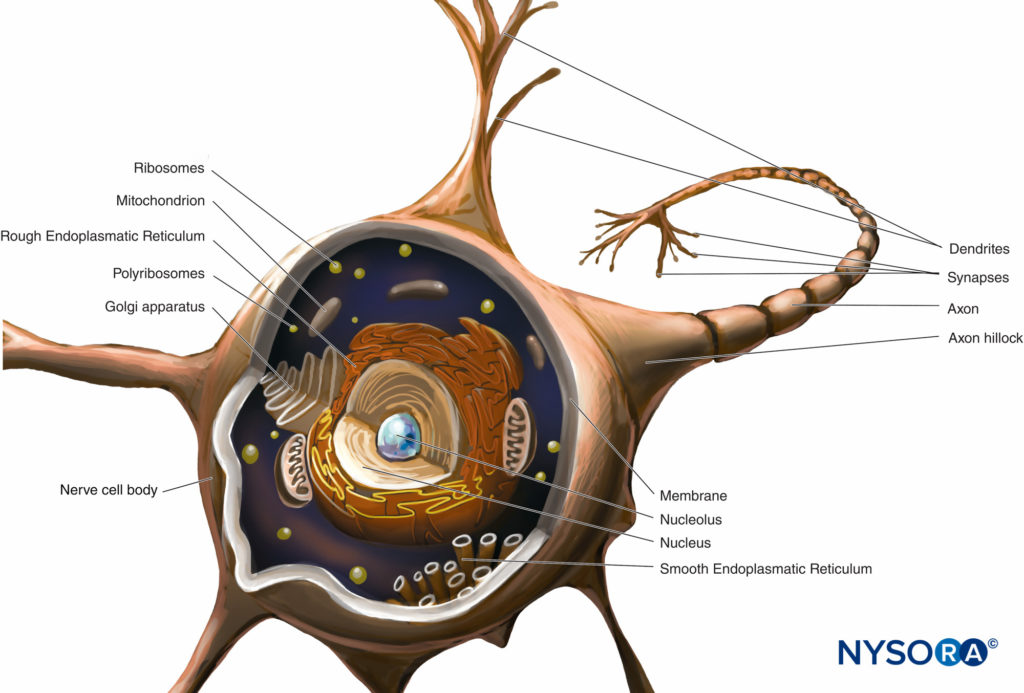
FIGURA 2. Diagrama de una neurona multipolar. El cuerpo de la célula nerviosa, las dendritas y la parte proximal del axón se encuentran dentro del SNC. Los axones que salen del SNC distales a los agujeros intervertebrales oa los agujeros del cráneo constituyen la parte principal del SNP.
Dendritas son elaboraciones de la membrana plasmática receptiva de la neurona. La mayoría de las neuronas poseen múltiples dendritas que normalmente surgen del cuerpo celular como troncos cortos únicos que se ramifican en ramas más pequeñas que se estrechan en los extremos. Los patrones de ramificación dendrita son característicos de cada tipo de neurona. La base de la dendrita contiene los mismos orgánulos que el cuerpo celular, excepto el aparato de Golgi. Muchos orgánulos se vuelven escasos o desaparecen hacia el extremo distal de la dendrita. La ramificación de dendrita da como resultado varias terminales sinápticas y permite que una neurona reciba e integre múltiples impulsos.
el axón Surge del cuerpo celular como un único proceso delgado, mucho más largo que las dendritas. Su grosor está directamente relacionado con la velocidad de conducción, que aumenta con el diámetro axonal. Algunos axones poseen ramas colaterales. La porción del axón entre el cuerpo celular y el comienzo de la vaina de mielina es el segmento inicial. Al final del axón, las ramificaciones pueden formar muchas ramas pequeñas. El citoplasma axonal se llama axoplasma.
Casi todas las moléculas de proteínas estructurales y funcionales se sintetizan en el cuerpo celular y se transportan a lugares distantes dentro de una neurona en un proceso conocido como transporte axonal. Crucial para las relaciones tróficas dentro del axón, el transporte axonal sirve como un modo de comunicación intracelular que transporta moléculas e información a lo largo de microtúbulos y filamentos intermedios desde el cuerpo de la célula neuronal hasta la terminal del axón (transporte anterógrado) o desde la terminal del axón hasta el cuerpo de la célula neuronal. (transporte retrógrado). Las neuronas se comunican con otras neuronas y con células efectoras por sinapsis. Estas uniones especiales entre las neuronas y las células efectoras facilitan la transmisión de los impulsos nerviosos de una neurona (presináptica) a otra neurona (postsináptica) o de los axones a las células efectoras (objetivo), como las células musculares y glandulares.
Las neuronas tienen una mayor variación en tamaño y forma que cualquier otro grupo de células en el cuerpo. Se clasifican morfológicamente en tres tipos principales según su forma y la disposición de sus procesos. El tipo de neurona más común, multipolar, posee un solo axón con varios arreglos de múltiples dendritas que emanan del cuerpo celular. La mayoría de las neuronas multipolares (Figura 2 y XNUMX y Figura 3) son neuronas motoras. Un segundo tipo de neurona, unipolar o pseudounipolar (Figura 3 y XNUMX), posee un solo proceso, el axón que emana del cuerpo celular y se abre en las ramas periférica y central poco después de abandonar el cuerpo celular. La rama central ingresa al SNC, mientras que la rama periférica procede a su receptor correspondiente en el cuerpo. Cada una de las dos ramas es morfológicamente axonal y puede propagar impulsos nerviosos, aunque la parte más distal de la rama periférica arboriza, indicando su función receptora. La mayoría de las neuronas unipolares son neuronas sensoriales, cuyos cuerpos celulares están situados en los ganglios de la raíz dorsal de los nervios espinales y en los ganglios sensoriales de los nervios craneales. El tercer tipo de neurona, bipolar, posee dos procesos que emanan del cuerpo celular: una sola dendrita y un solo axón. Solo se pueden encontrar en algunos nervios craneales.
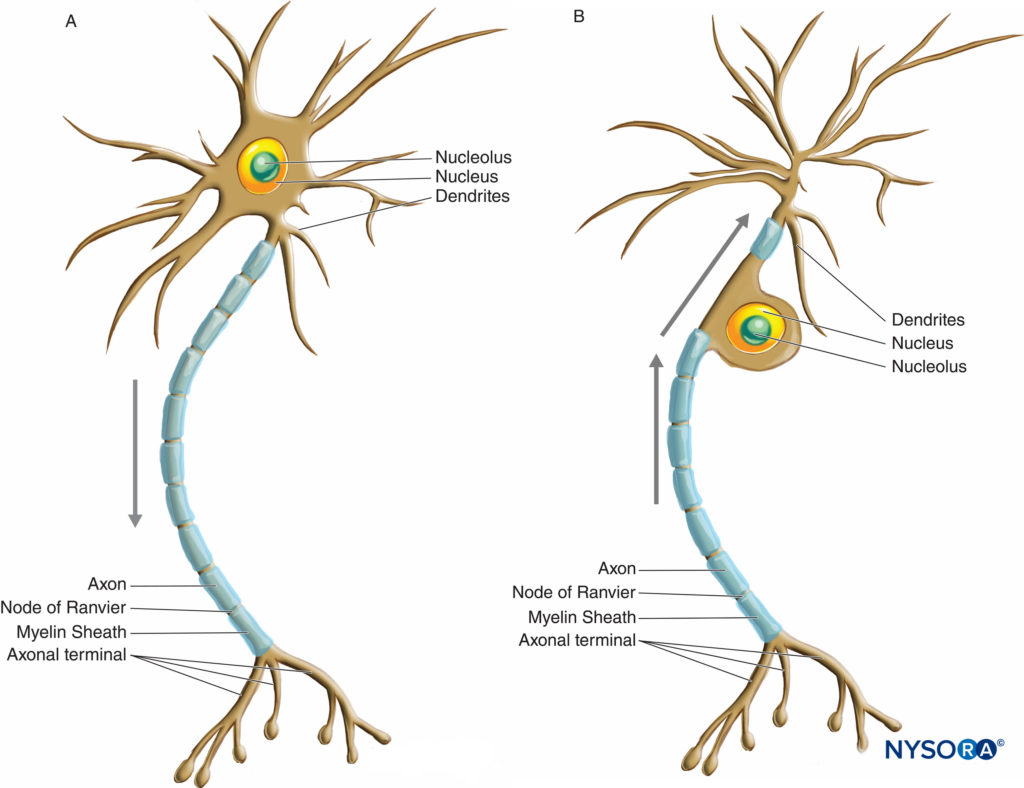
FIGURA 3. Diagrama que ilustra una neurona multipolar (A) y unipolar o pseudounipolar (B). Las flechas indican la dirección de propagación del impulso nervioso.
Funcionalmente, el sistema nervioso tiene somáticas y autonómico componentes Las fibras nerviosas que inervan los tejidos derivados de los somitas (músculos y piel) se describen como somáticas; Las fibras nerviosas que inervan los derivados endodérmicos u otros mesodérmicos (órganos internos) son viscerales. El sistema nervioso somático controla funciones que están bajo control voluntario consciente con la excepción del arco reflejo. Proporciona inervación sensorial y motora a todas las partes del cuerpo excepto a las vísceras, los músculos lisos, el músculo cardíaco y las glándulas. El sistema nervioso autónomo proporciona inervación involuntaria eferente a los músculos y glándulas lisos y cardíacos. También proporciona la inervación sensorial aferente de las vísceras (dolor y reflejos autónomos).
Axones eferentes
Los axones eferentes surgen del sistema nervioso somático o autónomo. Las neuronas eferentes (motoras) somáticas inervan el músculo esquelético y tienen cuerpos celulares ubicados en los núcleos motores somáticos del tronco del encéfalo (nervios craneales) o en los cuernos ventrales de la médula espinal (nervios espinales).
Las neuronas eferentes viscerales preganglionares de la parte simpática del sistema nervioso autónomo surgen de la columna intermediolateral de la médula espinal entre los niveles T1 y L2 y hacen sinapsis en paravertebral or prevertebral Ganglios (preaórticos). Los nervios periféricos contienen fibras simpáticas tanto preganglionares como posganglionares. Las neuronas eferentes viscerales preganglionares de la parte parasimpática del sistema nervioso autónomo surgen de los núcleos parasimpáticos dentro del tronco encefálico (parte craneal del sistema nervioso parasimpático) o de la médula espinal sacra entre los segmentos S2 y S4 (parte sacra del sistema nervioso parasimpático). Solo las fibras parasimpáticas preganglionares viajan a lo largo de los nervios periféricos para hacer sinapsis en los ganglios intramurales en la pared de los órganos diana.
Axones aferentes
Los axones aferentes son somáticos o viscerales y tienen cuerpos celulares en los ganglios de la raíz dorsal de los nervios espinales o en los ganglios sensoriales de los nervios craneales. Las neuronas aferentes somáticas (sensoriales) transmiten impulsos desde los receptores para el tacto, la temperatura o el dolor (nociceptores) ubicados en la pared del cuerpo (piel) y desde los propioceptores en los músculos esqueléticos y las articulaciones. Las neuronas aferentes viscerales transmiten información desde las vísceras (interoceptores y nociceptores). Los axones aferentes viscerales viajan a lo largo de las fibras eferentes viscerales y pasan a través de las ramas comunicantes y las raíces dorsales de los nervios espinales oa lo largo del nervio vago para ingresar al SNC.
CÉLULAS DE SCHWANN
Los axones de los nervios periféricos están envueltos por células de Schwann. Su vaina de mielina (plasmalema modificado) separa los axones del endoneuro. Las células de Schwann se distribuyen a lo largo de los axones en cadenas longitudinales dependiendo de la mielinización a lo largo del axón. La diferenciación coordinada de los axones y sus células mielinizantes requiere una estrecha comunicación entre las neuronas y la glía. Las señales proporcionadas por los axones regulan la proliferación, supervivencia y diferenciación de las células gliales. Por otro lado, las señales gliales recíprocas afectan el citoesqueleto axonal y el transporte. y son necesarios para la supervivencia axonal y regeneración. Las células de Schwann también tienen una función de guía para los axones en crecimiento, lo que indica que la glía hace más que brindar apoyo al axón.
Los fenotipos de células de Schwann se caracterizan por morfologías distintas y expresión diferencial de proteínas de mielina, moléculas de adhesión celular, receptores, enzimas, proteínas de filamentos intermedios, canales iónicos y proteínas de matriz extracelular. Todas las células de Schwann están rodeadas por una lámina basal, cuyas moléculas de matriz extracelular, como la laminina, regulan aspectos clave del desarrollo de las células de Schwann.
CLASIFICACIÓN DE LAS FIBRAS NERVIOSAS
Las fibras nerviosas se clasifican según el diámetro axonal, la velocidad de conducción, el tipo de receptor y el grosor de la vaina de mielina.Mesa 1). La velocidad de conducción está relacionada con el diámetro axonal; es decir, cuanto más grande sea la fibra, más rápida será la conducción.
TABLA 1. Clasificación de las fibras nerviosas periféricas según el diámetro axonal, la velocidad de conducción, el tipo de receptor y el grosor de la vaina de mielina (mielinización).
| axonal Diámetro (μm) | Conducción Velocidad (M / s) | Fibras eferentes | Fibras aferentesa (De Receptores Cutáneos) | Fibras aferentes del esqueleto Músculos, tendones y articulaciones | mielinización |
|---|---|---|---|---|---|
| 12-20 | 60-120 30-70 | Aα (a las fibras musculares extrafusales) | Aα (de mecanorreceptores de rápida adaptación) | Ia (de husos musculares) Ib (de los órganos tendinosos de Golgi) | fuertemente mielinizado |
| 6-12 | 25-70 | Aβ (de mecanorreceptores de adaptación lenta) | II (de propioceptores conjuntos) | Mielinizados | |
| 3-8 | 15-30 | Aγ (a las fibras musculares intrafusales) | Mielinizados | ||
| 1-6 | 12-30 | Aδ (de nociceptores y termorreceptores térmicos y mecánicos, solo frío) | III (de propioceptores conjuntos y nociceptores conjuntos) | finamente mielinizado | |
| 1-3 | 3-15 | B (visceral preganglionar) | Mielinizados | ||
| 0.2-1.5 | 0.5-2 | C (visceral posganglionar) | C (de nociceptores y termorreceptores mecánicos: nociceptores polimodales fríos y calientes) | IV (de nociceptores articulares) | desmielinizado |
aLas fibras aferentes viscerales (de los interoceptores) se clasifican como fibras Aδ y C.
Fuente: Modificado con permiso de Cramer GD, Darby S: Anatomía básica y clínica de la columna vertebral, la médula espinal y el SNA, 2ª ed. Filadelfia: Elsevier/Mosby; 2005.
Consejos NYSORA
Cuanto más grande sea la fibra, más concentrado debe ser el anestésico local para afectar el bloqueo neural.
FIBRAS NERVIOSAS MIELÍNICAS
Las fibras nerviosas mielinizadas están envueltas por mielina, plasmalema muy extendido y modificado de las células de Schwann.Figuras 4 y 5). La formación de mielina comienza con la extensión del citoplasma de las células de Schwann y el desarrollo del mesaxón interno, que envuelve el axón varias veces. Durante el proceso de envoltura, el citoplasma casi se extruye entre el plasmalema. Las caras extracelulares opuestas del plasmalema se convierten en “la línea densa principal”, y las caras citoplasmáticas opuestas forman una “línea intraperiódica” de mielina. La estructura molecular propuesta de la mielina se ajusta al concepto de plasmalema como una bicapa lipídica con proteínas de membrana integrales y periféricas unidas al lado extracelular o citoplasmático del plasmalema. A diferencia de la mayoría de las membranas biológicas, la mielina tiene una proporción alta de lípidos a proteínas (70 % a 85 % de lípidos, 15 % a 30 % de proteínas), donde estas últimas sirven como proteínas estructurales, enzimas, canales de voltaje y transductores de señales.
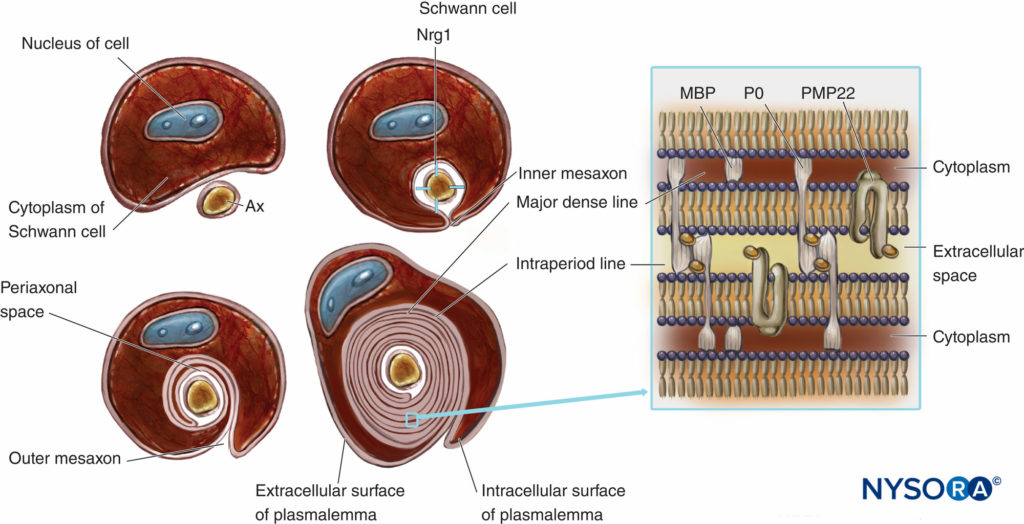
FIGURA 4. Presentación esquemática de la formación de mielina y esquema simplificado de su organización molecular. Para simplificar, no se dibuja la lámina basal de las células de Schwann. Nrg1 = neurregulina; MPB = proteína básica de mielina; P0 = proteína cero; PMP22 = proteína de membrana periférica de 22 kDa; Ax = axón. (Modificado con autorización de Ross M, Pawlina W: Histology: A Text and Atlas With Correlated Cell and Molecular Biology, 6.ª ed. Filadelfia: Wolters Kluwer; Lippincott Williams & Wilkins; 2011.)
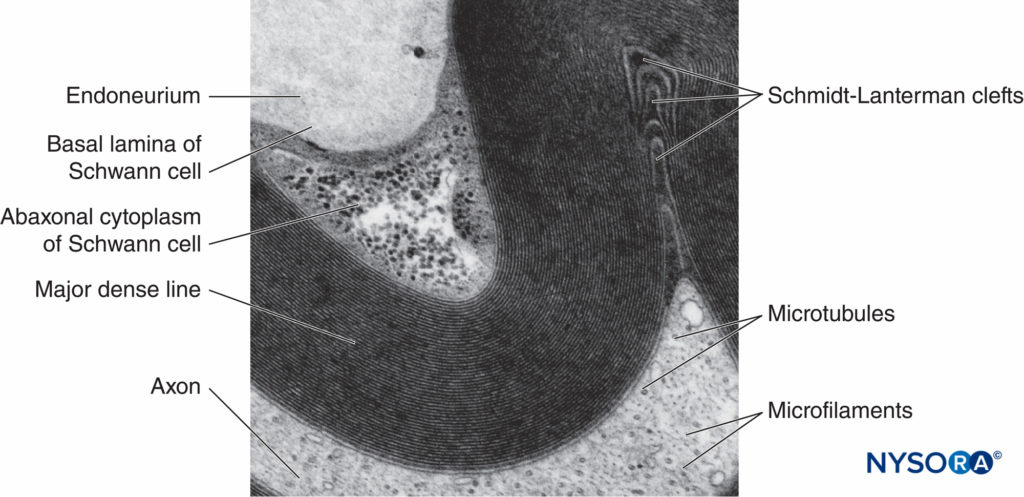
FIGURA 5. Micrografía electrónica de la fibra mielinizada. La mielina se visualiza como una serie de líneas alternas oscuras y menos oscuras. Biopsia de nervio sural humano.
La vaina de mielina envuelve el axón en segmentos. Las áreas del axón cubiertas por láminas concéntricas de mielina y una sola célula de Schwann productora de mielina se denominan entrenudos y varían en longitud de 200 a 1000 µm. Las interrupciones, que ocurren en la vaina de mielina a intervalos regulares a lo largo de los axones y exponen el axón, se denominan nódulos de Ranvier.Figura 6). Cada nodo indica una interfaz entre las vainas de mielina de dos células de Schwann diferentes ubicadas a lo largo del axón.
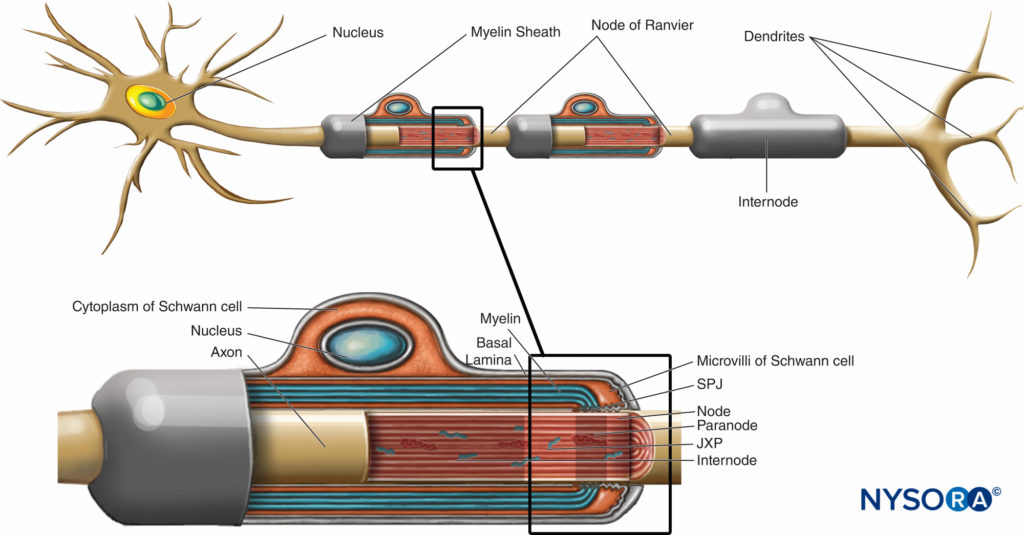
FIGURA 6. Distintos dominios de la región nodal. La región ocupada por distintas proteínas ubicadas en el axolema nodal se representa esquemáticamente en negro sobre el axón. SPJ = uniones septadas como; JXP = yuxtaparanodo. (Modificado con autorización de Poliak S, Peles E. The local difference of myelinated axons at nodes of Ranvier. Nat Rev Neurosci. 2003 Dec;4(12):968-980.)
La región nodal y sus alrededores se pueden subdividir en varios dominios (Figura 6 y XNUMX) que contienen un conjunto único de canales iónicos, moléculas de adhesión celular y proteínas adaptadoras citoplasmáticas. En el SNP, el nódulo está en contacto con las microvellosidades de las células de Schwann y está cubierto por su lámina basal.Figura 6 y XNUMX). Una característica importante de la nodal axolema es su alta densidad de Na activado por voltaje+ canales en comparación con el yuxtaparanodal axolema, que típicamente contiene una alta densidad de K+ . Na+ Los canales potencian el impulso nervioso de manera saltatoria (Figura 7) a lo largo de las fibras mielinizadas. Cuando se excita la membrana del nódulo, el circuito local que se genera no puede fluir a través de la vaina de mielina de alta resistencia. Por lo tanto, sale y despolariza la membrana en el siguiente nodo, que puede estar a 1 mm o más lejos. La baja capacitancia de la vaina significa que se requiere poca energía para despolarizar la membrana restante entre los nodos, lo que aumenta la velocidad de expansión del circuito local.
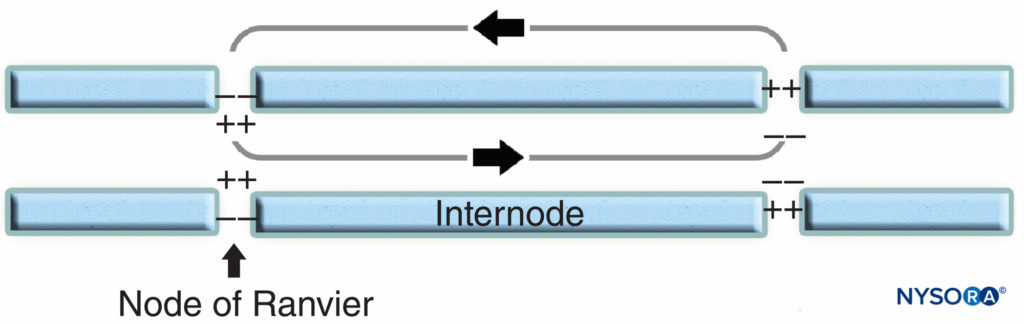
FIGURA 7. Conducción saltatoria en fibras nerviosas mielinizadas. Los canales de Na+, ubicados en el axolema nodal, potencian el impulso nervioso de manera saltatoria a lo largo de la fibra nerviosa mielinizada.
La mielinización es un ejemplo de comunicación de célula a célula en la que los axones interactúan con las células de Schwann. El número de capas de mielina está determinado por el axón y no por la célula de Schwann. El grosor de la vaina de mielina está regulado por un factor de crecimiento llamado neurregulina 1 (Nrg1). La compactación de la vaina de mielina está asociada con la expresión de proteínas específicas de mielina transmembrana como la proteína 0 (P0), una proteína de mielina periférica de 22 kilodaltons (PMP22) y una proteína básica de mielina (MBP). La ausencia de proteínas que regulan la formación de la vaina de mielina podría provocar hipomielinización o desmielinización severa en humanos y animales de experimentación.
FIBRAS NERVIOSAS AMIELÍNICAS
Los axones no mielinizados también están envueltos por células de Schwann y su lámina basal. Una célula de Schwann individual puede envolver uno o varios axones no mielinizados.Figuras 8 y 9). Las fibras amielínicas predominan en los nervios espinales cutáneos humanos, donde la proporción promedio de densidad de fibras amielínicas y mielínicas es de 3.7:1. En las fibras amielínicas, la velocidad de conducción es proporcional a la raíz cuadrada del diámetro de la fibra y es mucho más lenta en comparación con la conducción saltatoria en las fibras mielínicas.Tabla 1).
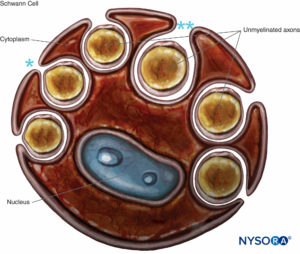
FIGURA 8. Célula de Schwann que engulle varios axones no mielinizados. Los labios del surco del citoplasma pueden cerrarse (*), formando el mesaxón, o abrirse (**). No se dibuja la lámina basal de la célula de Schwann.
REVESTIMIENTOS DE TEJIDO CONECTIVO DE NERVIOS PERIFÉRICOS
En un nervio periférico, las fibras nerviosas y las células de Schwann que las sostienen se mantienen unidas por tejido conectivo organizado en tres componentes distintivos que tienen características morfológicas y funcionales específicas. El epineuro forma el tejido conectivo más externo del nervio periférico, el perineuro rodea cada fascículo nervioso por separado, mientras que las fibras nerviosas individuales están incrustadas en el endoneuro. (Figuras 10 a 13).
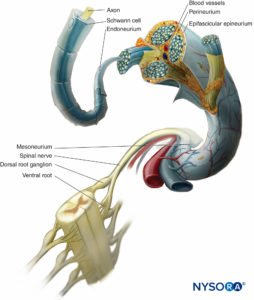
FIGURA 10. Revestimientos de tejido conectivo del nervio periférico. El diagrama demuestra la disposición del nervio periférico. Se amplía un segmento del nervio espinal para mostrar la relación de las fibras nerviosas con el tejido conjuntivo circundante (endoneurio, perineuro y epineuro).
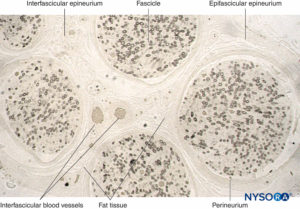
FIGURA 11. Sección semidelgada del nervio sural humano fijado en tetróxido de osmio. Las vainas de mielina se conservan y se tiñen de negro.
El perineuro rodea el fascículo nervioso. Rayas de tejido conectivo se originan en el epineuro epifascicular dentro del nervio como
epineuro interfascicular. El tejido adiposo y los vasos sanguíneos se localizan en el epineuro interfascicular.
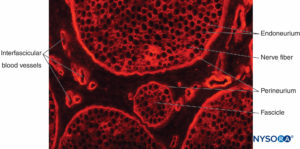
FIGURA 12. Sección transversal del nervio ciático del cerdo. Tinción inmunohistoquímica para colágeno. Los vasos sanguíneos discurren por el
epineuro interfascicular, que llena el espacio alrededor del perineuro y los fascículos.
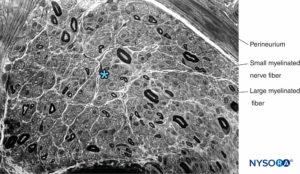
FIGURA 13. Sección semidelgada del nervio sural humano teñida con violeta de cresilo. Neuropatía axonal con pérdida predominante de fibras mielínicas grandes. * Espacio intrafascicular entre fibras mielinizadas (ocupado por endoneuro, núcleos de células de Schwann y fibras amielínicas).
epineuro
El epineuro es una condensación de un tejido conectivo areolar laxo que rodea un nervio periférico y une sus fascículos en un haz común.Figura 10 y XNUMX y Figura 11 y XNUMX).
El epineuro que se extiende entre los fascículos es el epineuro interfascicular o interno, mientras que el epineuro que rodea todo el tronco nervioso es el epineuro epifascicular o externo. llamado epineuro comprende del 30% al 75% del área de la sección transversal del nervio pero varía a lo largo del nervio. Es más grueso donde se continúa con la duramadre que cubre el SNC y más abundante en los nervios adyacentes a las articulaciones, donde los nervios están sujetos a presión. Por lo tanto, es probable que la susceptibilidad a la lesión por compresión sea mayor en los nervios unifasciculares que en los multifasciculares porque estos últimos tienen una mayor cantidad de epineuro. A medida que el nervio periférico se divide y se reduce el número de fascículos, el epineuro se adelgaza progresivamente y finalmente desaparece alrededor de los nervios monofasciculares.
El epineuro contiene colágeno, fibroblastos, mastocitos y células grasas. Los haces de colágeno tienen una orientación longitudinal predominante; sin embargo, un estudio de microscopía electrónica encontró colágeno epineural en haces de 10 a 20 µm de ancho dispuestos oblicuamente alrededor de la circunferencia del nervio. Las fibras elásticas también están presentes, particularmente adyacentes al perineuro, que se orientan principalmente longitudinalmente. Las fibras de colágeno y elásticas están alineadas y orientadas para evitar daños por estiramiento excesivo del haz de nervios, lo que sugiere que el epineuro está diseñado para acomodar el estiramiento.
El epineuro humano se construye predominantemente de colágeno tipo I y tipo III, predominando el tipo I. El diámetro de las fibrillas de colágeno tiene un promedio de 60 a 110 nm.
El tejido adiposo dentro de un nervio rodea los fascículos y forma vainas adiposas que separan los fascículos entre sí. El grosor de las vainas adiposas varía de un fascículo a otro y es mayor en los troncos nerviosos de mayor tamaño, destacando su función protectora al amortiguar los fascículos frente al daño por compresión. La pérdida de grasa epineural puede presentar un factor de riesgo de parálisis causadas por presión en pacientes postrados en cama y demacrados. Por el contrario, el exceso de tejido adiposo también puede retrasar la difusión del anestésico local inyectado cerca de un nervio, interfiriendo así con el bloqueo anestésico. El epineuro se continúa con el tejido conectivo llamado adventicia o mesoneurio que rodea el nervio cuando pasa a través, debajo o entre la fascia muscular, sirviendo como (1) un conducto para el anestésico local inyectado, (2) un camino que permite el deslizamiento del nervio, y (3) una capa de protección contra el trauma nervioso. Debido a que su unión es laxa, los nervios son relativamente móviles, excepto cuando están atados por vasos entrantes o ramas nerviosas salientes.
perineurio
El perineuro es un tejido conectivo especializado que rodea los fascículos nerviosos individuales (Figuras 10 y 12). Esta capa celular protectora es más delgada que el epineuro y separa el endoneuro del epineuro. El perineuro consta de capas alternas de células poligonales aplanadas, que se cree que se derivan de fibroblastos y tejido conectivo colágeno. cuya formación está controlada por las células de Schwann. Las células poligonales aplanadas, que constituyen las laminillas, están especializadas para funcionar como una barrera de difusión. El número de laminillas varía, dependiendo principalmente del diámetro del fascículo; cuanto más grande es el fascículo, mayor es el número de laminillas. En los troncos nerviosos de los mamíferos, el perineuro contiene de 15 a 20 capas de células. Las células contiguas en cada capa se interdigitan a lo largo de extensas uniones estrechas. Las células pueden ramificarse y dar lugar a procesos y contribuir a las laminillas adyacentes. Cada capa de células, encerrada por una lámina basal, puede alcanzar un grosor de hasta 0.5 µm en los nervios humanos.
Las fibras de colágeno se originan en una disposición en forma de celosía, en la que los haces están dispuestos de forma circular, longitudinal y oblicua. La capa de células perineurales más interna se adhiere a una capa límite distinta de fibras de colágeno densamente tejidas y fibroblastos subperineurales que unen mecánicamente el perineuro con el contenido endoneural. Las fibras de colágeno son predominantemente de tipo III, aunque también están presentes fibras de colágeno de tipo I. El diámetro de las fibrillas de colágeno es sustancialmente menor que el de las fibrillas epineurales, con un promedio de 52 nm en el nervio sural de rata. La lámina basal de las células poligonales está compuesta por colágenos IV y V, fibronectina, heparán sulfato proteoglicano, y laminina. La presencia ubicua de vesículas de pinocitosis ricas en enzimas fosforilantes subyace a la suposición de que el perineurio funciona como una barrera de difusión metabólicamente activa, desempeñando un papel esencial en el mantenimiento del medio osmótico y la presión del fluido dentro del endoneuro. Por ejemplo, en uno de nuestros estudios, las células inflamatorias acumuladas entre los fascículos nerviosos en lechones después de la exposición del nervio al gel de ultrasonido no penetraron en el perineuro. Debido a su estructura celular fuertemente adherida y al colágeno más orientado longitudinalmente, el perineuro es menos tolerante a la elongación que el epineuro. En el conejo, la falla mecánica durante la elongación coincidió con una ruptura del perineuro mientras que el epineuro permaneció intacto. La integridad de la barrera de difusión se mantuvo después de 2 horas de elongación del 15 %, mientras que la elongación del 27 % provocó una interrupción perineural aguda.
endoneuro
El endoneuro comprende tejido conjuntivo intrafascicular laxo que no incluye las particiones perineurales que subdividen los fascículos y rodea las células de Schwann.Figura 12 y XNUMX). Aproximadamente 40 a 50 % del espacio intrafascicular está ocupado por elementos no neurales (es decir, distintos del axón y las células de Schwann), de los cuales el líquido endoneural y la matriz de tejido conectivo ocupan 20 a 30 %. Hay variaciones sustanciales entre los nervios en diferentes especies. y grupos de edad.
El endoneuro está compuesto por fibras de colágeno (producidas por las células de Schwann y los fibroblastos subyacentes); los componentes celulares están bañados en líquido endoneural, contenido en espacios intrafasciculares sustanciales. Las fibras nerviosas tienden a agruparse en pequeños haces con hendiduras intermedias. La presión del líquido endoneural es ligeramente superior a la del epineuro circundante. Se cree que este gradiente de presión minimiza la contaminación endoneural por sustancias tóxicas externas al haz de nervios.
Las fibrillas de colágeno endoneurales son más pequeñas que las del epineuro y varían entre 30 y 65 nm de diámetro en humanos. Las fibrillas corren paralelas y alrededor de las fibras nerviosas, uniéndolas en fascículos o haces. Muestran condensaciones alrededor de capilares y fibras nerviosas. Cerca del extremo distal del axón, el endoneuro se reduce a unas pocas fibras reticulares que rodean la lámina basal de las células de Schwann. Los tipos de colágeno I, II y III están presentes en el endoneuro.
Los constituyentes celulares del endoneuro son fibroblastos, células endoteliales de los capilares, mastocitos y macrófagos. Los mastocitos se encuentran en cantidades variables, siendo especialmente numerosos a lo largo de los vasos sanguíneos. Los macrófagos representan del 2% al 4% de los núcleos intrafasciculares en el nervio periférico de rata y son las principales células presentadoras de antígenos del nervio periférico. Eliminan proteínas extracelulares y las presentan a las células T que emergen de la circulación. Los macrófagos median en la vigilancia inmunológica y participan en la reparación del tejido nervioso. Después de una lesión nerviosa, proliferan y fagocitan activamente los desechos de mielina.
La matriz extracelular es rica en glicoproteínas, glucosaminoglucanos y proteoglucanos. Los mejor caracterizados de estos incluyen la glucoproteína fibronectina, la tenascina C, la trombospondina y los proteoglucanos versicano y decorina del sulfato de condroitina. La expresión de estas moléculas cambia después de la lesión nerviosa, por lo que son potencialmente relevantes durante la regeneración nerviosa.
Desde un punto de vista hidrodinámico, los diversos tejidos que componen un nervio periférico se pueden dividir en el tejido conectivo expansible, laxo y de alta distensibilidad del epineuro y los fascículos y haces fasciculares disgregables y de baja distensibilidad, densamente empaquetados dentro del perineuro. Estas diferencias anatómicas entre los tejidos conectivos y los fascículos o sus haces explican por qué una inyección en los fascículos requiere más fuerza (presión) que una inyección en el tejido conjuntivo laxo del epineuro.
Consejos NYSORA
- El perineurio es un tejido duro y resistente, que tiende a escaparse al avanzar lentamente una aguja roma y de bisel corto durante el procedimiento de bloqueo nervioso.
- Se requiere una mayor fuerza (presión) para una inyección en un fascículo de baja distensibilidad en comparación con el epineuro de alta distensibilidad.
- En las regiones interescalenica y supraclavicular del plexo braquial, los nervios están más densamente empaquetados y
- oligofasciculares, mientras que más distalmente son polifasciculares con mayor cantidad de tejido estromal.
- Los nervios multifasciculares son menos susceptibles a lesiones en comparación con los monofasciculares debido a un diámetro fascicular reducido y una mayor protección epineural.
- La abundancia de tejido epineural laxo ofrece una explicación de por qué la mayoría de las inyecciones intraneurales (intraneurales, pero extrafasciculares) no provocan una lesión nerviosa manifiesta.
LA REGIÓN DE TRANSICIÓN CENTRO-PERIFÉRICO
La transición entre el SNC y el SNP en las raíces de los nervios craneales y espinales se conoce como el central-periférico región de transición or SNC-SNP frontera (Figura 14). Representa un cambio abrupto en el tipo de mielina, elementos de sostén y vascularización. Los principales componentes gliales en el SNC son los astrocitos y los oligodendrocitos, mientras que en el SNP los principales componentes son las células de Schwann. Las raíces nerviosas de los nervios espinales están bañadas en líquido cefalorraquídeo. los región de transición es la longitud de la raicilla que contiene tejido nervioso central y periférico. Los detalles de la transición que distinguen la envoltura de las raíces espinales con las meninges y los revestimientos de tejido conectivo de los nervios periféricos no se han aclarado por completo. Sin embargo, sus arreglos estructurales están bien documentados en estudios de microscopía electrónica.
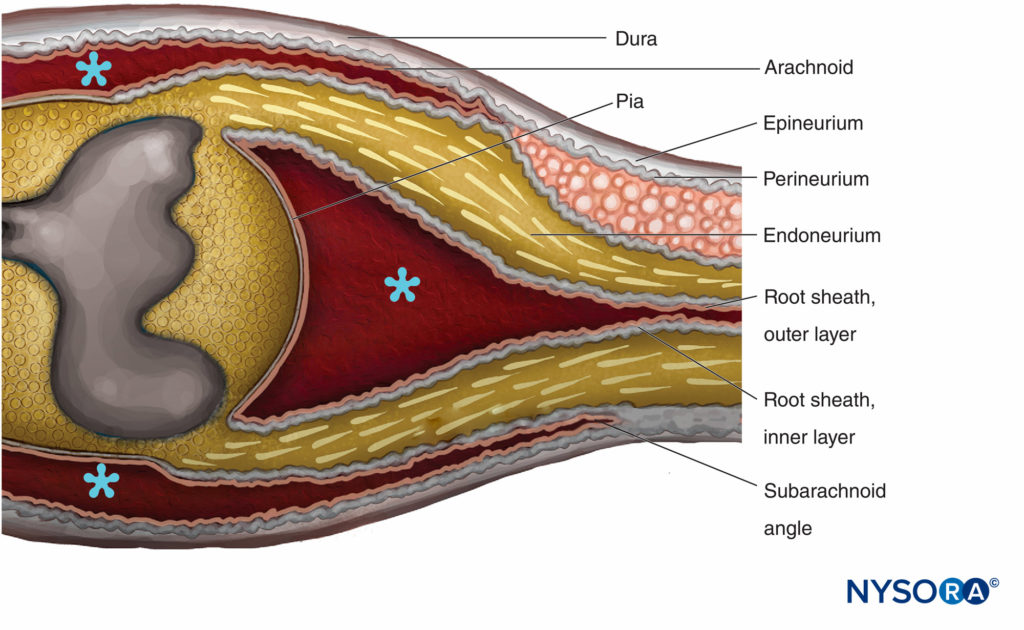
FIGURA 14. Región de transición centro-periférica. El epineuro se continúa con la duramadre. La aracnoides se refleja sobre las raíces en el ángulo subaracnoideo y se continúa con la capa externa de la vaina radicular. En la unión con la médula espinal, la capa externa se continúa con la piamadre. El perineurio se divide en dos capas en el ángulo subaracnoideo: la capa externa se separa de la raíz nerviosa y discurre entre la duramadre y la aracnoides; la capa interna se adhiere a las raíces espinales y constituye la capa interna de la vaina de la raíz. El ganglio espinal está incrustado en el perineuro. * Espacio subaracnoideo. (Reproducida con autorización de Haller FR, Low FN. The fine structure of the periférico nervio root sheath in the subaracnoid space in the rat and other Laboratory Animals. Am J Anat. 1971 May;131(1):1-19.
Los componentes celulares del endoneuro en las raíces espinales se asemejan a los de los nervios periféricos. La cantidad de colágeno es sustancialmente menor y no se organiza en vainas alrededor de las fibras nerviosas. La región en la que las raíces espinales se unen a la médula espinal se caracteriza por una transición de diseño irregular desde el nervio periférico al SNC, la zona de Ober-steiner-Redlich donde las células de Schwann son reemplazadas por oligodendrocitos. La porción central de la raíz está limitada en su periferia por la glía marginal, compuesta por astrocitos cubiertos por una lámina basal.
Las raíces espinales atraviesan el espacio subaracnoideo cubierto por una vaina radicular multicelular y penetran la duramadre en el ángulo subaracnoideo.Figura 14 y XNUMX). Externas al ángulo subaracnoideo, las raíces nerviosas poseen epineuro, perineuro y endoneuro como en los troncos nerviosos periféricos. El epineuro es la continuación de la duramadre espinal, mientras que el endoneuro se desarrolla distal a la unión de las raíces con el tejido nervioso central. El perineuro envuelve los ganglios espinales y está proximal a ellos. Se divide en las capas externas que pasan entre la duramadre y la aracnoides para formar el “mesotelio dural”, mientras que las capas internas del perineurio continúan sobre las raíces como la “capa interna de la vaina de la raíz”.
La vaina de la raíz está compuesta por láminas celulares y fibrosas divididas en dos capas. La capa externa consta de células asociadas de forma laxa que bordean el espacio subaracnoideo. Donde las raíces se adhieren a la médula espinal, las células de la capa externa de la vaina de la raíz se continúan con la piamadre. En el ángulo subaracnoideo, la capa externa se refleja en las inversiones meníngeas externas de la médula espinal (aracnoidea unida a la capa interna de la duramadre espinal). La capa interna de la vaina radicular consta de células aplanadas que están estrechamente asociadas entre sí, están revestidas intermitentemente con una lámina basal y se asemejan al perineuro, pero no se clasifican como células perineurales. Se continúa con el perineuro en la periferia.
El espacio subaracnoideo se abre en un receso lateral que se extiende entre las raíces ventral y dorsal y puede constituir un la comunicación entre los espacios subaracnoideo y endoneural. Esta comunicación tiene relevancia clínica porque permite que la inflamación se extienda desde el espacio subaracnoideo al endoneuro en el caso de las polirradiculoneuritis.
Consejos NYSORA
- La inyección de anestésico local dentro del manguito epineural durante la realización de bloqueos interescalénicos o del plexo lumbar puede conducir a la anestesia espinal debido a la extensión del manguito dural más allá del agujero intervertebral.
- Durante la realización del bloqueo del plexo lumbar, se observa la propagación epidural del anestésico local, en particular cuando se usa una presión (fuerza) de inyección alta durante el proceso de inyección.
APORTE VASCULAR DE LOS NERVIOS PERIFÉRICOS
El nervio periférico es una estructura bien vascularizada, irrigada por vasos que se originan en las grandes arterias y venas cercanas, así como en vasos sanguíneos periostales y musculares adyacentes más pequeños (Figura 12 y XNUMX). Los nervios periféricos tienen dos sistemas vasculares separados, funcionalmente independientes: un sistema extrínseco (vasos nutritivos regionales y vasos epineurales) y un sistema intrínseco (microvasos en el endoneuro). Hay abundantes anastomosis entre los dos sistemas, lo que da como resultado una superposición considerable entre los territorios de las arterias segmentarias.
El epineuro se caracteriza por un plexo vascular predominantemente longitudinal. Las arteriolas transperineurales, de 10 a 25 µm de diámetro, pasan del epineuro al endoneuro a través de manguitos de tejido perineural. Su trayecto a través del perineuro es oblicuo, lo que los hace potencialmente susceptibles a cambios en la presión intrafascicular o extrafascicular. Los vasos epineurales y perineurales tienen un rico plexo perivascular de nervios peptidérgicos, serotoninérgicos y adrenérgicos que desempeñan un papel importante en el control neurogénico del flujo sanguíneo endoneural.
La vasculatura endoneural se destaca por sus diferencias anatómicas con respecto a un lecho capilar convencional, aunque, fisiológicamente, cumple funciones metabólicas similares. Las arteriolas transperineurales pierden gradualmente su cubierta muscular continua y se convierten en capilares postarteriolares. Los capilares endoneurales tienen un diámetro y distancias intercapilares atípicamente mayores que los de muchos otros tejidos. Tal angioarquitectura sugiere una menor capacidad de intercambio. Las arteriolas endoneurales tienen una capa de músculo liso poco desarrollada y, por lo tanto, tienen una capacidad limitada para la autorregulación. La densidad de microvasos endoneurales varía significativamente a lo largo de los nervios periféricos; estas variaciones se correlacionan con la susceptibilidad a la neuropatía isquémica. Este patrón único de vasos, junto con el alto flujo sanguíneo basal en relación con los requisitos metabólicos del nervio, confiere un alto grado de resistencia a la isquemia, de modo que la disfunción nerviosa no ocurre durante la isquemia aguda hasta que el flujo sanguíneo es casi nulo. La característica sobresaliente del sistema neurovascular periférico es su flexibilidad. Los nervios periféricos pueden movilizarse quirúrgicamente, cortando sus vasos de nutrición sin consecuencias clínicas, en un grado sorprendente. Sin embargo, la distribución de la circulación dentro del endoneuro es sumamente sensible a la manipulación física y química.
Consejos NYSORA
- Los nervios periféricos son relativamente resistentes a la isquemia porque la disfunción nerviosa solo puede ocurrir cuando el flujo sanguíneo es casi nulo.
- Los anestésicos locales tienen la capacidad de contraer la vasculatura y disminuir el flujo de sangre a los nervios.
CAMBIOS EN LOS NERVIOS PERIFÉRICOS RELACIONADOS CON LA EDAD
Un SNP envejecido intacto se caracteriza por varios cambios estructurales, funcionales y bioquímicos extensos, que se han documentado tanto en fibras mielinizadas como amielínicas. En los ancianos, la densidad de fibras mielinizadas disminuye. Una relación regular entre la longitud internodal y el diámetro de la fibra se vuelve menos precisa con el envejecimiento. Esto se asocia con desmielinización y remielinización segmentaria y la degeneración y regeneración axonal clínicamente evidente como neuropatía periférica leve.
En fibras amielínicas, se han informado cambios regresivos atribuidos al envejecimiento. En los complejos de fibras amielínicas de los nervios que envejecen, aumenta la proporción de bandas de células de Schwann desprovistas de axones (las llamadas bolsas de colágeno; véase Figura 9 y XNUMX). Un cambio temprano relacionado con la edad parece ser la gemación de los procesos de células de Schwann en numerosas lenguas aplanadas, que generalmente ocurren en grupos. El índice perineural (relación entre el grosor del perineurio y el diámetro del fascículo) muestra una tendencia a aumentar con la edad, lo más probable es que refleje la pérdida de fibras nerviosas relacionada con la edad.
El envejecimiento se asocia con una disminución del número de capilares endoneurales y un aumento del grosor de las paredes capilares y del perineuro. La tasa de regeneración axonal se vuelve más lenta a medida que disminuye la densidad y el número de axones en regeneración. El envejecimiento también perjudica el brote terminal de axones regenerados y el brote colateral de axones adyacentes intactos, lo que limita aún más la reinervación y la recuperación funcional.
La causa de los cambios relacionados con el envejecimiento es incierta. Aún no se ha establecido si son el resultado del envejecimiento neuronal, que da lugar a la degeneración axonal distal y la desmielinización secundaria, oa factores locales en los nervios, como la isquemia o las consecuencias de traumatismos menores repetidos. Sin embargo, los cambios relacionados con la edad en los nervios periféricos probablemente se deban al efecto acumulativo de por vida de diversos factores patogénicos modificados por determinantes genéticos y por una disminución gradual de la capacidad regenerativa.
Consejos NYSORA
- Debido a la degeneración nerviosa relacionada con la edad, es posible que se necesite menos anestésico local a una concentración más baja para el bloqueo nervioso.
- Los cambios relacionados con la edad del nervio periférico pueden ser responsables de las imágenes ultrasonográficas típicamente más pobres de los nervios periféricos en los ancianos en comparación con los sujetos más jóvenes.
RESPUESTA DEL NERVIO PERIFÉRICO A LA LESIÓN
Las lesiones de los nervios periféricos dan como resultado la pérdida de funciones motoras, sensoriales y autonómicas en los segmentos denervados del cuerpo debido a la interrupción de los axones, la degeneración de las fibras nerviosas distales y la muerte final de las neuronas axotomizadas. Los déficits funcionales causados por lesiones nerviosas pueden compensarse mediante la reinervación de los objetivos denervados mediante la regeneración de los axones lesionados o mediante la ramificación colateral de los axones no lesionados y la remodelación de los circuitos del sistema nervioso relacionados con las funciones perdidas. La regeneración del nervio es posible si los extremos cortados permanecen cerca uno del otro de lo contrario, es posible que la regeneración no sea completa o exitosa.
Después de una lesión, la neurona intenta reparar el daño, regenerar el proceso y restaurar la función iniciando una serie de eventos estructurales y metabólicos llamados reacción del axón. Las reacciones al trauma se localizan en tres regiones de la neurona: en el sitio del daño (cambios locales), distal al sitio del daño (cambios anterógrados) y proximal al sitio del daño (cambios retrógrados). La reacción local a la lesión implica la eliminación de desechos por parte de las células neurogliales. La porción del axón distal a una lesión sufre degeneración y es fagocitada. La porción proximal del axón lesionado sufre una degeneración seguida por el brote de un nuevo axón cuyo crecimiento está dirigido por las células de Schwann.
Consejos NYSORA
- El umbral de estimulación eléctrica para una respuesta motora del nervio ciático aumenta en pacientes con gangrena del pie diabético, lo que puede afectar la identificación del nervio.
- Muchas lesiones nerviosas posteriores al procedimiento ocurren en nervios con patología preexistente.
RESUMEN
El conocimiento de que la anatomía neural es única en diferentes sitios anatómicos es esencial para una práctica segura y eficaz de la anestesia regional. Comprender la estructura de los nervios periféricos y sus implicaciones al usar monitores de última generación, que incluyen ultrasonografía, estimulación nerviosa y monitoreo de la presión de inyección, es útil para minimizar el potencial de lesiones al paciente.
Referencias
- Jessen KR, Mirsky R: El origen y desarrollo de las células gliales en los nervios periféricos. Nat Rev Neurosci 2005;6(9):671–682.
- Williams P: Anatomía de Grey, 38ª ed. Churchill Livingstone, 1995.
- Gartner L, Hiatt J: Libro de texto en color de histología, 2.ª ed. Saunders, 2001.
- Ross M, Pawlina W: Histología: un texto y un atlas con biología celular y molecular correlacionada, 6.ª ed. Wolters Kluwer Lippincott Williams & Wilkins, 2011.
- Thomas P, Berthold C, Ochoa J: Anatomía microscópica del sistema nervioso periférico. En Dyck P, Thomas P (eds): Neuropatía periférica, 3ra ed. Saunders, 1993, págs. 28–91.
- Brushart T: Reparación de nervios. Prensa de la Universidad de Oxford, 2011.
- Palay SL, Sotelo C, Peters A, Orkand PM: El axón hillock y el segmento inicial. J Cell Biol 1968;38(1):193–201.
- Poliak S, Peles E: La diferenciación local de los axones mielinizados en los nodos de Ranvier. Nat Rev Neurosci 2003;4(12):968–980.
- Colognato H, Baron W, Avellana-Adalid V, et al: Las integrinas del SNC cambian la señalización del factor de crecimiento para promover la supervivencia dependiente del objetivo. Nat Cell Biol 2002;4(11):833–841.
- Fernandez PA, Tang DG, Cheng L, Prochiantz A, Mudge AW, Raff MC: Evidencia de que la neurregulina derivada del axón promueve la supervivencia de oligodendrocitos en el nervio óptico de rata en desarrollo. Neurona 2000;28(1):81–90.
- de Waegh SM, Lee VM, Brady ST. Modulación local de la fosforilación de neurofilamentos, calibre axonal y transporte axonal lento por células mielinizantes de Schwann. Cell 1992;68(3):451–463.
- Griffiths I, Klugmann M, Anderson T, et al: Inflamaciones y degeneración axonal en ratones que carecen del principal proteolípido de la mielina. Ciencia 1998; 280 (5369): 1610–1613.
- Lappe-Siefke C, Goebbels S, Gravel M, et al: La interrupción de Cnp1 desacopla las funciones oligodendrogliales en el soporte axonal y la mielinización. Nat Genet 2003;33(3):366–374.
- Nadim W, Anderson PN, Turmaine M: El papel de las células de Schwann y los tubos de lámina basal en la regeneración de axones a través de largos tramos de injertos de nervio congelado. Neuropathol Appl Neurobiol 1990;16(5): 411–421.
- Noakes PG, Bennett MR: El crecimiento de los axones en los músculos en desarrollo de la extremidad anterior del pollo está precedido por células que se tiñen con anticuerpos de células de Schwann. J Comp Neurol 1987;259(3):330–347.
- Court FA, Wrabetz L, Feltri ML: Lámina basal: las células de Schwann se envuelven al ritmo del espacio-tiempo. Curr Opin Neurobiol 2006;16(5):501–507.
- Darby S, Frysztak R: Neuroanatomía de la médula espinal. En Cramer GD, Darby S (eds): Basic and Clinical Anatomy of the Spine, Spinal Cord, and ANS, 2nd ed. Elsevier Mosby, 2005, págs. 339–410.
- Morell P, Quarles R: Arquitectura molecular de la mielina. En Siegel G, Agranoff B, Albers R (eds): Neuroquímica básica: aspectos moleculares, celulares y médicos, 6.ª ed. Lippincott-Raven, 1999, págs. 51–71.
- Ritchie JM, Rogart RB: Densidad de canales de sodio en fibras nerviosas mielinizadas de mamíferos y naturaleza de la membrana axonal debajo de la vaina de mielina. Proc Natl Acad Sci USA 1977;74(1):211–215.
- Wang H, Kunkel DD, Martin TM, Schwartzkroin PA, Tempel BL: canales de K+ heteromultiméricos en regiones terminales y yuxtaparanodales de neuronas. Naturaleza 1993;365(6441):75–79.
- Thaxton C, Pillai AM, Pribisko AL, Dupree JL, Bhat MA: Los nodos de Ranvier actúan como barreras para restringir la invasión de los dominios paranodales flanqueantes en los axones mielinizados. Neurona 2011;69(2):244–257.
- Waxman SG, Ritchie JM: Disección molecular del axón mielinizado. Ann Neurol 1993;33(2):121–136.
- Ochoa J, Mair WG: El nervio sural normal en el hombre. I. Ultraestructura y número de fibras y células. Acta Neuropathol 1969;13(3):197–216.
- Millesi H, Terzis J: Nomenclatura en cirugía de nervio periférico. En Terzis J (ed): Microreconstrucción de lesiones nerviosas. Saunders, 1987, págs. 3–13.
- Sala-Blanch X, Vandepitte C, Laur JJ, et al: Una revisión práctica de las inyecciones perineurales versus intraneurales: Una llamada para una nomenclatura estándar. Int Anesthesiol Clin 2011;49(4):1–12.
- Sunderland S, Bradley KC: El perineuro de los nervios periféricos. Rec. Anat 1952;113(2):125–141.
- Sunderland S: Los tejidos conectivos de los nervios periféricos. Cerebro 1965;88(4):841–854.
- Ushiki T, Ide C: organización tridimensional de las fibrillas de colágeno en el nervio ciático de rata según lo revelado por microscopía electrónica de transmisión y de barrido. Cell Tissue Res 1990;260(1):175–184.
- Tomás PK. El tejido conectivo del nervio periférico: un estudio de microscopio electrónico. J Anat 1963;97:35–44.
- Thomas PK, Bhagat S: El efecto de la extracción del contenido intrafascicular de los troncos nerviosos periféricos en la estructura perineural. Acta Neuropathol 1978;43(1–2):135–141.
- Lorimier P, Mezin P, Labat Moleur F, Pinel N, Peyrol S, Stoebner P: Localización ultraestructural de los principales componentes de la matriz extracelular en el nervio de rata normal. J Histochem Cytochem 1992;40(6):859–868.
- Reina MA, Lopez A, De Andres JA: [Tejido adiposo dentro de los nervios periféricos. Estudio del nervio ciático humano]. Rev Esp Anestesiol Reanim 2002;49(8):397–402.
- Mirsky R, Parmantier E, McMahon AP, Jessen KR: El erizo del desierto derivado de células de Schwann señala la formación de la vaina nerviosa. Ann NY Acad Sci 1999;883:196–202.
- Shanthaveerappa TR, Bourne GH: Epitelio perineural: un nuevo concepto de su papel en la integridad del sistema nervioso periférico. Ciencia 1966; 154 (3755): 1464–1467.
- Lehmann HJ: [Estructura y función de la barrera de difusión perineural]. Z Zellforsch Mikrosk Anat 1957;46(2):232–241.
- Eldridge CF, Sanes JR, Chiu AY, Bunge RP, Cornbrooks CJ: proteoglicano de sulfato de heparán asociado a la lámina basal en el SNP de rata: caracterización y localización mediante anticuerpos monoclonales. J Neurocytol 1986;15(1):37–51.
- Paetau A, Mellstrom K, Vaheri A, Haltia M: Distribución de una importante proteína del tejido conectivo, la fibronectina, en tejido nervioso humano normal y neoplásico. Acta Neuropathol 1980;51(1):47–51.
- Stopar-Pintaric T, Cvetko E, Strbec M, et al: cambios inflamatorios intraneurales y perineurales en lechones después de la inyección de gel de ultrasonido, endotoxina, NaCl al 0.9% o inserción de aguja sin inyección. Anaesth Analg 2014;115:1–6.
- Rydevik BL, Kwan MK, Myers RR, et al: Un estudio mecánico e histológico in vitro del estiramiento agudo en el nervio tibial de conejo. J Orthop Res 1990;8(5):694–701.
- Olsson Y: Microambiente del sistema nervioso periférico en condiciones normales y patológicas. Crit Rev Neurobiol 1990;5(3): 265–311.
- Jacobs JM, Love S: Morfología cualitativa y cuantitativa del nervio sural humano a diferentes edades. Cerebro 1985; 108 (Parte 4): 897–924.
- Powell HC, Myers RR, Costello ML, Lampert PW: Presión del fluido endoneural en la degeneración walleriana. Ann Neurol 1979;5(6):550–557.
- Gamble HJ, Eames RA. Un estudio de microscopio electrónico de los tejidos conectivos del nervio periférico humano. J Anat 1964;98:655–663.
- Salonen V, Roytta M, Peltonen J: Los efectos de la transección del nervio en las vainas de fibrillas de colágeno endoneurales. Acta Neuropathol 1987;74(1):13–21.
- 45. Oldfors A: macrófagos en nervios periféricos. Un estudio histoquímico ultraestructural y enzimático en ratas. Acta Neuropathol 1980;49(1): 43–49.
- 46. Braunewell KH, Martini R, LeBaron R, et al: Regulación positiva de un epítopo de sulfato de condroitina durante la regeneración del nervio ciático del ratón: evidencia de que las moléculas inmunorreactivas están relacionadas con los proteoglicanos de sulfato de condroitina decorina y versicano. Eur J Neurosci 1995;7(4): 792–804.
- Kapur E, Vuckovic I, Dilberovic F, et al: Resultado neurológico e histológico después de inyecciones intraneurales de lidocaína en nervios ciáticos caninos. Acta Anaesthesiol Scand 2007;51(1):101–107.
- Jeng CL, Rosenblatt MA: Inyecciones intraneurales y anestesia regional: lo conocido y lo desconocido. Minerva Anestesiol 2011;77(1):54–58.
- Orebaugh SL, Mukalel JJ, Krediet AC, et al: Inyección en la raíz del plexo braquial en un modelo de cadáver humano: distribución de la inyección y efectos en el neuroeje. Reg Anesth Pain Med 2012;37(5):525–529.
- Moayeri N, Bigeleisen PE, Groen GJ: Arquitectura cuantitativa del plexo braquial y los compartimentos circundantes, y su posible importancia para los bloqueos del plexo. Anestesiología 2008;108(2):299–304.
- Sala Blanch X, Lopez AM, Carazo J, et al: Inyección intraneural durante el bloqueo del nervio ciático guiado por estimulador nervioso en la fosa poplítea. Hermano J Anaesth 2009;102(6):855–861.
- Berthold CH, Carlstedt T. Observaciones sobre la morfología en la transición entre el sistema nervioso periférico y el central en el gato. tercero Fibras mielinizadas en raicillas dorsales S1. Acta Physiol Scand Suppl 1977;446:43–60.
- Andres KH: [La estructura fina de la región olfativa de los animales macrosmáticos]. Z Zellforsch Mikrosk Anat 1966;69:140–154.
- Haller FR, Low FN: La estructura fina de la vaina de la raíz nerviosa periférica en el espacio subaracnoideo en la rata y otros animales de laboratorio. Am J Anat 1971;131(1):11–19.
- Himango WA, Low FN: La fina estructura de un receso lateral del espacio subaracnoideo en la rata. Rec. Anat 1971;171(1):1–19.
- McCabe JS, Low FN: El ángulo subaracnoideo: un área de transición en el nervio periférico. Rec. Anat 1969;164(1):15–33.
- Waggener JD, Beggs J: Las cubiertas membranosas de los tejidos neurales: un estudio de microscopía electrónica. J Neuropathol Exp Neurol 1967;26(3): 412–426.
- Pease DC, Schultz RL: Microscopía electrónica de meninges craneales de rata. Am J Anat 1958;102(2):301–321.
- Nabeshima S, Reese TS, Landis DM, Brightman MW: Uniones en las meninges y glía marginal. J Comp Neurol 1975;164(2):127–169.
- Evans PJ, Lloyd JW, Wood GJ: Inyección intratecal accidental de bupivacaína y dextrano. Anestesia 1981;36(7):685–687.
- Gadsden JC, Lindenmuth DM, Hadzic A, Xu D, Somasundarum L, Flisinski KA: El bloqueo del plexo lumbar con inyección de alta presión conduce a la propagación contralateral y epidural. Anestesiología 2008;109(4):683–688.
- Lundborg G. Microcirculación intraneural. Orthop Clin North Am 1988;19(1):1–12.
- McManis PG, Schmelzer JD, Zollman PJ, Low PA: Flujo sanguíneo y autorregulación en ganglios somáticos y autonómicos. Comparación con el nervio ciático. Cerebro 1997; 120 (Parte 3): 445–449.
- Beggs J, Johnson PC, Olafsen A, Watkins CJ, Cleary C: arteriolas transperineurales en el nervio sural humano. J Neuropathol Exp Neurol 1991;50(6): 704–718.
- Bell MA, Weddell AG: Un estudio morfométrico de los vasos intrafasciculares del nervio ciático de los mamíferos. Nervio muscular 1984;7(7):524–534.
- Smith DR, Kobrine AI, Rizzoli HV: flujo sanguíneo en los nervios periféricos. Caudales normales y posteriores a la separación. J Neurol Sci 1977;33(3): 341–346.
- Kozu H, Tamura E, Parry GJ: El suministro de sangre endoneural a los nervios periféricos no es uniforme. J Neurol Sci 1992;111(2):204–208.
- Pérez-Castro R, Patel S, Garavito-Aguilar ZV, et al: Citotoxicidad de los anestésicos locales en células neuronales humanas. Anesth Analg 2009;108(3):997–1007.
- Drac H, Babiuch M, Wisniewska W: Cambios morfológicos y bioquímicos en los nervios periféricos con el envejecimiento. Neuropatol Pol 1991;29(1–2–): 49–67.
- Lehmann J: [Cambios relacionados con la edad en los nervios periféricos]. Zentralbl Allg Pathol 1986;131(3):219–227.
- Arnold N, Harriman DG: La incidencia de anomalías en el control de los nervios periféricos humanos estudiados mediante disección de un solo axón. J Neurol Neurosurg Psychiatry 1970;33(1):55–61.
- Tohgi H, Tsukagoshi H, Toyokura Y: cambios cuantitativos con la edad en los nervios sural normales. Acta Neuropathol 1977;38(3):213–220.
- Vizoso AD: La relación entre la longitud internodal y el crecimiento en los nervios humanos. J Anat 1950;84(4):342–353.
- Ochoa J, Mair WG: El nervio sural normal en el hombre. II. Cambios en los axones y células de Schwann debido al envejecimiento. Acta Neuropathol 1969;13(3): 217–239.
- Ochoa J: Reconocimiento de la enfermedad de las fibras amielínicas: criterios morfológicos. Nervio muscular 1978; 1 (5): 375–387.
- Kovacic U, Sketelj J, Bajrovic FF: Capítulo 26: Diferencias relacionadas con la edad en la reinervación después de una lesión del nervio periférico. Int Rev Neurobiol 2009;87:465–482.
- Li X, Karmakar MK, Lee A, Kwok WH, Critchley LA, Gin T: Evaluación cuantitativa de la intensidad del eco del nervio mediano y los músculos flexores del antebrazo en jóvenes y ancianos. Br J Radiol 2012;85(1014):e140–e145.
- Navarro X, Vivo M, Valero-Cabre A: plasticidad neural después de la lesión y regeneración del nervio periférico. Prog Neurobiol 2007;82(4):163–201.
- Keyl C, Held T, Albiez G, Schmack A, Wiesenack C: aumento del umbral de estimulación nerviosa eléctrica del nervio ciático en pacientes con gangrena del pie diabético: un estudio de cohorte paralelo prospectivo. Eur J Anaesthesiol 2013;30(7):435–440.
- Borgeat A, Ekatodramis G, Kalberer F, Benz C: complicaciones agudas y no agudas asociadas con el bloqueo interescalénico y la cirugía del hombro: un estudio prospectivo. Anestesiología 2001;95(4):875–880.