Ariana Nelson, Honorio T. Benzon und Rasha S. Jabri
EINFÜHRUNG
Das spinale Epiduralhämatom (SEH) ist eine Ansammlung von Blut im lockeren Areolargewebe zwischen den Wirbeln und der Dura des Spinalkanals. Typischerweise ist das Hämatom asymptomatisch, aber in seltenen Fällen wird es das Rückenmark komprimieren, mit potenziell verheerenden neurologischen Folgen. Diese Symptome umfassen Gefühlsstörungen, Darm- und Blaseninkontinenz, motorische Schwäche oder in schweren Fällen eine vollständige Lähmung der betroffenen Gliedmaßen. Diese klinische Entität wurde erstmals 1682 in der medizinischen Literatur als spinales Hämatom mit spinaler Apoplexie in der Histoire de l'Academie Royale des Science (Band 2; GJ Duverney) beschrieben. Fast 200 Jahre später, im Jahr 1869, wurde im Lancet ein Bericht über die erste klinische Diagnose von SEH veröffentlicht.
Die SEHs können spontaner Natur sein oder im Rahmen eines invasiven Eingriffs wie einer Lumbalpunktion auftreten. neuraxiale Anästhesie, oder Wirbelsäulenchirurgie. Hämatome sind eher im zervikalen und thorakalen Bereich symptomatisch, da in diesem Bereich der Spinalkanal eingeengt ist im Vergleich zu dem größeren Raum, der für den Volumenausgleich im lumbalen und insbesondere im Cauda equina-Bereich zur Verfügung steht.
SPINALES EPIDURALES HÄMATOM
Häufigkeit
Symptomatische SEH macht weniger als 1 % aller raumfordernden Läsionen der Wirbelsäule aus4 und betrifft jährlich nur 1 von 1 Million Menschen. SEHs entstehen aus unzähligen Ätiologien, meistens jedoch durch einen Eingriff, der im oder in der Nähe des Epiduralraums durchgeführt wird. Zum Beispiel kann das Vorhandensein von SEH in der postoperativen Bildgebung bei 33 % bis 100 % der Patienten nach einer Wirbelsäulenoperation gefunden werden, aber die Patienten zeigen selten ein neurologisches Defizit. Eine systematische Überprüfung aus dem Jahr 2010 ergab eine berechnete Gesamtinzidenz von symptomatischer SEH nach einer Wirbelsäulenoperation von 0.2 %, wobei einzelne Studienberechnungen zwischen 0 % und 1.0 % lagen. Daher wird die Inzidenz von SEH routinemäßig als Inzidenz von symptomatischer SEH angegeben; fortan wird in diesem Kapitel der qualifizierende Begriff symptomatisch verwendet.
Die Inzidenz von SEH nach neuraxialer Anästhesie wurde historisch auf weniger als 1 von 150,000 epiduralen Platzierungen und weniger als 1 von 220,000 Spinalanästhetika geschätzt. Jüngsten epidemiologischen Studien zufolge könnte die Inzidenz jedoch zunehmen. Diese Einschätzung wurde durch eine groß angelegte schwedische Studie bestätigt, die eine SEH-Inzidenz nach Epiduralblockade von 1:18,000 ermittelte, eine Zahl, die sich aus dem Durchschnitt einer geburtshilflichen Inzidenz von 1:200,000 und einer bemerkenswert hohen Inzidenz von 1:3600 errechnet in einer Population älterer weiblicher Patienten, die sich einer Knieendoprothetik unterziehen. Eine andere Studie zeigte eine SEH-Gesamtinzidenz von 1:4741, die auf 1:1000 anstieg, wenn die untersuchte Population eingeengt wurde, um nur ältere Frauen einzubeziehen, die sich einer Operation an den unteren Extremitäten unterziehen.
Diese große Diskrepanz kann auf das Vorhandensein oder Fehlen von Risikofaktoren in diesen inkongruenten Patientenpopulationen zurückgeführt werden. Die Schwangerschaft führt zu einem relativ hyperkoagulablen Zustand, und geburtshilfliche Patientinnen sind auch jünger mit einem größeren und nachgiebigeren Epiduralraum als ältere Patientinnen. Die geringere Inzidenz von SEH bei geburtshilflichen Patientinnen wurde in einer kürzlich durchgeführten Studie bestätigt, in der bei 709,837 peripartalen Patientinnen keine Fälle von SEH erkannt wurden. Diese Studie verzeichnete eine Inzidenz von 1:9000 (95 % Konfidenzintervall [KI]: 1:20,189–1:4330) bei Patienten, die perioperative Epiduralanlagen erhielten.
Risikofaktoren
Mit zunehmendem Alter steigt das SEH-Risiko. Die Verringerung der Größe des Epiduralraums mit zunehmendem Alter wurde erstmals 1967 in einer Studie über die Ausbreitung von Lokalanästhetika berichtet.
Dies kann extrapoliert werden, um die höhere Inzidenz von SEH bei älteren Patienten zu berücksichtigen, da ein äquivalentes Blutvolumen einen erhöhten Druck im kleineren Epiduralraum eines älteren Patienten im Vergleich zu einem jüngeren Patienten verursacht. Es wurde keine rassische Vorliebe berichtet, aber SEH tritt häufiger bei Frauen auf. Dies könnte möglicherweise durch die höhere Prävalenz von Osteoporose bei weiblichen Patienten erklärt werden, die Wirbeldeformitäten oder -frakturen und eine Vergrößerung der Wirbelkörper verursacht, was zu einer Verengung des Wirbelkanals führt. Eine osteoporotische Verengung des Epiduralraums könnte daher sowohl für die Geschlechts- als auch für die Altersprädilektionen von SEH verantwortlich sein und zu der mehr als 50-fach erhöhten Wahrscheinlichkeit von SEH nach einer Epiduralanästhesie für eine Knieendoprothetik im Vergleich zu einer epiduralen Geburtsanalgesie beitragen. Die Thromboseprophylaxe ist jedoch eine Notwendigkeit in der orthopädisch-chirurgischen Bevölkerung, was auch zu ihrer relativ höheren Inzidenz von SEH im Vergleich zu geburtshilflichen Patienten beitragen kann, die keine routinemäßige Prophylaxe gegen tiefe Venenthrombose benötigen.
Tatsächlich ist der wichtigste Risikofaktor für SEH das Vorhandensein einer physiologischen oder iatrogenen Störung des Gerinnungssystems, wie Lebererkrankung, Alkoholismus, Thrombozytopenie oder pharmakologische Antikoagulation. Eine kürzlich durchgeführte retrospektive Studie identifizierte auch einen signifikanten Anstieg von SEH nach einer Wirbelsäulenoperation bei Patienten mit Rh+-Blutgruppen, intraoperativem Blutverlust von mehr als 1 l, Hämoglobinspiegel von weniger als 10 g/dl und einem international normalisierten Verhältnis von mehr als 2.0 in den ersten 48 Std. Als wichtigste Risikofaktoren für ein Epiduralhämatom wurden die Antikoagulanzientherapie in Verbindung mit einer neuraxialen Analgesie sowie die Dauer und Intensität der Antikoagulation identifiziert. Etwa ein Viertel bis ein Drittel aller SEH-Fälle stehen im Zusammenhang mit einer Antikoagulationstherapie. In einer umfassenden Überprüfung aller SEH-Fälle im Zusammenhang mit einer neuraxialen Anästhesie hatten 87 % der Patienten entweder eine hämatologische Anomalie oder ein durch technische Schwierigkeiten kompliziertes Verfahren. Fälle von spontanen Hämatomen sind selten, aber wenn sie auftreten, sind sie oft mit Antikoagulation, Thrombolyse, Blutdyskrasie, Koagulopathien, Thrombozytopenie, Neubildungen, Gefäßmissbildungen oder vertebralen Hämangiomen verbunden.
Ein verringertes Patientengewicht, das die Antikoagulanzienwirkung verstärken kann, stellt ein theoretisches Problem für die Blutungsneigung dar und wurde als Erklärung für das erhöhte Risiko bei Frauen und älteren Menschen vorgeschlagen. In Schweden wurde jedoch nicht gezeigt, dass eine geschlechtsspezifisch reduzierte Dosis von niedermolekularem Heparin zur Prophylaxe gegen tiefe Venenthrombosen die gut beschriebene erhöhte Inzidenz von SEH bei Frauen verbessert. Die thrombolytische Therapie birgt das größte Risiko von Blutungskomplikationen, und neuraxiale Verfahren sollten bei Patienten, die sich kürzlich einer Thrombolyse unterzogen haben, sorgfältig vermieden werden. Lerne mehr über Neuraxiale Anästhesie und periphere Nervenblockaden bei Patienten unter Antikoagulanzien.
Klinische Perle
- Neuere Studien zur Inzidenz des spinalen Hämatomrisikos bei Patienten ohne offensichtliche Risikofaktoren zeigten einen Anstieg auf 1:18,000 nach Epiduralanästhesie und 1:3600, sogar 1:1000, bei älteren Patienten, die sich einer Operation an den unteren Extremitäten unterziehen.
Ätiologie und Lokalisation von Hämatomen
Zu den vorgeschlagenen Faktoren, die SEH verursachen, gehören Trauma, Antikoagulation, Thrombolyse, Lumbalpunktion, Epidural- oder Spinalanästhesie, interventionelle Wirbelsäuleneingriffe oder -operationen, Koagulopathie oder blutende Diathese, Lebererkrankung mit portaler Hypertonie, vaskuläre Fehlbildung, Bandscheibenvorfall, Paget-Krankheit der Wirbelknochen , Valsalva-Manöver und Bluthochdruck. Die wichtigsten Ursachen einer spontanen SEH sind Gerinnungsstörungen, die erworben (z. B. Antikoagulanzientherapie, Malignome) oder angeboren (z. B. Hämophilie) sein können. Gefäßmalformationen sind selten für spontane epidurale Hämatome verantwortlich; nur 4 % in einer Serie von 158 Fällen und 6.5 % in einer Serie von 199 Fällen wurden als Folge einer vaskulären Fehlbildung gemeldet. Weniger häufige prädisponierende Faktoren sind systemischer Lupus erythematodes, Spondylitis ankylosans, rheumatoide Arthritis, Morbus Paget, Bandscheibenvorfall und Bluthochdruck.
Der dorsale Venenplexus ist die am häufigsten betroffene Blutungsquelle, da dieser Plexus keine Ventile hat und eine Umkehrung des Blutflusses während eines erhöhten intravaskulären Drucks durch körperliche Aktivität ermöglicht. Diese Venen sind nicht geschützt, da sie nur von lockerem Areolargewebe umgeben sind und daher anfällig für plötzliche Druckerhöhungen im Bauchraum oder Brustkorb sind, was zu Rupturen und Blutungen führt. Der epidurale Venenplexus ist in der Brustwirbelsäule am stärksten ausgeprägt, und spontane SEH tritt am häufigsten in der thorakalen und zervikothorakalen Region auf, gefolgt vom thorakolumbalen Bereich. SEH ist typischerweise posterior oder posterolateral zum Thekalsack (Figure 1), weil die feste Haftung des Duralsacks am hinteren Längsband im ventralen Bereich des Spinalkanals die Ansammlung von Hämatomen verhindert. Der dorsale Aspekt der Brust- oder Lendenregion ist häufig betroffen, und die Ausdehnung ist typischerweise auf nur wenige Wirbelebenen beschränkt.
Bei schwangeren Frauen wurde vermutet, dass ein erhöhter venöser Druck aufgrund einer Uterusvergrößerung in Verbindung mit den hämodynamischen Veränderungen der Schwangerschaft zur Ruptur einer vorbestehenden pathologischen Wand des epiduralen Venenplexus prädisponieren kann. Obwohl eine venöse Quelle am weitesten verbreitet ist, wird weiterhin über eine potenzielle arterielle Quelle von SEH diskutiert, wobei Befürworter dieser Theorie behaupten, dass der venöse Blutdruck geringer als der intrathekale Druck ist; Daher kann venöses Blut, obwohl ein Vorwärtsfluss in den Niederdruck-Epiduralraum möglich ist, keine Kompression des Rückenmarks verursachen.
NYSORA-Tipps
- Blutungen in den Spinalkanal treten aufgrund des prominenten epiduralen Venenplexus am häufigsten im Epiduralraum auf.
- SEH kann spontan auftreten oder nach einem kleineren Trauma wie einer Lumbalpunktion oder einer neuraxialen Anästhesie auftreten.
- SEH tritt hauptsächlich bei antikoagulierten oder thrombozytopenischen Patienten auf.
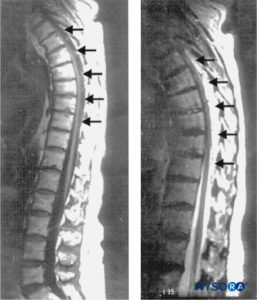
ABBILDUNG 1. Sagittale Magnetresonanzbilder der thorakolumbalen Wirbelsäule. Ein großes komplexes Epiduralhämatom, das sich von T3 über T10 bis T11 erstreckt, ist mit hypo- und isodensem Signalverlauf in einem T1-gewichteten Bild (links; Pfeile) und hyperintensem Signalverlauf in einem T2-gewichteten Bild (rechts; Pfeile) zu sehen. In der Mitte des Hämatoms grenzt das Rückenmark an die hintere Seite des Brustwirbels
Körper (links). Es werden keine Signalanomalien des Kabels selbst gesehen. (Wiedergabe mit freundlicher Genehmigung von Schwarz SK, Wong CL,
McDonald WN: Spontanheilung von einem epiduralen Hämatom der Wirbelsäule mit atypischer Präsentation bei einem Neunzigjährigen. Kann J Anaesth. 2004 Jun-Jul;51(6):557–561.)
Anamnese und körperliche Untersuchung
Klassischerweise ist das Symptom der SEH ein akuter axialer Rückenschmerz, der auf entsprechende Dermatome ausstrahlt und sich zu einem fokalen neurologischen Defizit mit Anzeichen einer Nervenwurzel- oder Rückenmarkskompression entwickelt. Der Schmerz wird im Allgemeinen als starker, lokalisierter, konstanter Rückenschmerz mit oder ohne radikuläre Komponente beschrieben, der einen Bandscheibenvorfall imitieren kann, insbesondere in der Lendenwirbelsäule.
Rückenschmerzen werden durch Perkussion über die Wirbelsäule sowie durch Manöver verstärkt, die den intraspinalen Druck erhöhen, wie Husten, Niesen oder Pressen. Eine Analyse aus dem Jahr 2010 zeigte jedoch, dass die Schwäche der unteren Extremitäten das häufigste Anzeichen ist, obwohl Rückenschmerzen immer noch ein häufiges Frühsymptom sind. Begleitsymptome können Taubheit, Schwäche und Harn- oder Stuhlinkontinenz sein. Das Einsetzen von Schmerzen ist gelegentlich mit geringer Belastung verbunden, wie z. B. beim Heben, Husten, Niesen oder Valsalva-Manövern, obwohl das Einsetzen der Schmerzen in den meisten Fällen spontan ist.
Zu den körperlichen Befunden gehören je nach Höhe und Größe des Hämatoms ein- oder beidseitige Schwäche, Sensibilitätsstörungen mit ein- oder beidseitigen Wurzelparästhesien, verschiedene Veränderungen der tiefen Sehnenreflexe sowie Veränderungen des Blasen- oder Analsphinktertonus. Anzeichen einer Dysfunktion des Rückenmarks und der Nervenwurzeln treten schnell auf und können sich zu einer Paraparese oder, in hochgelegenen thorakalen oder zervikalen Lagen, zu einer Quadriparese entwickeln. In Fällen von SEH im Zusammenhang mit einer neuraxialen Anästhesie oder Lumbalpunktion sollte das Vorhandensein neuer oder fortschreitender postoperativer neurologischer Symptome den Arzt auf ein mögliches Epiduralhämatom aufmerksam machen.
NYSORA-Tipps
- Der Patient kann sich mit starken, lokalisierten, konstanten Rückenschmerzen mit oder ohne radikulärer Komponente vorstellen, die einen Bandscheibenvorfall imitieren können.
- Begleitsymptome können Schwäche, Taubheit und Harn- oder Stuhlinkontinenz sein.
- Das Wiederauftreten eines sensorischen oder motorischen Defizits mehrere Stunden nach Abklingen der spinalen oder epiduralen Blockade (mit oder ohne Rückenschmerzen) ist höchst pathognomonisch und sollte als spinales oder epidurales Hämatom betrachtet und behandelt werden, bis das Gegenteil bewiesen ist.
- Bei Patienten mit Rückenschmerzen und Beinschwäche ohne Lähmung wurde über eine neurologische Erholung nach konservativer Behandlung berichtet.
- Eine neurologische Erholung kann eintreten, wenn eine Operation und Dekompression innerhalb von 36 Stunden nach einem vollständigen motorischen Defizit und innerhalb von 48 Stunden nach einem partiellen Defizit durchgeführt wird.
Diagnose
Wie bereits erwähnt, umfassen die klinischen Befunde von SEH in der Regel Rückenschmerzen und motorische/sensorische Defizite, die sich schnell zu Querschnittslähmung, Quadriplegie oder autonomer Dysfunktion entwickeln können.
Ein epidurales Hämatom tritt normalerweise innerhalb der ersten 24–48 Stunden nach einem Eingriff auf. Alle neuen oder fortschreitenden neurologischen Symptome erfordern eine sofortige klinische Bewertung und diagnostische Abklärung, um raumfordernde Läsionen, einschließlich Epiduralhämatom, auszuschließen. Ein neurologisches Defizit, das bei Vorliegen einer Epiduralanästhesie auftritt, erfordert ein sofortiges Absetzen der Infusion, wobei der Katheter an Ort und Stelle belassen wird, um einen Beitrag des Lokalanästhetikums auszuschließen.
Wenn die epidurale Infusion die Ursache der neurologischen Manifestation ist, wird eine Rückkehr der sensorischen und motorischen Funktion festgestellt. Andernfalls sollten eine sofortige Abklärung und radiologische Bildgebungsstudien durchgeführt und eine Konsultation mit einem Wirbelsäulenchirurgen angestrebt werden, um eine sich entwickelnde epidurale Läsion auszuschließen.
Bei einem Patienten mit akuten axialen Rückenschmerzen mit Fortschreiten neurologischer Defizite ist eine sofortige Beurteilung auf das Vorhandensein pathologischer Entitäten im Zusammenhang mit einer Nervenwurzel- und Rückenmarkskompression erforderlich, um verschiedene Läsionen zu unterscheiden, die SEH simulieren. Das klinische Bild eines Patienten mit Verdacht auf ein epidurales Hämatom kann dem Bild eines epiduralen Abszesses, einer Rückenmarkserkrankung, eines Neoplasmas oder eines akuten Bandscheibenvorfalls ähneln. Die Differentialdiagnose von neuen oder fortschreitenden postoperativen neurologischen Symptomen umfasst chirurgische Neuropraxie, verlängerte oder übertriebene neuroaxiale Blockade, vorderes Spinalarteriensyndrom, Exazerbation einer vorbestehenden neurologischen Störung und Präsentation eines zuvor nicht diagnostizierten neurologischen Zustands.
Ein vollständiges Blutbild mit Blutplättchen sollte angeordnet werden, um das Ausmaß der Blutung zu beurteilen und das Vorhandensein einer Infektion festzustellen. Die Prothrombinzeit und die aktivierte partielle Thromboplastinzeit bestimmen das Vorliegen einer Blutungsdiathese.
Eine schnelle radiologische Untersuchung ist unerlässlich, um Verzögerungen bei der Behandlung von SEH zu minimieren. Derzeit ist die Magnetresonanztomographie (MRT) das diagnostische Bildgebungsverfahren der Wahl für Wirbelsäulennotfälle, da sie eine schnelle, nicht-invasive Beurteilung der Wirbelsäule und des Rückenmarks in allen Ebenen ermöglicht. Die MRT der Wirbelsäule kann die Lokalisation eines epiduralen Hämatoms abgrenzen und eine damit verbundene vaskuläre Fehlbildung identifizieren; er gibt auch Aufschluss über das Ausmaß des Hämatoms sowie den Grad der Nabelschnurkompression. Die MRT kann auch bei der Beurteilung des Alters des Hämatoms helfen (Figure 1).
Die chronologischen Merkmale einer MRT von SEH ähneln denen, die bei einer intrakraniellen Blutung beobachtet werden. Im hyperakuten Stadium (erste 6 Stunden) erscheint die SEH im Vergleich zum Rückenmark auf T1-gewichteten Bildern isointens und auf T2-gewichteten Bildern leicht hyperintens und heterogen, was auf das Vorhandensein von intrazellulärem Oxyhämoglobin zurückzuführen ist. Im akuten Stadium (7–72 Stunden) ist das Hämatom auf T1-gewichteten Aufnahmen noch isointens und wird auf T2-gewichteten Aufnahmen hypointens. Dies ist auf das Vorhandensein von intrazellulärem Desoxyhämoglobin zurückzuführen, das eine T2-Verkürzung verursacht. Mit zunehmender Methämoglobinkonzentration wird das Hämatom hyperintens und homogen in T1- und T2-gewichteten Bildern. Eine gadoliniumverstärkte Magnetresonanzarteriographie (MRA) kann das Ausmaß einer arteriovenösen Fehlbildung weiter definieren.
Die konventionelle Computertomographie (CT) hat das Potenzial, ein epidurales Hämatom zu diagnostizieren, kann jedoch falsch-negative Ergebnisse liefern, wenn das Hämatom isodens zum Thekalsack oder Rückenmark ist und die Bildqualität durch Artefakte beeinträchtigt wird, die häufig im oberen Thoraxbereich zu sehen sind. Spinal-CT-Scans können in der Brustwirbelsäule nicht diagnostisch sein, wo die Auflösung aufgrund des hohen Kontrasts zwischen Lungenparenchym und Wirbelknochen schlechter ist als in der Lenden- und Halswirbelsäule. Eine konventionelle Angiographie kann erforderlich sein, um das Vorhandensein einer Gefäßveränderung definitiv nachzuweisen.
Die Myelographie und später die CT-Myelographie waren früher die wichtigsten Modalitäten für die Diagnose von epiduralen Hämatomen. In Kombination mit einem spinalen CT-Scan zeigt die Myelographie SEH als intraspinale bikonvexe und hyperdense Läsion mit einer Dichte, die der von Blut entspricht. Obwohl dies eine epidurale Läsion mit teilweiser oder vollständiger Blockade der Wirbelsäule darstellen kann, sind die Befunde nicht spezifisch. Darüber hinaus ist die Myelographie invasiv und kann den klinischen Zustand des Patienten verschlechtern. Darüber hinaus kann die Myelographie, obwohl sie Anzeichen einer Kompression mit Visualisierung einer unspezifischen Kontrastmittelblockade oder einer extraduralen konvexen Kompression zeigen kann, die Art und das wahre Ausmaß der Läsion nicht bestimmen. Diese Techniken werden heute in den Vereinigten Staaten nur noch selten eingesetzt, da die MRT zum diagnostischen Goldstandard geworden ist.
Prävention, Behandlung und Prognose
Eine Lumbalpunktion oder Epiduralanästhesie sollte bei Personen vermieden werden, die eine Antikoagulanzientherapie erhalten, eine Thrombolysetherapie erhalten haben oder bei denen der Verdacht auf eine Blutungsdiathese besteht. Anästhesisten werden dringend gebeten, sich über Antikoagulationsprotokolle, neue gerinnungshemmende Medikamente und aktuelle Leitlinienempfehlungen auf dem Laufenden zu halten. Die Entscheidung zur Durchführung einer neuraxialen Blockade und der Zeitpunkt der Katheterentfernung bei einem Patienten, der eine antithrombotische Therapie erhält, sollte individuell getroffen werden, wobei die Risiken eines spinalen Hämatoms mit den Vorteilen einer Regionalanästhesie für einen bestimmten Patienten abzuwägen sind. Die American Society of Regional Anaesthesie und die European and Scandinavian Society of Anaesthesiologists haben Konsenserklärungen zu neuraxialer Anästhesie und Antikoagulation veröffentlicht, die eine aktuelle Quelle für Richtlinien im Entscheidungsprozess bei der Durchführung einer neuraxialen Anästhesie bei Risikopatienten darstellen (siehe Neuraxiale Anästhesie und periphere Nervenblockaden bei Patienten unter Antikoagulanzien).
Im Gegensatz dazu existieren keine Richtlinien zur Antikoagulation bei chirurgischen Patienten. Neuere retrospektive Studien zur Inzidenz postoperativer Hämatome nach Wirbelsäulenoperationen kamen zu dem Schluss, dass Patienten vielleicht eine tiefe Venenthromboseprophylaxe erhalten sollten, da dies keinen Einfluss auf die Wahrscheinlichkeit einer SEH-Bildung zu haben scheint. Angesichts der verheerenden Folgen von SEH sind jedoch weitere prospektive Studien erforderlich, bevor nach einer Wirbelsäulenoperation eine weit verbreitete Thromboseprophylaxe eingeführt wird. Fallberichte haben eine erfolgreiche konservative Behandlung epiduraler Hämatome beschrieben. Eine nichtoperative Behandlung mit gutem Ergebnis wurde hauptsächlich bei Hämatomen auf Höhe der Cauda equina und solchen mit leichtem neurologischem Defizit berichtet. Es scheint, dass bei konservativer Behandlung eine vollständige Genesung eintreten kann, wenn der Patient über Rückenschmerzen und Beinschwäche oder Taubheitsgefühl berichtet, aber keine Beinlähmung aufweist. Die Umkehrung von Gerinnungsanomalien, die genaue Beobachtung neurologischer Defizite und in seltenen Fällen die Verabreichung von Steroiden können ohne Operation ein gutes Ergebnis erzielen. Ein praktischer Ansatz zur Behandlung eines vermuteten epiduralen Hämatoms wird in gezeigt Figure 2.
Eine dringende chirurgische Dekompression ist die Behandlung der Wahl für SEH, die eine akute Beeinträchtigung der Nabelschnurfunktion verursacht. Nach der Laminektomie erfolgt die Evakuierung des Hämatoms, Koagulation der Blutungsstellen und Inspektion der Dura. Die Dura wird dann bis zum Knochen gespannt, und gelegentlich werden Epiduraldrainagen für bis zu 24 Stunden verwendet. Obwohl die Wirksamkeit von Drainagen in der Vergangenheit umstritten war, deuten neuere Daten darauf hin, dass subfasziale Drainagen die SEH-Bildung signifikant verringern. Eine Genesung nach längerer Lähmung ohne Operation ist selten, und eine chirurgische Beratung zur Erwägung einer notfallmäßigen dekompressiven Laminektomie muss so bald wie möglich eingeholt werden. Die Gesamtsterblichkeitsrate beträgt 8 %. Letztendlich muss das OP-Team von Fall zu Fall entscheiden, ob man beobachtet oder operiert. Die kritischen Faktoren für die Genesung nach SEH sind das Niveau des präoperativen neurologischen Defizits und das Operationsintervall. Die Prognose für die neurologische Genesung hängt hauptsächlich vom präoperativen neurologischen Status des Patienten und der Dauer der neurologischen Dysfunktion ab. Die Prognose ist schlechter, wenn zwischen der Verletzung und dem chirurgischen Eingriff eine Verzögerung auftritt.
Bisher wurde eine vollständige neurologische Erholung als unwahrscheinlich angesehen, wenn mehr als 8 Stunden zwischen der Entwicklung der Lähmung und dem chirurgischen Eingriff vergangen waren. Andere Autoren haben jedoch eine Genesung festgestellt, wenn die Operation innerhalb von 12 Stunden nach der Lähmung durchgeführt wurde.
Dieser empfohlene Zeitrahmen für den Eingriff wurde durch die jüngste Erkenntnis weiter abgegrenzt, dass eine Genesung erreicht werden kann, wenn eine Operation innerhalb von 48 Stunden nach einem unvollständigen motorischen Defizit und innerhalb von 36 Stunden nach einem vollständigen motorischen Defizit durchgeführt wird (Tabelle 1). Es ist interessant festzustellen, dass über eine funktionelle Wiederherstellung nach 72 Stunden Symptome berichtet wurde. Obwohl es beruhigend ist, dass nach solchen Intervallen eine funktionelle Erholung eintreten kann, brauchen die Beurteilung der Symptome des Patienten und die Notfall-MRT Zeit. Daher sollte so bald wie möglich eine Konsultation mit einem Wirbelsäulenchirurgen bezüglich einer möglichen Notfallevakuierung des Hämatoms eingeholt werden.
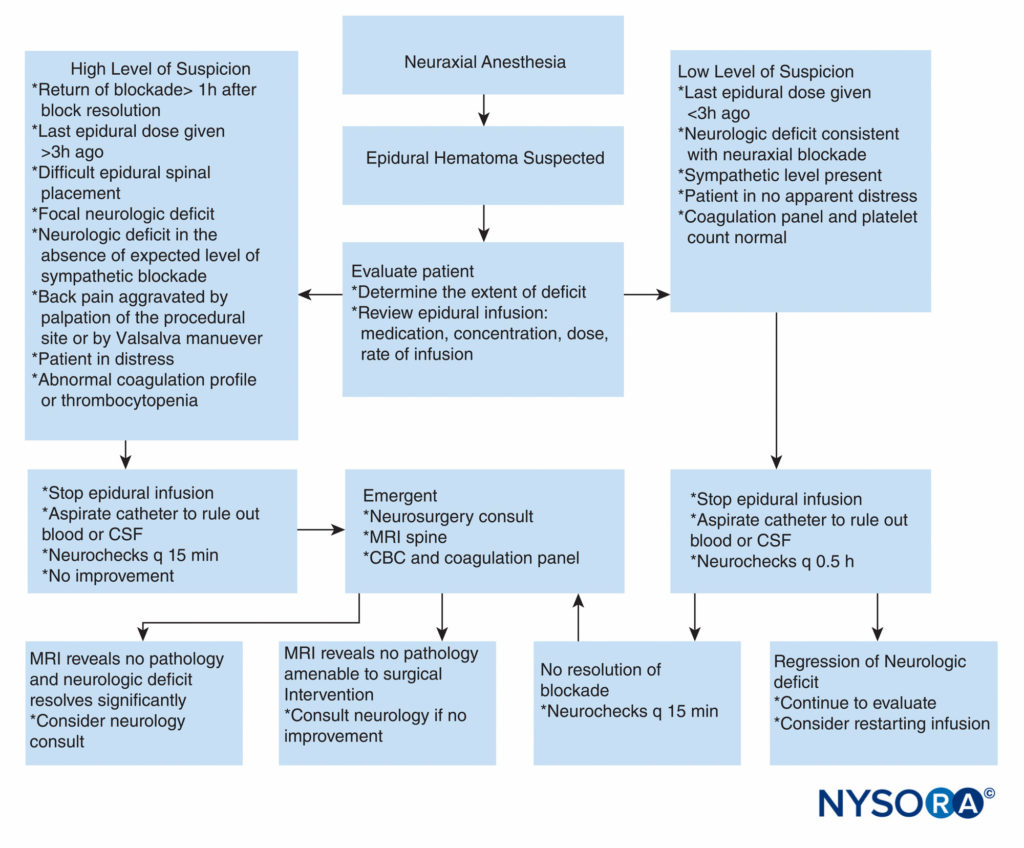
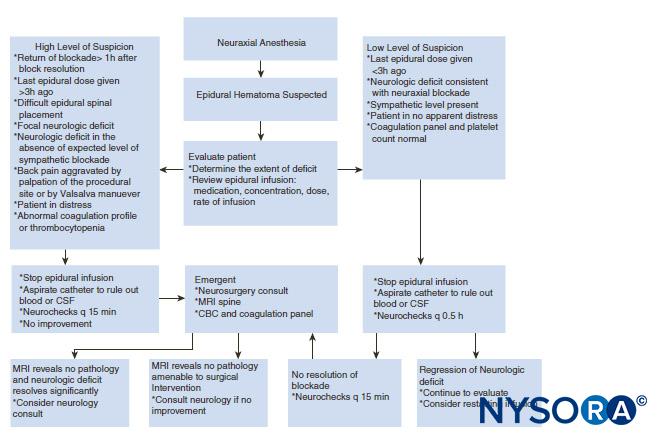
ABBILDUNG 2. Praktischer Ansatz zur Entscheidungsfindung bei der Abklärung und Behandlung eines Patienten mit Verdacht auf Epiduralhämatom. CBC = vollständiges Blutbild; Liquor = Liquor cerebrospinalis; MRT = Magnetresonanztomographie; q = alle.
TABELLE 1. Neurologische Genesung in Bezug auf den Zeitpunkt der Operation.
| Autorin | Intervall zwischen Lähmung und Erholung |
|---|---|
| Wulf68 | 8 Stunden 36 Stunden eines kompletten motorisches Defizit |
| Lawtonet al48 | 12 Stunden 48 Stunden eines unvollständigen motorisches Defizit |
| Groen und Van Alphen69 |
Spinales Epiduralhämatom: Zusammenfassung
Das spinale Epiduralhämatom ist eine seltene Quelle einer neurologischen Verschlechterung und kann je nach Ort und Größe der Blutung zu autonomen, sensorischen und motorischen Störungen unterschiedlichen Ausmaßes führen. SEH kann akut oder chronisch, spontan, posttraumatisch oder iatrogen sein. Bekannte Risikofaktoren sind technisch schwieriges neuraxiales Verfahren, Vorhandensein einer intrinsischen oder erworbenen Koagulopathie, weibliches Geschlecht und fortgeschrittenes Alter. Mögliche Risikofaktoren, die durch widersprüchliche Daten in der Literatur belegt werden, umfassen einen niedrigen Hämoglobinspiegel, das Vorhandensein von Rh+-Antikörpern und anatomische Anomalien des Rückenmarks. Angesichts der Tatsache, dass SEH eine seltene, aber potenziell reversible Ursache einer Rückenmarkskompression ist, ist es wichtig, dass die Diagnose unverzüglich gestellt wird, um eine vollständige Genesung zu ermöglichen. Ein spinales Hämatom kann auch ohne identifizierbare Risikofaktoren auftreten; Daher müssen Gesundheitsdienstleister bei der Überwachung auf neue neurologische Symptome einen hohen Misstrauensindex und Wachsamkeit aufrechterhalten.
Obwohl die MRT nicht mit der Geschwindigkeit eines CT-Scans durchgeführt werden kann, ist sie die diagnostische Methode der Wahl, da sie sowohl empfindlich als auch spezifisch ist. Die schnelle Erkennung einer neurologischen Verschlechterung ist entscheidend für eine frühzeitige diagnostische Bildgebung und eine sofortige Intervention. Es ist beruhigend festzustellen, dass eine Genesung ohne Operation erfolgen kann, wenn keine Lähmung vorliegt. Wenn eine Lähmung auftritt, kann eine chirurgische Dekompression des Rückenmarks und der Nervenwurzeln zu einer vollständigen funktionellen Wiederherstellung führen, wenn sie innerhalb eines angemessen schnellen Intervalls durchgeführt wird. Wenn die Intervention verzögert wird, können dauerhafte Folgen von SEH sensorische Defizite, Paraplegie, Spastik, neuropathische Schmerzen und Funktionsstörungen des Harn- oder Analsphinkters umfassen.
PERIPHERES HÄMATOM NACH NERVENBLOCKS
Das Hämatom im Epiduralraum ist sicherlich die verheerendste hämorrhagische Folge einer neuraxialen oder peripheren Regionalanästhesie, aber Hämatome können auch in der Peripherie nach einmaligen oder kontinuierlichen Nervenblockaden auftreten. Die häufigsten Risikofaktoren scheinen Verfahrensschwierigkeiten und die gleichzeitige Antikoagulation oder Thrombozytenaggregationshemmung zu sein. Diese Komplikation ist mit weniger als 30 Fällen von Hämatomen nach peripherer Nervenblockade (PNB) in der Literatur bisher äußerst selten, und die Folgen sind im Vergleich zu SEH auch weniger schwerwiegend, da die Blutung in einem komprimierbaren peripheren Raum auftritt.
Im Gegensatz zu SEH ist das Hauptsymptom eines Hämatoms nach PNB selten eine neurologische Dysfunktion, sondern eher sichtbare Blutergüsse (Figure 3), lokaler Druckschmerz, Abfall des Hämoglobins/Hämatokrits oder relative Hypotonie aufgrund von Blutverlust. Dies soll nicht heißen, dass die nachgiebige Art des peripheren Raums eine signifikante Morbidität und Mortalität ausschließt, da es einen berichteten Fall eines Patienten mit Todesfall als Folge einer retroperitonealen Blutung nach einem lumbalen Sympathikusblock im Rahmen einer Thrombozytenaggregationshemmung gibt. Bei der Autopsie wurde festgestellt, dass der Patient 3 l Blut in seinem retroperitonealen Raum verloren hatte, was für die okkulte Bedrohung spricht, die von der nachgiebigen Peripherie ausgeht. In der Tat wurden mehrere andere Fälle berichtet, in denen Patienten aufgrund eines PNB-Hämatoms eine erhebliche Morbidität erlitten, einschließlich eines verlängerten Krankenhausaufenthalts, der Notwendigkeit einer Transfusion oder eines akuten Nierenversagens.
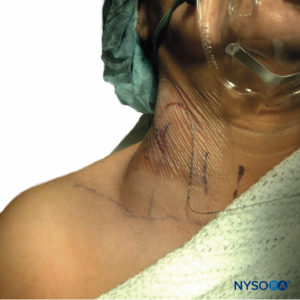
ABBILDUNG 3. Halshämatom bei einem Patienten, bei dem die externe Jugularvene mit einer 18-Gauge-Nadel im Tuohy-Stil punktiert wurde, während ein Katheter in die interskalenäre Furche eingeführt wurde. Das gezeigte Hämatom war in sich geschlossen und wurde konservativ mit lokaler Kompression behandelt.
Angesichts der Tatsache, dass in jedem Fall, über den in der Literatur berichtet wird, das neurologische Defizit, falls vorhanden, nach 1 Jahr abgeklungen war, scheint es, dass die besorgniserregendere Ursache der Morbidität der Blutverlust in das Hämatom ist. Aufgrund der Seltenheit dieser Komplikation ist es jedoch für Experten schwierig, Empfehlungen zu diesem Verfahren im Rahmen einer Antikoagulation abzugeben. Diese Schwierigkeit wird durch die Existenz von Fallberichten verschärft, in denen ein Hämatom auftrat, obwohl die Ärzte die Richtlinien der American Society of Regional Anästhesie und Schmerzmedizin (ASRA) befolgten. Darüber hinaus wurden Fälle von spontanen Hämatomen berichtet, die bei Patienten unter Enoxaparin oder dreimal täglich Heparin aufgetreten sind. Zusammengenommen haben diese Tatsachen zu etwas gegensätzlichen Richtlinien in verschiedenen Ländern geführt. Beispielsweise hat die Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin Empfehlungen zum Absetzen der Antikoagulation vor einer PNB herausgegeben, aber die Österreichische Gesellschaft gibt an, dass distale PNB, wie Ischias- oder Achselblockaden, bei einem antikoagulierten Patienten durchgeführt werden können.
Die ASRA-Richtlinien besagen, dass die Empfehlungen zu neuraxialen Techniken auf tiefe Plexusblockaden und PNBs angewendet werden sollten. Daher sind Patienten, die eine Antikoagulation erhalten, keine Kandidaten für diese Anästhesietechniken, aber einige Forscher schlugen vor, dass diese antikoagulierten Patienten mit dem Aufkommen der Ultraschallführung sicher einer Blockade peripherer Nerven unterzogen werden könnten. Darüber hinaus zeigten Studien nicht nur eine verringerte Inzidenz von Gefäßpunktionen bei der Verwendung von Ultraschall, sondern auch eine verringerte Toxizitätsrate von Lokalanästhetika. Diese Option hat das Potenzial, die Patientensicherheit zu verbessern, da Patienten unter Antikoagulation häufig Risikofaktoren für eine Vollnarkose aufweisen und von der Vermeidung der daraus resultierenden Schwankungen der Hämodynamik und des Flüssigkeitsstatus profitieren würden.
Ein CT-Scan ist derzeit das gebräuchlichste Bildgebungsverfahren zur Diagnose von Blut in peripheren Geweben, insbesondere im Retroperitonealraum. Ultraschall wurde jedoch verwendet, um das Vorhandensein eines subkapsulären Nierenhämatoms nachzuweisen93 und könnte möglicherweise eine leichter zugängliche diagnostische Technik als CT in Regionen des Körpers sein, die für diese Visualisierungsmethode geeignet sind. Der verstärkte Einsatz von Ultraschall bei der Erstplatzierung von PNBs könnte die Diagnose von Verdachtsfällen auf Postblock-Hämatome erleichtern, da die Ultraschallgeräte leicht verfügbar sein werden.
Obwohl eine rechtzeitige Diagnose ideal ist, ist die nachfolgende Behandlung von Hämatomen nach PNBs typischerweise eine abwartende Behandlung. Normalerweise wird ein chirurgisches Team konsultiert, Bluttransfusionen werden nach Bedarf angeordnet und eine chirurgische Drainage wird nur bei kritischen oder sich schnell verschlechternden Patienten in Betracht gezogen. Bestimmte Fallberichte über Psoas-Hämatome sind ohne chirurgische Entfernung des Hämatoms abgeklungen, und die Patienten haben ihren sensorischen und motorischen Status einige Tage bis 4 Monate nach der Diagnose wiedererlangt. Bei Hämatomen, die gleichzeitig mit einem peripheren Nervenkatheter einhergehen, sind diese ebenfalls oft selbstlimitierend, aber es gibt Berichte, bei denen eine chirurgische Drainage durchgeführt wurde.
Angesichts des Mangels an verfügbaren Daten zu Blutungen nach PNB oder kontinuierlicher Nervenblockade kann es schwierig sein, die Überlegenheit einer bestimmten Anästhesietechnik für einen bestimmten Patienten genau zu bestimmen. Anästhesisten sollten ihre Entscheidung basierend auf der Eignung von PNBs bei Patienten unter Antikoagulanzien individualisieren und wie immer die Risiken und Vorteile der Blockade ausführlich mit dem Patienten und dem Chirurgen besprechen. Wenn eine Blockade durchgeführt wird, sollte der Patient perioperativ engmaschig auf Anzeichen und Symptome eines peripheren Hämatoms überwacht werden.
REFERENZEN
- Plagne R: L'hematoma extradural rachidien non traumatique (hematoma epidural spontane) [Dissertation]. Clermont-Ferrand, Frankreich: Universität Clermont-Ferrand, 1961.
- Jackson R: Fall von spinaler Apoplexie. Lancet 1869;2:538–539.
- Holtas S, Heiling M, Lonntoft M: Spontanes spinales epidurales Hämatom: Befunde bei der MR-Bildgebung und klinische Korrelation. Radiologie 1996;199: 409–413.
- Alexiadou-Rudolf C, Ernestus R, Nanassis K, et al: Acute nontraumatic spinal epidural hematomas. Wirbelsäule 1998;23:1810–1813.
- Tekkok IH, Cataltepe O, Tata K, et al: Extradurales Hämatom nach kontinuierlicher extraduraler Anästhesie. Br. J. Anaesth 1991;67:112–115.
- Hejazi N, Thaper PY, Hassler W: Neun Fälle von nichttraumatischem epiduralem Hämatom der Wirbelsäule. Neurol Med Chir 1998;38:718–723.
- Sokolowski MJ, Garvey TA, Perl J, et al: Prospektive Studie zum postoperativen lumbalen epiduralen Hämatom. Wirbelsäule 2008;33:108–113.
- Glotzbecker MP, Bono CM, Wood KB, Harris M: Postoperatives epidurales Hämatom der Wirbelsäule: eine systematische Überprüfung. Wirbelsäule 2010;35:E413–E420.
- Tryba M: Epidural-Regionalanästhesie und niedermolekulares Heparin: pro. Anasthesiol Intensivmed Notfallmed Schmerzther 1993;28:179–181.
- Horlocker T: Komplikationen der Regionalanästhesie und Akutschmerztherapie. Anesthesiol Clin 2011;29:257–278.
- Moen V, Dahlgren N, Irestedt L: Schwere neurologische Komplikationen nach zentralen neuraxialen Blockaden in Schweden 1990–1999. Anesthesiology 2004;101:950–959.
- Popping DM, Zahn PK, Van Aken HK, Dasch B, Boche R, Pogatzki-Zahn EM: Wirksamkeit und Sicherheit der postoperativen Schmerzbehandlung: eine Befragung von 18,925 konsekutiven Patienten zwischen 1998 und 2006 (2. Überarbeitung): eine Datenbankanalyse von prospektiv erhobenen Daten. Br. J. Anaesth 2008;101:832–840.
- Horlocker T, Kopp S: Epiduralhämatom nach Epiduralblockade in den USA: Es ist nicht mehr nur niedermolekulares Heparin nach orthopädischer Operation. Anesth Analg 2013;116:1195–1197.
- Bateman BT, Mhyre JM, Ehrenfeld J, et al: Das Risiko und die Ergebnisse von epiduralen Hämatomen nach perioperativer und geburtshilflicher Epiduralkatheterisierung: ein Bericht des Forschungskonsortiums der multizentrischen Gruppe für perioperative Ergebnisse. Anesth Analg 2013;116:1380–1385.
- Usubiaga JE, WJ, Usabiaga LE: Epiduraldruck und seine Beziehung zur Ausbreitung von Anästhesielösungen im Epiduralraum. Anesth Analg 1967;46:440–446.
- Cummings SR, Nevitt MC, Browner WS, et al.: Die Studie der Forschungsgruppe für osteoporotische Frakturen: Risikofaktoren für Hüftfrakturen bei weißen Frauen. N. Engl. J. Med. 1995;332:767–773.
- Hasserius R, Johnell O, Nilsson BE, et al: Patienten mit Hüftfraktur haben mehr Wirbeldeformitäten als Probanden in bevölkerungsbezogenen Studien. Knochen 2003; 32:180–184.
- Awad JK, Kebaish KM, Donigan J, Cohen DB, Kostuik JP: Analyse von Risikofaktoren für die Entwicklung eines postoperativen spinalen epiduralen Hämatoms. J Bone Joint Surg Br 2005;87:1248–1252.
- Horlocker TT, Wedel DJ: Neuroaxiale Blockade und niedermolekulares Heparin: Balance zwischen perioperativer Analgesie und Thromboprophylaxe. Reg Anesth 1998;23:164–177.
- Johnston RA: Das Management der akuten Kompression des Rückenmarks. J Neurol Neurosurg Psychiatr 1993;56:1046–1054.
- Wysowski DK, Talarico L, Bacsanyi J, et al: Spinales und epidurales Hämatom und niedermolekulares Heparin. N. Engl. J. Med. 1998;338: 1774–1775.
- Vandermeulen E, Van Aken H, Vermylen J: Antikoagulantien und Spinalepiduralanästhesie. Anesth Analg 1994;79:1165–1177.
- Dickman CA, Shedd SA, Spetzler RF: Spinales Epiduralhämatom im Zusammenhang mit Epiduralanästhesie: Komplikationen der systemischen Heparinisierung bei Patienten, die eine periphere vaskuläre Thrombolysetherapie erhalten. Anesthesiology 1990;72:947–950.
- Mattle H, Sieb JP, Rohner M, et al: Nontraumatic spinal epidural and subdural hematomas. Neurologie 1987;37:1351–1356.
- Levine MN, Goldhaber SZ, Gore JM, et al: Hämorrhagische Komplikationen der thrombolytischen Therapie bei der Behandlung von Myokardinfarkt und venöser Thromboembolie. Chest 1995;108(Suppl 4):291S–301S.
- Graziani N, Bouillot P, Figarella-Bragner D, et al: Kavernöse Angiome und arteriovenöse Fehlbildungen des spinalen Epiduralraums: Bericht über 11 Fälle. Neurochirurgie 1994;35:856–864.
- Harik S, Raichle M, Reis D: Spontan remittierendes spinales Epiduralhämatom bei einem Patienten unter Antikoagulanzien. N. Engl. J. Med. 1971;284: 1355–1357.
- Zuccarello M, Scanarini M, D'Avella, et al: Spontanes spinales extradurales Hämatom während der Antikoagulanzientherapie. Surger Neurol 1980;14:411–413.
- Chen C, Fang W, Chen C, et al: Spontane epidurale Hämatome der Wirbelsäule mit wiederholter Remission und Rückfall. Neuroradiology 1997;39:737–740.
- Groen R, Ponssen H: Das spontane epidurale Hämatom der Wirbelsäule: eine Untersuchung der Ätiologie. J. Neurolog Sci 1990;98:121–138.
- Packer N, Cummins B: Spontane Epiduralblutung: ein chirurgischer Notfall. Lancet 1978;1:356–358.
- Hebl JR, Horlocker TT, Kopp SL, Schroeder DR: Neuraxialer Block bei Patienten mit vorbestehender Spinalkanalstenose, Bandscheibenerkrankung oder vorheriger Wirbelsäulenoperation: Wirksamkeit und neurologische Komplikationen. Anesth Analg 2010;111:1511–1519.
- Joseph A, Vinen J: Akutes epidurales Hämatom der Wirbelsäule. J Emerg Med 1993;11:437–441.
- Beatty RM, Winston KR: Spontanes zervikales Epiduralhämatom. Eine Betrachtung der Ätiologie. J Neurosurg 1984;61:143–148.
- Pan G, Kulkarni M, MacDougall DJ, et al: Traumatisches Epiduralhämatom der Halswirbelsäule: Diagnose mit Magnetresonanztomographie. J Neurosurg 1988;68:798–801.
- Foo D, Rossier A: Präoperativer neurologischer Status bei der Vorhersage des chirurgischen Ergebnisses von spinalen epiduralen Hämatomen. Surger Neurol 1981;15:389–340.
- David S, Salluzzo RF, Bartfield JM, et al: Spontanes zervikothorakales epidurales Hamam nach längerer Valsalva-Sekundärwirkung auf Trompetenspiel. Am J Emerg Med 1997;15:73–75.
- Fukui M, Swarnkar A, Williams R: Akute spontane spinale Epiduralhämatome. Am J Neuroradiol 1999;20:1365–1372.
- Joseph A, Vinen J: Akutes epidurales Hämatom der Wirbelsäule. J Emerg Med 1993;11:437–441.
- Bidzinski J: Spontanes spinales Epiduralhämatom während der Schwangerschaft. J Neurosurg 1966;24:1017–1018.
- Carroll S, Malhotra R, Eustace D, et al: Spontanes spinales extradurales Hämatom während der Schwangerschaft. J Matern Fetal Med 1997;6:218–219.
- Stoll AS, Sanchez M: Epiduralhämatom nach Epiduralblockade: Implikationen für seine Verwendung in der Schmerzbehandlung. Surger Neurol 2002;57:235–240.
- Bruyn GW, Bosma NJ: Spinales extradurales Hämatom. In Vinken PJ, Bruyn GW (Hrsg.): Handbuch der klinischen Neurologie. Nordholland, 1976, S. 1–30.
- Horlocker T, Wedel DJ, Rowlingson JC, et al: Regionalanästhesie bei Patienten, die eine antithrombotische oder thrombolytische Therapie erhalten: Evidenzbasierte Leitlinien der American Society of Regional Anästhesie und Schmerzmedizin (dritte Ausgabe). Reg Anesth Pain Med 2010;35:64–101.
- Matsume M, Shimoda M, Shibuya N: Spontanes zervikales Epiduralhämatom. Surger Neurol 1987;28:381–384.
- Lonjon M, Paquis P, Chanalet S, et al: Nichttraumatisches spinales Epiduralhämatom: Bericht über vier Fälle und Literaturübersicht. Neurochirurgie 1997;41:483–487.
- Cwik J: Postoperative Überlegungen zur neuraxialen Anästhesie. Anesthesiol Clin 2012;30:433–443.
- Lawton M, Porter R, Heiserman J, et al: Chirurgisches Management von epiduralen Hämatomen der Wirbelsäule: Beziehung zwischen chirurgischem Timing und neurologischem Ergebnis. J Neurosurg 1995;83:1–7.
- Avrahami E, Tadmor R, Ram Z, et al: MR-Demonstration eines spontanen akuten epiduralen Hämatoms der Brustwirbelsäule. Neuroradiology 1989;31:89–92.
- Mattle H, Sieb J, Rohner M, et al: Nontraumatic spinal epidural and subdural hematomas. Neurologie 1987;37:1351–1356.
- Beatty RM, Winston KR: Spontanes zervikales Epiduralhämatom. Eine Betrachtung der Ätiologie. J Neurosurg 1984;61:143–148.
- Cooper DW: Spontanes spinales Epiduralhämatom. Fallbericht. J Neurosurg 1967;26:343–345.
- Uribe JM, Moza K, Jimenez O, Green B, Levi AD: Verzögerte postoperative epidurale Hämatome der Wirbelsäule. Spine J 2003;3:125–129.
- W. Gogarten, E. Vandermeulen, H. Van Aken, S. Kozek, J. V. Llau, CM Samama; European Society of Anaesthesiology: Regionalanästhesie und Antithrombotika: Empfehlungen der European Society of Anaesthesiology. Eur J Anaesthesiol 2010;27:999–1015.
- Breivik H., Bang U., Jalonen J., Vigfusson G., Alahuhta S., Lagerkranser M.: Nordische Leitlinien für neuraxiale Blockaden bei gestörter Hämostase von der Scandinavian Society of Anaesthesiology and Intensive Care Medicine. Acta Anaesthesiol Scand 2010;54:16–41.
- Jacobs LJ, Woods BI, Chen AF, Lunardini DJ, Holh JB, Lee JY: Die Sicherheit der thromboembolischen Chemoprophylaxe bei Patienten mit Wirbelsäulentrauma, die eine chirurgische Stabilisierung benötigen. Wirbelsäule 2013;38:E1041–7.
- Pahapill PA, Lownie SP: Konservative Behandlung des akuten spontanen epiduralen Hämatoms der Wirbelsäule. Can J Anaesth 1998;25:159–163.
- Schwarz SK, Wong CL, McDonald WN: Spontanheilung von einem epiduralen Hämatom der Wirbelsäule mit atypischer Präsentation bei einem Neunzigjährigen. Can J. Anesth 2004;51:557–561.
- Benzon HT, Snitzer J, Hoxie S, Pollina R, Nelson A: Überprüfung von Fallberichten über spinale Hämatome. Präsentiert auf der Jahrestagung der American Society of Anesthesiologists, Washington, DC, 16. Oktober 2012.
- Tailor J, Dunn IF, Smith E: Konservatives Management eines spontanen spinalen epiduralen Hämatoms im Zusammenhang mit einer oralen Antikoagulanzientherapie bei einem Kind. Childs Nerv Syst 2006;22:1643–1645.
- Connoly SE, Winfree CJ, McCormick PC: Management von epiduralen Hämatomen der Wirbelsäule nach Gewebe-Plasminogen-Aktivator. Ein Fallbericht. Wirbelsäule 1996;21:1694–1698.
- Lopez AG, Lara JMP, Hidalgo RH, Gonzalo PE; Spinales epidurales Hämatom nach thrombolytischer Therapie bei akutem Myokardinfarkt. Orthopädie 1999;22:987–988.
- Marzai H, Eminoglu M, Orguc S: Sind Drainagen bei Bandscheibenoperationen sinnvoll? Eine prospektive randomisierte klinische Studie. J Spinal Disord Tech 2006;19:171–177.
- Hejazi N, Thaper PY, Hassler W: Neun Fälle von nichttraumatischem epiduralem Hämatom der Wirbelsäule. Neurol Med Chir 1998;38:718–723.
- Wolfgang P, Klaus M: Spinales Hämatom ohne Voroperationsbezug: Analyse von 15 konsekutiven Fällen, die in einer einzigen Institution innerhalb von 10 Jahren behandelt wurden. Wirbelsäule 2004;24:555–561.
- Rohde V, Küker W, Reinges MHT, et al: Mikrochirurgische Behandlung spontaner und nicht spontaner spinaler epiduraler Hämatome: neurologisches Ergebnis in Bezug auf die Ätiologie. Acta Neurochir 2000;142: 787–793.
- Wulf H: Epiduralanästhesie und spinales Hämatom. Can J Anaesth 1996;43:1260–1271.
- Mukerji N, Todd N. Spinales Epiduralhämatom; Faktoren, die das Ergebnis beeinflussen. Br J Neurosurg 2013;27:712–717.
- Groen RT, Van Alphen HA: Operative Behandlung von spontanen epiduralen Hämatomen der Wirbelsäule: eine Studie der Faktoren, die das postoperative Ergebnis bestimmen. Neurochirurgie 1996;39:494–508.
- Enomato T, Maki Y, Nakagawa K, et al: Spontanes spinales epidurales Hämatom: Bericht über einen Fall. Neurol Surg 1980;8:875–880.
- Klein SM, D'Ercole F, Greengrass RA, et al: Enoxaparin im Zusammenhang mit Psoas-Hämatomen und lumbaler Plexopathie nach lumbaler Plexusblockade. Anästhesiologie 1997;87:1576–1579.
- Weller RS, Gerancher JC, Crews JC, et al: Ausgedehntes retroperitoneales Hämatom ohne neurologisches Defizit bei zwei Patienten, die sich einer Plexus-Lumbal-Blockade unterzogen und später antikoaguliert wurden. Anesthesiology 2003;98:581–583.
- Maier C, Gleim M, Weiss T, Stachetzki U, Nicolas V, Zenz M: Schwere Blutungen nach lumbaler Sympathikusblockade bei zwei Patienten unter Medikation mit irreversiblen Thrombozytenaggregationshemmern. Anesthesiology 2002;97:740–743.
- Poivert C, Malinovsky JM: Oberschenkelhämatom nach Ischiasnervenblockade und Fondaparinux. Ann Fr. Anesth Reanim 2012;31:484–485.
- Ferraro LH, Tardelli MA, Yamashita AM, Cardone JD, Kishi JM: Ultraschallgeführte Femur- und Ischiasnervblockaden bei einem antikoagulierten Patienten. Fallberichte. Rev Bras Anestesiol 2010;60:422–428.
- Clendenen SR, Robards CB, Wang RD, Greengrass RA: Kontinuierlicher Skalenusblock im Zusammenhang mit Halshämatomen und postoperativer Sepsis. Anesth Analg 2010;110:1236–1238.
- Johr M: Eine Komplikation einer kontinuierlichen Blockade des N. femoralis. Reg Anaesth (deutsch) 1987;10:37–38.
- Neuberger M, Breithbarth J, Reisig F, Lang D, Buttner J: Komplikationen und Nebenwirkungen bei der kontinuierlichen peripheren Regionalanästhesie. Untersuchungsergebnisse an 3,491 Kathetern. Anaesthesist 2006;55: 33–40.
- Wiegel M, Gottschaldt U, Hennebach R, Hirschberg T, Reske A: Komplikationen und Nebenwirkungen im Zusammenhang mit kontinuierlichen peripheren Nervenblockaden bei orthopädischen Patienten. Anesth Analg 2007;104: 1578–1582.
- Enneking FK, Chan V, Greger J, Hadzic A, Lang SA, Horlocker TT: Periphere Nervenblockade der unteren Extremitäten: Grundlagen unseres aktuellen Verständnisses. Reg Anesth Pain Med 2005;30:4–35.
- Antonelli D, Fares L, Anene C: Enoxaparin im Zusammenhang mit riesigen Bauchwandhämatomen: ein Bericht über zwei Fälle. Am Surgeon 2000;66:797–800.
- Dickinson LD, Miller L, Patel CP, et al: Enoxaparin erhöht die Inzidenz postoperativer intrakranieller Blutungen, wenn es präoperativ zur Prophylaxe tiefer Venenthrombosen bei Hirntumoren eingeleitet wird. Neurochirurgie 1998;43:1074–1081.
- Ho KJ, Gawley SD, Young MR: Psoas-Hämatom und femorale Neuropathie im Zusammenhang mit einer Enoxaparin-Therapie. Int J Clin Pract 2003;57:553–554.
- Houde JP, Steinberg G: Intrahepatische Blutung nach Verwendung von niedermolekularem Heparin für eine totale Hüftendoprothetik. J Arthroplasty 1999;14:372–374.
- King CS, Holley AB, Jackson JL, et al.: Zweimal versus dreimal tägliche Heparindosierung zur Thromboembolieprophylaxe in der Allgemeinbevölkerung: eine Metaanalyse. Brust 2007;131:507–516.
- Kozek-Langenecker SA, Fries D, Gutl M, et al: Lokoregionale Anästhesie und Gerinnung bei Inhibitoren. Empfehlungen der Task Force Perioperative Gerinnung der Österreichischen Gesellschaft für Anästhesiologie und Intensivmedizin. Anaesthesist 2005;54:476–484.
- Abrahams MS, Aziz MF, Fu RF, Horn JL: Ultraschallführung im Vergleich mit elektrischer Neurostimulation bei peripherer Nervenblockade: eine systematische Überprüfung und Metaanalyse randomisierter kontrollierter Studien. Br. J. Anaesth 2009;102:408–417.
- Barrington MJ, Watts SA, Gledhill RA, et al: Vorläufige Ergebnisse der Australasian Regional Anästhesie-Kollaboration: eine prospektive Prüfung von mehr als 7000 peripheren Nerven- und Plexusblockaden auf neurologische und andere Komplikationen. Reg Anesth Pain Med 2009;34:534–541.
- Sites BD, Taenzer AH, Herrick MD, et al: Inzidenz lokaler systemischer Toxizität und postoperativer neurologischer Symptome im Zusammenhang mit 12,668 ultraschallgeführten Nervenblockaden. Eine Analyse aus einem prospektiven klinischen Register. Reg Anesth Pain Med 2012;37:478–482.
- Orebaugh SL, Mentor ML, Williams BA: Unerwünschte Ergebnisse im Zusammenhang mit Nervenstimulator-geführten und Ultraschall-geführten peripheren Nervenblockaden durch beaufsichtigte Auszubildende: Aktualisierung einer Single-Site-Datenbank. Reg Anesth Pain Med 2012;37:577–582.
- Barrington MJ, Kluger R: Die Ultraschallführung reduziert das Risiko einer Lokalanästhetika-Toxizität nach einer peripheren Nervenblockade. Reg Anesth Pain Med 2013;38:289–299.
- Monib S, Ritchie A, Thabet E: Idiopathisches retroperitoneales Hämatom. J Surg Tech Case Rep 2011;3:49–51.
- Aida S, Takahashi H, Shimoji K: Renales subkapsuläres Hämatom nach lumbaler Plexusblockade. Anesthesiology 1996;84:452–455.