超音波 (US) ガイド下神経ブロックの安全性と有効性は、機械の「ノブロジー」の包括的な理解に大きく依存しています [1–3]。 外観とレイアウトの違いにもかかわらず、すべての米国のマシンは、ユーザーが画像を最適化するために理解する必要がある同じ基本操作機能を共有しています。 最新の米国のマシンは豊富な機能を提供していますが、すべてのオペレーターが熟知している必要がある基本機能は、周波数とプローブの選択、深さ、ゲイン、時間ゲイン補正 (TGC)、フォーカス、事前にプログラムされたプリセット、カラー ドップラー、パワー ドップラー、複合イメージングです。 、ティッシュ ハーモニック イメージング (THI) (一部のモデル)、および画像のフリーズと取得。 米国の物理的原則が理解されると、「最高の」イメージを作成することは、多くの場合、ある機能を改善することと別の機能を犠牲にすることの間の一連のトレードオフであることが明らかになります. 前述の各機能は、米国のガイド付き介入を実行するときに使用するシーケンスに従って、以下に順番に表示されます.
1. 周波数とプローブの選択
放射される米国の波の適切な周波数を選択することは、おそらくすべての調整の中で最も重要です。 超音波は、方程式 v = f × λ で表されるように、特定の周波数 (f) と波長 (λ) によって特徴付けられます。ここで、v は波が伝わる速度です (すべての機械は、超音波が軟部組織を伝わると想定しています)。 1540 m/s で)。 神経ブロックに使用される周波数の範囲は 3 ~ 15 MHz です。 より高い周波数は、優れた軸方向分解能を提供します (図1).
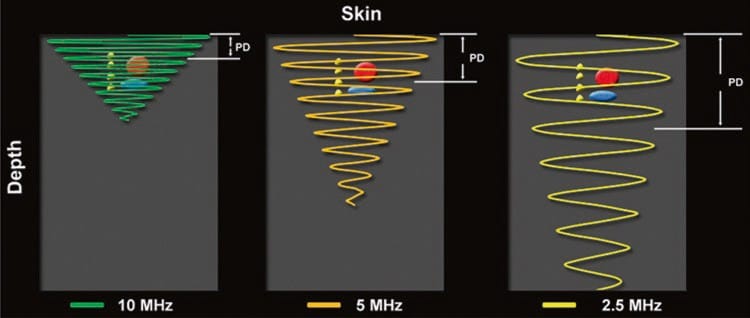
図1 超音波周波数が高いほど、パルス幅が短くなり、軸方向分解能が向上します。 低い周波数を使用する場合はその逆です
概念的には、軸方向の解像度により、超音波画像内の異なる深さ (y 軸)、つまり互いの上と下に近接して配置された構造を区別することができます。 軸方向の解像度が低い、または周波数が不適切であると、実際には上下に XNUMX つの構造が存在する場合でも、US 画像上に XNUMX つの構造しか生成されないため、誤解を招く可能性があります (図2).

図 2 軸方向分解能は、ビームに平行な方向 (y 軸) で重なり合っている XNUMX つの構造を視覚的に分離する超音波装置の能力を表します。 周波数が高くなるにつれて、軸方向の分解能は向上しますが、浸透の深さは減少します。 低周波
残念ながら、高周波は低周波よりも減衰します。 以下でより詳細に説明する減衰(「時間利得補償」を参照)は、超音波がプローブから標的組織に移動し、再びプローブに戻る際のエネルギー(すなわち、信号強度)の漸進的な損失を指す。画像への処理 (図3) [1]。 過剰な減衰の最終結果は、識別できない画像になります。 したがって、オペレーターは、ターゲットを視覚化するために適切な深さまで浸透できるようにしながら、可能な限り高い周波数を選択する必要があります。 高周波トランスデューサは、最大 3 ~ 4 cm の深さに最適です。 その後、より低い周波数のプローブが必要になることがよくあります。
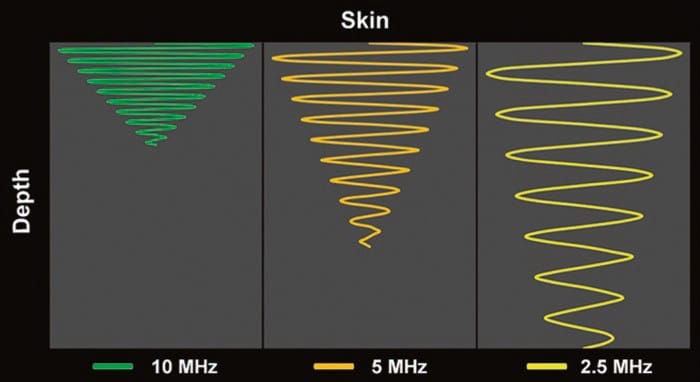
図 3 減衰量は、超音波の周波数と超音波の移動距離によって直接変化します。 与えられた距離 (深さ) で、より高い周波数 (10 MHz) の超音波がより低い周波数 (5 および 2.5 MHz) の超音波に比べてどのように減衰するかに注意してください。
プローブのカテゴリは、高 (8 ~ 12 MHz)、中 (6 ~ 10 MHz)、低 (2 ~ 5 MHz) の周波数範囲に分類できます。 一部のマシンでは、さまざまなプローブが常に接続されており、目的のプローブを選択するには、セレクター スイッチを切り替えるだけで済みます。 他のマシンでは、異なるプローブを毎回物理的に取り外して取り付ける必要があります。 ほとんどの US プローブには、「中心」(つまり、最適) 周波数と、この中心周波数の両側に帯域幅として知られる周波数範囲があります。 したがって、適切なプローブを選択した後、オペレータは、各トランスデューサの帯域幅から高域、中域、または低域の周波数のみをアクティブに選択することにより、トランスデューサから放出される超音波の周波数を微調整できます。
2.深さ
深度設定は、対象の構造が視野内に収まるように調整する必要があります (図4)。 目的は、深さを目的のターゲットのすぐ下に設定することです。
これにはXNUMXつの目的があります。
- 第一に、ディスプレイが有限サイズであるため、必要以上の深さでイメージングすると、ターゲットが小さくなります。 ターゲットが小さいほど、通常、視覚化して針でアプローチするのが難しくなります (図 4b).
- 第二に、深さを最小化すると、時間分解能が最適化されます。 時間分解能はフレーム レートと考えることができ、連続したリアルタイム イメージングで最高潮に達するために連続した一意の画像が生成される速度 (XNUMX 秒あたりのフレーム数で表される) を指します。
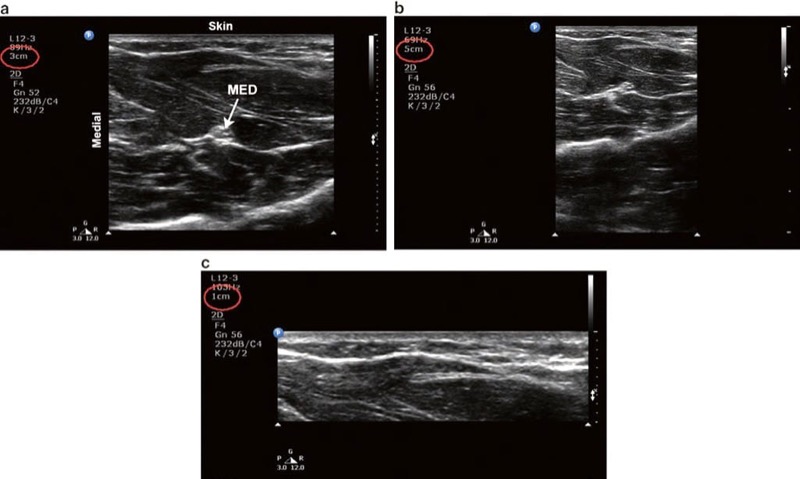
図4 深さ。 (a) 最適な深度設定。 正中神経 (MED) と周囲の筋肉組織が明らかです。 (b) 過度の深度設定。 深さの設定が深すぎるため、ターゲット構造の相対的なサイズが縮小されます。 (c) 深さの設定が不十分。 MED が表示されない
時間分解能は、フルセクタービームを形成するために連続した US 波が放射される速度 (通常は 1 秒あたり数千のオーダー) に依存します。 US 波は実際にはパルスで放射され、前のパルスがトランスデューサーに戻ったときにのみ次のパルスが放射されるため、より深い構造ではこの全体的な放射速度が遅くなる必要があります。したがって、上で説明したように、機能間のさらに別のトレードオフで深さが増加すると、時間解像度が失われます。現代の米国のマシンは、セクター ビームの幅を減らすことによって時間解像度を維持します。これは、深度が増加すると画面イメージが自動的に狭くなる理由を説明します。セクタ幅を縮小すると、トランスデューサに戻らなければならない放射波の数が効果的に減少するため、画像が表示されるまでの時間が短縮され、フレーム レートが維持されます。心臓の画像処理時とは異なり、動く物体を視覚化することが重要である場合、局所麻酔および局所麻酔では時間分解能はそれほど重要ではありません。 痛み管理。ただし、フレーム レートが低い場合でも、針の移動中または局所麻酔薬の急速注入中にぼやけた画像が作成されるため、重大な影響を与える可能性があります。
3.ゲイン
ゲイン ダイアルは、画像がどの程度明るい (高反響) または暗い (低反響) かを決定します。 プローブに戻ってくるエコーの機械的エネルギーは、US マシンによって電気信号に変換され、それが次に表示される画像に変換されます。 ゲインを上げると、これらすべての反射エコーによって生成される電気信号が増幅され、バックグラウンド ノイズを含む画像全体の明るさが増します (図5b)。 ゲイン ダイヤルを調整するときは注意が必要です。一部の初心者は明るければ明るいほどよいと認識していますが、ゲインが高すぎると、実際には人工的なエコーが発生したり、既存の構造が不明瞭になったりする可能性があります。 同様に、ゲインが小さすぎると、オペレーターが実際のエコー情報を失う可能性があります (図5c)。 最後に、ゲインを上げると横方向の解像度も低下します。 横方向の解像度とは、オブジェクトを並べて区別する能力を指し、次のレッスンで説明します。
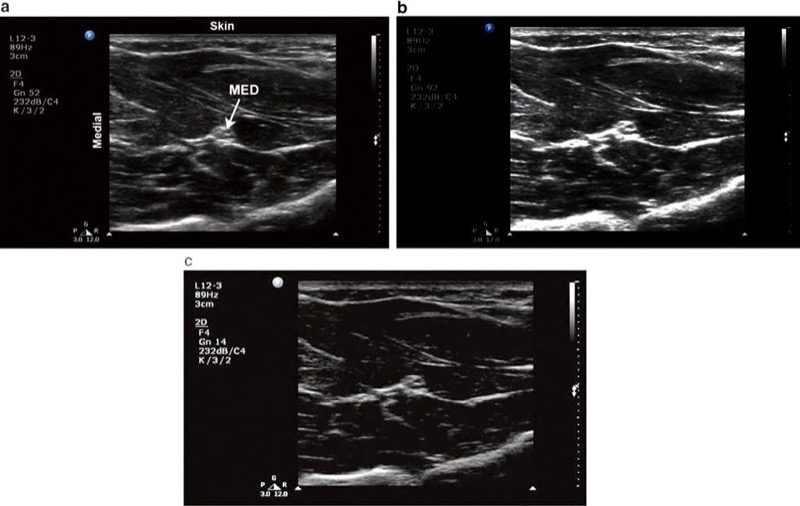
図 5 ゲイン。 (a) 最適なゲイン設定。 ターゲット正中神経 (MED) と前腕の周囲の筋肉組織が明らかです。 (b) ゲイン調整が高すぎる。 (c) ゲイン調整が低すぎる
4. タイムゲイン補正
ゲイン ダイヤルと同様に、TGC 機能により、オペレーターは明るさを調整できます。 ゲイン ダイヤルは全体的な明るさを増加させますが、TGC は、オペレーターが被写界の特定の深さで明るさを個別に調整できるようにする点で異なります (図6)。 TGC の目的を理解するには、減衰の原理を十分に理解する必要があります。 組織を通過する超音波は、主に吸収のためだけでなく、反射と屈折の結果としても減衰します。 減衰は、ビーム周波数 (前述のように、より高い周波数の波はより減衰します) と、超音波が通過する組織のタイプ (各組織タイプの特性減衰係数によって表されます) の両方に応じて異なります。 減衰も浸透の深さとともに増加するため、マシンがプローブに戻るエコーの振幅を実際に表示した場合、画像は表面から深部に向かって次第に暗くなります. これは、遠くから戻ってくる波がより減衰されるためです。 米国のマシンは減衰を自動的に補正するように設計されていますが、マシンの自動補正は必ずしも正確ではありません。 より均一な画像を作成するために、TGC は最も一般的には、遠視野の構造 (つまり、深い構造) の輝度を高めるように調整されます。 一部のマシンには、ディスプレイの小さなセグメントごとに個別のコントロール (「スライド ポット」) がありますが (Philips、GE)、他のマシンは、より単純に「近く」と「遠く」のゲインを備えています (SonoSite)。 個々のスライド ポットが存在する場合、最適な構成は通常、上記の減衰を補償するためにゲインを表面から深部までわずかに増加させることです。
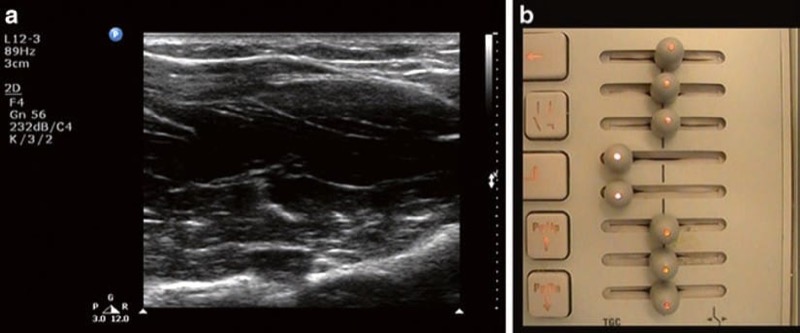
図 6 不適切な時間ゲイン補正設定。 (a) 正中神経は、画像中央の低エコー帯域により見えません。 これは、タイムゲイン補正ダイヤル (b) の不適切な低い設定が原因で、アンダーゲインの帯域が作成されます。
5.フォーカス
フォーカス ボタンはすべてのマシンにあるわけではありませんが、使用可能な場合は、横方向の解像度を最適化するように調整できます。 横方向の分解能とは、US ビームに対して垂直に、同じ深さで隣り合わせにある XNUMX つのオブジェクトを識別する機械の能力を指します (図7)。 トランスデューサの表面に並列に配置された複数の圧電素子が個々の波を放出し、それらが一緒になって 3D US ビームを生成します。 この 3-D US ビームは、最初に焦点ゾーンと呼ばれるビームが最も狭いポイントに収束し (フレネル ゾーン)、組織を伝搬するにつれて発散します (フラウンホーファー ゾーン)。図8).

図 7 横方向の解像度は、超音波装置がビームに垂直な方向 (x 軸) に並んでいる XNUMX つの構造を視覚的に分離する能力を表します。 振動数が増加すると、横方向の解像度は増加しますが、浸透の深さは減少します。 低周波は、横方向の分解能を犠牲にして、より深く浸透します。 周波数が低下するにつれて、超音波装置が各構造を明確に解決できなくなることに注意してください。
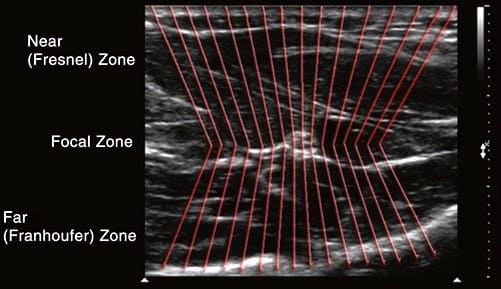
図8 焦点ゾーン。 焦点ゾーンは、ビームの収束が終わり発散が始まる境界です。 横方向の解像度は焦点ゾーンで最高です。 横方向の解像度は、超音波装置が並んでいる XNUMX つの構造を正しく区別する能力を表します (x 軸)
概念的には、ビームが発散すると、個々の要素波は平行に移動しなくなり、互いにますます離れていきます。 理想的には、XNUMX つの別個の構造が横方向の面でどれだけ近接して配置されていても、個々の要素の波がフィールド内のすべてのポイントに衝突します (その結果、対応する画像が生成されます)。 XNUMX つの個別の US 波が発散している場合、「間をすり抜ける」ことでターゲット オブジェクトを逃す可能性があります。 したがって、ビーム発散の量を制限すると、横方向の解像度が向上し、これは焦点ゾーンのレベルで最適です。 フォーカス ダイヤルの目的は、オペレータが焦点ゾーンを被写界のさまざまな深度に調整できるようにすることです。
関心のあるターゲットと同じレベルにフォーカスを配置することにより (図9)、ビーム発散の量を制限し、それに応じて横方向の分解能を最大化することができます。 フォーカス レベルは通常、画像の左または右にある小さな矢印で表されます。 一部のマシンは実際に複数の焦点ゾーンを設定する機能を提供しますが、焦点ゾーンの数を同時に増やすと、マシンが返されるエコーのリッスンと各画像の処理により多くの時間を費やすため、時間分解能が低下します。
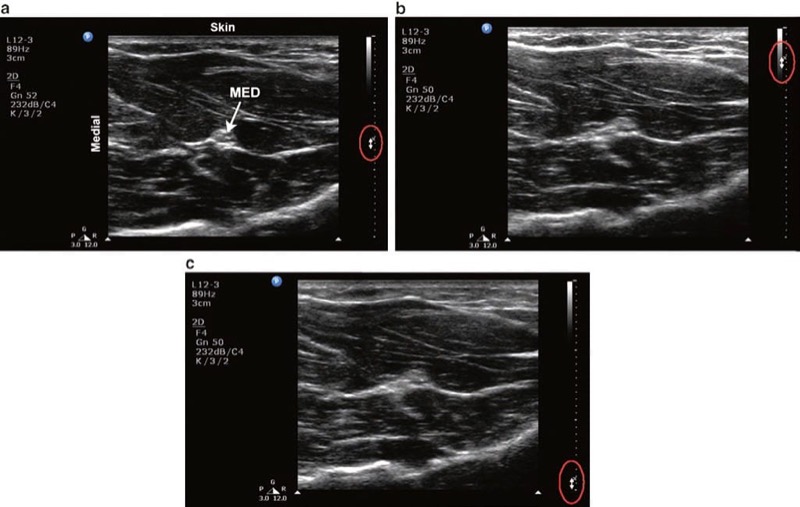
図 9 フォーカス。 (a) 前腕の正中神経 (MED) を表示するための正しいフォーカス設定。 画像の右端に沿った双方向の矢印は、フォーカス レベルの設定を示します。 (b) フォーカス レベルの設定が浅すぎる。 (c) フォーカスレベルの設定が深すぎる
6.プリセット
すべてのマシンには、特定の組織に一般的に最適な画像を作成するために、上記の設定の組み合わせを使用するプリセットがあります。 最も基本的なレベルでは、これは単純に神経または血管に対して設定される場合がありますが、他のマシンでは特定の神経ブロックごとに設定される場合があります。 これらは有用な出発点となりますが、通常、患者の体格と状態を補正するために、さらに手動で調整する必要があります。
7. カラードップラー
カラードップラー技術は、ドップラー情報をリアルタイム画像に重ね合わせ、血流の識別と定量化 (速度、方向) を容易にします。 ただし、超音波ガイド下の疼痛処置を行う麻酔科医にとってのドップラー技術の主な利点は、予想される針の軌道に血流がないことを確認できることです。
超音波に適用されるドップラー物理学は、音波が静止トランスデューサから放出され、移動する物体 (通常は赤血球) によって反射される場合、その反射音波の周波数が変化するという原理に関連しています (図10)。 血液がトランスデューサから遠ざかると、反射波は元の放射波よりも低い周波数で戻ります。 これは青色で表されます。 逆に、血液がトランスデューサに向かって移動している場合、反射波は元の放射波よりも高い周波数で戻ります。 これは赤い色で表されます。 オペレーターは、赤が必ずしも動脈血や青に関連付けられているわけではないことに注意する必要があります。 上記の周波数の変化はドップラー シフトとして知られており、心臓および血管のアプリケーションで血流速度と血流方向の両方を計算するために使用できるのはこの原理です。 ドップラー方程式は、:
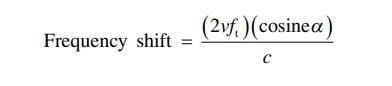
v は移動物体の速度、ft は送信周波数、α は US ビームと血流方向の間の入射角、c は血液中の US の速度です。 また、ビームの入射角が 90° に近づくと、90° のコサインが 0 になるため、ドップラー方程式に大きな誤差が生じることに注意することも重要です。 、偽陰性 – 図11)。 ゲイン機能で全体の明るさを調整できるように、ドップラー信号の表示量も調整できます。 一部の米国のマシンでは、ドップラー モードでゲイン ノブを回すことによってドップラー感度が調整されます。
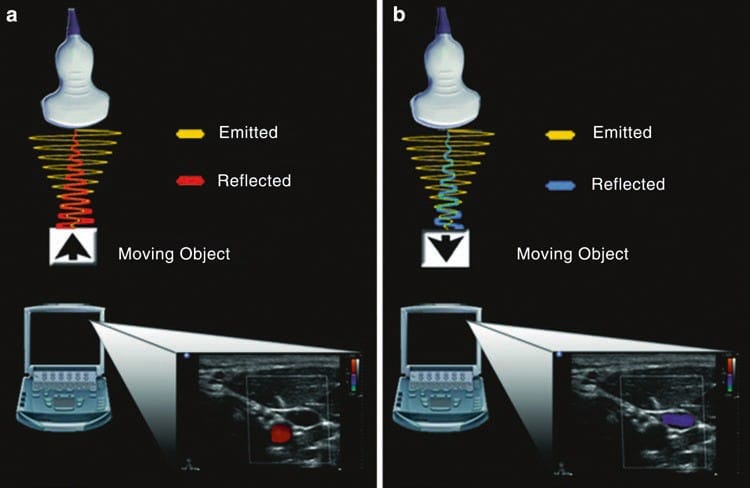
図10 ドップラー。 (a) トランスデューサから音波が放射され、トランスデューサに向かって移動する対象物から反射された場合、元の放射された音波よりも返ってくる周波数が高くなります。 超音波装置上の対応する画像は赤色で表されます。 (b) 逆に、対象物がトランスデューサから遠ざかっている場合、返ってくる周波数は元の放射された音波よりも低くなります。 超音波装置上の対応する画像は青色で表されます。
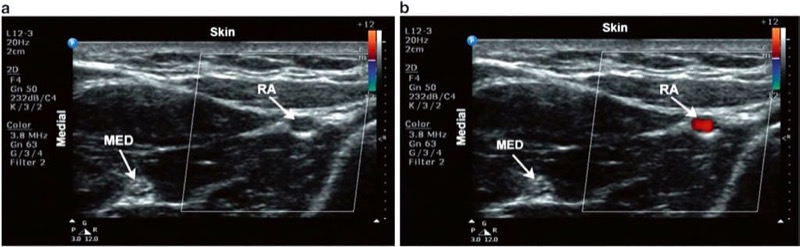
図 11 カラードップラー。 橈骨動脈の短軸像。 (a) ビームが血液の流れ方向に対して垂直である場合、流れは明らかではありません。 (b) プローブの傾きを調整すると、超音波照射の角度が変化し、その結果、血流が表示されます。
他のマシンには、別個のドップラー感度ノブがあります。 ただし、ドップラー感度を上げると、患者の微妙な動きによってモーション アーティファクト (偽陽性) が生成される可能性があることに注意してください。
ドップラー モードの場合、US マシンは、単純な B モード イメージングと比較して、返ってくるエコーを処理するのにより多くの時間を必要とするため、時間分解能が低下する可能性があります。 これは、この機能がオンになっているときに、ドップラー シフトについて画像の小さな領域 (通常は長方形または平行四辺形) のみが監視される理由を説明しています。 その後、オペレータは、トラックボールまたはタッチパッドを使用して、この形状を目的のターゲット上で移動できます。
8. パワードップラー
パワードップラーは米国の新しい技術で、血流の検出感度がカラードップラーの最大 XNUMX 倍であるため、標準のカラードップラーでは見ることが困難または不可能な血管を検出できます。 さらなる利点は、カラー ドップラーとは異なり、パワー ドップラーはほとんど角度に依存しないため、上記の偽陰性の発生率が減少することです。 ただし、このような利点は、呼吸などの微妙な動きを伴うより多くのモーション アーティファクトを犠牲にしてもたらされます。 パワー ドップラーのもう XNUMX つの欠点は、流れの方向を解決できないことです。 したがって、青または赤の色を表示するのではなく、フローを示すために、さまざまな色相で XNUMX つの色 (通常はオレンジ) のみが使用されます。
9. 複合イメージング
複合イメージングは、米国における最近の技術的進歩の XNUMX つです。 スペックルやその他の音響アーチファクトを低減することにより、従来の US と比較して画質が向上し、組織面の定義と針の視認性が向上します (図12).
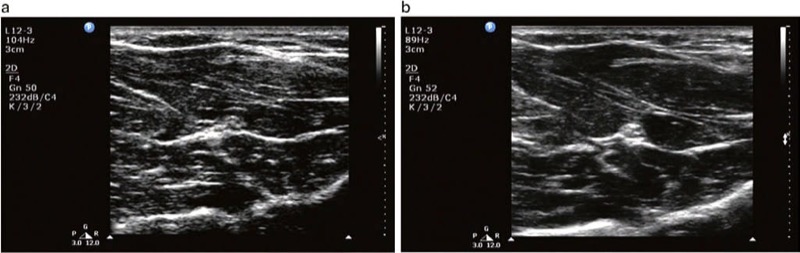
図 12 (a) オフモードでの複合イメージング。 (b) オン モードでの複合イメージング。 (b) と比較して (a) ではスペックル アーティファクトが大きく、解像度が低下していることに注意してください。
従来の US トランスデューサは、トランスデューサに垂直な一方向に音波を放射します。 最新の複合イメージングトランスデューサは、超音波をさまざまな角度で同時に放出して「操縦」できるため、複数の異なる角度のインソネーションから同じ組織の画像を生成できます (図13)。 複合イメージングは、すべての異なる角度から反射されたエコーを電子的に組み合わせて、単一の高品質の画像を生成することによって機能します (空間複合イメージング)。 周波数複合イメージングは似ていますが、超音波照射角度ではなく異なる周波数を使用して単一の画像を作成します。
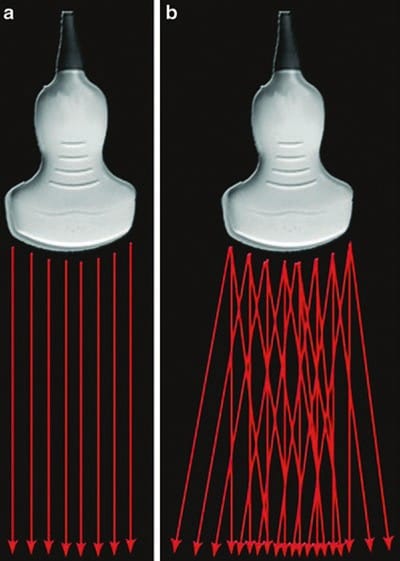
図13 ビームステア。 (a) 一方向に音波を放出する従来の超音波トランスデューサ。 (b) さまざまな角度で音波を放出する複合イメージング トランスデューサ。
10.組織ハーモニックイメージング
THI は、もう XNUMX つの比較的新しいテクノロジーです。 音波が身体組織を通過すると、高調波周波数が生成されます (図14)。 これらの高調波周波数は、元の基本周波数の倍数です。 THI が利用できる場合、トランスデューサは、画像処理のためにプローブに戻る際に、これらの高周波エコーを優先的にキャプチャします。 高調波周波数が高いため、アーティファクトが減少し、軸方向および横方向の解像度が向上します。 さらに重要な点は、従来の US とは異なり、これらのより高い周波数が浸透の深さを犠牲にすることなく達成されることです。 THI は、針の視認性を悪化させることが報告されていますが、低エコーの嚢胞構造の視覚化を特に改善するようです。
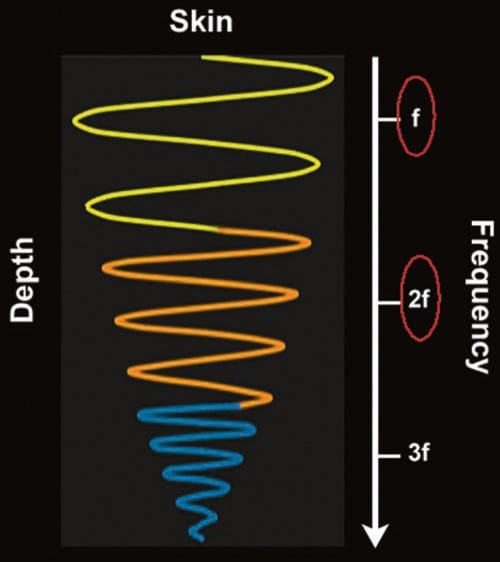
図 14 組織ハーモニクス。 超音波が組織を通過すると、途中で波の歪みが発生します。 結果として生じる歪んだ波は、基本(入力)周波数(f)の高調波(倍数)です。 2f、3f などの高い周波数では、解像度が高くなります。 組織高調波イメージングでは、超音波装置は基本周波数を含むほとんどの周波数を除外し、高調波の 2 つ、通常は第 XNUMX 高調波 (XNUMXf) を優先的に「聞く」ことで、軸方向と横方向の解像度が優れた画像が得られます。アーティファクト
11. 最適化ボタン
最近の多くのマシンには、自動画像最適化ボタンが実装されており、前述の機能の多くを瞬時に組み合わせて「理想的な画像」を作成します。 これは、画像の品質を改善するためのシンプルで効果的かつ迅速な方法ですが、さらに手動で調整する必要がある場合もあります。