Erika Cvetko, Marija Meznarič e Tatjana Stopar Pintaric
INTRODUZIONE
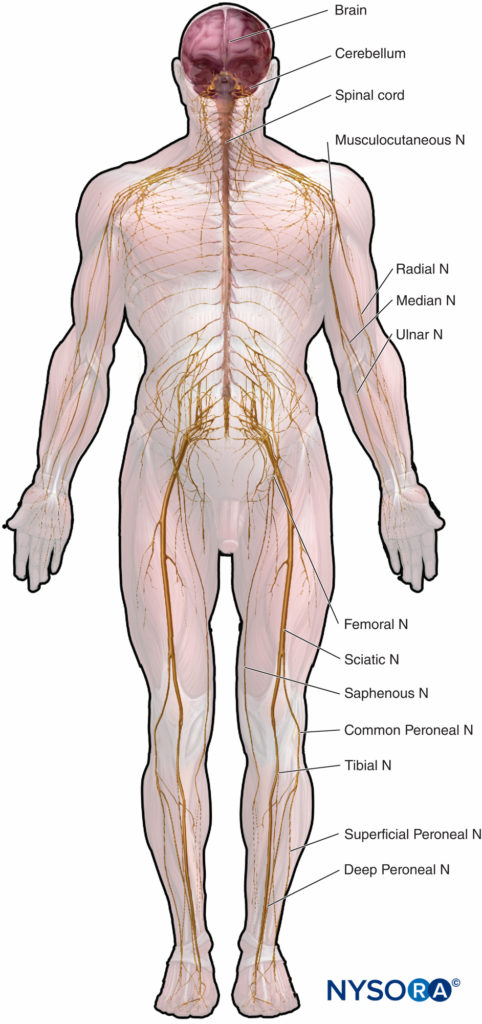
L'anatomia microscopica che enfatizzi le relazioni struttura-funzione è importante per la pratica clinica dell'anestesia regionale. Questo capitolo fornisce le basi per comprendere la struttura, la classificazione e l'organizzazione dei nervi periferici e per comprendere come le caratteristiche dei nervi periferici (figura 1) riguardano la pratica clinica dell'anestesia regionale.
ORGANIZZAZIONE DEL SISTEMA NERVOSO PERIFERICO
Il sistema nervoso consente al corpo di rispondere ai continui cambiamenti nei suoi ambienti esterni e interni. Controlla e integra le attività funzionali degli organi e dei sistemi di organi.
Le cellule del sistema nervoso sono costituite da neuroni e neuroglia. I neuroni trasmettono gli impulsi nervosi da e verso il sistema nervoso centrale (SNC), integrando così le funzioni motorie e sensoriali. Le cellule neurogliali supportano e proteggono i neuroni. Nel SNC, la mielina è prodotta dagli oligodendrociti e nel sistema nervoso periferico (SNP) dalle cellule di Schwann. Sebbene sia le cellule di Schwann che gli oligodendrociti siano responsabili della mielinizzazione degli assoni, hanno proprietà morfologiche e molecolari distinte e diverse origini embrionali, rispettivamente la cresta neurale e il tubo neurale.
Il SNP è costituito da nervi periferici (craniospinale, somatico, autonomo) con i gangli associati e gli investimenti di tessuto connettivo. Tutti giacciono periferici rispetto al rivestimento piale del SNC.
I nervi periferici contengono fasci di fibre nervose costituite da assoni. Nelle fibre nervose periferiche, gli assoni sono rivestiti dalle cellule di Schwann, che possono o meno formare mielina attorno agli assoni, a seconda del loro diametro. Le fibre nervose sono raggruppate in fascicoli di numero variabile. La dimensione, il numero e il modello dei fascicoli variano nei diversi nervi ea diversi livelli lungo i loro percorsi. Generalmente, il loro numero aumenta e la loro dimensione diminuisce ad una certa distanza prossimale al punto di ramificazione.
NEURONI
Un neurone è l'unità strutturale e funzionale del sistema nervoso. Comprende il corpo cellulare, i dendriti e l'assone.
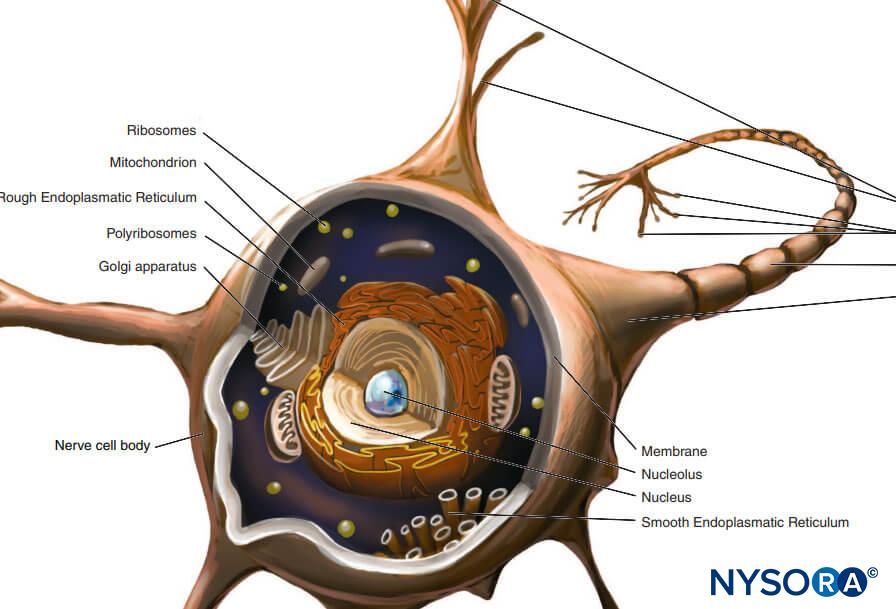
Il corpo cellulare (perykarion) è la regione dilatata del neurone che contiene un grande nucleo eucromatico con un nucleolo prominente e il citoplasma perinucleare circostante (figura 2). Il citoplasma perinucleare contiene abbondante reticolo endoplasmatico a superficie ruvida e ribosomi liberi. Al microscopio ottico, il reticolo endoplasmatico ruvido con rosette di ribosomi liberi appare come piccoli corpi, chiamati corpi di Nissl. Il citoplasma perinucleare contiene numerosi mitocondri, un grande apparato perinucleare del Golgi, liposomi, microtubuli, neurofilamenti, vescicole di trasporto e inclusioni. La presenza del nucleo eucromatico, del grande nucleolo, dell'apparato prominente del Golgi e dei corpi di Nissl indica l'alto livello di attività anabolica necessaria per mantenere queste grandi cellule.
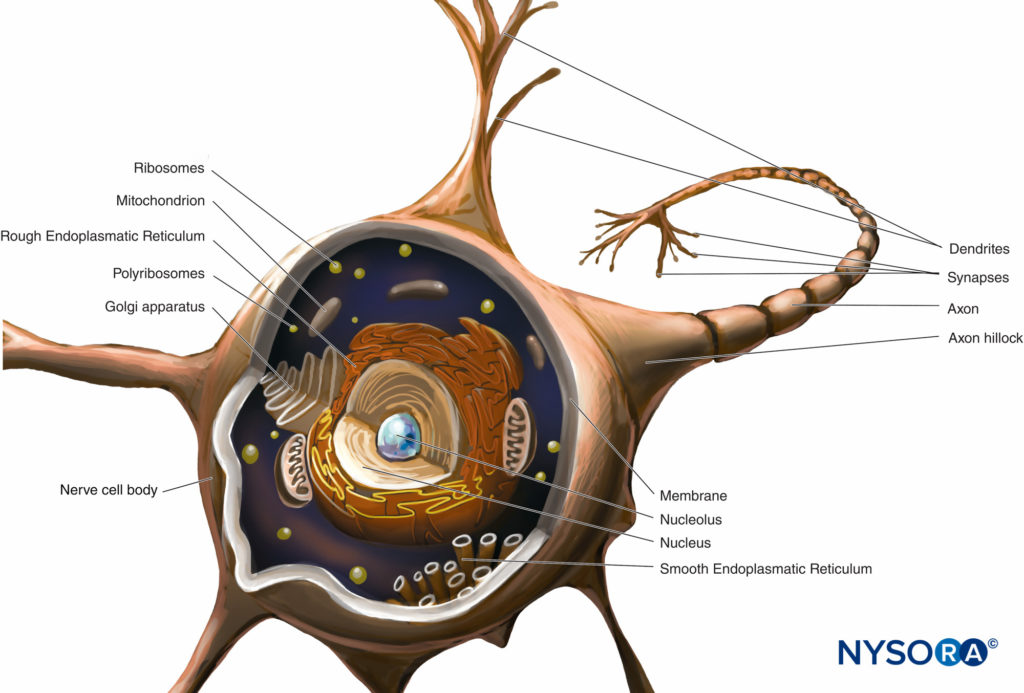
FIGURA 2. Schema di un neurone multipolare. Il corpo delle cellule nervose, i dendriti e la parte prossimale dell'assone si trovano all'interno del SNC. Gli assoni che escono dal SNC distalmente ai forami intervertebrali o ai forami del cranio costituiscono la parte principale del SNP.
dendriti sono elaborazioni della membrana plasmatica ricettiva del neurone. La maggior parte dei neuroni possiede più dendriti che in genere derivano dal corpo cellulare come singoli tronchi corti che si ramificano in rami più piccoli che si assottigliano alle estremità. I modelli di ramificazione dei dendriti sono caratteristici di ogni tipo di neurone. La base del dendrite contiene gli stessi organelli del corpo cellulare, ad eccezione dell'apparato di Golgi. Molti organelli diventano radi o assenti verso l'estremità distale del dendrite. La ramificazione dei dendriti si traduce in diversi terminali sinaptici e consente a un neurone di ricevere e integrare più impulsi.
L'assone nasce dal corpo cellulare come un unico processo sottile, molto più lungo dei dendriti. Il suo spessore è direttamente correlato alla velocità di conduzione, che aumenta con il diametro assonale. Alcuni assoni possiedono rami collaterali. La porzione dell'assone tra il corpo cellulare e l'inizio della guaina mielinica è il segmento iniziale. Alla fine dell'assone, le ramificazioni possono formare molti piccoli rami. Viene chiamato il citoplasma assonale assoplasma.
Quasi tutte le molecole proteiche strutturali e funzionali sono sintetizzate nel corpo cellulare e sono trasportate in luoghi distanti all'interno di un neurone in un processo noto come trasporto assonale. Fondamentale per le relazioni trofiche all'interno dell'assone, il trasporto assonale funge da modalità di comunicazione intracellulare trasportando molecole e informazioni lungo i microtubuli e i filamenti intermedi dal corpo cellulare neuronale al terminale dell'assone (trasporto anterogrado) o dal terminale dell'assone al corpo cellulare neuronale (trasporto retrogrado). I neuroni comunicano con altri neuroni e con le cellule effettrici sinapsi. Queste speciali giunzioni tra neuroni e cellule effettrici facilitano la trasmissione degli impulsi nervosi da un neurone (presinaptico) a un altro neurone (postsinaptico) o dagli assoni alle cellule effettrici (bersaglio), come le cellule muscolari e ghiandolari.
I neuroni hanno una maggiore variazione in termini di dimensioni e forma rispetto a qualsiasi altro gruppo di cellule del corpo. Sono classificati morfologicamente in tre tipi principali in base alla loro forma e alla disposizione dei loro processi. Il tipo di neurone più comune, multipolare, possiede un singolo assone con varie disposizioni di più dendriti che emanano dal corpo cellulare. La maggior parte dei neuroni multipolari (Figure 2 e figura 3) sono motoneuroni. Un secondo tipo di neurone, unipolare o pseudounipolare (Figure 3 ), possiede un solo processo, l'assone che emana dal corpo cellulare e si apre nei rami periferici e centrali poco dopo aver lasciato il corpo cellulare. Il ramo centrale entra nel SNC, mentre il ramo periferico procede al suo corrispondente recettore nel corpo. Ciascuno dei due rami è morfologicamente assonale e può propagare gli impulsi nervosi, sebbene la parte molto distale del ramo periferico si arborizzi, indicando la sua funzione di recettore. La maggior parte dei neuroni unipolari sono neuroni sensoriali, i cui corpi cellulari sono situati nei gangli della radice dorsale dei nervi spinali e nei gangli sensoriali dei nervi cranici. Il terzo tipo di neurone, bipolare, possiede due processi che emanano dal corpo cellulare: un singolo dendrite e un singolo assone. Possono essere trovati solo in alcuni nervi cranici.
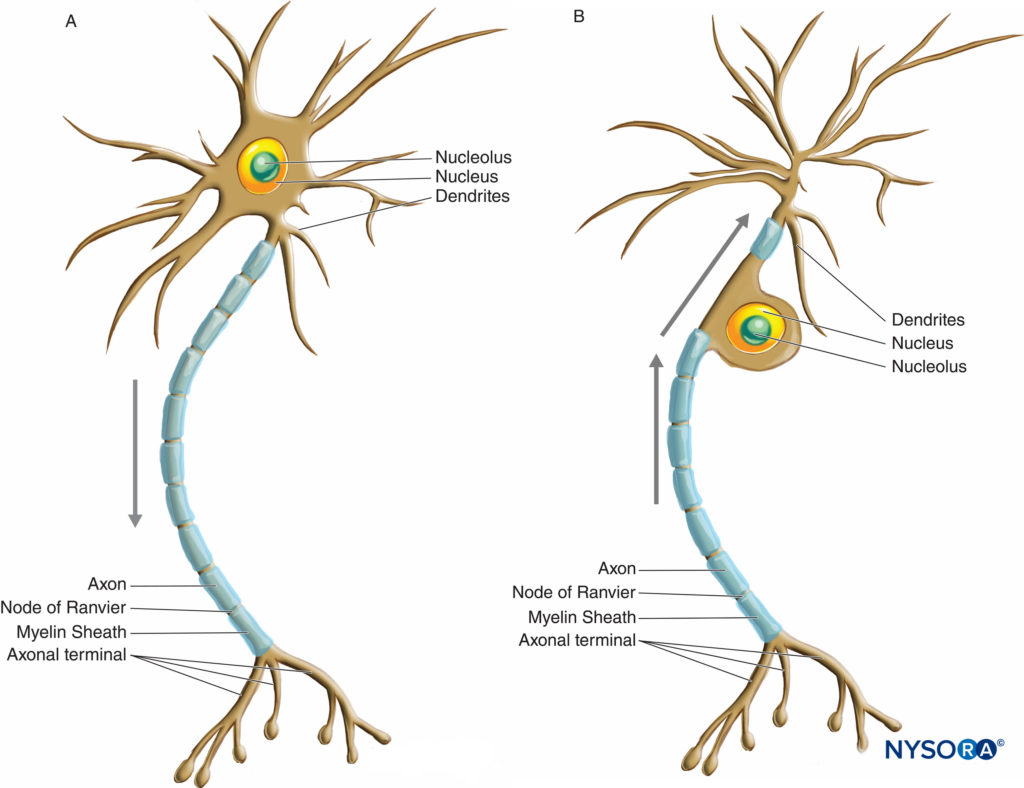
FIGURA 3. Diagramma che illustra un neurone multipolare (A) e unipolare o pseudounipolare (B). Le frecce indicano la direzione di propagazione dell'impulso nervoso.
Funzionalmente, il sistema nervoso ha somatico e autonomic componenti. Le fibre nervose che innervano i tessuti derivati dai somiti (muscoli e pelle) sono descritte come somatiche; le fibre nervose che innervano l'endoderma o altri derivati mesodermici (organi interni) sono viscerali. Il sistema nervoso somatico controlla le funzioni che sono sotto il controllo volontario cosciente con l'eccezione dell'arco riflesso. Fornisce l'innervazione sensoriale e motoria a tutte le parti del corpo ad eccezione dei visceri, della muscolatura liscia, del muscolo cardiaco e delle ghiandole. Il sistema nervoso autonomo fornisce un'innervazione efferente involontaria ai muscoli e alle ghiandole lisce e cardiache. Fornisce inoltre l'innervazione sensoriale afferente dei visceri (dolore e riflessi autonomi).
Assoni efferenti
Gli assoni efferenti derivano dal sistema nervoso somatico o autonomo. I neuroni somatici efferenti (motori) innervano il muscolo scheletrico e hanno corpi cellulari situati nei nuclei motori somatici del tronco cerebrale (nervi cranici) o nelle corna ventrali del midollo spinale (nervi spinali).
I neuroni efferenti viscerali pregangliari della parte simpatica del sistema nervoso autonomo derivano dalla colonna intermediolaterale del midollo spinale tra i livelli T1 e L2 e sinapsi su paravertebrale or prevertebrale gangli (preaortici). I nervi periferici contengono quindi fibre simpatiche pregangliari e postgangliari. I neuroni efferenti viscerali pregangliari della parte parasimpatica del sistema nervoso autonomo derivano dai nuclei parasimpatici all'interno del tronco cerebrale (parte cranica del sistema nervoso parasimpatico) o del midollo spinale sacrale tra i segmenti S2 e S4 (parte sacrale del sistema nervoso parasimpatico). Solo le fibre parasimpatiche pregangliari viaggiano lungo i nervi periferici per sinapsi sui gangli intramurali nella parete degli organi bersaglio.
Assoni afferenti
Gli assoni afferenti sono somatici o viscerali e hanno corpi cellulari nei gangli della radice dorsale dei nervi spinali o nei gangli sensoriali dei nervi cranici. I neuroni afferenti somatici (sensoriali) trasmettono impulsi dai recettori per il tatto, la temperatura o il dolore (nocicettori) situati nella parete del corpo (pelle) e dai propriocettori nei muscoli scheletrici e nelle articolazioni. I neuroni afferenti viscerali trasmettono informazioni dai visceri (interocettori e nocicettori). Gli assoni afferenti viscerali viaggiano lungo le fibre efferenti viscerali e passano attraverso i rami comunicanti e le radici dorsali dei nervi spinali o lungo il nervo vago per entrare nel SNC.
CELLULE DI SCHWANN
Gli assoni dei nervi periferici sono rivestiti dalle cellule di Schwann. La loro guaina mielinica (plasmalemma modificato) separa gli assoni dall'endoneurio. Le cellule di Schwann sono distribuite lungo gli assoni in catene longitudinali a seconda della mielinizzazione lungo l'assone. La differenziazione coordinata degli assoni e delle loro cellule mielinizzanti richiede una stretta comunicazione tra neuroni e glia. I segnali forniti dagli assoni regolano la proliferazione, la sopravvivenza e la differenziazione delle cellule gliali. D'altra parte, i segnali gliali reciproci influenzano il citoscheletro assonale e il trasporto e sono necessari per la sopravvivenza assonale e rigenerazione. Le cellule di Schwann hanno anche una funzione guida per la crescita degli assoni, indicando che la glia fa di più che fornire supporto all'assone.
I fenotipi delle cellule di Schwann sono caratterizzati da morfologie distinte ed espressione differenziale di proteine mieliniche, molecole di adesione cellulare, recettori, enzimi, proteine di filamenti intermedi, canali ionici e proteine della matrice extracellulare. Tutte le cellule di Schwann sono circondate da una lamina basale, le cui molecole della matrice extracellulare, come la laminina, regolano gli aspetti chiave dello sviluppo delle cellule di Schwann.
CLASSIFICAZIONE DELLE FIBRE NERVOSE
Le fibre nervose sono classificate in base al diametro assonale, alla velocità di conduzione, al tipo di recettore e allo spessore della guaina mielinica (Table 1). La velocità di conduzione è correlata al diametro assonale; cioè, più grande è la fibra, più veloce sarà la conduzione.
TABELLA 1. Classificazione delle fibre nervose periferiche in base al diametro assonale, alla velocità di conduzione, al tipo di recettore e allo spessore della guaina mielinica (mielinizzazione).
| assonale Diametro (μm) | Conduzione Velocità (SM) | Fibre Efferenti | Fibra afferente (Dai recettori cutanei) | Fibre afferenti dallo scheletro Muscoli, tendini e articolazioni | Mielinizzazione |
|---|---|---|---|---|---|
| 12-20 | 60-120 30-70 | Aα (alle fibre muscolari extrafusali) | Aα (da meccanocettori che si adattano rapidamente) | Ia (dai fusi muscolari) Ib (dagli organi tendinei del Golgi) | Fortemente mielinizzato |
| 6-12 | 25-70 | Aβ (dai meccanocettori che si adattano lentamente) | II (dai propriocettori articolari) | mielinizzato | |
| 3-8 | 15-30 | Aγ (alle fibre muscolari intrafusali) | mielinizzato | ||
| 1-6 | 12-30 | Aδ (da nocicettori termici e meccanici e termocettori solo a freddo) | III (dai propriocettori articolari e nocicettori articolari) | Sottilmente mielinizzato | |
| 1-3 | 3-15 | B (pregangliare viscerale) | mielinizzato | ||
| 0.2-1.5 | 0.5-2 | C (viscerale postgangliare) | C (da nocicettori e termocettori meccanici, nocicettori polimodali freddi e caldi) | IV (dai nocicettori articolari) | amielinico |
aLe fibre afferenti viscerali (dagli interocettori) sono classificate come fibre Aδ e C.
Fonte: Modificato con il permesso di Cramer GD, Darby S: Anatomia di base e clinica della colonna vertebrale, del midollo spinale e del SNA, 2a ed. Filadelfia: Elsevier/Mosby; 2005.
Consigli NYSORA
Più grande è la fibra, più concentrato deve essere l'anestetico locale per influenzare il blocco neurale.
FIBRE NERVOSE MIELINATE
Le fibre nervose mielinizzate sono rivestite dalla mielina, plasmalemma notevolmente esteso e modificato delle cellule di Schwann (Cifre 4 e 5). La formazione della mielina inizia con l'estensione del citoplasma delle cellule di Schwann e lo sviluppo del mesassone interno, che avvolge più volte l'assone. Durante il processo di avvolgimento, il citoplasma viene quasi estruso tra il plasmalemma. Le facce extracellulari contrapposte del plasmalemma diventano "la principale linea densa" e le facce citoplasmatiche contrapposte formano una "linea intraperiodo" di mielina. La struttura molecolare proposta della mielina si adatta al concetto di plasmalemma come un doppio strato lipidico con proteine di membrana integrali e periferiche attaccate al lato extracellulare o citoplasmatico del plasmalemma. Contrariamente alla maggior parte delle membrane biologiche, la mielina ha un alto rapporto tra lipidi e proteine (70%–85% di lipidi, 15%–30% di proteine), dove queste ultime fungono da proteine strutturali, enzimi, canali di tensione e trasduttori di segnale.
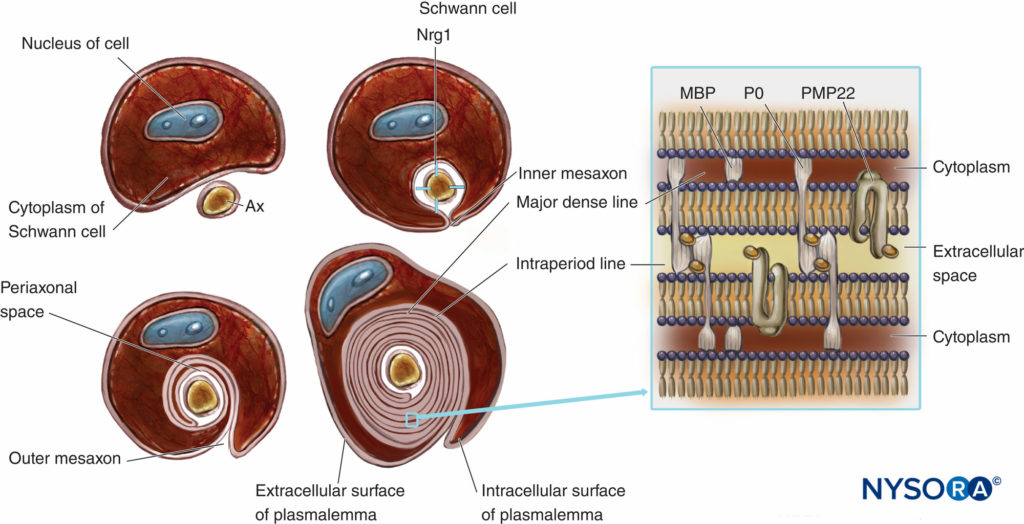
FIGURA 4. Presentazione schematica della formazione della mielina e schema semplificato della sua organizzazione molecolare. Per semplificazione, la lamina basale delle cellule di Schwann non viene disegnata. Nrg1 = neurogulina; MPB = proteina basica della mielina; P0 = proteina zero; PMP22 = proteina di membrana periferica di 22 kDa; Ascia = assone. (Modificato con il permesso di Ross M, Pawlina W: Histology: A Text and Atlas With Correlated Cell and Molecular Biology, 6a ed. Philadelphia: Wolters Kluwer; Lippincott Williams & Wilkins; 2011.)
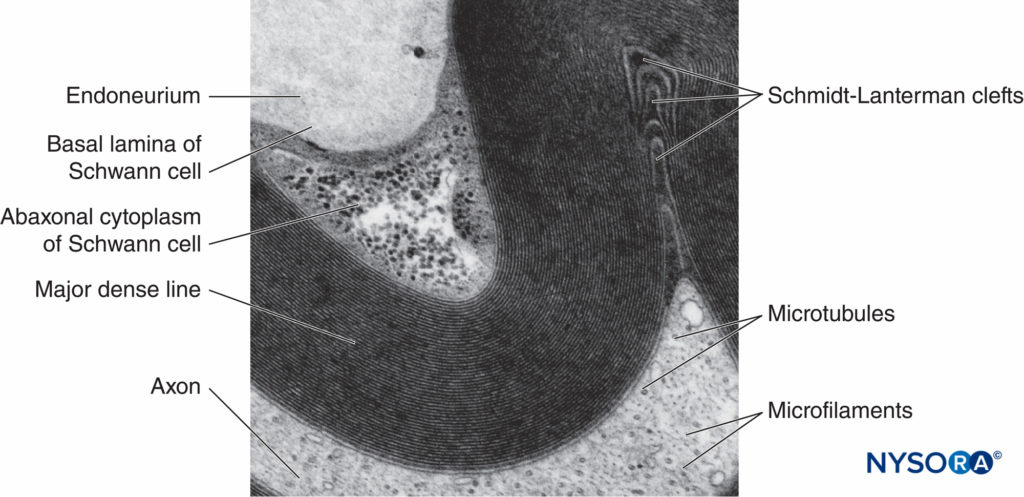
FIGURA 5. Micrografia elettronica della fibra mielinica. La mielina è visualizzata come una serie di linee scure e meno scure alternate. Biopsia del nervo surale umano.
La guaina mielinica avvolge l'assone in segmenti. Le aree dell'assone coperte da lamelle concentriche di mielina e da una singola cellula di Schwann che producono mielina sono chiamate internodi e hanno una lunghezza compresa tra 200 e 1000 µm. Le interruzioni, che si verificano nella guaina mielinica a intervalli regolari lungo la lunghezza degli assoni ed espongono l'assone, sono chiamate nodi di Ranvier (figura 6). Ogni nodo indica un'interfaccia tra le guaine mieliniche di due diverse cellule di Schwann situate lungo l'assone.
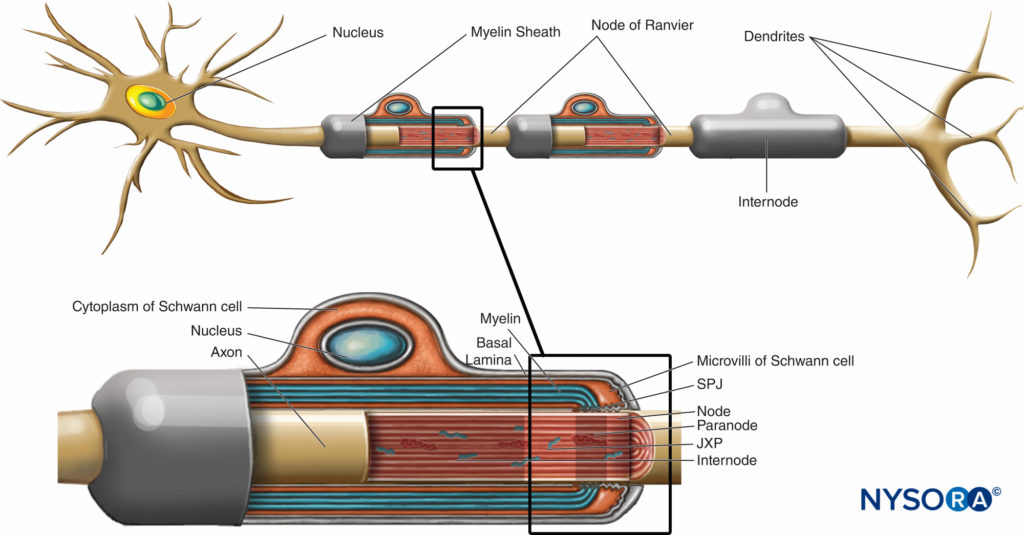
FIGURA 6. Domini distinti della regione nodale. La regione occupata da proteine distinte situate nell'axolemma nodale è schematicamente rappresentata in nero sopra l'assone. SPJ = giunzioni settate; JXP = juxtaparanode. (Modificato con il permesso di Poliak S, Peles E. La differenziazione locale degli assoni mielinizzati ai nodi di Ranvier. Nat Rev Neurosci. 2003 Dec;4(12):968-980.)
La regione nodale e i suoi dintorni possono essere ulteriormente suddivisi in diversi domini (Figure 6 ) che contengono un insieme unico di canali ionici, molecole di adesione cellulare e proteine adattatrici citoplasmatiche. Nel SNP, il nodo è in contatto con i microvilli delle cellule di Schwann e ricoperto dalla sua lamina basale (Figure 6 ). Una caratteristica importante del di nodo axolemma è la sua alta densità di Na voltaggio+ canali rispetto al giustaparanodale axolemma, che tipicamente contiene un'alta densità di K+ canali. Na+ i canali potenziano l'impulso nervoso in modo salatorio (figura 7) lungo le fibre mieliniche. Quando la membrana al nodo è eccitata, il circuito locale che viene generato non può fluire attraverso la guaina mielinica ad alta resistenza. Pertanto defluisce e depolarizza la membrana al nodo successivo, che può essere a 1 mm o più lontano. La bassa capacità della guaina significa che è necessaria poca energia per depolarizzare la membrana rimanente tra i nodi, con conseguente aumento della velocità di diffusione del circuito locale.
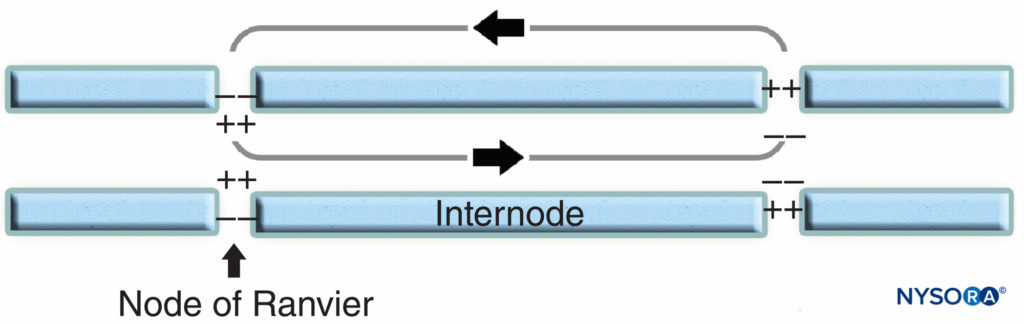
FIGURA 7. Conduzione salatoria nelle fibre nervose mieliniche. I canali Na+, localizzati all'axolemma nodale, potenziano l'impulso nervoso in maniera salatoria lungo la fibra nervosa mielinica.
La mielinizzazione è un esempio di comunicazione cellula-cellula in cui gli assoni interagiscono con le cellule di Schwann. Il numero di strati di mielina è determinato dall'assone e non dalla cellula di Schwann. Lo spessore della guaina mielinica è regolato da un fattore di crescita chiamato neuregulina 1 (Nrg1). La compattazione della guaina mielinica è associata all'espressione di proteine specifiche della mielina transmembrana come la proteina 0 (P0), una proteina mielinica periferica di 22 kilodaltoni (PMP22) e una proteina di base della mielina (MBP). L'assenza di proteine che regolano la formazione della guaina mielinica potrebbe causare grave ipomielinizzazione o dismielinizzazione nell'uomo e negli animali da esperimento.
FIBRE NERVOSE NON MIELINATE
Gli assoni amielinici sono anche avvolti dalle cellule di Schwann e dalla loro lamina basale. Una singola cellula di Schwann può rivestire uno o più assoni non mielinizzati (Cifre 8 e 9). Le fibre amieliniche predominano nei nervi spinali cutanei umani, dove il rapporto medio tra la densità delle fibre amieliniche e quella mielinica è 3.7:1. Nelle fibre non mieliniche, la velocità di conduzione è proporzionale alla radice quadrata del diametro della fibra ed è molto più lenta rispetto alla conduzione salatoria nelle fibre mielinizzate (Tabella 1).
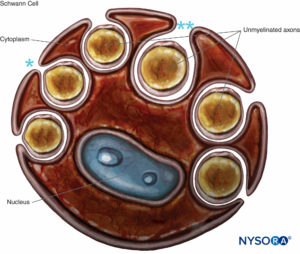
FIGURA 8. Cellula di Schwann che ingloba diversi assoni non mielinizzati. Le labbra del solco del citoplasma possono essere chiuse (*), formando il mesassone, o aperte (**). La lamina basale della cellula di Schwann non viene disegnata.
INVESTIMENTI DI TESSUTO CONNETTIVO DEI NERVI PERIFERICI
In un nervo periferico, le fibre nervose e le loro cellule di Schwann di supporto sono tenute insieme da tessuto connettivo organizzato in tre componenti distintivi che hanno specifiche caratteristiche morfologiche e funzionali. L'epinevrio forma il tessuto connettivo più esterno del nervo periferico, il perinevrio circonda ciascun fascicolo nervoso separatamente, mentre le singole fibre nervose sono incorporate nell'endoneurio (Cifre 10 a 13).
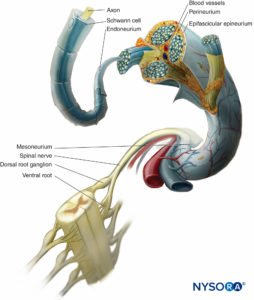
FIGURA 10. Investimenti di tessuto connettivo del nervo periferico. Il diagramma mostra la disposizione del nervo periferico. Un segmento del nervo spinale viene ingrandito per mostrare la relazione delle fibre nervose con il tessuto connettivo circostante (endoneurio, perinevrio ed epinevrio).
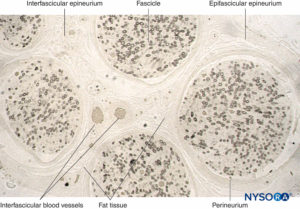
FIGURA 11. Sezione semisottile del nervo surale umano fissata in tetrossido di osmio. Le guaine mieliniche sono conservate e colorate di nero.
Il perineurio circonda il fascicolo nervoso. Striature di tessuto connettivo provengono dall'epifascicolare epinevrio all'interno del nervo come
epinevrio interfascicolare. Il tessuto adiposo e i vasi sanguigni sono localizzati nell'epineurio interfascicolare.
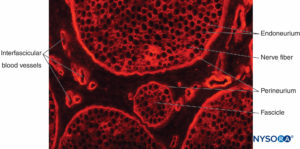
FIGURA 12. Sezione trasversale del nervo sciatico di maiale. Colorazione immunoistochimica per il collagene. I vasi sanguigni attraversano il
epinevrio interfascicolare, che riempie lo spazio intorno al perineurio e ai fascicoli.
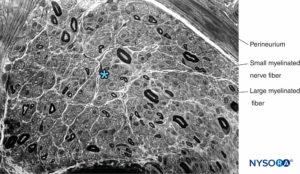
FIGURA 13. Sezione semisottile del nervo surale umano macchiata da violetto cresile. Neuropatia assonale con perdita predominante di grosse fibre mielinizzate. * Spazio intrafascicolare tra le fibre mieliniche (occupato da endoneurio, nuclei cellulari di Schwann e fibre non mieliniche).
epinevrio
L'epinevrio è una condensazione di un tessuto connettivo areolare lasso che circonda un nervo periferico e lega i suoi fasci in un fascio comune (Figure 10 e Figure 11 ).
L'epineurio che si estende tra i fascicoli è l'epineurio interfascicolare o interno, mentre l'epineurio che circonda l'intero tronco nervoso è l'epineurio epifascicolare o esterno chiamato epinevrio comprende il 30%-75% dell'area della sezione trasversale del nervo ma varia lungo il nervo. È il più spesso dove continua con la dura che ricopre il SNC e più abbondante nei nervi adiacenti alle articolazioni, dove i nervi sono soggetti a pressione. È quindi probabile che la suscettibilità al danno da compressione sia maggiore nei nervi unifascicolari rispetto a quelli multifascicolari perché questi ultimi hanno una maggiore quantità di epinevrio. Quando il nervo periferico si divide e il numero di fascicoli si riduce, l'epineurio diventa progressivamente più sottile e alla fine scompare attorno ai nervi monofascicolari.
L'epinevrio contiene collagene, fibroblasti, mastociti e cellule adipose. I fasci di collagene hanno un orientamento longitudinale predominante; tuttavia, uno studio di microscopia elettronica ha rilevato che il collagene epineurale in fasci di 10-20 µm di larghezza sono disposti obliquamente attorno alla circonferenza del nervo. Sono presenti anche fibre elastiche, particolarmente adiacenti al perineurio, che sono prevalentemente orientati longitudinalmente. Il collagene e le fibre elastiche sono allineate e orientate per prevenire danni da stiramento eccessivo del fascio nervoso, suggerendo che l'epineurio è progettato per accogliere l'allungamento.
L'epinevrio umano è costituito principalmente da collagene di tipo I e di tipo III, con predominanza di tipo I. Il diametro delle fibrille di collagene è in media di 60–110 nm.
Il tessuto adiposo all'interno di un nervo circonda i fascicoli e forma guaine adipose che separano i fascicoli l'uno dall'altro. Lo spessore delle guaine adipose varia da un fascicolo all'altro ed è maggiore nei tronchi nervosi più grandi, evidenziando la sua funzione protettiva nell'ammortizzare i fascicoli contro i danni da compressione. La perdita di grasso epineurale può presentare un fattore di rischio per paralisi da pressione in pazienti emaciati, costretti a letto. Al contrario, un eccesso di tessuto adiposo può anche ritardare la diffusione dell'anestetico locale iniettato in prossimità di un nervo, interferendo così con il blocco dell'anestetico. L'epineurio è continuo con il tessuto connettivo chiamato avventizia o mesoneurium che circonda il nervo quando passa attraverso, al di sotto o tra la fascia muscolare, fungendo da (1) un condotto per l'anestetico locale iniettato, (2) un percorso che consente lo scorrimento del nervo, e (3) uno strato di protezione contro i traumi nervosi. Poiché il loro attacco è allentato, i nervi sono relativamente mobili tranne dove sono legati entrando nei vasi o uscendo dai rami nervosi.
Perineurio
Il perineurio è un tessuto connettivo specializzato che circonda i singoli fasci nervosi (Figure 10 e 12). Questo strato cellulare protettivo è più sottile dell'epinevrio e separa l'endoneurio dall'epinevrio. Il perineurio è costituito da strati alternati di cellule poligonali appiattite, che si pensa siano derivate da fibroblasti, e tessuto connettivo collagene, la cui formazione è controllata dalle cellule di Schwann. Le celle poligonali appiattite, che costituiscono le lamelle, sono specializzate per fungere da barriera alla diffusione. Il numero delle lamelle varia, principalmente a seconda del diametro del fascicolo; più grande è il fascicolo, maggiore è il numero di lamelle. Nei tronchi nervosi dei mammiferi, il perineurio contiene 15-20 strati cellulari. Le cellule contigue in ogni strato interdigitano lungo giunzioni strette e estese. Le cellule possono ramificarsi e dare origine a processi e contribuire alle lamelle adiacenti. Ogni strato di cellule, racchiuso da lamina basale, può raggiungere uno spessore fino a 0.5 µm nei nervi umani.
Le fibre di collagene hanno origine in una disposizione reticolare, in cui i fasci sono circolari, longitudinali e disposti obliquamente. Lo strato cellulare perineurale più interno aderisce a un distinto strato limite di fibre di collagene densamente intrecciate e fibroblasti subperineuriali che collega meccanicamente il perineurio al contenuto endoneurale. Le fibre di collagene sono prevalentemente di tipo III, sebbene siano presenti anche fibre di collagene di tipo I. Il diametro delle fibrille di collagene è sostanzialmente inferiore a quello delle fibrille epineurali, con una media di 52 nm nel nervo surale del ratto. La lamina basale delle cellule poligonali è composta da collageni IV e V, fibronectina, eparan solfato proteoglicano, e laminina. L'onnipresente presenza di vescicole pinocitotiche ricche di enzimi fosforilanti è alla base del presupposto che il perineurio funzioni come una barriera di diffusione metabolicamente attiva, svolgendo un ruolo essenziale nel mantenimento dell'ambiente osmotico e della pressione del fluido all'interno dell'endoneurio. Ad esempio, in uno dei nostri studi, le cellule infiammatorie accumulate tra i fascicoli nervosi nei suinetti dopo l'esposizione del nervo al gel per ultrasuoni non sono penetrate nel perineurio. A causa della sua struttura cellulare strettamente aderente e del collagene più orientato longitudinalmente, il perineurio è meno tollerante all'allungamento rispetto all'epineurio. Nel coniglio, il cedimento meccanico durante l'allungamento ha coinciso con un'interruzione del perinevrio mentre l'epineurio è rimasto intatto. L'integrità della barriera di diffusione è stata mantenuta dopo 2 ore di allungamento del 15%, mentre un allungamento del 27% ha causato un'interruzione perineurale acuta.
Endoneurio
L'endoneurio comprende tessuto connettivo intrafascicolare lasso che non include le partizioni perineurali che suddividono i fascicoli e circonda le cellule di Schwann (Figure 12 ). Circa il 40%–50% dello spazio intrafascicolare è occupato da elementi non neurali (cioè diversi dalle cellule assonali e di Schwann), di cui il liquido endoneurale e la matrice del tessuto connettivo occupano il 20%–30%. Ci sono variazioni sostanziali tra i nervi nelle diverse specie e gruppi di età.
L'endoneurio è composto da fibre di collagene (prodotte dalle cellule di Schwann e dai fibroblasti sottostanti); i componenti cellulari sono immersi nel liquido endoneurale, contenuto in sostanziali spazi intrafascicolari. Le fibre nervose tendono ad essere raggruppate in piccoli fasci con fessure intermedie. La pressione del fluido endoneurale è leggermente superiore a quella dell'epinevrio circostante. Si ritiene che questo gradiente di pressione minimizzi la contaminazione endoneurale da parte di sostanze tossiche esterne al fascio nervoso.
Le fibrille di collagene endoneurale sono più piccole di quelle nell'epinevrio e nell'uomo hanno un diametro compreso tra 30 e 65 nm. Le fibrille corrono parallele e attorno alle fibre nervose, legandole in fascicoli o fasci. Mostrano condensazioni attorno ai capillari e alle fibre nervose. Vicino al terminale distale dell'assone, l'endoneurio è ridotto a poche fibre reticolari che circondano la lamina basale delle cellule di Schwann. Nell'endoneurio sono presenti collagene di tipo I, II e III.
I costituenti cellulari dell'endoneurio sono i fibroblasti, le cellule endoteliali dei capillari, i mastociti e i macrofagi. I mastociti sono presenti in numero variabile, essendo particolarmente numerosi lungo i vasi sanguigni. I macrofagi rappresentano il 2%-4% dei nuclei intrafascicolari nel nervo periferico del ratto e sono le cellule primarie che presentano l'antigene del nervo periferico. Eliminano le proteine extracellulari e le presentano ai linfociti T che emergono dalla circolazione. I macrofagi mediano la sorveglianza immunologica e partecipano alla riparazione del tessuto nervoso. A seguito di lesioni nervose, proliferano e fagocitano attivamente i detriti di mielina.
La matrice extracellulare è ricca di glicoproteine, glicosaminoglicani e proteoglicani. Le meglio caratterizzate di queste includono la glicoproteina fibronectina, tenascina C, trombospondina e condroitin solfato proteoglicani versican e decorin. L'espressione di queste molecole cambia dopo la lesione del nervo, quindi sono potenzialmente rilevanti durante la rigenerazione del nervo.
Da un punto di vista idrodinamico, i vari tessuti che compongono un nervo periferico possono essere suddivisi in tessuto connettivo lasso, ad alta compliance espandibile dell'epinevrio e fascicoli e fasci fascicolari a bassa compliance e disgregabili, densamente imballati all'interno del perineurio. Queste differenze anatomiche tra i tessuti connettivi e i fascicoli oi loro fasci spiegano perché un'iniezione nei fascicoli richiede più forza (pressione) rispetto all'iniezione nel tessuto connettivo lasso dell'epineurio.
Consigli NYSORA
- Il perineurio è un tessuto duro e resistente, che tende a fuoriuscire lentamente facendo avanzare un ago smussato e corto durante la procedura di blocco nervoso.
- È necessaria una forza (pressione) maggiore per un'iniezione in un fascicolo a bassa cedevolezza rispetto all'epinevrio ad alta cedevolezza.
- Nelle regioni interscaleniche e sopraclavicolari del plesso brachiale, i nervi sono più fitti e
- oligofascicolari, mentre più distalmente sono polifascicolari con una maggiore quantità di tessuto stromale.
- I nervi multifascicolari sono meno suscettibili alle lesioni rispetto agli unifascicolari a causa di un diametro fascicolare ridotto e di una maggiore protezione epinevriale.
- L'abbondanza di tessuto epineurale lasso offre una spiegazione del motivo per cui la maggior parte delle iniezioni intraneurali (intraneurale, ma extrafascicolare) non provocano lesioni nervose evidenti.
LA REGIONE DI TRANSIZIONE CENTRO-PERIFERICA
La transizione tra il SNC e il SNP nelle radici dei nervi cranici e spinali è indicata come il centro-periferico regione di transizione or SNC-PNS sistema (figura 14). Rappresenta un brusco cambiamento nel tipo di mielina, elementi di supporto e vascolarizzazione. I principali componenti gliali nel SNC sono astrociti e oligodendrociti, mentre nel SNP i componenti principali sono le cellule di Schwann. Le radici nervose dei nervi spinali sono immerse nel liquido cerebrospinale. Il regione di transizione è la lunghezza della radichetta che contiene sia il tessuto nervoso centrale che quello periferico. I dettagli di transizione che distinguono l'inguainamento delle radici spinali con le meningi e gli investimenti di tessuto connettivo dei nervi periferici non sono stati completamente chiariti. Le loro disposizioni strutturali, tuttavia, sono ben documentate negli studi al microscopio elettronico.
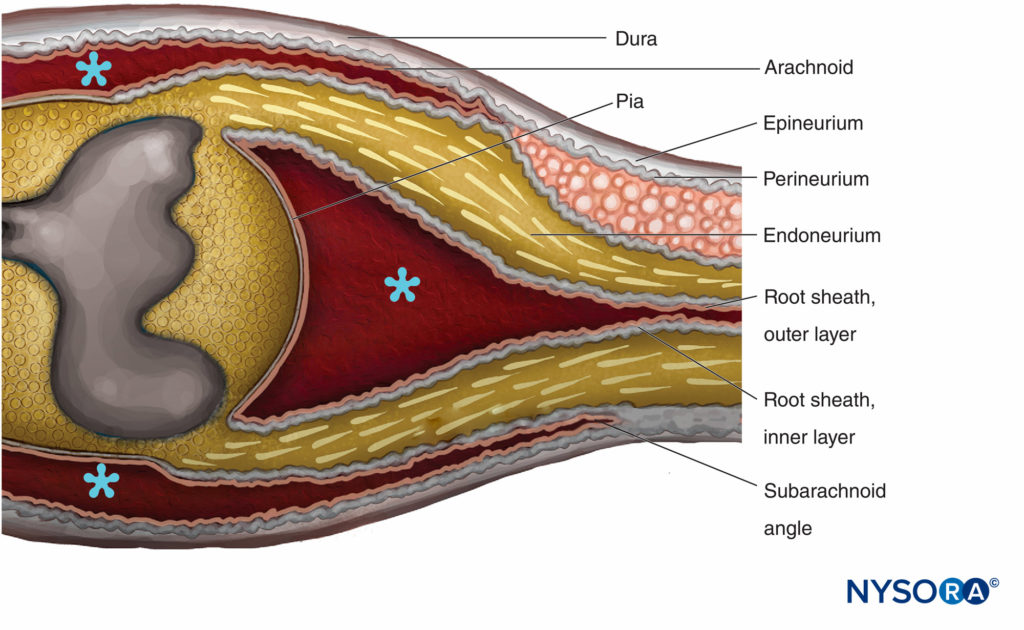
FIGURA 14. Regione di transizione centro-periferica. L'epinevrio diventa continuo con la dura madre. L'aracnoide si riflette sulle radici all'angolo subaracnoideo e diventa continuo con lo strato esterno della guaina radicolare. All'incrocio con il midollo spinale, lo strato esterno diventa continuo con la pia madre. Il perineurio si divide in due strati all'angolo subaracnoideo: lo strato esterno si separa dalla radice nervosa e corre tra la dura e l'aracnoide; lo strato interno è aderente alle radici spinali e costituisce lo strato interno della guaina radicolare. Il ganglio spinale è incorporato nel perineurio. * Spazio subaracnoideo. (Riprodotto con il permesso di Haller FR, Low FN. La struttura fine della guaina della radice del nervo periferico nello spazio subaracnoideo nel ratto e in altri animali da laboratorio. Am J Anat. 1971 May;131(1):1-19.
I componenti cellulari dell'endoneurio nelle radici spinali assomigliano a quelli dei nervi periferici. La quantità di collagene è sostanzialmente inferiore e non è organizzata in guaine attorno alle fibre nervose. La regione in cui le radici spinali si attaccano al midollo spinale è caratterizzata da una transizione irregolare dal nervo periferico al SNC, la zona di Ober-steiner-Redlich dove le cellule di Schwann sono sostituite da oligodendrociti. La porzione centrale della radice è limitata alla sua periferia da glia marginale, composta da astrociti ricoperti da lamina basale.
Le radici spinali attraversano lo spazio subaracnoideo coperto da una guaina radicolare multicellulare e penetrano nella dura ad angolo subaracnoideo (Figure 14 ). Esternamente all'angolo subaracnoideo, le radici nervose possiedono epinevrio, perinevrio ed endoneurio come nei tronchi nervosi periferici. L'epinevrio è la continuazione della dura spinale, mentre l'endoneurio si sviluppa distalmente alla giunzione delle radici con il tessuto nervoso centrale. Il perineurio avvolge i gangli spinali ed è ad esso prossimale. È diviso negli strati esterni che passano tra la dura e l'aracnoide per formare il "mesotelio durale", mentre gli strati interni del perineurio continuano sulle radici come "strato interno della guaina della radice".
La guaina radicolare è composta da lamelle cellulari e fibrose suddivise in due strati. Lo strato esterno è costituito da cellule vagamente associate che confinano con lo spazio subaracnoideo. Dove le radici si attaccano al midollo spinale, le cellule dello strato esterno della guaina radicolare diventano continue con la pia. All'angolo subaracnoideo, lo strato esterno si riflette sugli investimenti meningei esterni del midollo spinale (aracnoidea attaccata allo strato interno della dura spinale). Lo strato interno della guaina radicolare è costituito da cellule appiattite che sono strettamente associate tra loro, sono rivestite a intermittenza da una lamina basale e assomigliano al perineurio ma non sono classificabili come cellule perineurali. Diventa continuo con il perineurio perifericamente.
Lo spazio subaracnoideo si apre in un recesso laterale che si estende tra le radici ventrali e dorsali e può costituire un in termini di comunicazione tra lo spazio subaracnoideo e quello endoneurale. Questa comunicazione è clinicamente rilevante perché consente all'infiammazione di diffondersi dallo spazio subaracnoideo all'endoneurio nel caso di poliradiculoneuriti.
Consigli NYSORA
- L'iniezione di anestetico locale all'interno della cuffia epinevriale durante l'esecuzione di blocchi interscalenici o del plesso lombare può portare all'anestesia spinale a causa dell'estensione della cuffia durale oltre il forame intervertebrale.
- Durante l'esecuzione del blocco del plesso lombare, si osserva la diffusione epidurale dell'anestetico locale, in particolare quando viene utilizzata un'elevata pressione di iniezione (forza) durante il processo di iniezione.
FORNITURA VASCOLARE DEI NERVI PERIFERICI
Il nervo periferico è una struttura ben vascolarizzata, fornito da vasi che originano dalle grandi arterie e vene vicine, nonché da vasi sanguigni muscolari e periostali adiacenti più piccoli (Figure 12 ). I nervi periferici hanno due sistemi vascolari separati, funzionalmente indipendenti: un sistema estrinseco (vasi nutritivi regionali e vasi epineurali) e un sistema intrinseco (microvasi nell'endoneurio). Esistono ricche anastomosi tra i due sistemi, con conseguente notevole sovrapposizione tra i territori delle arterie segmentali.
L'epinevrio è caratterizzato da un plesso vascolare prevalentemente longitudinale. Le arteriole transperineurali, di 10-25 µm di diametro, passano dall'epinevrio all'endoneurio attraverso maniche di tessuto perineurale. Il loro percorso attraverso il perineurio è obliquo, il che li rende potenzialmente suscettibili alle variazioni della pressione intra o extrafascicolare. I vasi epinevriali e perineurali hanno un ricco plesso perivascolare di nervi peptidergico, serotoninergico e adrenergico che svolgono un ruolo importante nel controllo neurogeno del flusso sanguigno endoneurale.
La vascolarizzazione endoneurale è nota per le sue dissomiglianze anatomiche da un letto capillare convenzionale, sebbene, fisiologicamente, svolga funzioni metaboliche simili. Le arteriole transperineuriali perdono gradualmente il loro rivestimento muscolare continuo e diventano capillari postarteriolari. I capillari endoneurici hanno un diametro e una distanza intercapillare atipicamente maggiori rispetto a quelli di molti altri tessuti. Tale angioarchitettura suggerisce una minore capacità di scambio. Le arteriole endoneurali hanno uno strato muscolare liscio poco sviluppato e quindi una capacità limitata di autoregolazione. La densità dei microvasi endoneurici varia in modo significativo nei nervi periferici; queste variazioni sono correlate con la suscettibilità alla neuropatia ischemica. Questo modello unico di vasi, insieme all'elevato flusso sanguigno basale rispetto al fabbisogno metabolico del nervo, conferisce un alto grado di resistenza all'ischemia in modo che la disfunzione del nervo non si verifichi durante l'ischemia acuta fino a quando il flusso sanguigno non è quasi zero. La caratteristica principale del sistema neurovascolare periferico è la sua flessibilità. I nervi periferici possono essere mobilizzati chirurgicamente, recidendo i loro vasi nutritivi senza conseguenze cliniche, in misura sorprendente. Tuttavia, la distribuzione della circolazione all'interno dell'endoneurio è squisitamente sensibile alla manipolazione fisica e chimica.
Consigli NYSORA
- I nervi periferici sono relativamente resistenti all'ischemia perché la disfunzione nervosa può verificarsi solo quando il flusso sanguigno è quasi zero.
- Gli anestetici locali hanno la capacità di restringere il sistema vascolare e diminuire il flusso sanguigno ai nervi.
CAMBIAMENTI RELATIVI ALL'ETÀ DEI NERVI PERIFERICI
Un SNP intatto invecchiato è caratterizzato da numerosi estesi cambiamenti strutturali, funzionali e biochimici, che sono stati documentati sia nelle fibre mieliniche che in quelle non mielinizzate. Negli anziani, la densità delle fibre mieliniche diminuisce. Una relazione regolare tra lunghezza internodale e diametro della fibra diventa meno precisa con l'invecchiamento. Ciò è associato alla demielinizzazione e rimielinizzazione segmentale e alla degenerazione e rigenerazione assonale clinicamente evidenti come neuropatia periferica lieve.
Nelle fibre amieliniche sono stati segnalati cambiamenti regressivi attribuiti all'invecchiamento. Nei complessi di fibre amieliniche dei nervi invecchiati, la proporzione di bande cellulari di Schwann prive di assoni aumenta (le cosiddette tasche di collagene; cfr. Figure 9 ). Un primo cambiamento legato all'età sembra essere il germogliamento dei processi cellulari di Schwann in numerose lingue appiattite, che di solito si verificano in gruppi. L'indice perineuriale (rapporto tra lo spessore del perineurio e il diametro del fascicolo) mostra una tendenza ad aumentare con l'età, molto probabilmente riflette la perdita di fibre nervose correlata all'età.
L'invecchiamento è associato ad una diminuzione del numero dei capillari endoneurici e ad un aumento dello spessore delle pareti dei capillari e del perineurio. La velocità di rigenerazione assonale diventa più lenta al diminuire della densità e del numero di assoni rigeneranti. L'invecchiamento compromette anche il germogliamento terminale degli assoni rigenerati e il germogliamento collaterale degli assoni adiacenti intatti, limitando ulteriormente la reinnervazione del bersaglio e il recupero funzionale.
La causa dei cambiamenti legati all'invecchiamento è incerta. Non è ancora stabilito se siano il risultato dell'invecchiamento neuronale, che dà origine a degenerazione assonale distale e demielinizzazione secondaria, o fattori locali nei nervi, come l'ischemia o le conseguenze di traumi minori ripetuti. Tuttavia, i cambiamenti legati all'età nei nervi periferici derivano probabilmente dall'effetto cumulativo e permanente di vari fattori patogeni modificati da determinanti genetici e da una graduale diminuzione della capacità rigenerativa.
Consigli NYSORA
- A causa della degenerazione nervosa correlata all'età, potrebbe essere necessario meno anestetico locale a concentrazioni inferiori per il blocco nervoso.
- I cambiamenti legati all'età del nervo periferico possono essere responsabili delle immagini ecografiche tipicamente più povere dei nervi periferici negli anziani rispetto ai soggetti più giovani.
RISPOSTA DEL NERVO PERIFERICO ALLA LESIONI
Le lesioni ai nervi periferici provocano la perdita delle funzioni motorie, sensoriali e autonome nei segmenti denervati del corpo a causa dell'interruzione degli assoni, della degenerazione delle fibre nervose distali e dell'eventuale morte dei neuroni assotomizzati. I deficit funzionali causati da lesioni nervose possono essere compensati dalla reinnervazione dei bersagli denervati mediante la rigenerazione degli assoni danneggiati o dalla ramificazione collaterale degli assoni non danneggiati e dal rimodellamento dei circuiti del sistema nervoso correlati alle funzioni perse. La rigenerazione dei nervi è possibile se le estremità tagliate rimangono vicine l'una all'altra in caso contrario, la rigenerazione potrebbe non essere completa o avere esito positivo.
Dopo una lesione, il neurone tenta di riparare il danno, rigenerare il processo e ripristinare la funzione avviando una serie di eventi strutturali e metabolici chiamati reazione assonale. Le reazioni al trauma sono localizzate in tre regioni del neurone: al sito del danno (cambiamenti locali), distale al sito del danno (cambiamenti anterogradi) e prossimale al sito del danno (cambiamenti retrogradi). La reazione locale alla lesione comporta la rimozione dei detriti da parte delle cellule neurogliali. La porzione dell'assone distale a una lesione subisce la degenerazione ed è fagocitata. La porzione prossimale dell'assone danneggiato subisce la degenerazione seguita dalla germinazione di un nuovo assone la cui crescita è diretta dalle cellule di Schwann.
Consigli NYSORA
- La soglia di stimolazione elettrica per una risposta motoria del nervo sciatico è aumentata nei pazienti con gangrena del piede diabetico, che può influenzare l'identificazione del nervo.
- Molte lesioni nervose post-procedurale si verificano in nervi con patologia preesistente.
SOMMARIO
La conoscenza che l'anatomia neurale è unica in diversi siti anatomici è essenziale per una pratica sicura ed efficace dell'anestesia regionale. Comprendere la struttura del nervo periferico e le sue implicazioni durante l'utilizzo di monitor all'avanguardia, inclusi l'ecografia, la stimolazione nervosa e il monitoraggio della pressione di iniezione, è utile per ridurre al minimo il rischio di lesioni al paziente.
BIBLIOGRAFIA
- Jessen KR, Mirsky R: L'origine e lo sviluppo delle cellule gliali nei nervi periferici. Nat Rev Neurosci 2005;6(9):671–682.
- Williams P: Grey's Anatomy, 38a ed. Churchill Livingstone, 1995.
- Gartner L, Hiatt J: Color Textbook of Histology, 2a ed. Saunders, 2001.
- Ross M, Pawlina W: Istologia: un testo e un atlante con biologia cellulare e molecolare correlata, 6a ed. Wolters Kluwer Lippincott Williams & Wilkins, 2011.
- Thomas P, Berthold C, Ochoa J: Anatomia microscopica del sistema nervoso periferico. In Dyck P, Thomas P (a cura di): Neuropatia periferica, 3a ed. Saunders, 1993, pp 28–91.
- Brushart T: riparazione dei nervi. Oxford University Press, 2011.
- Palay SL, Sotelo C, Peters A, Orkand PM: La collinetta dell'assone e il segmento iniziale. J Cell Biol 1968;38(1):193–201.
- Poliak S, Peles E: La differenziazione locale degli assoni mielinizzati ai nodi di Ranvier. Nat Rev Neurosci 2003;4(12):968–980.
- Colognato H, Baron W, Avellana-Adalid V, et al: le integrine del SNC commutano la segnalazione del fattore di crescita per promuovere la sopravvivenza dipendente dal bersaglio. Nat Cell Biol 2002;4(11):833–841.
- Fernandez PA, Tang DG, Cheng L, Prochiantz A, Mudge AW, Raff MC: Prove che la neuregulina derivata dall'assone promuove la sopravvivenza degli oligodendrociti nel nervo ottico del ratto in via di sviluppo. Neurone 2000;28(1):81–90.
- de Waegh SM, Lee VM, Brady ST. Modulazione locale della fosforilazione dei neurofilamenti, del calibro assonale e del lento trasporto assonale da parte delle cellule di Schwann mielinizzanti. Cella 1992;68(3):451–463.
- Griffiths I, Klugmann M, Anderson T, et al: Gonfiore e degenerazione assonale nei topi privi del principale proteolipide della mielina. Scienza 1998;280(5369):1610–1613.
- Lappe-Siefke C, Goebbels S, Gravel M, et al: Disruption of Cnp1 disaccoppia le funzioni oligodendrogliali nel supporto assonale e nella mielinizzazione. Nat Genet 2003;33(3):366–374.
- Nadim W, Anderson PN, Turmaine M: Il ruolo delle cellule di Schwann e dei tubi della lamina basale nella rigenerazione degli assoni attraverso lunghi tratti di innesti nervosi congelati. Neuropathol Appl Neurobiol 1990;16(5): 411–421.
- Noakes PG, Bennett MR: La crescita degli assoni nei muscoli in via di sviluppo dell'arto anteriore del pulcino è preceduta da cellule che si colorano con gli anticorpi delle cellule di Schwann. J Comp Neurol 1987;259(3):330–347.
- Court FA, Wrabetz L, Feltri ML: Lamina basale: le cellule di Schwann si avvolgono al ritmo dello spazio-tempo. Curr Opin Neurobiol 2006;16(5):501–507.
- Darby S, Frysztak R: Neuroanatomia del midollo spinale. In Cramer GD, Darby S (a cura di): Anatomia di base e clinica della colonna vertebrale, del midollo spinale e dell'ANS, 2a ed. Elsevier Mosby, 2005, pp 339–410.
- Morell P, Quarles R: Architettura molecolare della mielina. In Siegel G, Agranoff B, Albers R (a cura di): Neurochimica di base: aspetti molecolari, cellulari e medici, 6a ed. Lippincott-Raven, 1999, pp 51–71.
- Ritchie JM, Rogart RB: Densità dei canali del sodio nelle fibre nervose mielinizzate dei mammiferi e natura della membrana assonale sotto la guaina mielinica. Proc Natl Acad Sci USA 1977;74(1):211–215.
- Wang H, Kunkel DD, Martin TM, Schwartzkroin PA, Tempel BL: canali K+ eteromultimerici nelle regioni terminali e iuxtaparanodali dei neuroni. Natura 1993;365(6441):75–79.
- Thaxton C, Pillai AM, Pribisko AL, Dupree JL, Bhat MA: I nodi di Ranvier agiscono come barriere per limitare l'invasione dei domini paranodali fiancheggianti negli assoni mielinizzati. Neurone 2011;69(2):244–257.
- Waxman SG, Ritchie JM: dissezione molecolare dell'assone mielinizzato. Ann Neurol 1993;33(2):121–136.
- Ochoa J, Mair WG: Il normale nervo surale nell'uomo. I. Ultrastruttura e numero di fibre e cellule. Acta Neuropathol 1969;13(3):197–216.
- Millesi H, Terzis J: Nomenclatura nella chirurgia dei nervi periferici. In Terzis J (a cura di): Microricostruzione di lesioni nervose. Saunders, 1987, pp 3–13.
- Sala-Blanch X, Vandepitte C, Laur JJ, et al: una revisione pratica delle iniezioni perineurali rispetto a quelle intraneurali: una richiesta di nomenclatura standard. Int Anesthesiol Clin 2011;49(4):1–12.
- Sunderland S, Bradley KC: Il perineurio dei nervi periferici. Anat Rec 1952;113(2):125–141.
- Sunderland S: I tessuti connettivi dei nervi periferici. Cervello 1965;88(4):841–854.
- Ushiki T, Ide C: Organizzazione tridimensionale delle fibrille di collagene nel nervo sciatico del ratto come rivelata dalla microscopia elettronica a trasmissione ea scansione. Ris. tessuto cellulare 1990; 260 (1): 175–184.
- Tommaso PK. Il tessuto connettivo del nervo periferico: uno studio al microscopio elettronico. J Anat 1963;97:35–44.
- Thomas PK, Bhagat S: L'effetto dell'estrazione del contenuto intrafascicolare dei tronchi nervosi periferici sulla struttura perineurale. Acta Neuropathol 1978;43(1–2):135–141.
- Lorimier P, Mezin P, Labat Moleur F, Pinel N, Peyrol S, Stoebner P: localizzazione ultrastrutturale dei componenti principali della matrice extracellulare nel nervo di ratto normale. J Histochem Cytochem 1992;40(6):859–868.
- Reina MA, Lopez A, De Andres JA: [Tessuto adiposo all'interno dei nervi periferici. Studio del nervo sciatico umano]. Rev. Esp Anestesiol Reanim 2002;49(8):397–402.
- Mirsky R, Parmantier E, McMahon AP, Jessen KR: Il riccio del deserto derivato da cellule di Schwann segnala la formazione della guaina nervosa. Ann NY Accad Sci 1999;883:196–202.
- Shanthaveerappa TR, Bourne GH: epitelio perineurale: un nuovo concetto del suo ruolo nell'integrità del sistema nervoso periferico. Scienza 1966;154(3755):1464–1467.
- Lehmann HJ: [Struttura e funzione della barriera di diffusione perineurale]. Z Zellforsch Mikrosk Anat 1957;46(2):232–241.
- Eldridge CF, Sanes JR, Chiu AY, Bunge RP, Cornbrooks CJ: proteoglicano eparan solfato associato alla lamina basale nel ratto PNS: caratterizzazione e localizzazione mediante anticorpi monoclonali. J Neurocytol 1986;15(1):37–51.
- Paetau A, Mellstrom K, Vaheri A, Haltia M: distribuzione di una delle principali proteine del tessuto connettivo, la fibronectina, nel tessuto nervoso umano normale e neoplastico. Acta Neuropathol 1980;51(1):47–51.
- Stopar-Pintaric T, Cvetko E, Strbec M, et al: alterazioni infiammatorie intraneurali e perineurali nei suinetti dopo l'iniezione di gel per ultrasuoni, endotossina, NaCl allo 0.9% o inserimento dell'ago senza iniezione. Anaesth Analg 2014;115:1–6.
- Rydevik BL, Kwan MK, Myers RR, et al: uno studio meccanico e istologico in vitro sull'allungamento acuto sul nervo tibiale del coniglio. J Orthop Res 1990;8(5):694–701.
- Olsson Y: Microambiente del sistema nervoso periferico in condizioni normali e patologiche. Crit Rev Neurobiol 1990;5(3): 265–311.
- Jacobs JM, Love S: morfologia qualitativa e quantitativa del nervo surale umano a diverse età. Cervello 1985;108(Pt 4):897–924.
- Powell HC, Myers RR, Costello ML, Lampert PW: pressione del fluido endoneurale nella degenerazione walleriana. Ann Neurol 1979;5(6):550–557.
- Gamble HJ, Eames RA. Uno studio al microscopio elettronico dei tessuti connettivi del nervo periferico umano. J Anat 1964;98:655–663.
- Salonen V, Roytta M, Peltonen J: Gli effetti della transezione nervosa sulle guaine di fibrilla di collagene endoneuriale. Acta Neuropathol 1987;74(1):13–21.
- 45. Oldfors A: Macrofagi nei nervi periferici. Uno studio istochimico ultrastrutturale ed enzimatico sui ratti. Acta Neuropathol 1980;49(1): 43–49.
- 46. Braunewell KH, Martini R, LeBaron R, et al: Up-regulation di un epitopo di condroitin solfato durante la rigenerazione del nervo sciatico del topo: evidenza che le molecole immunoreattive sono correlate ai proteoglicani di condroitin solfato decorin e versican. Eur J Neurosci 1995;7(4): 792–804.
- Kapur E, Vuckovic I, Dilberovic F, et al: Esito neurologico e istologico dopo iniezioni intraneurali di lidocaina nei nervi sciatici canini. Acta Anaesthesiol Scand 2007;51(1):101–107.
- Jeng CL, Rosenblatt MA: Iniezioni intraneurali e anestesia regionale: il noto e l'ignoto. Minerva Anestesio 2011;77(1):54–58.
- Orebaugh SL, Mukalel JJ, Krediet AC, et al: Iniezione della radice del plesso brachiale in un modello di cadavere umano: distribuzione dell'iniezione ed effetti sulla nevassi. Reg Anesth Antidolorifico 2012;37(5):525–529.
- Moayeri N, Bigeleisen PE, Groen GJ: Architettura quantitativa del plesso brachiale e dei compartimenti circostanti e loro possibile significato per i blocchi del plesso. Anestesiologia 2008;108(2):299–304.
- Sala Blanch X, Lopez AM, Carazo J, et al: Iniezione intraneurale durante il blocco del nervo sciatico guidato da stimolatore nervoso nella fossa poplitea. Fr. J Anaesth 2009;102(6):855–861.
- Berthold CH, Carlstedt T. Osservazioni sulla morfologia al passaggio tra il sistema nervoso periferico e centrale nella cat. III. Fibre mielinizzate nelle radichette dorsali S1. Acta Physiol Scand Suppl 1977;446:43–60.
- Andres KH: [La struttura fine della regione olfattiva degli animali macrosmatici]. Z Zellforsch Mikrosk Anat 1966;69:140–154.
- Haller FR, Low FN: La struttura fine della guaina della radice del nervo periferico nello spazio subaracnoideo nel ratto e in altri animali da laboratorio. Am J Anat 1971;131(1):11–19.
- Himango WA, Low FN: la struttura fine di un recesso laterale dello spazio subaracnoideo nel ratto. Anat Rec 1971;171(1):1–19.
- McCabe JS, Low FN: L'angolo subaracnoideo: un'area di transizione nel nervo periferico. Anat Rec 1969;164(1):15–33.
- Waggener JD, Beggs J: Le coperture membranose dei tessuti neurali: uno studio di microscopia elettronica. J Neuropathol Exp Neurol 1967;26(3): 412–426.
- Pease DC, Schultz RL: microscopia elettronica di meningi craniche di ratto. Am J Anat 1958;102(2):301–321.
- Nabeshima S, Reese TS, Landis DM, Brightman MW: Giunzioni nelle meningi e nella glia marginale. J Comp Neurol 1975; 164 (2): 127–169.
- Evans PJ, Lloyd JW, Wood GJ: iniezione intratecale accidentale di bupivacaina e destrano. Anestesia 1981;36(7):685–687.
- Gadsden JC, Lindenmuth DM, Hadzic A, Xu D, Somasundarum L, Flisinski KA: il blocco del plesso lombare mediante iniezione ad alta pressione porta alla diffusione controlaterale ed epidurale. Anestesiologia 2008;109(4):683–688.
- Lundborg G. Microcircolazione intraneurale. Orthop Clinic North Am 1988;19(1):1–12.
- McManis PG, Schmelzer JD, Zollman PJ, Low PA: flusso sanguigno e autoregolazione nei gangli somatici e autonomi. Confronto con il nervo sciatico. Cervello 1997;120(Pt 3):445–449.
- Beggs J, Johnson PC, Olafsen A, Watkins CJ, Cleary C: arteriole transperineurial nel nervo surale umano. J Neuropathol Exp Neurol 1991;50(6): 704–718.
- Bell MA, Weddell AG: uno studio morfometrico dei vasi intrafascicolari del nervo sciatico dei mammiferi. Nervo muscolare 1984;7(7):524–534.
- Smith DR, Kobrine AI, Rizzoli HV: flusso sanguigno nei nervi periferici. Portate normali e post severance. J Neurol Sci 1977;33(3): 341–346.
- Kozu H, Tamura E, Parry GJ: L'afflusso di sangue endoneurale ai nervi periferici non è uniforme. J Neurol Sci 1992; 111 (2): 204–208.
- Perez-Castro R, Patel S, Garavito-Aguilar ZV, et al: Citotossicità degli anestetici locali nelle cellule neuronali umane. Anesth Analg 2009;108(3):997–1007.
- Drac H, Babiuch M, Wisniewska W: Cambiamenti morfologici e biochimici nei nervi periferici con l'invecchiamento. Neuropatol Pol 1991;29(1–2–): 49–67.
- Lehmann J: [Cambiamenti legati all'età nei nervi periferici]. Zentralbl Allg Pathol 1986;131(3):219–227.
- Arnold N, Harriman DG: L'incidenza dell'anomalia nel controllo dei nervi periferici umani studiata mediante dissezione di un singolo assone. J Neurol Neurochirurgia Psichiatria 1970;33(1):55–61.
- Tohgi H, Tsukagoshi H, Toyokura Y: Cambiamenti quantitativi con l'età nei normali nervi surali. Acta Neuropathol 1977;38(3):213–220.
- Vizoso AD: La relazione tra lunghezza internodale e crescita nei nervi umani. J Anat 1950;84(4):342–353.
- Ochoa J, Mair WG: Il normale nervo surale nell'uomo. II. Cambiamenti negli assoni e nelle cellule di Schwann dovuti all'invecchiamento. Acta Neuropathol 1969;13(3): 217–239.
- Ochoa J: Riconoscimento della malattia delle fibre amieliniche: criteri morfologici. Nervo muscolare 1978;1(5):375–387.
- Kovacic U, Sketelj J, Bajrovic FF: Capitolo 26: Differenze legate all'età nella reinnervazione dopo la lesione del nervo periferico. Int Rev Neurobiol 2009;87:465–482.
- Li X, Karmakar MK, Lee A, Kwok WH, Critchley LA, Gin T: valutazione quantitativa dell'intensità dell'eco del nervo mediano e dei muscoli flessori dell'avambraccio nei giovani e negli anziani. Fr. J Radiol 2012;85(1014):e140–e145.
- Navarro X, Vivo M, Valero-Cabre A: Plasticità neurale dopo lesione e rigenerazione dei nervi periferici. Prog Neurobiol 2007;82(4):163–201.
- Keyl C, Held T, Albiez G, Schmack A, Wiesenack C: Aumento della soglia di stimolazione del nervo elettrico del nervo sciatico nei pazienti con cancrena del piede diabetico: uno studio prospettico di coorte parallela. Eur J Anaesthesiol 2013;30(7):435–440.
- Borgeat A, Ekatodramis G, Kalberer F, Benz C: Complicanze acute e non acute associate al blocco interscalenico e alla chirurgia della spalla: uno studio prospettico. Anestesiologia 2001;95(4):875–880.