1. GESCHICHTE
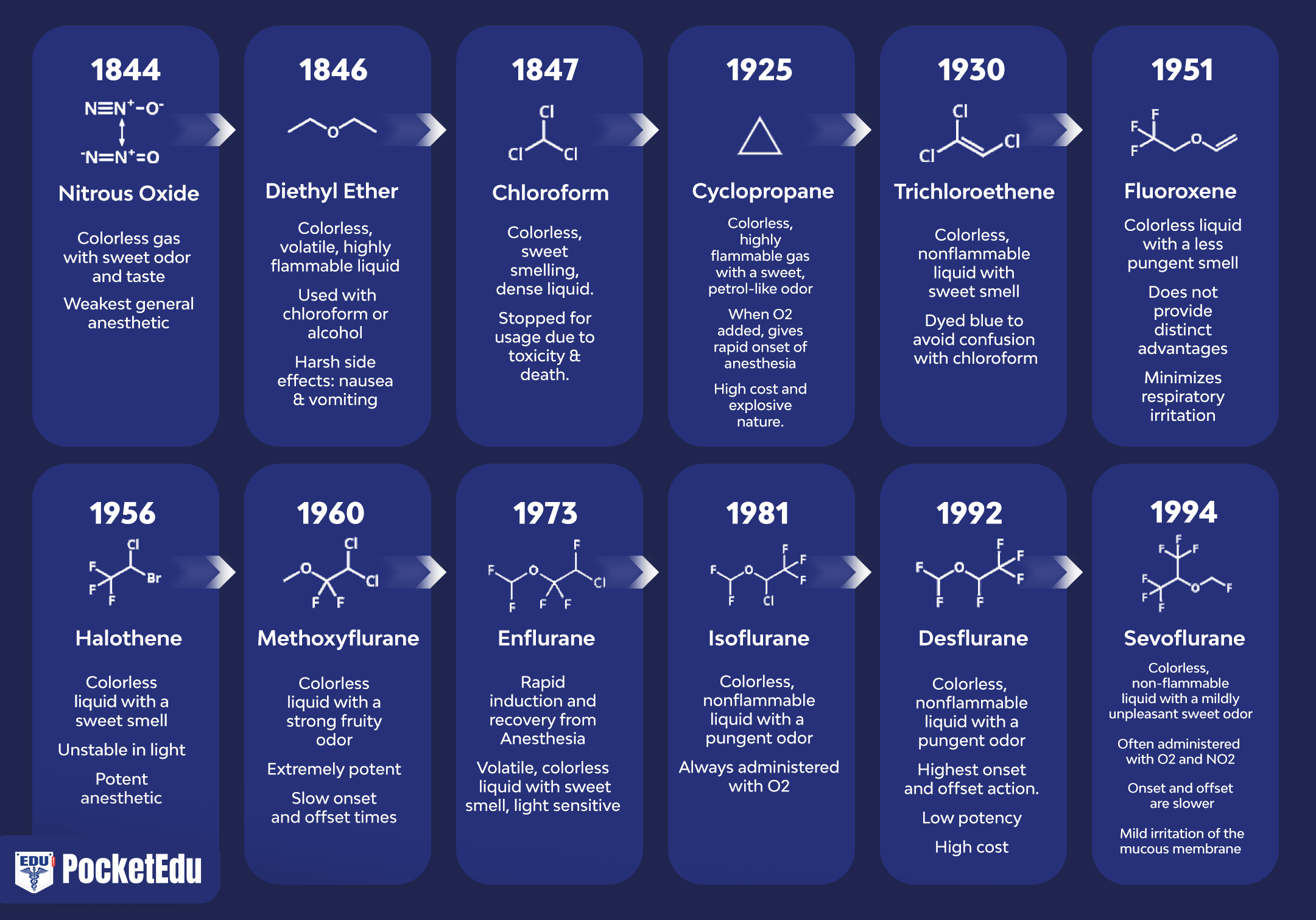
Die Entdeckung der Inhalationsanästhesie spiegelt die Beiträge von Klinikern und Wissenschaftlern in den Vereinigten Staaten und England wider (Abb. 1) (1). Die am häufigsten verwendeten Inhalationsanästhetika in der modernen Anästhesie umfassen flüchtige Flüssigkeiten (dh Halothan, Enfluran, Isofluran, Desfluran und Sevofluran) und ein einzelnes Gas (dh Lachgas) (Abb. 2 und 3). Halothan, Enfluran und Isofluran werden nicht mehr häufig verwendet. Keines dieser Inhalationsanästhetika erfüllt jedoch alle Kriterien eines „idealen“ Inhalationsanästhetikums, und die chemischen Eigenschaften unterscheiden sich zwischen den Arzneimitteln.

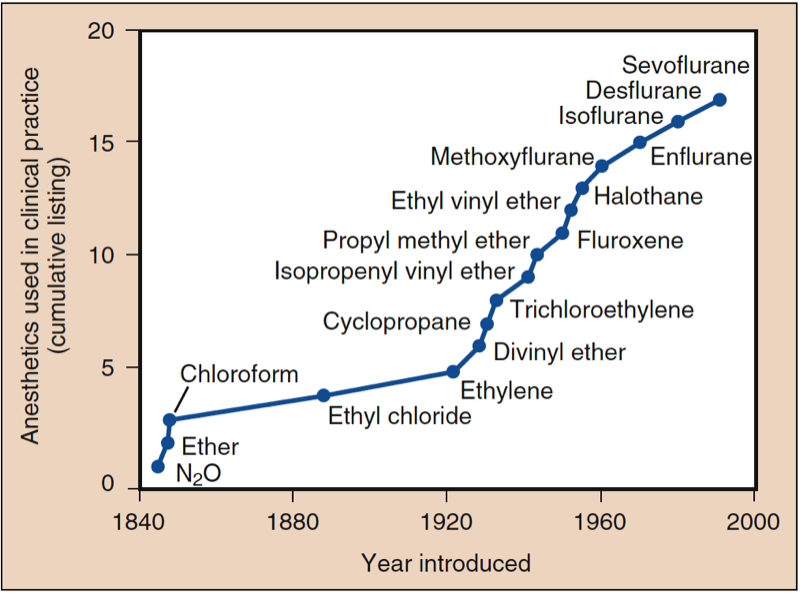
- Abb. 1. In der klinischen Praxis verwendete Anästhetika. Die Geschichte der Anästhesie begann mit der Einführung von Lachgas (N2O), Äther und Chloroform. Nach 1950 enthielten alle eingeführten Medikamente, mit Ausnahme von Ethylvinylether, Fluor. Alle Anästhetika, die beginnend mit Halothan eingeführt wurden, waren nicht brennbar. (Aus Eger EI. Desflurane (Suprane): A Compendium and Reference. Nutley, NJ: Anaquest; 1993:1, Verwendung mit Genehmigung.)

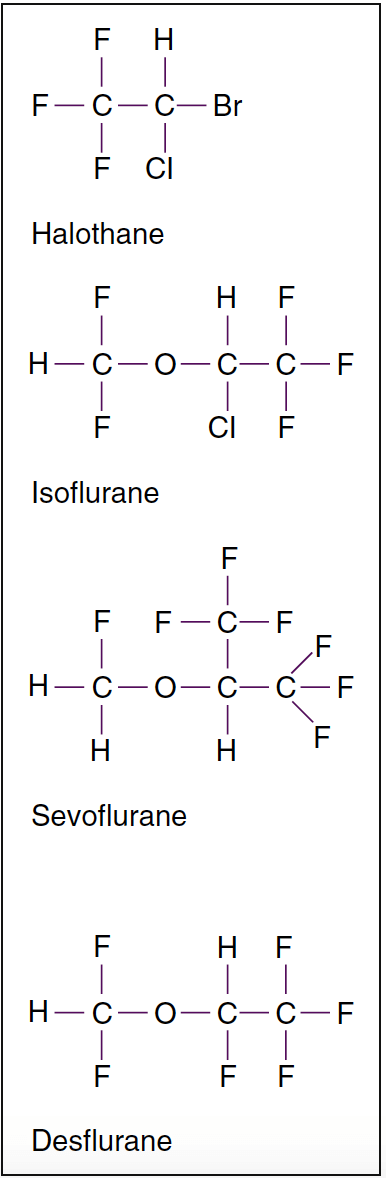
- Abb. 2. Molekulare Strukturen potenter flüchtiger Anästhetika. Halogenierte flüchtige Anästhetika sind bei Raumtemperatur Flüssigkeiten. Unter den flüchtigen Anästhetika ist Halothan ein Alkanderivat, während alle anderen Derivate von Methylethylether sind. Isofluran ist das chemische Isomer von Enfluran.

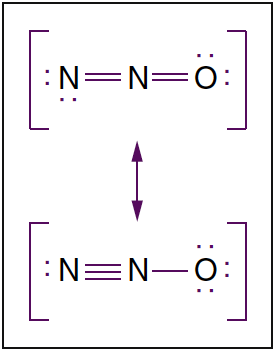
- Abb. 3. Molekülstruktur von Lachgas. Lachgas ist ein lineares Molekül, das in zwei Resonanzstrukturen existiert. Punkte bezeichnen nichtbindende Elektronen.
2. DIE ERSTEN INHALIERTEN ANÄSTHETIK
Lachgas
Lachgas wurde erstmals 1772 von dem englischen Chemiker, Autor und Minister der Unitarier, Joseph Priestley, synthetisiert. Siebenundzwanzig Jahre später verabreichte Sir Humphry Davy Lachgas zur zahnärztlichen Analgesie. Obwohl er vermutete, dass Lachgas zur Schmerzlinderung bei Operationen verwendet werden könnte, wurde es erst 42 Jahre später von einem 29-jährigen Zahnarzt namens Horace Wells verwendet, der sich selbst Lachgas verabreichte und feststellte, dass es seine Schmerzen linderte. Insbesondere bemerkte er 1842 auf einer öffentlichen Ausstellung in Hartford, Connecticut, die hypnotische und analgetische Wirkung von Lachgas. Am nächsten Tag unterzog sich Wells selbst einer Zahnextraktion durch einen anderen Zahnarzt. Wells verspürte bei der Extraktion nur minimale Schmerzen und lernte anschließend die Methode der Lachgassynthese, um sie seinen eigenen Patienten zur Verfügung zu stellen. Zwei Jahre später ließ er im Massachusetts General Hospital eine schmerzfreie Zahnchirurgie mit Lachgasverabreichung demonstrieren. Wells war nicht ganz erfolgreich und wurde infolge dieser Demonstration diskreditiert.
Diethylether
William Morton, ein Zahnarzt aus Boston, bemerkte, dass Diethylether während „Äther-Ausgelassenheiten“, bei denen Äther wegen seiner berauschenden Wirkung eingeatmet wurde, ähnliche Wirkungen hatte wie Lachgas. Wie Wells wendete Morton Äther in seiner Zahnarztpraxis an und demonstrierte dann am 16. Oktober 1846 („Äthertag“) seine anästhetischen Eigenschaften im Massachusetts General Hospital. Im Gegensatz zu Wells' Debakel wurde Mortons Demonstration mit großer Begeisterung aufgenommen. Die Ergebnisse erfolgreicher Ätheranästhetika wurden bald im Boston Medical and Surgical Journal veröffentlicht. Obwohl Crawford Long 1842, 4 Jahre früher als Morton, einem Patienten Diethylether verabreichte, veröffentlichte er seine Arbeit nicht, und Morton wird daher traditionell die Entdeckung der Fähigkeit von Diethylether zur Erzeugung von Anästhesie zugeschrieben.
Chloroform
James Simpson, ein Geburtshelfer aus Edinburgh, Schottland, entwickelte Chloroform, das die langwierige Induktion, Entzündlichkeit und postoperative Übelkeit, die bei Diethylether beobachtet wurden, nicht teilte. Chloroform wurde bald als inhalatives Anästhetikum in England populär, obwohl Diethylether die medizinische Praxis in Nordamerika dominierte. Leider war Chloroform mit mehreren ungeklärten intraoperativen Todesfällen bei ansonsten gesunden Patienten und zahlreichen Fällen von Hepatotoxizität verbunden.
3. Inhalative Anästhetika zwischen 1920 und 1940
Zwischen 1920 und 1940 wurden Ethylen, Cyclopropan und Divinylether als Anästhetika eingeführt und setzten sich gegenüber den älteren Inhalationsanästhetika (mit Ausnahme von Lachgas) durch, indem sie eine schnellere, angenehmere Narkoseeinleitung bewirkten und ein schnelleres Aufwachen ermöglichten den Abschluss der Operation. Jede hatte jedoch schwerwiegende Nachteile. Viele waren brennbar (dh Diethylether, Divinylether, Ethylen und Cyclopropan), während andere, die vollständig mit Chlor halogeniert waren, giftig waren (dh Chloroform, Ethylchlorid und Trichlorethylen).
4. FLUORCHEMIE UND MODERNE INHALATIONSANÄSTHETIK
Techniken der Fluorchemie, die aus den Bemühungen zur Herstellung der ersten Atomwaffen entwickelt wurden, fanden einen zufälligen, gesellschaftlich vorteilhaften Zweck, indem sie ein Verfahren zur Synthese moderner Inhalationsanästhetika bereitstellten (2,3). Moderne Inhalationsanästhetika sind teilweise oder vollständig mit Fluor halogeniert (siehe Abb. 2). Fluorierung sorgt für größere Stabilität und geringere Toxizität.
Halothan
Halothan wurde 1956 in die klinische Praxis eingeführt und weit verbreitet verwendet. Es hatte im Vergleich zu den älteren Anästhetika mehrere Vorteile, darunter Nichtentflammbarkeit, einen angenehmen Geruch, geringere Organtoxizität und pharmakokinetische Eigenschaften, die im Vergleich zu Äther eine viel schnellere Einleitung der Anästhesie und einen schnelleren Austritt ermöglichen. Leider tauchten nach 4 Jahren kommerzieller Anwendung Berichte über fulminante Lebernekrose nach Halothan-Anästhesie bei Patienten auf, bei denen andere Ursachen für Leberschäden nicht offensichtlich waren. Das Problem unvorhersehbarer Leberschäden regte die Suche nach anderen flüchtigen Anästhetika an. Halothan sensibilisiert das Myokard auch für die rhythmusfördernden Wirkungen von Katecholaminen.
Methoxyfluran
Methoxyfluran wurde erstmals 1960 in die klinische Praxis eingeführt. Innerhalb des ersten Jahrzehnts seiner Einführung tauchten Berichte über Nierenversagen bei Methoxyfluran-Anästhesie auf, was zu Studien führte, die eine dosisabhängige Nephrotoxizität aufgrund des anorganischen Fluorids bestätigten, das aus dem Metabolismus dieses Anästhetikums resultierte.
Enfluran
Enfluran wurde 1972 in die klinische Praxis eingeführt. Im Gegensatz zu Halothan sensibilisierte es das Herz nicht für Katecholamine und war nicht mit Hepatotoxizität verbunden. Enfluran wurde jedoch zu anorganischem Fluorid metabolisiert und könnte im Elektroenzephalogramm (EEG) Hinweise auf Anfallsaktivität hervorrufen, insbesondere wenn es in hohen Konzentrationen und bei Vorhandensein von Hypokapnie verabreicht wird.
Isofluran
Isofluran wurde 1980 in die klinische Praxis eingeführt und fand breite klinische Anwendung. Es war nicht mit Herzrhythmusstörungen verbunden. Da es nicht so leicht metabolisiert wird wie Halothan und Enfluran, wurde Isofluran mit einer geringeren Toxizität in Verbindung gebracht. Isofluran ermöglichte im Vergleich zu seinen Vorgängern einen schnelleren Beginn der chirurgischen Anästhesie und ein schnelleres Aufwachen.
Sevofluran und Desfluran
Sevofluran und Desfluran werden ausschließlich mit Fluor halogeniert und wurden erstmals in den späten 1960er bzw. 1970er Jahren synthetisiert (2,3). Beide waren teuer und schwierig zu synthetisieren und wurden daher nicht sofort für eine kommerzielle Verwendung in Betracht gezogen. In den 1980er Jahren wurde ihre Entwicklung angesichts der neuen Erkenntnis überdacht, dass ein wachsender Anteil der Anästhesiepraxis im ambulanten Bereich stattfindet und dass ausschließlich mit Fluor halogenierte Medikamente weniger löslich in Blut und Gewebe sind, was ein schnelleres Aufwachen und eine schnellere Genesung ermöglicht.
5. WIRKUNGSMECHANISMUS
Die Frage, wie inhalierte Anästhetika den anästhetischen Zustand erzeugen, kann auf vielen Ebenen der biologischen Organisation angegangen werden, einschließlich ihres Wirkungsortes innerhalb des Zentralnervensystems, der Moleküle, mit denen sie interagieren, und der Art dieser biologischen Wechselwirkung. Die Beantwortung dieser Fragen erfordert die Fähigkeit, anästhetische Wirkungen zu messen (4). Obwohl Inhalationsanästhetika seit fast 160 Jahren zur chirurgischen Anästhesie verwendet werden, gibt es keine einheitliche, akzeptierte Definition dessen, was den Anästhesiezustand ausmacht. Für experimentelle Zwecke hat sich eine operative Definition von Immobilität als Reaktion auf chirurgische Stimulation und Amnesie für intraoperative Ereignisse als nützlich erwiesen.
Messbare Eigenschaften
Zu den messbaren und universellen Merkmalen aller Inhalationsanästhetika gehören die Erzeugung von Immobilität und amnestische Wirkungen. Die Immobilität wird anhand der minimalen alveolären Konzentration (MAC) des Anästhetikums gemessen, die erforderlich ist, um bei 50 % der Patienten die Bewegung zu einer chirurgischen Inzision zu unterdrücken (2,5). Das Vorhandensein von Amnesie oder Bewusstsein ist jedoch schwer sicherzustellen. Analgesie gehört zwar zum Anästhesiezustand, kann aber auch bei einem immobilen Patienten, der sich nicht erinnern kann, nicht gemessen werden. Surrogatmaße für Schmerzen (dh erhöhte Herzfrequenz oder systemischer arterieller Blutdruck) deuten darauf hin, dass inhalierte Anästhetika die Wahrnehmung schmerzhafter Reize nicht unterdrücken. Einige Inhalationsanästhetika haben in geringen Konzentrationen hyperalgetische (schmerzverstärkende) Wirkungen. Die Entspannung der Skelettmuskulatur ist eine häufige, aber nicht universelle, zentrale Wirkung von inhalativen Anästhetika, wie durch Lachgas belegt wird, das den Tonus der Skelettmuskulatur erhöht.
Unbeweglichkeit
Starke inhalierte Anästhetika erzeugen hauptsächlich durch ihre Wirkungen auf das Rückenmark Immobilität, wie durch die Bestimmung von MAC bei decerebrierten Tieren nachgewiesen wurde (6). Studien an Nagetieren deuten darauf hin, dass Lachgas absteigende noradrenerge Bahnen aktiviert, die ihren Ursprung im periaquäduktalen Hirnstamm der grauen Substanz haben, die wiederum den nozizeptiven Input im Hinterhorn des Rückenmarks hemmen (7,8).
Amnestische Wirkungen
Supraspinale Strukturen wie die Amygdala, der Hippocampus und der Kortex gelten als sehr wahrscheinliche Ziele für die amnestischen Wirkungen von Anästhetika.
Depression des zentralen Nervensystems und Ionenkanäle
Inhalierte Anästhetika erzeugen eine Depression des Zentralnervensystems durch ihre Wirkung auf Ionenkanäle, die das elektrische Verhalten des Nervensystems steuern (4). Inhalierte Anästhetika erzeugen wahrscheinlich eine Anästhesie, indem sie die Funktion von inhibitorischen Ionenkanälen verstärken und die Funktion von exzitatorischen Ionenkanälen blockieren. Die Verstärkung der Funktion von inhibitorischen Ionenkanälen führt zu einer Hyperpolarisation des Neurons. Hyperpolarisation entsteht, wenn Chloridanionen durch γ-Aminobuttersäure A (GABAA)-Rezeptoren oder Glycinrezeptoren in Neuronen eindringen oder wenn Kaliumkationen durch Kaliumionenkanäle aus Neuronen ausströmen. Das Blockieren der Funktion von exzitatorischen Ionenkanälen verhindert eine Depolarisation des Neurons, indem der Durchgang positiver Ladungen in das Neuron (dh der Durchgang von Natriumionen durch N-Methyl-D-Aspartat [NMDA]-Rezeptoren oder Natriumkanäle) verhindert wird. Anästhetika können auch die Freisetzung von Neurotransmittern beeinflussen, und diese Wirkung kann teilweise durch Ionenkanäle vermittelt werden, die die Freisetzung von Neurotransmittern regulieren.
6. PHYSIKALISCHE EIGENSCHAFTEN
Molekulare Struktur
Moderne inhalative Anästhetika sind mit Ausnahme von Lachgas halogenierte Kohlenwasserstoffe. Halothan fehlt die Ethereinheit, die in Isofluran, Sevofluran und Desfluran vorhanden ist, was für seine Fähigkeit verantwortlich ist, ventrikuläre Herzrhythmusstörungen hervorzurufen. Isofluran und Desfluran unterscheiden sich nur durch den Ersatz von Fluor durch ein Chloratom. Die Fluorsubstitution verleiht eine größere Stabilität und Resistenz gegenüber dem Metabolismus.
Dampfdruck und Lieferung
Distickstoffmonoxid liegt bei Umgebungstemperatur als Gas vor, wird jedoch bei höheren Drücken flüssig. Die verbleibenden inhalierten Anästhetika sind Flüssigkeiten bei Umgebungstemperatur.
Verdampfer mit variablem Bypass
Halothan, Sevofluran und Isofluran werden von Verdampfern mit variablem Bypass abgegeben (Tec 4, 5 und 7; North American Draeger 19.n und 20.n). Der Verdampfer mit variablem Bypass enthält zwei Ströme von einströmendem Frischgas – einer berührt ein Reservoir (Sumpf) mit flüssigem Anästhetikum und der andere umgeht den Sumpf. Der Gasstrom, der den Sumpf durchquert, wird mit Anästhetikum gesättigt, wie es durch den Sättigungsdampfdruck des Anästhetikums bestimmt wird. Da die flüchtigen Anästhetika bei Partialdrücken weit unterhalb ihres gesättigten Dampfdrucks eine klinisch brauchbare Anästhesie erzeugen, muss das aus dem Sumpf austretende Gas durch Gas verdünnt werden, das nicht mit dem Anästhetikum in Kontakt gekommen ist. Die Konzentration des Anästhetikums in dem Gas, das den Verdampfer verlässt, wird durch den relativen Fluss (dh das Teilungsverhältnis) von frischem Gas durch den Sumpfkanal gegenüber dem Umgehungskanal bestimmt. Die Steuerung der aus dem Verdampfer austretenden Anästhetikum-Ausgangskonzentration erfolgt, wenn der Kliniker den Verdampferregler oder die elektronische Steuerung einstellt. Verdampfer mit variablem Bypass sind temperaturkompensiert, halten über einen weiten Temperaturbereich eine konstante Leistung aufrecht und werden für jedes einzelne Anästhetikum gemäß seinem unterschiedlichen Dampfdruck kalibriert. Das Kippen oder Überfüllen eines Verdampfers kann möglicherweise zu einer Überdosierung des Anästhetikums führen, wenn der Dampf des Anästhetikums in den Bypass-Kanal gelangt.
Der Datex-Ohmeda Aladin Cassette Vaporizer, der in den Maschinen der Datex-Ohmeda Anästhesieeinheit (ADU) verwendet wird, ist ein einzelner elektronisch gesteuerter Verdampfer, dessen Bypass innerhalb der ADU untergebracht ist und dessen Sumpf sich in austauschbaren, magnetisch codierten Kassetten zur Abgabe von Halothan befindet, Enfluran, Isofluran, Sevofluran und Desfluran. Der Aladin verwendet einen variablen Bypass als Mittel zur Regulierung der Ausgangskonzentration, was durch die Aktivität einer zentralen Verarbeitungseinheit (CPU) geschieht. Die CPU erhält Eingaben von mehreren Quellen, einschließlich der Konzentrationseinstellung, Durchflussmessern und internen Druck- und Temperatursensoren, und regelt wiederum ein Durchflussregelventil am Auslass der Verdampfungskammer. Wenn der Druck in der Kassette (Sumpf) den in der Bypass-Kammer übersteigt, was bei einer Raumtemperatur von über 22.8 °C während der Desfluran-Verabreichung der Fall wäre, schließt ein Einweg-Rückschlagventil und verhindert so den Rückfluss von mit Anästhetikum gesättigtem Gas zurück in die ADU mit anschließender Narkoseüberdosierung.
Beheizter Verdampfer
Der Dampfdruck von Desfluran auf Meereshöhe beträgt 700 mm Hg bei 20 °C (fast Siedezustand bei Raumtemperatur), und die Abgabe durch einen Verdampfer mit variablem Bypass kann zu unvorhersehbaren Konzentrationen führen. Aus diesem Grund wird ein speziell entwickelter Verdampfer (Tec 6, Datex-Ohmeda), der Desflurangas auf einen Druck von 2 atm erhitzt, verwendet, um Desflurandampf entsprechend den Einstellungen des Konzentrationsreglers durch den Anästhesieanbieter genau zu dosieren und abzugeben. Im Gegensatz zu den Verdampfern mit variablem Bypass ist die Ausgangskonzentration von Desfluran aus dem Tec 6 über einen Bereich barometrischer Drücke hinweg konstant (9). Daher ist der Partialdruck von Desfluran in großen Höhen bei einer bestimmten Tec 6-Verdampfereinstellung und Ausgangskonzentration (Volumenprozent) niedriger als auf Meereshöhe, was zu einer Unterdosierung des Anästhetikums führt, es sei denn, es wird eine Anpassung vorgenommen, die die größere Höhe berücksichtigt: erforderliche Verdampfereinstellung = (gewünschte Verdampfereinstellung auf Meereshöhe × 760 mm Hg)/örtlicher barometrischer Druck (in mm Hg) (10). Das Gegenteil (eine größere Leistung) kann bei Vaporizern mit variablem Bypass auftreten. Der pharmakologisch relevante quantitative Parameter für die anästhetische Aktivität ist jedoch der Partialdruck, nicht der Volumenprozentsatz. Obwohl bei gleicher Verdampfereinstellung in größerer Höhe ein größerer Anästhesieausstoß aus einem Verdampfer auftritt, sind daher der abgegebene Partialdruck und die Anästhesiewirkung an beiden Orten in Bezug auf die Verdampfereinstellung ähnlich.
Ökonomische und ökologische Erwägungen
Die Frischgasflussrate wirkt sich direkt auf die Menge der verwendeten flüchtigen Flüssigkeit und folglich auf die Kosten der Narkosemittelabgabe aus. Höhere Frischgasflüsse (bei oder über Atemminutenvolumen) minimieren die Rückatmung und ermöglichen einen schnelleren Ausgleich zwischen dem eingeatmeten und dem Partialdruck des zentralen Nervensystems (ZNS). Die Verwendung von Flüssen ohne Rückatmung beinhaltet jedoch den Verlust von Anästhetikum an die Umgebung und sollte nur für einen begrenzten Zeitraum von Minuten verwendet werden, normalerweise bei der Anästhesieeinleitung oder bei leichter Sedierung und bevorstehender chirurgischer Stimulation. Das Bewusstsein und die Besorgnis über den Beitrag der Freisetzung von eingeatmeten Anästhetika zu den gesamten Treibhausgasemissionen und zum Klimawandel nehmen zu. Mögliche Auswirkungen auf die Umwelt scheinen von dem atmosphärischen Lebenszeitgas sowie dem einzigartigen Infrarotabsorptionsspektrum jedes Anästhetikums herzurühren. Die atmosphärische Lebensdauer inhalierter Anästhetika unterscheidet sich erheblich (Lachgas, Desfluran, Sevofluran und Isofluran haben geschätzte 114, 10, 3.6 bzw. 1.2 Jahre). Einzelne Infrarot-Absorptionsspektren unterscheiden sich, wobei Desfluran im Vergleich zu Sevofluran die geringste Auswirkung auf das Kohlendioxidäquivalent besitzt. Obwohl die Auswirkungen von inhalativen Anästhetika auf den allgemeinen Klimawandel nach wie vor umstritten sind, verdienen mehrere Punkte Beachtung. Erstens wird die Verwendung von niedrigen Frischgasflüssen (0.5–1 l/min) die Kosten und die Freisetzung in die Umwelt ausgleichen. Zweitens verspricht die Entwicklung von Systemen zur Rückgewinnung und Wiederverwendung von Anästhetika, die Umweltbelastung weiter zu begrenzen und Geld zu sparen (11).
Stabilität
Der Abbau von Anästhetika durch Metabolismus oder durch eine Wechselwirkung mit Kohlendioxid-Absorptionsmitteln (insbesondere bei Austrocknung) erzeugt mehrere potenziell toxische Verbindungen (11).
Stoffwechsel und Abbau
Methoxyfluran produziert anorganisches Fluorid, das in der Vergangenheit für das sporadische Auftreten von Nephrotoxizität (dh Hochleistungsnierenversagen) nach längerer Anästhesie verantwortlich war. Verbindung A (dh Fluormethyl-2,2-difluor-1-[trifluormethyl]vinylether), hergestellt durch den Abbau von Sevofluran, und eine ähnliche Verbindung, hergestellt aus Halothan, sind bei Tieren nach längerer Exposition nephrotoxisch. Beim Menschen führt eine verlängerte Anästhesie mit Sevofluran und geringen Frischgasflüssen (1 l/min) zu einer Verbindung A-Exposition, die ausreicht, um vorübergehende Proteinurie, Enzymurie und Glykosurie hervorzurufen, aber es gibt keine Hinweise auf erhöhte Serumkreatininkonzentrationen oder schädliche Langzeitwirkungen auf die Nierenfunktion. Dennoch empfiehlt die Packungsbeilage für Sevofluran, einen niedrigen Frischgasfluss (< 2 l/min) auf weniger als 2 MAC-Stunden (d. h. MAC-Konzentration × Verabreichungsdauer) der Sevofluran-Anästhesie zu beschränken.
Kohlendioxid-Absorptionsmittel und exotherme Reaktionen
Zu den Variablen, die das Ausmaß des Abbaus flüchtiger Anästhetika bei Exposition gegenüber Kohlendioxid-Absorptionsmitteln beeinflussen, gehören der Zustand (d. h. Hydratation und Temperatur) und die chemische Zusammensetzung des Absorptionsmittels, Frischgasflussraten, Atemminutenvolumen und vor allem das Anästhetikum selbst (12). . Obwohl Desfluran und Isofluran in hydratisierten Kohlendioxid-Absorptionsmitteln bis zu Temperaturen von mehr als 60 °C sehr stabil sind, verursacht die vollständige Austrocknung herkömmlicher Kohlendioxid-Absorptionsmittel, die Natrium- und Kaliumhydroxid enthalten, einen Abbau und die Bildung von Kohlenmonoxid aus allen flüchtigen Anästhetika, unabhängig von der Temperatur. Hohe Frischgasflussraten (insbesondere solche, die das normale Atemminutenvolumen überschreiten) beschleunigen die Austrocknung des Absorptionsmittels, und die Austrocknung führt zu einem beschleunigten Abbau. Da der Abbau ein exothermer Prozess ist, kann die Temperatur des Absorptionsmittels dramatisch ansteigen.
Die exotherme Reaktion, die aus der Wechselwirkung von getrocknetem Kohlendioxid-Absorptionsmittel und flüchtigen Anästhetika (insbesondere Sevofluran) resultiert, kann extrem hohe Temperaturen im Inneren des Absorptionsmittelbehälters erzeugen (13,14). Der Temperaturanstieg kann zu einer Explosion und einem Brand im Kanister oder Anästhesiekreislauf führen. Das entfernte Brand- und Explosionsrisiko durch exotherme Reaktionen kann vollständig vermieden werden, indem Maßnahmen ergriffen werden, die die Aufrechterhaltung einer angemessenen Hydratation im Kohlendioxid-Absorptionsmittel sicherstellen (z Gasflussraten während der Anästhesie und im Zweifelsfall die Hydratation des Absorptionsmittels ändern). Kommerziell erhältliche Kohlendioxid-Absorptionsmittel mit verringerten oder fehlenden einwertigen Basen (dh Natriumhydroxid und Kaliumhydroxid) unterliegen keinem starken Abbau, wenn sie flüchtigen Anästhetika ausgesetzt werden, unabhängig vom Hydratationsstatus des Absorptionsmittels.
7. RELATIVE WIRKSTÄRKE VON INHALIERTEN ANÄSTHETIK
Die relative Potenz zwischen inhalativen Anästhetika wird am häufigsten durch die Dosis beschrieben, die erforderlich ist, um die Bewegung bei 50 % der Patienten als Reaktion auf einen chirurgischen Schnitt zu unterdrücken (5). Diese Dosis (ein einzelner Punkt auf einer Dosis-Wirkungs-Kurve) wird als MAC bezeichnet. Da die Standardabweichung des MAC ungefähr 10 % beträgt, sollten sich 95 % der Patienten als Reaktion auf eine Inzision bei 1.2 MAC des inhalierten Anästhetikums nicht bewegen, und 99 % der Patienten sollten sich als Reaktion auf eine Inzision bei 1.3 MAC des inhalierten Anästhetikums nicht bewegen . Die MAC wird von mehreren Variablen beeinflusst, bleibt jedoch vom Geschlecht oder der Dauer der Operation und Anästhesie unbeeinflusst.
MAC ermöglicht den Potenzvergleich zwischen Anästhetika; 1.15 % Isofluran ist gleich wirksam wie 6 % Desfluran bei der Verhinderung von Bewegungen als Reaktion auf einen chirurgischen Einschnitt bei Patienten ähnlichen Alters und ähnlicher Körpertemperatur. Bemerkenswerterweise sind die MAC-Werte für verschiedene Inhalationsanästhetika additiv. Beispielsweise haben 0.5 MAC Distickstoffmonoxid, verabreicht mit 0.5 MAC Isofluran, die gleiche Wirkung wie 1 MAC eines beliebigen inhalierten Anästhetikums bei der Verhinderung der Bewegung als Reaktion auf einen Einschnitt (was die anästhesieinduzierte Hemmung der Reflexantworten auf der Ebene des Rückenmarks widerspiegelt) ( 6). Die Konzentration des Anästhetikums im Gehirn, die erforderlich ist, um eine Bewegung als Reaktion auf einen chirurgischen Einschnitt zu verhindern, ist wahrscheinlich größer als die MAC.
Die zur Erzeugung einer Amnesie erforderliche Dosis des Anästhetikums weist wahrscheinlich eine größere Variabilität auf als die MAC. Die alveoläre Konzentration von Isofluran, die die Erinnerung an einen verbalen Stimulus verhinderte, betrug 0.20 MAC bei 50 % und 0.40 MAC bei 95 % der Freiwilligen (15). Unter der Annahme einer Standard-Normalverteilung der Dosis-Wirkungs-Verteilung beträgt die Standardabweichung der minimalen Konzentration, die einen Rückruf verhindert, daher etwa die Hälfte des Mittelwerts (0.1 MAC). Unter Bezugnahme auf Standardnormalkurven können wir berechnen, dass die Konzentration, die von 1 von 100,000 Probanden mit dem höchsten Anästhesiebedarf benötigt wird, 4.27 Standardabweichungen (SD) über dem Mittelwert (dh größer als 0.627 MAC) liegen würde, um die Erinnerung an einen verbalen Stimulus zu verhindern. Eine Extrapolation dieses Wertes auf den Kontext einer Operation muss jedoch mit Vorsicht erfolgen, da die erforderliche Dosis zur Verhinderung des Abrufs schmerzhafter im Vergleich zu einer verbalen Stimulation erheblich höher sein kann (16). Das Verhältnis der Konzentration, die erforderlich ist, um die motorische Reaktion auf einen chirurgischen Einschnitt zu verhindern (wiedergegeben in MAC), zu der Konzentration, die erforderlich ist, um das Bewusstsein zu unterdrücken und den Rückruf zu verhindern, unterscheidet sich geringfügig zwischen einzelnen starken inhalativen Anästhetika und unterscheidet sich erheblich zwischen starken inhalativen Anästhetika insgesamt und Lachgas. Freiwillige, denen Isofluran verabreicht wurde, zeigten bei 0.45 MAC von Isofluran kein Erinnerungsvermögen, während es bei bis zu 0.6 MAC von Lachgas zu einem Erinnerungsvermögen kam (17).
8. PHARMAKOKINETIK VON INHALIERTEN ANÄSTHETIK
Die Pharmakokinetik inhalierter Anästhetika beschreibt ihre Aufnahme (Absorption) aus den Alveolen in den systemischen Kreislauf, die Verteilung im Körper und schließlich die Ausscheidung durch die Lunge oder den Metabolismus hauptsächlich in der Leber. Durch Steuerung des eingeatmeten Partialdrucks (PI) (entspricht der Konzentration [%] bezogen auf die Gasphase) eines eingeatmeten Anästhetikums wird ein Gradient erzeugt, so dass das Anästhetikum vom Anästhesiegerät an seinen Wirkort, den, abgegeben wird Gehirn. Das primäre Ziel der Inhalationsanästhesie ist es, einen konstanten und optimalen Hirnpartialdruck (Pbr) des Anästhetikums zu erreichen.
Das Gehirn und alle anderen Gewebe gleichen sich mit dem Partialdruck des eingeatmeten Anästhetikums aus, das ihnen durch das arterielle Blut (Pa) zugeführt wird. Ebenso gleicht sich das Blut mit dem alveolären Partialdruck (PA) des Anästhetikums an:
PA ⇄ Pa ⇄ Pbr
Die Aufrechterhaltung eines konstanten und optimalen PA wird zu einer indirekten, aber nützlichen Methode zur Steuerung des Pbr. Der PA eines inhalierten Anästhetikums spiegelt seinen Pbr wider und ist der Grund, warum der PA als Index der Anästhesietiefe, als Spiegel der Induktions- und Erholungsrate von der Anästhesie und als Maß für die gleiche Potenz verwendet wird (siehe frühere Diskussion unter „Relative Potenz“. von Inhalationsanästhetika“). Das Verständnis der Faktoren, die den PA und den Pbr bestimmen, ermöglicht es dem Anästhesieanbieter, die Dosis des inhalierten Anästhetikums, das an das Gehirn abgegeben wird, geschickt zu steuern und anzupassen.
Faktoren, die den alveolären Partialdruck bestimmen
Der PA und letztendlich der Pbr eines inhalierten Anästhetikums werden durch den Eintrag (Abgabe) in die Alveolen abzüglich der Aufnahme (Verlust) des Arzneimittels aus den Alveolen in das pulmonalarterielle Blut bestimmt. Die Zufuhr des inhalierten Anästhetikums hängt vom PI, der alveolären Ventilation ( ˙VA) und den Eigenschaften des Anästhesie-Atemsystems ab. Die Aufnahme des inhalierten Anästhetikums hängt von der Löslichkeit, dem Herzzeitvolumen (CO) und der alveolar-venösen Partialdruckdifferenz (PA − Pv) ab. Diese sechs Faktoren wirken gleichzeitig, um den PA zu bestimmen. Metabolismus und perkutaner Verlust von inhalierten Anästhetika haben keinen signifikanten Einfluss auf die PA während der Einleitung und Aufrechterhaltung der Anästhesie.
Inspirierter Anästhesie-Partialdruck
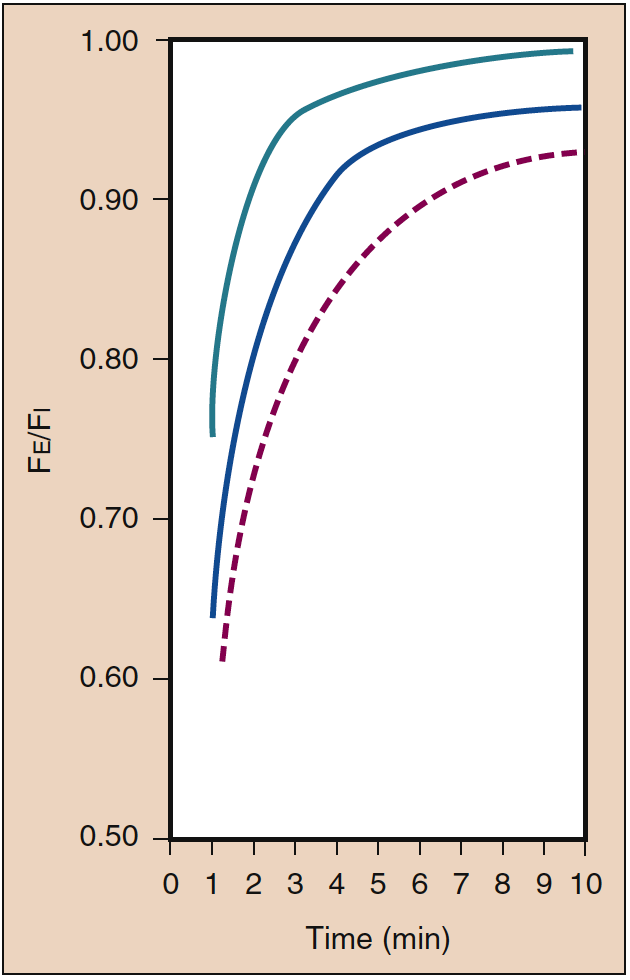
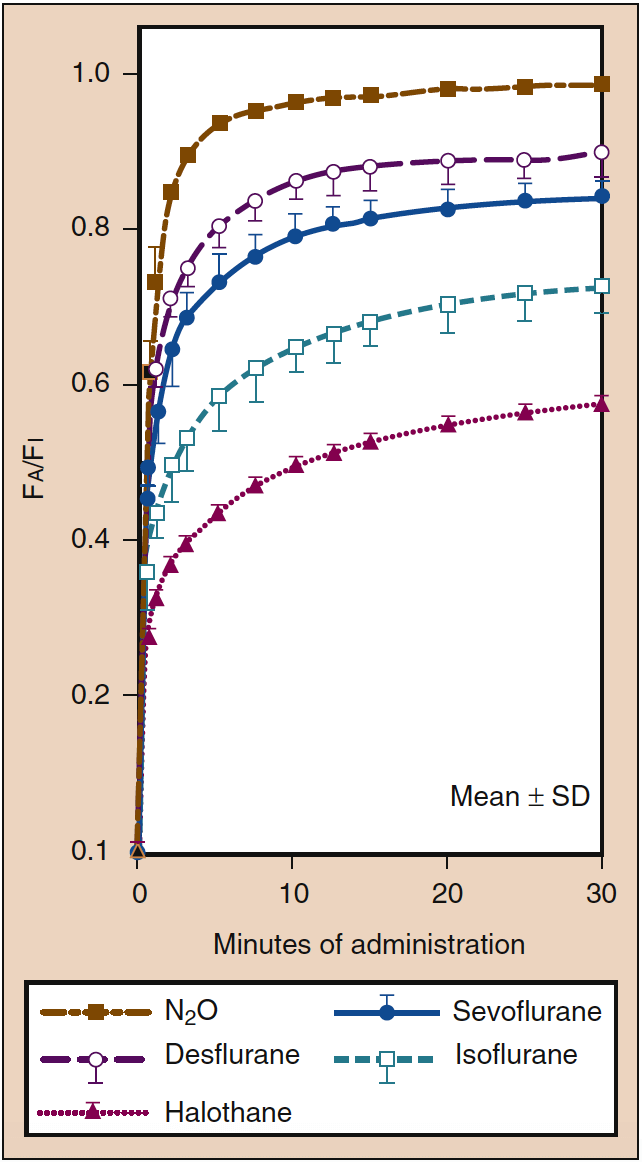
Während der anfänglichen Verabreichung eines inhalativen Anästhetikums ist ein hoher PI erforderlich. Dieser anfänglich hohe PI (dh Input) gleicht die Auswirkungen der Aufnahme in das Blut aus und beschleunigt die Einleitung der Anästhesie, wie durch die Anstiegsrate des PA widergespiegelt wird. Dieser Effekt des PI ist als Konzentrationseffekt bekannt. Klinisch ist der für eine Konzentrationswirkung notwendige Konzentrationsbereich wohl nur mit Lachgas möglich (Abb. 4) (19).

- Abb. 4. Der Einfluss der eingeatmeten Konzentration (%) (Fi) auf die Anstiegsrate der alveolären (endtidalen) Konzentration (Fe) ist als Konzentrationseffekt bekannt. Die Linien zeigen Konzentrationen von 85 % (grün), 50 % (blau) und 10 % (rot gestrichelt). (Aus Eger EI. Wirkung der eingeatmeten Anästhesiekonzentration auf die Anstiegsgeschwindigkeit der alveolären Konzentration. Anesthesiology. 1963;24:153-157, mit Genehmigung verwendet.)
Mit der Zeit, wenn die Aufnahme in das Blut abnimmt, sollte der PI verringert werden, um der verringerten Aufnahme des Anästhetikums zu entsprechen. Die Verringerung des PI zur Anpassung an die mit der Zeit abnehmende Aufnahme ist entscheidend, wenn der Anästhesieanbieter das Ziel erreichen will, einen konstanten und optimalen Pbr aufrechtzuerhalten. Wenn zum Beispiel der PI mit der Zeit konstant gehalten würde (Eingabekonstante), würde der PA (und die Tiefe der Anästhesie, wie durch den Pbr wiedergegeben) fortschreitend zunehmen, wenn die Aufnahme des Anästhetikums in das Blut mit der Zeit abnimmt.
Zweiter Gaseffekt
Der zweite Gaseffekt ist ein eigenständiges Phänomen, das unabhängig vom Konzentrationseffekt auftritt. Die Fähigkeit der großvolumigen Aufnahme eines Gases (erstes Gas), die Anstiegsrate des PA eines gleichzeitig verabreichten Begleitgases (zweites Gas) zu beschleunigen, ist als Zweitgaseffekt bekannt. Beispielsweise beschleunigt die anfängliche Aufnahme eines großen Volumens von Lachgas die Aufnahme von Begleitgasen wie flüchtigen Anästhetika und Sauerstoff. Der vorübergehende Anstieg (ca. 10 %) des PaO2, der die frühe Phase der Lachgasverabreichung begleitet, spiegelt die Zweitgaswirkung von Lachgas auf Sauerstoff wider. Dieser Anstieg des PaO2 wurde als alveoläre Hyperoxygenierung bezeichnet. Erhöhter trachealer Einstrom aller eingeatmeten Gase (dh erstes und zweites Gas) und Konzentration der zweiten Gase in einem kleineren Lungenvolumen (dh Konzentrationseffekt) aufgrund der hochvolumigen Aufnahme des ersten Gases sind die Erklärungen für das zweite Gas Wirkung. Obwohl der Second-Gas-Effekt auf bewährten pharmakokinetischen Prinzipien beruht, ist seine klinische Bedeutung zweifelhaft.
Alveoläre Ventilation
Ein erhöhter ˙VA fördert wie PI den Eintrag von inhalierten Anästhetika, um die Aufnahme in das Blut auszugleichen. Der Nettoeffekt ist eine schnellere Anstiegsrate des PA und eine schnellere Narkoseeinleitung. Hypoventilation hat erwartungsgemäß den gegenteiligen Effekt und verlangsamt die Narkoseeinleitung.
Eine kontrollierte Beatmung der Lunge, die zu einer Hyperventilation und einem verringerten venösen Rückstrom führt, beschleunigt die Anstiegsrate des PA aufgrund eines erhöhten Inputs (dh eines erhöhten ˙VA) und einer verringerten Aufnahme (dh eines verringerten CO). Infolgedessen kann das Risiko einer Überdosierung von Anästhetika während einer kontrollierten Beatmung der Lunge erhöht sein, und es kann angebracht sein, den PI volatiler Anästhetika zu verringern, wenn die Beatmung der Lunge von spontan auf kontrolliert umgestellt wird, um die PA ähnlich wie bisher zu halten bei Spontanatmung.
Ein weiterer Effekt der Hyperventilation ist eine verminderte zerebrale Durchblutung aufgrund der damit verbundenen Abnahme des PaCO2. Es ist denkbar, dass die Auswirkung einer erhöhten Anästhetikumzufuhr auf die Anstiegsrate des PA durch eine verringerte Abgabe von Anästhetikum an das Gehirn ausgeglichen würde. Theoretisch kann der koronare Blutfluss unverändert bleiben, so dass eine erhöhte Anästhesiezufuhr eine myokardiale Depression erzeugt und ein verringerter zerebraler Blutfluss ein gleichzeitiges Einsetzen einer Depression des zentralen Nervensystems verhindert.
Anästhesie-Beatmungssystem
Zu den Merkmalen des Anästhesie-Beatmungssystems, die die Anstiegsrate des PA beeinflussen, gehören das Volumen des Systems, die Löslichkeit der inhalierten Anästhetika in den Gummi- oder Kunststoffkomponenten des Systems und der Gaszufluss aus dem Anästhesiegerät. Das Volumen des Anästhesie-Beatmungssystems wirkt als Puffer, um das Erreichen des PA zu verlangsamen. Ein hoher Gaszufluss aus dem Anästhesiegerät hebt diesen Puffereffekt auf. Die Löslichkeit inhalierter Anästhetika in den Komponenten des Anästhesie-Beatmungssystems verlangsamt zunächst die Rate, mit der der PA ansteigt. Am Ende einer Anästhesie führt die Umkehrung des Partialdruckgradienten im Anästhesie-Beatmungssystem zu einer Elution der Anästhetika, die die Rate verlangsamt, mit der der PA abnimmt.
Löslichkeit
Die Löslichkeit inhalierter Anästhetika in Blut und Gewebe wird durch Verteilungskoeffizienten angegeben. Ein Verteilungskoeffizient ist ein Verteilungsverhältnis, das beschreibt, wie sich das eingeatmete Anästhetikum im Gleichgewicht (bei gleichen Partialdrücken) zwischen zwei Phasen verteilt. Beispielsweise bedeutet ein Blut-Gas-Verteilungskoeffizient von 10, dass die Konzentration des eingeatmeten Anästhetikums im Blut 10 und im Alveolargas 1 beträgt, wenn die Partialdrücke dieses Anästhetikums in diesen beiden Phasen identisch sind. Verteilungskoeffizienten sind temperaturabhängig. Beispielsweise wird die Löslichkeit eines Gases in einer Flüssigkeit erhöht, wenn die Temperatur der Flüssigkeit sinkt. Wenn nicht anders angegeben, sind die Verteilungskoeffizienten für 37 °C angegeben.
Blut-Gas-Verteilungskoeffizient
Hohe Blutlöslichkeit bedeutet, dass eine große Menge an inhaliertem Anästhetikum im Blut gelöst (dh aufgenommen) werden muss, bevor das Gleichgewicht mit der Gasphase erreicht ist. Das Blut kann als pharmakologisch inaktives Reservoir angesehen werden, dessen Größe durch die Löslichkeit des Anästhetikums im Blut bestimmt wird. Bei einem hohen Blut-Gas-Verteilungskoeffizienten muss eine große Menge Anästhetikum im Blut gelöst werden, bevor sich das Pa mit dem PA äquilibriert (Abb. 5) (18). Klinisch kann der Einfluss einer hohen Blutlöslichkeit auf die Anstiegsrate des PA bis zu einem gewissen Grad durch eine Erhöhung des PI kompensiert werden. Wenn die Blutlöslichkeit gering ist, müssen minimale Mengen des Anästhetikums im Blut gelöst werden, bevor ein Gleichgewicht erreicht wird, so dass die Anstiegsrate von PA und die von Pa und Pbr schnell sind (siehe Abb. 5) (20).

- Abb. 5. Der Blut-Gas-Verteilungskoeffizient ist die Hauptdeterminante der Rate, mit der die alveoläre Konzentration (Fa) zu einer konstanten eingeatmeten Konzentration (Fi) ansteigt. Die Geschwindigkeit der Anästhesieeinleitung ist parallel zur Anstiegsgeschwindigkeit des Fa. Trotz ähnlicher Blutlöslichkeit (siehe Tabelle 1) ist die Anstiegsrate von Fa für Lachgas (gestrichelte bräunlich-goldene Linie) schneller als für Desfluran (gestrichelte violette Linie) oder Sevofluran (durchgezogene blaue Linie), was die Auswirkungen von widerspiegelt Konzentrationseffekt auf Lachgas (siehe Abb. 4). Eine größere Gewebelöslichkeit von Desfluran und Sevofluran kann auch zu einem langsameren Anstieg des Fa dieser Arzneimittel im Vergleich zu Lachgas beitragen. SD, Standardabweichung. (Aus Yasuda N, Lockhart SH, Eger EI II, et al. Comparison of kinetics of sevoflurane and isflurane in humans. Anesth Analg. 1991;72:316-324, mit Genehmigung verwendet.)
Gewebe-Blut-Verteilungskoeffizienten
Gewebe-Blut-Verteilungskoeffizienten bestimmen die Zeit, die für die Äquilibrierung des Gewebes mit dem Pa erforderlich ist (siehe Tabelle 1). Diese Zeit kann vorhergesagt werden, indem eine Zeitkonstante (dh Menge an inhaliertem Anästhetikum, die in dem Gewebe gelöst werden kann, dividiert durch Gewebedurchblutung) für jedes Gewebe berechnet wird. Gehirn-Blut-Verteilungskoeffizienten für ein flüchtiges Anästhetikum wie Isofluran ergeben Zeitkonstanten von etwa 3 bis 4 Minuten. Eine vollständige Äquilibrierung jedes Gewebes, einschließlich des Gehirns, mit dem Pa erfordert mindestens drei Zeitkonstanten. Dies ist der Grund dafür, den PA dieses flüchtigen Anästhetikums 10 bis 15 Minuten lang konstant zu halten, bevor angenommen wird, dass der Pbr ähnlich ist. Zeitkonstanten für weniger lösliche Anästhetika wie Distickstoffmonoxid, Desfluran und Sevofluran betragen etwa 2 Minuten, und eine vollständige Äquilibrierung wird in etwa 6 Minuten erreicht (dh drei Zeitkonstanten).
Anästhetikumtransfer durch Intergewebediffusion
Es gibt zunehmend Hinweise darauf, dass ein Teil der Anästhetikumaufnahme nicht durch Blutfluss zu verschiedenen Geweben erfolgt, sondern durch direkten Transfer von Geweben mit geringerer zu höherer Affinität für das Anästhetikum (dh von magerem zu fettigem Gewebe), wie z. B. der Grenzfläche zwischen Eingeweiden und omentales Fett (siehe „Kontextsensitive Halbzeit“). Größere Menschen (21) und Tiere (22) mit vermutlich größerer Mager-Fett-Oberflächengrenzfläche zeigen eine größere Aufnahme von Sevofluran und Isofluran. Es ist unwahrscheinlich, dass die Übertragung auf Massenfett durch Blutfluss während einer Anästhesie von klinisch realistischer Dauer (weniger als 12 bis 24 Stunden) diese Unterschiede erklärt, angesichts des relativ geringen Blutflusses, den das Massenfettkompartiment erhält, und seiner relativ großen Größe.
Lachgas- und Methionin-Synthase-Inaktivierung
Lachgas ist einzigartig unter den Anästhetika, da es die Methionin-Synthase, das Enzym, das den Vitamin-B12- und Folatstoffwechsel reguliert, inaktiviert. Obwohl die Auswirkungen der Enzyminaktivierung bei vielen Patienten subtil oder subklinisch sein können, können Patienten mit einer zugrunde liegenden kritischen Erkrankung oder einem bereits bestehenden Vitamin-B12-Mangel neurologische oder hämatologische Folgeerscheinungen erleiden. Homocystein, das für die Umwandlung in Methionin eine funktionelle Methioninsynthase benötigt, ist mit einem erhöhten Risiko für unerwünschte koronare Ereignisse verbunden, wenn es in erhöhten Konzentrationen im Blut vorhanden ist (23). Patienten, die Lachgas während der Karotis-Endarteriektomie erhielten, zeigten signifikant erhöhte Homocysteinspiegel und eine signifikant erhöhte Häufigkeit myokardialer ischämischer Episoden im Vergleich zu Patienten, die kein Lachgas erhielten (24).
Lachgastransfer in geschlossene Gasräume
Der Blut-Gas-Verteilungskoeffizient von Lachgas (0.46) ist 34-mal größer als der von Stickstoff (0.014). Diese unterschiedliche Löslichkeit bedeutet, dass Lachgas das Blut verlassen kann, um in einen luftgefüllten Hohlraum 34-mal schneller zu gelangen, als Stickstoff den Hohlraum verlassen kann, um in das Blut einzudringen. Als Ergebnis dieser bevorzugten Übertragung von Distickstoffmonoxid nimmt das Volumen oder der Druck des luftgefüllten Hohlraums zu. Der Eintritt von Lachgas in einen luftgefüllten Hohlraum, der von einer nachgiebigen Wand umgeben ist (z. B. Darmgas, Pneumothorax, Lungenbläschen, Luftembolie), führt zu einer Ausdehnung des Gasraums. Umgekehrt verursacht der Eintritt von Lachgas in einen luftgefüllten Hohlraum, der von einer nicht nachgiebigen Wand umgeben ist (z. B. Mittelohr, Hirnventrikel, supratentorieller Subduralraum), einen Druckanstieg.
Die Größenordnung des Volumen- oder Druckanstiegs im luftgefüllten Hohlraum wird durch die PA von Lachgas, den Blutfluss zum luftgefüllten Hohlraum und die Dauer der Lachgasverabreichung beeinflusst. In einem Tiermodell verdoppelt die Inhalation von 75 % Lachgas das Volumen eines Pneumothorax in 10 Minuten (25). Das Vorhandensein eines geschlossenen Pneumothorax ist eine Kontraindikation für die Verabreichung von Lachgas. Eine abnehmende pulmonale Compliance während der Verabreichung von Lachgas an einen Patienten mit Brusttrauma in der Vorgeschichte (z. B. Rippenfrakturen) kann eine durch Lachgas verursachte Ausdehnung eines zuvor nicht erkannten Pneumothorax widerspiegeln. Ebenso dehnen sich Luftblasen im Zusammenhang mit einer venösen Luftembolie schnell aus, wenn sie Lachgas ausgesetzt werden. Im Gegensatz zur schnellen Ausdehnung eines Pneumothorax oder von Luftblasen (d. h. einer venösen Luftembolie) ist die Zunahme des durch Lachgas erzeugten Darmgasvolumens langsam. Die Frage, ob bei intraabdominell operierten Patienten Lachgas verabreicht werden soll, ist bei kurzen Eingriffen von geringer Bedeutung. Die Begrenzung der eingeatmeten Lachgaskonzentration auf 50 % kann jedoch eine vorsichtige Empfehlung sein, wenn das Darmgasvolumen präoperativ erhöht ist (z. B. Darmverschluss). Nach dieser Richtlinie würde sich das Darmgasvolumen auch bei längeren Operationen höchstens verdoppeln (25).
Herzzeitvolumen
Das CO beeinflusst die Aufnahme in das pulmonalarterielle Blut und damit PA, indem es mehr oder weniger Anästhetikum aus den Alveolen abtransportiert. Ein hoher CO (z. B. induziert durch Angst) führt zu einer schnelleren Aufnahme, so dass die Anstiegsrate des PA und die Einleitung der Anästhesie verlangsamt werden. Ein niedriges CO (z. B. Schock) beschleunigt die Anstiegsrate des PA, da weniger Aufnahme in das Blut erfolgt, um der Zufuhr entgegenzuwirken. Ein allgemeiner klinischer Eindruck ist, dass die Narkoseeinleitung bei Schockpatienten schnell erfolgt.
Shunt
Ein intrakardialer oder intrapulmonaler Rechts-Links-Shunt verlangsamt die Geschwindigkeit der Narkoseeinleitung. Diese Verlangsamung spiegelt die Verdünnungswirkung von geshuntetem Blut wider, das kein Anästhetikum enthält, auf den Partialdruck des Anästhetikums im Blut, das aus belüfteten Alveolen kommt. Ein ähnlicher Mechanismus ist für die Abnahme des PaO2 bei Vorliegen eines Rechts-Links-Shunts verantwortlich.
Ein Links-Rechts-Shunt (z. B. arteriovenöse Fistel, flüchtige Anästhesie-induzierte Erhöhungen des Hautblutflusses) führt zur Abgabe von venösem Blut an die Lunge, das einen höheren Partialdruck des Anästhetikums enthält als in venösem Blut, das durch die venöse Blutpassage gelangt ist Gewebe. Infolgedessen gleicht ein Links-Rechts-Gewebe-Shunt den Verdünnungseffekt eines Rechts-Links-Shunts auf den Pa aus. Der Effekt eines Links-Rechts-Shunts auf die Anstiegsrate des Pa ist nur nachweisbar, wenn gleichzeitig besteht ein Rechts-Links-Shunt. Ebenso ist der Verdünnungseffekt eines Rechts-Links-Shunts am größten, wenn kein Links-Rechts-Shunt vorhanden ist. Unter Berücksichtigung aller Faktoren erscheint es unwahrscheinlich, dass die Auswirkungen eines Rechts-Links-Shunts klinisch erkennbar sind.
Verschwendete Belüftung
Die Ventilation nicht perfundierter Alveolen beeinflusst die Geschwindigkeit der Narkoseeinleitung nicht, da keine Verdünnungswirkung auf den Pa entsteht. Der Haupteffekt der verschwendeten Ventilation ist die Erzeugung einer Differenz zwischen dem PA und dem Pa des eingeatmeten Anästhetikums. Ein ähnlicher Mechanismus ist für den oft beobachteten Unterschied zwischen endtidalem PCO2 und PaCO2 verantwortlich.
Alveolar-zu-venöse Partialdruckunterschiede
PA – Pv spiegelt die Gewebeaufnahme von inhalierten Anästhetika wider. Stark durchblutete Gewebe (dh Gehirn, Herz, Nieren und Leber) machen weniger als 10 % der Körpermasse aus, erhalten jedoch etwa 75 % des CO. Als Ergebnis äquilibrieren diese stark durchbluteten Gewebe schnell mit dem Pa. Nach drei Mal Konstanten (6 bis 12 Minuten bei Inhalationsanästhetika) haben etwa 75 % des zurückfließenden venösen Bluts den gleichen Partialdruck wie der PA (dh enger PA – Pv). Aus diesem Grund ist die Aufnahme volatiler Anästhetika aus den Alveolen nach 6 bis 12 Minuten stark verringert, was sich in einer Verringerung der PI-PA-Differenz widerspiegelt. Nach dieser Zeit sollten die inhalierten Konzentrationen volatiler Anästhetika verringert werden, um bei verminderter Aufnahme einen konstanten PA aufrechtzuerhalten.
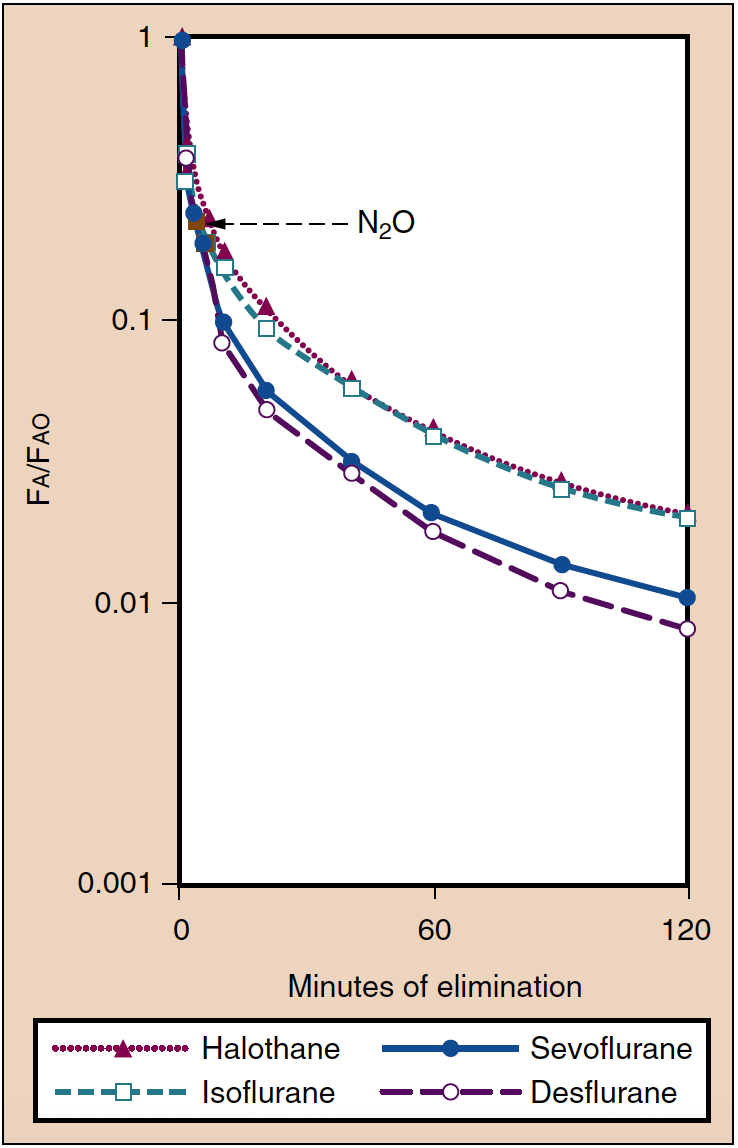
Erholung von der Anästhesie
Die Erholung von der Anästhesie kann als die Rate definiert werden, mit der der PA mit der Zeit abnimmt (Abb. 6) (20). In vielerlei Hinsicht ist die Genesung das Gegenteil der Narkoseeinleitung. Beispielsweise bestimmen ˙VA, Löslichkeit und CO die Geschwindigkeit, mit der der PA abnimmt. Nach Absetzen der Narkosemittelgabe erfolgt die Elimination des Narkosemittels durch Beatmung der Lunge. Wenn der alveoläre Partialdruck abnimmt, wird anschließend Anästhetikum aus den Geweben (einschließlich des Gehirns) in die Alveolen übertragen. Eine Hypoventilation oder die Verwendung von Frischgasflüssen, die niedrig genug sind, um eine Rückatmung des Anästhetikums zu ermöglichen, führt zu einem Transfer des Anästhetikums zurück in das Gewebe (einschließlich des Gehirns) und verzögert die Genesung des Patienten.

- Abb. 6. Die Ausscheidung inhalierter Anästhetika spiegelt sich in der Abnahme der alveolären Konzentration (Fa) im Vergleich zu der am Ende der Anästhesie vorhandenen Konzentration (Fao) wider. Das Erwachen aus der Anästhesie verläuft parallel zu diesen Kurven. (Aus Yasuda N, Lockhart SH, Eger EI II, et al. Comparison of kinetics of sevoflurane and isflurane in humans. Anesth Analg. 1991;72:316-324, mit Genehmigung verwendet.)
Wie unterscheidet sich die Genesung von der Narkoseeinleitung?
Die Erholung aus der Anästhesie unterscheidet sich von der Einleitung der Anästhesie in Bezug auf das Fehlen eines Konzentrationseffekts auf die Erholung (der PI kann nicht kleiner als Null sein), die variablen Gewebekonzentrationen von Anästhetika zu Beginn der Erholung und die potenzielle Bedeutung des Stoffwechsels für die Rate Abnahme der PA.
Gewebekonzentrationen
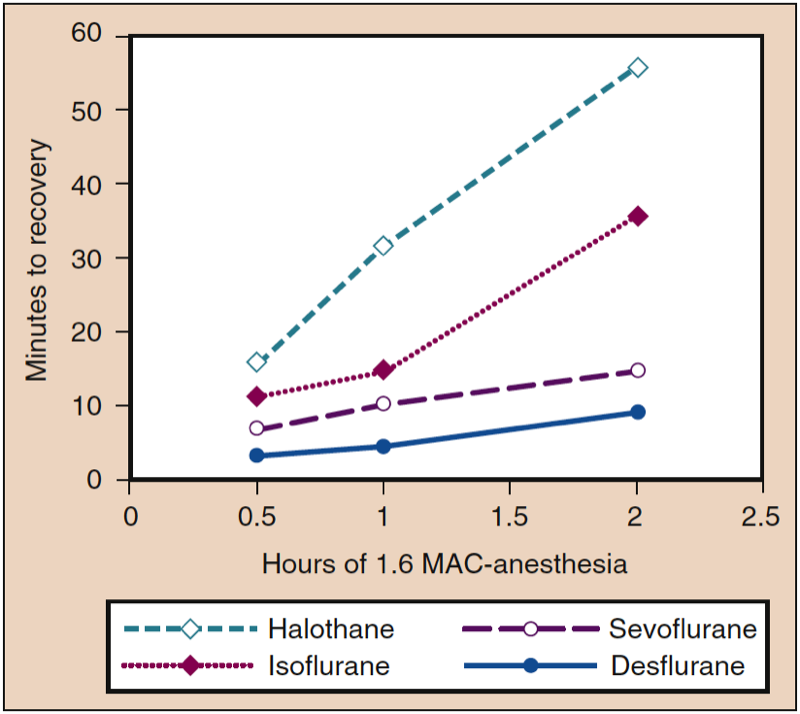
Gewebekonzentrationen von inhalierten Anästhetika dienen als Reservoir, um den PA aufrechtzuerhalten, wenn der Partialdruckgradient umgekehrt wird, indem der PI am Ende der Anästhesie auf oder nahe Null gesenkt wird. Die Wirkung der Gewebelagerung hängt von der Anästhesiedauer und der Löslichkeit der Anästhetika in verschiedenen Gewebekompartimenten ab. Beispielsweise verlängert sich die Zeit bis zur Genesung bei einem löslichen Anästhetikum (z. B. Isofluran) proportional zur Dauer der Anästhesie, während die Auswirkung der Verabreichungsdauer auf die Zeit bis zur Genesung bei schwer löslichen Anästhetika (z. B. Sevofluran, Desfluran) minimal ist ( Abb. 7) (1). Die variablen Konzentrationen von Anästhetika in verschiedenen Geweben am Ende der Anästhesie stehen im Gegensatz zur Einleitung der Anästhesie, wenn alle Gewebe anfänglich die gleiche Anästhesiekonzentration von Null aufweisen.

- Abb. 7. Eine Verlängerung der Anästhesiedauer bei konstanter Anästhesiedosis (1.6 MAC) ist mit einer Verlängerung der Zeit bis zur Genesung verbunden (d. h. der motorischen Koordination in einem Tiermodell), wobei die größten Verlängerungen mit dem meisten Blut auftreten -lösliche Anästhetika. MAC, minimale alveoläre Konzentration. (Aus Eger EI II. Desflurane (Suprane): A Compendium and Reference. Nutley, NJ: Anaquest; 1993:1-11, Verwendung mit Genehmigung.)
Stoffwechsel
Ein wichtiger Unterschied zwischen der Einleitung einer Anästhesie und der Erholung von der Anästhesie ist der mögliche Einfluss des Stoffwechsels auf die Abnahmerate des PA am Ende der Anästhesie. In dieser Hinsicht ist der Metabolismus eine Hauptdeterminante der Abnahmerate des PA des hoch fettlöslichen Methoxyflurans. Metabolismus und ˙VA sind gleichermaßen wichtig für die Abnahmerate des PA von Halothan, während die Abnahmerate des PA von weniger fettlöslichem Isofluran, Desfluran und Sevofluran hauptsächlich aus ˙VA resultiert (26).
Kontextsensitive Halbzeit
Die Pharmakokinetik der Elimination inhalativer Anästhetika hängt von der Verabreichungsdauer (dem „Kontext“) und der Löslichkeit des inhalierten Anästhetikums in Blut und Gewebe ab. Wie bei intravenösen Anästhetika ist es möglich, Computersimulationen zu verwenden, um kontextabhängige Dekrementzeiten für volatile Anästhetika zu bestimmen (die Zeit, die erforderlich ist, um die Anästhesiekonzentrationen im zentralen Nervensystem auf einen Bruchteil der von einem interessierenden Ausgangspunkt gegebenen zu verringern). Die kinetische Modellierung basiert auf dem Vorhandensein jedes Gewebekompartiments innerhalb des Körpers (dh Blut, gefäßreiche Gruppe, Muskel, Fett), der relativen Größe jedes Kompartiments, dem proportionalen Blutfluss, der von jedem Kompartiment empfangen wird, und der Löslichkeit von jedem spezifisches Anästhetikum in dem Gewebe, aus dem das Kompartiment besteht. Während der Verabreichung des Anästhetikums impliziert die Äquilibrierung eine fortgesetzte Aufnahme des Anästhetikums, bis die Gewebekonzentration fast so groß wie die alveoläre Konzentration wird. Der Ausgleich der Anästhetikumkonzentration zwischen den Alveolen und einem kleinen (weniger als 10 % Körpermasse) Kompartiment mit hohem Blutfluss (dh Herz, Nieren, Gehirn) erfolgt innerhalb einer relativ kurzen Zeitspanne (10 bis 15 Minuten). Umgekehrt erfolgt die Anästhetikum-Äquilibrierung in größeren Kompartimenten mit geringerem proportionalem Blutfluss (dh Skelettmuskel und Massenfett) über einen längeren Zeitraum (Stunden), wenn die Anästhetikum-Aufnahme fortgesetzt wird. Die Zeit, die für eine 50-prozentige Abnahme der Narkosemittelkonzentrationen von Isofluran, Desfluran und Sevofluran benötigt wird, beträgt weniger als 5 Minuten und nimmt mit zunehmender Narkosedauer nicht signifikant zu (27). Vermutlich spiegelt dies die Anfangsphase der Elimination wider, die hauptsächlich eine Funktion von ˙VA ist. Die Bestimmung anderer Dekrementzeiten (≥80 %) zeigt größere Unterschiede zwischen verschiedenen Inhalationsanästhetika, insbesondere wenn die Anästhesiedauer länger wird (Abb. 8). Die Simulation kann die Aufnahme des Anästhetikums unterschätzen, insbesondere bei löslicheren Anästhetika, da es nicht berücksichtigt, dass das Anästhetikum durch Diffusion zwischen den Geweben von mageren zu Fettgeweben übertragen wird.

- Abb. 8. Die Auswirkungen steigender Konzentrationen (MAC) von Halothan, Isofluran, Desfluran und Sevofluran auf den mittleren arteriellen Druck (mm Hg) bei Verabreichung an gesunde Probanden. MAC, minimale alveoläre Konzentration. (Aus Cahalan MK. Hemodynamic Effects of Inhaled Anesthetics. Review Courses. Cleveland: International AnAesthetic Research Society; 1996:14-18, Verwendung mit Genehmigung.)
Bis auf geringe Mengen an Anästhetika (weniger als nötig, damit Patienten Anweisungen befolgen können) muss alles eliminiert werden, bevor ein Patient wieder koordinierte Schutzfunktionen wie die Fähigkeit, effektiv zu schlucken und zu atmen, wiedererlangt. Chirurgische Patienten, die eine längere Anästhesie und ein besser lösliches Anästhetikum (Sevofluran im Vergleich zu Desfluran) erhielten, benötigten ein längeres Zeitintervall zwischen dem Aufwachen und der Wiedererlangung der Fähigkeit, effektiv zu schlucken (22). Wache Probanden, denen geringe Konzentrationen von Sevofluran und Isofluran verabreicht wurden, zeigten Rachendiskoordination (28) und verminderten chemischen Atemantrieb (29).
Diffusionshypoxie
Diffusionshypoxie kann am Ende der Lachgasverabreichung auftreten, wenn Patienten Raumluft einatmen dürfen. Die anfängliche großvolumige Ausschüttung von Lachgas aus dem Blut in die Lungenbläschen bei Beendigung der Inhalation dieses Gases kann das PAO2 so stark verdünnen, dass das PaO2 sinkt. Das Auftreten einer Diffusionshypoxie wird verhindert, indem die Lungen des Patienten am Ende der Lachgasverabreichung mit Sauerstoff gefüllt werden.
Durchführbarkeit der Verwendung von Inhalationsanästhetika zur Sedierung auf der Intensivstation
AnaConDa (Anaesthetic Conserving Device, Sedana Medical AB, Uppsala, Schweden) ist ein Instrument, das die Verabreichung von inhalativen Anästhetika (Isofluran, Sevofluran) auf der Intensivstation (ICU) erleichtert. Flüssiges Anästhetikum wird über eine Spritzenpumpe in eine Kammer geleitet, die zwischen dem Endotrachealtubus und dem Y-Stück mit dem Beatmungskreislauf verbunden ist. Die Spritze gibt flüssiges Anästhetikum sehr langsam an einen porösen Kunststoffstab in der Kammer ab, wo die Flüssigkeit verdampft und sich mit frischem Gas vermischt, das aus dem Inspirationszweig des Kreislaufs fließt. Das ausgeatmete Gas wird durch einen Aktivkohlefilter geleitet, der etwa 90 % des ausgeatmeten Anästhetikums absorbiert und zurückgewinnt. Der nachfolgende Inspirationsfluss wird durch den Aktivkohlefilter geleitet, wo sich das absorbierte Anästhetikum wieder mit dem Frischgas vermischt.
Es besteht ein wachsendes Interesse an der Verwendung von potenten inhalativen Anästhetika außerhalb des Operationssaals bei postoperativen Patienten auf der Intensivstation, und es häufen sich zunehmend Beweise dafür, dass dies machbar und möglicherweise vorteilhaft ist (30,31). Zu den Herausforderungen bei der Verwendung von Inhalationsanästhetika auf der Intensivstation gehören jedoch ein erhöhter Totraum und Atemarbeit aufgrund der Zwischenschaltung des Anästhetikum-Verabreichungsgeräts zwischen Trachealtubus und Kreislauf; Verlust des Anästhetikums an die Umgebung während des häufigen Absaugens des Trachealtubus; und fragwürdige Verfügbarkeit von geeigneter Ausrüstung und Pflegekräften mit ausreichendem Wissen und technischer Erfahrung bei der Verabreichung von Inhalationsanästhetika.
9. AUSWIRKUNGEN AUF ORGANSYSTEME
Auswirkungen auf den Kreislauf
Äquipotente Konzentrationen inhalierter Anästhetika haben ähnliche Wirkungen auf den Kreislauf, insbesondere während der Aufrechterhaltung der Anästhesie bei freiwilligen Probanden. Patienten, die sich einer Operation unterziehen, können jedoch anders reagieren als gesunde Probanden. Zum Beispiel können Faktoren wie eine gleichzeitig bestehende Krankheit, extremes Alter, nicht optimaler intravaskulärer Volumenstatus, das Vorhandensein einer chirurgischen Stimulation und gleichzeitige Medikamente die Reaktionen verändern, abschwächen oder übertreiben, die auf der Grundlage von Daten von gesunden Freiwilligen erwartet werden.
Reaktionen während der Aufrechterhaltung der Anästhesie
Mittlerer arterieller Druck
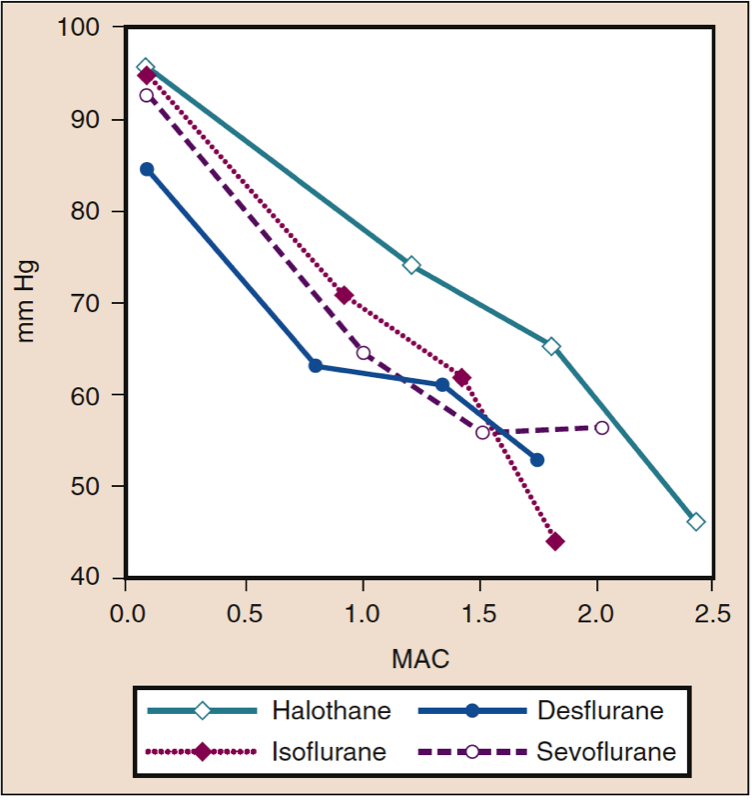
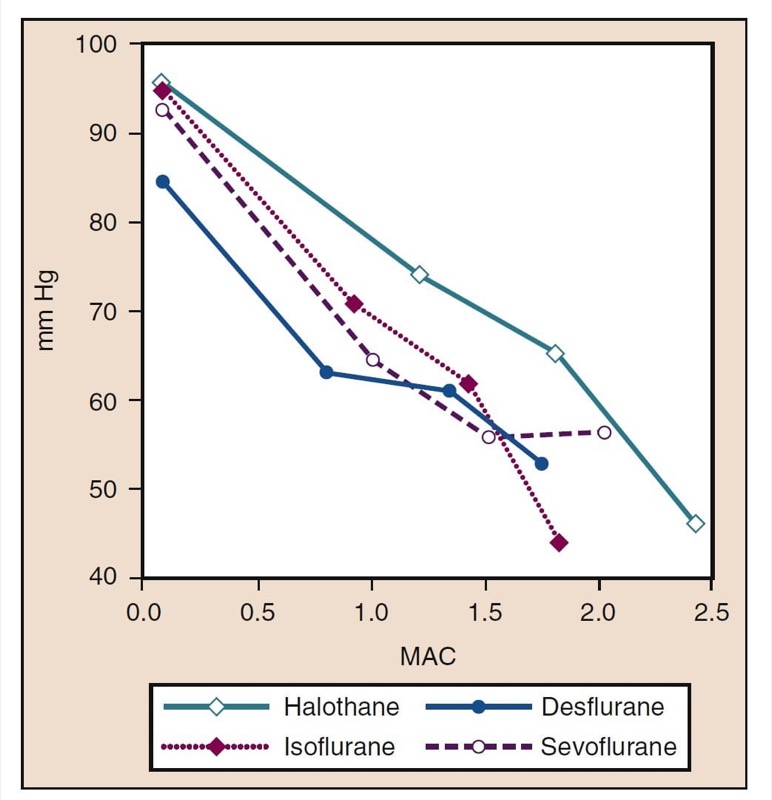
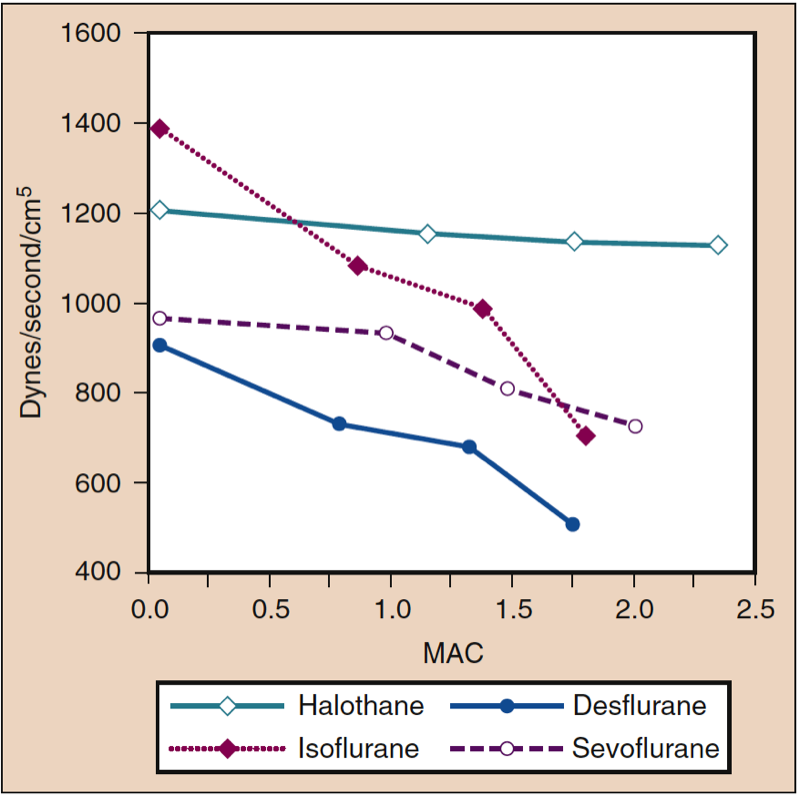
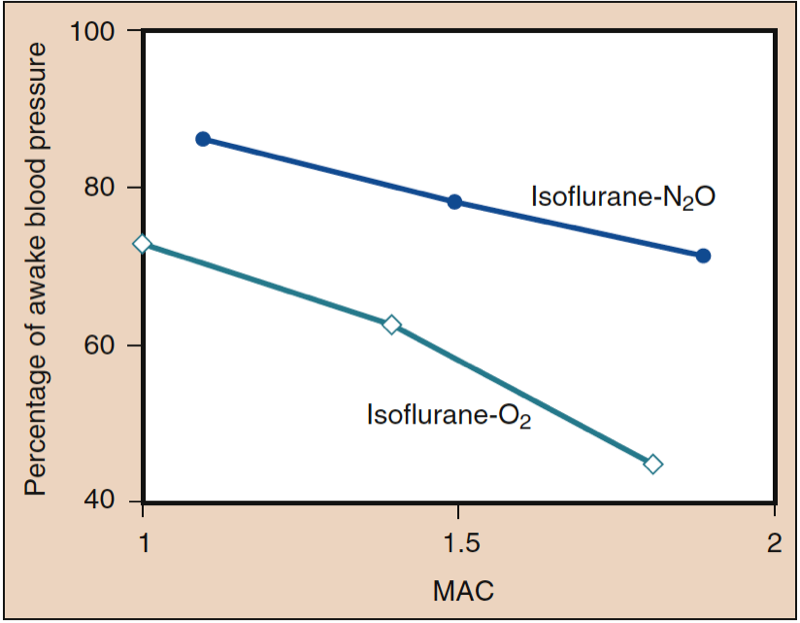
Der mittlere arterielle Druck (MAP) nimmt dosisabhängig mit steigenden Konzentrationen von Desfluran, Sevofluran, Isofluran, Halothan und Enfluran ab (siehe Abb. 8) (17,18). Mit Ausnahme von Halothan spiegelt die Abnahme des MAP in erster Linie eine Abnahme des systemischen Gefäßwiderstands (SVR) gegenüber einer Abnahme des CO wider (Abb. 9 und 10) (32,33, 11). Im Gegensatz dazu verringert Halothan den MAP teilweise oder vollständig durch Verringerung von CO, während SVR relativ unverändert bleibt. Diese Ergebnisse werden durch SVR-Messungen bei Patienten gestützt, die Desfluran, Sevofluran und Isofluran erhalten, während sie sich einer kardiopulmonalen Bypass-Perfusion unterziehen. Die dosisabhängige Abnahme des SVR wird minimiert, indem ein Teil des flüchtigen Arzneimittels durch Lachgas ersetzt wird (Abb. 34) (XNUMX). Lachgas verursacht im Gegensatz zu den anderen inhalativen Anästhetika einen unveränderten oder leicht erhöhten MAP.

- Abb. 8 Die Auswirkungen steigender Konzentrationen (MAC) von Halothan, Isofluran, Desfluran und Sevofluran auf den mittleren arteriellen Druck (mm Hg) bei Verabreichung an gesunde Probanden. MAC, minimale alveoläre Konzentration. (Aus Cahalan MK. Hemodynamic Effects of Inhaled Anesthetics. Review Courses. Cleveland: International AnAesthetic Research Society; 1996:14-18, Verwendung mit Genehmigung.)

- Abb. 9. Die Auswirkungen steigender Konzentrationen (MAC) von Halothan, Isofluran, Desfluran und Sevofluran auf den systemischen Gefäßwiderstand (dynes/sec/cm5) bei Verabreichung an gesunde Probanden. MAC, minimale alveoläre Konzentration. (Aus Cahalan MK. Hemodynamic Effects of Inhaled Anesthetics. Review Courses. Cleveland: International AnAesthetic Research Society; 1996:14-18, Verwendung mit Genehmigung.)

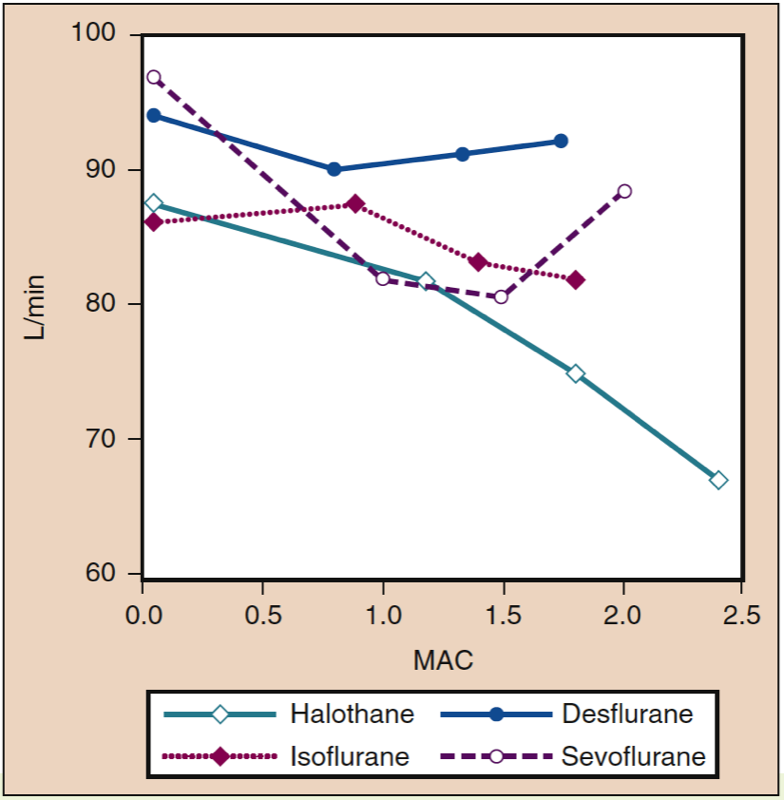
- Abb. 10. Die Auswirkungen steigender Konzentrationen (MAC) von Halothan, Isofluran, Desfluran und Sevofluran auf den Herzindex (l/min) bei Verabreichung an gesunde Freiwillige. MAC, minimale alveoläre Konzentration. (Aus Cahalan MK. Hemodynamic Effects of Inhaled Anesthetics. Review Courses. Cleveland: International AnAesthetic Research Society; 1996:14-18, Verwendung mit Genehmigung.)

- Abb. 11. Der Ersatz einer Portion Isofluran durch Distickstoffmonoxid führt zu einer geringeren Abnahme des systemischen Blutdrucks als die gleiche Dosis eines flüchtigen Anästhetikums allein. MAC, minimale alveoläre Konzentration. (Aus Eger EI II. Isoflurane (Forane): A Compendium and Reference. Madison, WI: Ohio Medical Products; 1985:1-110, Verwendung mit Genehmigung.)
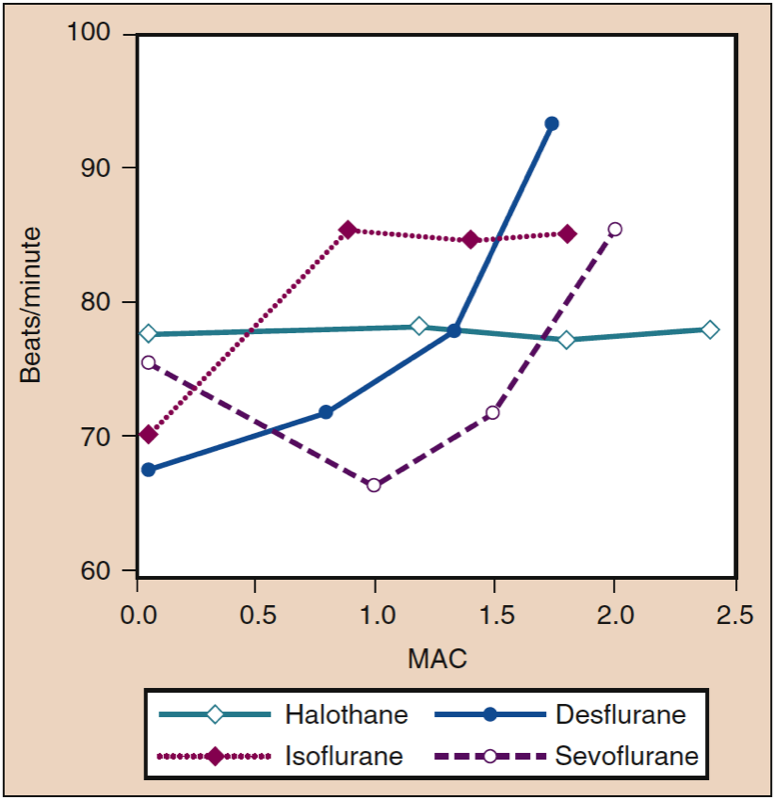
Heart Rate
Stufenweise Erhöhungen der zugeführten Konzentrationen von Isofluran, Desfluran und Sevofluran erhöhen die Herzfrequenz bei Patienten und Probanden, wenn auch bei unterschiedlichen Konzentrationen (Abb. 12) (33). Bei Konzentrationen von nur 0.25 MAC verursacht Isofluran einen linearen, dosisabhängigen Anstieg der Herzfrequenz. Bei Desfluran-Konzentrationen von weniger als 1 MAC steigt die Herzfrequenz minimal an. Wenn die Desfluran-Konzentration über 1 MAC erhöht wird, beschleunigt sich die Herzfrequenz auf lineare, dosisabhängige Weise. Im Gegensatz zu Desfluran und Isofluran steigt die Herzfrequenz in Gegenwart von Sevofluran erst ab einer Konzentration von 1.5 MAC (35). Die Induktion mit 8 % Sevofluran (dh Induktion mit einem Atemzug) verursacht jedoch sowohl bei Kindern als auch bei erwachsenen Patienten, die sich einer kontrollierten Hyperventilation unterziehen, eine Tachykardie. Diese Tachykardie kann aus einer Stimulation des sympathischen Nervensystems in Verbindung mit epileptiformer Gehirnaktivität resultieren (36).

- Abb. 12. Die Auswirkungen steigender Konzentrationen (MAC) von Halothan, Isofluran, Desfluran und Sevofluran auf die Herzfrequenz (Schläge/min) bei Verabreichung an gesunde Freiwillige. MAC, minimale alveoläre Konzentration. (Aus Cahalan MK. Hemodynamic Effects of Inhaled Anesthetics. Review Courses. Cleveland: International AnAesthetic Research Society; 1996:14-18, Verwendung mit Genehmigung.)
Die Tendenz von Desfluran, den Kreislauf zu stimulieren (dh den MAP und die Herzfrequenz zu erhöhen), wird durch die Verabreichung von β-adrenergen Blockern (Esmolol), Opioiden (Fentanyl) und im Laufe der Zeit (10 bis 15 Minuten) während der Aufrechterhaltung der Anästhesie abgeschwächt ( siehe auch „Kreislaufeffekte bei schneller Konzentrationssteigerung“). Der dosisabhängige Anstieg der Herzfrequenz, der bei Desfluran-Konzentrationen von mehr als 1 MAC beobachtet wird, wird durch die Substitution eines Teils des Desflurans durch Lachgas nicht abgeschwächt. Isofluran, Sevofluran und Desfluran vermindern wie Halothan die Barorezeptorreaktionen auf konzentrationsabhängige Weise. Der vorübergehende Anstieg der Herzfrequenz über 1 MAC, der mit Desfluran beobachtet wird, resultiert eher aus einer Stimulation des sympathischen Nervensystems als aus einer Reflex-Barorezeptor-Aktivitätsreaktion auf einen verringerten MAP (37).
Herzindex
Der Herzindex wird durch die Gabe von Desfluran, Sevofluran oder Isofluran über einen weiten Konzentrationsbereich bei gesunden jungen Erwachsenen nur minimal beeinflusst (siehe Abb. 10) (32). Transösophageale Echokardiographie-Daten zeigen, dass Desfluran im Vergleich zu Messungen im Wachzustand geringfügige Erhöhungen der Ejektionsfraktion und der linksventrikulären Geschwindigkeit der Umfangsverkürzung bewirkt.
Kreislaufeffekte mit schneller Konzentrationssteigerung
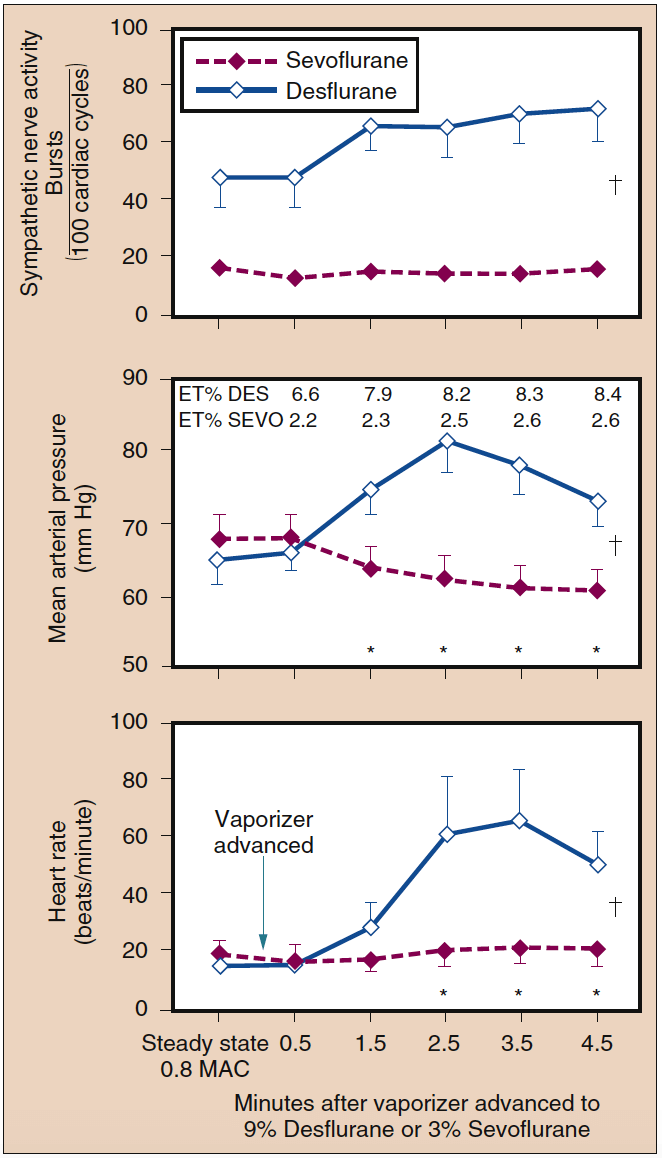
Bei Konzentrationen von weniger als 1 MAC erhöht Desfluran weder die Herzfrequenz noch den MAP. Jedoch verursachen abrupte Anstiege der eingeatmeten Desflurankonzentrationen über 1 MAC eine vorübergehende Kreislaufstimulation in Abwesenheit von Opioiden, adrenergen Blockern oder anderen analgetischen Zusatzstoffen (Abb. 13) (38). In geringerem Maße hat Isofluran eine ähnliche Fähigkeit, einen Anstieg der Herzfrequenz und des Blutdrucks hervorzurufen. Begleitend zur hämodynamischen Stimulation, die bei abrupt erhöhten Konzentrationen von Desfluran und Isofluran beobachtet wird, kommt es zu einem Anstieg der Adrenalin- und Noradrenalin-Plasmakonzentrationen und der Aktivität des sympathischen Nervensystems. Ein abrupter Anstieg der eingeatmeten Sevoflurankonzentration von 1 MAC auf 1.5 MAC ist mit einer leichten Abnahme der Herzfrequenz verbunden.

- Abb. 13. Ein rascher Anstieg der eingeatmeten Konzentration von Sevofluran von 0.8 MAC auf 3 % veränderte die sympathische Nervenaktivität, den mittleren arteriellen Druck oder die Herzfrequenz nicht. Umgekehrt führte ein rascher Anstieg der eingeatmeten Konzentration von Desfluran von 0.8 MAC auf 9 % zu einer signifikanten Erhöhung der sympathischen Nervenaktivität, des mittleren arteriellen Drucks und der Herzfrequenz (Mittelwert ± SE; *p < 0.05). ET, Endtidal; MAC, minimale alveoläre Konzentration. (Aus Ebert TJ, Muzi M, Lopatka CW. Neurocirculatory responses to sevoflurane in humans: a Comparison to Desflurane. Anesthesiology. 1995;83:88-95, mit Genehmigung verwendet.)
Eine schrittweise Erhöhung der endtidalen Desflurankonzentration von 4 % auf 8 % innerhalb von 1 Minute kann zu einer Verdoppelung der Herzfrequenz und des Blutdrucks gegenüber dem Ausgangswert führen. Die Verabreichung kleiner Dosen von Opioiden, Clonidin oder Esmolol dämpft die Herzfrequenz- und Blutdruckreaktionen auf die schrittweise Erhöhung der Desfluran-Konzentration erheblich. Die Wiederholung des schnellen Anstiegs der endtidalen Desflurankonzentration von 4 % auf 8 % nach 30 Minuten führt zu minimalen Änderungen der Herzfrequenz und des MAP, was darauf hindeutet, dass sich die Rezeptoren, die diese Kreislaufänderungen vermitteln, an die wiederholte Stimulation anpassen. Bei abrupten Konzentrationsanstiegen von Sevofluran, Halothan oder Enfluran bis zu 2 MAC ist keine Kreislaufstimulation zu beobachten (siehe Abb. 13) (38).
Sevofluran und Halothan werden aufgrund ihrer mangelnden Schärfe häufig per Inhalation verabreicht, um eine Anästhesie einzuleiten. Die Narkoseeinleitung bei Kindern mit Halothan, aber nicht mit Sevofluran, unterdrückt die myokardiale Kontraktilität. Bei Erwachsenen verringert die Aufrechterhaltung der Anästhesie mit 1 MAC Sevofluran oder Halothan mit 67 % Distickstoffmonoxid die myokardiale Kontraktilität. Bei Erwachsenen kann Sevofluran bei kontrollierter Beatmung die Herzfrequenz vorübergehend erhöhen.
Verabreichung mit Lachgas und Sauerstoff versus 100 % Sauerstoff
Desfluran, Isofluran und Sevofluran, verabreicht mit Distickstoffmonoxid und Sauerstoff, senken dosisabhängig MAP, SVR, Herzindex und linksventrikulären Schlaganfallindex (LVSWI), wohingegen Herzfrequenz, Pulmonalarteriendruck und Zentralvenen Druckanstieg, im Einklang mit den Befunden, bei denen jedes flüchtige Anästhetikum nur in Sauerstoff verabreicht wird (siehe Abb. 11) (32,33, 34). Der direkte Vergleich zeigt eine ausgeprägtere Verringerung von MAP, SVR, Herzindex und LVSWI sowie eine schnellere Herzfrequenz und einen größeren CO, wenn Desfluran in Sauerstoff anstatt in Lachgas bei etwa äquivalenten MAC-Vielfachen verabreicht wird (XNUMX).
Myokardleitung und Dysrhythmogenität
Isofluran, Sevofluran und Desfluran prädisponieren das Herz nicht für vorzeitige ventrikuläre Extrasystolen (39). Im Gegensatz dazu sensibilisiert Halothan das Myokard für vorzeitige ventrikuläre Extrasystolen, insbesondere in Gegenwart von Katecholaminen; diese Beziehung wird mit Hypercarbia übertrieben. Inhalative Anästhetika unterdrücken wahrscheinlich ventrikuläre Rhythmusstörungen während einer myokardialen Ischämie, indem sie die effektive Refraktärzeit verlängern.
Die Wahl des inhalierten Anästhetikums beeinflusst das Auftreten reflektorischer Bradydysrhythmien, die aus einer vagalen Stimulation resultieren können. Mit Sevofluran anästhesierte Kinder zeigen im Vergleich zu Halothan weniger Episoden von verringerter Herzfrequenz oder Sinusknotenstillstand als Reaktion auf chirurgische Traktion an den Augenmuskeln.
QT-Intervall
Inhalative Anästhetika verlängern das QT-Intervall im Elektrokardiogramm (40). Obwohl die relative Tendenz jedes Anästhetikums zur Verlängerung des QT-Intervalls nicht systematisch verglichen wurde, sollte Sevofluran bei Patienten mit bekanntem angeborenem Long-QT-Syndrom (LQTS) vermieden werden. Obwohl Sevofluran- und Propofol-Anästhetika bei Kindern eine Verlängerung des QT-Intervalls verursachen, erhöht keines der Anästhetika die transmurale Streuung der Repolarisation, ein Maß für die heterogenen Repolarisationsraten von Myokardzellen während der Phasen 2 und 3 des Aktionspotentials (41). Die klinische Bedeutung einer QT-Verlängerung mit Sevofluran und anderen inhalativen Anästhetika bei empfindlichen Patienten ist unklar. Bei Patienten mit LQTS ist die β-adrenerge Blockade die Hauptstütze der Therapie. Patienten mit bekanntem LQTS wurden sicher mit allen modernen inhalativen Anästhetika anästhesiert, wenn sie gleichzeitig β-adrenerge Blocker erhielten. Bei Patienten, die sich einer Anästhesie mit Halothan unterzogen, sind zahlreiche maligne intraoperative Arrhythmien aufgetreten, die anschließend einem nicht diagnostizierten LQTS zugeschrieben wurden, und keiner der Patienten hatte β-Blocker-Medikamente erhalten (40).
Patienten mit koronarer Herzkrankheit
Zahlreiche Studien an Patienten, die sich einer Koronararterien-Bypass-Operation unterziehen oder bei denen das Risiko einer koronaren Herzkrankheit besteht, konnten keinen Unterschied im Ergebnis zwischen Gruppen, die inhalative (d. h. Desfluran) versus intravenös verabreichte (d. h. Fentanyl oder Sufentanil) Anästhesietechniken erhielten, oder zwischen Gruppen, die eine solche erhielten, nachweisen Inhalationsanästhetikum im Vergleich zu einem anderen (dh Desfluran vs. Isofluran oder Sevofluran vs. Isofluran) (42). Bedenken, dass die Fähigkeit von Isofluran, Koronararterien mit kleinem Durchmesser zu erweitern, einen Koronardiebstahl verursachen könnte, bei dem ein Patient mit anfälliger Anatomie infolge der Koronargefäßerweiterung eine regionale Myokardischämie entwickeln könnte, waren nicht berechtigt. Flüchtige Anästhetika üben stattdessen eine schützende Wirkung auf das Herz aus, indem sie den Bereich der Myokardverletzung begrenzen und die Funktion nach der Exposition gegenüber einem ischämischen Insult erhalten.
Anästhesie-Vorkonditionierung
Die Erklärung für den protektiven Nutzen volatiler Anästhetika gegen myokardiale Ischämie wird als anästhetische Vorkonditionierung bezeichnet und wird nicht durch eine günstige Änderung des myokardialen Sauerstoffangebots-Nachfrageverhältnisses erklärt. Es gibt Hinweise darauf, dass flüchtige Anästhetika bei eingeschränkter regionaler Durchblutung eine schützende Wirkung auf das Myokard ausüben. Bei Patienten, die sich einer Koronararterien-Bypass-Operation (CABG) unterziehen, verringerte die Erhaltungstherapie mit 0.2 bis 1 MAC Desfluran oder Sevofluran die Inzidenz abnormal erhöhter Troponinspiegel im Vergleich zu Patienten, die Propofol erhielten (43). Die Verabreichung von Sevofluran während der gesamten Dauer der CABG-Operation im Vergleich zur Verabreichung vor oder nach dem Bypass führte zu einer geringeren Häufigkeit postoperativer Myokardinfarkte im Vergleich zu Sevofluran, das nur in der Phase vor oder nach dem Bypass verabreicht wurde, und die Verabreichung vor oder nach dem Bypass führte im Vergleich zu einem geringeren Risiko eines Myokardinfarkts mit Propofol-Anästhesie (44).
Mechanismen der ischämischen Vorkonditionierung
Die ischämische Präkonditionierung ist ein grundlegender Schutzmechanismus, der in allen Geweben aller Arten vorhanden ist. In seiner chemischen Vorkonditionierung kann die Exposition gegenüber einzelnen oder mehreren kurzen Ischämie-Episoden eine schützende Wirkung auf das Myokard gegen reversible oder irreversible Schädigungen mit einem anschließenden verlängerten ischämischen Insult ausüben. Nach einer kurzen ischämischen Episode gibt es zwei unterschiedliche Perioden, während denen das Myokard geschützt ist. Die erste Periode tritt 1 bis 2 Stunden nach der Konditionierungsepisode auf und verschwindet dann. In der zweiten Periode tritt der Vorteil 24 Stunden später wieder auf und kann bis zu 3 Tage anhalten. Die Öffnung der mitochondrialen Adenosintriphosphat (ATP)-sensitiven Kaliumkanäle (KATP) ist das entscheidende Ereignis, das die schützende Aktivität verleiht, die aus der Bindung verschiedener Liganden an G-Protein-gekoppelte Rezeptoren resultiert. Flüchtige Anästhetika verstärken die ischämische Präkonditionierung oder bieten direkten myokardialen Schutz, und die KATP-Kanäle spielen eine zentrale Rolle bei ihren Schutzwirkungen (45).
Belüftungseffekte
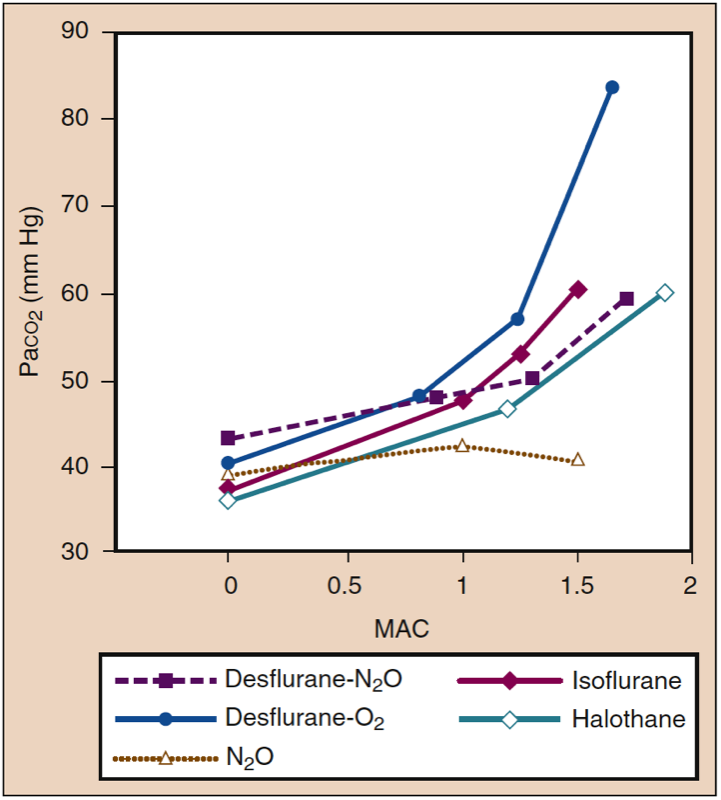
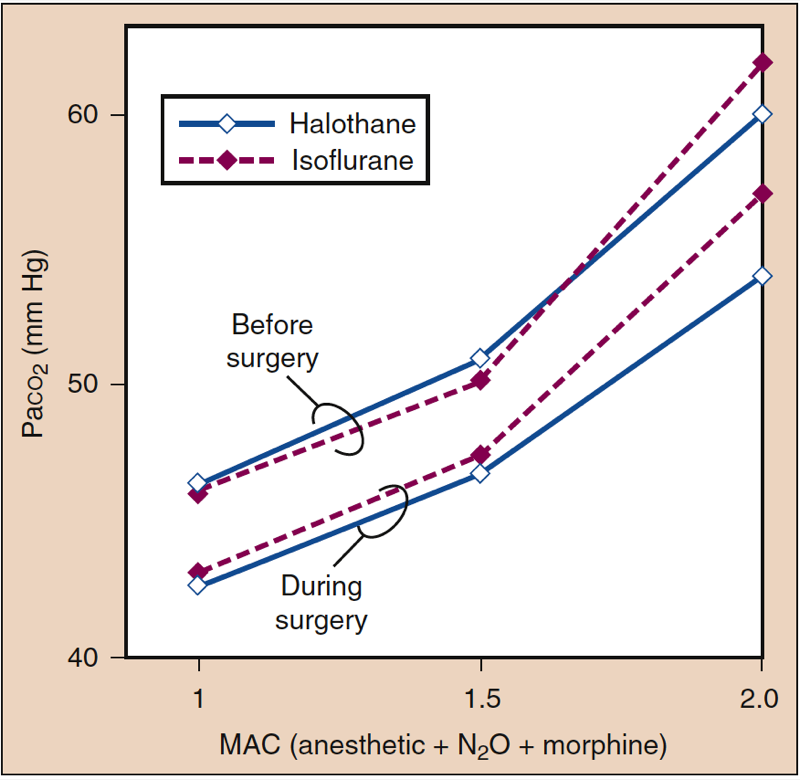
Inhalierte Anästhetika erhöhen die Atemfrequenz und verringern das Atemzugvolumen, wenn die Anästhetikakonzentration zunimmt. Obwohl die Minutenventilation relativ erhalten bleibt, führt das verringerte Tidalvolumen zu einem relativ größeren Anteil an Totraumventilation im Vergleich zur alveolären Ventilation. Der Gasaustausch wird bei tieferen Anästhesiestufen zunehmend weniger effizient, und der PaCO2 steigt proportional mit der Anästhetikumkonzentration (Abb. 14) (1). Die Wirkungen sind bei potenten Anästhetika bei gegebenen MAC-Vielfachen ähnlich. Der Ersatz von Distickstoffmonoxid (60 %) durch einen äquivalenten Anteil eines flüchtigen Anästhetikums kann den Anstieg des PaCO2 bei tieferen Anästhesiestufen abschwächen.

- Abb. 14. Inhalative Anästhetika führen zu medikamentenspezifischen und dosisabhängigen Erhöhungen von Paco2. MAC, minimale alveoläre Konzentration. (Aus Eger EI II. Desflurane (Suprane): A Compendium and Reference. Nutley, NJ: Anaquest; 1993:1-119, Verwendung mit Genehmigung.)
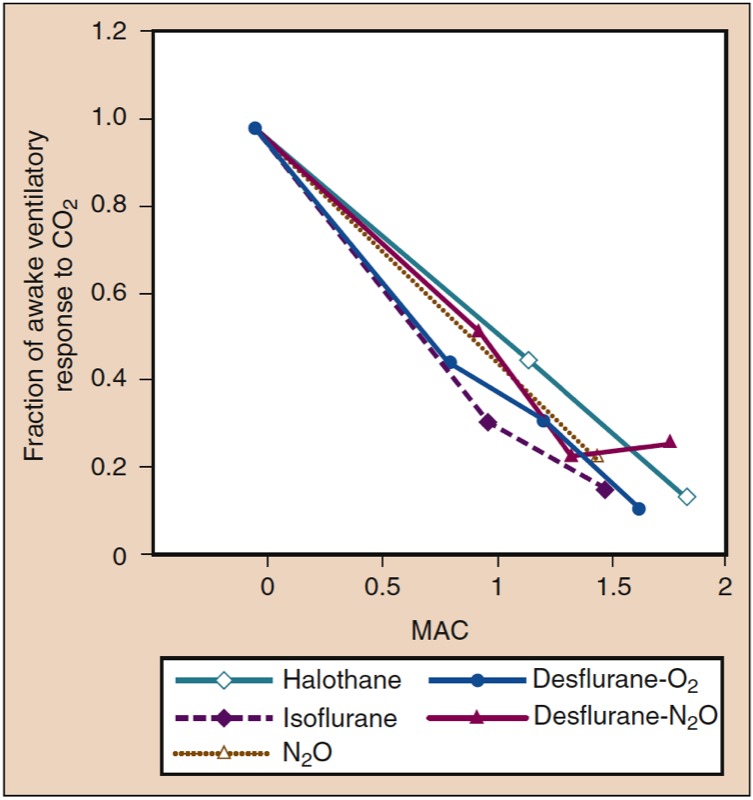
Freiwillige und Patienten, die Desfluran (und andere flüchtige Anästhetika) atmen, zeigen eine dosisabhängige Abschwächung der Reaktionsfähigkeit auf Kohlendioxid, was bei Probanden, die 1.7 MAC Desfluran in Sauerstoff erhalten, zu Apnoe führt (Abb. 15) (1). Im Vergleich zu Probanden kann die Abstumpfung der Beatmung mit Inhalationsanästhetika bei Patienten, die sich einer Operation unterziehen, weniger ausgeprägt sein, was die stimulierende Wirkung der Operation auf die Atmung widerspiegelt (Abb. 16) (1). Flüchtige Anästhetika dämpfen alle die Atemstimulation, die durch arterielle Hypoxämie hervorgerufen wird (46).

- Abb. 15. Alle inhalierten Anästhetika erzeugen ähnliche dosisabhängige Abnahmen der Beatmungsreaktionen auf Kohlendioxid. MAC, minimale alveoläre Konzentration. (Aus Eger EI II. Desflurane (Suprane): A Compendium and Reference. Nutley, NJ: Ana Quest; 1993:1-119, Verwendung mit Genehmigung.)

- Abb. 16. Einfluss der chirurgischen Stimulation auf das Ruhe-Paco2 (mm Hg) während der Verabreichung von Isofluran oder Halothan. MAC, minimale alveoläre Konzentration. (Aus Eger EI II. Desflurane (Suprane): A Compendium and Reference. Nutley, NJ: Anaquest; 1993:1-119, Verwendung mit Genehmigung.)
Änderungen der Brustwand
Inhalierte Anästhetika tragen zu Konformationsänderungen in der Brustwand bei, die die Beatmungsmechanik beeinflussen können. Eine Cephalad-Verlagerung des Zwerchfells und eine Einwärtsverschiebung des Brustkorbs treten aufgrund einer verstärkten Exspirationsmuskelaktivität auf, und das Nettoergebnis trägt zur Verringerung der funktionellen Residualkapazität bei. Atelektasen treten bevorzugt in den abhängigen Bereichen der Lunge auf und treten verstärkt auf, wenn eine Spontanatmung zugelassen wird.
Hypoxische pulmonale Vasokonstriktion
Inhalierte Anästhetika verändern den pulmonalen Blutfluss, aber die Hemmung der hypoxischen pulmonalen Vasokonstriktion ist minimal. Beispielsweise ist die arterielle Oxygenierung bei Patienten, die sich einer Einlungenbeatmung mit Isofluran- versus Desfluran-Anästhesie und Sevofluran- versus Propofol-Anästhesie unterziehen, ähnlich (47).
Atemwegswiderstand
Ohne Bronchokonstriktion sind die bronchodilatatorischen Wirkungen inhalierter Anästhetika gering. Bei Freiwilligen verringern Isofluran, Halothan und Sevofluran, aber nicht Lachgas und Thiopental, den respiratorischen systemischen Widerstand nach trachealer Intubation. Bei Nichtrauchern zeigt der Atemwegswiderstand nach trachealer Intubation und Desfluran-Anästhesie keine Veränderung im Vergleich zu einer leichten Abnahme unter Sevofluran, während Raucher einen leichten, vorübergehenden Anstieg des Atemwegswiderstands nach trachealer Intubation und Desfluran-Anästhesie zeigen (48). Einige oder alle Änderungen des Atemwegswiderstands können durch Änderungen der Gasdichte vermittelt werden.
Reizende Wirkungen auf die Atemwege
Inhalierte Anästhetika unterscheiden sich in ihrer Fähigkeit, die Atemwege zu reizen (dh Schärfe). Sevofluran, Halothan und Lachgas sind nicht stechend und verursachen über einen breiten Konzentrationsbereich nur minimale oder keine Reizungen. Desfluran und Isofluran sind scharf und können die Atemwege in Konzentrationen über 1 MAC reizen, insbesondere wenn keine intravenösen Medikamente (z. B. Opioide, Beruhigungsmittel und Hypnotika) verabreicht werden, die die Wahrnehmung von Schärfe verringern.
Sevofluran oder Halothan werden am häufigsten gewählt, wenn eine inhalative Narkoseeinleitung gewünscht wird. Allerdings können Desfluran und Isofluran chirurgischen Patienten über eine Larynxmaske verabreicht werden, ohne dass es im Vergleich zu Sevofluran oder Propofol zu einer größeren Inzidenz von Atemwegsreizungen (z. B. Husten, Atemanhalten, Laryngospasmus, arterielle Sauerstoffentsättigung) kommt, da dies normalerweise der Fall ist erfordern keine Konzentration von mehr als 1 MAC (dh nicht reizende Konzentrationen) (49).
Auswirkungen auf das zentrale Nervensystem
Zerebraler Blutfluss
Lachgas, das ohne flüchtige Anästhetika verabreicht wird, verursacht eine zerebrale Vasodilatation und erhöht den zerebralen Blutfluss. Die zerebrale Stoffwechselrate für Sauerstoff (CMRO2) steigt leicht an. Die gleichzeitige Verabreichung von Opioiden, Barbituraten oder Propofol (jedoch nicht von Ketamin) wirkt diesen Wirkungen entgegen (50). Inhalierte Anästhetika heben die zerebrale vaskuläre Reaktionsfähigkeit auf Änderungen des PaCO2 nicht auf (51).
Halothan, Isofluran, Sevofluran und Desfluran verringern CMRO2. Bei normokapnischen Menschen verursachen diese flüchtigen Anästhetika bei Konzentrationen über 0.6 MAC eine zerebrale Vasodilatation. Es gibt eine zweiphasige, dosisabhängige Wirkung auf den zerebralen Blutfluss. Bei 0.5 MAC wirkt die Abnahme von CMRO2 der Vasodilatation entgegen, so dass sich der zerebrale Blutfluss nicht signifikant ändert. Bei Konzentrationen über 1 MAC überwiegen die gefäßerweiternden Wirkungen und der zerebrale Blutfluss steigt, insbesondere wenn der systemische Blutdruck auf Wachniveau gehalten wird. Die Erhöhung des zerebralen Blutflusses ist bei Halothan relativ größer als bei Isofluran, Sevofluran oder Desfluran.
Hirndruck
Der intrakranielle Druck steigt mit allen flüchtigen Anästhetika bei Dosen von mehr als 1 MAC, und die Autoregulation (dh der adaptive Mechanismus, der den zerebralen Blutfluss über einen weiten Bereich systemischer arterieller Drücke bei wachen Patienten normalisiert) wird bei Konzentrationen von weniger als 1 MAC beeinträchtigt. Patienten, die sich wegen supratentorieller Tumoren einer Kraniotomie unterziehen und 1 MAC Isofluran oder Desfluran erhalten, zeigen einen verringerten zerebralen Perfusionsdruck und eine arteriovenöse Sauerstoffdifferenz für Sauerstoff, aber keine Änderung des intrakraniellen Drucks (52). Patienten, die sich einer Hypophysentumorresektion unterziehen und 1 MAC Desfluran, Isofluran oder Sevofluran erhalten, zeigen jedoch einen geringen Anstieg des intrakraniellen Drucks und einen verringerten zerebralen Blutfluss. Neurochirurgische Patienten, die 50 % Distickstoffmonoxid plus 0.5 MAC Desfluran oder Isofluran erhalten, haben offensichtlich eine stärkere Gehirnentspannung als Patienten, die 1 MAC Desfluran oder Isofluran ohne Distickstoffmonoxid erhalten. Inhalierte Anästhetika heben die zerebrale vaskuläre Reaktionsfähigkeit auf Änderungen des PaCO2 nicht auf (51).
Evozierte Potenziale
Alle volatilen Anästhetika und Distickstoffmonoxid senken dosisabhängig die Amplitude und erhöhen die Latenz der somatosensorisch evozierten Potenziale. Evozierte Potenziale können bei 1 MAC eines flüchtigen Anästhetikums allein oder über 0.5 MAC, verabreicht mit 50 % Distickstoffmonoxid, aufgehoben werden. Niedrige Konzentrationen volatiler Anästhetika (0.2 bis 0.3 MAC) können die Zuverlässigkeit der Überwachung des motorisch evozierten Potenzials verringern, obwohl die Auswirkungen teilweise durch die Verwendung von Multipuls-Stimuli überwunden werden können (53).
Elektroenzephalographische Effekte
Flüchtige Anästhetika verursachen charakteristische, dosisabhängige Veränderungen im EEG. Die zunehmende Anästhesietiefe aus dem Wachzustand ist durch eine erhöhte Amplitude und Synchronität gekennzeichnet. Perioden elektrischer Ruhe nehmen mit zunehmender Tiefe einen größeren Anteil der Zeit ein (dh Burst-Unterdrückung). Dieses isoelektrische Muster überwiegt im EEG im Bereich von 1.5 bis 2.0 MAC.
Sevofluran und Enfluran können mit epileptiformen Aktivitäten im EEG verbunden sein, insbesondere bei höheren Konzentrationen oder wenn eine kontrollierte Hyperventilation eingeleitet wird. Anfallsähnliche Aktivität wurde bei Kindern während der Sevofluran-Induktion berichtet, aber die klinischen Implikationen dieser Beobachtungen sind nicht klar (54).
Neuromuskuläre Wirkungen
Flüchtige Anästhetika bewirken eine dosisabhängige Entspannung der Skelettmuskulatur und verstärken die Aktivität von neuromuskulären Blockern. Die Verstärkung der relaxierenden Wirkung von Rocuronium ist bei Anästhesie durch Desfluran stärker als bei Sevofluran oder Isofluran, obwohl alle volatilen Anästhetika die Skelettmuskelrelaxation im Vergleich zu intravenösen Anästhetika (z. B. Propofol plus Fentanyl) verstärken. Die Eliminierung flüchtiger Anästhetika verbessert die Erholung von einer neuromuskulären Blockade. Eine Abnahme der Desfluran-Konzentration auf 0.25 MAC erleichtert die Aufhebung der neuromuskulären Blockade nach Verabreichung von Vecuronium mehr als eine gleichstarke Abnahme der Isofluran-Konzentration.
Maligne Hyperthermie
Die maligne Hyperthermie (MH) ist nach wie vor eine lebensbedrohliche Komplikation der Anästhesie. Es handelt sich um eine erbliche Erkrankung mit erhöhtem Skelettmuskelstoffwechsel, die durch die Verabreichung eines flüchtigen Anästhetikums, insbesondere Halothan und/oder Succinylcholin, ausgelöst wird. Obwohl alle potenten inhalativen volatilen Anästhetika auch das Potenzial haben, MH auszulösen, weisen Studien mit Desfluran, Sevofluran und möglicherweise Isofluran auf ein geringeres Risiko hin als das von Halothan. Männer scheinen anfälliger für die Entwicklung einer klinischen MH-Episode zu sein als Frauen (55,56). Die pädiatrische Population macht 52.1 % aller MH-Reaktionen aus (57,58). Anzeichen von MH hängen mit einem erhöhten Stoffwechsel zusammen und umfassen Tachykardie, erhöhte endtidale Kohlendioxidwerte, Muskelsteifheit und erhöhte Temperatur.
Neuere Fälle von MH sind weniger schwerwiegend aufgrund eines verbesserten diagnostischen Bewusstseins, einer Früherkennung durch endexpiriertes Kohlendioxid, einer geringeren Verwendung starker anästhetischer Auslöser und der Verabreichung von Medikamenten, die fulminante Episoden von MH abschwächen.
Zu den wichtigsten Aspekten der Behandlung gehören das Absetzen von volatilen Anästhetika und Succinylcholin, die sofortige Verabreichung von intravenösem Dantrolen und die Behandlung potenziell lebensbedrohlicher Elektrolytanomalien wie Hyperkaliämie. Die Maligne Hyperthermia Association of the United States (MHAUS) gibt auf ihrer Website detaillierte Behandlungsempfehlungen. MHAUS unterhält auch eine 24-Stunden-Hotline für Notfallberatung (1-800-644-9737 in den USA; 001-209-417-3722 außerhalb der USA).
Hepatische Wirkungen
Eine Leberschädigung nach Anästhesie kann als schwer (immunvermittelt) oder leicht kategorisiert werden (59).
Immunvermittelte Leberschädigung
Eine schwere Leberschädigung kann nach einer Anästhesie mit Halothan, Isofluran, Sevofluran oder Desfluran erfolgen. Bei dieser schweren Form kommt es zu einer massiven Lebernekrose, die zum Tod führen oder eine Lebertransplantation erforderlich machen kann. Der Mechanismus für diese schwere Verletzung ist immunologisch und erfordert die vorherige Exposition gegenüber einem flüchtigen Anästhetikum. Halothan, Isofluran und Desfluran unterliegen alle einem oxidativen Metabolismus durch Cytochrom-P-450-Enzyme, um Trifluoracetat zu produzieren. Das Trifluoracetat kann kovalent an Hepatozytenproteine binden. Die Trifluoracetyl-Hepatozyten-Einheiten können als Haptene wirken, die der Körper als fremd erkennt und gegen die das Immunsystem Antikörper bildet. Die anschließende Exposition gegenüber einem Anästhetikum, das Trifluoracetat produzieren kann, kann eine Immunantwort hervorrufen, die zu einer schweren Lebernekrose führt (60). Sevofluran wird zu Hexafluorisopropanol metabolisiert, einer Verbindung, die nicht das gleiche antigene Verhalten wie Trifluoracetat aufweist (61).
Leichte Leberschädigung
Eine klinisch milde Form einer Leberschädigung kann nach der Verabreichung von Halothan auftreten. Das Hauptmerkmal dieser häufigeren Entität ist eine mäßige Erhöhung der Serum-Transaminase-Spiegel. Es wird angenommen, dass diese leichte Form der Leberschädigung durch den reduktiven Metabolismus von Halothan vermittelt wird und möglicherweise eher nach einer gleichzeitigen Verringerung des hepatischen Blutflusses und einer damit verbundenen Verringerung der Sauerstoffzufuhr zur Leber auftritt.
Anamnese früherer anästhesiebedingter Leberfunktionsstörungen
Obwohl volatile Anästhetika häufig nicht bei Patienten verabreicht werden, bei denen nach einer inhalativen Anästhesie bei einer früheren Gelegenheit ungeklärte Symptome einer Leberfunktionsstörung aufgetreten sind, sind volatile Anästhetika wahrscheinlich nicht schädlich für Patienten mit einer vorbestehenden Lebererkrankung, die nicht mit einer Anästhesie in Zusammenhang steht.
Niereneffekte
Methoxyfluran war das erste nicht brennbare flüchtige Anästhetikum, das in die klinische Praxis eingeführt wurde. Seine Verwendung wurde mit Nierenschäden in Verbindung gebracht. Nachfolgende Untersuchungen deuten darauf hin, dass sein umfangreicher Metabolismus, insbesondere zu anorganischem Fluorid und Dichloressigsäure aus der O-Demethylierung, wahrscheinlich für die Verletzung verantwortlich ist. Die Fluoridproduktion aus dem Metabolismus anderer starker Inhalationsanästhetika, insbesondere Sevofluran, zeigt jedoch keinen Zusammenhang mit Nierenschäden (62).
10. FRAGEN DES TAGES
- Welche physikalischen Eigenschaften von Desfluran erfordern seine Verabreichung durch einen speziell entwickelten Verdampfer? Wie wird die Leistung eines Desfluran-Verdampfers durch große Höhen beeinflusst?
- Welche inhalativen Anästhetika haben die größten Auswirkungen auf die Umwelt in Bezug auf „Kohlendioxid-Äquivalente“ sowie atmosphärische Langlebigkeit?
- Wie verhält sich die Dosis des inhalierten Anästhetikums, die erforderlich ist, um eine Amnesie zu erzeugen, im Vergleich zu der Dosis, die erforderlich ist, um eine Bewegung durch den chirurgischen Einschnitt zu verhindern? Was ist die Standardabweichung von MAC für die chirurgische Inzision? Welche Medikamente erhöhen oder verringern den Bedarf an inhalativen Anästhetika?
- Welche sechs Faktoren bestimmen bei der Verabreichung eines inhalativen Anästhetikums den alveolären Partialdruck des Anästhetikums?
- Welche Faktoren beeinflussen während der Erholung von einem inhalierten Anästhetikum am meisten die Abnahme des Partialdrucks des Anästhetikums?
- Welche Wirkungen auf den Kreislauf hat ein schneller Konzentrationsanstieg von Desfluran im Vergleich zu Isofluran und Sevofluran? Wie können diese Effekte minimiert werden?