Johan Raeder et Ulrich J. Spreng
INTRODUCTION
L'infiltration ou l'instillation d'anesthésiques locaux autour et dans l'articulation en tant qu'analgésique d'appoint pour la douleur postopératoire de la chirurgie articulaire est utilisée depuis des décennies. Cependant, il y a eu un regain d'intérêt pour l'analgésie par infiltration locale (LIA), en partie grâce aux travaux en 2008 de Kerr et Kohan, qui ont démontré une analgésie supérieure après une arthroplastie totale du genou ou de la hanche avec une infiltration prolongée et diluée d'anesthésie locale avec de l'épinéphrine et du kétorolac. injections ajoutées et répétées à travers des cathéters intra-articulaires. L'intérêt d'utiliser le LIA dans la chirurgie du genou et de la hanche peut également être dû au manque d'alternatives d'anesthésie régionale plus simples qui existent pour d'autres articulations. Par exemple, l'analgésie après une chirurgie de l'épaule et des membres supérieurs peut être réalisée avec un simple bloc d'injection unique du plexus brachial, tandis que l'analgésie des articulations de la hanche et du genou nécessite des blocs nerveux multiples et plus difficiles sur le plan technique. De plus, alors que la faiblesse motrice est courante avec les blocs nerveux, l'analgésie par infiltration épargne généralement la fonction motrice.
LE CONCEPT D'INFILTRATION LOCALE
ANALGÉSIE
Il existe trois composants de base du concept LIA : volume élevé d'anesthésique local dilué à action prolongée ; les adjuvants anesthésiques non locaux ; et des injections bolus par cathéter (appoints) pendant 1 à 3 jours.
Volume élevé de longue durée d'action diluée
Médicament anesthésique
Un problème avec l'infiltration anesthésique locale pour une chirurgie majeure est que de nombreuses structures et couches différentes doivent être infiltrées. Ce faisant, un certain volume minimum d'anesthésique local est nécessaire pour une infiltration locale efficace couvrant toutes les structures concernées. Avec des concentrations conventionnelles de solutions anesthésiques locales, des volumes aussi élevés comportent un risque inacceptable de toxicité systémique (voir Toxicité systémique des anesthésiques locaux). Cependant, l'anesthésie des petites terminaisons nerveuses dans et autour des articulations ne nécessite pas d'anesthésie locale à haute concentration. Ainsi, la concentration d'anesthésique local peut être abaissée et le volume augmenté, en maintenant la dose totale dans des limites de sécurité. De plus, comme les principales articulations sont dépourvues de vaisseaux sanguins majeurs, le risque d'injection par inadvertance d'un grand bolus directement dans la circulation est faible.
Adjuvants anesthésiques non locaux
Étant donné que des injections soigneuses d'anesthésique local sont effectuées à proximité du site de la lésion chirurgicale, il est possible de cibler la source de la douleur causée par l'inflammation et la douleur locales pour fournir un traitement efficace près de l'origine de la douleur. Il s'agit d'une alternative à l'approche systémique de l'analgésie par laquelle une dose totale potentiellement plus élevée de médicament est nécessaire et comporte un potentiel plus élevé d'effets secondaires généraux. Des adjuvants anesthésiques non locaux tels que des agents anti-inflammatoires, des anti-inflammatoires non stéroïdiens (AINS - inhibiteurs traditionnels ou de la cyclooxygénase [COX] 2) et des stéroïdes, ainsi que des opioïdes et de la kétamine ont tous été utilisés. Le rôle de l'épinéphrine ou de la clonidine dans le mélange LIA n'a cependant pas été bien étudié. Bien que les deux médicaments aient un effet analgésique sur les récepteurs spinaux α2 lorsqu'ils sont administrés par voie épidurale ou rachidienne, il n'existe aucune documentation sur un effet analgésique spécifique ou un mécanisme cible de ces médicaments lorsqu'ils sont utilisés par voie périphérique. L'épinéphrine est souvent incluse de manière empirique "juste au cas où" en raison du potentiel de prolonger l'effet d'autres médicaments actifs localement, car leur clairance du site local est retardée en raison de la vasoconstriction induite par l'épinéphrine.
Recharges de cathéter pendant 1 à 3 jours
Les anesthésiques locaux à action prolongée utilisés pour l'infiltration, les injections périopératoires et l'infiltration ont tous une durée limitée et s'usent en quelques heures après l'injection. Parce que l'injection répétée de l'anesthésique local est douloureuse ou incommode, une approche consiste à laisser un ou plusieurs cathéters dans la plaie ou l'articulation pour fournir le véhicule pour les bolus ou l'infusion continue d'anesthésiques locaux. L'utilisation de cathéters dans le cadre d'une arthroplastie majeure est cependant controversée en raison du potentiel d'infection. L'utilisation courante du cathéter est également remise en question aux États-Unis par le développement récent et l'approbation par la FDA de la bupivacaïne à action prolongée (bupivacaïne liposomale), bien que le rôle et le potentiel de ce médicament dans le concept LIA nécessitent un examen plus approfondi.
INFORMATIONS BASEES SUR DES PREUVES SUR L'EFFICACITE ET LA SECURITE DE L'ANALGESIE PAR INFILTRATION LOCALE
Comme c'est souvent le cas avec les nouvelles méthodes et techniques, l'enthousiasme initial pour la LIA exprimé dans les pratiques cliniques, les réunions professionnelles et les rapports de cas,1 attend un examen fondé sur des preuves avant que des recommandations pour une utilisation clinique quotidienne puissent être faites. Voici des questions importantes qui nécessitent un examen minutieux :
1. La méthode est-elle suffisamment efficace ?
2.Quels composants de la nouvelle méthode sont efficaces ?
3.Comment la LIA se compare-t-elle à d'autres méthodes courantes en termes de sécurité, de qualité et de coût ?
Si une nouvelle méthode est testée en tant que composant d'un régime multimodal et montre une supériorité par rapport aux témoins, nous pouvons avoir la réponse à la première question, mais les questions 2 et 3 restent sans réponse. Les prochaines étapes logiques consistent à tester chaque composant individuellement (en gardant tout le reste inchangé et standardisé) dans des conditions contrôlées et standardisées pour élucider quels composants du protocole multimodal sont réellement bénéfiques. Le LIA doit être comparé aux meilleures alternatives potentielles utilisées dans des conditions optimales : opiacé intrathécal, analgésie péridurale, bloc nerveux fémoral, autres blocs nerveux, ou simplement analgésie multimodale optimale, y compris l'infiltration de la plaie d'anesthésie locale. Nous savons que l'infiltration d'anesthésiques locaux confère une analgésie après une arthroplastie du genou, en supposant que l'anesthésique local est habilement infiltré dans tous les tissus concernés. Dans une étude sur la réparation des hernies avec une analgésie par infiltration de bupivacaïne, Aasboe et al ont montré un soulagement amélioré de la douleur jusqu'à 1 semaine après la procédure. Pourtant, ces résultats sont dans une certaine mesure spécifiques à la procédure et ne sont pas reproduits avec LIA par d'autres. Dans l'étude d'Andersen et al sur l'arthroplastie du genou, l'infiltration préopératoire de ropivacaïne était supérieure au placebo à 6 heures mais pas à 24 heures. Le succès de la LIA peut dépendre de l'étendue de la technique d'infiltration locale en termes d'inclusion de toutes les structures pertinentes, et pas seulement des couches superficielles de la plaie. Avec tous les nouveaux concepts, il faut trouver un équilibre entre intégrer rapidement les bénéfices dans la pratique quotidienne tout en attendant une documentation objective d'études de qualité. Les études réalisées jusqu'à présent sur l'efficacité du LIA n'ont pas la puissance, la standardisation ou la qualité pour fournir une réponse claire ou même fournir des données regroupées de qualité pour les méta-analyses.
L'une des raisons de la rareté des preuves est que les études randomisées en aveugle incorporant la LIA sont quelque peu difficiles à concevoir car toutes les injections, cathéters et remplissages doivent également être effectués dans le groupe placebo. Même dans ce cas, un tel groupe placebo ne serait pas pertinent car, dans la pratique clinique, les injections de solution saline dans les structures de plaies et les cathéters ne se produiraient pas, et pourtant, les injections de solution saline seules peuvent avoir des avantages analgésiques. En effet, l'infiltration de solution saline dans l'articulation du genou a un effet analgésique, éventuellement par refroidissement et dilution des protéines locales inflammatoires, ou placebo. Comme il existe de nombreux facteurs de confusion, les études idéales sur l'efficacité du LIA ne devraient porter que sur un ou quelques éléments spécifiques à la fois, en contrôlant ou en standardisant les autres. Ces éléments spécifiques comprennent un type spécifique de chirurgie, des contrôles systémiques pour tous les médicaments actifs dans le mélange LIA, et des perfusions factices ou placebo ou des compléments lors du test de LIA postopératoire. Les effets analgésiques du kétorolac et de la ropivacaïne administrés par voie systémique sont bien connus. De même, l'administration intra-articulaire entraînera également une absorption systémique et des effets systémiques. Il convient de rappeler que le LIA peut ne jamais être bien standardisé en tant que dose définie d'un seul médicament intraveineux ou d'un bloc nerveux spécifique pour plusieurs raisons.
Premièrement, différents types de chirurgie et d'articulations varient en termes de composition anatomique, d'acceptabilité et de propagation du LIA et de degré de douleur postopératoire. Deuxièmement, les différences dans les techniques d'infiltration peuvent influencer les avantages analgésiques. L'impression clinique suggère que l'injection du matin le lendemain de la chirurgie semble avoir un effet analgésique sur les patients douloureux, bien que cela n'ait pas été démontré de manière convaincante dans des études contrôlées. Cela peut être dû au fait que les patients témoins dans les études reçoivent généralement une injection de placebo et ont souvent une douleur faible à modérée et donc peu de puissance potentielle ou statistique pour montrer des améliorations pour l'ensemble du groupe. Deux autres aspects de l'interprétation clinique des études sont importants : si le groupe témoin reçoit un régime analgésique multimodal efficace entraînant de faibles scores de douleur, il est difficile de démontrer les avantages supplémentaires d'une nouvelle méthode. Cependant, si une nouvelle méthode est tout aussi efficace mais pas meilleure, cela ne signifie pas que la nouvelle méthode est sans valeur. En revanche, cela offre simplement le choix entre deux méthodes différentes avec des différences dans le profil des effets secondaires, les risques et les aspects pratiques et économiques. Les avantages de la LIA peuvent concerner divers aspects des soins infirmiers, moins de besoin d'observance du patient, une dose totale plus faible d'AINS, un besoin moindre d'opioïdes, un besoin moindre de gabapentinoïdes et leurs effets secondaires potentiels, etc. Pourtant, le nombre de patients dans de nombreuses études est trop faible pour répondre aux questions de sécurité et d'effets secondaires moins fréquents. Les études doivent examiner attentivement les effets secondaires graves, mais rares, ainsi que la manière d'utiliser la LIA comme outil pour améliorer la réadaptation, raccourcir le séjour à l'hôpital et obtenir de meilleurs résultats fonctionnels.
Quelles sont les alternatives au LIA pour les arthroplasties du genou ou de la hanche ? En termes de soulagement de la douleur « le plus efficace », il est difficile d'améliorer l'analgésie péridurale. Cependant, l'analgésie péridurale ne procure aucun avantage analgésique au-delà de la période d'utilisation active. De plus, lors du traitement antalgique, la technique est gourmande en ressources et nuit à la mobilisation et à la kinésithérapie. Il existe également des risques de rétention urinaire, d'hypotension et d'hématome épidural. Le bloc nerveux fémoral pour arthroplastie du genou offre un traitement plus spécifique mais ne couvre pas tous les nerfs impliqués dans l'innervation du genou et entraîne une faiblesse du muscle quadriceps.
Comme pour le bloc épidural, cette technique peut être associée à des lésions nerveuses très rares mais graves. Dans une étude récente comparant LIA et bloc fémoral pour l'arthroplastie du genou, Affas et al ont montré moins de douleur à l'activité avec LIA à 24 heures et un avantage en termes de facilité de réalisation et de moindre coût. D'autres blocs nerveux peuvent fournir un soulagement plus ciblé de la douleur au genou unique sans bloc moteur, comme un bloc du canal adducteur des nerfs saphène et obturateur. L'opioïde intrathécal, tel qu'utilisé dans l'étude d'Essving et al, peut également être bénéfique. La morphine semble être le meilleur médicament en termes d'effet prolongé après une seule injection. Cependant, une dose supérieure à 0.1 mg peut dans certains cas prolonger l'effet, mais avec un risque plus élevé d'effets secondaires. La recommandation d'expert, fondée sur des preuves et spécifique à la procédure pour l'arthroplastie du genou (voir http://www.postoppain.org/image.aspx?imgid=654) est la combinaison soit d'une rachianesthésie sans opioïde, soit d'une anesthésie générale avec bloc fémoral comme le premier choix pour l'anesthésie. L'un ou l'autre doit être complété par de l'acétaminophène plus un AINS plus un opioïde pour les accès douloureux paroxystiques. La recommandation d'éviter la morphine intrathécale était basée sur les nausées dans une étude avec une dose de morphine de 0.25 mg et peut ne pas être pertinente avec la dose de 0.1 mg utilisée par Essving et al. Bien qu'ils soient utilisés par certains, il n'existe aucune donnée convaincante indiquant que les stéroïdes ou le gabapentinoïde confèrent des avantages analgésiques supplémentaires.
AVANTAGES ET INCONVÉNIENTS POTENTIELS ET DOCUMENTÉS DE L'ANALGESIE PAR INFILTRATION LOCALE ET DES ALTERNATIVES
Avantages
Un avantage majeur de la LIA est l'absence de déficience motrice souvent observée avec les techniques alternatives de blocs nerveux, telles que les blocs fémoraux ou sciatiques ou l'analgésie péridurale. Avec LIA, il existe également un risque mineur de formation d'hématome, qui est une complication redoutée des blocs profonds, tels que le bloc lombaire ou l'analgésie péridurale. De plus, la LIA n'est pas contre-indiquée en cas de risque hémorragique accru d'autres causes, telles que l'anticoagulation thérapeutique, l'inhibition plaquettaire ou même l'utilisation d'AINS traditionnels ou d'acide acétylsalicylique à faible dose. Un autre argument pour LIA est sa simplicité ; l'infiltration peut être effectuée par le chirurgien en peropératoire ou par les anesthésistes à l'aide d'ultrasons. Les recharges postopératoires d'un ou plusieurs cathéters peuvent être effectuées facilement par une infirmière du service.
Inconvénients
Certains des inconvénients spécifiques de la LIA sont liés aux dangers potentiels de fournir un médicament puissant à proximité de structures articulaires délicates. L'anesthésique local peut être neurotoxique pour les petits nerfs lorsqu'il est administré à plusieurs reprises, bien que la ropivacaïne diluée se soit avérée sans danger pendant 2 à 3 jours de perfusion continue. Une préoccupation plus sérieuse peut être l'effet chondrotoxique, en particulier avec la bupivacaïne. Étant donné que dans la plupart des chirurgies de remplacement de la hanche et du genou, le cartilage est retiré dans le cadre de la procédure, cette considération peut ne pas être une préoccupation pratique. L'ajout d'AINS, d'inhibiteurs de la COX-2 ou de glucocorticoïdes peut ralentir ou altérer la cicatrisation ou la croissance des tissus, bien que l'impact pratique n'ait pas encore été démontré dans les études cliniques humaines chez les patients ayant une arthroplastie de la hanche ou du genou. Une préoccupation a été exprimée concernant un potentiel de risque accru d'infection par le LIA. Cette préoccupation découle principalement de l'utilisation postopératoire d'un cathéter avec le risque de contamination par de multiples injections ainsi que la migration des bactéries le long du cathéter à demeure, plutôt que de l'infiltration stérile faite pendant la chirurgie. Il est également théorisé que l'épinéphrine peut entraver la circulation, l'oxygénation et la fonction des macrophages. Pour minimiser le risque d'infection, il est important d'utiliser des procédures aseptiques strictes pour tous les appoints et renouvellements de perfusions.
ANALGÉSIE PAR INFILTRATION LOCALE POUR ARTHROPLASTIE DE HANCHE
Kehlet et al ont examiné six études disponibles en 2011, tandis que McCarthy et Iohom ont étendu l'examen en incluant des études supplémentaires supplémentaires. Depuis, les deux études de Rikalainen-Salimi et Murphy et al ont également été publiées. Les premières études de Kerr et Kohan et al et Otte et al ont rapporté une analgésie favorable et une mobilisation rapide avec LIA ; cependant, il n'y avait pas de groupes témoins. Dans les études de Parvataneni et al et Busch et al, la LIA a été comparée à l'analgésie opioïde intraveineuse. Les deux études ont rapporté des scores de douleur inférieurs avec le LIA ; l'étude de Parvataneni et al a réduit le séjour à l'hôpital de 1 jour avec LIA. Quatre études ont comparé LIA versus placebo.
Le premier essai contrôlé par placebo de Bianconi et al de 2003 n'a utilisé que 40 ml de ropivacaïne 5 mg/mL pour l'infiltration, mais la perfusion de 10 mg/h s'est poursuivie pendant 35 heures. Le groupe LIA avait des scores de douleur plus faibles au repos et pendant la mobilisation jusqu'à 72 heures après l'opération et un besoin plus faible d'opioïdes. L'étude d'Andersson et al a utilisé une infiltration, suivie d'un bolus le lendemain, et a démontré moins de douleur et de consommation d'opioïdes de 4 heures après l'opération jusqu'à 2 semaines, alors que la fonction articulaire était améliorée à 1 semaine. Murphy et al ont comparé l'infiltration avec 60 mL de lévobupivacaïne 2.5 mg/mL versus placebo. La consommation de morphine a été réduite de 4 % dans le groupe LIA au cours des 12 premières heures, mais la qualité de l'analgésie et les effets secondaires étaient similaires. Dans l'étude contrôlée par placebo de Lunn et al, le groupe placebo a reçu un régime analgésique multimodal optimal d'acétaminophène, d'élécoxib et de gabapentine avec des résultats égaux à ceux du groupe LIA. Andersen et al ont comparé la LIA avec des injections complémentaires à l'analgésie péridurale et ont trouvé moins de consommation d'opioïdes, une meilleure mobilisation et un séjour hospitalier plus court avec la LIA. Specht et al ont constaté qu'un bolus d'appoint à 10 et 22 heures n'était pas meilleur qu'un placebo chez les patients ayant reçu une LIA périopératoire. Rikalainen-Salmi et al ont comparé le LIA avec un complément le matin après la chirurgie à la morphine 0.1 mg administrée dans le cadre de la rachianesthésie. La technique LIA a permis une moindre consommation d'opioïdes le jour de l'intervention et une meilleure mobilisation précoce, sans différence sur les scores de douleur et la satisfaction des patients ; le complément LIA, cependant, n'a conféré aucun avantage. Pris ensemble, LIA semble être meilleur que le placebo pour la chirurgie de remplacement de la hanche, alors qu'en comparaison avec d'autres méthodes optimisées, les résultats sont mitigés. La question de savoir si les compléments des solutions LIA ont un effet local spécifique par rapport à l'administration systémique n'a pas été correctement étudiée en chirurgie de la hanche.
ANALGÉSIE PAR INFILTRATION LOCALE POUR ARTHROPLASTIE DU GENOU
Un large éventail de techniques LIA pour l'arthroplastie totale du genou a été décrit dans la littérature récente. Dans des études antérieures, le volume du mélange d'anesthésiques locaux et d'adjuvants utilisé était inférieur à 50 mL. Dans l'étude de Kerr et Kohan, un mélange de ropivacaïne (2 mg/mL, maximum 300 mg), de kétorolac (30 mg) et d'épinéphrine (10 μg/mL) a été dilué avec une solution saline jusqu'à un volume de 150 à 170 mL. Le mélange a été injecté dans les différentes structures du genou au cours de l'arthroplastie du genou en trois étapes : après préparation des surfaces osseuses (30 à 50 mL), après insertion des composants de la prothèse (35 à 50 mL) et dans le tissu sous-cutané (25 à 50 mL). mL). À la fin de la chirurgie, un cathéter péridural de calibre 18 a été inséré avec l'extrémité du cathéter placée en avant de la capsule postérieure, et 10 à 15 ml du mélange ont été injectés. Ce cathéter a été utilisé pour une nouvelle injection 15 à 20 heures après l'opération, lorsque 50 ml supplémentaires du mélange ont été injectés à travers le cathéter.
À notre connaissance, les premières études randomisées portant sur l'injection multimodale intra- ou périarticulaire de volume élevé de médicaments dans l'arthroplastie totale du genou ont été publiées par Busch et al et Vendittoli et al. Plusieurs revues concernant le LIA après arthroplastie totale du genou ont été publiées récemment. La revue la plus récente de Gibbs et al comprenait un total de 29 études randomisées. Cependant, ce nombre dans la revue de Gibbs et ses collègues comprenait également certaines études d'infiltration locale dans lesquelles de faibles volumes de LIA (<100 ml) étaient utilisés. La plupart des études individuelles manquaient de mise en aveugle adéquate. Cependant, lors de la comparaison de différentes modalités de traitement (par exemple, LIA vs analgésie péridurale), un essai approprié nécessiterait des procédures invasives dans le groupe placebo, ce qui peut être contraire à l'éthique et donc difficile à exécuter. Andersen et ses collègues ont mené une étude en double aveugle contrôlée par placebo chez des patients subissant une arthroplastie totale bilatérale du genou et ont démontré l'efficacité de la technique LIA. Cependant, sur la base des informations actuelles, l'efficacité d'une dose complémentaire postopératoire est discutable et peut comporter un risque d'infection. Néanmoins, plusieurs auteurs ont rapporté que les injections complémentaires postopératoires sont associées à une consommation moindre d'opioïdes et à des scores de douleur plus faibles. À ce jour, aucune étude n'a rapporté une augmentation de l'incidence des infections postopératoires avec les cathéters LIA.
Conseils NYSORA
La LIA présente-t-elle un bénéfice clinique suffisant pour justifier une utilisation clinique de routine ?
A. Chirurgie de remplacement de la hanche
La LIA n'est pas meilleure que la rachianesthésie préopératoire suivie d'une analgésie multimodale avec acétaminophène + AINS/inhibiteur de la COX-2 + glucocorticoïde ou gabapentinoïde.
Chez les patients chez qui la thérapie multimodale est contre-indiquée, la LIA peut être une méthode analgésique précieuse, réduisant le besoin d'opioïdes de secours.
B. Chirurgie de remplacement du genou
Oui, même avec une colonne vertébrale préopératoire optimale (ou d'autres blocs nerveux) et une analgésie multimodale systémique à trois composants, la LIA préopératoire fournit toujours une analgésie supplémentaire pendant 24 à 48 heures.
Par rapport à l'absence d'injections ou aux injections de solution saline, toutes les études ont montré que la LIA avait un effet analgésique bénéfique. Les deux études comparant le LIA au bloc du nerf fémoral ont cependant montré des résultats contradictoires. Alors que Toftdahl et ses collègues ont conclu que le LIA était supérieur à un bloc continu du nerf fémoral en ce qui concerne la consommation d'opioïdes et les scores de douleur au cours du premier jour postopératoire, Carli et al ont suggéré que le nerf fémoral est meilleur. Il convient de noter que les patients de l'étude de Carli et al ont reçu une infiltration de ropivacaïne, de kétorolac et d'épinéphrine dans la capsule postérieure de l'articulation du genou pendant la chirurgie (en plus du LIA ou du bloc nerveux fémoral). Les deux études comparant la LIA à l'analgésie péridurale (Tableau 1) ont démontré que le LIA peut réduire à la fois la consommation postopératoire d'opioïdes et les scores de douleur postopératoire.
TABLE 1. Comparaison de l'analgésie par infiltration locale avec d'autres techniques.
| Auteur (Référence Nombre) | Patients (n) | Groupes Peropératoire | Traitement peropératoire | Groupes Postopératoire | Traitement Postopératoire | Conclusions de la LIA |
|---|---|---|---|---|---|---|
| 1. Études comparant la LIA à l'absence d'injections ou aux injections de solution saline | ||||||
| Busch et coll. (2006) 37 | 64 | LIA (100 ml) Pas d'injection | 400 mg de ropivacaïne 30 mg de kétorolac 5 mg d'épimorphine 0.6 mg d'épinéphrine | Tous les patients | Pas d'injections dans le genou Morphine PCA | Consommation d'opioïdes ↓ (0h24 à XNUMXhXNUMX) Douleur ↓ (0–4 h) |
| Venditoli et al (2006) 38 | 42 | LIA (160 ml) Pas d'injection | 275 mg de ropivacaïne 30 mg de kétorolac 0.5 mg d'épinéphrine | LIA (15 ml) Pas d'injection | 150 mg de ropivacaïne après 16 à 24 h | Consommation d'opioïdes ↓ (0h48 à XNUMXhXNUMX) Douleur ↓ (0–48 h) |
| Andersen et coll. (2008) 8 | 12 (24 genoux) | LIA (170 ml) Contrôle | 340 mg de ropivacaïne 1.7 mg d'épinéphrine Solution saline (170 ml) | LIA Contrôle | 8h : 40 mg de ropivacaïne + 0.2 mg épinéphrine (20 ml) 24h : 100 mg de ropivacaïne + 0.5 mg épinéphrine (50 ml) 8 h + 24 h : solution saline (20 + 50 mL) | Douleur ↓ (0–24 h) |
| Kazak et al. (2010) 45 | 60 | LIA (150 ml) LIA (150 ml) Contrôle | 200 mg de bupivacaïne 0.5 mg épinéphrine 200 mg de lévobupivacaïne 0.5 mg d'épinéphrine Solution saline (150 ml) | LIA (25 ml) LIA (25 ml) Contrôle | 10h + 22h : 120 mg de bupivacaïne 10 h + 22 h : 120 mg lévobupivacaïne + 0.5 mg d'épinéphrine 10 h + 22 h : solution saline (25 mL + 25 mL) | Consommation d'opioïdes ↓ (0h48 à XNUMXhXNUMX) Douleur ↓ (0–48 h) |
| Essving et coll. (2010) 43 | 48 | LIA (166 ml) Pas d'injection | 400 mg de ropivacaïne 30 mg de kétorolac 0.5 mg d'épinéphrine | LIA (22 ml) Contrôle | 21h : 200 mg de ropivacaïne + 30 mg kétorolac + 0.1 mg d'épinéphrine 21 h : solution saline (22 ml) | Consommation d'opioïdes ↓ (0h48 à XNUMXhXNUMX) Douleur ↓ (0–27 h) |
| 2. Études comparant le LIA au bloc du nerf fémoral | ||||||
| Carli et coll. (2010)46 | 40 | LIA (102 ml) → péri- et intra-articulaire BFN (8mL) Tous les patients : → Infiltrations postopératoire gélule (51 ml) | 200 mg de ropivacaïne 30 mg de kétorolac 0.5 mg d'épinéphrine + 8 ml de solution saline dans cathéter fémoral 16 mg de ropivacaïne + 100 mL solution saline en périarticulaire cathéter 100 mg de ropivacaïne 15 mg de kétorolac 0.25 mg d'épinéphrine | LIA (50) ml FNB | 24h : 250 mg de ropivacaïne + 30 mg kétorolac + 0.25 mg d'épinéphrine + 8 ml/h de solution saline par voie fémorale cathéter pendant 48 h Ropivacaïne 2 mg/mL 8mL/h pour 48 h + 50 mL de solution saline en périarticulaire cathéter 24 h après la chirurgie | Consommation d'opioïdes ↑ (0–48 h) pour LIA groupe (péri- et intra-articulaire infiltrations) |
| Toftdahl et coll. (2007)44 | 77 | LIA (152 ml) BFN (20 ml) | 300 mg de ropivacaïne 30 mg de kétorolac 0.5 mg d'épinéphrine 200 mg de ropivacaïne 4 mg de morphine + 50 mg de bupivacaïne par drain (intra-articulaire) | LIA (22 ml) FNB | 12 h + 24 h : 200 mg de ropivacaïne + 30 mg de kétorolac + 0.5 mg d'épinéphrine Ropivacaïne 2 mg/mL à 10 mL/h pendant 48 h | Consommation d'opioïdes ↓ (0–24 h) Douleur ↓ (0–24 h) |
| 3. Études comparant la LIA à l'analgésie péridurale | ||||||
| Andersen et coll. (2010)47 | 40 | LIA (152 ml) EDA | 300 mg de ropivacaïne 30 mg de kétorolac 0.5 mg d'épinéphrine Dose test 3 mL : lidocaïne + épinéphrine | LIA EDA | Perfusion continue à 4 mL/h pendant 48 h (380 mg de ropivacaïne, 60 mg de kétorolac) Perfusion continue à 4 mL/h pendant 48 h (ropivacaïne 2 mg/mL) Kétorolac 15 mg IV × 6 | Consommation d'opioïdes ↓ (0–48 h) Douleur ↓ (0–72 h) |
| Spreng et coll. (2010)14 | 99 | LIA (150 ml) LIA IV (150mL) EDA | 150 mg de ropivacaïne 30 mg de kétorolac 5 mg de morphine 0.5 mg d'épinéphrine 6 ml de solution saline IV 150 mg de ropivacaïne 0.5 mg d'épinéphrine 6 ml de solution saline (LIA) 30 mg de kétorolac IV 5 mg de morphine IV Dose test 3 mL : lidocaïne + épinéphrine | LIA (20 ml) LIA IV (20 ml) EDA | 22–24 h : 142.5 mg de ropivacaïne + 30 mg de kétorolac 1 ml de solution saline IV 22–24 h : 142.5 mg de ropivacaïne + 1 mL de sérum physiologique (LIA) 1 ml de kétorolac IV 6–10 mL/h pendant 48h : fentanyl 2 μg/mL + bupivacaïne 1 mg/mL + épinéphrine 1 μg/mL | Consommation d'opioïdes ↓ (0–72 h) Douleur ↓ (24–72 h) |
| 4. Études comparant différentes techniques LIA | ||||||
| Andersen et coll. (2008)49 | 48 | LIA ± bandage compressif | 340 mg de ropivacaïne 1 mg d'épinéphrine (170 ml) | LIA ± bandage compressif | 6 h + 12 h : 40 mg de ropivacaïne + 0.2 mg d'épinéphrine (20 mL) 24 h : 100 mg d'épinéphrine (50 ml) | Douleur ↓ (0–8h) avec bandage compressif |
| Andersen et coll. (2010;p984) | 43 | Tous les patients : LIA (150 ml) | 300 mg de ropivacaïne 1 mg d'épinéphrine | LIA (20 ml) LIA (10 ml) | 6 h + 24 h : ropivacaïne 5 mg/mL 6 h + 24 h : ropivacaïne 10 mg/mL | Pas de différences entre les groupes |
| Andersen et coll. (2010;p543)42 | 16 (32 genoux) | LIA (150 ml) LIA (100 ml) | 200 mg de ropivacaïne 1 mg d'épinéphrine 100 mg de ropivacaïne aux couches superficielles 200 mg de ropivacaïne 1 mg d'épinéphrine 50 ml de solution saline pour les couches superficielles | LIA (20 ml) Contrôle (20 ml) | 24 h : 100 mg de ropivacaïne en sous-cutané 24 h : solution saline en sous-cutané | Douleur ↓ (0–6 h) avec infiltration des couches superficielles, mais pas de différence après 24 h |
| Andersen et coll. (2010;p904) | 60 | Tous les patients : LIA (150 ml) | 300 mg ropivacaïne 1 mg épinéphrine | LIA (20 ml) intracapsulaire LIA (20 ml) intra-articulaire | 6h + 24h : 100 mg de ropivacaïne | Aucune différence entre les groupes |
| Andersen et coll. (2008;p800)49 | 32 | Tous les patients : LIA (170 ml) | 340 mg ropivacaïne 1.2 mg épinéphrine | LIA LIA | 6 h + 12 h + 24 h : 40 mg de ropivacaïne + 0.2 mg d'épinéphrine (20 mL). 60 mg supplémentaires de ropivacaïne + 0.3 mg d'épinéphrine (30 mL) pendant rétraction du cathéter 6 h + 12 h + 24 h : 40 mg de ropivacaïne + 0.2 mg d'épinéphrine (20 mL). 30 ml supplémentaires de solution saline pendant rétraction du cathéter | Aucune différence entre les groupes |
| Spreng et coll. (2010) 14 | 99 | LIA (150 ml) LIA IV (150 ml) EDA | 150 mg de ropivacaïne 30 mg de kétorolac 5 mg de morphine 0.5 mg d'épinéphrine 6 ml de solution saline IV 150 mg de ropivacaïne 0.5 mg d'épinéphrine 6 ml de solution saline (LIA) 30 mg de kétorolac IV 5 mg de morphine IV Dose test 3 mL : lidocaïne + épinéphrine | LIA (20 ml) LIA IV (20 ml) EDA | 22–24 h : 142.5 mg de ropivacaïne + 30 mg kétorolac 1 ml de solution saline IV 22–24 h : 142.5 mg de ropivacaïne + 1 mL solution saline (LIA) 1 ml de kétorolac IV 6–10 mL/h pendant 48 h (fentanyl 2 μg/mL + bupivacaïne 1 mg/mL + épinéphrine 1 μg/mL) | Consommation d'opioïdes ↓ (0–72 h) lorsque kétorolac et la morphine étaient infiltré dans le genou Douleur ↓ (0–72 h) quand kétorolac et la morphine étaient infiltré dans le genou |
| Andersen et coll. (2013) 48 | 60 | LIA (151 ml) LIA (151 ml) | 300 mg de ropivacaïne 30 mg de kétorolac 300 mg de ropivacaïne 1 ml de solution saline | LIA (10 ml) LIA (10 ml) | Toutes les 6 h pendant 48 h : 100 mg de ropivacaïne + 15 mg de kétorolac Toutes les 6 h pendant 48 h : 100 mg de ropivacaïne + 1mL | Consommation d'opioïdes ↓ (0–48 h) dans le groupe kétorolac Douleur ↓ (0–48 h) dans le groupe kétorolac |
EDA = analgésie péridurale ; IV = intraveineux ; LIA = analgésie par infiltration locale ; FNB = bloc nerveux fémoral ; PCA = analgésie contrôlée par le patient.
De plus, le LIA était associé à une mobilisation plus rapide et à une préparation plus précoce à la sortie de l'hôpital. La recette LIA (c'est-à-dire le volume, le contenu ainsi que l'utilisation d'adjuvants) n'est pas bien définie. Deux études récemment publiées ont montré que le kétorolac est un facteur important dans le mélange LIA. De plus, Spreng et ses collègues ont montré que l'administration locale de kétorolac et de morphine peut également avoir un effet local. L'application d'un bandage compressif pendant 24 heures après l'opération et l'infiltration des couches superficielles de l'articulation du genou avec des anesthésiques locaux sont également importantes pour l'efficacité de la LIA. Plusieurs études récentes ont été publiées concernant la perfusion continue d'anesthésiques locaux avec ou sans adjuvants. Gomez-Cardero et Rodriguez-Merchán50 ont comparé le LIA continu pendant 60 heures (ropivacaïne) avec un placebo et ont constaté une réduction de la consommation d'opioïdes et des scores de douleur pendant les 3 premiers jours après la chirurgie. Ong et ses collègues ont examiné l'utilisation d'une perfusion intra-articulaire continue ou d'une dose bolus et ont démontré une réduction de la consommation d'opioïdes et des scores de douleur inférieurs par rapport au traitement de la douleur par voie intraveineuse uniquement.
RECETTES D'ANALGESIE D'INFILTRATION LOCALE
LIA en arthroplastie totale du genou
La recette LIA
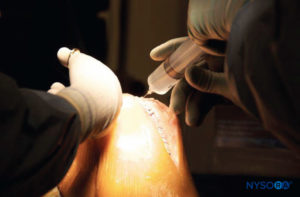
La solution, qui est infiltrée dans le genou, doit être préparée dans des conditions aseptiques (Figure 1). Le volume total de la solution est de 150 mL et contient les éléments suivants :
• 200 mg de ropivacaïne (2 mg/mL) (la quantité de ropivacaïne infiltrée dans les études publiées variait : 150 mg, 200 mg, 300 mg, 1 400 mg)
• 30 mg de kétorolac (30 mg/mL)
• 0.5 mg d'épinéphrine (1 mg/mL)
• Solution saline isotonique (dilution à 150 ml au total)

FIGURE 1. Au bloc opératoire, une poche stérile contenant de la ropivacaïne de la pharmacie reçoit l'ajout de 30 mg (1 mL) de kétorolac et 0.5 mg (0.5 mL) d'épinéphrine.
Conseils NYSORA
Bien qu'il existe de nombreuses recettes, la formule suivante est efficace pour la chirurgie de remplacement du genou et de la hanche :
• Volume total 150 mL (ajouter une solution saline normale selon le nombre de millilitres utilisés par les autres médicaments)
• 200 mg de ropivacaïne (utiliser n'importe quelle préparation pratique : 2, 5, 7.7 mg/mL, diluée)
• 30 mg de kétorolac
L'ajout d'épinéphrine (p. ex., 0.5 mg dans 150 mL) peut avoir un effet bénéfique sur l'hémostase.
La solution, qui est infiltrée dans le cathéter du genou en postopératoire (dose complémentaire), doit également être préparée dans des conditions aseptiques. Le volume total de la solution doit être de 15 à 20 ml pour chaque injection et contient les éléments suivants :
• 150 mg de ropivacaïne (5 à 7.5 mg/mL)
• 30 mg de kétorolac (30 mg/mL)
• Solution saline isotonique (dilution à 15-20 mL au total)
Technique d'injection
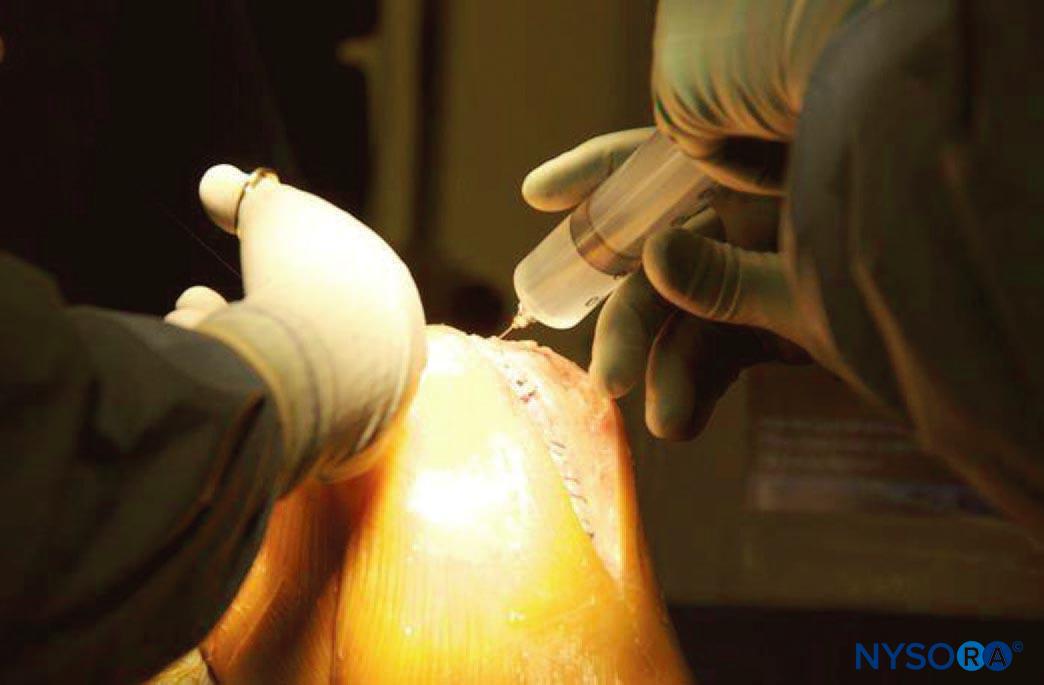
• Après préparation chirurgicale de l'articulation du genou, 40 mL de la solution LIA sont infiltrés dans les structures capsulaires postérieures par le chirurgien orthopédique. Une « technique de l'aiguille mobile » est préférable (Figure 2, zone marquée I).
• Après l'arthroplastie, 50 à 60 mL de la solution sont infiltrés circulairement autour de la prothèse (Figure 2, zone marquée IIa et IIb).
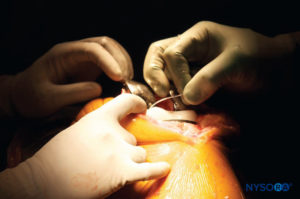
• Un cathéter péridural de calibre 18 avec un filtre bactérien peut être placé du côté latéral dans l'articulation du genou (facultatif) (Figure 2, ligne sinusoïdale, marquée III ;Figure 3).
• Après fermeture de la capsule, 50 mL supplémentaires de la solution sont infiltrés dans le fascia et le sous-cutané (Figure 4).
• Si un cathéter est utilisé, 10 ml de la solution sont injectés par le cathéter du genou à la fin de la chirurgie pour vérifier l'écoulement du liquide (Figure 5).
• Injections complémentaires aseptiques dans le cathéter du genou (15 à 20 ml, selon la taille réelle du genou) après 8, 16 et 24 heures (Figure 6).
• Le cathéter du genou est retiré lors de la dernière injection et ensuite étendu dans le fascia et le sous-cutané.
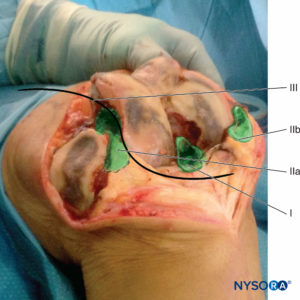
FIGURE 2. Technique d'injection LIA en quatre étapes chez les patients subissant une arthroplastie du genou.
FIGURE 5. La dernière injection à travers le cathéter : 10 mL pour l'analgésie et pour tester le cathéter.
FIGURE 6. Sites d'infiltration de LIA dans une arthroplastie de hanche : zone bleue transparente pour la première injection (voir texte) et zone verte transparente pour la deuxième injection.
LIA en arthroplastie totale de la hanche
Le cocktail LIA
La solution cocktail LIA, infiltrée dans la hanche, doit être préparée dans des conditions aseptiques (Figure 1). Le volume total de la solution est de 100 mL et contient les éléments suivants :
• 200 mg de ropivacaïne (2 mg/mL)
• 30 mg de kétorolac (30 mg/mL)
• 0.5 mg d'épinéphrine (1 mg/mL)
• Solution saline isotonique (dilution à 100 ml au total)
Technique d'injection
Selon la taille de l'incision chirurgicale et le choix de l'abord chirurgical, 100 mL de la solution LIA sont injectés en deux temps :
• Après préparation chirurgicale de l'acétabulum, 50 mL de la solution sont infiltrés dans les structures capsulaires (s'il en reste), dans les muscles adducteurs et dans le muscle gluteus medius.
Conseils NYSORA
Devrions-nous inclure des cathéters pour perfusion/remplissage péri- ou intra-articulaire lors de l'utilisation de LIA ?
• Non, il existe des preuves solides de l'absence de bénéfice du cathéter après une prothèse de hanche.
• Après une prothèse du genou, les preuves sont plus contradictoires, indiquant pour la plupart aucun effet supplémentaire par rapport à l'analgésie systémique multimodale optimale, mais un certain effet si tous les composants des régimes multimodaux ne sont pas utilisés.
• Un rapport récent d'un taux accru d'infections par des cathéters, ajouté à des rapports anecdotiques de résultats similaires, a ajouté à la preuve en défaveur de l'utilisation de cathéters.
• Après insertion du composant fémoral, 50 mL supplémentaires sont infiltrés dans les rotateurs externes (muscle quadratus femoris, muscle obturateur et tendon du muscle grand fessier) (Figure 6).
Références
- Kerr DR, Kohan L : Analgésie par infiltration locale : une technique pour le contrôle de la douleur postopératoire aiguë après une chirurgie du genou et de la hanche : une étude de cas de 325 patients. Acta Orthop 2008;79:174–183.
- Goodwin RC, Amjadi F, Parker RD : effets analgésiques à court terme des injections intra-articulaires après arthroscopie du genou. Arthroscopie 2005 ;21 : 307–312.
- Brummett CM, Williams BA : Additifs aux anesthésiques locaux pour le bloc nerveux périphérique. Int Anesthesiol Clin 2011;49:104–116.
- Ilfeld BM : Blocs nerveux périphériques continus : Une revue des preuves publiées. Anesth Analg 2011;113:904–925.
- Smoot JD, Bergese SD, Onel E, et al : L'efficacité et l'innocuité de la bupivacaïne DepoFoam chez les patientes subissant une plastie mammaire d'augmentation bilatérale, cosmétique et sous-musculaire : une étude randomisée, à double insu et à contrôle actif. Esthet Surg J 2012;32:69–76.
- Kehlet H, Andersen LO : Analgésie par infiltration locale dans le remplacement articulaire : preuves et recommandations pour la pratique clinique. Acta Anesthesiol Scand 2011;55:778–784.
- Raeder J, Spreng UJ : Anesthésie par infiltration locale (LIA) : La gestion de la douleur post-opératoire revisitée et appréciée par les chirurgiens ? Acta Anaesthesiol Scand 2011;55:772–774.
- Andersen LO, Husted H, Otte KS, et al : Analgésie par infiltration à volume élevé dans l'arthroplastie totale du genou : essai randomisé, en double aveugle et contrôlé par placebo. Acta Anesthesiol Scand 2008;52:1331–1335.
- Aasbo V, Thuen A, Raeder J : Amélioration de l'analgésie postopératoire de longue durée, de la fonction de récupération et de la satisfaction du patient après la réparation d'une hernie inguinale avec bloc de champ inguinal par rapport à l'anesthésie générale. Acta Anaesthesiol Scand 2002;46:674–678.
- Parker RD, Streem K, Schmitz L, Martineau PA : Efficacité de la perfusion intra-articulaire continue de bupivacaïne pour l'analgésie postopératoire après reconstruction du ligament croisé antérieur : Une étude en double aveugle, contrôlée par placebo, prospective et randomisée. Am J Sports Med 2007; 35:531–536.
- Rosseland LA, Helgesen KG, Breivik H, Stubhaug A : Une douleur modérée à sévère après arthroscopie du genou est soulagée par une solution saline intra-articulaire : un essai contrôlé randomisé. Anesth Analg 2004;98:1546–1551, tableau.
- Lenz H, Raeder, Heyerdahl F, et al : Modulation de l'hyperalgésie post-infusion induite par le rémifentanil par le parécoxib ou le kétorolac chez l'homme. Douleur 2011 ; 100–110.
- Dye SF: La physiopathologie de la douleur fémoro-patellaire: Une perspective d'homéostasie tissulaire. Clin Orthop Relat Res 2005;100–110.
- Spreng UJ, Dahl V, Hjall A, et al : Analgésie par infiltration locale à volume élevé associée à du kétorolac + morphine par voie intraveineuse ou locale par rapport à une analgésie péridurale après une arthroplastie totale du genou. Br J Anaesth 2010;105 : 675–682.
- Affas F, Nygards EB, Stiller CO, et al : Contrôle de la douleur après une arthroplastie totale du genou : un essai randomisé comparant l'anesthésie par infiltration locale et le bloc fémoral continu. Acta Orthop 2011;82(4):441–447.
- Lund J, Jenstrup MT, Jaeger P, et al : bloc canal adducteur continu pour l'analgésie postopératoire adjuvante après une chirurgie majeure du genou : résultats préliminaires. Acta Anaesthesiol Scand 2011;55:14–19.
- Essving P, Axelsson K, Åberg E, et al : analgésie par infiltration locale (LIA) vs morphine intrathécale pour la gestion de la douleur postopératoire après une arthroplastie totale du genou. Un essai randomisé et contrôlé. Anesth Analg 2011;113 : 926–933.
- Sites BD, Beach M, Gallagher JD, et al : Un bloc nerveux fémoral assisté par ultrasons à injection unique fournit une analgésie épargnant les effets secondaires par rapport à la morphine intrathécale chez les patients subissant une arthroplastie totale du genou. Anesth Analg 2004;99:1539–1543.
- Hval K, Thagaard KS, Schlichting E, Raeder J : L'effet analgésique postopératoire prolongé lorsque la dexaméthasone est ajoutée à un anti-inflammatoire non stéroïdien (rofécoxib) avant la chirurgie mammaire. Anesth Analg 2007;105:481–486.
- Zhang J, Ho KY, Wang Y : Efficacité de la prégabaline dans la douleur postopératoire aiguë : une méta-analyse. Br J Anaesth 2011;106:454–462.
- Banques A : Innovations dans la gestion de la douleur postopératoire : Perfusion continue d'anesthésiques locaux. AORN J 2007;85:904–914.
- Piper SL, Kramer JD, Kim HT, Feeley BT : Effets des anesthésiques locaux sur le cartilage articulaire. Am J Sports Med 2011;39:2245–2253.
- McCarthy D, Iohom G : Analgésie par infiltration locale pour le contrôle de la douleur postopératoire après une arthroplastie totale de la hanche : une revue systématique. Anesthesiol Res Pract 2012;2012:709531.
- Rikalainen-Salmi R, Forster JG, Makela K, et al : Analgésie par infiltration locale avec la lévobupivacaïne comparée à la morphine intrathécale chez les patients ayant subi une arthroplastie totale de la hanche. Acta Anaesthesiol Scand 2012 ; 56 : 695–705.
- Murphy TP, Byrne DP, Curtin P, et al : une injection périarticulaire de lévobupivacaïne peut-elle réduire la consommation postopératoire d'opiacés lors d'une arthroplastie primaire de la hanche ? Clin Orthop Relat Res 2012;470:1151–1157.
- Otte K, Husted H, Andersen L, et al : Analgésie par infiltration locale dans l'arthroplastie totale du genou et le resurfaçage de la hanche : une étude méthodologique. Douleur aiguë 2008;10:111–116.
- Parvataneni HK, Shah VP, Howard H, et al : Contrôle de la douleur après une arthroplastie totale de la hanche et du genou à l'aide d'un protocole multimodal avec des injections périarticulaires locales : une étude prospective randomisée. J Arthroplastie 2007;22:33–38.
28. Busch CA, Whitehouse MR, Shore BJ, et al : L'efficacité de l'infiltration médicamenteuse multimodale périarticulaire dans l'arthroplastie totale de la hanche. Clin Orthop Relat Res 2010;468:2152–2159. - Bianconi M, Ferraro L, Traina GC, et al : Pharmacocinétique et efficacité de l'instillation continue de ropivacaïne après une chirurgie de remplacement articulaire. Br J Anaesth 2003;91:830–835.
- Andersen LJ, Poulsen T, Krogh B, Nielsen T : Analgésie postopératoire dans l'arthroplastie totale de la hanche : étude randomisée en double aveugle et contrôlée par placebo sur l'infiltration peropératoire et postopératoire de ropivacaïne, de kétorolac et d'adrénaline. Acta Orthop 2007;78:187–192.
- Lunn TH, Husted H, Solgaard S, et al : Analgésie par infiltration locale peropératoire pour l'analgésie précoce après une arthroplastie totale de la hanche : Un essai randomisé, en double aveugle et contrôlé par placebo. Reg Anesth Pain Med 2011;36 : 424–429.
- Andersen KV, Pfeiffer-Jensen M, Haraldsted V, Soballe K : Réduction du séjour à l'hôpital et de la consommation de narcotiques, et amélioration de la mobilisation avec infiltration locale et intra-articulaire après arthroplastie de la hanche : essai clinique randomisé d'une technique intra-articulaire par rapport à une perfusion péridurale chez 80 patients. Acta Orthop 2007;78:180–186.
- Specht K, Leonhardt JS, Revald P, et al : aucune preuve d'un effet cliniquement important de l'ajout d'une analgésie par perfusion locale administrée par un cathéter dans le traitement de la douleur après une arthroplastie totale de la hanche. Acta Orthop 2011;82:315–320.
- Badner NH, Bourne RB, Rorabeck CH, et al : injection intra-articulaire de bupivacaïne dans les opérations de remplacement du genou. Résultats d'utilisation pour l'analgésie et pour le bloc préemptif. J Bone Joint Surg Am 1996;78:734–738.
- Mauerhan DR, Campbell M, Miller JS, et al : morphine intra-articulaire et/ou bupivacaïne dans la prise en charge de la douleur après une arthroplastie totale du genou. J Arthroplasty 1997;12:546–552.
- Ritter MA, Koehler M, Keating EM, et al : morphine intra-articulaire et/ou bupivacaïne après arthroplastie totale du genou. J Bone Joint Surg Br 1999; 81:301–303.
- Busch CA, Shore BJ, Bhandari R, et al : Efficacité de l'injection de médicament multimodale périarticulaire dans l'arthroplastie totale du genou. Un essai randomisé. J Bone Joint Surg Am 2006;88:959–963.
- Vendittoli PA, Makinen P, Drolet P, et al : Un protocole d'analgésie multimodale pour l'arthroplastie totale du genou. Une étude randomisée et contrôlée. J Bone Joint Surg Am 2006;88:282–289.
- Morin AM, Wulf H : Analgésie par infiltration locale à haut volume (LIA) pour l'arthroplastie totale de la hanche et du genou : Un bref examen de l'état actuel [en allemand]. Anasthesiol Intensivmed Notfallmed Schmerzther 2011;46 : 84–86.
40. Ganapathy S, Brookes J, Bourne R : Analgésie par infiltration locale. Anesthesiol Clin 2011;29:329–342. - Gibbs DM, Green TP, Esler CN : L'infiltration locale de l'analgésie après une arthroplastie totale du genou : une revue de la littérature actuelle. J Bone Joint Surg Br 2012;94:1154–1159.
- Andersen LO, Husted H, Kristensen BB, et al : Efficacité analgésique de l'infiltration anesthésique locale sous-cutanée de la plaie dans l'arthroplastie bilatérale du genou : Un essai randomisé, contrôlé par placebo, en double aveugle. Acta Anesthesiol Scand 2010;54:543–548.
- Essving P, Axelsson K, Kjellberg J, et al : réduction de la consommation de morphine et de l'intensité de la douleur avec l'analgésie par infiltration locale (LIA) après une arthroplastie totale du genou. Acta Orthop 2010;81:354–360.
- Toftdahl K, Nikolajsen L, Haraldsted V, et al : Comparaison de l'analgésie péri- et intra-articulaire avec le bloc nerveux fémoral après arthroplastie totale du genou : un essai clinique randomisé. Acta Orthop 2007;78 : 172–179.
- Kazak BZ, Aysu SE, Darcin K, et al : L'administration intra-articulaire de lévobupivacaïne ou de bupivacaïne diminue les scores de douleur et permet une meilleure récupération après une arthroplastie totale du genou. J Anesth 2010;24:694–699.
- Carli F, Clemente A, Asenjo JF, et al : Analgésie et résultat fonctionnel après arthroplastie totale du genou : infiltration périarticulaire vs bloc nerveux fémoral continu. Br J Anaesth 2010;105:185–195.
- Andersen KV, Bak M, Christensen BV, et al : Un essai contrôlé randomisé comparant l'analgésie par infiltration locale à la perfusion épidurale pour l'arthroplastie totale du genou. Acta Orthop 2010;81:606–610.
- Andersen KV, Nikolajsen L, Haraldsted V, et al : Infiltration locale
analgésie pour arthroplastie totale du genou : Faut-il ajouter du kétorolac ? Br J Anaesth 2013;111:242–248. - Andersen LO, Husted H, Otte KS, et al : Un bandage compressif améliore
analgésie par infiltration locale dans les prothèses totales de genou. Acta Orthop 2008;79:806–811. - Gomez-Cardero P, Rodriguez-Merchan EC : Analgésie postopératoire chez
PTG : Ropivacaïne en perfusion intra-articulaire continue. Clin Orthop Relat Res 2010;468:1242–1247. - Ong JC, Chin PL, Fook-Chong SM, et al : Infiltration continue d'anesthésique local après une arthroplastie totale du genou. J Orthop Surg (Hong Kong)
2010; 18: 203207. - Essving P, Axelsson K, Kjellberg J, et al : Réduction du séjour à l'hôpital, de la consommation de morphine et de l'intensité de la douleur avec analgésie par infiltration locale après
prothèse unicompartimentale du genou. Acta Orthop 2009;80:213–219. - Ali A, Sundberg M, Hansson U, Malmvik J, Flivik G : Effet douteux de
analgésie intra-articulaire continue après arthroplastie totale du genou. Acta Orthop 2015;86:373–377.