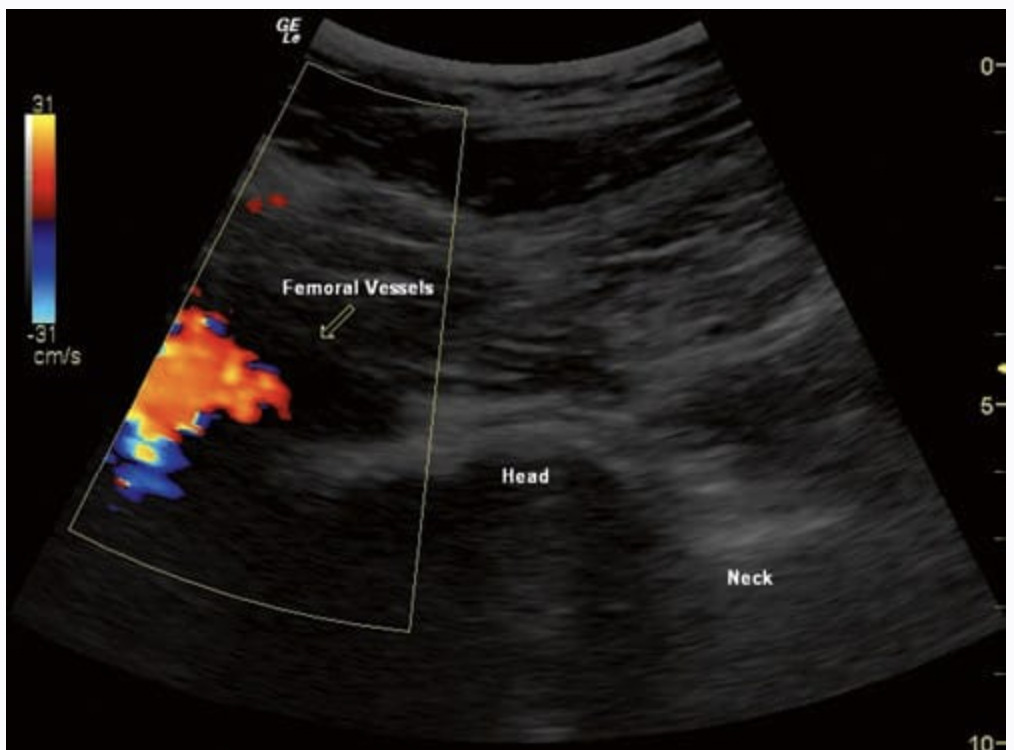
Pendant une grande partie de la dernière décennie, la fluoroscopie s'est imposée comme l'outil d'imagerie préféré de nombreux praticiens effectuant des douleur interventionnelle procédures. Tout récemment, l’échographie est devenue un « challenger » pour cette modalité bien établie. La popularité croissante de l'application des ultrasons en anesthésie régionale et en médecine de la douleur reflète un changement dans les opinions contemporaines sur l'imagerie pour la localisation nerveuse et les injections spécifiques à une cible. Pour l'anesthésie régionale, l'échographie a déjà eu un impact marqué en transformant une pratique clinique désuète en une science moderne. Aucun outil de chevet n'a jamais permis aux praticiens de visualiser l'avancement de l'aiguille en temps réel et d'observer la propagation de l'anesthésique local autour des structures nerveuses. Pour les procédures interventionnelles contre la douleur, cette technologie sans rayonnement au point d'intervention trouvera également son rôle et son utilité uniques dans la médecine de la douleur et pourra compléter certaines des demandes d'imagerie non satisfaites par la fluoroscopie, la tomodensitométrie et l'imagerie par résonance magnétique. Et au fil du temps, les praticiens découvriront de nouveaux avantages de cette technologie, notamment pour l’évaluation dynamique des douleurs musculo-squelettiques et l’amélioration de la précision de l’injection à l’aiguille pour les petits nerfs, les tendons des tissus mous et les articulations.
1. INTRODUCTION
Les procédures interventionnelles de la douleur sont généralement réalisées soit avec une fluoroscopie guidée par l'image, une tomodensitométrie (TDM) ou une échographie (US) ou sans guidage par l'image utilisant des repères de surface. Récemment, des suites d'angiographie rotationnelle tridimensionnelle (3D-RA) également connues sous le nom de tomodensitométrie à détecteur plat (FDCT) ou de tomodensitométrie à faisceau conique (CBCT) et d'angiographie par soustraction numérique (DSA) ont été introduites comme compléments d'imagerie. Ces systèmes sont révélateurs d'une tendance à l'utilisation accrue de techniques de visualisation spécialisées. Les lignes directrices sur la pratique de la médecine de la douleur suggèrent que la plupart des procédures nécessitent un guidage par image pour améliorer l'exactitude, la reproductibilité (précision), la sécurité et les informations de diagnostic dérivées de la procédure [1]. Historiquement, les praticiens de la médecine de la douleur ont adopté lentement les techniques de guidage par image, en grande partie parce que la spécialité parentale la plus courante (anesthésiologie) avait une culture d'utilisation de repères de surface pour faciliter la performance périopératoire de divers blocs nerveux et placements de lignes vasculaires [2]. En effet, certains praticiens de la médecine de la douleur dans les années 1980 et au début des années 1990 estimaient que les études prônant l'inexactitude des injections péridurales de stéroïdes effectuées avec des repères de surface [3] étaient publiées davantage pour l'accès à la spécialité que pour accroître la sécurité des patients ou améliorer les résultats.
L'échographie a récemment explosé en popularité pour le bloc régional périopératoire, mais l'utilisation d'autres modalités d'imagerie dans le domaine périopératoire, par exemple la fluoroscopie, a pris du retard, malgré des placements plus précis par rapport aux placements basés sur des repères de surface [2]. Les coûts d'acquisition de la technologie et l'apprentissage requis par le médecin pour maîtriser les nouvelles technologies sont des obstacles importants à la mise en œuvre complète de nombreux systèmes d'imagerie avancés. Cependant, l'accent national croissant sur la sécurité en médecine clinique peut finalement rendre obligatoire l'utilisation d'un guidage par image optimal pour certaines procédures. Dans la plupart des cas, les études manquent pour comparer les différents types de guidage par imagerie en termes de résultats pour les patients, de sécurité et de valeur de coût pour des procédures spécifiques. Ceci est encore compliqué par le fait que de nombreuses procédures en médecine de la douleur ont été considérées comme mal validées pour les conditions traitées [4-6]. Ainsi, peu importe si une technique de guidage par image particulière améliore la fiabilité d'une procédure donnée, si cette procédure perd finalement la faveur en raison de preuves médiocres ou d'un manque de preuves. La question de savoir si l'imagerie de haute technologie apporte de la sécurité et/ou des économies de coûts à la performance des procédures de douleur fondées sur des preuves est donc d'une importance primordiale. Les risques du guidage d'image doivent également être considérés comme faisant partie de toute technologie d'imagerie jugée nécessaire pour une utilisation de routine. Par exemple, un rapport risque/bénéfice de la tomodensitométrie par rapport à une technique alternative tout aussi appropriée peut forcer les médecins à utiliser la technologie la moins performante dans certains cas. La tomodensitométrie en tant qu'outil de diagnostic a fait l'objet d'un examen plus approfondi avec la publication récente de plusieurs essais décrivant l'augmentation fulgurante de la performance annuelle des tomodensitogrammes (maintenant plus de 72 millions par an) et les fortes doses de rayonnement reçues par les adultes et en particulier les enfants [7 ]. Le risque de cancer lié au rayonnement CT a été modélisé à partir d'études longitudinales sur les occurrences de cancer chez les survivants de la bombe atomique [8]. Maintenant, il semble que le risque de cancer soit quelque chose qui devrait être plus activement pris en compte lorsque la tomodensitométrie est utilisée. Les risques de rayonnement ne sont pas négligeables et s'élèvent probablement à environ 14,000 2007 décès futurs ou plus par cancer à la suite des tomodensitogrammes de 7 [XNUMX]. Pour ceux qui traitent des patients souffrant de douleur chronique, il suffit de considérer combien de patients avec un diagnostic insaisissable reçoivent une imagerie avancée dans le but de trouver la cause de cette douleur. Ainsi, répéter des études d'imagerie avec un rendement assez faible peut en fait nuire à nos patients. Le guidage par ultrasons, objet de cet atlas, a de nombreux défenseurs de ces mêmes problèmes de radioprotection [9]. L'utilisation de l'échographie, cependant, est limitée chez de nombreux adultes obèses ou plus grands [10], et le coût de certains systèmes avancés capables de rendre des structures plus profondes avec une grande clarté peut dépasser le coût des fluoroscopes dans certains cas. L'utilisation de modalités d'imagerie telles que 3D-RA et DSA est préconisée par d'autres. Alors qu'une suite FDCT est extrêmement coûteuse, la DSA est en fait un complément relativement peu coûteux à un fluoroscope conventionnel qui peut jouer un rôle important dans la performance sûre des injections de stéroïdes épidurales transforaminales [11]. (Fig. 1). En fin de compte, une étude plus approfondie sera nécessaire pour déterminer les pratiques les plus sûres, précises et rentables pour les procédures guidées par l'image.
2. C-ARM FDCT
La plupart des procédures anti-douleur nécessitent une imagerie transversale ou 3D des tissus mous pour cibler avec précision les structures dans un paysage anatomique complexe. Très peu de procédures sont destinées à cibler les structures osseuses, à l'exception de procédures telles que l'augmentation vertébrale et sacrée, les biopsies osseuses et quelques autres. Pourtant, la fluoroscopie reste la méthode d'imagerie la plus populaire, pour les cibles principalement des tissus mous, malgré ses limites. Les procédures intradiscales, l'augmentation vertébrale, les procédures de neuromodulation et les blocs abdominopelviens profonds et de la tête et du cou peuvent être des exemples de certaines procédures où une capacité limitée de tomodensitométrie (FDCT) améliorerait la précision et la sécurité de la procédure par rapport à la fluoroscopie simple. C-arm FDCT et C-arm CBCT utilisent différents portiques, mais sont des termes presque synonymes pour un système d'imagerie 3D moderne qui peut également intégrer des données 2D de fluoroscopie, parfois US, et DSA dans une seule suite. Les radiologues interventionnels et certains médecins de la douleur utilisent ces systèmes avancés de guidage par image pour faciliter les performances procédurales dans certains cas, avec une liste croissante d'indications potentielles. Le FDCT est réalisé via une seule rotation du portique du fluoroscope, rendant un ensemble de données volumétriques complet à l'aide d'un détecteur à écran plat. Ces détecteurs à écran plat ont une résolution nettement meilleure que les anciens intensificateurs d'image. Cela contraste avec la tomodensitométrie conventionnelle qui utilise plusieurs détecteurs et nécessite plusieurs rotations du portique, le patient étant déplacé dans le scanner [12]. Avec FDCT, le patient est stationnaire tout au long du cycle d'imagerie. Les images CT prennent environ 5 à 20 s pour être acquises; il ne s'agit donc pas d'une véritable procédure de fluoroscopie CT en temps réel. Les images du balayage FDCT ont une résolution inférieure en raison du rayonnement diffusé, mais dans de nombreux cas, les images de résolution inférieure sont plus que suffisantes pour la procédure prévue. Cependant, lors de la rotation de 200° du portique d'un système FDCT, des expériences ont montré que les doses de rayonnement sont inférieures à celles d'un seul CT hélicoïdal [12]. Limiter soigneusement le champ de balayage diminuera la dose de rayonnement pour le patient et améliorera le contraste de l'image. Les unités CBCT peuvent avoir une application significative pour les applications chirurgicales mini-invasives peropératoires. Les chirurgiens utilisant le CBCT pour les procédures mini-invasives de la colonne vertébrale avaient tendance à vouloir utiliser la technologie supérieure du CBCT dans leurs cas de manière croissante avec une exposition croissante à la nouvelle technologie [13].
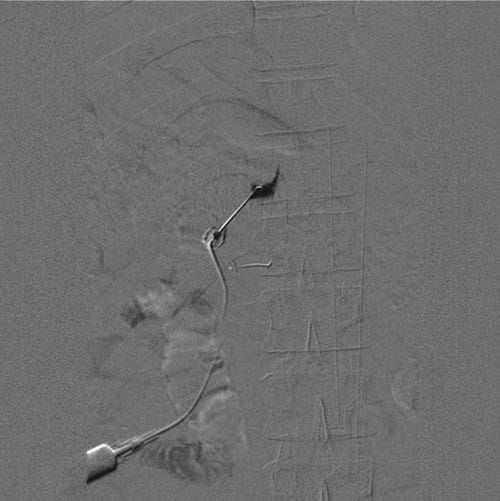
Fig.1 Une image de soustraction numérique d'une injection de contraste dans le ganglion de la racine dorsale thoracique à T11 avant la radiofréquence pulsée. Notez que le contraste se propage en dedans du pédicule. Ci-dessous, une deuxième aiguille a été placée au pédicule de T12 juste en dessous de la bissectrice sagittale.
De nombreux interventionnistes créatifs adaptent la capacité FDCT à de nouvelles procédures, telles que la discographie, sans avoir besoin d'un scanner standard post-procédural (Figues. 2 et 3). En discographie, il est usuel et coutumier de réaliser des injections de contraste dans le disque présumé malade ainsi que dans un disque témoin. Une image CT retardée post-opératoire pour mieux quantifier les déchirures annulaires et la fuite de contraste dans le canal rachidien est considérée comme standard. La technologie CBCT peut permettre d'effectuer ces images CT dans la même suite, ce qui permet d'économiser du temps et de l'argent. Ce concept de « suite individuelle » pour des blocs spécifiques permet également d'économiser sur l'exposition aux rayonnements tant pour le patient que pour les médecins.
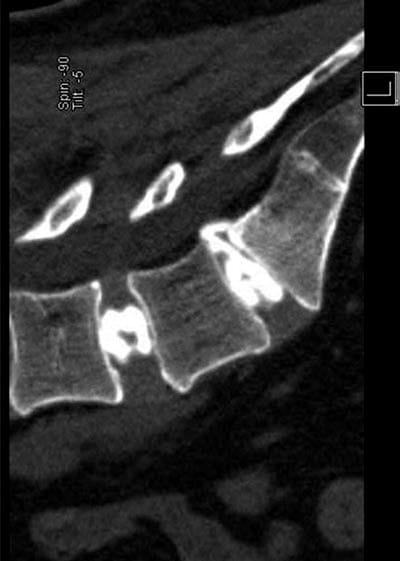
Fig. 2 Vue TDM sagittale d'un discogramme à deux niveaux. A noter une déchirure annulaire en L5/S1 avec extravasation péridurale.
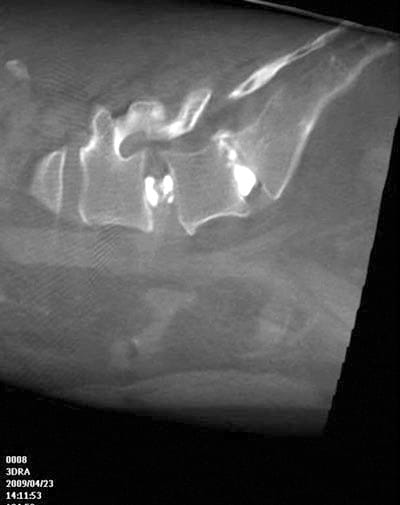
Fig. 3 Comparer un discogramme sagittal FDCT/3D-RA similaire chez le même patient que ci-dessus. L'extravasation épidurale est à nouveau vue.
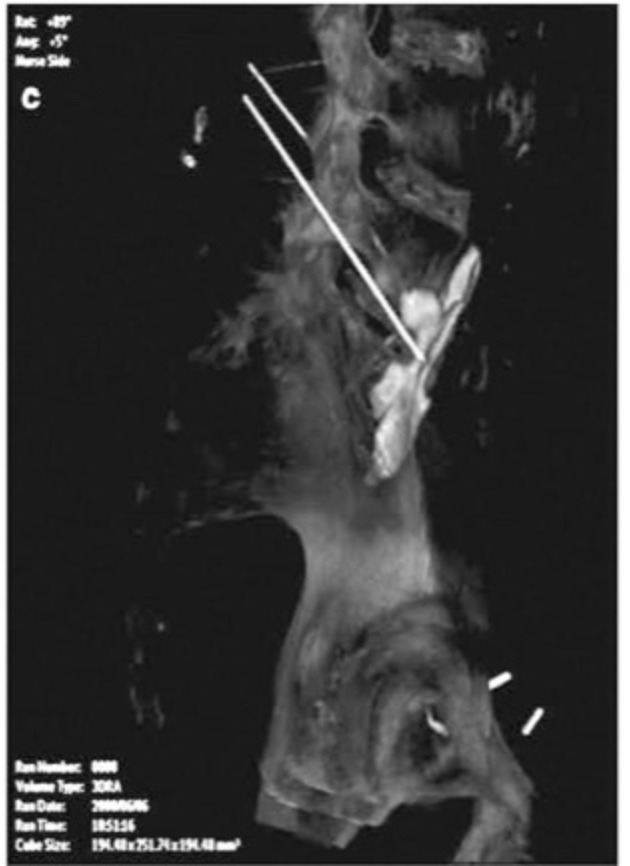
Les blocs du plexus profond tels que les blocs du plexus coeliaque ou hypogastrique supérieur peuvent bénéficier de la capacité de mieux quantifier la propagation du contraste injecté dans plusieurs plans. Potentiellement, des facteurs tels que la charge tumorale locale ou la lymphadénopathie qui limitent la propagation du produit de contraste et de la solution neurolytique peuvent être notés plus tôt avec ces techniques d'imagerie avancées. Par exemple, Goldschneider et al. [14] ont réalisé des blocs du plexus coeliaque chez des enfants en utilisant 3D-RA pour montrer les avantages de l'examen de la propagation du contraste en trois dimensions. De même, les blocs hypogastriques supérieurs (Fig. 4a–c) ont ajouté des détails lors du rendu d'une image 3D. Dans un autre rapport récent [15], Knight et al. effectué une vertébroplastie chez un patient présentant un fragment osseux rétropulsé dans le canal rachidien, normalement au moins une contre-indication relative. Les auteurs ont utilisé la technologie FDCT pour visualiser ces zones lors de l'injection du ciment de polyméthacrylate de méthyle et éviter les lésions de la moelle épinière [15]. La neuromodulation, en particulier la stimulation de la moelle épinière, peut être plus facilement ciblée dans certains cas avec la technologie FDCT. Le mouvement antérieur ou latéral des électrodes pourrait être plus facilement vu, éliminant le besoin de repositionnements multiples de l'électrode et de l'aiguille dans l'espace épidural. L'utilisation de la technologie FDCT/CBCT/3D-RA pour mieux traiter les patients semble n'être limitée que par l'imagination.
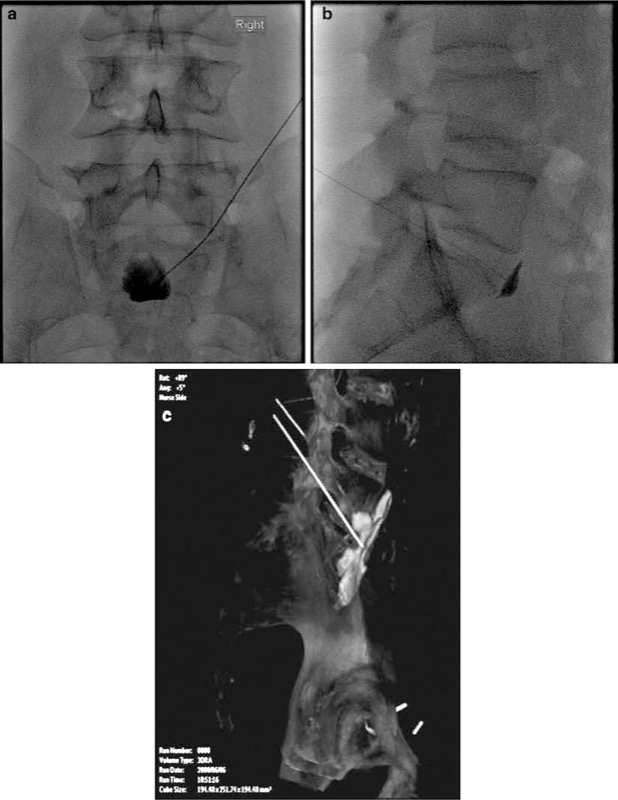
Fig.4 (a) Vue AP du bloc du plexus hypogastrique supérieur fluoroscopique, (b) vue latérale du bloc du plexus hypogastrique supérieur et (c) vue 3D-RA du contraste en trois dimensions.
3. ULTRASONS
L'échographie est devenue extrêmement populaire dans les procédures de blocage de la douleur aiguë, et les praticiens de la douleur chronique adoptent lentement l'échographie comme aide au diagnostic et au blocage guidé par l'image. Les procédures de douleur chronique peuvent inclure des blocs nerveux (tels que le plexus brachial ou lombaire) couramment pratiqués dans une suite de blocs nerveux périopératoires aigus, mais peuvent également nécessiter une injection guidée par l'image de branches plus distales du plexus ou à des endroits moins courants (proximaux aux sites d'un traumatisme ou d'un piégeage ou de la formation d'un névrome). un bloc de divers petits nerfs sensitifs ou mixtes, tels que les ilio-inguinaux [16, 17], cutané fémoral latéral [18], suprascapulaire [19], pudendal [20], intercostal [21], et divers autres sites, a été réalisé. En outre, de nombreuses procédures rachidiennes, notamment les péridurales, les blocs nerveux spinaux sélectifs [22, 23], les blocs des facettes articulaires, les blocs de la branche médiale et les blocs du troisième nerf occipital [24, 25], ainsi que les blocs sympathiques (ganglion stellaire) [26] peuvent être exécuté. Enfin, un large éventail d'applications possibles pour le placement des électrodes de neuromodulation périphérique peut être possible avec le guidage par ultrasons [27].
4. INJECTIONS INTRA-ARTICULAIRES
Les injections intra-articulaires de médicaments (principalement des corticostéroïdes) sont des procédures extrêmement courantes effectuées par des médecins de disciplines de soins primaires ainsi que par des spécialistes. Bien que peu de gens contestent que ces procédures soient faciles à réaliser et très précises, on ne savait pas précisément si le guidage par l'image pouvait améliorer le résultat des procédures intra-articulaires. Une étude récente sur les injections intra-articulaires suggère que celles-ci pourraient être un domaine où l'utilisation du guidage par l'image est utile [28]. L'étude de 148 articulations douloureuses (épaule, genou, cheville, poignet, hanche) a comparé l'utilisation du guidage échographique à une injection de surface basée sur des repères. Les auteurs ont constaté que l'utilisation de l'échographie entraînait une diminution de 43 % de la douleur procédurale, une augmentation de 25.6 % du taux de répondeurs et une diminution de 62 % du taux de non-répondeurs. L'échographie a également augmenté le taux de détection d'épanchement de 200 % par rapport à l'utilisation de repères de surface. Personne ne contestera que l'utilisation du guidage par image augmenterait le coût des procédures réelles. Cependant, des études sur l'économie des soins de santé seraient nécessaires pour déterminer si l'amélioration des résultats conduirait à une meilleure valeur des soins de santé dans une perspective à long terme.
5. TRIGGER POINT ET INJECTIONS MUSCULAIRES
La réalisation de la plupart des injections musculaires profondes et des points de déclenchement a été reléguée à une procédure triviale en cabinet, générant peu d'enthousiasme de la part de la communauté interventionnelle de la douleur. Le guidage par image (fluoroscopie) pour ces structures de tissus mous n'a pas été utile, et de nombreux médecins considéraient la performance des procédures comme «l'art de la médecine». Cependant, l'ajout de l'échographie peut changer la façon dont on perçoit ces procédures. Certes, il est facile de voir comment une cible telle qu'un muscle piriforme pourrait être identifiée avec plus de précision à l'aide de l'échographie. Il est probable que les techniques fluoroscopiques peuvent parfois confondre les muscles fessiers ou quadratus femoris. De plus, la variabilité anatomique et la proximité des structures neurovasculaires, y compris le nerf sciatique, rendent la visualisation importante. Les échographies autorisent également l'utilisation d'un examen diagnostique (rotation de la hanche) pour faciliter l'identification correcte du muscle (Fig. 5). Les études à ce jour suggèrent que le muscle piriforme est facilement injecté en utilisant cette modalité [29]. D'autres cibles musculaires telles que les points de déclenchement ont été ciblées à l'aide des directives américaines [30]. Le pneumothorax est une complication trop fréquente des trigger points de la région thoracique. Dans le cadre du projet de réclamations fermées de l'ASA de 2004, 59 réclamations pour pneumothorax ont été déposées. Sur ces 59, une bonne moitié (23 blocs intercostaux et 1 injection costochondrale) auraient probablement pu être évités sous la direction des États-Unis. De plus, 15 des cas étaient des injections musculaires au point de déclenchement qui seraient probablement également évitables. Ensemble, au moins 2/3 des réclamations de pneumothorax (et probablement même plus) pourraient être évitées avec une meilleure imagerie [31].
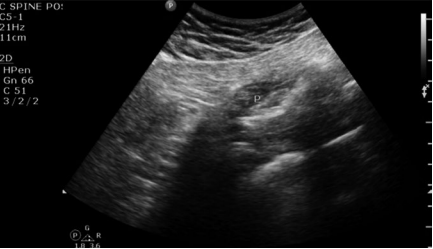
Fig. 5 Un examen dynamique est représenté dans lequel le muscle piriforme (P) est contracté
Que l'utilisation de l'échographie ou d'une autre technique d'imagerie soit justifiée dans tous les cas par la prévention des complications peut dépendre d'une description plus précise de l'incidence réelle des complications et de meilleures données sur les résultats. Certes, il peut être vrai que les réponses positives pourraient être reproduites avec plus de précision dans certains cas.
6. BLOCS ZYGAPOPHYSAIRES ET MÉDIAUX
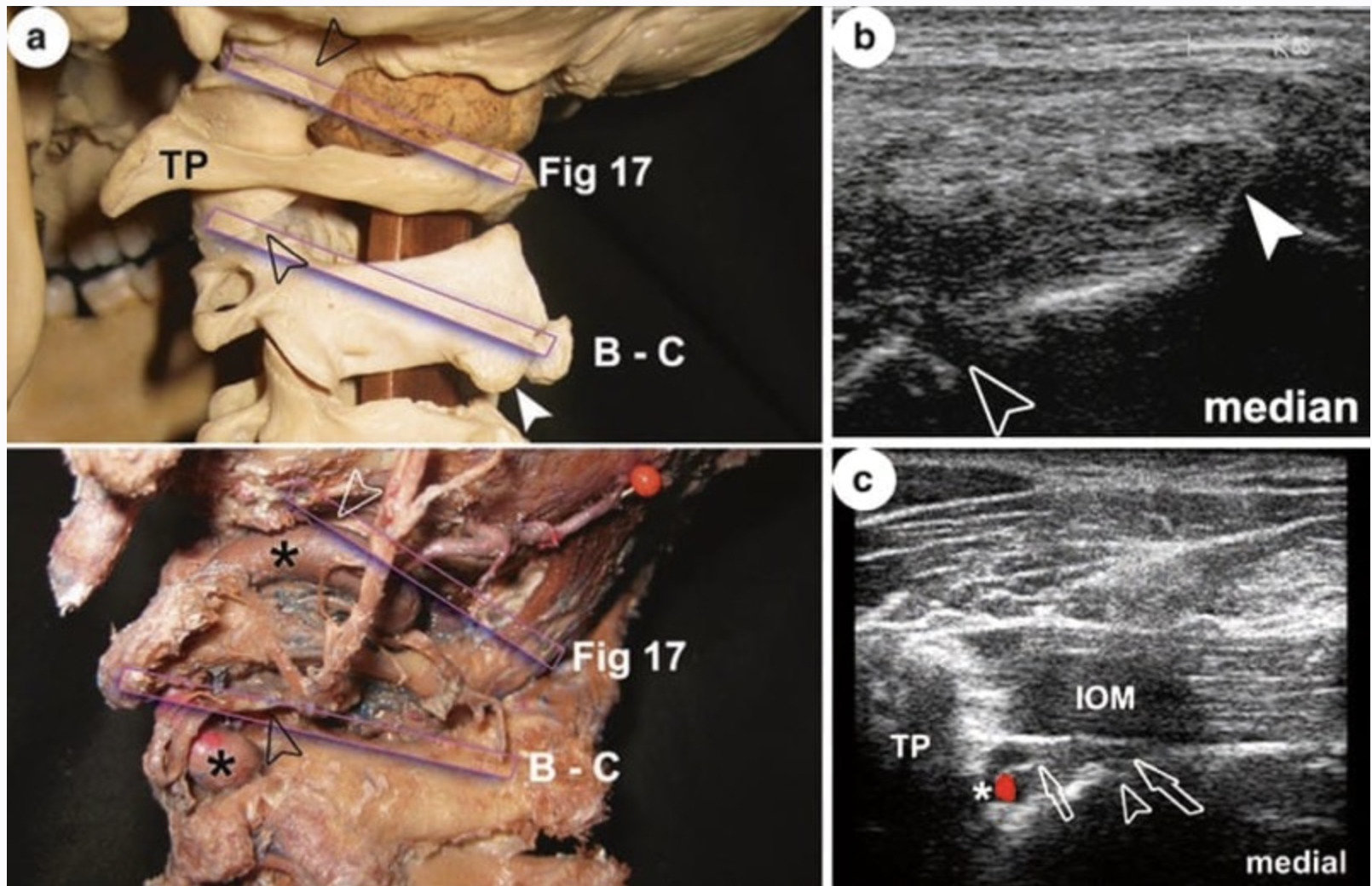
L'une des meilleures études sur le guidage échographique en médecine de la douleur a évalué les procédures de blocage du troisième nerf occipital et a suscité un intérêt pour l'US pour de nombreux membres de la communauté de la médecine de la douleur [24]. Le troisième nerf occipital avait été suggéré comme cible thérapeutique pour des affections telles que la spondylose cervicale haute et les céphalées cervicogènes, et comme prédicteur du succès des procédures ablatives par radiofréquence. Dans cette étude, la précision du guidage échographique par rapport à celle de la fluoroscopie était bonne, avec 23 aiguilles sur 28 démontrant un positionnement radiographique précis [24]. Des procédures fluoroscopiques ciblant le troisième nerf occipital autour de l'articulation zygapophysaire C2/C3 ont été réalisées en utilisant trois placements d'aiguille séquentiels. Ces placements guidés par fluoroscopie ont été très précis mais souffrent de l'incapacité de voir réellement le nerf ciblé. Reste à savoir si l'échographie est supérieure d'une certaine manière à la fluoroscopie standard.
7. BLOCS PÉRIDURAUX
Les techniques péridurales, y compris les blocs radiculaires interlaminaires, caudaux et sélectifs de la colonne vertébrale, ont été étudiées de manière limitée en utilisant le guidage par ultrasons. Les techniques de fluoroscopie sont extrêmement simples et utilisent généralement de petites quantités de rayonnement ; ainsi, les défenseurs des États-Unis devront effectuer des études comparatives pour démontrer tout avantage particulier. Les procédures caudales sont peut-être les plus prometteuses à cet égard.
Il faut faire preuve de prudence jusqu'à ce que les mécanismes des lésions ischémiques au cours des procédures épidurales transforaminales soient mieux compris. L'absence de contrôle de contraste en échographie malgré la visibilité de la structure vasculaire « extraforaminale » est l'inconvénient le plus important. Même la tomodensitométrie n'est pas infaillible pour les injections transforaminales cervicales de corticostéroïdes [11, 22, 23].
8. BLOCAGES SYMPATHIQUES
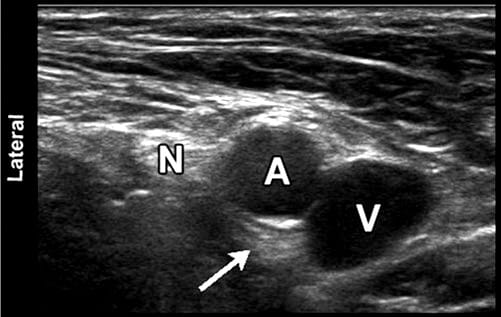
Les blocs sympathiques ont été étudiés de façon limitée sous guidage échographique. Le bloc ganglionnaire stellaire (SGB) a été réalisé à C6 en avant du tubercule de Chassaignac sur la base de repères de surface pendant des années avant les techniques de fluoroscopie modernes qui sont devenues la norme de soins dans la plupart des régions. Une analyse récente de 27 cas précédemment rapportés d'hématome rétropharyngé après SGB a souligné le potentiel de saignement retardé et de formation d'hématome [32]. Bien que les techniques guidées par l'image n'aient pas été décrites dans cette revue, l'aspiration de sang était négative dans tous les cas sauf quatre nécessitant une redirection de l'aiguille. L'un des premiers articles examinant les directives américaines a été rédigé par Kapral et al. [26]. Dans cette étude, le groupe non échographique avait trois hématomes. Les auteurs ont émis l'hypothèse que l'artère vertébrale pourrait être plus susceptible d'être impliquée dans les injections du côté gauche. Eux et d'autres chercheurs ont évoqué la possibilité d'autres artères à risque, en particulier la branche cervicale ascendante de l'artère thyroïdienne inférieure, qui passe généralement sur le tubercule antérieur C6 [33]. Aucune étude de comparaison directe de l'échographie par rapport à la tomodensitométrie ou à la fluoroscopie pour le SGB n'a encore été réalisée. Les avantages de l'échographie semblent être d'éviter les lésions vasculaires ou des tissus mous. Les avantages de la fluoroscopie ou du scanner seraient la facilité d'interprétation des schémas d'étalement du contraste et une meilleure représentation de l'anatomie 3D dans le cas du scanner.
9. US COMBINÉ ET TDM/FLUOROSCOPIE
L'utilisation de combinaisons de ces modalités d'imagerie a fait l'objet d'études limitées à ce jour, mais peut avoir certaines indications à mesure que le temps et l'expérience s'accumulent. Par exemple, la stimulation des nerfs périphériques peut être mieux réalisée avec US et FDCT ou US et fluoroscopie [27]. Il est possible que les techniques d'imagerie combinées de l'US-fluoroscopie, de la CT-fluoroscopie et de l'US/CT et d'autres techniques combinées se normalisent dans des procédures particulièrement compliquées.
10. CONCLUSION
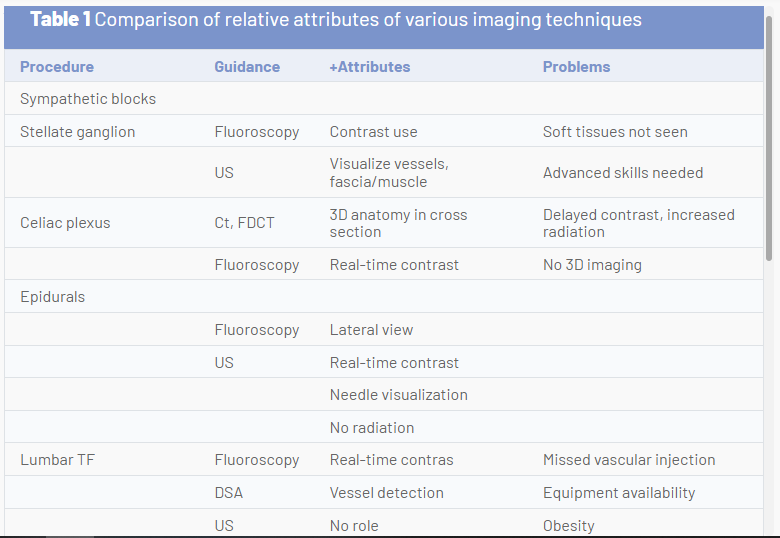
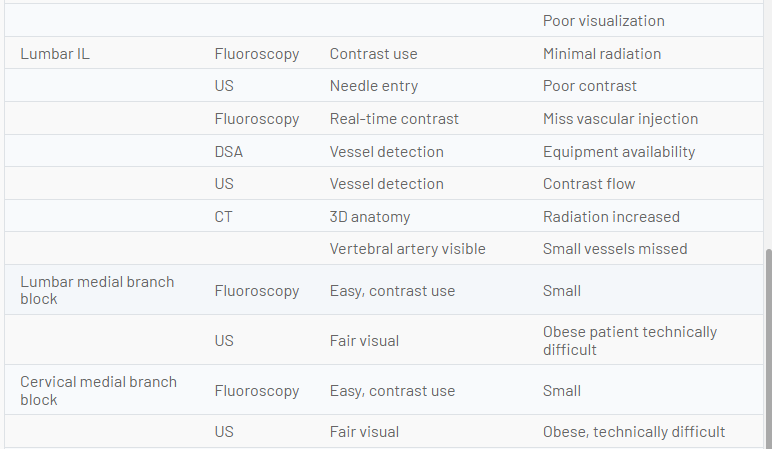
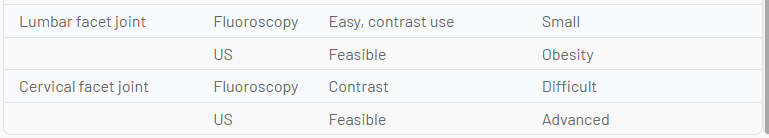
L'avenir du guidage par l'image pour les interventions de médecine de la douleur doit équilibrer le risque pour le patient et le clinicien des rayonnements ionisants, les risques de complications procédurales, les résultats et la valeur relative. Bien que l'imagerie par ultrasons soit réalisable dans de nombreux cas, les meilleures pratiques peuvent favoriser la fluoroscopie ou la tomodensitométrie dans certains cas. L'échographie semble avoir des avantages pour le diagnostic musculo-squelettique et la thérapie de certaines affections des articulations et des tissus mous, les procédures où le péritoine ou la plèvre peuvent être perforés, les injections musculaires profondes, la plupart des procédures nerveuses périphériques, éventuellement la SGB, éventuellement les péridurales caudales, et peut-être l'équivalence pour l'articulation sacro-iliaque et certains blocs de branche médiale. D'autres utilisations nécessiteront une comparaison continue avec d'autres techniques de guidage d'image. Le tableau suivant compare les attributs relatifs de diverses techniques d'imagerie et indique les domaines dans lesquels une modalité de guidage d'image peut présenter des avantages uniques par rapport à une autre (Tableau 1).