Marina Gitman, Michael Fettiplace y Guy Weinberg
INTRODUCCIÓN
La introducción de la cocaína como primera anestesia local (LA) a fines del siglo XIX pronto fue acompañado por informes de su toxicidad sistémica. Los síntomas de toxicidad se describieron con frecuencia como convulsiones o insuficiencia respiratoria, pero algunos casos también incluyeron relatos de efectos cardíacos adversos. A menudo, la toxicidad sistémica anestésica local letal (LAST) se trató con cafeína, amoníaco o incluso éter hipodérmico. El desarrollo de la procaína en 1904 no resolvió el problema de la toxicidad sistémica y el Comité para el Estudio de los Efectos Tóxicos de los Anestésicos Locales publicó un informe de 43 casos fatales relacionados con el uso de AL. La identificación de los factores contribuyentes, el énfasis en la prevención y la eliminación casi completa de la cocaína de la práctica clínica ayudaron a disminuir la incidencia de LAST durante casi 50 años.
Sin embargo, la síntesis de LA solubles en lípidos de acción prolongada, como la bupivacaína, a fines de la década de 1950, con los informes asociados posteriores de LAST, dio como resultado el retorno de LAST letal. Estos incluyeron múltiples casos de muerte fetal asociados con bloqueos nerviosos paracervicales, fibrilación ventricular después de un bloqueo del nervio interescalénico, y el que se considera el caso “centinela” de un joven que sufrió un paro cardíaco tras un bloqueo del nervio caudal. Las siguientes décadas estuvieron plagadas de relatos aislados que describían un problema común: muerte cardiovascular (CV) asociada con LAST que era particularmente resistente a las medidas de reanimación disponibles, como vasopresores (p. ej., epinefrina) y desfibrilación.
MECANISMO DE TOXICIDAD DE LOS ANESTÉSICOS LOCALES
Los anestésicos locales generalmente son seguros y efectivos cuando se limitan al sitio de la terapia, como la infiltración de tejido, cerca de un nervio o un plexo de nervios. Sin embargo, si una gran cantidad de LA llega a la circulación sistémica, los niveles sanguíneos y tisulares supraterapéuticos pueden causar toxicidad. Este tránsito a la sangre puede deberse a una inyección intravascular inadvertida oa una captación vascular por diseminación local. En el sitio objetivo, los LA reducen el flujo de iones de sodio a través de los canales de sodio dependientes de voltaje mediante una combinación de una mayor barrera de energía y un impedimento estérico. Este bloqueo nervioso ocurre desde el lado intracelular y requiere que los LA se muevan primero a través de la bicapa lipídica. Los LA también bloquean los nervios de los canales de calcio y otros canales en concentraciones similares. A concentraciones más bajas, los nervios LA bloquean la señalización de la proteína quinasa inducida por el factor de necrosis tumoral α. En concentraciones más altas, los LA pueden inhibir otros canales, enzimas y receptores, incluida la translocasa de carnitina-acilcarnitina en las mitocondrias.
Haz clic aquí para más información sobre la mecanismo de acción de los anestésicos locales
Aunque no existe un consenso claro, es probable que la toxicidad cardíaca se deba a la combinación de disfunción electrofisiológica y contráctil. En comparación con otros AL de uso clínico común, la bupivacaína es más lipofílica y tiene una mayor afinidad por los canales de sodio dependientes de voltaje. Estas cualidades pueden contribuir a su perfil cardiotóxico. Cabe señalar que la toxicidad puede ocurrir a concentraciones séricas inferiores a las esperadas porque los LA se acumulan en las mitocondrias y el tejido cardíaco en una proporción de aproximadamente 6:1 (o mayor) en relación con el plasma.
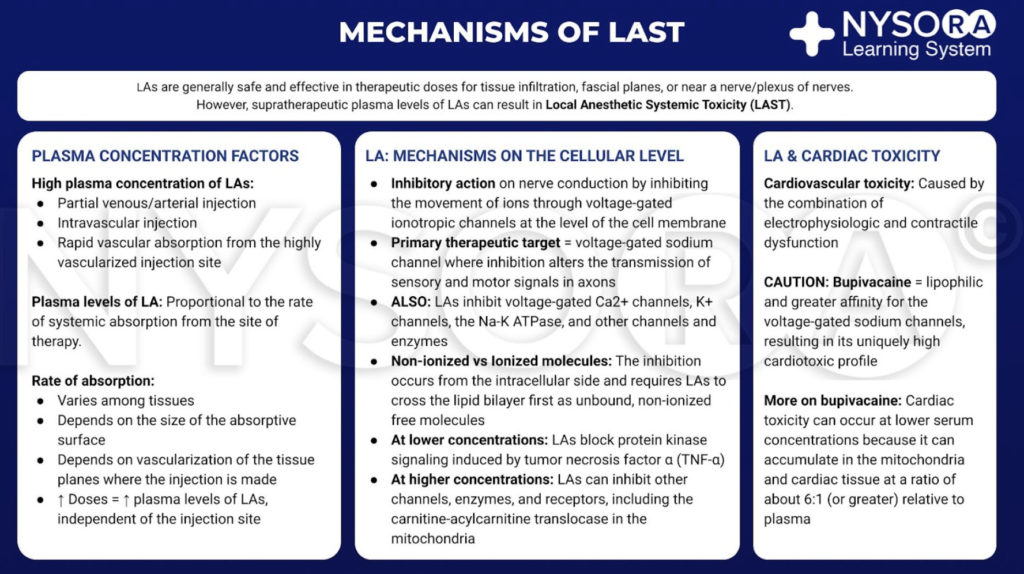
Del Compendio de Anestesia Regional: Mecanismos de infografía de toxicidad sistémica de los anestésicos locales.
DIAGNÓSTICO Y FACTORES CONTRIBUYENTES
La presentación típica de LAST suele comenzar con síntomas y signos prodrómicos, como entumecimiento perioral, tinnitus, agitación, disartria y confusión. Estos pueden ir seguidos de trastornos más graves del sistema nervioso central (SNC), como convulsiones y coma. También pueden ocurrir trastornos cardiovasculares, que inicialmente se presentan con hipertensión y taquicardia, luego bradicardia e hipotensión, con progresión a complicaciones más graves, que incluyen arritmias ventriculares y asistolia. La mayoría de los eventos adversos ocurren dentro de 1 minuto después de la inyección de LA, pero no todos los casos siguen este patrón. La toxicidad puede tener un inicio tardío de más de 1 hora después de la inyección y puede manifestarse como una disfunción CV aislada o como una combinación de signos del SNC y CV sin la progresión clásica.
Las variables que aumentan el riesgo de toxicidad incluyen el tipo de AL y la dosis, el lugar de la inyección, las comorbilidades del paciente, los extremos de edad y el tamaño pequeño o la masa muscular limitada. La lipofilia de un LA está asociada con la toxicidad. Los LA más lipofílicos, como la bupivacaína, tienen un mayor riesgo de toxicidad en relación con los LA menos lipofílicos, como la mepivacaína y la lidocaína.
Una dosis total más alta y la relación dosis-peso del fármaco pueden aumentar potencialmente la posibilidad de LAST. En particular, el músculo esquelético actúa como un depósito para LA absorbido sistémicamente, lo que puede explicar el riesgo clínico de LAST en pacientes diminutos cuya masa muscular es sustancialmente menor que la normal. En consecuencia, los bloqueos nerviosos y los anestésicos epidurales que requieren dosis mayores conllevan un riesgo inherente para dichos pacientes. Por ejemplo, los bloqueos nerviosos bilaterales del plano transverso del abdomen realizados con hasta 40 ml de ropivacaína al 0.5 % pueden dar lugar a una mayor incidencia de toxicidad local.
Por último, pero no menos importante, el sitio de inyección también contribuye al riesgo de propagación vascular del fármaco. La enseñanza clásica de que la absorción vascular de los LA es más alta con bloqueos de nervios intercostales seguido por epidural y las inyecciones del plexo braquial corresponden a los datos clínicos que demuestran que la incidencia más alta de LAST ocurre con bloqueos nerviosos paravertebrales, seguido de bloqueos nerviosos de las extremidades superiores y del tronco/extremidades inferiores.
Los factores de riesgo dependientes del paciente incluyen la disfunción orgánica, el nivel sérico de las proteínas de unión y la edad. Preexistente enfermedad cardiaca puede hacer que los pacientes sean más propensos a los efectos arritmogénicos y depresores del miocardio de los AL. Se recomienda extrema precaución para aquellos con insuficiencia cardíaca descompensada, patología valvular grave o función ventricular deprimida. La disfunción hepática o renal puede dar como resultado una disminución del metabolismo y la eliminación y un nivel más alto de fármaco circulante. Además, la insuficiencia hepática/renal, la desnutrición o cualquier otro proceso patológico que resulte en una disminución del nivel sérico de albúmina puede aumentar indirectamente el nivel del fármaco libre para una dosis dada.
Los pacientes en los extremos de edad son más susceptibles a la toxicidad, un hallazgo que puede estar relacionado con una serie de factores. los anciano tienen más probabilidades de tener disfunción orgánica, lo que contribuirá a la toxicidad. Además, tanto los pacientes de edad avanzada como los pediátricos pueden tener una masa muscular disminuida y, como tal, es más probable que reciban una dosis más alta del fármaco para su peso. La mayoría de los niños son anestesiados cuando se coloca un bloqueo nervioso, por lo que los síntomas tempranos se perderán y un trastorno cardíaco/del SNC más grave podría ser el primer signo de toxicidad.

Del Compendio de Anestesia Regional: Síntomas, diagnóstico y tratamiento de la infografía de toxicidad sistémica del anestésico local.
PRESENCIA DE TOXICIDAD
La anestesia neuroaxial y los bloqueos de nervios periféricos (PNB) son los procedimientos más comúnmente realizados que requieren el uso de AL. El bajo volumen de fármaco necesario para la dosificación intratecal rara vez plantea un problema. Sin embargo, el alto volumen requerido para anestesia epidural y los PNB aumentan el riesgo de LAST. Los datos actualmente disponibles indican que la incidencia de LAST asociada con BNP ha disminuido de 1.6 a 2/1000 en la década de 1990 a 0.08 a 0.98/1000 entre 2003 y 2013. De hecho, un estudio reciente no observó casos de LAST con más de 9000 BNP durante un período de 6 años. Asimismo, la incidencia de LAST con anestesia epidural disminuyó de 9.75/1000 a principios de la década de 1980 a 0.1-1.2/1000 en la década de 1990 y se mantuvo en 0.1/1000 en 2003.
Si bien los estudios de gran población se limitan principalmente a la epidural y los BNP, existen numerosos informes que describen LAST con otros tipos de anestesia local. Por ejemplo, con la reciente popularidad del bloqueo del nervio del plano transverso del abdomen para procedimientos abdominales, ha habido varios casos de LAST después de que estos bloqueos del nervio se realizaron para cesáreas.
También se ha descrito toxicidad neurológica después del uso tópico de AL, que los anestesistas utilizan con frecuencia antes de la instrumentación de las vías respiratorias para intubación despierto. Es probable que esto no se informe porque los síntomas neurológicos pueden ser leves (entumecimiento perioral, tinnitus, agitación) y estar enmascarados por la sedación preoperatoria que precede a la inducción de la anestesia general que sigue inmediatamente a la intubación despierto.
Las causas ocasionales de LAST fuera del alcance habitual de un anestesiólogo incluyen bloqueos nerviosos retrobulbares para cirugía oftalmológica y bloqueos del nervio alveolar inferior para procedimientos dentales. La toxicidad de un bloqueo del nervio retrobulbar es causada por la propagación subaracnoidea del anestésico que causa la anestesia del tronco encefálico; que puede manifestarse como estado mental alterado, apnea y convulsiones. Los informes específicos de LAST después de bloqueos del nervio alveolar inferior son raros, pero es claramente un riesgo potencial. El área abundantemente vascular del espacio pterigomandibular aumenta el riesgo de colocación de agujas intravasculares, que puede llegar al 15.3 % incluso entre cirujanos orales experimentados. Finalmente, hay un aumento reciente en la utilización de bloqueos nerviosos regionales en salas de emergencia y los informes correspondientes de LAST en la sala de emergencias, pero actualmente se desconoce el alcance de este problema.
TRATAMIENTO
En la actualidad, los tres pilares del tratamiento LAST consisten en el control de las convulsiones, el soporte vital cardíaco avanzado (ACLS) y la administración inmediata de una emulsión de lípidos al 20 %. Para pacientes hemodinámicamente estables con actividad convulsiva aislada, se pueden usar benzodiazepinas intravenosas. Algunas personas consideran que las dosis pequeñas de propofol son una alternativa aceptable para el control de las convulsiones, pero pueden empeorar la disfunción cardíaca que se puede desarrollar con LAST. El oxígeno suplementario es apropiado para cualquier paciente que muestre signos de LAST, pero para pacientes con apnea, arritmias hemodinámicamente inestables o paro cardíaco, se requiere un manejo inmediato y más agresivo de las vías respiratorias o soporte circulatorio. Los objetivos son mantener la ventilación pulmonar y la perfusión adecuada de los órganos con sangre bien oxigenada y evitar una mayor acidosis hasta el inicio de la terapia con emulsión de lípidos.
Antes de la introducción de la reanimación con emulsión de lípidos, el tratamiento de la toxicidad cardíaca grave se limitaba al ACLS y al bypass cardiopulmonar. El uso de vasopresores durante la reanimación potencialmente empeoró la acidosis y las arritmias. En algunos casos se había utilizado el bypass cardiopulmonar; desafortunadamente, no todos los hospitales tienen esa capacidad. La idea de que una sustancia rica en lípidos tiene el potencial de revertir los efectos de ciertos medicamentos comenzó en la década de 1960, cuando varios experimentos con animales demostraron que la administración intravenosa de una emulsión de aceite disminuía la duración de la acción del tiopental o disminuía la fracción libre de clorpromazina en sangre. Casualmente, en 1997, el caso de LAST en una mujer joven con acidemia isovalérica y deficiencia de carnitina inspiró una serie de experimentos con animales. La carnitina es necesaria para el transporte de ácidos grasos a la mitocondria para la oxidación β, y la acumulación de acilcarnitinas citoplasmáticas (p. ej., durante la isquemia miocárdica) se asocia con arritmias. Entonces, Weinberg et al plantearon la hipótesis de que sobrecargar las células con ácidos grasos exógenos mediante la infusión de una emulsión de lípidos exacerbaría la toxicidad de LA. Sorprendentemente, se vio lo contrario. La infusión de una emulsión de grasa disminuyó e incluso revirtió la toxicidad de LA.
En 2006, se informó la primera reanimación exitosa de un paciente humano con una emulsión de lípidos. Desde entonces, ha habido muchos informes clínicos que describen la reversión efectiva de LAST en adultos y niños. El tratamiento de la toxicidad con una emulsión lipídica intravenosa se ha denominado terapia de reanimación lipídica (LRT). El mecanismo de LRT es multimodelo en acción, con lípidos ejerciendo tanto un efecto de barrido (anteriormente conocido como "sumidero de lípidos") como un efecto cardiotónico directo.
El efecto de barrido es moderado por la capacidad de la emulsión de lípidos para absorber fracciones lipofílicas y transferirlas por la sangre a sitios de almacenamiento y desintoxicación. Esto proporciona un efecto de "transporte de lípidos". Sin embargo, el efecto de barrido no es suficiente para explicar la rápida recuperación. Se produce un segundo efecto mediante el cual, en modelos de laboratorio, la infusión de la emulsión de lípidos aumenta el gasto cardíaco a través de una combinación de volumen y efectos cardiotónicos directos para mejorar el gasto cardíaco una vez que la concentración cardíaca del fármaco cae por debajo de los umbrales de bloqueo de los canales iónicos. Una emulsión de lípidos al 20% es eficaz en el tratamiento de la LAST causada por la bupivacaína y otros LA menos solubles, como la ropivacaína, la mepivacaína y la lidocaína.
Se encontró que la emulsión de lípidos LD50 (dosis letal media) probada en un modelo de rata era mucho más alta que las dosis utilizadas para el rescate de lípidos en humanos. Los posibles efectos secundarios incluyen interferencia con las mediciones de laboratorio clínico (hemoglobina, metahemoglobina, electrolitos, exceso de base); reacciones alérgicas; náuseas/émesis; disnea; y dolor de pecho. No obstante, los efectos secundarios informados reales se limitan a broncoespasmo, hiperamilasemia e interferencia en las mediciones de laboratorio.
La transaminitis, la hepatoesplenomegalia y la contaminación bacteriana se asocian típicamente con el uso prolongado de una emulsión de lípidos y no desempeñan un papel en la administración a corto plazo de LAST. Aunque el uso de grandes volúmenes de emulsión de lípidos (especialmente 30%) en recién nacidos prematuros y de bajo peso al nacer se ha asociado con la muerte por acumulación de grasa en los pulmones, hay informes de casos en recién nacidos, niños pequeños y niños mayores de reversión exitosa de la droga. sobredosis (bupivacaína y no LA) utilizando regímenes estándar recomendados de 20% de lípidos. Por último, como se mencionó, se debe tener precaución con el uso de propofol en este entorno: no es un sustituto de una emulsión de lípidos. Hay un contenido de lípidos insuficiente en las dosis sedantes o anticonvulsivas estándar de propofol para ejercer un beneficio en el entorno de sobredosis; sin embargo, el propofol puede comprometer la estabilidad CV.
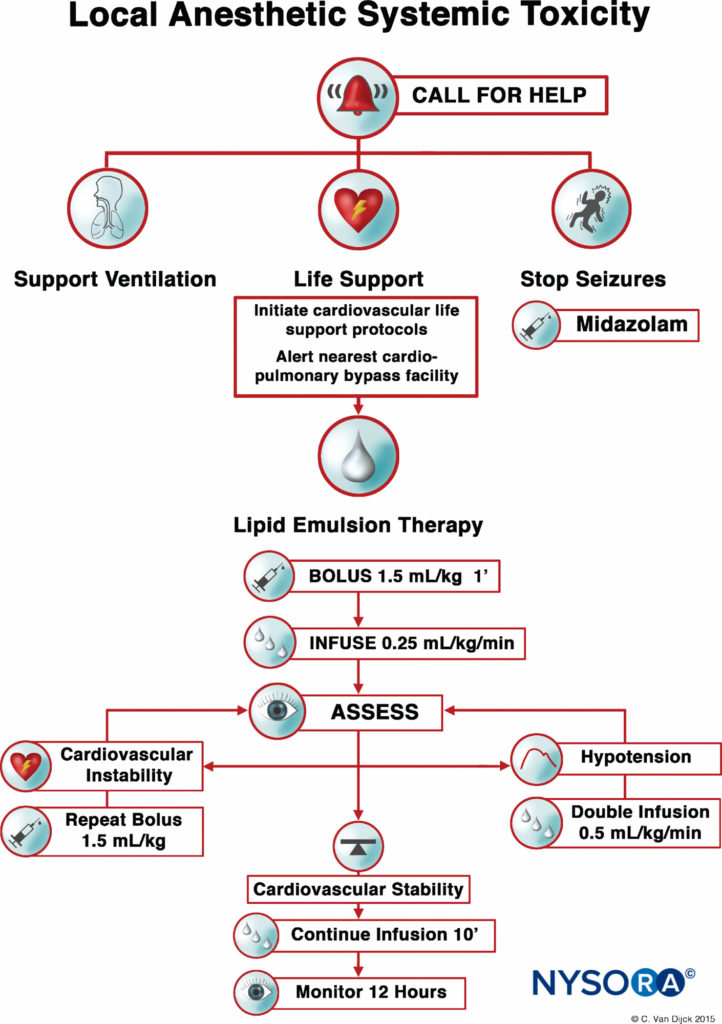
FIGURA 1. Lista de verificación para el manejo de la toxicidad sistémica de los anestésicos locales.
Después de numerosos informes de casos validaron el papel de LRT como un tratamiento eficaz de LAST, la Sociedad Estadounidense de Anestesia Regional y Medicina del Dolor (ASRA) emitió un aviso de práctica en 2010 seguido en 2012 por una lista de verificación para el manejo de LAST (Figura 1 y XNUMX). Las directrices destacan la importancia de la reanimación cardiopulmonar inmediata y proporcionan un algoritmo detallado para la dosificación y administración de la emulsión de lípidos.
El uso oportuno de la LRT, ante los primeros signos de toxicidad, puede mejorar los esfuerzos de reanimación y disminuir la cantidad de vasopresores utilizados. Al igual que con cualquier emergencia que ponga en peligro la vida, es esencial asegurar el acceso intravenoso; sin embargo, la administración intraósea de emulsión de lípidos es una posible alternativa si el acceso intravenoso resulta problemático.
de EMPLEO
Como siempre, el mejor tratamiento es la prevención. Esto es especialmente cierto para LAST. La eficacia y disponibilidad de LRT no disminuye la morbilidad potencial incluso en casos de tratamiento exitoso. La presencia de una "bala de plata" no elimina la necesidad de precaución. Por ello, se recomienda el uso de ultrasonido, marcadores intravasculares, inyección incremental con aspiración, fármacos menos tóxicos y menor dosis efectiva.
Consejos NYSORA
- Existe una mayor probabilidad de toxicidad sistémica de LA en pacientes pequeños (pequeña masa muscular), en los extremos de edad y en pacientes con enfermedad cardíaca preexistente o deficiencia de carnitina.
- Aproximadamente la mitad de los casos de LAST son atípicos, sin convulsiones (otros síntomas del SNC), solo toxicidad CV o aparición tardía.
- La incidencia de toxicidad aumenta con las inyecciones cerca de áreas ricamente vascularizadas. Es más alto con inyecciones paravertebrales, seguidas de BNP en extremidades superiores e inferiores.
- La prevención de la morbilidad relacionada con LAST requiere optimizar un sistema completo de anestesia regional: selección de pacientes, elección de bloqueo nervioso, fármaco y dosis, monitorización completa y uso de USGRA cuando sea posible, y preparación para LAST con un kit disponible y práctica con simulación.
- La prevención también incluye crear conciencia y educar a nuestros colegas que no son anestesiólogos sobre el uso adecuado de los LA y los riesgos, incluido el manejo de LAST.
El ultrasonido ofrece varias ventajas potenciales. Permite la visualización directa de la propagación inyectable del fármaco, la detección de inyecciones intravasculares no intencionadas y el uso de volúmenes más pequeños de AL. Además, existe evidencia de que el uso de ultrasonido para BNP puede reducir la incidencia de LAST.
Un marcador intravascular como 10 a 15 μg de epinefrina tiene sensibilidad razonable (aunque imperfecta) y valor predictivo positivo y puede administrarse con una dosis de prueba. Un aumento de la frecuencia cardíaca de 10 latidos por minuto o más o un aumento de la presión arterial sistólica de 15 mm Hg o más sugiere una inyección intravascular. Se han recomendado regularmente inyecciones incrementales de AL (por lo general, 3 a 5 ml) y aspiración frecuente y, junto con el uso de la dosis de prueba, pueden haber contribuido a la disminución de la incidencia de LAST observada con epidurales.
Finalmente, el uso de la dosis efectiva más baja proporciona un margen adicional de seguridad. También es razonable ajustar una dosis hacia abajo para los pacientes que se sabe que tienen una condición que podría aumentar su susceptibilidad a LAST. Esto parece algo redundante si uno siempre usa la dosis mínima necesaria para cualquier bloqueo nervioso. La prudencia es el punto. Ninguna de estas medidas es en sí misma precisa o perfecta; por lo tanto, es vital no confiar en un solo paso de prevención, sino incorporar varios más el sentido común para poner la seguridad del paciente en primer lugar.
SENSIBILIZACIÓN Y EDUCACIÓN
Los anestesiólogos usan los LA todos los días en varios lugares de práctica y para una amplia variedad de procedimientos. Por lo tanto, todo sitio donde se usen AL en dosis potencialmente tóxicas debe estar equipado con equipo básico de reanimación y una emulsión de lípidos al 20%. Además, la lista de verificación ASRA para el tratamiento de LAST puede ayudar a guiar el proceso de tratamiento. Se demostró que una herramienta electrónica de apoyo a la toma de decisiones mejora el cumplimiento de las pautas durante la simulación del manejo de LAST y puede ser beneficiosa en casos reales. Finalmente, la educación de los proveedores que no son de anestesia es crucial para aumentar su conciencia sobre el riesgo de LAST y su tratamiento. Los pacientes podrían salvarse si estos eventos tan raros son diagnosticados y manejados adecuadamente por personas que no son anestesiólogos u otros no iniciados que, de otro modo, permanecerían ignorantes del riesgo. La educación difiere entre instituciones y departamentos, pero existe un conocimiento subóptimo de la dosificación de LA, las precauciones de seguridad y el tratamiento de LAST, entre otras especialidades. Por esa razón, la lista de verificación ASRA y la herramienta electrónica de apoyo a la decisión pueden ser invaluables para los médicos en caso de toxicidad por AL.
Referencias
- Drasner K: Toxicidad sistémica del anestésico local. Una perspectiva histórica. Reg Anesth Pain Med 2010;35:162–166.
- Mayer E: Los efectos tóxicos posteriores al uso de anestésicos locales: un análisis de los informes de cuarenta y tres muertes presentados al Comité para el Estudio de los Efectos Tóxicos de los Anestésicos Locales de la Asociación Médica Estadounidense y las recomendaciones del comité. JAMA 1924; 82: 875–876.
- Edde RR, Deutsch S: Paro cardíaco después del bloqueo interescalénico del plexo braquial. Anesth Analg 1977;56:446–447.
- Prentiss JE: Paro cardíaco tras anestesia caudal. Anestesiología 1979;50:51–53.
- Clarkson CW, Hondeghem LM: Mecanismo para la depresión de bupivacaína de conducción cardíaca: bloqueo rápido de los canales de sodio durante el potencial de acción con recuperación lenta del bloqueo durante la diástole. Anestesiología 1985;62:396–405.
- Coyle DE, Sperelakis N: Bupivacaína y lidocaína bloquean los potenciales de acción lenta mediados por calcio en el músculo ventricular del conejillo de Indias. J Pharmacol Exp Ther 1987;242:1001–1005.
- Piegeler T, Votta-Velis, Bakhshi FR, et al: Protección de la barrera endotelial por anestésicos locales: la ropivacaína y la lidocaína bloquean la activación de Src de células endoteliales inducida por el factor de necrosis tumoral a. Anestesiología 2014;120: 1414–1428.
- Weinberg GL, Palmer JW, VadeBoncouer, et al: La bupivacaína inhibe el intercambio de acilcarnitina en las mitocondrias cardíacas. Anestesiología 2000;92: 523–528.
- Wolfe JW, Butterworth JF: Toxicidad sistémica de anestésicos locales: actualización sobre mecanismos y tratamiento. Curr Opin Anesthesiol 2011;24:561–566.
- Albright EA: Parada cardiaca tras anestesia regional con etidocaína o bupivacaína. Anestesiología 1979;51:285–287.
- Heavner JE: Toxicidad cardíaca de los anestésicos locales en el modelo de corazón aislado intacto: una revisión. Reg Anesth Pain Med 2002;27:545–555.
- Hiller N, Mirtschink P, Merkel C, et al: La acumulación miocárdica de bupivacaína y ropivacaína se asocia con efectos reversibles sobre las mitocondrias y una función miocárdica reducida. Anesth Analg 2013; 116: 83-92.
- Fettiplace MR, Pichurko A, Ripper R, et al: La depresión cardíaca inducida por la cocaína o el cocaetileno se alivia con la emulsión de lípidos más eficazmente que con la sulfobutiléter-B-ciclodextrina. Acad Emerg Med 2015;22:508–517.
- Di Gregorio, Neal JM, Rosenquist RW, et al: Presentación clínica de la toxicidad sistémica del anestésico local. Una revisión de los casos publicados, 1979–2009. Reg Anesth Pain Med 2010;35:181–187.
- Pertrar S: El anestésico local total administrado es parte integral del síndrome de toxicidad sistémica del anestésico local. Anestesiología 2014;121: 1130–1131.
- Barrington MJ, Kluger R: La guía por ultrasonido reduce el riesgo de toxicidad sistémica del anestésico local después del bloqueo del nervio periférico. Reg Anesth Pain Med 2013;38:289–299.
- Eng HC, Ghosh SM, Chin KJ: Uso práctico de los anestésicos locales en anestesia regional. Curr Opin Anesthesiol 2015;27:382–387.
- Calenda E, Baste JM, Hajjej R, et al: concentración plasmática tóxica de ropivacaína después de un bloqueo paravertebral en un paciente que sufre de hipoalbuminemia severa. J Clin Anesth 2014;26:149–151.
- Fagenholz PJ, Bowler GM, Carnochan FM, et al: local sistémico Toxicidad anestésica por bloqueo paravertebral torácico continuo. Hermano J Anaesth 2012;109:260–262.
- Lonnqvist PA: Toxicidad de los anestésicos locales: una perspectiva pediátrica. Pediatr Anaesth 2012;22:39–43.
- Auroy Y, Narchi P, Messiah A, et al: Complicaciones graves relacionadas con la anestesia regional: resultados de una encuesta prospectiva en Francia. Anestesiología 1997;87:447–486.
- Auroy Y, Benhamou D, Barques L, et al: Complicaciones mayores de la anestesia regional en Francia: el servicio de línea directa de anestesia regional SOS. Anestesiología 2002;97:1274–1280.
- Brown, Ransom DM, Hall JA, et al: Anestesia regional y local toxicidad sistémica inducida por anestésicos: frecuencia de las convulsiones y cambios cardiovasculares acompañantes. Anesth Analg 1995;81:321–328.
- Barrington MJ, Watts SA, Gledhill SR, et al: Resultados preliminares de la Colaboración de Anestesia Regional Australiana. Una auditoría prospectiva de más de 7000 bloqueos de plexos y nervios periféricos por complicaciones neurológicas y de otro tipo. Reg Anesth Pain Med 2009;34:534–541.
- Sitios BD, Taenzer AH, Herrick MD, et al: Incidencia de toxicidad sistémica anestésica local y síntomas neurológicos posoperatorios asociados con 12,668 bloqueos nerviosos guiados por ultrasonido. Un análisis a partir de un registro clínico prospectivo. Reg Anesth Pain Med 2012;37:478–482.
- Orebaugh SL, Kentor ML, Williams BA: Resultados adversos asociados con nervio periférico guiado por estimulador nervioso y guiado por ultrasonido Bloques por aprendices supervisados: actualización de una base de datos de un solo sitio. Reg Anesth Pain Med 2012;37:577–582.
- Tanaka K, Watanabe R, Harada T, et al: Aplicación extensiva de anestesia y analgesia epidural en un hospital universitario: incidencia de complicaciones relacionadas con la técnica. Reg Anesth 1993; 18:34–38.
- Kenepp NB, Gutsche BB: inyecciones intravasculares involuntarias durante la anestesia epidural lumbar. Anestesiología 1981;54:172–173.
- Griffiths JD, Le NV, Grant S, et al: Toxicidad sintomática del anestésico local y concentraciones plasmáticas de ropivacaína después del bloqueo del plano del transverso del abdomen para la cesárea. Hermano J Anaesth 2013;110:996–1000.
- Weiss E, Jolly C, Dumoulin JL, et al: Convulsiones en 2 pacientes después de bloqueos bilaterales del plano del transverso del abdomen guiados por ecografía para cesárea. Reg Anesth Pain Med 2014;39:248–251.
- Giordano D, Panini A, Pernice C, et al: Toxicidad neurológica de la lidocaína durante la intubación despierto en un paciente con absceso en la base de la lengua. Reporte de un caso. Am J Otoralyngol 2014;35:62–65.
- Gunja N, Varshney K: Anestesia del tronco encefálico después del bloqueo retrobulbar: una causa rara de coma que se presenta en el departamento de emergencias. Emerg Med Australas 2006;18:83–85.
- Dahle JM, Iserson KV: Tratamiento en la sala de urgencias de la anestesia del tronco encefálico
bloqueo retrobulbar. Am J Emerg Med 2007;25:105–106. - Tatum PL, Defalque RJ: Inyección subaracnoidea durante bloqueo retrobulbar: reporte de un caso. Soy enfermera asociada Anesth J 1994;62:49–52.
- Zenous AT, Ebrahimi H, Mahdipour M, et al: La incidencia de entrada de la aguja intravascular durante la inyección del bloqueo del nervio alveolar inferior. J Dent Res Dent Clin Prospects 2008;2:38–41.
- Hahn C, Nagdev A: bloqueo del plexo braquial supraclavicular guiado por ultrasonido Doppler color para prevenir la inyección vascular. West J Emerg Med 2014;15:703–705.
- Monti M, Monti A, Borgognoni F, et al: Tratamiento con terapia lipídica para reanimar a un paciente que sufre toxicidad por anestésicos locales. Emerg Care J 2014;10:41–44.
- Harvey M, Cave G, Chanwai G, et al: Reanimación exitosa del colapso cardiovascular inducido por bupivacaína con emulsión de lípidos intravenosos después del bloqueo del nervio femoral en un departamento de emergencias. Emerg Med Australas 2014;23:209–214.
- Weinberg GL: Tratamiento de la toxicidad sistémica por anestésicos locales. Reg Anesth Pain Med 2010;35:188–193.
- Soltesz EG, van Pelt F, Byrne JG, et al: Derivación cardiopulmonar emergente para la cardiotoxicidad de la bupivacaína. J Cardiothorc Vasc Anesth 2003;17: 357–358.
- Russell RL, Westfall BA: Alivio de la depresión por barbitúricos. Anesth Analg 1962;41:582–585.
- Krieglstein J, Meffert A, Niemeyer DH: Influencia de la grasa emulsionada en la disponibilidad de clorpromazina en sangre de conejo. Experientia 1974;30: 924–926.
- Corr PB, Yamada KA: Alteraciones metabólicas seleccionadas en el corazón isquémico y sus contribuciones a la arritmogénesis. Hertz 1995;20:156–168.
- Weinberg GL, Laurito CE, Geldner P, et al: Arritmias ventriculares malignas en un paciente con academia isovalérica que recibe anestesia general y local para lipectomía por succión. J Clin Anesth 1997;9:668–670.
- Weinberg GL, Ripper R, Murphy P, et al: La infusión de lípidos acelera la eliminación de bupivacaína y la recuperación de la toxicidad de bupivacaína en el corazón de rata aislado. Reg Anesth Pain Med 2006;31:296–303.
- Rosenblatt MA, Abel M, Fischer GW, et al: uso exitoso de una emulsión de lípidos al 20 % para reanimar a un paciente después de un presunto paro cardíaco relacionado con la bupivacaína. Anestesiología 2006;105:217–218.
- Cave G, Harvey M, Willers J, et al: Informe LIPAEMIC: resultados del uso clínico de la emulsión de lípidos intravenosos en la toxicidad de fármacos informados en un registro de lípidos en línea. J Med Toxicol 2014;10:133–142.
- Presley JD, Chyka PA: Emulsión lipídica intravenosa para revertir la toxicidad aguda por fármacos en pacientes pediátricos. Ann Pharmacother 2013;47:735–743.
- Fettiplace MR, Weinberg G: Pasado, presente y futuro de la terapia de reanimación con lípidos. JPEN J Parent Enteral Nutr 2015;39(1 suplemento):72S–83S, 2015.
- Wagner M, Zausiq YA, Ruf S, et al: El rescate de lípidos revierte el bloqueo inducido por bupivacaína de la corriente rápida de Na+ (INa) en cardiomiocitos del ventrículo izquierdo de rata. Anestesiología 2014;120:724–736.
- Mazoit JX, Le Guen R, Beloeil H, et al: Unión de anestésicos locales de larga duración a emulsiones de lípidos. Anestesiología 2009;110:380–386.
- Kuo IK, Akpa BS: Validez del sumidero de lípidos como mecanismo para revertir la toxicidad sistémica del anestésico local. Anestesiología 2013;118:1350–1361.
- Fettiplace MR, Ripper R, Lis K, et al: efectos cardiotónicos rápidos de la infusión de emulsión de lípidos. Crit Care Med 2013;41:e156–e162.
- Fettiplace MR, Akpa BS, Ripper R, et al: Resucitación con emulsión de lípidos: la recuperación dependiente de la dosis de la farmacotoxicidad cardíaca requiere un efecto cardiotónico. Anestesiología 2014;120:915–925.
- Ozcan MS, Weinberg G: Actualización sobre el uso de emulsiones de lípidos en la toxicidad sistémica de anestésicos locales: un enfoque en la eficacia diferencial y la emulsión de lípidos como parte del soporte vital cardíaco avanzado. Int Anesthesiol Clin 2011;49:91–103.
- Hiller DB, DiGrigorio G, Kelly K, et al: Seguridad de la infusión de emulsión de lípidos de alto volumen. Una primera aproximación de LD50 en ratas. Reg Anesth Pain Med 2010;35:140–144.
- Ozcan MS, Weinberg G: Emulsión lipídica intravenosa para el tratamiento de la toxicidad por fármacos. J Cuidados Intensivos Med 2014;29:59–70.
- Brull SJ: Emulsión de lípidos para el tratamiento de la toxicidad por anestésicos locales: implicaciones para la seguridad del paciente. Anesth Analg 2008;106:1337–1339.
- Neal JM, Bernards CM, Butterworth JF 4th, et al: Asesoramiento práctico de la ASRA sobre la toxicidad sistémica de los anestésicos locales. Medicamento para el dolor Reg Anesth 2010; 35: 152-161.
- Neal JM, Mulroy MF, Weinberg GL: Sociedad Estadounidense de Estudios Regionales
Lista de verificación de anestesia y medicina del dolor para el manejo de la anestesia local
toxicidad sistémica: versión 2012. Reg Anesth Pain Med 2012;37:16–18. - Fettiplace MR, Ripper R, Lis K, et al: Emulsión lipídica intraósea: una alternativa eficaz a la administración intravenosa en situaciones de emergencia. Crit Care Med 2014;42:157–160.
- Neal JM: Anestesia regional guiada por ultrasonido y seguridad del paciente. Reg Anesth Pain Med 2010;35:S59–S67.
- Orebaugh SL, Williams BA, Vallejo M, et al: Resultados adversos asociados con bloqueos de nervios periféricos basados en estimulador con versus sin visualización de ultrasonido. Reg Anesth Pain Med 2009;34:251–255.
- Salinas FV, Hanson NA: Medicina basada en la evidencia para la anestesia regional guiada por ultrasonido. Anesthesiol Clin 2014;32:771–787.
- Mulroy MF, Hejtmanek MR: Prevención de la anestesia local sistémica
toxicidad. Reg Anesth Pain Med 2010;35:177–180. - Neal JM: Toxicidad sistémica de los anestésicos locales. Mejorando la seguridad del paciente paso a paso. Reg Anesth Pain Med 2013;38:259–261.
- Neal JM, Hsiung Rl, Mulroy MF, et al: La lista de verificación de ASRA mejora el rendimiento del alumno durante un episodio simulado de toxicidad sistémica por anestésico local. Reg. Anesth Pain Med 212;37:8–15.
- McEvoy MD, Hand WR, Stoll WD, et al: El cumplimiento de las pautas para el manejo de la toxicidad sistémica de los anestésicos locales se mejora mediante una herramienta electrónica de apoyo a la toma de decisiones y un "lector" designado. Reg Anesth Pain Med 2014;392:299–305.
- Sagir A, Goyal R: Una evaluación de la conciencia de la toxicidad sistémica de los anestésicos locales entre los residentes de posgrado de múltiples especialidades. J Anesth 2015; 29:299–302.
Marina Gitman, Michael Fettiplace y Guy Weinberg

