1. HISTOIRE
La découverte de l'anesthésie inhalée reflète les contributions de cliniciens et de scientifiques aux États-Unis et en Angleterre (Fig. 1) (1). Les anesthésiques inhalés les plus couramment utilisés dans l'anesthésie moderne comprennent les liquides volatils (c'est-à-dire l'halothane, l'enflurane, l'isoflurane, le desflurane et le sévoflurane) et un seul gaz (c'est-à-dire le protoxyde d'azote) (Figs. 2 et 3). L'halothane, l'enflurane et l'isoflurane ne sont plus couramment utilisés. Pourtant, aucun de ces anesthésiques inhalés ne répond à tous les critères d'un anesthésique inhalé « idéal », et les caractéristiques chimiques diffèrent d'un médicament à l'autre.

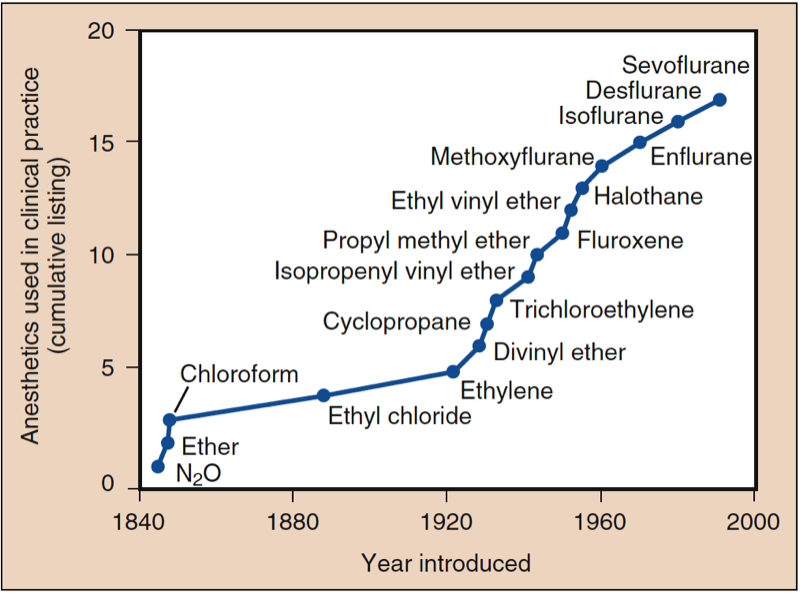
- Fig. 1. Anesthésiques utilisés en pratique clinique. L'histoire de l'anesthésie a commencé avec l'introduction du protoxyde d'azote (N2O), de l'éther et du chloroforme. Après 1950, tous les médicaments introduits, à l'exception de l'éther éthylvinylique, contenaient du fluor. Tous les anesthésiques introduits à partir de l'halothane sont ininflammables. (De Eger EI. Desflurane (Suprane): A Compendium and Reference. Nutley, NJ: Anaquest; 1993:1, utilisé avec permission.)

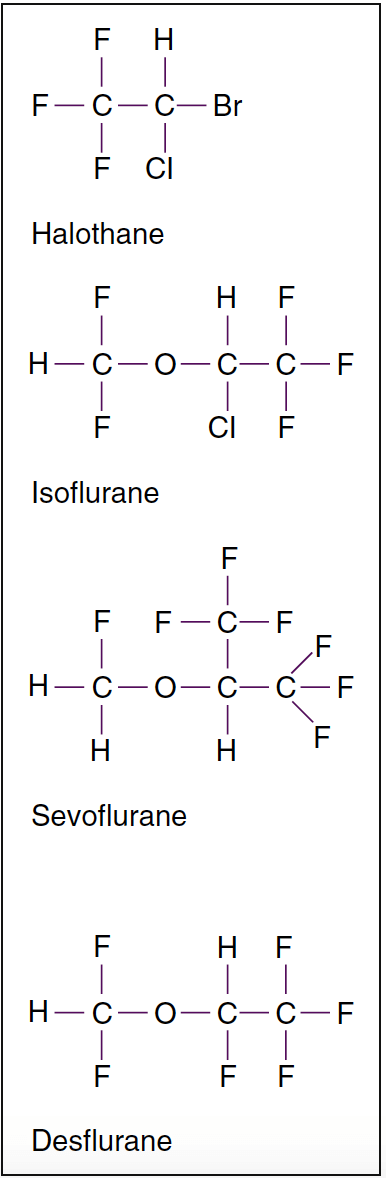
- Fig. 2. Structures moléculaires d'anesthésiques volatils puissants. Les anesthésiques volatils halogénés sont des liquides à température ambiante. Parmi les anesthésiques volatils, l'halothane est un dérivé d'alcane, alors que tous les autres sont des dérivés de l'éther méthyléthylique. L'isoflurane est l'isomère chimique de l'enflurane.

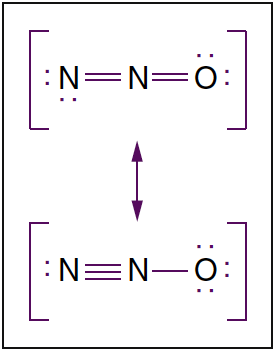
- Fig. 3. Structure moléculaire de l'oxyde nitreux. L'oxyde nitreux est une molécule linéaire existant dans deux structures de résonance. Les points désignent les électrons non liés.
2. LES PREMIERS ANESTHÉSIQUES INHALÉS
L'oxyde nitreux
Le protoxyde d'azote a été synthétisé pour la première fois en 1772 par le chimiste anglais, auteur et ministre unitarien Joseph Priestley. Vingt-sept ans plus tard, Sir Humphry Davy a administré du protoxyde d'azote pour l'analgésie dentaire. Bien qu'il soupçonnait que le protoxyde d'azote pouvait être utilisé pour soulager la douleur lors d'une intervention chirurgicale, ce n'est que 42 ans plus tard qu'il a été utilisé par un dentiste de 29 ans nommé Horace Wells qui s'est administré du protoxyde d'azote et a constaté que cela soulageait sa douleur. Plus précisément, il remarqua les effets hypnotiques et analgésiques du protoxyde d'azote lors d'une exposition publique à Hartford, Connecticut, en 1842. Le lendemain, Wells lui-même subit une extraction dentaire par un collègue dentiste. Wells n'a ressenti qu'une douleur minime lors de l'extraction, et il a ensuite appris la méthode de synthèse de l'oxyde nitreux pour la mettre à la disposition de ses propres patients. Deux ans plus tard, il s'est arrangé pour faire la démonstration d'une chirurgie dentaire indolore utilisant l'administration de protoxyde d'azote au Massachusetts General Hospital. N'ayant pas complètement réussi, Wells a été discrédité à la suite de cette démonstration.
L'éther diéthylique
William Morton, un dentiste de Boston, a remarqué que l'éther diéthylique, lors des "ébats éthériques" au cours desquels l'éther était respiré pour ses effets enivrants, avait des effets similaires à ceux de l'oxyde nitreux. Comme Wells, Morton appliqua l'éther dans son cabinet dentaire, puis démontra ses propriétés anesthésiques au Massachusetts General Hospital le 16 octobre 1846 (« jour de l'éther »). Contrairement à la débâcle de Wells, la démonstration de Morton a été accueillie avec beaucoup d'enthousiasme. Les résultats des anesthésiques à l'éther réussis furent bientôt publiés dans le Boston Medical and Surgical Journal. Bien que Crawford Long ait administré de l'éther diéthylique à un patient en 1842, 4 ans plus tôt que Morton, il n'a pas rendu public son travail, et Morton a donc traditionnellement été crédité de la découverte de la capacité de l'éther diéthylique à produire une anesthésie.
Chloroforme
James Simpson, un obstétricien d'Édimbourg, en Écosse, a développé du chloroforme, qui ne partageait pas l'induction prolongée, l'inflammabilité et les nausées postopératoires observées avec l'éther diéthylique. Le chloroforme est rapidement devenu populaire comme anesthésique inhalé en Angleterre, bien que l'éther diéthylique ait dominé la pratique médicale en Amérique du Nord. Malheureusement, le chloroforme a été associé à plusieurs décès peropératoires inexpliqués de patients par ailleurs en bonne santé et à de nombreux cas d'hépatotoxicité.
3. LES ANESTHÉSIQUES INHALÉS ENTRE 1920 ET 1940
Entre 1920 et 1940, l'éthylène, le cyclopropane et l'éther divinylique ont été introduits dans l'utilisation comme anesthésiques, gagnant l'acceptation sur les anesthésiques inhalés plus anciens (à l'exception de l'oxyde nitreux) en produisant une induction plus rapide et plus agréable de l'anesthésie et en permettant un réveil plus rapide à la conclusion de la chirurgie. Cependant, chacun présentait de sérieux inconvénients. Beaucoup étaient inflammables (c.-à-d. éther diéthylique, éther divinylique, éthylène et cyclopropane), tandis que d'autres, entièrement halogénés avec du chlore, étaient toxiques (c.-à-d. chloroforme, chlorure d'éthyle et trichloroéthylène).
4. CHIMIE DU FLUOR ET ANESTHÉSIQUES INHALÉS MODERNES
Les techniques de la chimie du fluor, développées à partir des efforts pour produire les premières armes atomiques, ont trouvé un but fortuit et socialement bénéfique en fournissant une méthode de synthèse des anesthésiques inhalés modernes (2,3). Les anesthésiques inhalés modernes sont halogénés partiellement ou entièrement avec du fluor (voir Fig. 2). La fluoration offre une plus grande stabilité et une moindre toxicité.
Halothane
L'halothane a été introduit dans la pratique clinique en 1956 et est devenu largement utilisé. Il présentait plusieurs avantages par rapport aux anesthésiques plus anciens, notamment l'ininflammabilité, une odeur agréable, une moindre toxicité pour les organes et des propriétés pharmacocinétiques permettant une induction et une émergence beaucoup plus rapides de l'anesthésie par rapport à l'éther. Malheureusement, après 4 ans d'utilisation commerciale, des rapports de nécrose hépatique fulminante après anesthésie à l'halothane ont commencé à apparaître chez des patients chez lesquels d'autres causes de lésions hépatiques n'étaient pas évidentes. La question des lésions hépatiques imprévisibles a stimulé la recherche d'autres anesthésiques volatils. L'halothane sensibilise également le myocarde aux effets arythmogènes des catécholamines.
Méthoxyflurane
Le méthoxyflurane a été introduit pour la première fois dans la pratique clinique en 1960. Au cours de la première décennie de son introduction, des rapports d'insuffisance rénale avec anesthésie au méthoxyflurane sont apparus, conduisant à des études confirmant une néphrotoxicité liée à la dose en raison du fluorure inorganique résultant du métabolisme de cet anesthésique.
Enflurane
L'enflurane a été introduit dans la pratique clinique en 1972. Contrairement à l'halothane, il n'a pas sensibilisé le cœur aux catécholamines et n'a pas été associé à une hépatotoxicité. Cependant, l'enflurane était métabolisé en fluorure inorganique et pouvait provoquer des signes d'activité convulsive sur l'électroencéphalogramme (EEG), en particulier lorsqu'il était administré à des concentrations élevées et en présence d'hypocapnie.
Isoflurane
L'isoflurane a été introduit dans la pratique clinique en 1980 et a été largement utilisé en clinique. Il n'a pas été associé à des troubles du rythme cardiaque. Parce qu'il n'est pas métabolisé aussi facilement que l'halothane et l'enflurane, l'isoflurane a été associé à une toxicité moindre. L'isoflurane a permis un début plus rapide de l'anesthésie chirurgicale et un réveil plus rapide par rapport à ses prédécesseurs.
Sévoflurane et Desflurane
Le sévoflurane et le desflurane sont halogénés exclusivement avec du fluor et ont été synthétisés pour la première fois à la fin des années 1960 et dans les années 1970, respectivement (2,3). Les deux étaient coûteux et difficiles à synthétiser et n'ont donc pas été immédiatement envisagés pour une utilisation commerciale. Dans les années 1980, leur développement a été reconsidéré à la lumière d'une nouvelle appréciation selon laquelle une proportion croissante de la pratique anesthésique se déroulait en ambulatoire et que les médicaments halogénés exclusivement avec du fluor étaient moins solubles dans le sang et les tissus, permettant un réveil et une récupération plus rapides.
5. MECANISME D'ACTION
La question de savoir comment les anesthésiques inhalés produisent l'état anesthésique peut être abordée à de nombreux niveaux d'organisation biologique, y compris leur emplacement d'action dans le système nerveux central, les molécules avec lesquelles ils interagissent et la nature de cette interaction biologique. Pour répondre à ces questions, il faut être capable de mesurer les effets anesthésiques (4). Bien que les anesthésiques inhalés soient utilisés pour fournir une anesthésie chirurgicale depuis près de 160 ans, il n'existe pas de définition unique et acceptée de ce qui constitue l'état anesthésique. À des fins expérimentales, une définition opérationnelle de l'immobilité en réponse à la stimulation chirurgicale et de l'amnésie pour les événements peropératoires s'est avérée utile.
Caractéristiques mesurables
Les caractéristiques mesurables et universelles de tous les anesthésiques inhalés comprennent la production d'immobilité et d'effets amnésiques. L'immobilité est mesurée par la concentration alvéolaire minimale (MAC) d'anesthésique nécessaire pour supprimer le mouvement vers une incision chirurgicale chez 50 % des patients (2,5). Cependant, la présence d'amnésie ou de prise de conscience est difficile à assurer. Bien que l'analgésie fasse partie de l'état anesthésique, elle ne peut pas non plus être mesurée chez un patient immobile qui ne se souvient pas. Des mesures de substitution de la douleur (c.-à-d. augmentation de la fréquence cardiaque ou de la pression artérielle systémique) suggèrent que les anesthésiques inhalés ne suppriment pas la perception des stimuli douloureux. Certains anesthésiques inhalés ont des effets hyperalgésiques (renforçant la douleur) à de petites concentrations. La relaxation des muscles squelettiques est un effet central courant, mais pas universel, des anesthésiques inhalés, comme en témoigne l'oxyde nitreux, qui augmente le tonus des muscles squelettiques.
Immobilité
Les anesthésiques inhalés puissants produisent l'immobilité principalement par leurs actions sur la moelle épinière, comme en témoigne la détermination du MAC chez les animaux décérébrés (6). Des études chez les rongeurs suggèrent que le protoxyde d'azote active les voies noradrénergiques descendantes provenant du tronc cérébral de la matière grise périaqueducale, qui à leur tour inhibent l'entrée nociceptive dans la corne dorsale de la moelle épinière (7,8).
Effets amnésiques
Les structures supraspinales telles que l'amygdale, l'hippocampe et le cortex sont considérées comme des cibles hautement probables pour les effets amnésiques des anesthésiques.
Dépression du système nerveux central et canaux ioniques
Les anesthésiques inhalés produisent une dépression du système nerveux central par leurs actions sur les canaux ioniques, qui régissent le comportement électrique du système nerveux (4). Les anesthésiques inhalés produisent probablement une anesthésie en améliorant la fonction des canaux ioniques inhibiteurs et en bloquant la fonction des canaux ioniques excitateurs. L'amélioration de la fonction des canaux ioniques inhibiteurs conduit à une hyperpolarisation du neurone. L'hyperpolarisation se produit lorsque les anions chlorure pénètrent dans les neurones via les récepteurs de l'acide γ-aminobutyrique A (GABAA) ou les récepteurs de la glycine ou lorsqu'il y a un efflux de cations potassium hors des neurones via les canaux ioniques potassium. Le blocage de la fonction des canaux ioniques excitateurs empêche la dépolarisation du neurone en empêchant le passage de charges positives dans le neurone (c'est-à-dire le passage des ions sodium à travers les récepteurs N-méthyl-D-aspartate [NMDA] ou les canaux sodium). Les anesthésiques peuvent également affecter la libération des neurotransmetteurs, et cet effet peut être médié en partie par les canaux ioniques qui régulent la libération des neurotransmetteurs.
6. PROPRIÉTÉS PHYSIQUES
Structure moleculaire
Les anesthésiques inhalés modernes, à l'exception du protoxyde d'azote, sont des hydrocarbures halogénés. L'halothane n'a pas la fraction éther présente sur l'isoflurane, le sévoflurane et le desflurane, ce qui explique sa capacité à produire des arythmies cardiaques ventriculaires. L'isoflurane et le desflurane ne diffèrent que par la substitution d'un atome de chlore au fluor. La substitution du fluor confère une plus grande stabilité et résistance au métabolisme.
Pression de vapeur et livraison
Le protoxyde d'azote existe sous forme de gaz à température ambiante, bien qu'il devienne liquide à des pressions plus élevées. Les autres anesthésiques inhalés sont des liquides à température ambiante.
Vaporisateurs à Bypass Variable
L'halothane, le sévoflurane et l'isoflurane sont délivrés par des vaporisateurs à dérivation variable (Tec 4, 5 et 7 ; North American Draeger 19.n et 20.n). Le vaporisateur à dérivation variable contient deux flux de gaz frais entrant, l'un entrant en contact avec un réservoir (puisard) d'anesthésique liquide et l'autre contournant le puisard. Le flux de gaz traversant le puisard devient saturé d'anesthésique, tel que régi par la pression de vapeur saturée de l'anesthésique. Étant donné que les anesthésiques volatils produisent une anesthésie cliniquement utile à des pressions partielles bien inférieures à celle de leur pression de vapeur saturante, le gaz sortant du puisard doit être dilué par un gaz qui n'est pas entré en contact avec l'anesthésique. La concentration d'anesthésique dans le gaz sortant du vaporisateur est déterminée par le débit relatif (c'est-à-dire le rapport de séparation) de gaz frais à travers le canal de puisard par rapport au canal de dérivation. Le contrôle de la concentration de sortie de l'anesthésique sortant du vaporisateur se produit lorsque le clinicien ajuste le cadran du vaporisateur ou la commande électronique. Les vaporisateurs à dérivation variable sont compensés en température, maintenant une sortie constante sur une large plage de températures, et sont calibrés pour chaque anesthésique individuel en fonction de sa pression de vapeur différente. L'inclinaison ou le remplissage excessif d'un vaporisateur peut potentiellement conduire à l'administration d'une surdose d'anesthésique si la vapeur d'anesthésique pénètre dans le canal de dérivation.
Le vaporisateur à cassette Datex-Ohmeda Aladin, utilisé dans les appareils de l'unité d'administration d'anesthésie (ADU) Datex-Ohmeda, est un vaporisateur à commande électronique unique avec sa dérivation logée dans l'ADU et le puisard situé dans des cassettes interchangeables à codage magnétique pour l'administration d'halothane, enflurane, isoflurane, sévoflurane et desflurane. L'Aladin utilise une dérivation variable comme moyen de régulation de la concentration de sortie, via l'activité d'une unité centrale de traitement (CPU). Le CPU reçoit des entrées de plusieurs sources, y compris le réglage de la concentration, les débitmètres et les capteurs de pression et de température internes, et régule à son tour une vanne de régulation de débit à la sortie de la chambre de vaporisation. Si la pression dans la cassette (puisard) dépasse celle dans la chambre de dérivation, ce qui se produirait si la température ambiante dépassait 22.8 °C pendant l'administration de desflurane, un clapet anti-retour unidirectionnel est conçu pour se fermer, empêchant le retour rétrograde du gaz saturé d'anesthésique dans la ADU avec surdosage anesthésique ultérieur.
Vaporisateur chauffé
La pression de vapeur du desflurane au niveau de la mer est de 700 mm Hg à 20 ° C (état proche de l'ébullition à température ambiante) et la livraison par un vaporisateur à dérivation variable peut produire des concentrations imprévisibles. Pour cette raison, un vaporisateur spécialement conçu (Tec 6, Datex-Ohmeda) qui chauffe le gaz de desflurane à 2 atm de pression est utilisé pour mesurer et délivrer avec précision la vapeur de desflurane correspondant aux ajustements du cadran de concentration par le fournisseur d'anesthésie. Contrairement aux vaporisateurs à dérivation variable, la concentration de sortie de desflurane du Tec 6 est constante sur une plage de pressions barométriques (9). Par conséquent, à haute altitude, la pression partielle du desflurane sera inférieure à un réglage de vaporisateur Tec 6 et à une concentration de sortie (pourcentage en volume) donnés qu'au niveau de la mer, entraînant un sous-dosage de l'anesthésique à moins qu'un ajustement ne soit effectué en tenant compte de l'altitude plus élevée : réglage requis du vaporisateur = (réglage désiré du vaporisateur au niveau de la mer × 760 mm Hg)/pression barométrique locale (en mm Hg) (10). L'inverse (une plus grande sortie) peut se produire avec des vaporisateurs à dérivation variable. Cependant, le paramètre quantitatif pharmacologiquement pertinent pour l'activité anesthésique est la pression partielle, et non le pourcentage en volume. Par conséquent, bien qu'une plus grande sortie d'anesthésie d'un vaporisateur se produise à une altitude plus élevée pour le même réglage de vaporisateur, la pression partielle délivrée et l'impact anesthésique seront similaires dans les deux endroits en fonction du réglage du vaporisateur.
Considérations économiques et environnementales
Le débit de gaz frais impacte directement la quantité de liquide volatil utilisé, et par conséquent le coût de l'administration de l'anesthésique. Des débits de gaz frais plus élevés (à une ventilation minute ou supérieure) minimisent la réinspiration et permettent un équilibrage plus rapide entre les pressions partielles inspirées et du système nerveux central (SNC). Cependant, l'utilisation de flux sans réinspiration implique une perte d'anesthésique dans l'environnement et ne doit être utilisée que pendant une période limitée de minutes, généralement lors de l'induction de l'anesthésie ou dans les circonstances d'une sédation légère et d'une stimulation chirurgicale imminente. Il y a une prise de conscience et une préoccupation croissantes concernant la contribution de la libération d'anesthésique inhalé aux émissions globales de gaz à effet de serre et au changement climatique. L'impact environnemental potentiel semble provenir de la durée de vie atmosphérique du gaz, ainsi que du spectre d'absorption infrarouge unique de chaque anesthésique. Les longévités atmosphériques des anesthésiques inhalés diffèrent considérablement (protoxyde d'azote, desflurane, sévoflurane et isoflurane ayant respectivement 114, 10, 3.6 et 1.2 années estimées). Les spectres d'absorption infrarouge individuels diffèrent, le desflurane possédant relativement le plus grand impact équivalent en dioxyde de carbone par rapport au sévoflurane avec le plus faible. Bien que l'impact des anesthésiques inhalés sur le changement climatique global reste un sujet de controverse, plusieurs points méritent d'être pris en considération. Premièrement, l'utilisation de faibles débits de gaz frais (0.5-1 L/min) compensera les coûts et les rejets dans l'environnement. Deuxièmement, le développement de systèmes de récupération et de réutilisation des anesthésiques promet de limiter davantage l'impact environnemental et d'économiser de l'argent (11).
Stabilité
La dégradation de l'anesthésique par le métabolisme ou par une interaction avec les absorbants de dioxyde de carbone (surtout lorsqu'ils sont desséchés) produit plusieurs composés potentiellement toxiques (11).
Métabolisme et dégradation
Le méthoxyflurane produit du fluorure inorganique, responsable de l'incidence sporadique de la néphrotoxicité (c.-à-d. insuffisance rénale à haut débit) après une anesthésie prolongée dans le passé. Le composé A (c'est-à-dire le fluorométhyl-2,2-difluoro-1-[trifluorométhyl] vinyl éther), produit à partir de la dégradation du sévoflurane, et un composé similaire produit à partir de l'halothane sont néphrotoxiques chez les animaux après une exposition prolongée. Chez l'homme, une anesthésie prolongée avec du sévoflurane et de faibles débits de gaz frais (1 L/min) entraîne une exposition au composé A suffisante pour produire une protéinurie, une enzymurie et une glycosurie transitoires, mais il n'y a aucune preuve d'augmentation des concentrations de créatinine sérique ou d'effets délétères à long terme sur la fonction rénale. Néanmoins, la notice d'emballage du sévoflurane recommande qu'un faible débit de gaz frais (<2 L/min) soit limité à moins de 2 heures MAC (c.-à-d. concentration MAC × durée d'administration) d'anesthésie au sévoflurane.
Absorbants de dioxyde de carbone et réactions exothermiques
Les variables influençant la quantité de dégradation de l'anesthésique volatil lors de l'exposition aux absorbants de dioxyde de carbone comprennent l'état (c'est-à-dire l'hydratation et la température) et la composition chimique de l'absorbant, les débits de gaz frais, la ventilation minute et, le plus important, l'anesthésique lui-même (12) . Bien que le desflurane et l'isoflurane soient très stables dans les absorbants de dioxyde de carbone hydratés jusqu'à des températures supérieures à 60 °C, la dessiccation complète des absorbants de dioxyde de carbone conventionnels contenant de l'hydroxyde de sodium et de potassium provoque une dégradation et la production de monoxyde de carbone à partir de tous les anesthésiques volatils, quelles que soient les températures. Des débits de gaz frais élevés (en particulier ceux dépassant la ventilation minute normale) accélèrent la dessiccation de l'absorbant, et la dessiccation conduit à une dégradation accélérée. Comme la dégradation est un processus exothermique, la température de l'absorbant peut augmenter considérablement.
La réaction exothermique qui résulte de l'interaction de l'absorbant de dioxyde de carbone desséché et des anesthésiques volatils (en particulier le sévoflurane) peut produire des températures extrêmement élevées à l'intérieur de la cartouche absorbante (13,14). L'augmentation de la température peut entraîner une explosion et un incendie dans la cartouche ou le circuit d'anesthésie. Le faible risque d'incendie et d'explosion dû à des réactions exothermiques peut être entièrement évité en employant des mesures qui garantissent le maintien d'une hydratation adéquate dans l'absorbant de dioxyde de carbone (c'est-à-dire, changer régulièrement l'absorbant, couper ou couper le débit de gaz frais sur les appareils d'anesthésie sans surveillance, limiter les débits de gaz pendant l'anesthésie, et en cas de doute sur l'hydratation de l'absorbant, le changer). Les absorbants de dioxyde de carbone disponibles dans le commerce avec des bases monovalentes réduites ou absentes (c'est-à-dire l'hydroxyde de sodium et l'hydroxyde de potassium) ne subissent pas de dégradation importante lors de l'exposition à des anesthésiques volatils, quel que soit l'état d'hydratation de l'absorbant.
7. PUISSANCE RELATIVE DES ANESTHÉSIQUES INHALÉS
La puissance relative entre les anesthésiques inhalés est le plus souvent décrite par la dose nécessaire pour supprimer le mouvement chez 50 % des patients en réponse à une incision chirurgicale (5). Cette dose (un seul point sur une courbe dose-réponse) est appelée MAC. Étant donné que l'écart type du MAC est d'environ 10 %, 95 % des patients ne doivent pas bouger en réponse à l'incision à 1.2 MAC de l'anesthésique inhalé, et 99 % des patients ne doivent pas bouger en réponse à l'incision à 1.3 MAC de l'anesthésique inhalé. . Le MAC est affecté par plusieurs variables mais n'est pas affecté par le sexe ou la durée de la chirurgie et de l'anesthésie.
Le MAC permet de comparer les puissances entre les anesthésiques; L'isoflurane à 1.15 % est équipotent avec le desflurane à 6 % pour prévenir les mouvements en réponse à une incision chirurgicale chez des patients d'un âge et d'une température corporelle similaires. Remarquablement, les valeurs MAC pour différents anesthésiques inhalés sont additives. Par exemple, 0.5 MAC d'oxyde nitreux administré avec 0.5 MAC d'isoflurane a le même effet que 1 MAC de tout anesthésique inhalé pour empêcher le mouvement en réponse à l'incision (reflétant l'inhibition induite par l'anesthésie des réponses réflexes au niveau de la moelle épinière) ( 6). La concentration d'anesthésique au niveau du cerveau nécessaire pour empêcher le mouvement en réponse à une incision chirurgicale est susceptible d'être supérieure à la MAC.
La dose d'anesthésique nécessaire pour produire l'amnésie a probablement plus de variabilité que la MAC. La concentration alvéolaire d'isoflurane empêchant le rappel d'un stimulus verbal était de 0.20 MAC chez 50 % et de 0.40 MAC chez 95 % des volontaires (15). En supposant une distribution normale standard de la dose-réponse, l'écart type de la concentration minimale empêchant le rappel est donc environ la moitié de la valeur moyenne (0.1 MAC). En se référant aux courbes normales standard, nous pouvons calculer que la concentration nécessaire à 1 sujet sur 100,000 4.27 ayant le besoin anesthésique le plus élevé serait de 0.627 écarts-types (ET) au-dessus de la moyenne (c'est-à-dire supérieure à 16 MAC) pour empêcher le rappel du stimulus verbal. L'extrapolation de cette valeur au contexte de la chirurgie doit cependant être faite avec prudence, car la dose nécessaire pour empêcher le rappel d'une stimulation douloureuse par opposition à une stimulation verbale peut être considérablement plus importante (0.45). Le rapport de la concentration nécessaire pour empêcher la réponse motrice à l'incision chirurgicale (reflétée dans la MAC) à celle requise pour supprimer la conscience et empêcher le rappel diffère légèrement entre les anesthésiques inhalés puissants individuels et diffère considérablement entre les anesthésiques inhalés puissants collectivement par rapport au protoxyde d'azote. Les volontaires ayant reçu de l'isoflurane n'ont pas présenté de rappel avec 0.6 MAC d'isoflurane, alors qu'un rappel s'est produit avec jusqu'à 17 MAC d'oxyde nitreux (XNUMX).
8. PHARMACOCINÉTIQUE DES ANESTHÉSIQUES INHALÉS
La pharmacocinétique des anesthésiques inhalés décrit leur absorption (absorption) des alvéoles dans la circulation systémique, leur distribution dans le corps et leur élimination éventuelle par les poumons ou leur métabolisme principalement dans le foie. En contrôlant la pression partielle inspirée (PI) (identique à la concentration [%] en se référant à la phase gazeuse) d'un anesthésique inhalé, un gradient est créé de sorte que l'anesthésique est délivré de la machine anesthésique à son site d'action, le cerveau. L'objectif principal de l'anesthésie par inhalation est d'obtenir une pression partielle cérébrale constante et optimale (Pbr) de l'anesthésique.
Le cerveau et tous les autres tissus s'équilibrent avec la pression partielle de l'anesthésique inhalé qui leur est délivré par le sang artériel (Pa). De même, le sang s'équilibre avec la pression partielle alvéolaire (PA) de l'anesthésique :
PA ⇄ Pa ⇄ Pbr
Le maintien d'un PA constant et optimal devient une méthode indirecte mais utile pour contrôler le Pbr. Le PA d'un anesthésique inhalé reflète son Pbr et est la raison pour laquelle le PA est utilisé comme un indice de profondeur d'anesthésie, un reflet du taux d'induction et de récupération de l'anesthésie, et une mesure de puissance égale (voir la discussion précédente sous « Puissance relative des anesthésiques inhalés »). Comprendre les facteurs qui déterminent le PA et le Pbr permet au fournisseur d'anesthésie de contrôler et d'ajuster habilement la dose d'anesthésique inhalé délivrée au cerveau.
Facteurs qui déterminent la pression partielle alvéolaire
Le PA et finalement le Pbr d'un anesthésique inhalé sont déterminés par l'entrée (délivrance) dans les alvéoles moins l'absorption (perte) du médicament des alvéoles dans le sang artériel pulmonaire. L'apport d'anesthésique inhalé dépend de l'IP, de la ventilation alvéolaire (˙VA) et des caractéristiques du système respiratoire anesthésique. L'absorption de l'anesthésique inhalé dépend de la solubilité, du débit cardiaque (CO) et de la différence de pression partielle alvéolaire-veineuse (PA - Pv). Ces six facteurs agissent simultanément pour déterminer l'AP. Le métabolisme et la perte percutanée d'anesthésiques inhalés n'influencent pas significativement l'AP pendant l'induction et le maintien de l'anesthésie.
Pression partielle anesthésique inspirée
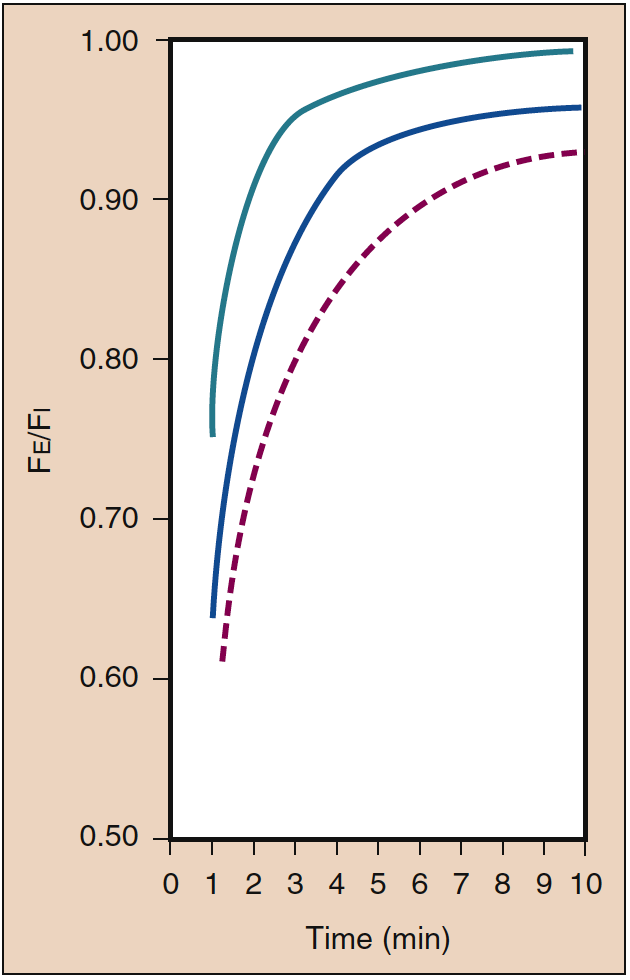
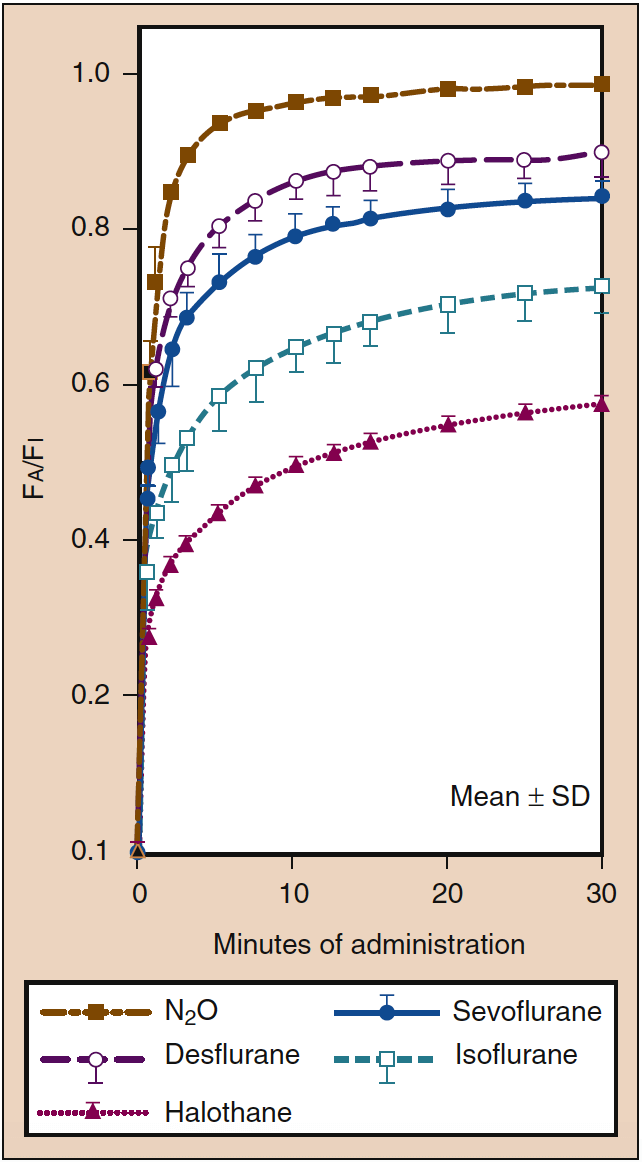
Un IP élevé est nécessaire lors de l'administration initiale d'un anesthésique inhalé. Cet IP initial élevé (c'est-à-dire l'apport) compense l'impact de l'absorption dans le sang et accélère l'induction de l'anesthésie comme en témoigne le taux d'augmentation de l'AP. Cet effet du PI est connu sous le nom d'effet de concentration. Cliniquement, la gamme de concentrations nécessaires pour produire un effet de concentration n'est probablement possible qu'avec le protoxyde d'azote (Fig. 4) (19).

- Fig. 4. L'impact de la concentration inspirée (%) (Fi) sur le taux d'augmentation de la concentration alvéolaire (de fin d'expiration) (Fe) est connu sous le nom d'effet de concentration. Les lignes indiquent des concentrations de 85 % (vert), 50 % (bleu) et 10 % (rouge pointillé). (D'après Eger EI. Effet de la concentration anesthésique inspirée sur le taux d'augmentation de la concentration alvéolaire. Anesthesiology. 1963;24:153-157, utilisé avec permission.)
Avec le temps, à mesure que l'absorption dans le sang diminue, l'IP doit être diminué pour correspondre à la diminution de l'absorption de l'anesthésique. La diminution de l'IP pour correspondre à la diminution de l'absorption avec le temps est essentielle si le fournisseur d'anesthésie veut atteindre l'objectif de maintenir une Pbr constante et optimale. Par exemple, si l'IP était maintenu constant avec le temps (constante d'entrée), l'AP (et la profondeur de l'anesthésie telle que reflétée par le Pbr) augmenteraient progressivement à mesure que l'absorption de l'anesthésique dans le sang diminuait avec le temps.
Deuxième effet de gaz
Le deuxième effet de gaz est un phénomène distinct qui se produit indépendamment de l'effet de concentration. La capacité de l'absorption à grand volume d'un gaz (premier gaz) à accélérer le taux d'augmentation du PA d'un gaz compagnon administré simultanément (second gaz) est connue sous le nom d'effet du second gaz. Par exemple, l'absorption initiale en grand volume d'oxyde nitreux accélère l'absorption de gaz compagnons tels que les anesthésiques volatils et l'oxygène. L'augmentation transitoire (environ 10 %) de la PaO2 qui accompagne la phase précoce de l'administration de protoxyde d'azote reflète le deuxième effet gazeux du protoxyde d'azote sur l'oxygène. Cette augmentation de PaO2 a été appelée hyperoxygénation alvéolaire. L'augmentation de l'afflux trachéal de tous les gaz inhalés (c'est-à-dire les premier et deuxième gaz) et la concentration des deuxièmes gaz dans un volume pulmonaire plus petit (c'est-à-dire l'effet de concentration) en raison de l'absorption de volume élevé du premier gaz sont les explications du deuxième gaz effet. Bien que le deuxième effet gazeux soit basé sur des principes pharmacocinétiques éprouvés, son importance clinique est douteuse.
Ventilation alvéolaire
L'augmentation de ˙VA, comme l'IP, favorise l'apport d'anesthésiques inhalés pour compenser l'absorption dans le sang. L'effet net est un taux d'augmentation plus rapide de l'AP et de l'induction de l'anesthésie. Comme on pouvait s'y attendre, l'hypoventilation a l'effet inverse, agissant pour ralentir l'induction de l'anesthésie.
La ventilation contrôlée des poumons qui entraîne une hyperventilation et une diminution du retour veineux accélère le taux d'augmentation de l'AP en raison de l'augmentation de l'apport (c. En conséquence, le risque de surdosage d'anesthésique peut être augmenté pendant la ventilation contrôlée des poumons, et il peut être approprié de diminuer l'IP des anesthésiques volatils lorsque la ventilation des poumons passe de spontanée à contrôlée pour maintenir l'AP similaire à celle présente. lors de la ventilation spontanée.
Un autre effet de l'hyperventilation est la diminution du débit sanguin cérébral en raison de la diminution associée de la PaCO2. En théorie, l'impact d'une augmentation de l'apport d'anesthésique sur le taux d'augmentation de l'AP serait compensé par une diminution de l'administration d'anesthésique au cerveau. Théoriquement, le débit sanguin coronaire peut rester inchangé, de sorte qu'une augmentation de l'apport anesthésique produit une dépression myocardique et qu'une diminution du débit sanguin cérébral empêche l'apparition concomitante d'une dépression du système nerveux central.
Système respiratoire anesthésique
Les caractéristiques du système respiratoire anesthésique qui influencent le taux d'augmentation de l'AP comprennent le volume du système, la solubilité des anesthésiques inhalés dans les composants en caoutchouc ou en plastique du système et l'afflux de gaz de la machine d'anesthésie. Le volume du système respiratoire anesthésique agit comme un tampon pour ralentir l'atteinte de l'AP. L'afflux élevé de gaz provenant de la machine d'anesthésie annule cet effet tampon. La solubilité des anesthésiques inhalés dans les composants du système respiratoire anesthésique ralentit initialement la vitesse à laquelle l'AP augmente. À la fin d'une anesthésie, l'inversion du gradient de pression partielle dans le système respiratoire anesthésique entraîne une élution des anesthésiques qui ralentit la vitesse à laquelle le PA diminue.
Solubilité
La solubilité des anesthésiques inhalés dans le sang et les tissus est indiquée par des coefficients de partage. Un coefficient de partage est un rapport de répartition décrivant comment l'anesthésique inhalé se répartit entre deux phases à l'équilibre (lorsque les pressions partielles sont identiques). Par exemple, un coefficient de partage sang-gaz de 10 signifie que la concentration de l'anesthésique inhalé est de 10 dans le sang et de 1 dans le gaz alvéolaire lorsque les pressions partielles de cet anesthésique dans ces deux phases sont identiques. Les coefficients de partage dépendent de la température. Par exemple, la solubilité d'un gaz dans un liquide est augmentée lorsque la température du liquide diminue. Sauf mention contraire, les coefficients de partage sont donnés pour 37°C.
Coefficient de partage sang-gaz
Une solubilité élevée dans le sang signifie qu'une grande quantité d'anesthésique inhalé doit être dissoute (c'est-à-dire subir une absorption) dans le sang avant que l'équilibre avec la phase gazeuse ne soit atteint. Le sang peut être considéré comme un réservoir pharmacologiquement inactif, dont la taille est déterminée par la solubilité de l'anesthésique dans le sang. Lorsque le coefficient de partage sang-gaz est élevé, une grande quantité d'anesthésique doit être dissoute dans le sang avant que le Pa ne s'équilibre avec le PA (Fig. 5) (18). Cliniquement, l'impact d'une solubilité sanguine élevée sur le taux d'augmentation de l'AP peut être compensé dans une certaine mesure par l'augmentation de l'IP. Lorsque la solubilité du sang est faible, des quantités minimales d'anesthésique doivent être dissoutes dans le sang avant que l'équilibre ne soit atteint, de sorte que le taux d'augmentation du PA et celui du Pa et du Pbr soient rapides (voir Fig. 5) (20).

- Fig. 5. Le coefficient de partage sang-gaz est le principal déterminant de la vitesse à laquelle la concentration alvéolaire (Fa) augmente vers une concentration inspirée constante (Fi). Le taux d'induction de l'anesthésie est parallèle au taux d'augmentation du Fa. Malgré une solubilité sanguine similaire (voir tableau 1), le taux d'augmentation de Fa est plus rapide pour le protoxyde d'azote (ligne pointillée brun-or) que pour le desflurane (ligne violette pointillée) ou le sévoflurane (ligne bleue continue), reflétant l'impact de la effet de la concentration sur le protoxyde d'azote (voir Fig. 4). Une plus grande solubilité tissulaire du desflurane et du sévoflurane peut également contribuer à un taux d'augmentation plus lent du Fa de ces médicaments par rapport au protoxyde d'azote. SD, écart type. (De Yasuda N, Lockhart SH, Eger EI II, et al. Comparaison de la cinétique du sévoflurane et de l'isoflurane chez l'homme. Anesth Analg. 1991;72:316-324, utilisé avec permission.)
Coefficients de partage tissu-sang
Les coefficients de partage tissu-sang déterminent le temps nécessaire à l'équilibrage du tissu avec le Pa (voir tableau 1). Ce temps peut être prédit en calculant une constante de temps (c'est-à-dire la quantité d'anesthésique inhalé qui peut être dissoute dans le tissu divisée par le flux sanguin tissulaire) pour chaque tissu. Les coefficients de partage cerveau-sang pour un anesthésique volatil tel que l'isoflurane donnent des constantes de temps d'environ 3 à 4 minutes. L'équilibrage complet de tout tissu, y compris le cerveau, avec le Pa nécessite au moins trois constantes de temps. C'est la raison pour maintenir le PA de cet anesthésique volatil constant pendant 10 à 15 minutes avant de supposer que le Pbr est similaire. Les constantes de temps pour les anesthésiques moins solubles tels que le protoxyde d'azote, le desflurane et le sévoflurane sont d'environ 2 minutes, et l'équilibrage complet est atteint en environ 6 minutes (c'est-à-dire trois constantes de temps).
Transfert anesthésique par diffusion intertissulaire
Il est de plus en plus évident qu'une partie de l'absorption d'anesthésique peut se produire non pas par le flux sanguin vers divers tissus, mais par transfert direct à partir de tissus ayant une affinité faible à élevée pour l'anesthésique (c'est-à-dire des tissus maigres aux tissus adipeux), comme l'interface entre les viscères et graisse épiploïque (voir « Mi-temps sensible au contexte »). Les personnes plus grandes (21) et les animaux (22) avec une surface d'interface maigre-gras vraisemblablement plus grande montrent une plus grande absorption de sévoflurane et d'isoflurane. Le transfert vers la masse grasse par le flux sanguin au cours d'une anesthésie d'une durée cliniquement réaliste (moins de 12 à 24 heures) est peu susceptible d'expliquer ces différences, compte tenu du débit sanguin relativement faible reçu par le compartiment de la masse grasse et de sa taille relativement importante.
Inactivation de l'oxyde nitreux et de la méthionine synthase
Le protoxyde d'azote est unique parmi les anesthésiques par son inactivation de la méthionine synthase, l'enzyme régulant le métabolisme de la vitamine B12 et du folate. Bien que l'impact de l'inactivation enzymatique puisse être subtil ou subclinique chez de nombreux patients, ceux qui ont une maladie grave sous-jacente ou une carence préexistante en vitamine B12 peuvent souffrir de séquelles neurologiques ou hématologiques. L'homocystéine, qui nécessite une méthionine synthase fonctionnelle pour être convertie en méthionine, est associée à un risque accru d'événements coronariens indésirables lorsqu'elle est présente à une concentration élevée dans le sang (23). Les patients recevant du protoxyde d'azote au cours d'une endartériectomie carotidienne présentaient des taux d'homocystéine et une fréquence d'épisodes ischémiques myocardiques significativement élevés par rapport aux patients ne recevant pas de protoxyde d'azote (24).
Transfert d'oxyde nitreux vers des espaces gazeux fermés
Le coefficient de partage sang-gaz du protoxyde d'azote (0.46) est 34 fois supérieur à celui de l'azote (0.014). Cette solubilité différentielle signifie que le protoxyde d'azote peut quitter le sang pour pénétrer dans une cavité remplie d'air 34 fois plus rapidement que l'azote ne peut quitter la cavité pour pénétrer dans le sang. Du fait de ce transfert préférentiel de protoxyde d'azote, le volume ou la pression de la cavité remplie d'air augmente. L'entrée de protoxyde d'azote dans une cavité remplie d'air entourée d'une paroi souple (p. ex., gaz intestinaux, pneumothorax, bulles pulmonaires, embolie gazeuse) provoque l'expansion de l'espace gazeux. Inversement, l'entrée de protoxyde d'azote dans une cavité remplie d'air entourée d'une paroi non compliante (p. ex., oreille moyenne, ventricules cérébraux, espace sous-dural supratentoriel) provoque une augmentation de la pression.
L'ampleur de l'augmentation de volume ou de pression dans la cavité remplie d'air est influencée par l'AP du protoxyde d'azote, le flux sanguin vers la cavité remplie d'air et la durée de l'administration de protoxyde d'azote. Dans un modèle animal, l'inhalation de protoxyde d'azote à 75 % double le volume d'un pneumothorax en 10 minutes (25). La présence d'un pneumothorax fermé est une contre-indication à l'administration de protoxyde d'azote. La diminution de la compliance pulmonaire lors de l'administration de protoxyde d'azote à un patient ayant des antécédents de traumatisme thoracique (c.-à-d. fractures de côtes) peut refléter l'expansion induite par le protoxyde d'azote d'un pneumothorax précédemment non reconnu. De même, les bulles d'air associées à l'embolie gazeuse veineuse se dilatent rapidement lorsqu'elles sont exposées au protoxyde d'azote. Contrairement à l'expansion rapide d'un pneumothorax ou de bulles d'air (c'est-à-dire une embolie gazeuse veineuse), l'augmentation du volume des gaz intestinaux produits par le protoxyde d'azote est lente. La question de savoir s'il faut administrer du protoxyde d'azote aux patients subissant une chirurgie intra-abdominale importe peu si l'intervention est courte. Cependant, limiter la concentration inhalée de protoxyde d'azote à 50 % peut être une recommandation prudente lorsque le volume de gaz intestinaux est augmenté (p. ex., occlusion intestinale) avant l'opération. En suivant cette ligne directrice, le volume de gaz intestinal doublerait au maximum, même pendant des opérations prolongées (25).
Débit cardiaque
Le CO influence la captation dans le sang artériel pulmonaire et donc le PA en emportant plus ou moins d'anesthésique des alvéoles. Un CO élevé (p. ex., induit par l'anxiété) entraîne une absorption plus rapide, de sorte que le taux d'augmentation de l'AP et l'induction de l'anesthésie sont ralentis. Un faible taux de CO (par exemple, un choc) accélère le taux d'augmentation du PA car il y a moins d'absorption dans le sang pour s'opposer à l'entrée. Une impression clinique commune est que l'induction de l'anesthésie chez les patients en état de choc est rapide.
Shunter
Un shunt intracardiaque ou intrapulmonaire droite-gauche ralentit la vitesse d'induction de l'anesthésie. Ce ralentissement reflète l'effet de dilution du sang shunté ne contenant pas d'anesthésique sur la pression partielle d'anesthésique dans le sang provenant des alvéoles ventilées. Un mécanisme similaire est responsable de la diminution de la PaO2 en présence d'un shunt droite-gauche.
Un shunt gauche-droite (p. ex., fistule artério-veineuse, augmentation du débit sanguin cutané induite par un anesthésique volatil) entraîne l'administration aux poumons de sang veineux contenant une pression partielle d'anesthésique plus élevée que celle présente dans le sang veineux qui a traversé le tissus. En conséquence, un shunt tissulaire gauche-droite compense l'effet de dilution d'un shunt droite-gauche sur le Pa. L'effet d'un shunt gauche-droite sur le taux d'augmentation du Pa n'est détectable que si il y a présence concomitante d'un shunt droite-gauche. De même, l'effet de dilution d'un shunt droite-gauche est plus important en l'absence d'un shunt gauche-droite. Tous facteurs confondus, il semble peu probable que l'impact d'un shunt droite-gauche soit cliniquement apparent.
Ventilation gaspillée
La ventilation des alvéoles non perfusées n'influence pas la vitesse d'induction de l'anesthésie car il n'y a pas d'effet de dilution sur le Pa. L'effet principal de la ventilation gaspillée est la production d'une différence entre le PA et le Pa de l'anesthésique inhalé. Un mécanisme similaire est responsable de la différence souvent observée entre la PCO2 de fin d'expiration et la PaCO2.
Différences de pression partielle alvéolaire à veineuse
Le PA – Pv reflète l'absorption tissulaire des anesthésiques inhalés. Les tissus hautement perfusés (c'est-à-dire le cerveau, le cœur, les reins et le foie) représentent moins de 10 % de la masse corporelle mais reçoivent environ 75 % du CO. En conséquence, ces tissus hautement perfusés s'équilibrent rapidement avec le Pa. Après trois temps constantes (6 à 12 minutes pour les anesthésiques inhalés), environ 75 % du sang veineux de retour est à la même pression partielle que le PA (c'est-à-dire PA étroit - Pv). Pour cette raison, l'absorption d'anesthésiques volatils par les alvéoles est fortement diminuée après 6 à 12 minutes, comme en témoigne un rétrécissement de la différence PI - PA. Passé ce délai, les concentrations inhalées d'anesthésiques volatils doivent être diminuées pour maintenir une PA constante en présence d'une diminution de l'absorption.
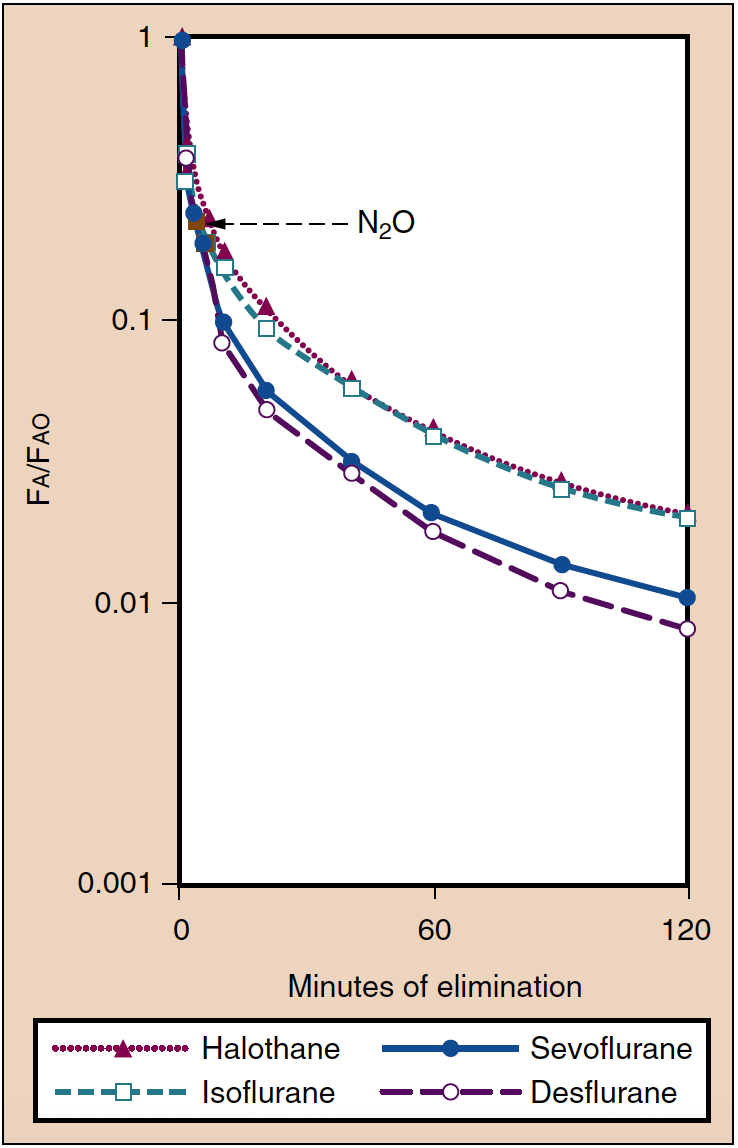
Récupération de l'anesthésie
La récupération après l'anesthésie peut être définie comme la vitesse à laquelle l'AP diminue avec le temps (Fig. 6) (20). À bien des égards, la récupération est l'inverse de l'induction de l'anesthésie. Par exemple, ˙VA, la solubilité et le CO déterminent la vitesse à laquelle le PA diminue. Après l'arrêt de l'administration d'anesthésique, l'élimination de l'anesthésique se produit par la ventilation des poumons. Au fur et à mesure que la pression partielle alvéolaire diminue, l'anesthésique est ensuite transféré des tissus (y compris le cerveau) dans les alvéoles. L'hypoventilation ou l'utilisation de débits de gaz frais suffisamment faibles pour permettre la réinhalation de l'anesthésique entraînera le transfert de l'anesthésique dans les tissus (y compris le cerveau), retardant la récupération du patient.

- Fig. 6. L'élimination des anesthésiques inhalés se traduit par la diminution de la concentration alvéolaire (Fa) par rapport à la concentration présente en fin d'anesthésie (Fao). Le réveil de l'anesthésie est parallèle à ces courbes. (De Yasuda N, Lockhart SH, Eger EI II, et al. Comparaison de la cinétique du sévoflurane et de l'isoflurane chez l'homme. Anesth Analg. 1991;72:316-324, utilisé avec permission.)
En quoi la récupération diffère-t-elle de l'induction de l'anesthésie ?
La récupération après l'anesthésie diffère de l'induction de l'anesthésie en ce qui concerne l'absence d'effet de la concentration sur la récupération (l'IP ne peut pas être inférieur à zéro), les concentrations tissulaires variables d'anesthésiques au début de la récupération et l'importance potentielle du métabolisme sur la vitesse de diminution de l'AP.
Concentrations tissulaires
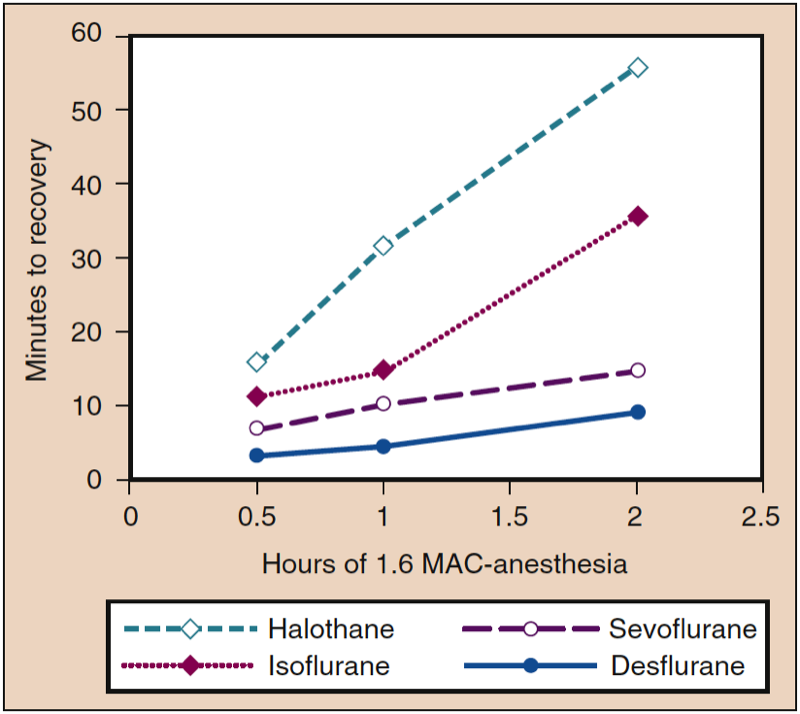
Les concentrations tissulaires d'anesthésiques inhalés servent de réservoir pour maintenir l'AP lorsque le gradient de pression partielle est inversé en diminuant l'IP à ou près de zéro à la fin de l'anesthésie. L'impact du stockage des tissus dépend de la durée de l'anesthésie et de la solubilité des anesthésiques dans les différents compartiments tissulaires. Par exemple, le délai de récupération est prolongé proportionnellement à la durée de l'anesthésie pour un anesthésique soluble (p. ex., isoflurane), alors que l'impact de la durée d'administration sur le délai de récupération est minime avec des anesthésiques peu solubles (p. ex., sévoflurane, desflurane) ( Figure 7) (1). Les concentrations variables d'anesthésiques dans différents tissus à la fin de l'anesthésie contrastent avec l'induction de l'anesthésie, lorsque tous les tissus ont initialement la même concentration nulle d'anesthésique.

- Fig. 7. Une augmentation de la durée de l'anesthésie pendant une dose constante d'anesthésique (1.6 MAC) est associée à des augmentations du temps de récupération (c'est-à-dire la coordination motrice dans un modèle animal), les augmentations les plus importantes se produisant avec le plus de sang - anesthésiques solubles. MAC, Concentration alvéolaire minimale. (Tiré d'Eger EI II. Desflurane (Suprane) : A Compendium and Reference. Nutley, NJ : Anaquest ; 1993 : 1-11, utilisé avec autorisation.)
Métabolisme
Une différence importante entre l'induction de l'anesthésie et la récupération de l'anesthésie est l'impact potentiel du métabolisme sur le taux de diminution de l'AP à la fin de l'anesthésie. À cet égard, le métabolisme est un déterminant principal du taux de diminution de l'AP du méthoxyflurane hautement liposoluble. Le métabolisme et la ˙VA sont également importants dans le taux de diminution de la PA de l'halothane, tandis que le taux de diminution de la PA de l'isoflurane, du desflurane et du sévoflurane moins liposolubles résulte principalement de la ˙VA (26).
Mi-temps contextuel
La pharmacocinétique de l'élimination des anesthésiques inhalés dépend de la durée d'administration (le « contexte ») et de la solubilité de l'anesthésique inhalé dans le sang et les tissus. Comme pour les anesthésiques intraveineux, il est possible d'utiliser des simulations informatiques pour déterminer les temps de décrémentation contextuels pour les anesthésiques volatils (le temps nécessaire pour diminuer les concentrations d'anesthésique dans le système nerveux central à une fraction de celle donnée à partir d'un point de départ d'intérêt). La modélisation cinétique est basée sur la présence de chaque compartiment tissulaire dans le corps (c'est-à-dire le sang, le groupe riche en vaisseaux, le muscle, la graisse), la taille relative de chaque compartiment, le débit sanguin proportionnel reçu par chaque compartiment et la solubilité de chaque compartiment. anesthésique spécifique dans le tissu composant le compartiment. Pendant l'administration de l'anesthésique, l'équilibrage implique une absorption continue de l'anesthésique jusqu'à ce que la concentration tissulaire devienne presque aussi élevée que la concentration alvéolaire. L'équilibrage de la concentration d'anesthésique entre les alvéoles et un petit compartiment (moins de 10 % de la masse corporelle) avec un débit sanguin élevé (c'est-à-dire le cœur, les reins, le cerveau) se produit dans un laps de temps relativement court (10 à 15 minutes). À l'inverse, l'équilibrage anesthésique dans des compartiments plus grands avec un débit sanguin proportionnel moindre (c'est-à-dire, muscle squelettique et graisse en vrac) se produit sur une plus longue période de temps (heures), à mesure que l'absorption de l'anesthésique se poursuit. Le temps nécessaire pour une diminution de 50 % des concentrations anesthésiques d'isoflurane, de desflurane et de sévoflurane est inférieur à 5 minutes et n'augmente pas de manière significative avec l'augmentation de la durée de l'anesthésie (27). Vraisemblablement, cela reflète la phase initiale d'élimination, qui est principalement fonction de ˙VA. La détermination d'autres temps de décrémentation (≥ 80 %) révèle des différences plus importantes entre les divers anesthésiques inhalés, d'autant plus que la durée de l'anesthésie devient plus longue (Fig. 8). La simulation peut sous-estimer l'absorption de l'anesthésie, en particulier avec des anesthésiques plus solubles, car elle ne tient pas compte de l'anesthésique transféré des tissus maigres aux tissus adipeux par diffusion intertissulaire.

- Fig. 8. Effets de concentrations croissantes (MAC) d'halothane, d'isoflurane, de desflurane et de sévoflurane sur la pression artérielle moyenne (mm Hg) lorsqu'ils sont administrés à des volontaires sains. MAC, Concentration alvéolaire minimale. (Tiré de Cahalan MK. Hemodynamic Effects of Inhaled Anesthetics. Review Courses. Cleveland: International Anesthesia Research Society; 1996:14-18, utilisé avec permission.)
L'élimination de toutes les quantités d'anesthésiques, sauf de petites quantités (plus petites que nécessaire pour que les patients suivent les ordres) doit avoir lieu avant qu'un patient ne retrouve des fonctions de protection coordonnées, telles que la capacité d'avaler et de respirer efficacement. Les patients chirurgicaux recevant une anesthésie plus longue et un anesthésique plus soluble (sévoflurane par rapport au desflurane) nécessitaient un intervalle de temps plus long entre le réveil et la récupération de la capacité à avaler efficacement (22). Des sujets éveillés ayant reçu de petites concentrations de sévoflurane et d'isoflurane présentent une discoordination pharyngée (28) et une diminution de la fonction ventilatoire chimique (29).
Hypoxie de diffusion
Une hypoxie de diffusion peut survenir à la fin de l'administration de protoxyde d'azote si les patients sont autorisés à inhaler l'air ambiant. Le déversement initial à haut volume de protoxyde d'azote du sang dans les alvéoles lorsque l'inhalation de ce gaz est interrompue peut tellement diluer la PAO2 que la PaO2 diminue. La survenue d'une hypoxie de diffusion est prévenue en remplissant les poumons du patient d'oxygène à la fin de l'administration de protoxyde d'azote.
Faisabilité de l'utilisation d'anesthésiques inhalés pour la sédation en soins intensifs
AnaConDa (Anesthetic Conserving Device, Sedana Medical AB, Uppsala, Suède) est un outil qui facilite l'administration d'anesthésique inhalé (isoflurane, sévoflurane) dans l'unité de soins intensifs (USI). L'anesthésique liquide est administré via une pompe à seringue dans une chambre qui se fixe au circuit respiratoire, entre le tube endotrachéal et la pièce en Y. La seringue délivre un anesthésique liquide à un débit très lent à une tige en plastique poreux à l'intérieur de la chambre, où le liquide s'évapore et se mélange au gaz frais s'écoulant de la branche inspiratoire du circuit. Le gaz expiré est acheminé à travers un filtre à charbon qui absorbe et récupère environ 90 % de l'anesthésique expiré. Le flux inspiratoire ultérieur est acheminé à travers le filtre à charbon, où l'anesthésique absorbé se remélange avec le gaz frais.
Il existe un intérêt croissant pour l'utilisation d'anesthésiques inhalés puissants en dehors de la salle d'opération pour les patients post-chirurgicaux dans l'USI, et une accumulation croissante de preuves que cela est faisable et éventuellement avantageux (30,31). Cependant, les défis liés à l'utilisation de l'anesthésique inhalé dans le cadre des soins intensifs comprennent l'augmentation de l'espace mort et du travail respiratoire en raison de l'interposition du dispositif d'administration d'anesthésique entre le tube trachéal et le circuit ; perte d'anesthésique dans l'environnement pendant l'aspiration fréquente du tube trachéal ; et la disponibilité douteuse d'équipements appropriés et de soignants ayant des connaissances et une expertise technique suffisantes dans l'administration d'anesthésiques inhalés.
9. EFFETS SUR LES SYSTÈMES D'ORGANES
Effets circulatoires
Des concentrations équipotentes d'anesthésiques inhalés ont des effets circulatoires similaires, en particulier pendant le maintien de l'anesthésie chez des volontaires humains. Cependant, les patients subissant une intervention chirurgicale peuvent réagir différemment des volontaires sains. Par exemple, des facteurs tels qu'une maladie coexistante, des âges extrêmes, un volume intravasculaire non optimal, la présence d'une stimulation chirurgicale et des médicaments concomitants peuvent modifier, atténuer ou exagérer les réponses attendues sur la base des données obtenues auprès de volontaires sains.
Réponses pendant le maintien de l'anesthésie
Signifie pression artérielle
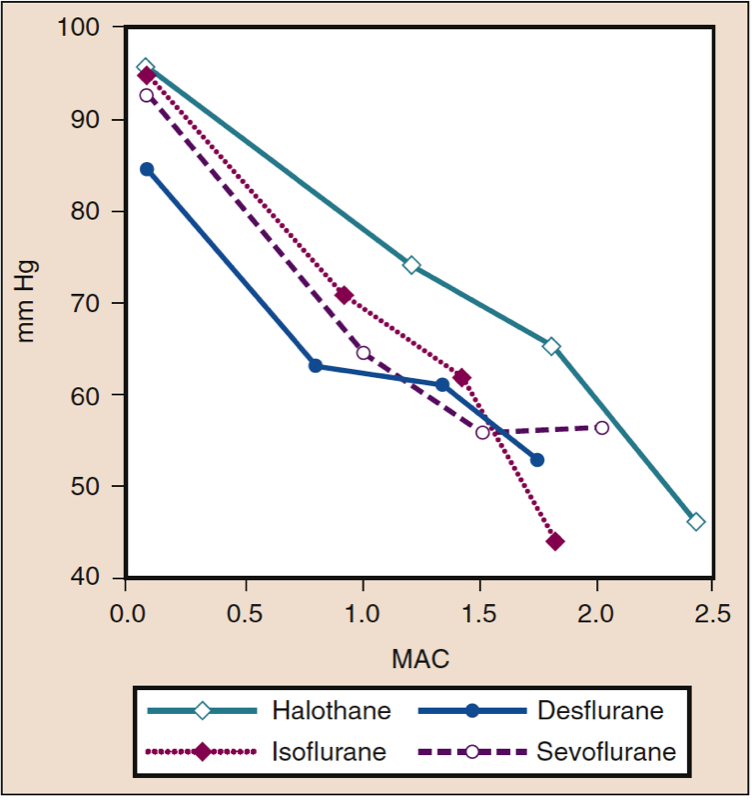
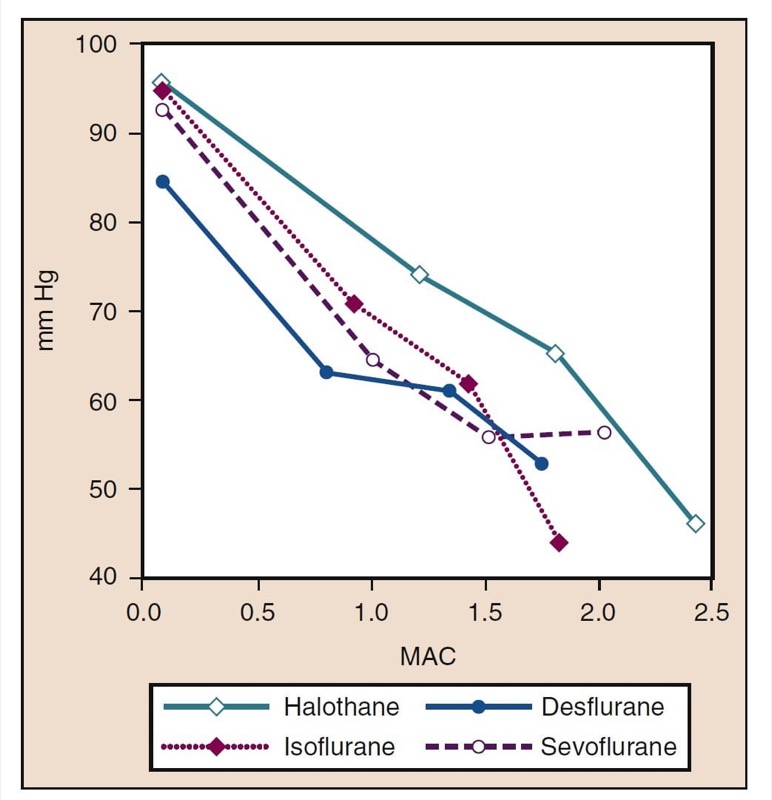
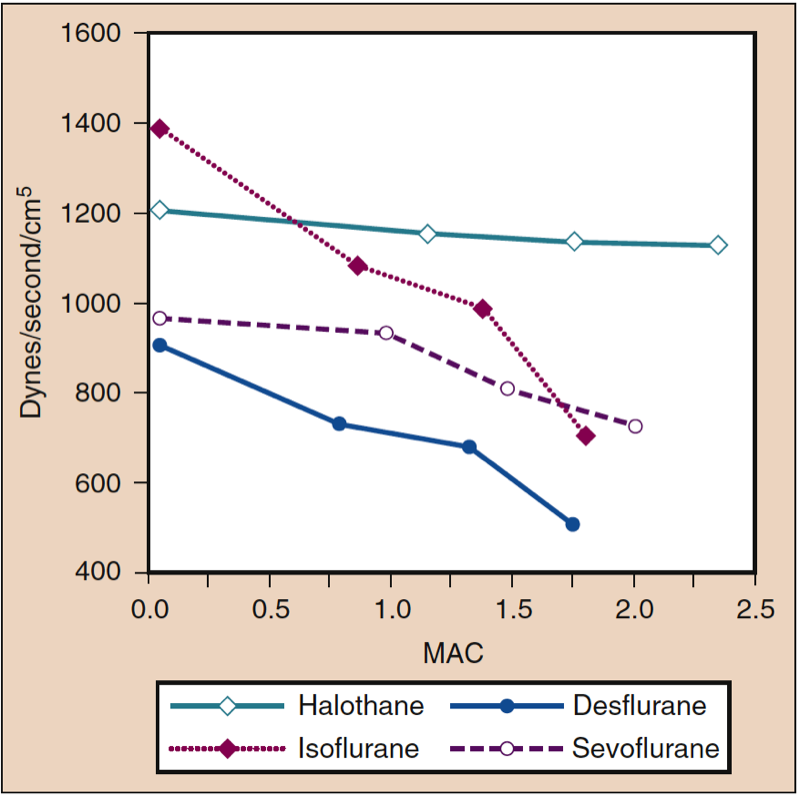
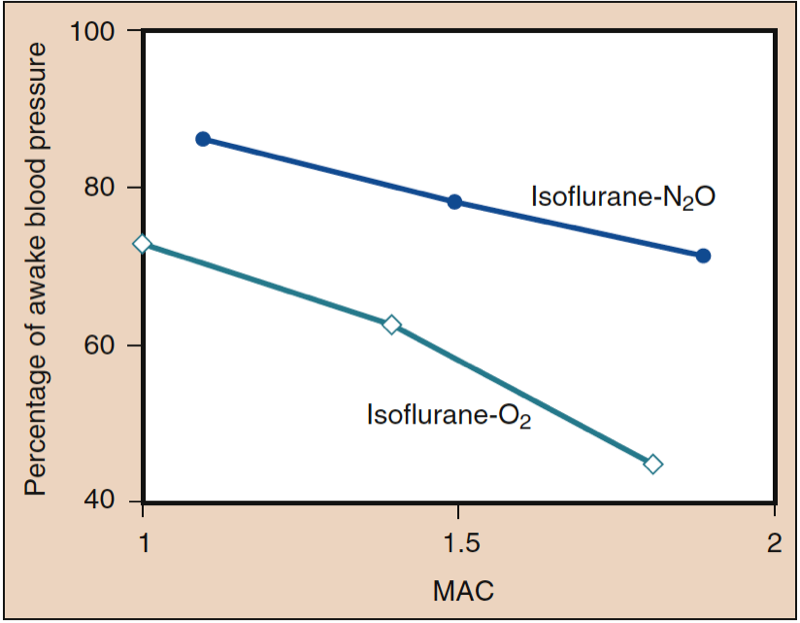
La pression artérielle moyenne (PAM) diminue avec l'augmentation des concentrations de desflurane, de sévoflurane, d'isoflurane, d'halothane et d'enflurane de manière dose-dépendante (voir Fig. 8) (17,18). À l'exception de l'halothane, la diminution de la PAM reflète principalement une diminution de la résistance vasculaire systémique (RVS) par rapport à une diminution du CO (Figs. 9 et 10) (32,33). En revanche, l'halothane diminue le MAP partiellement ou entièrement en diminuant le CO, alors que le SVR est relativement inchangé. Ces résultats sont étayés par des mesures de RVS chez des patients recevant du desflurane, du sévoflurane et de l'isoflurane tout en subissant une perfusion de pontage cardiopulmonaire. La diminution de la RVS liée à la dose est minimisée par la substitution d'oxyde nitreux à une partie du médicament volatil (Fig. 11) (34). Le protoxyde d'azote, contrairement aux autres anesthésiques inhalés, provoque une MAP inchangée ou légèrement augmentée.

- Fig. 8 Effets de concentrations croissantes (MAC) d'halothane, d'isoflurane, de desflurane et de sévoflurane sur la pression artérielle moyenne (mm Hg) lorsqu'ils sont administrés à des volontaires sains. MAC, Concentration alvéolaire minimale. (Tiré de Cahalan MK. Hemodynamic Effects of Inhaled Anesthetics. Review Courses. Cleveland: International Anesthesia Research Society; 1996:14-18, utilisé avec permission.)

- Fig. 9. Effets de concentrations croissantes (MAC) d'halothane, d'isoflurane, de desflurane et de sévoflurane sur la résistance vasculaire systémique (dynes/sec/cm5) lorsqu'il est administré à des volontaires sains. MAC, Concentration alvéolaire minimale. (Tiré de Cahalan MK. Hemodynamic Effects of Inhaled Anesthetics. Review Courses. Cleveland: International Anesthesia Research Society; 1996:14-18, utilisé avec permission.)

- Fig. 10. Effets de concentrations croissantes (MAC) d'halothane, d'isoflurane, de desflurane et de sévoflurane sur l'indice cardiaque (L/min) lorsqu'il est administré à des volontaires sains. MAC, Concentration alvéolaire minimale. (Tiré de Cahalan MK. Hemodynamic Effects of Inhaled Anesthetics. Review Courses. Cleveland: International Anesthesia Research Society; 1996:14-18, utilisé avec permission.)

- Fig. 11. La substitution d'oxyde nitreux à une portion d'isoflurane produit moins de diminution de la pression artérielle systémique que la même dose d'anesthésique volatil seul. MAC, Concentration alvéolaire minimale. (De Eger EI II. Isoflurane (Forane): A Compendium and Reference. Madison, WI: Ohio Medical Products; 1985:1-110, utilisé avec permission.)
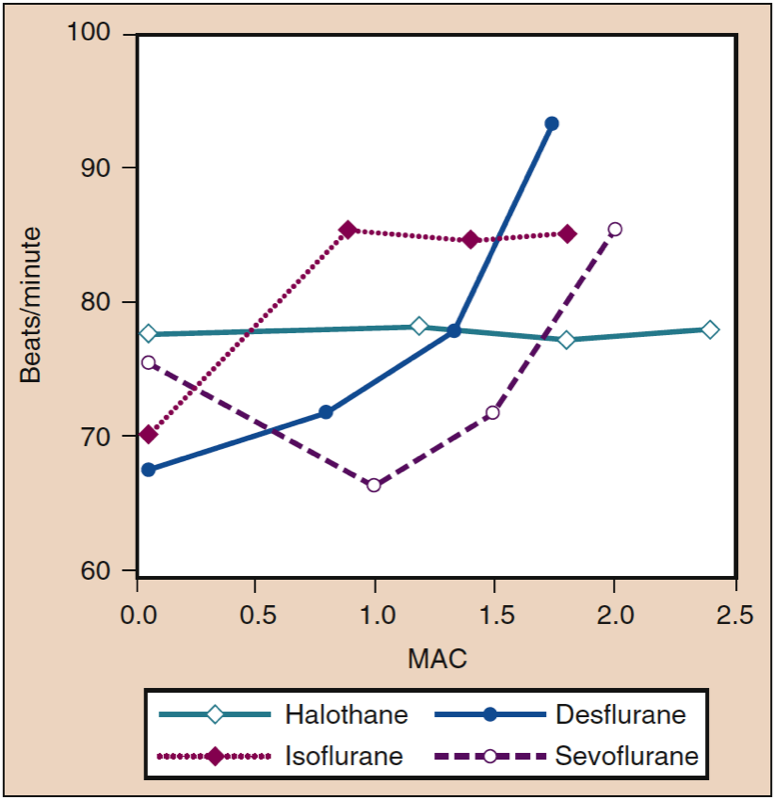
Fréquence cardiaque
Des augmentations progressives des concentrations délivrées d'isoflurane, de desflurane et de sévoflurane augmentent la fréquence cardiaque chez les patients et les volontaires, bien qu'à des concentrations différentes (Fig. 12) (33). À des concentrations aussi faibles que 0.25 MAC, l'isoflurane provoque une augmentation linéaire et dose-dépendante de la fréquence cardiaque. La fréquence cardiaque augmente légèrement avec des concentrations de desflurane inférieures à 1 MAC. Lorsque les concentrations de desflurane sont augmentées au-dessus de 1 MAC, la fréquence cardiaque s'accélère de manière linéaire et dose-dépendante. Contrairement au desflurane et à l'isoflurane, la fréquence cardiaque en présence de sévoflurane n'augmente pas tant que la concentration ne dépasse pas 1.5 MAC (35). Cependant, l'induction avec 8 % de sévoflurane (c'est-à-dire l'induction sur un seul cycle) provoque une tachycardie chez les enfants et les adultes sous hyperventilation contrôlée. Cette tachycardie peut résulter d'une stimulation du système nerveux sympathique associée à une activité cérébrale épileptiforme (36).

- Fig. 12. Effets de concentrations croissantes (MAC) d'halothane, d'isoflurane, de desflurane et de sévoflurane sur la fréquence cardiaque (battements/min) lorsqu'ils sont administrés à des volontaires sains. MAC, Concentration alvéolaire minimale. (Tiré de Cahalan MK. Hemodynamic Effects of Inhaled Anesthetics. Review Courses. Cleveland: International Anesthesia Research Society; 1996:14-18, utilisé avec permission.)
La tendance du desflurane à stimuler la circulation (c.-à-d. augmenter la PAM et la fréquence cardiaque) est atténuée par l'administration d'un β-bloquant (esmolol), d'un opioïde (fentanyl) et du temps (10 à 15 minutes) pendant le maintien de l'anesthésie ( voir également « Effets circulatoires avec augmentation rapide de la concentration »). L'augmentation dose-dépendante de la fréquence cardiaque observée avec des concentrations de desflurane supérieures à 1 MAC n'est pas atténuée par la substitution d'une partie du desflurane par du protoxyde d'azote. L'isoflurane, le sévoflurane et le desflurane, comme l'halothane, diminuent les réponses des barorécepteurs d'une manière dépendante de la concentration. L'augmentation transitoire de la fréquence cardiaque au-dessus de 1 MAC observée avec le desflurane résulte de la stimulation du système nerveux sympathique plutôt que d'une réponse réflexe de l'activité des barorécepteurs à une diminution de la MAP (37).
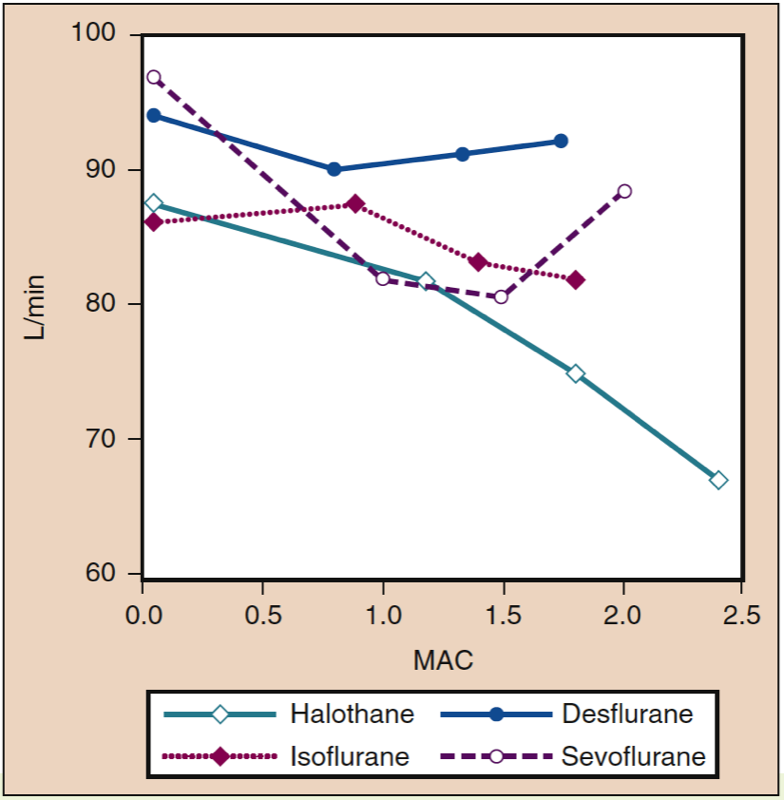
Indice cardiaque
L'index cardiaque est peu influencé par l'administration de desflurane, de sévoflurane ou d'isoflurane sur une large gamme de concentrations chez de jeunes adultes en bonne santé (voir Fig. 10) (32). Les données d'échocardiographie transoesophagienne montrent que le desflurane produit des augmentations mineures de la fraction d'éjection et de la vitesse ventriculaire gauche de raccourcissement circonférentiel par rapport aux mesures à l'état de veille.
Effets circulatoires avec augmentation rapide de la concentration
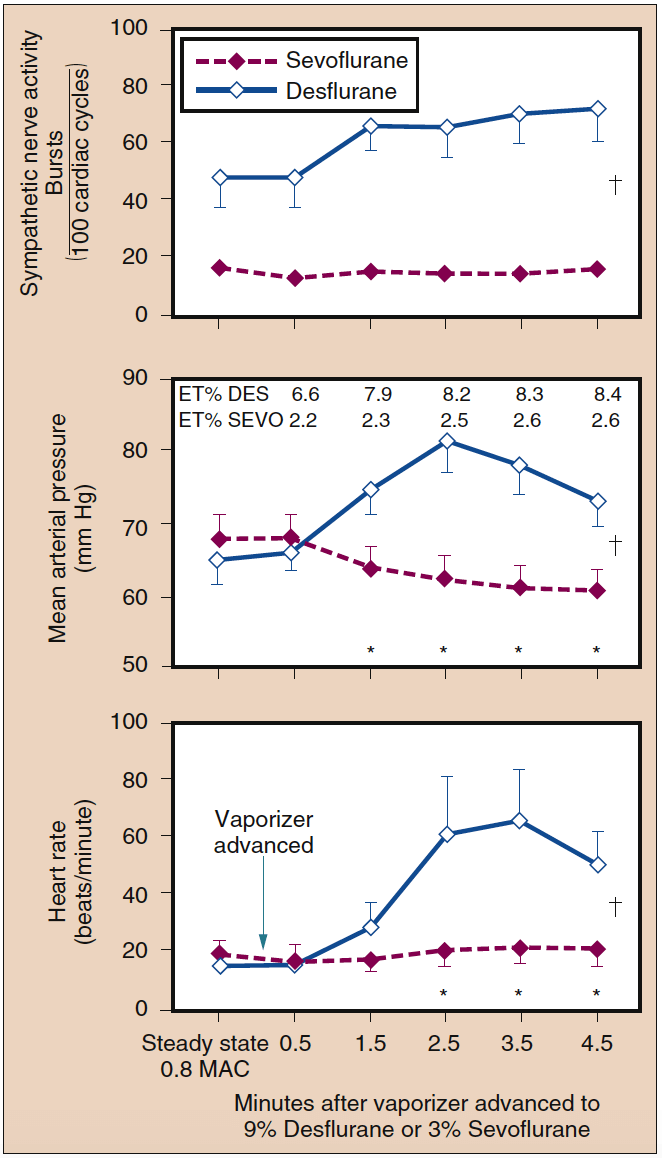
À des concentrations inférieures à 1 MAC, le desflurane n'augmente pas la fréquence cardiaque ni la PAM. Cependant, des augmentations brusques des concentrations de desflurane inspiré au-dessus de 1 MAC provoquent une stimulation circulatoire transitoire en l'absence d'opioïdes, de bloqueurs adrénergiques ou d'autres analgésiques complémentaires (Fig. 13) (38). Dans une moindre mesure, l'isoflurane a une capacité similaire à provoquer des augmentations de la fréquence cardiaque et de la pression artérielle. Accompagnant la stimulation hémodynamique observée avec l'augmentation brutale des concentrations de desflurane et d'isoflurane, il y a des augmentations des concentrations plasmatiques d'épinéphrine et de noradrénaline et de l'activité du système nerveux sympathique. Une augmentation brutale de la concentration de sévoflurane inspiré de 1 MAC à 1.5 MAC est associée à une légère diminution de la fréquence cardiaque.

- Fig. 13. Une augmentation rapide de la concentration inspirée de sévoflurane de 0.8 MAC à 3 % n'a pas modifié l'activité du nerf sympathique, la pression artérielle moyenne ou la fréquence cardiaque. Inversement, une augmentation rapide de la concentration inspirée de desflurane de 0.8 MAC à 9 % a augmenté de manière significative l'activité du nerf sympathique, la pression artérielle moyenne et la fréquence cardiaque (moyenne ± ET ; *p < 0.05). ET, Endtidal ; MAC, concentration alvéolaire minimale. (D'après Ebert TJ, Muzi M, Lopatka CW. Réponses neurocirculatoires au sévoflurane chez l'homme : une comparaison avec le desflurane. Anesthésiologie. 1995 ; 83 : 88-95, utilisé avec autorisation.)
Une augmentation progressive de la concentration de desflurane en fin d'expiration de 4 % à 8 % en 1 minute peut entraîner un doublement de la fréquence cardiaque et de la pression artérielle au-dessus de la ligne de base. L'administration de petites doses d'opioïdes, de clonidine ou d'esmolol atténue profondément les réponses de la fréquence cardiaque et de la pression artérielle à l'augmentation progressive de la concentration de desflurane. La répétition de l'augmentation rapide de la concentration de desflurane en fin d'expiration de 4 % à 8 % après 30 minutes entraîne des modifications minimes de la fréquence cardiaque et de la PAM, ce qui suggère que les récepteurs responsables de ces modifications circulatoires s'adaptent à une stimulation répétée. Aucune stimulation circulatoire n'est observée avec des augmentations brutales des concentrations de sévoflurane, d'halothane ou d'enflurane jusqu'à 2 MAC (voir Fig. 13) (38).
Le sévoflurane et l'halothane sont fréquemment administrés par inhalation pour induire une anesthésie en raison de leur manque de piquant. L'induction de l'anesthésie chez les enfants avec de l'halothane, mais pas du sévoflurane, déprime la contractilité myocardique. Chez l'adulte, le maintien de l'anesthésie avec 1 MAC de sévoflurane ou d'halothane avec 67 % de protoxyde d'azote diminue la contractilité myocardique. Chez l'adulte, le sévoflurane peut augmenter transitoirement la fréquence cardiaque lors de l'utilisation d'une ventilation contrôlée.
Administration avec du protoxyde d'azote et de l'oxygène versus 100 % d'oxygène
Le desflurane, l'isoflurane et le sévoflurane, administrés avec du protoxyde d'azote et de l'oxygène, diminuent la PAM, la RVS, l'indice cardiaque et l'indice de travail d'AVC ventriculaire gauche (LVSWI) de manière dose-dépendante, tandis que la fréquence cardiaque, la pression artérielle pulmonaire et la pression veineuse centrale augmentation de la pression, compatible avec les résultats dans lesquels chaque anesthésique volatil est administré dans de l'oxygène seul (voir Fig. 11) (32,33). Une comparaison directe révèle une diminution plus prononcée de la MAP, de la RVS, de l'index cardiaque et du LVSWI, ainsi qu'une fréquence cardiaque plus rapide et un CO plus important lorsque le desflurane est administré dans de l'oxygène plutôt que dans du protoxyde d'azote à des multiples de MAC à peu près équivalents (34).
Conduction myocardique et arythmogénicité
L'isoflurane, le sévoflurane et le desflurane ne prédisposent pas le cœur aux extrasystoles ventriculaires prématurées (39). En revanche, l'halothane sensibilise le myocarde aux extrasystoles ventriculaires prématurées, notamment en présence de catécholamines ; cette relation est exagérée avec l'hypercapnie. Les anesthésiques inhalés suppriment probablement les dysrythmies ventriculaires au cours de l'ischémie myocardique en prolongeant la période réfractaire effective.
Le choix de l'anesthésique inhalé influence la survenue de bradydysrythmies réflexes pouvant résulter d'une stimulation vagale. Les enfants anesthésiés au sévoflurane, par rapport à l'halothane, présentent moins d'épisodes de diminution de la fréquence cardiaque ou d'arrêt du nœud sinusal en réponse à une traction chirurgicale sur les muscles oculaires.
Intervalle QT
Les anesthésiques inhalés prolongent l'intervalle QT sur l'électrocardiogramme (40). Bien que la tendance relative de chaque anesthésique à allonger l'intervalle QT n'ait pas été comparée systématiquement, le sévoflurane doit être évité chez les patients atteints du syndrome du QT long congénital (SQTL) connu. Bien que les anesthésiques sévoflurane et propofol provoquent un allongement de l'intervalle QT chez les enfants, aucun des anesthésiques n'augmente la dispersion transmurale de la repolarisation, une mesure des taux hétérogènes de repolarisation des cellules myocardiques pendant les phases 2 et 3 du potentiel d'action (41). La signification clinique de l'allongement de l'intervalle QT avec le sévoflurane et d'autres anesthésiques inhalés chez les patients sensibles n'est pas claire. Chez les patients atteints de LQTS, le bloc β-adrénergique est le pilier du traitement. Les patients atteints de SQTL connu ont été anesthésiés en toute sécurité avec tous les anesthésiques inhalés modernes lorsqu'ils recevaient simultanément des médicaments bloquants β-adrénergiques. De nombreuses arythmies peropératoires malignes sont survenues chez des patients subissant une anesthésie à l'halothane qui ont ensuite été attribuées à un LQTS non diagnostiqué, et aucun des patients n'avait reçu de médicaments β-bloquants (40).
Patients atteints de maladie coronarienne
De nombreuses études portant sur des patients subissant un pontage coronarien ou à risque de maladie coronarienne n'ont pas réussi à démontrer une différence de résultat entre les groupes recevant des techniques d'anesthésie par inhalation (c.-à-d., desflurane) et par voie intraveineuse (c.-à-d., fentanyl ou sufentanil) ou entre les groupes recevant une technique d'anesthésie. anesthésique inhalé par rapport à un autre (c.-à-d., desflurane par rapport à l'isoflurane ou sévoflurane par rapport à l'isoflurane) (42). Les inquiétudes selon lesquelles la capacité de l'isoflurane à dilater les artères coronaires de petit diamètre pourrait provoquer un vol coronarien, dans lequel un patient présentant une anatomie sensible pourrait développer une ischémie myocardique régionale à la suite d'une vasodilatation coronarienne, n'étaient pas fondées. Les anesthésiques volatils exercent plutôt un effet protecteur sur le cœur, limitant la zone de lésion myocardique et préservant la fonction après exposition à une agression ischémique.
Préconditionnement anesthésique
L'explication des avantages protecteurs des anesthésiques volatils contre l'ischémie myocardique est appelée préconditionnement anesthésique, et elle ne s'explique pas par une modification favorable du rapport offre-demande en oxygène du myocarde. Les preuves suggèrent que les anesthésiques volatils exercent des effets protecteurs sur le myocarde dans le cadre d'une perfusion régionale compromise. Chez les patients subissant un pontage aortocoronarien (CABG), l'entretien avec 0.2 à 1 MAC de desflurane ou de sévoflurane a diminué l'incidence des taux de troponine anormalement élevés par rapport aux patients recevant du propofol (43). Le sévoflurane administré pendant toute la durée du pontage coronarien par rapport à l'administration avant ou après pontage a entraîné un taux moins fréquent d'infarctus du myocarde postopératoire par rapport au sévoflurane administré uniquement pendant la période avant ou après pontage, et l'administration avant ou après pontage a entraîné un risque plus faible d'infarctus du myocarde par rapport sous anesthésie au propofol (44).
Mécanismes du préconditionnement ischémique
Le préconditionnement ischémique est un mécanisme de protection fondamental présent dans tous les tissus de toutes les espèces. Dans son préconditionnement chimique, l'exposition à un ou plusieurs épisodes brefs d'ischémie peut conférer un effet protecteur sur le myocarde contre une lésion réversible ou irréversible avec une atteinte ischémique prolongée ultérieure. Il existe deux périodes distinctes après un bref épisode ischémique pendant lesquelles le myocarde est protégé. La première période survient pendant 1 à 2 heures après l'épisode de conditionnement, puis se dissipe. Dans la deuxième période, le bénéfice réapparaît 24 heures plus tard et peut durer jusqu'à 3 jours. L'ouverture des canaux potassiques mitochondriaux sensibles à l'adénosine triphosphate (ATP) (KATP) est l'événement crucial qui confère l'activité protectrice, résultant de la liaison de divers ligands aux récepteurs couplés aux protéines G. Les anesthésiques volatils améliorent le préconditionnement ischémique ou assurent une protection directe du myocarde, et les canaux KATP jouent un rôle central dans leurs effets protecteurs (45).
Effets de ventilation
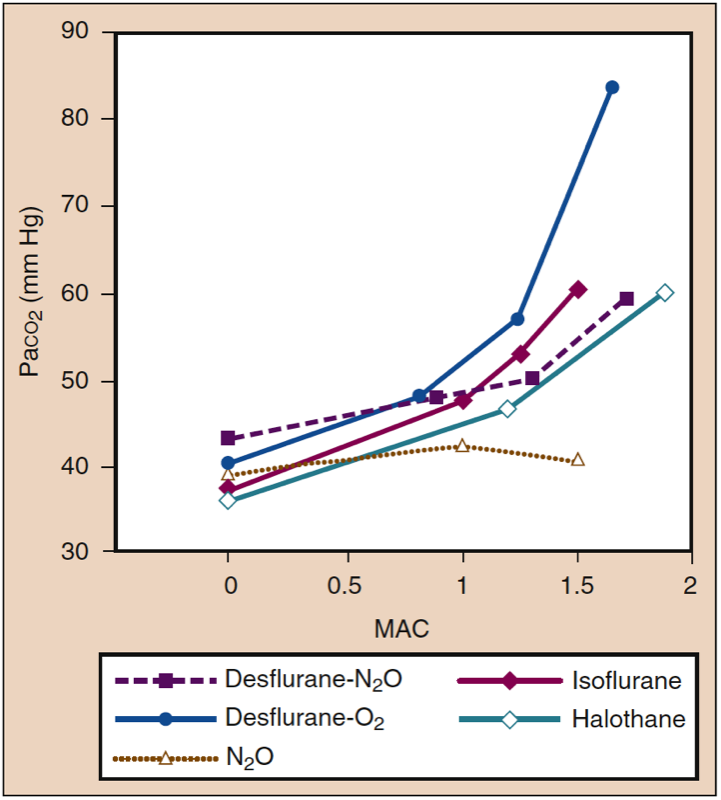
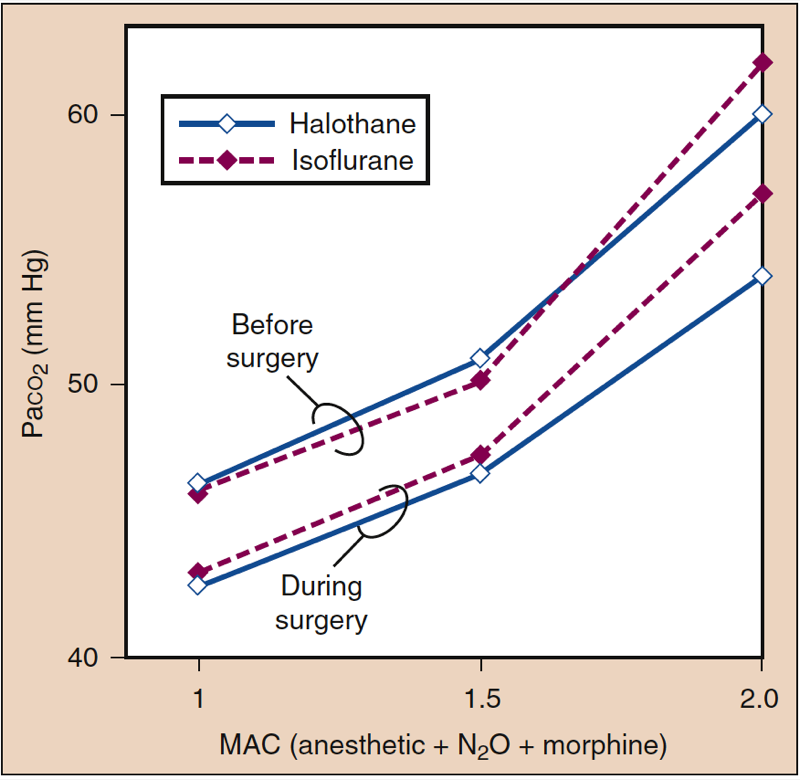
Les anesthésiques inhalés augmentent la fréquence respiratoire et diminuent le volume courant à mesure que la concentration d'anesthésique augmente. Bien que la ventilation minute soit relativement préservée, la diminution du volume courant entraîne une proportion relativement plus importante de ventilation de l'espace mort par rapport à la ventilation alvéolaire. Les échanges gazeux deviennent progressivement moins efficaces à des niveaux d'anesthésie plus profonds et la PaCO2 augmente proportionnellement à la concentration d'anesthésique (Fig. 14) (1). Les effets sont similaires parmi les anesthésiques puissants à des multiples de MAC donnés. La substitution d'oxyde nitreux (60 %) à une portion équivalente d'anesthésique volatil peut atténuer l'augmentation de la PaCO2 à des niveaux d'anesthésie plus profonds.

- Fig. 14. Les anesthésiques inhalés produisent des augmentations spécifiques au médicament et dépendantes de la dose de Paco2. MAC, Concentration alvéolaire minimale. (Tiré d'Eger EI II. Desflurane (Suprane) : A Compendium and Reference. Nutley, NJ : Anaquest ; 1993 : 1-119, utilisé avec autorisation.)
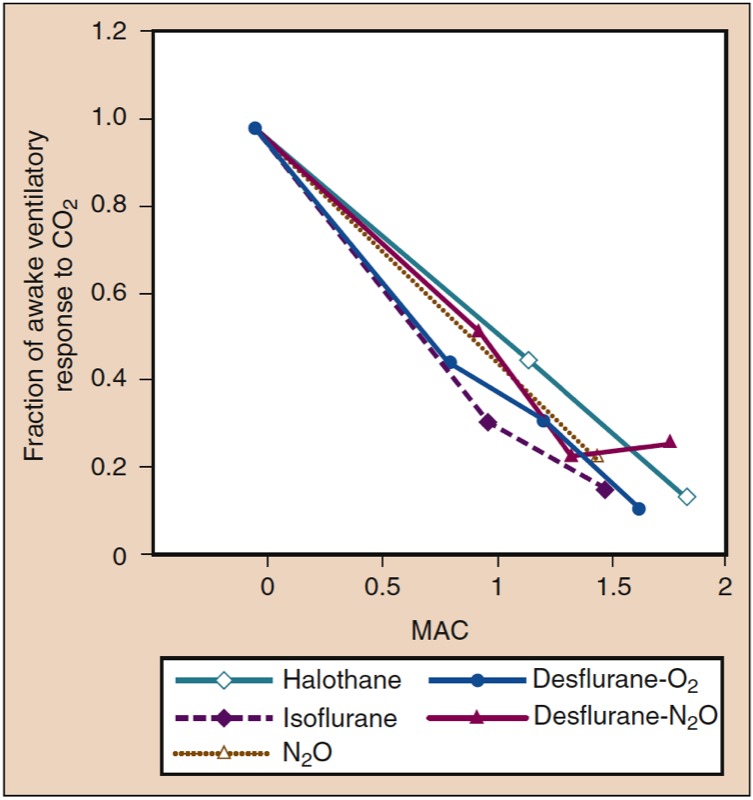
Les volontaires et les patients respirant du desflurane (et d'autres anesthésiques volatils) montrent un émoussement lié à la dose de la réactivité au dioxyde de carbone, ce qui entraîne une apnée chez les sujets recevant 1.7 MAC de desflurane dans l'oxygène (Fig 15) (1). Par rapport aux volontaires, l'émoussement de la ventilation avec des anesthésiques inhalés peut être moins prononcé chez les patients subissant une intervention chirurgicale, reflétant l'effet stimulant de la chirurgie sur la respiration (Fig. 16) (1). Les anesthésiques volatils atténuent tous la stimulation ventilatoire provoquée par l'hypoxémie artérielle (46).

- Fig. 15. Tous les anesthésiques inhalés produisent des diminutions dose-dépendantes similaires des réponses ventilatoires au dioxyde de carbone. MAC, Concentration alvéolaire minimale. (Tiré d'Eger EI II. Desflurane (Suprane) : A Compendium and Reference. Nutley, NJ : Ana quest ; 1993 : 1-119, utilisé avec autorisation.)

- Fig. 16. Impact de la stimulation chirurgicale sur la Paco2 au repos (mm Hg) lors de l'administration d'isoflurane ou d'halothane. MAC, Concentration alvéolaire minimale. (Tiré d'Eger EI II. Desflurane (Suprane) : A Compendium and Reference. Nutley, NJ : Anaquest ; 1993 : 1-119, utilisé avec autorisation.)
Modifications de la paroi thoracique
Les anesthésiques inhalés contribuent aux changements conformationnels de la paroi thoracique qui peuvent influencer la mécanique ventilatoire. Le déplacement céphalique du diaphragme et le déplacement vers l'intérieur de la cage thoracique résultent d'une activité accrue des muscles expiratoires, et le résultat net contribue à la réduction de la capacité résiduelle fonctionnelle. L'atélectasie survient préférentiellement dans les zones dépendantes du poumon et survient davantage lorsque la ventilation spontanée est autorisée.
Vasoconstriction pulmonaire hypoxique
Les anesthésiques inhalés modifient le flux sanguin pulmonaire, mais l'inhibition de la vasoconstriction pulmonaire hypoxique est minime. Par exemple, l'oxygénation artérielle est similaire chez les patients subissant une ventilation unipulmonaire avec une anesthésie à l'isoflurane par rapport au desflurane et une anesthésie au sévoflurane par rapport au propofol (47).
Résistance des voies respiratoires
En l'absence de bronchoconstriction, les effets bronchodilatateurs des anesthésiques inhalés sont faibles. Chez les volontaires, l'isoflurane, l'halothane et le sévoflurane, mais pas le protoxyde d'azote et le thiopental, diminuent la résistance respiratoire systémique après intubation trachéale. Chez les non-fumeurs, la résistance des voies respiratoires ne montre aucun changement après l'intubation trachéale et l'anesthésie au desflurane par rapport à une légère diminution avec le sévoflurane, tandis que les fumeurs présentent une augmentation légère et transitoire de la résistance des voies respiratoires après l'intubation trachéale et l'anesthésie au desflurane (48). Certains ou tous les changements de résistance des voies respiratoires peuvent être médiés par des changements de densité de gaz.
Effets irritants sur les voies respiratoires
Les anesthésiques inhalés diffèrent dans leur capacité à irriter les voies respiratoires (c.-à-d. piquant). Le sévoflurane, l'halothane et le protoxyde d'azote ne sont pas piquants et ne causent qu'une irritation minime ou nulle sur une large gamme de concentrations. Le desflurane et l'isoflurane sont piquants et peuvent irriter les voies respiratoires à des concentrations supérieures à 1 MAC, en particulier en l'absence de médicaments intraveineux (p. ex., opioïdes, sédatifs-hypnotiques) qui diminuent la perception du piquant.
Le sévoflurane ou l'halothane est le plus souvent choisi lorsqu'une induction de l'anesthésie par inhalation est souhaitée. Cependant, le desflurane et l'isoflurane peuvent être administrés aux patients chirurgicaux au moyen d'un masque laryngé sans une plus grande incidence d'irritation des voies respiratoires (p. ex., toux, apnée, laryngospasme, désaturation artérielle en oxygène) par rapport au sévoflurane ou au propofol, car l'entretien ne suffit généralement pas. ne nécessitent pas une concentration supérieure à 1 MAC (c'est-à-dire des concentrations non irritantes) (49).
Effets sur le système nerveux central
Flux sanguin cérébral
Le protoxyde d'azote administré sans anesthésique volatil provoque une vasodilatation cérébrale et augmente le débit sanguin cérébral. Le taux métabolique cérébral de l'oxygène (CMRO2) augmente modestement. L'administration concomitante d'opioïdes, de barbituriques ou de propofol (mais pas de kétamine) neutralise ces effets (50). Les anesthésiques inhalés n'abolissent pas la réactivité vasculaire cérébrale aux changements de PaCO2 (51).
L'halothane, l'isoflurane, le sévoflurane et le desflurane diminuent le CMRO2. Chez l'homme normocapnique, ces anesthésiques volatils provoquent une vasodilatation cérébrale à des concentrations supérieures à 0.6 MAC. Il existe un effet dose-dépendant biphasique sur le débit sanguin cérébral. À 0.5 MAC, la diminution de CMRO2 neutralise la vasodilatation de sorte que le débit sanguin cérébral ne change pas de manière significative. À des concentrations supérieures à 1 MAC, les effets vasodilatateurs prédominent et le débit sanguin cérébral augmente, en particulier si la pression artérielle systémique est maintenue à des niveaux éveillés. L'augmentation du débit sanguin cérébral est relativement plus importante avec l'halothane qu'avec l'isoflurane, le sévoflurane ou le desflurane.
Pression intracrânienne
La pression intracrânienne augmente avec tous les anesthésiques volatils à des doses supérieures à 1 MAC, et l'autorégulation (c'est-à-dire un mécanisme adaptatif normalisant le flux sanguin cérébral sur une large gamme de pressions artérielles systémiques chez les patients éveillés) est altérée à des concentrations inférieures à 1 MAC. Les patients subissant une craniotomie pour des tumeurs supratentorielles qui reçoivent 1 MAC d'isoflurane ou de desflurane présentent une diminution de la pression de perfusion cérébrale et une différence d'oxygène artérioveineuse pour l'oxygène mais aucun changement de la pression intracrânienne (52). Cependant, les patients subissant une résection de tumeur hypophysaire qui reçoivent 1 MAC de desflurane, d'isoflurane ou de sévoflurane présentent de légères augmentations de la pression intracrânienne et une diminution du débit sanguin cérébral. Les patients neurochirurgicaux recevant 50 % de protoxyde d'azote plus 0.5 MAC de desflurane ou d'isoflurane ont apparemment plus de relaxation cérébrale que ceux recevant 1 MAC de desflurane ou d'isoflurane sans protoxyde d'azote. Les anesthésiques inhalés n'abolissent pas la réactivité vasculaire cérébrale aux changements de PaCO2 (51).
Potentiels évoqués
Tous les anesthésiques volatils et le protoxyde d'azote diminuent l'amplitude et augmentent la latence des potentiels évoqués somatosensoriels de manière dose-dépendante. Les potentiels évoqués peuvent être abolis à 1 MAC d'anesthésique volatil seul ou au-dessus de 0.5 MAC administré avec 50 % de protoxyde d'azote. De faibles concentrations d'anesthésiques volatils (0.2 à 0.3 MAC) peuvent diminuer la fiabilité de la surveillance des potentiels évoqués moteurs, bien que l'impact puisse être partiellement surmonté par l'utilisation de stimuli multipulsés (53).
Effets électroencéphalographiques
Les anesthésiques volatils provoquent des modifications caractéristiques et dose-dépendantes de l'EEG. L'augmentation de la profondeur de l'anesthésie à partir de l'état d'éveil se caractérise par une amplitude et une synchronie accrues. Les périodes de silence électrique commencent à occuper une plus grande proportion du temps à mesure que la profondeur augmente (c'est-à-dire la suppression des rafales). Ce schéma isoélectrique prédomine sur l'EEG dans la plage de 1.5 à 2.0 MAC.
Le sévoflurane et l'enflurane peuvent être associés à une activité épileptiforme sur l'EEG, en particulier à des concentrations plus élevées ou lorsqu'une hyperventilation contrôlée est instaurée. Une activité semblable à une crise a été rapportée chez des enfants pendant l'induction du sévoflurane, mais les implications cliniques de ces observations ne sont pas claires (54).
Effets neuromusculaires
Les anesthésiques volatils produisent une relaxation des muscles squelettiques liée à la dose et améliorent l'activité des médicaments bloquants neuromusculaires. L'amélioration de l'effet relaxant du rocuronium est plus intense avec l'anesthésie au desflurane qu'avec le sévoflurane ou l'isoflurane, bien que tous les anesthésiques volatils améliorent la relaxation des muscles squelettiques par rapport aux anesthésiques intraveineux (p. ex., propofol plus fentanyl). L'élimination de l'anesthésique volatil améliore la récupération après un bloc neuromusculaire. Une diminution de la concentration de desflurane à 0.25 MAC facilite l'inversion du bloc neuromusculaire après l'administration de vécuronium plus qu'une diminution équipotente de la concentration d'isoflurane.
Hyperthermie maligne
L'hyperthermie maligne (HM) continue d'être une complication potentiellement mortelle de l'anesthésie. Il s'agit d'un trouble héréditaire du métabolisme accru du muscle squelettique qui est déclenché par l'administration d'un anesthésique volatil, en particulier l'halothane et/ou la succinylcholine. Bien que tous les anesthésiques volatils inhalés puissants aient également le potentiel de déclencher la MH, des études sur le desflurane, le sévoflurane et éventuellement l'isoflurane suggèrent un risque moindre que celui de l'halothane. Les hommes semblent être plus susceptibles de développer un épisode clinique de MH que les femmes (55,56). La population pédiatrique représente 52.1 % de toutes les réactions de MH (57,58). Les signes de MH sont liés à une augmentation du métabolisme et comprennent la tachycardie, l'augmentation des niveaux de dioxyde de carbone en fin d'expiration, la rigidité musculaire et l'augmentation de la température.
Les cas plus récents de MH sont moins graves en raison d'une meilleure connaissance du diagnostic, d'une détection précoce grâce au dioxyde de carbone en fin de vie, d'une utilisation moindre de déclencheurs anesthésiques puissants et de l'administration de médicaments qui atténuent les épisodes fulminants de MH.
Les principaux aspects de la prise en charge comprennent l'arrêt des anesthésiques volatils et de la succinylcholine, l'administration immédiate de dantrolène par voie intraveineuse et le traitement des anomalies électrolytiques potentiellement mortelles telles que l'hyperkaliémie. La Malignant Hyperthermia Association of the United States (MHAUS) fournit des recommandations de traitement détaillées sur son site Web . MHAUS maintient également une ligne d'assistance téléphonique 24 heures sur 1 pour les conseils d'urgence (800-644-9737-001 aux États-Unis ; 209-417-3722-XNUMX en dehors des États-Unis).
Effets hépatiques
Les lésions hépatiques après anesthésie peuvent être classées comme graves (à médiation immunitaire) ou légères (59).
Lésion hépatique à médiation immunitaire
Des lésions hépatiques graves peuvent suivre une anesthésie avec de l'halothane, de l'isoflurane, du sévoflurane ou du desflurane. Cette forme sévère se traduit par une nécrose hépatique massive pouvant entraîner la mort ou nécessiter une transplantation hépatique. Le mécanisme de cette blessure grave est immunologique, nécessitant une exposition préalable à un anesthésique volatil. L'halothane, l'isoflurane et le desflurane subissent tous un métabolisme oxydatif par les enzymes du cytochrome P-450 pour produire du trifluoroacétate. Le trifluoroacétate peut se lier de manière covalente aux protéines des hépatocytes. Les fractions trifluoroacétyl-hépatocytes peuvent agir comme des haptènes, que le corps reconnaît comme étrangers et contre lesquels le système immunitaire forme des anticorps. Une exposition ultérieure à tout anesthésique capable de produire du trifluoroacétate peut provoquer une réponse immunitaire, conduisant à une nécrose hépatique sévère (60). Le sévoflurane est métabolisé en hexafluoroisopropanol, un composé qui n'a pas le comportement antigénique équivalent au trifluoroacétate (61).
Blessure légère au foie
Une forme cliniquement bénigne de lésion hépatique peut suivre l'administration d'halothane. La principale caractéristique de cette entité plus courante est une élévation modeste des taux sériques de transaminases. On pense que cette forme bénigne de lésion hépatique est médiée par le métabolisme réducteur de l'halothane et peut être plus susceptible de se produire après une diminution concomitante du débit sanguin hépatique et des réductions associées de l'apport d'oxygène au foie.
Antécédents de dysfonctionnement hépatique lié à l'anesthésie
Bien que les anesthésiques volatils ne soient souvent pas administrés aux patients qui ont présenté des symptômes inexpliqués de dysfonctionnement hépatique après une anesthésie par inhalation lors d'une précédente occasion, les anesthésiques volatils ne sont probablement pas nocifs pour les patients atteints d'une maladie hépatique préexistante non liée à l'anesthésie.
Effets rénaux
Le méthoxyflurane a été le premier anesthésique volatil ininflammable introduit dans la pratique clinique. Son utilisation a été associée à des lésions rénales. Une enquête ultérieure suggère que son métabolisme étendu, en particulier en fluorure inorganique et en acide dichloroacétique par O-déméthylation, est probablement responsable de la blessure. Pourtant, la production de fluorure à partir du métabolisme d'autres anesthésiques inhalés puissants, en particulier le sévoflurane, ne montre aucune association avec une lésion rénale (62).
10. QUESTIONS DU JOUR
- Quelles propriétés physiques du desflurane nécessitent son administration par un vaporisateur spécialement conçu ? Comment la sortie d'un vaporisateur de desflurane est-elle affectée par les hautes altitudes ?
- Quels anesthésiques inhalés ont le plus grand impact sur l'environnement en termes d'« équivalents dioxyde de carbone » ainsi que de longévité atmosphérique ?
- Comment la dose d'anesthésique inhalé nécessaire pour produire l'amnésie se compare-t-elle à la dose nécessaire pour empêcher le mouvement avec l'incision chirurgicale ? Quel est l'écart type du MAC pour l'incision chirurgicale ? Quels médicaments augmentent ou diminuent les besoins en anesthésiques inhalés ?
- Lors de l'administration d'un anesthésique inhalé, quels sont les six facteurs qui déterminent la pression partielle alvéolaire de l'anesthésique ?
- Lors de la récupération d'un anesthésique inhalé, quels facteurs influencent le plus la diminution de la pression partielle anesthésique ?
- Quels sont les effets circulatoires d'une augmentation rapide de la concentration du desflurane par rapport à l'isoflurane et au sévoflurane ? Comment ces effets peuvent-ils être minimisés ?