Erika Cvetko, Marija Meznarič und Tatjana Stopar Pintaric
EINFÜHRUNG
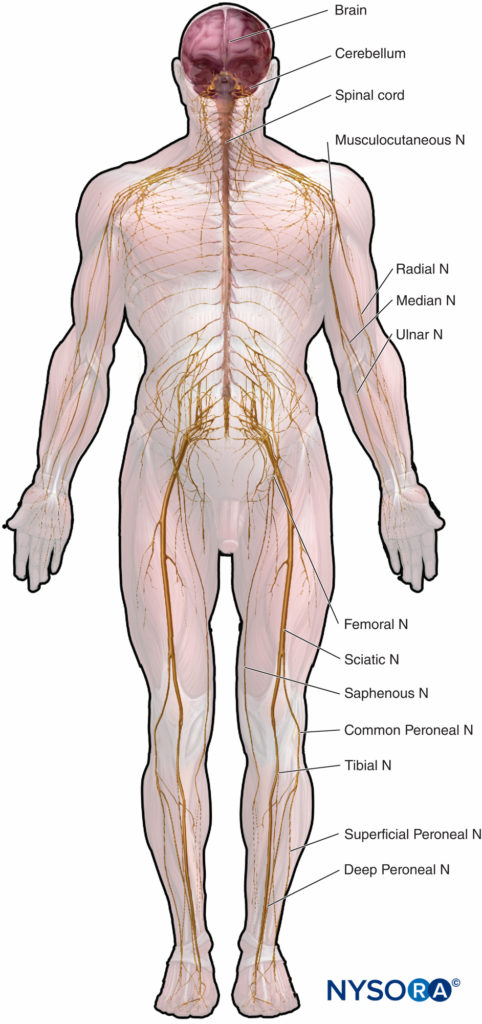
Mikroskopische Anatomie, die Struktur-Funktions-Beziehungen hervorhebt, ist wichtig für die klinische Praxis der Regionalanästhesie. Dieses Kapitel bietet eine Grundlage für das Verständnis der Struktur, Klassifikation und Organisation der peripheren Nerven und einen Einblick, wie die Eigenschaften der peripheren Nerven (Abbildung 1) beziehen sich auf die klinische Praxis der Regionalanästhesie.
ORGANISATION DES PERIPHEREN NERVENSYSTEMS
Das Nervensystem ermöglicht es dem Körper, auf kontinuierliche Veränderungen in seiner äußeren und inneren Umgebung zu reagieren. Es steuert und integriert die funktionellen Aktivitäten der Organe und Organsysteme.
Zellen des Nervensystems bestehen aus Neuronen und Neuroglia. Neuronen übertragen Nervenimpulse zum und vom Zentralnervensystem (ZNS) und integrieren dadurch motorische und sensorische Funktionen. Neurogliazellen unterstützen und schützen die Neuronen. Im ZNS wird Myelin von Oligodendrozyten und im peripheren Nervensystem (PNS) von den Schwann-Zellen produziert. Obwohl sowohl Schwann-Zellen als auch Oligodendrozyten für die Axon-Myelinisierung verantwortlich sind, haben sie unterschiedliche morphologische und molekulare Eigenschaften und unterschiedliche embryonale Ursprünge, die Neuralleiste bzw. das Neuralrohr.
Das PNS besteht aus peripheren Nerven (kraniospinal, somatisch, autonom) mit den dazugehörigen Ganglien und Bindegewebsanlagen. Alle liegen peripher zur pialen Hülle des ZNS.
Periphere Nerven enthalten Bündel von Nervenfasern, die aus Axonen bestehen. In peripheren Nervenfasern sind Axone von Schwann-Zellen umhüllt, die je nach Durchmesser Myelin um die Axone bilden können oder nicht. Nervenfasern sind in Faszikel unterschiedlicher Anzahl gruppiert. Die Größe, Anzahl und das Muster der Faszikel variieren in verschiedenen Nerven und auf verschiedenen Ebenen entlang ihrer Bahnen. Im Allgemeinen nimmt ihre Anzahl zu und ihre Größe in einem gewissen Abstand proximal zum Verzweigungspunkt ab.
NEURONEN
Ein Neuron ist die strukturelle und funktionelle Einheit des Nervensystems. Es umfasst den Zellkörper, Dendriten und das Axon.
Der Zellkörper (perykarion) ist die erweiterte Region des Neurons, die einen großen, euchromatischen Kern mit einem prominenten Nukleolus und umgebendem perinukleärem Zytoplasma enthält (Abbildung 2). Das perinukleäre Zytoplasma enthält reichlich endoplasmatisches Retikulum mit rauer Oberfläche und freie Ribosomen. Unter dem Lichtmikroskop erscheint das raue endoplasmatische Retikulum mit Rosetten aus freien Ribosomen als kleine Körperchen, sogenannte Nissl-Körperchen. Das perinukleäre Zytoplasma enthält zahlreiche Mitochondrien, einen großen perinukleären Golgi-Apparat, Liposomen, Mikrotubuli, Neurofilamente, Transportvesikel und Einschlüsse. Das Vorhandensein des euchromatischen Kerns, des großen Nukleolus, des prominenten Golgi-Apparats und der Nissl-Körper weist auf das hohe Maß an anaboler Aktivität hin, die erforderlich ist, um diese großen Zellen zu erhalten.
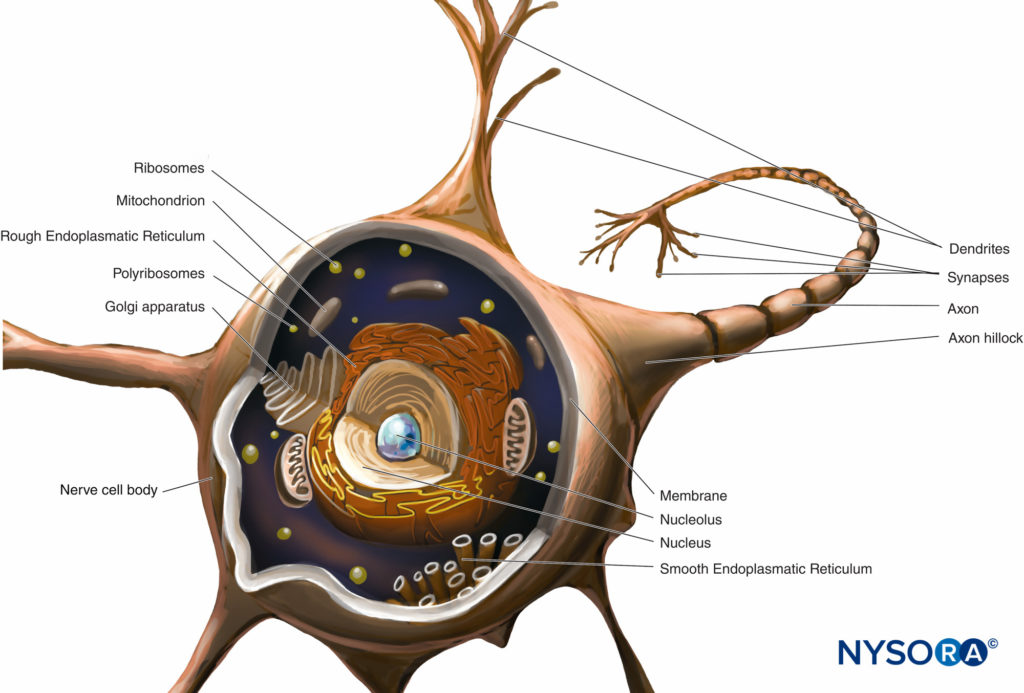
ABBILDUNG 2. Diagramm eines multipolaren Neurons. Der Nervenzellkörper, die Dendriten und der proximale Teil des Axons befinden sich innerhalb des ZNS. Die Axone, die das ZNS distal zu Zwischenwirbelforamina oder Foramina des Schädels verlassen, bilden den Hauptteil des PNS.
Dendriten sind Ausarbeitungen der rezeptiven Plasmamembran des Neurons. Die meisten Neuronen besitzen mehrere Dendriten, die typischerweise aus dem Zellkörper als einzelne kurze Stämme entstehen, die sich in kleinere Äste verzweigen, die sich an den Enden verjüngen. Dendritenverzweigungsmuster sind charakteristisch für jede Art von Neuron. Die Basis des Dendriten enthält die gleichen Organellen wie der Zellkörper, mit Ausnahme des Golgi-Apparats. Viele Organellen werden spärlich oder fehlen zum distalen Ende des Dendriten hin. Die Dendritenverzweigung führt zu mehreren synaptischen Terminals und ermöglicht es einem Neuron, mehrere Impulse zu empfangen und zu integrieren.
Das Axon entsteht aus dem Zellkörper als ein einziger dünner Fortsatz, viel länger als die Dendriten. Seine Dicke steht in direktem Zusammenhang mit der Leitungsgeschwindigkeit, die mit dem Axondurchmesser zunimmt. Einige Axone besitzen Seitenäste. Der Abschnitt des Axons zwischen dem Zellkörper und dem Beginn der Myelinscheide ist das Anfangssegment. Am Ende des Axons können die Verzweigungen viele kleine Äste bilden. Das axonale Zytoplasma heißt Axoplasma.
Fast alle strukturellen und funktionellen Proteinmoleküle werden im Zellkörper synthetisiert und in einem Prozess, der als axonaler Transport bekannt ist, zu entfernten Orten innerhalb eines Neurons transportiert. Der axonale Transport ist entscheidend für die trophischen Beziehungen innerhalb des Axons und dient als Weg der intrazellulären Kommunikation, bei dem Moleküle und Informationen entlang Mikrotubuli und Zwischenfilamenten vom neuronalen Zellkörper zum Axonterminal (anterograder Transport) oder vom Axonterminal zum neuronalen Zellkörper transportiert werden (retrograder Transport). Neuronen kommunizieren mit anderen Neuronen und mit Effektorzellen durch Synapsen. Diese speziellen Verbindungen zwischen Neuronen und Effektorzellen ermöglichen die Übertragung von Nervenimpulsen von einem (präsynaptischen) Neuron zu einem anderen (postsynaptischen) Neuron oder von Axonen zu Effektor-(Ziel-)Zellen wie Muskel- und Drüsenzellen.
Neuronen weisen eine größere Variation in Größe und Form auf als jede andere Gruppe von Zellen im Körper. Sie werden morphologisch nach ihrer Form und der Anordnung ihrer Fortsätze in drei Haupttypen eingeteilt. Der häufigste Neuronentyp, multipolar, besitzt ein einzelnes Axon mit verschiedenen Anordnungen mehrerer Dendriten, die vom Zellkörper ausgehen. Die Mehrheit der multipolaren Neuronen (Figure 2 und Abbildung 3) sind Motoneuronen. Ein zweiter Neuronentyp, unipolar oder pseudounipolar (Figure 3), besitzt nur einen Fortsatz, das Axon, das vom Zellkörper ausgeht und kurz nach Verlassen des Zellkörpers in die peripheren und zentralen Äste mündet. Der zentrale Ast tritt in das ZNS ein, während der periphere Ast zu seinem entsprechenden Rezeptor im Körper weitergeht. Jeder der beiden Äste ist morphologisch axonal und kann Nervenimpulse weiterleiten, obwohl der äußerst distale Teil des peripheren Zweigs baumartig ist, was auf seine Rezeptorfunktion hinweist. Die Mehrzahl der unipolaren Neuronen sind sensorische Neuronen, deren Zellkörper sich in den Spinalnerven in den Spinalnerven und in den sensorischen Ganglien der Hirnnerven befinden. Der dritte Neuronentyp, bipolar, besitzt zwei Fortsätze, die vom Zellkörper ausgehen: einen einzelnen Dendriten und ein einzelnes Axon. Sie kommen nur in einigen Hirnnerven vor.
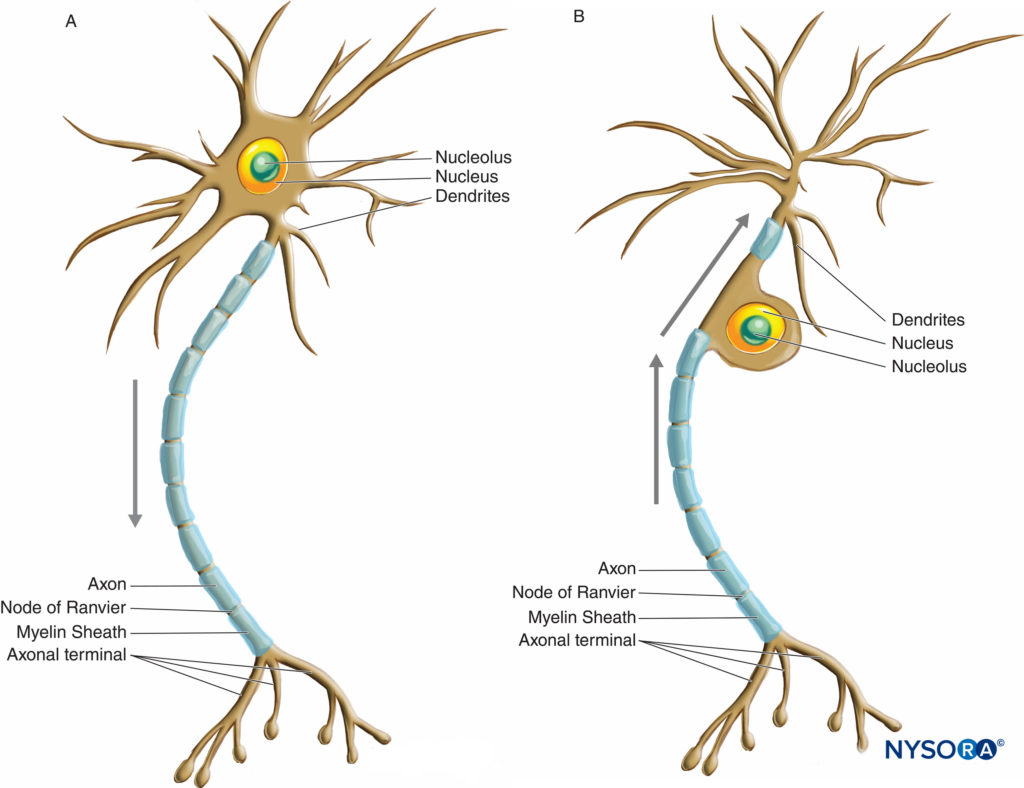
ABBILDUNG 3. Diagramm zur Veranschaulichung eines multipolaren (A) und unipolaren oder pseudounipolaren (B) Neurons. Pfeile zeigen die Richtung der Nervenimpulsausbreitung an.
Funktionell hat das Nervensystem somatisch und autonom Komponenten. Nervenfasern, die Gewebe innervieren, die von Somiten (Muskeln und Haut) stammen, werden als somatisch beschrieben; Nervenfasern, die endodermale oder andere mesodermale Derivate (innere Organe) innervieren, sind viszeral. Das somatische Nervensystem steuert Funktionen, die mit Ausnahme des Reflexbogens bewusst willkürlich gesteuert werden. Es bietet sensorische und motorische Innervation für alle Körperteile mit Ausnahme der Eingeweide, der glatten Muskulatur, des Herzmuskels und der Drüsen. Das autonome Nervensystem sorgt für eine efferente unwillkürliche Innervation glatter und kardialer Muskeln und Drüsen. Es sorgt auch für die afferente sensorische Innervation der Eingeweide (Schmerzen und autonome Reflexe).
Efferente Axone
Efferente Axone entstehen entweder aus dem somatischen oder dem autonomen Nervensystem. Somatische efferente (motorische) Neuronen innervieren Skelettmuskeln und haben Zellkörper, die sich in somatischen motorischen Kernen des Hirnstamms (Hirnnerven) oder in den ventralen Hörnern des Rückenmarks (Spinalnerven) befinden.
Präganglionäre viszerale efferente Neuronen des sympathischen Teils des autonomen Nervensystems entstehen aus der intermediolateralen Säule des Rückenmarks zwischen den Ebenen T1 und L2 und bilden eine Synapse paravertebral or prävertebral (präaortalen) Ganglien. Periphere Nerven enthalten somit sowohl präganglionäre als auch postganglionäre sympathische Fasern. Präganglionäre viszerale efferente Neuronen des parasympathischen Teils des autonomen Nervensystems entstehen aus den parasympathischen Kernen im Hirnstamm (kranialer Teil des parasympathischen Nervensystems) oder im sakralen Rückenmark zwischen den Segmenten S2 und S4 (sakraler Teil des parasympathischen Nervensystems). Nur präganglionäre parasympathische Fasern wandern entlang peripherer Nerven, um an intramuralen Ganglien in der Wand der Zielorgane Synapsen zu bilden.
Afferente Axone
Afferente Axone sind entweder somatisch oder viszeral und haben Zellkörper entweder in den Hinterwurzelganglien der Spinalnerven oder in den sensorischen Ganglien der Hirnnerven. Somatische afferente (sensorische) Neuronen übertragen Impulse von den Rezeptoren für Berührung, Temperatur oder Schmerz (Nozizeptoren) in der Körperwand (Haut) und von den Propriozeptoren in den Skelettmuskeln und -gelenken. Viszerale afferente Neuronen übertragen Informationen von den Eingeweiden (Interozeptoren und Nozizeptoren). Die viszeralen afferenten Axone wandern entlang der viszeralen efferenten Fasern und passieren die kommunizierenden Äste und dorsalen Wurzeln der Spinalnerven oder entlang des Vagusnervs, um in das ZNS einzutreten.
SCHWANN-ZELLEN
Axone peripherer Nerven werden von Schwann-Zellen umhüllt. Ihre Myelinscheide (modifiziertes Plasmalemma) trennt die Axone vom Endoneurium. Schwann-Zellen sind entlang der Axone in Längsketten verteilt, abhängig von der Myelinisierung entlang des Axons. Die koordinierte Differenzierung der Axone und ihrer myelinisierenden Zellen erfordert eine enge Kommunikation zwischen Neuronen und Gliazellen. Von den Axonen bereitgestellte Signale regulieren die Proliferation, das Überleben und die Differenzierung von Gliazellen. Andererseits beeinflussen reziproke Gliasignale das axonale Zytoskelett und den Transport und sind für das axonale Überleben erforderlich und Regeneration. Schwann-Zellen haben auch eine Leitfunktion für wachsende Axone, was darauf hindeutet, dass Glia mehr als nur das Axon unterstützen.
Schwann-Zell-Phänotypen sind durch unterschiedliche Morphologien gekennzeichnet und differentielle Expression von Myelinproteinen, Zelladhäsionsmolekülen, Rezeptoren, Enzymen, intermediären Filamentproteinen, Ionenkanälen und extrazellulären Matrixproteinen. Alle Schwann-Zellen sind von einer Basallamina umgeben, deren extrazelluläre Matrixmoleküle wie Laminin Schlüsselaspekte der Entwicklung von Schwann-Zellen regulieren.
KLASSIFIZIERUNG DER NERVENFASERN
Nervenfasern werden nach Axondurchmesser, Leitungsgeschwindigkeit, Rezeptortyp und Dicke der Myelinscheide klassifiziert (Tisch 1). Die Leitungsgeschwindigkeit hängt mit dem Axondurchmesser zusammen; Das heißt, je größer die Faser ist, desto schneller wird die Leitung sein.
TABELLE 1. Klassifikation peripherer Nervenfasern nach Axondurchmesser, Leitungsgeschwindigkeit, Rezeptortyp und Dicke der Myelinscheide (Myelinisierung).
| Axonal Durchmesser (um) | Konduktion: Geschwindigkeit (M / s) | Efferente Fasern | Afferente Fibersa (Von kutanen Rezeptoren) | Afferente Fasern vom Skelett Muskeln, Sehnen und Gelenke | Myelinisierung |
|---|---|---|---|---|---|
| 12-20 | 60-120 30-70 | Aα (zu extrafusalen Muskelfasern) | Aα (von schnell adaptierenden Mechanorezeptoren) | Ia (von Muskelspindeln) Ib (aus Golgi-Sehnenorganen) | Stark myelinisiert |
| 6-12 | 25-70 | Aβ (von langsam adaptierenden Mechanorezeptoren) | II (von gemeinsamen Propriozeptoren) | Myelinisiert | |
| 3-8 | 15-30 | Aγ (zu intrafusalen Muskelfasern) | Myelinisiert | ||
| 1-6 | 12-30 | Aδ (von thermischen und mechanischen Nozizeptoren und Thermorezeptoren – nur Kälte) | III (von gemeinsamen Propriozeptoren und gemeinsamen Nozizeptoren) | Dünn myelinisiert | |
| 1-3 | 3-15 | B (präganglionäres Viszeral) | Myelinisiert | ||
| 0.2-1.5 | 0.5-2 | C (postganglionär viszeral) | C (von mechanischen Nozizeptoren und Thermorezeptoren – kalte und warme, polymodale Nozizeptoren) | IV (von gemeinsamen Nozizeptoren) | Myelinisiert |
aViszerale afferente Fasern (von Interozeptoren) werden als Aδ- und C-Fasern klassifiziert.
Quelle: Modifiziert mit Genehmigung von Cramer GD, Darby S: Grundlegende und klinische Anatomie der Wirbelsäule, des Rückenmarks und des ANS, 2. Aufl. Philadelphia: Elsevier/Mosby; 2005.
NYSORA-Tipps
Je größer die Faser, desto konzentrierter muss das Lokalanästhetikum sein, um eine neurale Blockade zu bewirken.
Myelinisierte Nervenfasern
Myelinisierte Nervenfasern sind von Myelin umhüllt, stark ausgedehntes und modifiziertes Plasmalemma der Schwann-Zellen (Zahlen 4 und 5). Die Myelinbildung beginnt mit der Ausdehnung des Cytoplasmas der Schwann-Zelle und der Entwicklung des inneren Mesaxons, das das Axon mehrfach umschlingt. Während des Wickelvorgangs wird das Zytoplasma fast zwischen dem Plasmalemma extrudiert. Angrenzende extrazelluläre Flächen des Plasmalemmas werden zur „großen dichten Linie“, und anliegende zytoplasmatische Flächen bilden eine „Intraperiodenlinie“ von Myelin. Die vorgeschlagene Molekularstruktur von Myelin passt zum Konzept des Plasmalemmas als einer Lipiddoppelschicht mit integralen und peripheren Membranproteinen, die an der extrazellulären oder der zytoplasmatischen Seite des Plasmalemmas befestigt sind. Im Gegensatz zu den meisten biologischen Membranen hat Myelin ein hohes Verhältnis von Lipid zu Protein (70–85 % Lipid, 15–30 % Protein), wobei letztere als Strukturproteine, Enzyme, Spannungskanäle und Signalwandler dienen.
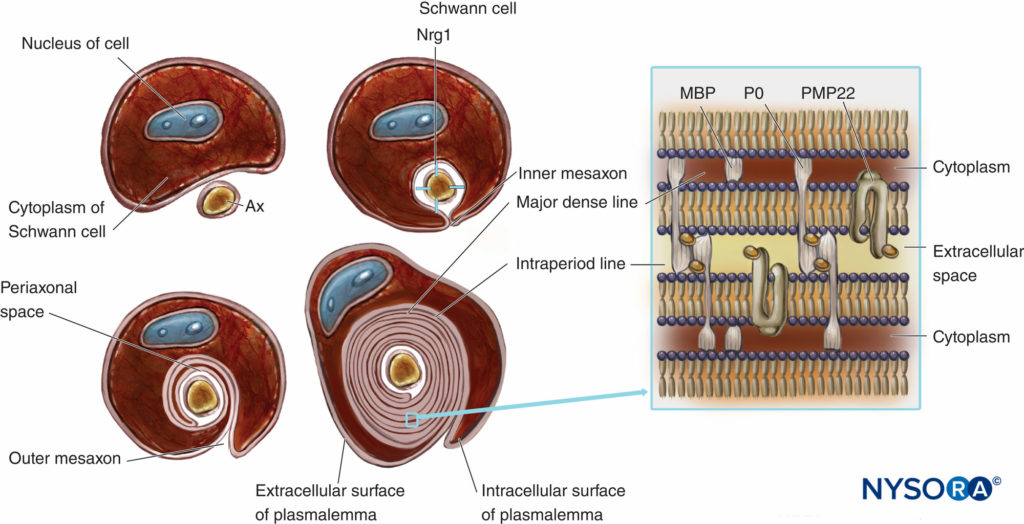
ABBILDUNG 4. Schematische Darstellung der Myelinbildung und vereinfachtes Schema ihrer molekularen Organisation. Zur Vereinfachung ist die Basallamina der Schwann-Zellen nicht gezeichnet. Nrg1 = Neuregulin; MPB = basisches Myelinprotein; P0 = Protein Null; PMP22 = peripheres Membranprotein von 22 kDa; Ax = Axon. (Geändert mit Genehmigung von Ross M, Pawlina W: Histology: A Text and Atlas With Correlated Cell and Molecular Biology, 6. Aufl. Philadelphia: Wolters Kluwer; Lippincott Williams & Wilkins; 2011.)
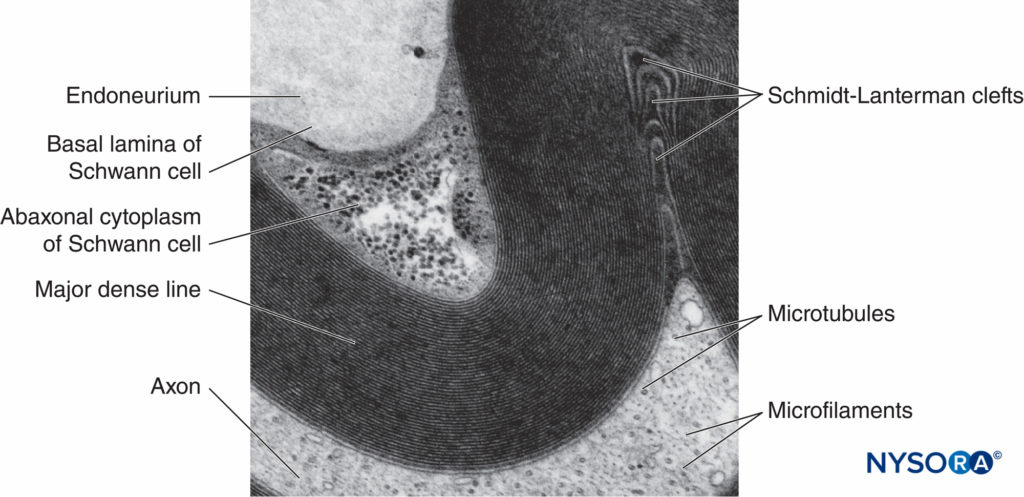
ABBILDUNG 5. Elektronenmikroskopische Aufnahme der myelinisierten Faser. Myelin wird als eine Reihe abwechselnd dunkler und weniger dunkler Linien visualisiert. Biopsie des menschlichen Suralnervs.
Die Myelinscheide umhüllt das Axon in Segmenten. Bereiche des Axons, die von konzentrischen Myelinlamellen und einer einzelnen myelinproduzierenden Schwann-Zelle bedeckt sind, werden als bezeichnet Internodien und haben einen Längenbereich von 200 bis 1000 µm. Unterbrechungen, die in regelmäßigen Abständen entlang der Länge der Axone in der Myelinscheide auftreten und das Axon freilegen, werden Ranvier-Knoten genannt (Abbildung 6). Jeder Knoten zeigt eine Schnittstelle zwischen den Myelinscheiden zweier unterschiedlicher Schwann-Zellen entlang des Axons an.
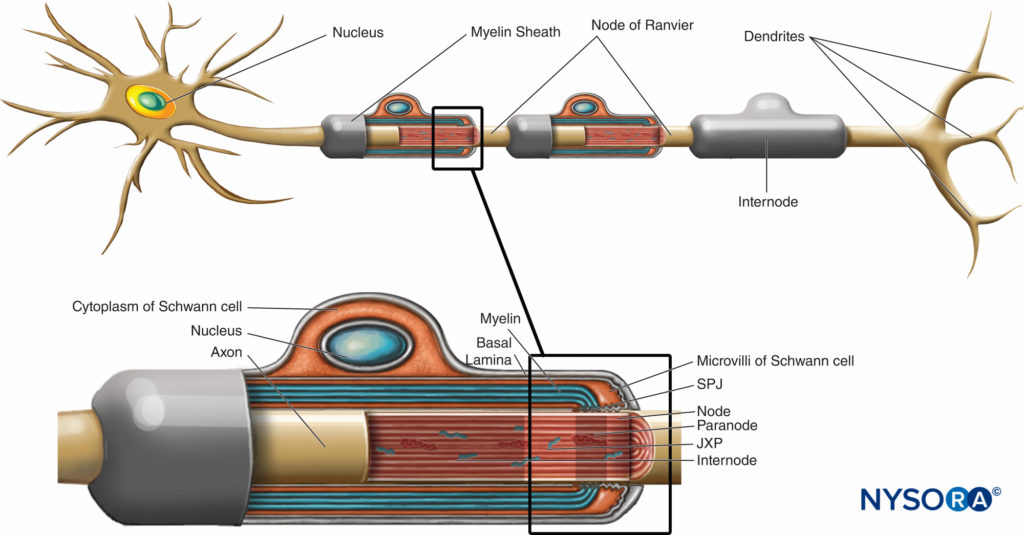
ABBILDUNG 6. Eindeutige Domänen der Knotenregion. Die Region, die von unterschiedlichen Proteinen besetzt ist, die sich im nodalen Axolemm befinden, ist schematisch in Schwarz über dem Axon dargestellt. SPJ = septate like junctions; JXP = juxtaparanode. (Modifiziert mit Genehmigung von Poliak S, Peles E. The local difference of myelinated axons at nodes of Ranvier. Nat Rev Neurosci. 2003 Dec;4(12):968-980.)
Die Knotenregion und ihre Umgebung können weiter in mehrere Domänen unterteilt werden (Figure 6), die einen einzigartigen Satz von Ionenkanälen, Zelladhäsionsmolekülen und zytoplasmatischen Adapterproteinen enthalten. Im PNS steht der Knoten in Kontakt mit Schwann-Zell-Mikrovilli und ist von seiner Basallamina bedeckt (Figure 6). Ein wichtiges Merkmal der Knoten Axolemma ist seine hohe Dichte an spannungsgesteuertem Na+ Kanäle im Vergleich zu der juxtaparanodal Axolemma, das typischerweise eine hohe Dichte an K enthält+ Kanäle Na+ Kanäle potenzieren den Nervenimpuls in salziger Weise (Abbildung 7) entlang der myelinisierten Fasern. Wenn die Membran am Knoten erregt wird, kann der erzeugte lokale Stromkreis nicht durch die hochohmige Myelinscheide fließen. Es fließt daher heraus und depolarisiert die Membran am nächsten Knoten, der 1 mm oder weiter entfernt sein kann. Die geringe Kapazität der Hülle bedeutet, dass wenig Energie erforderlich ist, um die verbleibende Membran zwischen den Knoten zu depolarisieren, was zu einer erhöhten Geschwindigkeit der Ausbreitung des lokalen Schaltkreises führt.
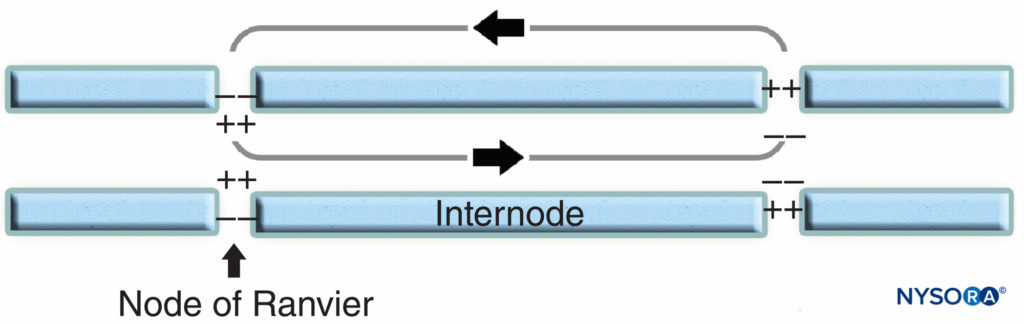
ABBILDUNG 7. Saltatorische Leitung in myelinisierten Nervenfasern. Na+-Kanäle, die sich am nodalen Axolemm befinden, potenzieren den Nervenimpuls auf salzige Weise entlang der myelinisierten Nervenfaser.
Die Myelinisierung ist ein Beispiel für die Kommunikation von Zelle zu Zelle, bei der Axone mit Schwann-Zellen interagieren. Die Anzahl der Myelinschichten wird durch das Axon und nicht durch die Schwann-Zelle bestimmt. Die Dicke der Myelinscheide wird durch einen Wachstumsfaktor namens Neuregulin 1 (Nrg1) reguliert. Die Verdichtung der Myelinscheide ist mit der Expression von Transmembran-Myelin-spezifischen Proteinen wie Protein 0 (P0), einem peripheren Myelinprotein von 22 Kilodalton (PMP22) und einem basischen Myelinprotein (MBP) verbunden. Das Fehlen von Proteinen, die die Myelinscheidenbildung regulieren, könnte bei Menschen und Versuchstieren zu einer schweren Hypomyelinisierung oder Dismyelinisierung führen.
UNMYELINIERTE NERVENFASERN
Unmyelinisierte Axone sind ebenfalls von Schwann-Zellen und ihrer Basallamina umhüllt. Eine einzelne Schwann-Zelle kann ein einzelnes oder mehrere marklose Axone umhüllen (Zahlen 8 und 9). Unmyelinisierte Fasern überwiegen in menschlichen kutanen Spinalnerven, wo das durchschnittliche Verhältnis von unmyelinisierter zu myelinisierter Faserdichte 3.7:1 beträgt. In myelinisierten Fasern ist die Leitungsgeschwindigkeit proportional zur Quadratwurzel des Faserdurchmessers und viel langsamer im Vergleich zur Salzleitung in myelinisierten Fasern (Tabelle 1).
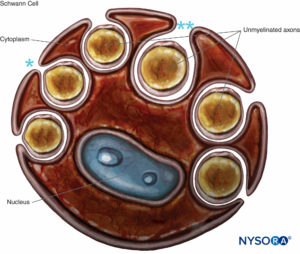
ABBILDUNG 8. Schwann-Zelle, die mehrere marklose Axone umschließt. Die Lippen der Zytoplasmafurche können geschlossen (*) sein und das Mesaxon bilden oder geöffnet sein (**). Basallamina der Schwann-Zelle ist nicht gezeichnet.
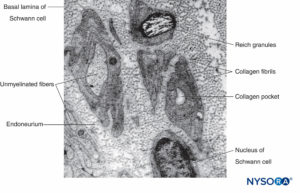
ABBILDUNG 9. Elektronenmikroskopische Aufnahme nichtmyelinisierter Axone. Biopsie des menschlichen Suralnervs.
BINDEGEWEBE INVESTITIONEN VON PERIPHEREN NERVEN
In einem peripheren Nerv werden Nervenfasern und ihre unterstützenden Schwann-Zellen durch Bindegewebe zusammengehalten, das in drei charakteristische Komponenten organisiert ist, die spezifische morphologische und funktionelle Eigenschaften haben. Das Epineurium bildet das äußerste Bindegewebe des peripheren Nervs, das Perineurium umgibt jeden Nervenfaszikel separat, während die einzelnen Nervenfasern im Endoneurium eingebettet sind (Zahlen 10 zu 13).
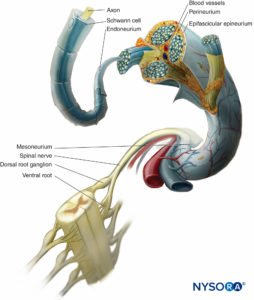
ABBILDUNG 10. Bindegewebsinvestitionen des peripheren Nervs. Das Diagramm zeigt die Anordnung des peripheren Nervs. Ein Segment des Spinalnervs ist vergrößert, um die Beziehung der Nervenfasern zum umgebenden Bindegewebe (Endoneurium, Perineurium und Epineurium) darzustellen.
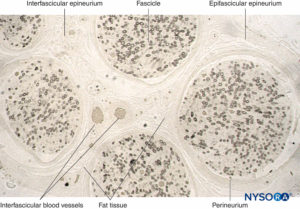
ABBILDUNG 11. Semidünnschnitt des menschlichen Suralnervs fixiert in Osmiumtetroxid. Die Myelinscheiden sind erhalten und schwarz gefärbt.
Perineurium umgibt den Nervenfaszikel. Bindegewebsstreifen stammen aus dem epifaszikulären Epineurium im Inneren des Nervs als
interfaszikuläres Epineurium. Fettgewebe und Blutgefäße sind im interfaszikulären Epineurium lokalisiert.
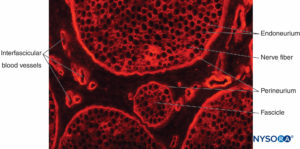
ABBILDUNG 12. Querschnitt des Ischiasnervs vom Schwein. Immunhistochemische Färbung für Kollagen. Blutgefäße verlaufen durch die
interfaszikuläres Epineurium, das den Raum um das Perineurium und die Faszikel ausfüllt.
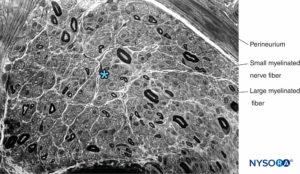
ABBILDUNG 13. Mit Cresylviolett gefärbter Halbdünnschnitt des menschlichen Suralnervs. Axonale Neuropathie mit überwiegendem Verlust großer myelinisierter Fasern. * Intrafaszikulärer Raum zwischen myelinisierten Fasern (besetzt durch Endoneurium, Schwann-Zellkerne und unmyelinisierte Fasern).
Epineurium
Das Epineurium ist eine Kondensation eines lockeren Areolar-Bindegewebes, das einen peripheren Nerv umgibt und seine Faszikel zu einem gemeinsamen Bündel bindet (Figure 10 und Figure 11).
Epineurium, das sich zwischen den Faszikeln erstreckt, ist das interfaszikuläre oder innere Epineurium, während das Epineurium, das den gesamten Nervenstamm umgibt, das epifaszikuläre oder externe Epineurium ist Das sogenannte Epineurium umfasst 30–75 % der Nervenquerschnittsfläche variiert aber entlang des Nervs. Sie ist dort am dicksten, wo sie in die Dura übergeht, die das ZNS bedeckt, und häufiger in den Nerven neben den Gelenken, wo die Nerven Druck ausgesetzt sind. Die Anfälligkeit für Kompressionsverletzungen ist daher bei unifaszikulären Nerven wahrscheinlich größer als bei multifaszikulären Nerven, da letztere eine größere Menge an Epineurium aufweisen. Wenn sich der periphere Nerv teilt und die Anzahl der Faszikel reduziert wird, wird das Epineurium zunehmend dünner und verschwindet schließlich um die monofaszikulären Nerven.
Das Epineurium enthält Kollagen, Fibroblasten, Mastzellen und Fettzellen. Kollagenbündel haben eine vorherrschende Längsorientierung; Eine elektronenmikroskopische Studie ergab jedoch, dass epineurales Kollagen in Bündeln mit einer Breite von 10–20 µm schräg um den Umfang des Nervs angeordnet ist. Elastische Fasern sind auch vorhanden, insbesondere neben dem Perineurium, die überwiegend längs ausgerichtet sind. Kollagen- und elastische Fasern sind ausgerichtet und orientiert, um Schäden durch Überdehnung des Nervenbündels zu verhindern, was darauf hindeutet, dass das Epineurium so konstruiert ist, dass es die Dehnung aufnehmen kann.
Menschliches Epineurium ist überwiegend aus Kollagen vom Typ I und Typ III aufgebaut, wobei der Typ I vorherrscht. Der Durchmesser der Kollagenfibrillen beträgt durchschnittlich 60–110 nm.
Fettgewebe innerhalb eines Nervs umgibt die Faszikel und bildet Fetthüllen, die die Faszikel voneinander trennen. Die Dicke der Fetthüllen variiert von einem Faszikel zum anderen und ist in größeren Nervenstämmen größer, was ihre Schutzfunktion bei der Polsterung der Faszikel gegen Schäden durch Kompression unterstreicht. Der Verlust von epineuralem Fett kann ein Risikofaktor für druckbedingte Lähmungen bei abgemagerten, bettlägerigen Patienten darstellen. Im Gegensatz dazu kann übermäßiges Fettgewebe auch die Diffusion eines in der Nähe eines Nervs injizierten Lokalanästhetikums verzögern und somit die Anästhesieblockade stören. Das Epineurium ist kontinuierlich mit dem Bindegewebe namens Adventitia oder Mesoneurium, das den Nerv umgibt, wenn es durch, unter oder zwischen den Muskelfaszien verläuft, und dient als (1) eine Leitung für das injizierte Lokalanästhetikum, (2) ein Weg, der das Nervengleiten ermöglicht, und (3) eine Schutzschicht gegen Nerventrauma. Da ihre Befestigung locker ist, sind Nerven relativ beweglich, außer wenn sie durch Eintritt in Gefäße oder Austritt von Nervenästen angebunden sind.
Damm
Das Perineurium ist ein spezialisiertes Bindegewebe, das einzelne Nervenbündel umgibt (Figuren 10 und 12). Diese schützende Zellschicht ist dünner als das Epineurium und trennt das Endoneurium vom Epineurium. Das Perineurium besteht aus abwechselnden Schichten abgeflachter polygonaler Zellen, von denen angenommen wird, dass sie von Fibroblasten abstammen, und kollagenem Bindegewebe. deren Bildung von den Schwann-Zellen gesteuert wird. Die abgeflachten polygonalen Zellen, die die Lamellen bilden, sind darauf spezialisiert, als Diffusionsbarriere zu fungieren. Die Anzahl der Lamellen variiert hauptsächlich in Abhängigkeit vom Durchmesser des Faszikels; Je größer der Faszikel ist, desto größer ist die Anzahl der Lamellen. In den Nervenstämmen von Säugetieren enthält das Perineurium 15–20 Zellschichten. Aneinandergrenzende Zellen in jeder Schicht verzahnen sich entlang ausgedehnter Tight Junctions. Die Zellen können sich verzweigen und Prozesse hervorrufen und zu den benachbarten Lamellen beitragen. Jede Zellschicht, eingeschlossen von der Basallamina, kann in menschlichen Nerven eine Dicke von bis zu 0.5 µm erreichen.
Kollagenfasern entstehen in einer gitterartigen Anordnung, in der Bündel kreisförmig, längs und schräg angeordnet sind. Die innerste perineurale Zellschicht haftet an einer ausgeprägten Grenzschicht aus dicht gewebten Kollagenfasern und subperineuralen Fibroblasten, die das Perineurium mechanisch mit dem endoneuralen Inhalt verbindet. Kollagenfasern sind überwiegend vom Typ III, obwohl auch Kollagenfasern vom Typ I vorhanden sind. Der Durchmesser der Kollagenfibrillen ist mit durchschnittlich 52 nm im Suralnerv der Ratte wesentlich kleiner als der der epineuralen Fibrillen. Die Basallamina polygonaler Zellen besteht aus den Kollagenen IV und V, Fibronektin, Heparansulfat-Proteoglycan, und Laminin. Das allgegenwärtige Vorhandensein von pinozytotischen Vesikeln, die reich an phosphorylierenden Enzymen sind, begründet die Annahme, dass das Perineurium als metabolisch aktive Diffusionsbarriere fungiert, die eine wesentliche Rolle bei der Aufrechterhaltung des osmotischen Milieus und des Flüssigkeitsdrucks innerhalb des Endoneuriums spielt. Beispielsweise drang in einer unserer Studien zwischen den Nervenfaszikeln bei Ferkeln angesammelte Entzündungszellen nicht in das Perineurium ein, nachdem der Nerv Ultraschallgel ausgesetzt worden war. Aufgrund seiner fest anhaftenden Zellstruktur und des stärker in Längsrichtung orientierten Kollagens ist das Perineurium weniger dehnungstolerant als das Epineurium. Beim Kaninchen fiel das mechanische Versagen während der Dehnung mit einer Zerstörung des Perineuriums zusammen, während das Epineurium intakt blieb. Die Integrität der Diffusionsbarriere wurde nach 2 Stunden bei 15 % Dehnung aufrechterhalten, während 27 % Dehnung eine akute perineurale Störung verursachte.
Endoneurium
Das Endoneurium besteht aus lockerem intrafaszikulärem Bindegewebe, das die perineuralen Trennwände, die die Faszikel unterteilen, nicht enthält und Schwann-Zellen umgibt (Figure 12). Ungefähr 40–50 % des intrafaszikulären Raums werden von nichtneuralen Elementen (dh anderen als Axon- und Schwann-Zellen) eingenommen, von denen die endoneurale Flüssigkeit und die Bindegewebsmatrix 20–30 % einnehmen. Es gibt erhebliche Unterschiede zwischen den Nerven verschiedener Arten und Altersklassen.
Das Endoneurium besteht aus Kollagenfasern (produziert von den darunter liegenden Schwann-Zellen und Fibroblasten); Zellkomponenten werden in endoneuraler Flüssigkeit gebadet, die in beträchtlichen intrafaszikulären Räumen enthalten ist. Die Nervenfasern neigen dazu, in kleinen Bündeln mit dazwischen liegenden Spalten gruppiert zu sein. Der endoneurale Flüssigkeitsdruck ist etwas höher als der des umgebenden Epineuriums. Es wird angenommen, dass dieser Druckgradient die endoneurale Kontamination durch toxische Substanzen außerhalb des Nervenbündels minimiert.
Endoneurale Kollagenfibrillen sind kleiner als die im Epineurium und haben beim Menschen einen Durchmesser zwischen 30 und 65 nm. Die Fibrillen verlaufen parallel zu und um die Nervenfasern herum und binden sie zu Faszikeln oder Bündeln zusammen. Sie zeigen Kondensationen um Kapillaren und Nervenfasern. In der Nähe des distalen Endes des Axons ist das Endoneurium auf wenige retikuläre Fasern reduziert, die die Basallamina der Schwann-Zellen umgeben. Kollagen vom Typ I, II und III ist im Endoneurium vorhanden.
Zelluläre Bestandteile des Endoneuriums sind Fibroblasten, Endothelzellen von Kapillaren, Mastzellen und Makrophagen. Mastzellen kommen in unterschiedlicher Zahl vor, besonders zahlreich entlang von Blutgefäßen. Makrophagen machen 2–4 % der intrafaszikulären Kerne im peripheren Nerv der Ratte aus und sind die primären Antigen-präsentierenden Zellen des peripheren Nervs. Sie fangen extrazelluläre Proteine auf und präsentieren sie T-Zellen, die aus dem Kreislauf austreten. Die Makrophagen vermitteln die immunologische Überwachung und sind an der Reparatur von Nervengewebe beteiligt. Nach einer Nervenverletzung vermehren sie sich und phagozytieren aktiv Myelintrümmer.
Die extrazelluläre Matrix ist reich an Glykoproteinen, Glykosaminoglykanen und Proteoglykanen. Die am besten charakterisierten davon schließen das Glykoprotein Fibronektin, Tenascin C, Trombospondin und die Chondroitinsulfat-Proteoglykane Versican und Decorin ein. Die Expression dieser Moleküle ändert sich nach einer Nervenverletzung, sodass sie möglicherweise während der Nervenregeneration relevant sind.
Aus hydrodynamischer Sicht können die verschiedenen Gewebe, aus denen ein peripherer Nerv besteht, in das lockere, hochdehnbare Bindegewebe des Epineuriums mit hoher Nachgiebigkeit und die zerbrechlichen Faszikel und Faszikelbündel mit geringer Nachgiebigkeit, die dicht im Perineurium gepackt sind, unterteilt werden. Diese anatomischen Unterschiede zwischen Bindegewebe und Faszikeln bzw. deren Bündeln erklären, warum eine Injektion in Faszikel mehr Kraft (Druck) erfordert als eine Injektion in das lockere Bindegewebe des Epineuriums.
NYSORA-Tipps
- Das Perineurium ist ein zähes und widerstandsfähiges Gewebe, das beim langsamen Vorschieben einer stumpfen, kurz abgeschrägten Nadel während des Nervenblockadeverfahrens dazu neigt, auszuweichen.
- Für eine Injektion in ein Faszikel mit niedriger Compliance ist eine höhere Kraft (Druck) erforderlich als in das Epineurium mit hoher Compliance.
- In den interskalenären und supraklavikulären Regionen des Plexus brachialis sind die Nerven dichter gepackt und
- oligofaszikulär, während sie weiter distal polyfaszikulär mit einer größeren Menge an Stromagewebe sind.
- Multifaszikuläre Nerven sind im Vergleich zu unifaszikulären aufgrund eines reduzierten faszikulären Durchmessers und eines erhöhten epineurialen Schutzes weniger anfällig für Verletzungen.
- Die Fülle an lockerem epineurialem Gewebe bietet eine Erklärung dafür, warum die meisten intraneuralen Injektionen (intraneural, aber extrafaszikulär) nicht zu einer offensichtlichen Nervenverletzung führen.
DIE ÜBERGANGSREGION ZENTRAL-PERIPHERIE
Der Übergang zwischen dem ZNS und dem PNS in Hirn- und Spinalnervenwurzeln wird als der bezeichnet zentral-peripher Übergangsbereich or ZNS-PNS Grenze (Abbildung 14). Es stellt eine abrupte Veränderung des Myelintyps, der Stützelemente und der Vaskularisation dar. Die Hauptkomponenten der Glia im ZNS sind Astrozyten und Oligodendrozyten, während die Hauptkomponenten im PNS die Schwann-Zellen sind. Die Nervenwurzeln der Spinalnerven sind in Liquor cerebrospinalis gebadet. Das Übergangsbereich ist die Länge der Wurzel, die sowohl zentrales als auch peripheres Nervengewebe enthält. Übergangsdetails, die die Umhüllung der Spinalwurzeln mit den Hirnhäuten und bindegewebigen Einlagen der peripheren Nerven unterscheiden, sind nicht vollständig geklärt. Ihre strukturellen Anordnungen sind jedoch in elektronenmikroskopischen Untersuchungen gut dokumentiert.
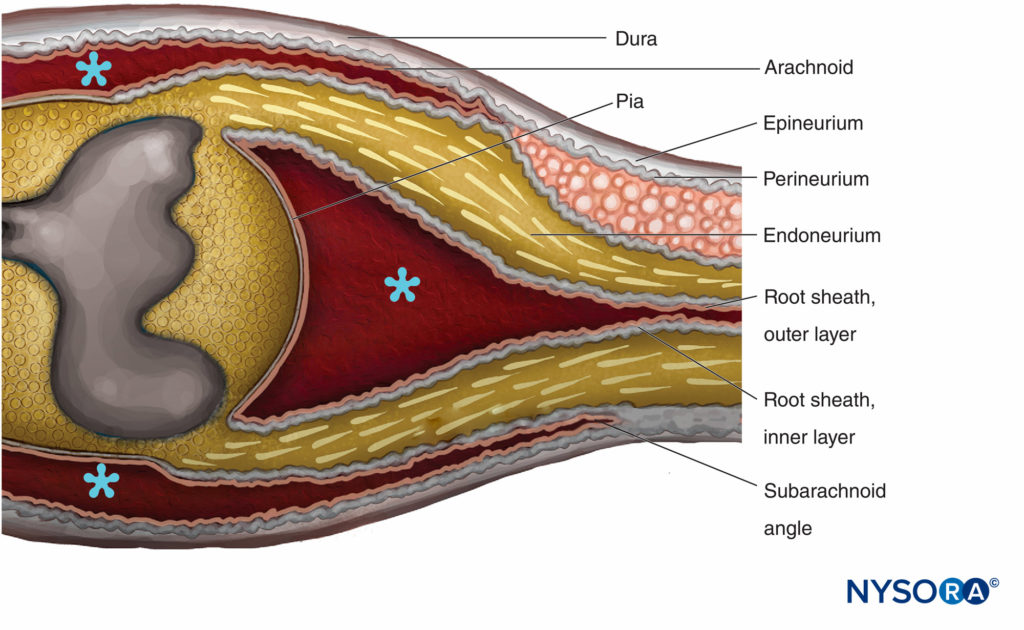
ABBILDUNG 14. Übergangsbereich Zentral-Peripherie. Das Epineurium geht in die Dura mater über. Die Arachnoidea wird im Subarachnoidalwinkel über den Wurzeln reflektiert und geht in die äußere Schicht der Wurzelscheide über. An der Verbindung mit dem Rückenmark geht die äußere Schicht in die Pia mater über. Das Perineurium teilt sich im Subarachnoidalwinkel in zwei Schichten: Die äußere Schicht trennt sich von der Nervenwurzel und verläuft zwischen Dura und Arachnoidea; Die innere Schicht haftet an Spinalwurzeln und bildet die innere Schicht der Wurzelscheide. Das Spinalganglion ist in das Perineurium eingebettet. * Subarachnoidalraum. (Wiedergabe mit freundlicher Genehmigung von Haller FR, Low FN. Die feine Struktur der peripheren Nervenwurzelscheide im Subarachnoidalraum bei der Ratte und anderen Labortieren. Am J Anat. 1971 May;131(1):1-19.
Die zellulären Bestandteile des Endoneuriums in den Spinalwurzeln ähneln denen peripherer Nerven. Die Kollagenmenge ist wesentlich geringer und nicht in Hüllen um die Nervenfasern herum organisiert. Die Region, in der die Spinalwurzeln am Rückenmark ansetzen, ist gekennzeichnet durch einen unregelmäßig gestalteten Übergang vom peripheren Nerv zum ZNS, der Obersteiner-Redlich-Zone, wo Schwann-Zellen durch Oligodendrozyten ersetzt werden. Der zentrale Teil der Wurzel wird an seiner Peripherie durch marginale Glia begrenzt, die aus Astrozyten besteht, die von einer Basallamina bedeckt sind.
Die Spinalwurzeln durchqueren den von einer vielzelligen Wurzelscheide bedeckten Subarachnoidalraum und durchdringen die Dura im Subarachnoidalwinkel (Figure 14). Außerhalb des Subarachnoidalwinkels besitzen die Nervenwurzeln Epineurium, Perineurium und Endoneurium wie in den peripheren Nervenstämmen. Das Epineurium ist die Fortsetzung der spinalen Dura, während das Endoneurium distal der Verbindung der Wurzeln mit dem Zentralnervengewebe entwickelt wird. Perineurium umhüllt die Spinalganglien und liegt ihnen proximal. Es ist in die äußeren Schichten unterteilt, die zwischen der Dura und der Arachnoidea verlaufen, um das „durale Mesothel“ zu bilden. während sich die inneren Schichten des Perineuriums als „innere Schicht der Wurzelscheide“ über die Wurzeln fortsetzen.
Die Wurzelscheide besteht aus Zell- und Faserlamellen, die in zwei Schichten unterteilt sind. Die äußere Schicht besteht aus locker verbundenen Zellen, die an den Subarachnoidalraum grenzen. Wo die Wurzeln am Rückenmark anhaften, gehen die Zellen der äußeren Schicht der Wurzelscheide in die Pia über. Im Subarachnoidalwinkel wird die äußere Schicht zu den äußeren meningealen Investitionen des Rückenmarks reflektiert (Arachnoidea, die an der inneren Schicht der Spinaldura befestigt sind). Die innere Schicht der Wurzelscheide besteht aus abgeflachten Zellen, die eng miteinander verbunden sind, intermittierend mit einer Basallamina bedeckt sind und dem Perineurium ähneln, aber nicht als Perineuralzellen zu klassifizieren sind. Es wird peripher mit dem Perineurium kontinuierlich.
Der Subarachnoidalraum mündet in eine laterale Aussparung, die sich zwischen den ventralen und dorsalen Wurzeln erstreckt und eine darstellen kann Kommunikation zwischen Subarachnoidal- und Endoneuralraum. Diese Kommunikation ist klinisch relevant, weil sie bei Polyradikuloneuritiden eine Entzündungsausbreitung vom Subarachnoidalraum zum Endoneurium ermöglicht.
NYSORA-Tipps
- Die Injektion eines Lokalanästhetikums in die Epineurialmanschette während der Ausführung von interskalenären oder lumbalen Plexusblockaden kann zu einer Spinalanästhesie führen, da sich die Duramanschette über das Foramen intervertebrale hinaus erstreckt.
- Während der Durchführung einer Plexus-Lumbal-Blockade wird eine epidurale Ausbreitung des Lokalanästhetikums beobachtet, insbesondere wenn während des Injektionsvorgangs ein hoher Injektionsdruck (Kraft) angewendet wird.
Gefäßversorgung der peripheren Nerven
Der periphere Nerv ist eine gut vaskularisierte Struktur, versorgt durch Gefäße, die aus den nahe gelegenen großen Arterien und Venen sowie aus kleineren angrenzenden muskulären und periostalen Blutgefäßen stammen (Figure 12). Periphere Nerven haben zwei getrennte, funktionell unabhängige Gefäßsysteme: ein extrinsisches System (regionale Ernährungsgefäße und epineurale Gefäße) und ein intrinsisches System (Mikrogefäße im Endoneurium). Es gibt reiche Anastomosen zwischen den beiden Systemen, was zu einer beträchtlichen Überlappung zwischen den Territorien der Segmentarterien führt.
Das Epineurium ist durch ein überwiegend längsverlaufendes Gefäßgeflecht gekennzeichnet. Transperineurale Arteriolen mit einem Durchmesser von 10–25 µm verlaufen vom Epineurium zum Endoneurium durch Hüllen aus perineuralem Gewebe. Ihr Verlauf durch das Perineurium ist schräg, was sie möglicherweise anfällig für Änderungen des intra- oder extrafaszikulären Drucks macht. Epineuriale und perineurale Gefäße haben einen reichen perivaskulären Plexus von peptidergen, serotoninergen und adrenergen Nerven, die eine wichtige Rolle bei der neurogenen Kontrolle des endoneuralen Blutflusses spielen.
Das endoneurale Gefäßsystem ist bekannt für seine anatomischen Unterschiede zu einem herkömmlichen Kapillarbett, obwohl es physiologisch ähnlichen Stoffwechselfunktionen dient. Transperineurale Arteriolen verlieren allmählich ihre kontinuierliche Muskelhülle und werden zu postarteriolaren Kapillaren. Endoneurale Kapillaren haben untypischerweise einen größeren Durchmesser und interkapillare Abstände als die in vielen anderen Geweben. Eine solche Angioarchitektur deutet auf eine geringere Austauschkapazität hin. Endoneurale Arteriolen haben eine schlecht entwickelte glatte Muskelschicht und daher eine begrenzte Fähigkeit zur Autoregulation. Die Dichte der endoneuralen Mikrogefäße variiert signifikant über die peripheren Nerven hinweg; diese Schwankungen korrelieren mit der Anfälligkeit für ischämische Neuropathie. Dieses einzigartige Muster von Gefäßen verleiht zusammen mit dem hohen basalen Blutfluss relativ zu den metabolischen Anforderungen des Nervs einen hohen Grad an Widerstandsfähigkeit gegen Ischämie, so dass eine Nervendysfunktion während einer akuten Ischämie nicht auftritt, bis der Blutfluss nahezu Null ist. Die herausragende Eigenschaft des peripheren neurovaskulären Systems ist seine Flexibilität. Periphere Nerven können chirurgisch mobilisiert werden, wobei ihre Ernährungsgefäße ohne klinische Folgen in einem überraschenden Ausmaß durchtrennt werden. Die Verteilung der Zirkulation innerhalb des Endoneuriums ist jedoch äußerst empfindlich gegenüber physikalischer und chemischer Manipulation.
NYSORA-Tipps
- Periphere Nerven sind gegenüber Ischämie relativ resistent, da eine Nervenfunktionsstörung nur auftreten kann, wenn der Blutfluss nahezu Null ist.
- Lokalanästhetika haben die Fähigkeit, das Gefäßsystem zu verengen und den Blutfluss zu den Nerven zu verringern.
ALTERSBEZOGENE VERÄNDERUNGEN DER PERIPHEREN NERVEN
Ein intaktes gealtertes PNS ist durch mehrere umfangreiche strukturelle, funktionelle und biochemische Veränderungen gekennzeichnet, die sowohl in myelinisierten als auch in nichtmyelinisierten Fasern dokumentiert wurden. Bei älteren Menschen nimmt die myelinisierte Faserdichte ab. Ein regelmäßiger Zusammenhang zwischen Internodienlänge und Faserdurchmesser wird mit zunehmendem Alter ungenauer. Dies ist verbunden mit segmentaler Demyelinisierung und Remyelinisierung und der axonalen Degeneration und Regeneration, die sich klinisch als leichte periphere Neuropathie manifestiert.
Bei myelinisierten Fasern wurde über regressive Veränderungen berichtet, die dem Altern zugeschrieben werden. In myelinisierten Faserkomplexen alternder Nerven nimmt der Anteil axonfreier Schwann-Zellbänder zu (sog. Kollagentaschen; s Figure 9). Eine frühe altersbedingte Veränderung scheint die Ausknospung von Schwann-Zellfortsätzen in zahlreiche abgeflachte Zungen zu sein, die meist in Gruppen auftreten. Der Perineurialindex (Verhältnis Perineuriumdicke zu Faszikeldurchmesser) zeigt eine tendenziell steigende Tendenz mit zunehmendem Alter, höchstwahrscheinlich ein altersbedingter Verlust von Nervenfasern.
Das Altern ist mit einer verringerten Anzahl endoneuraler Kapillaren und einer Zunahme der Dicke der Kapillarwände und des Perineuriums verbunden. Die Rate der axonalen Regeneration wird langsamer, wenn die Dichte und Anzahl der regenerierenden Axone abnimmt. Das Altern beeinträchtigt auch das terminale Sprossen regenerierter Axone und das kollaterale Sprossen intakter benachbarter Axone, was die Reinnervation des Ziels und die funktionelle Wiederherstellung weiter einschränkt.
Die Ursache altersbedingter Veränderungen ist ungewiss. Ob sie das Ergebnis neuronaler Alterung mit distaler axonaler Degeneration und sekundärer Demyelinisierung oder lokaler Faktoren in den Nerven wie Ischämie oder Folgen wiederholter Bagatelltraumen sind, ist noch nicht geklärt. Dennoch resultieren altersbedingte Veränderungen peripherer Nerven wahrscheinlich aus der kumulativen, lebenslangen Wirkung verschiedener pathogener Faktoren, die durch genetische Determinanten modifiziert werden, und durch eine allmähliche Abnahme der Regenerationsfähigkeit.
NYSORA-Tipps
- Aufgrund der altersbedingten Nervendegeneration kann für die Nervenblockade weniger Lokalanästhetikum in geringerer Konzentration erforderlich sein.
- Altersbedingte Veränderungen des peripheren Nervs können für die typischerweise schlechteren sonographischen Bilder der peripheren Nerven bei älteren Menschen im Vergleich zu jüngeren Probanden verantwortlich sein.
REAKTION VON PERIPHEREN NERVEN AUF VERLETZUNG
Verletzungen der peripheren Nerven führen zum Verlust motorischer, sensorischer und autonomer Funktionen in den denervierten Körpersegmenten aufgrund der Unterbrechung von Axonen, Degeneration distaler Nervenfasern und schließlich zum Tod axotomisierter Neuronen. Funktionelle Defizite, die durch Nervenverletzungen verursacht werden, können durch Reinnervation denervierter Ziele durch Regeneration verletzter Axone oder durch kollaterale Verzweigung unbeschädigter Axone und Remodellierung von Schaltkreisen des Nervensystems im Zusammenhang mit den verlorenen Funktionen kompensiert werden. Eine Nervenregeneration ist möglich, wenn die Schnittenden nahe beieinander bleiben andernfalls ist die Regenerierung möglicherweise nicht vollständig oder erfolgreich.
Nach einer Verletzung versucht das Neuron, den Schaden zu reparieren, den Prozess zu regenerieren und die Funktion wiederherzustellen, indem es eine Reihe von strukturellen und metabolischen Ereignissen auslöst, die als Neuronen bezeichnet werden Axonreaktion. Die Reaktionen auf das Trauma sind in drei Regionen des Neurons lokalisiert: am Ort der Schädigung (lokale Veränderungen), distal des Ortes der Schädigung (anterograde Veränderungen) und proximal des Ortes der Schädigung (retrograde Veränderungen). Die lokale Reaktion auf eine Verletzung umfasst die Entfernung von Zelltrümmern durch Neurogliazellen. Der Teil des Axons distal einer Verletzung wird degeneriert und phagozytiert. Der proximale Teil des verletzten Axons erfährt eine Degeneration, gefolgt vom Sprießen eines neuen Axons, dessen Wachstum von Schwann-Zellen gesteuert wird.
NYSORA-Tipps
- Die elektrische Stimulationsschwelle für eine motorische Reaktion des Ischiasnervs ist bei Patienten mit diabetischer Fußbrand erhöht, was die Nervenerkennung beeinträchtigen kann.
- Viele Nervenverletzungen nach dem Eingriff treten in Nerven mit vorbestehender Pathologie auf.
ZUSAMMENFASSUNG
Das Wissen, dass die neurale Anatomie an verschiedenen anatomischen Stellen einzigartig ist, ist wesentlich für eine sichere und effektive Praxis der Regionalanästhesie. Das Verständnis der peripheren Nervenstruktur und ihrer Auswirkungen bei Verwendung modernster Monitore, einschließlich Ultraschall, Nervenstimulation und Überwachung des Injektionsdrucks, ist hilfreich, um das Risiko einer Verletzung des Patienten zu minimieren.
REFERENZEN
- Jessen KR, Mirsky R: Entstehung und Entwicklung von Gliazellen in peripheren Nerven. Nat. Rev. Neurosci 2005;6(9):671–682.
- Williams P: Greys Anatomy, 38. Aufl. Churchill Livingstone, 1995.
- Gartner L, Hiatt J: Farblehrbuch der Histologie, 2. Aufl. Saunders, 2001.
- Ross M, Pawlina W: Histology: A Text and Atlas With Correlated Cell and Molecular Biology, 6. Aufl. Wolters Kluwer Lippincott Williams & Wilkins, 2011.
- Thomas P, Berthold C, Ochoa J: Mikroskopische Anatomie des peripheren Nervensystems. In Dyck P., Thomas P. (Hrsg.): Periphere Neuropathie, 3. Aufl. Saunders, 1993, S. 28–91.
- Brushart T: Nervenreparatur. Oxford University Press, 2011.
- Palay SL, Sotelo C, Peters A, Orkand PM: Der Axonhügel und das Anfangssegment. J Cell Biol 1968;38(1):193–201.
- Poliak S, Peles E: Die lokale Differenzierung myelinisierter Axone an Knoten von Ranvier. Nat. Rev. Neurosci 2003;4(12):968–980.
- Colognato H, Baron W, Avellana-Adalid V, et al.: ZNS-Integrine schalten die Signalübertragung von Wachstumsfaktoren um, um das zielabhängige Überleben zu fördern. Nat Cell Biol 2002;4(11):833–841.
- PA Fernandez, DG Tang, L Cheng, A Prochiantz, AW Mudge, MC Raff Neuron 2000;28(1):81–90.
- de Waegh SM, Lee VM, Brady ST. Lokale Modulation der Neurofilament-Phosphorylierung, des axonalen Kalibers und des langsamen axonalen Transports durch myelinisierende Schwann-Zellen. Zelle 1992;68(3):451–463.
- Griffiths I, Klugmann M, Anderson T, et al: Axonale Schwellungen und Degeneration bei Mäusen, denen das Hauptproteolipid Myelin fehlt. Wissenschaft 1998;280(5369):1610–1613.
- Lappe-Siefke C, Goebbels S, Gravel M, et al: Disruption of Cnp1 entkoppelt oligodendrogliale Funktionen in axonaler Unterstützung und Myelinisierung. Nat Genet 2003;33(3):366–374.
- Nadim W, Anderson PN, Turmaine M: Die Rolle von Schwann-Zellen und Basallaminaröhren bei der Regeneration von Axonen durch lange Längen gefriergeschädigter Nerventransplantate. Neuropathol Appl Neurobiol 1990;16(5): 411–421.
- Noakes PG, Bennett MR: Dem Wachstum von Axonen in sich entwickelnde Muskeln des Hühnervorderbeins gehen Zellen voraus, die mit Schwann-Zell-Antikörpern gefärbt werden. J Comp Neurol 1987;259(3):330–347.
- Court FA, Wrabetz L, Feltri ML: Basallamina: Schwannsche Zellen wickeln sich im Rhythmus der Raumzeit. Curr Opin Neurobiol 2006;16(5):501–507.
- Darby S, Frysztak R: Neuroanatomie des Rückenmarks. In Cramer GD, Darby S (Hrsg.): Basic and Clinical Anatomy of the Spine, Spinal Cord, and ANS, 2nd ed. Elsevier Mosby, 2005, S. 339–410.
- Morell P, Quarles R: Molekulare Architektur von Myelin. In Siegel G, Agranoff B, Albers R (Hrsg.): Basic Neurochemistry: Molecular, Cellular and Medical Aspects, 6. Aufl. Lippincott-Raven, 1999, S. 51–71.
- Ritchie JM, Rogart RB: Dichte von Natriumkanälen in myelinisierten Nervenfasern von Säugetieren und Beschaffenheit der Axonmembran unter der Myelinscheide. Proc Natl Acad Sci USA 1977;74(1):211–215.
- Wang H, Kunkel DD, Martin TM, Schwartzkroin PA, Tempel BL: Heteromultimere K+-Kanäle in terminalen und juxtaparanodalen Regionen von Neuronen. Nature 1993;365(6441):75–79.
- Thaxton C, Pillai AM, Pribisko AL, Dupree JL, Bhat MA: Knoten von Ranvier wirken als Barrieren, um die Invasion flankierender paranodaler Domänen in myelinisierten Axonen einzuschränken. Neuron 2011;69(2):244–257.
- Waxman SG, Ritchie JM: Molekulare Dissektion des myelinisierten Axons. Ann Neurol 1993;33(2):121–136.
- Ochoa J, Mair WG: Der normale Suralnerv beim Menschen. I. Ultrastruktur und Zahl der Fasern und Zellen. Acta Neuropathol 1969;13(3):197–216.
- Millesi H, Terzis J: Nomenklatur in der peripheren Nervenchirurgie. In Terzis J (Hrsg.): Mikrorekonstruktion von Nervenverletzungen. Saunders, 1987, S. 3–13.
- Sala-Blanch X, Vandepitte C, Laur JJ, et al: Ein praktischer Überblick über perineurale versus intraneurale Injektionen: Ein Aufruf zur Standardnomenklatur. Int Anesthesiol Clin 2011;49(4):1–12.
- Sunderland S, Bradley KC: Das Perineurium der peripheren Nerven. Anat Rec 1952;113(2):125–141.
- Sunderland S: Das Bindegewebe der peripheren Nerven. Gehirn 1965;88(4):841–854.
- Ushiki T, Ide C: Dreidimensionale Organisation der Kollagenfibrillen im Ischiasnerv der Ratte, wie durch Transmissions- und Rasterelektronenmikroskopie gezeigt. Cell Tissue Res 1990;260(1):175–184.
- Thomas PK. Das Bindegewebe des peripheren Nervs: eine elektronenmikroskopische Untersuchung. J Anat 1963;97:35–44.
- Thomas PK, Bhagat S: Die Wirkung der Extraktion des intrafaszikulären Inhalts peripherer Nervenstämme auf die perineurale Struktur. Acta Neuropathol 1978;43(1–2):135–141.
- Lorimier P, Mezin P, Labat Moleur F, Pinel N, Peyrol S, Stoebner P: Ultrastrukturelle Lokalisierung der Hauptkomponenten der extrazellulären Matrix im normalen Rattennerv. J Histochem Cytochem 1992;40(6):859–868.
- Reina MA, Lopez A, De Andres JA: [Fettgewebe in peripheren Nerven. Untersuchung des menschlichen Ischiasnervs. Rev. Esp Anestesiol Reanim 2002;49(8):397–402.
- Mirsky R, Parmantier E, McMahon AP, Jessen KR: Schwann-Zell-abgeleiteter Wüstenigel signalisiert Nervenscheidenbildung. Ann NY Acad Sci 1999;883:196–202.
- Shanthaveerappa TR, Bourne GH: Perineurales Epithel: Ein neues Konzept seiner Rolle bei der Integrität des peripheren Nervensystems. Wissenschaft 1966;154(3755):1464–1467.
- Lehmann HJ: [Aufbau und Funktion der perineuralen Diffusionsbarriere]. Z Zellforsch Mikrosk Anat 1957;46(2):232–241.
- Eldridge CF, Sanes JR, Chiu AY, Bunge RP, Cornbrooks CJ: Basallamina-assoziiertes Heparansulfat-Proteoglykan im Ratten-PNS: Charakterisierung und Lokalisierung mit monoklonalen Antikörpern. J Neurocytol 1986;15(1):37–51.
- Paetau A, Mellstrom K, Vaheri A, Haltia M: Verteilung eines wichtigen Bindegewebsproteins, Fibronektin, in normalem und neoplastischem menschlichem Nervengewebe. Acta Neuropathol 1980;51(1):47–51.
- Stopar-Pintaric T, Cvetko E, Strbec M, et al: Intraneurale und perineurale entzündliche Veränderungen bei Ferkeln nach Injektion von Ultraschallgel, Endotoxin, 0.9 % NaCl oder Nadeleinstich ohne Injektion. Anaesth Analg 2014;115:1–6.
- Rydevik BL, Kwan MK, Myers RR, et al: Eine mechanische und histologische In-vitro-Studie zur akuten Dehnung des Schienbeinnervs von Kaninchen. J. Orthop Res. 1990;8(5):694–701.
- Olsson Y: Mikroumgebung des peripheren Nervensystems unter normalen und pathologischen Bedingungen. Crit Rev Neurobiol 1990;5(3): 265–311.
- Jacobs JM, Love S: Qualitative und quantitative Morphologie des menschlichen Suralnervs in verschiedenen Altersstufen. Brain 1985;108(Teil 4):897–924.
- Powell HC, Myers RR, Costello ML, Lampert PW: Endoneuraler Flüssigkeitsdruck bei wallerischer Degeneration. Ann Neurol 1979;5(6):550–557.
- Glücksspiel HJ, Eames RA. Eine elektronenmikroskopische Untersuchung des Bindegewebes des menschlichen peripheren Nervs. J Anat 1964;98:655–663.
- Salonen V, Roytta M, Peltonen J: Die Auswirkungen der Nervendurchtrennung auf die endoneuralen Kollagenfibrillenhüllen. Acta Neuropathol 1987;74(1):13–21.
- 45. Oldfors A: Makrophagen in peripheren Nerven. Eine ultrastrukturelle und enzymhistochemische Studie an Ratten. Acta Neuropathol 1980;49(1): 43–49.
- 46. Braunewell KH, Martini R, LeBaron R, et al: Hochregulierung eines Chondroitinsulfat-Epitops während der Regeneration des Ischiasnervs der Maus: Nachweis, dass die immunreaktiven Moleküle mit den Chondroitinsulfat-Proteoglykanen Decorin und Versican verwandt sind. Eur. J. Neurosci 1995;7(4): 792–804.
- Kapur E, Vuckovic I, Dilberovic F, et al: Neurologisches und histologisches Ergebnis nach intraneuraler Injektion von Lidocain in Ischiasnerven des Hundes. Acta Anaesthesiol Scand 2007;51(1):101–107.
- Jeng CL, Rosenblatt MA: Intraneurale Injektionen und Regionalanästhesie: Das Bekannte und das Unbekannte. Minerva Anestesiol 2011;77(1):54–58.
- Orebaugh SL, Mukalel JJ, Krediet AC, et al: Brachialplexus-Wurzelinjektion in einem menschlichen Leichenmodell: Injektionsverteilung und Auswirkungen auf die Neuraxis. Reg Anesth Pain Med 2012;37(5):525–529.
- Moayeri N, Bigeleisen PE, Groen GJ: Quantitative Architektur des Plexus brachialis und der umgebenden Kompartimente und ihre mögliche Bedeutung für Plexusblöcke. Anesthesiology 2008;108(2):299–304.
- Sala Blanch X, Lopez AM, Carazo J, et al: Intraneurale Injektion während einer Nervenstimulator-geführten Ischiasnervblockade an der Kniekehle. Br. J. Anaesth 2009;102(6):855–861.
- Berthold CH, Carlstedt T. Beobachtungen zur Morphologie am Übergang zwischen peripherem und zentralem Nervensystem bei der Katze. III. Myelinisierte Fasern in S1-Dorsalwurzeln. Acta Physiol Scand Suppl 1977;446:43–60.
- Andres KH: [Die Feinstruktur der Riechregion makrosmatischer Tiere]. Z Zellforsch Mikrosk Anat 1966;69:140–154.
- Haller FR, Low FN: Die Feinstruktur der peripheren Nervenwurzelscheide im Subarachnoidalraum bei der Ratte und anderen Versuchstieren. Am J Anat 1971;131(1):11–19.
- Himango WA, Low FN: Die Feinstruktur einer lateralen Aussparung des Subarachnoidalraums bei der Ratte. Anat Rec 1971;171(1):1–19.
- McCabe JS, Low FN: Der Subarachnoidalwinkel: ein Übergangsbereich im peripheren Nerv. Anat Rec 1969;164(1):15–33.
- Waggener JD, Beggs J: Die Membranhüllen von Nervengewebe: Eine elektronenmikroskopische Studie. J Neuropathol Exp Neurol 1967;26(3): 412–426.
- Pease DC, Schultz RL: Elektronenmikroskopie von Rattenhirnhäuten. Am J Anat 1958;102(2):301–321.
- Nabeshima S, Reese TS, Landis DM, Brightman MW: Verbindungen in den Meningen und marginalen Glia. J Comp Neurol 1975;164(2):127–169.
- Evans PJ, Lloyd JW, Wood GJ: Versehentliche intrathekale Injektion von Bupivacain und Dextran. Anästhesie 1981;36(7):685–687.
- Gadsden JC, Lindenmuth DM, Hadzic A, Xu D, Somasundarum L, Flisinski KA: Lumbaler Plexusblock mit Hochdruckinjektion führt zu einer kontralateralen und epiduralen Ausbreitung. Anesthesiology 2008;109(4):683–688.
- Lundborg G. Intraneurale Mikrozirkulation. Orthop Clin North Am 1988;19(1):1–12.
- McManis PG, Schmelzer JD, Zollman PJ, Low PA: Blutfluss und Autoregulation in somatischen und autonomen Ganglien. Vergleich mit Ischiasnerv. Brain 1997;120(Teil 3):445–449.
- Beggs J, Johnson PC, Olafsen A, Watkins CJ, Cleary C: Transperineurale Arteriolen im menschlichen Suralnerv. J Neuropathol Exp Neurol 1991;50(6): 704–718.
- Bell MA, Weddell AG: Eine morphometrische Untersuchung von intrafaszikulären Gefäßen des Ischiasnervs von Säugetieren. Muskelnerv 1984;7(7):524–534.
- Smith DR, Kobrine AI, Rizzoli HV: Blutfluss in peripheren Nerven. Normale Durchflussraten und Durchflussraten nach der Trennung. J Neurol Sci 1977;33(3): 341–346.
- Kozu H, Tamura E, Parry GJ: Die endoneurale Blutversorgung der peripheren Nerven ist nicht einheitlich. J Neurol Sci 1992;111(2):204–208.
- Perez-Castro R, Patel S, Garavito-Aguilar ZV, et al: Zytotoxizität von Lokalanästhetika in menschlichen neuronalen Zellen. Anesth Analg 2009;108(3):997–1007.
- Drac H, Babiuch M, Wisniewska W: Morphologische und biochemische Veränderungen in peripheren Nerven mit dem Alter. Neuropatol Pol 1991;29(1–2–): 49–67.
- Lehmann J: Altersbedingte Veränderungen peripherer Nerven. Zentralbl Allg Pathol 1986;131(3):219–227.
- Arnold N., Harriman DG: Das Auftreten von Anomalien in peripheren Kontrollnerven des Menschen, untersucht durch Einzelaxondissektion. J Neurol Neurosurg Psychiatry 1970;33(1):55–61.
- Tohgi H, Tsukagoshi H, Toyokura Y: Quantitative Veränderungen mit dem Alter in normalen Suralnerven. Acta Neuropathol 1977;38(3):213–220.
- Vizoso AD: Die Beziehung zwischen der Länge der Internodien und dem Wachstum menschlicher Nerven. J Anat 1950;84(4):342–353.
- Ochoa J, Mair WG: Der normale Suralnerv beim Menschen. II. Alterungsbedingte Veränderungen der Axone und Schwann-Zellen. Acta Neuropathol 1969;13(3): 217–239.
- Ochoa J: Erkennung einer unmyelinisierten Fasererkrankung: morphologische Kriterien. Muskelnerv 1978;1(5):375–387.
- Kovacic U, Sketelj J, Bajrovic FF: Kapitel 26: Altersbedingte Unterschiede in der Reinnervation nach peripherer Nervenverletzung. Int Rev Neurobiol 2009;87:465–482.
- Li X, Karmakar MK, Lee A, Kwok WH, Critchley LA, Gin T: Quantitative Evaluation of the Echo Intensity of the Medianus Nerv and Flexor Muscles of the Forearm in the Young and Old. Br J Radiol 2012;85(1014):e140–e145.
- Navarro X, Vivo M, Valero-Cabre A: Neurale Plastizität nach Verletzung und Regeneration peripherer Nerven. Prog Neurobiol 2007;82(4):163–201.
- Keyl C, Held T, Albiez G, Schmack A, Wiesenack C: Erhöhte elektrische Nervenstimulationsschwelle des Ischiasnervs bei Patienten mit diabetischer Fußgangrän: Eine prospektive parallele Kohortenstudie. Eur J Anaesthesiol 2013;30(7):435–440.
- Borgeat A, Ekatodramis G, Kalberer F, Benz C: Akute und nicht akute Komplikationen im Zusammenhang mit interskalenären Blockaden und Schulteroperationen: Eine prospektive Studie. Anesthesiology 2001;95(4):875–880.