1. HISTOLOGISCHE ÜBERLEGUNGEN
Aus histologischer Sicht sind Nerven runde oder abgeflachte Stränge mit einer komplexen inneren Struktur aus myelinisierten und nicht myelinisierten Nervenfasern, die Axone und Schwann-Zellen enthalten, die in Bündeln gruppiert sind (Abb. 1a) (Erickson 1997). Entlang des Nervs können Fasern von einem Faszikel zum anderen verlaufen und Faszikel können sich teilen und verschmelzen. Basierend auf der faszikulären Anordnung wurden zwei Theorien aufgestellt, um die innere Architektur eines Nervs zu erklären: das „Kabel“- und das „plexiforme“ Modell (Stewart 2003). Die erste besagt, dass Nerven kabelartige Strukturen sind, in denen Faszikel getrennt über die gesamte Nervenlänge verlaufen (Abb. 1b). Die zweite behauptet, dass sich Faszikel im Verlauf des Nervenstamms abwechselnd teilen, verzweigen und wieder zusammenfügen (Abb. 1c). Tatsächlich haben Nerven je nach Untersuchungsebene sowohl eine kabel- als auch eine plexiforme Anordnung der Faszikel. In ihrem proximaleren Anteil (z. B. Plexus brachialis) überwiegt eine plexiforme Organisation der Faszikel. Weiter distal (z. B. N. medianus) stellen Nerven eine kabelartige Struktur mit einem hohen Grad an somatischer Organisation dar (z. B. sensorische und motorische Fasern für einen bestimmten Bereich der Haut oder des Muskels, die in demselben Faszikel enthalten sind) (Stewart 2003). Das Nervengewebe ist in eine Reihe von Bindegewebsschichten eingebettet.
Ein genauerer Blick auf die Nervenhüllen zeigt eine äußere Hülle – das äußere Epineurium – die die Nervenbündel umgibt. Jeder Faszikel ist wiederum von einer eigentlichen Bindehaut – dem Perineurium – umgeben, die eine unterschiedliche Anzahl von Nervenfasern umschließt und für die „Blut-Nerv“-Schranke verantwortlich ist. Anschließend werden die einzelnen Nervenfasern vom Endoneurium umhüllt. Das Bindegewebe zwischen der äußeren Nervenscheide und den Faszikeln wird allgemein als interfaszikuläres Epineurium (inneres Epineurium) bezeichnet, im Gegensatz zum äußeren Epineurium, das den gesamten Nervenstamm umgibt. Generell ist die Menge an Bindegewebe des Epineuriums in großen multifaszikulären Nerven und in Regionen, in denen der Nerv über Gelenke beweglich ist, reichlicher (Delfiner 1996). Diese Verdickung des Bindegewebes scheint den Nerv stärker zu dämpfen und somit widerstandsfähiger gegen Kompressionsverletzungen zu sein (Delfiner 1996). Äußerlich geht das äußere (äußere) Epineurium in das Mesoneurium über, das aus lockerem Areolargewebe besteht. Dieser letztgenannten Struktur wird zugeschrieben, dass sie nicht nur das Gerüst für die in den Nerv eintretende Blutversorgung bereitstellt, sondern auch die Exkursion des Nervs in seinem Bett ohne Zug auf seine Blutversorgung während der Gelenkbewegung erleichtert (George und Smith 1996).
Nerven haben eine herausragende Gefäßversorgung, um ihre kontinuierliche Versorgung mit lokaler Energie sicherzustellen, die für die Impulsübertragung und den axonalen Transport erforderlich ist. Die Gefäßversorgung wird durch ein miteinander verbundenes System von perineuralen Gefäßen gebildet, die im äußeren Epineurium längsverlaufen und sich zwischen den Faszikeln (endoneurale Gefäße) verzweigen.
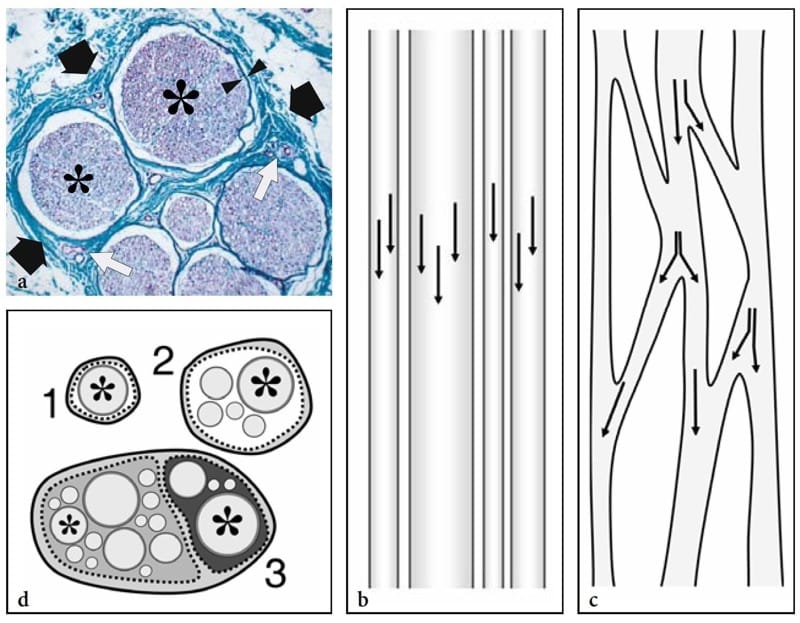
Abbildung 1. a–d. Histologie der Nerven. a Histologische Querschnittsansicht des menschlichen Suralnervs (schwarze Pfeile) zeigt einige Nervenbündel (Sternchen) unterschiedlicher Größe, die Nervengewebe (violett) mit Ansammlungen von Axonen, Myelinscheiden und Schwann-Zellen enthalten. Einzelne Faszikel sind von einer dünnen Hülle – dem Perineurium (Pfeilspitzen) – umgeben und durch eine lockere bindegewebige Hülle – das Epineurium (grün) – mit kleinen intraneuralen Gefäßen (weiße Pfeile) voneinander getrennt. Probe gefärbt nach dem van-Gieson-Verfahren (ursprüngliche Vergrößerung ×150). b,c Schematische Darstellungen einer Längsachsenansicht durch den Nervenstamm veranschaulichen die Modelle der faszikulären Organisation. Pfeile zeigen den axonalen Pfad an. b Beim „Kabelmodell“ verlaufen die Faszikel parallel zur Nervenachse ohne Axonaustausch. c Im „plexiformen Modell“ teilen sich Faszikel und fügen sich in verschiedenen Kombinationen wieder zusammen, wobei sich Axone von einem zum anderen vermischen. d Schematische Darstellung einer Querschnittsansicht der monofaszikulären (1), oligofaszikulären (2) und polyfaszikulären (3) Nervenmodelle. Bei komplexen motorischen und sensorischen Nerven (3) sind Faszikel (Sternchen) unterschiedlich groß und können in funktionsbezogenen Bereichen innerhalb des Nervs gruppiert sein. Diese Zeichnung (3) erinnert an den Aufbau des Ischiasnervs, bei dem die Nervenfasern für den N. tibialis (hellgrau) und für den N. peroneus (dunkelgrau) im Verlauf des Nervs auch proximal eng gruppiert bleiben.
2. NORMALE US-ANATOMIE UND SCANTECHNIK
Dank der neuesten Generation von hochfrequenten „Kleinteile“-Schallköpfen und der Compound-Technologie hat sich die US zu einer gut akzeptierten und weit verbreiteten bildgebenden Modalität zur Beurteilung peripherer Nerven entwickelt. Die verbesserte Leistung dieser Wandler hat es ermöglicht, subtile anatomische Details zu erkennen, die mindestens gleich oder sogar kleiner sind als die, die mit der Oberflächenspulen-MR-Bildgebung dargestellt werden, und ein breites Spektrum an pathologischen Zuständen darzustellen, die Nerven betreffen (Martinoli et al. 1999; Keberle et al., 2000; Beekman und Visser, 2004). Abgesehen von der Verfügbarkeit von High-End-Technologie erfordert der Nerven-US eine sorgfältige Kenntnis anatomischer Details und eine enge Korrelation der Bildgebungsbefunde mit der Krankengeschichte des Patienten und den Ergebnissen elektrophysiologischer Studien. Mit diesen Referenzen bietet US kostengünstige und nicht-invasive Bildgebung, Leistungsgeschwindigkeit und wichtige Vorteile gegenüber der MR-Bildgebung, einschließlich einer höheren räumlichen Auflösung und der Möglichkeit, lange Segmente von Nervenstämmen in einer einzigen Studie zu untersuchen und Nerven sowohl statisch zu untersuchen und dynamische Zustände mit Echtzeit-Scanning.
Das US-Erscheinungsbild normaler Nerven ist ziemlich einheitlich und spiegelt ihre histologische Zusammensetzung genau wider (Abb.. 2) (Silvestri et al. 1995). Auf Kurzachsenebenen zeigt der US Nerven als wabenartige Strukturen, die aus echoarmen Flecken bestehen, die in einen echoreichen Hintergrund eingebettet sind, in dem die echoarmen Strukturen den Faszikeln entsprechen, die längs innerhalb des Nervs verlaufen, und der echoreiche Hintergrund sich auf das interfaszikuläre Epineurium bezieht (Feigen. 2a, 3a) (Silvestri et al. 1995). Dieses Muster ähnelt etwas dem Abschnitt eines Elektrokabels. Auf Längsachsenebenen nehmen Nerven typischerweise ein längliches Aussehen mit mehreren echoarmen parallelen linearen Bereichen an, die den neuronalen Faszikeln entsprechen, die in Längsrichtung innerhalb des Nervs verlaufen und durch echoreiche Bänder getrennt sind (Abb. 3b) (Silvestri et al. 1995). Bei einem einzelnen Nerv können die Größe und Anzahl der Faszikel in Abhängigkeit von der Entfernung von der Ursprungsstelle, dem Druck, dem der Nerv ausgesetzt ist, und dem Auftreten von Nervenverzweigungen variieren. Bei Nervenbifurkationen beispielsweise teilt sich der Nervenstamm in zwei oder mehr sekundäre Nervenbündel, während Faszikel nur in einen der Teilungsäste eintreten, ohne sich zu teilen. Die äußeren Grenzen der Nerven sind normalerweise undefiniert, da sie ein ähnliches echoreiches Aussehen wie ihre Verbindungshüllen haben, einschließlich des äußeren Epineuriums, des Mesoneuriums und der umgebenden lockeren Verbindungsräume, die alle Fett enthalten.
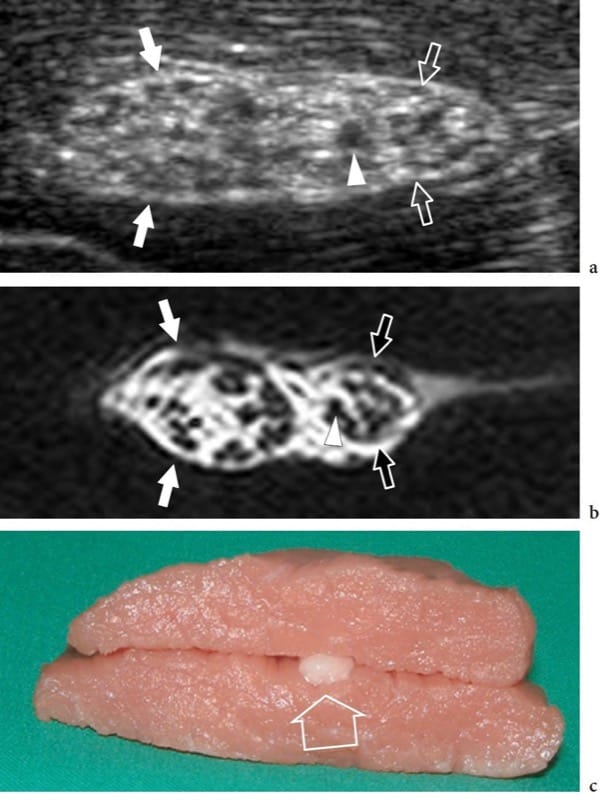
Abbildung 2. a–c. Anatomie der Nerven. In vitro zeigt eine kurzachsige 12–5-MHz-US-Aufnahme des bovinen Ischiasnervs (Pfeile) mit b-korrelativer T1-gewichteter MRT-Bildgebung eine wabenförmige Nervenechotextur, die aus kleinen abgerundeten echoarmen Bereichen (Pfeilspitze), den Faszikeln, besteht, die eingebettet sind bei echoreichem Hintergrund das Epineurium. Beachten Sie die eindeutige Gruppierung von Faszikeln innerhalb des Ischiasnervs für die Schienbeinnerven (weiße Pfeile) und die Peronaeusnerven (offene Pfeile). c Das In-vitro-Modell wurde durch Einbau des Nervs (offener Pfeil) in Muskelgewebe hergestellt.
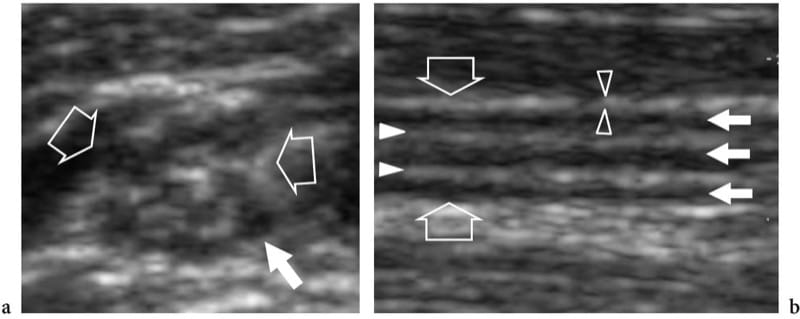
Abbildung 3. a,b. Normale Nervenechotextur. a Kurzachsen- und b Langachsen-US-Bilder mit 15–7 MHz über dem Nervus medianus (offene Pfeile) in der Mitte des Unterarms. In a sind die Nervenbündel (weißer Pfeil) als gut umschriebene Einzelstrukturen unterschiedlicher Größe dargestellt, die durch ein echoreiches Epineurium getrennt sind. In diesem Segment werden im Querschnittsbereich des N. medianus 11 Faszikel unterschieden. In b erscheinen die Nervenfaszikel als längliche echoarme Bänder (weiße Pfeile), die parallel zueinander verlaufen. Das innere Epineurium (weiße Pfeilspitzen) trennt sie deutlicher, während das äußere Epineurium (offene Pfeilspitzen) hilft, die äußeren Grenzen des Nervs zu definieren.
Farb- und Power-Doppler-Systeme sind im Normalzustand meist nicht in der Lage, die schwachen und kleinen Blutflusssignale aus dem perineuralen Plexus und den intraneuralen Ästen zu erkennen. Im Allgemeinen sind Nerven komprimierbar und ändern ihre Form in Abhängigkeit vom Volumen der anatomischen Räume, in denen sie verlaufen, sowie von der Masse und Konformation der perineuralen Strukturen (Abb. 4a, b). Selbst bei leichtem Druck, der mit der Sonde ausgeübt wird, können sie gesehen werden, wie sie über die Oberfläche einer Arterie oder eines Muskels gleiten. In der Regel verläuft jeder einzelne Faszikel eines Nervs unabhängig von den anderen. Über Synovialgelenke passieren sie enge anatomische Gänge – die osteofibrösen Tunnel, die ihren Verlauf umlenken. Der Boden dieser Tunnel besteht aus Knochen, während das Dach aus fokalen Verdickungen der Faszien – der Retinacula – besteht, die eine Dislokation und traumatische Beschädigung der im Tunnel enthaltenen Strukturen während der Gelenkaktivität verhindern (Martinoli et al. 2000b). Wenn Nerven enge Passagen wie Neuralforamina und osteofibröse Tunnel durchqueren, können subtile echotexturale Veränderungen mit einem homogeneren echoarmen Erscheinungsbild gesehen werden, das durch eine engere Packung der Faszikel und eine lokale Verringerung des Volumens des Epineuriums verursacht wird (Sheppard et al. 1998) .
Eine sorgfältige Scantechnik, die auf der genauen Kenntnis ihrer Position und der Analyse ihrer anatomischen Beziehungen zu umgebenden Strukturen basiert, ist für die Erkennung peripherer Nerven mit US unerlässlich. Anders als andere Strukturen des Bewegungsapparates zeigen Nerven keine anisotropen Eigenschaften. Daher ist eine geeignete Sondenausrichtung während des Scannens nicht erforderlich, um sie abzubilden; jedoch wird systematisches Scannen in der Kurzachsenebene bevorzugt, um den Nerven zusammenhängend durch die Gliedmaßen zu folgen (Martinoli et al. 1999). Längsachsen-Scans sind für diesen Zweck weniger effektiv, da die länglichen Faszikel leicht mit Echos von Muskeln und Sehnen verwechselt werden können, die entlang derselben Ebene verlaufen. Nach der Erkennung wird der Nerv in seiner kurzen Achse in der Mitte des US-Bildes gehalten und dann proximal und distal verfolgt, wobei der Schallkopf entsprechend dem Verlauf des Nervs nach oben oder unten verschoben wird. Mit dieser Technik, die wir „Lift-Technik“ nennen, ist der Untersucher in der Lage, in wenigen Sekunden lange Nervenabschnitte in den Gliedmaßen und Extremitäten zu erkunden (Abb. 4c). Wenn während des Scannens auf intrinsische oder extrinsische Nervenanomalien gestoßen wird, wird die US-Untersuchung dann unter Verwendung von schrägen und longitudinalen US-Scanebenen angemessen auf die interessierende Region fokussiert. Obwohl alle Hauptnerven aufgrund ihrer oberflächlichen Lage und des fehlenden Knochens in den Extremitäten gut dargestellt werden können, ist die Darstellung des peripheren Nervensystems im US nicht überall möglich. Tatsächlich die meisten Hirnnerven – mit Ausnahme des Vagus – und der N. accessorius der Wirbelsäule (Giovagnorio und Martinoli, 2001; Bodner et al. 2002a), die Nervenwurzeln, die die dorsale, lumbale und sakrale Wirbelsäule verlassen, die sympathischen Ketten und der Splanchnikus Nerven im Abdomen sind aufgrund ihres zu tiefen Verlaufs oder der Zwischenlage knöcherner Strukturen nicht darstellbar. Darüber hinaus beeinflussen die perineuralen Strukturen die Nervendetektion in den Gliedmaßen und Extremitäten stark. Wenn die Nerven tief verlaufen, wie bei übergewichtigen Patienten, kann ihre Beurteilung schwierig sein. In der Regel verlaufen die Nerven der unteren Extremität tiefer als die der oberen Extremität und sind schwieriger einsehbar. Nerven, die zwischen echoarmen Muskeln verlaufen, werden leichter erkannt als solche, die von echoreichem Fett umgeben sind. In ähnlicher Weise wird ein Nerv eines jungen körperlich aktiven Probanden besser dargestellt als derselbe Nerv, der bei einem Probanden mit atrophischen Muskeln untersucht wird.
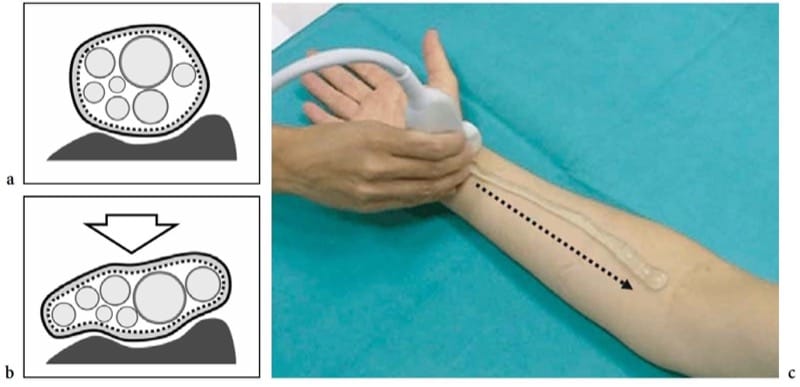
Abbildung 4. a–c. Reaktion auf Kompressions- und Nervenscantechnik. a,b Schematische Darstellungen der Querschnittsansicht eines Nervs, der über einer steifen Oberfläche (Knochen) liegt, a in Ruhe und b während externer Kompression (Pfeil). Aufgrund der Flexibilität der Epineurialscheide flacht der Nerv ab, während sich die Faszikel – die nicht komprimierbare Strukturen sind – entsprechend den Veränderungen der Nervenform neu verteilen. c Foto zeigt die Standardtechnik zur Untersuchung von Nerven in den Gliedmaßen. Die kurze Achse des N. medianus am Handgelenk ist im Sichtfeld des US-Bildes zentriert. Dann wird der Schallkopf entlang des Nervenverlaufs im Unterarm nach oben geschwenkt (gestrichelter Pfeil). Diese Technik, die wir „Lift-Technik“ nennen können, ermöglicht eine einfache und zuverlässige Beurteilung langer Nervensegmente in einem einzigen Durchlauf, wobei mögliche intrinsische und extrinsische Anomalien entlang des Nervenpfads ausgeschlossen werden. Die Fähigkeit des US, den gesamten Nervenverlauf in den Gliedmaßen so schnell zu verfolgen, ist ein großer Vorteil gegenüber der MR-Bildgebung.
3. ANATOMISCHE VARIANTEN, VERERBTE UND ENTWICKLUNGSANORMALIEN
Aufgrund des charakteristischen US-Erscheinungsbildes normaler Nerven können mit dieser Technik einige anatomische Varianten erkannt werden. Unter diesen wurde die proximale Bifurkation des N. medianus am Handgelenk ausführlich in der Literatur beschrieben (Propeck et al. 2000; Iannicelli et al. 2000; Gassner et al. 2002). Ebenso einige erbliche und entwicklungsbedingte Anomalien des peripheren Nervensystems, wie die spindelförmige Vergrößerung des N. medianus durch fibröses Fettgewebe (sog. fibrolipomatöses Hamartom), die Hypertrophie von Nerven beim Charcot-Marie-Tooth-Syndrom (Martinoli et al. 2002 ) und die fokale Vergrößerung von Nerven bei hereditärer Neuropathie mit Anfälligkeit für Drucklähmungen (Beekman und Visser 2002) können mit dem US erkannt werden. Bei diesen Störungen können US-Befunde zum Verständnis der Pathophysiologie beitragen, indem sie einige wichtige morphologische Informationen nichtinvasiv aufdecken. Es sind jedoch weitere Arbeiten erforderlich, um den Einfluss und die Zuverlässigkeit der USA in diesem Bereich vollständig zu analysieren.
4. Fibrolipomatöses Hamartom
Fibrolipomatöses Hamartom ist eine entwicklungsbedingte, tumorähnliche Nervenstörung, die mit der Hypertrophie von reifem Fett und Fibroblasten im Epineurium zusammenhängt, die häufig in der frühen Kindheit auftritt. Dieser Zustand, der auch als neurales Fibrolipom, perineurales Lipom, Fettinfiltration des Nervs, Lipofibrom oder neurales Lipom bezeichnet wird, hat eine deutliche Vorliebe für den Nervus medianus und seine Äste mit Beteiligung der unteren Extremität (Plantarnerv, Ischiasnerv) als selten gemeldet (Marom und Helms 1999; Wong et al. 2006). Fibrolipomatöses Hamartom kann mit lokalem Gigantismus einer Extremität verbunden sein, normalerweise der Hand oder des Fußes, im Zusammenhang mit knöchernem Überwuchern, Fettproliferation in den Weichteilen und Nerventerritorium-orientierter Makrodaktylie, die charakteristisch für die als Makrodystrophia lipomatosa bekannte Erkrankung ist (Amadio et al 1988; Murphey et al. 1999). Das US-Erscheinungsbild des fibrolipomatösen Hamartoms ist pathognomonisch für diese Entität und spiegelt die Morphologie der Läsion wider. US zeigt eine auffällige fusiforme Vergrößerung des N. medianus am distalen Unterarm durch die Handfläche, gekennzeichnet durch eine erhöhte Masse echoreichen Fettgewebes im Epineurium, das normal erscheinende Faszikel umgibt und zwischen ihnen liegt (Feige. 5a–d) (Murphey et al. 1999; Chen et al. 1996). Auf der Ebene des Karpaltunnels kann der betroffene Nervus medianus früher als andere Nerven symptomatisch werden, da er vom Retinaculum flexorus eingenommen wird. In diesen Fällen weist der Nachweis von Nervenfaszikeln, die innerhalb der Fettmasse fokal geschwollen erscheinen, auf eine Kompression und die Notwendigkeit einer Freigabe des Karpaltunnels hin (Abb. 5e–g). Das Debulking der Masse kann das intraneurale Gefäßsystem beeinträchtigen und katastrophale motorische und sensorische Defizite oder eine intensive Heilungsreaktion verursachen, die die Funktion weiter gefährden kann (Marom und Helms 1999).
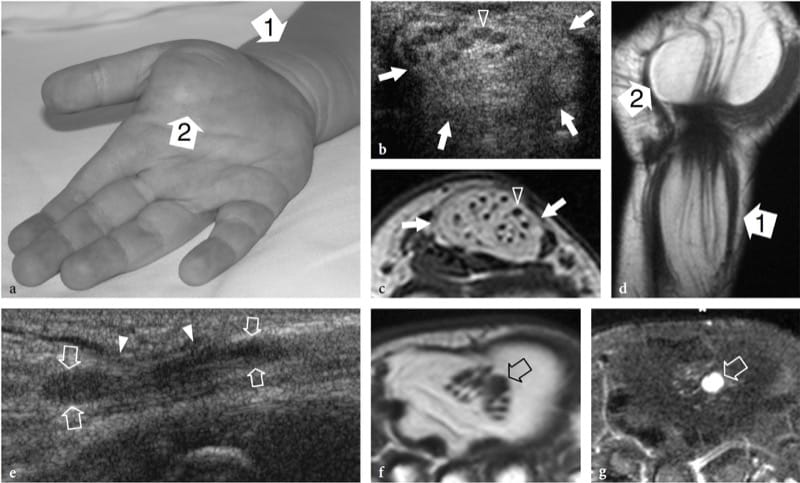
Abbildung 5. a–g. Fibrolipomatöses Hamartom. a Foto der rechten Hand eines 3-jährigen Kindes mit leichten Symptomen einer medianen Neuropathie und einer diffusen Weichteilschwellung und -empfindlichkeit, die sich vom distalen Radius (1) bis zum radialen Aspekt der Handfläche (2) erstreckt. b Transversales 12–5-MHz-US-Bild, das proximal zum Karpaltunnel aufgenommen wurde, mit korrelierenden c transversalen und d koronalen T1-gewichteten MRT-Bildern zeigt eine abnormale fusiforme Vergrößerung des N. medianus (Pfeile). Der Nerv zeigt normal erscheinende Faszikel (Pfeilspitze), die mit echoreichem Fett im Epineurium durchsetzt sind. Es besteht eine enge Korrelation zwischen den US- und MR-Bildgebungsbefunden. In der koronalen Ebene zeigt die MR-Bildgebung ein abnormales vorherrschendes Fettwachstum außerhalb des begrenzten Raums des Karpaltunnels. e 12–5-MHz-US-Längsbild auf Höhe des Karpaltunnels zeigt eine spindelförmige Schwellung eines einzelnen Faszikels (Pfeile) knapp unterhalb des Retinaculum flexorum (Pfeilspitzen). Korrespondierende transversale f T1-gewichtete und g-Fett-unterdrückte T2-gewichtete MR-Bilder bestätigen das Vorhandensein eines einzelnen geschwollenen T2-hyperintensen Faszikels (Pfeil) im Vergleich zu den benachbarten normalen, was möglicherweise auf eine Kompressionsanomalie hinweist. Der Patient erfuhr postoperativ eine Linderung der Symptome und die Schmerzen traten während der 1-jährigen postoperativen Nachsorge nicht wieder auf.
5. CHARCOT-MARIE-ZAHN-KRANKHEIT
Die Charcot-Marie-Tooth-Krankheit ist eine komplexe und heterogene Gruppe erblicher Erkrankungen des peripheren Nervensystems, auch bekannt als erbliche motorische und sensorische Neuropathien, die durch eine hypertrophierte periphere Neuropathie aufgrund des abnormalen Wachstums (wie eine Zwiebel) von Schwann gekennzeichnet ist Zellen (Abb. 6a, b). Zu den häufigsten klinischen Merkmalen gehören ein unsicherer Gang aufgrund einer fortschreitenden distalen Schwäche der Peronealmuskulatur, ein Hohlfuß, gedämpfte oder fehlende tiefe Sehnenreflexe und ein leichter Sensibilitätsverlust. Die histopathologischen Anomalien betreffen alle Nerven im Körper und treten überwiegend in den Faszikeln auf. Obwohl sich das Klassifikationssystem der Charcot-Marie-Tooth-Krankheit ständig ändert (weil noch nicht alle ursächlichen Gene beschrieben sind), gehören zu den häufigsten Formen die autosomal dominanten Typen 1A und 2, die mit der DNA-Duplikation einer Region auf dem Chromosom zusammenhängen 17, das für ein peripheres Myelinprotein kodiert, und der X-chromosomale Typ, der mit einer Mutation im Gen verwandt ist, das für Connexin 32 kodiert, das ein Gap-Junction-Protein ist (Schenone und Mancardi 1999). Der Grad der elektrophysiologischen Veränderungen variiert stark zwischen Patienten mit unterschiedlichen Formen der Erkrankung, insbesondere bei Typ 1A, als Ergebnis phänotypischer Unterschiede und der Wirkung stochastischer Faktoren oder umweltbedingter Modulation der Schwere der Erkrankung (Schenone und Mancardi 1999). Die Nerven erscheinen größer als normal, behalten aber eine normale faszikuläre Echotextur (Heinemeyer und Reimers 1999; Martinoli et al. 2002). Betrachtet man die wichtigsten genetischen Typen der Charcot-Marie-Tooth-Krankheit, wie die autosomal dominanten Typen 1A und 2 und den X-chromosomalen Typ, haben Patienten mit Typ 1A deutlich größere Faszikel als Patienten mit den anderen Subtypen der Krankheit. Bei diesen Patienten sind der Durchmesser der Faszikel und der resultierende Nervenbereich mehr als doppelt so hoch wie bei gesunden Probanden und bei Typ 2 und X-chromosomalem Typ (Fig. 6c, d) (Martinoli et al. 2002). Es besteht keine Korrelation zwischen der maximalen faszikulären Größe des Nervs und elektrophysiologischen Merkmalen wie distale Latenzen, Geschwindigkeiten und Amplitude (Martinoli et al. 2002). In diesem spezifischen klinischen Umfeld kann US verwendet werden, um dem Neurologen zu helfen, eine nicht erkannte Krankheit bei Patienten mit unspezifischen Symptomen zu identifizieren, den genetischen 1A-Subtyp zu differenzieren und ein nützliches Screening-Tool für eine erste Auswahl der Personen in einer betroffenen Verwandtschaft bereitzustellen, die betroffen sind sich genetischen Untersuchungen zu unterziehen.
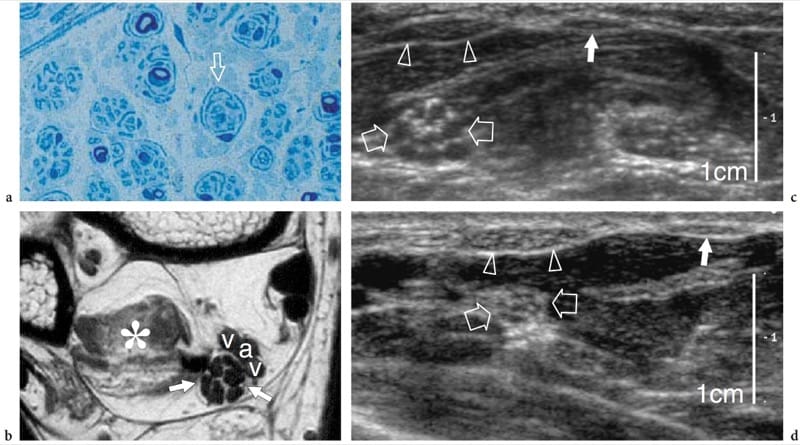
Abbildung 6. a–d. Charcot-Marie-Tooth-Krankheit bei einer 37-jährigen Frau mit Typ-1A-Erkrankung. a Der histologische Schnitt eines Faszikels des Nervus suralis zeigt das abnorme „Zwiebelknollen“-Aussehen (Pfeil) der Schwann-Zellen, ein besonderer Befund der Charcot-Marie-Tooth-Krankheit. Originalvergrößerung ×800. b T1-gewichtetes MR-Bild transversal des hinteren Sprunggelenks zeigt einen vergrößerten N. tibialis (Pfeile), der durch geschwollene Faszikel gekennzeichnet ist. Der Nerv ist viel größer als normal. Beachten Sie die atrophischen Veränderungen im Musculus flexor hallucis longus (Sternchen) und der angrenzenden A. tibialis posterior (a) und Venen (v). c Kurzachsen-12–5-MHz-US-Bild über dem mittleren Unterarm zeigt eine Hypertrophie des Nervus medianus (offene Pfeile) und seiner Faszikel. d Ein entsprechendes 12–5-MHz-US-Bild des Nervus medianus, das zum Vergleich bei einer gesunden Frau bei derselben Vergrößerung wie in c erhalten wurde, zeigt einen kleineren Nervus medianus (offene Pfeile) und Faszikel. Beachten Sie die äquivalente Größe der Sehne des Flexor carpi radialis (Pfeilspitzen) und der Palmaris longus (weißer Pfeil) in den beiden Bildern. Der Vergrößerungsmaßstab ist rechts angegeben.
6. HEREDITÄRE NEUROPATHIE MIT HAFTUNG FÜR DRUCKLÄHMUNGEN
Die hereditäre Neuropathie mit Anfälligkeit für Drucklähmungen, auch bekannt als tomakulöse Neuropathie, ist eine autosomal-dominant vererbte Erkrankung, die durch eine Tendenz zur Entwicklung fokaler Neuropathien nach einem Bagatelltrauma gekennzeichnet ist, die mit einer Deletion in Chromosom 17p11.2-12 zusammenhängt, die zu einer verminderten Expression von peripherem Myelin führt Protein 22 (Verhagen et al. 1993). Histopathologisch ist eine wurstförmige Myelinscheidenschwellung, die sogenannte Tomakula, für die multifokale Nervenvergrößerung verantwortlich. Elektrophysiologische Studien zeigen eine oder mehrere Engpassneuropathien vor dem Hintergrund einer motorischen und sensorischen Polyneuropathie. Die am häufigsten beteiligten Nerven sind: N. peroneus am Fibulatunnel, N. ulnaris am Cubitaltunnel, N. radialis an der Spiralrille und N. medianus am Karpaltunnel (Verhagen et al. 1993; Beekman und Visser 2002 ). Der Ultraschall kann eine fokale Nervenvergrößerung nicht nur an den typischerweise beteiligten osteofibrösen Tunneln erkennen, sondern auch entlang des Nervenverlaufs in den Extremitäten (Abb.. 7). Es ist denkbar, dass die „wurstförmigen“ Myelinschwellungen (Tomacula), die bei Nervenfaserstudien bei Patienten mit dieser Störung gefunden wurden, für die Nervenvergrößerung verantwortlich sind (Beekman und Visser 2002).
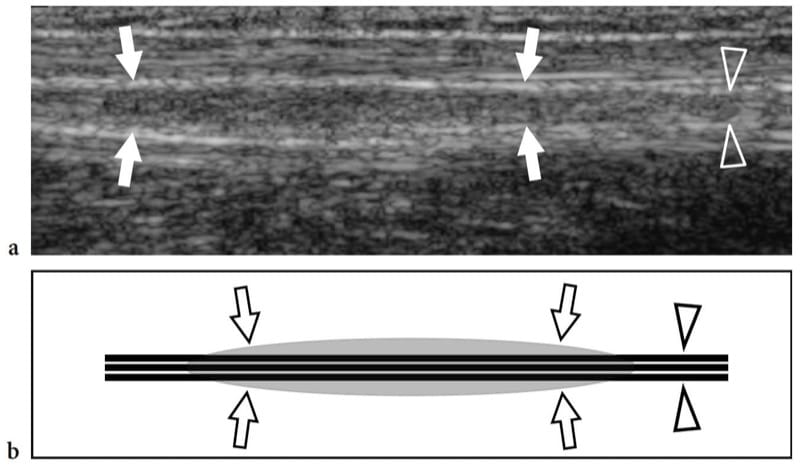
Abbildung 7. a,b. Hereditäre Neuropathie mit Anfälligkeit für Drucklähmungen bei einem 42-jährigen Mann mit leichter medianer und ulnarer Neuropathie. a Längsachsen-12–5-MHz-US-Bild des Nervus ulnaris (Pfeilspitzen) am mittleren Unterarm mit b Schemazeichnungskorrelation zeigt eine leichte fusiforme Verdickung (Pfeile) des Nervs aus den osteofibrösen Tunneln.
7. NERVENINSTABILITÄT
Der dynamische US des Ellbogens kann verwendet werden, um eine abnormale Luxation des N. ulnaris mit oder ohne Trizeps-Schnappsyndrom zu demonstrieren. Dieser Befund tritt typischerweise im Kubitaltunnel auf, einem osteofibrösen Tunnel, der durch eine Rinne zwischen dem Olecranon und dem medialen Epicondylus gebildet und vom Osborn-Retinaculum überbrückt wird. Dynamisches Scannen bei voller Ellbogenflexion kann eine kontinuierliche Darstellung der intermittierenden Luxation des N. ulnaris über dem medialen Epicondylus ermöglichen, wenn das Retinaculum locker ist oder fehlt (Jacobson et al. 2001). Eine Luxation der medialen Trizepskante kann auch in Kombination mit einer Luxation des N. ulnaris auftreten (Jacobson et al. 2001). Bei diesem Syndrom ist die Luxation des Nervus ulnaris sekundär zum Schnappen des Trizeps, und dynamisches Scannen zeigt, dass der mediale Kopf des Trizeps und der Nervus ulnaris in enger Kontinuität bleiben, wenn sie sich über dem medialen Epikondylus dislozieren.
8. KOMPRESSIONSSYNDROME
Aus allgemeiner pathophysiologischer Sicht kann eine Nervenkompression akut auftreten oder sich chronisch entwickeln. Kurze Perioden der Konstriktion führen zu einer Verlangsamung und zum Ausfall der Leitung über den Konstriktionspunkt, während der Nervenabschnitt distal zu dem komprimierten Bereich eine normale Funktion beibehält. Die Überleitungsstörungen, die allgemein mit dem Begriff „Neuroapraxie“ bezeichnet werden, neigen dazu, sich zu bessern, aber es kann eine verlängerte Latenzzeit bis zur vollständigen Genesung geben. Diese Art von Verletzung tritt typischerweise im N. radialis an der Spiralfurche des Oberarmknochens auf, die sogenannte „Samstag-Nacht-Radialparese“, und im N. peroneus um den Wadenbeinkopf und -hals, die sogenannte „Peronealparese mit gekreuzten Beinen“. “. Wenn die lokale Kompression verlängert wird, kann eine durch direkte starke Kompression induzierte Ischämie, eine mechanische Verzerrung der Nervenarchitektur, eine stärkere Schädigung der Myelinscheide und eine axonale Degeneration (Wallesche Degeneration) der Nervenfasern und ein anhaltendes Nervendefizit aufgrund einer Störung des Axoplasmas verursachen nach Entlastung der Kompression (Delfiner 1996). Bei chronischer Nerveneinklemmung kann eine Reizung oder Kompression des Nervs eine Störung der intraneuralen mikrovaskulären Versorgung und eine ischämische Reaktion hervorrufen, die hauptsächlich das Epineurium betrifft. Eine venöse Stauung kann ein endoneurales Ödem mit erhöhtem Flüssigkeitsdruck in der Umgebung der Faszikel hervorrufen, wodurch ein Mikrokompartiment-Syndrom induziert wird (Shon 1994; Delfiner 1996). In den frühen Stadien können die Symptome nach Belastung intermittierend oder sogar gelindert werden, parallel zur Wiederherstellung der intraneuralen Zirkulation und Drainage des intraneuralen Ödems. Im weiteren Krankheitsverlauf kann das anhaltende Ödem des Epineuriums in fibrotische Veränderungen mit Verdickung und Fibrose der Nervenhüllen übergehen, die weiter zu einer chronischen Einengung des Nervs beitragen. Langanhaltende Kompression führt zu einer Schädigung der Myelinscheide und einer durch Fibrose induzierten axonalen Degeneration mit dauerhaftem Verlust der Nervenfunktion und Atrophie der innervierten Muskulatur. Chronisch komprimierte Nervenstämme sind typischerweise an der Kompressionsstelle dünn (mit Verringerung der Anzahl myelinisierter Fasern) und proximal zum Kompressionspunkt geschwollen. Die physiologischen Folgen einer chronischen Kompression sind eine Verlangsamung der Leitungsgeschwindigkeit und gelegentlich eine Leitungsblockade.
9. NERVENEINSCHLAGSYNDROME
Eine Nervenbeteiligung durch äußere Ursachen kann überall im Körper auftreten. Es tritt jedoch häufiger an anatomischen Stellen auf, an denen der Nerv in nicht dehnbaren osteofibrösen Tunneln oder unter einem prominenten oder abnormalen Muskelband, Bindegewebe oder Knochenkamm verläuft, das den Nerv anbindet. Die diagnostische Beurteilung von Nervenkompressionssyndromen basiert im Wesentlichen auf klinischen Merkmalen und elektrophysiologischen Tests, und der Hauptwert der Bildgebung liegt in der Beurteilung schwieriger oder atypischer Fälle oder bei Verdacht auf eine Raumforderung aus klinischen Gründen. In den letzten Jahren wurde US zunehmend als effiziente und kostengünstige Alternative zur MR-Bildgebung zur Erkennung von Kompressionsläsionen vorgeschlagen.
Bei Nerveneinklemmungssyndromen kann der Ultraschall Veränderungen sowohl in der Nervenform als auch in der Echotextur zeigen, wobei die häufigste eine plötzliche Abflachung (Notch-Zeichen) mit fokaler Verringerung der Nervenquerschnittsfläche am Kompressionspunkt und eine Nervenschwellung ist, die proximal zum Niveau auftritt der Kompression (Abb.. 8) (Buchberger et al. 1991; Martinoli et al. 2000b). Die Nervenschwellung ist typischerweise spindelförmig, erstreckt sich über eine Länge von 2–4 cm und erscheint maximal in unmittelbarer Nähe der Kompressionsebene, wo der Nerv abrupt abflacht. Angesichts dieser Merkmale ist der US ein genaues Mittel zur Identifizierung des Kompressionsniveaus, das sich direkt vor dem geschwollenen Nervenabschnitt befindet. Obwohl die Nervenabflachung als Hauptzeichen einer Nervenkompression angesehen werden sollte, hat sich die quantitative Analyse der Nervenverdickung mittels der Ellipsenformel [(maximaler AP-Durchmesser) × (maximaler LL-Durchmesser) × (π/4)] am besten bewährt einheitliches Kriterium für die Diagnose an verschiedenen Einklemmstellen (Chiou et al. 1998; Duncan et al. 1999; Bargfrede et al. 1999). Als Nebenbefund kann das dynamische Scannen eine reduzierte Beweglichkeit des Nervs über der Masse oder unter dem Retinaculum zeigen, aber dieses letztere Zeichen ist zu subjektiv und mit US schwer zu quantifizieren (Nakamichi und Tachibana 1995). Die Querschnittsfläche des N. medianus gilt zumindest auf Karpaltunnelebene auch als Anhaltspunkt für die Auswahl von Patienten mit schwerer Erkrankung, bei denen eine chirurgische Dekompression indiziert ist (Lee et al. 1999). Es ist denkbar, dass der Verlust von Axonen mit einer Nervenvergrößerung als Ausdruck eines vermehrten endoneuralen Ödems einhergeht (Beekman et al. 2004b). Bei Einklemmungsneuropathien kann die Nervenechotextur gleichmäßig echoarm werden, wobei das faszikuläre Muster auf Höhe der Kompressionsstelle und proximal davon verloren geht (Abb.. 9). Im Allgemeinen treten die echoarmen Veränderungen allmählich auf und werden stärker, wenn sich der Nerv der Kompressionsstelle nähert (Martinoli et al. 2000b). Sie rühren von einer Schwellung der einzelnen Faszikel und einer verminderten Echogenität des Epineuriums her. Die äußere Auskleidung des Nervs, die normalerweise undefiniert und Teil eines Kontinuums mit dem Epineurium und umgebendem Fett ist, wird scharf und gut abgegrenzt. Die Darstellung solcher Veränderungen kann das Vertrauen in die Diagnose und die Bestimmung des genauen Ausmaßes der Läsion erhöhen. Bei Einklemmung durch Narbengewebe können diagnostische Schwierigkeiten bei der Unterscheidung echostruktureller Veränderungen im Zusammenhang mit dem komprimierten Nerv von der Narbe selbst aufgrund eines ähnlichen echoarmen Erscheinungsbilds auftreten. Dann kann eine verbesserte Darstellung intraneuraler Blutflusssignale mit Farb- und Power-Doppler-Techniken als Zeichen lokaler Störungen in der Nervenmikrovaskulatur gewürdigt werden, die in einem kompressiven Kontext auftreten (Martinoli et al. 2000b). Das hypervaskuläre Muster wird deutlicher bei geschwollenen echoarmen Nerven von Patienten mit chronischer, langjähriger Erkrankung wahrgenommen. Intranervöse Flusssignale bestehen aus vielen Gefäßstielen, die vom oberflächlichen Epineurium in den Nerv eintreten und senkrecht zu den Faszikeln verlaufen (Abb.. 10) (Martinoli et al. 1999, 2000b).
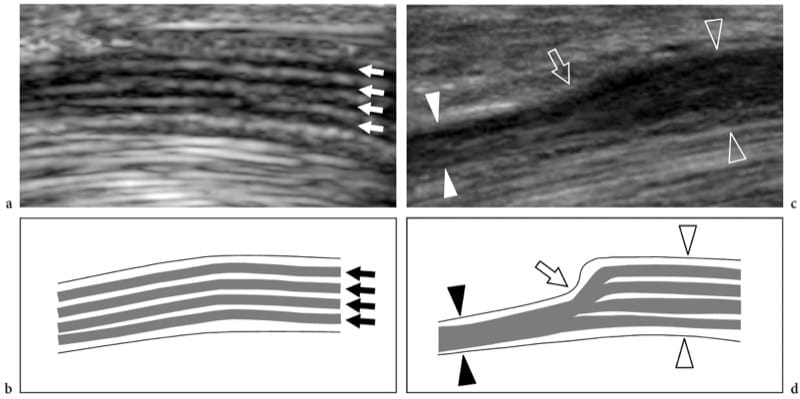
Abbildung 8. a–d. Einklemmungsneuropathien: Veränderungen der Nervenform. a Längsachse 15–7 MHz US-Bild des N. medianus auf Höhe des Karpaltunnels mit b Schemazeichnungskorrelation bei einem gesunden Probanden zeigt einen normal großen Nerv und eine klare Abgrenzung der faszikulären Anordnung (Pfeile). c Entsprechendes 17–5 MHz-Langachsen-US-Bild des Nervus medianus bei einem Patienten mit schwerer medianer Neuropathie zeigt eine abrupte Veränderung (Pfeil) in der Größe des Nervs am proximalen Rand des Retinakulums (Kompressionspunkt). Der Nerv ist innerhalb des Karpaltunnels abgeflacht (weiße Pfeilspitzen) und proximal der Kompressionsebene deutlich geschwollen (offene Pfeilspitzen).
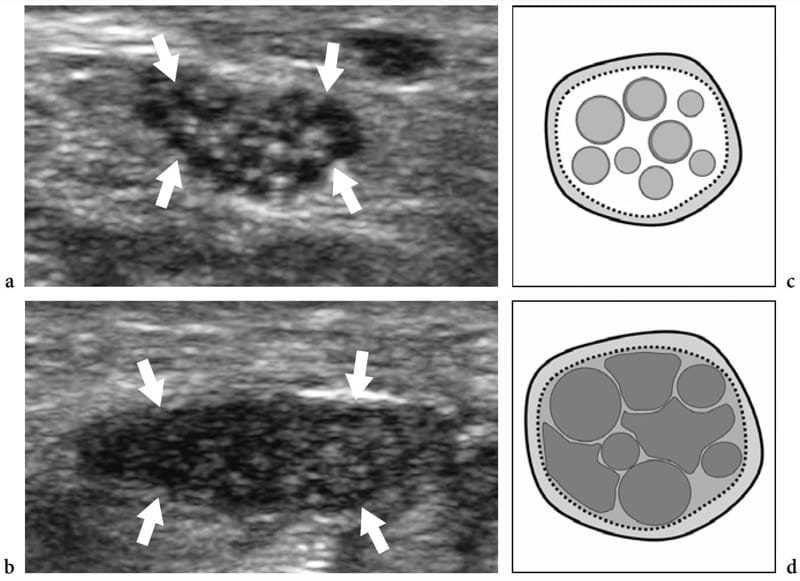
Abbildung 9. a–d. Einklemmungsneuropathien: echotexturale Veränderungen. a,b Kurzachsige 17–5-MHz-US-Bilder des rechten N. medianus, a am distalen Radius und b kurz vor dem Kompressionspunkt bei einem Patienten mit langjährigem Karpaltunnelsyndrom. Wenn sich der Nerv (Pfeile) der Kompressionsstelle nähert, werden zunehmende echoarme Veränderungen aufgrund einer Ansammlung ödematöser Faszikel und einer verringerten Echogenität des Epineuriums festgestellt. Dies führt zu einem vollständigen Verlust der faszikulären Echotextur. c,d Korrelation der schematischen Zeichnung.
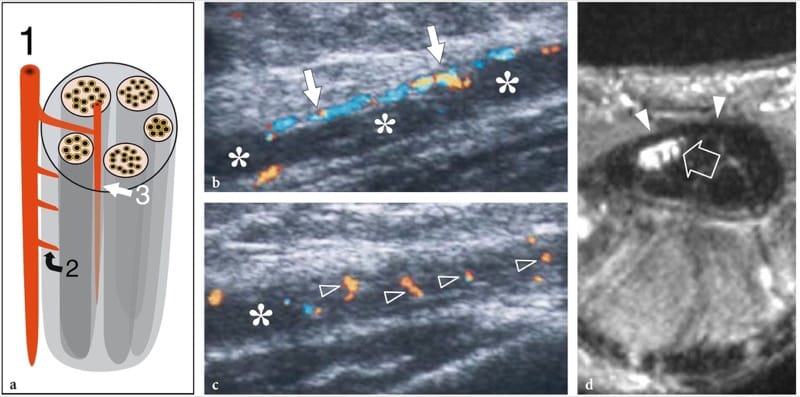
Abbildung 10. a–d. Einklemmungsneuropathien: mikrovaskuläre Veränderungen. a Schematische Darstellung des Nervengefäßsystems, bestehend aus perineuralen Gefäßen (1), die entlang des Nervs verlaufen. Diese Gefäße geben intraneurale Äste ab, die das äußere Epineurium (2) durchbohren und sich in Längsrichtung (3) zwischen den Faszikeln verteilen. b,c 12–5 MHz Farbdoppler-US-Langachsenbilder des Nervus medianus (Sternchen) bei einem 56-jährigen Patienten mit Karpaltunnelsyndrom zeigen subtile Flusssignale vom longitudinalen perineuralen Plexus (Pfeile) und einer Reihe von intranervösen Äste (Pfeilspitzen), die zwischen den Faszikeln verlaufen. d Entsprechendes transversales Gd-verstärktes fettunterdrücktes T1-gewichtetes MRT-Bild, das knapp unterhalb des Retinaculum flexorum (Pfeilspitzen) aufgenommen wurde, zeigt eine deutliche Aufnahme von Kontrastmittel in den Nervus medianus (Pfeil).
Basierend auf der US-Bewertung können Nerveneinklemmungssyndrome in drei Hauptklassen eingeteilt werden. Die erste umfasst große Nerven (dh den Median, den Ulnar, den Radial, den Ischias, den Tibia usw.), die mit US an der Kompressionsstelle leicht dargestellt werden können. In diesen Fällen kann die US-Bewertung effektiv mit herkömmlicher (mittlerer) Ausrüstung durchgeführt werden und die Diagnose basiert auf Mustererkennungsanalyse und quantitativen Messungen. Die zweite umfasst kleine Nerven (dh die posterioren und anterioren interossären, die muskulokutanen, die peronealen, die suralen, die Fußsohlen usw.), deren Darstellung High-End-Ausrüstung und Hochleistungswandler erfordert. In diesen Fällen werden in der Regel keine quantitativen Messungen durchgeführt. Die dritte Klasse umfasst Nerven, die im US nicht nachweisbar sind, weil sie entweder zu klein sind (d. h. der größte Teil des Saphenus usw.) oder zu tief verlaufen und durch dazwischen liegenden Knochen verdeckt sind (d intrapelviner Verlauf des Ischias- und des N. femoralis etc.). In diesen Fällen basiert die US-Diagnose nur auf der indirekten Beurteilung der innervierten Muskeln, um Denervationszeichen zu identifizieren. In den ersten beiden Klassen gibt es viele Stellen von Nerveneinklemmungen, die für eine US-Untersuchung in den oberen und unteren Extremitäten zugänglich sind, und unabhängig von der Stelle und dem beteiligten Nerv sind die zuvor beschriebenen US-Zeichen praktisch pathognomonisch für eine kompressive Neuropathie. Dazu gehören: der Bereich der spinoglenoid-supraspinösen Kerbe in der hinteren Schulter für den N. suprascapularis (Martinoli et al. 2003); der viereckige Raum für den N. axillaris (Martinoli et al. 2003; die Spiralfurche des Humerus für den N. radialis (Peer et al. 2001; Bodneret al. 1999, 2001; Rossey-Marec et al. 2004; Martinoliet al. 2004); der Supinatorbereich am Ellbogen für den N. interosseus posterior (Bodner et al. 2002b; Chienet al. 2003; Martinoliet al. 2004) und das Handgelenk für den oberflächlichen Ast des N. radialis; die Cubital- und Guyon-Tunnel für den N. ulnaris (Chiou et al. 1998; Puiget al. 1999; Okamotoet al. 2000; Martinoliet al. 2000b, 2004; Nakamichi et al. 2000; Bianchiet al. 2004; Beekmanet al. 2004a; Beekman und Visser 2004); der mittlere Unterarm für den N. interosseus anterior (Hide et al. 1999) und der Karpaltunnel für den Nervus medianus (Altinok et al. 2004; Buchbergeret al. 1991, 1992; Nakamichi und Tachibana 1995; Bertolottoet al. 1996; Leeet al. 1999; Chenet al. 1997; Duncanet al. 1999; Martinoliet al. 2002b; Keleet al. 2003; Bianchiet al. 2004; El Miedanyet al. 2004; Yesildag et al. 2004; Wilson 2004; Wonget al. 2004; Kotevoglu und Gülbahce-Saglam 2005; Koyuncuogluet al. 2005; Ziswileret al. 2005); die hintere Hüfte oder der proximale Oberschenkel für den Ischiasnerv (Graif et al. 1991); Fibulakopf und -hals für den N. peroneus communis (Martinoli et al. 2000b); der Tarsaltunnel für den N. tibialis (Martinoli et al. 2000b) und die Intermetatarsalräume für die Interdigitalnerven (Redd et al. 1989; Lesen et al. 1999; Sobiesk et al. 1997; Quinn et al. 2001).
In Bezug auf die elektrophysiologischen Befunde wurde eine positive Korrelation zwischen der Nervenquerschnittsfläche und dem Schweregrad des elektromyografischen Befunds gefunden, während zwischen elektrodiagnostischen Parametern wie Motorgeschwindigkeit, CMAP-Amplitude, distalem SNAP nur eine mäßige negative Korrelation zu bestehen scheint , und die Nervenquerschnittsfläche (Kele et al. 2003; Beekman et al. 2004; El Miedany et al. 2004; Ziswiler et al. 2005). Im Allgemeinen kann der US Nervenleitungsstudien bei der Bewertung von Nerveneinklemmungssyndromen ergänzen. Es kann bei Patienten mit fehlenden motorischen oder sensorischen Reaktionen aufschlussreich sein, wenn es schwierig ist, die Kompressionsstelle zu lokalisieren. Eine positive US-Studie kann die Unsicherheit von Nervenleitungsstudien verringern und verringert daher die Notwendigkeit weiterer Ausschlussstudien. Darüber hinaus kann der US auffällige Befunde in der Nervenumgebung, wie z. B. Synovitis, Raumforderungen oder anomale Muskeln, identifizieren und wichtige Informationen im präoperativen Umfeld liefern.
Nach chirurgischer Dekompression können sich das US-Erscheinungsbild und die Beweglichkeit der betroffenen Nerven verbessern, und es ist möglich, die veränderte Morphologie des osteofibrösen Tunnels nach Freisetzung des Retinakulums darzustellen (Martinoli et al. 2000b; El-Karabaty et al. 2005).
10. DEHNUNGSVERLETZUNGEN
Nervendehnungsverletzungen treten typischerweise als Folge von wiederholten Verstauchungen oder Belastungsverletzungen sowie bei Überbeanspruchung auf. Eine charakteristische Verletzung ist der Ausriss der Nervenwurzeln, der bei einem Trauma des Plexus brachialis bei Autounfällen auftritt (Shafighi et al. 2003; Graif et al. 2004). Ein weiterer typischer Ort der Nerventraktion ist die Fossa poplitea, wo der Nervus peroneus bei hochgradigen Verstauchungen, Knieluxationen oder Frakturen gedehnt werden kann (Gruber et al. 2005). Bei kompletten Nervenrissen zeigt der US eine Störung der Faszikel mit Retraktion und welligem Verlauf der Nervenenden (Shafighi et al. 2003; Graif et al. 2004; Gruber et al. 2005). Die äußere Nervenscheide kann intakt sein. Wenn eine Traktionsverletzung zu einem partiellen Nervenriss führt, kann sich ein Spindelneurom (Traktionsneurom) als unregelmäßige Schwellung von echoarmem Gewebe entlang des durchtrennten Nervs ohne Anzeichen einer Nervenunterbrechung entwickeln (Abb.. 11) (Bodner et al. 2001; Graif et al. 2004). In leichten Fällen kann das Neurom nur einen oder wenige Faszikel betreffen, während die Querschnittsfläche des Nervs ziemlich normal oder leicht vergrößert erscheint.
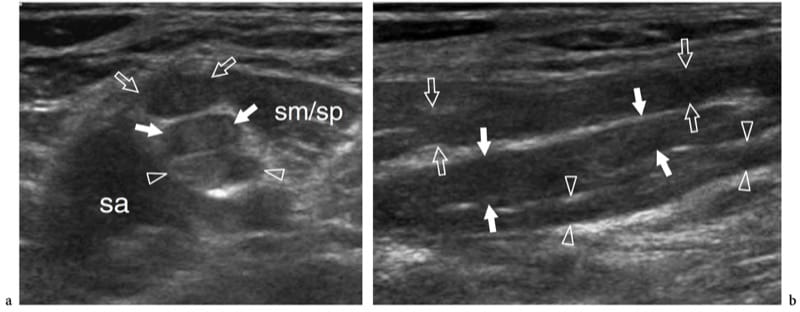
Abbildung 11. a,b. Dehnungsverletzung (Burner/Stinger-Syndrom) der Nerven des Plexus brachialis bei einem 25-jährigen Rugbyspieler mit anhaltendem Kribbeln von der linken Schulter bis zur Hand und fortschreitender Schwäche der Extremitätenmuskulatur nach einer erheblichen Kontaktverletzung. a Kurzachsen- und b Langachsen-US-Bilder mit 12–5 MHz über dem Bereich zwischen den Skalenus zeigen eine segmentale Verdickung der C5- (offene Pfeile), C6- (weiße Pfeile) und C7- (Pfeilspitzen) Komponenten des Plexus (oberer und mittlerer Stamm). ), die fusiforme Neurome im Zusammenhang mit einem Dehnungstrauma widerspiegeln. sa, scalenus anterior; sm/sp, scalenus medius/scalenus hintere Muskeln. Beim Burner-Stinger-Syndrom sollte immer eine MRT der Halswirbelsäule durchgeführt werden, um Nervenschädigungen im Wirbelkanal sowie Bandscheibenvorfälle, Bandverletzungen, Facettenverletzungen und nicht dislozierte Frakturen auszuschließen.
11. KONTUS-TRAUMA
Ein Prellungstrauma tritt am häufigsten dort auf, wo Nerven eng an Knochenoberflächen an Stellen mit geringer Mobilität verlaufen und daher anfälliger für äußere Verletzungen sind. In den meisten Fällen löst sich ein solches Trauma von selbst auf und verursacht keine morphologischen Veränderungen, die mit US nachweisbar sind (Abb.. 12). Ein wiederholtes leichtes Quetschtrauma ist normalerweise erforderlich, um Anomalien innerhalb der Nervensubstanz zu verursachen, die mit dem US erkannt werden können. Ein typisches Kontusionstrauma ist das des N. radialis, wo er das laterale intermuskuläre Septum durchbohrt, oder des N. peronaeus profundus gegen die Mittelfußknochen bei Fußballspielern, die wiederholt Schläge auf den Fußrücken erhalten (Schon 1994; Quinn et al. 2001). . Diese Läsionen führen zur Entwicklung einer segmentalen spindelförmigen Verdickung des Nervs an der Stelle des Traumas. Eine besondere Art von Kontusionstrauma ist das mit instabilen Ulnarisnerven am Kubitaltunnel bei Patienten mit fehlendem Osborne-Retinakulum. Bei prädisponierten Personen kann die wiederholte Reibung des Nervs am Epicondylus während der Ellbogenbeugung zu chronischen Schäden und Funktionseinschränkungen, der sogenannten „Reibungsneuritis“, führen. In diesen Fällen erscheint der Nerv infolge fibrotischer Veränderungen geschwollen und echoarm und zeigt ein verdicktes äußeres Epineurium (Jacobson et al. 2001).
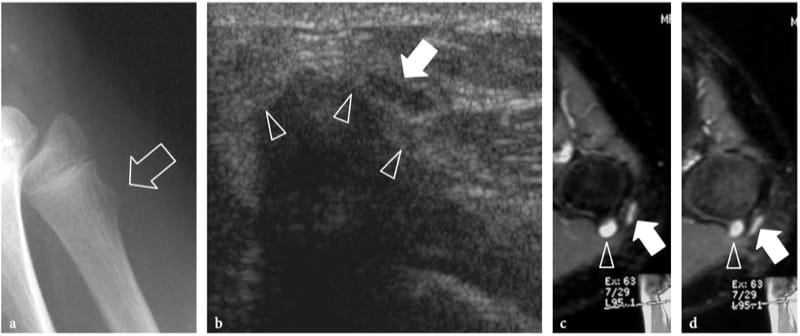
Abbildung 12. a–d. Trauma durch Nervenquetschung. Peroneale Neuropathie bei einem 15-jährigen Jungen mit Beginn eines Fallfußes nach einem Schlag auf das laterale Knie. a Lateraler einfacher Film zeigt eine Exostose (Pfeil) an der Fibulametaphyse. b Transversales 12–5-MHz-US-Bild zeigt Impingement des Nervus peroneus (Pfeil) gegen die knorpelige Komponente (Pfeilspitzen) der Exostose. Der Nerv ist geschwollen und echoarm. c, d Korrelative transversale fettunterdrückte GRE-T2*-MRT-Bilder zeigen einen hyperintensen Nerv (Pfeil), der die Exostose (Pfeilspitze) durchquert. Beachten Sie die T2-hyerintense Kappe der Exostose.
12. EINDRINGENDE WUNDEN
Bei penetrierenden Wunden (oft sind Glassplitter im Spiel!) kann es zu einer teilweisen oder vollständigen Unterbrechung der Nervenbündel kommen. Regenerierende Schwann-Zellen und Axone wachsen zufällig an der Läsionsstelle in einem Versuch, die Kontinuität des Nervs wiederherzustellen. Im Allgemeinen ist die Lücke zwischen den getrennten Faszikeln breit, und neue axonale Sprossen entwickeln sich in viele Richtungen. Eine echoarme Fasermasse ist das Ergebnis eines solchen desorganisierten Reparaturprozesses. Bei vollständigen Rissen erscheinen Stumpfneurome (terminale Neurome) als kleine echoarme Massen in Kontinuität mit den gegenüberliegenden Rändern des durchtrennten Nervs (Provost et al. 1997; Graif et al. 1991; Simonetti et al. 1999). Normalerweise ist ihre Größe etwas größer als der axiale Durchmesser des Nervs. Die meisten haben gut definierte Ränder; Wenn sie jedoch durch Adhäsionen und umhüllendes Narbengewebe mit dem umgebenden Gewebe verbunden sind, können ihre Grenzen unregelmäßig oder schlecht definiert sein (Bodner et al. 2001). Die US-Darstellung von terminalen Neuromen kann die Position der Nervenenden abbilden, die von der Verletzungsstelle verschoben und zurückgezogen werden können (Abb. 13a – c). Wenn die Nervenenden nahe beieinander liegen, kann der Großteil des Neuroms sie umhüllen und einen teilweisen Riss nachahmen. In gewisser Weise scheint dies darauf hinzudeuten, dass US nicht in der Lage ist, den Grad der Nervenschädigung innerhalb eines Spindelneuroms zu quantifizieren. Wenn der Nerv teilweise gerissen ist, kann das echoarme Neurom resezierte und erhaltene Faszikel umhüllen, was zu einer homogenen spindelförmigen Schwellung des Nervs führt, oder es kann gesehen werden, wie es spezifisch aus den resezierten Faszikeln entsteht, während die nicht betroffenen Faszikel ihren Verlauf neben den fibrösen fortsetzen können Masse (Fig.14). In diesem letzteren Fall ist US in der Lage, die Menge (Prozent) der am Neurom beteiligten Faszikel abzuschätzen (Abb. 14d). Insgesamt kann der US die klinische Untersuchung und Nervenleitungsstudien unterstützen, um Informationen über den Zustand des verletzten Nervs zu liefern, und insbesondere bei der Entscheidung, ob eine frühzeitige chirurgische Behandlung erforderlich ist. Dies gilt insbesondere für kleinere Nervenläsionen ohne axonale Schädigung.
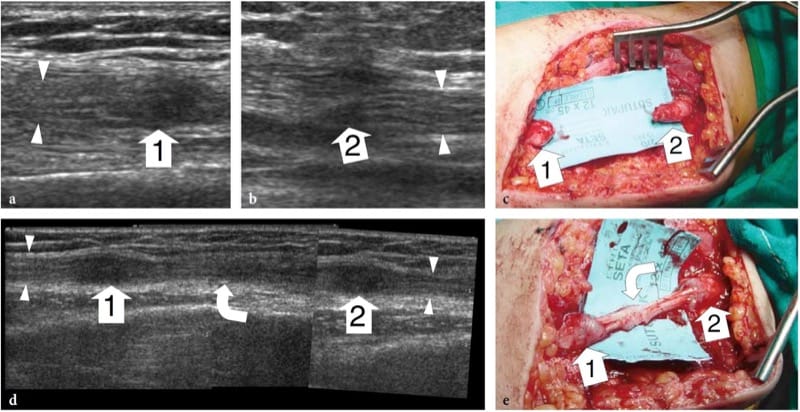
Abbildung 13. a–e. Kompletter Nervenriss bei einem 12-jährigen Mädchen mit Funktionsverlust des Nervus medianus nach penetrierender Verletzung des Arms durch ein Glassplitter. In der Akutsituation wurde der Patient wegen einer Verletzung der Brachialarterie operiert. a,b Längsachsen-US-Bilder mit 15-7 MHz auf der Verletzungsebene zeigen eine Diskontinuität des Nervus medianus. Beachten Sie die proximalen und distalen Stümpfe (Pfeilspitzen) des durchtrennten Nervenendes in einem echoarmen terminalen Neurom (1, 2). c Die grobe chirurgische Ansicht zeigt eine diskrete Retraktion (4 cm Lücke) der Nervenenden. d Nach der rekonstruktiven Operation zeigt ein 12–5-MHz-US-Langachsenbild das Transplantat des N. suralis (gekrümmter Pfeil) zwischen den Nervenenden (Pfeilspitzen). An der proximalen (1) und distalen (2) Stelle der Anastomose wird eine fusiforme echoarme Verdickung beobachtet, die als normaler Befund angesehen werden sollte. Es wurde ein Bild mit geteiltem Bildschirm verwendet, wobei die beiden Bildschirme für ein erweitertes Sichtfeld ausgerichtet waren. e Chirurgische Korrelation.
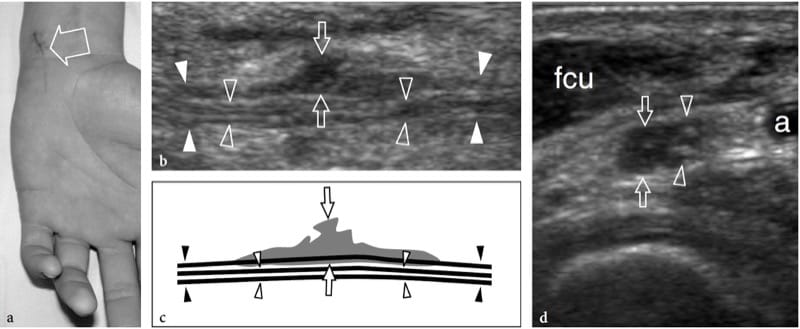
Abbildung 14. a–d. Teilriss des Nervus ulnaris am Handgelenk bei einem 15-jährigen Jungen. Die Wunde wurde durch einen scharfen Gegenstand erzeugt und führte zu einem selektiven motorischen Defizit. a Foto zeigt die Verletzungsstelle (Pfeil). Beachten Sie die Semiflexionsdeformität des Ringfingers und des kleinen Fingers im Zusammenhang mit der Schwäche der ulnar-innervierten interossären Muskulatur. b 15–7-MHz-Langachsen-US-Bild über dem Hauptstamm des N. ulnaris (weiße Pfeilspitzen in b, schwarze Pfeilspitzen in c) mit c Schemazeichnungskorrelation zeigt echoarmes Gewebe (Pfeile), an dem ein Teil der Nervenfaszikel beteiligt ist, während einige erhalten sind Faszikel (offene Pfeilspitzen) überqueren die Verletzungsstelle unbeeinflusst. d Kurzachsen-15–7-MHz-US-Bild zeigt die betroffenen (Pfeile) und erhaltenen (Pfeilspitzen) Anteile des N. ulnaris. Echoarmes fibröses Gewebe ist zu sehen, das etwa 50% der medialseitigen Faszikel des Nervs betrifft, die den tiefen motorischen Ast hervorrufen. Umgekehrt setzen sich die normalen lateralseitigen Faszikel im oberflächlichen sensorischen Ast des Nervs fort. a, Arteria ulnaris; fcu, Musculus flexor carpi ulnaris.
13. POSTOPERATIVE EIGENSCHAFTEN
Bei Patienten mit partiellem Nervenriss wird ein empfindliches Verfahren der inneren Neurolyse des Nervs und seiner Hülle hauptsächlich verwendet, um entweder die unterbrochenen Nervenbündel zu reparieren oder intraneurales Narbengewebe zu entfernen. Bei diesem Verfahren besteht das Hauptrisiko in der versehentlichen Beschädigung erhaltener Faszikel und der Bildung einer neuen postoperativen Narbe nahe der Nervenoberfläche. Bei vollständiger Durchtrennung des Nervs ist ein komplexerer chirurgischer Eingriff erforderlich. Die geeignete Auswahl einer adäquaten Rekonstruktionstechnik hängt von der Länge des Zwischenraums zwischen den Nervenenden nach Entfernung von irreversibel geschädigtem Gewebe und terminalen Neuromen ab. Bei einem kurzen Spalt wird eine „End-zu-End“-Anastomose bevorzugt, da eine erhebliche Spannung auf die genähten Nervenstümpfe vermieden werden kann. Bei großen Lücken ist die Überbrückung mit einem Nerventransplantat zur Erzielung einer Anastomose „proximales Nervenende – Transplantat – distales Nervenende“ die Technik der Wahl. Für dieses letztere Verfahren wird üblicherweise Gewebe von kleineren oberflächlichen sensorischen Nerven, wie dem Suralnerv oder den medialen brachialen und antebrachialen Hautnerven, entnommen. Für die Anastomose werden sehr dünne Nähte verwendet, die innerhalb des äußeren und interfaszikulären Epineuriums platziert werden. Sie sind im US gut als helle echoreiche Flecken innerhalb der Nervensubstanz zu erkennen und sollten nicht mit pathologischen Befunden wie Verkalkungen in granulomatösem Gewebe verwechselt werden (Abb.. 15). In der rekonstruktiven Nervenchirurgie ermöglicht der Ultraschall eine zuverlässige postoperative Beurteilung der Kontinuität des Nervs an der Anastomose und kann perineurale Ansammlungen ausschließen. Eine leichte und spindelförmige Zunahme der Nervengröße auf der Nahtebene ist ein normaler Befund. Dagegen ist eine ausgeprägte unregelmäßige Vorwölbung von echoarmem Gewebe an der Anastomose, möglicherweise unter Beteiligung einer Seite des Nervs, als pathologisches Zeichen zu werten, das auf eine unzureichende Fusion der Nervenränder und eine postoperative Neurombildung hinweist (Graif et al. 1991; Peer et al . 2001). Übermäßige Spannung an den Nervenkanten und Infektionen sind mögliche Ursachen für eine fehlerhafte Anastomose. In diesem klinischen Umfeld kann der US die Einschränkungen der Elektrodiagnostik und der klinischen Untersuchung kompensieren, indem er zuverlässige Informationen über die Größe, das Ausmaß und die Lokalisation postoperativer Narben und Neurome im Hinblick auf weitere chirurgische Eingriffe liefert (Peer et al. 2003).
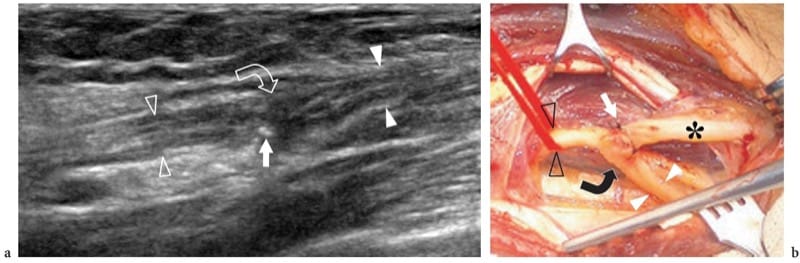
Abbildung 15. a,b. Nervenrekonstruktive Chirurgie. Bei diesem 62-jährigen Mann wurde der N. medianus am Unterarm aufgrund einer Einkapselung durch ein Weichteilsarkom amputiert. Während der proximale Nervenstumpf in den M. flexor digitorum superficialis implantiert wurde, wurde der distale Stumpf mit dem N. ulnaris durch eine endständige laterale Naht anastomosiert. Nach der Operation kam es zu einer teilweisen Wiederherstellung der N. medianus-Funktion. a Langachsiges 17–5-MHz-US-Bild über der Anastomose mit b korrelativer chirurgischer Ansicht zeigt den distalen Stumpf des N. medianus (weiße Pfeilspitzen), der mit dem N. ulnaris (offene Pfeilspitzen) vernäht ist. Beachten Sie eine gewisse spindelförmige Verdickung des Nervs an der Stelle der Anastomose (gekrümmter Pfeil) mit einigen feinen Stichen (gerader Pfeil), die als winzige echoreiche punktartige Strukturen an der Oberfläche des Nervs erscheinen. Sternchen, N. ulnaris distal der Anastomose.
Zusätzlich zu primären (traumabedingten, neurolysebedingten) Ursachen kann eine Narbenbildung nach Operationen auftreten, die nicht primär auf den Nerv gerichtet waren (z. B. Frakturreparatur, Gefäßchirurgie usw.). Narbengewebe kann den Nerv als Ganzes umhüllen oder an seiner Oberfläche anhaften (Abb.. 16). Der Nerv erscheint innerhalb der Narbe abgeflacht und nicht unterscheidbar oder kann an seiner Peripherie mit reaktiver fokaler Schwellung im Zusammenhang mit Ödemen und venöser Stauung verzerrt sein (Abb. 16c,h). Unter diesen Umständen kann die Nervenvernarbung zu anhaltenden Schmerzen und einer verzögerten Wiederherstellung der Nervenfunktion führen, da der Nerv ständig gezogen wird und die Fähigkeit zur Längstranslation während der Gelenkbewegungen eingeschränkt ist. Im postoperativen Setting wurde über US-Befunde zufälliger iatrogener Verletzungen peripherer Nerven an den N. radialis, femoralis, akzessorisch und Ischias berichtet (Graif et al. 1991; Peer et al. 2001; Bodner et al. 2002a; Gruber et al . 2003).
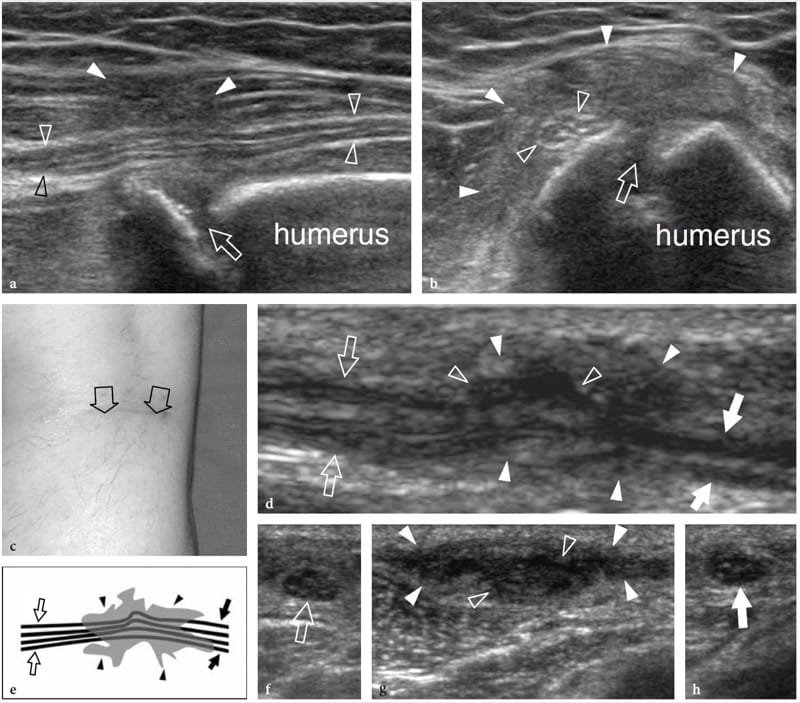
Abbildung 16. a–h. Postoperative Umhüllung von Nerven durch Narbengewebe. Zwei verschiedene Fälle. a,b N. radialis, vergraben in einem fibrösen Kallus nach Reparatur einer Humerusschaftfraktur. a Längsachsen- und b Kurzachsen-US-Bilder mit 17–5 MHz zeigen eine fokale Umhüllung des N. radialis (offene Pfeilspitzen) durch eine schlecht definierte echoarme Masse (weiße Pfeilspitzen), die sich über der Frakturstelle (Pfeil) entwickelt und die Bildung von Fibrösem widerspiegelt Kallus. Die faszikuläre Echotextur des Nervs bleibt im Kallus erhalten. Der Patient unterzog sich einem zweiten chirurgischen Eingriff, um den Nerv von der Hornhaut zu befreien. c–h N. peronaeus in einer Narbe eingeschlossen nach chirurgischem Strippen der V. saphena. c Foto zeigt den chirurgischen Zugang. d 12–5 MHz-Langachsen-US-Bild des N. peroneus (Pfeile) mit e schematischer Zeichnungskorrelation zeigt Verzerrung und Einklemmen der Nervenfaszikel (offene Pfeilspitzen) durch echoarmes Narbengewebe (weiße Pfeilspitzen). f–h Kurzachsige 12–5-MHz-US-Bilder, die von f proximal nach h distal aufgenommen wurden, zeigen den normalen N. peroneus (offener Pfeil), der innerhalb der Narbe (weiße Pfeilspitzen) und dann nicht mehr zu unterscheiden ist (offene Pfeilspitzen) und dann so bleibt (weißer Pfeil). verlässt die Narbe, um zu einem normalen Aussehen zurückzukehren.
14. RHEUMATOLOGISCHE UND INFEKTIONELLE ERKRANKUNGEN
Bei mehreren rheumatologischen Erkrankungen, wie z. B. rheumatoider Arthritis, Polyarteritis nodosa, Wegener-Granulomatose und Churg-Strauss- und Sjögren-Syndrom, ist eines der klinischen Kennzeichen der Vaskulitis das Auftreten neurologischer Befunde (Lanzillo et al. 1998; Rosenbaum 2001). Aus pathophysiologischer Sicht betrifft die Vaskulitis-assoziierte Neuropathie große Nervenstämme, die eine multifokale Degeneration von Fasern als Folge einer nekrotisierenden Angiopathie kleiner Nervenarterien, einer sogenannten multiplen Mononeuropathie, hervorrufen (Said und Lacroix 2005). Bei diesen Patienten korreliert die Neuropathie nicht mit Krankheitsparametern wie Krankheitsaktivität, Rheumafaktor und funktionellen und radiologischen Scores, und es kommt zu einer sequentiellen Beteiligung einzelner Nerven sowohl zeitlich als auch anatomisch (Nadkar et al. 2001). Die Nervenleitungsgeschwindigkeiten sind normalerweise nicht deutlich vom Normalwert herabgesetzt, vorausgesetzt, dass die Amplitude des zusammengesetzten Nerven- oder Muskelaktionspotentials nicht stark herabgesetzt ist (Sivri und Guler-Uysal 1998). Obwohl multiple Mononeuropathie die häufigste Manifestation ist, können Nerveneinklemmungssyndrome auch an Stellen auftreten, an denen Nerven in unmittelbarer Nähe entweder eines Synovialgelenks (d. h. Kubitaltunnel, Tarsaltunnel, Guyon-Tunnel) oder einer oder mehrerer synovialer Sehnen (d. h , Beugesehnen am Karpaltunnel, Flexor hallucis longus am Tarsaltunnel) oder paraartikuläre Schleimbeutel (dh Schleimbeutel iliopsoas an der Hüfte). Da die klinische Beurteilung der Nerven bei diesen Patienten oft durch gleichzeitig auftretende Symptome aufgrund einer Gelenkbeteiligung eingeschränkt ist, kann die US-Bildgebung dazu beitragen, Einklemmungsneuropathien im Zusammenhang mit Gelenkstörungen, Ergüssen und synovialem Pannus von Nicht-Einklemmungsneuropathie zu unterscheiden. Dies beruht auf der Tatsache, dass die multiple Mononeuropathie nicht zu einer veränderten Morphologie des betroffenen Nervs führt, während dies bei Einklemmneuropathien der Fall ist.
15. Lepra
Lepra (Hansen-Krankheit) ist eine durch Mycobacterium leprae verursachte chronische Infektionskrankheit, die in ihren vielfältigen klinischen Formen Haut und Nerven befällt (Abb. 17a). Obwohl Lepra in der westlichen Welt fast nur bei Einwanderern auftritt, ist sie in Entwicklungsländern (Tropen und Subtropen) mit 12 Millionen Betroffenen endemisch; sie stellt damit die am weitesten verbreitete Neuropathie der Welt dar. Lepra wird wahrscheinlich durch Tröpfcheninfektion übertragen, aber ein längerer häuslicher Kontakt ist erforderlich und die meisten Menschen sind nicht anfällig für die Krankheit. Aus klinischer Sicht kann Lepra in zwei polare Formen eingeteilt werden – tuberkuloid und lepromatös – zwischen denen Grenzformen ein intermediäres Spektrum an Phänotypen aufweisen (Ridley und Jopling 1966). Bei tuberkuloider Lepra kommt es zu einer intensiven Immunantwort: Aggressive Infiltration von Epithelioid- und Lymphoidzellen in den Nerv verursacht eine Verdickung des Epineuriums und Perineuriums und die Zerstörung von Faszikeln. Beim lepromatösen Typ ist die Immunantwort träge und es kommt zu einer aktiven Proliferation von Bazillen: Diese Form zeigt eine bessere Erhaltung der Nervenarchitektur. Der Übergang zu einer Form der Lepra mit höherer Resistenz kann Episoden einer akuten Neuritis hervorrufen, wie die sogenannte „Umkehrreaktion“ und „Erythema nodosum leprosum“. Während dieser Phasen kann ein Nervensegment sehr schmerzhaft und empfindlich werden. Wenn die Krankheit fortschreitet, tragen nachfolgende Neuritis-Episoden zu dem Defizit bei, bis der betroffene Nerv vollständig zerstört sein kann. Sensorische Anomalien gehen normalerweise einer Lähmung voraus. Das erste Symptom einer Nervenbeteiligung ist ein Sensibilitätsverlust, der die Häufigkeit kleinerer Traumata erhöht, was zu Infektionen und schließlich zu verstümmelnden Verletzungen und Blindheit führt. Die bevorzugten Stellen der Nervenschwellung bei Lepra ähneln denen der Engpassneuropathie (d. h. der Kubitaltunnel für den N. ulnaris, der Karpaltunnel für den N. medianus, der Wadenbeinhals für den N. peroneus communis, der Tarsaltunnel für den N. tibialis). ). Im Vergleich zu einem chronisch komprimierten Nerv ist die Nervenvergrößerung jedoch umfangreicher und weniger umschrieben. Bei Leprapatienten ist der Ultraschall in der Lage, Nervenanomalien aufzudecken, einschließlich Nervenschwellungen, echoarme Veränderungen im Epineurium und Verlust der faszikulären Echotextur (Fig. 17b, c) (Martinoli et al. 2000c). Diese Veränderungen erfordern mehrere Episoden von lepromatösen Reaktionen und einen kumulativen Effekt mit der Zeit, um bei US sichtbar zu werden. Tatsächlich korreliert die Nervenvergrößerung gut mit Patienten, bei denen zuvor Umkehrreaktionen aufgetreten waren (Martinoli et al. 2000c). Im Verlauf einer Umkehrreaktion ist das betroffene Nervensegment deutlich verdickt, stark schmerzhaft und druckempfindlich (Fornage und Nerot 1987; Martinoli et al. 2000c). Das Einsetzen dieser Reaktionen kann durch ein intraneurales hyperämisches Muster in der Farb- und Power-Doppler-Bildgebung angezeigt werden (Abb. 17d-h) (Martinoli et al. 2000c). Diese Anzeichen deuten auf ein schnelles Fortschreiten der Nervenschädigung und eine schlechte Prognose hin, sofern nicht mit einer Antireaktionsbehandlung begonnen wird (Martinoli et al. 2000c). Seltener können „kalte“ Weichteilabszesse gesehen werden, die vom betroffenen Nerv ausgehen und sich über die Faszienebenen der Gliedmaßen und Extremitäten ausbreiten (Abb.. 18).
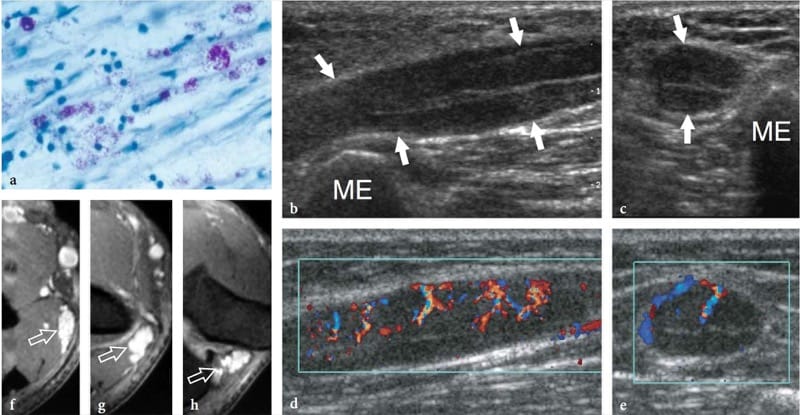
Abbildung 17. a–h. Umkehrreaktion bei Lepra. a Mikroskopische Ansicht des N. suralis bei einem 25-jährigen Patienten mit Lepra zeigt das Vorhandensein von Mykobakterien (lila) im Nervengewebe. Ziehl-Nielsen-Färbung; Originalvergrößerung ×800. b–h N. ulnaris rechts eines 22-jährigen Mannes mit grenzwertiger tuberkuloider Lepra, untersucht am Ellbogen im Verlauf einer Umkehrreaktion. b Langachsen- und c Kurzachsen-Graustufen-US-Bilder von 12–5 MHz zeigen eine hochgradige Schwellung des Nervs (Pfeile) mit glatter spindelförmiger Vergrößerung einzelner Faszikel. ME, medialer Epikondylus. Entsprechende d-Langachsen- und e-Kurzachsen-Farbdoppler-12–5-MHz-US-Bilder zeigen einen dramatisch erhöhten Blutfluss in endoneuralen Gefäßen. f–h Sequenz von Gd-verstärkten fettunterdrückten MR-Bildern von kranial nach kaudal durch den medialen Ellbogen zeigt eine deutliche Kontrastverstärkung in den Nerv hinein (Pfeil).
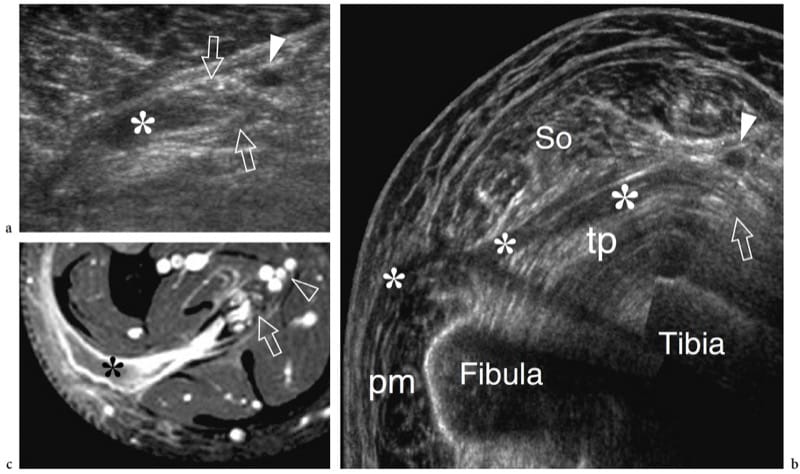
Abbildung 18. a–c. Neurogener Abszess bei Lepra. a Transversaler Scan und b 12–5 MHz US-Bilder mit erweitertem Sichtfeld über dem Nervus tibialis (Pfeile) im mittleren distalen Drittel des Beins zeigen eine Flüssigkeitsansammlung (Sternchen), die aus der Nervensubstanz stammt und sich entlang der Faszien ausbreitet Ebenen, tief bis zum Soleus-Muskel (So) und oberflächlich bis zum Tibialis posterior (tp) und den Peroneals (pm). c Korrelatives Gd-verstärktes fettunterdrücktes MRT-Bild zeigt eine diskrete Kontrastverstärkung in den Abszesswänden. Beachten Sie den Ursprung des Abszesses vom Nerv. Pfeilspitze, hintere Schienbeingefäße. Aspiration von Flüssigkeit zeigte aseptisches nekrotisches Material.
16. TUMOREN UND TUMORÄHNLICHE ZUSTÄNDE
Zu den peripheren Nerventumoren gehören zwei gutartige Hauptformen – das Schwannom (auch als Neurinom oder Neurilemmom bezeichnet) und das Neurofibrom sowie der bösartige periphere Nervenscheidentumor, der am häufigsten aus der bösartigen (sarkomatösen) Transformation eines Neurofibroms entsteht (Murphey et al. 1999). Darüber hinaus können sich gelegentlich andere Raumforderungen wie Hämangiome, Lymphome und Ganglienzysten innerhalb des Nervs entwickeln, die die Faszikel durchtrennen und sich innerhalb des neuralen Gewebes ausdehnen. Das Auftreten dieser Massen ist selten, aber sie können Nervenfunktionsstörungen und lokale Symptome verursachen und sollten nicht mit den häufigeren Nervenscheidentumoren verwechselt werden. Schließlich kann eine Vielzahl von extrinsischen Weichteilneoplasmen, sowohl gutartig mit aggressivem Verhalten als auch bösartig, während ihrer lokalen Ausbreitung einen Nerv betreffen.
17. TUMOREN DER PERIPHEREN NERVENHÜLLE
Periphere Nervenscheidentumoren stammen von Schwann-Zellen ab. Schmerzen und neurologische Symptome sind ungewöhnlich, außer bei großen Tumoren (Murphey et al. 1999; Reynolds et al. 2004). Im Allgemeinen basiert die US-Diagnose dieser Tumoren auf der Darstellung einer soliden echoarmen Masse in direkter Kontinuität mit einem Nerv an seinem proximalen und distalen Pol (Fornage 1988; Beggs 1999; Martinoli et al. 2000a; Lin und Martel 2001; Reynolds et Al. 2004). Die Erkennung der Verbindung zwischen dem Tumor und dem Ursprungsnerv erfordert ein sorgfältiges Scannen, da die Nervenenden verzerrt und über die Masse gedehnt werden können. Außerdem kann der Nervenursprung einer Masse, die von einem kleinen Nerv (bestehend aus einem einzelnen echoarmen Faszikel) ausgeht, möglicherweise nicht zuverlässig beurteilt werden: Dies kann insbesondere bei oberflächlich sitzenden Läsionen der Fall sein. Einige unterschiedliche Merkmale wurden zwischen Tumorhistotypen und insbesondere zwischen Schwannomen und Neurofibromen beschrieben.
Schwannome sind langsam wachsende bekapselte Tumore, die häufiger an den Extremitäten zu finden sind. Sie bestehen aus neoplastischen Zellen, die die ultrastrukturellen Eigenschaften und den antigenen Phänotyp von Schwann-Zellen aufweisen, aber keine Axone enthalten (Woodruff 1993). Die meisten erscheinen als einzelne globoide Massen, die sich entlang eines Nervs und exzentrisch zur Nervenachse befinden, mit homogen echoarmer Echotextur, posteriorer akustischer Verstärkung und einem hypervaskulären Muster in der Farb- und Power-Doppler-Bildgebung (Abb. 19a, b) (Fornage 1988; Beggs 1999; Martinoli et al. 2000a; Lin und Martel 2001; Reynolds et al. 2004). Gelegentlich können intratumorale zystische Veränderungen im Zusammenhang mit einer Ansammlung von myxoider Matrix (zystisches Schwannom) und Verkalkungen (altes Schwannom) erkannt werden (Abb.. 20) (Isobe et al. 2004). Die Unterscheidung zwischen zystischen Schwannomen und intraneuralen Ganglien kann durch die charakteristische Lage der letzteren erleichtert werden (siehe unten). Bei Schwannomen kann das proximale Nervenende außerhalb des Tumors verdickt und echoarm erscheinen, wobei das faszikuläre Muster verloren geht, wodurch die ovale Masse sich verjüngt. Dies kann sogar für ein langes Nervensegment geschätzt werden und scheint zumindest teilweise die Infiltration von Tumorzellen entlang der Faszikel widerzuspiegeln (Graif M., unveröffentlichte Daten). Solche Anomalien sind normalerweise nicht am distalen Ende des betroffenen Nervs zu sehen. Darüber hinaus können sich Schwannome aus einem einzelnen Faszikel entwickeln, das auch in einiger Entfernung von der Masse diffus verdickt erscheint, während die anderen Fasern desselben Nervs durch die Masse des Tumors verdrängt werden, aber hinsichtlich Größe und Echotextur unbeeinflusst bleiben (Feige. 21a). Dies kann erklären, warum einige Schwannome eine zentrale Kontinuität mit der Längsachse des Nervs zu haben scheinen.
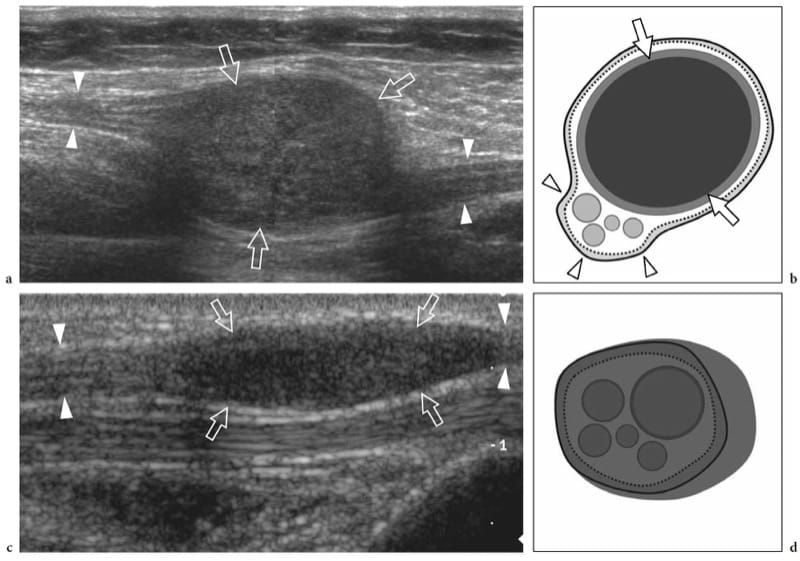
Abbildung 19. a–d. Periphere Nervenscheidentumoren. a,b Schwannom des N. tibialis am hinteren Bein. a Langachsen-Graustufen-US-Bild mit 12–5 MHz und b Schemazeichnungskorrelation zeigt den Tumor als globoide echoarme Masse (Pfeile), die sich exzentrisch an der Peripherie des Nervs entwickelt (Pfeilspitzen). c,d Neurofibrom des N. medianus am distalen Unterarm. c Langachsen-Graustufen-US-Bild mit 12–5 MHz und d Schemazeichnungskorrelation zeigt den Tumor als eine echoarme spindelförmige Masse (Pfeile), die sich innerhalb des Nervs ausdehnt und die Faszikel (Pfeilspitzen) einbezieht. Es wird eine fokale Vergrößerung des Nervs und ein Verschwinden des faszikulären Musters beobachtet.
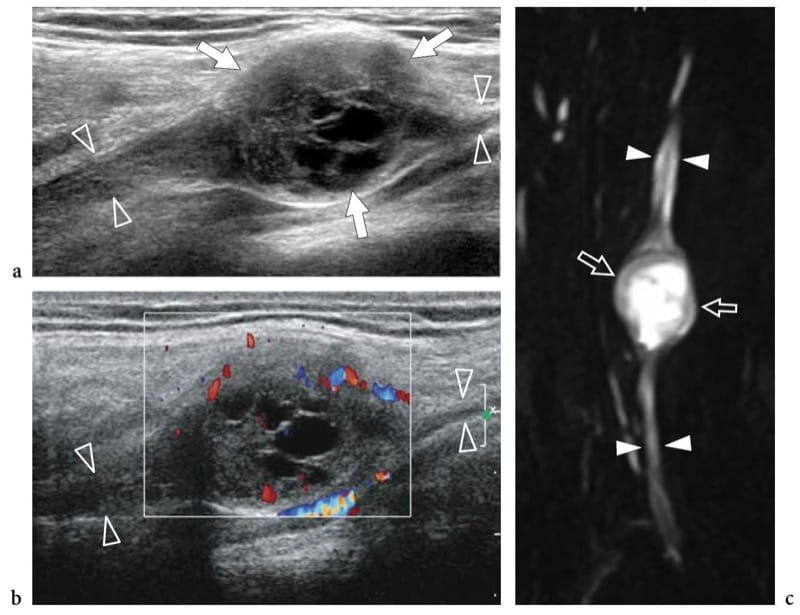
Abbildung 20. a–c. Zystisches Schwannom. a,b Langachse a Graustufen- und b Farbdoppler 12–5 MHz US-Bilder über dem N. radialis (Pfeilspitzen) am Arm mit c MR-neurographischer Korrelation zeigen eine abgerundete Raumforderung (Pfeile) mit intratumoralen zystischen Veränderungen, bezogen auf Ansammlung myxoider Matrix in Kontinuität mit dem Elternnerv (Pfeilspitzen). Der Tumor zeigt ein hypervaskuläres Muster aus peripheren und zentralen Farbdopplersignalen.
Neurofibrome hingegen sind eng mit dem übergeordneten Nerv verbunden und entwickeln sich spindelförmig (nicht globoid), wobei der Nerv an den Extremitäten der Läsion eintritt und aus ihnen austritt (Fig. 19c, d) (King et al. 1997; Lin und Martel 2001). Histopathologisch bestehen sie aus einer Mischung von Zelltypen, von denen der vorherrschende Eigenschaften der perineuralen Zellen aufweist. Wenn die proliferativen Zellen eines Neurofibroms wachsen, breiten sie sich durch das Epineurium in das umgebende Weichgewebe aus. Neurofibrome können in drei Formen eingeteilt werden: lokalisiert, diffus und plexiform (assoziiert mit Typ-1-Neurofibromatose). Die lokalisierte Variante ist die häufigste und macht etwa 90 % der Fälle aus (Murphey et al. 1999). Oft findet sich in diesen Tumoren ein Zielzeichen, das durch eine subtile zentrale echoreiche Region innerhalb der echoarmen Masse gebildet wird und einen zentralen fibrotischen Fokus widerspiegelt, der von peripherem myxomatösem Gewebe umgeben ist (Abb. 21b–d) (Lin et al. 1999). Neurofibrome sind in der Farb- und Power-Doppler-Bildgebung weniger hypervaskulär als Schwannome. Im Gegensatz zu lokalisierten Neurofibromen betreffen diffuse Neurofibrome hauptsächlich die Haut und das Unterhautgewebe und zeigen sich als Plaque-artige Erhebung der Haut mit Verdickung des Unterhautgewebes (Abb. 22a, b) (Murphey et al. 1999).
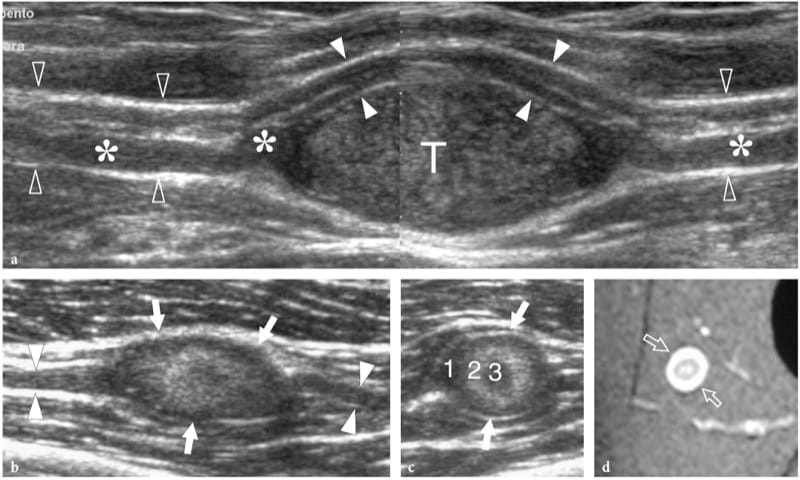
Abbildung 21. a–d. Periphere Nervenscheidentumoren: eigenartige US-Befunde. Zwei verschiedene Fälle. a Schwannom des Nervus medianus am Sulcus bicipitalis. Das 12–5-MHz-US-Langachsenbild zeigt den Tumor (T) als exzentrische echoarme Masse in Kontinuität mit dem Nerv (offene Pfeilspitzen). An seinem proximalen und distalen Ende ist der Tumor mit einem geschwollenen Faszikel (Sternchen) verbunden, während die anderen Faszikel (weiße Pfeilspitzen) unberührt bleiben und an der Peripherie der Masse verschoben sind. Es wurde ein Bild mit geteiltem Bildschirm verwendet, wobei die beiden Bildschirme für ein erweitertes Sichtfeld ausgerichtet waren. b–d Neurofibrom. b Langachsen- und c Kurzachsen-US-Bilder mit 12–5 MHz eines kleinen Neurofibroms im Oberschenkel mit d fettunterdrückter T2-gewichteter MR-Bildgebungskorrelation zeigen eine gut abgegrenzte ovale Masse (Pfeile) in Kontinuität mit dem N. femorocutaneus posterior (Pfeilspitzen). Der Tumor ist durch konzentrische echoarme und echoreiche Schichten (1, 2, 3) gekennzeichnet, die mit dem sonographischen Zielzeichen übereinstimmen.
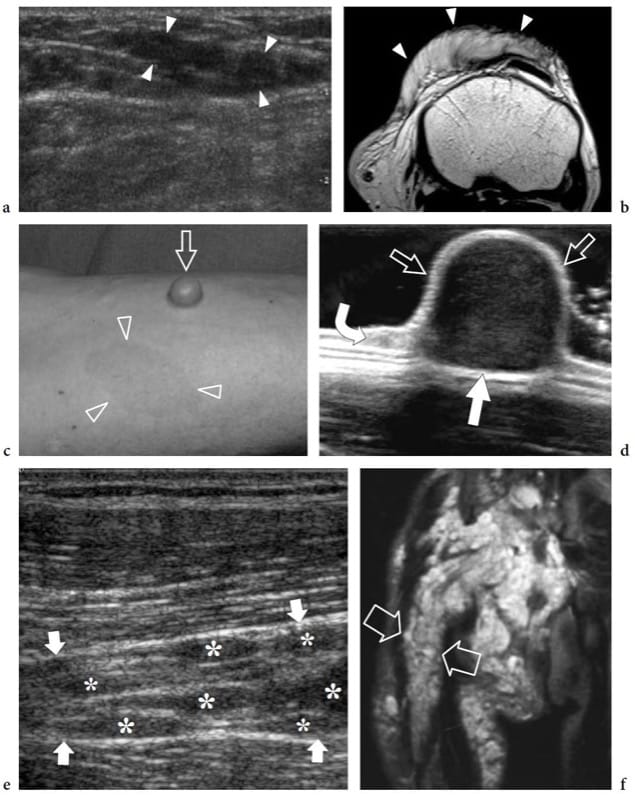
Abbildung 22. a–f. Neurofibrom: Spektrum der US-Auftritte. Drei verschiedene Fälle. a,b Diffuses Neurofibrom. a Transversale 12–5 MHz US- und b T1-gewichtete MRT-Bilder der suprapatellaren Region bei einem 10-jährigen Kind ohne Neurofibromatose zeigen eine schlecht definierte infiltrative Masse (Pfeilspitzen), die sich entlang des subkutanen Gewebes des vorderen Knies erstreckt. c,d Sitzendes Neurofibrom. c Fotografie des rechten Unterarms eines 43-jährigen Mannes mit Neurofibromatose zeigt ein sessiles kutanes Neurofibrom (Pfeil) verbunden mit Café-au-lait-Flecken (Pfeilspitzen). d Das 17–5-MHz-US-Bild zeigt das sessile Neurofibrom als eine oberflächliche solide echoarme Masse (gerade Pfeile), die aus der Dermis (gekrümmter Pfeil) entsteht. e–f Plexiforme Neurofibrome. e Längsachsen-12–5-MHz-US-Bild über dem Ischiasnerv bei einem 8-jährigen Kind mit intra- und extraabdomineller Neurofibromatose zeigt multiple Neurofibrome (Sternchen), die von einzelnen Faszikeln des Ischiasnervs (Pfeile) ausgehen. f Koronares T2-gewichtetes MRT-Bild des Beckens und des proximalen Oberschenkels zeigt unzählige Neurofibrome im Verlauf eines verdickten und hyperintensen Ischiasnervs (Pfeile).
Beim bösartigen peripheren Nervenscheidentumor sind die einzigen Befunde, die den Untersucher vermuten lassen, dass ein Nerventumor bösartig ist, eine plötzliche Größenzunahme eines zuvor stabilen Knotens und das Vorhandensein undeutlicher Ränder und Verwachsungen der Masse mit umgebendem Gewebe. Besonders bei Patienten mit Typ-1-Neurofibromatose weist ein sich schnell vergrößernder Knoten auf die Notwendigkeit einer sofortigen Biopsie hin.
Trotz dieser Unterschiede kann der Ultraschall nicht zwischen Schwannomen, Neurofibromen und malignen peripheren Nervenscheidentumoren unterscheiden (Lin und Martel 2001; Reynolds et al. 2004). Der US kann zur präoperativen Beurteilung des Krankheitsausmaßes beitragen, indem er die Beziehung des Tumors zu angrenzenden neurovaskulären Strukturen und umgebenden Muskeln definiert und auch die chirurgische Planung unterstützt. Nach bildgebender Beurteilung kann eine Feinnadel-Aspirationsbiopsie der Masse sicher unter US-Anleitung durchgeführt werden. Während der Biopsie werden häufig quälende Schmerzen durch das Einstechen der Nadel ausgelöst. Aus chirurgischer Sicht können Schwannome geschält werden, wobei die Nervenkontinuität und -funktion erhalten bleiben (Murphey et al. 1999). Postoperativ ist im US fast immer eine echoarme Restverdickung des Nervs an der Stelle der Tumorresektion zu sehen, die als Normalbefund gewertet werden sollte (Abb.. 23). Rezidive sind ungewöhnlich. Im Gegensatz dazu muss bei der chirurgischen Resektion von Neurofibromen der übergeordnete Nerv geopfert werden, da die Masse nicht von den Nervenfaszikeln getrennt werden kann und eine anschließende Nerventransplantation erforderlich ist, um die Funktion zu erhalten und wiederherzustellen. Obwohl ein chirurgisches Management bei kutanen Neurofibromen akzeptabel sein kann, werden tief sitzende Läsionen normalerweise konservativ behandelt, um funktionelle Defizite zu vermeiden.
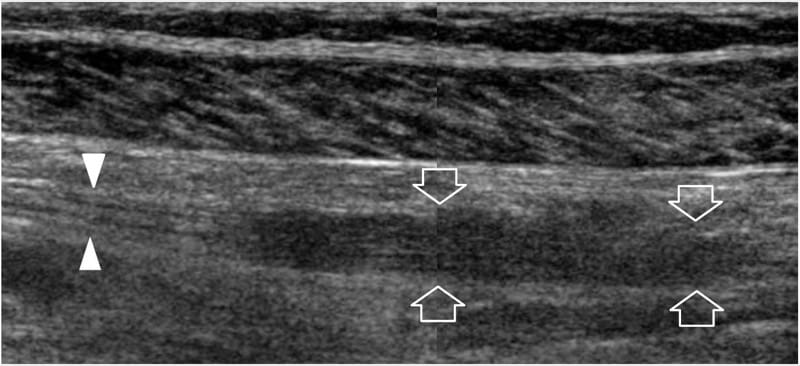
Abbildung 23. Periphere Nervenscheidentumoren: postoperative Befunde. Langachsiges 12–5-MHz-US-Bild über dem Schienbeinnerv (Pfeilspitzen) in der Mitte des hinteren Beins einer 48-jährigen Frau, die zuvor wegen eines Schwannoms operiert wurde, zeigt eine echoarme Restverdickung (Pfeile) des Nervs an der Stelle des Tumorresektion mit Verlust der faszikulären Echotextur. Dieser Befund war nach 3 Jahren Follow-up stabil. Es wurde ein Bild mit geteiltem Bildschirm verwendet, wobei die beiden Bildschirme für ein erweitertes Sichtfeld ausgerichtet waren.
Typ-1-Neurofibromatose (von Recklinghausen-Krankheit), eine relativ häufige (1:2500–3000 Geburten) autosomal-dominant vererbte Krankheit, die mit einer Veränderung eines Gens auf Chromosom 17 zusammenhängt, weist die typische klinische Trias von Hautläsionen auf (Café-au- Milchflecken), Skelettdeformitäten (Skoliose) und geistige Schwäche. Eine weit verbreitete Beteiligung durch Neurofibrome der lokalisierten, diffusen und plexiformen Art tritt bei Tumoren auf, die von kleinen Hautnerven und großen tiefliegenden Nerven ausgehen. Bei der Neurofibromatose betreffen lokalisierte Neurofibrome häufig die Dermis und das Unterhautgewebe: Wenn sie gestielt sind, werden sie als „Fibrom molluscum“ bezeichnet (Fig. 22c, d) (Murphey et al. 1999). Bei der plexiformen (multinodulären) Neurofibromatose – der pathognomonischen Form der Erkrankung – entstehen aus den Faszikeln eines großen Nervenstammes, der typischerweise über ein langes Segment mit seinen Ästen befallen ist, unzählige Neurofibrome, die zum sogenannten „bag-of“ führen -Würmer“ Aussehen des betroffenen Nervs bei grober Inspektion und US-Bildgebung, das aus der diffusen gewundenen Nervenverdickung resultiert (Feigen. 22e, f, 24) (Murphey et al. 1999). Eine entstellende Riesenvergrößerung der Extremitäten kann damit einhergehen, die sogenannte Elephantiasis neuromatosa (Murphey et al. 1999). Plexiforme Neurofibrome sind nicht von den selteneren plexiformen Schwannomen zu unterscheiden, die sporadisch bei Kindern und jungen Erwachsenen auftreten: Letztere sind nicht mit einer Typ-1-Neurofibromatose assoziiert und unterliegen keiner bösartigen Transformation (Abb.. 25) (Ikushima et al. 1999; Katsumi et al. 2003).
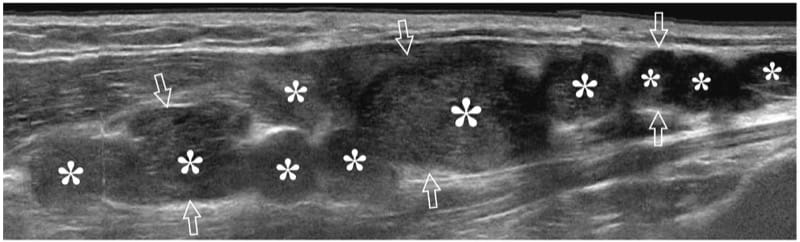
Abbildung 24. Plexiforme Neurofibromatose. Längsachsen-US-Bild mit erweitertem Sichtfeld bei 17–5 MHz über dem Nervus medianus (Pfeile) am Unterarm eines Patienten mit Neurofibromatose zeigt mehrere plexiforme Neurofibrome (Sternchen), von denen einige einen zentralen echoreichen Bereich aufweisen, der das Ziel darstellt Zeichen. Der N. medianus ist deutlich vergrößert und zeigt ein verschlungenes multinoduläres Aussehen.
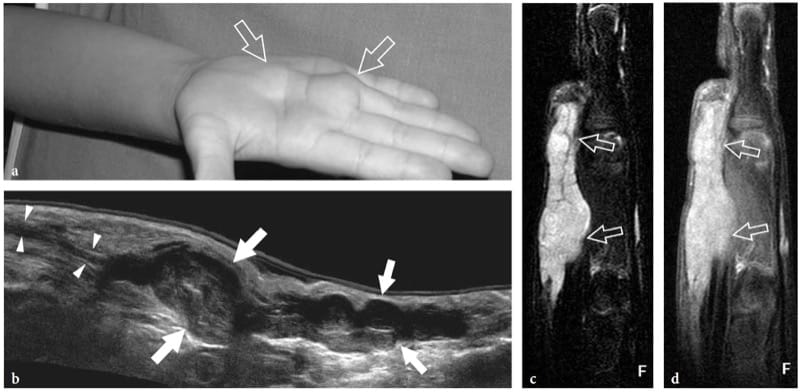
Abbildung 25. a–d. Plexiformes Schwannom. a Fotografie der rechten Hand eines 4-jährigen Kindes mit einer länglichen tastbaren Beule (Pfeile) auf der Handfläche, die zwischen dem dritten und vierten Mittelhandknochen wächst. b 17–5-MHz-US-Bild mit erweitertem Sichtfeld, ausgerichtet entlang der Längsachse des Knotens, mit fettunterdrückter c T2-gewichteter und d Postkontrast-GRE T1-gewichteter MR-Bildgebungskorrelation zeigt eine multinoduläre echoarme Raumforderung (Pfeile). von geschwollenen gewundenen Faszikeln, die vom N. medianus (Pfeilspitzen) ausgehen und sich distal verzweigen. Der Tumor erscheint in T2 und nach Gadoliniumgabe hyperintens.
18. HÄMANGIOMA UND NON-HODGKIN-LYMPHOM
Nervenhämangiome sind äußerst seltene Tumoren, die aus der Endothelschicht des Endoneuriums entstehen, aus dem neue Gefäße entstehen oder sich in Nerven aus dem perineuralen Gewebe einfalten. Die meisten werden bei Kindern und jungen Patienten erkannt; es gibt keine Geschlechtsprävalenz. Die Tumoren neigen dazu, sich mit dem Alter oder aufgrund stimulierender Faktoren wie Trauma zu vergrößern (Bilge et al. 1989). Nervenhämangiome haben eine Vorliebe für den Nervus medianus; Zur Erklärung dieser Prävalenz wurde eine persistierende Mittelarterie vorgeschlagen (Prosser und Burke 1987). Klinische Befunde umfassen eine tastbare Nervenschwellung am distalen Unterarm mit oder ohne Symptome eines Karpaltunnelsyndroms. US zeigt einen deutlich geschwollenen Nervus medianus, der große, mit intraneuraler Flüssigkeit gefüllte Räume enthält, die die Faszikel trennen (Abb.. 26). Typischerweise sind diese echofreien Räume entsprechend der Längsachse des Nervs orientiert und mit dem Wandler komprimierbar. Farb- und Power-Doppler-Bildgebung zeigen langsam fließendes Blut in ihnen (Abb. 26c). Venöse Wellenformen sind bei der Spektral-Doppler-Analyse vorherrschend. Die chirurgische Neurolyse von Nervenhämangiomen wird nicht empfohlen, da intraneurale Gefäße Teil des „vasa nervorum“-Systems sind und aufgrund der vermischten Verteilung von Gefäßen mit Faszikeln. Bei symptomatischen Patienten kann zur Verbesserung der klinischen Symptome eine Karpaltunnelfreigabe durchgeführt werden.
Primäre Non-Hodgkin-Lymphome, die periphere Nerven betreffen, sind sehr selten. Die meisten betreffen den Ischiasnerv und sind das Ergebnis einer direkten Ausbreitung von benachbarten Tumoren (Roncaroli et al. 1997). Periphere Neuropathie kann auch ohne direkte Beteiligung des Nervs als paraneoplastische Manifestation lymphoproliferativer Erkrankungen gewürdigt werden. Histopathologisch zeigen die betroffenen Nerven eine ausgedehnte neoplastische Infiltration des Endoneuriums und Perineuriums. Die Nervenfaszikel sind durch diffuse Infiltrate neoplastischer lymphoider Zellen getrennt, die in einem verdickten Epineurium enthalten sind (Eusebi et al. 1990). US zeigt eine heterogene Nervenmasse mit Verzerrung und Schwellung der einzelnen Faszikel (Abb.. 27). Die Behandlung besteht in der Regel aus Chemo- und Strahlentherapie (Pillay et al. 1988).
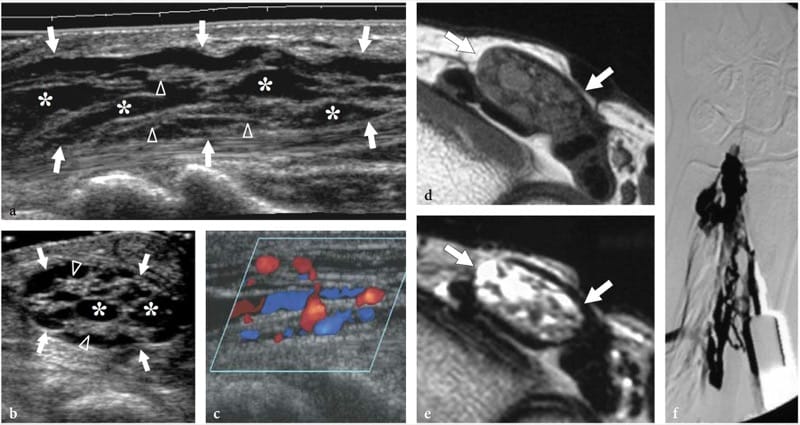
Abbildung 26. a–f. Hämangiom des Nervus medianus bei einer 40-jährigen Frau mit Karpaltunnelsyndrom und einem großen intramuskulären Hämangiom, das sich durch die Beugemuskeln des Unterarms bis zum Karpaltunnel erstreckt. Bei der Patientin wurde das Retinaculum gelöst und die Raumforderung teilweise reseziert, wobei der Musculus flexor digitorum superficialis entfernt wurde. a Längsachsen- und b Kurzachsen-US-Bilder mit 17–5 MHz, die am distalen Radius aufgenommen wurden, zeigen einen vergrößerten N. medianus (Pfeile) mit intranervösen abnormalen flüssigkeitsgefüllten Räumen (Sternchen), die entlang der Faszikel (Pfeilspitzen) verlaufen. c Längsfarbdoppler 12–5 MHz US-Bild zeigt langsam fließendes Blut in den intraneuralen Räumen, was auf ein Hämangiom hinweist. Gefäße sind komprimierbar und weisen venöse Wellenformen auf. d,e Korrelative transversale d T1-gewichtete und e T2-gewichtete MRT-Bilder zeigen eine erhöhte T2-Signalintensität im Epineurium, das die Faszikel des N. medianus umgibt (Pfeile), aufgrund des Vorhandenseins abnormaler Gefäße innerhalb der Nervensubstanz. f Die digitale Subtraktionsangiographie bestätigt das Vorhandensein eines venösen Netzwerks im N. medianus.
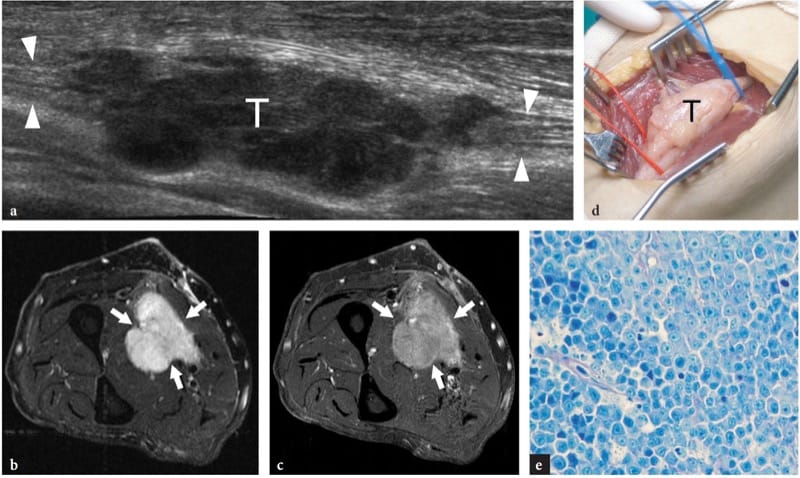
Abbildung 27. a–e. Primäres Non-Hodgkin-Lymphom des N. medianus bei einem 62-jährigen Mann mit einer langsam wachsenden schmerzlosen Weichteilmasse am mittleren Unterarm. a 17–5-MHz-US-Bild mit erweitertem Sichtfeld und transversaler fettunterdrückter b T2-gewichteter und c Gadolinium-verstärkter T1-gewichteter MR-Bildgebungskorrelation zeigt eine lobulierte multinoduläre echoarme Masse (T) in Kontinuität mit den Faszikeln des N. medianus (Pfeilspitzen), ein ganz anderes Erscheinungsbild als bei peripheren Nervenscheidentumoren. Der Tumor (Pfeile) erscheint in T2 und nach Gadoliniumgabe diffus hyperintens. d Die grobe chirurgische Ansicht bestätigt die neurogene Natur der Raumforderung (T). e Das histologische Präparat zeigt eine diffuse Beteiligung des Nervengewebes durch lymphoide Elemente. Originalvergrößerung ×800.
19. INTRANEURALE GANGLIEN
Die Inzidenz intraneuraler Ganglien ist relativ gering und betrifft am häufigsten den Nervus peroneus communis (Yamazaki et al. 1999). Dieser Nerv entspringt an der Spitze der Kniekehle vom Ischiasnerv und bewegt sich nach unten zum Fibulaköpfchen, wo er sich in seine beiden Endäste teilt: den tiefen und den oberflächlichen Nervus peroneus. Um den Wadenbeinhals gibt der N. peronaeus profundus einen kleinen wiederkehrenden Gelenkast ab, um die Kapsel des oberen Schienbeingelenks zu versorgen. Das Kapselende dieses kleinen Astes kann zur Entwicklung intraneuraler Ganglien führen (Spinner et al. 2003, 2005). Tatsächlich dient dieser Ast als Leitung für Zystenflüssigkeit, die vom Gelenkspalt in den Nerv gelangt (Spinner et al. 2003). Die Gelenkflüssigkeit durchtrennt das Epineurium zwischen den Faszikeln und bewegt sich in Richtung des tiefen Peroneusnervs, des N. peroneus communis und sogar des Ischiasnervs, wobei eine verlängerte intraneurale Zyste gebildet wird. Intraneurale Ganglien haben keine fibröse Kapsel oder Synovialauskleidung und müssen von den häufigeren extraneuralen Ganglien unterschieden werden. Als Verlängerung des oberen Tibiofibulargelenks erscheinen sie als spindelförmige zystische Massen, die in der Nervenscheide enthalten sind und in den Raum zwischen dem Epineurium und den Nervenfaszikeln wachsen (Martinoli et al. 2000b).
20. NERVENUMHÄLTUNG DURCH EXTRINISCHE NEOPLASMEN
Extrinsische Weichteiltumoren können durch Kontiguität normale Nerven betreffen. Sie können entweder den Nerv an der Peripherie der Raumforderung ohne infiltrative Zeichen verschieben und komprimieren oder den Nerv inkorporieren. In erster Linie kann die Integrität des Nervs bei der Operation nach Entfernung oder Debulking der Masse erhalten werden. Bei letzterem muss der chirurgische Eingriff den umhüllten Nerv zusammen mit dem Tumor opfern (Abb.. 28). US kann helfen, das Ausmaß des Tumors präoperativ zu beurteilen und die genaue Beziehung der Masse zum Nerv und seinen Teilungsästen zu definieren (Abb.. 29).
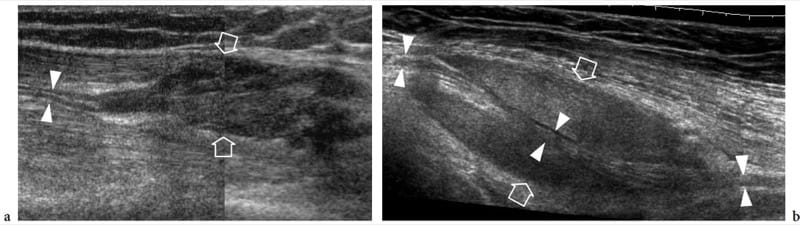
Abbildung 28. a,b. Nervenbeteiligung durch extrinsische Tumoren. Zwei verschiedene Fälle. a 12–5-MHz-US-Längsbild über dem lateralen Knie bei einem 25-jährigen Patienten mit rezidiviertem Desmoidtumor nach Operation zeigt den N. peroneus (Pfeilspitzen), der von der Raumforderung (Pfeile) inkorporiert ist. b Schräges 12-5-MHz-US-Längsbild über dem mittleren distalen Drittel des Arms einer 67-jährigen Frau mit Liposarkom zeigt ein langes Segment des N. radialis (Pfeilspitzen), das von dem Neoplasma umhüllt ist (Pfeile). In beiden Fällen musste der betroffene Nerv chirurgisch geopfert werden.
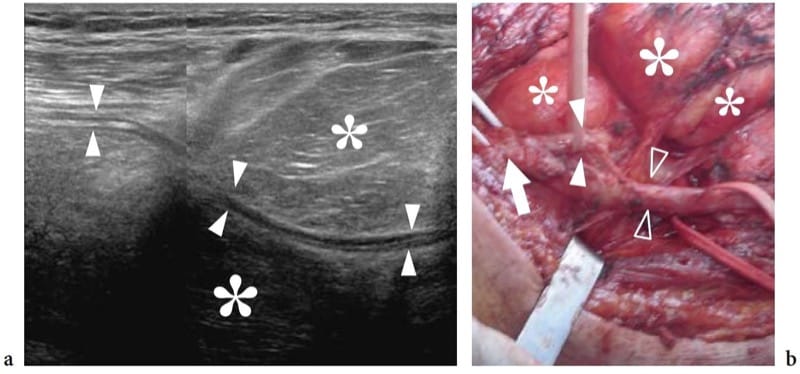
Abbildung 29. a,b. Nervenbeteiligung durch extrinsische Tumoren. a Schräges 12-5-MHz-US-Längsbild über der Kniekehle zeigt eine große lipomatöse Masse (Sternchen), die den N. peroneus umgibt (Pfeilspitzen). Es wurde ein Bild mit geteiltem Bildschirm verwendet, wobei die beiden Bildschirme für ein erweitertes Sichtfeld ausgerichtet waren. b Die grobe chirurgische Ansicht zeigt die Bifurkation des Ischiasnervs (Pfeil) in den Schienbeinnerv (offene Pfeilspitzen) und den Peronaeusnerv (weiße Pfeilspitzen). Dieser letztere Nerv kann gesehen werden, wie er sich innerhalb der Masse einfaltet (Sternchen). Die pathologische Untersuchung ergab ein Liposarkom.
21. BLUTGEFÄSSE
Eine tiefgründige vollständige Abhandlung über die Arterien und Venen, die in den Gliedmaßen und Extremitäten verlaufen, und die damit zusammenhängende Pathologie würde den Rahmen eines Buches über den Bewegungsapparat sprengen. Hier konzentrieren wir uns auf allgemeine Aspekte der Gefäßpathologie im Zusammenhang mit Erkrankungen des Bewegungsapparates. Die Analyse der eigentlichen vaskulären Pathologie der Gliedmaßenarterien und -venen, wie z. B. atherosklerotische Erkrankungen und venöse Insuffizienz, wird angemessener in anderen Lehrbüchern und spezifischer Literatur behandelt (Polak et al. 1989; Edwards und Zierler 1992; Foley et al. 1989; Fraser und Anderson 2004).
22. HISTOLOGISCHE ÜBERLEGUNGEN
Aufgrund ihres histologischen Aufbaus lassen sich die Arterien in vier verschiedene Gruppen einteilen: elastische Arterien, mittelgroße Muskelarterien, kleine Arterien und Arteriolen (dh die Radial- und Ulnararterien gehören zur mittelgroßen Muskelgruppe). Elastische Arterien sind die größten im Körper; Sie dehnen sich aus, wenn sich das Herz zusammenzieht, und kehren in der Diastole zu einem normalen Kaliber zurück. Muskelarterien sind kleine und mittelgroße Gefäße mit einem relativ engen Lumen und dicken Wänden, die aus umlaufend angeordneten glatten Muskelfasern bestehen, die das Lumen einschränken, wenn sie sich zusammenziehen. Der Tonus der glatten Muskulatur hängt vom vegetativen Nervensystem ab und ist verantwortlich für die runde Querschnittsform der Arterien, für die Höhe des Blutdrucks und für regulatorische Funktionen des Blutflusses (z. B. erhöhtes Flussvolumen in der Skelettmuskulatur bei Belastung). ). Die Arterienwand besteht aus drei konzentrischen Schichten: der Intima (innere Tunica), die die Endothelauskleidung enthält; die Media (mittlere Tunica) beherbergt glattes Muskelgewebe; und die Adventitia (äußere Tunika), die durch faseriges Gewebe gekennzeichnet ist, das mit dem lockeren Verbindungsraum um das Gefäß herum verschmilzt (Abb. 30a). In einer Muskelarterie liegt die Lamina elastica interna zwischen der Intima und der Media, während die Lamina elastica externa die Media von der Adventitia trennt.
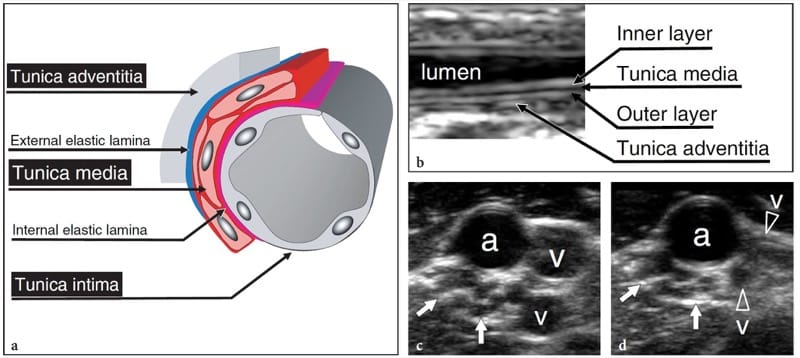
Abbildung 30. a–d. Anatomie der Muskelarterien. a Schematische Darstellung eines Querschnitts durch eine kleine bis mittelgroße Muskelarterie verdeutlicht den histologischen Aufbau der aus drei konzentrischen Schichten bestehenden Gefäßwand. Von innen nach außen sind dies: die Tunica Intima, bestehend aus Endothel; die Tunica media, gekennzeichnet durch glatte Muskelzellen; und die Tunica adventitia, bestehend aus lockerem Bindegewebe in Kontinuität mit den perivaskulären Räumen. Die Intima ist durch die Lamina elastica interna von der Media getrennt; und die Media aus der Adventitia durch die Lamina elastica externa. b Langachsen-17–5-MHz-US-Bild einer kleinen Arterie zeigt die geordnete Struktur der Arterienwand, die aus einer Kombination von echoreichen und echoarmen Schichten besteht. Sie sind: eine innere echogene Schicht aufgrund der Grenzfläche von Blut mit der Intima und der Lamina elastica interna; eine echoarme Zwischenschicht aufgrund der Tunica media; eine äußere echogene Schicht, die durch die akustische Grenzfläche zwischen der Lamina elastica externa und der Adventitia gegeben ist. c,d Kurzachsen-US-Bilder mit 17–5 MHz über dem großen neurovaskulären Bündel des Arms, c ohne und d mit Sondenkompression. Eine gemeinsame echoreiche Bindehaut umfasst eine Arterie (a), zwei Satellitenvenen (v) und einen Nerv (Pfeile). Die Arterie kann von den angrenzenden Venen auf der Basis ihres abgerundeteren Querschnittsprofils, ihrer mehrschichtigen Wand, ihrer Pulsatilität (nicht gezeigt) und weil sie nicht kollabiert, wenn ein Wandlerdruck darauf ausgeübt wird, unterschieden werden.
Verglichen mit den Arterien haben Venen dünnere Wände und größere Lumen. Eine ihrer Hauptfunktionen besteht darin, Blut zu speichern, und sie brauchen Muskeln, um das Blut zurück zum Herzen zu drücken. Da die Venenwände kollabieren können, variiert die Gefäßform in Abhängigkeit von den umgebenden Gewebebedingungen, einschließlich der Positionierung und Schwerkraft des Subjekts. Im Gegensatz zu den Arterien ist die Schichtung der Venenwand nicht so ausgeprägt: Die Intima ist sehr dünn (nur die größten Venen enthalten diskrete Mengen an subendothelialem Bindegewebe); Die Media ist dünner als die Adventitia, und die beiden Schichten gehen ineinander über. Periphere Venen können doppelt oder mehrfach sein, wenn sie eine mittelgroße Arterie begleiten, und sind im Allgemeinen variabler als die Arterien selbst, wobei zwischen ihnen sehr häufig Anastomosen auftreten. Viele kleine bis mittelgroße Venen enthalten Klappen (Feige. 31a).
Dies sind lose, taschenförmige Falten der Intima, die sich in das Lumen der Vene erstrecken. Die Öffnung der Segel verhindert den Rückfluss des Blutes und fördert den Blutfluss zum Herzen. Blut, das zum Herzen fließt, passiert die Taschen (Abb. 31a, b); Wenn sich der Fluss umkehrt, füllt Blut die Taschen und verschließt so das Lumen der Vene und verhindert, dass sich Blut ansammelt (Fig. 31c, d). Im Stehen hängt der venöse Rückfluss aus den Beinen hauptsächlich von der Aktivität der Wadenmuskulatur, der sogenannten Wadenpumpe, ab.
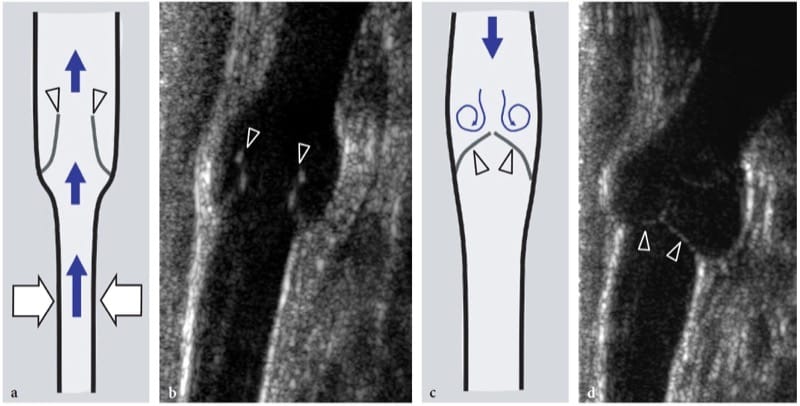
Abbildung 31. a–d. Venenklappen. a,c Schematische Zeichnungen und korrelierende b,d Längsachsen-US-Bilder mit 12–5 MHz über einer peripheren Vene veranschaulichen die hämodynamischen Auswirkungen einer Klappe auf den venösen Blutfluss. a,b Während der Kontraktion der Wadenmuskulatur (weiße Pfeile) öffnen sich die Höcker (Pfeilspitzen) der Klappe, sodass Blut (blaue Pfeile) zum Herzen fließen kann. c,d Sobald die Muskelaktion aufgehört hat, neigt der Fluss dazu, sich umzukehren und die Segel der Klappe zu schließen. Das Schließen der Klappe hindert das Blut daran, es nach hinten zu leiten.
23. NORMALE US-ANATOMIE UND SCANTECHNIK
Da die Gliedmaßenarterien relativ oberflächlich sind, werden mit den für muskuloskelettale Anwendungen verwendeten Schallköpfen normalerweise US-Bilder von sehr guter Qualität erhalten. Ähnlich wie bei anderen Anwendungen hängt die Auswahl der geeigneten Schallkopffrequenz vom Körperbau des Patienten und der Tiefe des zu untersuchenden Gefäßes ab. Das Ändern der Geräteeinstellungen von einer muskuloskelettalen Anwendung zu einer gefäßspezifischen Einstellung und das Verringern der Verstärkung können dazu beitragen, Artefaktflecken im Gefäßlumen zu reduzieren, die zu einer Verwechslung mit Thrombus führen können. In normalen Zuständen erscheinen Gliedmaßenarterien als pulsierende Strukturen: Die Pulsatilität wird bei längerer Beobachtung auf Kurzachsenebenen besser eingeschätzt. Dieses Zeichen reicht normalerweise aus, um Gliedmaßenarterien während einer konventionellen Untersuchung des Bewegungsapparates für andere Zwecke zu beurteilen.
Basierend auf korrelativen Mikrodissektionsstudien und der Verwendung hochauflösender intravaskulärer Sonden zeigt US die normale Wand einer kleinen bis mittelgroßen Muskelarterie als dreischichtige Struktur. Ein inneres helles akustisches lineares Echo stammt von der Grenzfläche des Blutes mit der Intima und der Lamina elastica interna, und eine äußere echogene Schicht wird durch Reflexion an der Grenzfläche zwischen der Lamina elastica externa und der Adventitia erzeugt (Chong et al. 1993; Siegel et Al. 1993). Die Tunica media besteht hauptsächlich aus glatter Muskulatur und erscheint als ein mittel-echoarmes Band, das zwischen den beiden echogenen Schichten liegt (Chong et al. 1993; Siegel et al. 1993). Im Gegensatz dazu erscheint die Wand elastischer Arterien, deren Media einen hohen Elastinanteil aufweisen, gleichmäßig echogen (Chong et al. 1993; Siegel et al. 1993; Martin et al. 1997).
Bei Verdacht auf eine Gefäßerkrankung können die Farbdoppler-Bildgebung und die Spektraldoppleranalyse die Graustufenbefunde ergänzen, um die Durchgängigkeit und Gefäßverengung zu bestimmen. In der Regel sollte die Doppler-Untersuchung entlang der Längsachse der Gefäße mit einem Doppler-Winkel von 60° oder weniger durchgeführt werden (Abb.32a). Da die meisten Gefäße der Extremitäten parallel zur Haut verlaufen, sollte die Strahlsteuerung als Standardeinstellung verwendet werden, um adäquate Dopplerwinkel zu erhalten. In Ruhe zeigen die Spektral-Doppler-Analyse der Flusswellenformen und die Farb-Doppler-Bildgebung der Arterien der oberen und unteren Extremitäten ein charakteristisches Muster eines hohen distalen Widerstands (Abb. 32b). Als Reaktion auf Bewegung und Muskelaktivierung erzeugt die Vasodilatation normalerweise einen höheren Vorwärtsfluss während des gesamten Herzzyklus, insbesondere in der Diastole, was verringerte Widerstände widerspiegelt (Feige. 32c).
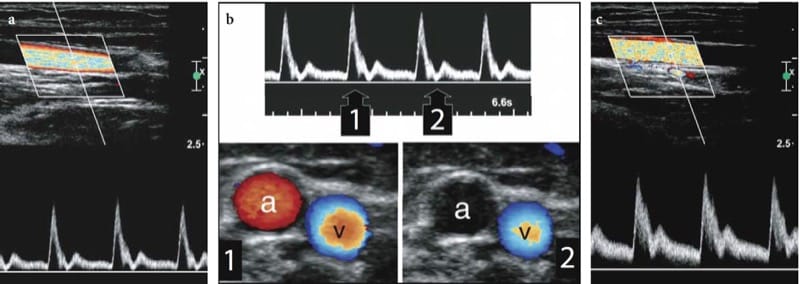
Abbildung 32. a–c. Normale Doppler-Bildgebungsbefunde in der A. brachialis. Eine gepulste Doppler-Analyse zeigt einen normalen pulsierenden Hochwiderstandsfluss mit Oszillationen in der Diastole. Eine gesteuerte Farbbox wird verwendet, um einen adäquaten Doppler-Winkel und klare Doppler-Kurven zu erhalten. b Farbdoppler-Darstellung des Flusses in der A. brachialis mit hohem Widerstand (a). Es gibt Hinweise auf ein Farbflusssignal in der Systole (1), aber nicht in der frühen diastolischen Phase (2). In der benachbarten Brachialvene (v) wird ein kontinuierlicher Blutfluss mit vollständiger Füllung des Gefäßlumens festgestellt, was auf eine Durchgängigkeit hinweist. c Nach wiederholtem Faustballen führt die resultierende Vasodilatation zu einem höheren Vorwärtsfluss während des gesamten Herzzyklus, insbesondere in der Diastole.
Im Gegensatz zu den Arterien haben Gliedmaßenvenen sehr dünne echogene Wände, die oft nicht von den umgebenden echogenen Räumen zu unterscheiden sind, insbesondere wenn das Gefäß kollabiert ist. Das Venensystem wird durch Platzierung der Sonde senkrecht zur Gefäßflussrichtung mit der sogenannten Kompressionstechnik (Kompressionssonographie) untersucht, da die Nichtkompressibilität das empfindlichste und spezifischste Zeichen einer Venenthrombose ist (Cronan et al. 1987; Fraser und Anderson 2004). Der Grund für die Kompression in der Querebene hängt damit zusammen, dass die Sonde in der Längsachse vom Gefäß rutschen kann, was möglicherweise zu einem falsch-negativen Befund führt (Chin et al. 2005).
Zunächst wird leichter Druck ausgeübt, um die Vene nicht zu kollabieren (Abb. 33a). Wenn die Sonde sowohl Arterie als auch Vene überspannt, wird anschließend weiterer Druck ausgeübt. Wenn die Vene offen ist, kollabieren die Wände und liegen vollständig aneinander an (Abb. 33b). Wenn der Druck abgelassen wird, kehrt das Lumen der Vene zur Normalität zurück. Wenn die Vene Gerinnsel enthält, wird sie nicht kollabieren, sondern bleibt ausgedehnt, wenn Sondendruck ausgeübt wird (Feige. 33a, b). In den Venen der unteren Gliedmaßen zeigen Doppler-Bildgebung und Spektralanalyse eher einen monophasischen venösen Fluss als dreiphasige Wellenformen. Im Gegensatz dazu weisen die Venen der oberen Extremitäten aufgrund ihrer näheren Nähe zum Herzen einen stärker pulsierenden Fluss auf (Chin et al. 2005). Die Verwendung einer niedrigen Geschwindigkeit (3–6 cm/s) und niedriger Filtereinstellungen ist obligatorisch, um einen künstlichen Venenverschluss zu vermeiden. Unter normalen Bedingungen sollte der venöse Fluss beim Einatmen erhöht und beim Ausatmen reduziert werden. Das Fehlen einer Variation kann auf eine proximalere obstruktive oder kompressive Läsion hindeuten, und eine weitere Beurteilung ist erforderlich. Das Valsalva-Manöver kann auch als Mittel zur Beurteilung des proximaleren Venensystems verwendet werden. Die Anwendung einer distalen Augmentation (z. B. Zusammendrücken der Wade zur Beurteilung der Kniekehlenvene, Zusammendrücken des Fußes zur Beurteilung der Schienbeinvenen) führt zu einer Erhöhung des Farb- und Spektraldopplersignals (Fig. 33c, d). Dieses Phänomen weist darauf hin, dass die venösen Segmente zwischen dem Kompressionspunkt und der Position der Sonde offen sind. Bei einer akuten Venenthrombose kann es zu einer Venenerweiterung kommen.
Unter den anatomischen Varianten ist eine Duplikation von Venen, insbesondere auf femoraler (20 %) und poplitealer (35 %) Ebene, üblich. In diesem Fall sind Venen im Allgemeinen kleiner als in einem einzelnen System und können eine potenzielle Fehlerquelle bei der Dauerstrich-Doppler-Analyse sein.
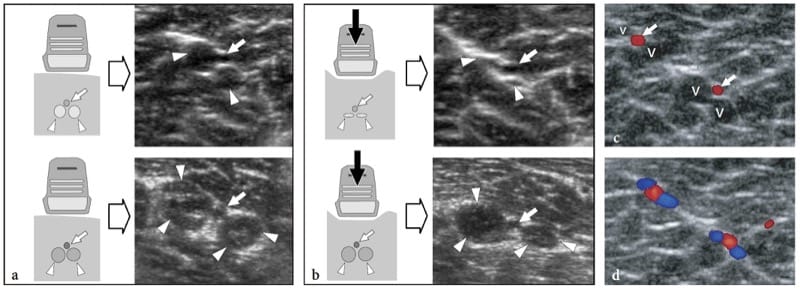
Abbildung 33. ad. Dynamische Kompressionstechnik zur Beurteilung der Venendurchgängigkeit. a,b Schematische Zeichnungen und entsprechende kurzachsige 17–5-MHz-US-Bilder, die bei zwei verschiedenen Patienten über offenen (obere Bilder) und thrombosierten (untere Bilder) Gemellavenen (Pfeilspitzen) aufgenommen wurden. Der Pfeil zeigt die Arteria gemellaris an. a Die Sonde wird zunächst ohne Druck quer zu den Gefäßen gehalten. Sowohl offene als auch thrombosierte Venen zeigen ein abgerundetes Profil. Im unteren Bild sind einige interne Echos zu sehen, die Blutgerinnsel widerspiegeln. b Druck mit der Sonde über den Venen bewirkt ein Kollabieren der Vorder- und Hinterwand, wenn sie offen sind (oberes Bild). Im Gegenteil, die mit Thromben gefüllten Venen bleiben gedehnt. c,d Distales Augmentationsmanöver. c Farbdoppler-US-Bild, das in Ruhe über normalen Gemellavenen aufgenommen wurde, zeigt keinen spontanen Blutfluss in diesen Venen (v). Beobachten Sie den spontanen Farbfluss in den Gemellarterien (Pfeile). d Nach distaler manueller Quetschung der Wade zeigt sich ein Blutfluss in den Gemellavenen. Dieses Augmentationsmanöver deutet auf eine Durchgängigkeit der Wadenvenen hin.
24. MUSKULOSKELETALE BEZOGENE GEFÄSSERKRANKUNGEN
Wie bereits erwähnt, konzentrieren wir uns hier auf eine kurze Beschreibung der vaskulären Pathologie im Zusammenhang mit traumatischen Verletzungen oder bestimmten Erkrankungen des Bewegungsapparates, die dem Sonologen bekannt sein müssen, wenn er eine US-Studie des Bewegungsapparates durchführt. Andere vaskuläre Pathologien, auch wenn sie relevant sind, wurden weggelassen, da sie außerhalb der Ziele dieses Buches liegen.
25. ARTERIELLE ERKRANKUNGEN
Aufgrund ihrer oberflächlichen Lage und engen Anlagerung an die Knochen sind die Arterien der Gliedmaßen und Extremitäten besonders anfällig für traumatische Verletzungen. Aufgrund seines Pathomechanismus kann das arterielle Trauma willkürlich in drei Haupttypen unterteilt werden: akute direkte Verletzungen nach einer penetrierenden Wunde durch einen scharfen Gegenstand oder stumpfe Arterienrisse im Zusammenhang mit einem schweren Dehnungs- oder Quetschtrauma (einschließlich hochgradiger Verstauchungen, Blutergüsse, ausgerenkte Gelenke und Fraktur-Verrenkungen in der Nähe von Arterien – wie suprakondyläre Humerusfrakturen für die Brachialarterie, glenohumerale Luxationen für die Achselarterie, suprakondyläre Femurfrakturen für die Kniekehlenarterie und Knieluxation für die A. tibialis posterior); chronisch wiederholtes Mikrotrauma, das eine fortschreitende Schädigung der Gefäßwand verursacht, die zu Pseudoaneurysmen, Aneurysmen und Gefäßverschlüssen führen kann; und iatrogene Verletzungen, die entweder zu Thrombosen oder lokalen Blutungen führen. Wenn große Arterienstämme der Gliedmaßen betroffen sind, sind direkte traumatische Verletzungen klinische Notfälle und erfordern in den meisten Fällen eine sofortige chirurgische Reparatur, um eine akute Ischämie der Gliedmaßen, hypotensiven Schock und Tod durch Blutverlust zu vermeiden (Davison und Polak 2004). Der Doppler-US wird für die Diagnose eines akuten arteriellen Traumas an den Extremitäten im Notfall empfohlen, seine Sensitivität ist jedoch geringer als die der CT-Angiographie (Fry et al. 1993; Knudson et al. 1993; Miller-Thomas et al. 2005). ; Rieger et al. 2006). Ähnlich wie bei der MR-Bildgebung hat der Farbdoppler-US in diesem Bereich erhebliche Einschränkungen, die sich auf den beträchtlichen Zeitaufwand beziehen, der für die Erstellung der Diagnose benötigt wird. Darüber hinaus ist die Farbdoppler-Bildgebung bedienerabhängig, kann bei der Beurteilung des arteriellen Flusses distal einer arteriellen Verletzung unzureichend sein, ist anfällig für Verwechslungen durch Kollateralgefäße und kann bei Patienten mit offenen Wunden ungeeignet sein (Rieger et al. 2006 ).
Die Farbdoppler-Bildgebung scheint nützlicher zu sein, um geringfügige arterielle Verletzungen zu identifizieren und zu überwachen, die während eines Traumas auftreten und keine spezifische sofortige operative Behandlung erfordern – wie z . 1993). In ähnlicher Weise scheinen Graustufen-US- und Doppler-Bildgebungstechniken relevanter für die Identifizierung zufälliger arterieller Schäden als Folge von chronischen Mikrotrauma- und Überbeanspruchungssyndromen zu sein. Diese Läsionen treten typischerweise in der Hand auf, wo die Äste der Ulnararterie zwischen der Haut und dem darunter liegenden Hamatum als Folge wiederholter äußerer Traumata gegen die Handfläche eingeklemmt werden können (Abb.. 34). Dieser Zustand, der gemeinhin als „Hypothenar-Hammer-Syndrom“ bezeichnet wird, führt zu Intimaverletzung, Thrombose oder Aneurysma mit anschließender digitaler Ischämie, Schmerzen oder einer tastbaren Raumforderung in der Hand (Okereke et al. 1999; Liskutin et al. 2000; Velling et al. 2001). Ähnliche Gefäßanomalien können auf Höhe der A. dorsalis pedis nach wiederholten stumpfen Traumata über dem Knöchel- und Mittelfußrücken auftreten (Yamaguchi et al. 2002; Ozdemir et al. 2003). In diesen Fällen sollten US- und Doppler-Techniken die bildgebende Methode der ersten Wahl sein. Eine digitale Subtraktionsangiographie oder eine kontrastmittelunterstützte MR-Angiographie kann weiterhin vom Gefäßchirurgen für eine präzise präoperative Planung gefordert werden. Andere seltene Ursachen für geschlossene arterielle Schäden im Zusammenhang mit Anomalien des Bewegungsapparates hängen mit anatomischen Varianten zusammen, wie z. Poplitealarterien-Einklemmsyndrom, verursacht durch anomales proximales Einführen des medialen Kopfes des M. gastrocnemius (Abb.. 35) (Wright et al. 2004); und Einklemmung der Brachialarterie im Arm infolge des Vorhandenseins eines Suprakondylärfortsatzes und des Struthers-Bandes, sogenanntes Suprakondylärfortsatzsyndrom (Talha et al. 1987).
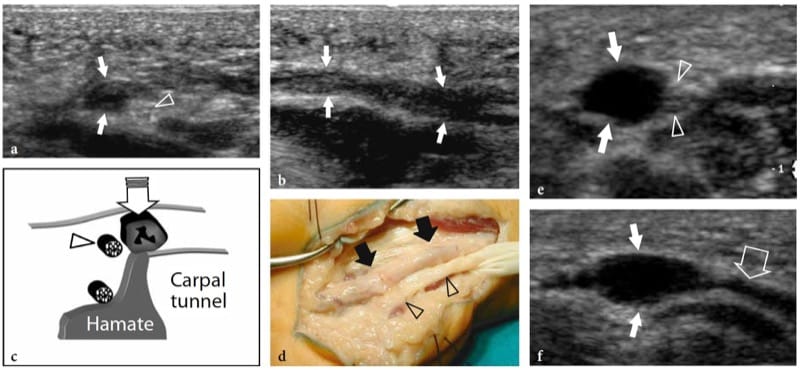
Abbildung 34. a–f. Hypothenar-Hammer-Syndrom. Zwei unterschiedliche Fälle von Arbeitern – der eine ein Automechaniker, der andere ein Gewichtheber – die in ihrer rechten Hand ein berufliches Hämmern hatten. a–d Verschluss der A. ulnaris. a Transversale und b longitudinale 15–7-MHz-US-Bilder über dem Hypothenar mit c schematischer Zeichnung und d grober chirurgischer Ansichtskorrelation zeigen den vollständigen Verschluss der A. ulnaris (Pfeile) an der Stelle, an der sie neben dem Hamatum verläuft. Beachten Sie den angrenzenden unverletzten sensorischen Ast des N. ulnaris (Pfeilspitze). Die operative Ansicht zeigt eine verdickte helle Arterie, die neben dem N. ulnaris verläuft. Der Patient hatte ischämische Symptome im vierten und fünften Finger. e,f Aneurysma der A. ulnaris. e Transversale und f longitudinale 12–5-MHz-US-Aufnahmen über dem Hypothenar zeigen ein Aneurysma (weiße Pfeile) der A. ulnaris (großer offener Pfeil). Im Lumen sind keine Echos erkennbar, was auf das Fehlen eines Thrombus hindeutet. Der Patient klagte über nur leichte Schmerzen über dem Aneurysma. Pfeilspitzen, sensorischer Ast des N. ulnaris.
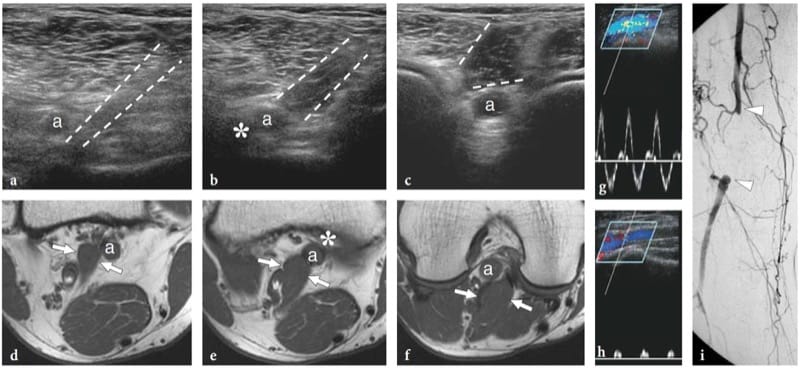
Abbildung 35. a–i. Einklemmsyndrom der Arteria poplitea. a–c Serie von transversalen 17–5-MHz-US-Bildern der Kniekehle mit d–f T1-gewichteter MRT-Korrelation bei einem 45-jährigen Mann mit belastungsinduzierter Claudicatio der rechten unteren Extremität zeigen einen anomalen medialen Verlauf von A. poplitea (a), die von medial nach lateral über ein in der Kniekehle liegendes abnormes Muskelband (gestrichelte Linie in ac, Pfeile in df) verläuft. Bei der Farb-Doppler-Bildgebung (nicht gezeigt) wird der Gefäßverschluss an dem Punkt initiiert, an dem die Arterie eng an der posteromedialen Ecke des medialen Femurkondylus (Sternchen) anliegt und daher anfällig für eine Kompression durch den anomalen Muskel ist. Die MR-Bildgebung ermöglichte die Klassifizierung dieser Muskelanomalie als Typ 2. g, h Spektral-Doppler-Analyse, durchgeführt g auf Höhe der oberen Kniekehlenarterie und h stromabwärts in der Tibialarterie am proximalen Bein, zeigt g normalen pulsierenden Fluss kranial der Okklusion und h Dämpfung der distalen Flusswellenformen. i Die anteroposteriore digitale Subtraktionsangiographie zeigt einen segmentalen Verschluss (Pfeilspitzen) der A. poplitea mit kollateraler Füllung durch die Arteria geniculata.
Bei iatrogenen Verletzungen können arterielle Katheterisierungsverfahren für Gefäßdissektionen, Weichteilhämatome, Pseudoaneurysmen und arteriovenöse Fistelbildungen verantwortlich sein (Clevert et al. 2005; Schwartz et al. 1991). Diese Läsionen befinden sich typischerweise an der Punktionsstelle, einschließlich der Leiste für die Femoralarterie und ihre Teilungsäste (Roubidoux et al. 1990; Helvie et al. 1988) und dem medialen Arm für die Brachialarterie (Chuang et al. 2002). Die kompressionsbasierte femorale und mediane Neuropathie ist eine gut etablierte Komplikation von Hämatomen und Pseudoaneurysmen nach arterieller Katheterisierung (Jacobs et al. 1992; Chuang et al. 2002). Die Farbdoppler-Bildgebung ist hilfreich bei der Differenzierung von Komplikationen der femoralen Arterienkatheterisierung, wie z. B. Hämatom, Pseudoaneurysma und arteriovenöse Fisteln. Es zeigt ein arterielles Pseudoaneurysma als perivaskulären Sack mit verdickten echogenen Wänden (Wandthrombus), der eine wirbelnde Strömung mit abwechselnd roter und blauer Farbe enthält (Abb. 36a – c). Im Allgemeinen ist der Hals, der die Arterie mit dem Pseudoaneurysma verbindet, in der Farbdoppler-Bildgebung besser zu erkennen als in der Graustufen-US (Schwartz et al. 1991). Bei der Doppler-Spektralanalyse weist der Blutfluss im Hals hohe bidirektionale Geschwindigkeiten auf, wenn Blut aus der beschädigten Arterie in der Systole (Fluss angezeigt über der Grundlinie) in den Hohlraum eintritt und in der Diastole (Fluss angezeigt unter der Grundlinie) austritt, dem sogenannten „to -und-her“-Signal (Abb. 36d) (Säcke et al. 1989). Andererseits sind charakteristische Befunde arteriovenöser Fisteln: sichtbare Verbindung zwischen Arterie und Vene, mehrfarbige (Mosaikmuster) gesprenkelte Masse an der Fistelstelle, Ausbreitung von Farbpixeln in die perivaskulären Weichteile, hoher diastolischer Fluss in der arteriellen Wellenform proximal zu der Fistelstelle, verringerter Fluss in der Arterie kaudal der Fistel und turbulenter Hochgeschwindigkeitsfluss, manchmal mit einer pulsierenden Komponente, in der abführenden Vene (Helvie und Rubin 1989; Roubidoux et al. 1990). US-geführte Verfahren zur Behandlung von Pseudoaneurysmen mit direkter Sondenkompression und Thrombininjektion sind an anderer Stelle beschrieben. In der postoperativen Umgebung haben sich US- und Doppler-Techniken als wertvoll bei der Bewertung von Bypass-Transplantaten erwiesen, um den Beginn eines frühen Versagens, einschließlich Stenosen, Thrombosen und infektiösen Ansammlungen, zu erkennen (Abb.. 37).
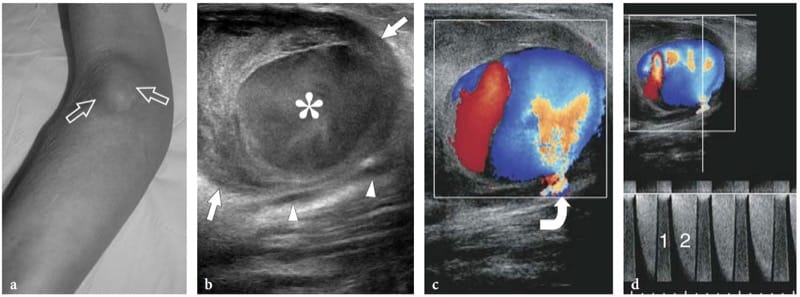
Abbildung 36. a–d. Iatrogenes Pseudoaneurysma der A. brachialis. a Fotografie des vorderen rechten Ellbogens einer 72-jährigen Frau mit einem sich vergrößernden pulsierenden Weichteilknoten (Pfeile), der sich nach einer Venenkanülierung entwickelt hatte. Transversale b-Graustufen- und c-Farbdoppler-17–5-MHz-US-Bilder über dem Knoten zeigen eine große komplexe Masse (gerader Pfeil) mit verdickten Wänden und einem zentralen Hohlraum, der mit wirbelnder Strömung (Sternchen) gefüllt ist, was mit einem Pseudoaneurysma der A. brachialis übereinstimmt ( Pfeilspitzen). Der langsame Fluss im Pseudoaneurysma macht das Blut bei der Graustufenbildgebung echogen. Die Farbdoppler-Bildgebung zeigt die Kontinuität der Pseudoaneurysmahöhle mit einer dislozierten A. brachialis mittels eines dünnen Halses (gekrümmter Pfeil). d Die Spektral-Doppler-Analyse, die im Kommunikationstrakt erhalten wurde, zeigt bidirektionale Geschwindigkeiten, da der Vorwärtsfluss (1) in der Systole ausgestoßen wird (2) in der Diastole.
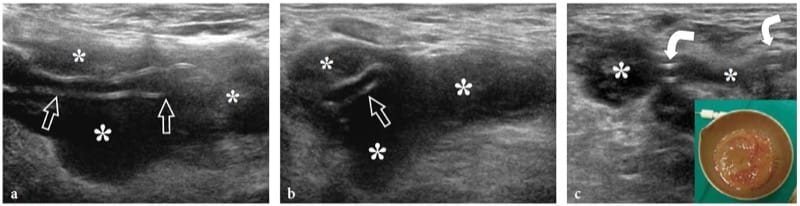
Abbildung 37. a–c. Abszess um ein Bypass-Graft. a Langachsen- und b Kurzachsen-US-Bilder mit 17–5 MHz über einem verschlossenen aorto-femoralen Bypass-Graft (Pfeile) bei einem 70-jährigen Diabetiker mit amputiertem Unterschenkel und klinischen Anzeichen einer Sepsis. Beachten Sie das geschrumpfte Aussehen des Transplantats, umgeben von einer Flüssigkeitsansammlung (Sternchen). c Präoperative perkutane Drainage der Sammlung. Der Katheter (gekrümmte Pfeile) ist im fast leeren Abszess (Sternchen) zu sehen. Wie in der Beilage gezeigt, führte die Aspiration zu eitrigem Material.
26. VENÖSE ERKRANKUNGEN
Ein direktes Trauma des tiefen und oberflächlichen Venensystems erzeugt nur gelegentlich eine vaskuläre Läsion, wie beispielsweise ein Aneurysma oder einen Venenverschluss. Obwohl selten, sollte die Möglichkeit eines venösen Aneurysmas berücksichtigt werden, um ein Aneurysma weder mit einem Ganglion (bei Patent) noch mit einer soliden Weichteilmasse (bei Thrombose) zu verwechseln. Der Nachweis der Kontinuität des dilatierten venösen Segments mit einer oberflächlichen, sogar kleinen Vene und Blutfluss innerhalb der Raumforderung kann die Diagnose unterstützen (Abb. 38a – d). Wenn thrombosiert, können venöse Aneurysmen eine diagnostische Herausforderung darstellen, da sie als unspezifische solide avaskuläre Raumforderungen erscheinen (Abb. 38e). Posttraumatische Venenthrombosen können gelegentlich nach Muskelzerrungen durch Dehnung der Gefäßwände auftreten. Diese Art von Trauma tritt typischerweise in den infrapoplitealen Venen (am häufigsten betroffen sind die Gemellavenen) von Patienten mit Tennisbeinläsion auf (Delgado et al. 2002). Posttraumatische Muskelödeme und Hämatome können auch eine Kompression und dann einen Verschluss von intramuskulären Niederdruckvenen hervorrufen. Ebenso kann eine verlängerte Kontrakturfreiheit der Wadenmuskulatur infolge lokaler Schmerzen und posttraumatischer Immobilisierung als mögliche Ursache einer Venenthrombose impliziert werden.
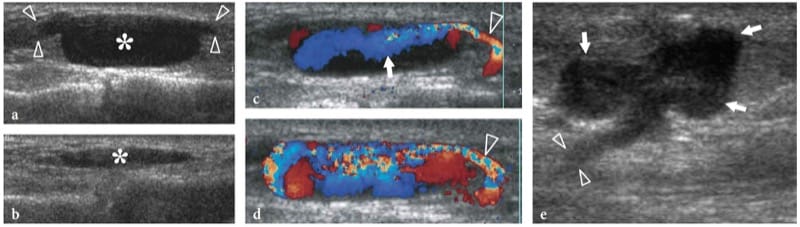
Abbildung 38. a–e. Venöse Aneurysmen. Zwei verschiedene Fälle. Langachsen-a,b-Graustufen- und c,d-Farbdoppler-12–5-MHz-US-Bilder, erhalten a,c,d ohne und b mit Sondenkompression über einer komprimierbaren Weichteilmasse des Mittelfußrückens in a Patient mit geheilten mittleren Tarsalfrakturen zeigt eine mit Flüssigkeit gefüllte ovale Läsion (Sternchen), die an ihren gegenüberliegenden Enden mit einer kleinen oberflächlichen Vene (Pfeilspitzen) verbunden ist. Wie in b gezeigt, ist die Masse ohne inneren Thrombus vollständig komprimierbar. Dieses Zeichen kann zusammen mit der Darstellung der venösen Enden und des inneren Blutflusses in der Farbdoppler-Bildgebung eine Verwechslung mit Ganglienzysten vermeiden. Beim Lösen der Sondenkompression ist ein Blutfluss (Pfeil) zu sehen, der von der Muttervene (Pfeilspitze) in das Aneurysma strömt, um dessen Hohlraum vollständig zu füllen. e Thrombosierte oberflächliche Krampfader. Das sagittale 12–5-MHz-US-Bild über dem posteromedialen Aspekt des Beins zeigt eine polyzyklische echoarme Masse (Pfeile) in Kontinuität mit einem dünnen Pedikel (Pfeilspitzen), der in die Tiefe gerichtet ist, ein bei der US-Untersuchung unspezifisches Erscheinungsbild. Nach chirurgischer Resektion erwies sich diese Masse als thrombosierte Varize.
In der unteren Extremität können Kompressions-US und Farbdoppler-Bildgebung eine tiefe Venenthrombose leicht diagnostizieren und ein Gefäßproblem von anderen Erkrankungen des Bewegungsapparates unterscheiden, die es vortäuschen können, einschließlich einer geplatzten Baker-Zyste oder eines posttraumatischen Hämatoms. Die klassische Beschreibung einer Venenthrombose ist die einer erweiterten Vene mit verdickten Wänden, die echoreiches Material enthalten, mit mehreren umgebenden Kollateralgefäßen (Murphy und Cronan 1990). Basierend auf den bildgebenden Befunden kann der US vollständig okklusive (Abb. 39a, b) von partieller nicht-okklusiver Thrombose (Fig. 39c, d). Ein nicht okklusiver Thrombus kann das spektrale Doppler-Flussmuster nicht verändern. In manchen Fällen kann der Thrombuskopf frei im Gefäßlumen schweben (Abb. 4.39e,f). Dieser Befund sollte im Bericht angegeben werden, da er sich auf ein erhöhtes Embolierisiko bezieht. Obwohl viele versucht haben, den Thrombus auf der Grundlage seines Reflexionsvermögens zu datieren, waren solche Versuche unwirksam (Murphy und Cronan 1990). Bei einer chronischen Venenthrombose kann sich die Rekanalisation des Thrombus als Netzwerk dünner echoarmer Strömungskanäle innerhalb des echogenen Thrombus darstellen, was schließlich zu einer offensichtlichen Gerinnselresorption und Wiedereröffnung des Gefäßes führen kann (Abb. 39g, h). Sowohl die Verringerung des spontanen Flusses als auch die unvollständige Kompressibilität der Venen begleiten diese Stadien in der postphlebitischen Extremität. Kollateralgefäße stellen häufig die venöse Durchgängigkeit wieder her (Abb. 40a). Wenn keine Rekanalisation erfolgt, sind chronisch thrombosierte Venen durch eine verengte Größe, verdickte und unregelmäßige Wände und die Bildung von Kollateralgefäßen gekennzeichnet (Abb. 39i,j). Weichteil- oder Muskelödeme können Begleitbefunde bei Venenthrombosen als Folge einer venösen Stauung sein (Abb. 40b). US kann leicht eine Thrombophlebitis diagnostizieren, die eine Behandlung mit entzündungshemmenden Medikamenten erfordert und nicht, zumindest routinemäßig, eine Antikoagulationstherapie (Fig. 40c, d).
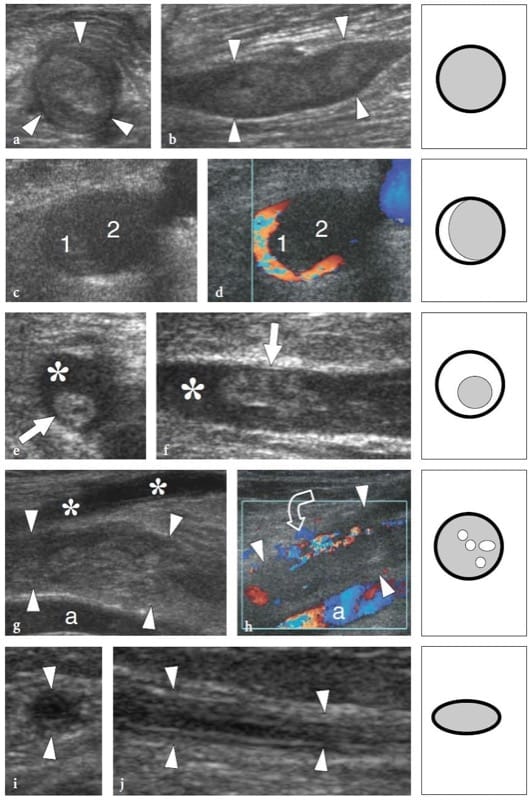
Abbildung 39. a–j. Venenthrombose: Spektrum der US-Auftritte bei verschiedenen Patienten. a,b Vollständige Venenthrombose. a Kurzachsen- und b Langachsen-US-Bilder mit 12–5 MHz einer intramuskulären Vene (Pfeilspitzen) des Soleus, die stark echogenes Material enthält, das mit einem chronischen Thrombus übereinstimmt. Diese Ader war bei US nicht komprimierbar. c,d Partielle Venenthrombose. c Kurzachsen-Graustufen-12–5-MHz-US-Bild der Kniekehlenvene zeigt ein ausgedehntes Lumen mit reflektierendem Material (1), was auf eine Thrombose hindeutet. d Korrelatives transversales Farbdoppler-12–5-MHz-US-Bild bestätigt das Vorhandensein eines Bereichs mit nicht okklusivem Thrombus mit Blutfluss, der die Peripherie des Gerinnsels mit einem halbmondförmigen Aussehen umgibt. Beachten Sie, dass ein Teil des echofreien Lumens (2) ebenfalls thrombosiert war, was auf aufeinander folgende Phasen der Thrombus-Apposition mit der Zeit hinweist. e,f Schwebender Thrombus. e Kurzachsen- und f Langachsen-12–5-MHz-US-Bilder der V. saphena magna zeigen, dass der proximale Kopf des Thrombus (Pfeil) frei im durchgängigen Gefäßlumen (Sternchen) schwimmt. Während der Echtzeitbeobachtung war zu sehen, wie der Thrombus gegen die Gefäßwand schlug. Diese Art von Thrombus korreliert mit dem höchsten Embolierisiko. g,h Rekanalisierter Thrombus. Langachse g-Graustufen- und h-Farbdoppler-US-Bilder mit 12–5 MHz über dem hinteren Knie zeigen eine vergrößerte Kniekehlenvene (Pfeilspitzen), die einen heterogenen Thrombus enthält. Innerhalb des Thrombus sind winzige echoarme Längskanäle mit Fluss (gekrümmter Pfeil) zu sehen, die einen Prozess der teilweisen Rekanalisierung widerspiegeln. Beobachten Sie die A. poplitea (a) und die oberflächlichen venösen Kollateralen (Sternchen). i,j Chronischer Venenverschluss. i Kurzachsen- und j Langachsen-12–5-MHz-US-Bilder der V. saphena parva zeigen ein verschlossenes Gefäß (Pfeilspitzen), das deutlich verengt erscheint. Die schematischen Zeichnungen auf der rechten Seite der US-Bilder zeigen das Querschnittsprofil einer Vene mit Anordnung von Thrombus (grau) und offenem Lumen (weiß) in Bezug auf die verschiedenen beschriebenen Arten von Venenthrombosen.
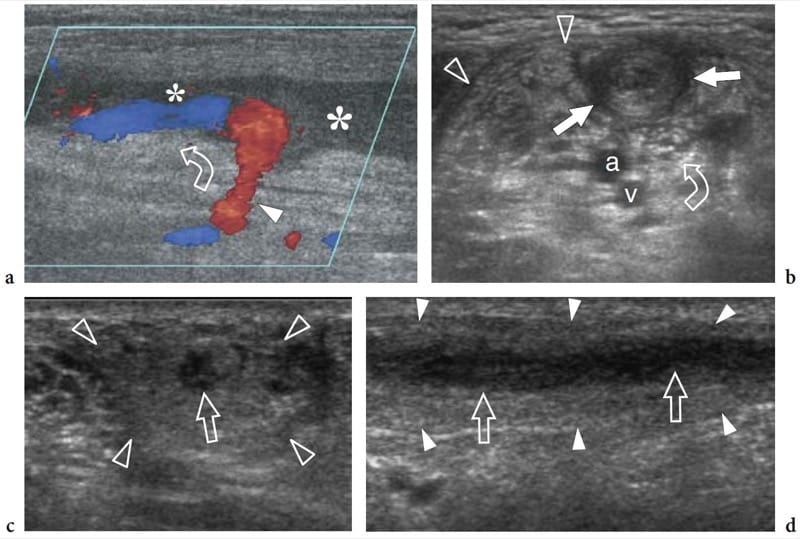
Abbildung 40. a–d. Häufige Gefäß- und Weichteilanomalien im Zusammenhang mit Venenthrombosen. Drei verschiedene Fälle. a Eröffnung von Kollateralgefäßen. Langachsen-Farbdoppler 12–5 MHz US-Bild über einer thrombosierten V. saphena magna (Sternchen) zeigt einen Prozess der teilweisen Rekanalisation (gekrümmter Pfeil) durch ein Kollateralgefäß (Pfeilspitze). b Muskelödem im Zusammenhang mit venöser Stase. Kurzachsen-Graustufen-12–5-MHz-US-Bild über der Fossa bicipitalis zeigt eine thrombosierte V. cephalica (Pfeile), die oberflächlich der A. brachialis (a) liegt, den N. medianus (gekrümmter Pfeil) und eine offene A. brachialis (v ). Beachten Sie das subfasziale Ödem (Pfeilspitzen) des M. biceps brachii als Folge einer venösen Stase. c,d Oberflächliche Thrombophlebitis des Unterschenkels. c Kurzachsen- und d Langachsen-12–5-MHz-US-Bilder über einer thrombosierten Vena saphena parva (Pfeile) zeigen schlecht definierte Gefäßwände und einen breiten echoreichen Halo (Pfeilspitzen), der die thrombosierte Vene umgibt, was mit reaktivem entzündetem subkutanem Fett übereinstimmt.
27. GEFÄßTUMOREN
Der häufigste Gefäßtumor, das Weichteilhämangiom, wird in diesem Kapitel nicht behandelt, da er bereits in seinen verschiedenen Formen beschrieben wurde: als Teil von Haut- und subkutanen Gewebemassen, in Kapitel 3 hinsichtlich seiner intramuskulären Lokalisation und in Kapitel 5 in Bezug auf seinen synovialen Typ. Ein vaskulärer Tumor, der in der US-Literatur besondere Aufmerksamkeit erhalten hat, ist das Angioleiomyom (vaskuläres Leiomyom), ein seltener gutartiger Histotyp, der aus der Tunica media der Venen entsteht und aus einem Konglomerat dickwandiger Gefäße besteht, die mit glatter Muskulatur assoziiert sind (Sardanelli et al. 1996; Hwang et al. 1998). Sie findet sich am häufigsten an einer Extremität, insbesondere am Unterschenkel und am Fuß (50–70 % der Fälle) (Hwang et al. 1998). Das Angioleiomyom verursacht Schmerzen, die oft mit Problemen mit Schuhen zusammenhängen und selbst durch ein leichtes Trauma ausgelöst werden können. Der US zeigt einen scharf abgegrenzten, massiven, echoarmen, abgerundeten Knoten, normalerweise weniger als 2 cm im Durchmesser, mit einem oder mehreren Arterienstielen, die sich innerhalb verzweigen (Abb.. 41). Die Spektral-Doppler-Analyse zeigt ein Strömungsmuster mit hohem Widerstand (Sardanelli et al. 1996). In der klinischen Praxis sollte das Angioleiomyom bei der Differentialdiagnose von schmerzhaften nodulären Läsionen der Extremität in Betracht gezogen werden. Andere vaskuläre Tumoren umfassen seltene aggressive Histotypen wie Hämangioendotheliom, Hämangioperizytom und Angiosarkom, die alle durch ein unspezifisches US-Erscheinungsbild gekennzeichnet sind.
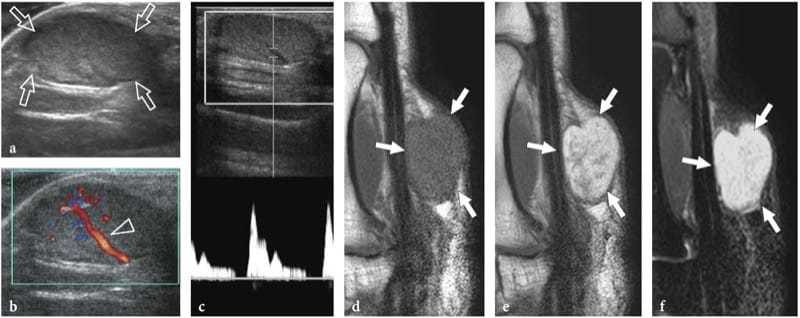
Abbildung 41. a–f. Angioleiomyom. a,b Sagittal-a-Graustufen- und b-Farbdoppler-US-Bilder der Handfläche zeigen eine subkutane scharf abgegrenzte solide echoarme Raumforderung (Pfeile) mit einem großen Arterienstiel, der sich darin verzweigt (Pfeilspitze). c Die Spektral-Doppler-Analyse der intratumoralen Gefäße zeigt arterielle Wellenformen mit hohem Widerstand. d–f Sagittal d T1w, e postkontrast T1w und f fettunterdrückte T2w MRT-Korrelation zeigen eine überwiegend hyperintense Raumforderung (Pfeile) in T2-Signalintensität und nach Gadolinium-Gabe. Im Postkontrastbild sind kleine hypointense Herde innerhalb des Tumors sichtbar.