Opioide spielen eine unverzichtbare Rolle in der Praxis der Anästhesiologie, der Intensivmedizin und der Schmerzbehandlung. Ein solides Verständnis der Opioid-Pharmakologie, einschließlich sowohl grundlagenwissenschaftlicher als auch klinischer Aspekte, ist entscheidend für die sichere und wirksame Anwendung dieser wichtigen Arzneimittel. Dieses Kapitel konzentriert sich fast ausschließlich auf intravenös verabreichte Opioid-Rezeptor-Agonisten, die perioperativ eingesetzt werden.
1. GRUNDLEGENDE PHARMAKOLOGIE
Struktur-Aktivität
Die Opioide von klinischem Interesse in der Anästhesiologie teilen viele strukturelle Merkmale. Morphin ist ein Benzylisochinolin-Alkaloid (Abb. 1). Viele häufig verwendete halbsynthetische Opioide werden durch einfache Modifikation des Morphinmoleküls hergestellt. Codein zum Beispiel ist das 3-Methyl-Derivat von Morphin. In ähnlicher Weise werden auch Hydromorphon, Hydrocodon und Oxycodon durch relativ einfache Modifikationen von Morphin synthetisiert. Komplexere Veränderungen des Morphin-Molekülskeletts führen zu gemischten Agonisten-Antagonisten wie Nalbuphin und sogar zu vollständigen Antagonisten wie Naloxon.
Die Fentanyl-Reihe von Opioiden ist chemisch mit Meperidin verwandt. Meperidin ist das erste vollständig synthetische Opioid und kann als Prototyp des klinischen Phenylpiperidins angesehen werden (siehe Abb. 1). Fentanyl ist eine einfache Modifikation der Phenylpiperidin-Grundstruktur. Andere häufig verwendete Fentanyl-Kongenere wie Alfentanil und Sufentanil sind etwas komplexere Versionen des gleichen Phenylpiperidin-Skeletts.
Opioide haben viele physikochemische Eigenschaften gemeinsam, obwohl einige einzelne Medikamente einzigartige Eigenschaften haben. Im Allgemeinen sind Opioide hochlösliche schwache Basen, die stark an Proteine gebunden und bei physiologischem pH-Wert weitgehend ionisiert sind. Die physikalisch-chemischen Eigenschaften von Opioiden beeinflussen ihr klinisches Verhalten. Zum Beispiel haben relativ ungebundene, nichtionisierte Moleküle wie Alfentanil und Remifentanil eine kürzere Latenz bis zum Erreichen der maximalen Wirkung nach der Bolusinjektion.
Mechanismus
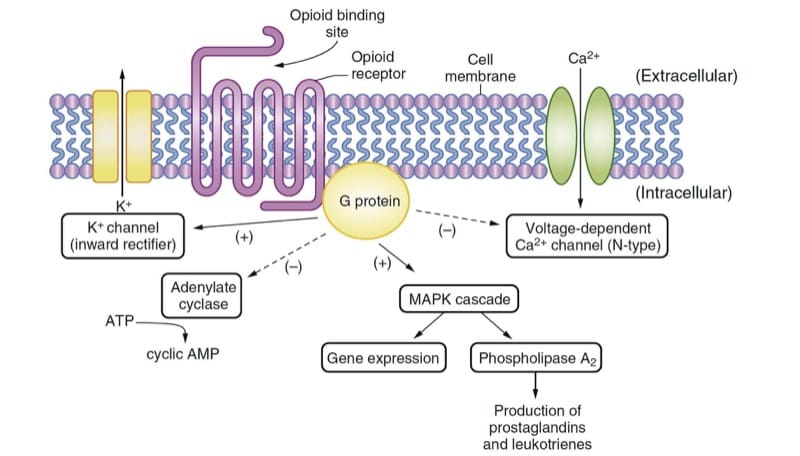
Opioide erzeugen ihre wichtigsten pharmakologischen Wirkungen durch Wechselwirkung mit Opioidrezeptoren, die typisch für die G-Protein-gekoppelte Familie von Rezeptoren sind, die in der Biologie weit verbreitet sind (z. B. β-adrenerg, dopaminerg und andere). Die Expression klonierter Opioidrezeptoren in kultivierten Zellen hat die Analyse der intrazellulären Signaltransduktionsmechanismen erleichtert, die durch die Opioidrezeptoren aktiviert werden. 1); diese Effekte gipfeln schließlich in einer Hyperpolarisierung der Zelle und einer Verringerung der neuronalen Erregbarkeit.
Drei klassische Opioidrezeptoren wurden mit molekularbiologischen Techniken identifiziert: μ, κ und δ. Vor kurzem wurde auch ein vierter Opioidrezeptor, ORL1 (auch bekannt als NOP), identifiziert, obwohl seine Funktion sich deutlich von der der klassischen Opioidrezeptoren unterscheidet. Jeder dieser Opioidrezeptoren hat einen allgemein verwendeten experimentellen Bioassay, assoziierte endogene Liganden, eine Reihe von Agonisten und Antagonisten und ein Spektrum physiologischer Wirkungen, wenn der Rezeptor agonisiert wird. Obwohl die Existenz von Opioidrezeptor-Subtypen (z. B. μ1 μ2) vorgeschlagen wurde, ist aus molekularbiologischen Techniken nicht klar ersichtlich, dass unterschiedliche Gene für sie existieren. Posttranslationale Modifikationen von Opioidrezeptoren treten sicherlich auf und können für widersprüchliche Daten zu Opioidrezeptor-Subtypen verantwortlich sein.(2)
Opioide entfalten ihre therapeutische Wirkung an mehreren Stellen. Sie hemmen die Freisetzung von Substanz P aus primären sensorischen Neuronen im Hinterhorn des Rückenmarks und mildern so die Übertragung von Schmerzempfindungen an das Gehirn. Opioidwirkungen im Hirnstamm modulieren die nozizeptive Übertragung im Hinterhorn des Rückenmarks durch absteigende Hemmungswege. Es wird angenommen, dass Opioide die affektive Reaktion auf Schmerzen durch Aktionen im Vorderhirn verändern; Decerebration verhindert die analgetische Wirkung von Opioiden bei Ratten.(3) Darüber hinaus induziert Morphin Signaländerungen in „Belohnungsstrukturen“ im menschlichen Gehirn.(4)
Studien an genetisch veränderten Mäusen haben wichtige Informationen über die Funktion von Opioidrezeptoren geliefert. Bei μ-Opioidrezeptor-Knockout-Mäusen fehlen Morphin-induzierte Analgesie, Belohnungseffekt und Entzugseffekt.(5,6) Wichtig ist, dass μ-Rezeptor-Knockout-Mäuse auch keine Atemdepression als Reaktion auf Morphin zeigen.(7)

- Abb.2 Wirkungsmechanismen von Opioiden. Der endogene Ligand oder das Medikament bindet an den Opioidrezeptor und aktiviert das G-Protein, was zu mehreren Effekten führt, die hauptsächlich inhibitorischer Natur sind. Die Aktivitäten der Adenylatcyclase und der spannungsabhängigen Ca2+-Kanäle werden unterdrückt. Die nach innen gleichrichtenden K+-Kanäle und die Kaskade der Mitogen-aktivierten Proteinkinase (MAPK) werden aktiviert. AMP, Adenosinmonophosphat; ATP, Adenosintriphosphat.
Stoffwechsel
Die intravenös verabreichten Opioide im routinemäßigen perioperativen klinischen Einsatz werden über viele Stoffwechselwege umgewandelt und ausgeschieden. Im Allgemeinen werden Opioide durch das hepatische mikrosomale System metabolisiert, obwohl für einige Opioide die hepatische Konjugation und die anschließende Ausscheidung durch die Niere wichtig sind. Bei bestimmten Opioiden hat der beteiligte spezifische Stoffwechselweg wichtige klinische Auswirkungen in Bezug auf aktive Metaboliten (z. B. Morphin, Meperidin) oder eine ultrakurze Wirkdauer (z. B. Remifentanil). Bei anderen Opioiden kann eine genetische Variation im Stoffwechselweg die klinischen Wirkungen drastisch verändern (z. B. Codein). Diese Nuancen werden in einem nachfolgenden Abschnitt behandelt, der sich auf einzelne Medikamente konzentriert.
2. KLINISCHE PHARMAKOLOGIE
Pharmacokinetics
Pharmakokinetische Unterschiede sind die primäre Grundlage für die rationale Auswahl und Verabreichung von Opioiden in der perioperativen Anästhesiepraxis. Wichtige pharmakokinetische Verhaltensweisen sind (1) die Latenz bis zum Erreichen der maximalen Konzentration am Wirkungsort nach der Bolusinjektion (d. h. Bolus-Front-End-Kinetik), (2) die Zeit bis zum klinisch relevanten Abfall der Konzentration nach der Bolusinjektion (d. h. Bolus-Back-End-Kinetik). ), (3) die Zeit bis zur Steady-State-Konzentration nach Beginn einer kontinuierlichen Infusion (d. h. Front-End-Kinetik der Infusion) und (4) die Zeit bis zum klinisch relevanten Abfall der Konzentration nach Beendigung einer kontinuierlichen Infusion (d. h. Infusionsrück- Endkinetik).
Die Anwendung pharmakokinetischer Konzepte von Opioiden auf die klinische Anästhesiologie erfordert die Anerkennung mehrerer grundlegender Prinzipien. Erstens hat eine Tabelle mit pharmakokinetischen Variablen einen begrenzten klinischen Wert. Das Verständnis des pharmakokinetischen Verhaltens wird am besten durch Computersimulation erreicht. Zweitens müssen Opioide, die als Bolusinjektion oder Dauerinfusion verabreicht werden, gesondert betrachtet werden. (8) Drittens müssen pharmakokinetische Informationen mit dem Wissen über die Konzentrations-Wirkungs-Beziehung und Arzneimittelwechselwirkungen (dh Pharmakodynamik) integriert werden, um klinisch nützlich zu sein.
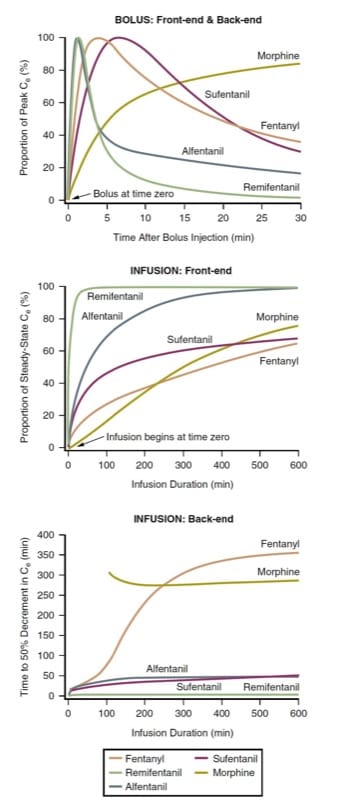
Die Latenz bis zum Spitzeneffekt und der Offset des Effekts nach der Bolusinjektion (dh Bolus-Front-End-Kinetik und Bolus-Back-End-Kinetik) verschiedener intravenöser Opioide können durch Vorhersage des Zeitverlaufs der Konzentrationen am Wirkungsort nach Verabreichung eines Bolus definiert werden . Da sich die Opioide in Bezug auf die Potenz (und damit die erforderlichen Dosierungen) unterscheiden, müssen die Konzentrationen am Wirkungsort zu Vergleichszwecken auf den Prozentsatz der Spitzenkonzentration für jedes Medikament normalisiert werden. Betrachtet man Morphin, Fentanyl, Sufentanil, Alfentanil und Remifentanil als die intraoperativ am häufigsten verwendeten Opioide, zeigt eine pharmakokinetische Simulation, wie sich Opioide in Bezug auf die Latenzzeit bis zur maximalen Wirkung nach Verabreichung eines Bolus unterscheiden (Abb. 3, oberes Feld). (9-12)
Die Simulation einer Bolusinjektion (siehe Abb. 3, oberes Feld) hat klinische Implikationen. Wenn beispielsweise ein rasches Einsetzen der Opioidwirkung erwünscht ist, ist Morphin möglicherweise keine gute Wahl. Wenn das klinische Ziel eine kurze Dauer der Opioidwirkung ist, gefolgt von einem schnellen Abbau, könnten Remifentanil oder Alfentanil bevorzugt werden. Beachten Sie, wie die Konzentration von Remifentanil sehr stark abgenommen hat, bevor die Spitzenkonzentration von Fentanyl überhaupt erreicht wurde. Die Simulation veranschaulicht, warum die Front-End-Kinetik von Fentanyl es zu einem Medikament macht, das sich gut für die patientenkontrollierte Analgesie (PCA) eignet (siehe auch Kapitel Erholung nach der Anästhesie und perioperatives Schmerzmanagement). Im Gegensatz zu Morphin zeigt sich die Spitzenwirkung eines Fentanyl-Bolus vor Ablauf einer typischen PCA-Sperrzeit, wodurch ein „Dose-Stacking“-Problem gemildert wird (siehe auch Kapitel Perioperative Schmerztherapie).
Die Latenz bis zum Spitzeneffekt wird durch die Geschwindigkeit bestimmt, mit der das Plasma und die Wirkungsstelle ins Gleichgewicht kommen (dh der ke0-Parameter). Arzneimittel mit einer schnelleren Äquilibrierung haben einen höheren „diffundierbaren“ Anteil (dh den Anteil des nicht gebundenen Arzneimittels) und eine hohe Lipidlöslichkeit. Jedoch kann eine sehr hohe Dosis sogar eines Opioids mit langsamer Wirkung zu einem scheinbar schnellen Wirkungseintritt führen (weil ein supratherapeutischer Arzneimittelspiegel an der Wirkungsstelle erreicht wird, obwohl die Spitzenkonzentration später eintritt).
Diese Simulation einfacher Infusionen mit konstanter Rate hat offensichtliche klinische Implikationen. Erstens ist die Zeit, die erforderlich ist, um einen wesentlichen Bruchteil der endgültigen Steady-State-Konzentration zu erreichen, im Zusammenhang mit der intraoperativen Verwendung sehr lang. Um einen nahezu stabilen Zustand schneller zu erreichen, muss ein Bolus verabreicht werden, bevor die Infusion begonnen (oder erhöht) wird. Remifentanil stellt vielleicht eine teilweise Ausnahme von dieser allgemeinen Regel dar. Außerdem steigen die Opioidkonzentrationen für viele Stunden nach Beginn einer Infusion an; mit anderen Worten, die Konzentrationen steigen typischerweise an, obwohl die Infusionsrate möglicherweise über Stunden gleich war! Dass Remifentanil relativ schnell einen nahezu stabilen Zustand erreicht, ist sicherlich einer der Gründe, warum es sich zu einem beliebten Medikament für die totale intravenöse Anästhesie (TIVA) entwickelt hat.
Die Zeit bis zum Steady-State nach Beginn einer kontinuierlichen Infusion lässt sich am besten durch pharmakokinetische Simulation untersuchen. Unter Verwendung der gleichen Prototypen wie bei der Bolusverabreichung zeigt die pharmakokinetische Simulation (Abb. 3, mittleres Feld) die Zeit, die erforderlich ist, um Steady-State-Konzentrationen am Wirkort zu erreichen (dh Infusions-Front-End-Kinetik).
Die Zeit bis zum Abklingen der Wirkung nach dem Stoppen einer Steady-State-Infusion wird am besten durch die kontextsensitive Halbzeitsimulation (CSHT) ausgedrückt.(13) Definiert als die Zeit, die erforderlich ist, um eine 50 %ige Konzentrationsabnahme nach dem Stoppen einer kontinuierlichen, Steady-State-Infusion ist die CSHT ein Mittel zur Normalisierung des pharmakokinetischen Verhaltens von Arzneimitteln, so dass rationale Vergleiche hinsichtlich des vorhergesagten Offsets der Arzneimittelwirkung angestellt werden können. Das CSHT konzentriert sich daher auf die „Infusions-Back-End“-Kinetik.
Das untere Feld von (Abb. 3) ist eine CSHT-Simulation für häufig verwendete Opioide. Bei den meisten Medikamenten ändert sich die CSHT mit der Zeit. Daher unterscheiden sich die vorhergesagten Back-End-Kinetiken für kurze Infusionen für die verschiedenen Arzneimittel nicht sehr (Remifentanil ist eine bemerkenswerte Ausnahme von dieser allgemeinen Regel). Wenn sich die Infusionszeit verlängert, beginnen sich die CSHTs zu differenzieren, was eine rationale Grundlage für die Arzneimittelauswahl liefert. Zweitens können je nach gewünschter Dauer der Opioidwirkung entweder kürzer wirkende oder länger wirkende Medikamente gewählt werden. Schließlich unterscheiden sich die Formen dieser Kurven in Abhängigkeit vom Grad der erforderlichen Konzentrationsabnahme. Mit anderen Worten, die Kurven, die die Zeit darstellen, die erforderlich ist, um eine Konzentrationsabnahme von 20 % oder 80 % zu erreichen (z. B. die 20 %- oder 80 %-Dekrementzeitsimulationen) sind ziemlich unterschiedlich.(8) Somit abhängig von der angewandten Anästhesietechnik , sind die CSHT-Simulationen nicht notwendigerweise die klinisch relevanten Simulationen (dh eine 50-prozentige Abnahme ist möglicherweise nicht das klinische Ziel). Außerdem berücksichtigt die CSHT-Simulation für Morphin keine aktiven Metaboliten (siehe spätere Erörterung einzelner Arzneimittel unter „Einzigartige Merkmale einzelner Opioide“).

- Abb. 3 Opioid-Pharmakokinetik. Simulationen, die das Front-End- und Back-End-Pharmakokinetikverhalten nach Verabreichung durch Bolusinjektion oder kontinuierliche Infusionen von Morphin, Fentanyl, Alfentanil, Sufentanil und Remifentanil unter Verwendung von pharmakokinetischen Parametern aus der Literatur veranschaulichen (Einzelheiten siehe Text).(9-12,45)
Pharmakodynamik
In vielerlei Hinsicht können die μ-Agonisten-Opioide als pharmakodynamisch gleichwertig mit wichtigen pharmakokinetischen Unterschieden betrachtet werden; das heißt, sowohl die therapeutischen als auch die nachteiligen Wirkungen sind im Wesentlichen gleich. Ihre Wirksamkeit als Analgetika und ihre Neigung, eine Atmungsdepression hervorzurufen, sind nicht voneinander zu unterscheiden. Pharmakodynamische Unterschiede bestehen bei Nicht-Opioidrezeptormechanismen wie der Histaminfreisetzung.
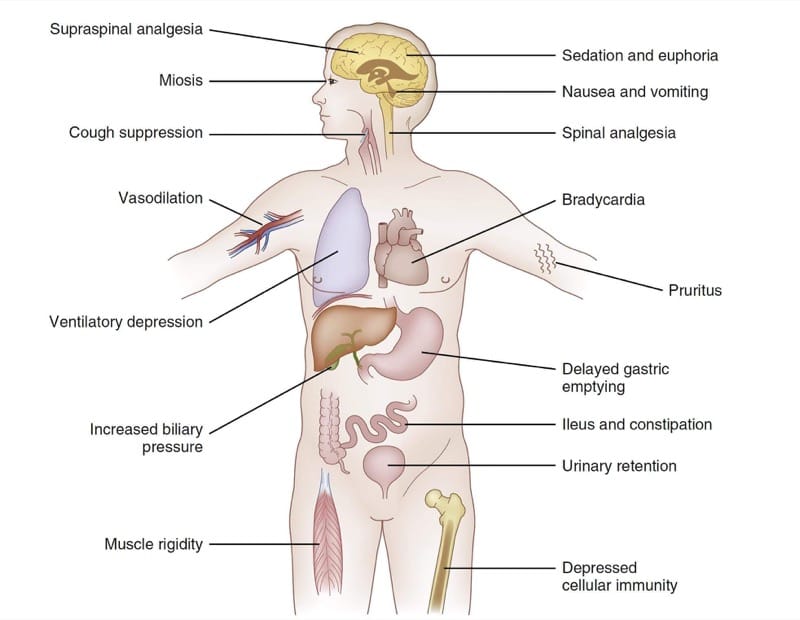
Da das Nervensystem die Funktion des gesamten Körpers stark beeinflusst, werden pharmakodynamische Wirkungen von Opioid-μ-Agonisten in vielen Organsystemen beobachtet. Abb. 4 fasst die wichtigsten pharmakodynamischen Wirkungen der Fentanyl-Kongenere zusammen. Abhängig von den klinischen Umständen und den klinischen Zielen der Behandlung können einige dieser weit verbreiteten Wirkungen als therapeutisch oder nachteilig angesehen werden. Beispielsweise könnte in einigen klinischen Umgebungen die durch μ-Agonisten erzeugte Sedierung als Therapieziel angesehen werden. Bei anderen würde Schläfrigkeit eindeutig als nachteilige Wirkung angesehen werden.

- Abb. 4 Pharmakodynamik von Opioiden. Ein zusammenfassendes Diagramm ausgewählter Wirkungen der Fentanyl-Kongenere (siehe Text für Details).
Therapeutische Wirkungen
Die Linderung von Schmerzen ist die primäre therapeutische Wirkung von Opioid-Analgetika. Opioide, die an den μ-Rezeptoren der Wirbelsäule und des Gehirns wirken, sorgen für Analgesie, indem sie sowohl den nozizeptiven Verkehr von der Peripherie dämpfen als auch die affektive Reaktion auf eine schmerzhafte Stimulation zentral verändern.
μ-Agonisten sind am wirksamsten bei der Behandlung von „zweiten Schmerz“-Empfindungen, die von langsam leitenden, myelinisierten C-Fasern getragen werden; Sie sind weniger wirksam bei der Behandlung von „ersten Schmerzempfindungen“ (getragen von kleinen, myelinisierten A-Delta-Fasern) und neuropathischen Schmerzen. Ein einzigartiger Aspekt der opioidinduzierten Analgesie (im Gegensatz zu Arzneimitteln wie Lokalanästhetika) ist, dass andere sensorische Modalitäten nicht beeinflusst werden (z. B. Berührung, Temperatur usw.).
Perioperativ (allerdings intraoperativ) ist auch die durch μ-Agonisten hervorgerufene Schläfrigkeit eine der angestrebten Wirkungen. Das Gehirn ist das anatomische Substrat für die sedierende Wirkung von μ-Agonisten. Mit zunehmender Dosis erzeugen μ-Agonisten schließlich Schläfrigkeit und Schlaf (die Linderung von Schmerzen trägt zweifellos zur Förderung des Schlafs bei Patienten mit Unbehagen sowohl prä- als auch postoperativ bei). Bei ausreichender Dosierung erzeugen die μ-Agonisten eine ausgeprägte Delta-Wellen-Aktivität im Elektroenzephalogramm, die dem Muster ähnelt, das während des natürlichen Schlafs beobachtet wird.
μ-Agonisten können natürlich durch Dosen, die keinen Schlaf erzeugen, eine signifikante Schmerzlinderung bewirken. Dies ist die klinische Grundlage für ihren Einsatz in der Schmerzbehandlung bei ambulanten Patienten. Die Verabreichung zusätzlicher Dosen führt jedoch schließlich zu Schläfrigkeit (und als Folge davon zur Unfähigkeit, zusätzliche Dosen anzufordern) und ist die wesentliche wissenschaftliche Grundlage für die Sicherheit von PCA-Geräten (siehe auch Kapitel Perioperative Schmerzbehandlung). Allerdings führen selbst große Dosen von Opioiden nicht zuverlässig zu Reaktionslosigkeit und Amnesie, und daher können Opioide bei alleiniger Anwendung nicht als vollständige Anästhetika angesehen werden.
Opioide unterdrücken über die Hustenzentren im Rückenmark auch den Hustenreflex. Die Abschwächung des Hustenreflexes macht vermutlich ein Husten und ein „Ruckeln“ gegen den Verweiltubus unwahrscheinlicher.
Unerwünschte Wirkungen

Atemstillstand ist die primäre Nebenwirkung von μ-Agonisten. Wenn der Atemweg gesichert und die Beatmung intraoperativ kontrolliert wird, ist eine opioidinduzierte Atemdepression von geringer Bedeutung. Eine Opioid-induzierte Atemdepression in der postoperativen Phase kann jedoch zu Hirnverletzungen und zum Tod führen.
μ-Agonisten verändern die Beatmungsreaktion auf arterielle Kohlendioxidkonzentrationen am Beatmungskontrollzentrum im Medulla. Die Unterdrückung der Ventilation wird durch den μ-Rezeptor vermittelt; μ-Rezeptor-Knockout-Mäuse zeigen keine Atemdepression durch Morphin.(14)
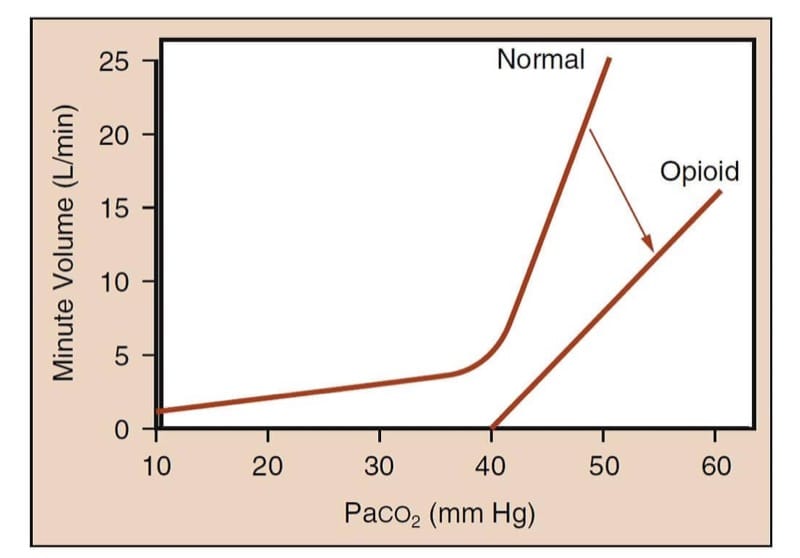
Bei unbehandelten Menschen erhöht ein Anstieg des arteriellen Kohlendioxid-Partialdrucks das Minutenvolumen deutlich (Abb. 5). Unter dem Einfluss von Opioid-Analgetika wird die Kurve abgeflacht und für einen gegebenen Kohlendioxid-Partialdruck nach rechts verschoben, was widerspiegelt, dass das Minutenvolumen kleiner ist. (15) Noch wichtiger ist, dass die „Hockeyschläger“-Form der normalen Kurve verloren geht ; das heißt, es kann einen Kohlendioxid-Partialdruck geben, unterhalb dessen der Patient in Gegenwart von Opioiden nicht atmet (dh die „Apnoe-Schwelle“).

- Abb. 5 Methodik der Opioid-induzierten Atemdepressionsstudie. Das Verfahren charakterisiert den Zusammenhang zwischen Paco2 und Minutenvolumen. Die mit „Normal“ bezeichnete Kurve stellt die erwartete Reaktion des Minutenvolumens auf steigende Paco2-Spiegel bei einem wachen Menschen dar. Beachten Sie den dramatischen Anstieg des Minutenvolumens bei steigender CO2-Spannung. Die mit „Opioid“ bezeichnete Kurve stellt die abgestumpfte Reaktion des Minutenvolumens auf steigende CO2-Spiegel nach Verabreichung eines Opioids dar. Beachten Sie, dass die Steigung der Kurve abnimmt und die Kurve nicht länger die Form eines „Hockeyschlägers“ hat; Dies bedeutet, dass bei physiologischen Paco2-Spiegeln der Patient, der ausreichend Opioid erhält, Apnoe oder schwere Hypoventilation haben kann. (Adaptiert von Gross JB. When you Breathe IN you inspire, when you DON'T Breathe, you . . . Expire: new insights related opioid-induced ventila-tory depression. Anesthesiology. 2003;99:767-770, mit Genehmigung verwendet .)
Die klinischen Anzeichen einer depressiven Ventilation sind bei moderaten Opioiddosen recht subtil. Postoperative Patienten, die eine Opioid-Analgetikatherapie erhalten, können wach und aufmerksam sein und dennoch ein signifikant verringertes Minutenvolumen aufweisen. Die Atemfrequenz (oft verbunden mit einem leicht erhöhten Tidalvolumen) nimmt ebenfalls ab. Mit zunehmender Opioidkonzentration nehmen die Atemfrequenz und das Atemzugvolumen zunehmend ab, was schließlich zu einem unregelmäßigen Atemrhythmus und schließlich zu einer vollständigen Apnoe führt.
Viele Faktoren können das Risiko einer opioidinduzierten Atemdepression erhöhen. Zu den eindeutigen Risikofaktoren gehören eine hohe Opioiddosis, fortgeschrittenes Alter, die gleichzeitige Anwendung anderer das zentrale Nervensystem (ZNS) dämpfender Mittel und Niereninsuffizienz (für Morphin). Natürlicher Schlaf verstärkt auch die atmungsdämpfende Wirkung von Opioiden.(16)
Opioide können die kardiovaskuläre Physiologie durch eine Vielzahl unterschiedlicher Mechanismen verändern. Im Vergleich zu vielen anderen Anästhetika (z. B. Propofol, flüchtige Anästhetika) sind die kardiovaskulären Wirkungen von Opioiden, insbesondere der Fentanyl-Kongenere, jedoch relativ gering (Ausnahmen sind Morphin und Meperidin – siehe nachfolgender Abschnitt zu einzelnen Medikamenten).
Die Fentanyl-Kongenere verursachen Bradykardie, indem sie den Vagusnerventonus im Hirnstamm direkt erhöhen, was experimentell durch Mikroinjektion von Naloxon in den Vagusnervenkern oder durch periphere Vagotomie blockiert werden kann.(17,18)
Opioide bewirken auch eine Vasodilatation, indem sie vasomotorische Zentren im Hirnstamm unterdrücken und in geringerem Maße durch eine direkte Wirkung auf Gefäße. Diese Aktion verringert sowohl die Vorlast als auch die Nachlast. Senkungen des arteriellen Blutdrucks sind ausgeprägter bei Patienten mit erhöhtem Sympathikustonus, wie z. B. Patienten mit dekompensierter Herzinsuffizienz oder Bluthochdruck. Klinische Dosen von Opioiden verändern die myokardiale Kontraktilität nicht nennenswert.
Opioide können Muskelstarre hervorrufen, normalerweise durch die schnelle Verabreichung großer Bolusdosen der Fentanyl-Kongenere. Diese Steifheit kann sogar die Beatmung über einen Beutel und eine Maske während der Narkoseeinleitung aufgrund der Steifheit und des Verschlusses der Stimmbänder nahezu unmöglich machen. (19) Das Auftreten von Steifheit fällt tendenziell mit dem Beginn der Nichtreagibilität zusammen. (20) Obwohl der Mechanismus der Opioid- induzierte Muskelrigidität ist unbekannt, es handelt sich nicht um eine direkte Wirkung auf den Muskel, da sie durch die Verabreichung von neuromuskulären Blockern eliminiert werden kann.
Eine durch μ-Agonisten induzierte Pupillenverengung kann ein nützliches diagnostisches Zeichen sein, das auf eine anhaltende Opioidwirkung hinweist. Opioide stimulieren den Edinger-Westphal-Kern des N. oculomotorius zur Produktion von Miosis. Selbst kleine Opioiddosen lösen diese Reaktion aus und es entwickelt sich nur eine sehr geringe Toleranz gegenüber der Wirkung. Somit ist Miosis ein nützlicher, wenn auch unspezifischer Indikator für eine Opioid-Exposition, selbst bei Opioid-toleranten Patienten. Opioid-induzierte Pupillenverengung ist durch Naloxon reversibel.
Opioide haben wichtige Wirkungen auf die gastrointestinale Physiologie. Opioidrezeptoren befinden sich im gesamten enterischen Plexus des Darms. Die Stimulation dieser Rezeptoren durch Opioide verursacht eine tonische Kontraktion der glatten Muskulatur des Gastrointestinaltrakts, wodurch koordinierte, peristaltische Kontraktionen verringert werden. Klinisch führt diese Kontraktion zu einer verzögerten Magenentleerung und vermutlich zu größeren Magenvolumina bei Patienten, die präoperativ eine Opioidtherapie erhalten. Postoperativ können Patienten einen Opioid-induzierten Ileus entwickeln, der möglicherweise die Wiederaufnahme der richtigen Ernährung und die Entlassung aus dem Krankenhaus verzögern kann. Eine Erweiterung dieses akuten Problems ist die chronische Verstopfung, die mit einer Langzeit-Opioidtherapie verbunden ist.
Ähnliche Effekte werden im Gallensystem beobachtet, das ebenfalls über eine Fülle von μ-Rezeptoren verfügt. μ-Agonisten können eine Kontraktion der glatten Muskulatur der Gallenblase und einen Spasmus des Schließmuskels von Oddi hervorrufen, was möglicherweise ein falsch positives Cholangiogramm während einer Operation an Gallenblase und Gallengang verursacht. Diese Wirkungen sind durch Naloxon vollständig reversibel und können teilweise durch eine Glukagonbehandlung rückgängig gemacht werden.
Obwohl die urologischen Wirkungen minimal sind, können Opioide manchmal einen Harnverhalt verursachen, indem sie den Detrusortonus der Blase verringern und den Tonus des Harnschließmuskels erhöhen. Diese Wirkungen werden teilweise zentral vermittelt, obwohl aufgrund der weitverbreiteten Präsenz von Opioidrezeptoren im Urogenitaltrakt auch periphere Wirkungen wahrscheinlich sind.(21,22) Obwohl die mit einer Opioidtherapie verbundene Harnretention typischerweise nicht ausgeprägt ist, kann sie bei Männern störend sein , insbesondere wenn das Opioid intrathekal oder epidural verabreicht wird.
Opioide unterdrücken die zelluläre Immunität. Morphin und das endogene Opioid β-Endorphin beispielsweise hemmen neben anderen immunologischen Wirkungen die Transkription von Interleukin 2 in aktivierten T-Zellen.(23) Einzelne Opioide (und möglicherweise Klassen von Opioiden) können sich hinsichtlich der genauen Art und des Ausmaßes unterscheiden ihrer immunmodulatorischen Wirkung. Obwohl die opioidinduzierte Beeinträchtigung der zellulären Immunität nicht gut verstanden ist, sind eine beeinträchtigte Wundheilung, perioperative Infektionen und ein Wiederauftreten von Krebs mögliche unerwünschte Folgen.
Drug Interactions
Arzneimittelwechselwirkungen können auf zwei Mechanismen beruhen: pharmakokinetischen (dh wenn ein Arzneimittel die Konzentration des anderen beeinflusst) oder pharmakodynamischen (dh wenn ein Arzneimittel die Wirkung des anderen beeinflusst). In der Anästhesiepraxis treten, obwohl manchmal unbeabsichtigte pharmakokinetische Wechselwirkungen auftreten, pharmakodynamische Wechselwirkungen mit praktisch jedem Anästhetikum auf und werden oft durch das Design erzeugt.
Die häufigste pharmakokinetische Wechselwirkung in der klinischen Pharmakologie von Opioiden wird beobachtet, wenn intravenöse Opioide mit Propofol kombiniert werden. Möglicherweise aufgrund der durch Propofol induzierten hämodynamischen Veränderungen und ihrer Auswirkungen auf pharmakokinetische Prozesse können die Opioidkonzentrationen größer sein, wenn sie in Kombination mit einer kontinuierlichen Propofol-Infusion verabreicht werden.(24)
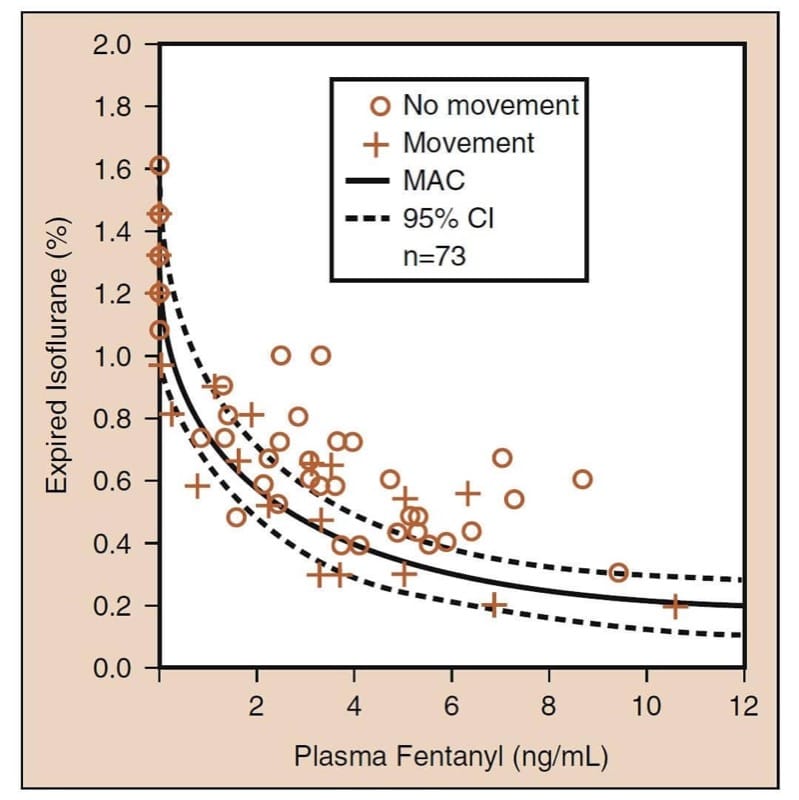
Die wichtigste pharmakodynamische Wechselwirkung mit Opioiden ist die synergistische Wechselwirkung, die auftritt, wenn Opioide mit Beruhigungsmitteln kombiniert werden. (25) In Kombination mit volatilen Anästhetika reduzieren Opioide die minimale alveoläre Konzentration (MAC) eines volatilen Anästhetikums (Abb. 6). Eine sorgfältige Untersuchung der Daten zur „Opioid-MAC-Reduktion“ offenbart mehrere klinisch kritische Konzepte (siehe Abb. 6). Erstens reduzieren Opioide synergistisch MAC. Zweitens ist die MAC-Reduktion beträchtlich (bis zu 75 % oder mehr). Drittens tritt der größte Teil der MAC-Reduktion bei moderaten Opioidspiegeln auf (dh selbst moderate Opioiddosen reduzieren MAC erheblich). Viertens ist die MAC-Reduktion nicht vollständig (dh Opioide sind keine vollständigen Anästhetika). Die Zugabe des Opioids kann die Notwendigkeit des anderen Anästhetikums nicht vollständig beseitigen. Und fünftens gibt es eine unendliche Anzahl von Hypnotikum-Opioid-Kombinationen, die eine MAC erreichen (dies impliziert, dass Ärzte die optimale Kombination basierend auf den Zielen der Anästhesie und der Operation auswählen müssen). Alle diese Konzepte gelten auch, wenn Opioide in Kombination mit Propofol für TIVA verwendet werden. (26)

- Abb.6 Verringerung der minimalen alveolären Konzentration (MAC) flüchtiger Anästhetika durch Opioide: das Prototypbeispiel von Isofluran und Fentanyl. Die durchgezogene Kurve ist MAC; die gepunkteten Kurven sind die 95 % Konfidenzintervalle (CIs) (siehe Text für Details). (Adaptiert von McEwan AI, Smith C, Dyar O, et al. Isoflurane minimum alveolarkonzentrationsreduzierung durch Fentanyl. Anesthesiology. 1993;78:864-869, mit Genehmigung verwendet.)
Spezielle Populationen
Leberversagen
Obwohl die Leber das Stoffwechselorgan ist, das hauptsächlich für die Biotransformation der meisten Opioide verantwortlich ist, ist Leberversagen normalerweise nicht schwerwiegend genug, um einen wesentlichen Einfluss auf die Pharmakokinetik von Opioiden zu haben. Natürlich bildet die anhepatische Phase der orthotopen Lebertransplantation eine bemerkenswerte Ausnahme von dieser allgemeinen Regel (siehe auch Kapitel Organtransplantation). Bei fortgesetzter Medikamentengabe steigen die Konzentrationen von Opioiden, die auf den Leberstoffwechsel angewiesen sind, wenn der Patient keine Leber hat. Selbst nach einer Leberteilresektion kommt es zu einem Anstieg des Verhältnisses von Morphinglucuroniden zu Morphin, was auf eine Abnahme der Morphinstoffwechselrate hindeutet.(27) Da der Metabolismus von Remifentanil völlig unabhängig von hepatischen Clearance-Mechanismen ist, wird seine Disposition während einer Lebertransplantation nicht beeinflusst .(28)
Pharmakodynamische Erwägungen können für die Opioidtherapie bei Patienten mit schwerer Lebererkrankung wichtig sein. Patienten mit anhaltender hepatischer Enzephalopathie sind besonders anfällig für die sedierenden Wirkungen von Opioiden. Daher muss diese Arzneimittelklasse bei dieser Patientenpopulation mit Vorsicht angewendet werden.
Nierenversagen
Nierenversagen hat Auswirkungen von großer klinischer Bedeutung in Bezug auf Morphin und Meperidin (siehe die folgende Diskussion zu einzelnen Arzneimitteln). Bei den Fentanyl-Kongeneren ist die klinische Bedeutung des Nierenversagens viel geringer. Der Metabolismus von Remifentanil wird durch eine Nierenerkrankung nicht beeinflusst. (29)
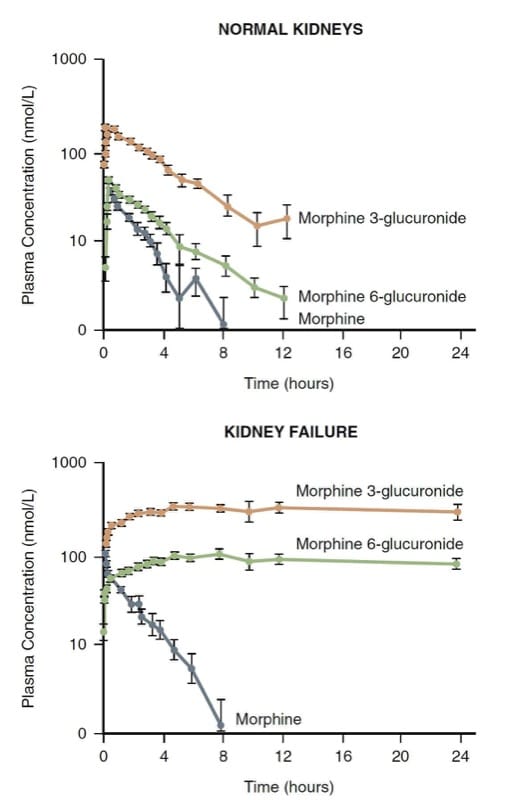
Morphin wird hauptsächlich durch Konjugation in der Leber metabolisiert; die resultierenden wasserlöslichen Glucuronide (dh Morphin-3-Glucuronid und Morphin-6-Glucuronid – M3G und M6G) werden über die Niere ausgeschieden. Die Niere spielt auch eine Rolle bei der Konjugation von Morphin und kann für die Hälfte seiner Umwandlung in M3G und M6G verantwortlich sein.
M3G ist inaktiv, aber M6G ist ein Analgetikum mit einer Potenz, die mit Morphin konkurriert. Bei Patienten mit Nierenversagen können sich sehr hohe M6G-Spiegel und eine lebensbedrohliche Atemdepression entwickeln (Abb. 7). (30) Folglich ist Morphin bei Patienten mit stark veränderten renalen Clearance-Mechanismen möglicherweise keine gute Wahl.
Die klinische Pharmakologie von Meperidin wird auch durch Nierenversagen signifikant verändert. Normeperidin, der Hauptmetabolit, hat analgetische und erregende ZNS-Wirkungen, die von Angst und Zittern bis hin zu Myoklonus und offenen Krampfanfällen reichen. Da die aktiven Metaboliten renal ausgeschieden werden, ist die ZNS-Toxizität als Folge der Akkumulation von Normeperidin bei Patienten mit Nierenversagen besonders besorgniserregend. Dieser Mangel an Meperidin hat dazu geführt, dass viele Krankenhausrezepturen seine Verwendung einschränken oder es ganz aus der Rezeptur streichen.

- Abb. 7 Die Pharmakokinetik von Morphin und seinen Metaboliten bei normalen Probanden im Vergleich zu Patienten mit Nierenversagen. Beachten Sie die signifikante Akkumulation der Metaboliten bei Nierenversagen. (Übernommen von Osborne R., Joel S., Grebenik K., et al. The pharmacokinetics of morphine and morphine glucuronides in kidney failure. Clin Pharmacol Ther. 1993;54:158-167, mit Genehmigung verwendet.)
Geschlecht
Das Geschlecht kann einen wichtigen Einfluss auf die Opioid-Pharmakologie haben. Morphin ist bei Frauen wirksamer als bei Männern und hat einen langsameren Wirkungseintritt bei Frauen. (31) Einige dieser Unterschiede können mit zyklischen Keimdrüsenhormonen und psychosozialen Faktoren zusammenhängen.
Alter
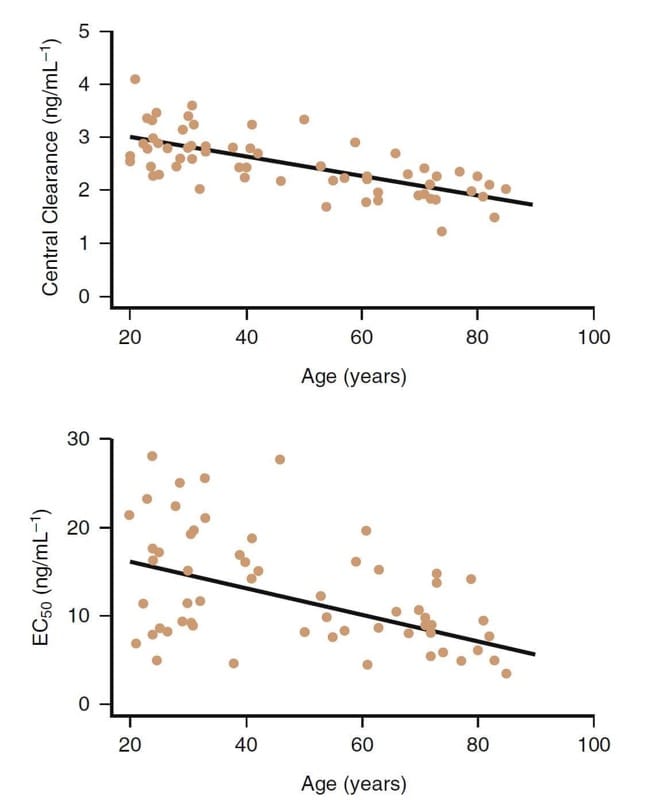
Fortschreitendes Alter ist eindeutig ein wichtiger Faktor, der die klinische Pharmakologie von Opioiden beeinflusst. Zum Beispiel sind Fentanyl-Kongenere bei älteren Patienten wirksamer (Abb. 8).(32,33) Abnahmen der Clearance und des zentralen Verteilungsvolumens treten auch bei älteren Patienten auf.
Mit zunehmendem Alter spielen zwar auch pharmakokinetische Veränderungen eine Rolle, pharmakodynamische Unterschiede sind jedoch in erster Linie für den verringerten Dosisbedarf bei älteren Patienten (> 65 Jahre) verantwortlich. Die Remifentanil-Dosen sollten bei älteren Patienten um mindestens 50 % oder mehr reduziert werden. Ähnliche Dosisreduktionen sind auch für die anderen Opioide ratsam.

- Abb.8 Der Einfluss des Alters auf die klinische Pharmakologie von Remifentanil. Obwohl es eine beträchtliche Variabilität gibt, haben ältere Personen im Allgemeinen eine niedrigere zentrale Clearance und eine höhere Potenz (dh niedrigere EC50).32
Fettleibigkeit
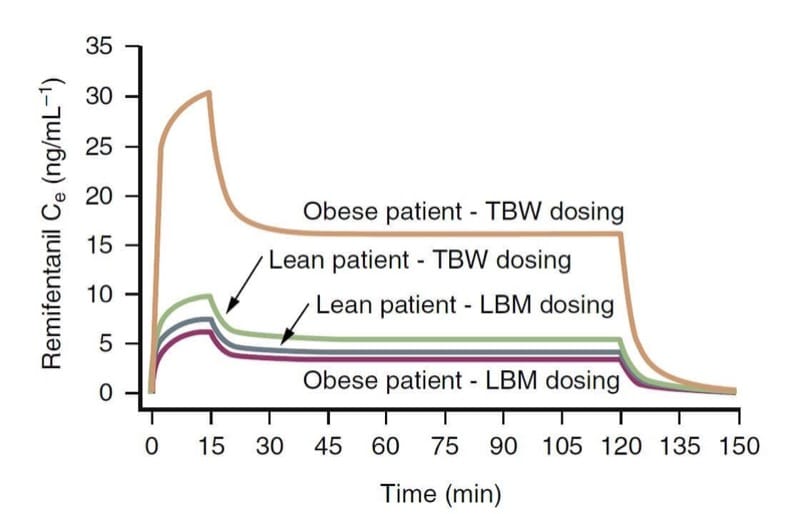
Das Körpergewicht ist wahrscheinlich ein wichtiger Faktor, der die klinische Pharmakologie von Opioiden beeinflusst. Die pharmakokinetischen Variablen von Opioiden, insbesondere die Clearance, hängen enger mit der fettfreien Körpermasse (LBM) als mit dem Gesamtkörpergewicht (TBW) zusammen. Praktisch bedeutet dies, dass krankhaft adipöse Patienten zwar eine höhere Dosierung benötigen als schlanke Patienten, um die gleiche Zielkonzentration zu erreichen, aber nicht so viel, wie es ihre TBW nahelegen würde. (34)
Wie zum Beispiel durch pharmakokinetische Simulation (Abb. 9) veranschaulicht, führt ein TBW-basiertes Dosierungsschema zu viel größeren Remifentanil-Wirkortkonzentrationen als eine Dosierungsberechnung basierend auf LBM.(35) Im Gegensatz dazu führen TBW- und LBM-Dosierungsschemata zu ähnliche Konzentrationen für schlanke Patienten. Diese Konzepte gelten wahrscheinlich auch für andere Opioide.

- Abb. 9 Eine pharmakokinetische Simulation, die die Konsequenzen der Berechnung der Remifentanil-Dosierung basierend auf dem Gesamtkörpergewicht (TBW) oder der mageren Körpermasse (LBM) bei übergewichtigen und schlanken Patienten veranschaulicht (1 μg/kg Bolusinjektion, gefolgt von einer Infusion von 0.5 μg/kg /min für 15 Minuten und 0.25 μg/kg/min für weitere 105 Minuten). Beachten Sie, dass die TBW-basierte Dosierung bei einem übergewichtigen Patienten zu dramatisch höheren Konzentrationen führt. (Übernommen von Egan TD, Huizinga B, Gupta SK, et al. Remifentanil pharmacokinetics in adipöse versus schlanke Patienten. Anesthesiology. 1998;89:562-573, mit Genehmigung verwendet.)
Einzigartige Merkmale einzelner Opioide
Kodein
Obwohl Codein intraoperativ nicht häufig verwendet wird, hat es unter den Opioiden aufgrund der damit verbundenen gut charakterisierten pharmakogenomischen Nuancen eine besondere Bedeutung. Codein ist eigentlich ein Prodrug; Morphin ist der Wirkstoff. Codein wird (teilweise) durch O-Demethylierung zu Morphin metabolisiert, ein Stoffwechselprozess, der durch die mikrosomale Isoform CYP2D6 der Leber vermittelt wird Kaukasier) oder deren CYP36D2 gehemmt ist (z. B. Patienten, die Chinidin einnehmen), würde nicht erwartet werden, dass sie von Codein profitieren, obwohl sie eine normale Reaktion auf Morphin zeigen. (6)
Morphium
Morphin ist das Prototyp-Opioid, mit dem alle Neuankömmlinge verglichen werden. Es gibt keinen Beweis dafür, dass ein synthetisches Opioid bei der Schmerzkontrolle wirksamer ist als das natürliche Morphin. Ohne die mit Morphin verbundene Histaminfreisetzung und die daraus resultierende Hypotonie hätte Fentanyl Morphin als intraoperativ am häufigsten verwendetes Opioid möglicherweise nicht ersetzt.
Morphin hat eine langsame Wirkungszeit. Der pKa von Morphin macht es bei physiologischem pH fast vollständig ionisiert. Diese Eigenschaft und seine geringe Lipidlöslichkeit sind für die verlängerte Latenzzeit von Morphin bis zur Spitzenwirkung verantwortlich; Morphin dringt langsam in das ZNS ein. Dieses Merkmal hat sowohl Vor- als auch Nachteile, die damit verbunden sind. Die verlängerte Latenzzeit bis zur maximalen Wirkung bedeutet, dass Morphin im Vergleich zu den schneller wirkenden Opioiden möglicherweise weniger wahrscheinlich eine akute Atemdepression nach Bolusinjektion typischer analgetischer Dosen verursacht. Auf der anderen Seite bedeutet die langsame Wirkungsdauer, dass Kliniker bei einem Patienten mit starken Schmerzen möglicherweise eher mehrere Morphindosen unangemessen „stapeln“, wodurch das Potenzial für eine toxische „Überschreitung“ entsteht (39).
Der aktive Metabolit von Morphin, M6G, hat wichtige klinische Auswirkungen. Obwohl die Umwandlung in M6G nur 10 % des Morphinstoffwechsels ausmacht, kann M6G selbst bei Patienten mit normaler Nierenfunktion zur analgetischen Wirkung von Morphin beitragen, insbesondere bei längerfristiger Anwendung. Aufgrund des hohen hepatischen Extraktionsverhältnisses von Morphin ist die Bioverfügbarkeit von oral verabreichtem Morphin signifikant geringer als nach parenteraler Injektion. Der hepatische First-Pass-Effekt auf oral verabreichtes Morphin führt zu hohen M6G-Spiegeln. Tatsächlich kann M6G der primäre Wirkstoff sein, wenn Morphin oral verabreicht wird. (40) Wie im vorangegangenen Abschnitt „Niereninsuffizienz“ erwähnt, ist die Akkumulation von M6G auf potenziell toxische Niveaus bei Dialysepatienten eine weitere wichtige Auswirkung dieses aktiven Metaboliten.
Fentanyl
Fentanyl ist möglicherweise das wichtigste Opioid, das in der modernen Anästhesiepraxis verwendet wird. Als ursprüngliches Fentanyl-Kongener ist seine klinische Anwendung gut etabliert und sehr vielfältig. Fentanyl kann auf zahlreiche Arten verabreicht werden. Außer auf intravenösem Weg kann Fentanyl auch auf transdermalem, transmukosalem, transnasalem und transpulmonalem Weg verabreicht werden.
Die orale transmukosale Verabreichung von Fentanylcitrat (OTFC) führt zu einem schnelleren Erreichen höherer Spitzenspiegel als beim Schlucken derselben Dosis. (41) Die Vermeidung des First-Pass-Effekts führt zu einer wesentlich größeren Bioverfügbarkeit. Da OTFC nicht invasiv ist und schnell eintritt, ist es eine erfolgreiche Therapie für Durchbruchschmerzen bei Opioid-toleranten Krebspatienten, oft in Kombination mit einem transdermalen Fentanylpflaster (siehe auch Kapitel 40).
Alfentanil
Alfentanil war das erste Opioid, das fast ausschließlich als Dauerinfusion verabreicht wurde. Aufgrund seiner relativ kurzen terminalen Halbwertszeit wurde ursprünglich vorausgesagt, dass die Wirkung von Alfentanil nach Beendigung einer kontinuierlichen Infusion schnell nachlässt. (42) Nachfolgende Fortschritte im pharmakokinetischen Wissen (dh der CSHT) erwiesen sich als falsch. 8) Alfentanil ist jedoch aufgrund seines hohen „diffusiblen Anteils“ nach einer einzelnen Bolusinjektion tatsächlich ein kurz wirkendes Medikament; es erreicht schnell Spitzenkonzentrationen am Wirkungsort und beginnt dann abzunehmen (siehe die vorherige Diskussion über „Pharmakokinetik“). Alfentanil veranschaulicht, wie ein Medikament je nach Verabreichungsmethode (dh Bolus versus Dauerinfusion) unterschiedliche pharmakokinetische Profile aufweisen kann. Alfentanil zeigt mehr als Fentanyl oder Sufentanil einen unvorhersehbaren hepatischen Metabolismus aufgrund der signifikanten interindividuellen Variabilität von hepatischem CYP3A4, dem primären Enzym, das für die Biotransformation von Alfentanil verantwortlich ist.
Sufentanil
Sufentanil zeichnet sich dadurch aus, dass es das stärkste Opioid ist, das üblicherweise in der Anästhesiepraxis verwendet wird. Da es am Opioidrezeptor von Natur aus wirksamer ist, sind die verwendeten absoluten Dosen im Vergleich zu anderen weniger wirksamen Arzneimitteln viel geringer (z. B. 1000-mal geringer als Morphindosen).
Remifentanil
Remifentanil ist ein Prototypbeispiel dafür, wie spezifische klinische Ziele erreicht werden können, indem Moleküle mit spezialisierten Struktur-Aktivitäts- (oder Struktur-Metabolismus-) Beziehungen entwickelt werden. Durch den Verlust seiner μ-Rezeptor-Agonist-Aktivität bei der Esterhydrolyse entsteht ein sehr kurz wirkendes Opioid (Abb. 10). (43) Der wahrgenommene ungedeckte Bedarf, der die Entwicklung von Remifentanil vorantreibt, war ein Opioid mit schnellem Wirkungs- und Wirkungseintritt, sodass das Medikament nach Bedarf hoch- und heruntertitriert werden kann, um den dynamischen Bedürfnissen des Patienten während der sich schnell ändernden Bedingungen von Anästhesie und Operation gerecht zu werden.
Im Vergleich zu den derzeit vermarkteten Fentanyl-Kongeneren ist die CSHT von Remifentanil kurz, in der Größenordnung von etwa 5 Minuten. (44) Pharmakodynamisch weist Remifentanil ähnlich wie Alfentanil eine kurze Latenz bis zur Spitzenwirkung und eine etwas geringere Potenz als Fentanyl auf. (45)
Die Rolle von Remifentanil in der modernen Anästhesiepraxis ist mittlerweile relativ gut etabliert. Remifentanil ist vielleicht am besten geeignet für Fälle, in denen sein ansprechendes pharmakokinetisches Profil vorteilhaft genutzt werden kann (z. B. wenn eine schnelle Genesung wünschenswert ist; wenn der Bedarf an Anästhetika schnell schwankt; wenn die Titration von Opioiden unvorhersehbar oder schwierig ist oder wenn eine erhebliche Gefahr für Opioide besteht Überdosierung oder wenn eine Opioid-Technik mit „großer Dosis“ vorteilhaft ist, der Patient aber postoperativ nicht mechanisch beatmet wird).(46) Die häufigste klinische Anwendung von Remifentanil ist die Bereitstellung von TIVA in Kombination mit Propofol. Es wird auch häufig als intravenöser Bolus verabreicht, wenn nur ein sehr kurzer Impuls der Opioidwirkung gefolgt von einer schnellen Erholung erwünscht ist (z. B. zur Vorbereitung einer Injektion eines Lokalanästhetikums während einer überwachten Anästhesieversorgung) (siehe Kapitel Ambulante Anästhesie).

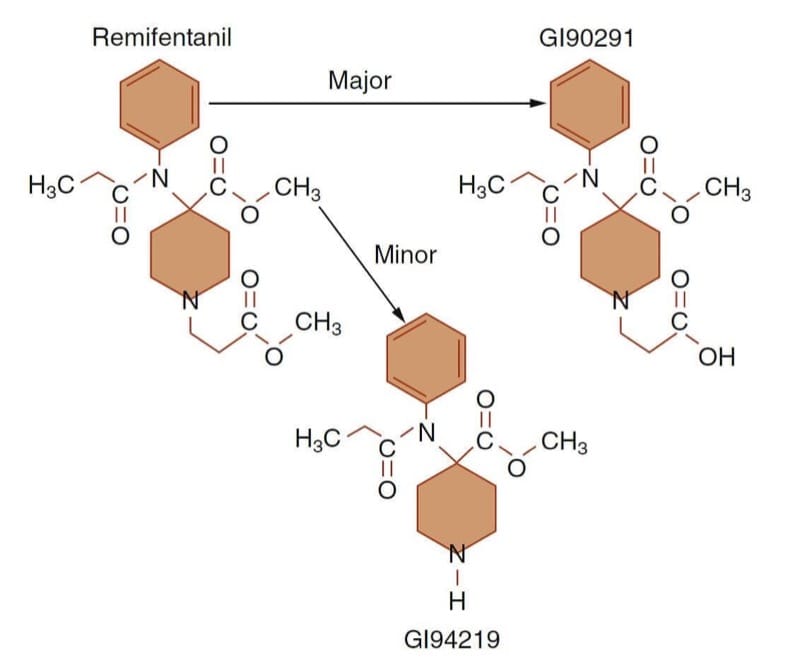
- Abb. 10 Stoffwechselweg von Remifentanil. Die Entesterung (dh Esterhydrolyse) durch unspezifische Plasma- und Gewebeesterasen zu einem inaktiven Säuremetaboliten (GI90291) macht den größten Teil des Metabolismus von Remifentanil aus. (Übernommen von Egan TD, Huizinga B, Gupta SK, et al. Remifentanil pharmacokinetics in adipöse versus schlanke Patienten. Anesthesiology. 1998;89:562-573, mit Genehmigung verwendet.)
Opioid-Agonisten-Antagonisten und reine Antagonisten
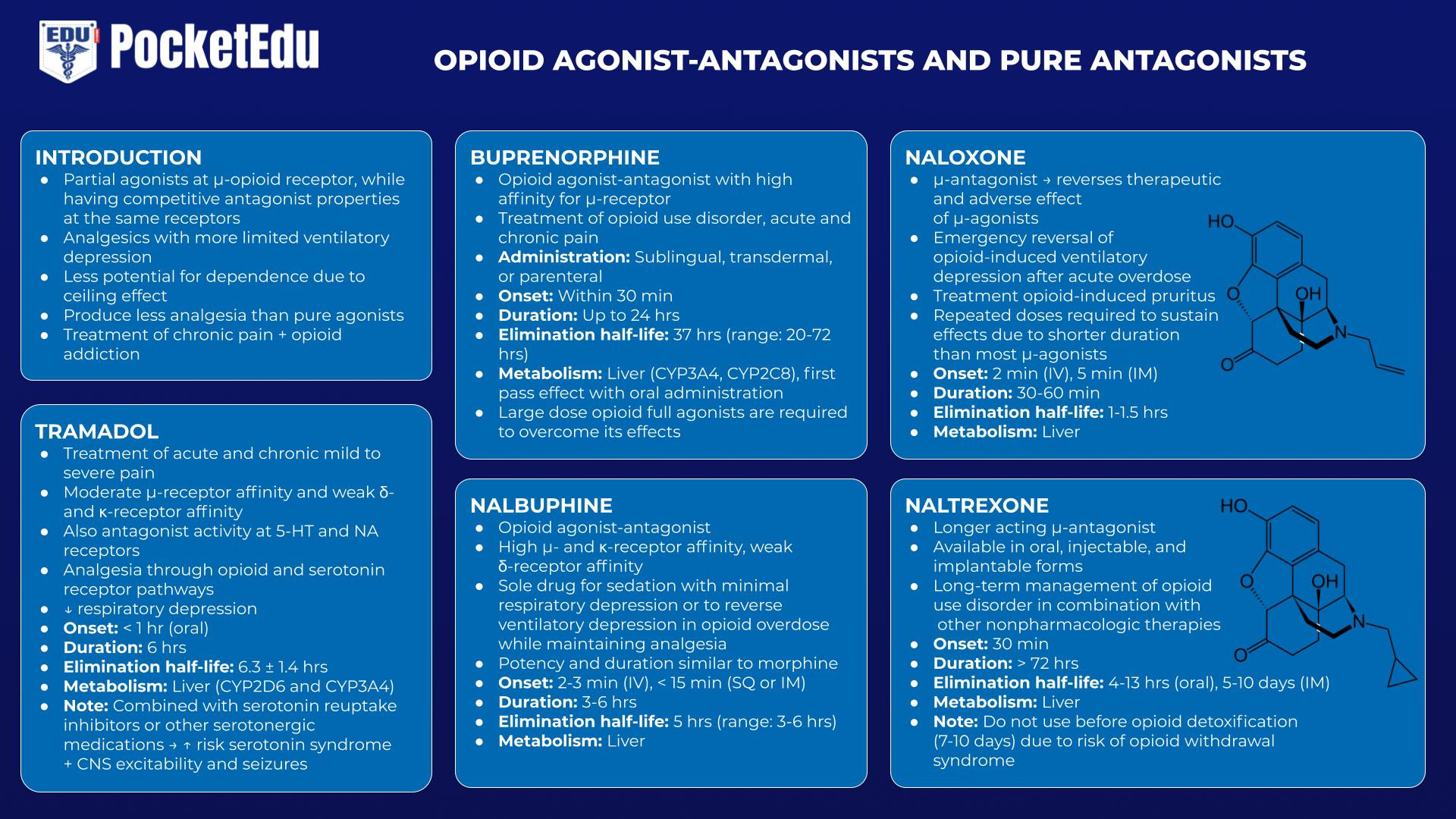
Opioid-Agonist-Antagonisten wirken als partielle Agonisten am μ-Rezeptor, während sie an denselben Rezeptoren kompetitive antagonistische Eigenschaften haben. Diese Medikamente dienen als Analgetika mit einer begrenzteren Atmungsdepression und einem geringeren Abhängigkeitspotential, da sie einen „Ceiling-Effekt“ zeigen, der im Vergleich zu reinen Agonisten eine geringere Analgesie hervorruft. Das geringere Missbrauchspotential war der primär wahrgenommene unerfüllte Bedarf, der der Entwicklung dieser Medikamente zugrunde lag. Arzneimittel dieser Kategorie werden zur Behandlung chronischer Schmerzen sowie zur Behandlung von Opioidabhängigkeit eingesetzt. Diese Arzneimittel verursachen einen gewissen Grad an kompetitivem Antagonismus, wenn sie in Anwesenheit einer andauernden vollen Agonistenaktivität verabreicht werden (z. B. wenn sie nach Morphin und anderen reinen Agonisten verabreicht werden). Reine Opioidantagonisten, von denen Naloxon der Prototyp ist, sind vollständige kompetitive Antagonisten des Opioidrezeptors, die keinerlei agonistische Aktivität aufweisen. Diese reinen Antagonisten werden zur Behandlung einer akuten Opioid-Überdosierung und eines chronischen Missbrauchs eingesetzt.
Tramadol
Tramadol ist ein zentral wirkendes Analgetikum mit mäßiger μ-Rezeptoraffinität und schwacher κ- und δ-Rezeptoraffinität. Bemerkenswerterweise hat Tramadol auch eine antagonistische Aktivität an den 5-Hydroxytryptamin (5-HT)- und nikotinergen Acetylcholin (NA)-Rezeptoren. Tramadol bietet zwar Analgesie sowohl über Opioid- als auch über Serotoninrezeptorwege, birgt jedoch ein geringeres Risiko einer Atemdepression. In Kombination mit Serotonin-Wiederaufnahmehemmern oder anderen serotonergen Medikamenten birgt es jedoch das Risiko eines Serotonin-Syndroms und auch einer Erregbarkeit des ZNS und Krampfanfällen. (47)
Buprenorphin
Buprenorphin ist ein Opioid-Agonist-Antagonist mit hoher Affinität zum μ-Rezeptor. Es kann sublingual, transdermal oder parenteral verabreicht werden, unterliegt aber bei oraler Verabreichung einem ausgedehnten hepatischen First-Pass-Metabolismus. Obwohl moderate Dosen zur Behandlung chronischer Schmerzen verwendet werden können, können höhere Dosen zur Behandlung chronischer Schmerzen die Wirkungen anderer Opioide antagonisieren, was die Behandlung akuter oder chronischer Schmerzen erschwert. Da es Opioidrezeptoren mit so hoher Affinität bindet und seine Eliminationshalbwertszeit im Bereich von 20 bis 72 Stunden liegt, sind hochdosierte Opioid-Vollagonisten erforderlich, um seine Wirkung zu überwinden.(48)
Nalbuphine
Nalbuphin ist ebenfalls ein Opioid-Agonist-Antagonist und hat eine Wirkungsstärke und -dauer, die Morphin ähneln. Es kann als alleiniges Medikament zur Sedierung mit minimaler Atemdepression sowie als Medikament zur Umkehrung der Atemdepression bei einer Opioid-Überdosierung verwendet werden, während eine gewisse Analgesie aufrechterhalten wird.(49)
Naloxon/Naltrexon
Naloxon ist ein injizierbarer μ-Antagonist, der sowohl die therapeutischen als auch die nachteiligen Wirkungen von μ-Agonisten umkehrt.(50) Die häufigste Indikation von Naloxon ist die notfallmäßige Aufhebung einer Opioid-induzierten Atmungsdepression nach einer akuten Überdosierung. Seine wichtige Rolle in dieser Hinsicht hat die Aufnahme von Naloxon in die „Liste der unentbehrlichen Arzneimittel“ der Weltgesundheitsorganisation verdient. Naloxon wird manchmal in viel geringeren Dosen während des Aufwachens aus der Anästhesie verwendet, um eine angemessene Beatmungsanstrengung wiederherzustellen und dadurch die Extubation der Luftröhre zu beschleunigen. Die Behandlung von Opioid-induziertem Juckreiz (wobei nur geringe Dosen erforderlich sind) ist eine weitere häufige therapeutische Anwendung.
Obwohl Naloxon bei der Umkehrung der mit Opioiden verbundenen Atmungsdepression sehr wirksam ist, hat es zahlreiche unerwünschte Wirkungen, darunter unter anderem akutes Entzugssyndrom, Übelkeit, Erbrechen, Tachykardie, Bluthochdruck, Krampfanfälle und Lungenödem Die Wirkung ist kürzer als die der meisten μ-Agonisten. Dies ist ein wichtiger Punkt bei der Festlegung des Dosierungsplans. wiederholte Dosen können erforderlich sein, um die Wirkung aufrechtzuerhalten.
Als Reaktion auf die Epidemie des Opioidmissbrauchs in den Vereinigten Staaten wurden neue Verabreichungssysteme entwickelt, die für den Notfallgebrauch durch Laien im Falle einer Opioid-Überdosis bestimmt sind; dazu gehören Nasenspray und Autoinjektorpräparate.(52,53)
Naltrexon, ein länger wirkender Opioid-μ-Antagonist, der in oraler, injizierbarer und implantierbarer Form erhältlich ist, wird zur Langzeitbehandlung von Opioidabhängigen in Kombination mit anderen nicht-pharmakologischen Therapien eingesetzt. (54)
3. KLINISCHE ANWENDUNG
Opioide spielen in praktisch allen Bereichen der Anästhesiepraxis eine entscheidende Rolle. Bei der Behandlung von postoperativen Schmerzen sind Opioide von vorrangiger Bedeutung, wohingegen Opioide in den meisten anderen Bereichen der perioperativen Medizin therapeutische Hilfsmittel sind, die in Kombination mit anderen Arzneimitteln verwendet werden.
Allgemeine klinische Indikationen
Die postoperative Analgesie ist die am längsten bestehende Indikation zur Opioidtherapie in der Anästhesiepraxis. In der Neuzeit ist die Verabreichung von Opioiden über PCA-Geräte vielleicht die häufigste Verabreichungsart. In den letzten Jahren werden Opioide zunehmend postoperativ mit verschiedenen anderen Analgetika wie nichtsteroidalen Antirheumatika (NSAIDs) kombiniert, um die Wirksamkeit und Sicherheit zu erhöhen.
Die international häufigste klinische Indikation für Opioide in der Anästhesiepraxis ist ihre Verwendung für die sogenannte balancierte Anästhesie. Dieser vielleicht irreführende Begriff bezeichnet die Verwendung mehrerer Medikamente (z. B. flüchtige Anästhetika, neuromuskuläre Blocker, Sedativa-Hypnotika und Opioide) in kleineren Dosen, um den Zustand der Anästhesie zu erreichen. Bei dieser Technik werden die Opioide hauptsächlich wegen ihrer Fähigkeit verwendet, die MAC zu verringern. Eine Grundannahme dieses ausgewogenen Anästhesieansatzes ist, dass die in Kombination verwendeten Medikamente die Nachteile der einzelnen Medikamente (dh der volatilen Anästhetika) mildern, die in größeren Dosen als Einzelmedikamententherapie verwendet werden.
„Großdosis-Opioid-Anästhesie“, eine Technik, die ursprünglich für Morphin in den frühen Tagen der Operation am offenen Herzen beschrieben wurde (55) und später mit den Fentanyl-Kongeneren in Verbindung gebracht wurde (56), ist eine weitere häufige Anwendung von Opioiden in der klinischen Anästhesie. Die ursprüngliche wissenschaftliche Untermauerung dieses Ansatzes bestand darin, dass große Dosen von Opioiden es dem Kliniker ermöglichten, die Konzentration des flüchtigen Anästhetikums auf ein Minimum zu reduzieren, wodurch die direkte myokardiale Depression und andere ungünstige hämodynamische Wirkungen bei Patienten vermieden wurden, deren kardiovaskuläres System bereits beeinträchtigt war. Außerdem erzeugt Fentanyl oft eine relative Bradykardie, die bei Patienten mit myokardialer Ischämie hilfreich sein könnte. Obwohl das allgemeine Konzept immer noch angewendet wird, sind die verwendeten Opioiddosen derzeit geringer. Opioide werden auch wegen ihrer möglichen vorteilhaften Wirkungen im Hinblick auf die Kardioprotektion (dh Präkonditionierung) verabreicht.
TIVA ist eine erst kürzlich entwickelte und zunehmend beliebte Indikation für Opioide in der Anästhesiepraxis. Diese Technik beruht vollständig auf intravenösen Arzneimitteln zur Bereitstellung einer Vollnarkose. Am häufigsten werden Dauerinfusionen von Remifentanil oder Alfentanil mit einer Propofol-Infusion kombiniert. Sowohl das Opioid als auch das Beruhigungsmittel werden häufig durch zielgesteuerte Infusions-(TCI)-fähige Pumpen verabreicht. Ein klarer Vorteil dieser Technik, vielleicht unter anderem, ist das gesteigerte Wohlbefinden des Patienten in der frühen postoperativen Phase, einschließlich weniger Übelkeit und Erbrechen und oft ein Gefühl der Euphorie. (57)
Rationale Arzneimittelauswahl und -verabreichung
Bei der Formulierung einer wissenschaftlichen Grundlage für eine rationale Opioidauswahl sind pharmakokinetische Überlegungen äußerst wichtig. Tatsächlich können die μ-Agonisten (Opioide) als pharmakodynamisch gleichwertig mit wichtigen pharmakokinetischen Unterschieden angesehen werden.(58) Daher erfordert die rationale Auswahl eines Opioid-μ-Agonisten gegenüber einem anderen, dass der Kliniker das gewünschte zeitliche Profil der Arzneimittelwirkung identifiziert und dann einen auswählt Opioid, das es dem Arzt am besten ermöglicht, dies zu erreichen (innerhalb offensichtlicher Einschränkungen, wie z. B. pharmakoökonomischer Bedenken).
Bei der Auswahl des geeigneten Opioids sind unter anderem folgende Schlüsselfragen zu beantworten: Wie schnell muss die gewünschte Opioidwirkung erzielt werden? Wie lange muss die Opioidwirkung aufrechterhalten werden? Wie kritisch ist es, dass die Opioid-induzierte Atmungsdepression oder Sedierung schnell verschwindet (z. B. wird der Patient postoperativ mechanisch beatmet)? Ist die Fähigkeit, das Ausmaß der Opioidwirkung während der Anästhesie schnell zu erhöhen und zu verringern, von entscheidender Bedeutung? Wird es postoperativ erhebliche Schmerzen geben, die eine Opioidbehandlung erfordern? All diese Fragen beziehen sich auf das optimale zeitliche Profil der Opioidwirkung. Die Antworten auf diese Fragen werden durch die Anwendung pharmakokinetischer Konzepte angegangen.
Wenn zum Beispiel ein kurzer Impuls der Opioidwirkung gefolgt von einer schnellen Erholung erwünscht ist (z. B. um eine Analgesie für einen retrobulbären Block bereitzustellen), könnte ein Bolus von Remifentanil oder Alfentanil bevorzugt werden. Wenn eine lang anhaltende Opioidwirkung erwünscht ist, z. B. wenn erhebliche postoperative Schmerzen auftreten oder wenn die Luftröhre intubiert bleibt, ist eine Fentanyl-Infusion eine umsichtige Wahl. Wenn der Patient kurz nach Abschluss des Eingriffs wach und aufmerksam sein sollte (z. B. eine Kraniotomie, bei der der Chirurg hofft, unmittelbar postoperativ eine neurologische Untersuchung im Operationssaal durchführen zu können), kann eine Remifentanil-Infusion vorteilhaft sein.
Die Formulierung einer rationalen Verabreichungsstrategie erfordert auch die richtige Anwendung pharmakokinetischer Prinzipien. Ein wichtiges Ziel jedes Dosierungsschemas ist es, ein Steady-State-Niveau der Opioidwirkung zu erreichen und aufrechtzuerhalten. Um eine Steady-State-Konzentration am Wirkort zu erreichen, werden Opioide heute häufig als Dauerinfusion verabreicht. Dies wird zunehmend durch den Einsatz der TCI-Technologie erreicht, was erfordert, dass der Kliniker mit dem geeigneten pharmakokinetischen Modell für das interessierende Opioid vertraut ist. Wenn diese Systeme nicht verfügbar sind, muss der Arzt daran denken, dass den Infusionen ein Bolus vorausgehen muss, um rechtzeitig einen nahezu stabilen Zustand zu erreichen.
4. NEUE ENTWICKLUNGEN
Opioide und Krebsrezidive
Der Einfluss der Opioidtherapie auf das Wiederauftreten von Krebs ist umstritten. Da die immunsuppressiven Wirkungen von Opioiden (insbesondere Morphin) und ihre Wirkung auf die Angiogenese in Tier- und In-vitro-Studien gezeigt wurden, sind Bedenken hinsichtlich des Einflusses dieser Arzneimittel auf das Wiederauftreten und Überleben von Krebs entstanden. Einige frühe retrospektive Daten zum Vergleich der Krebsrezidivraten bei Patienten, die postoperative Standard-Opioid-Analgesie erhielten, mit Patienten, die alternative Techniken (z. B. epidurale Schmerzbehandlung) erhielten, deuteten auf eine häufigere Krebsrezidivrate in der Opioidtherapie-Gruppe hin; andere Studien fanden widersprüchliche Ergebnisse. Eine retrospektive Überprüfung von mehr als 34,000 Brustkrebspatientinnen von 1996 bis 2008 zeigte keinen Zusammenhang zwischen einer Opioidtherapie und einem Wiederauftreten des Krebses. (59) In ähnlicher Weise fand eine retrospektive Überprüfung von 819 Patienten mit hepatozellulärem Karzinom, die entweder postoperativ intravenös Fentanyl oder postoperativ epidural mit Morphin erhielten, keine Auswirkung auf das rezidivfreie Überleben.(60)
Andere Studien haben jedoch einige verbesserte Ergebnisse mit opioidsparenden Techniken nahegelegt. Eine Überprüfung von 984 Patienten mit nicht-kleinzelligem Lungenkrebs von 2006 bis 2011 ergab ein verbessertes Überleben und ein längeres krankheitsfreies Überleben bei opioidsparenden Schmerzbehandlungsstrategien. (61) Daher bleibt die Rolle der perioperativen Opioidtherapie beim Wiederauftreten von Krebs umstritten; Laufende Studien werden die anästhesiebezogene klinische Entscheidungsfindung bei der Behandlung onkologischer Patienten weiter verfeinern.
Epidemie des Opioidmissbrauchs
Todesfälle im Zusammenhang mit dem Missbrauch und der Abzweigung von verschreibungspflichtigen Opioiden sind in den Vereinigten Staaten und anderswo sprunghaft angestiegen. (62) Neben Todesfällen hat dieses allgegenwärtige Muster der Verschreibung und des illegalen Opioidmissbrauchs zu einem enormen Anstieg der Einweisungen in Behandlungseinrichtungen für Opioidmissbrauch geführt. (63) Der Trend kann zumindest teilweise auf die Verschreibungspraxis von Opioiden bei chronischen Schmerzzuständen zurückzuführen sein, die einige Patienten für eine Sucht prädisponieren können. (64,65)
Die Epidemie hat ein solches Krisenniveau erreicht, dass Bundes- und Landesregierungen in den USA Gesetze erlassen und Mittel bereitgestellt haben, um die Erforschung, Prävention und Behandlung des Problems zu unterstützen. (66,67) Die staatlich zugelassene Apothekenabgabe von Naloxon (ohne ärztliche Verschreibung) für Patienten, die Opioidrezepte einlösen, ist ein bemerkenswertes Beispiel für die Bemühungen, die durch eine solche Gesetzgebung unterstützt werden. (68) Darüber hinaus haben Fachgesellschaften und die Centers for Disease Control and Prevention (CDC) neue Richtlinien für die Verschreibung von Opioiden erstellt. (69) Dies ist derzeit ein Bereich intensiver öffentlicher Diskussionen und medizinischer Untersuchungen.
5. FRAGEN DES TAGES
- Ein Patient benötigt eine postoperative patientenkontrollierte Analgesie (PCA). Was sind aus pharmakokinetischer Sicht die relativen Vorteile von Fentanyl im Vergleich zu Morphin für die Anwendung bei PCA?
- Welcher pharmakokinetische Parameter eignet sich am besten zur Beschreibung der Offsetzeit einer kontinuierlichen Opioidinfusion?
- Welche Auswirkungen haben Opioide auf das Atemminutenvolumen und die Atmungsreaktion auf Kohlendioxid?
- Wie beeinflusst Nierenversagen die Pharmakokinetik von Morphin und Meperidin?
- Einem Patienten mit postoperativer Atemdepression durch Morphin wird intravenös Naloxon verabreicht. Was sind die möglichen Nebenwirkungen von Naloxon?
- Welche Schlüsselfragen sollten bei der Auswahl eines Opioids für die intraoperative Anwendung beantwortet werden?