Kenneth D. Candido、Anthony R. Tharian 和 Alon P. Winnie
引言
静脉区域麻醉 (IVRA) 或“Bier 阻滞”技术于 1908 年由德国外科医生 August Bier 首次引入。 Bier 阻滞主要包括将局部麻醉溶液注入上肢或下肢的静脉系统,该静脉系统已通过压缩或重力放血,并已通过止血带与中央循环隔离。 在 Bier 的原始技术中,通过静脉插管注射浓度为 0.25% 至 0.5% 的局部麻醉剂普鲁卡因,该插管放置在两个用作止血带的 Esmarch 绷带之间,将手臂分为近端和远端部分。 注射局部麻醉剂后,比尔注意到两种不同类型的麻醉:在两个止血带之间几乎立即开始“直接”麻醉,然后在延迟 5 到 7 分钟后,在远端放置的远端“间接”麻醉止血带。 通过对注射亚甲蓝后的尸体上肢静脉系统进行解剖,Bier 能够确定直接麻醉是局部麻醉将裸露的神经末梢浸入组织中的结果,而间接麻醉很可能是由于局部麻醉通过神经血管输送到神经物质,发生典型的传导阻滞。 Bier 的结论是,两种麻醉机制与该技术相关:外周浸润阻滞和传导阻滞。 Bier 最初描述的技术在过去的 106 年中在现代实践中基本保持不变,除了在当前临床实践中引入了气动式双止血带制剂。图1).
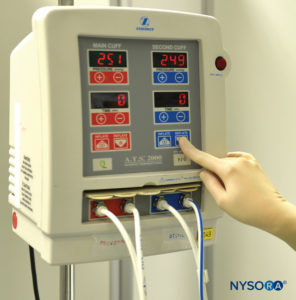
图1。双气动止血带系统,用于上肢或下肢静脉局部麻醉。
Bier 块可用于简短的外科手术或上肢或下肢的操作。 然而,由于在下肢使用 IVRA 时,止血带问题和其他安全问题似乎更频繁地出现,因此该技术在上肢的使用中得到了最大的认可。 Bier 阻滞也是一种已发现可用作复杂区域疼痛综合征 (CRPS)(以前称为反射性交感神经营养不良,伴有交感神经持续性疼痛)的患者的辅助治疗方法,可替代重复的交感神经节阻滞。 在这方面,IVRA 已被证明可以减少神经源性炎症,这是一种可能与 CRPS 相关的现象,对感觉功能几乎没有损害,至少当甲哌卡因是选择用于阻滞的局部麻醉剂时。 阻塞后 10 到 30 分钟对寒冷的敏感性显着降低,即使阻塞侧的皮肤温度降低。
与通常仅持续数小时的局部麻醉阻滞相比,使用带有胍乙啶或溴乙炔等药物的 IVRA 进行的化学交感神经切除术可持续长达 5 天。 此类阻滞前后的定量感觉测试(QSART,定量促汗轴突反射测试)表明,可以预测哪些患者在创伤性损伤或手术后使用 IVRA 胍乙啶阻滞可长期缓解疼痛。
尽管 IVRA 是一种安全有效的局部麻醉剂用于手术和疼痛控制的肢体阻滞,但一项已发表的大型调查指出,大多数第三年 (CA-3) 麻醉住院医师在整个手术过程中进行的此类阻滞不到 10 次。他们的训练。
解剖学
唯一相关的解剖结构是手部、肘前窝、足部和踝部静脉的位置和分布。
适应症
上肢
使用局部麻醉剂进行的静脉区域麻醉,最常见的是 0.5%–1% 的利多卡因(欧洲为 1% 的丙胺卡因),适用于需要长达 1 小时的麻醉时间的四肢手术和操作。 它最适合外周软组织手术,例如神经节切除术、腕管松解术、Dupuytren 挛缩手术或骨折复位术。 然而,使用 Esmarch 绷带为四肢放血的必要性,这是一种潜在的痛苦操作,可能会妨碍使用这种技术进行某些程序。图2 和 图3).
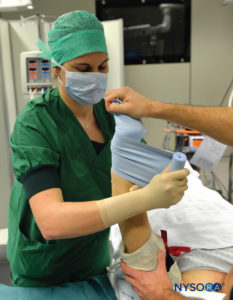
图2。使用紧紧包裹的 Esmarch 绷带从远端止血带底部到上肢近端,开始抬高左上肢的放血过程。
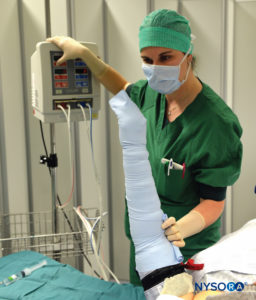
图3。 保持 Esmarch 绷带紧紧包裹,首先是远端止血带,然后是近端止血带,高于收缩动脉压 50-100 毫米汞柱。
同样,对尺神经、正中神经或桡神经的操作可能会导致感觉异常,这可能需要使用辅助的肠外镇痛剂或镇静剂。 IVRA 的一种新用途是在注射肉毒杆菌毒素 A (BTX-A) 治疗多汗症之前对手进行麻醉。 BTX-A 显着减少了汗液的产生,通过 Minor 的测试测量并通过角膜测量仪分析进行量化,但是除非事先对手进行麻醉,否则注射是痛苦的; 已发现 IVRA 适用于此目的。 根据最近的一项研究,对于影响上肢的 70 型 CRPS 患者,IVRA 和星状神经节阻滞 (SGB) 联合使用 30 mg 利多卡因和 1 μg 可乐定的镇痛程度和持续时间没有差异。 该研究得出结论,在这种情况下,IVRA 比 SGB 更可取,因为其不良副作用的风险较低,并且比 SGB 更容易执行。
上肢 IVRA 偶尔用于延长镇痛/麻醉(即手术预计持续时间超过 1 小时),在恢复麻醉状态之前强制止血带放气至少 1 分钟。
下肢
静脉局部麻醉可用于下肢的简短外科手术,其方式类似于上肢手术所述。 可以使用这种方法完成的外科手术包括切除肿块; 数字神经修复; 指骨骨折/脱位手术; 和副舟骨切除术。 任何需要大约 45 分钟或更短时间才能完成的足部、踝部或下肢远端骨科手术都可以采用这种方式。
尽管 IVRA 与 隔室综合征 在治疗胫骨干骨折并因此被视为禁忌症时,一项针对志愿者的研究表明,无论使用的盐水体积(≤1.5 mL/kg)或作为止血带充气期间注射盐水后的时间。 作者得出结论,在正常无创伤肢体中,使用生理盐水 (NS) 进行的模拟 IVRA 不会增加腿部前室内的组织压力。
儿科
在选定的儿科患者中,静脉内局部麻醉是一种可接受的选择,以减少上肢骨折。 一项回顾性研究比较了 IVRA 和清醒镇静剂在减少儿科前臂骨折方面的作用,发现 IVRA 是一种减少儿科前臂骨折的安全、有效且具有成本效益的方法。 IVRA组有600例患者,清醒镇静组有645例患者。 没有患者出现隔室综合征或需要继发于石膏应用的再入院。 程序性镇静组 28 名患者 (4.34%) 和 IVRA 组 13 名患者 (2.16%) 需要对他们的石膏进行一些干预。
禁忌症
IVRA 的唯一绝对禁忌症是患者拒绝。 相对禁忌症包括:
• 四肢挤压伤
• 无法定位外周静脉
• 局部皮肤感染
• 蜂窝织炎
• 复合骨折
• 有令人信服的局部麻醉剂过敏史的患者
• 四肢严重血管损伤的患者
• 已有血管动静脉分流管和不适合使用止血带的患者(即患有严重外周血管疾病的患者)
• 镰状细胞性贫血症
• 由于止血带疼痛的发生,计划进行>1 小时的手术通常不是IV 区域麻醉的良好指征。

来自区域麻醉纲要:静脉内区域麻醉(IVRA,Bier block):作用机制、适应症和禁忌症信息图。
设备
图1 至 图8 展示 IVRA 中使用的设备
1. 局麻药:盐酸利多卡因,0.25%~0.1%(替代品为丙胺卡因,0.5%)
2. 一根橡胶止血带(彭罗斯排水管),长 12-18 英寸(30-45 厘米)和 7/8 英寸。 宽(2.3 厘米),用于放置静脉插管前
3. 一个 20 或 22 号静脉导管(针上导管)(图5)
4. 一袋 500-mL 或 1-L 的静脉输液袋连接到输液器(与 hep lock 相比)连接到静脉插管以保持其通畅,直到将麻醉液注射到孤立的肢体中(可以替代一个盐水冲洗的静脉注射口)
5. 标准美国麻醉医师协会 (ASA) 监护仪(心电图仪、血压、脉搏血氧仪)
6. 复苏设备(静脉导管、晶体溶液、对侧上肢输液器)(用于上肢IVRA)
7. 两个适合所选肢体大小的气动止血带(数字6 和 9)
8. 一根 60 英寸长(152 厘米)和 4 英寸宽(10 厘米)的 Esmarch 绷带用于手臂放血(图 2、3、 和 7)
9. 无菌皮肤准备套装
10. 30 或 50 毫升 Luer 锁注射器
11. 100个用于混合溶液的刻度量杯,容量最好为XNUMX毫升
12. 胶带,各种尺寸
进一步了解 局部麻醉设备.
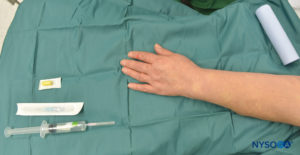
图4。 IVRA 的设备包括 Esmarch 绷带、局部麻醉药瓶、橡胶止血带、静脉 (IV) 外导管(针头上的导管)、酒精棉签和用于抽取局部麻醉剂的注射器。
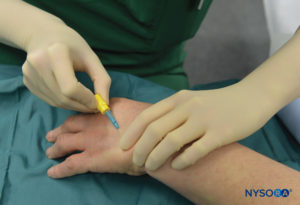
图5。静脉插管和 Hep-Lock 置于手的远端静脉中,为 IVRA 做准备。
患者准备
只要选择要放置的静脉易于接近,患者就躺在背卧位。 检查复苏设备,并对气动止血带进行测试并准备使用。 对于肘部手术,针将放置在前臂或肘前窝中。 对于手部或前臂的手术,最好选择手背的静脉(图5).
对于下肢手术,选择脚、脚踝或小腿上的静脉。 在非手术肢体获得静脉通路后(或者,可以确保中心静脉通路),完整的补充 ASA 监视器 应用,并评估基线生命体征。 如果患者疼痛剧烈,现在可以给予少量静脉镇痛剂(即芬太尼 1-2 μg/kg)以促进放血过程。 因为患者的全面合作对于成功并不重要,小剂量的水溶性苯二氮卓类药物(即咪达唑仑 15-25 μg/kg)也可用于抗焦虑。 选择苯二氮卓类药物的一个重要好处是抑制与局部麻醉剂毒性相关的惊厥反应,这是接受 IVRA 的患者的一个有效关注点,因为大量药物直接进入血管系统。
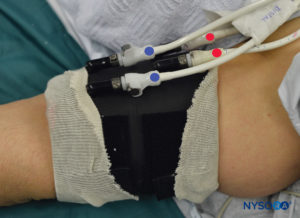
图6。 双止血带系统的近端 (RED) 和远端 (BLUE) 止血带清晰标记。 止血带总是按以下顺序充气:远端、近端。 检查功能后,远端止血带 (BLUE) 会放气。
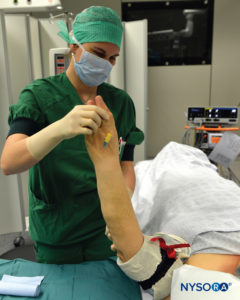
图7。 抬高肢体以允许被动放血。
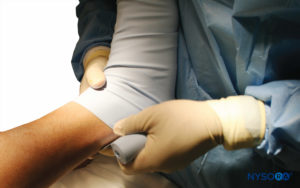
图8。 抬高的右下肢用紧绷的 Esmarch 绷带包裹在止血带上。
技术

来自区域麻醉纲要:静脉内区域麻醉(IVRA,Bier block):技术信息图。
上肢IVRA
以下是用于上肢手术的 IVRA 技术:
1. 插入留置塑料导管 在严格的无菌预防措施下,尽可能远地进入外周静脉(图5).
2. 将双气动止血带放置在上臂高处的近端袖带上 (数字6 和 7)。 虽然按照惯例,止血带放在二头肌区域,但一项研究发现,当止血带放在前臂而不是上臂时,利多卡因的剂量几乎可以减半。 1.5 名接受前臂和手部手术的患者接受了 IVRA,联合利多卡因 0.15 mg/kg 和酮咯酸 20 mg/kg,并在前臂上放置止血带。 另外 20 名接受类似手术的患者接受了 IVRA,其剂量是相同药物的两倍,止血带放置在上臂上。 上臂止血带组 19 例患者手术麻醉均评定为优,前臂止血带组 20/28 例患者手术麻醉评定为优。 两组感觉阻滞的发作和消退相似。 最近的一项研究比较了前臂止血带放置(n = 8)与 2 mL 10% 利多卡因和 28 mg 酮咯酸以及上臂止血带放置(n = 15)与 2 mL 20% 利多卡因和 XNUMX mg 酮咯酸,发现前臂患者与使用上臂止血带的组相比,止血带组的不适感更少,镇静干预更少,绕过麻醉后护理单元 (PACU) 的可能性更大。
3. 整个手臂被抬高以允许被动放血 (图7),然后将橡胶 Esmarch 绷带从手的指尖到双止血带的远端袖口螺旋缠绕在手臂上,以使手臂抽血 (数字2 和 3).
4. 腋动脉闭塞,在保持压力的同时,将近端充气袖带充气至高于收缩动脉压 50-100 mm Hg,然后移除 Esmarch 绷带。
5. 在近端袖带充气并移除 Esmarch 绷带后,注射 30-50 mL 0.5% 盐酸利多卡因 通过留置的塑料导管,体积取决于被麻醉手臂的大小。
6.至手术台水平,拔出手术肢体的静脉插管,用无菌纱布快速施压。
7. 麻醉开始后约 25-30 分钟或当患者抱怨止血带疼痛时,远端袖带充气,近端袖带放气 尽量减少止血带疼痛的发展。
下肢IVRA
上肢和下肢IVRA的唯一显着区别是下肢IVRA技术由于上肢和下肢之间明显的大小差异,需要相对较大量的局麻药溶液。 这对于从远端放置的静脉插管到近端止血带更完全地填充下肢较大的血管隔室是必要的(100 mL 与 50 mL)。
药理学注意事项
局部麻醉注意事项
利多卡因是美国用于 IVRA 的典型局部麻醉剂。 然而,在欧洲,丙胺卡因可能更常用,实际上已成为大多数临床试验的主题。 已尝试最大限度地提高利多卡因的功效,同时尽量减少副作用或 毒性 的代理。 在 0.5 名患者中研究了用于 IVRA 的 1.4% 利多卡因(使用 31% 碳酸氢钠)的碱化。 作者发现利多卡因碱化在感觉阻滞、运动阻滞或术后疼痛出现方面没有临床优势。 将利多卡因与碱化和非碱化 2-氯普鲁卡因(均以 0.5% 浓度使用并专门用于手部手术)进行比较时,碱化氯普鲁卡因的行为与利多卡因相似,但与利多卡因相比,普通氯普卡因没有任何益处,并且产生的副作用更多。
另一项研究在接受上肢手术的患者中比较了 IVRA 与低浓度/高容量利多卡因(0.5% 浓度 30-50 mL 利多卡因)和高浓度/低容量利多卡因(2% 浓度 12-15 mL 利多卡因)在高浓度/低容量组中显示出更快的感觉阻滞开始和延迟消退。 两组的收缩压和舒张压、平均血压、心率等血流动力学数据均无显着差异。
在两项独立的研究中,利多卡因与罗哌卡因用于上肢 IVRA 的效果进行了比较。 在 1.2 名志愿者中比较了两剂罗哌卡因(1.8 和 3.0 mg/kg)与一剂利多卡因(15 mg/kg)。 大剂量罗哌卡因组释放止血带后感觉和运动阻滞的恢复最慢。 利多卡因组中更多的患者(5 人中的 5 人)在松开止血带后出现头晕,而大剂量罗哌卡因组只有 1 人。 在第二项研究中,51 名患者随机接受 0.375% 的罗哌卡因或 0.5% 的利多卡因,剂量为 0.4 mL/kg 至 25 mL。 罗哌卡因组的术后镇痛(以首次申请镇痛剂来衡量)优于罗哌卡因组。
在 20 名健康志愿者中研究了用 0.3 mL 10% 罗哌卡因和双止血带置于前臂的 IVRA 后手部感觉阻滞的进展。 在手部放血后,使用 Esmarch 绷带将局部麻醉剂通过 22 号静脉导管注射到手背的显着静脉中,并依次将远端止血带充气至收缩血以上 150 毫米汞柱或 20 毫米汞柱压力(以较高者为准)和近端止血带至 250 毫米汞柱。 然后将远端止血带放气,并移除 Esmarch 绷带。 在阻滞前确定冷感和触感的基线值,并从局部麻醉剂注射后 5 分钟开始反复连续获得更新值,一直持续到所有区域失去感觉。 冷知觉几乎立即丧失,随后触觉丧失延迟且不均匀地扩散。 在手背的近端和远端均注意到麻醉的初始扩散,然后进展到指尖,延迟的近端扩散从手的手掌表面到手腕。
丙胺卡因已与利多卡因以及其他用于 IVRA 的局部麻醉剂进行了比较。 在评估感觉和运动阻滞的发作时,在 40 名接受 IVRA 的志愿者中将 0.5 mL 100% 丙胺卡因(10 mg)与相同体积和相同浓度的氯普鲁卡因进行了比较。 各组之间运动阻滞的发作没有差异,感觉恢复几乎同样好。 然而,丙胺卡因组的运动功能恢复时间较短,更多氯普鲁卡因患者在止血带放气后 30-45 分钟内出现静脉刺激或肘前荨麻疹迹象。 氯普鲁卡因组的心率变化也更为显着。 同一组研究人员将他们的研究扩大到包括 60 名患者,在前面详述的各个组中各有 30 名。 现在,研究人员发现丙胺卡因组感觉阻滞的完全恢复更快(7.1 分钟对 9.8 分钟)。 否则,氯普鲁卡因组的副作用发生率仍然较高。
接下来,这些研究人员比较了 0.5% 丙胺卡因与相同浓度的阿替卡因(一种较新的氨基酰胺类局部麻醉剂,含有噻吩,药理学上与甲哌卡因相似)用于上肢 IVRA。 阿替卡因是一种强效局部麻醉剂,由于其与酯酶的快速代谢,毒性程度低,被认为是丙胺卡因的合适替代品。 十名志愿者参与了这两个代理的双盲交叉比较。
他们发现两者在麻醉或运动阻滞的开始或感觉或运动功能的恢复方面没有显着差异。 然而,80% 的受试者在接受阿替卡因后出现皮疹,而丙胺卡因组为 20%。
将 0.5% 丙胺卡因与相同浓度的阿替卡因或利多卡因对 10 组每组 1 名患者进行 IVRA 进行比较时,发现阿替卡因组的感觉阻滞发作时间明显较短,其血浆峰浓度也最低止血带释放后局部麻醉。 已将 0.25% 丙胺卡因与相同的局部麻醉剂联合四种不同的 IVRA 添加剂进行了比较:布比卡因 150%、可乐定 25 μg、舒芬太尼 20 μg 或替诺昔康 XNUMX mg。 添加舒芬太尼组的感觉阻滞起效最快; 添加可乐定或替诺昔康可改善术后疼痛评分。 否则,五组在感觉阻滞的发作和持续时间方面没有显着差异。 与添加碳酸氢盐作为佐剂的利多卡因不同,在丙胺卡因中添加碳酸氢盐似乎确实缩短了 IVRA 期间的起效时间并延长了麻醉持续时间。
已经研究了使用甲哌卡因进行 IVRA。 对 1.4 名患者使用 40 mg/kg 共 20 mL 的 IVRA 与在对侧手臂上相同的个体中进行的盐水阻滞进行了评估。 动脉闭塞维持60分钟。 在 XNUMX 分钟的评估期内,甲哌卡因治疗组的反应性充血减弱,表明甲哌卡因是一种有效的血管收缩剂,作用时间长。 这一发现对在上肢血流受损或患有 CRPS 的个体中使用甲哌卡因有影响,对于这些人来说,可能不应将其视为首选的局部麻醉剂。
同一研究组评估了甲哌卡因 IVRA 对皮内辣椒素诱导的灼痛和微血管皮肤血流的影响,测量方法为 多普勒 灌注成像。 释放止血带 10 分钟后,甲哌卡因治疗组的反应性充血较少,而使用辣椒素后甲哌卡因治疗组的反应性充血面积更小。 作者得出结论,甲哌卡因 IVRA 对 IVRA 后细传入纤维的感觉功能没有影响,但不同程度地减少了辣椒素引起的耀斑的扩散。
NYSORA 小贴士
• 利多卡因是美国IVRA 的典型药物。 丙胺卡因在欧洲受到青睐。
• 利多卡因碱化对IVRA 商业利多卡因的优势很小(如果有的话)。
• 甲哌卡因强大的血管收缩特性降低了其作为IVRA 主要药物的整体吸引力。
IVRA 局部麻醉剂的辅助用药
对文献进行了系统评价,以评估使用 局部麻醉剂的辅助剂 对于 IVRA。 1217 项研究符合随机、双盲和对照的标准。 审查了 30 名研究对象的数据,研究的药物包括阿片类药物(芬太尼、舒芬太尼、哌替啶和吗啡); 可乐定; 肌肉松弛剂(阿曲库铵、泮库溴铵、米瓦库铵); 曲马多; 非甾体抗炎药(NSAIDs)(酮咯酸、替诺昔康、乙酰水杨酸盐); 使用碳酸氢钠碱化; 添加钾; 和温度变化。 作者发现确凿的证据支持使用非甾体抗炎药,尤其是酮咯酸可改善术后镇痛和延长 IVRA 期间止血带的耐受性。 阿片类药物在用于 IVRA 时表现不佳,只有 XNUMX mg 或更大剂量的哌替啶显示出显着的术后益处,但会导致放气后恶心、呕吐和头晕。 肌肉松弛剂改善了术后运动阻滞,并有利于骨折减少,其中肌肉松弛对于获得良好效果是必不可少的。
Alpha2 激动剂(可乐定和右美托咪定)
可乐定已添加到丙胺卡因和利多卡因中,作为 IVRA 的辅助手段用于四肢手术。 当 2 名接受上肢手术的患者以随机、双盲方式将 0.5 μg/kg 添加到 56% 丙胺卡因中时,各组之间感觉或运动阻滞的发作或持续时间没有差异。 使用可乐定的患者在释放止血带后动脉血压显着降低(24%–48%),而心率保持不变。
作者得出的结论是,可乐定作为局部麻醉剂的辅助用药效果有限。35 丙胺卡因中添加可乐定可显着抑制止血带疼痛,但并未改变止血带放气后的术后疼痛。
在接受腕管松解术的患者中,当将可乐定添加到利多卡因中用于 IVRA 时,发现可乐定没有提供可测量的益处。
右美托咪定对 α-肾上腺素受体的选择性比可乐定高 0.5 倍。 因此,它已在 IVRA 中用于确定它是否可能促进后一种药物注意到的一些有益发现。 0.5 名接受 IVRA 手部手术的患者仅接受 XNUMX% 利多卡因或利多卡因加右美托咪定 XNUMX μg/kg。
右美托咪定组的感觉和运动阻滞起效更快; 延长感觉和运动阻滞恢复; 延长对止血带的耐受性; 与仅接受局部麻醉的组相比,镇痛质量有所提高。
缩短的感觉阻滞发作时间; 延长感觉和运动阻滞恢复时间; 止血带镇痛时间延长; 在另一项随机、双盲研究中,比较氯诺昔康或右美托咪定在 IVRA 与丙胺卡因对手部或前臂手术患者的影响,并发现在接受 IVRA 和右美托咪定的患者中术后镇痛时间延长。 在这项研究中,对照组(n = 2)用 3% 丙胺卡因 25 mg/kg 实现 IVRA,右美托咪定组 2% 丙胺卡因 3 mg/kg 加右美托咪定 0.5 μg/kg(n = 25),氯诺昔康组中 2% 丙胺卡因 3 mg/kg 加氯诺昔康 8 mg(n = 25)。 各组药物用0.9%生理盐水稀释至总体积40 mL。
最近的一项研究比较了右美托咪定与利多卡因联合用于 IVRA 以及在 IVRA 前作为术前药物肠外给药时的效果,发现这两组的麻醉质量和围手术期镇痛效果相似。 这项研究是对接受腕管松解术的患者进行的,随机分为三组。
使用 40 mL 0.5% 利多卡因进行 IVRA。 在 IVRA 之前,分别向 P 组(n = 0.5)和 S 组(n = 20)给予单剂量的右美托咪定 15 μg/kg 和总体积为 15 mL 的安慰剂(盐水)溶液。 在 IVRA 期间,将 0.5 μg/kg 的右美托咪定添加到 A 组(n = 15)的利多卡因中。 记录感觉和运动阻滞的发作和恢复时间、术中术后视觉模拟评分(VAS)、Ramsay 镇静评分(RSS)、镇痛要求、血流动力学变量和副作用。 P组和A组感觉阻滞起效和恢复时间明显缩短,P组运动阻滞起效时间明显缩短,P组和A组术中VAS评分和镇痛要求降低。 P组术中RSS和P组、A组术后RSS均高于S组。P组术中、术后心率和术后平均动脉压(MAP)分别显着低于A组和S组。
阿片类药物
由于发现阿片受体存在于周围神经系统中,并且证明阿片类药物与臂丛神经阻滞的局部麻醉剂一起注射时可产生有效、持久的镇痛作用,因此一些研究人员试图降低局部毒性的可能性。通过添加阿片类药物来降低利多卡因的浓度,进行仅麻醉的 IVRA。 尽管尚未证明在利多卡因中添加芬太尼用于 IVRA 会改善镇痛效果同时降低风险,但在 200% 丙胺卡因中添加 0.5 μg 剂量的芬太尼确实比使用 100 μg 的患者具有更完全的镇痛效果添加,或当普通丙胺卡因用于 IVRA 时。 芬太尼添加组的术后恶心和中枢神经系统副作用高于仅接受局部麻醉的组。 然而,另外两项研究发现,在丙胺卡因中添加阿片类药物并没有提高该技术的成功率。 更多关于在丙胺卡因中添加阿片类药物对 IVRA 的影响的研究可能最终解决这一差异。
一些研究人员发现,在 0.25% 利多卡因中添加阿片类药物和肌肉松弛剂可提供与单独使用 0.5% 利多卡因相同的镇痛和肌肉松弛,同时降低全身毒性的可能性。 添加到利多卡因的佐剂包括芬太尼 50 μg 加泮库溴铵 0.5 mg、芬太尼加罗库溴铵、芬太尼加 D-筒箭毒碱和芬太尼加维库溴铵。 在每种情况下,作者都报告了出色的操作条件,并且由于利多卡因浓度能够降低到 0.20%(即超过正常使用量的二分之一),因此潜在的 全身毒性 至少减半。
当哌替啶 0.25%,40 mL (100 mg) 用作 IVRA 的单药时,产生了完全的运动阻滞,与利多卡因产生的效果一样。 在本研究组的 15 名患者中,运动阻滞的发作与感觉阻滞的发作一样快或更快。 然而,与本研究中的普通利多卡因相比,注射部位的头晕、恶心和疼痛的发生率更高。
曲马多
曲马多已被评估用于上肢 IVRA。 15 名志愿者分为 40 组,每组 0.25 名患者,每组接受 IVRA,其中 100 mL 曲马多 0.9%(0.5 mg)、0.25% 生理盐水、利多卡因 XNUMX% 或利多卡因加曲马多 XNUMX%。 仅曲马多和生理盐水的感觉和运动阻滞的发生和恢复相似——但是,在利多卡因中加入曲马多会导致感觉阻滞的发生更快,但会增加皮疹和注射时疼痛的烧灼感地点。 作者的结论是,单独使用曲马多不具有局部麻醉作用,但如果添加到局部麻醉剂(如利多卡因)中,可能会改变效果。
在另一项比较 0.5% 利多卡因加和不加曲马多治疗上肢 IVRA 的研究中,加曲马多组比仅局部组经历的止血带疼痛更少,但正如前面提到的研究,有几例皮肤荨麻疹在曲马多组中,但在仅利多卡因组中没有。 曲马多 (50 mg) 添加到利多卡因中用于 IVRA 用于上肢麻醉,在术中血流动力学数据、感觉阻滞恢复时间、发作方面与局部麻醉中添加舒芬太尼 (100 μg) 或可乐定 (25 μg/kg) 的作用相似以及运动阻滞、镇静评分和术后疼痛的恢复。1 总之,曲马多作为 IVRA 的单药无效,但与利多卡因联合使用可能会带来一些优势。 然而,这种优势可能会被在失血的肢体中静脉内给予曲马多的显着皮肤病副作用发生率所抵消。
肌肉松弛剂
可选择小剂量的非去极化肌松剂作为 IVRA 局麻药的辅助用药; 然而,由于 D-筒箭毒碱即使在合理的剂量下也会释放组胺,所以最好完全避免使用这种药物。 已将阿曲库铵添加到利多卡因中,以努力改善 IVRA 期间的肌肉松弛,特别是在减少上肢骨折和脱位期间。 IVRA 在利多卡因中加入 3 mg 阿曲库铵可缩短手部镇痛的起效时间,但止血带部位没有。 在同一项研究中,添加这种药物或将阿芬太尼添加到利多卡因中没有额外的好处。 一项将 2 mg 阿曲库铵添加到 40 mL 0.5% 利多卡因中进行手部手术的 40 名患者进行 IVRA 的研究,随机分配到两组中的一组患者中发现,添加阿曲库铵可提供更大程度的肌肉松弛,更容易减少骨折,并且更好的手术条件,以及更少的手术后疼痛。
新斯的明
新斯的明被建议用作镇痛剂,用于 硬膜外 和 鞘内 镇痛和麻醉,但缺乏其对周围神经系统有益的证据。 在两项研究中,一项使用添加到利多卡因中的新斯的明,另一项使用添加到丙胺卡因中的佐剂,结果相互矛盾。 在一项随机分为三个研究组之一的 1 名志愿者的研究中,将新斯的明 (0.5 mg) 添加到 54% 利多卡因用于 IVRA 时,发现与对照组相比,添加佐剂在镇痛或麻醉方面没有任何益处。 当随机分配到两个治疗组之一的 0.5 名患者中,将一半剂量的新斯的明 (3 mg) 添加到丙胺卡因 (30 mg/kg) 用于 IVRA 时,发现辅助组表现出感觉和运动阻滞发作时间缩短与单纯丙胺卡因组相比,感觉和运动阻滞恢复时间延长,麻醉质量提高,首次镇痛需要时间延长。
最近的一项研究观察了在 0.5 mL 40% 利多卡因中添加 0.5 mg 新斯的明对接受择期或紧急前臂和手部手术的患者进行 IVRA 的效果,随机分为两组,1 mL 等渗盐水添加到 40 mL 0.5% 的生理盐水中与对照组相比,对照组的利多卡因注意到新斯的明组感觉和运动阻滞的发作时间显着缩短,恢复时间更长。 两组术中麻醉质量和止血带疼痛频率相似。 似乎需要通过合并更大患者样本量的额外工作来确认与两种不同剂量的新斯的明添加到利多卡因中的相互矛盾的结果,以解决前面提到的两项小型研究中的差异。
非甾体抗炎药
其他使用利多卡因改善 IVRA 的尝试包括使用 NSAID 来抑制止血带疼痛,同时增强术后镇痛。 尽管酮咯酸已显示出一些疗效,但其他非甾体抗炎药的表现却不尽如人意。 在接受手部或前臂手术的患者中,使用前臂或上臂止血带研究了酮咯酸作为利多卡因的佐剂。 在这项研究中,患者被随机分为两组:UA 组,由 20 名接受上臂止血带的 IVRA 患者组成; 和 FA 组,由 20 名接受前臂止血带的 IVRA 患者组成。 上臂止血带组患者接受 0.5% 利多卡因 3 mg/kg 剂量的 IVRA 加 0.3 mg/kg 酮咯酸。 前臂止血带组的 IVRA 采用 0.5% 利多卡因 0.15 mg/kg 加上酮咯酸 0.15 mg/kg。 两组在感觉阻滞的发生时间和持续时间以及是否需要补充镇痛剂方面没有统计学上的显着差异。 两组的术后疼痛评分也相似。 作者得出结论,前臂止血带 IVRA 与 0.5% 利多卡因剂量为 1.5 mg/kg 加酮咯酸 0.15 mg/kg 是一种安全且临床上可行的选择,其提供的围手术期麻醉和镇痛与使用 0.5% 上臂止血带 IVRA 提供的相似利多卡因 3 mg/kg 加上酮咯酸 0.3 mg/kg,同时将利多卡因和酮咯酸的剂量减半。
在一项对 45 名患者进行的研究中,另一种 NSAID 替诺昔康被添加到丙胺卡因中。 接受 IVRA 以减少 Colles 骨折的患者使用 20 mg 剂量的 NSAID,患者分为三组。 一组仅接受局部麻醉; 20人接受局部加替诺昔康; 一组进行了仅局部麻醉的 IVRA 加静脉注射非甾体抗炎药。 在最后一组中,替诺昔康(XNUMX mg)被注射到对侧手臂,与 IVRA 手术手臂相对。 在局部麻醉剂中加入非甾体抗炎药的组比其他两组患者的镇痛效果更好,疼痛评分更低。
最近一项比较氯诺昔康和芬太尼联合利多卡因用于手部手术患者的 IVRA 的术中和术后镇痛效果的研究表明,氯诺昔康组的感觉阻滞恢复时间和首次镇痛剂需要时间增加,而副作用的发生率没有增加,与仅利多卡因组和带有芬太尼组的利多卡因相比。 在这项研究中,共有 45 名患者被随机分为三组。 第 1 组患者接受 3 mg/kg 2% 利多卡因(40 mL); 第 2 组接受 3 mg/kg 利多卡因、38 mL 加氯诺昔康 2 mL (4 mg/mL); 第 3 组接受 3 mg/kg 利多卡因、38 mL 加 2 mL 芬太尼(0.05 mg/mL)。 该研究还得出结论,在利多卡因 IVRA 中添加芬太尼(第 3 组)似乎优于利多卡因 IVRA(第 1 组)和氯诺昔康添加到利多卡因 IVRA(第 2 组)中减少止血带疼痛; 然而,这是以增加瘙痒等副作用为代价的。
右酮洛芬是另一种已被研究作为利多卡因辅助治疗 IVRA 的 NSAID。 在这项前瞻性、随机、安慰剂对照研究中,计划进行选择性手部或前臂软组织手术的患者被随机分为三组。 所有 45 名患者均接受 0.5% 利多卡因作为 IVRA。 右酮洛芬 50 mg 静脉注射或添加到 IVRA 溶液中,对照组接受等体积的生理盐水静脉注射和作为 IVRA 的一部分。 记录感觉和运动阻滞起效时间、恢复时间和术后镇痛剂用量。 与对照组相比,在 IVRA 溶液中添加右酮洛芬后,感觉和运动阻滞起效更快,恢复时间更长,术中和术后疼痛评分降低,术后镇痛剂需求减少。 本研究中使用的右酮洛芬药理学制剂含有乙醇作为赋形剂。 作者指出,乙醇的神经溶解作用可能有助于本研究中 IVRA 组感觉和运动阻滞的更快发展和更长的恢复时间。
其他特定药物:皮质类固醇
在类风湿性关节炎 (RA) 患者的 IVRA 局部麻醉剂中添加糖皮质激素类类固醇时,已经评估了这些药物的抗炎特性。 在一项随机、双盲、交叉、安慰剂对照研究中,20 名 RA 患者接受了 50 mg 甲哌卡因 0.25% 甲哌卡因或甲哌卡因平原用于上肢 IVRA。 另一肢接受相反的治疗。 一周后,将相同的药物分别注射到对侧四肢。 1% 的患者在 6 周和 6 周报告主观改善; 握力等客观参数直到 XNUMX 周评估才发生变化,此时注意到显着增加,握力分离和运动引起的疼痛减少。 该报告表明,IVRA 给予的皮质类固醇可以为某些 RA 患者提供持续镇痛。
类固醇 IVRA 也被用作 1 型 CRPS 的辅助治疗。40 名患者以随机、双盲、安慰剂对照的方式将甲基强的松龙 (22 mg) 添加到利多卡因用于 IVRA。 每周进行一次治疗,最多三个疗程。 研究人员发现在局部添加类固醇在改善疼痛严重程度或缩短病程方面没有任何益处。 有趣的是,一项涉及 168 例上肢 1 型 CRPS 患者的病例系列使用 25 mL 0.5% 利多卡因和 125 mg 甲基强的松龙稀释在 10 mL 生理盐水中进行 IVRA 治疗,并在 5 年内随访报告完全没有在随访期结束时,92% 的患者出现疼痛。 IVRA 是在止血带保持充气 20 分钟的情况下进行的,在此期间操作受影响的肢体以试图增加运动范围。 然后将止血带逐渐放气以避免注射剂快速进入循环。
根据患者症状的强度和持续性,每周重复一次或两次相同的过程,并且在两次治疗之间,患者接受温和的物理治疗,不会延长或压力。 平均需要 4.8 个疗程来缓解症状并提供功能性肢体。 作者将临床结果归因于 1 型 CRPS 在开始治疗时的早期阶段以及与之前的研究相比甲基强的松龙剂量增加。
对乙酰氨基酚
由于其已知的镇痛作用,对乙酰氨基酚 (APAP)(扑热息痛)已被研究作为在 IVRA 下接受手部手术的患者的局部麻醉剂的辅助剂。 3 名接受手部手术的患者被随机分为三组。 所有组均接受用生理盐水稀释至总体积为 40 mL 的 IVRA 利多卡因 (1 mg/kg)。 第 2 组接受 IVRA 利多卡因加静脉注射盐水。 第 300 组接受 IVRA 利多卡因和 APAP(3 mg)混合物加静脉注射盐水; 第 300 组接受 IVRA 利多卡因加静脉 APAP (1 mg)。 在手术期间评估感觉和运动阻滞的开始时间、止血带疼痛和镇痛药的使用。 止血带放气后,VAS 评分分别在 2、4、6、12、24 和 24 小时; 首次需要镇痛剂的时间; 前 2 小时的总镇痛药用量; 并注意到副作用。 三组之间感觉阻滞的发生无显着差异; 然而,第 2 组感觉阻滞的持续时间明显更长。第 2 组的运动阻滞开始时间较短,运动阻滞的持续时间较长。止血带疼痛减轻,麻醉质量评分由失明的麻醉师报告与研究药物相比,第 300 组的疼痛评分也显着升高。三组之间的术后疼痛评分没有明显降低。 作者确实指出了 APAP(XNUMX 毫克)的任意剂量是该研究的缺陷。 需要进一步的剂量范围研究来优化对乙酰氨基酚在用作 IVRA 利多卡因的佐剂时的剂量。
另一项评估在 IVRA 中加入利多卡因时 APAP 对感觉和运动阻滞起效时间、止血带疼痛和术后镇痛的影响的研究发现,感觉阻滞起效时间更短。 延迟止血带疼痛发作时间; 并减少术后疼痛评分和镇痛剂消耗。 对乙酰氨基酚的剂量与早期研究相同(0.5% 利多卡因用 300 mg 静脉 APAP 稀释至总体积 40 mL)。 对照组接受0.5%利多卡因用0.9%生理盐水稀释至总体积40 mL。 本研究未评估运动阻滞的发作时间和持续时间。 为了解释利多卡因-对乙酰氨基酚组感觉阻滞的起效时间更快,作者研究了利多卡因对乙酰氨基酚混合物的 pH 值,发现该混合物的 pH 值为 5.88,低于利多卡因的 pH 值-生理盐水混合物,为 6.16。 这与以下事实相矛盾:局部麻醉剂的 pH 值越高,神经穿透力越大,因此神经阻滞的发作越快。 在这项研究中,作者将感觉阻滞的更快发生归因于 APAP 在外周部位可能的镇痛作用。
硝酸甘油
在一项前瞻性、随机、双盲研究中研究了硝酸甘油 (NTG) 与利多卡因一起用于 IVRA 的效果。76 15 名接受手部手术的患者被随机分配到两组。 对照组(C组,n = 40)接受总剂量为 3 mL 的 15 mg/kg 利多卡因用生理盐水稀释,NTG 组(NTG 组,n = 200)接受额外的 XNUMX μg NTG。 缩短感觉和运动阻滞的发作时间; 延长感觉和运动阻滞恢复时间; 止血带疼痛减轻; NTG 组的麻醉质量得到改善。 NTG 组的术后镇痛需求也显着降低。 作者将感觉和运动阻滞起效时间较短归因于 NTG 的血管舒张作用,促进了局部麻醉剂向神经的分布。 可能有助于改善 NTG 镇痛的其他一些机制可能包括 NTG 代谢为一氧化氮,这反过来导致细胞内环磷酸鸟苷浓度增加,从而产生
中枢和周围神经系统的疼痛调节。 一氧化氮发生器还显示通过局部应用阻断痛觉过敏和炎症性水肿的神经源性成分来诱导抗炎作用和镇痛作用。
蓝精灵
当与布比卡因一起用于臂丛神经阻滞时,咪达唑仑已被证明可加速感觉和运动阻滞的发生并改善术后镇痛。 在动物研究中,咪达唑仑被证明具有通过脊髓中的 GABA(γ-氨基丁酸)受体介导的镇痛作用。 GABA 受体也在周围神经中被发现。 咪达唑仑也被证明可以降低 A-delta 和 C-纤维活性。
在一项旨在评估咪达唑仑与利多卡因联合用于 IVRA 的效果的研究中,40 名接受手部手术的患者被随机分配到两组。 对照组给予 3 mg/kg 利多卡因 2% 用生理盐水稀释至总体积 40 mL,咪达唑仑组给予额外 50 μg/kg 咪达唑仑。 两组之间感觉和运动阻滞的开始和恢复时间没有统计学上的显着差异。 然而,咪达唑仑组使用数字评分量表 (NRS) 对止血带疼痛的主观疼痛评估评分显着降低。 由患者和外科医生评估的麻醉质量在咪达唑仑组中也明显更好。
在术后最初的 2 小时内,咪达唑仑组的术后 NRS 疼痛评分也显着降低。
然而,咪达唑仑组的术后镇静评分也较高。 作者指出,止血带放气后术后镇痛增强的原因可能是咪达唑仑的全身作用以及外周镇痛作用。
另一项研究涉及 60 名接受手部手术的患者,随机分为两组,对照组和咪达唑仑组接受 IVRA,利多卡因和咪达唑仑的剂量与之前的研究完全相同。 该研究显示,除了止血带疼痛评分和术后疼痛评分降低外,感觉和运动阻滞的开始时间缩短,感觉和运动阻滞恢复时间延长。 关于感觉和运动阻滞发作时间的相互矛盾的发现可能需要进一步研究更大的样本量以解决差异。 目前,只能说咪达唑仑在用于上肢 IVRA 时,似乎有望作为局部麻醉剂的辅助剂。
氯胺酮
氯胺酮是一种强效镇痛剂,其主要作用机制是拮抗 N-甲基-D-天冬氨酸 (NMDA) 谷氨酸受体,该受体在脊髓水平的疼痛处理机制中起关键作用。 动物研究表明外周神经中存在 NMDA 受体。 氯胺酮也被证明可以暂时阻断周围神经钠和钾通道。 外周神经中可能存在 NMDA 受体以及氯胺酮局部阻断钠通道的能力表明氯胺酮可能存在外周作用位点,以及其公认的中心作用位点。
氯胺酮作为利多卡因 IVRA 的辅助剂用于手部手术的患者进行了研究,并将其在控制术中止血带疼痛、术后镇痛和副作用方面的功效与全身给药的相同剂量氯胺酮进行了比较。 在这项随机、双盲、全身对照研究中,40 名接受门诊手部手术的患者被随机分为两组。 在“IVRA”组中,在 IVRA 利多卡因中加入 0.1 mL 生理盐水中的 1 mg/kg 氯胺酮,并通过外周静脉管线给予 1 mL 生理盐水。 在“全身”组中,将 1 mL 生理盐水添加到 IVRA 注射器中,并通过外周静脉管线给予 0.1 mL 生理盐水中的 1 mg/kg 氯胺酮。 两组均接受 40 mL 0.5% 利多卡因进行 IVRA。
该研究发现所提到的研究参数组之间没有差异,作者得出结论,IVRA 氯胺酮和全身静脉注射氯胺酮在术中止血带疼痛和术后镇痛剂消耗方面无法区分。 本研究未测量感觉和运动阻滞的发病速度和持续时间。 另一项比较氯胺酮和可乐定在接受手或前臂手术的患者中分别加入 40 mL 0.5% 利多卡因进行 IVRA 的疗效的研究发现,与对照组相比,这两组患者的止血带疼痛发作延迟和镇痛剂消耗减少接受 40 mL 的 0.5% 利多卡因和生理盐水。 与可乐定相比,氯胺酮对研究参数的影响更大。 在这项涉及 45 名患者的研究中,随机分为三组,使用 40 mL 0.5% 利多卡因和生理盐水、1 μg/kg 可乐定或 0.1 mg/kg 氯胺酮进行 IVRA。
针对 CRPS 的特定 IVRA 治疗
肾上腺素能阻滞剂或拮抗剂,特别是那些对 α 受体有效的药物,已显示出治疗 CRPS 的前景,尤其是当这些药物用于 IVRA 时。 其他肾上腺素能佐剂释放并随后阻止去甲肾上腺素在神经血管接头处的再摄取。 它们在 CRPS 中的使用是直观的,因为怀疑该疾病的病理生理学包括 α 受体并由去甲肾上腺素介导。 然而,关于这个话题存在很大的争议,特别是当将当前的研究与近 40 年前进行的研究结果进行比较时。 胍乙啶、利血平和溴苯乙胺均已针对 CRPS 进行了 IVRA 评估。 在一组 15 例上肢和手部 CRPS 患者中,将 0.5 mg 胍乙啶添加到 57% 丙胺卡因中时,未发现胍乙啶在治疗桡骨远端骨折后 CRPS 的异常性疼痛和烧灼痛方面比生理盐水更有效。
这些发现证实了 7 年前在一项双盲、随机、多中心研究中所做的工作。 4 名反射性交感神经营养不良 (RSD)/灼痛患者接受了 0.5 次 IVRA 阻滞,间隔 35 天,使用 XNUMX% 利多卡因中的胍乙啶或安慰剂。 长期来看,安慰剂组和胍乙啶组之间没有显着差异,所有组中只有 XNUMX% 的患者问题得到解决。
Bretylium 也被用于 CRPS。 在一项随机对照试验中,将 0.5% 利多卡因与添加了 1.5 mg/kg 溴苯乙胺的相同局部麻醉剂进行了比较。 疼痛减轻 30% 或更多被认为是显着的。 与仅使用利多卡因的组相比,溴苯铵局部组的疼痛缓解时间为 20 ± 17.5 天,其中镇痛仅持续 2.7 ± 3.7 天。 在这项研究中,溴溴铵在治疗 CRPS 方面远远优于单独的局部麻醉剂。
使用溴苯乙胺进行静脉局部麻醉来证明锻炼前臂肌肉的交感神经张力降低会增加血流量,减少肌肉酸中毒,并减弱反射反应。 尽管在运动阶段静脉钾和氢离子含量都升高了,但带有溴乙炔的 IVRA 增加了运动前臂的血流量和耗氧量,这意味着反射效应不受溴乙二胺阻滞的影响。
并发症
IVRA 引起的并发症可归类为药物或设备(即止血带)相关。 药物相关并发症取决于直接注入血管系统的药物,包括局部麻醉剂和佐剂。 设备相关并发症包括用于将血管空间与体循环隔离的所有设备和技术。 袖带的无意或无意放气、袖带失效、闭塞组织内的静脉压力突然增加到高于袖带压力的水平以及完整的骨间循环都可能导致 IVRA 的并发症。
利多卡因是 IVRA 最常用的局部麻醉剂,因此是报道最多并发症的药物。 幸运的是,在治疗血浆浓度下,利多卡因不会在钠通道中大量蓄积,而且由于它既能快速结合通道又能从通道中解离,因此药物在通道中的毒性蓄积是非典型的。 97,98 利多卡因的血浆浓度过高与止血带系统故障的大剂量静脉推注有关,会导致外周血管舒张和心脏收缩力减弱,临床上通常表现为低血压。 使用 0.5% 浓度利多卡因的 IVRA 通常起效很快(约 4.5 ± 0.3 分钟),止血带放气后麻醉终止也很快(5.8 ± 0.5 分钟)。99 通常,没有任何迹象或如果止血带在药物注入静脉系统后至少 30 分钟放气,则会出现心血管或中枢神经系统毒性症状,尽管在标准充气时间后放气后 20 秒和 27 秒时会出现耳鸣。
然而,在美国国家医学图书馆的 PubMed®、Embase® 和 MEDLINE® 中进行的文献检索显示,从 1950 年到 2007 年期间有 24 例癫痫发作,据报道有 12 例癫痫发作,而袖带仍处于充气状态袖带放气后9例。 在三个案例中信息不可用。 据报道,在止血带充气期间发生癫痫发作,止血带压力超过初始收缩动脉压 150 mm Hg。 据报道,止血带放气后癫痫发作的时间长达 60 分钟,止血带放气后最多延迟 10 分钟。 与癫痫发作相关的最低局部麻醉剂量为利多卡因 1.4 mg/kg、丙胺卡因 4 mg/kg 和布比卡因 1.3 mg/kg。
尽管在止血带放气后约 70% 的利多卡因给药剂量保留在离体肢体的组织内,但剩余的 30% 在随后的 45 分钟内进入体循环。 如果肢体被无意地锻炼,更多的药物会在止血带放气后从孤立肢体的组织释放到循环中,强调在止血带放气后立即保持先前麻醉的肢体静止一段时间的重要性。
用于 IVRA 的另一种常用局部麻醉剂丙胺卡因与高铁血红蛋白 (MetHb) 的形成有关,该形成在给药后约 4 至 8 小时发生。 幸运的是,当丙胺卡因用于 IVRA 时,尚未报告明显的高铁血红蛋白血症。 丙胺卡因 (0.5%) 用于 IVRA 的镇痛开始时间约为 11 分钟(±6.8 分钟),止血带放气后镇痛终止平均为 7.2 分钟(±4.6 分钟)25。非常安全。 事实上,在一项对 45,000 个丙胺卡因 IVRA 阻滞的调查中,通过这种技术使用这种药物没有严重的副作用,也没有死亡。102 在有效性方面,丙胺卡因用于 IVRA 时似乎与利多卡因相当。
当阿片类药物与 IVRA 的局部麻醉剂联合给药以试图延长袖带放气后的镇痛时,通常会在袖带放气后注意到通常归因于全身给药的阿片类药物的偶发副作用。 这些包括恶心、呕吐和轻度镇静。
当神经血管阻断药物与局部麻醉剂联合使用以改善骨折复位患者的手术条件时,没有关于这些辅助剂并发症的报道。
NYSORA 小贴士
• 完整的止血带系统对于IVRA 的成功和安全执行至关重要。
• 止血带意外放气或存在血管连通,即使止血带完好无损,也可能导致严重的全身毒性。
• 当外科手术时间短于 30 分钟时,间歇性袖带放气和充气可有效延长达到局部麻醉剂动脉浓度峰值的时间,但由于局部麻醉剂释放到循环中,在最大限度地减少毒性方面可能并不完全可靠。
• 将局部麻醉剂(和辅助剂,如果使用)注入隔离的静脉系统至少 30 分钟后,止血带才可以放气。
此外,止血带本身可能是并发症的来源,因为它可能导致缺血性疼痛和不适。
全身性高血压可能是由持续或长时间的止血带膨胀引起的。 由于这种技术,设备误用或故障是一个重要且可避免的并发症来源。 即使是完整的、功能齐全的止血带也可能与给药的药物从所谓的孤立肢体泄漏到全身循环有关。
下肢 IVRA 的局部麻醉剂从止血带下方泄漏的发生率几乎为 100%,而上肢阻滞的发生率约为 25%。 作为这种渗漏现象的必然结果,使用 IVRA 进行下肢镇痛具有相关的低质量阻滞的高发生率(在一项前瞻性研究中接近 40%)。 药物可能通过明显功能齐全的袖带泄漏并通过骨间循环进入全身循环,骨间循环不受肌肉、软组织和其中包括的伴随血管通道闭塞的影响。 这一因素已被认识到近 50 年,但它似乎在 IVRA 引起的并发症中并不显着。
IVRA 后止血带放气与以下症状和体征有关 全身局麻药毒性,范围从与中枢神经系统相关的轻微事件,如耳鸣和口周麻木,到癫痫发作,最后到毁灭性的心血管衰竭。 这些与动脉血中的局部麻醉剂浓度相关,与静脉浓度无关。
IVRA 引起的另一个并发症是止血带疼痛,如果不使用双气动装置,这种情况并不少见。图1 和 图9)。 对于使用 IVRA 执行的预计持续时间超过 30 分钟的任何程序,我们建议使用这种止血带。 然而,即使遵循这些指导方针,在“安全”时间间隔后止血带放气后也会发生不良事件。 非常罕见,孤立的报告 神经系统并发症,包括对正中神经、尺神经和肌皮神经的损伤,都与 IVRA 有关。 这种并发症的原因似乎是止血带对这些神经的直接压力,随后表现出类似于挤压伤的组织学变化。 建议止血带使用时间不超过 2 小时,以减少组织酸中毒继发毛细血管和肌肉损伤的可能性。
室综合征 IVRA 后可能很少发生,尤其是当 IVRA 用于复位下肢长骨骨折时,这可能是由于注射了大量局部麻醉剂以达到镇痛效果,也可能是由于在进行手术前肢体放血不足或不完全所致。堵塞。 在打算注射局部麻醉剂时,无意中注射了高渗盐水后,有一个病例报告显示了这种并发症。
一名 33 岁的孕妇接受 IVRA 进行内镜腕管松解术,在注射局部麻醉剂后出现严重的幻肢感。
IVRA 消散后症状消失。 有一份报告称,一名 28 岁的患者在短暂的止血带闭塞时间后,其桡动脉和尺动脉在 IVRA 后形成血栓形成了手臂的毁灭性必要性。这是否是由于意外的动脉内注射药物造成的,药物管理错误,或者可能是一种特殊的药物反应纯粹是推测性的。 在 1980 年至 1999 年的 ASA 已结案索赔项目中报告了三起案件,包括与 IVRA 相关的死亡或永久性脑损伤。这些案件的具体情况尚不清楚。
图9。双止血带系统放置在右大腿近端,为右下肢的 IVRA 做准备。
局部麻醉毒性
虽然利多卡因是美国最常用的 IVRA 局部麻醉剂,但在欧洲,0.5% 的丙胺卡因更常用。 然而,丙胺卡因被代谢为邻甲苯胺,一种能够将血红蛋白转化为 MetHb 的氧化化合物。 这通常只有在丙胺卡因的剂量超过 600 mg 时才值得关注,即使对于使用大至 100 mL 的下肢 IVRA,也不应该达到(即 100 mL × 0.5% 丙胺卡因 = 500 mg) .
NYSORA 小贴士
• 严重的高铁血红蛋白血症是一种需要及时识别和适当治疗的医疗紧急情况。
• 做出诊断需要良好的病史和高度怀疑。
• 对于药物暴露引起的高铁血红蛋白血症,传统的一线治疗包括输注亚甲蓝 (MB)。
• 应该给予葡萄糖,因为红细胞中NADH(还原[氢化]烟酰胺腺嘌呤二核苷酸)的主要来源是糖酵解分解代谢。 葡萄糖也是通过己糖单磷酸分流形成NADPH(还原[氢化]NAD磷酸盐)所必需的,这对于MB有效。
• MB 的剂量为 1 至 2 mg/kg IV 超过 5 分钟(总剂量不应超过 7-8 mg/kg)。
• MB 可引起呼吸困难、胸痛或溶血。
• MB 为通过 NADPH 依赖性途径还原 MetHb 提供人工电子转运体。 反应迅速; 剂量可以重复
如果在初次输注后 1 小时 MetHb 水平仍然很高,则 1 小时。
• 由于脂肪组织中的亲脂性药物(苯佐卡因)吸收时间延长,可能在服用 MB 后 18 小时内出现反弹性高铁血红蛋白血症。 用 MB 治疗后对 MetHb 水平进行连续测量是合理的。 MB 不应用于葡萄糖-6-磷酸脱氢酶 (G6PD) 缺乏症的患者,因为 MB 对 MetHb 的降低依赖于 G6PD(溶血)产生的 NADPH。 这些患者的另一种治疗方法是抗坏血酸(2 mg/kg)。
• 输血或换血可能对休克患者有帮助。 高压氧已在严重病例中取得成功。
手术后止血带放气是减少 毒性 与 IVRA 相关。 首先,绝对强制止血带不要放气,除非自注射局部麻醉剂后至少经过 30 分钟,即使手术或操作的持续时间很短。 如果手术时间短,患者需要在 PACU 中恢复,可以在远端止血带充气时夹住远端止血带,将患者从手术区(止血带充气)移出,并将患者转移到受监控的护理环境。 但是,在注射局部麻醉剂溶液开始的 30 分钟时间结束之前,任何人都不应取下夹住的止血带。 此时,在 PACU 中松开止血带后,应持续监测患者至少 15 分钟。 据报道,至少有 XNUMX 例心脏骤停病例是在注射局部麻醉剂后不久松开止血带,手术时间极短。
其次,止血带放气必须以“周期性”方式完成,如下所示:袖带放气(至少 30 分钟后)并立即重新充气。 仔细观察或询问患者是否出现与局麻药毒性相关的症状,如耳鸣、头晕、口中有金属味等。 显然,刺激中枢神经系统的迹象也可能代表局麻药毒性,也必须寻找。 如果约 1 分钟后没有此类体征或症状,袖带会再次放气并立即再次充气约 1 至 2 分钟,同时观察并询问患者的全身局部麻醉毒性。 如果此时没有出现,止血带可以安全地放气并从四肢移除。 这种循环放气/再充气的安全性在于,每次放气时,只有一小部分施用的(和未结合的)局部麻醉剂被允许进入体循环,从而最大限度地减少血液水平突然、持续升高的可能性。局部麻醉剂。
概要
静脉内局部麻醉是治疗急性受伤患者的任何专业临床医生的重要辅助设备。 该技术的简单性和相对安全性(如果严格遵守之前列出的协议)使其成为一个有吸引力的替代方案 臂丛神经阻滞 (用于上肢手术或操作)和 脊 or 硬膜外阻滞 (用于下肢手术或操作)。 只需能够识别和进入外周静脉并使用气动止血带,就可以使其成为临床实践中最“用户友好”的区域阻滞方式之一。 无需轻松使用周围神经刺激器或解释从超声机器获得的图像。 与 IVRA 相关的唯一潜在缺点之一是与其使用相关的麻醉/镇痛的有限持续时间。 相对无法将镇痛延长到术后阶段很长一段时间,这降低了它的效用。 在这些情况下,通过神经丛麻醉进行连续导管插入和维护可确保提供有吸引力的替代方案。
参考文献:
- 比尔 A:Uber einen neun weg 局部麻醉和 den gliedmassen zuerzeugen。 Arch Klin Chir 1908;86:1007–1016。
- 比尔 - 答:关于一种新的局部麻醉方法。 慕尼黑医学杂志 1909; 56:589。
- Bier A:关于静脉麻醉。 Berl Klin Wschr 1909;46:477–489。
- 比尔答:关于局部麻醉,特别提到静脉麻醉。 爱丁堡医学杂志 19105:103-123。
- Morrison J:静脉局部麻醉。 Br J 外科杂志 1930–1931;18:641–647。
- Herreros L:通过静脉途径进行区域麻醉。 麻醉学 1946;7:558–560。
- Holmes CMcK:静脉局部镇痛。 柳叶刀 1963;1:245–247。
- Kalman S、Svenson H、Lisander B 等人:用甲哌卡因进行静脉局部阻滞后人类的定量感觉变化。 Reg Anesth Pain Med 1999;24:236-241。
- Wahren L、Torebjork E、Nystorm B:手部神经痛患者区域性胍乙啶阻滞前后的定量感觉测试。 疼痛 1991;46:23-30。
- Smith M、Sprung J、Zura A 等:美国麻醉住院医师培训计划中区域麻醉技术暴露情况调查。 Reg Anesth 疼痛医学 1999;24:11-16。
- Blaheta H、Vollert B、Zuder D 等人:用于肉毒杆菌毒素治疗手掌多汗症的静脉局部麻醉(Bier 阻滞)是安全有效的。 皮肤外科杂志 2002;28:666–671。
- Bosdotter Enroth S、Rystedt A、Covaciu L 等:丙胺卡因双侧前臂静脉局部麻醉用于肉毒杆菌毒素治疗手掌多汗症。J Am Acad Dermatol 2010;63(3):466–474。
- Nascimento MSA、Klamt JG 和 Prado WA:静脉区域阻滞类似于交感神经节阻滞,用于 1 型复杂区域疼痛综合征患者的疼痛管理。Braz J Med Biol Res 2010; 43(12):1239-1244。
- Glickman L、Mackinnon S、Rao T 等人:连续静脉局部麻醉。 手外科杂志 1992;17:82-86。
- Mabee J、Shean C、Orlinsky M 等人:模拟 Bier 阻滞 IVRA 对室内组织压力的影响。 Acta Anaesthesiol Scand 1997;41:208–213。
- Aarons CE、Fernandez MD、Willsey M、Peterson B、Key C、Fabregas J:Bier 阻滞区域麻醉和前臂骨折铸造:儿科急诊科环境中的安全性。 J Pediatr Orthop 2014;34:45-49。
- Singh R、Bhagawat A、Bhadoria P、Kohli A:前臂 IVRA,使用 0.5% 利多卡因,剂量为 1.5 mg/kg,酮咯酸 0.15 mg/kg,用于手部和腕部手术。 Minerva Anestesiol 2010;76:109–114。
- Chiao FB、Chen J、Lesser JB、Resta-Flarer F、Bennett H:静脉区域麻醉中的单袖前臂止血带与上臂止血带相比,疼痛和镇静需求更少。 Br J Anaesth 2013;111(2):271–275。
- Benlabed M、Jullien P、Guelmi K 等人:0.5% 利多卡因的烷基化用于静脉区域麻醉。 Reg Anesth 1990;15:59-60。
- Lavin P、Henderson C、Vaghadia H:非碱化和碱化 2-氯普鲁卡因与利多卡因在门诊手部手术中用于静脉局部麻醉。 Can J Anaesth 1999;46:939–945。
- Ulus A、Gurses E、Oztrurk I、Serin S:两种不同体积的利多卡因在静脉区域麻醉中的比较评价。 医学科学监测 2013;19:978–983。
- Chan V、Weisbrod M、Kaszas Z 等人:罗哌卡因和利多卡因在志愿者静脉区域麻醉中的比较:麻醉效果和血药浓度的初步研究。 麻醉学 1999;90:1602–1608。
- Peng P、Coleman M、McCartney C 等:0.375% 罗哌卡因与 0.5% 利多卡因在前臂静脉局部麻醉中的麻醉效果比较。 Reg Anesth Pain Med 2002;27;595–599。
- Horn JL、Cordo P、Kunster D 等人:罗哌卡因前臂静脉局部麻醉的进展。 Reg Anesth 疼痛医学 2011;36(2): 177 180。
- Pitkanen M、Suzuki N、Rosenberg P:使用 0.5% 丙胺卡因或 0.5% 氯普鲁卡因进行静脉局部麻醉。 志愿者的双盲比较。 麻醉 1992;47:618–619。
- Pitkanen M、Kytta J、Rosenberg P:2-氯普鲁卡因和丙胺卡因用于手臂静脉区域麻醉的比较:一项临床研究。 麻醉 1993;48:1091–1093。
- Pitkanen M、Xu M、Haasio J 等人:0.5% 阿替卡因与 0.5% 丙胺卡因在手臂静脉区域麻醉中的比较:志愿者交叉研究。 Reg Anesth Pain Med 1999;24:131-135。
- Simon M、Gielen M、Albernik N 等人:用 0.5% 阿替卡因、0.5% 利多卡因或 0.5% 丙胺卡因进行静脉局部麻醉。 一项双盲随机临床研究。 Reg Anesth 1997;22:29-34。
- Hoffman V、Vercauteren M、Van Steenberge A 等:静脉局部麻醉。 评价丙胺卡因的四种不同添加剂。 比利时麻醉学报 1997;48:71-76。
- Armstrong P、Brockway M、Wildsmith J:用于静脉局部麻醉的丙胺卡因碱化。 麻醉 1990;45:11-13。
- Solak M、Akturk G、Erciyes N 等人:在 IV 区域麻醉期间向丙胺卡因溶液中添加碳酸氢钠。 Acta Anaesthesiol Scand 1991;35:572–574。
- Kalman S、Bjorn K、Tholen E 等人:甲哌卡因作为静脉局部阻滞剂会干扰反应性充血并降低稳态血流。 Reg Anesth 1997;22:552–556。
- Kalman S、Liderfalk C、Wardell K 等人:在使用甲哌卡因进行静脉局部麻醉时,对人体皮内辣椒素后血管舒张和疼痛的不同影响。 Reg Anesth Pain Med 1998;23:402-408。
- Choyce A,Peng P:外科手术静脉区域麻醉辅助剂的系统评价。 Can J Anaesth 2002;49:32-45。
- Kleinschmidt S、Stockl W、Wilhelm W 等人:在丙胺卡因中加入可乐定用于静脉局部麻醉。 Eur J Anaesthesiol 1997;14:40-46。
- Cucchia G、Chasot-Di Dio V 等:Bier 阻滞期间局部麻醉剂中添加可乐定对术前和术后镇痛的影响。 Br J Anaesth 1997;78(增刊 1):78-79。
- Ivie CS、Viscomi CM、Adams DC、Friend AF、Murphy TR、Parker CJ:可乐定作为静脉局部麻醉的辅助手段:一项随机、双盲、安慰剂对照剂量范围研究。 麻醉临床 Pharmacol 2011;27(3):323–327.
- Memis D、Turan A、Karamanlioglu B 等人:在利多卡因中加入右美托咪定进行静脉局部麻醉。 麻醉分析 2004;98:835–840。
- Kol IO、Ozturk H、Kaygusuz K、Gursoy S、Comert B、Mimaroglu C:在丙胺卡因静脉局部麻醉中加入右美托咪定或氯诺昔康用于手部或前臂手术:一项随机对照研究。 临床药物调查 2009;29(2):121–129。
- Mirzak A、Gul R、Erkutlu I、Alptekin M、Oner U:单独使用右美托咪定或与 0.5% 利多卡因一起用于 IVRA 的术前用药。 J Surg Res 2010;164(2):242–247。
- Fields H、Emson P、Leigh B 等人:初级传入纤维上的多个阿片受体位点。 自然 1980;284:351-353。
- Young W、Wamsley J、Zarbin M 等人:阿片受体经历轴突流动。 科学 1980;210:76-78。
- Boogaerts J、Balatoni E、Lafont N 等人:Utilization des morphiniques dans les blocs neuroux peripheriques。 大会 Ser Ars Medicina 1985;3:143–150。
- Gobeaux D,Landais A:利用 de deux morphiniques dans les blocs du plexus brachial。 J Can Anesth 1988;36:437–440。
- Gobeaux D、Landais A、Bexon G 等:Adjonction de fentanyl la lidocaine adjonction de fentanyl la lidocaine adrenaline pour le blocage du plexus brachial。 J Can Anesth 1987;35:195–199。
- Viel E、Eledjam J、de la Coussaye J 等:臂丛神经阻滞与阿片类药物缓解术后疼痛:丁丙诺啡和吗啡的比较。 Reg Anesth 1989;14:274–278。
- Candido K、Khan M、Raja D 等人:用于缓解术后疼痛的臂丛神经阻滞。 Reg Anesth 2000;25:23。
- Arhtur J、Mian T、Heavner J 等人:芬太尼和利多卡因对比利多卡因用于 Bier 阻滞。 Reg Anesth 1992;17:223–227。
- Bobart V、Hartmannsgruber M、Atanassoff P 等人:芬太尼加利多卡因与普通利多卡因静脉区域麻醉后的镇痛/麻醉。 Anesth Analg 1998:86:S-3。
- Pitkanen M、Rosenberg P、Pere P 等:芬太尼-丙胺卡因混合物用于接受手术的患者的静脉区域麻醉。 麻醉 1992;47:395–398。
- Armstrong P、Power I、Wildsmith J:在丙胺卡因中加入芬太尼用于静脉局部麻醉。 麻醉 1991;46:278–280。
- Gupta A、Begntsson M、Bjornsson A 等:静脉区域麻醉期间低剂量吗啡缺乏外周镇痛作用。 Reg Anesth 1993;18:250–253。
- Abdulla W,Fadhil N:静脉区域麻醉的新方法。 Anesth Analg 1992;75:597–601。
- Sztark F、Thicoipe M、Favarel-Garriques J 等人:使用 0.25% 利多卡因与芬奈尔和泮库溴铵进行静脉局部麻醉。 Anesth Analg 1997;84:777–779。
- Subxedar D、Gevirtz C、Malik V 等人:静脉局部麻醉:0.25% 利多卡因与芬太尼和罗库溴铵的前瞻性评估。 Reg Anesth 1997;22:41。
- Thapar P,Skerman J:评价 0.2% 利多卡因与芬太尼和 D-筒箭毒碱在静脉区域麻醉中的作用。 注册麻醉 1997; 84:S342。
- Santhosh MC、Rohini BP、Roopa S、Raghavendra PR:0.5% 利多卡因单独和 0.25% 利多卡因与芬太尼和维库溴铵联合用于上肢手术静脉区域麻醉的研究。 Rev Bras Anestesiol 2013;63(3):254–257。
- Acalovschi I,Cristea T:哌替啶静脉局部麻醉。 Anesth Analg 1995;81:539–543。
- Acalovschi I、Cristea T、Margarit S 等:曲马多添加到利多卡因中用于静脉局部麻醉。 Anesth Analg 2001;92:209–214。
- Tan S、Pay L、Chan S:使用利多卡因和曲马多的静脉局部麻醉。 Ann Acad Med 新加坡 2001;30:516–519。
- Alayurt S、Memis D、Pamucku Z:在利多卡因中加入舒芬太尼、曲马多或可乐定用于静脉局部麻醉。 麻醉重症监护 2004;32:22-27。
- Kurt N、Kurt I、Aygunes B 等人:在利多卡因溶液中加入阿芬太尼或阿曲库铵对静脉局部麻醉的影响。 Eur J Anaesthesiol 2002;19:522–525。
- Elhakim M,Sadek R:在利多卡因中加入阿曲库铵进行静脉局部麻醉。 Acta Anaesthesiol Scand 1994;38:542–544。
- McCartney C、Brill S、Rawson R 等人:对于手部手术,在使用 1% 利多卡因的静脉区域麻醉中添加 0.5 mg 新斯的明没有麻醉或镇痛益处。 Reg Anesth Pain Med 2003;28:414–417。
- Turan A、Karamanlyoglu B、Memis D 等人:使用丙胺卡因和新斯的明进行静脉局部麻醉。 Anesth Analg 2002;95:1419–1422。
- Sethi D,Wason R:使用利多卡因和新斯的明进行上肢手术的静脉局部麻醉。 临床麻醉杂志 2010;22(5): 324–328。
- Singh R、Bhagwat A、Bhadoria P、Kohli A:前臂 IVRA,使用 0.5% 利多卡因,剂量为 1.5 mg/kg,酮咯酸 0.15 mg/kg,用于手部和腕部手术。 Minerva Anestesiol 2010;76(2):109–114。
- Jones N,Pugh S:在丙胺卡因中加入替诺昔康用于静脉局部麻醉。 麻醉 1996;51:446–448。
- Sertoz N、Kocaoglu N、Ayanoglu HO:氯诺昔康和芬太尼在静脉局部麻醉中加入利多卡因时的比较。 Rev Bras Anestesiol 2013;63(4):311–316。
- Yurtlu S、Hanci V、Kargi E、Erdogan G 等人:右酮洛芬加入利多卡因进行静脉局部麻醉时的镇痛作用:一项前瞻性、随机、安慰剂对照研究。 J Int Med Res 2011;39(5):1923–1931。
- Bengtsson A、Bengtsson M、Nilsson I 等:甲基强的松龙加甲哌卡因静脉局部给药对类风湿性关节炎的影响。 Scand J Rheumatol 1998;27:277–280。
- Taskaynatan M、Ozgul A、Tan A 等人:在 CRPS 1 型中使用甲基强的松龙和利多卡因进行 Bier 阻滞:一项随机、双盲安慰剂对照研究。 Reg Anesth Pain Med 2004;29:408–412。
- Varitimidis SE、Papatheodorou LK、Dailiana ZH、Poultsides L、Malizos KN:上肢创伤或手术导致的 I 型复杂区域疼痛综合征:使用利多卡因和甲基强的松龙进行静脉区域麻醉管理。 J Hand Surg Eur 2011;36(9):771–777。
- Sen H、Kulachi Y、Bicerer E、Ozkan S、Dagli G、Turan A:对乙酰氨基酚加入利多卡因进行静脉区域麻醉时的镇痛作用。 Anesth Analg 2009;109(4):1327–1330。
- Ko MJ、Lee JH、Cheong SH 等:对乙酰氨基酚与酮咯酸添加到利多卡因进行静脉区域麻醉时的效果比较。 韩国麻醉杂志 2010;58(4):357–361。
- Sen S、Ugur B、Aydin ON 等:利多卡因加入硝酸甘油对静脉区域麻醉的镇痛作用。 Anesth Analg 2006;102(3):916–920。
- Lauretti GR, Perez MV, Reis MP, Pereira NL:双盲评估透皮硝酸甘油作为口服吗啡辅助治疗癌症疼痛。 临床麻醉杂志 2002:14:83-86)。
- Lauretti GR、de Olivera R、Reis MP 等:透皮硝酸甘油可增强骨科手术后脊髓舒芬太尼的术后镇痛作用。 麻醉学 1999;90:734–739。
- Ferreira SH、Lorenzette BB、Faccioli LH:通过局部应用 NTG 阻断痛觉过敏和神经源性水肿。 Eur J Pharmacol 1992;217:207–209。
- Jaro K、Batra YK、Panda NB:使用咪达唑仑和布比卡因进行臂丛神经阻滞可改善镇痛效果。 Can J Anaesth 2005;52:822–826。
- Laig N、Khan MN、Arif M、Khan S:咪达唑仑与布比卡因改善上肢手术臂丛神经阻滞的镇痛质量。 J Coll Physicians Surg Pak 2008;18:674–678。
- Nishiyama T,Tamai H,Hanaoka K:狗硬膜外给药后咪达唑仑的血清和脑脊液浓度。 Anesth Analg 2003;96:159–162。
- Bhisitkul RB、Villa JE、Kocsis JD:轴突 GABA 受体选择性地存在于大鼠外周神经的正常和再生感觉纤维中。 Exp Brain Res 1987:66:659–663。
- Brown DA,Marsh S:哺乳动物外周神经干中的轴突 GABA 受体。 大脑研究 1978;156:187–191。
- Cairns BE,Sessle BJ,Hu JW:外周 GABA-A 受体的激活抑制颞下颌关节诱发的颌肌活动。 神经生理学杂志 1999;81:1966–1969。
- Kontinen VK,Dickenson AH:咪达唑仑在大鼠神经性疼痛脊神经结扎模型中的作用。 疼痛 2000;85:425–431。
- Farouk S,Aly AJ:利多卡因镇痛加和不加咪达唑仑用于静脉区域麻醉的质量。 麻醉杂志 2010;24(6):864–868。
- Kashefi P、Montazeri K、Honarmand A、Safavi M、Hosseini HM:咪达唑仑加入利多卡因进行静脉局部麻醉时的镇痛作用。 J Res Med Sci 2011;16(9):1139–1148。
- Carlton SM、Hargett GL、Coggeshall RE:大鼠无毛皮肤髓鞘轴突中谷氨酸受体的定位和激活。 神经科学快报 1995;197:25-28。
- Brau ME、Sander F、Vogel W、Hempelmann G:单通道实验揭示氯胺酮及其对映异构体在酶促脱髓鞘周围神经中的阻断机制。 麻醉学 1997;86:394–404。
- Viscomi CM、Friend C、Parker C、Murphy T、Yarnell M:氯胺酮作为利多卡因静脉局部麻醉的佐剂:一项随机、双盲、全身对照试验。 Reg Anesth Pain Med 2009;34(2): 130–133。
- Georgias NK、Maidatsi PG、Kyriakidis AM 等:可乐定与氯胺酮在利多卡因静脉局部麻醉期间预防止血带疼痛。 Reg Anesth Pain Med 2001;26(6):512–517。
- Livingstone J,Atkins R:静脉局部胍乙啶阻滞治疗手部创伤后复杂区域疼痛综合征 1(algodystrophy)。 骨关节外科杂志 Br 2002;84:380–386。
- Ramamurthy S, Hoffman J. 静脉局部胍乙啶治疗反射性交感神经营养不良/灼痛。 一项随机、双盲研究。 胍乙啶研究组。 Anesth Analg 1995;81:718–723。
- Hord A、Rooks M、Stephens B 等人:静脉注射局部溴苯胺和利多卡因治疗反射性交感神经营养不良:一项随机、双盲研究。 Anesth Analg 1992;74:818–821。
- Lee F、Shoemaker J、McQuillan P 等人:前臂 Bier 阻滞与溴苯乙胺对手柄的血流动力学和代谢反应的影响。 Am J Physiol Heart Circ 2000;279:H586–H593。
- Bader A、Concepcion M、Hurley R 等人:利多卡因和丙胺卡因在静脉区域麻醉中的比较。 麻醉学 1988;69:409–412。
- Tucker G,Boas R:静脉麻醉的药代动力学方面。 麻醉学 1971;34:538–549。
- Ware R:使用布比卡因的静脉内局部麻醉。 与利多卡因的双盲比较。 麻醉 1979;34:231–235。
- Smith C、Steinhaus J、Haynes C:静脉局部麻醉的安全性和有效性。 南方医学杂志 1968;61:1057–1060。
- Guay J:与静脉局部麻醉(Bier Block)相关的不良事件:并发症的系统评价。 临床麻醉杂志 2009;21:585–594。
- Bartholomew K, Sloan J:丙胺卡因用于 Bier's block:安全性如何? Arch Emerg Med 1990;7:189–195。
- Sukhani R、Garcia C、Munhall R 等人:采用不同放气技术进行静脉区域麻醉后的利多卡因处置 Anesth Analg 1989;68:633–637。
- Mazze R,Dunbar R:尾部、腰部硬膜外、腋窝阻滞和静脉区域麻醉后的血浆利多卡因浓度。 麻醉学 1966;27:574–579。
- Dunbar R,Mazze R:静脉局部麻醉:779 例经验。 Anesth Analg 1967;46:806–813。
- Davies J,Walford A:足部手术的静脉局部麻醉。 Acta Anaesthesiol Scand 1986;30:145–147。
- Kim D、Shuman C、Sadr B:门诊足踝手术的静脉局部麻醉。 一项前瞻性研究。 骨科 1993:16; 1109–1113。
- Cotev S,Robin G:使用放射性利多卡因进行静脉局部麻醉的实验研究。 Br J Anaesth 1966;38:936–940。
- Hargrove R、Hoyle J、Parker J:静脉局部镇痛后的血液利多卡因水平。 麻醉 1996;21:37-41。
- Larsen U,Hommelgaard P:静脉局部麻醉后的气动止血带麻痹。 麻醉 1987;42:526–528。
- Shaw-Wilgis E:对止血带缺血影响的观察。 骨关节外科杂志 1971;1104:190。
- Mabee J,Bostwick T,Burke M:比尔块注射高渗盐水引起的医源性隔室综合征。 急诊医学杂志 1994;12: 473 476。
- Quigley J、Popich G、Lanz U:前臂和手部室综合征:病例报告。 临床骨科 1981;161:247–251。
- Hastings H 2nd,Misamore G:静脉区域麻醉引起的隔室综合征。 手外科杂志 1987;12:559–562。
- Dominguez E:静脉局部麻醉期间令人痛苦的上肢幻肢感觉。 Reg Anesth Pain Med 2001;26:72-74。
- Luce E,Mangubat E:Bier 阻滞后失去手和前臂:病例报告。 手外科杂志 1983;8:280–283。
- Lee LA、Posner K、Domino KB 等人:1980 年代和 1990 年代与区域麻醉相关的损伤。 封闭式索赔分析。 麻醉学 2004;101:143–152。
- Kennedy B、Duthie A、Parbrook G、Carr T:静脉局部麻醉:评估。 医学杂志 J 1965;5440:954–957。

