Belen De José Maria, Luc Tielens e Steve Roberts
ANESTESIA EPIDURAL EM CRIANÇAS
INTRODUÇÃO
A analgesia epidural é comumente usada em adição à anestesia geral e para controlar a dor pós-operatória. O alívio eficaz da dor pós-operatória da analgesia epidural tem inúmeros benefícios, incluindo deambulação precoce, facilitação do desmame dos ventiladores, redução do tempo gasto em estado catabólico e redução dos níveis circulantes de hormônio do estresse. A colocação precisa de agulhas peridural para técnicas de injeção única e cateteres para anestesia peridural contínua garante que os dermátomos envolvidos no procedimento cirúrgico sejam bloqueados seletivamente, permitindo o uso de doses menores de anestésicos locais e poupando bloqueios desnecessários em regiões não desejadas. A abordagem do espaço epidural pode ser no nível caudal, lombar ou torácico.
ANATOMIA E IMPLICAÇÕES FISIOLÓGICAS
Existem diferenças anatômicas significativas em crianças em comparação com adultos que devem ser consideradas ao usar anestesia neuroaxial. Por exemplo, em recém-nascidos e lactentes, o cone medular está localizado mais abaixo na coluna vertebral (aproximadamente na vértebra L3) em comparação com os adultos, nos quais está situado aproximadamente na vértebra L1. Isso é resultado de diferentes taxas de crescimento entre a medula espinhal e a coluna vertebral óssea em bebês. No entanto, por volta de 1 ano de idade, o cone medular atinge o nível L1 semelhante ao de um adulto.
Dicas NYSORA
- Em recém-nascidos e lactentes, o cone medular termina aproximadamente no nível L3, em oposição aos adultos, onde está localizado aproximadamente na vértebra L1.
- Com aproximadamente 1 ano de idade, o cone medular atinge o nível L1, semelhante ao de um adulto.
O sacro das crianças também é mais plano e estreito em comparação com a população adulta. Ao nascimento, a placa sacral, que é formada por cinco vértebras sacrais, não está completamente ossificada e continua a se fundir até aproximadamente 8 anos de idade (embora possa demorar até os 21 anos de idade). Há uma incidência de 6% de atresia sacral. A fusão incompleta do arco vertebral sacral forma o hiato sacral. O espaço peridural caudal pode ser acessado facilmente em lactentes e crianças através do hiato sacral. Devido ao desenvolvimento contínuo do teto do canal sacral, há uma variação considerável no hiato sacral. Em crianças pequenas, o hiato sacral está localizado mais cefálica do que em crianças mais velhas, e o saco dural pode terminar mais caudalmente: em S4 em crianças menores de 1 ano e em S2 em crianças mais velhas. Portanto, devido ao risco aumentado de punção dural acidental, é necessário cautela ao colocar bloqueios caudais em lactentes.
Dicas NYSORA
- Em crianças pequenas, o hiato sacral está localizado mais cefalicamente do que em crianças mais velhas, e o saco dural pode terminar mais caudalmente (em S4 em bebês com menos de 1 ano).
- O cuidado com o uso de bloqueios caudais é necessário em lactentes devido ao risco de punção dural.
A avaliação ultrassonográfica (US) das estruturas neuroaxiais é menos desafiadora em crianças mais novas porque a ossificação é menos desenvolvida. Em bebês, as fibras da medula espinhal, o líquido cefalorraquidiano (LCR) e a dura-máter são facilmente identificados usando sondas lineares de US de alta frequência. Também foi sugerido que a gordura epidural é menos densamente compactada em crianças do que em adultos. A gordura epidural frouxamente compactada pode facilitar a disseminação do anestésico local e ajudar a obter um início de bloqueio mais rápido. Também pode permitir o avanço desimpedido dos cateteres peridurais do espaço peridural caudal para os níveis lombar e torácico. No entanto, a colocação final da ponta de um cateter é melhor monitorada diretamente sob orientação de US ou indiretamente, identificando a injeção de anestésico local.
A quantidade de LCR por peso corporal é maior em recém-nascidos e lactentes (4 mL/kg) em comparação com adultos (2 mL/kg), e o LCR está localizado principalmente no canal espinhal. Além disso, a medula espinhal em recém-nascidos ainda é não mielinizada, o que significa que concentrações mais baixas de anestésico local podem ser usadas de forma eficaz. Como as crianças têm um débito cardíaco maior em comparação aos adultos, a absorção sistêmica do anestésico local ocorre mais rapidamente. Isso pode levar a níveis plasmáticos tóxicos e uma duração mais curta do bloqueio.
Dicas NYSORA
- Comparado às crianças mais velhas, o hiato sacral em neonatos está localizado mais cefálica, e o saco dural termina mais baixo, aumentando o risco de punção dural acidental.
- A imagem de US pode ser usada para avaliar a anatomia do neuroeixo e a abordagem do espaço peridural.
ANESTÉSICOS LOCAIS PARA ANESTESIA EPIDURAL EM CRIANÇAS
Como a maioria dos pacientes pediátricos recebe analgesia peridural em conjunto com anestesia geral, o objetivo principal do cateter peridural é fornecer solução anestésica local suficiente para analgesia intra e pós-operatória eficaz. Assim como na anestesia peridural em adultos, a concentração e o volume do anestésico local são fatores importantes na determinação da densidade e do nível de bloqueio. Entretanto, em pacientes pediátricos, o conhecimento da dose total do fármaco também é importante para evitar a toxicidade do anestésico local. Uma descrição mais detalhada das soluções anestésicas locais, suas características e potencial de toxicidade foi descrita em Farmacologia Clínica de Anestésicos Locais.
Bupivacaína, ropivacaína e levobupivacaína são os anestésicos locais mais comumente usados para anestesia neuroaxial em crianças. A lidocaína não é usada com frequência devido ao seu bloqueio motor excessivo. Como regra geral, altas concentrações de anestésicos locais, como bupivacaína a 0.5% ou ropivacaína a 0.5%, raramente são usadas em bloqueios peridurais em crianças. Em vez disso, volumes maiores de anestésico local mais diluído são mais comumente usados para cobrir vários dermátomos. O peso corporal geralmente é uma correlação melhor do que a idade do paciente na previsão da disseminação do anestésico local após um bloqueio caudal. A dose máxima segura de bupivacaína é de 2.5 mg/kg. Para uso caudal, a concentração ideal de bupivacaína é de 0.125% a 0.175%. Em comparação com a preparação de 0.25%, esta concentração proporciona uma duração semelhante de analgesia pós-operatória (4-8 horas), mas com menos bloqueio motor. Alguns médicos preferem administrar doses com base no volume por peso. Uma dose de 1.0 mL/kg de uma solução diluída, como bupivacaína a 0.125%, até um volume máximo de 20 mL pode, algumas vezes, fornecer bloqueio sensorial T10 sem exceder os níveis máximos recomendados na literatura. Em lactentes, volumes maiores, como 1.25 mL/kg ou mesmo 1.5 mL/kg, podem ser administrados para proporcionar um bloqueio mais cefálico sem risco de toxicidade do anestésico local. Para infusão peridural contínua, uma diretriz de dosagem comumente aceita para bupivacaína é 0.2 mg/kg/h para recém-nascidos e 0.4 mg/kg/h para crianças mais velhas. A toxicidade cumulativa é uma preocupação mesmo em taxas mais baixas de infusões de solução anestésica local. Portanto, a duração das infusões peridurais neonatais deve ser limitada a 48 horas.
A ropivacaína tem índice terapêutico mais alto que o anestésico local mais antigo bupivacaína. Em baixas concentrações, a ropivacaína pode produzir menos bloqueio motor e analgesia equivalente em comparação com a bupivacaína, com menor incidência de toxicidade cardíaca e do sistema nervoso central. Devido às suas possíveis propriedades vasoconstritoras, a ropivacaína pode sofrer absorção sistêmica mais lenta do que a bupivacaína. Isso pode ter implicações clínicas quando uma infusão prolongada de anestésico local é usada em crianças com função hepática prejudicada. Para um bloqueio caudal de injeção única, um bolus de 1 mL/kg de ropivacaína a 0.2% é recomendado. Uma infusão de ropivacaína a 0.1% a 0.2 mg/kg/h em lactentes e 0.4 mg/kg/h em crianças mais velhas, com duração não superior a 48 horas, também se mostrou eficaz e segura.
A levobupivacaína, o isômero S (–) da bupivacaína, tem menor probabilidade de causar depressão miocárdica e arritmias fatais e também é menos tóxica para o sistema nervoso central do que a bupivacaína racêmica. Uma dose de 0.8 mL/kg de levobupivacaína a 0.25% injetada caudalmente fornece analgesia em crianças submetidas a cirurgia peniana ou na virilha. Para infusão peridural contínua, a dose da levobupivacaína é semelhante à da bupivacaína racêmica.
Dicas NYSORA
- Altas concentrações de anestésico local, como bupivacaína a 0.5% ou ropivacaína a 0.5%, não são recomendadas na população pediátrica. Como a mielinização não é completa, concentrações mais baixas de anestésicos locais de aminoamida são eficazes (por exemplo, levobupivacaína a 0.125%).
- Em vez disso, volumes maiores de anestésicos locais mais diluídos são mais comumente usados para cobrir vários dermátomos de interesse.
- Nos pacientes pediátricos, o peso corporal fornece uma melhor correlação do que a idade do paciente na previsão da disseminação do anestésico local após um bloqueio caudal.
- Uma regra simples para uma injeção única caudal em crianças com menos de 20 kg é usar bupivacaína 0.125%–0.175% ou ropiva-caína 0.2% e dar um bolus de um dos seguintes:
- 0.5 ml/kg para atingir um nível cirúrgico sacral
- 1.0 ml/kg para atingir um nível cirúrgico lombar alto
- 1.25 ml/kg para atingir um nível cirúrgico torácico baixo
- Para infusão peridural contínua, a bupivacaína 0.125% a uma taxa de 0.2 mg/kg/h para neonatos e 0.4 mg/kg/h para crianças mais velhas é frequentemente usada. Ropivacaína 0.1% a uma taxa de 0.2 mg/kg/h para recém-nascidos e 0.4 mg/kg/h para crianças mais velhas por 48 horas demonstrou ser um regime eficaz e seguro.
ADJUVANTES PARA ANESTESIA EPIDURAL EM CRIANÇAS
Um bloqueio caudal de injeção única com anestésico local é usado principalmente para pequenas cirurgias devido à duração limitada da analgesia. Adjuvantes podem ser usados para prolongar a duração do bloqueio, e vários medicamentos foram testados. O adjuvante mais comumente usado para anestésicos locais tem sido a epinefrina. A epinefrina na concentração de 1:200,000 é usada para diminuir a taxa de absorção do anestésico local e tem o benefício adicional de servir como um possível marcador para uma injeção intravascular inadvertida. Pesquisas recentes se concentraram no uso de uma infinidade de adjuvantes. Midazolam e neostigmina também foram estudados; no entanto, não há evidências de que esses medicamentos forneçam qualquer benefício analgésico quando administrados por via peridural. Opióides, clonidina e cetamina merecem mais consideração e, portanto, serão discutidos com mais detalhes.
Opióides
Os opióides epidurais podem aumentar o efeito dos anestésicos locais e prolongar a analgesia. No entanto, alguns opioides podem não ser aconselháveis em ambiente ambulatorial devido ao potencial de depressão respiratória e outros efeitos colaterais inaceitáveis (por exemplo, náuseas e vômitos, coceira, retenção urinária). Como resultado, o uso de opioides peridural caudal em crianças deve ser restrito a situações clínicas especiais fora do ambulatório. Uma dose de 2 mcg/kg de fentanil para anestesia caudal com injeção única, juntamente com a solução anestésica local padrão, tem sido recomendada para procedimentos mais extensos ou dolorosos e em pacientes com cateter urinário no pós-operatório. A adição de 1-2 mcg/mL de fentanil a 0.1% de bupivacaína para infusões epidural contínuas também tem sido usada com sucesso em crianças em um ambiente de internação bem monitorado. No entanto, o fentanil não deve ser usado em infusões peridurais neonatais. A morfina epidural também pode ser usada para pacientes internados submetidos a cirurgia abdominal ou torácica de grande porte. Quando adicionado a bloqueios peridurais caudais de injeção única, aumentará o nível de bloqueio devido à sua dispersão rostral (já que a morfina é uma molécula hidrofílica). As doses de morfina caudal variam de 30 a 90 mcg/kg, dependendo do tipo de cirurgia. A morfina epidural traz um risco potencial de depressão respiratória; portanto, a oximetria de pulso contínua é recomendada com doses menores de morfina caudal e é obrigatória com doses médias. Quando doses mais altas de morfina caudal são usadas, a internação pós-operatória em terapia intensiva deve ser planejada.
clonidina
Dos vários adjuvantes não opióides usados em bloqueios peridurais em crianças, a clonidina oferece o melhor perfil. A clonidina é um α1-agonista e atua estimulando as vias noradrenérgicas descendentes medulares, que inibem a liberação de neurotransmissores nociceptivos no corno dorsal da medula espinhal. A adição de clonidina (1-5 mcg/kg) pode melhorar o efeito analgésico dos anestésicos locais para bloqueio caudal com injeção única e prolongar a duração da ação do anestésico local sem os efeitos colaterais indesejados dos opioides epidurais. Para infusões peridural contínuas, clonidina 0.1 mcg/kg/h tem sido usada com bom efeito. Deve-se alertar que doses mais altas têm sido associadas a sedação e instabilidade hemodinâmica na forma de hipotensão e bradicardia. Com doses em bolus de 2 mcg/kg, esses efeitos colaterais são incomuns. Além disso, a clonidina epidural atenua a resposta ventilatória ao aumento dos níveis de dióxido de carbono expirado (PCO2). Embora a depressão respiratória não pareça ser um problema comum, apneia foi relatada em um recém-nascido a termo que recebeu um bloqueio caudal consistindo de 1 mL/kg de ropivacaína a 0.2% com clonidina 2 mcg/kg. Deve-se ter cuidado ao usar clonidina em lactentes muito jovens devido à sedação e hipotensão que podem ocorrer.
Ketamina
A adição de S-cetamina a um bloqueio caudal de injeção única prolonga o efeito analgésico dos anestésicos locais. As principais desvantagens da cetamina são seus efeitos psicomiméticos. No entanto, em pequenas doses (0.25-0.5 mg/kg), a cetamina é eficaz sem efeitos colaterais comportamentais perceptíveis. A cetamina 1 mg/kg também pode ser usada como analgésico caudal eficaz apenas sem a adição de solução anestésica local. A combinação de S(+)-cetamina (0.5-1 mg/kg) e clonidina (1 ou 2 mcg/kg) demonstrou fornecer analgesia eficaz após herniotomia inguinal em crianças com duração prolongada do efeito (> 20 horas) sem quaisquer efeitos adversos no sistema nervoso central (SNC) ou deficiência motora. Uma preocupação em relação ao uso de cetamina em recém-nascidos está relacionada a uma série controversa de estudos em animais sugerindo que a cetamina pode produzir neurodegeneração apoptótica no cérebro em desenvolvimento. Outros estudos em animais infantis demonstraram que a cetamina pode ter um efeito neuroprotetor. No entanto, muitos anestesiologistas hesitam em introduzir a S-cetamina caudal em sua prática clínica de rotina, e é improvável que a cetamina seja amplamente adotada em países onde as fórmulas sem conservantes não estão disponíveis.
COMPLICAÇÕES ASSOCIADAS À ANESTESIA EPIDURAL
Complicações maiores de bloqueios peridurais com injeção única ou contínua são raras se a técnica adequada for usada.
Lesão Neurológica
Um grande estudo prospectivo, que resumiu dados de mais de 15,000 bloqueios centrais em crianças, não relatou incidência de lesões neurológicas permanentes e concluiu que a incidência de complicações é rara. No entanto, três mortes infantis e duas outras incidências de paraplegia e tetraplegia foram relatadas em outro grande relatório retrospectivo publicado em 1995 com mais de 24,000 bloqueios peridurais em crianças. Este estudo também relatou dois casos de parestesia transitória. Embora o risco geral pareça baixo, complicações devastadoras de danos diretos à medula espinhal podem ocorrer, particularmente com a colocação de agulha peridural torácica e lombar alta. Além disso, a hipotensão pode comprometer a perfusão espinhal. Como a colocação de agulhas e cateteres peridurais geralmente é realizada com o paciente sob sedação ou anestesia geral, o fato de pacientes inconscientes não conseguirem relatar dor ou parestesia (o sinal de alerta atualmente aceito de invasão da agulha na medula espinhal) gera preocupação. Manter o paciente respirando espontaneamente durante a realização do bloqueio neuroaxial tem sido sugerido como medida de segurança. A ultrassonografia pré-procedimento da anatomia neuraxial, quando disponível, é altamente recomendada para avaliar a profundidade do espaço epidural.
Um relato de caso de lesão medular após a colocação de uma peridural torácica de injeção única sob anestesia geral para apendicectomia destaca a importância da avaliação rotineira da relação risco-benefício da colocação de uma peridural torácica direta para cirurgias menos extensas. Em particular, o uso de cateter epidural torácico e lombar alto deve ser reservado apenas para procedimentos torácicos e abdominais extensos e deve ser realizado por anestesiologistas com experiência em colocação epidural torácica. punção), o conhecimento da profundidade esperada do espaço peridural é importante. Como regra geral, o espaço peridural em crianças com peso superior a 10 kg é encontrado em 1 mm/kg de peso corporal. Existem outras fórmulas baseadas no peso corporal ou na idade do paciente para calcular essa profundidade. No entanto, a melhor opção é medir a profundidade por imagem de US pré-procedimento da anatomia do neuroeixo.tabela 1)
Dicas NYSORA
Como regra geral, o espaço peridural em crianças com peso superior a 10 kg encontra-se a uma profundidade de 1 mm/kg de peso corporal. No entanto, a imagem de US pré-procedimento é útil para determinar a profundidade do espaço epidural.
TABELA 1. Fórmulas para determinar a profundidade do espaço peridural da pele.
| Observação: | Uma avaliação ultrassonográfica individual pré-procedimento é o método preferido para determinar a profundidade do espaço peridural a partir da pele. |
| 1. Estimativa aproximada: 1 mm/kg de peso corporal | |
| 2. Profundidade (cm) = 1 + (0.15 × idade em anos) | |
| 3. Profundidade (cm) = 0.8 + (0.05 × peso em quilogramas) |
Hematoma epidural
Hematoma epidural associado à analgesia epidural em crianças é raro. Isso pode ocorrer porque os protocolos de anticoagulação raramente são indicados durante o período perioperatório em pacientes pediátricos. No entanto, a analgesia epidural deve ser evitada em pacientes com coagulopatia clinicamente significativa ou trombocitopenia. Diretrizes para o uso de anestesia peridural em pacientes adultos também devem ser aplicadas em pacientes pediátricos recebendo terapia antitrombótica ou trombolítica.
Infecção
Embora a taxa geral de infecção associada a cateteres peridurais caudais pareça ser baixa, existem relatos de casos isolados de infecção relacionada a cateteres peridurais em crianças. Comparado aos cateteres peridurais lombares, há alguma preocupação quanto à infecção do cateter com o uso prolongado de cateteres posicionados caudalmente devido à proximidade do hiato sacral ao reto. Embora os estudos não tenham encontrado evidências clínicas de maiores taxas de infecção com a abordagem caudal, a colonização bacteriana tem sido relatada como sendo maior. Staphylococcus epidermidis é o microrganismo predominante colonizado na pele e cateteres de peridural lombar e caudal. Bactérias Gram-negativas também foram encontradas nas pontas de cateteres caudais. Mesmo com bloqueios caudais de injeção única amplamente utilizados, infecções como a osteomielite sacral ainda podem ocorrer. Para reduzir o risco de contaminação por fezes e urina, técnicas como tunelização do cateter e fixação do cateter com curativo oclusivo em direção cefálica podem ser utilizadas. Uma técnica asséptica rigorosa, incluindo o uso de um sistema de infusão fechado estéril, também deve ser usada, e deve-se tomar cuidado para evitar trauma tecidual local. A inspeção diária do curativo e do local de entrada também é importante, embora o curativo não deva ser trocado a menos que seja estritamente necessário. Se a criança desenvolver febre persistente superior a 38°C de origem desconhecida, o cateter deve ser removido e enviado para cultura.
Dor de cabeça punção dural e pós-punção dural
A punção dural durante a analgesia peridural caudal é incomum se for tomado cuidado para evitar o avanço da agulha muito para dentro do canal sacral. O uso de imagens de US em tempo real para controlar a posição da agulha torna esse risco extremamente baixo. O tratamento da cefaleia pós-punção dural (CPPD) inclui repouso no leito, hidratação oral ou intravenosa (IV), analgesia (por exemplo, acetaminofeno regular, anti-inflamatórios não esteroides [AINEs]) e antieméticos. O repouso no leito, embora alivie a gravidade da cefaleia, não tem efeito sobre a incidência ou duração da CPPD.
Em adultos, a cafeína tem sido usada tanto na profilaxia quanto no tratamento da CPPD. A cafeína causa vasoconstrição cerebral ao bloquear os receptores de adenosina, que dilatam os vasos quando ativados. A redução do fluxo sanguíneo cerebral diminui a quantidade de sangue no cérebro e pode diminuir a tração nas estruturas intracranianas sensíveis à dor, aliviando assim a CPPD. No entanto, a cafeína não é frequentemente usada em crianças para alívio da CPPD, e uma dose ideal é desconhecida. crianças também. Acredita-se que um adesivo de sangue epidural seja eficaz através da formação de uma cobertura gelatinosa sobre o orifício dural pelo sangue injetado. A curto prazo, o remendo de sangue peridural sela o orifício e alivia a hipotensão do LCR tanto pelo efeito de massa do deslocamento craniano do LCR quanto pelo aumento do volume e da pressão intracraniana. A cura real ocorre a longo prazo. Em crianças, é recomendado que aproximadamente 1960 mL/kg de sangue autólogo seja injetado no paciente acordado ou levemente sedado, se possível, para detectar o aparecimento de sintomas radiculares. Uma discussão mais completa sobre PDPH é apresentada em Cefaleia pós-punção dural.
Efeitos hemodinâmicos e raquianestesia total
Alterações significativas na pressão arterial são incomuns em pacientes pediátricos após a administração precisa de analgesia epidural. Descobriu-se que um bloqueio caudal simpático de injeção única alta para T6 não evoca alterações significativas na frequência cardíaca, índice cardíaco ou pressão arterial em crianças. Mesmo quando o bloqueio peridural torácico é combinado com anestesia geral, a estabilidade cardiovascular geralmente é mantida em pacientes pediátricos saudáveis. Portanto, a hipotensão deve levantar a suspeita de raquianestesia total e/ou injeção intravascular levando à toxicidade do anestésico local. Após a exclusão dessas complicações, outras causas, como estado de hidratação, pressão de enchimento intravascular e estado inotrópico, e a profundidade da anestesia devem ser avaliadas.
Se tiver ocorrido raquianestesia total, medidas de suporte devem ser fornecidas até que o efeito do bloqueio se dissipe. No entanto, no caso de uma extensão com risco de vida de uma raquianestesia total, se as tentativas de medidas de suporte não forem eficazes nem uma opção, a lavagem cerebrospinal pode ser considerada como última manobra. Um relato de caso sugeriu que 20–30 mL de LCR podem ser retirados e substituídos por 30–40 mL de solução salina normal sem conservantes, Ringer lactato ou Plasmalyte através do cateter epidural. Esta intervenção pode encurtar o tempo de recuperação, minimizar o potencial insulto neurotóxico e reduzir a incidência de punção pós-dural. No entanto, à luz da experiência e informações limitadas sobre a lavagem cerebrospinal, os riscos e benefícios potenciais devem ser avaliados caso a caso antes de usar esta técnica em crianças.
Dicas NYSORA
- A anestesia e analgesia peridural em crianças saudáveis raramente causa instabilidade cardiovascular.
- A ocorrência de hipotensão deve levantar a suspeita de raquianestesia total e/ou injeção intravascular levando à toxicidade do anestésico local.
- Após a exclusão dessas complicações, outras causas, como estado de hidratação, pressão de enchimento intravascular e estado inotrópico, e a profundidade da anestesia devem ser avaliadas.
Toxicidade Sistêmica Anestésica Local
Toxicidade sistêmica do anestésico local (LAST) muitas vezes decorre de injeção intravascular acidental em vasos sanguíneos epidurais. Esta complicação muitas vezes pode ser evitada usando aspiração cuidadosa e dosagem de teste. tabela 2 resume recomendações para dosagem de teste em bloqueio epidural. Para um bloqueio caudal de injeção única, a punção vascular e a absorção do anestésico local são mais prováveis de ocorrer quando agulhas de ponta afiada são usadas. Para infusão peridural contínua, recém-nascidos e lactentes muito jovens correm maior risco de toxicidade anestésica local do que crianças mais velhas. Convulsões foram relatadas em crianças que receberam infusões contínuas de anestésicos locais. Isso pode ser evitado usando soluções diluídas de anestésicos locais (≤ 0.125% de bupivacaína) e seguindo as recomendações de dosagem atuais (consulte “Anestésicos Locais para Anestesia Epidural em Crianças”, acima).
Mais importante, o monitoramento vigilante durante a administração de analgesia epidural deve ser uma prioridade. As diretrizes para o tratamento LAST devem estar prontamente acessíveis em todas as áreas do hospital onde são usados anestésicos locais. Todo o pessoal das enfermarias onde são atendidos os pacientes submetidos à infusão epidural deve ser treinado no reconhecimento dos sintomas e tratamento da LAST. Além disso, um registro completo da técnica regional e da infusão utilizada em cada caso deve estar presente ao lado do prontuário de observações do paciente.
TABELA 2. Dosagem de teste para bloqueio epidural.
| 1. | Use a dosagem de teste rotineiramente, mesmo que a dosagem de teste para todos os agentes disponíveis não seja 100% sensível. Além disso, como a incidência real de colocação intravascular é relativamente baixa, a maioria dos testes positivos (isto é, aumento da frequência cardíaca) será falso-positivo. Quando há uma resposta limítrofe, repetir a dose do teste aumenta a especificidade e a sensibilidade do teste. |
| 2. | Monitore continuamente o ECG e efetue o ciclo repetidamente no manguito de pressão arterial. Com soluções contendo epinefrina, se a frequência cardíaca não aumentar, um aumento na pressão arterial deve levantar a suspeita de colocação intravascular. |
| 3. | Evite realizar a dosagem do teste quando a criança estiver em um plano de anestesia muito leve ou quando houver estimulação (por exemplo, reposicionamento do paciente na mesa de operação, instrumentação da via aérea, incisão). A realização da dose de teste nessas condições aumenta a probabilidade de aumentos falso-positivos induzidos por estimulação na frequência cardíaca ou na pressão arterial. |
| 4. | Após a dose de teste, o restante da dose total deve ser administrado de forma incremental. A dosagem incremental e o monitoramento contínuo ajudam a aumentar as chances de que uma colocação intravascular seja detectada e que a injeção adicional seja interrompida antes que as doses completas de cardiodepressores sejam administradas. |
| 5. | Sempre que possível, manter o paciente sob ventilação espontânea durante toda a colocação e dosagem inicial do bloqueio peridural. Qualquer alteração no padrão respiratório do paciente é um alerta de que pode ter ocorrido uma injeção intravascular ou intratecal inadvertida: taquipneia se dor à injeção; depressão respiratória se houver absorção sistêmica do anestésico local; ou taquipneia seguida de bradipneia causada por raquianestesia total se o anestésico local tiver sido administrado por via intratecal. |
Outros efeitos adversos
Em uma revisão retrospectiva baseada em dados prospectivos coletados de 286 pacientes pediátricos, prurido (26.1%), náuseas e vômitos (16.9%) e retenção urinária (20.8%) foram os efeitos colaterais mais comuns encontrados durante a anestesia peridural com infusão de bupivacaína e fentanil. Sedação e bloqueio excessivo ocorreram em menos de 2% dos pacientes. A incidência de depressão respiratória foi de 4.2%, mas a administração de naloxona para depressão respiratória grave nunca foi necessária. A perfuração do reto pode ocorrer se a agulha caudal for inclinada muito acentuadamente. tabela 3 resume os tratamentos recomendados para efeitos adversos comuns.
TABELA 3. Resumo dos tratamentos recomendados de efeitos em bloqueios peridurais.
| Coceira | |
| 1. Excluir e/ou corrigir outras causas remediáveis. | |
| 2. Use infusões de baixa dose de naloxona, agonistas-antagonistas parciais (por exemplo, nalbufina) ou anti-histamínicos. | |
| 3. Se a coceira persistir, remova o opioide da infusão epidural e considere clonidina. | |
| Náusea | |
| 1. Excluir e/ou corrigir outras causas remediáveis. | |
| 2. Use antagonistas de 5-HT (por exemplo, ondansetron, dolasetron) | |
| 3. Use infusões de baixa dose de naloxona ou nalbufina | |
| 4. Evitar opioides nas infusões e considerar clonidina. | |
| Íleo e disfunção intestinal | |
| 1. Excluir e/ou corrigir outras causas remediáveis. | |
| 2. Dê laxantes se não houver contraindicação. | |
| 3. Evitar opioides nas infusões e considerar clonidina. | |
| 4. Use infusões de baixa dose de naloxona ou nalbufina. | |
| 5. Usar antagonistas opióides com restrição periférica ou enteral; por exemplo, metilnaltrexona ou alvimopan (atualmente em investigação). | |
| Sedação ou hipoventilação | |
| 1. Excluir e/ou corrigir outras causas remediáveis. | |
| 2. Dependendo da gravidade, reduzir ou suspender a dosagem de opioides ou clonidina. | |
| 3. Desperte, estimule e encoraje a respiração profunda. | |
| 4. Se for grave, considere naloxona ou ventilação assistida conforme necessário. | |
| Retenção urinária | |
| 1. Excluir e/ou corrigir outras causas remediáveis. | |
| 2. Evite usar anticolinérgicos ou anti-histamínicos se houver alternativas disponíveis. | |
| 3. Use infusões de baixa dose de naloxona ou nalbufina. | |
| 4. Use cateterismo vesical. | |
BLOQUEIO PERIDURAL PARA CIRURGIA PEDIÁTRICA: TÉCNICAS
A analgesia epidural pode ser administrada por meio de uma técnica de injeção única ou de infusão contínua. As agulhas e cateteres podem ser inseridos no nível caudal, lombar ou torácico. O principal objetivo da técnica epidural é posicionar com precisão a agulha e/ou cateter no espaço epidural. Testes de aspiração e doses de teste indicam possível administração inadvertida de drogas por via intravascular ou intratecal. A estimulação epidural, o eletrocardiograma epidural (ECG) e as técnicas de US foram desenvolvidas, além da imagem convencional de raios-X, para auxiliar na colocação precisa da agulha ou cateter epidural.
Confirmação da colocação adequada da agulha ou cateter peridural
Aspiração e Dose de Teste
Um teste de aspiração realizado antes da injeção de anestésico local é usado para evitar injeções espinais e intravasculares totais. No entanto, uma aspiração negativa de sangue ou LCR não deve ser considerada um indicador absoluto da colocação adequada da agulha e do cateter. As veias são tão pequenas que podem colapsar facilmente na aspiração; portanto, recomenda-se usar uma seringa de 2 mL, aspirar lentamente e considerar a abertura para o ar para procurar fluxo livre.
O ECG do paciente deve ser monitorado continuamente durante a injeção de anestésico local no espaço caudal. As alterações de especificidade do ECG (ou seja, aumento > 25% na onda T) após a injeção de uma dose de teste de epinefrina (0.5 mcg/kg) podem ajudar a prever a injeção intravascular.
Se possível, o paciente deve ser mantido sob ventilação espontânea durante toda a colocação e dosagem inicial do bloqueio peridural. Qualquer alteração no padrão respiratório do paciente é um alerta de que algo pode estar acontecendo acidentalmente: depressão respiratória se houver absorção sistêmica do anestésico local; taquipneia se houver dor à injeção; ou taquipnéia seguida de bradipnéia se houver administração intratecal de anestésico local (ver tabela 2). tabela 4 resume vários métodos para confirmar a colocação do cateter peridural.
TABELA 4. Confirmação da posição do cateter peridural.
| No intraoperatório (enquanto o paciente está sob anestesia geral) |
| 1. A ultrassonografia é altamente recomendada para avaliar a dispersão do anestésico local na ponta do cateter ou no espaço epidural. |
| 2. Assegurar aspiração negativa; injetar o anestésico local lentamente em pequenos incrementos através do cateter; e avaliar a resposta à cirurgia. Se possível, manter ventilação espontânea. |
| 3. Radiografia com contraste. |
| 4. Técnica de estimulação elétrica e/ou ECG. |
| Pós-operatório (enquanto o paciente está acordado, se ele pode ou não dar respostas verbais) |
| 1. A ultrassonografia é o método atualmente recomendado. Isso é indolor e pode ser feito na SRPA sem incomodar muito a criança. |
| 2. Se o US não estiver disponível, o teste de cloroprocaína pode ser usado. Isso envolve a dosagem incremental de uma solução de cloro-procaína a 3% para demonstrar analgesia (por autorrelato ou medidas comportamentais, conforme apropriado) e sinais de efeito segmentar: uma. Ponta do cateter lombar: • Pelo menos bloqueio sensorial e motor parcial em ambas as pernas • Aquecimento da superfície volar dos dedos b. Ponta do cateter torácico inferior: • Força reduzida na flexão do quadril • Reflexos cutâneos abdominais reduzidos • Alguma redução na frequência cardíaca e pressão arterial c. Ponta do cateter torácico superior: • Alguma redução na frequência cardíaca e pressão arterial • Aquecimento da superfície volar das mãos • Síndrome de Horner unilateral ou bilateral |
Métodos Radiográficos
A imagem de raios-X em conjunto com um agente de contraste identifica com precisão a ponta do cateter em um nível específico da coluna vertebral.
Uma radiografia sem contraste, no entanto, não pode distinguir a colocação inadvertida do cateter intratecal ou subdural da colocação epidural correta. Além disso, a radiografia padrão não permite que o anestesiologista ajuste a posição do cateter durante a inserção, a menos que a fluoroscopia seja usada. Embora a fluoroscopia permita o monitoramento e o ajuste em tempo real dos cateteres em avanço, ela requer configuração adicional, aumenta as despesas e aumenta a exposição do paciente à radiação ionizante. Como resultado, a fluoroscopia não é recomendada rotineiramente e geralmente é limitada a circunstâncias difíceis e/ou especiais, como a colocação de cateter peridural de longo prazo para dor oncológica.
Teste de estimulação epidural (teste de Tsui) e técnica de ECG epidural
Um teste de estimulação elétrica de baixa corrente (o teste de Tsui; Figura 1) tem sido sugerido para monitorar e orientar a posição do cateter peridural durante a inserção. A configuração requer que o eletrodo catódico (preto para bloqueio) do estimulador de nervo seja conectado ao cateter epidural por meio de um adaptador de eletrodo enquanto o eletrodo anódico é conectado a um eletrodo na pele do paciente como local de aterramento. Para evitar interpretações errôneas da resposta da estimulação (por exemplo, uma contração muscular local pode ser confundida com estimulação epidural), o eletrodo aterrado é colocado na extremidade inferior para epidurais torácicas e na extremidade superior para epidurais lombares. A colocação correta da ponta do cateter peridural (1-2 cm das raízes nervosas) é indicada por uma resposta motora eliciada com uma corrente entre 1 mA e 10 mA. Uma resposta motora observada com uma corrente de limiar significativamente mais baixa (< 1 mA) sugere que o cateter está no espaço subaracnóideo ou subdural ou está próximo a uma raiz nervosa. Embora a estimulação crônica da medula espinhal seja um meio seguro e eficaz de controle da dor, a segurança desse teste de estimulação epidural não é completamente conhecida. No entanto, prevê-se que o risco de uma breve estimulação elétrica intermitente deste teste seja mínimo. tabela 5 resume as diferentes localizações do cateter de acordo com a resposta motora e a corrente elétrica.
TABELA 5. Teste de estimulação elétrica.
| Localização do cateter | Resposta do Motor | Atual |
|---|---|---|
| Subcutânea | nenhum | > 10 mA |
| Subdural | Bilateral (muitos segmentos) | <1 mA |
| Subaracnóide | Unilateral ou bilateral | <1 mA |
| Espaço epidural | ||
| - Contra a raiz nervosa | Unilateral | <1 mA |
| - Não intravascular | Unilateral ou bilateral | 1–10 mA (aumento da corrente de limiar após injeção de LA) |
| - Intravascular | Unilateral ou bilateral | 1–10 mA (sem alteração na corrente limite após a injeção de LA) |
Uma desvantagem da técnica de estimulação epidural é que ela não pode ser realizada de forma confiável se houver algum bloqueio neuromuscular clínico significativo ou se anestésicos locais tiverem sido administrados no espaço epidural. Para superar essa limitação, uma técnica de monitoramento alternativa usando o monitoramento de ECG foi sugerida. Um ECG de referência é monitorado no nível espinhal necessário para a cirurgia; este é então comparado com o ECG formado a partir da ponta do cateter peridural à medida que é rosqueado cefálica. Infelizmente, esta técnica não pode diferenciar facilmente complexos QRS sutis onde o cateter é enfiado a uma curta distância; nem reconhece o posicionamento do cateter intravascular ou intratecal.
Técnicas guiadas por ultrassom
Como o principal objetivo de um bloqueio peridural é colocar a agulha e/ou cateter com precisão no espaço peridural, o conhecimento da profundidade esperada da superfície da pele até o espaço peridural é extremamente importante. tabela 1 resume algumas fórmulas para calcular essa profundidade em crianças. Quando disponível, a US permite a identificação em tempo real de pontos anatômicos e uma estimativa muito mais precisa da profundidade do espaço epidural. É altamente recomendável fazer a varredura da anatomia com ultrassonografia em todas as crianças antes de realizar o bloqueio e especialmente em casos difíceis, como pacientes com escoliose ou covinhas sacrais. A US também permite a visualização da agulha dentro do espaço peridural em neonatos. Em lactentes, a US pode detectar o avanço do cateter peridural, direta ou indiretamente, pela observação da injeção de líquido.
Abordagens Epidurais
Os tipos mais comuns de analgesia peridural são analgesia caudal (que constitui a técnica regional mais utilizada em crianças), analgesia peridural lombar e analgesia peridural torácica.
Analgesia epidural caudal: técnica de injeção única
O bloqueio peridural caudal com injeção única é amplamente utilizado para fornecer analgesia perioperatória na prática pediátrica. Como uma única injeção, oferece um bloqueio confiável e eficaz para pacientes submetidos a cirurgia urológica, geral e ortopédica envolvendo o abdome inferior e membros inferiores. A peridural caudal de injeção única pode não ser adequada para todos os casos porque tem distribuição dermatomal limitada e curta duração de ação. Novos anestésicos locais e adjuvantes, bem como abordagens contínuas por cateter, podem superar essas limitações.
Escolha da agulha para analgesia caudal
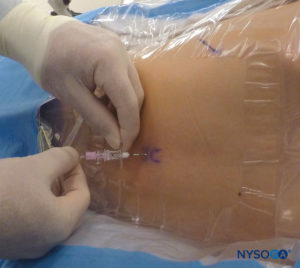
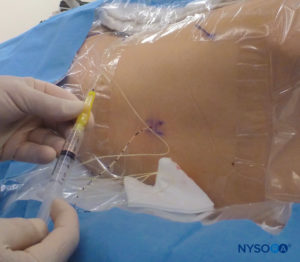
Uma variedade de agulhas está disponível para bloqueio caudal de injeção única. O tamanho ou tipo de agulha não parece afetar a taxa de sucesso ou a incidência de complicações do bloqueio caudal. Agulhas Tuohy ou Crawford de bisel curto (5 cm de comprimento) com estiletes oferecem uma melhor sensação tátil quando o ligamento sacrococcígeo é puncionado. Para crianças de 1 ano ou mais, é usada uma agulha de calibre 22; para crianças menores de 1 ano de idade, uma agulha de calibre 25 pode ser usada. O uso de uma agulha estilete pode reduzir o risco de introdução de um tampão dérmico no espaço caudal, embora ainda não tenha sido relatado um tumor de enxerto de células epidérmicas no espaço epidural. Alguns autores defendem o uso de um angiocath de calibre 22, sugerindo que é mais fácil detectar o posicionamento intravascular e o posicionamento intraósseo com essa agulha. O angiocath é usado apenas para o bloqueio caudal de injeção única e é retirado após a administração da dose (ou seja, não se destina a ser um cateter caudal peridural). Para evitar a perfuração do tecido com o angiocath, a agulha deve ser removida antes de qualquer injeção.
Técnica para realizar um bloqueio peridural caudal de injeção única
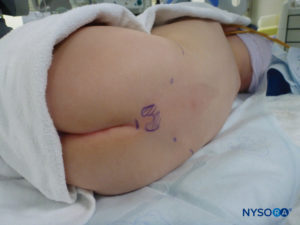
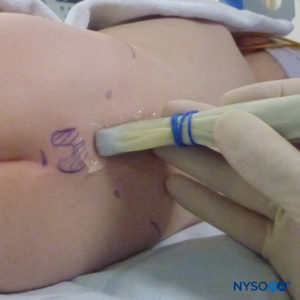
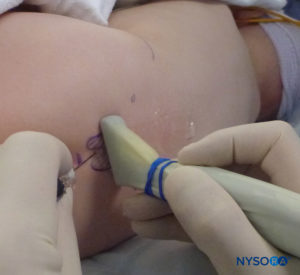
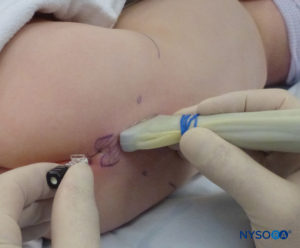
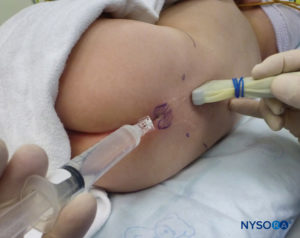
Em todas as crianças, é importante assegurar a prevenção adequada da perda de calor durante o procedimento. Em lactentes, recomendamos evitar a perda de calor com um campo transparente estéril, pois isso também permitirá a visualização da respiração do paciente (Figura 2). O paciente é colocado em decúbito lateral com o pescoço flexionado e os joelhos dobrados em direção ao tórax. Após o posicionamento adequado, os pontos de referência para bloqueio peridural caudal (Figura 3) são facilmente identificados em crianças: inicialmente o cóccix é identificado e, continuando a palpar na linha média de forma cefálica, os cornos sacrais podem ser sentidos em ambos os lados da linha média com aproximadamente 1 cm de distância. O hiato sacral é sentido como uma depressão entre duas proeminências ósseas dos cornos sacrais. Sob condições estéreis, a agulha é inserida e avançada no hiato sacral em um ângulo de aproximadamente 70 graus em relação à pele até que um “estalo” distinto seja sentido quando o ligamento sacrococcígeo é perfurado. Após esta punção, o ângulo da agulha deve ser reduzido para aproximadamente 20 a 30 graus enquanto a agulha é avançada 2 a 4 mm no canal caudal. Qualquer avanço além deste ponto não é recomendado porque o risco de punção dural inadvertida aumenta significativamente. Se um angiocath for usado, o cateter de plástico deve ser facilmente avançado sobre a agulha no espaço epidural caudal.
FIGURA 2. Capa transparente usada em neonatos e lactentes para permitir a visualização do paciente e evitar a perda de calor. A máquina dos EUA é colocada no lado oposto.
Dicas NYSORA
Cuidados devem ser tomados para garantir a prevenção da perda de calor durante o procedimento.
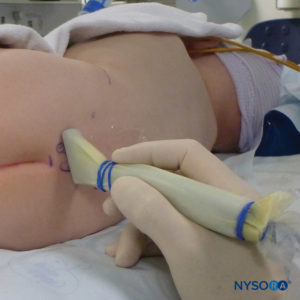
A US pode ser usada para avaliar a anatomia caudal antes da técnica baseada em pontos de referência ou para orientar a colocação da agulha. A pré-avaliação é particularmente útil na triagem de crianças com estigmas cutâneos de disrafismo espinhal. O paciente é colocado em decúbito lateral com os joelhos flexionados em direção ao tórax. A máquina dos EUA é colocada em frente ao operador para que ele possa olhar por cima das mãos em direção à tela. O paciente é preparado e a sonda de US é coberta de forma estéril. Uma sonda de alta frequência é usada: uma sonda linear de taco de hóquei é usada em bebês, enquanto uma sonda com pegada grande é preferível em crianças com peso superior a 10 kg, pois permite que mais espaços intervertebrais sejam visualizados de cada vez no plano sagital.
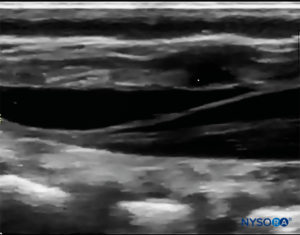
A sonda é posicionada primeiro em um plano transversal ao nível do sacro; isso é chamado de visão de eixo curto (SAX). A posição exata dos cornos e da membrana sacrococcígea (SCM) são definidas (Figura 4). Com a membrana sacrococcígea no meio da imagem (Figura 5), a sonda é então girada 90 graus em uma posição sagital da linha média sobre o sacro inferior, que é chamada de visão do eixo longo (LAX; Figura 6). O ECM e a camada ventral e dorsal do os sacrum, com o espaço peridural caudal entre eles, são facilmente identificados. Em crianças pequenas, o saco dural pode ser visível nesta posição, embora em crianças mais velhas você precise escanear mais em uma direção mais cefálica (Figura 7). Esses movimentos podem ser realizados na ordem oposta, mas recomenda-se uma exploração completa do espaço em ambos os eixos.
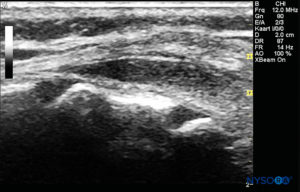
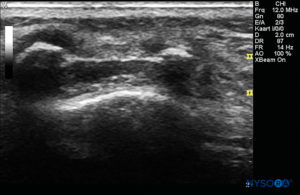
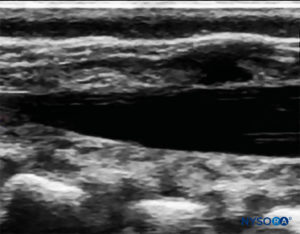
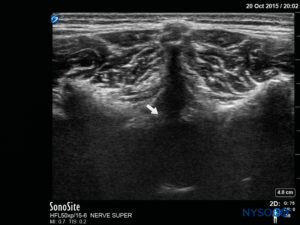
FIGURA 7. Imagem de US no eixo longo mostrando a membrana sacrococcígea e o espaço peridural caudal no os sacrum
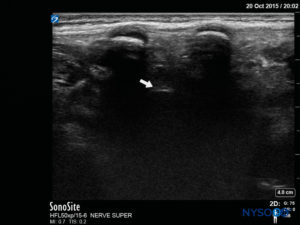
Após esta avaliação pré-procedimento da anatomia caudal por US, a agulha pode ser introduzida no hiato sacral com a sonda em qualquer eixo. Se a sonda for mantida no SAX, a inserção da agulha será automaticamente na abordagem fora do plano (OOP) (Figura 8). Se a sonda for mantida no LAX, a inserção da agulha será então na abordagem no plano (IP) (Figura 9).
O ângulo de inserção da agulha é observado durante a varredura. A agulha pode ser avançada 2–4 mm no espaço caudal e o estilete é removido. Para garantir o posicionamento caudal ideal da agulha, um pequeno bolus de solução salina ou anestésico local é administrado sob orientação de US com a sonda na linha média (LAX; Figura 10). A sonda é posicionada cefálica conforme necessário para visualizar o saco dural na tela de US (Figura 11). Quando a injeção começar, você notará que a dura-máter está deslocada ventralmente, especialmente em crianças menores. A propagação do anestésico local pode ser monitorada movendo-se a sonda cefálica para cima na coluna na linha média ou em um eixo sagital paramediano.Figura 12). O mesmo movimento da dura-máter pode ser visualizado com a sonda no SAX nas posições mais cefálicas (Figuras 13 e 14).
Confirmação da Distribuição Anestésica Local Correta
O “pop” clássico sentido quando o SCM é perfurado geralmente é procurado para confirmar o posicionamento adequado da agulha caudal. A ausência de abaulamento subcutâneo e a falta de resistência à injeção são sinais adicionais de colocação correta da agulha e distribuição do anestésico local. A aspiração da agulha deve estar livre de sangue e LCR, e uma resposta negativa a uma dose de teste de epinefrina também deve ser usada para descartar a colocação intravascular. A US tem sido usada para fornecer orientação em tempo real da agulha no espaço caudal e para avaliar a propagação do anestésico local. Estudos recentes com US mostraram que o volume de anestésico local não se correlaciona com sua propagação cranial durante o bloqueio caudal em lactentes e crianças. Inicialmente, pensava-se que a avaliação por US da disseminação do anestésico local fosse um preditor do dermátomo atingido, mas isso provou não ser o caso, pois a maioria dos bloqueios caudais é bem-sucedida, apesar da falta de disseminação cefálica imediatamente monitorada. No entanto, verificou-se que há uma disseminação secundária do anestésico local no espaço peridural. Isso ocorre em dois padrões: uma redistribuição horizontal intrasegmentar do espaço epidural dorsal para ventral e uma propagação cranial longitudinal retardada à medida que a dura retorna à sua posição original, empurrando assim o anestésico local epidural cefálico. O movimento bidirecional observado do LCR (referido como o “mecanismo de recuperação do LCR”) também ajuda a explicar um componente da diferença entre a disseminação inicial avaliada por US e o efeito mais cefálico final determinado por testes cutâneos. Mais estudos com ultrassonografia são necessários para determinar a melhor forma de predizer a disseminação do anestésico local.
Analgesia peridural caudal: técnica contínua
A analgesia peridural caudal contínua supera a duração limitada e o efeito segmentar de uma técnica de injeção única. Cateteres caudais podem ser avançados para o nível lombar ou torácico. A técnica de inserção de agulha para analgesia caudal contínua é muito semelhante à abordagem caudal de injeção única. Pode ser feito com cateter intravenoso (angiocateter calibre 18 para cateter peridural calibre 20 ou angiocateter calibre 16 para cateter peridural calibre 19) ou com agulha Crawford ou Tuohy calibre 18 inserido através da membrana sacrococcígea , conforme descrito para a técnica de injeção única. O cateter epidural é então avançado cuidadosamente do espaço caudal para o nível alvo. A resistência menor à passagem do cateter geralmente pode ser superada pela simples flexão ou extensão da coluna vertebral do paciente e/ou pela injeção simultânea de solução salina normal através do cateter. Alguns autores utilizam um cateter epidural de estimulação especializado (o Sistema de Posicionamento Epidural usando o teste de Tsui, Arrow International Inc., Reading, PA).
É extremamente importante saber onde a ponta do cateter está finalmente localizada: um nível muito baixo da ponta do cateter resultará em analgesia ruim; muito alto pode causar depressão respiratória. No entanto, como os cateteres não viajam linearmente no espaço epidural, medir o comprimento do cateter contra as costas do paciente não determina com precisão o nível cirúrgico alvo. Portanto, a localização da ponta do cateter deve ser verificada por meio de um teste objetivo, conforme descrito na seção anterior (ou seja, radiografia, estimulação nervosa, eletrocardiografia ou, preferencialmente, US).
Essas técnicas podem ser consideradas trabalhosas ou redundantes e, em crianças acima de 1 ano de idade, o desenvolvimento de uma curva lombar durante a infância pode impedir o fácil avanço cefálico do cateter. Portanto, alguns sugeriram que a colocação do cateter caudal deve ser limitada a pacientes com menos de 1 ano de idade. É opinião dos autores que, pelo menos em crianças com mais de 1 ano de idade, os cateteres devem ser colocados o mais próximo possível do dermátomo cirúrgico. Portanto, o treinamento pediátrico e ultrassonográfico apropriado é recomendado em todos os casos e obrigatório antes da realização de epidurais lombares ou torácicas em crianças pequenas.
Anestesia Epidural Lombar
A analgesia peridural lombar é comumente usada para infusões contínuas e raramente é usada como técnica de injeção única. A abordagem lombar direta é indicada principalmente para controle da dor durante e após a cirurgia de membros inferiores. A colocação epidural lombar, particularmente em crianças pequenas, é realizada após a indução da anestesia geral. No entanto, essa abordagem também pode ser realizada acordado em um grupo seleto de crianças e adolescentes cooperativos. Deve-se ter cautela sempre que realizar analgesia epidural lombar acima do nível da extremidade da medula espinhal para evitar trauma direto com agulha.
É preferível uma abordagem na linha média para a colocação da agulha peridural lombar. A identificação do espaço peridural é comumente conseguida pela perda de resistência (LOR) à solução salina. LOR ao ar deve ser evitado devido ao risco de introdução de embolia gasosa venosa, principalmente em recém-nascidos e lactentes. As crianças devem ser posicionadas em decúbito lateral para colocação epidural lombar direta. Em crianças com mais de 1 ano de idade, frequentemente é utilizada uma agulha Tuohy de 18 cm de calibre 5, marcada a cada 0.5 cm, com um cateter peridural de calibre 20. Em crianças menores de 1 ano, deve-se considerar uma agulha Tuohy de 20 cm de calibre 5, marcada a cada 0.5 cm, com um cateter de calibre 22. No entanto, esses cateteres mais estreitos se dobram, ocluem e vazam com mais frequência. Embora a identificação do espaço intervertebral e do ligamento amarelo na maioria dos pacientes pediátricos seja fácil, o ligamento amarelo pode ser menos tenso em crianças; portanto, um “pop” distinto pode não ser sentido facilmente ao penetrar nesta camada. Além disso, a distância da pele ao espaço peridural pode ser muito superficial. Fórmulas para estimar a distância da pele ao espaço epidural foram propostas (ver tabela 1). No entanto, as fórmulas são apenas uma orientação e mudam de acordo com o ângulo de colocação da agulha peridural. Hoje, o melhor método disponível para avaliar a profundidade epidural é a imagem de US. Com a sonda em um plano sagital oblíquo paramediano, a distância da pele ao ligamento amarelo é medida com o paquímetro do aparelho de US. Esta medida fornece uma boa estimativa da profundidade em que o LOR será sentido. Portanto, uma avaliação US pré-procedimento de cada paciente individual é altamente recomendada.
Para obter uma descrição exata da técnica epidural lombar, consulte “Anestesia epidural torácica”, abaixo (as figuras ilustram uma colocação epidural torácica).
Abordagem Epidural Lombar-Torácica
Cateteres colocados pela via lombar podem ser avançados cefálicos aos níveis vertebrais torácicos. Semelhante aos problemas encontrados ao avançar os cateteres no espaço caudal em crianças mais velhas, a resistência significativa também impede o fácil avanço dos cateteres peridurais lombares para os níveis torácicos. Apesar dos resultados favoráveis com a estimulação por via caudal, apenas um relato de caso demonstrou o sucesso da colocação de um cateter peridural torácico por via lombar com guia de estimulação epidural. Portanto, os autores recomendam a colocação do cateter o mais próximo possível do sítio cirúrgico.
Analgesia peridural torácica
Existem controvérsias sobre a segurança de colocar epidurais torácicas sob sedação intensa ou anestesia geral, porque pacientes inconscientes são incapazes de relatar sintomas que possam alertar o anestesiologista sobre potenciais complicações neurológicas O trauma direto com agulha na medula espinhal durante a inserção epidural é raro, mas pode causar complicações devastadoras . Relatos detalham casos de trauma direto com agulha na medula espinhal durante a colocação epidural em pacientes acordados e anestesiados. Para cirurgia torácica, o cateter deve ser introduzido o mais próximo possível do nível da incisão do dermátomo.
O avanço de cateteres dos espaços peridural lombar e caudal para o nível torácico é uma alternativa apenas em crianças de até 1 ano de idade. No entanto, o avanço dos cateteres no espaço peridural torna-se cada vez mais difícil com o avançar da idade devido ao desenvolvimento da curvatura lombar.
A colocação direta de cateteres peridurais torácicos é mais comum em centros terciários, onde anestesiologistas pediátricos bem treinados realizam os bloqueios em crianças submetidas a cirurgias de grande porte. A ultrassonografia pré-procedimento é fortemente recomendada. Além disso, os autores acreditam que o treinamento em epidurais torácicas assistidas por US deve ser fornecido para anestesiologistas dispostos a realizar epidurais torácicas em crianças.
Dicas NYSORA
- As crianças precisam de um volume (dose) significativamente maior de anestésico local em comparação com os adultos para obter a mesma disseminação dermatomal.
- O avanço pretendido do cateter torácico alto a partir de um local de inserção lombar raramente é bem-sucedido.
- A inserção do cateter peridural torácico deve ser realizada apenas por profissionais experientes na técnica peridural torácica pediátrica.
- A inserção da agulha peridural em pacientes pediátricos pode ser realizada em qualquer interespaço torácico usando uma abordagem de linha média ou paramediana; no entanto, uma abordagem de linha média é frequentemente preferida.
Analgesia Epidural Torácica: Abordagem Mediana
A utilização da abordagem da linha média oferece a vantagem de ser semelhante à abordagem lombar (com a agulha angulada em apenas um plano). Usando a abordagem da linha média, a inserção da agulha é mais fácil no nível torácico inferior (T10-T12) do que no nível torácico médio (T4-T7). A borda inferior da escápula, que está no nível da sétima vértebra torácica, é comumente usada como referência anatômica. O paciente é colocado em decúbito lateral e cuidados são tomados para evitar a perda de calor. Uma avaliação da anatomia do paciente pode ser feita em uma configuração não estéril antes da realização do bloqueio; isso também é útil para fins de ensino.
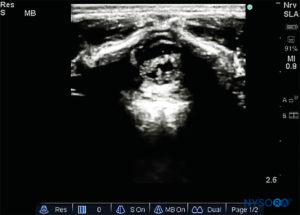
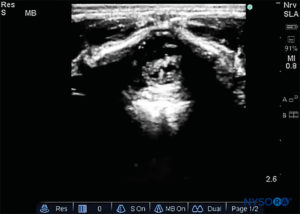
O processo espinhoso do nível vertebral alvo deve ser identificado contando-se a partir da linha de Tuffier e contando-se a partir da vértebra cervical C7 mais proeminente.Figura 15). A imagem de US pré-procedimento é realizada com a sonda em três planos: transversal (SAX), sagital mediano (LAX mediano) e sagital oblíquo paramediano (LAX oblíquo paramediano). A distância da pele do paciente ao espaço epidural pode assim ser medida. No SAX (Figura 16), deve-se encontrar a janela entre dois processos espinhosos, e o complexo anterior da coluna vertebral (ligamento longitudinal posterior, dura anterior e corpo vertebral) na profundidade da imagem serão as primeiras estruturas a serem identificadas. O complexo posterior (ligamento amarelo e dura posterior) pode ser mais difícil de visualizar, mas estará aproximadamente no nível da lâmina.Figura 17).
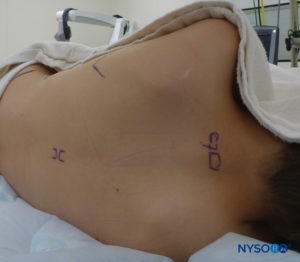
FIGURA 15. Analgesia peridural torácica: posicionamento do paciente e pontos de referência para uma abordagem na linha média.
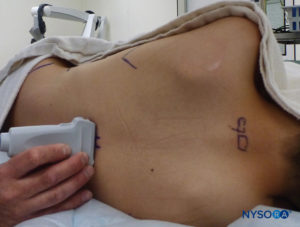
FIGURA 16. Escaneamento pré-procedimento com configuração não estéril para fins de ensino; a sonda US está na visualização de eixo curto.
Se o paciente for um lactente e as estruturas ósseas da coluna vertebral ainda não estiverem totalmente ossificadas, um LAX mediano (Figura 18) fornece imagens claras e reais da anatomia envolvida. Com esta posição da sonda, o processo espinhoso na imagem quase atingirá a pele (ou o topo da tela dos EUA). Entre o processo espinhoso, a dura-máter será vista como uma dupla camada branca; encontra-se um pouco menos profundo do que o nível em que o complexo posterior é encontrado no SAX (Figura 19).No LAX oblíquo paramediano (Figura 20), o processo transverso e/ou a lâmina podem ser visualizados, dependendo de quão lateral e oblíqua a sonda é colocada. O complexo anterior é novamente facilmente visualizado e, na maioria das vezes, a pia-máter pode ser vista em crianças pequenas. As características “cabeças de cavalo” podem ser encontradas na imagem, e a dura-máter será vista no meio, em um nível mais profundo (Figura 21). A profundidade da dura-máter será mais ou menos igual, como nas posições SAX e LAX mediana.
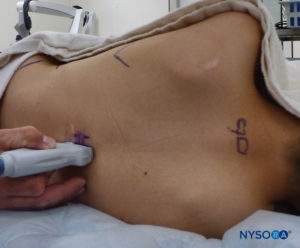
FIGURA 18. Escaneamento pré-procedimento com configuração não estéril para fins de ensino; a sonda dos EUA está na visão do eixo longo mediano. A sonda deve estar exatamente na linha média, mas nesta foto, ela foi posicionada na visão paramediana do eixo longo para ver a direção.
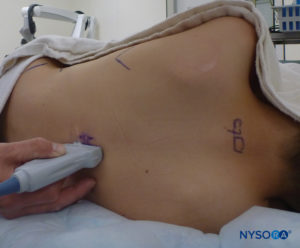
FIGURA 20. Escaneamento pré-procedimento com configuração não estéril para fins de ensino; a sonda de US está na visão do eixo longo oblíquo paramediano. A inclinação da sonda pode ser comparada com a mostrada na Figura 16.
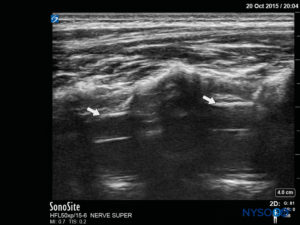
FIGURA 21. Imagem de US na incidência do eixo longo oblíquo paramediano, mostrando o complexo posterior com a dura-máter (setas brancas).
Após a imagem pré-procedimento para medir a profundidade em que o espaço peridural será alcançado, a pele da criança é preparada e coberta (Figura 22). Uma agulha peridural Tuohy calibre 18, com 5 cm de comprimento, com marcações a cada 0.5 cm, é então inserida no interespaço em um ângulo cefálico de aproximadamente 70 graus em relação ao eixo longitudinal da coluna. Uma manobra útil é inserir a agulha em um ângulo semelhante àquele com que a sonda de US foi segurada quando a distância em direção ao espaço peridural foi medida.Figura 23). A resistência contínua deve ser sentida à medida que a agulha é inserida através dos ligamentos supraespinhosos e interespinhosos. Quando o ligamento interespinhoso é atingido, o estilete é removido e uma seringa LOR cheia de solução salina é conectada à agulha. A pressão contínua é colocada no êmbolo à medida que a agulha avança mais (Figura 24). Em crianças mais velhas, um aumento na resistência é inicialmente sentido quando o ligamento amarelo é penetrado, pouco antes do LOR ser sentido. No entanto, em crianças mais novas, a resistência encontrada no ligamento amarelo pode não ser visivelmente diferente da dos outros ligamentos.
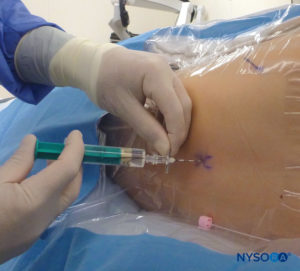
FIGURA 24. Avanço da agulha com pressão contínua no êmbolo com a mão direita enquanto a mão esquerda avança a agulha.
A agulha não deve ser inserida a uma profundidade maior do que a profundidade estimada do espaço peridural pré-procedimento pelo US. O espaço peridural torácico é identificado com LOR para solução salina; ar não é recomendado em crianças. A seringa é então retirada e, após descartar a punção dural, o cateter é inserido (Figura 25). O comprimento do cateter inserido deve ser apenas cerca de 2 cm além da ponta da agulha se a punção peridural tiver sido realizada no nível apropriado. Se a punção foi realizada um nível abaixo, o cateter pode ser inserido até 3 a 4 cm, mas deve-se ter em mente que em crianças pequenas, alguns centímetros podem representar vários segmentos vertebrais.
Depois de retirar a agulha e garantir que um comprimento adequado de cateter seja mantido no lugar, o conector é fixado ao cateter. Neste ponto, é imperativo verificar se há queda do menisco e realizar aspiração lenta e cuidadosa através do cateter para verificar se há sangue ou LCR.Figura 26). O filtro é então conectado e doses incrementais de anestésico local podem ser administradas com a propagação avaliada por imagem de US.
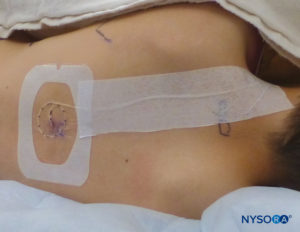
Recomendamos tunelar o cateter ou usar um curativo líquido ou o adesivo tópico da pele Histoacryl para fechar o orifício de entrada para evitar vazamento. A prevenção de vazamento de anestésico local em pacientes pediátricos é importante, pois o vazamento de anestésico pode consistir em uma porcentagem significativa da droga total administrada. Vazamentos sob o dispositivo de fixação ou Tegaderm podem representar um problema para a própria fixação do cateter. Recomenda-se um dispositivo transparente de fixação epidural para permitir a observação de qualquer vazamento de anestésico local ou sinais de infecção.Figura 27).
Dicas NYSORA
- Existem várias fórmulas para calcular o volume de anestésico local necessário para bloquear um determinado número de segmentos.
- Um bolus de 1.0 mg/kg de bupivacaína a 0.25% ou ropivacaína a 0.2% é administrado para estabelecer o bloqueio.
- Em crianças em idade pré-escolar e especialmente lactentes, pode ocorrer irritabilidade ou agitação apesar de uma analgesia epidural aparentemente bem-sucedida. Este é provavelmente o resultado da linha IV, sonda nasogástrica, cateter urinário ou ambiente hospitalar.
- A sedação satisfatória pode ser alcançada com qualquer um dos seguintes:
– Bolus IV de morfina 25 mcg/kg conforme necessário, ou
– Adição de clonidina 0.5 mcg/mL à mistura epidural
MANEJO DE INFUSÃO EPIDURAL PÓS-OPERATÓRIO
Para uma analgesia epidural eficaz e segura, recomenda-se uma abordagem sistemática e baseada em protocolo para o atendimento ao paciente. Uma equipe pediátrica dedicada à dor aguda, composta por anestesiologistas e enfermeiros, é vital para garantir avaliações padronizadas da dor, monitoramento vigilante do paciente e tratamento adequado dos efeitos adversos. A colocação precisa de agulhas e cateteres peridurais é a chave para o sucesso da analgesia epidural. Isso requer o uso de um método confiável para confirmar a localização da ponta do cateter (ou seja, US, estimulação epidural). A duração média da infusão epidural é de cerca de 72 horas, embora possa ser necessário continuar a infusão por períodos mais longos, especialmente em crianças com histórico médico complicado ou necessidade prolongada de analgesia. Em recém-nascidos, a duração da infusão epidural deve ser limitada a 48 horas devido ao risco de toxicidade sistêmica. Uma equipe de pessoal dedicado com foco no manejo da dor deve cuidar desses pacientes. Quando houver planos para descontinuar a infusão epidural, um opioide deve ser considerado para permitir analgesia adequada. Finalmente, o sucesso do processo é baseado em ordens devidamente escritas – uma parte crucial da execução de analgesia adequada.
Dicas NYSORA
Para analgesia pós-operatória, administra-se bupivacaína 0.125% ou ropivacaína 0.1–0.2%, com ou sem fentanil 1–2 mcg/mL, nas seguintes taxas:
- Idade > 3 meses: 0.20–0.35 mL/kg/h (< 0.4 mg/kg/h bupivacaína)
- Idade < 3 meses: 0.1–0.15 mL/kg/h (< 0.2 mg/kg/h bupivacaína)
ANESTESIA ESPINHAL EM CRIANÇAS
INTRODUÇÃO
A raquianestesia talvez seja uma das modalidades mais antigas e estudadas para o alívio da dor em pacientes submetidos à cirurgia. J. Leonard Corning é creditado com a administração do primeiro anestésico espinhal em 1885, e sua experiência foi posteriormente publicada em uma revista médica. Embora o uso da administração de anestesia intratecal em crianças tenha sido descrito no início do século XX, essa técnica era pouco utilizada na população pediátrica até que Melman relatou uma série de lactentes de alto risco submetidos à cirurgia bem-sucedida sob raquianestesia. Relatos de apnéia após anestesia geral em prematuros surgiram na literatura no início da década de 1980, e uma série de Abajian et al. ofereceu aos profissionais um impulso para oferecer uma técnica alternativa com menos complicações do que a anestesia geral. Desde então, várias séries foram relatadas em todas as faixas etárias para uma variedade de procedimentos cirúrgicos atestando a segurança e eficácia da raquianestesia.
TABELA 6. Diferenças anatômicas entre adultos e bebês no canal medular.
| O cone medular termina em L2-L3 em bebês versus L1 em adultos. |
| Os bebês têm uma pelve pequena e o sacro começa mais cefálico do que em adultos. |
| O saco dural termina mais caudalmente em bebês do que em adultos. |
ANATOMIA
Compreender as diferenças anatômicas entre adultos e bebês é crucial para administrar com segurança a raquianestesia em crianças de maneira tecnicamente proficiente.tabela 6). A medula espinhal termina em um nível muito mais caudal em recém-nascidos e lactentes do que em adultos. O cone medular termina aproximadamente em L1 em adultos e no nível L2 ou L3 em recém-nascidos e lactentes. Para evitar possíveis lesões na medula espinhal, a punção dural deve ser realizada abaixo do nível da medula espinhal; isto é, abaixo de L2–L3 em recém-nascidos e lactentes. Em adultos, a raquianestesia é frequentemente realizada no interespaço mais próximo de uma linha imaginária que se estende pelo topo das cristas ilíacas, a linha intercristal ou de Tuffier, correspondente ao interespaço L3-L4. No entanto, neonatos e lactentes têm uma pelve proporcionalmente menor que os adultos, e o sacro está localizado mais cefálico em relação às cristas ilíacas. Portanto, a linha de Tuffier cruza a linha média da coluna vertebral no interespaço L4–L5 ou L5–S1, bem abaixo da terminação da medula espinhal, tornando esse marco aplicável em todos os pacientes pediátricos. O saco dural em recém-nascidos e lactentes também termina em uma localização mais caudal em comparação com a dos adultos, geralmente no nível de S3 em comparação com o nível de S1 do adulto. A terminação mais caudal do saco dural torna mais provável uma punção dural inadvertida durante a realização de um bloqueio caudal com injeção única se a agulha for avançada demais no espaço epidural.
O volume do LCR é maior em mililitros por quilograma em bebês e neonatos (4 mL/kg) em comparação com adultos (2 mL/kg). Além disso, o LCR em lactentes é distribuído relativamente mais no canal espinhal do que na cabeça, em oposição à distribuição em adultos. Isso pode, em parte, ser responsável pela maior necessidade de dose de anestésico local e menor duração de ação da raquianestesia em lactentes. O alto débito cardíaco característico da população pediátrica reduz ainda mais a duração da raquianestesia em crianças.
ANESTÉSICOS LOCAIS
Uma variedade de anestésicos locais e doses tem sido descrita na literatura, incluindo bupivacaína86 e ropivacaína. A bupivacaína 0.5%, 0.5-1 mg/kg, é geralmente usada para raquianestesia em crianças com peso inferior a 10 kg. Uma dose na extremidade superior da faixa é preferida para crianças menores; o risco de raquianestesia total é baixo desde que o procedimento seja realizado de forma diligente (tabela 7). É preferível uma “lavagem com epinefrina” da seringa, em vez de uma dose padrão de epinefrina. Uma solução de bupivacaína hiperbárica com glicose a 8% fornece um bloqueio de qualidade e duração semelhantes à bupivacaína isobárica com glicose a 0.9%.
Adjuvantes aos anestésicos locais em raquianestesia também foram descritos. A clonidina na dose de 1 mcg/kg adicionada à bupivacaína (1 mg/kg) usada em raquianestesia para recém-nascidos demonstrou prolongar a duração do bloqueio para quase o dobro da duração da raquianestesia sem clonidina. Entretanto, o uso de 2 mcg/kg de clonidina pode causar diminuição transitória da pressão arterial e maior sedação pós-operatória. Pode ser aconselhável usar uma dose de cafeína de 10 mg/kg por via intravenosa para prevenir uma potencial apneia pós-operatória, especialmente se a clonidina for usada na solução de anestésico espinhal.
Em casos de correção de hérnia bilateral em ex-prematuros, a raquianestesia pode ser complementada com um bloqueio caudal. O paciente é virado do lado da maior hérnia enquanto o bloqueio é realizado; uma injeção espinhal de 0.8 mg/kg de bupivacaína é seguida imediatamente por uma injeção caudal de 0.1% de bupivacaína. Esta técnica prolonga a duração da anestesia e analgesia. Alternativamente, uma solução hipobárica de anestésico local pode ser injetada com o lado cirúrgico para cima.
TABELA 7. Dosagem de raquianestesia em crianças.
| Solução anestésica local: ropivacaína ou bupivacaína 0.5% 0.5–1 mg/kg. | ||
| Uma maneira fácil de calcular a dose para um único reparo de hérnia em bebês é a seguinte: | ||
| Idade (mais) | Peso (kg) | Dose de bupivacaína 0.5% |
| 1 | 3 | 1 mg / kg |
| 2 | 4 | 0.8 mg / kg |
| 3 | 5 | 0.6 mg / kg |
| > 4 | 6 | 0.4 mg / kg |
| Aditivos possíveis: • Lavagem com epinefrina • Clonidina 1 mcg/kg • Morfina 10 mcg/kg apenas para cirurgia cardíaca para facilitar a extubação precoce) |
||
EFEITOS ADVERSOS
Os efeitos adversos da raquianestesia comumente observados em adultos são menos comuns em crianças. Estes incluem hipotensão, bradicardia, CPPD e sintomas radiculares transitórios.
Hipotensão e bradicardia são incomuns em crianças, apesar dos altos níveis de bloqueio necessários. A carga de líquidos para aumentar a pré-carga raramente é necessária em crianças, mas, se necessário, pode ser feita a uma taxa de 10 mL/kg. Embora alguns autores obtenham acesso venoso nos membros inferiores do paciente após a realização da raquianestesia (colocação de cateter intravenoso sem dor), recomendamos a obtenção de acesso venoso antes da realização da raquianestesia. Puncuh et ai. relataram sua experiência com 1132 anestésicos espinhais consecutivos nos quais a hipotensão foi raramente relatada: apenas uma leve diminuição da pressão arterial foi relatada em 9 de 942 pacientes com menos de 10 anos de idade e em 8 de 190 pacientes com mais de 10 anos de idade.
A incidência de CPPD é menor em crianças do que em adultos. No entanto, uma incidência de 8% foi relatada em pacientes oncológicos após punções lombares frequentes para punção lombar. O uso de diferentes tipos de agulha espinhal foi estudado neste subgrupo de pacientes, mas não foi encontrada diferença na incidência de cefaleia (15% Quincke; 9% ponta de lápis Whitacre; p = 0.43). Além disso, a incidência de cefaleia não foi diferente por faixa etária, com 8 de 11 CPPD ocorrendo em crianças menores de 10 anos e a mais jovem relatada em uma criança de 23 meses. As PDPHs foram tratadas com repouso na cama e cafeína em adultos, mas são seguidas por remendo de sangue se a dor de cabeça não desaparecer. Em crianças, a dose ideal de cafeína não é conhecida, e um tampão sanguíneo peridural é realizado com 0.3 mL/kg de sangue quando a cefaleia persiste. Sintomas radiculares transitórios foram relatados em crianças, mas sem efeitos adversos a longo prazo.
CONTRA-INDICAÇÕES RELATIVAS
A principal contraindicação para uma técnica espinhal em uma criança não sedada é uma cirurgia com duração superior a 60 minutos. A raquianestesia deve ser evitada em recém-nascidos e crianças que possam ter pressão intracraniana aumentada. Em crianças com doenças neuromusculares, derivações ventriculares (atrial ou peritoneal) e convulsões mal controladas, o uso de raquianestesia é controverso. Outras contraindicações à raquianestesia são semelhantes às da população adulta e incluem deformidades anatômicas graves, infecção sistêmica ou no local da punção, coagulopatia subjacente e instabilidade hemodinâmica.tabela 8).
Ao considerar a raquianestesia, atenção especial deve ser dada às crianças com via aérea difícil conhecida. Embora a raquianestesia possa ser uma escolha razoável nesses pacientes, a primeira consideração deve ser a capacidade do profissional de manejar as vias aéreas. A necessidade de sedação IV em crianças em idade pré-escolar e escolar apresenta seu próprio conjunto de riscos em pacientes pediátricos com via aérea difícil. O local cirúrgico, a duração prevista do procedimento e a posição cirúrgica (ou seja, supina, lateral ou prona) também são fatores importantes a serem considerados.
TABELA 8. Contra-indicações relativas à raquianestesia em crianças.
| Anormalidades anatômicas da coluna vertebral |
| Doença neuromuscular degenerativa |
| Dissidência do paciente e família |
| Coagulopatia |
| Infecção bacteriana |
| Aumento da pressão intracraniana |
| Derivações ventriculoperitoneais |
Dicas NYSORA
Considerações especiais para bebês e crianças submetidas à raquianestesia incluem o seguinte:
- A experiência do anestesista
- A motivação do cirurgião
- A duração estimada da cirurgia é inferior a 90 minutos
ANESTESIA ESPINHAL PARA PACIENTES PEDIÁTRICOS: TÉCNICA
PREPARAÇÃO
Mistura eutética de creme anestésico local (EMLA) ou LMX (creme de lidocaína a 4%) pode ser aplicada no local de inserção, embora o risco de metemoglobinemia deva ser levado em consideração em prematuros muito pequenos. A sala de cirurgia deve ser aquecida antes de trazer o paciente para a sala. Cobertores quentes e lâmpadas de aquecimento radiante ajudam a diminuir a perda de calor em bebês. Com crianças maiores, a sala deve ser silenciosa e, se possível, os instrumentos cirúrgicos cobertos para minimizar a ansiedade do paciente. As salas de cirurgia pediátrica podem ser equipadas com equipamento estéreo ou de vídeo, que pode ser usado para distrair crianças mais velhas se o bloqueio for realizado sem sedação. Dispositivos de monitoramento padrão (oxímetro de pulso, eletrocardiograma e manguito de pressão arterial) devem ser aplicados antes de realizar o bloqueio.
Um plano deve ser feito em relação ao uso concomitante de sedação intravenosa ou anestesia geral inalatória. A abordagem deve ser ditada pela condição médica e idade do paciente, o nível de conforto do anestesista e a natureza e duração prevista do procedimento cirúrgico. A anestesia geral pode predispor bebês muito prematuros a apneia e bradicardia. A raquianestesia em lactentes não dura mais que 90 minutos devido às suas características fisiológicas. Portanto, em ex-prematuros submetidos a procedimentos abdominais inferiores com duração inferior a 90 minutos, a raquianestesia sem sedação adjuvante pode ser realizada. No entanto, um curto período de anestesia geral inalatória ou sedação IV suplementar pode às vezes ser necessário enquanto o bloqueio está sendo realizado, especialmente se o creme EMLA não tiver sido usado. Crianças mais velhas podem necessitar de sedação suplementar ou anestesia geral leve antes de realizar o bloqueio. Em alguns casos, a raquianestesia pode ser combinada com anestesia caudal ou peridural para prolongar a analgesia.
Posição do Paciente
A raquianestesia é habitualmente administrada na posição lateral ou sentada em crianças. Se a posição lateral for preferida, o paciente é posicionado na borda da mesa cirúrgica e segurado firmemente por um assistente. Caso contrário, o paciente pode ser colocado no meio da mesa cirúrgica, mas em cima de vários cobertores; estes darão a altura necessária para que as mãos do anestesiologista sejam colocadas confortavelmente durante a realização do bloqueio (Figura 28). Se a posição sentada for preferida, atenção especial deve ser dada aos lactentes para garantir que o pescoço não fique flexionado, pois isso pode resultar em obstrução das vias aéreas (Figura 29). É essencial monitorar atentamente a saturação de oxigênio em lactentes durante a realização da coluna vertebral para garantir a adequação e a permeabilidade das vias aéreas. Além disso, a flexão do pescoço não é necessária porque não facilita a realização do bloqueio em crianças pequenas. Em crianças maiores, um assistente deve estar presente para manter o posicionamento adequado e tranquilizar e distrair a criança enquanto o bloqueio está sendo realizado. O uso de chupeta, enquanto o bloqueio está sendo realizado em uma criança não sedada, geralmente é útil.
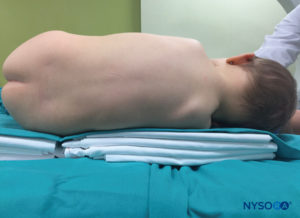
FIGURA 28. Raquianestesia em decúbito lateral. A criança é colocada em cima de vários cobertores para ganhar altura para as mãos do anestesiologista enquanto realiza o bloqueio.
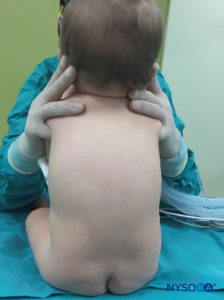
FIGURA 29. Raquianestesia na posição sentada. A flexão da cabeça deve ser evitada para prevenir a obstrução das vias aéreas.
Técnica
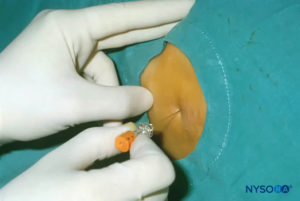
Em lactentes, o interespaço L4–L5 ou L5–S1 deve ser identificado; o interespaço L3–L4 pode ser usado em crianças mais velhas. A área deve ser preparada e coberta de forma estéril. Caso não tenha sido aplicado creme anestésico tópico no pré-operatório, a anestesia local deve ser administrada antes do bloqueio em pacientes acordados ou levemente sedados. A dose desejada de anestésico local espinhal deve ser calculada e preparada em uma seringa antes da punção dural para garantir que a dose correta seja administrada. Como o volume de anestésico local necessário pode ser pequeno em neonatos, é importante medir o volume correspondente ao eixo da agulha e contar esse volume também na dose total de anestésico local. Uma seringa de insulina é útil para medir a dose exata com precisão. Uma agulha espinhal curta de calibre 22 ou 25 é frequentemente usada (Figura 30). Uma abordagem de linha média é geralmente recomendada em vez de uma abordagem paramediana. O ligamento amarelo é muito macio em crianças, e um “estalo” distinto pode não ser percebido quando a dura-máter é penetrada.Figura 31). Uma vez que o LCR claro está saindo da agulha, o(s) medicamento(s) pode(m) ser administrado(s) e, mais importante, deve ser injetado lentamente (Figura 32).
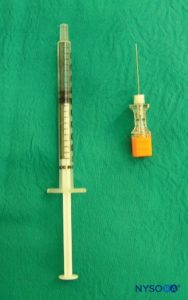
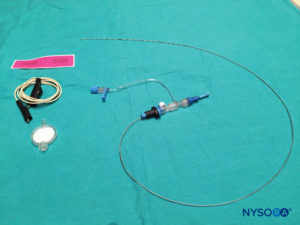
FIGURA 30. Equipamento utilizado para raquianestesia em neonatos: agulha raquidiana e seringa com anestésico local.
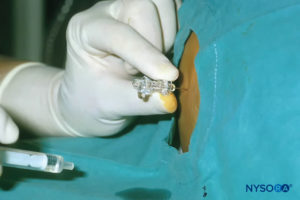
FIGURA 32. Anestesia espinhal: o líquido cefalorraquidiano sai da agulha e o anestésico local é injetado.
O método de barbotagem não é recomendado, pois pode resultar em níveis inaceitavelmente altos de bloqueio motor e tem potencial para bloqueio espinhal total. Os membros inferiores do paciente não devem ser elevados para a colocação do eletrodo de retorno do eletrocautério nas costas do lactente, pois a raquianestesia total pode resultar da disseminação do anestésico local para um nível espinhal mais alto. Para prolongar a duração da anestesia cirúrgica no caso de correção de hérnia bilateral, a raquianestesia pode ser complementada com um bloqueio caudal.
Avaliação do bloco
A avaliação do nível de bloqueio pode ser difícil em lactentes e crianças pequenas, particularmente em pacientes que receberam sedação ou naqueles nos quais o bloqueio está sendo realizado sob anestesia geral. Em lactentes, pode-se usar picada de alfinete ou resposta a estímulos frios (p. Em crianças com mais de 2 anos de idade, é utilizada a escala de Bromage. Após o bloqueio, deve-se ter cuidado para evitar colocar o paciente em posição de Trendelenburg ou levantar os membros inferiores; por exemplo, para colocar uma almofada de eletrocautério nas costas do bebê. No caso de um nível de bloqueio rapidamente crescente, o paciente pode ser colocado na posição de Trendelenburg reversa.
Dicas NYSORA
Avaliação da raquianestesia: a escala de Bromage
- Sem bloqueio: é possível o movimento livre de joelhos e pés
- Bloqueio parcial: Capaz apenas de flexionar os joelhos, mas o movimento livre dos pés ainda é possível
- Bloqueio quase completo: Incapaz de flexionar os joelhos, mas a flexão dos pés ainda é possível
- Completo: Incapaz de mover pernas ou pés
USOS CLÍNICOS
Apnéia e Ex-Bebês Pré-termo
A indicação mais comum de raquianestesia em pacientes pediátricos é em prematuros submetidos à correção de hérnia inguinal unilateral.tabela 9). A apnéia pode ocorrer em ex-pacientes pré-termo após anestesia geral. A anestesia regional pode diminuir, se não eliminar, o risco de apnéia pós-operatória e certamente diminui o risco de dessaturação e bradicardia.
TABELA 9. Indicações de raquianestesia em crianças.
| Correção de hérnia inguinal |
| Reparação de mielomeningocele |
| Cirurgia de Membros Inferiores e Abdome Inferior |
| Extubação precoce desejada após cirurgia cardíaca |
No entanto, há considerável desacordo sobre a incidência de apnéia e a idade conceitual em que um ex-prematuro pode ser submetido com segurança à anestesia geral ambulatorialmente. A falta de uniformidade no desenho do estudo, o pequeno tamanho da população de pacientes e as variações na metodologia provavelmente explicam as diferenças observadas. Cote em al. realizaram uma meta-análise de oito estudos, compreendendo 255 pacientes, investigando apnéia pós-operatória em ex-prematuros após anestesia geral. No geral, o risco foi independentemente relacionado à idade gestacional e à idade conceitual. Fatores de risco adicionais para apnéia pós-operatória foram hematócrito inferior a 30% e episódios de apnéia contínuos em casa. O estudo estratificou os bebês em dois grupos: um grupo de risco de 5% e um grupo de risco de 1%. Para pacientes com idade gestacional de 35 semanas, o risco de apnéia pós-operatória não caiu abaixo de 5% (com um intervalo de confiança estatístico de 95%) até os pacientes atingirem uma idade pós-conceptual de 48 semanas e não diminuiu abaixo de 1% até os bebês atingiu uma idade pós-conceptual de 54 semanas. Em pacientes mais prematuros, como aqueles com idade gestacional de 32 semanas, o risco de apnéia não caiu abaixo de 1% (com intervalo de confiança estatístico de 95%) até que os bebês atingissem uma idade pós-conceptual de 56 semanas.
O uso concomitante de cetamina como sedativo em prematuros também foi relatado para aumentar a incidência de apnéia pós-operatória acima da relatada em pacientes controle. No entanto, estes são todos estudos um pouco mais antigos. Nesse meio tempo, houve avanços substanciais no manejo ventilatório de recém-nascidos e lactentes prematuros, tornando o risco de apneia controverso nos dias atuais. Além disso, melhorias na anestesia, como o uso prolongado de sevoflurano em vez de halotano e máscaras laríngeas em vez de intubação traqueal, diminuíram ainda mais a incidência dos efeitos deletérios da anestesia geral em lactentes. Craven et ai. revisaram vários estudos controlados randomizados e encontraram apenas uma vantagem estatística limítrofe da anestesia espinhal sobre a anestesia geral. Em nossa opinião, a administração de sevoflurano durante a ventilação espontânea por um curto período de tempo pode às vezes ser útil para auxiliar na realização da raquianestesia, especialmente se nenhum creme EMLA for usado.
A raquianestesia também tem sido usada para uma variedade de outros procedimentos, incluindo reparo de mielomeningocele e outros procedimentos abdominais, urológicos e ortopédicos em crianças. O relato inicial de Abajian et al. incluíram não apenas crianças submetidas a herniorrafia inguinal, mas também outros pacientes não infantis que os autores consideraram que enfrentavam um risco aumentado para anestesia geral. Este estudo incluiu pacientes com uma variedade de condições médicas, incluindo laringomalácia, macroglossia, micrognatia, cardiopatia congênita, síndrome de Down, síndrome adrenogenital, déficit de crescimento e artrogripose. Blaise et ai. relataram 30 pacientes com idades entre 7 semanas e 13 anos submetidos à raquianestesia para diversos procedimentos cirúrgicos. Kokki et ai. relataram anestesia satisfatória em 92 de 93 crianças de 1 a 17 anos submetidas à raquianestesia com ropivacaína para procedimentos de abdome inferior ou membros inferiores. Técnicas regionais têm sido utilizadas em cirurgia cardíaca para facilitar a extubação precoce. Esta grande série investigando raquianestesia para cirurgia cardíaca vem de uma análise prospectiva randomizada da Universidade de Stanford. O grupo que recebeu raquianestesia para alívio da dor pós-operatória apresentou menor necessidade de opióides no pós-operatório de cirurgia cardíaca eletiva com extubação precoce na sala de cirurgia.
Em resumo, a raquianestesia em pediatria é mais comumente utilizada em prematuros submetidos à anestesia para correção de hérnia inguinal. A raquianestesia também pode ser usada efetivamente em crianças para alívio da dor pós-operatória em cirurgia cardíaca, especialmente se forem usados opioides.
REFERÊNCIAS
- Peutrell JM, Lonnqvist PA: Bloqueios neuroaxiais para anestesia e analgesia em crianças. Curr Opin Anesthesiol 2003;16:461–470. 2
- Suresh S, Long J, Birmingham PK, et al: Os bloqueios caudais para controle da dor são seguros em crianças? Uma análise de 18,650 bloqueios caudais do banco de dados da Pediatric Regional Anesthesia Network (PRAN). Anesth Analg 2015;120:151–156.
- Gunter JB, Eng C: Anestesia peridural torácica por via caudal em crianças. Anestesiologia 1992;76:935-938.
- Larsson BA, Lonnqvist PA, Olsson GL: Concentrações plasmáticas de bupivacaína em neonatos após infusão epidural contínua. Anesth Analg 1997;84:501–505.
- Luz G, Innerhofer P, Bachmann B, et al: Concentrações plasmáticas de bupivacaína durante anestesia peridural contínua em lactentes e crianças. Anesth Analg 1996;82:231–234.
- Berde C: Anestésicos locais em bebês e crianças: uma atualização. Pediatra Anaesth 2004;14:387–393.
- Gunter JB, Dunn CM, Bennie JB, et al: Concentração ótima de bupivacaína para anestesia combinada caudal-geral em crianças. Anestesiologia 1991;75:57–61.
- Tsui BC, Berde CB: Analgesia caudal e técnicas de anestesia em crianças. Curr Opin Anesthesiol 2005;18:283–288.
- Lönnqvist PA: Artigo de revisão. Toxicidade de drogas anestésicas locais: uma perspectiva pediátrica. Pediatra Anaesth 2012;22:39–43.
- Da Conceição MJ, Coelho L, Khalil M: Ropivacaína 0.25% em comparação com bupivacaína 0.25% pela via caudal. Pediatra Anaesth 1999; 9:229-233.
- Eledjam JJ, Gros T, Viel E, et al: overdose de ropivacaína e toxicidade sistêmica. Anaesth Intensive Care 2000;28:705–707.
- Ivani G, Lampugnani E, Torre M, et al: Comparação de ropivacaína com bupivacaína para bloqueio caudal pediátrico. Br J Anaesth 1998;81: 247–248.
- Karmakar MK, Aun CS, Wong EL, et al: A ropivacaína sofre absorção sistêmica mais lenta do espaço epidural caudal em crianças do que a bupivacaína (tabela). Anesth Analg 2002;94:259–265.
- Kokko TI, Karinen J, Raiha E, et al: Farmacocinética de ropivacaína a 0.75% e bupivacaína a 0.5% após bloqueio do nervo ilioinguinal-iliohipogástrico em crianças. Br J Anaesth 2002;89:438–441.
- Gunter JB: Benefícios e riscos dos anestésicos locais em bebês e crianças. Medicamentos Pediátricos 2002;4:649–672.
- Bosenberg A, Thomas J, Lopez T, et al: A eficácia da ropivacaína caudal 1, 2 e 3 mg × l (-1) para analgesia pós-operatória em crianças. Pediatra Anaesth 2002;12:53–58.
- Ivani G. Ropivacaína: é hora das crianças? Pediatra Anaesth 2002; 12:383-387.
- Taylor R, Eyres R, Chalkiadis GA, et al: Eficácia e segurança da injeção caudal de levobupivacaína, 0.25%, em crianças menores de 2 anos submetidas a correção de hérnia inguinal, circuncisão ou orquidopexia. Pediatra Anaesth 2003;13:114–121.
- Lonnqvist PA: Adjuntos ao bloqueio caudal em crianças – Quo vadis? Br J Anaesth 2005;95:431–433.
- Lonnqvist PA, Ivani G, Moriarty T: Uso de opioides caudal-epidural em crianças: ainda estado da arte ou começo do fim? Pediatra Anaesth 2002;12:747–749.
- Attia J, Ecoffey C, Sandouk P, et al: Morfina epidural em crianças: farmacocinética e sensibilidade ao CO2. Anestesiologia 1986;65:590–594.
- Ansermino M, Basu R, Vandebeek C, et al: Aditivos não opióides aos anestésicos locais para bloqueio caudal em crianças: uma revisão sistemática. Pediatra Anaesth 2003;13:561–573.
- De Negri P, Ivani G, Visconti C, et al: A relação dose-resposta para clonidina adicionada a uma infusão peridural contínua pós-operatória de ropivacaína em crianças. Anesth Analg 2001;93:71–76.
- Penon C, Ecoffey C, Cohen SE: Resposta ventilatória ao dióxido de carbono após injeção epidural de clonidina. Anesth Analg 1991;72:761–991.
- Fellmann C, Gerber AC, Weiss M: Apnéia em ex-prematuro após bupivacaína caudal com clonidina para herniorrafia inguinal. Pediatra Anaesth 2002;12:637–640.
- Passariello M, Almenrader N, Canneti A, et al: Analgesia caudal em crianças: S(+)-cetamina vs S(+)-cetamina mais clonidina. Pediatra Anaesth 2004;14:851–855.
- Hager H, Marhofer P, Sitzwohl C, et al: A clonidina caudal prolonga a analgesia da S (+)-cetamina caudal em crianças. Anesth Analg 2002; 94:1169-1172.
- Hayashi H, Dikkes P, Soriano SG: A administração repetida de cetamina pode levar à degeneração neuronal no cérebro do rato em desenvolvimento. Pediatra Anaesth 2002;12:770–774.
- Proescholdt M, Heimann A, Kempski O: Neuroprotection of S(+) ketamine isomer in global forebrain ischemia. Brain Res 2001; 904: 245-251.
- Suresh S, Wheeler M: Anestesia regional pediátrica prática. Anesthesiol Clin North Am 2002;20:83–113.
- Giaufre E, Dalens B, Gombert A: Epidemiologia e morbidade da anestesia regional em crianças: uma pesquisa prospectiva de um ano da Sociedade Francesa de Anestesiologistas Pediátricos. Anesth Analg 1996;83:904–912
- Flandin-Blety C, Barreira G: Acidentes após analgesia extradural em crianças. Os resultados de um estudo retrospectivo. Pediatra Anaesth 1995;5:41–46.
- Fischer HB: Realizando inserção epidural sob anestesia geral. Anestesia 2000;55:288–289.
- Kasai T, Yaegashi K, Hirose M, et al: Lesão da medula espinhal em uma criança causada por uma punção dural acidental com uma agulha peridural torácica de um único tiro. Anesth Analg 2003;96:65–67.
- Horlocker T, Wedel DJ, Rowlingson JC, et al: Anestesia regional no paciente recebendo terapia antitrombótica ou trombolítica. Diretrizes baseadas em evidências da Sociedade Americana de Anestesia Regional e Medicina da Dor (Terceira Edição). Reg Anesth Pain Med 2010;35:64–101.
- Kost-Byerly S, Tobin JR, Greenberg RS, et al: Colonização bacteriana e taxa de infecção de cateteres peridurais contínuos em crianças. Anesth Analg 1998;86:712–716.
- Wittum S, Hofer CK, Rolli U, et al: Osteomielite sacral após anestesia epidural com injeção única via abordagem caudal em uma criança. Anestesiologia 2003;99:503–505.
- Bubeck J, Boos K, Krause H, Thies KC: O tunelamento subcutâneo de cateteres caudais reduz a taxa de colonização bacteriana para a dos cateteres peridurais lombares. Anesth Analg 2004;99:689–693.
- Oliver A: Punções durais em crianças: o que devemos fazer? Pediatra Anaesth 2002;12:473–477.
- Liley A, Manoharan M, Upadhyay V: O manejo de uma dor de cabeça pós-punção dural em uma criança. Pediatra Anaesth 2003;13:534–537.
- Janssens E, Aerssens P, Alliet P, et al: Cefaleias pós-punção dural em crianças. Uma revisão de literatura. Eur J Pediatr 2003;162:117–121.
- Tsuji MH, Horigome H, Yamashita M: As funções ventriculares esquerdas não são prejudicadas após anestesia peridural lombar em crianças pequenas. Pediatra Anaesth 1996;6:405–409.
- Tsui BC, Malherbe S, Koller J, et al: Reversão de um anestésico espinhal não intencional por lavagem cerebrospinal. Anesth Analg 2004;98:434–436.
- Tobias JD: Bloqueio peridural caudal: uma revisão da dosagem do teste e reconhecimento da injeção sistêmica em crianças. Anesth Analg 2001;93:1156–1161.
- Neal JM, Mulroy MF, Weinberg GF: Sociedade Americana de Anestesia Regional e Medicina da Dor. Lista de Verificação para Gerenciamento de Toxicidade Sistêmica Anestésica Local: Versão 2012. Reg Anesth Pain Med 2012;37:16Y18.
- Flandin-Blety C, Barreira G: Acidentes após analgesia extradural em crianças. Os resultados de um estudo retrospectivo. Pediatra Anaesth 1995; 5:41-46.
- Valairucha S, Seefelder C, Houck CS: Cateteres peridurais torácicos colocados pela via caudal em lactentes: a importância da confirmação radiográfica. Pediatra Anaesth 2002;12:424–428.
- Tsui BC, Gupta S, Finucane B: Confirmação da colocação do cateter peridural usando estimulação nervosa. Can J Anaesth 1998;45:640–644.
- Tsui BC, Seal R, Koller J, et al: Analgesia peridural torácica através da abordagem caudal em pacientes pediátricos submetidos a fundoplicatura usando orientação de estimulação nervosa. Anesth Analg 2001;93:1152–1155.
- Tsui BC, Gupta S, Finucane B: Detecção de colocação de cateter peridural subaracnóideo e intravascular. Can J Anaesth 1999;46: 675–678.
- Tsui BC, Gupta S, Emery D, Finucane B: Detecção de colocação subdural de cateter peridural usando estimulação nervosa. Can J Anaesth 2000;47:471–473.
- Tsui BC: Colocação de cateter peridural torácico em lactentes por via caudal sob orientação eletrocardiográfica: simplificação da técnica original. Anesth Analg 2004;98:273.
- Chen CP, Tang SF, Hsu TC, et al: Orientação por ultrassom na colocação da agulha peridural caudal. Anestesiologia 2004;101:181–184.
- Chawathe MS, Jones RM, Gildersleve CD, et al: Detecção de cateteres peridurais com ultra-som em crianças. Pediatra Anaesth 2003;13: 681–684.
- Baris S, Guldogus F, Baris YS, et al: O tecido coring é um problema real após a injeção caudal em crianças? Pediatra Anaesth 2004;14:755–758.
- Lam DK, Corry GN, Tsui BC: Evidências para o uso de imagens de ultra-som em anestesia regional pediátrica: uma revisão sistemática. Reg Anesth Pain Med 2016;41:229–241.
- Rubin K, Sullivan D, Sadhasivam S: Os bloqueios periféricos e neuroaxiais guiados por ultrassom são mais eficazes e seguros em crianças? Pediatra Anaesth 2009;19:92–96.
- Perlas A: Evidências para o uso do ultrassom em bloqueios neuroaxiais. Reg Anesth Pain Med 2010;35(2 Supl):S43–46.
- Triffterer L, Machata AM, Latzke D, et al: Avaliação ultrassonográfica da propagação cranial durante o bloqueio caudal em crianças: efeito da velocidade de injeção de anestésicos locais. Br J Anaesth 2012;108:670–674.
- Brenner L, Marhofer P, Kettner SC, et al: Avaliação ultra-sonográfica da propagação cranial durante o bloqueio caudal em crianças: o efeito de diferentes volumes de anestésicos locais. Br J Anaesth 2011;107:229–235.
- Lundblad M, Lönnqvist PA, Eksborg S, et al: Distribuição segmentar de anestesia caudal de alto volume em recém-nascidos, bebês e crianças pequenas, avaliada por ultrassonografia. Pediatra Anaesth 2010;21:121–127.
- Lundblad M, Eksborg S, Lönnqvist PA: Disseminação secundária do bloqueio caudal avaliada por ultrassonografia. Br J Anaesth 2012;108:675–681.
- Tamai H, Sawamura S, Kanamori Y, et al: Inserção de cateter peridural torácico usando a abordagem caudal assistida com um estimulador elétrico de nervo em crianças pequenas. Reg Anesth Pain Med 2004;29:92–95.
- Tsui BC, Wagner A, Cave D, et al: Analgesia peridural torácica e lombar através da abordagem caudal usando orientação de estimulação elétrica em pacientes pediátricos: uma revisão de 289 pacientes. Anestesiologia 2004;100:683–689.
- Tsui BC, Entwistle L: Analgesia peridural torácica via abordagem lombar usando estimulação nervosa em um paciente pediátrico com síndrome de Down. Acta Anesthesiol Scand 2005;49:712–714.
- Fischer HB: Realizando inserção epidural sob anestesia geral. Anestesia 2000;55:288–289.
- Kasai T, Yaegashi K, Hirose M, et al: Lesão da medula espinhal em uma criança causada por uma punção dural acidental com uma agulha peridural torácica de um único tiro. Anesth Analg 2003;96:65–67.
- Bromage PR, Benumof JL: Paraplegia após injeção intracordial durante tentativa de anestesia peridural sob anestesia geral. Reg Anesth Pain Med 1998;23:104–107.
- Chawathe MS, Jones RM, Gildersleve CD, et al: Detecção de cateteres peridurais com ultra-som em crianças. Pediatra Anaesth 2003;13: 681–684.
- Corning JL: Raquianestesia e medicação local da medula. NY J Med 1885;42:483–485.
- Gray H: Um estudo de raquianestesia em crianças e bebês: de uma série de 200 casos. Lancet 1909;2:913-917.
- Bainbridge W: Analgesia em crianças por injeção espinhal com relato de um novo método de esterilização do fluido de injeção. Med Rec 1900;58:937–940.
- Melman E, Penuelas JA, Marrufo J: Anestesia regional em crianças. Anesth Analg 1975;54:387–390.
- Gregory GA, Steward DJ: Apnéia perioperatória com risco de vida na ex-"premie". Anestesiologia 1983;59:495–498.
- Steward DJ: Síndrome de apnéia pós-operatória em prematuros. West J Med 1992;157:567.
- Steward DJ: Bebês prematuros são mais propensos a complicações após pequenas cirurgias do que bebês a termo. Anestesiologia 1982;56:304–306.
- Cote CJ, Zaslavsky A, Downes JJ, et al: Apnéia pós-operatória em recém-nascidos prematuros após herniorrafia inguinal. Uma análise combinada [ver comentários]. Anestesiologia 1995;82:809–822.
- Liu LM, Cote CJ, Goudsouzian NG, et al: Apnéia com risco de vida em bebês se recuperando de anestesia. Anestesiologia 1983;59:506–510.
- Abajian JC, Mellish RW, Browne AF, et al: Raquianestesia para cirurgia no recém-nascido de alto risco. Anesth Analg 1984;63:359–362.
- Frumiento C, Abajian JC, Vane DW: Raquianestesia para prematuros submetidos à correção de hérnia inguinal. Arch Surg 2000;135:445–451.
- Blaise GA, Roy WL: Raquianestesia para pequenas cirurgias pediátricas. Can Anaesth Soc J 1986;33:227–230.
- Kokki H, Tuovinen K, Hendolin H: Raquianestesia para cirurgia pediátrica ambulatorial: um grupo duplo-cego, randomizado, paralelo, comparação prospectiva de bupivacaína isobárica e hiperbárica. Br J Anaesth 1998;81:502–506.
- Busoni P, Messeri A: Raquianestesia em crianças: anatomia de superfície. Anesth Analg 1989;68:418–419.
- Busoni P, Messeri A: Raquianestesia em bebês: uma abordagem L5-S1 poderia ser mais segura? Anestesiologia 1991;75:168–169.
- Gray H: Anatomia do Corpo Humano: Anatomia de Gray, 30ª ed. Filadélfia: Lippincott Williams & Wilkins, 1985.
- Puncuh F, Lampugnani E, Kokki H: Uso de raquianestesia em pacientes pediátricos: experiência de um único centro com 1132 casos. Pediatra Anaesth 2004;14:564–567.
- Kokki H, Ylonen P, Laisalmi M, et al: ropivacaína isobárica 5 mg/mL para raquianestesia em crianças. Anesth Analg 2005;100:66–70.
- Kokki H, Hendolin H: Bupivacaína hiperbárica para raquianestesia em crianças de 7 a 18 anos: comparação de bupivacaína 5 mg mL-1 em soluções de glicose a 0.9% e 8%. Br J Anaesth 2000;84:59–62.
- Rochette A, Raux O, Troncin R, et al: A clonidina prolonga a raquianestesia em recém-nascidos: um estudo prospectivo de variação de dose. Anesth Analg 2004;98:56–59.
- Welborn LG, de Soto H, Hannallah RS, et al: O uso de cafeína no controle da apnéia pós-anestésica em ex-prematuros. Anestesiologia 1988;68:796–798.
- Oberlander TF, Berde CB, Lam KH, et al: Os bebês toleram a raquianestesia com alterações autonômicas gerais mínimas: análise da variabilidade da frequência cardíaca em ex-prematuros submetidos à correção de hérnia. Anesth Analg 1995;80:20–27.
- Ramamoorthy C, Geiduschek JM, Bratton SL, et al: Cefaleia pós-punção dural em pacientes oncológicos pediátricos. Clin Pediatr 1998;37:247–251.
- Kokki H, Salonvaara M, Herrgard E, Onen P: Cefaleia pós-punção dural não é um sintoma relacionado à idade em crianças: s estudo prospectivo, aberto, randomizado, de grupos paralelos comparando uma agulha Quincke de calibre 22 com uma agulha Whitacre de calibre 22. Pediatra Anaesth 1999;9:429–434.
- Salmela L, Aromaa U: Irritação radicular transitória após raquianestesia induzida com soluções hiperbáricas de lidocaína diluída no líquido cefalorraquidiano 50 mg/mL ou mepivacaína 40 mg/mL ou bupivacaína 5 mg/mL. Acta Anesthesiol Scand 1998;42:765–769.
- Welborn LG, Rice LJ, Hannallah RS, et al: Apnéia pós-operatória em recém-nascidos pré-termo: comparação prospectiva de raquianestesia e anestesia geral. Anestesiologia 1990;72:838–842.
- Gleason CA, Martin RJ, Anderson JV, et al: Posição ideal para punção lombar em bebês prematuros. Pediatria 1983;71:31-35.
- Krane EJ, Haberkern CM, Jacobson LE: Apneia pós-operatória, bradicardia e dessaturação de oxigênio em recém-nascidos prematuros: comparação prospectiva de anestesia espinhal e geral. Anesth Analg 1995;80:7–13.
- Craven PD, Badawi M, Henderson-Smart DJ, O'Brien M: Regional (espinhal, peridural, caudal) versus anestesia geral em prematuros submetidos a herniorrafia inguinal na primeira infância. Sistema de banco de dados Cochrane Rev 2003;(3):CD003669.
- Viscomi CM, Abajian JC, Wald SL, et al: Raquianestesia para reparo de meningomielocele em neonatos. Anesth Analg 1995;81:492–495.
- Kokki H, Hendolin H. Comparação de raquianestesia com anestesia epidural em cirurgia pediátrica. Acta Anesthesiol Scand 1995;39: 896-900.
- Hammer GB, Ramamoorthy C, Cao H, et al: Analgesia pós-operatória após bloqueio espinhal em lactentes e crianças submetidas à cirurgia cardíaca. Anesth Analg 2005;100:1283–1288.