Gli oppioidi svolgono un ruolo indispensabile nella pratica dell'anestesiologia, terapia intensiva e gestione del dolore. Una solida conoscenza della farmacologia degli oppioidi, inclusi sia gli aspetti scientifici di base che quelli clinici, è fondamentale per l'uso sicuro ed efficace di questi importanti farmaci. Questo capitolo si concentrerà quasi esclusivamente sugli agonisti dei recettori degli oppioidi per via endovenosa utilizzati nel perioperatorio.
1. FARMACOLOGIA DI BASE
Struttura-Attività
Gli oppioidi di interesse clinico in anestesiologia condividono molte caratteristiche strutturali. La morfina è un alcaloide benzilisochinolina (Fig.1). Molti oppioidi semisintetici di uso comune vengono creati mediante una semplice modifica della molecola di morfina. La codeina, ad esempio, è il 3-metil derivato della morfina. Allo stesso modo, anche l'idromorfone, l'idrocodone e l'ossicodone sono sintetizzati da modificazioni relativamente semplici della morfina. Alterazioni più complesse dello scheletro molecolare della morfina determinano agonisti-antagonisti misti come la nalbufina e persino antagonisti completi come il naloxone.
La serie di oppioidi del fentanil è chimicamente correlata alla meperidina. La meperidina è il primo oppioide completamente sintetico e può essere considerato il prototipo clinico della fenilpiperidina (vedi Fig 1). Il fentanil è una semplice modifica della struttura di base della fenilpiperidina. Altri congeneri del fentanil comunemente usati come alfentanil e sufentanil sono versioni un po' più complesse dello stesso scheletro di fenilpiperidina.
Gli oppioidi condividono molte caratteristiche fisico-chimiche in comune, sebbene alcuni singoli farmaci abbiano caratteristiche uniche. In generale, gli oppioidi sono basi deboli altamente solubili che sono fortemente legate alle proteine e ampiamente ionizzate a pH fisiologico. Le proprietà fisico-chimiche degli oppioidi influenzano il loro comportamento clinico. Ad esempio, le molecole unionizzate relativamente non legate come alfentanil e remifentanil hanno una latenza più breve per l'effetto di picco dopo l'iniezione in bolo.
Meccanismo
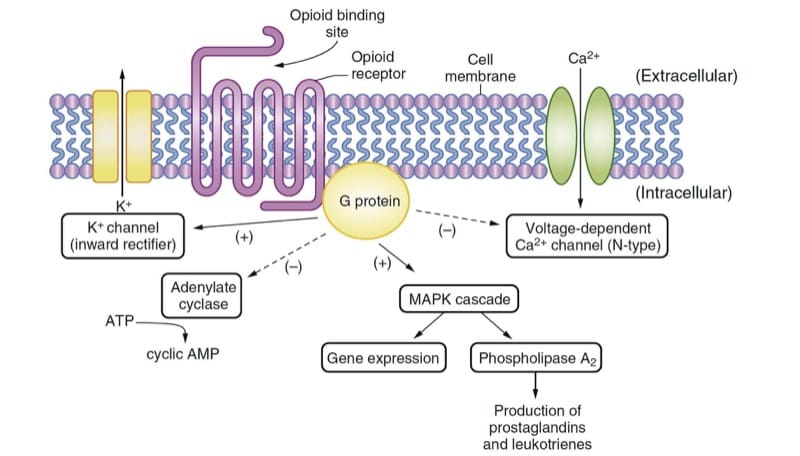
Gli oppioidi producono i loro principali effetti farmacologici interagendo con i recettori oppioidi, che sono tipici della famiglia di recettori accoppiati a proteine G ampiamente presenti in biologia (p. es., β-adrenergici, dopaminergici, tra gli altri). L'espressione di recettori oppioidi clonati in cellule in coltura ha facilitato l'analisi dei meccanismi di trasduzione del segnale intracellulare attivati dai recettori oppioidi. (1) Il legame degli agonisti oppioidi con i recettori porta all'attivazione della proteina G, producendo effetti che sono principalmente inibitori (Fig. 2); questi effetti alla fine culminano nell'iperpolarizzazione della cellula e nella riduzione dell'eccitabilità neuronale.
Tre recettori oppioidi classici sono stati identificati utilizzando tecniche di biologia molecolare: μ, κ e δ. Più recentemente è stato identificato anche un quarto recettore per gli oppioidi, ORL1 (noto anche come NOP), sebbene la sua funzione sia molto diversa da quella dei classici recettori per gli oppioidi. Ciascuno di questi recettori oppioidi ha un saggio biologico sperimentale comunemente impiegato, ligandi endogeni associati, una serie di agonisti e antagonisti e uno spettro di effetti fisiologici quando il recettore è agonizzato. Sebbene sia stata proposta l'esistenza di sottotipi di recettori oppioidi (p. es., μ1 μ2), non è chiaro dalle tecniche di biologia molecolare che esistano geni distinti per essi. La modifica post-traduzionale dei recettori oppioidi si verifica certamente e può essere responsabile di dati contrastanti sui sottotipi di recettori oppioidi. (2)
Gli oppioidi esercitano i loro effetti terapeutici in più siti. Inibiscono il rilascio della sostanza P dai neuroni sensoriali primari nel corno dorsale del midollo spinale, mitigando il trasferimento delle sensazioni dolorose al cervello. Le azioni degli oppioidi nel tronco encefalico modulano la trasmissione nocicettiva nel corno dorsale del midollo spinale attraverso vie inibitorie discendenti. Si pensa che gli oppioidi modifichino la risposta affettiva al dolore attraverso azioni nel cervello anteriore; la decerebrazione impedisce l'efficacia analgesica degli oppioidi nei ratti.(3) Inoltre, la morfina induce cambiamenti di segnale nelle "strutture di ricompensa" nel cervello umano.(4)
Studi su topi geneticamente modificati hanno fornito importanti informazioni sulla funzione dei recettori degli oppioidi. Nei topi knockout per il recettore μ degli oppioidi, l'analgesia indotta dalla morfina, l'effetto di ricompensa e l'effetto di astinenza sono assenti.(5,6) È importante sottolineare che anche i topi knockout per il recettore μ non mostrano depressione respiratoria in risposta alla morfina.(7)

- Fig.2 Meccanismi d'azione degli oppioidi. Il ligando o farmaco endogeno si lega al recettore degli oppioidi e attiva la proteina G, determinando molteplici effetti che sono principalmente inibitori. Le attività dell'adenilato ciclasi e dei canali del Ca2+ voltaggio-dipendenti sono ridotte. Vengono attivati i canali K+ a rettifica interna e la cascata della proteina chinasi attivata dal mitogeno (MAPK). AMP, adenosina monofosfato; ATP, adenosina trifosfato.
Metabolismo
Gli oppioidi somministrati per via endovenosa nell'uso clinico perioperatorio di routine vengono trasformati ed escreti da molte vie metaboliche. In generale, gli oppioidi sono metabolizzati dal sistema microsomiale epatico, sebbene la coniugazione epatica e la successiva escrezione da parte del rene siano importanti per alcuni oppioidi. Per alcuni oppioidi, la specifica via metabolica coinvolta ha importanti implicazioni cliniche in termini di metaboliti attivi (p. es., morfina, meperidina) o durata d'azione ultra breve (p. es., remifentanil). Per altri oppioidi, la variazione genetica nella via metabolica può alterare drasticamente gli effetti clinici (p. es., codeina). Queste sfumature sono affrontate in una sezione successiva incentrata sui singoli farmaci.
2. FARMACOLOGIA CLINICA
farmacocinetica
Le differenze farmacocinetiche sono la base primaria per la selezione razionale e la somministrazione di oppioidi nella pratica dell'anestesia perioperatoria. I principali comportamenti farmacocinetici sono (1) la latenza al picco di concentrazione al sito dell'effetto dopo l'iniezione in bolo (ossia, cinetica di front-end del bolo), (2) il tempo al decadimento clinicamente rilevante della concentrazione dopo l'iniezione in bolo (ossia, cinetica di back-end del bolo ), (3) il tempo alla concentrazione allo stato stazionario dopo l'inizio di un'infusione continua (ossia, cinetica front-end dell'infusione) e (4) il tempo al decadimento clinicamente rilevante della concentrazione dopo l'interruzione di un'infusione continua (ossia, infusione back- cinetica finale).
L'applicazione dei concetti di farmacocinetica degli oppioidi all'anestesia clinica richiede il riconoscimento di diversi principi fondamentali. In primo luogo, una tabella di variabili farmacocinetiche ha un valore clinico limitato. La comprensione del comportamento farmacocinetico si ottiene meglio attraverso la simulazione al computer. In secondo luogo, gli oppioidi somministrati mediante iniezione in bolo o infusione continua devono essere considerati separatamente. (8) In terzo luogo, le informazioni farmacocinetiche devono essere integrate con la conoscenza della relazione concentrazione-effetto e delle interazioni farmacologiche (vale a dire, farmacodinamica) per essere clinicamente utili.
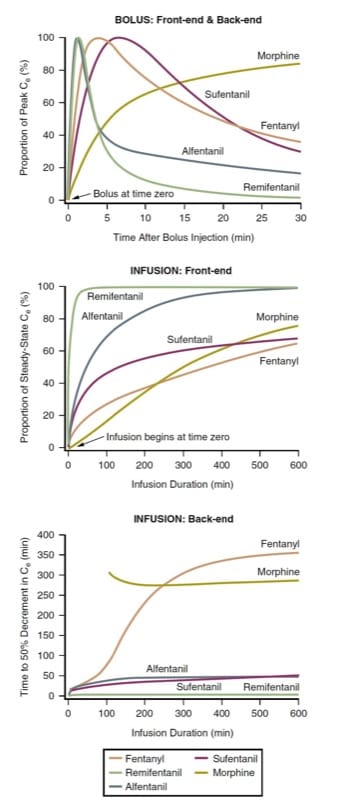
La latenza all'effetto di picco e l'offset dell'effetto dopo l'iniezione del bolo (ossia, la cinetica di front-end del bolo e la cinetica di back-end del bolo) di vari oppioidi per via endovenosa possono essere definiti prevedendo l'andamento temporale delle concentrazioni al sito dell'effetto dopo la somministrazione di un bolo . Poiché gli oppioidi differiscono in termini di potenza (e quindi di dosaggi richiesti), a scopo di confronto, le concentrazioni al sito dell'effetto devono essere normalizzate alla percentuale della concentrazione di picco per ciascun farmaco. Considerando la morfina, il fentanyl, il sufentanil, l'alfentanil e il remifentanil come tra gli oppioidi più comunemente usati intraoperatoriamente, la simulazione farmacocinetica illustra come gli oppioidi differiscono in termini di latenza al picco dell'effetto dopo la somministrazione di un bolo (Fig. 3, pannello superiore). (9-12)
La simulazione di un'iniezione in bolo (vedi Fig.3, pannello superiore) ha implicazioni cliniche. Ad esempio, quando è auspicabile una rapida insorgenza dell'effetto oppioide, la morfina potrebbe non essere una buona scelta. Allo stesso modo, quando l'obiettivo clinico è una breve durata dell'effetto oppioide seguita da una rapida dissipazione, si potrebbe preferire remifentanil o alfentanil. Si noti come la concentrazione di remifentanil sia diminuita in modo molto sostanziale prima ancora che il picco di concentrazione di fentanil fosse raggiunto. La simulazione illustra perché la cinetica front-end del fentanyl lo rende un farmaco adatto per l'analgesia controllata dal paziente (PCA) (vedere anche i capitoli Recupero post-anestesia e Gestione del dolore perioperatorio). Contrariamente alla morfina, l'effetto di picco di un bolo di fentanil si manifesta prima che sia trascorso un tipico periodo di blocco del PCA, mitigando così un problema di "impilamento della dose" (vedere anche il capitolo Gestione del dolore perioperatorio).
La latenza all'effetto di picco è governata dalla velocità con cui il plasma e il sito dell'effetto raggiungono l'equilibrio (cioè il parametro ke0). I farmaci con un equilibrio più rapido hanno una frazione "diffusibile" più alta (cioè la proporzione di farmaco che è unionizzata e non legata) e un'elevata liposolubilità. Tuttavia, una dose molto elevata anche di un oppioide a lenta insorgenza può produrre un'apparente rapida insorgenza (poiché viene raggiunto un livello di farmaco sovraterapeutico nel sito dell'effetto anche se il picco di concentrazione arriva più tardi).
Questa simulazione di infusioni semplici ea velocità costante ha ovvie implicazioni cliniche. In primo luogo, il tempo necessario per raggiungere una frazione sostanziale della concentrazione finale allo stato stazionario è molto lungo nel contesto dell'uso intraoperatorio. Per raggiungere uno stato quasi stazionario più rapidamente è necessario somministrare un bolo prima di iniziare (o aumentare) l'infusione. Il remifentanil rappresenta forse una parziale eccezione a questa regola generale. Inoltre, le concentrazioni di oppioidi aumenteranno per molte ore dopo l'inizio di un'infusione; in altre parole, le concentrazioni in genere aumentano anche se la velocità di infusione può essere rimasta la stessa per ore! Il fatto che il remifentanil raggiunga uno stato quasi stazionario in tempi relativamente brevi è certamente uno dei motivi per cui è emerso come farmaco popolare per l'anestesia endovenosa totale (TIVA).
Anche il tempo allo stato stazionario dopo l'inizio di un'infusione continua viene esaminato al meglio mediante simulazione farmacocinetica. Utilizzando gli stessi prototipi della somministrazione in bolo, la simulazione farmacocinetica (Fig. 3, pannello centrale) mostra il tempo necessario per raggiungere le concentrazioni del sito dell'effetto allo stato stazionario (ovvero, la cinetica del front-end dell'infusione).
Il tempo necessario per compensare l'effetto dopo l'interruzione di un'infusione allo stato stazionario è meglio espresso dalla simulazione del tempo di dimezzamento sensibile al contesto (CSHT).(13) Definito come il tempo necessario per raggiungere una diminuzione del 50% della concentrazione dopo l'interruzione di un'infusione continua, infusione allo stato stazionario, il CSHT è un mezzo per normalizzare il comportamento farmacocinetico dei farmaci in modo da poter effettuare confronti razionali per quanto riguarda l'offset previsto dell'effetto del farmaco. Il CSHT è quindi focalizzato sulla cinetica di "infusione back-end".
Il pannello inferiore di (Fig.3) è una simulazione CSHT per gli oppioidi comunemente usati. Per la maggior parte dei farmaci, il CSHT cambia nel tempo. Pertanto, per infusioni brevi, le cinetiche di back-end previste per i vari farmaci non differiscono molto (il remifentanil è un'eccezione notevole a questa regola generale). Man mano che il tempo di infusione si allunga, i CSHT iniziano a differenziarsi, fornendo una base razionale per la selezione del farmaco. In secondo luogo, a seconda della durata desiderata dell'effetto oppioide, è possibile scegliere farmaci ad azione più breve o ad azione prolungata. Infine, le forme di queste curve differiscono a seconda del grado di riduzione della concentrazione richiesto. In altre parole, le curve che rappresentano il tempo necessario per ottenere una diminuzione della concentrazione del 20% o dell'80% (ad esempio, le simulazioni del tempo di decremento del 20% o dell'80%) sono piuttosto diverse.(8) Pertanto, a seconda della tecnica di anestesia applicata , le simulazioni CSHT non sono necessariamente le simulazioni clinicamente rilevanti (vale a dire, una riduzione del 50% potrebbe non essere l'obiettivo clinico). Inoltre, la simulazione CSHT per la morfina non tiene conto dei metaboliti attivi (vedere la discussione successiva sui singoli farmaci in "Caratteristiche uniche dei singoli oppioidi").

- Fig.3 Farmacocinetica degli oppioidi. Simulazioni che illustrano il comportamento farmacocinetico front-end e back-end dopo la somministrazione mediante iniezione in bolo o infusioni continue di morfina, fentanil, alfentanil, sufentanil e remifentanil utilizzando i parametri farmacocinetici della letteratura (vedere il testo per i dettagli).(9-12,45)
Farmacodinamica
Per molti aspetti, gli oppioidi μ-agonisti possono essere considerati equivalenti farmacodinamici con importanti differenze farmacocinetiche; cioè, sia gli effetti terapeutici che quelli avversi sono essenzialmente gli stessi. La loro efficacia come analgesici e la loro propensione a produrre depressione ventilatoria sono indistinguibili l'una dall'altra. Esistono differenze farmacodinamiche con i meccanismi dei recettori non oppioidi come il rilascio di istamina.
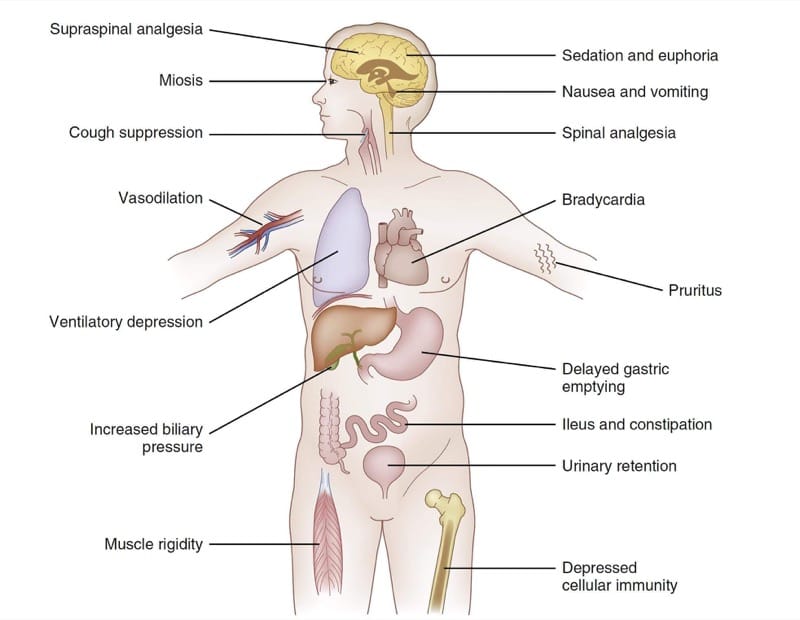
Poiché il sistema nervoso influenza profondamente la funzione dell'intero organismo, gli effetti farmacodinamici degli oppioidi μ-agonisti si osservano in molti sistemi di organi. La Fig.4 riassume i principali effetti farmacodinamici dei congeneri del fentanyl. A seconda delle circostanze cliniche e degli obiettivi clinici del trattamento, alcuni di questi effetti diffusi possono essere considerati terapeutici o avversi. Ad esempio, in alcuni contesti clinici la sedazione prodotta dai μ-agonisti potrebbe essere vista come un obiettivo della terapia. In altri, la sonnolenza sarebbe chiaramente considerata un effetto avverso.

- Fig. 4 Farmacodinamica degli oppioidi. Una tabella riassuntiva degli effetti selezionati dei congeneri del fentanil (vedere il testo per i dettagli).
Effetti terapeutici
Il sollievo dal dolore è il principale effetto terapeutico degli analgesici oppioidi. Agendo sui recettori μ spinali e cerebrali, gli oppioidi forniscono analgesia sia attenuando il traffico nocicettivo dalla periferia sia alterando la risposta affettiva alla stimolazione dolorosa a livello centrale.
I μ-agonisti sono più efficaci nel trattamento delle sensazioni di "secondo dolore" trasportate da fibre C non mielinizzate a conduzione lenta; sono meno efficaci nel trattamento delle sensazioni di "primo dolore" (portate da piccole fibre A-delta mielinizzate) e del dolore neuropatico. Un aspetto unico dell'analgesia indotta da oppioidi (a differenza di farmaci come gli anestetici locali) è che le altre modalità sensoriali non sono influenzate (p. es., tatto, temperatura, tra gli altri).
Nel periodo perioperatorio (certamente intraoperatorio), anche la sonnolenza prodotta dai μ-agonisti è uno degli effetti mirati. Il cervello è il substrato anatomico per l'azione sedativa dei μ-agonisti. Con l'aumentare delle dosi, i μ-agonisti alla fine producono sonnolenza e sonno (il sollievo dal dolore senza dubbio contribuisce alla promozione del sonno nei pazienti scomodi sia prima che dopo l'intervento). Con dosi sufficienti, i μ-agonisti producono un'attività dell'onda delta pronunciata sull'elettroencefalogramma, che assomiglia allo schema osservato durante il sonno naturale.
I μ-agonisti possono naturalmente produrre un significativo sollievo dal dolore con dosi che non producono sonno. Questa è la base clinica per il loro utilizzo nel trattamento del dolore nei pazienti ambulatoriali. Tuttavia, la somministrazione di dosi aggiuntive alla fine produce sonnolenza (e, di conseguenza, l'impossibilità di richiedere dosi aggiuntive) ed è il fondamento scientifico essenziale per la sicurezza dei dispositivi PCA (vedi anche capitolo gestione del dolore perioperatorio). Tuttavia, anche dosi elevate di oppioidi non producono in modo affidabile mancanza di risposta e amnesia e quindi gli oppioidi non possono essere considerati anestetici completi se usati da soli.
Gli oppioidi sopprimono anche il riflesso della tosse attraverso i centri della tosse nel midollo. L'attenuazione del riflesso della tosse presumibilmente rende meno probabile la tosse e il "colpo" contro il tubo endotracheale interno.
Effetti collaterali

La depressione della ventilazione è il principale effetto avverso associato ai farmaci μ-agonisti. Quando le vie aeree sono protette e la ventilazione è controllata durante l'intervento, la depressione della ventilazione indotta da oppioidi ha scarse conseguenze. Tuttavia, la depressione respiratoria indotta da oppioidi nel periodo postoperatorio può portare a lesioni cerebrali e morte.
I μ-agonisti alterano la risposta ventilatoria alle concentrazioni arteriose di anidride carbonica nel centro di controllo ventilatorio nel midollo. La depressione della ventilazione è mediata dal recettore μ; I topi knock-out del recettore μ non mostrano depressione respiratoria da morfina.(14)
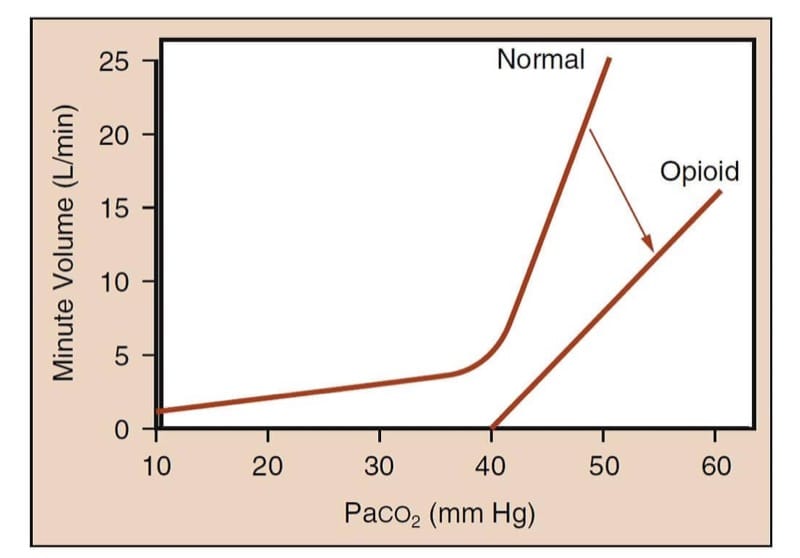
Negli esseri umani non medicati, gli aumenti della pressione parziale di anidride carbonica arteriosa aumentano notevolmente il volume minuto (Fig.5). Sotto l'influenza di analgesici oppioidi, la curva si appiattisce e si sposta verso destra per una data pressione parziale di anidride carbonica e riflettendo che il volume minuto è più piccolo. (15) Ancora più importante, la forma a "bastone da hockey" della curva normale viene persa ; cioè, potrebbe esserci una pressione parziale di anidride carbonica al di sotto della quale il paziente non respirerà (cioè la "soglia apneica") in presenza di oppioidi.

- Fig.5 Metodologia di studio della depressione ventilatoria indotta da oppioidi. Il metodo caratterizza il rapporto tra PaCO2 e volume minuto. La curva denominata "Normale" rappresenta la risposta prevista del volume minuto all'aumento dei livelli di PaCO2 in un essere umano sveglio. Notare il drammatico aumento del volume minuto all'aumentare della tensione di CO2. La curva denominata "oppioide" rappresenta la risposta attenuata del volume minuto all'aumento dei livelli di CO2 in seguito alla somministrazione di un oppioide. Si noti che la pendenza della curva diminuisce e la curva non ha più una forma a “bastone da hockey”; ciò significa che a livelli fisiologici di PaCO2, il paziente che riceve una quantità sufficiente di oppioidi può essere apneico o gravemente ipoventilatorio. (Adattato da Gross JB. Quando inspiri, ispiri, quando NON respiri,... scadi: nuovi approfondimenti sulla depressione ventilatoria indotta da oppioidi. Anesthesiology. 2003;99:767-770, usato con permesso .)
I segni clinici della ventilazione depressa sono piuttosto sottili con dosi moderate di oppioidi. I pazienti postoperatori che ricevono terapia analgesica oppioide possono essere svegli e vigili e tuttavia avere un volume minuto significativamente ridotto. Anche la frequenza respiratoria (spesso associata a un volume corrente leggermente aumentato) diminuisce. All'aumentare della concentrazione di oppioidi, la frequenza respiratoria e il volume corrente diminuiscono progressivamente, culminando infine in un ritmo ventilatorio irregolare e quindi in apnea completa.
Molti fattori possono aumentare il rischio di depressione ventilatoria indotta da oppioidi. I chiari fattori di rischio includono una dose elevata di oppioidi, l'età avanzata, l'uso concomitante di altri depressori del sistema nervoso centrale (SNC) e l'insufficienza renale (per la morfina). Il sonno naturale aumenta anche l'effetto depressivo ventilatorio degli oppioidi.(16)
Gli oppioidi possono alterare la fisiologia cardiovascolare attraverso una varietà di meccanismi diversi. Rispetto a molti altri farmaci anestetici (p. es., propofol, anestetici volatili), tuttavia, gli effetti cardiovascolari degli oppioidi, in particolare dei congeneri del fentanil, sono relativamente minimi (la morfina e la meperidina sono eccezioni, vedere la sezione seguente sui singoli farmaci).
I congeneri del fentanil causano bradicardia aumentando direttamente il tono del nervo vagale nel tronco encefalico, che sperimentalmente può essere bloccato mediante microiniezione di naloxone nel nucleo del nervo vagale o mediante vagotomia periferica.(17,18)
Gli oppioidi producono anche vasodilatazione deprimendo i centri vasomotori nel tronco encefalico e, in misura minore, con un effetto diretto sui vasi. Questa azione riduce sia il precarico che il postcarico. Le diminuzioni della pressione arteriosa sono più pronunciate nei pazienti con aumento del tono simpatico come i pazienti con insufficienza cardiaca congestizia o ipertensione. Le dosi cliniche di oppioidi non alterano sensibilmente la contrattilità miocardica.
Gli oppioidi possono indurre rigidità muscolare, di solito dalla rapida somministrazione di grandi dosi in bolo dei congeneri del fentanil. Questa rigidità può persino rendere quasi impossibile la ventilazione tramite pallone e maschera durante l'induzione dell'anestesia a causa della rigidità e della chiusura delle corde vocali. la rigidità muscolare indotta non è nota, non è un'azione diretta sul muscolo perché può essere eliminata con la somministrazione di farmaci bloccanti neuromuscolari.
La costrizione pupillare indotta dai μ-agonisti può essere un utile segno diagnostico che indica un effetto oppioide in corso. Gli oppioidi stimolano il nucleo di Edinger-Westphal del nervo oculomotore a produrre miosi. Anche piccole dosi di oppioidi suscitano questa risposta e si sviluppa una tolleranza molto ridotta all'effetto. Pertanto, la miosi è un indicatore utile, sebbene non specifico, dell'esposizione agli oppioidi anche nei pazienti tolleranti agli oppioidi. La costrizione pupillare indotta da oppioidi è reversibile con naloxone.
Gli oppioidi hanno effetti importanti sulla fisiologia gastrointestinale. I recettori degli oppioidi si trovano in tutto il plesso enterico dell'intestino. La stimolazione di questi recettori da parte degli oppioidi provoca una contrazione tonica della muscolatura liscia gastrointestinale, diminuendo così le contrazioni peristaltiche coordinate. Clinicamente, questa contrazione provoca uno svuotamento gastrico ritardato e volumi gastrici presumibilmente maggiori nei pazienti sottoposti a terapia con oppioidi prima dell'intervento. Dopo l'intervento, i pazienti possono sviluppare ileo indotto da oppioidi che può potenzialmente ritardare la ripresa di una corretta alimentazione e la dimissione dall'ospedale. Un'estensione di questo problema acuto è la costipazione cronica associata alla terapia con oppioidi a lungo termine.
Effetti simili si osservano nel sistema biliare, che ha anche un'abbondanza di recettori μ. I μ-agonisti possono produrre la contrazione della muscolatura liscia della cistifellea e lo spasmo dello sfintere di Oddi, causando potenzialmente un colangiogramma falsamente positivo durante la chirurgia della cistifellea e del dotto biliare. Questi effetti sono completamente reversibili con naloxone e possono essere parzialmente annullati dal trattamento con glucagone.
Sebbene gli effetti urologici siano minimi, gli oppioidi possono talvolta causare ritenzione urinaria diminuendo il tono detrusoriale della vescica e aumentando il tono dello sfintere urinario. Questi effetti sono in parte mediati a livello centrale, sebbene siano probabili anche effetti periferici data la diffusa presenza di recettori oppioidi nel tratto genito-urinario.(21,22) Sebbene la ritenzione urinaria associata alla terapia con oppioidi non sia tipicamente pronunciata, può essere fastidiosa nei maschi , in particolare quando l'oppioide viene somministrato per via intratecale o epidurale.
Gli oppioidi deprimono l'immunità cellulare. La morfina e l'oppioide endogeno β-endorfina, ad esempio, inibiscono la trascrizione dell'interleuchina 2 nelle cellule T attivate, tra gli altri effetti immunologici. (23) I singoli oppioidi (e forse le classi di oppioidi) possono differire in termini di natura ed estensione dei loro effetti immunomodulatori. Sebbene la compromissione dell'immunità cellulare indotta da oppioidi non sia ben compresa, la compromissione della guarigione delle ferite, le infezioni perioperatorie e la recidiva del cancro sono possibili esiti avversi.
Interazioni con altri farmaci
Le interazioni farmacologiche possono essere basate su due meccanismi: farmacocinetico (cioè quando un farmaco influenza la concentrazione dell'altro) o farmacodinamico (cioè quando un farmaco influenza l'effetto dell'altro). Nella pratica anestesiologica, sebbene a volte si verifichino interazioni farmacocinetiche non intenzionali, le interazioni farmacodinamiche si verificano praticamente con ogni anestetico e sono spesso prodotte dalla progettazione.
L'interazione farmacocinetica più comune nella farmacologia clinica degli oppioidi si osserva quando gli oppioidi per via endovenosa sono combinati con il propofol. Forse a causa dei cambiamenti emodinamici indotti dal propofol e del loro impatto sui processi farmacocinetici, le concentrazioni di oppioidi possono essere maggiori se somministrati in combinazione con un'infusione continua di propofol.(24)
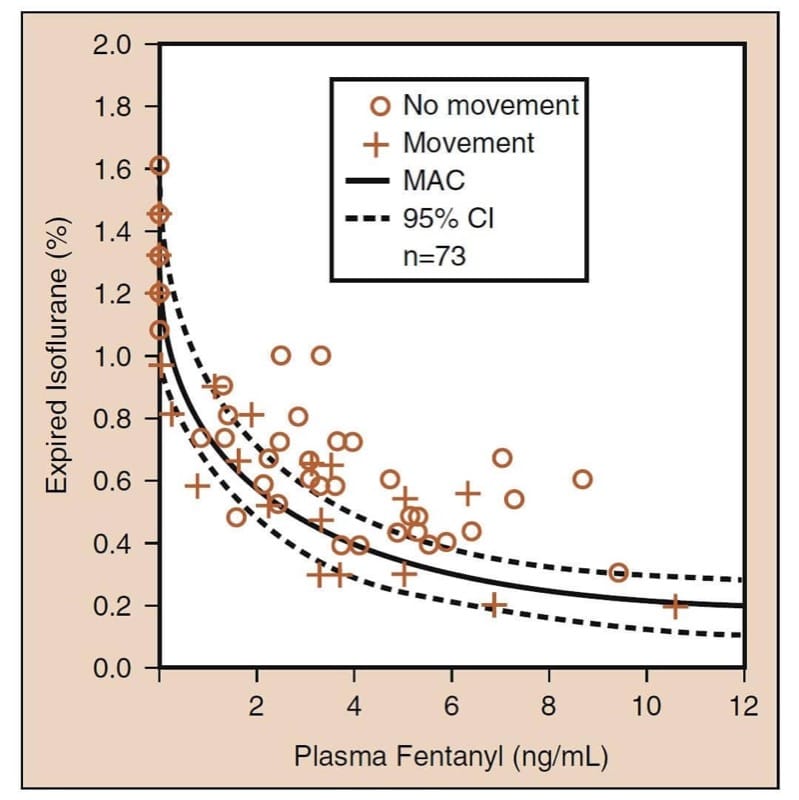
La più importante interazione farmacodinamica farmacodinamica che coinvolge gli oppioidi è l'interazione sinergica che si verifica quando gli oppioidi sono combinati con i sedativi. (25) Quando combinati con anestetici volatili, gli oppioidi riducono la concentrazione alveolare minima (MAC) di un anestetico volatile (Fig.6). Un attento esame dei dati sulla "riduzione del MAC da oppioidi" rivela diversi concetti clinicamente critici (vedi Fig.6). In primo luogo, gli oppioidi riducono sinergicamente il MAC. In secondo luogo, la riduzione del MAC è sostanziale (fino al 75% o più). In terzo luogo, la maggior parte della riduzione della MAC avviene a livelli moderati di oppioidi (cioè, anche dosi modeste di oppioidi riducono sostanzialmente la MAC). Quarto, la riduzione della MAC non è completa (cioè, gli oppioidi non sono anestetici completi). L'aggiunta dell'oppioide non può eliminare completamente la necessità dell'altro anestetico. E quinto, c'è un numero infinito di combinazioni ipnotico-oppioide che raggiungeranno il MAC (questo implica che i medici devono scegliere la combinazione ottimale in base agli obiettivi dell'anestesia e dell'operazione). Tutti questi concetti si applicano anche quando gli oppioidi sono usati in combinazione con il propofol per il TIVA. (26)

- Fig.6 Riduzione della concentrazione alveolare minima (MAC) dell'anestetico volatile da parte degli oppioidi: l'esempio prototipo di isoflurano e fentanil. La curva continua è MAC; le curve tratteggiate sono gli intervalli di confidenza al 95% (IC) (vedere il testo per i dettagli). (Adattato da McEwan AI, Smith C, Dyar O, et al. Riduzione della concentrazione alveolare minima di isoflurano mediante fentanyl. Anesthesiology. 1993;78:864-869, utilizzato con autorizzazione.)
Popolazioni speciali
Insufficienza epatica
Anche se il fegato è l'organo metabolico principalmente responsabile della biotrasformazione della maggior parte degli oppioidi, l'insufficienza epatica di solito non è abbastanza grave da avere un impatto importante sulla farmacocinetica degli oppioidi. Naturalmente, la fase anepatica del trapianto di fegato ortotopico è una notevole eccezione a questa regola generale (vedi anche capitolo trapianto d'organo). Con la somministrazione continua del farmaco, le concentrazioni di oppioidi che dipendono dal metabolismo epatico aumentano quando il paziente non ha fegato. Anche dopo una resezione epatica parziale, si verifica un aumento del rapporto tra morfina glucuronidi e morfina, indicando una diminuzione della velocità del metabolismo della morfina. (27) Poiché il metabolismo del remifentanil è completamente indipendente dai meccanismi di clearance epatica, la sua disposizione non è influenzata durante il trapianto di fegato .(28)
Le considerazioni farmacodinamiche possono essere importanti per la terapia con oppioidi nei pazienti con grave malattia epatica. I pazienti con encefalopatia epatica in corso sono particolarmente vulnerabili agli effetti sedativi degli oppioidi. Di conseguenza, questa classe di farmaci deve essere utilizzata con cautela in questa popolazione di pazienti.
Insufficienza renale
L'insufficienza renale ha implicazioni di maggiore importanza clinica rispetto alla morfina e alla meperidina (si veda la seguente discussione sui singoli farmaci). Per i congeneri del fentanyl, l'importanza clinica dell'insufficienza renale è molto meno marcata. Il metabolismo del remifentanil non è influenzato dalla malattia renale. (29)
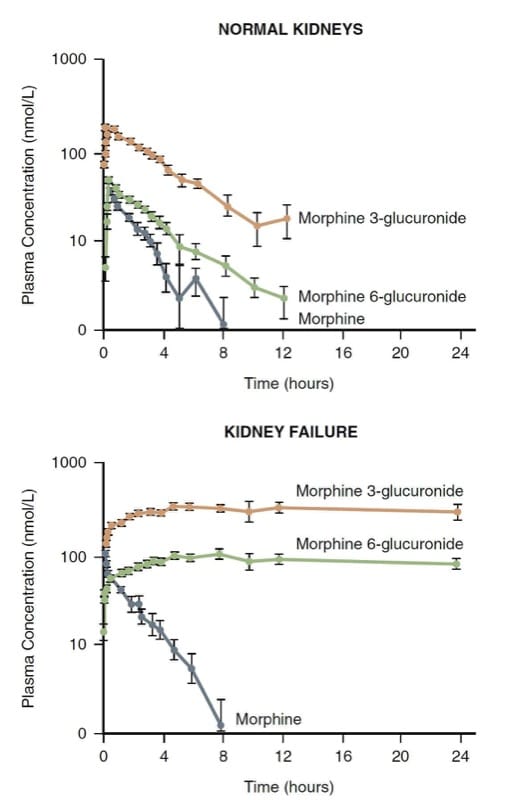
La morfina è metabolizzata principalmente per coniugazione nel fegato; i risultanti glucuronidi idrosolubili (cioè morfina 3-glucuronide e morfina 6-glucuronide—M3G e M6G) vengono escreti attraverso il rene. Il rene svolge anche un ruolo nella coniugazione della morfina e può rappresentare fino alla metà della sua conversione in M3G e M6G.
M3G è inattivo, ma M6G è un analgesico con una potenza che rivaleggia con la morfina. Livelli molto elevati di M6G e depressione respiratoria pericolosa per la vita possono svilupparsi in pazienti con insufficienza renale (Fig.7). (30) Di conseguenza, la morfina potrebbe non essere una buona scelta nei pazienti con meccanismi di clearance renale gravemente alterati.
Anche la farmacologia clinica della meperidina è significativamente alterata dall'insufficienza renale. La normeperidina, il principale metabolita, ha effetti analgesici ed eccitatori sul SNC che vanno da ansia e tremore a mioclono e convulsioni franche. Poiché i metaboliti attivi sono soggetti a escrezione renale, la tossicità del SNC secondaria all'accumulo di normeperidina è particolarmente preoccupante nei pazienti con insufficienza renale. Questa carenza di meperidina ha indotto molti formulari ospedalieri a limitarne l'uso oa rimuoverla del tutto dal formulario.

- Fig.7 La farmacocinetica della morfina e dei suoi metaboliti in volontari normali versus pazienti con insufficienza renale. Si noti il significativo accumulo dei metaboliti nell'insufficienza renale. (Adattato da Osborne R, Joel S, Grebenik K, et al. The pharmacokinetics of morphine and morphine glucuronides in renal failure. Clin Pharmacol Ther. 1993;54:158-167, usato con permesso.)
Sesso
Il genere può avere un'influenza importante sulla farmacologia degli oppioidi. La morfina è più potente nelle donne che negli uomini e ha un inizio d'azione più lento nelle donne.(31) Alcune di queste differenze possono essere correlate agli ormoni gonadici ciclici ea fattori psicosociali.
Età
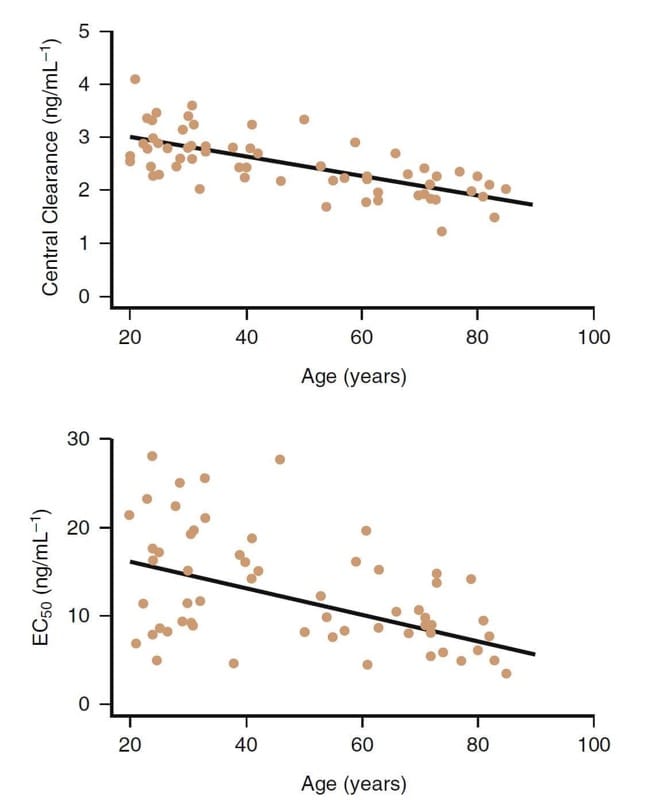
L'avanzare dell'età è chiaramente un fattore importante che influenza la farmacologia clinica degli oppioidi. Ad esempio, i congeneri del fentanyl sono più potenti nei pazienti più anziani (Fig.8).(32,33) Diminuzioni della clearance e del volume di distribuzione centrale si verificano anche nei pazienti più anziani.
Con l'età avanzata, sebbene anche i cambiamenti farmacocinetici svolgano un ruolo, le differenze farmacodinamiche sono le principali responsabili della riduzione della dose richiesta nei pazienti più anziani (>65 anni di età). Le dosi di remifentanil devono essere ridotte di almeno il 50% o più nei pazienti anziani. Analoghe riduzioni del dosaggio sono prudenti anche per gli altri oppioidi.

- Fig.8 L'influenza dell'età sulla farmacologia clinica del remifentanil. Sebbene vi sia una notevole variabilità, in generale, i soggetti più anziani hanno una clearance centrale inferiore e una potenza maggiore (ossia, EC50 inferiore).32
Obesità
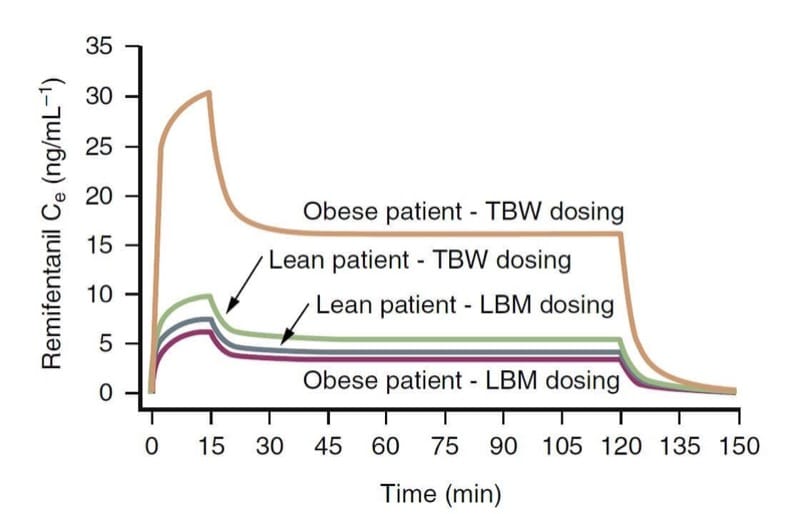
Il peso corporeo è probabilmente un fattore importante che influenza la farmacologia clinica degli oppioidi. Le variabili farmacocinetiche degli oppioidi, in particolare la clearance, sono più strettamente correlate alla massa corporea magra (LBM) piuttosto che al peso corporeo totale (TBW). In termini pratici, ciò significa che i pazienti patologicamente obesi richiedono un dosaggio maggiore rispetto ai pazienti magri per raggiungere la stessa concentrazione target, ma non tanto quanto suggerirebbe il loro TBW. (34)
Ad esempio, come illustrato attraverso la simulazione farmacocinetica (Fig. 9), uno schema di dosaggio basato su TBW determina concentrazioni al sito dell'effetto di remifentanil molto maggiori rispetto a un calcolo del dosaggio basato su LBM.(35) Al contrario, gli schemi di dosaggio TBW e LBM determinano concentrazioni simili per i pazienti magri. Questi concetti probabilmente si applicano anche ad altri oppioidi.

- Fig.9 Una simulazione farmacocinetica che illustra le conseguenze del calcolo del dosaggio di remifentanil basato sul peso corporeo totale (TBW) o sulla massa corporea magra (LBM) in pazienti obesi e magri (iniezione in bolo di 1 μg/kg seguita da un'infusione di 0.5 μg/kg /min per 15 minuti e 0.25 μg/kg/min per ulteriori 105 minuti). Si noti che il dosaggio basato su TBW in un paziente obeso determina concentrazioni notevolmente più elevate. (Adattato da Egan TD, Huizinga B, Gupta SK, et al. Remifentanil pharmacokinetics in obesi versus magri pazienti. Anesthesiology. 1998;89:562-573, usato con autorizzazione.)
Caratteristiche uniche dei singoli oppioidi
Codeina
La codeina, sebbene non comunemente usata intraoperatoriamente, ha un'importanza speciale tra gli oppioidi a causa della sfumatura farmacogenomica ben caratterizzata ad essa associata. La codeina è in realtà un profarmaco; la morfina è il composto attivo. La codeina è metabolizzata (in parte) dalla O-demetilazione in morfina, un processo metabolico mediato dall'isoforma microsomiale epatica CYP2D6.(36) Pazienti che mancano di CYP2D6 a causa di delezioni, frame shift o mutazioni di giunzione popolazione caucasica) o il cui CYP10D2 è inibito (p. es., i pazienti che assumono chinidina) non dovrebbero trarre beneficio dalla codeina anche se mostrano una risposta normale alla morfina. (6)
Morfina
La morfina è il prototipo di oppioide con cui vengono confrontati tutti i nuovi arrivati. Non ci sono prove che qualsiasi oppioide sintetico sia più efficace nel controllare il dolore della morfina naturale. Se non fosse stato per il rilascio di istamina e la conseguente ipotensione associata alla morfina, il fentanil potrebbe non aver sostituito la morfina come oppioide più comunemente usato durante l'intervento.
La morfina ha un tempo di insorgenza lento. Il pKa della morfina la rende quasi completamente ionizzata a pH fisiologico. Questa proprietà e la sua bassa solubilità lipidica spiegano la prolungata latenza della morfina fino all'effetto di picco; la morfina penetra lentamente nel SNC. Questa funzione ha sia vantaggi che svantaggi ad essa associati. La prolungata latenza al picco dell'effetto significa che la morfina ha forse meno probabilità di causare depressione respiratoria acuta dopo l'iniezione in bolo di dosi analgesiche tipiche rispetto agli oppioidi ad azione più rapida. D'altra parte, il tempo di insorgenza lento significa che è forse più probabile che i medici "accumulino" in modo inappropriato più dosi di morfina in un paziente che soffre di forte dolore, creando così il potenziale per un "overshoot" tossico.(39)
Il metabolita attivo della morfina, M6G, ha importanti implicazioni cliniche. Sebbene la conversione in M6G rappresenti solo il 10% del metabolismo della morfina, l'M6G può contribuire agli effetti analgesici della morfina anche in pazienti con funzione renale normale, in particolare con un uso a lungo termine. A causa dell'elevato rapporto di estrazione epatica della morfina, la biodisponibilità della morfina somministrata per via orale è significativamente inferiore rispetto all'iniezione parenterale. L'effetto di primo passaggio epatico sulla morfina somministrata per via orale determina livelli elevati di M6G. Infatti, l'M6G può essere il principale composto attivo quando la morfina viene somministrata per via orale.(40) Come notato nella sezione precedente, "Insufficienza renale", l'accumulo di M6G a livelli potenzialmente tossici nei pazienti in dialisi è un'altra importante implicazione di questo metabolita attivo.
Fentanyl
Il fentanil può essere l'oppioide più importante utilizzato nella moderna pratica dell'anestesia. Essendo il congenere originale del fentanyl, la sua applicazione clinica è ben radicata e molto diversificata. Il fentanil può essere somministrato in numerosi modi. Oltre che per via endovenosa, il fentanil può essere somministrato per via transdermica, transmucosa, transnasale e transpolmonare.
La somministrazione transmucosale orale di fentanil citrato (OTFC) determina il raggiungimento più rapido di livelli di picco più elevati rispetto a quando la stessa dose viene ingerita. (41) L'eliminazione dell'effetto di primo passaggio si traduce in una biodisponibilità notevolmente maggiore. Il fatto che l'OTFC sia non invasivo e abbia un'insorgenza rapida ne ha fatto una terapia di successo per il dolore episodico intenso nei pazienti oncologici tolleranti agli oppioidi, spesso in combinazione con un cerotto transdermico al fentanil (vedere anche il capitolo 40).
alfentanil
L'alfentanil è stato il primo oppioide ad essere somministrato quasi esclusivamente per infusione continua. A causa della sua emivita terminale relativamente breve, si prevedeva originariamente che l'alfentanil avesse una rapida cessazione dell'effetto dopo la fine di un'infusione continua.(42) Successivi progressi nella conoscenza farmacocinetica (vale a dire, il CSHT) hanno dimostrato che questa affermazione è falsa.( 8) Tuttavia, l'alfentanil è di fatto un farmaco a breve durata d'azione dopo una singola iniezione in bolo a causa della sua elevata “frazione diffusibile”; raggiunge rapidamente le concentrazioni di picco nel sito dell'effetto e quindi inizia a diminuire (vedere la discussione precedente su "Farmacocinetica"). L'alfentanil illustra come un farmaco può presentare diversi profili farmacocinetici a seconda del metodo di somministrazione (vale a dire, bolo contro infusione continua). L'alfentanil, più del fentanil o del sufentanil, presenta un metabolismo epatico imprevedibile a causa della significativa variabilità interindividuale del CYP3A4 epatico, l'enzima primario responsabile della biotrasformazione dell'alfentanil.
sufentanil
La caratteristica distintiva del sufentanil è che è l'oppioide più potente comunemente usato nella pratica dell'anestesia. Poiché è intrinsecamente più efficace sul recettore degli oppioidi, le dosi assolute utilizzate sono molto più piccole rispetto agli altri farmaci meno potenti (p. es., 1000 volte inferiori rispetto alle dosi di morfina).
remifentanil
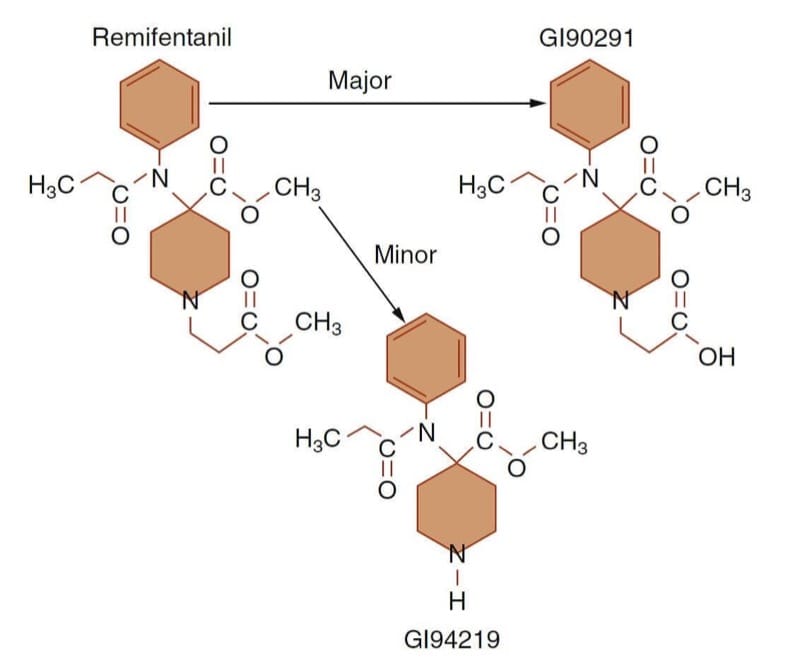
Il remifentanil è un esempio prototipo di come è possibile raggiungere obiettivi clinici specifici progettando molecole con relazioni struttura-attività (o struttura-metabolismo) specializzate. Perdendo la sua attività agonista del recettore μ durante l'idrolisi dell'estere, si ottiene un oppioide ad azione molto breve (Fig.10). (43) L'esigenza insoddisfatta percepita alla base dello sviluppo del remifentanil era quella di avere un oppioide con una rapida insorgenza e compensazione in modo che il farmaco potesse essere titolato su e giù secondo necessità per soddisfare le esigenze dinamiche del paziente durante le condizioni in rapida evoluzione dell'anestesia e della chirurgia.
Rispetto ai congeneri del fentanil attualmente in commercio, il CSHT del remifentanil è breve, dell'ordine di circa 5 minuti. (44) Dal punto di vista farmacodinamico, il remifentanil presenta una breve latenza al picco dell'effetto simile all'alfentanil e una potenza leggermente inferiore a quella del fentanil. (45)
Il ruolo del remifentanil nella moderna pratica dell'anestesia è ora relativamente ben consolidato. Il remifentanil è forse il più adatto per i casi in cui il suo profilo farmacocinetico reattivo può essere sfruttato con vantaggio (p. es., quando è desiderabile un rapido recupero; quando il fabbisogno di anestesia varia rapidamente; quando la titolazione degli oppioidi è imprevedibile o difficile o quando vi è un pericolo sostanziale per l'assunzione di oppioidi overdose o quando una tecnica di oppioidi a “dosi elevate” è vantaggiosa ma il paziente non sarà ventilato meccanicamente dopo l'intervento).(46) L'applicazione clinica più comune del remifentanil è la somministrazione di TIVA in combinazione con propofol. Viene anche comunemente somministrato in bolo endovenoso quando si desidera solo un brevissimo impulso di effetto oppioide seguito da un rapido recupero (p. es., in preparazione all'iniezione di anestetico locale durante la cura dell'anestesia monitorata) (vedi capitolo anestesia ambulatoriale).

- Fig.10 Via metabolica del remifentanil. La deesterificazione (cioè l'idrolisi dell'estere) da parte di esterasi plasmatiche e tissutali aspecifiche in un metabolita acido inattivo (GI90291) è responsabile della stragrande maggioranza del metabolismo del remifentanil. (Adattato da Egan TD, Huizinga B, Gupta SK, et al. Remifentanil pharmacokinetics in obesi versus magri pazienti. Anesthesiology. 1998;89:562-573, usato con autorizzazione.)
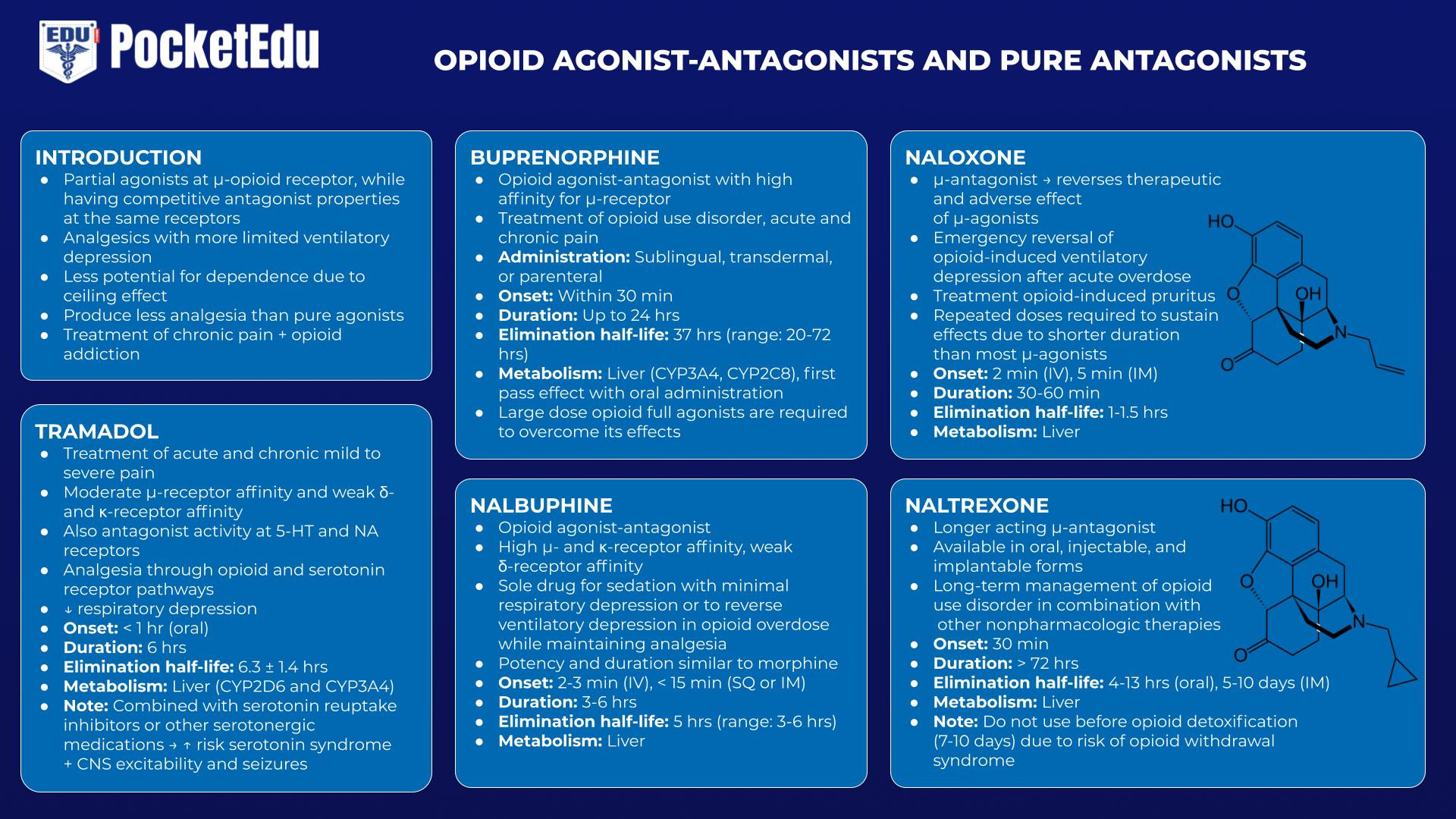
Agonisti-antagonisti degli oppioidi e antagonisti puri
Gli agonisti-antagonisti degli oppioidi agiscono come agonisti parziali sul recettore μ, pur avendo proprietà antagoniste competitive sugli stessi recettori. Questi farmaci fungono da analgesici con depressione ventilatoria più limitata e un minore potenziale di dipendenza in quanto dimostrano un "effetto soffitto", producendo meno analgesia rispetto agli agonisti puri. Il minore potenziale di abuso era il principale bisogno insoddisfatto percepito alla base dello sviluppo di questi farmaci. I farmaci di questa categoria sono utilizzati per il trattamento del dolore cronico, nonché per il trattamento della dipendenza da oppiacei. Questi farmaci causano un certo grado di antagonismo competitivo quando somministrati in presenza di un'attività agonista completa in corso (p. es., quando somministrati dopo la morfina e altri agonisti puri). Gli antagonisti puri degli oppioidi, di cui il naloxone è il prototipo, sono antagonisti competitivi completi del recettore degli oppioidi privi di qualsiasi attività agonista. Questi antagonisti puri sono utilizzati nella gestione dell'overdose acuta da oppioidi e dell'abuso cronico.
Tramadolo
Il tramadolo è un analgesico ad azione centrale con moderata affinità per i recettori μ e debole per i recettori κ e δ. In particolare, tramadolo ha anche attività antagonista a livello dei recettori 5-idrossitriptamina (5-HT) e nicotinico dell'acetilcolina (NA). Pur fornendo analgesia attraverso le vie del recettore degli oppioidi e della serotonina, il tramadolo comporta un minor rischio di depressione respiratoria. Tuttavia, se combinato con inibitori della ricaptazione della serotonina o altri farmaci serotoninergici, comporta il rischio di sindrome serotoninergica e anche di eccitabilità e convulsioni del SNC.(47)
Buprenorfina
La buprenorfina è un agonista-antagonista degli oppioidi con un'elevata affinità per il recettore μ. Può essere somministrato per via sublinguale, transdermica o parenterale, ma subisce un esteso metabolismo epatico di primo passaggio con la somministrazione orale. Sebbene dosi moderate possano essere utilizzate per trattare il dolore cronico, dosi più elevate utilizzate nel trattamento del dolore cronico possono antagonizzare gli effetti di altri oppioidi, rendendo difficile il trattamento del dolore acuto o cronico. Poiché lega i recettori degli oppioidi con un'affinità così elevata e la sua emivita di eliminazione è compresa tra 20 e 72 ore, per superare i suoi effetti sono necessari agonisti completi degli oppioidi a dosi elevate.(48)
Nalbuphine
Anche un agonista-antagonista degli oppioidi, la nalbufina ha una potenza e una durata d'azione simili alla morfina. Può essere utilizzato come unico farmaco per la sedazione con depressione respiratoria minima, nonché come farmaco per invertire la depressione ventilatoria in caso di sovradosaggio da oppioidi mantenendo una certa analgesia.(49)
Naloxone/Naltrexone
Il naloxone è un μ-antagonista iniettabile che inverte sia gli effetti terapeutici che quelli avversi dei μ-agonisti.(50) L'indicazione più comune del naloxone è l'inversione di emergenza della depressione ventilatoria indotta da oppioidi dopo un'overdose acuta. Il suo ruolo importante in questo senso ha meritato l'inclusione del naloxone nella "Lista dei farmaci essenziali" dell'Organizzazione mondiale della sanità. Il naloxone è talvolta utilizzato in dosi molto più piccole durante l'emergenza dall'anestesia per ripristinare un adeguato sforzo ventilatorio e quindi accelerare l'estubazione della trachea. Il trattamento del prurito indotto da oppioidi (che richiede solo piccole dosi) è un'altra applicazione terapeutica comune.
Sebbene il naloxone sia molto efficace nell'invertire la depressione ventilatoria associata agli oppioidi, ha numerosi effetti negativi, tra cui sindrome da astinenza acuta, nausea, vomito, tachicardia, ipertensione, convulsioni ed edema polmonare, tra gli altri.(51) Riconoscendo che la durata del naloxone l'azione è più breve di quella della maggior parte dei μ-agonisti è un punto chiave nel determinare il programma di dosaggio; possono essere necessarie dosi ripetute per sostenerne gli effetti.
In risposta all'epidemia di abuso di oppioidi negli Stati Uniti, sono stati sviluppati nuovi sistemi di somministrazione destinati all'uso di emergenza da parte di non addetti ai lavori in caso di overdose di oppioidi; questi includono spray nasali e preparati per autoiniettore.(52,53)
Il naltrexone, un μ-antagonista oppioide ad azione prolungata disponibile in forma orale, iniettabile e impiantabile, è utilizzato nella gestione a lungo termine dei tossicodipendenti da oppioidi in combinazione con altre terapie non farmacologiche. (54)
3. APPLICAZIONE CLINICA
Gli oppioidi svolgono un ruolo fondamentale praticamente in ogni area della pratica dell'anestesia. Nel trattamento del dolore postoperatorio, gli oppioidi sono di primaria importanza, mentre nella maggior parte degli altri contesti di medicina perioperatoria gli oppioidi sono coadiuvanti terapeutici usati in combinazione con altri farmaci.
Indicazioni cliniche comuni
L'analgesia postoperatoria è l'indicazione più longeva per la terapia con oppioidi nella pratica anestesiologica. Nell'era moderna, la somministrazione di oppioidi tramite dispositivi PCA è forse la modalità di somministrazione più comune. Negli ultimi anni, gli oppioidi sono sempre più combinati nel postoperatorio con vari altri analgesici, come i farmaci antinfiammatori non steroidei (FANS), per aumentare l'efficacia e la sicurezza.
A livello internazionale, l'indicazione clinica più comune per gli oppioidi nella pratica dell'anestesia è il loro uso per quella che è diventata nota come anestesia bilanciata. Questo termine forse fuorviante connota l'uso di più farmaci (p. es., anestetici volatili, bloccanti neuromuscolari, sedativi-ipnotici e oppioidi) in dosi più piccole per produrre lo stato di anestesia. Con questa tecnica, gli oppioidi vengono utilizzati principalmente per la loro capacità di diminuire la MAC. Un presupposto di base alla base di questo approccio di anestesia bilanciata è che i farmaci usati in combinazione mitigano gli svantaggi dei singoli farmaci (cioè gli anestetici volatili) usati in dosi maggiori come terapia farmacologica singola.
"L'anestesia con oppioidi ad alte dosi", una tecnica originariamente descritta per la morfina nei primi giorni della chirurgia a cuore aperto (55) e successivamente associata ai congeneri del fentanyl, (56) è un'altra applicazione comune degli oppioidi nell'anestesia clinica. La base scientifica originale di questo approccio era che grandi dosi di oppioidi consentivano al medico di ridurre al minimo la concentrazione di anestetico volatile, evitando così la depressione miocardica diretta e altri effetti emodinamici spiacevoli in pazienti i cui sistemi cardiovascolari erano già compromessi. Inoltre, il fentanil produce spesso una relativa bradicardia che potrebbe essere utile nei pazienti con ischemia miocardica. Sebbene il concetto generale sia ancora applicato, attualmente le dosi di oppioidi utilizzate sono inferiori. Gli oppioidi vengono somministrati anche per i loro possibili effetti benefici in termini di cardioprotezione (cioè precondizionamento).
TIVA è un'indicazione più recentemente sviluppata e sempre più popolare per gli oppioidi nella pratica dell'anestesia. Questa tecnica si basa interamente su farmaci per via endovenosa per la fornitura di anestesia generale. Più comunemente, le infusioni continue di remifentanil o alfentanil sono combinate con un'infusione di propofol. Sia l'oppioide che il sedativo sono spesso erogati da pompe abilitate all'infusione controllata dall'obiettivo (TCI). Un chiaro vantaggio di questa tecnica, forse tra gli altri, è il miglioramento del benessere del paziente nel primo periodo postoperatorio, che comprende meno nausea e vomito e spesso una sensazione di euforia. (57)
Selezione e somministrazione razionale dei farmaci
Nell'articolare una base scientifica per la selezione razionale degli oppioidi, le considerazioni farmacocinetiche sono estremamente importanti. Infatti, i μ-agonisti (oppioidi) possono essere considerati equivalenti farmacodinamici con importanti differenze farmacocinetiche.(58) Pertanto, la selezione razionale di un μ-agonista oppioide rispetto a un altro richiede che il medico identifichi il profilo temporale desiderato dell'effetto del farmaco e quindi scelga un oppioide che meglio consente al medico di raggiungerlo (entro ovvi vincoli come le preoccupazioni farmacoeconomiche).
Nella selezione dell'oppioide appropriato, tra le domande chiave da porsi ci sono In quanto tempo si deve ottenere l'effetto oppioide desiderato? Per quanto tempo deve essere mantenuto l'effetto oppioide? Quanto è importante che la depressione ventilatoria o la sedazione indotte dagli oppioidi si dissipino rapidamente (p. es., il paziente sarà ventilato meccanicamente dopo l'intervento)? La capacità di aumentare e diminuire rapidamente il livello dell'effetto oppioide durante l'anestesia è critica? Ci sarà un dolore significativo dopo l'intervento che richiederà un trattamento con oppioidi? Tutte queste domande si riferiscono al profilo temporale ottimale dell'effetto oppioide. Le risposte a queste domande vengono affrontate attraverso l'applicazione di concetti di farmacocinetica.
Per esempio, quando si desidera un breve impulso di effetto oppioide seguito da un rapido recupero (p. es., per fornire analgesia per un blocco retrobulbare), potrebbe essere preferito un bolo di remifentanil o alfentanil. Quando si desidera un effetto oppioide di lunga durata, come quando ci sarà un dolore postoperatorio significativo o quando la trachea rimarrà intubata, un'infusione di fentanil è una scelta prudente. Se il paziente deve essere sveglio e vigile poco dopo la fine della procedura (p. es., una craniotomia in cui i chirurghi sperano di eseguire un esame neurologico in sala operatoria immediatamente dopo l'intervento), un'infusione di remifentanil potrebbe essere vantaggiosa.
La formulazione di una strategia di somministrazione razionale richiede anche la corretta applicazione dei principi farmacocinetici. Un obiettivo importante di qualsiasi schema di dosaggio è raggiungere e mantenere un livello stazionario di effetto oppioide. Al giorno d'oggi, per ottenere una concentrazione stazionaria nel sito d'azione, gli oppioidi vengono spesso somministrati per infusione continua. Ciò viene sempre più realizzato attraverso l'uso della tecnologia TCI, che richiede che il medico abbia familiarità con il modello farmacocinetico appropriato per l'oppioide di interesse. Quando questi sistemi non sono disponibili, il medico deve ricordare che le infusioni devono essere precedute da un bolo per raggiungere tempestivamente uno stato quasi stazionario.
4. SVILUPPI EMERGENTI
Oppiacei e recidiva del cancro
L'influenza della terapia con oppioidi sulla recidiva del cancro è controversa. Poiché gli effetti immunosoppressivi degli oppioidi (in particolare la morfina) e il loro impatto sull'angiogenesi sono stati dimostrati in studi su animali e in vitro, è emersa preoccupazione per l'influenza di questi farmaci sulla recidiva e sulla sopravvivenza del cancro. Alcuni primi dati retrospettivi che confrontavano i tassi di recidiva del cancro nei pazienti che ricevevano analgesia oppioide postoperatoria standard con quelli che ricevevano tecniche alternative (p. es., gestione del dolore epidurale) suggerivano un tasso più frequente di recidiva del cancro nel gruppo di terapia con oppioidi; altri studi hanno trovato risultati contrastanti. Una revisione retrospettiva di oltre 34,000 pazienti con carcinoma mammario dal 1996 al 2008 non ha dimostrato alcuna associazione tra terapia con oppioidi e recidiva del cancro. (59) Allo stesso modo, una revisione retrospettiva di 819 pazienti con carcinoma epatocellulare che hanno ricevuto fentanyl per via endovenosa postoperatoria o epidurale postoperatoria con morfina non ha riscontrato alcun effetto sulla sopravvivenza libera da recidiva.(60)
Tuttavia, altri studi hanno suggerito alcuni risultati migliori con le tecniche di risparmio di oppioidi. Una revisione di 984 pazienti con carcinoma polmonare non a piccole cellule dal 2006 al 2011 ha rilevato una sopravvivenza migliorata e una sopravvivenza libera da malattia più lunga nelle strategie di gestione del dolore che risparmiano oppioidi. (61) Pertanto, il ruolo della terapia perioperatoria con oppioidi nella recidiva del cancro rimane controverso; gli studi in corso affineranno ulteriormente il processo decisionale clinico relativo all'anestesia nel trattamento dei pazienti oncologici.
Epidemia di abuso di oppiacei
I decessi legati all'abuso e alla diversione degli oppioidi da prescrizione sono saliti alle stelle negli Stati Uniti e altrove. (62) Oltre ai decessi, questo modello pervasivo di prescrizione e abuso illecito di oppiacei ha provocato un enorme aumento dei ricoveri nelle strutture per il trattamento dell'abuso di oppiacei. (63) La tendenza può essere dovuta almeno in parte alle pratiche di prescrizione di oppioidi per condizioni di dolore cronico che possono predisporre alcuni pazienti alla dipendenza. (64,65)
L'epidemia ha raggiunto un tale livello di crisi che le autorità governative federali e statali negli Stati Uniti hanno emanato leggi e stanziato fondi per sostenere la ricerca, la prevenzione e il trattamento del problema. (66,67) L'erogazione di naloxone in farmacia approvata dallo stato (senza prescrizione medica) per i pazienti che compilano le prescrizioni di oppioidi è un notevole esempio degli sforzi sostenuti da tale legislazione. (68) Inoltre, le associazioni professionali ei centri per il controllo e la prevenzione delle malattie (CDC) hanno prodotto nuove linee guida per la prescrizione di oppiacei. (69) Questa è attualmente un'area di intense discussioni pubbliche e indagini mediche.
5. DOMANDE DEL GIORNO
- Un paziente necessita di analgesia postoperatoria controllata dal paziente (PCA). Dal punto di vista farmacocinetico, quali sono i vantaggi relativi del fentanil rispetto alla morfina per l'uso nella PCA?
- Quale parametro farmacocinetico è più adatto per descrivere il tempo di offset di un'infusione continua di oppioidi?
- Quali sono gli effetti degli oppioidi sulla ventilazione minuto e sulla risposta ventilatoria all'anidride carbonica?
- In che modo l'insufficienza renale influisce sulla farmacocinetica della morfina e della meperidina?
- A un paziente con depressione respiratoria postoperatoria da morfina viene somministrato naloxone per via endovenosa. Quali sono i potenziali effetti collaterali del naloxone?
- Quali domande chiave dovrebbero essere affrontate quando si seleziona un oppioide per uso intraoperatorio?