Steven L. Orebaugh et Kyle R. Kirkham
INTRODUCTION
L'échographie (US) comme moyen de guider le bloc nerveux périphérique (PNB) a été explorée pour la première fois par des anesthésistes de l'Université de Vienne au milieu des années 1990. Bien que les radiologues aient utilisé la technologie des ultrasons pour guider les aiguilles pour la biopsie, l'application de cette modalité d'imagerie pour la PNB était nouvelle à l'époque. L'utilité de l'échographie pour faciliter une gamme de techniques d'anesthésie régionale, y compris le plexus brachial et les blocs fémoraux, a été démontrée. Une décennie plus tard, des collègues de l'Université de Toronto, au Canada, ont commencé à adopter cette technologie, démontrant davantage son utilité et décrivant en détail la sonoanatomie du plexus brachial. Un certain nombre d'avancées technologiques ont eu lieu entre-temps, notamment des plates-formes d'échographie plus petites et plus mobiles, une résolution améliorée et un logiciel de reconnaissance d'aiguille, tous cumulatifs conduisant à une utilité accrue de l'échographie au chevet du patient par les anesthésistes.
AVANTAGES DU GUIDAGE PAR ULTRASONS
Les techniques basées sur l'anatomie de surface précédemment utilisées, telles que la stimulation nerveuse, la palpation des repères, les «clics» fasciaux, les paresthésies et les approches transartérielles, ne permettaient pas de surveiller la disposition de l'injectat d'anesthésique local. Le guidage échographique, cependant, offre un certain nombre d'avantages pratiques importants pour le bloc nerveux. L'échographie permet de visualiser l'anatomie de la région d'intérêt. Cela permet un guidage plus éclairé du trajet de l'aiguille vers la cible tout en évitant les structures qui pourraient être endommagées par l'aiguille. L'échographie permet également de visualiser la pointe de l'aiguille lorsqu'elle passe à travers les tissus, confirmant l'alignement avec le chemin prévu, réduisant à nouveau la probabilité d'un traumatisme accidentel de l'aiguille aux structures non intentionnelles. Peut-être le plus important, l'imagerie par ultrasons en temps réel permet une visualisation continue de l'administration de la solution anesthésique locale pour assurer une distribution appropriée, avec la possibilité d'ajuster la position de la pointe de l'aiguille si nécessaire pour optimiser la distribution de l'anesthésique local.
Introduction du guidage échographique dans les régions anesthésie a conduit au perfectionnement de nombreuses techniques de bloc nerveux, à une utilisation élargie du PNB et à une plus grande acceptation par les collègues chirurgicaux et les patients.
ÉCHOGRAPHIE ET ÉCHOANATOMIE
La PNB échoguidée peut être décomposée en deux aspects fondamentaux : l'imagerie des structures dans le plan de coupe, y compris le nerf cible, et le guidage de l'aiguille. La compréhension et la reconnaissance des structures anatomiques tridimensionnelles sur une image bidimensionnelle nécessite une formation à la technologie et à la reconnaissance des formes échographiques (Tableau 1).
TABLE 1. Optimisation de la visualisation de l'échographie.
| Choisissez le transducteur/la fréquence appropriés Comprendre les relations anatomiques sous-jacentes Appliquer différents degrés de pression avec le transducteur Aligner le transducteur avec la cible nerveuse sous-jacente Faire pivoter le transducteur pour affiner l'image Inclinez le transducteur pour optimiser l'image |
Comme la reconnaissance anatomique reste essentielle pour placer des blocs, même avec un guidage visuel en temps réel, les directives des sociétés spécialisées pour la formation des résidents et des boursiers continuent de souligner l'importance de la dissection anatomique et de la formation en anatomie macroscopique en tant que composante inhérente de l'apprentissage de l'anesthésie régionale guidée par ultrasons (UGRA). Dans une étude menée sur une rotation d'un mois en anesthésie régionale, les résidents ont démontré une reconnaissance nettement améliorée des structures pertinentes sur les sites de plusieurs PNB différents, en utilisant l'imagerie par ultrasons. Dans une évaluation de l'enseignement du bloc interscalène guidé par échographie, les résidents ont démontré une efficacité croissante de la reconnaissance de l'échographie à mesure que leur expérience au cours de la rotation augmentait.
Des méthodes de formation plus innovantes se sont également révélées prometteuses. Il a été démontré que l'intégration d'un programme anatomique dans le logiciel d'un échographe de chevet améliore les résultats d'un test écrit d'anatomie. Après avoir été exposés à une présentation multimédia sur l'anatomie, les résidents et les anesthésistes communautaires ont démontré une connaissance accrue de l'anatomie échographique lors d'un post-test, bien qu'ils n'aient pas été en mesure d'améliorer les scores lors d'un examen pratique de l'échographie sur des modèles vivants. Cependant, le lien optimal entre la connaissance anatomique et la reconnaissance de motifs anatomiques bidimensionnels à l'échographie n'a pas encore été suffisamment exploré.
Certains principes de base de l'optimisation d'une image échographique sont applicables à tous les blocs nerveux. Par exemple, l'échographie nécessite une compréhension de la mécanique et de l'ergonomie. Les novices sont sujets à des erreurs telles que la fatigue de la sonde, l'inversion de l'orientation de la sonde et une préparation inadéquate de l'équipement. Pour optimiser l'image échographique, la partie mnémotechnique (pression, alignement, rotation, inclinaison) a été préconisée. La pression est nécessaire pour minimiser la distance à la cible et comprimer les tissus adipeux sous-cutanés sous-jacents. L'alignement consiste à placer le transducteur dans une position au-dessus de l'extrémité (ou du tronc) à laquelle le nerf sous-jacent est censé se trouver dans le champ de vision. La rotation permet d'affiner la vue de la structure cible. L'inclinaison permet d'amener la face de la sonde dans une disposition perpendiculaire à la cible sous-jacente pour maximiser le nombre d'échos de retour et ainsi fournir la meilleure image (Figure 1). Une discussion approfondie sur l'optimisation de l'imagerie par ultrasons est abordée dans "Optimiser une image échographique" .
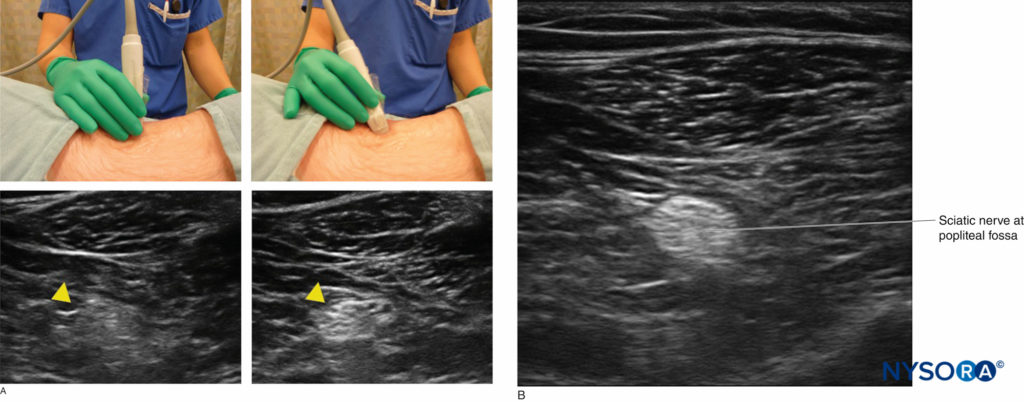
FIGURE 1. Un réglage fin de l'inclinaison de la sonde est nécessaire pour optimiser le retour d'écho de la structure cible et améliorer la résolution de l'image (les pointes de flèches jaunes indiquent le nerf sciatique au niveau de la fosse poplitée).
Conseils NYSORA
- Pour optimiser l'image échographique, le mnémonique PART a été préconisé : pression, alignement, rotation, inclinaison.
- La reconnaissance et la compréhension de l'échographie nécessitent une connaissance de l'anatomie tridimensionnelle sous-jacente.
- Une visualisation optimale du nerf cible nécessite une pression appropriée du transducteur, un alignement avec le nerf, ainsi qu'une rotation et une inclinaison de la sonde pour affiner l'image.
OPTIMISER L'IMAGERIE DES NERFS ET DES AIGUILLES AVEC DES SCÉNARIOS CLINIQUES PAR ULTRASONS
L'imagerie nerveuse peut être réalisée en position axe court (face de la sonde perpendiculaire à l'axe du nerf) ou axe long (face de la sonde parallèle à l'axe du nerf) (Figure 2).
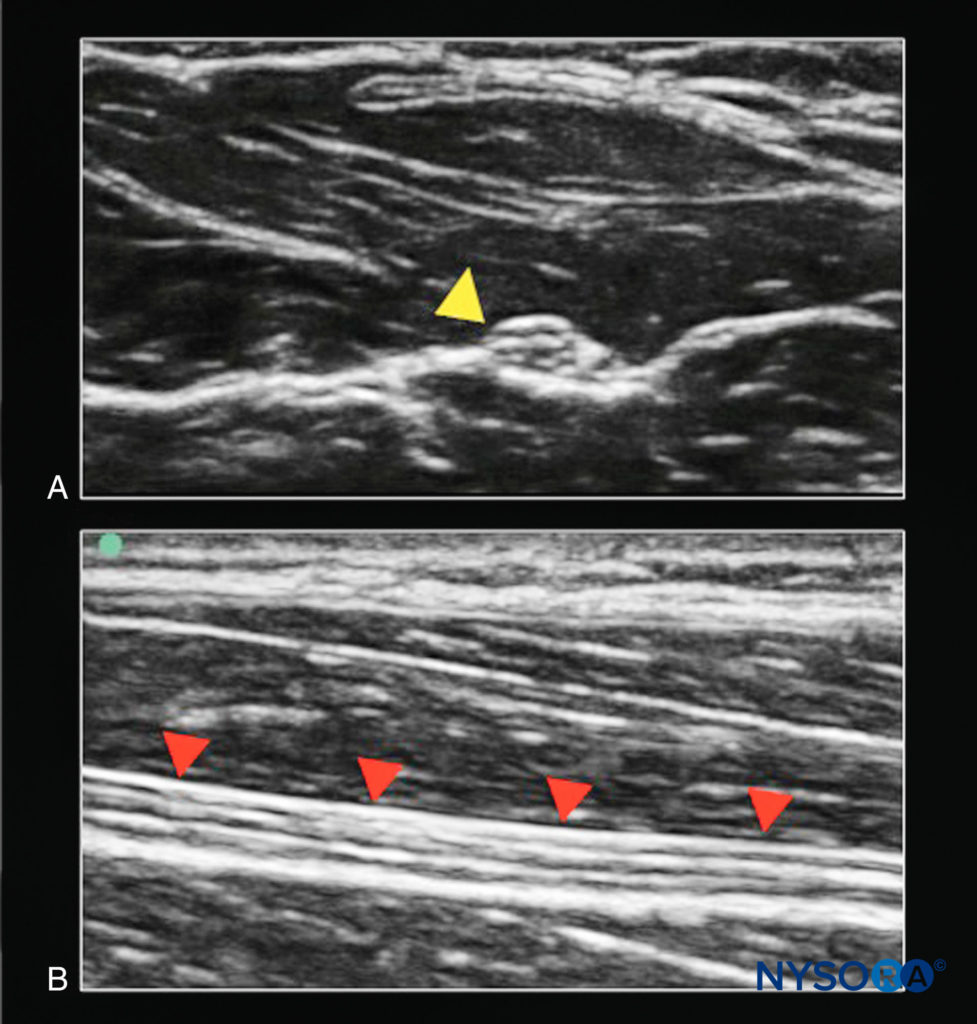
FIGURE 2. Le nerf médian. A: Coupe transversale (structure cible hors du plan du faisceau d'ultrasons ; pointe de flèche jaune). B: Coupe longitudinale (structure cible dans le plan du faisceau d'ultrasons ; pointes de flèches rouges).
Il est souvent plus facile de reconnaître l'élément neuronal rond, souvent hyperéchogène, avec l'imagerie à petit axe, en particulier pour un débutant. Étant donné que la plupart des blocs nerveux sont effectués dans les extrémités, cette orientation se traduit par une position du transducteur qui est transversale, à travers l'axe longitudinal du bras ou de la jambe. En général, la compréhension du parcours des nerfs, basée sur la connaissance de l'anatomie générale, permet d'aligner et de faire pivoter le transducteur perpendiculairement au parcours du nerf en ajustant ensuite l'inclinaison comme décrit précédemment pour optimiser l'image.
Une fois le nerf et l'anatomie environnante identifiés, un chemin d'aiguille peut être choisi de sorte qu'il soit imagé soit dans le plan (aiguille parallèle au grand axe de la sonde) soit hors du plan (aiguille perpendiculaire au grand axe de la sonde) par rapport au faisceau d'ultrasons. Bien qu'aucune des deux méthodes ne se soit révélée supérieure pour le succès du bloc ou la sécurité du patient, l'approche préférée peut varier en fonction de considérations anatomiques ou techniques. Cependant, avec l'imagerie dans le plan, il est possible de conserver une image de l'ensemble de l'aiguille, y compris la pointe, bien qu'il puisse être difficile de maintenir l'aiguille entièrement dans le plan de visualisation du transducteur. Cette méthode est particulièrement bénéfique pendant l'instruction, car le superviseur a une visualisation continue de la pointe de l'aiguille au fur et à mesure qu'elle avance à travers les tissus.
Pendant l'imagerie hors plan, l'observateur ne peut voir que la section transversale de l'aiguille, qui apparaît comme un petit point hyperéchogène, à n'importe quel plan sur toute sa longueur, de sorte qu'il est beaucoup plus difficile de distinguer la pointe de la tige. .
Cependant, guider la pointe de l'aiguille vers la cible tout en maintenant l'ensemble de l'aiguille dans le plan d'imagerie peut s'avérer difficile (Tableau 2).
TABLE 2. Optimisation de l'imagerie de l'aiguille par ultrasons.
| Utiliser un faible angle d'approche, si possible « Talez » le transducteur pour rendre le visage plus parallèle à l'aiguille Faites pivoter le transducteur pour vous assurer que toute l'aiguille est visible Inclinez le transducteur si nécessaire Choisir une aiguille « échogène » Appliquer un logiciel de reconnaissance d'aiguille, si disponible "L'hydrolocalisation" peut aider à déterminer l'emplacement de la pointe de l'aiguille |
Réglage approprié de la hauteur du lit et placement ergonomique de l'échographe afin que les yeux de l'opérateur puissent facilement et rapidement passer de l'image au champ (Figure 3), où l'alignement de l'aiguille avec le grand axe de la sonde peut être assuré, est bénéfique. Il est étonnamment facile pour le transducteur de s'éloigner du plan de l'aiguille alors que la vision est fixée sur l'écran à ultrasons. Cela est plus probable si l'opérateur a la sonde et l'aiguille alignées perpendiculairement à son propre axe de visualisation, par opposition à l'alignement de l'aiguille et de la sonde avec l'axe de visualisation.
Dans une étude d'étudiants en médecine novices apprenant les bases de l'UGRA, Speer et al ont constaté que les sujets avaient besoin de moins de temps pour localiser la cible et étaient mieux en mesure de garder l'aiguille visualisée dans le plan sur l'image échographique, lorsque les yeux, l'aiguille, la sonde , et l'écran de visualisation étaient alignés. Les guides d'aiguille peuvent également permettre une meilleure imagerie de l'aiguille lors de l'approche de la cible, bien que davantage de travail ait été effectué dans l'accès vasculaire. Un inconvénient des guides d'aiguille est qu'ils limitent le mouvement de l'aiguille à un plan, ce qui n'est pas toujours souhaitable.
Les nerfs en petit axe ont une apparence qui est dans une certaine mesure déterminée par leur proximité avec le neuraxis. Bien que dans la plupart des régions, les nerfs soient ronds, ils peuvent apparaître fusiformes, comme le nerf musculo-cutané dans le bras proximal, ou de forme ovale, comme le nerf sciatique dans la région sous-fessière. En association étroite avec la colonne vertébrale, les nerfs et les racines nerveuses sont constitués principalement de tissu neural, avec un minimum de tissu conjonctif. Étant donné que le tissu neural apparaît hypoéchogène à l'échographie, tandis que le tissu conjonctif entre les fascicules est hyperéchogène, les nerfs proches du neuraxis apparaissent sous forme de nodules sombres.
Au fur et à mesure que les nerfs circulent périphériquement, le nombre de faisceaux augmente, bien qu'ils diminuent en taille, tandis que la quantité de tissu conjonctif augmente également. Ces modifications conduisent à un aspect « nid d'abeille » de plus en plus complexe en échographie en vision petit axe (Figure 4). Malheureusement, en raison des limitations technologiques des appareils à ultrasons actuels, le nombre et la disposition des faisceaux dans un nerf périphérique peuvent ne pas être représentés avec précision.
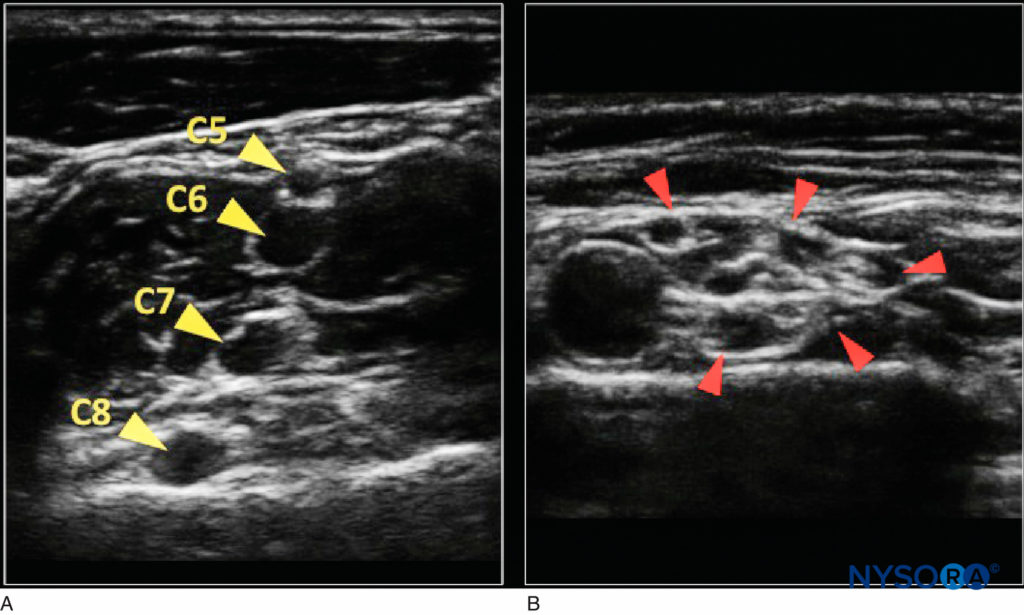
FIGURE 4. A: Apparition nerveuse proximale dans le sillon interscalénique (les flèches jaunes indiquent les racines nerveuses) avec peu de tissu conjonctif échogène. B: Plus distal dans la fosse sus-claviculaire (les flèches rouges indiquent les troncs du plexus brachial) avec un aspect en « nid d'abeille ».
Alors que différents tissus ont des aspects caractéristiques à l'échographie, le nerf peut ne pas être facilement distingué du tendon lorsque les deux sont vus dans un petit axe. Cependant, en utilisant ses connaissances en anatomie, l'opérateur peut suivre le trajet de la structure caudale-céphalique pour déterminer la nature de la structure imagée. Les tendons finiront par disparaître dans le muscle d'origine ou s'inséreront dans les os. Un bon exemple est le nerf médian au poignet, où il est difficile de discerner la structure neurale des nombreux tendons du canal carpien, par rapport au milieu de l'avant-bras, où le nerf est beaucoup plus distinct visuellement, car il est situé entre deux couches. de muscle, sans tendons environnants (Figure 5).
Un aspect important de la préparation d'un bloc est d'obtenir le plan d'imagerie préféré tout en planifiant l'itinéraire pour le trajet de l'aiguille. L'opérateur doit s'assurer qu'aucune structure vulnérable ne se trouve dans le parcours projeté, comme un vaisseau sanguin, la plèvre ou des structures sensibles comme le périoste.
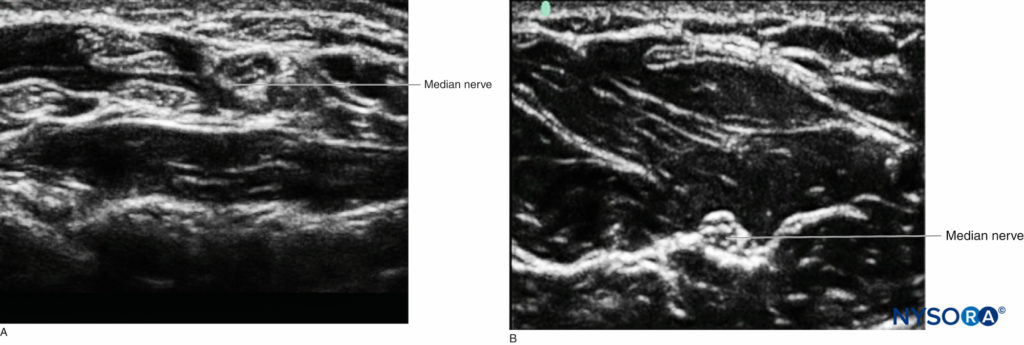
FIGURE 5. A: Le nerf médian au poignet parmi de nombreux tendons dans le canal carpien. B: Le nerf médian plus proximal dans l'avant-bras entouré de muscle.
Ce processus est appelé « analyse de préblocage », qui peut contribuer à la sécurité du patient et à la réussite du blocage. En plus de l'imagerie bidimensionnelle, le réglage Doppler couleur doit être utilisé pour identifier les petits vaisseaux, qui peuvent facilement être confondus avec les structures nerveuses (en particulier les racines) lorsqu'ils sont vus dans un petit axe (Figure 6).
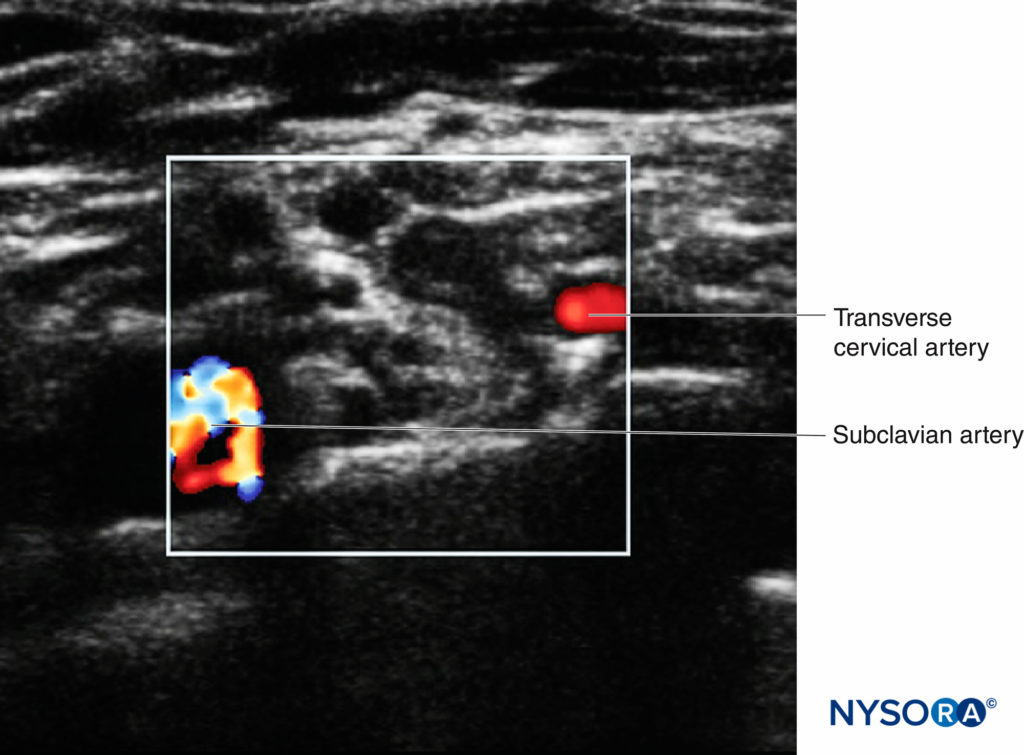
FIGURE 6. Le plexus brachial supraclaviculaire avec la vascularisation environnante. L'artère sous-clavière est indiquée par la zone multicolore, l'artère cervicale transversale étant indiquée par la zone rouge.
Pour maintenir la vue de la pointe et de la tige de l'aiguille, plusieurs techniques peuvent être utilisées. Plus l'aiguille est parallèle à la face de la sonde, plus les échos sont transmis au transducteur, ce qui donne une meilleure image. Cela peut être accompli en indentant doucement la peau au niveau du site d'insertion de l'aiguille ou en éloignant le site d'insertion de la sonde, ce qui entraîne un angle d'insertion moins aigu (Figure 7). La limitation de cette approche est qu'une aiguille plus longue peut être nécessaire, et plus de tissu est traversé en route vers la cible.
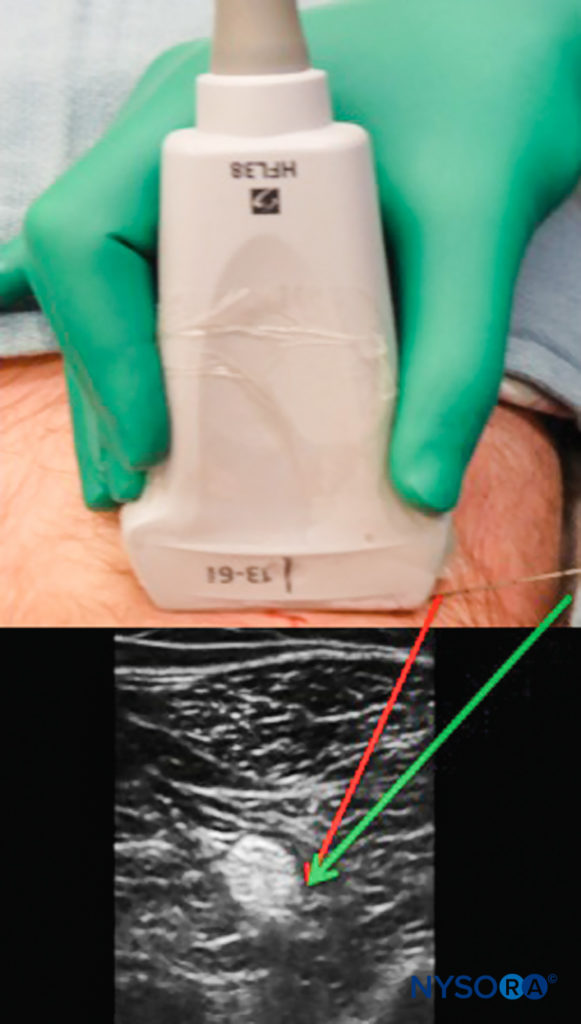
FIGURE 7. L'insertion de l'aiguille directement à côté de la sonde à ultrasons peut entraîner une visualisation difficile. L'insertion à distance de la sonde permet une approche moins profonde, permettant un retour d'écho plus fort et une meilleure visualisation de l'aiguille (flèche verte) bien que traversant un trajet tissulaire plus long.
Une autre technique, appelée talonnage, consiste à appuyer sur le bord du transducteur opposé au côté d'insertion de l'aiguille, ce qui se traduit par un alignement plus parallèle de la face de la sonde avec l'aiguille. De plus, l'aiguille elle-même peut être structurellement modifiée pour augmenter son échogénicité; les versions disponibles dans le commerce de ces «aiguilles échogènes» ont généralement été gravées sur la surface de la tige avec des hachures pour créer un plus grand degré de dispersion du faisceau ultrasonore.
Comme indiqué, des guides d'aiguille peuvent être utilisés pour améliorer l'imagerie de l'aiguille, bien qu'au prix d'une contrainte de mouvement. Des systèmes de guidage laser ont également été créés pour améliorer l'alignement, avec un certain succès. Une nouvelle méthode alternative de placement ciblé de l'aiguille et d'administration d'anesthésique local utilise un système de guidage GPS, qui peut être particulièrement utile lorsque l'imagerie est rendue difficile par des angles d'aiguille prononcés. Un logiciel propriétaire pour la localisation de l'aiguille à des angles prononcés utilise l'imagerie composée spatiale, qui combine des images de différents angles d'insonation. Cela se traduit par une meilleure imagerie de l'aiguille avec des aiguilles à blocs standard et échogènes. Enfin, la localisation de la pointe de l'aiguille peut être réalisée par « hydrolocalisation », dans laquelle de petits volumes de solution de dextrose ou d'anesthésique local sont injectés pour visualiser la propagation dans les tissus, ce qui révèle généralement la position de la pointe de l'aiguille.
Conseils NYSORA
• Plusieurs techniques différentes sont utiles pour maintenir la visualisation de l'aiguille avec l'imagerie par ultrasons, notamment l'utilisation d'un angle d'approche peu prononcé, la « gîte » du transducteur, des aiguilles échogènes disponibles dans le commerce et des mesures physiques telles que la rotation et l'inclinaison du transducteur.
• De plus, l'hydrolocalisation avec une petite injection de fluide peut être utilisée pour faciliter la localisation de l'aiguille dans des situations difficiles.
• L'aiguille doit être avancée avec une visualisation continue pour éviter de blesser les structures anatomiques.
• Un balayage prébloc, y compris l'utilisation de la fonction Doppler couleur, aide à planifier le parcours de l'aiguille.
• Le passage de la pointe de l'aiguille à travers les plans fasciaux qui jouxtent un nerf doit être effectué de manière tangentielle pour éviter d'empaler le nerf lorsque le fascia « libère » l'aiguille.
GUIDAGE SÉCURISÉ DE L'AIGUILLE AVEC ULTRASONS
En avançant la pointe de l'aiguille vers le nerf ciblé avec l'imagerie dans le plan, il faut être prudent et délibéré, en essayant de maintenir l'aiguille dans le plan à tout moment (Tableau 3). La pointe de l'aiguille dans le plan est caractérisée par un retour à double écho généré à partir de la surface biseautée.
TABLE 3. Conseils de sécurité lors des blocs nerveux guidés par échographie.
| Effectuez un « scan prébloc » pour vérifier l'anatomie Utiliser le réglage Doppler couleur pour identifier les vaisseaux sanguins Ne pas avancer l'aiguille si la pointe n'est pas localisée "L'hydrodissection" peut être utilisée pour délimiter l'anatomie Lorsque vous poussez à travers le fascia vers un nerf, approchez-vous tangentiellement Traversez lentement le fascia, en attendant un « pop » ou un libérer Réoptimiser l'image de la pointe de l'aiguille après passage bande En cas de doute sur l'interface aiguille-nerf, doucement déplacer l'aiguille pour s'assurer que le nerf ne déplacez-vous avec lui (indiquant que la pointe est intégrée dans épinèvre) |
Les ultrasons sont réfléchis à la fois par les parois superficielles et profondes de l'aiguille, ce qui donne un aspect en escalier qui se distingue du simple retour de la tige de l'aiguille. Un mouvement de glissement subtil de la sonde à ultrasons peut aider à confirmer l'emplacement de la pointe lorsque le faisceau monte et descend la tige de l'aiguille.
On rencontrera généralement des plans fasciaux qui résistent à l'avance de l'aiguille. On peut voir ces couches dures de tissu conjonctif se «tenter» lorsque la pointe pousse contre elles, cédant soudainement et revenant à leur position d'origine. Ce changement brusque peut avoir deux conséquences : premièrement, l'aiguille peut avancer rapidement et par inadvertance au-delà de l'intention de l'opérateur (sauf si cela est anticipé) ; deuxièmement, l'aiguille peut sortir du plan. À ce stade, le mouvement vers l'avant de l'aiguille doit être arrêté jusqu'à ce que l'image dans le plan soit à nouveau optimisée. Il est courant que ces plans fasciaux soient juste superficiels ou adjacents à la cible nerveuse, comme au niveau du sillon interscalénique, du faisceau neurovasculaire axillaire ou du nerf fémoral. Ce mouvement peut en fait entraîner la poussée de l'aiguille vers l'avant et rencontrer le nerf si la cession soudaine du plan fascial n'est pas anticipée. Pour cette raison, il est recommandé d'approcher les nerfs tangentiellement, en projetant l'avancée de l'aiguille de manière à ce que sa pointe soit adjacente au nerf, mais sans viser son centre.
La résistance rencontrée par ces plans faciaux durs peut également rediriger par inadvertance une aiguille lorsqu'elle est approchée sous un angle peu profond. L'inclinaison temporaire de l'angle de l'aiguille peut permettre un passage plus facile et plus contrôlé. Malheureusement, le guidage échographique ne produit pas toujours des images claires permettant de distinguer le tissu nerveux des tissus environnants. Dans de telles situations, à mesure que l'aiguille est avancée, "l'hydrodissection" (injection délibérée de fluide dans les plans tissulaires) peut être utilisée pour séparer les structures, permettant une meilleure clarté de l'imagerie, avec du dextrose ou une solution anesthésique locale.
De plus, le comportement des tissus peut être observé lorsque l'aiguille est avancée pour aider à localiser la pointe de l'aiguille par rapport au tissu neural.
Alors qu'il était autrefois considéré que le contact d'un nerf avec une pointe d'aiguille entraînerait probablement une paresthésie, et, en effet, cela était considéré comme une technique de localisation nerveuse appropriée, nous savons maintenant que la paresthésie n'est pas systématiquement provoquée par le contact avec le nerf de l'aiguille. Cela souligne la nécessité de localiser avec précision la pointe de l'aiguille avec l'imagerie par ultrasons ainsi que d'utiliser une surveillance supplémentaire pendant les PNB pour détecter les relations dangereuses aiguille-nerf, telles que la stimulation nerveuse et la surveillance de la pression d'injection.
Conseils NYSORA
- Le dépôt de la solution anesthésique locale doit être optimisé en tirant parti des plans fasciaux ou des gaines qui peuvent contenir ou canaliser le médicament autour du nerf
et longitudinalement le long de son parcours. - Pour les nerfs sans un tel confinement fascial local, la solution doit être injectée de manière circonférentielle pour accélérer l'apparition du bloc.
UTILISATION DE LA STIMULATION DES NERFS PÉRIPHÉRIQUES PAR ULTRASONS
Le stimulateur nerveux périphérique (PNS) est un outil standard dans la localisation nerveuse lors des PNB depuis plusieurs décennies, avec un degré de réussite élevé et un faible taux de complications. Cependant, l'adoption généralisée de échographie a remis en question son rôle actuel au sein de la PNB. Il y a plus de dix ans, Perlas et al. ont évalué la sensibilité des nerfs périphériques des membres supérieurs à la stimulation nerveuse périphérique lors de l'imagerie échographique du contact aiguille-nerf. Les auteurs ont rapporté que, malgré la visualisation de la pointe de l'aiguille indentant la surface du nerf, avec le stimulateur réglé pour délivrer un courant de 0.5 mA ou moins, aucune stimulation motrice ne s'est produite dans 25 % des cas.
Plusieurs études, avec une variété de blocs différents, ont été réalisées pour évaluer l'utilité de cet outil de localisation en association avec UGRA. Que ce soit pour le bloc sus-claviculaire, pour le bloc axillaire ou pour le bloc fémoral, les auteurs ont montré que l'ajout du stimulateur nerveux comme outil de localisation nerveuse lors de la PNB échoguidée n'était pas contributif au succès.
De plus, Robards et al ont découvert que l'absence de réponse motrice au SNP entre 0.2 et 0.5 mA pendant le bloc poplité n'excluait pas toujours le placement de l'aiguille dans le nerf, et que la stimulation pouvait en fait conduire à une manipulation inutile de l'aiguille dans le nerf.
Cependant, le stimulateur peut être utile en complément de l'UGRA pour des raisons autres que d'assurer l'efficacité du bloc. Puisqu'il a été bien établi qu'un seuil de stimulation nerveuse inférieur à 0.2 mA indique une forte probabilité de placement de la pointe de l'aiguille dans le nerf, le stimulateur peut être utilisé pendant l'UGRA comme moniteur de sécurité. Le stimulateur nerveux est particulièrement nécessaire lors d'un bloc échographique des nerfs profonds, ou lorsque l'image échographique est moins précise que souhaitée. Dans ce contexte, une réponse motrice évoquée pourrait mettre en garde contre l'injection intrafasciculaire d'anesthésique local.
De plus, dans certaines circonstances, il peut être souhaitable d'identifier différents nerfs avec plus de précision, comme lors du bloc axillaire, pour lequel le SNP sert à délimiter les nerfs par leur réponse motrice spécifique à la stimulation électrique. Il peut y avoir, dans certaines localisations anatomiques, des structures neurales qui peuvent être difficiles à identifier par la seule visualisation, qu'elles soient la cible d'un blocage ou que l'on souhaite simplement les éviter avec l'aiguille ; dans ces cas, un PNS peut être inestimable pour fournir cette identification.
Enfin, il existe des nerfs qui ne se prêtent pas facilement à la visualisation par ultrasons, principalement en raison de la profondeur ou de l'interférence osseuse avec la transmission des ultrasons. L'exemple le plus courant en est l'abord postérieur du plexus lombaire, dans lequel les ultrasons peuvent être utilisés pour identifier les structures osseuses locales pour guider le bloc, mais pour lequel le SNP reste un outil précieux pour guider la pointe de l'aiguille à proximité de la nerfs du plexus.
Dans l'ensemble, une pléthore de données indiquent que l'utilisation systématique d'un stimulateur nerveux pendant les blocs nerveux guidés par échographie fournit des informations de sécurité cliniquement pertinentes qui peuvent influencer la prise de décision clinique et affecter positivement la sécurité des patients.
Cependant, l'objectif principal de l'utilisation systématique suggérée de la stimulation nerveuse avec l'UGRA est la surveillance de la sécurité, plutôt que la localisation nerveuse (Figure 8). À ce titre, le stimulateur nerveux peut être simplement réglé à 0.5 mA (0.1 ms), 2 Hz, sans modifier l'intensité du courant tout au long de la procédure.
Bien que la réponse motrice ne soit pas recherchée, l'apparition de la réponse motrice devrait nécessiter l'arrêt de l'avancement de l'aiguille et un léger retrait de l'aiguille car une réponse motrice à ce réglage de livraison actuel indique presque toujours un contact aiguille-nerf ou un placement intraneural de l'aiguille.
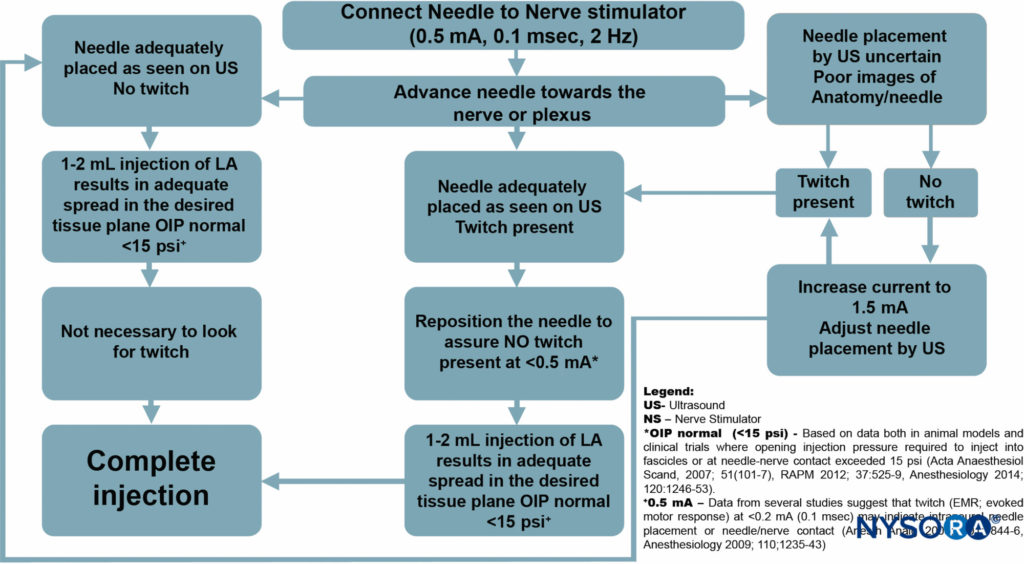
FIGURE 8. Algorithme : L'objectif principal de l'utilisation systématique suggérée de la stimulation nerveuse avec l'UGRA est de surveiller la sécurité plutôt que de localiser les nerfs.
OPTIMISER L'ADMINISTRATION D'ANESTHÉSIQUE LOCAL À PROXIMITÉ DU NERF CIBLE
Après un placement précis de l'aiguille près du nerf cible et après avoir vérifié que l'aspiration est négative pour le placement de l'aiguille intravasculaire, l'injection de l'anesthésique local est effectuée dans le plan tissulaire qui contient le ou les nerfs à anesthésier (Tableau 4).
TABLE 4. Optimisation du dépôt d'anesthésique local.
| Injecter la solution anesthésique locale en petites aliquotes Observez la douleur ou la pression élevée pendant l'injection Assurez-vous que la propagation du liquide est observée à la pointe de l'aiguille pendant l'injection Aspirer entre les injections Soyez conscient des plans fasciaux intermédiaires qui peuvent séquestrer ou canaliser la solution Éviter le dépôt d'anesthésique local dans le muscle Pour les nerfs solitaires des extrémités, cherchez à créer un « beignet » ou "halo" autour du nerf Pour les nerfs situés dans une enceinte fasciale, cherchez à « remplir » le fascia confins avec solutiona |
Brull et al ont évalué la notion de longue date selon laquelle la solution anesthésique locale devrait être dirigée de manière circonférentielle autour du nerf visible, avec un changement de position de l'aiguille si nécessaire, par rapport à simplement permettre à la solution de s'accumuler le long d'un aspect du nerf avec une position d'aiguille.
Ils ont constaté que le bloc résultant s'installait 33% plus rapidement avec le premier qu'avec le second. Alors que la création d'un « beignet » ou d'un « halo » autour du nerf peut être suggérée comme une recommandation générale, certains nerfs, en raison de leur situation anatomique, peuvent ne pas nécessiter un tel placement circonférentiel délibéré. Ceci est généralement dicté par l'emplacement et la configuration des plans fasciaux sus-jacents ou environnants, tels que dans la rainure interscalène et au niveau du triangle fémoral. L'administration optimale d'anesthésique local autour de chaque nerf est décrite dans les sections UGRA spécifiques suivantes.
L'imagerie en temps réel de l'injection d'anesthésique local permet d'évaluer la disposition correcte du liquide. La phase d'injection doit être effectuée avec de petites aliquotes d'anesthésique local (3 à 5 ml), avec une courte période autorisée entre chacune, pour permettre la manifestation de tout symptôme de toxicité systémique de l'anesthésique local (LAST) avant de continuer à administrer le médicament, conformément aux directives de l'American Society of Regional Anesthesia and Pain Medicine (ASRA).
De plus, l'administration de chaque aliquote doit être précédée d'une aspiration et doit progresser en faisant attention aux pressions d'injection d'ouverture ou aux plaintes de douleur ou de paresthésie dans la distribution du nerf cible.
Bien qu'il ait été démontré que l'échographie produit une probabilité plus faible de placement d'aiguille intravasculaire, une injection intravasculaire avec LAST peut toujours se produire. Il est donc impératif d'être conscient de l'emplacement des vaisseaux, qui ont une pression de distension si faible qu'une pression ordinaire à la surface du corps avec un transducteur oblitère entièrement leur lumière. Par conséquent, il est utile de dépister la présence de vaisseaux à l'aide du Doppler couleur lors de l'analyse pré-bloc. Cependant, de petits navires peuvent être manqués et la fonction Doppler se détériore à de plus grandes profondeurs.
Ainsi, il est impératif d'observer l'image échographique tout au long de l'injection pour mettre en évidence la propagation du tissu par la solution anesthésique locale à la pointe de l'aiguille. Le fait de ne pas visualiser une telle propagation suggère que la pointe de l'aiguille est hors du plan ou se trouve dans la lumière d'un vaisseau.
Le placement errant de l'aiguille a été décrit à la fois dans les vaisseaux et dans les nerfs. Moayeri et al, dans une étude basée sur des cadavres, ont montré que l'imagerie par ultrasons est sensible à l'injection dans le nerf périphérique, avec aussi peu que 0.5 ml provoquant des signes visibles de distension nerveuse. Une telle visualisation permet le retrait immédiat de l'aiguille, ce qui peut réduire le risque de lésion nerveuse, par rapport à l'injection d'un grand volume d'anesthésique local.
CONCLUSION
L'échographie a révolutionné le domaine de l'anesthésie régionale. L'application efficace de cette technologie nécessite une compréhension de l'anatomie bidimensionnelle, une imagerie optimale des nerfs et des structures anatomiques, un guidage précis de l'aiguille en temps réel et une administration précise d'anesthésique local. La combinaison de ces éléments permet de tirer le meilleur parti de cette puissante modalité d'imagerie, garantissant un succès élevé du bloc nerveux et une sécurité améliorée du patient, en particulier en ce qui concerne le LAST.
Références
- Kapral S, Krafft P, Eibenberger K, et al : Approche supraclaviculaire guidée par ultrasons pour l'anesthésie régionale du plexus brachial. Anesth Analg 1994;78:507–513.
- Marhofer P, Schrogendofer K, Koinig H, et al : le guidage ultrasonographique améliore le bloc sensoriel et le temps d'apparition des blocs trois en un. Anesth Analg 1997;85:854–857.
- Marhofer P, Schrogendofer K, Wallner T, et al : le guidage échographique réduit la quantité d'anesthésique local pour les blocs 3 en 1. Reg Anesth Pain Med 1998;23:584–588.
- Perlas A, Chan VW, Simons M : examen et localisation du plexus brachial par ultrasons et stimulation électrique. Anesthésiologie 2003 ;99 : 429–435.
- TA grise : Anesthésie régionale échoguidée. Anesthésiologie 2006 ; 104:368–373.
- Manickam BP, Perlas A, Chan VW, et al : Le rôle d'une enquête systématique pré-intervention dans l'anesthésie régionale guidée par échographie. Reg Anesth Pain Med 2008;33:566–570.
- Sites BD, Brull R : Guidage échographique en anesthésie régionale périphérique : philosophie, médecine factuelle et techniques. Curr Opin Anesth 2006;19:630–639.
- Sites BD, Chan VW, Neal JM, et al : Recommandations du comité mixte de l'American Society of Regional Anesthesia and Pain Medicine et de l'European Society of Regional Anesthesia and Pain Therapy pour l'éducation et la formation en anesthésie régionale guidée par ultrasons. Reg Anesth Pain Med 2010;35(Suppl 1):S74–80.
- Orebaugh SL, Bigeleisen PE, Kentor ML : Impact d'une rotation en anesthésie régionale sur l'identification échographique des structures anatomiques par les résidents en anesthésiologie. Acta Anaesth Scand 2009;53:364–368.
- Orebaugh SL, Williams BA, Kentor ML, et al : Bloc interscalène sous guidage échographique : Impact de l'expérience sur la performance des résidents. Acta Anaesth Scand 2009;53:1268–1274.
- Adhikary SD, Hadzic A, McQuillan PM : Simulateur pour l'enseignement de la coordination œil-main lors d'une anesthésie régionale guidée par échographie. Br J Anaesth 2013;111(5):844–845.
- Wegener JT, van Doorn T, Eshuis JH, et al : valeur d'un didacticiel électronique pour l'interprétation d'images en anesthésie régionale guidée par ultrasons. Reg Anesth Pain Med 2013;38:44–49.
- Woodworth GE, Chen EM, Horn JL, et al : Efficacité de la vidéo et de la simulation informatisées dans la formation en anesthésie régionale guidée par ultrasons. J Clin Anesth 2014;26:212–221.
- Sites BD, Spence BC, Gallagher JD, et al : Caractérisation du comportement novice associé à l'apprentissage de l'anesthésie régionale périphérique guidée par ultrasons. Reg Anesth Pain Med 2007;32:107–115.
- Sites BD, Spence BC, Gallagher J, et al : L'anesthésie régionale rencontre l'échographie : une spécialité en transition. ACTA Anaesthes Scand 2008;52:456–466.
- Speer M, McLennan N, Nixon C : Imagerie par ultrasons dans le plan de l'apprenant novice. Reg Anesth Pain Med 2013;38:350–352.
- Ball RD, Scouras NE, Orebaugh S, et al : Étude de simulation observationnelle prospective randomisée comparant les techniques d'échographie guidées par aiguille et à main levée des résidents pour l'accès au cathéter veineux central. Br J Anaesth 2012;108:72–79.
- Schafhalter-Zoppoth I, Gray AT : Le nerf musculocutané : Aspect échographique d'un bloc nerveux périphérique. Reg Anesth Pain Med 2005;30:385–390.
- Moayeri N, van Geffen GJ, Bruhn J, et al : Corrélation entre l'échographie, l'anatomie en coupe et l'histologie du nerf sciatique. Reg Anesth Pain Med 2010;35:442–449.
- Bonnel F : Anatomie microscopique du plexus brachial humain adulte : Une base anatomique et histologique pour la microchirurgie. Microchirurgie 1984;5:107–118.
- van Geffen GJ, Moayeri N, Bruhn J, et al : Corrélation entre l'imagerie par ultrasons, l'anatomie en coupe et l'histologie du plexus brachial. Reg Anesth Pain Med 2009;34:490–497.
- Moayeri N, Bigeleisen PE, Groen GJ : Architecture quantitative du plexus brachial et des compartiments environnants, et leur signification possible pour les blocs du plexus. Anesthésiologie 2008 ;108 : 299–304.
- Sylvestri E, Martinoli C, Derchi LE, et al : Échotexture des nerfs périphériques : Corrélations entre les résultats US et histologiques et les critères pour différencier les tendons. Radiologie 1995;197 : 291–296.
- McCartney CJ, Xu D, Constantinescu C, et al : Examen échographique des nerfs périphériques de l'avant-bras. Reg Anesth Pain Med 2007;32:434–439.
- Sites BD, Brull R, Chan VW, et al : Artefacts et erreurs pièges associés à l'anesthésie régionale guidée par ultrasons. Reg Anesth Pain Med 2007;32:419–433.
- Chin KJ, Perlas A, Chan VW, et al : Visualisation de l'aiguille dans l'anesthésie régionale guidée par ultrasons : défis et solutions. Reg Anesth Pain Med 2008;33:532–544.
- Hebard S, Hocking G : La technologie échogène peut améliorer la visibilité de l'aiguille lors d'une anesthésie régionale guidée par ultrasons. Reg Anesth Pain Med 2011;36:185–189.
- Rettig HC, Gielen MJ : Technique à main levée ou dispositif de guidage mécanique de l'aiguille ? [lettre] Reg Anesth Pain Med 2009;34:608–609.
- Tsui, C.-B. : Facilitation de l'alignement de l'aiguille dans le plan d'un faisceau d'ultrasons à l'aide d'une unité laser portable. Reg Anesth Pain Med 2007;32:84–88.
- Wong SW, Niazi AU, Chin KJ, et al : rachianesthésie guidée par ultrasons en temps réel à l'aide du système de suivi des aiguilles SonixGPS. Can J Anaesth 2013;60:50–53.
- Wiesmann T, Borntrager A, Zoremba M, et al : technologie d'imagerie composée et conception d'aiguilles échogènes. Reg Anesth Pain Med 2013 ; 38:452–455.
- Soong J, Schafhalter-Zoppoth I, Gray AT : L'importance de l'angle du transducteur pour la visibilité échographique du nerf fémoral. Reg Anesth Pain Med 2005;30:505.
- Alakkad H, Chin KJ : L'importance d'une bonne technique d'aiguilletage dans le bloc axillaire guidé par échographie. Reg Anesth 2013;38(2):166.
- Bigeleisen PE1, Moayeri N, Groen GJ. Seuils de stimulation extraneurale versus intraneurale lors d'un bloc supraclaviculaire échoguidé. Anesthésiologie. 2009;110:1235–43.
- Hadzic A, Dilberovic F, Shah S, Kulenovic A, Kapur E, Zaciragic A, Cosovic E, Vuckovic I, Divanovic KA, Mornjakovic Z, Thys DM, Santos AC. La combinaison d'une injection intraneurale et d'une pression d'injection élevée entraîne des lésions fasciculaires et des déficits neurologiques chez le chien. Reg Anesth Pain Med 2004;29:417–23.
- Auroy Y, Benhamou D, Bargues L : Complications majeures de l'anesthésie locorégionale en France. Anesthésiologie 2002 ;97 :1274–1280.
- Perlas A, Niazi A, McCartney C, et al : La sensibilité de la réponse motrice à la stimulation nerveuse et à la paresthésie pour la localisation nerveuse telle qu'évaluée par ultrasons. Reg Anesth Pain Med 2006;31:445–450.
- Beach ML, Sites BD, Gallagher JD : L'utilisation d'un stimulateur nerveux n'améliore pas l'efficacité du bloc supraclaviculaire échoguidé. J Clin Anesth 2006;18:580–584.
- Chan VW, Perlas A, McCartney CJ, et al : le guidage échographique améliore le taux de réussite du bloc du plexus brachial axillaire. Can J Anaesth 2007;54:176–182.
- Sites BD, Beach ML, Chinn CD, et al : une comparaison des pertes sensorielles et motrices après un bloc du nerf fémoral réalisé avec des ultrasons par rapport aux ultrasons et à la stimulation nerveuse. Reg Anesth Pain Med 2009;34:508–513.
- Robards C, Hadzic A, Somasundraram L, et al : Injectine intraneurale avec stimulation à faible courant pendant le bloc du nerf sciatique poplité. Anesthésie Analg
2009; 109: 673-677. - Sigenthaler A, Moriggl B, Mlekusch S, et al : bloc nerveux suprascapulaire guidé par ultrasons : description d'une nouvelle approche supraclaviculaire. Reg Anesth Pain Med 2012;37:325–328.
- Hanson NA, Auyong DB : Identification échographique systématique des nerfs scapulaires dorsaux et longs thoraciques lors du bloc interscalénique. Reg Anesth Pain Med 2013;38:54–57.
- Karmakar MK, Ho AM, Li X, et al : bloc du plexus lombaire guidé par ultrasons à travers la fenêtre acoustique du trident d'échographie lombaire. Br J Anaesth 2008;100:533–537.
- Gadsden J, Latmore M, Levine DM, Robinson A : Une pression d'injection d'ouverture élevée est associée au contact aiguille-nerf et aiguille-fascia pendant le bloc du nerf fémoral. Reg Anesth Pain Med 2016;41(1):50–55.
- Gadsden JC, Choi JJ, Lin E, Robinson A : La pression d'injection d'ouverture détecte systématiquement le contact aiguille-nerf pendant le bloc du plexus brachial interscalénique guidé par échographie. Anesthésiologie 2014;120(5):1246–1253.
- Brull R, MacFarlane AJ, Parrington SJ, et al : L'injection circonférentielle est-elle avantageuse pour le bloc du nerf sciatique poplité guidé par échographie ? Reg Anesth Pain Med 2011;36:266–270.
- Spence BC, Beach ML, Gallagher JD, et al : Blocs interscalènes guidés par ultrasons : Comprendre où injecter l'anesthésique local. Anesthésie 2011;66(6):509–514.
- Neal JM, Bernards CM, Butterworth JF, et al : ASRA pratique consultatif sur
toxicité systémique des anesthésiques locaux. Reg Anesth Pain Med 2010;35:350–352. - Abrahams MS, Aziz MF, Fu RF, et al : Guidage par ultrasons par rapport à la neurostimulation électrique pour le bloc nerveux périphérique : une revue systématique et une méta-analyse d'essais contrôlés randomisés. Anaesth 2009 ;102 : 408–417.
- Zetlaoui PJ, Labbe JP, Benhamou D : Le guidage échographique du bloc du plexus axillaire n'empêche pas l'injection intravasculaire [lettre]. Anesthésiologie 2008;109:761.
- VadeBancouer TR, Weinberg GL, Oswald S, et al : Détection précoce d'une injection intravasculaire lors d'une échographie supraclaviculaire brachiale
bloc plexique. Reg Anesth Pain Med 2008;33:278–279. - Liu SS, YaDeau JT, Shaw PM, et al : Incidence des injections intraneurales non intentionnelles et des complications neurologiques postopératoires avec des blocs nerveux interscalènes et supraclaviculaires guidés par ultrasons. Anesthésie 2011 ; 66 : 1365–2044.
- Hara K, Sakura S, Yokokawa N, et al : Incidence et effets de l'injection intraneurale involontaire pendant le bloc du nerf sciatique sous-glutéal guidé par échographie. Reg Anesth Pain Med 2012;37:289–293.
- Krediet AC, Moayer N, Bleys RL, et al : Intraneural ou extraneural : Précision diagnostique ou évaluation échographique de la localisation d'une injection à faible volume. Reg Anesth Pain Med 2014;39:409–413.