1. CONSIDÉRATIONS HISTOLOGIQUES
Tous les os sont constitués d'os cortical périphérique (compact) et d'os médullaire central (trabéculaire ou spongieux). Dans les os longs, il existe une relation inverse entre la quantité d'os cortical et spongieux en un site donné : dans la diaphyse, l'os cortical est épais alors que l'os trabéculaire est clairsemé ; à l'inverse, les régions métaphysaires et épiphysaires sont caractérisées par un os cortical fin et un os spongieux proéminent. En plus des trabécules osseuses, la cavité médullaire contient de la moelle osseuse, y compris de la moelle jaune (abritant de la graisse et du tissu conjonctif) et de la moelle rouge (constituée de cellules hématopoïétiques, de graisse et de tissu conjonctif). La distribution de la moelle hématopoïétique et graisseuse dépend de l'âge et de l'état métabolique (Ricci et al. 1990). La surface externe de l'os cortical est investie par le périoste - une couche de tissu conjonctif fibreux dense qui est ancrée à l'os cortical au moyen de fibres de Sharpey perforantes - qui joue un rôle dans la guérison rapide des fractures. L'épaisseur du périoste varie selon l'âge : il est plus épais et plus actif chez l'enfant. Les artères nourricières et les veines émissaires traversent l'os cortical à travers les foramens nourriciers. Dans les os longs matures, ils sont le plus souvent observés au niveau de la diaphyse. En termes d'histogenèse, l'os se développe à partir de deux processus distincts appelés ossification intramembraneuse et endochondrale (Erickson 1997). L'ossification intramembraneuse se produit par minéralisation directe du tissu conjonctif vasculaire et est responsable de la croissance des os plats ; il contribue également à la largeur de la tige des os longs. L'ossification endochondrale survient dans un modèle de cartilage et est responsable de la croissance longitudinale des os longs et de la formation du squelette axial (Fig. 1).
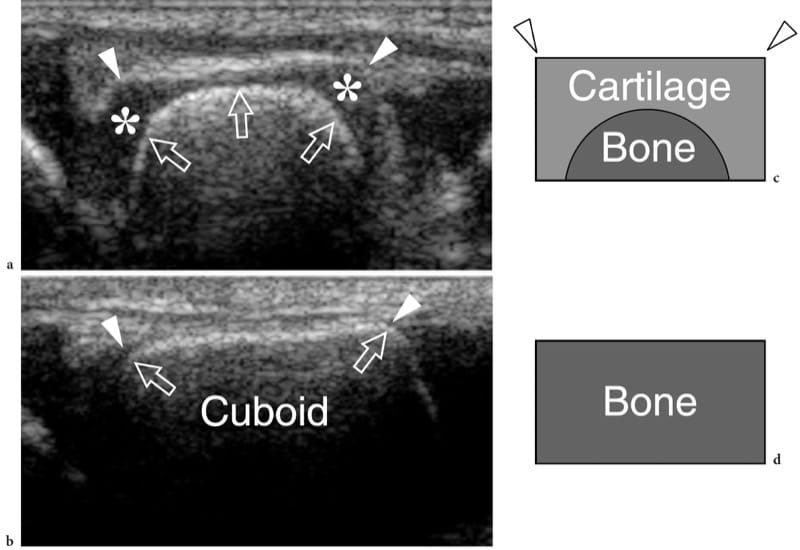
Figure 1. a–d. Ossification endochondrale. a,b Les images coronales 12–5 MHz US sur le médio-pied latéral avec corrélation de dessin schématique c,d montrent le cuboïde en croissance à a,c 1 an et b,d à la fin du développement. Le cuboïde est un os carré à angles droits (pointes de flèches). Initialement, le cartilage (astérisques) forme un modèle carré reflétant l'aspect définitif de l'os. Le centre primaire d'ossification est visible au centre du futur os sous la forme d'une image arrondie hyperéchogène (flèches). Au cours de la croissance, l'ossification endochondrale progresse vers chaque extrémité du modèle cartilagineux. Au terme de ce processus, le centre primaire a atteint les extrémités du modèle cartilagineux et prend la forme carrée définitive.
2. ANATOMIE AMÉRICAINE NORMALE ET TECHNIQUE DE NUMÉRISATION
Il ne fait aucun doute que la radiographie est la modalité d'imagerie de première intention pour l'évaluation des troubles osseux : elle permet une évaluation panoramique, peu coûteuse et reproductible de l'os. Une analyse plus précise peut être obtenue au moyen de la tomodensitométrie, en particulier si des zones anatomiques complexes doivent être examinées. Alors que la tomodensitométrie permet une évaluation optimale du cortex osseux, l'IRM est la technique de choix pour évaluer la moelle osseuse. L'échographie a des limites intrinsèques dans l'évaluation de l'os. Dans certaines applications, cependant, il peut être utile d'évaluer des troubles osseux sélectionnés, en particulier s'il est réalisé en complément des radiographies standard (Cho et al. 2004). Avec l'échographie, l'interface entre les tissus mous et l'os cortical est hautement échogène en raison d'une inadéquation inhérente de l'impédance acoustique élevée (Erickson 1997). Le cortex osseux apparaît comme une ligne hyperéchogène lumineuse continue régulière avec une forte ombre acoustique postérieure et un certain artefact de réverbération (Fig. 2). Les structures plus profondes, telles que l'architecture corticale interne, l'endosteum et l'os trabéculaire sous-jacent, restent inaccessibles à l'échographie, à l'exception de rares conditions pathologiques dans lesquelles le cortex est extrêmement aminci ou détruit dans toute son épaisseur. Chez les adultes normaux, le périoste ne peut pas être détecté comme une structure distincte avec les États-Unis. En utilisant des sondes à très haute fréquence, il peut apparaître comme une fine ligne hypoéchogène apposée au cortex osseux à certains endroits chez les enfants.
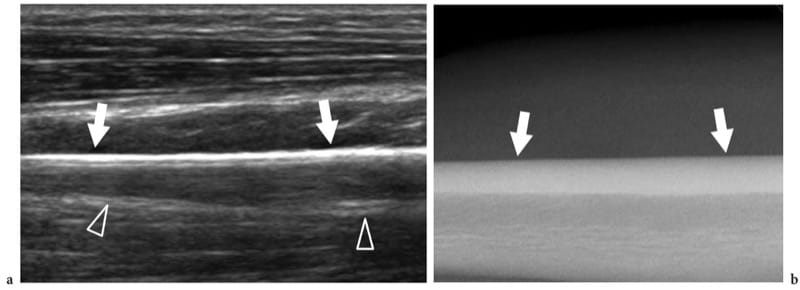
Figure 2.a,b. Aspect échographique de l'os normal : échotexture de surface. a Une image longitudinale 12–5 MHz US obtenue sur la diaphyse du radius avec une corrélation radiographique b montre la surface osseuse comme une ligne hyperéchogène droite continue (flèches) produite par une forte réflexion du son en raison de la différence marquée d'impédance acoustique de la moelle tissus et os. Un artefact de réverbération (pointes de flèches) projetant dans l'ombre au-delà de l'os peut être vu.
Compte tenu de l'aspect droit et continu de l'écho brillant du cortex osseux, de subtiles irrégularités de surface et des sites de pénétration des vaisseaux nutritifs peuvent être visualisés (Fig. 3). Une technique de balayage soignée et l'imagerie Doppler permettent une représentation aisée des vaisseaux pénétrant dans l'os. L'ombrage acoustique postérieur des sésamoïdes ou des calcifications situées en relation étroite avec la surface osseuse peut mimer des ruptures corticales. Les plaques de croissance dans le squelette immature peuvent également ressembler à une discontinuité focale de la surface osseuse : elles peuvent être distinguées des fractures en raison de leur emplacement anatomique particulier (Fig. 4). Des ostéophytes marginaux ou des éperons osseux peuvent se projeter sur le cortex imitant les ruptures focales. Une intervention chirurgicale antérieure peut également affecter la continuité du cortex. Des interruptions focales de la ligne corticale hyperéchogène sont observées après la construction de tunnels osseux, comme dans la chirurgie de reconstruction ligamentaire ou après l'ablation de vis et de broches. Une corrélation étroite avec les radiographies standard permet un diagnostic définitif dans presque toutes les circonstances décrites ci-dessus.
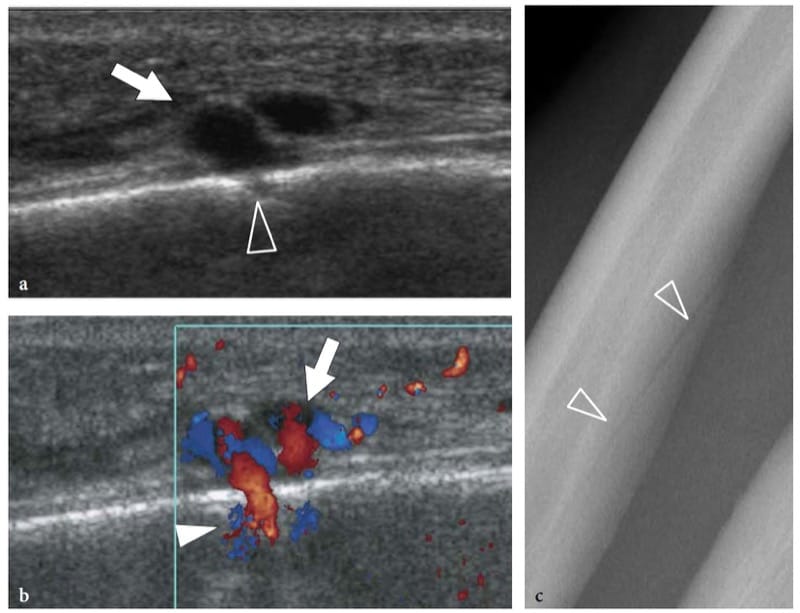
Figure 3. a–c. Aspect échographique de l'os normal : vaisseaux nourriciers. a,b Les images échographiques longitudinales a en niveaux de gris et b couleur Doppler 12–5 MHz sur la diaphyse de l'ulna révèlent une petite cassure (tête de flèche) dans la surface osseuse traversée par des vaisseaux nutritifs (flèche). Cette découverte ne doit pas être confondue avec des fractures ou des érosions. c La corrélation radiographique montre un canal nutritif (têtes de flèches) perçant obliquement la diaphyse ulnaire.
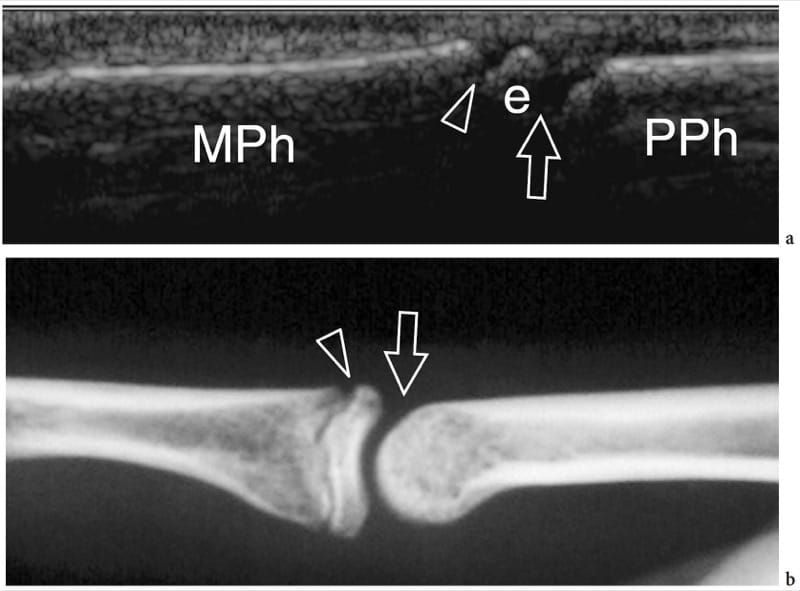
Figure 4.a,b. Développement osseux. a Image échographique longitudinale 12–5 MHz sur l'articulation interphalangienne proximale chez un garçon de 10 ans avec une corrélation radiographique b montrant la base (e) de la phalange moyenne (MPh) séparée de la tête de la phalange proximale (PPh) par une large cassure de l'os cortical due à l'espace articulaire (flèche). Une autre cassure hypoéchogène plus petite (tête de flèche) sépare la diaphyse de la base de la phalange moyenne. Il est lié à la plaque de croissance (physis), qui est chargée de permettre à la tige de l'os de s'allonger jusqu'à l'obtention d'une croissance complète. L'épiphyse fusionne avec la diaphyse par l'os lorsque la plaque de croissance cartilagineuse s'ossifie.
Une variété de projections focales (tubérosités, crêtes, etc.) et de défauts (fosses, sulci) de l'os modulent la surface corticale ; elles sont souvent associées à une insertion tendineuse ou ligamentaire (tubérosités, crêtes) ou à une réflexion tendineuse et nerveuse (sulci). Les États-Unis peuvent les apprécier comme des excroissances ou des dépressions du contour cortical autrement droit (Fig. 5). Dans certains cas, ces altérations sont des repères utiles pour orienter la sonde de manière plus appropriée lors de la numérisation des structures articulaires et para-articulaires. La variation anatomique de la forme et de la taille des sillons et des tubercules peut également avoir une pertinence clinique et peut être facilement appréciée par échographie. Les sillons osseux peu profonds prédisposent à l'instabilité du tendon lors de la contraction musculaire et du mouvement articulaire (Levinsohn et Santelli 1991). L'hypertrophie des tubercules qui agissent comme des poulies de réflexion pour les tendons entraîne des frottements locaux lors des mouvements et le développement d'une ténosynovite sténosante. Au membre inférieur, la mesure de l'angle de torsion des os longs a une valeur clinique car des états pathologiques peuvent affecter la fonction articulaire et la prédisposer à des modifications dégénératives. Les mesures d'angle de torsion peuvent être effectuées en collectant des images américaines transversales en série au niveau des épiphyses proximales et distales. L'évaluation de la rétroversion tibiale et de l'antéversion fémorale a été rapportée avec l'échographie : dans ce contexte, les résultats de l'échographie se sont avérés bien corrélés avec les résultats de la tomodensitométrie (Kumar et al. 1992 ; Pasciak et al. 1996 ; Ehrenstein et al. 1999). Après enclouage centromédullaire fermé des fractures fémorales, la détection peropératoire des anomalies de torsion par échographie peut éviter un second regard chirurgical au patient (Ehrenstein et al. 1999).
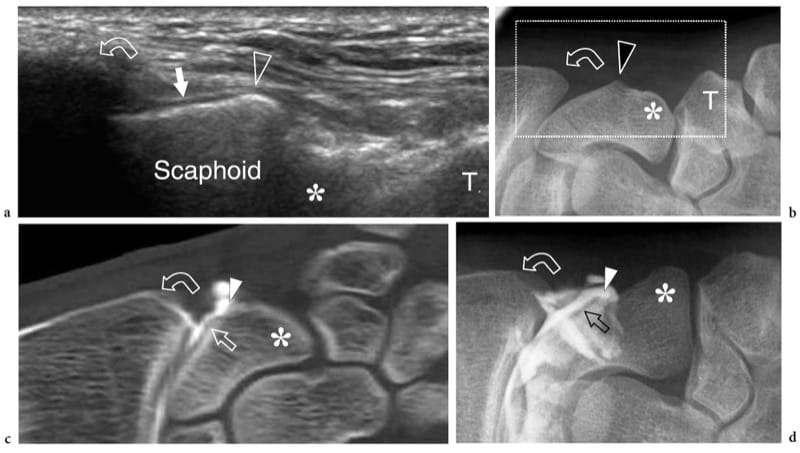
Figure 5. a–d. Aspect échographique de l'os normal : détails de surface. a Image coronale 12–5 MHz US obtenue sur la face latérale du scaphoïde avec une radiographie antéropostérieure corrélative du poignet radial montrant une projection focale émoussée de l'os (tête de flèche) à sa taille émergeant de sous la styloïde radiale (flèche incurvée) et séparant la surface articulaire proximale recouverte de cartilage hyalin (flèche) de la partie extra-articulaire de l'os. Distalement, notez le tubercule scaphoïde (astérisque) dans un endroit plus profond. T, trapèze. Le champ de vision de l'image US est indiqué par un rectangle en pointillés en b. c Arthroscanner coronale reformaté et d arthrographie conventionnelle antéropostérieure obtenue après injection intra-articulaire de produit de contraste dans l'articulation radiocarpienne montrent la relation des repères décrits ci-dessus avec les parties intra- et extra-articulaires de la surface scaphoïdienne.
Les anomalies de la surface osseuse affichées à l'échographie peuvent refléter une pathologie osseuse sous-jacente (Fig. 6). Sur la base des découvertes américaines, ces anomalies peuvent être arbitrairement divisées en : "excroissances" ou "images plus", qui sont des projections focales d'os s'extrudant dans les tissus mous (Fig. 6b); les « irrégularités du contour cortical », qui sont des ruptures focales ou des déformations en palier de l'écho cortical (Fig. 6c); et les "défauts" ou "images en moins", qui sont des irrégularités du contour cortical associées à des lésions se développant depuis l'intérieur de l'os ou à des lésions s'étendant à l'extérieur de l'os et l'envahissant plus tard (Fig. 6d). Bien que le diagnostic de la pathologie osseuse repose principalement sur les radiographies conventionnelles, la tomodensitométrie et l'imagerie par résonance magnétique, les échographistes doivent être conscients de l'apparition aux États-Unis d'anomalies osseuses fondamentales car les radiographies ne sont pas toujours disponibles au moment de l'examen échographique ; de plus, à la radiographie, des lésions subtiles peuvent être masquées par la courbure de l'os et des structures sus-jacentes. Ce sont les principales raisons pour lesquelles l'os doit invariablement être contrôlé lors d'un examen américain standard du système musculo-squelettique. Les anomalies osseuses observées aux États-Unis peuvent facilement être corrélées avec les résultats cliniques et peuvent suggérer la nécessité de vues radiographiques supplémentaires ou d'autres études d'imagerie si une évaluation plus approfondie est justifiée.
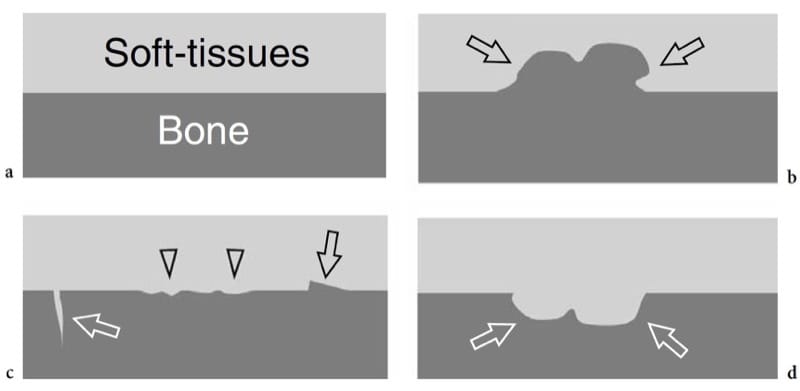
Figure 6. a–d. Anomalies de la surface osseuse détectables par échographie. a Os normal : une interface droite et régulière sépare l'os des tissus mous. b Excroissances ou « images plus » : une projection focale de l'os (flèches) est observée dans les tissus mous. c Irrégularités du contour cortical : l'interface os-tissu mou est rugueuse (têtes de flèches) ; des cassures focales (flèche blanche) ou des déformations en escalier (flèche noire) peuvent être observées. d Défauts ou « images en moins » : une perte osseuse focale (flèches) est observée. Les tissus mous interviennent dans le défaut.
3. EXCROISSANCES
Variantes anatomiques
Les lésions plus peuvent être liées à des variantes anatomiques normales qui peuvent devenir symptomatiques en raison de la compression exercée sur les structures des tissus mous adjacents. Le rôle de l'échographie dans l'évaluation des variants osseux est double : les détecter et révéler les modifications pathologiques associées dans les tissus mous adjacents. L'échographie est non seulement capable de démontrer la relation entre l'excroissance osseuse anormale et les tissus mous environnants, mais elle peut également évaluer l'empiétement tendineux ou nerveux lors d'un balayage dynamique. Parmi les exemples possibles d'excroissances osseuses qui représentent des variantes anatomiques, le processus supracondylien est une excroissance osseuse rare qui provient de la face médiale de la diaphyse humérale distale (Sener et al. 1998 ; Subasi et al. 2002). Elle peut donner naissance à une bande fibreuse épaisse (ligament de Struthers) s'insérant dans l'épiphyse humérale distale. En raison de la relation étroite avec le nerf médian, le processus et le ligament adjacent peuvent provoquer un syndrome de compression nerveuse. Le tubercule péronier du calcanéum est une petite crête osseuse qui donne insertion au rétinaculum péronier inférieur et sépare le court fibulaire des tendons du long péronier. L'hypertrophie congénitale du tubercule apparaît à l'examen physique comme une masse ferme située juste en dessous de l'extrémité de la malléole latérale. Le frottement chronique d'un tubercule hypertrophié avec les tendons adjacents peut provoquer une ténosynovite sténosante ou une rupture de tendon (Bruce et al. 1999 ; Wang et al. 2005).
4. EXOSTOSES OSSEUSES
Les exostoses osseuses (ostéochondromes) sont des tumeurs bénignes issues, le plus souvent, de la métaphyse des os longs. Ils sont constitués d'un éperon osseux dont la coiffe est recouverte de cartilage hyalin. L'exostose peut être solitaire ou multiple, cette dernière condition étant connue sous le nom d'exostose héréditaire multiple (Murphey et al. 2000 ; Stieber et Dormans 2005). La plupart des ostéochondromes solitaires surviennent dans le fémur distal, le tibia proximal et l'humérus proximal. Ils peuvent devenir symptomatiques en raison d'un impact sur les structures des tissus mous adjacents, tels que les nerfs, les tendons et les vaisseaux ou, plus rarement, en raison de modifications néoplasiques (chondrosarcome) survenant dans la coiffe cartilagineuse. Dans d'autres cas, les exostoses peuvent entraîner la formation d'une bourse synoviale enflammée à la suite d'une friction chronique. L'échographie montre des exostoses comme des excroissances d'os hyperéchogène recouvertes de cartilage hypoéchogène (Fig. 7). La composante osseuse de l'exostose apparaît comme une ligne hyperéchogène continue, tandis que la coiffe cartilagineuse est constituée d'une couche hypoéchogène pouvant contenir des foyers hyperéchogènes avec une ombre acoustique postérieure liée aux calcifications du cartilage (Murphey et al. 2000). Il a été démontré que l'échographie permet une mesure précise de l'épaisseur de la calotte cartilagineuse, un facteur lié au risque de dégénérescence sarcomateuse (Malghem et al. 1992). Les principales limites de l'échographie sont son incapacité à évaluer les lésions profondes inaccessibles à la sonde et l'analyse de la composante osseuse de la lésion (Murphey et al. 2000). Une compression locale exercée sur les tissus mous adjacents peut être diagnostiquée par échographie. La thrombose veineuse profonde, l'insuffisance artérielle, la formation de bourse synoviale et la bursite (bursa exostosica) sont des signes associés détectables par l'échographie en échelle de gris et l'imagerie Doppler (Fig. 8) ( El – Khoury et Bassett 1979 ; Keeling et al. 1993 ; de Matos et al. 1983).
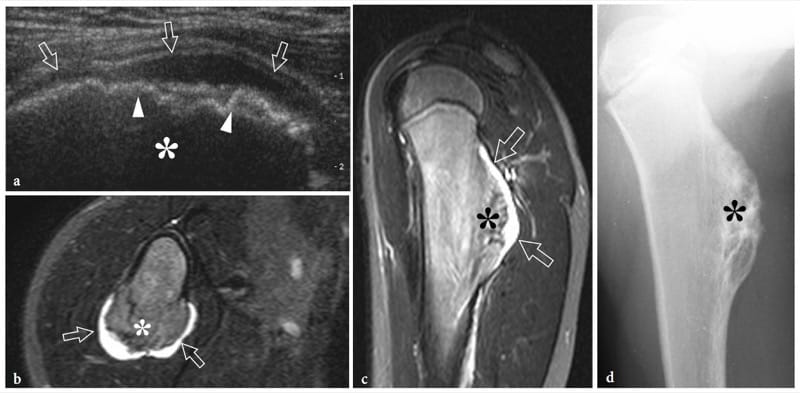
Figure 7. a–d. Ostéochondrome sessile. une image échographique longitudinale 12–5 MHz sur le bras droit proximal chez un enfant de 8 ans présentant un gonflement local indolore révèle une projection large de l'humérus (astérisque) caractérisée par des contours irréguliers (têtes de flèches) et une coiffe hypoéchogène continue ( flèches) fusionnant sans interruption avec la surface externe de l'os. Les images IRM corrélatives transversales b et sagittales c en pondération T2 révèlent un ostéochondrome à base large naissant de la corticale postérieure de la diaphyse proximale de l'humérus droit recouvert d'une zone de haute intensité de signal (flèches) en rapport avec la coiffe cartilagineuse. L'imagerie IRM b,c et le film simple d confirment que le cortex de l'os hôte fusionne sans interruption avec le cortex de la tumeur et que la partie médullaire (astérisque) communique avec la cavité médullaire de l'humérus adjacent.
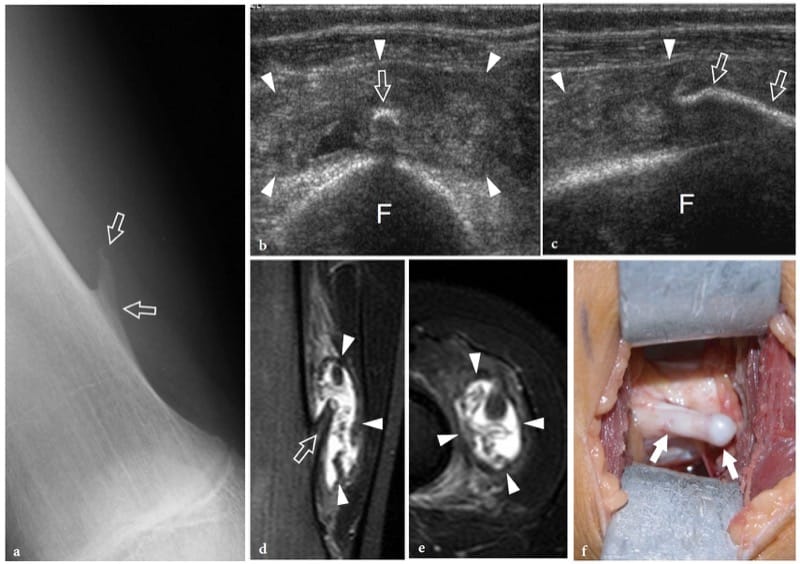
Figure 8. a–f. Exostose osseuse. une radiographie antéropostérieure du fémur droit distal montre une exostose en forme de piqûre (flèches) provenant du côté médial de la diaphyse chez un garçon de 13 ans avec un gonflement local, une sensibilité et une douleur augmentant progressivement. b Les images américaines transversales et c longitudinales à 12–5 MHz obtenues par rapport à la découverte radiographique avec une corrélation d'imagerie IRM pondérée en T2 avec suppression de la graisse d coronale et transversale montrent l'exostose (flèches) comme une projection osseuse mince anormale provenant du fémur (F) arbre. Une énorme réaction de bourse (têtes de flèches) contenant du tissu fluide et inflammatoire avec des frondes est observée autour de l'exostose. L'échographie dynamique permet une évaluation aisée du caractère compressible de la bourse, excluant une éventuelle transformation maligne en chondrosarcome. f La vue opératoire macroscopique du même cas montre l'exostose (flèches).
5. DÉFAUTS
L'échographie peut détecter une variété de lésions « moins » allant de petites érosions para-articulaires causées par une synovite chronique à de grands défauts post-traumatiques. L'un des défauts osseux les plus courants est la lésion de Hill-Sachs, une fracture compressive de la tête humérale qui fait suite à une luxation antérieure de l'épaule. La lésion dérive de l'action traumatique du bord antérieur aigu de la glène contre la face postérolatérale de la tête humérale luxée. L'échographie s'est avérée être une modalité efficace pour détecter une lésion de Hill-Sachs et évaluer sa taille et sa profondeur (Cicak et al. 1998 ; Pancione et al. 1997 ; Farin et al. 1996). Par rapport à la chirurgie, l'échographie a une sensibilité de 96 %, une spécificité de 100 % et une précision de 97 % dans le diagnostic (Cicak et al. 1998). La fracture de McLaughlin est le pendant de la lésion de Hill-Sachs chez les patients présentant une luxation postérieure de l'épaule ; il est situé sur la face antérieure de la tête humérale et résulte de l'impaction de la tête humérale luxée postérieurement contre le rebord glénoïdien postérieur. Un degré élevé de suspicion est nécessaire pour détecter les fractures de Hill-Sachs et de McLaughlin, car elles peuvent facilement passer inaperçues lors d'une échographie de routine de l'épaule. Les deux sont détectés comme des encoches triangulaires de la surface osseuse ; du fait de leur localisation intra-articulaire, elles peuvent être comblées par un épanchement synovial. Une fois détectée, une évaluation minutieuse de la taille de la fracture est obligatoire car des lésions plus importantes sont très probablement associées à une luxation récurrente.
6. IRRÉGULARITÉS DU CONTOUR CORTICAL
Les irrégularités de la surface osseuse font généralement référence à des fractures et des érosions.
7. FRACTURES AIGUËS
Il est admis que l'échographie n'est pas la modalité d'imagerie de première ligne pour détecter les fractures osseuses aiguës. En phase aiguë, les radiographies simples permettent de diagnostiquer la majorité des fractures et d'évaluer le déplacement des extrémités osseuses. La tomodensitométrie peut être réalisée dans des cas sélectionnés (fractures du plateau tibial, de la ceinture pelvienne ou du rachis, etc.) lorsque l'anatomie locale complexe entraîne un chevauchement osseux sur les radiographies conventionnelles. Grâce à des algorithmes d'acquisition volumétrique, CT est capable de détecter avec précision le nombre de fragments de fracture et leur position. Les images reformatées dans les plans sagittal et coronal peuvent fournir une carte précise des lignes de fracture. De plus, la tomodensitométrie à collimation fine permet d'identifier de petites fractures non déplacées qui peuvent facilement passer inaperçues sur les clichés simples (apophyse latérale du talus, fractures de l'apophyse transverse, etc.). Contrairement à la tomodensitométrie, l'IRM a un rôle marginal dans l'évaluation des fractures aiguës : dans la plupart des cas, les fractures identifiées par l'IRM sont des découvertes fortuites chez des patients examinés pour d'éventuelles lésions des tissus mous. Cette technique semble cependant supérieure à la TDM pour le bilan des fractures non déplacées du col fémoral et de l'épiphyse tibiale proximale ainsi que pour la détection des fractures de fatigue.
L'échographie peut être utile pour détecter les fractures dans les cas où la fracture n'était pas détectée lors de l'examen radiographique initial. En général, les patients souffrant de douleurs localisées persistantes sont soumis à un examen américain 2 à 3 semaines après le traumatisme pour exclure des lésions des tissus mous. À l'échographie, les fractures apparaissent comme des ruptures focales de la ligne corticale hyperéchogène, généralement associées à un épaississement périosté et à un hématome sous-périosté (Fig. 9) : les fractures ne doivent pas être confondues avec des ruptures corticales liées au passage des vaisseaux nourriciers. Dans tous les cas, les résultats des États-Unis nécessitent une comparaison avec les films simples, l'examen physique et les antécédents du patient. Dans les fractures aiguës, une pression locale sur la fracture, appliquée soit avec la sonde, soit avec les doigts, génère de la douleur. Plusieurs rapports ont décrit l'utilité de l'échographie dans le diagnostic des fractures non déplacées difficiles à voir sur les radiographies standard, telles que celles du tubercule majeur (Patten et al. 1992), du scaphoïde (Hodgkinson et al. 1993 ; Munk et al. 2000 ; Herneth et al. 2001 ; Hauger et al. 2002 ; Senall et al. 2004), tibia, y compris la fracture dite de Segond (Boutry et al. 2005 ; Lewis et Logan 2006), cuboïde (Wang et al. 1999 ; Enns et al. 2004), du processus latéral du talus (Copercini et al. 2003), du processus antérosupérieur du calcanéum (Boutry et al. 2006) et de l'os péronier (Brigido et al. 2005). Au niveau du thorax, l'échographie peut aider à différencier les fractures des côtes des métastases (Griffith et al. 1999 ; Hurley et al. 2004). Plusieurs articles ont souligné l'utilité de l'échographie pour détecter les fractures dans le squelette immature des enfants (Markowitz et al. 1992 ; Steiner et Sprigg 1992 ; Hubner et al. 2000 ; Kayser et al. 2003). Dans des contextes spécifiques, l'échographie est un moyen efficace pour détecter l'interposition de tissus mous dans la ligne de fracture qui peuvent interférer avec la cicatrisation, ainsi que pour identifier le conflit nerveux entre des fragments de fracture ou à l'intérieur d'un cal (Bodner et al. 1999, 2001 ; Tukenmez et al. 2006).
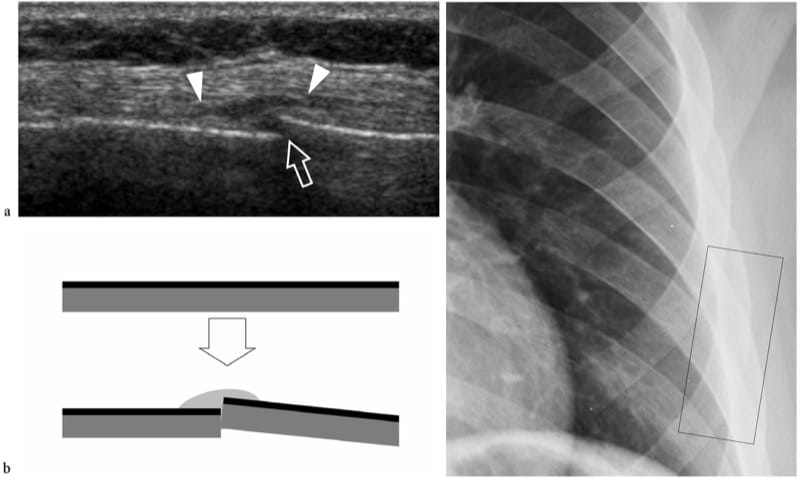
Figure 9. a–c. Fracture occulte. a Image échographique 12 MHz grand axe sur la sixième côte gauche avec une corrélation de dessin schématique b chez un patient se plaignant de douleur locale persistante après une chute montre une discontinuité (flèche) de la surface de la côte avec un œdème des tissus mous sus-jacent (têtes de flèche ) en raison d'une fracture. Le site de la fracture était extrêmement douloureux lors de l'application d'une pression avec la sonde dessus. c La radiographie thoracique obtenue 1 semaine plus tôt n'a montré aucune anomalie osseuse. Le rectangle noir indique le positionnement de la sonde US.
8. FRACTURES DE STRESS
Les fractures de stress résultent de forces de stress répétitives transférées à l'os; elles peuvent être divisées en fractures de fatigue et en fractures d'insuffisance. Les fractures de fatigue se produisent lorsque l'os normal subit une surutilisation répétitive mettant l'accent sur la distalité du site de fracture. Les fractures par insuffisance impliquent des os affaiblis qui sont plus vulnérables aux contraintes normales ; ces fractures s'observent chez les femmes âgées atteintes d'ostéoporose et concernent, dans la plupart des cas, le calcanéus et les métatarsiens. D'autre part, les fractures de fatigue impliquent généralement les membres inférieurs chez les sportifs ; ils peuvent résulter d'impacts importants pendant la course et le saut ou d'une pratique prolongée du vélo ou de la marche. Sur les radiographies simples, le diagnostic précoce des fractures par insuffisance non déplacées n'est pas envisageable car le cal n'est pas encore calcifié. L'échographie peut être utile pour évaluer les fractures de fatigue métatarsiennes précoces (Howard et al. 1992 ; Bodner et al. 2005). Dans les fractures de stress, l'échographie met en évidence une tuméfaction des tissus mous et une hyperémie locale, alors que le trait de fracture n'est pas visible (continuité préservée du contour cortical). Une fine bande hypoéchogène recouvrant le cortex est souvent observée à la suite d'une réaction périostée et d'une inflammation (Fig. 10). Plus tard, de subtils dépôts calcifiés peuvent être observés sur l'os reflétant la formation initiale de callosités (Fig. 11). Dans le cadre clinique approprié, nous pensons que l'aspect américain des fractures de stress est plutôt spécifique. Dans les cas positifs, le patient est traité avec du repos et des analgésiques jusqu'à la résolution des symptômes. L'examen par IRM peut être limité aux patients dont l'examen échographique est négatif ou dont les résultats échographiques sont positifs et qui ne répondent pas à un traitement approprié.
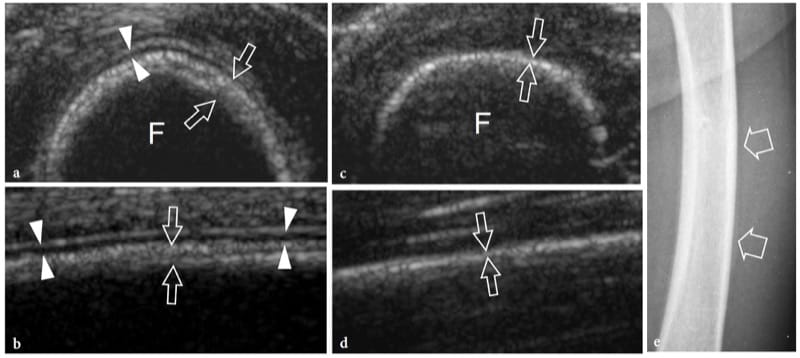
Figure 10. a–e. Réaction de stress. a Une image échographique transversale et b longitudinale à 12–5 MHz sur la diaphyse médiane du fémur gauche (F) chez un enfant de 1 an après un traumatisme contondant montre une couche hypoéchogène droite recouvrant le cortex liée à l'élévation et à l'épaississement du périoste (pointes de flèches). Un épaississement et un délaminage concomitants de l'écho cortical sous-jacent (flèches) peuvent être appréciés. Ces caractéristiques indiquent une réaction de stress post-traumatique de l'os. c,d Images US correspondantes obtenues du côté sain pour comparaison. Notez l'aspect plus mince de la surface corticale (flèches) et le manque de visibilité du périoste. e La radiographie de face de la diaphyse fémorale ne révèle aucune anomalie osseuse.
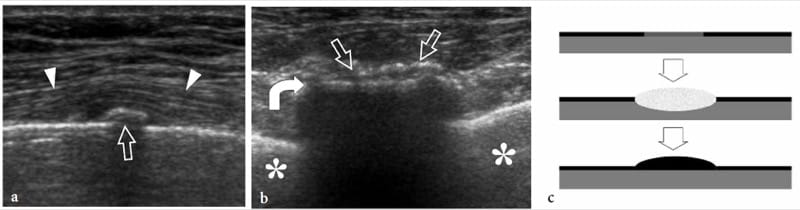
Figure 11. a–c. Fracture de stress. a Les images échographiques 12 MHz à axe long et b à axe court sur la septième côte chez un patient qui a subi un traumatisme thoracique latéral 2 semaines plus tôt montrent une formation osseuse périostée subtile (flèches droites) sur la surface osseuse (flèche incurvée) et une légère élévation des tissus (têtes de flèches) indiquant le site de la fracture. La radiographie initiale était négative. Astérisque, poumon. c Le dessin schématique illustre le pathomécanisme d'une lésion de stress impliquant une zone osseuse limitée en l'absence d'une ligne franche de fracture corticale (image du haut). La mécanique altérée conduit à la formation d'un périoste focal et d'un œdème médullaire (image du milieu) avec un nouveau dépôt final de calcification dans le périoste au-dessus du site impliqué (image du bas).
9. GUÉRISON DES FRACTURES
Dans les fractures aiguës des os longs, l'échographie s'est avérée plus sensible que la radiographie conventionnelle pour montrer les premières phases d'organisation du cal et sa progression vers le pontage de l'os nouveau, prédisant ainsi si le développement du cal est normal ou retardé (Craig et al. 1999). Dans les fractures radiales distales extra-articulaires déplacées, l'échographie peut aider le chirurgien orthopédiste à évaluer l'alignement osseux pendant la réduction fermée et l'immobilisation du plâtre (Chern et al. 2002). L'échographie peut également évaluer l'état du site de fracture chez les patients présentant une pseudarthrose en montrant des tissus mous désorganisés autour des extrémités osseuses (Maffulli et Thorton 1995). Après enclouage tibial, l'échographie peut fournir des informations pronostiques sur la cicatrisation de la fracture, aidant ainsi à choisir le traitement le plus approprié (Moed et al. 1998). De plus, il est capable de détecter les complications d'un traitement orthopédique (Gibbon et al. 2002). Les implants de fixation de fracture peuvent être suivis de complications, telles qu'une infection, un conflit et une défaillance mécanique. Dans les infections, l'échographie peut identifier les abcès des tissus mous et les voies sinusales, et évaluer leur relation avec les implants et les structures vitales (Fig. 12a, b) (Gibbon et al. 2002). En outre, les États-Unis peuvent être utilisés pour guider l'aspiration à l'aiguille des collections de fluides à des fins culturelles. Récemment, l'attache du tendon du long extenseur du pouce après l'insertion d'une broche de Kirschner pour traiter les fractures instables du radius distal a été décrite avec l'échographie (Harrison et al. 2004). Après ostéotomie de la plaque palmaire pour fracture de Colles, une ténosynovite et des déchirures de ce tendon suite à un conflit avec la vis peuvent également être démontrées par échographie. Un conflit du tendon de la cheville dû au matériel orthopédique a également été signalé (Fig. 12c–e) (Shetty et al. 2002). Chez les enfants ayant une fixation percutanée par broche croisée pour des fractures humérales supracondyliennes déplacées, l'échographie dynamique peut évaluer le glissement altéré et l'impact du nerf cubital dans le tunnel cubital (Karakurt et al. 2005).
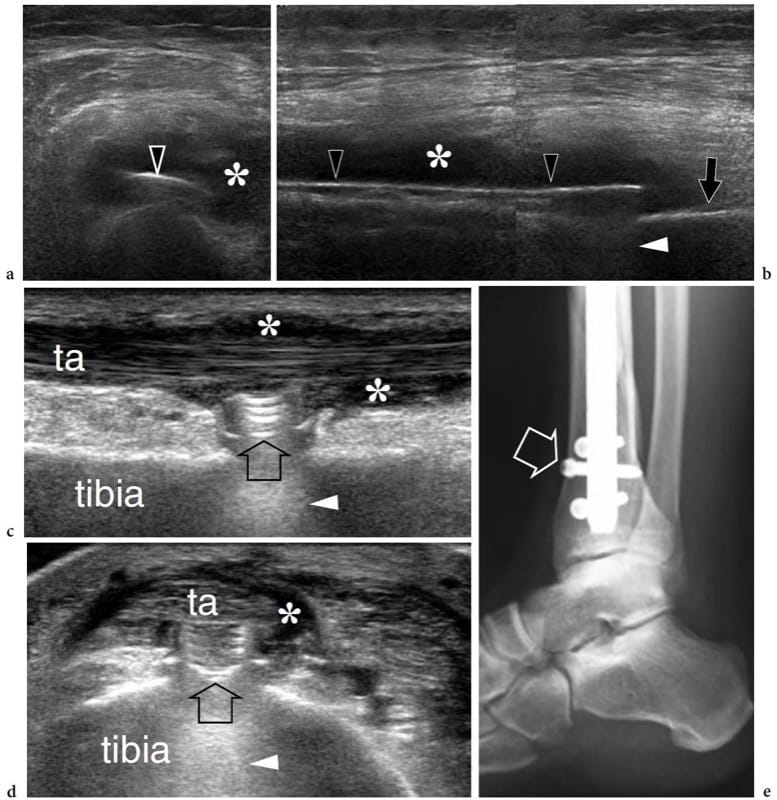
Figure 12. a–e. Complications du traitement orthopédique des fractures. Deux cas différents. a,b Des images américaines transversales et b longitudinales à 12–5 MHz du fémur gauche chez un patient qui a déjà été traité pour une fracture de la diaphyse fémorale avec mise en place d'un implant métallique (têtes de flèche ouvertes) démontrent une collection de liquide hypoéchogène (astérisques) entourant la compression assiette. Une intervention chirurgicale ultérieure a révélé un abcès. Notez l'artefact de réverbération postérieur (pointe de flèche blanche) de la plaque par rapport à l'os cortical fémoral (flèche). c Images échographiques 17–5 MHz à axe long et d sur le cortex antérieur de la
tibia avec une corrélation radiographique chez un patient préalablement opéré d'une fracture du tibia révèlent les contours de surface d'une tête de vis de verrouillage (flèche) empiétant sur le tendon du tibial antérieur (ta). La réverbération (pointe de flèche) est indiquée en profondeur par rapport à la tête de vis. Notez la ténosynovite associée (astérisques) du tendon tibial antérieur.
Certains auteurs ont suggéré que le processus de cicatrisation des fractures peut être suivi par imagerie Doppler couleur et analyse spectrale (Caruso et al. 2000). La justification est basée sur le fait qu'au moment du traumatisme, l'apport sanguin au site de la fracture est interrompu; ensuite, les vaisseaux sanguins atteignent la partie périostée du cal à partir des tissus mous adjacents formant une nouvelle circulation vers le cal (Postacchini et al. 1995). L'échographie est capable de suivre la formation de nouveaux vaisseaux au site de la fracture et d'évaluer les caractéristiques de leur écoulement pendant le développement du cal de fracture (Fig. 13a) (Caruso et al. 2000). Chez les patients dont le développement du cal est normal, l'analyse spectrale Doppler révèle une diminution initiale de l'indice de résistance en raison du processus néoangiogénétique survenant au cours des premières semaines après la fracture (Fig. 13b). Au fil du temps, la résistance artérielle augmente progressivement, reflétant une diminution physiologique du degré de vascularisation locale qui accompagne la phase mature du cal. En revanche, les patients présentant une pseudarthrose et un retard de cicatrisation ont des résistances précoces plus élevées, liées à une mauvaise formation de la néovascularisation. Bien que ces caractéristiques nécessitent une expérience plus approfondie dans des séries plus importantes, l'imagerie Doppler semble être une modalité prometteuse pour prédire la cicatrisation normale ou retardée d'une fracture basée sur une vascularisation défectueuse au site de la fracture environ 1 mois après le traumatisme (Caruso et al. 2000). Cependant, les radiographies standard restent la principale technique d'imagerie pour évaluer la formation de cals.
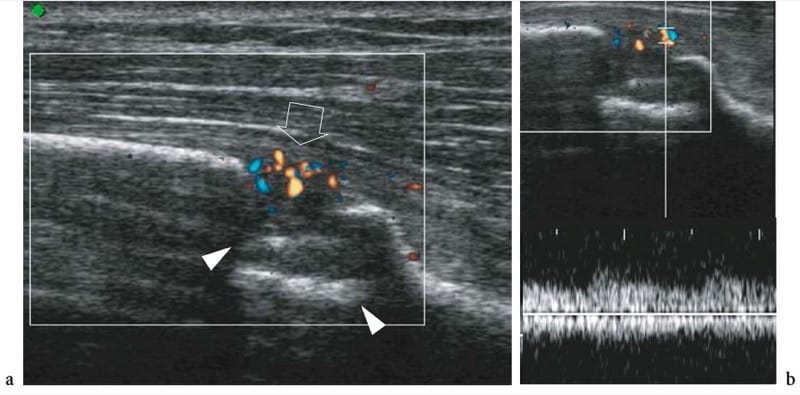
Illustration 13. a, b. Formation précoce de callosités après fracture du tibia distal. une image US Doppler couleur 12–5 MHz obtenue 12 jours après le traitement montre un défaut osseux (têtes de flèches) lié au site de la fracture et de multiples signaux de flux sanguin (flèche) dans les tissus mous périosseux superficiels à la fracture. b L'analyse spectrale révèle un flux artériel de faible résistance (RI <0.50) dans les vaisseaux entourant la fracture. Ces caractéristiques indiquent un développement initial normal du cal de fracture.
10. ÉROSIONS
Chez les patients atteints de polyarthrite rhumatoïde, l'échographie s'est révélée être une excellente modalité de détection des érosions osseuses précoces, avec une sensibilité supérieure même aux clichés simples (Wakefield et al. 2000). Les érosions se produisent généralement dans la main, le capitatum étant l'os le plus souvent touché, suivi du triquetrum, de l'hamate, du scaphoïde et du trapèze ; les deuxième et troisième têtes métacarpiennes sont également une localisation commune (Cimmino et al. 2000). L'échographie montre des érosions sous forme de cassures corticales ovales ou arrondies bien définies avec un plancher irrégulier visible dans les plans longitudinaux et transversaux (Fig. 14a, b). Ils affectent initialement les zones nues de la surface articulaire et partagent une apparence commune dans la polyarthrite rhumatoïde et d'autres arthropathies séronégatives. Le pannus synovial hypoéchogène et les signaux Doppler de flux sont souvent détectables en leur sein. La perte de définition du cartilage articulaire et l'élargissement des espaces articulaires sont des résultats associés. Par rapport aux radiographies standard, l'échographie peut être considérée comme un moyen plus sensible, efficace et fiable pour détecter les érosions dans la polyarthrite rhumatoïde (Wakefield et al. 2000 ; Alarcon et al. 2002 ; Weidekamm et al. 2003). Au début de la maladie, il s'est avéré capable de détecter 6.5 fois plus d'érosions que la radiographie chez 7.5 fois le nombre de patients. À un stade avancé de la maladie, ces différences étaient respectivement de 3.4 et 2.7 fois (Wakefield et al. 2000). Selon leur localisation, l'échographie s'est avérée supérieure à la radiographie pour la représentation des érosions des première, deuxième et cinquième articulations métacarpo-phalangiennes, mais inférieure à la quatrième articulation métacarpo-phalangienne en raison du problème d'accès (Schmidt 2001). Les érosions étant le plus souvent localisées le long des côtés radial et ulnaire des articulations, le principal inconvénient de l'échographie est lié à l'évaluation des troisième et quatrième articulations métacarpophalangiennes car les défauts sont masqués par l'os et pas suffisamment exposés au faisceau échographique (Fig. 14c). C'est la principale raison pour laquelle l'IRM ou la TDM sont, dans cette application particulière, plus sensibles. Lorsqu'une fenêtre acoustique adéquate existe, l'US peut apprécier même des érosions minimes.
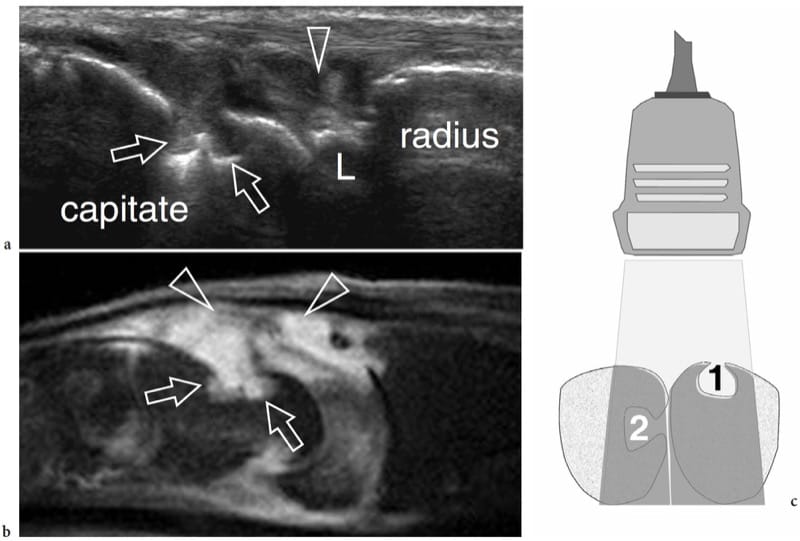
Figure 14. a–c. Les érosions osseuses dans la polyarthrite rhumatoïde. a Image échographique longitudinale 17–5 MHz sur la face dorsale du poignet avec b corrélation d'imagerie IRM pondérée en T2 avec suppression de la graisse sagittale montrant deux érosions adjacentes (flèches) sur le capitatum sous forme de défauts corticaux focaux bien définis remplis par une synovie hypertrophiée (têtes de flèche ). L, lunaire. c Le dessin schématique illustre la capacité dépendante du site de l'US à détecter les érosions osseuses. Deux érosions sont représentées : l'une placée sur une surface osseuse faisant face à la sonde (1), l'autre sur la surface latérale d'un os adjacent (2). L'échographie ne peut afficher que le premier, car le second est masqué par l'ombrage acoustique (gris intermédiaire) provenant de l'os intermédiaire.
11. OSTÉOMYÉLITE
L'ostéomyélite est la réponse inflammatoire de l'os secondaire à une infection. Selon le mécanisme pathologique impliqué, l'ostéomyélite peut provenir d'une propagation hématogène par rapport à l'ensemencement direct de bactéries dans l'os. L'ostéomyélite hématogène a tendance à impliquer la métaphyse hautement vascularisée des os en croissance dans le groupe d'âge pédiatrique, avec une distribution bimodale affectant les enfants de moins de 3 ans et de plus de 7 ans. Elle est plus souvent causée par Staphylococcus aureus et, dans une moindre mesure, par les entérobactéries, les streptocoques des groupes A et B et Haemophilus influenzae (Jbara et al. 2006). L'ostéomyélite directe peut être secondaire à un traumatisme pénétrant, à des corps étrangers, à des fractures ouvertes et à des gestes iatrogènes. Par rapport à la forme hématogène, l'infection directe touche plus généralement un groupe d'âge plus avancé, composé d'adolescents et d'adultes. Staphylococcus aureus, Enterobacter et Pseudomonas sont les agents responsables les plus courants (Jbara et al. 2006). Enfin, la propagation contiguë de l'infection à partir des tissus adjacents est souvent rencontrée chez les patients immunodéprimés et diabétiques. Dans l'ostéomyélite, l'imagerie diagnostique permet de poser un diagnostic précoce et d'établir une thérapeutique adaptée (Sammak et al. 1999). La radiographie est couramment utilisée comme modalité d'imagerie de première intention mais, en général, ne montre aucune anomalie au cours des 1 à 2 premières semaines d'infection (Sammak et al. 1999). Une réaction périostée subtile peut indiquer une maladie initiale. En raison de problèmes d'accès, l'échographie ne peut pas évaluer l'atteinte de la moelle osseuse et de l'os trabéculaire, mais constitue un excellent moyen d'identifier la formation d'abcès et l'atteinte des tissus mous adjacents (Mah et al. 1994 ; Davidson et al. 2003). Dans le groupe d'âge pédiatrique, le gonflement profond des tissus mous a été décrit comme le premier signe de maladie suivi d'une élévation du périoste et de la formation d'une fine couche de liquide sous-périosté (Mah et al. 1994). Aux États-Unis, l'élévation du périoste peut être appréciée comme des échos linéaires simples ou multiples entourant l'os cortical, tandis que le liquide sous-périosté apparaît comme une collection anéchoïque ou hypoéchogène séparant le périoste de l'os cortical à la suite de l'extension superficielle du processus intra-osseux (Fig. 15a) (Steiner et Sprigg 1992; Sammak et al. 1999). La détection du flux sanguin à l'intérieur ou autour du périoste infecté démontrée par l'imagerie Doppler peut être utile pour distinguer l'ostéomyélite aiguë précoce de l'ostéomyélite aiguë avancée (Chao et al. 1999). L'échographie Doppler s'est également avérée utile pour évaluer l'efficacité de l'antibiothérapie (Chao et al. 1999). Il faut cependant savoir qu'un examen échographique normal n'exclut pas une infection osseuse (Bureau et al. 1999). Les stades ultérieurs de la maladie sont caractérisés par des irrégularités et des érosions corticales, que l'on trouve généralement chez les patients présentant des symptômes qui durent plus d'une semaine (Fig. 15b–e). Ensuite, les collections sous-périostées peuvent s'étendre et former des abcès qui peuvent être drainés sous contrôle américain lorsque le traitement médical seul est insuffisant (Abiri et al. 1989 ; Bureau et al. 1999 ; Craig 1999). Les directives américaines contribuent à réduire les complications liées à la procédure, telles que la contamination par inadvertance des compartiments non impliqués et les lésions traumatiques des vaisseaux et des nerfs le long du trajet de l'aiguille (Bureau et al. 1999 ; Craig 1999). Une ouverture (cloaque) reliant l'os infecté à l'abcès ou un canal entre l'os infecté et la peau (tractus sinusal) peut être vu comme un défaut de la couche corticale en continuité avec la collection hypoéchogène. D'une manière générale, l'intérêt de l'échographie apparaît encore plus pertinent en phase post-opératoire où l'utilisation de l'IRM peut être gênée par la présence d'implants métalliques orthopédiques. Dans ce cas, l'US peut révéler la collection de fluides apposée à l'implant, qui apparaît comme une structure linéaire brillante avec un artefact de réverbération postérieur entouré de fluide hypoéchogène. Enfin, il est important de souligner que l'évaluation de l'atteinte osseuse nécessite des algorithmes d'imagerie composite pour des scénarios cliniques spécifiques, avec l'utilisation combinée de clichés simples, de médecine nucléaire, d'imagerie CT et IRM (Sammak et al. 1999).
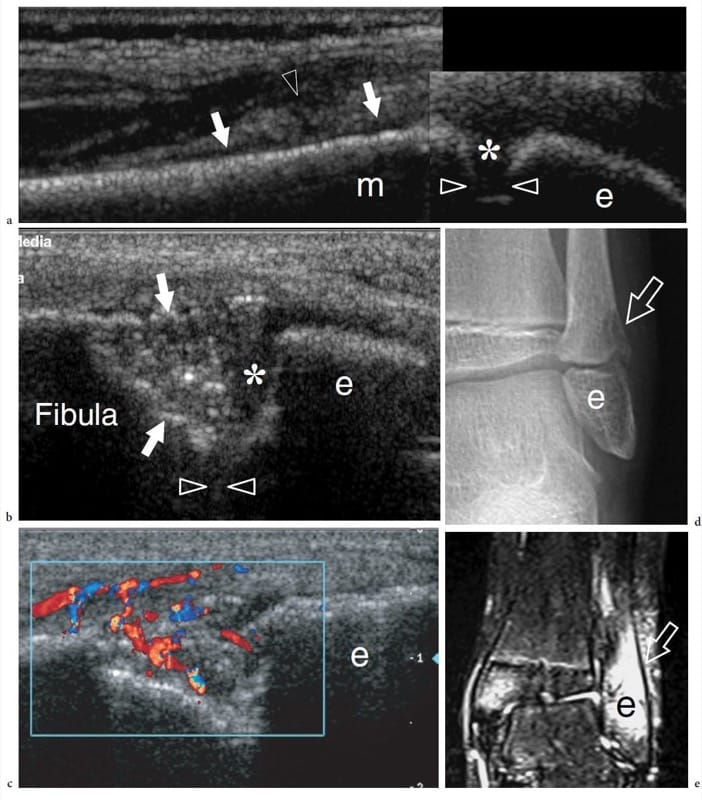
Figure 15. a–e. Ostéomyélite aiguë. une image échographique longitudinale 12–5 MHz sur le péroné distal chez un enfant de 7 ans présentant de la fièvre, une douleur latérale gauche à la cheville et un gonflement montre un épaississement échogène des tissus mous juxtacorticaux (tête de flèche) associé à un léger liquide sous-périosté (flèches) recouvrant le métaphyse du péroné. Notez la plaque de croissance (astérisque) intervenant entre l'épiphyse (e) et la métaphyse (m). L'examen radiographique initial était négatif. Le patient a suivi une cure d'antibiothérapie. b, c Les images échographiques longitudinales b en échelle de gris et c Doppler couleur 12–5 MHz obtenues 2 semaines plus tard sur le même plan de balayage montré dans a avec d radiographie et e corrélation d'imagerie IRM pondérée en T2 avec suppression de la graisse coronale démontrent un défaut profond ( flèches) au niveau métaphysaire avec résorption osseuse focale. Un schéma de flux sanguin hypervasculaire et une hyperintensité T2 marquée sont trouvés à l'intérieur et autour du défaut. Notez la couche résiduelle de cartilage physaire (astérisque) de la plaque de croissance (têtes de flèches).
12. COMMUNE
Considérations histologiques
L'anatomie articulaire est variable en fonction des exigences fonctionnelles spécifiques. Sur la base de leur structure anatomique, les articulations peuvent être divisées en trois groupes principaux : fibreux, cartilagineux et synovial (Erickson 1997). Dans les articulations fibreuses, les extrémités osseuses sont reliées par un tissu conjonctif solide intermédiaire, comprenant un ligament sutural (sutures), un ligament ou une membrane interosseux collagène (syndesmoses) ou un parodonte cartilagineux (gomphoses). Les articulations cartilagineuses sont divisées en symphyses - qui contiennent un disque fibrocartilagineux - et en synchondroses - qui sont formées par des extrémités osseuses recouvertes de cartilage mais dépourvues de synoviale. Les articulations synoviales sont formées par des os adjacents reliés par une cavité tapissée par la membrane synoviale. Les types d'articulations ci-dessus permettent différents degrés de mouvement, qui est minimal dans le premier groupe (fibreux) et maximal dans le second (synovial). Étant donné que les articulations synoviales sont les plus couramment examinées par échographie, nous discuterons spécifiquement de leur anatomie normale.
Les articulations synoviales sont formées par l'articulation des surfaces osseuses, de la capsule fibreuse et des ligaments, de la synoviale et d'autres structures intra-articulaires (ménisques, lèvres, ligaments, coussinets adipeux, etc.) (Fig. 17). La plaque osseuse sous-chondrale est une fine couche d'os dense liée à l'os spongieux et cortical de la métaphyse qui sert de support au cartilage articulaire. La fonction principale des plaques osseuses est d'adsorber une partie de la charge du cartilage et de la transférer à l'os cortical à travers la métaphyse. La microstructure de l'os sous-chondral, avec son orientation particulière des trabécules, reflète cette fonction. Les surfaces articulaires de l'os sont recouvertes de cartilage hyalin (Fig. 16a). L'épaisseur du cartilage varie d'une articulation à l'autre : un cartilage plus épais se trouve dans les grosses articulations soumises à une charge considérable, comme les articulations portantes du membre inférieur. L'épaisseur du cartilage varie également dans différents sites d'une même articulation en tant qu'expression de différences locales de charge. Le cartilage hyalin est formé de cellules - les chondrocytes, qui représentent 0.1 % du volume du cartilage - et d'une matrice chondroïde constituée de collagène et de protéoglycanes. Du point de vue histologique, quatre couches de cartilage peuvent être reconnues de la surface à la profondeur, sur la base d'une architecture et d'une orientation différentes des fibres de collagène. Dans la couche superficielle, les fibres de collagène sont tangentielles à la surface ; dans la couche de transition, les fibres de collagène sont disposées de manière aléatoire ; dans les couches profondes (zone radiale et couche calcifiée) les fibres sont orientées verticalement. La fonction principale du cartilage articulaire est l'absorption de la charge par déformation progressive et sa distribution aux os sous-jacents. Lors de la mise en charge, le cartilage est comprimé et réduit son épaisseur en raison de la compression transitoire de l'eau et de la compression des fibres de collagène. Après le retrait de la charge, la déformation induite du cartilage revient à la normale. Le cartilage hyalin est avasculaire et principalement alimenté par le liquide synovial ; seule sa couche la plus profonde reçoit les artérioles de la plaque osseuse sous-chondrale (Erickson 1997). En marge des surfaces articulaires de l'os, la capsule articulaire s'insère dans l'os cortical et le périoste (Fig. 17a). L'épaisseur de la capsule articulaire varie selon les articulations et entre les différentes parties des articulations individuelles en fonction de la demande locale et des exigences fonctionnelles. La capsule articulaire gléno-humérale, par exemple, est très fine et lâche pour permettre une large gamme de mouvements, tandis que la capsule antérieure de l'articulation de la hanche est épaisse pour aider à maintenir une posture droite. Les discontinuités focales dans la capsule permettent à la synoviale de hernier dans les tissus mous environnants formant des évidements synoviaux (Fig. 17b). La fonction de ces évidements (bourses synoviales) est double : faciliter le glissement des tendons para-articulaires avec l'articulation sous-jacente, et servir de réservoirs, limitant les dommages aux structures intra-articulaires provoqués par la pression liquidienne dans les épanchements articulaires abondants. . La capsule peut être renforcée et stabilisée par des ligaments, qui sont des cordons fibreux dotés de certaines propriétés élastiques reliant deux os juste au-dessus de la ligne articulaire. Les ligaments peuvent être complètement indépendants de la capsule articulaire (c'est-à-dire le ligament collatéral latéral du genou), ou représenter simplement un épaississement capsulaire focal (c'est-à-dire les ligaments gléno-huméraux) (Fig. 17c). Les ligaments sont orientés selon des plans anatomiques spécifiques pour stabiliser l'articulation dans différentes positions (c'est-à-dire que le ligament collatéral propre des articulations interphalangiennes agit comme un stabilisateur lors de la flexion, tandis que les ligaments collatéraux accessoires jouent le même rôle lors de l'extension). La synoviale, un dérivé mésodermique, est constituée d'une fine membrane synoviale soutenue par du tissu stromal : elle produit le liquide synovial, un liquide visqueux clair ou jaune pâle qui permet la lubrification de l'articulation et la nutrition du cartilage. La membrane synoviale tapisse la cavité articulaire à l'exception du cartilage hyalin et des structures intra-articulaires du fibrocartilage (Fig. 17d). Il investit également certaines zones de transition s'étendant des limites périphériques du cartilage hyalin et de la capsule fibreuse, les zones dites dénudées. Au niveau de ces sites, l'os est recouvert de synovie sans la couche protectrice de cartilage : cela le rend particulièrement vulnérable à la destruction osseuse induite par la synovite (Sommer et al. 2005). Différentes structures de fibrocartilage peuvent être trouvées à l'intérieur de l'espace articulaire ou liées à la capsule articulaire : leur fonction principale est d'augmenter la congruence des surfaces articulaires en remplissant l'espace entre elles et d'agir comme des amortisseurs évitant ainsi d'endommager le cartilage hyalin (Fig. 17d). Certaines articulations contiennent des coussinets adipeux, qui sont des structures adipeuses remplissant l'espace entre la membrane synoviale et la capsule périphérique (Fig. 17d). Les coussinets adipeux intra-articulaires adaptent leur forme aux mouvements articulaires et à la quantité de liquide synovial intra-articulaire ; ils absorbent les forces générées lors du mouvement articulaire.
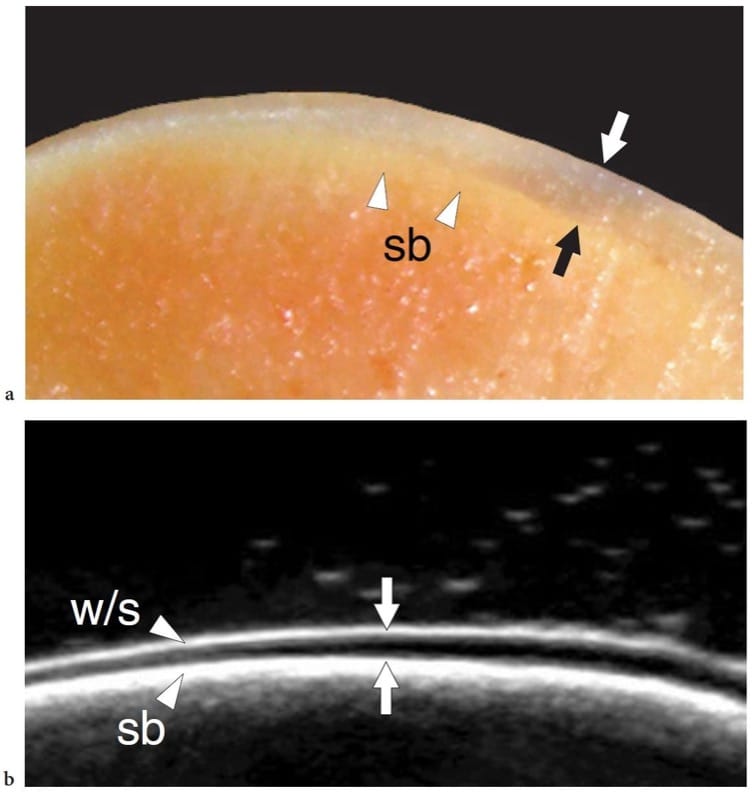
Illustration 16. a, b. Cartilage hyalin normal. une photographie en coupe cadavérique du dôme du talus montre une couche uniforme superficielle de cartilage articulaire (flèches) recouvrant l'os sous-chondral (sb). b L'image US in vitro 17–5 MHz correspondante montre une couche échogène superficielle (w/s) liée à une inadéquation de l'impédance acoustique entre le cartilage (solide) et le liquide adjacent (eau), une bande hypoéchogène intermédiaire (flèches) due au cartilage hyalin et une couche échogène profonde à l'interface cartilage-os sous-chondral (sb).
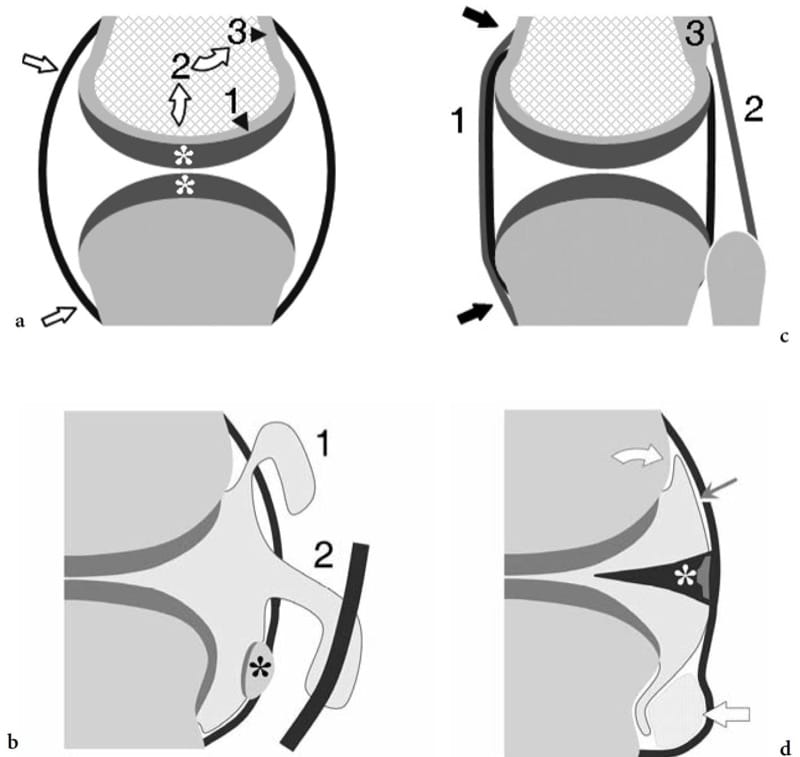
Figure 17. a–d. Anatomie générale des articulations synoviales. Dessins schématiques d'une vue en coupe d'une articulation synoviale. a Capsule articulaire et cartilage articulaire. La capsule articulaire (flèches droites) est un sac fibreux qui s'insère au-delà des surfaces articulaires des os articulés. L'épaisseur du cartilage articulaire (astérisques) peut varier entre les parties d'une même articulation en fonction des différentes exigences de charge et de mise en charge (têtes de flèches). Le cartilage transmet la charge à la plaque osseuse sous-chondrale (1) qui, à son tour, en transfère une partie (flèches courbes) à l'os cortical (3) à travers la région métaphysaire (2). b Récessus synoviaux et sésamoïdes. Les évidements synoviaux proviennent de discontinuités focales de la capsule, permettant à la synoviale de s'extruder dans les tissus mous environnants. La hernie synoviale peut former des poches synoviales communicantes (1) ou peut relier la cavité articulaire aux gaines tendineuses synoviales adjacentes (2). Les sésamoïdes (astérisque) sont de petits osselets intégrés dans la capsule fibreuse ou la plaque plantaire. Ils peuvent ou non s'articuler avec les surfaces articulaires. c Ligaments. Ce sont des bandes fibreuses formées par épaississement focal de la capsule (1) ou situées à une certaine distance de celle-ci (2). Les ligaments les plus forts s'insèrent dans les crêtes osseuses para-articulaires ou les tubercules (3); ceux-ci sont orientés de manière appropriée pour contrer l'instabilité articulaire. d Synovie, fibrocartilages et coussinets adipeux. La membrane synoviale (flèche fine) investit la cavité articulaire à l'exception des structures fibrocartilagineuses (astérisque) et des coussinets adipeux intra-articulaires extrasynoviaux (flèche épaisse). Entre les limites périphériques du cartilage hyalin et la capsule, la synoviale investit directement l'os. Ces zones sont appelées « zones nues » (flèche courbe).
13. ANATOMIE AMÉRICAINE NORMALE ET TECHNIQUE DE NUMÉRISATION
Les indications de l'échographie articulaire se développent rapidement en raison du raffinement des transducteurs à haute résolution et du fait que les radiologues et les cliniciens sont de plus en plus conscients du potentiel de l'échographie dans ce domaine. L'échographie peut identifier et quantifier de manière fiable les épanchements intra-articulaires dans toutes les articulations appendiculaires, y compris celles, comme la hanche, pour lesquelles l'examen physique ne fournit pas suffisamment d'informations. La détection d'un épanchement articulaire indique l'origine articulaire des symptômes et exclut pratiquement les douleurs projetées ou les troubles para-articulaires. La ponction à l'aiguille guidée par échographie des espaces articulaires permet un prélèvement moins douloureux et plus rapide du liquide synovial pour analyse et culture que l'utilisation d'une technique à l'aveugle. De plus, l'injection intra-articulaire correcte de médicaments, tels que la lidocaïne ou les stéroïdes, peut facilement être confirmée par une échographie en temps réel. Selon l'articulation individuelle examinée, l'échographie ne peut visualiser que des parties limitées des surfaces articulaires. Les joints serrés sont difficiles à examiner avec ces techniques. D'autre part, l'imagerie des articulations larges et lâches peut être améliorée par différentes manœuvres qui aident à repositionner les surfaces articulaires sous l'os. La surface articulaire de la tête métacarpienne, par exemple, peut être évaluée presque complètement si le balayage est obtenu à différents degrés de flexion. De même, une flexion forcée de l'articulation du genou permet d'évaluer la trochlée en plaçant la sonde sur la région suprapatellaire (Martino et al. 1998). En l'absence d'espace articulaire, comme cela se produit dans la coalition tarsienne congénitale, l'échographie peut mettre en évidence un pontage fibreux ou osseux au niveau de l'interligne articulaire (Lee et al. 2002). La détection de la coalition est cliniquement pertinente car elle peut provoquer des symptômes liés à une charge altérée sur les articulations adjacentes. Une fois suspecté à l'examen américain, le diagnostic doit être confirmé par TDM (Herzenberg et al 1986).
En général, l'examen échographique des surfaces articulaires révèle une bande linéaire lisse hypoéchogène homogène due au cartilage hyalin (Martino et al. 1998 ; Grassi et al. 1999). En profondeur, l'os sous-chondral apparaît comme une ligne hyperéchogène brillante régulière et continue (Fig. 18). A l'aide d'échantillons in vitro et de sondes à très haute fréquence (50 MHz), certains chercheurs ont mis en évidence que le cartilage articulaire est composé de trois couches, caractérisées, de superficielle à profonde, par un aspect respectivement hypoéchogène, hyperéchogène et anéchoïque (Kim et al. 1995). Bien qu'il y ait eu des spéculations selon lesquelles un schéma quelque peu similaire peut être discerné chez les nourrissons et les jeunes enfants in vivo en utilisant un équipement conventionnel, l'expérience quotidienne suggère que, dans des conditions normales, le cartilage articulaire adulte apparaît, et doit être considéré, de manière homogène hypoéchogène (Erickson 1997 ). Les modifications de l'épaisseur du cartilage sont bien représentées par l'échographie et peuvent être mesurées avec précision. Dans les états normaux, la membrane synoviale est trop fine pour être discriminée avec l'échographie : elle ne peut être appréciée que dans les états pathologiques qui conduisent à son épaississement et à son hypertrophie. De nombreuses articulations contiennent des structures fibrocartilagineuses, telles que le ménisque du genou, le labrum de la hanche et de l'épaule, le fibrocartilage triangulaire du poignet et les plaques palmaire et plantaire de la main et du pied. Toutes ces structures apparaissent hyperéchogènes de manière homogène et adhérentes à l'os ou à la capsule articulaire (Fig. 19) (Gerngross et Sohn 1992). L'échotexture du fibrocartilage diffère significativement de celle du cartilage hyalin : dans le fibrocartilage, le composant prédominant est les fibres de collagène et celles-ci provoquent une réflectivité accrue. En raison de leur emplacement profond et de leur contact étroit avec l'os, ces structures ne peuvent être évaluées que partiellement et, dans la plupart des cas, de manière non fiable par échographie. Dans de nombreuses articulations, le balayage dynamique pendant le mouvement articulaire peut induire des changements dans la forme du fibrocartilage. L'échographie montre la capsule articulaire comme une ligne hyperéchogène bordant la cavité articulaire et fusionnant avec les tissus para-articulaires. Récemment, l'apparition aux États-Unis d'un osselet méniscal a été signalée (Martinoli et al. 2000).
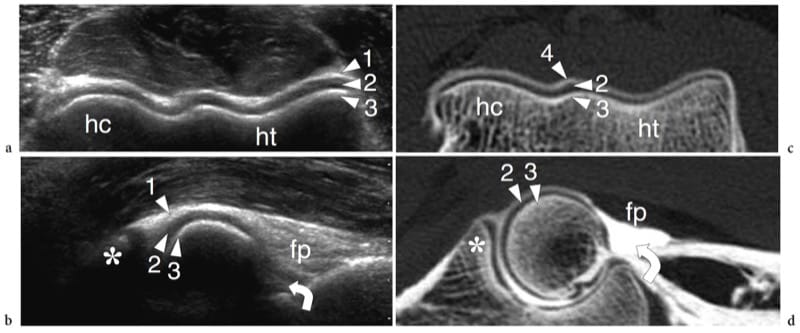
Figure 18. a–d. Aspect échographique d'une articulation synoviale normale. a Des images échographiques transversales et b sagittales à 12–5 MHz de l'épiphyse humérale distale avec corrélation c,d CT-arthrographie montrent le cartilage hyalin normal (têtes de flèches) sous la forme d'une bande hypoéchogène uniforme (2) recouvrant l'os sous-chondral hyperéchogène (3) du le capitellum huméral (hc) et la trochlée humérale (ht). La capsule articulaire (1) apparaît comme une ligne hyperéchogène recouvrant le cartilage. Dans l'image sagittale, le récessus coronoïde (flèche courbe) et le coussinet adipeux antérieur (fp) sont mis en évidence. Dans les images CT-arthrographiques, le produit de contraste intra-articulaire (4) aide à délimiter les limites superficielles des cartilages. Astérisque, processus coronoïde.
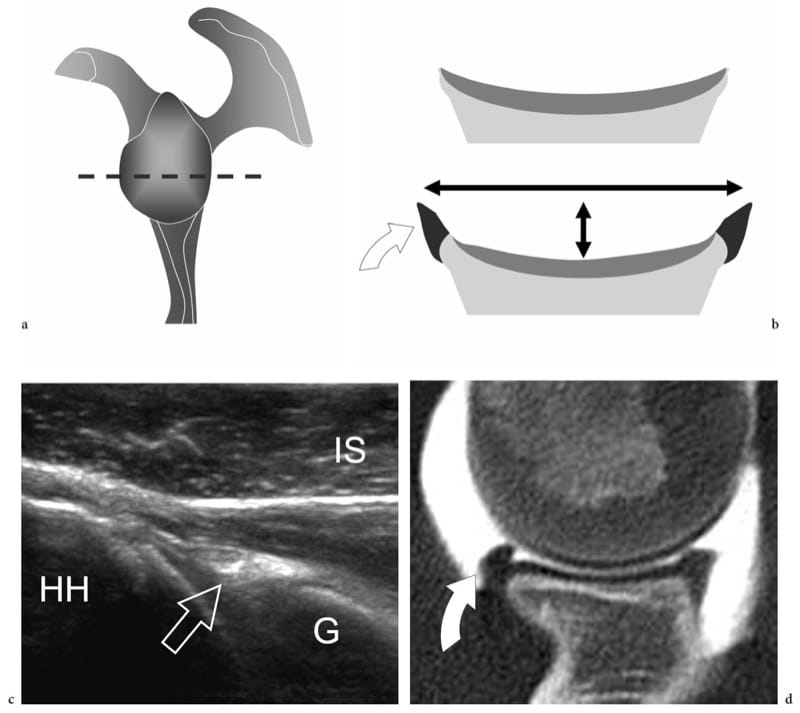
Figure 19. a–d. Fibrocartilages articulaires : bourrelet glénoïdien. a Le dessin schématique indique le plan de coupe (ligne pointillée) représenté en b. Le bourrelet glénoïdien (flèche courbée) est un anneau fibrocartilagineux attaché au bord périphérique de la cavité glénoïdienne. Sa fonction principale est d'élargir la fosse glénoïdienne (flèche longue à double pointe) et de la creuser (flèche courte à double pointe). c Image échographique transversale 12–5 MHz obtenue sur la face postérieure de l'articulation gléno-humérale avec d Corrélation CT-arthrographie montrant le labrum glénoïdien postérieur (flèche) comme une structure triangulaire hyperéchogène homogène avec sa base adhérente au bord glénoïdien (G). HH, tête humérale ; IS, muscle sous-épineux.
Les ligaments apparaissent sous forme de bandes fibrillaires hyperéchogènes joignant deux surfaces osseuses opposées (Fig. 20) (Lee et al. 1996 ; Mathieu et al. 1997 ; Brasseur et al. 1994 ; Morvan et al. 2000 ; Ward et al. 2003 ; Miller et al. 2004 ; Finlay et al. 2004 ; Peetrons et al. 2004 ; Boutry et al. 2005). Un peu comme les tendons, les ligaments sont des structures anisotropes. Par conséquent, il faut veiller à placer la sonde aussi parallèlement que possible à eux pour éviter les modèles hypoéchogènes artéfactuels qui peuvent imiter la pathologie. Souvent, changer la position de l'articulation améliore la visualisation des ligaments. Les petites sondes qui peuvent mieux épouser les courbes et les renflements des repères osseux sont préférées pour l'imagerie des ligaments. Certains ligaments situés dans la partie centrale des articulations (c'est-à-dire les ligaments interosseux du sinus tarsien et les ligaments croisés du genou) ne peuvent pas être visualisés par échographie en raison des structures osseuses sus-jacentes. Les ligaments complexes (c'est-à-dire le ligament collatéral médial du genou, le ligament deltoïde de la cheville) sont constitués de composants individuels qui peuvent être distingués par US en tant que structures individuelles. En général, les ligaments qui stabilisent une articulation sont mieux évalués lorsqu'ils sont étirés. Par exemple, à l'état relâché, le ligament calcanéo-fibulaire de la cheville a une trajectoire concave qui rend difficile l'évaluation de son insertion crânienne ; avec la cheville en dorsiflexion, le ligament se resserre, poussant les péroniers superficiellement, et est mieux représenté (Peetrons et al. 2004). Les coussinets adipeux intra-articulaires apparaissent aux États-Unis sous forme de structures hyperéchogènes ressemblant à de la graisse (Fig. 18c). Les plus importants sont reconnus au niveau du genou (coussinet de Hoffa) et du coude (coussinets graisseux antérieur et postérieur) (Miles et Lamont 1989 ; Ferrara et Marcelis 1997). Dans la plupart des articulations, de petites quantités de liquide intra-articulaire normal peuvent être détectées dans la cavité articulaire au moyen d'une échographie à haute résolution.

Figure 20. a–d. Ligaments normaux. a–c Les dessins schématiques illustrent la relation d'un ligament (grandes flèches droites) avec les structures articulaires sous-jacentes, y compris le cartilage hyalin (fine flèche droite), la cavité articulaire (astérisque) et la ou les membranes synoviales. La position de la capsule fibreuse par rapport au ligament peut être variable : a interne (entre le ligament et la synovie, c'est-à-dire le ligament collatéral latéral du genou) ; b s'y plier (c'est-à-dire les ligaments gléno-huméraux de l'épaule, le ligament talo-fibulaire antérieur de la cheville, le ligament collatéral médial du genou) ; c externe (en dehors du ligament et de la synoviale, c'est-à-dire le ligament croisé antérieur du genou). d Image échographique long axe 17–5 MHz sur la cheville latérale montrant le ligament talofibulaire antérieur normal sous la forme d'une bande fibrillaire épaisse (têtes de flèches) joignant la malléole latérale (ML) et le talus. La face profonde du ligament talo-fibulaire antérieur est confondue avec la capsule articulaire de la cheville. Notez le liquide articulaire (astérisque) en contact étroit avec le ligament. Flèche fine, cartilage articulaire.
14. CHANGEMENTS PATHOLOGIQUES
Épanchement articulaire
La démonstration d'un épanchement intra-articulaire est une étape majeure dans l'investigation des troubles musculo-squelettiques, car elle attire l'attention du clinicien sur un problème articulaire et exclut d'autres sources extra-articulaires de douleur et d'incapacité. Un épanchement articulaire peut provenir aussi bien de causes traumatiques ou mécaniques que d'une synovite inflammatoire ou infectieuse ; plus rarement, elle peut être liée à des conditions néoplasiques. À l'examen physique, la détection de l'épanchement synovial dépend de la quantité globale de liquide et du type d'articulation impliquée. Une palpation précise permet de détecter des épanchements moyens à importants dans le coude, la main et le genou. D'après les données cliniques, les épanchements articulaires du poignet et de la cheville sont plus difficiles à apprécier et à différencier des tuméfactions para-articulaires des tissus mous et des ténosynovites : distinguer l'atteinte sélective d'une articulation parmi les normales adjacentes (p. médiocarpien) est souvent problématique sur ces sites. Les épanchements de l'épaule et de la hanche ne peuvent pas non plus être identifiés avec certitude sur la base des seuls résultats physiques. Les radiographies standard permettent de diagnostiquer un épanchement intra-articulaire important au niveau du coude, du genou et de la cheville. Le repère radiographique des épanchements articulaires est lié à la visualisation directe des cavités synoviales distendues et au déplacement secondaire des coussinets adipeux extrasynoviaux intracapsulaires (Smith et Lee 1978). Les radiographies sont cependant imprécises pour diagnostiquer les épanchements articulaires de l'épaule, du poignet et de la hanche. L'identification des épanchements intra-articulaires est l'une des principales raisons pour lesquelles l'examen échographique des articulations est demandé. L'échographie s'est révélée extrêmement sensible et fiable dans la détection même de petites quantités de liquide intra-articulaire en scannant non seulement le niveau de l'interligne articulaire mais aussi les cavités et les bourses para-articulaires qui sont, en général, mieux exposées au Faisceau américain (Jacobson et al. 1998; Moss et al. 1998; Iagnocco et Coari 2000; Delaunoy et al. 2003). Si la quantité de liquide est faible, l'examen de l'articulation controlatérale peut être utile pour déterminer si une synovite est présente. Dans certains troubles rhumatologiques (par exemple, la polyarthrite rhumatoïde), cependant, la règle habituelle de comparer le côté opposé n'aide pas toujours car la maladie peut avoir une présentation symétrique. Bien que l'échographie soit très sensible pour détecter le liquide intra-articulaire, elle ne peut pas différencier définitivement les différents types d'épanchements (Wilson 2004). Selon sa nature, un épanchement articulaire non hémorragique non infecté peut être complètement anéchoïque avec absence d'échos internes (Fig. 21); ou il peut contenir des taches échogènes dispersées en raison du contenu protéique, de la fibrine, des cristaux ou des débris cellulaires (Fig. 21b) (Farina et al. 2002). Le rôle de l'échographie dans l'évaluation de l'épanchement articulaire ne se limite pas à la détection de liquide, mais peut également aider au placement percutané de l'aiguille. La mise en évidence d'un épanchement intra-articulaire touchant une seule articulation (monoarthrite) est une indication certaine de prélèvements, d'analyses et de procédures de culture afin d'exclure une arthrite microcristalline et une infection. Pour l'injection de petites articulations, le guidage américain permet une précision nettement supérieure à une approche en aveugle (Raza et al. 2003). Dans notre pratique, l'aspiration guidée par échographie du liquide articulaire réduit considérablement la douleur associée à la ponction à l'aiguille. De plus, la surveillance en temps réel de l'aiguille réduit le risque de dommages potentiels aux structures adjacentes, y compris les artères et les nerfs. En situation traumatique, les épanchements articulaires hémorragiques peuvent apparaître très échogènes dans les premières heures suivant le traumatisme (Fig. 21c). La lipohémarthrose est une affection dans laquelle le sang et la graisse de la moelle osseuse se trouvent à l'intérieur de la cavité synoviale. Alors que le sang provient généralement des déchirures de la membrane synoviale, la graisse provient de la moelle osseuse jaune à la suite d'une fracture osseuse ou, plus rarement, de la graisse périligamentaire. Dans la plupart des cas, la lipohémarthrose peut être considérée comme un indicateur fiable d'une fracture intra-articulaire : elle se caractérise par un aspect multicouche composé d'une couche hyperéchogène superficielle reflétant la graisse et d'une couche hypoéchogène profonde due à la sédimentation des globules rouges. Après 10 à 15 minutes d'immobilisation articulaire, on note une fine bande intermédiaire due au sérum entre la graisse et les globules rouges (Fig. 21j,e) (Bianchi et al. 1995).
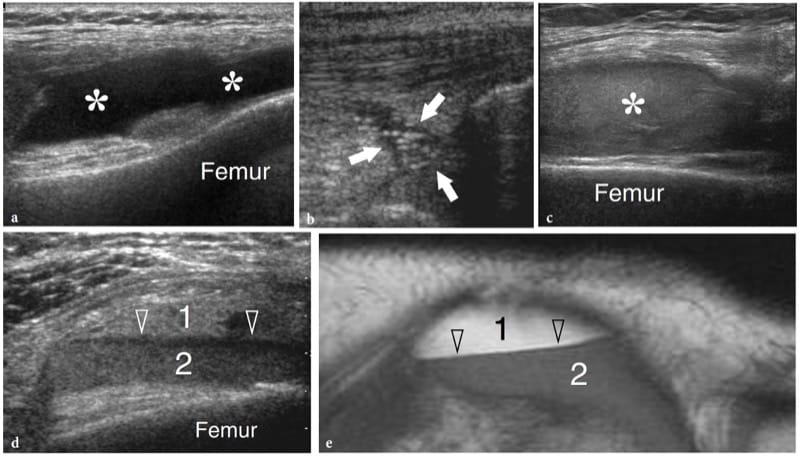
Figure 21. a–e. Épanchement articulaire : spectre des apparitions échographiques dans différentes conditions pathologiques. Des images US ont été obtenues sur l'évidement suprapatellaire du genou avec un transducteur de 12–5 MHz. a Les épanchements mécaniques ou inflammatoires (astérisques) présentent généralement un aspect anéchoïque. b Des taches échogènes éparses (flèches) peuvent parfois être rencontrées au sein d'épanchements mécaniques ou inflammatoires du fait d'un contenu très protéique, de fibrine, de cristaux ou de débris cellulaires. c Un épanchement hémorragique récent (astérisque) peut apparaître hyperéchogène de manière homogène suite à une fuite de sang dans la cavité synoviale. d,e La comparaison des images d US et e IRM pondérées en T1 dans la lipohémarthrose montre de la graisse hyperéchogène (1) en suspension flottant au-dessus d'une couche profonde (2) d'échos de niveau moyen dus au sang. Une troisième fine bande hypoéchogène (têtes de flèches) correspondant au sérum peut être appréciée entre les deux autres couches.
15. ARTHRITE RHUMATOÏDE ET AUTRES ARTHROPATHIES INFLAMMATOIRES
L'échographie a été proposée pour la détection précoce et le suivi de plusieurs troubles inflammatoires chroniques des articulations, notamment la polyarthrite rhumatoïde (Wakefield et al. 2000 ; Keen et al. 2005 ; Scheel et al. 2006 ; Gibbon 2004) et les arthropathies séronégatives (Gibbon 2004 ; Milosavljevic et al. 2005 ; Kane 2005). La polyarthrite rhumatoïde est une maladie systémique chronique qui touche environ 0.5 à 1 % de la population et a une prévalence définie (2:1 à 3:1) chez les femmes. L'étiologie de la polyarthrite rhumatoïde est inconnue mais elle semble être multifactorielle, avec toute susceptibilité génétique, expression de HLA-DR4 et facteurs environnementaux supposés jouer un rôle (Sommer et al. 2005). Le diagnostic nécessite un éventail de manifestations de la maladie et peut être posé selon des critères cliniques établis, dont la description dépasse toutefois le cadre de ce chapitre (Arnett et al. 1988 ; Sommer et al. 2005). Du point de vue physiopathologique, l'hyperémie synoviale est la première étape du processus inflammatoire dans la polyarthrite rhumatoïde qui peut être identifiée avec des modalités d'imagerie diagnostique, y compris l'échographie avec contraste Doppler puissance (Sommer et al. 2005). Ensuite, la réponse immunitaire médiée par les cytokines (TNFα et IL-1) et l'infiltration subséquente par les cellules inflammatoires entraînent un œdème et un gonflement de la synoviale. Cela provoque un élargissement de l'espace articulaire, qui peut être encore élargi par épanchement (Fig. 22a). On suppose que les stades ci-dessus de la maladie peuvent être entièrement réversibles. Plus tard, la réponse inflammatoire conduit à une hypertrophie de la membrane synoviale par un tissu de granulation invasif avec prolifération de synoviocytes, de macrophages, de lymphocytes, de plasmocytes et de mastocytes. Au fur et à mesure que l'hypertrophie synoviale se poursuit, la synoviale hypertrophiée - généralement appelée «pannus» (le latin pour «tissu») - subit une transformation villeuse et se dilate de manière concentrique dans l'espace articulaire, entraînant des lésions de la partie centrale du cartilage articulaire et de l'os sous-chondral. (formation de kystes sous-chondraux et érosions) (Fig. 22b). L'atteinte de la gaine ténosynoviale coexiste dans de nombreux cas. Du point de vue clinique, les anomalies ci-dessus se rencontrent non seulement dans la polyarthrite rhumatoïde mais également dans d'autres formes d'arthrite chronique. La caractéristique de la polyarthrite rhumatoïde est l'atteinte symétrique bilatérale de plus de trois articulations. Au début de son évolution, la maladie affecte généralement les petites articulations de la main, les deuxième et troisième articulations métacarpo-phalangiennes et la troisième articulation interphalangienne proximale étant les plus généralement touchées (une constatation caractéristique de la polyarthrite rhumatoïde est l'épargne des articulations interphalangiennes distales, qui sont couramment impliquées dans arthrose et rhumatisme psoriasique). Dans une maladie plus avancée, la synovite implique les plus grosses articulations des membres et des extrémités. L'action destructrice du pannus est responsable d'une atteinte progressive de la surface articulaire, d'une déchirure ligamentaire et capsulaire et, enfin, d'une instabilité et de déformations articulaires (Fig. 22c, d). Lors de l'imagerie de la polyarthrite rhumatoïde, il faut considérer que la maladie progresse de manière non linéaire et que l'atteinte articulaire n'est pas uniforme, en particulier dans les premiers stades. Bien qu'il n'y ait pas de consensus sur les articulations à contrôler systématiquement, celles qui sont symptomatiques et celles typiquement impliquées dans la polyarthrite rhumatoïde (c'est-à-dire les articulations du poignet et de la main) doivent être examinées (Sommer et al. 2005). À des fins de suivi, les articulations du poignet et de la main sont les sites privilégiés pour évaluer l'efficacité de la thérapie (Sommer et al. 2005). En termes de traitement, parmi les médicaments qui ont une influence sur l'évolution de la maladie, on trouve les soi-disant modificateurs de la réponse biologique (c'est-à-dire les médicaments anti-TNFα) qui inhibent certaines cytokines, réduisant ainsi l'activité inflammatoire. Ces médicaments sont coûteux, ont des effets secondaires importants et doivent être utilisés chez les patients atteints d'arthrite érosive agressive chez qui les médicaments conventionnels (AINS, stéroïdes, antalgiques, etc.) ne produisent pas de réponse positive. Un diagnostic précoce de la synovite est donc nécessaire pour commencer un traitement agressif adéquat avant l'apparition de lésions structurelles de l'articulation (Herburn 1988).
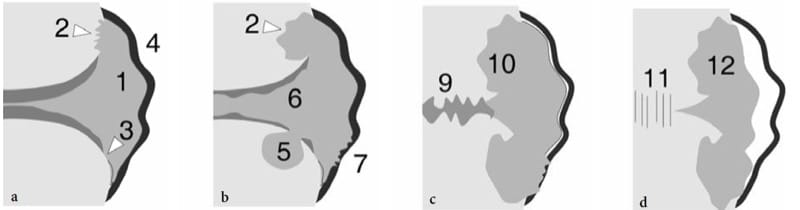
Illustration 22. a–d. La polyarthrite rhumatoïde. Dessins schématiques montrant la progression des lésions articulaires au cours de la maladie. a L'atteinte précoce se caractérise par un épanchement articulaire et la formation d'un pannus (1) associés à des érosions marginales (2), un amincissement du cartilage (3) et un relâchement des structures capsuloligamenteuses (4). b Au fur et à mesure que la maladie progresse, les érosions augmentent de taille, les kystes sous-chondraux deviennent évidents (5) et le cartilage hyalin apparaît de plus en plus aminci (6). Des déchirures partielles des structures para-articulaires (7) peuvent survenir entraînant une instabilité articulaire. c Plus tard, une ankylose fibreuse (9) de l'articulation peut se produire avec une destruction plus évidente des extrémités osseuses (10). d Dans certaines articulations (articulations carpiennes et tarsiennes), l'ankylose osseuse (11) est le stade terminal. Le pannus fibreux inactif (12) peut remplacer le pannus érosif actif dans la phase chronique.
Étant donné que les changements précoces dans la polyarthrite rhumatoïde sont de nature non osseuse, l'échographie s'est avérée supérieure à la radiographie conventionnelle en termes de détection de la maladie (Gibbon 2004 ; Clement et al. 2005 ; Keen et al. 2005). Chez les patients atteints de polyarthrite rhumatoïde et d'autres arthropathies séronégatives, l'échographie est un moyen efficace pour détecter les signes précoces de synovite, permettant ainsi la mise en place rapide d'un traitement approprié (Grassi et al. 1993, 2001 ; Brown et al. 2004). Comme indiqué précédemment, l'échographie est capable de détecter un épanchement articulaire qui accompagne les phases inflammatoires aiguës ou l'exacerbation de la maladie - même dans les petites articulations synoviales et peut distinguer les articulations affectées des articulations normales adjacentes. Il peut définir des changements synoviaux, permettant d'évaluer le pannus comme des végétations hypoéchogènes faisant saillie à l'intérieur du liquide synovial ou remplissant complètement l'espace articulaire (Fig. 23a, b). En utilisant l'IRM comme méthode de référence, l'échographie s'est avérée plus sensible et plus précise dans la détection des signes d'inflammation des articulations des doigts que les examens cliniques et radiographiques, sans perte de spécificité (Szkudlarek et al. 2006). Dans d'autres séries, elle était encore plus sensible que l'IRM pour détecter les synovites (Backhaus et al. 1999). L'utilisation intégrée de l'imagerie Doppler peut aider à distinguer le pannus hypervasculaire (actif) du pannus hypovasculaire (inactif), à surveiller la réponse au traitement sur la base d'une diminution de l'hyperémie (reflétant une amélioration en termes de symptômes et de variables d'activité de la maladie) et à différencier le pannus actif du épanchement échogène (Fig. 23c–f) (Spiegel et al. 1987 ; Newman et al. 1996 ; Hau et al. 1999, 2002 ; Backhaus et al. 1999 ; Stone et al. 2001 ; Szkudlarek et al. 2001 ; Klauser et al. 2002 ; Fiocco et al. 2005 ; Kiris et al. 2006). De plus, l'échographie Doppler peut être utile pour distinguer la prolifération synoviale non inflammatoire dans l'arthrose de l'arthrite inflammatoire (Breidahl et al. 1996). Semblable à l'imagerie par résonance magnétique améliorée au gadolinium, certaines tentatives ont été faites avec les États-Unis pour obtenir une estimation quantitative du volume synovial. Bien qu'une corrélation entre les résultats histologiques, les marqueurs cliniques de l'activité de la maladie et le volume synovial semble exister, de telles mesures prennent du temps et, par conséquent, ne sont pas actuellement applicables en pratique courante. Plus récemment, les agents de contraste US à base de microbulles semblent être un complément prometteur pour évaluer l'activité du processus pathologique (Magarelli et al. 2001 ; Klauser et al. 2002). Il y a eu de nombreux rapports dans la littérature sur le Doppler puissance plutôt que sur l'imagerie Doppler couleur pour détecter l'hyperémie synoviale. La technologie américaine actuelle indique cependant que la sensibilité des systèmes Doppler couleur pour détecter les signaux de débit sanguin lent et faible est maintenant au moins égale ou même supérieure à celle de l'imagerie Doppler puissance. Les principales limites des deux techniques sont essentiellement liées au manque de standardisation de la technique d'examen, de la reproductibilité, de l'expérience de l'opérateur et du choix du matériel (Cardinal et al. 1996 ; Koski et al. 2006).
Figure 23. a–f. Polyarthrite rhumatoïde : spectre des apparitions américaines de synovite dans la maladie active. Différents cas. une image US longitudinale 12–5 MHz sur le col fémoral antérieur (Fneck) montre un évidement antérieur distendu (astérisque) avec des parois synoviales épaissies (têtes de flèches). L'espace de la cavité est rempli d'épanchement mêlé de synovie hypoéchogène. b L'image échographique longitudinale 12–5 MHz au-dessus de l'évidement suprapatellaire (flèches) du genou montre des frondes synoviales proéminentes (sf) dans l'épanchement (astérisques), remplissant partiellement l'espace articulaire. Les frondes synoviales peuvent être vues se déplacer d'avant en arrière pendant la compression et la libération alternées de la sonde au-dessus de l'évidement. c Image échographique transversale 12–5 MHz sur le poignet dorsal avec une corrélation d'imagerie IRM pondérée en T2 avec suppression de la graisse et révélant une distension marquée des récessus carpiens dorsaux par un pannus synovial actif hypervasculaire (têtes de flèches ouvertes) (têtes de flèches blanches). Notez les multiples érosions (flèches) affectant les surfaces osseuses. e,f Des images échographiques longitudinales e en échelle de gris et f couleur Doppler 17–5 MHz sur le milieu du pied dorsal chez un patient se plaignant de douleur et de gonflement local montrent les espaces articulaires naviculaire-cunéiforme (1) et cunéiforme-métatarsien (2). La première articulation est caractérisée par une distension hypoéchogène de l'espace articulaire (astérisque) traduisant une synovite. Notez l'hyperémie marquée qui l'entoure sur l'image Doppler couleur. La deuxième articulation peut sembler normale sur l'échographie en niveaux de gris mais montre une augmentation du flux sanguin (flèche) sur l'imagerie Doppler couleur. Dans ce cas particulier, le Doppler couleur a augmenté la sensibilité de l'échographie en échelle de gris pour détecter l'atteinte articulaire au niveau médio-tarsien.
Dans la maladie avancée, le processus inflammatoire peut entraîner des érosions massives et des lésions osseuses étendues avec désintégration des structures des articulations et autour, fibrose, subluxation ou luxation et, au stade terminal, ankylose osseuse. Sur la base des mesures d'épaisseur du cartilage, l'échographie s'est avérée capable d'estimer la quantité de cartilage détruit (Grassi et al. 1993 ; Grassi et al. 1999). L'échographie peut également représenter des anomalies de l'espace articulaire à un stade plus précoce que la radiographie conventionnelle. Une caractéristique de la polyarthrite rhumatoïde est la libération d'un sous-ensemble de corps lâches, appelés « corps de riz », dans la cavité articulaire. Ces particules sont considérées comme le résultat de tissus synoviaux infarcis recouverts de fibrinogène ou d'agrégats de fibrine, de fibronectine ou de cellules multinucléaires (McCarthy et Cheung 1982; Popert 1985). Les États-Unis peuvent démontrer que les corps du riz sont des sphérules hypoanéchogènes mesurant quelques millimètres (Martini et al. 2003). Dans de nombreux cas, cependant, il peut être difficile de les distinguer de la synoviale hypertrophiée avec US (Fig. 24).
Parmi les arthropathies séronégatives (facteur rhumatoïde négatif), l'échographie s'est avérée utile pour examiner les patients atteints de rhumatisme psoriasique (Kane et al. 1999 ; Fiocco et al. 2005 ; Ory et al. 2005 ; Kane 2005). Comme la polyarthrite rhumatoïde, le rhumatisme psoriasique est une maladie chronique entraînant des lésions articulaires importantes à un stade précoce du processus de la maladie (Husted et al. 2001). Les articulations interphalangiennes distales sont généralement affectées selon un schéma asymétrique. Les caractéristiques radiographiques caractéristiques comprennent les érosions articulaires, le rétrécissement de l'espace articulaire, la prolifération osseuse, y compris la périostite périarticulaire et diaphysaire, l'ostéolyse avec déformation en "crayon dans la tasse" et l'acro-ostéolyse, l'ankylose, la formation d'éperons et la spondylarthrite. Dans le rhumatisme psoriasique, la synovite, l'enthésite et la ténosynovite peuvent être évaluées de manière fiable par échographie (Barozzi et al. 1998 ; Kane et al. 1999 ; Fiocco et al. 2005 ; Ory et al. 2005 ; Kane 2005 ; Falsetti et al. 2003). En général, les résultats des É.-U. ne sont pas spécifiques, car ils peuvent également survenir chez des patients atteints de polyarthrite rhumatoïde et d'arthrose (Fiocco et al. 2005 ; Ory et al. 2005). Dans la dactylite psoriasique (chiffon en saucisse), l'échographie peut montrer une hypertrophie des tissus mous sous-cutanés et, dans une moindre mesure, une ténosynovite et une synovite articulaire, ce dernier signe étant corrélé au pincement de l'interligne articulaire et à la périostite sur les clichés simples (Fig. 25) (Barozzi et al. 1998; Kane et al. 1999). Dans les arthropathies séronégatives, l'imagerie Doppler couleur sans contraste et avec contraste peut mettre en évidence une sacro-iliite active en montrant un schéma hypervasculaire autour de la face postérieure des articulations sacro-iliaques (Arslan et al. 1999 ; Klauser et al. 2005). Dans la spondylarthrite ankylosante, il existe une atteinte prédominante des grosses articulations, telles que le genou, l'épaule et la hanche, avec un rétrécissement uniforme de l'espace articulaire et une sclérose sous-chondrale et une synovite de bas grade. L'arthrite de Reiter est caractérisée par une atteinte fréquente des membres inférieurs distaux et un dépôt osseux visible. L'arthrite dans les maladies inflammatoires de l'intestin est, pour la plupart, transitoire et non destructrice ; les articulations les plus souvent atteintes sont le genou et la cheville. Les caractéristiques de l'arthrite juvénile idiopathique sont discutées en détail ailleurs.
Illustration 24. a, b. Corps de riz dans la polyarthrite rhumatoïde. une image US longitudinale 12–5 MHz sur la partie antérieure du genou montre un évidement suprapatellaire distendu (flèches) rempli de tissu solide hétérogène ressemblant à un pannus synovial. b L'image IRM sagittale pondérée en T2 correspondante révèle plusieurs points hypoéchogènes (têtes de flèches) dans le liquide lié aux corps du riz. L'apparence américaine des corps de riz peut être pratiquement impossible à distinguer du pannus synovial.
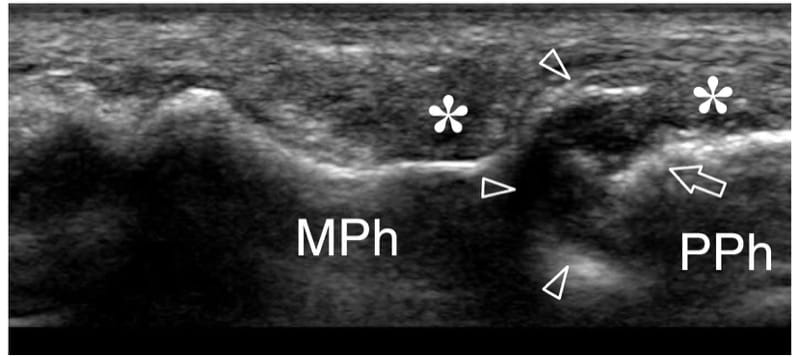
Figure 25. Dactylite psoriasique. L'image longitudinale 17–5 MHz des États-Unis sur l'articulation interphalangienne proximale du majeur chez une femme de 45 ans atteinte de rhumatisme psoriasique montre une destruction étendue de la surface articulaire (têtes de flèches) de la phalange moyenne (MPh). Une déformation coexistante (flèche) de la tête de la phalange proximale (PPh) et un aspect hétérogène des tissus mous para-articulaires (astérisques) sont retrouvés. Les constatations correspondent au signe radiographique appelé déformation « en forme de crayon ».
16. ARTHRITE SEPTIQUE
L'arthrite septique est une affection grave entraînant une maladie articulaire rapidement destructrice (Goldenberg 1998 ; Mohana-Borges et al. 2004). Cette condition est le plus souvent causée par Staphylococcus aureus (chez les adultes et les enfants de plus de 2 ans) et Neisseria gonorrheae (chez les jeunes adultes), qui ont un tropisme défini pour la synovie (Craig et al. 2003 ; Mohana-Borges et al. 2004 ). Une variété de streptocoques, y compris S. viridans et S. pneumoniae, groupe B, des bâtonnets Gram-négatifs aérobies, des virus, des mycobactéries et des champignons peuvent également produire une infection articulaire de manière isolée ou à la suite d'une association polymicrobienne (Jbara et al. 2006 ). Les mécanismes pathogéniques possibles de l'infection sont les suivants : ensemencement hématogène de la synoviale à partir d'un foyer distant ou d'une zone adjacente d'ostéomyélite ; propagation à partir d'un site infecté contigu, tel que les tissus mous du pied diabétique; et implantation accidentelle lors d'une arthrocentèse ou secondaire à des plaies pénétrantes et à une infection postopératoire (Mohana-Borges et al. 2004). Le mode de présentation le plus courant de l'arthrite septique est monoarticulaire. Les articulations les plus souvent atteintes sont la hanche, le genou, l'épaule, le coude et la cheville (Mohana-Borges et al. 2004 ; Chau et Griffith 2005). L'infection provoque une lyse du cartilage articulaire, un rétrécissement de l'espace articulaire et une ostéopénie périarticulaire. Les complications tardives de l'arthrite comprennent la sous-luxation articulaire, l'arthrose précoce, l'ostéonécrose, l'ankylose fibreuse ou osseuse et le raccourcissement des membres. Dans le contexte aigu, l'échographie est un moyen fiable de détecter une arthrite septique précoce avant la survenue d'une lyse importante du cartilage et lorsque les radiographies sont encore non contributives (Bureau et al. 1999). Le principal signe américain d'arthrite septique est la détection d'un épanchement articulaire chez un patient présentant des signes cliniques d'infection articulaire (douleur, rougeur, chaleur, gonflement des tissus mous autour de l'articulation concernée). En ce qui concerne l'échotexture fluide, les épanchements septiques contiennent souvent un schéma diffus d'échos de bas niveau et sont clairement démarqués des parois synoviales épaissies (Chau et Griffith 2005). Des épanchements très hyperéchogènes avec débris et septations sont souvent rencontrés. Cette apparence pourrait dérouter l'examinateur inexpérimenté car la collection semble solide sur les scans statiques ; cependant, l'examen dynamique et la compression de la sonde peuvent montrer un tourbillon d'échos indiquant le fluide (Fig. 26). Des bulles de gaz peuvent également être trouvées dans l'infection articulaire. En revanche, les collections complètement anéchoïques de liquide articulaire infecté sont rares. Cependant, ces caractéristiques sont trop subtiles pour permettre un diagnostic définitif et une aspiration de liquide à l'aiguille, éventuellement obtenue sous contrôle américain, est nécessaire pour confirmer la nature infectieuse de l'épanchement (Bureau et al. 1999 ; Widman et al. 2001). L'imagerie Doppler puissance montre presque invariablement un schéma de flux hyperémique synovial de synovie hypertrophiée et de tissus para-articulaires. Même si l'absence de liquide dans une articulation n'exclut pas une ostéomyélite adjacente, un examen d'échographie et d'imagerie Doppler négatif rend peu probable le diagnostic d'arthrite septique (Zawin et al. 1993).
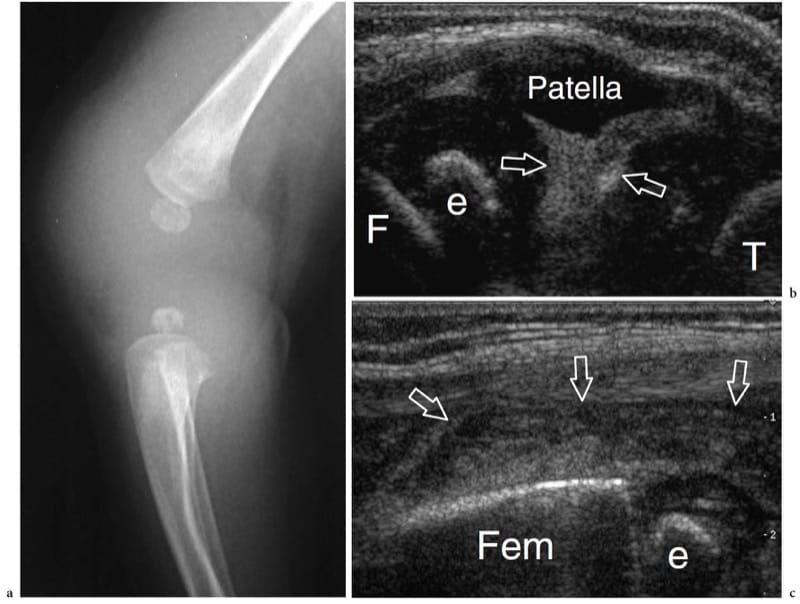
Illustration 26. a–c. Arthrite septique. a Une radiographie latérale du genou chez un nouveau-né présentant de la fièvre et un genou enflé douloureux suggérant une infection révèle un gonflement diffus des tissus mous et un espace articulaire du genou élargi. b,c Les images échographiques longitudinales 12–5 MHz obtenues sur b la rotule et c le récessus suprapatellaire montrent la cavité articulaire remplie de liquide dense hautement échogène (flèches) lié à du matériel purulent et à des débris. Notez l'aspect hypoéchogène de la rotule non ossifiée et des cartilages épiphysaires du fémur (F) et du tibia (T). e, centre d'ossification de l'épiphyse fémorale distale. L'aspiration du liquide articulaire a révélé une infection à Staphylococcus aureus.
17. BLESSURES TRAUMATIQUES
Lorsqu'elles affectent des parties articulaires qui se prêtent à l'examen américain, l'ostéochondrose et les fractures ostéochondrales peuvent être détectées comme des irrégularités de surface du cartilage ou la formation d'un nidus impliquant le cartilage et l'os sous-chondral (Takahara et al. 1988). Dans l'arthrose dégénérative, le cartilage peut apparaître progressivement plus mince et irrégulier, voire complètement désagrégé, alors que la ligne hyperéchogène de l'os sous-chondral présente des irrégularités. Aux États-Unis, les ostéophytes sont généralement représentés au niveau des marges articulaires sous forme de projections osseuses hyperéchogènes en forme de bec recouvertes de cartilage. À la suite de fractures de la surface articulaire ou d'autres conditions entraînant un dérangement progressif des articulations (c.-à-d. arthrose, ostéo-chondromatose, maladie articulaire neuropathique), des corps étrangers peuvent être libérés dans la cavité articulaire, entraînant éventuellement un blocage intermittent de l'articulation et des changements dégénératifs précoces. Les corps étrangers intra-articulaires sont des fragments osseux, chondraux ou ostéochondraux. Ils ont souvent une structure à trois couches composée d'un écho brillant superficiel dû à un artefact à l'interface avec le fluide, d'une bande hypoéchogène intermédiaire due au cartilage et d'une surface hypoéchogène profonde avec une ombre acoustique postérieure due à la composante osseuse (Bianchi et Martinoli 2000). Dans de nombreux cas, l'échographie peut donner une meilleure délimitation des corps étrangers que les films simples et l'imagerie par résonance magnétique (Fig. 27). D'autre part, l'imagerie par résonance magnétique est supérieure pour détecter le nidus du fragment. Un aspect monolaminaire est observé dans les vieux fragments largement calcifiés, qui apparaissent comme des images hyperéchogènes comme des calculs biliaires sans bord détectable de cartilage hypoéchogène (Bianchi et Martinoli 2000). Pendant le mouvement articulaire ou lors de l'application de la pression du transducteur, des corps libres peuvent être mobilisés dans les cavités articulaires : cela peut être utile pour le diagnostic différentiel avec des ostéophytes ou des calcifications capsulaires et synoviales.
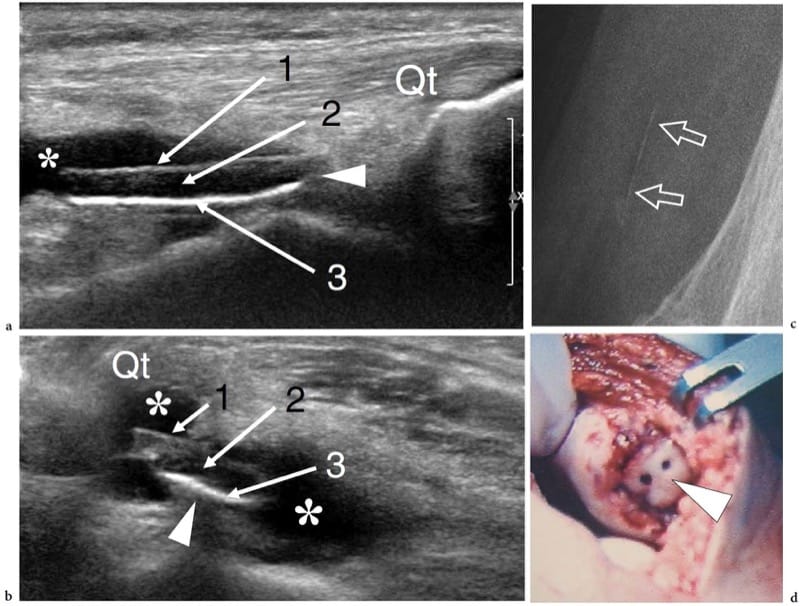
Illustration 27. a–d. Fracture ostéochondrale. a Des images américaines longitudinales et b transversales à 17–5 MHz de la partie antérieure du genou chez un patient présentant un début de tuméfaction douloureuse et un blocage du genou suite à un épisode de luxation rotulienne montrent un récessus suprapatellaire distendu (astérisques) contenant un corps ostéochondral lâche (tête de flèche) . Le fragment est caractérisé par une structure tricouche composée de : un écho lumineux superficiel (1) dû à la désadaptation d'impédance acoustique à l'interface solide-fluide ; une couche hypoéchogène intermédiaire (2) due au cartilage ; et une surface échogène profonde et brillante (3) avec une légère atténuation postérieure due à l'os sous-chondral détaché. c La radiographie de profil est incapable de révéler le corps meuble à l'exception d'une image linéaire radio-opaque subtile (flèches) reflétant sa composante osseuse. Qt, tendon du quadriceps. d La vue opératoire macroscopique montre le corps libre (tête de flèche) fixé dans le nidus rotulien.
Le diagnostic d'instabilité articulaire repose essentiellement sur des radiographies simples. Dans certains cas, cependant, l'anatomie complexe des articulations et des structures environnantes peut rendre difficile la détection de la subluxation et de la luxation des articulations sur les radiographies standard. Si elle n'est pas détectée, l'instabilité articulaire peut entraîner des douleurs locales chroniques, une arthrose secondaire et une altération de la fonction articulaire. Dans des contextes cliniques spécifiques où l'examen physique peut ne pas être concluant, l'échographie peut contribuer à la détection d'anomalies articulaires positionnelles occultes, y compris la luxation postérieure de l'épaule et une légère instabilité de l'articulation acromio-claviculaire (Hunter et al. 1998 ; Bianchi et al. 1994 ; Bize et al. 2004 ; Borsa et al. 2005).
De nombreuses articulations contiennent des structures fibrocartilagineuses, notamment le ménisque du genou, le labrum de la hanche et de l'épaule, le fibrocartilage triangulaire du poignet et les plaques palmaire et plantaire de la main et du pied. En raison de leur emplacement profond et de leur contact étroit avec l'os, ces structures ne peuvent être évaluées par échographie que partiellement et de manière non fiable. Bien que différents auteurs aient signalé une sensibilité et une spécificité élevées de l'échographie dans le diagnostic des déchirures du ménisque du genou et du labrum de l'épaule (Sohn et al. 1987a, b ; Schydlowsky et al. 1998 ; Hammar et al. 2001), d'autres preuves ont démontré que l'échographie ne peut pas être considéré comme une technique précise pour diagnostiquer les déchirures du fibrocartilage (Azzoni et Cabitza 2002). En particulier, distinguer les déchirures des états dégénératifs est problématique sur la base des découvertes américaines en raison d'un modèle d'échotexture similaire. Cependant, certaines conditions impliquant la partie superficielle de ces structures, telles qu'un ménisque extrudé, un décollement méniscocapsulaire avec fluide s'intercalant entre la capsule et le fibrocartilage ou un osselet méniscal peuvent être déduites à l'échographie. Une première expérience est également disponible dans la littérature sur l'investigation échographique du fibrocartilage triangulaire normal du poignet et des plaques palmaires (Boutry et al. 2004 ; Chiou et al. 1988 ; Keogh et al. 2004). Cependant, d'autres études sont nécessaires pour établir la valeur ultime de l'échographie dans l'imagerie des conditions pathologiques affectant ces structures. Contrairement aux résultats de l'évaluation du fibrocartilage, l'échographie s'est avérée être une modalité efficace pour diagnostiquer les kystes paraméniscals et paralabraux (Peetrons et al. 1990 ; Rutten et al. 1998 ; Seymour et Lloyd 1998). On pense que ces kystes dérivent de forces tangentielles ou compressives qui entraînent un traumatisme, une dégénérescence et une déchirure du fibrocartilage. Le liquide synovial est expulsé à travers la déchirure vers la marge périphérique du fibrocartilage, l'expansant et déplaçant la capsule vers l'extérieur dans les tissus environnants (McCarthy et McNally 2004). Étant donné que ces kystes sont presque invariablement associés à une déchirure du fibrocartilage, le diagnostic américain d'une rupture méniscale ou labrale associée est simple, même en cas de résultats peu clairs ou douteux (Fig. 28a, b). Le kyste peut suivre une certaine distance depuis le fibrocartilage avant de devenir cliniquement palpable et l'échographie peut montrer un pédicule étroit le reliant à la déchirure. Les kystes paraméniscals et paralabraux apparaissent comme des masses occupant de l'espace avec des bords nettement définis. Ils présentent souvent une échotexture interne mixte à la suite d'une dégénérescence mucoïde ou apparaissent comme un ramollissement et un gonflement indéfinis des espaces conjonctifs dans lesquels ils se développent (Fig. 28c, d). Même s'ils sont de petite taille, les kystes liés au labrum peuvent entraîner une neuropathie des nerfs adjacents, tels que le nerf suprascapulaire (kystes du labrum glénoïde postérieur), le nerf axillaire (kystes du labrum glénoïde inférieur) et le nerf fémoral (kystes du labrum acétabulaire antérieur) ( Takagishi et al. 1991).
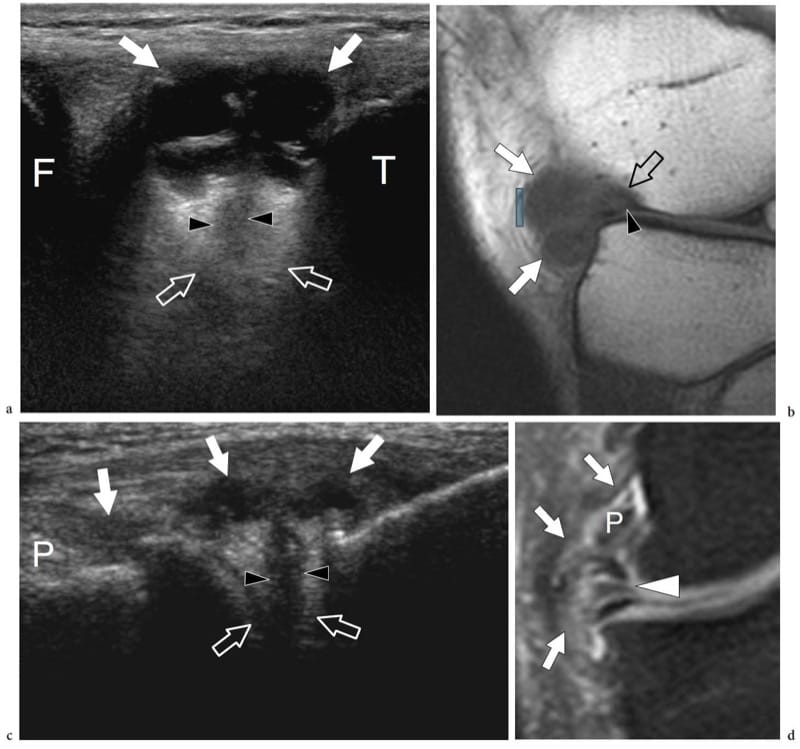
Illustration 28. a–d. Kystes associés à des lésions du fibrocartilage. Spectre d'apparitions échographiques de kystes paraméniscals chez deux patients différents. a Image échographique sagittale oblique 17–5 MHz avec corrélation d'imagerie IRM pondérée en T1 sagittale b sur le genou antérolatéral montre un gros kyste (flèches blanches) avec des septa internes adjacents à la corne antérieure du ménisque latéral (flèches ouvertes). Une fente (pointes de flèches) représentant une déchirure méniscale horizontale s'étend à travers le ménisque. F, fémur ; T, tibia. c Image échographique coronale 12–5 MHz obtenue au-dessus du genou latéral avec une corrélation d'imagerie IRM pondérée en T2 avec suppression de la graisse montrant une déchirure dégénérative horizontale (têtes de flèches) du tiers médian du ménisque latéral (flèche ouverte) associée à une extrusion de liquide articulaire dans les tissus mous adjacents formant un kyste de forme irrégulière (flèches blanches). Remarquez le tendon poplité (P) partiellement entouré de liquide.
Des déchirures ligamentaires peuvent être démontrées par échographie à différents sites, y compris la cheville et le pied (Campbell et al. 1994 ; Peetrons et al. 2004), le poignet et la main (Jones et al. 2000 ; Noszian et al. 1995 ; Finlay et al. 2004 ; Boutry et al. 2005), le genou (Ptasznik et al. 1995 ; Miller 2002 ; O'Reilly et al. 2003) et le coude (Nazarian et al. 2003). Les caractéristiques américaines d'un ligament déchiré varient selon que la lésion est aiguë ou guérie. Dans les phases aiguës, un ligament partiellement déchiré apparaît gonflé et hypoéchogène mais continu (Fig. 29a); une bande anéchoïque sur la face superficielle du ligament peut être observée représentant un œdème réactif des tissus mous (Peetrons et al. 2004). Dans les ligaments complexes, l'échographie peut distinguer la partie hypoéchogène anormale du ligament de la partie non affectée conservant un aspect normal (Fig. 29b). Dans les ruptures complètes aiguës, une fente hypoéchogène reflétant l'hématome peut être détectée à travers la substance ligamentaire et les extrémités libres du ligament sectionné peuvent apparaître rétractées et ondulées (Fig. 30a, b). Dans les cas douteux, la possibilité d'évaluer le ligament de manière dynamique est un avantage certain de l'échographie : à l'effort, un ligament normal se resserre empêchant un élargissement excessif de l'interligne articulaire ; si le ligament est déchiré, on obtient un mouvement paradoxal traduisant une instabilité articulaire (Fig. 30) (De Smet et al. 2002 ; Brasseur et al. 2005). Dans les déchirures partielles chroniques, le ligament apparaît toujours plus épais que la normale sur les images américaines. Des calcifications au sein de la substance ligamentaire dans les déchirures anciennes et des irrégularités des insertions osseuses dans les lésions par avulsion peuvent être observées (Fig. 31) (Brasseur et al. 2005). Un exemple typique est le syndrome de Pellegrini-Stieda (calcification de l'extrémité proximale du ligament collatéral médial du genou). Dans les allongements ligamentaires consécutifs à une déchirure partielle, un balayage dynamique lors d'une manœuvre d'effort obtenue au repos et lors d'un étirement peut être utile pour distinguer une laxité normale d'une déchirure ligamentaire partielle basée sur un élargissement de l'espace articulaire (Nazarian et al. 2003 ; Peetrons et al. 2004 ). L'importance de ces manœuvres n'a pas encore été pleinement déterminée.
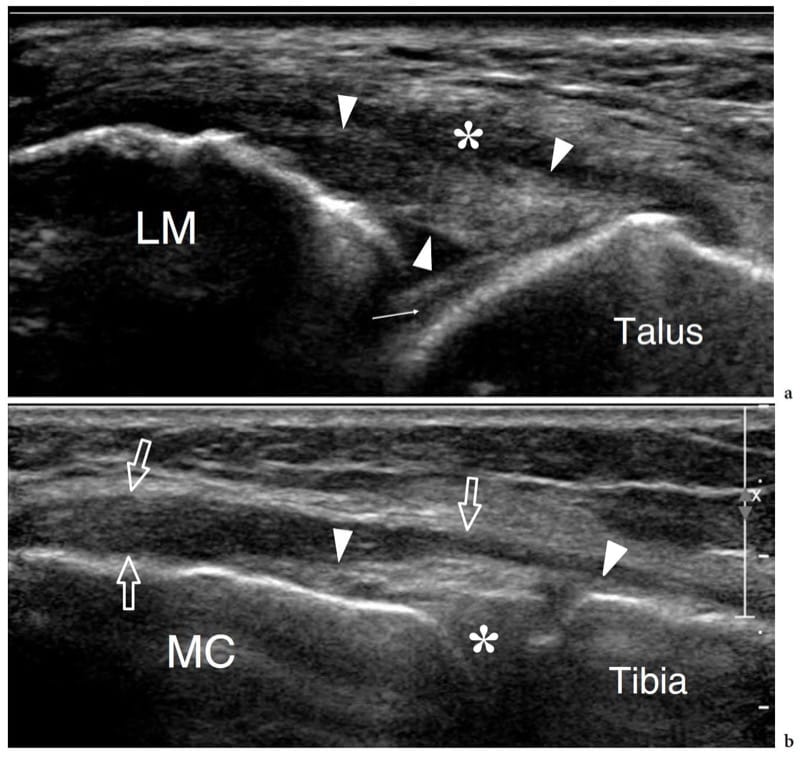
Illustration 29. a, b. Déchirure ligamentaire partielle. une image échographique grand axe 17–5 MHz sur le ligament talofibulaire antérieur (têtes de flèches) chez un patient suite à une blessure d'inversion de la cheville montre un ligament nettement épaissi et hypoéchogène mais droit sans signes de discontinuité macroscopique. Une bande liquidienne hypoéchogène (astérisque) souligne l'aspect superficiel du ligament traduisant un œdème réactif des tissus mous. LM, malléole latérale. Flèche, cartilage articulaire du talus. b L'image coronale 17–5 MHz US sur la face médiale du condyle fémoral médial (MC) révèle un épaississement hypoéchogène diffus de la composante superficielle (flèches) du ligament collatéral médial proximal, tandis que la composante méniscofémorale profonde (têtes de flèches) n'est pas affectée. Astérisque, ménisque médial.

Figure 30. a–g. Rupture ligamentaire complète. Spectre des apparitions échographiques dans a–d les ligaments talo-fibulaires antérieurs et, par exemple, les ligaments scapho-lunaires. une image US à axe long 17–5 MHz obtenue au repos sur le ligament talofibulaire antérieur après une blessure d'inversion avec une corrélation de dessin schématique b montre les extrémités déchirées (1, 2) du ligament sous une forme ondulée avec un hématome s'insinuant entre elles. c,d Lors d'un test de tiroir antérieur, il y a une ouverture (grandes flèches) de l'espace articulaire (astérisques) et les extrémités des ligaments sont plus clairement séparées les unes des autres. e L'image US transversale 17–5 MHz sur la face dorsale de la rangée carpienne proximale montre un ligament scapho-lunaire normal (flèches) joignant le lunatum (Lun) et le scaphoïde (Scaph). f,g Images échographiques transversales 17–5 MHz obtenues chez un patient ayant déjà subi une blessure au poignet. f En position neutre, il y a absence du ligament scapho-lunaire par rapport aux résultats normaux indiqués en e. Les lignes pointillées délimitent la distance entre
le scaphoïde et le lunatum. g Lors de la déviation ulnaire du poignet, on observe un élargissement (flèches) de la distance scapho-lunaire : cela peut être considéré comme un signe de rupture ligamentaire.
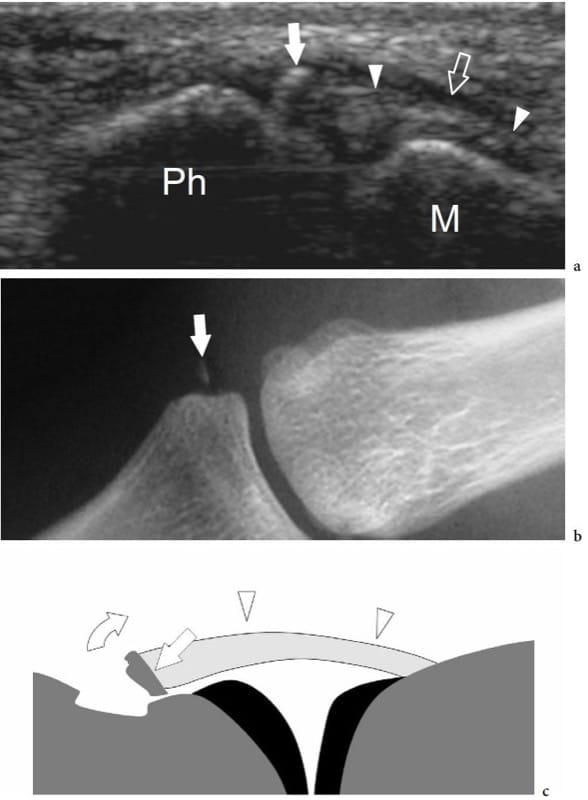
Illustration 31. a–c. Lésion par avulsion du ligament collatéral ulnaire du pouce (pouce du garde-chasse). une image coronale 15–7 MHz US obtenue sur la face ulnaire de l'articulation métacarpo-phalangienne du pouce avec une corrélation radiographique b et schématique c montre un ligament collatéral ulnaire rétracté (têtes de flèches) situé profondément à l'aponévrose de l'adducteur du pouce (flèche droite ouverte). Remarquez une petite tâche osseuse hyperéchogène distale (flèche droite blanche) correspondant à une avulsion corticale (flèche courbe) de la base de la phalange proximale (Ph). L'insertion du ligament proximal sur le premier métacarpien (M) semble normale.
18. MALADIE DÉGÉNÉRATIVE DES ARTICULATIONS (ARTHROSE)
Le terme « arthrose » (maladie dégénérative des articulations) comprend un groupe hétérogène de troubles caractérisés par une intégrité défectueuse du cartilage articulaire et des modifications associées de l'os sous-jacent et des marges articulaires (Felson 2004 ; Gupta et al. 2004). L'arthrose est la forme de maladie articulaire la plus répandue dans le monde occidental et peut être divisée en formes idiopathiques et secondaires (Gupta et al. 2004). Les causes de l'arthrose comprennent diverses combinaisons de facteurs de risque systémiques (vieillissement, hérédité, déficit en œstrogènes), de vulnérabilités articulaires locales (blessures antérieures, désalignement osseux) et de facteurs extrinsèques agissant sur l'articulation (obésité, faiblesse musculaire, surmenage professionnel et sportif mais aussi sous-utilisation chronique) (Felson et al. 2004). L'anomalie initiale de l'arthrose survient au niveau du cartilage articulaire avec un œdème suivi d'une fibrillation et de fentes superficielles et profondes évoluant éventuellement vers des ulcérations et la production de nouveau cartilage et d'os. Dans les formes sévères, une perte complète de cartilage associée à des modifications pathologiques de l'os sous-chondral (c.-à-d. sclérose, kystes) et des ostéophytes marginaux peut survenir. Des corps lâches intra-articulaires peuvent se développer à la suite du détachement de petits morceaux de cartilage ou de fragments d'os qui peuvent activer une nouvelle formation chondrale ou osseuse. Le diagnostic de l'arthrose repose essentiellement sur les données cliniques et radiographiques. L'échographie est capable de détecter les anomalies de la surface articulaire et du cartilage hyalin (Grassi et al. 2005). Les changements comprennent un amincissement progressif et une irrégularité de la couche de cartilage jusqu'à sa désintégration complète et des irrégularités de l'os sous-chondral sous-jacent (Fig. 32) (Grassi et al. 1999). L'une des principales limites de l'échographie dans l'évaluation de l'arthrose est l'évaluation incomplète de la surface du cartilage, qui est, pour la plupart, masquée par les extrémités des os opposés. Cela est vrai pour les joints serrés et les gros joints. Au genou, par exemple, les cartilages articulaires vulnérables aux déchirures et aux ulcérations sont principalement localisés à la face postéro-inférieure du condyle fémoral et sur la face latérale de la rotule : les deux surfaces sont peu évaluées à l'échographie. De même, les géodes (kystes sous-chondraux) ne sont pas visibles à l'échographie car elles sont complètement entourées d'os. D'autre part, les ostéophytes peuvent être facilement appréciés comme des projections osseuses en forme de bec recouvertes de cartilage hypoéchogène adjacent à la ligne articulaire (Fig. 33). Ils augmentent la surface du cartilage articulaire, diminuant ainsi les contraintes et les forces de charge subies par l'articulation et, en même temps, augmentant sa stabilité : les emplacements typiques des ostéophytes sont la tête humérale postérieure, le fémorotibial interne et le antérieur. articulations tibiotaliennes (Gupta et al. 2004). Enfin, l'échographie peut être utile pour évaluer les anomalies des tissus mous para-articulaires qui peuvent être responsables de douleurs dans l'arthrose et peuvent aider à guider l'injection intra-articulaire de médicaments (Naredo et al. 2005 ; Migliore et al. 2005).
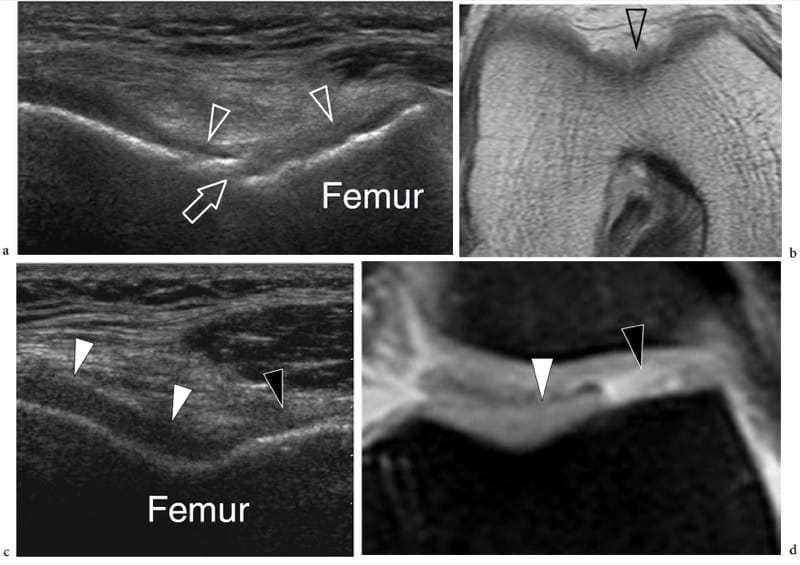
Figure 32. a–d. Arthrose dégénérative. Deux cas différents. a Une image US transversale 12–5 MHz obtenue sur le cartilage trochléaire avec une corrélation d'imagerie IRM de densité de protons b montre un amincissement diffus (têtes de flèches) du tiers médian du cartilage. Notez les changements érosifs (flèche) dans l'os sous-chondral. c,d Perte de cartilage articulaire du compartiment latéral. c Image échographique transversale 12–5 MHz avec corrélation d'imagerie IRM à densité de protons avec suppression de la graisse montre un large défaut cartilagineux (tête de flèche noire) dans la facette latérale de la trochlée. Notez le cartilage d'apparence normale du compartiment trochléaire médial (têtes de flèches blanches).
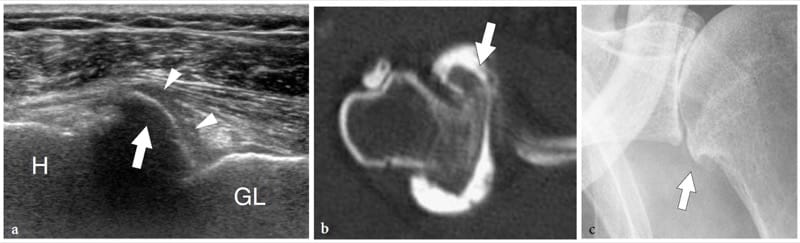
Illustration 33. a–c. Arthrose dégénérative. a Image échographique transversale 12–5 MHz obtenue sur la face antérieure de l'articulation gléno-humérale avec b CT-arthrographie et c corrélation radiographique standard chez un patient atteint d'une maladie articulaire dégénérative avancée montre un gros ostéophyte marginal de l'humérus (H) en forme de bec- comme une projection osseuse (flèche) adjacente à la ligne articulaire, recouverte de cartilage hypoéchogène (têtes de flèches). GL, glène osseuse.
19. MALADIES DE DÉPÔT
Le dépôt de cristaux d'urate monosodique (goutte), de pyrophosphate de calcium déshydraté (CPPD ; chondrocalcinose, pseudogoutte) et d'hydroxyapatite de calcium (HADD ; tendinite calcifiante) dans la synoviale, le cartilage articulaire, les fibrocartilages et les tissus mous para-articulaires peut produire un éventail de conditions cliniques allant d'entités asymptomatiques à une arthropathie sévère rapidement destructrice (Steinbach 2004 ; Clement et al. 2005). L'accumulation de cristaux met des mois à des années à se développer et conduit à l'établissement d'une synovite chronique avec poussées aiguës intermittentes.
La goutte est la forme la plus courante d'arthropathie microcristalline, avec un pic d'incidence chez les hommes entre la troisième et la cinquième décennie (Monu et Pope 2004). Elle résulte d'une perturbation du métabolisme de l'urate et comprend des formes aiguës et chroniques. La goutte aiguë affecte généralement la première articulation métatarsophalangienne du pied (podagre), mais presque toutes les autres articulations peuvent être impliquées. Les crises initiales sont monoarticulaires et concernent généralement le membre inférieur. Après des poussées intermittentes ou des exacerbations sur une période de plusieurs années, la maladie devient chronique et tend à impliquer plusieurs articulations. Une articulation enflammée partage la présentation habituelle avec une synovite aiguë, y compris un épanchement articulaire, un œdème para-articulaire et une hyperémie. En général, les cristaux goutteux ne sont pas représentés avec les échographies à moins que des agrégats plus gros ne se soient calcifiés (Farina et al. 2002). Fondamentalement, les résultats américains ne sont pas spécifiques à une maladie (Filippucci et al. 2003). L'échographie peut être utilisée pour la surveillance à court terme des crises de goutte aiguës (Filippucci et al. 2003). Les résultats de l'échographie dans la goutte tophacée chronique sont décrits ailleurs.
La maladie des dépôts de cristaux de pyrophosphate de calcium déshydraté est répandue chez les personnes âgées et présente des présentations cliniques à multiples facettes allant d'une maladie asymptomatique à une arthropathie destructrice douloureuse sévère, avec des symptômes qui confondent souvent les cliniciens (Steinbach 2004). Les patients peuvent se plaindre soit de douleurs articulaires chroniques imitant l'arthrose, soit d'une articulation enflée et enflammée imitant la goutte (pseudogoutte) ou d'une articulation septique. Le genou est l'articulation la plus touchée (cartilage articulaire et ménisque), suivi de la hanche (symphyse pubienne), du poignet (fibrocartilage triangulaire, ligaments intrinsèques), de l'articulation gléno-humérale, du coude et de la cheville. Lors des crises de pseudogoutte, il se produit une libération de cristaux de pyrophosphate dans le liquide articulaire. En général, ces crises sont spontanément résolutives, moins douloureuses que les crises de goutte et peuvent durer jusqu'à plusieurs semaines, entraînant une raideur articulaire et une limitation des mouvements articulaires. Les radiographies standard peuvent montrer de petits dépôts calcifiés dans le cartilage hyalin dégénéré, la synoviale et les structures para-articulaires, y compris les ligaments, les tendons et les bourses (Abreu et al. 2004 ; Steinbach 2004). Un diagnostic concluant est basé sur la détection de cristaux de pyrophosphate dans le liquide synovial au moyen d'un microscope polarisant. L'échographie peut démontrer le dépôt de cristaux dans le cartilage articulaire sous forme de multiples points hyperéchogènes dans l'épaisseur moyenne du cartilage formant une ligne échogène dense qui s'étend parallèlement à la marge articulaire, en particulier au niveau des condyles fémoraux (Fig. 34) (Kellner et al. 1990 ; Coari et al. 1995 ; Foldes 2002 ; Sofka et al. 2002 ; Frediani et al. 2005). Trois schémas principaux de dépôts calcifiés ont été décrits (Frediani et al. 2005) : de fines bandes hyperéchogènes parallèles à la surface du cartilage hyalin (plus fréquentes au niveau du genou) ; un motif « ponctué », composé de plusieurs fines taches échogènes lumineuses (fréquemment observées dans le fibrocartilage et les tendons) ; et des dépôts nodulaires ou ovales hyperéchogènes homogènes (trouvés dans les bourses et les cavités articulaires).
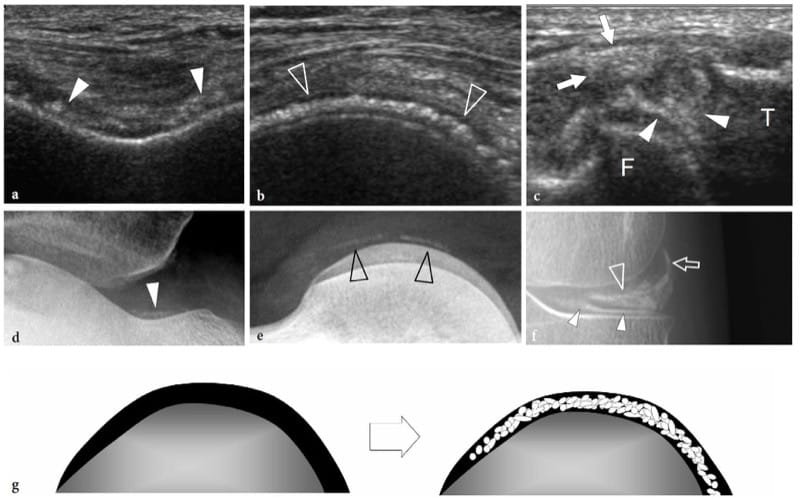
Figure 34. a–g. Maladie des dépôts de pyrophosphate de calcium. a–c Des images échographiques transversales 12–5 MHz obtenues sur a la trochlée fémorale, b la face postérieure du condyle médial et c le ménisque latéral chez un patient atteint d'arthrose dégénérative bilatérale du genou révèlent des foyers hyperéchogènes dispersés (têtes de flèches) dus au cristal dépôt dans le cartilage hyalin, le ménisque médial et la capsule articulaire (flèches). F, fémur ; T, tibia . Notez que les cristaux ont tendance à se déposer dans la couche médiane du cartilage, parallèlement à l'os sous-chondral. d–f Corrélation radiographique. g Le dessin schématique illustre le schéma de dépôt typique des cristaux de pyrophosphate dans le cartilage.
L'atteinte intra-articulaire de la maladie des dépôts d'hydroxyapatite de calcium - une affection plus communément appelée «tendinite calcifiante» en raison de l'atteinte des tendons à proximité de leur insertion osseuse - peut produire une arthrite aiguë (arthropathie chronique à l'apatite) imitant éventuellement une affection infectieuse.
L'amylose est une complication clinique majeure avec divers sous-types qui surviennent en association avec le myélome multiple (maladie primaire), d'autres troubles chroniques (maladie secondaire) et chez les patients souffrant d'insuffisance rénale chronique sous traitement d'hémodialyse à long terme (Jbara et al. 2006). Sa prévalence augmente avec la durée de l'hémodialyse, allant d'environ 20 % des cas dans les 2 ans de traitement à la quasi-totalité des cas après 13 ans (Dzido et Sprague 2003). Cette maladie multiorganique est liée au dépôt de β2 microglobuline dans les tissus. Dans le système musculo-squelettique, le dépôt d'amyloïde se produit généralement sur des surfaces contenant du collagène, le plus souvent la synovie des articulations et des tendons. Une telle prédilection semble être liée à l'activation des macrophages et des cytokines, un processus qui pourrait être impliqué à la fois dans le traitement protéolytique de la molécule - une étape qui augmenterait la formation d'amyloïde - et dans la génération de douleur, de dysfonctionnement et même d'arthropathie destructrice (Bancroft et al. 2004). Dans sa forme articulaire, l'amylose implique le plus souvent la hanche, le genou et le poignet entraînant le développement de gros kystes sous-chondraux remplis d'amyloïde dans l'os juxta-articulaire. L'épaisseur des tissus mous anormaux mesurée par échographie dans la cavité antérieure de la hanche et la cavité suprapatellaire du genou s'est avérée positivement corrélée avec la durée de la dialyse et les signes radiologiques et histologiques d'amylose (Jadoul et al. 1993). Sur la base des découvertes échotexturales, les dépôts amyloïdes ne peuvent être distingués des autres pathologies synoviales (Fig. 35a, b). L'IRM met en évidence une amyloïde avec un signal faible à intermédiaire sur les séquences pondérées en T1 et T2 (Fig. 35c, d) (Cobby et al. 1991).
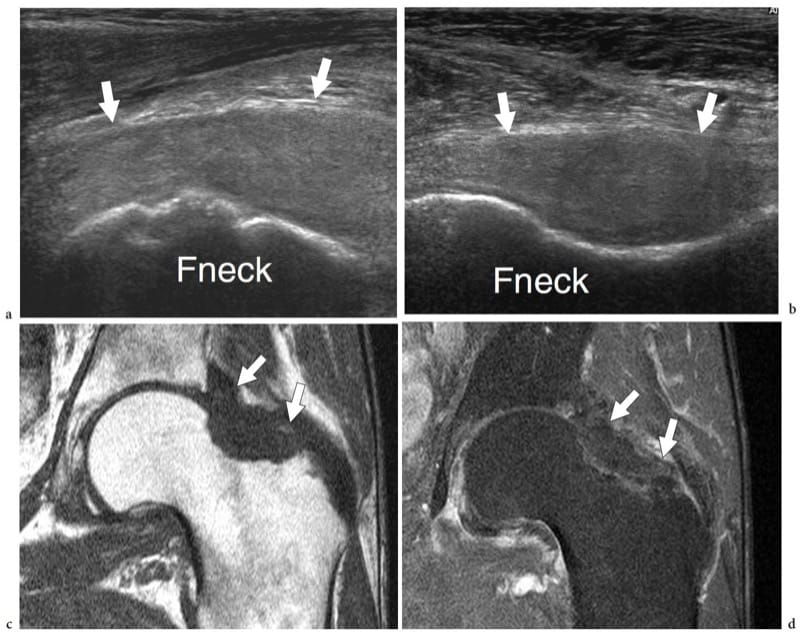
Figure 35. a–d. Arthropathie amyloïde. a Des images échographiques transversales et b longitudinales 12–5 MHz obtenues sur la hanche antérieure chez un patient atteint d'insuffisance rénale chronique montrent une distension de l'évidement articulaire antérieur (flèches) par un tissu solide homogène et hypoéchogène. c,d Corrélation d'imagerie IRM coronale c pondérée en T1 et d pondérée en T2 avec suppression de la graisse confirme la présence d'amyloïde intra-articulaire (flèches), caractérisée par de faibles intensités de signal. Fcol, col fémoral.
20. COMPLICATIONS POSTOPÉRATOIRES
La détection et la localisation de l'infection postopératoire peuvent être une tâche difficile. L'arthrite septique compliquant les procédures de remplacement de l'articulation de la hanche et du genou est un facteur de risque important qui concerne environ 2 % des cas (Goldenberg 1998). Sur la base des résultats cliniques et radiographiques, il peut être impossible de distinguer le descellement mécanique d'une prothèse d'un descellement septique (Bureau et al. 1999). La médecine nucléaire, la tomodensitométrie et l'imagerie par résonance magnétique peuvent être altérées autour du matériel orthopédique par un blindage métallique et des artefacts. L'échographie est moins entravée à plusieurs de ces égards et peut être considérée comme la modalité de diagnostic de première ligne dans ce contexte, à condition qu'un accès adéquat à la sonde soit disponible (Chau et Griffith 2005). Au niveau de la hanche postopératoire, une infection peut être suspectée à l'échographie par la présence d'un important épanchement articulaire (distance moyenne os-pseudocapsule : normale, 3.2 mm ; infecté, 10.2 mm) associé à une collection extracapsulaire de liquide des tissus mous non communicants et locale changements inflammatoires (van Holsbeeck et al. 1994). Plus récemment, cependant, une étude rétrospective a révélé certaines limites de l'échographie en tant qu'indicateur d'épanchement de l'articulation de la hanche chez l'adulte, même en situation postopératoire (Weybright et al. 2003). Lorsqu'une collection est présente autour d'une hanche postopératoire, l'échographie peut guider efficacement l'arthrocentèse pour obtenir du matériel pour la coloration de Gram et la culture bactérienne (van Holsbeeck et al. 1994 ; Gibbon et al. 2002). L'échographie Doppler peut également être utilisée pour exclure une thrombose veineuse profonde après une arthroplastie totale de la hanche ou du genou, en particulier si la prophylaxie antithrombotique pharmacologique périopératoire de routine n'est pas pratiquée (Ko et al. 2003).
La synovite granulomateuse peut être observée à la suite d'une réaction à de petites particules de polymères de silicone ou d'autres composants synthétiques de prothèses secondaires à la desquamation, appelée «synovite silastique» ou «synovite détritique». Souvent rencontrée dans les implants de poignet, cette affection découle d'une sorte de réponse à corps étranger, dans laquelle les macrophages activés provoquent une résorption osseuse et une dissection autour de l'implant (Bancroft et al. 2004). Les radiographies standard montrent une clarté sous-chondrale bien définie et des érosions généralement associées à une fracture et/ou une luxation de la prothèse (Rosenthal et al. 1983 ; Schneider et al. 1987). L'IRM confirme les résultats radiographiques et met en évidence de multiples petites particules hypointenses qui représentent des fragments de silicone résultant de la rupture et de la désintégration de l'implant (Chan et al. 1998). L'échographie peut démontrer que les débris dérivés de l'implant sont des taches hyperéchogènes incrustées dans la synoviale hypertrophiée : ces fragments doivent être différenciés des calcifications en fonction de la présence d'une réverbération postérieure et d'un artefact de sonnerie (Fig. 36).
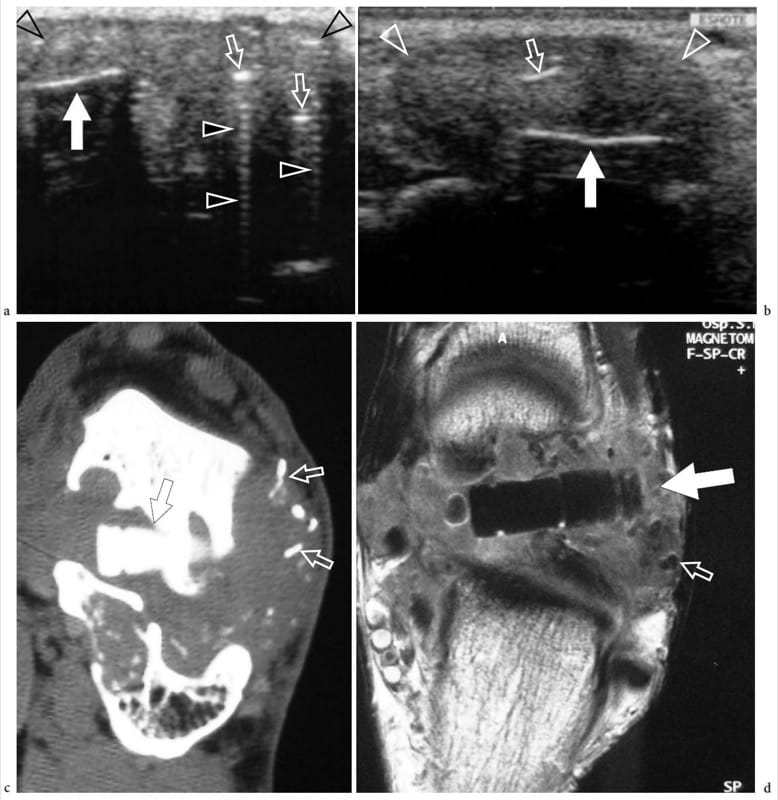
Figure 36. a–d. Synovite silastique. a Les images échographiques coronales et b transversales 12–5 MHz obtenues sur la face latérale du sinus du tarse chez un patient précédemment opéré d'un pied plat montrent une masse solide hypoéchogène (têtes de flèches ouvertes) contenant de multiples points hyperéchogènes (flèches ouvertes) avec réverbération postérieure artefact (pointes de flèches noires). Une grande structure hyperéchogène (flèche blanche) se trouve également en saillie à l'extérieur du sinus du tarse. c Les images CT coronales reformatées et d IRM transversales pondérées en T1 identifient une résorption osseuse étendue et une hypertrophie synoviale frappante autour d'une prothèse en silicone desserrée (flèche blanche). Certaines particules (flèches pleines) représentant des fragments de silicone sont également retrouvées.
21. MASSES OCCUPANT L'ESPACE
Tumeurs osseuses
Le rôle de l'échographie pour la détection et l'évaluation des tumeurs osseuses est évidemment faible, compte tenu de son incapacité à définir les processus intra-osseux. L'échographie ne peut détecter que les lésions associées à un amincissement cortical considérable et/ou à une grande propagation extraosseuse, telles que de grosses tumeurs érodant le cortex (Saifuddin et al. 1998). Lors de l'évaluation des tumeurs osseuses, l'échographie peut être utile dans deux situations cliniques principales : la détection d'une tumeur par ailleurs insoupçonnée, ou comme guide pour une biopsie percutanée d'une tumeur osseuse déjà étudiée avec des radiographies standard, une tomodensitométrie et une imagerie par résonance magnétique. Il n'est pas rare que des patients porteurs d'une tumeur osseuse, primitive ou métastatique, se plaignent de douleurs régionales non spécifiques et subissent un examen échographique pour une suspicion d'anomalie des tissus mous avant une étude radiographique. Par conséquent, une évaluation minutieuse de la surface osseuse doit faire partie d'un examen échographique standard des tissus mous et les signes échographiques suggérant une éventuelle anomalie osseuse - même minime - doivent être connus de l'examinateur.
Dans les tumeurs ostéolytiques à extension extraosseuse, l'échographie montre une masse périosseuse des tissus mous résultant d'une rupture ou d'un défect profond du cortex osseux hyperéchogène (Fig. 37). La continuité directe de la masse de l'os interne dans les tissus mous adjacents est un signe de l'origine intra-osseuse de la tumeur. Bien que l'échographie ait des limites dans l'évaluation de l'infiltration des plans tissulaires périosseux, les limites du composant extraosseux du néoplasme sont généralement bien circonscrites. En général, l'échotexture tumorale varie d'un hypoéchogène solide à un aspect hétérogène mixte dû à des zones anéchoïques internes liées à la nécrose. Dans la plupart des cas, l'échographie est incapable de suggérer le diagnostic histologique ainsi que de différencier les tumeurs malignes des tumeurs bénignes localement agressives. Sur la base de leur apparence remplie de liquide, l'échographie peut diagnostiquer les ganglions intraosseux s'extrudant dans les tissus mous paraosseux (Bianchi et al. 1995). Parfois, un diagnostic présomptif peut être posé, comme dans le cas de kystes osseux anévrismaux présentant un amincissement cortical marqué et de multiples niveaux liquidiens (Fig. 38) (Haber et al. 1993; Gomez et al. 1998). Dans ces cas, la modification du positionnement du patient peut montrer des changements respectifs dans la disposition des couches de liquide dans les compartiments tumoraux (Figures 38a-d). Récemment, l'aspect américain d'un ostéome ostéoïde localisé dans la métaphyse proximale du tibia droit et de la diaphyse fémorale gauche d'adolescents a été décrit (Gil-Sanchez et al. 1999). L'imagerie Doppler couleur peut être utile pour la détection du nidus hypervasculaire et pour guider la localisation percutanée et la biopsie. L'imagerie Doppler doit toujours être effectuée lors de l'évaluation des tumeurs des tissus mous. Il peut montrer une vascularisation interne, aidant ainsi à différencier les tissus viables des tissus nécrotiques. Lorsqu'une tumeur osseuse présente une importante composante extraosseuse à l'IRM, l'échographie peut être efficace et fiable pour guider la biopsie percutanée à l'aiguille (Civardi et al. 1994 ; Saifuddin et al. 1998, 2000 ; Konermann et al. 2000 ; Yeow et al. 2000 ; Gil-Sanchez et al. 2001 ; Torriani et al. 2002). La biopsie est une étape fondamentale dans l'investigation des tumeurs osseuses suspectées et doit être obtenue dans des centres spécialisés pour éviter un prélèvement de tissu inadéquat, qui est la raison la plus courante de l'impossibilité d'effectuer une chirurgie de sauvetage de membre (Skrzynski et al. 1996 ; Saifuddin et al . 2000). La biopsie échoguidée ne doit être réalisée que chez les patients chez qui la faisabilité de la procédure a été préalablement vérifiée par IRM ou scanner. La biopsie d'une tumeur osseuse doit être réalisée en accord avec le chirurgien orthopédique référent afin de décider par consensus du trajet d'aiguille le plus approprié : cela permet d'éviter l'ensemencement des cellules tumorales hors du compartiment concerné. Comme décrit au chapitre 18, les appareils automatiques de type Tru-cut de calibre 14 à 18 sont recommandés pour obtenir un meilleur rendement diagnostique pour le diagnostic histologique. La biopsie par aspiration à l'aiguille fine semble avoir des limites certaines dans ce domaine, même dans la détection d'une récidive tumorale ou le diagnostic d'une métastase d'une tumeur primaire connue. Par rapport au guidage CT, les principaux avantages des biopsies guidées par échographie des tumeurs osseuses reposent sur la capacité de l'échographie : à reconnaître la tumeur viable et les vaisseaux adjacents avec l'imagerie Doppler ; permettre une visualisation continue en temps réel de l'aiguille pour éviter les zones nécrotiques et le risque de blessure des structures adjacentes ; et pour effectuer la procédure plus rapidement, réduisant l'inconfort du patient (Torriani et al. 2002). Si la biopsie échographique est réalisée par des mains expérimentées, les complications sont rares (Torriani et al. 2002). Dans les lésions costales, des douleurs locales et des hématomes, des infections et des pneumothorax ont été rapportés comme complications.
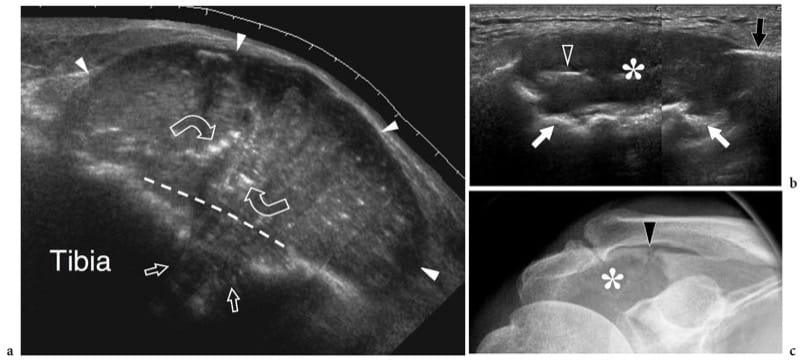
Illustration 37. a–c. Tumeurs osseuses. Deux cas différents. une image US à champ de vision étendu de 12 à 5 MHz sur une masse prétibiale palpable à croissance lente chez une patiente atteinte d'un cancer du sein montre une grande tumeur solide bien circonscrite provoquant une ostéolyse (flèches droites) et s'étendant dans les espaces extraosseux adjacents (flèches blanches). pointes de flèches). La ligne pointillée indique le niveau de cortex tibial détruit. De petits fragments osseux résiduels (flèches courbes) déplacés par le néoplasme en croissance sont visibles. La biopsie a révélé des métastases mammaires. b Une image échographique longitudinale 12–5 MHz obtenue au-dessus de l'épaule d'un patient suspecté d'une maladie de la coiffe des rotateurs révèle une masse hypoéchogène importante (astérisque) provoquant une ostéolyse étendue (flèches blanches) de l'acromion (flèche noire) : certains fragments d'os sont visibles à l'intérieur de la masse (pointe de flèche). c La radiographie de face confirme la lésion ostéolytique (astérisque) et une fracture pathologique associée (tête de flèche noire). La biopsie a révélé des métastases d'un cancer du poumon.
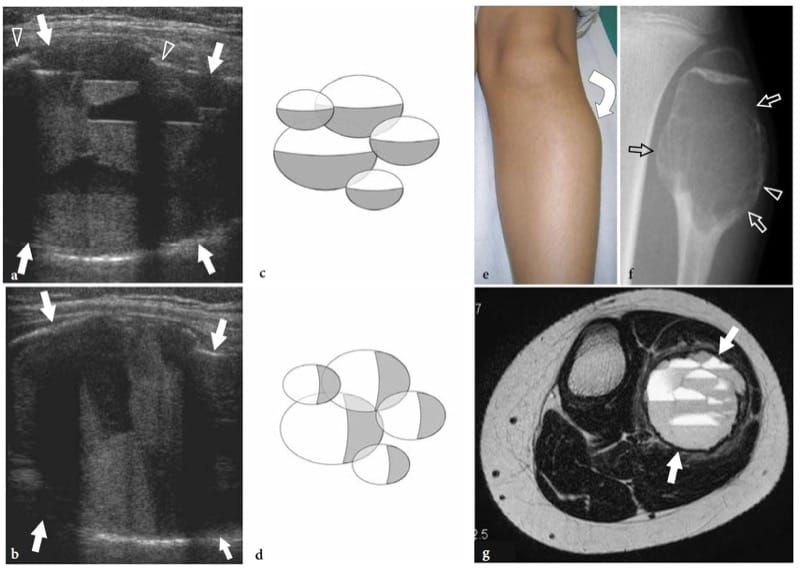
Figure 38. a–g. Kyste osseux anévrismal chez un garçon de 12 ans avec un gonflement raide et indolore à croissance lente sur la tête et le cou du péroné. a,b Les images échographiques coronales 12–5 MHz obtenues au-dessus de la tête fibulaire a avec le patient en décubitus dorsal et b debout révèlent une masse complexe (flèches) qui crée un renflement à la surface de l'os avec un amincissement cortical (têtes de flèches) suffisant pour permettre l'échographie pénétration du faisceau. La masse est caractérisée par de multiples niveaux liquidiens doubles, aspect assez spécifique d'un kyste osseux anévrismal. Lorsque la position du patient est modifiée, les niveaux de liquide se réarrangent parallèlement au sol en fonction de la gravité. c,d Les diagrammes montrent la disposition des niveaux de liquide comme on le voit en a et b. e La photographie montre un renflement focal (flèche courbée) sur la tête du péroné. f La radiographie de face et g l'IRM transversale pondérée en T2 confirment le diagnostic échographique.
22. SYNOVITE VILLONODULAIRE PIGMENTÉE
La synovite villonodulaire pigmentée est une maladie proliférative bénigne peu fréquente de la synoviale qui touche les articulations, les bourses ou les gaines tendineuses (Dorwart et al. 1984 ; Yang et al. 1998 ; Bianchi et al. 1998 ; Lin et al. 1999 ; Middleton et al. 2004 ). Du point de vue pathogénétique, l'étiologie de la synovite villonodulaire pigmentée reste controversée. Parmi les deux théories les plus largement acceptées, l'une implique un processus inflammatoire chronique, l'autre une tumeur bénigne (Byers et al. 1968 ; Mukhopadhyay et al. 2006). La présence d'histiocytes contenant de la graisse ou de l'hémosidérine (un produit de dégradation de l'hémoglobine), des cellules géantes multinucléées et des plasmocytes semble suggérer une inflammation, alors que la cellularité élevée, la tendance à la récidive et les études cytogénétiques récentes révélant une prolifération cellulaire clonale favorisent un processus néoplasique (Mukhopadhyay et al. 2006). La présentation clinique de la synovite villonodulaire pigmentée articulaire dépend de la forme morphologique de la maladie, y compris un type diffus et nodulaire. La synovite villonodulaire pigmentée diffuse la plus courante apparaît grossièrement comme une prolifération généralisée de la synoviale qui montre des masses et des villosités en forme de doigts. Elle survient généralement dans la troisième et la quatrième décennie de la vie sous la forme d'une arthrite monoarticulaire touchant le genou (80 % des cas), la hanche et la cheville. Les plaintes des patients incluent l'apparition insidieuse d'un gonflement progressif des articulations, d'un inconfort, de douleurs, d'un dérangement mécanique et d'une diminution de l'amplitude des mouvements. La synovite villonodulaire pigmentée focale survient plus fréquemment dans la cinquième et la sixième décennie, touchant les bourses articulaires, para-articulaires et les gaines tendineuses synoviales (tumeur à cellules géantes de la gaine tendineuse), ces dernières étant plus fréquentes. Il a une prédominance féminine et affecte les doigts de la main et du pied, se présentant comme une masse indolore à croissance lente (Rao et Vigorita 1984).
Les radiographies simples peuvent être normales ou montrer un épanchement intra-articulaire, une masse des tissus mous para-articulaire mal définie et, dans les maladies de longue date, des érosions osseuses juxta-articulaires et des kystes sous-chondraux causés par la pression et une synoviale hypertrophiée. La tomodensitométrie montre des dépôts d'hémosidérine et de graisse et est capable de détecter des érosions osseuses qui ne se manifestent pas sur les radiographies.
L'IRM montre un épanchement synovial et une synovite hypertrophiée contenant des zones dispersées d'hémosidérine qui présentent une faible intensité de signal sur les séquences pondérées en T1 et T2 - plus sombres sur les séquences d'écho de gradient T2 * en raison d'un artefact de susceptibilité (Fig. 39). Bien que des apparences similaires puissent être observées dans l'arthrite hémophilique et rhumatoïde dans le cadre clinique approprié, ces résultats sont souvent considérés comme un diagnostic de synovite villonodulaire pigmentée (Hughes et al. 1995 ; Jelinek et al. 1989 ; Narváez et al. 2001). L'aspect américain de la synovite villonodulaire pigmentée diffuse est non spécifique car il apparaît soit comme une zone intra-articulaire d'épaississement synovial hypoéchogène, soit comme une masse irrégulière située dans la cavité articulaire généralement associée à un épanchement articulaire (Fig. 39a). Dans certains cas, l'échographie peut détecter des érosions de pression sur le cortex osseux comme des défauts des surfaces articulaires remplies de synovie hypertrophiée. L'imagerie Doppler peut montrer un schéma hypervasculaire dans la masse synoviale (Yang et al. 1998 ; Lin et al. 1999). Un schéma de flux relativement accru à la périphérie de la capsule synoviale peut être présent (Lin et al. 1999). Une récidive locale après synovectomie chirurgicale ou arthroscopique survient dans près de 50 % des cas (Sheldon et al. 2005). Le type nodulaire de la synovite villonodulaire pigmentée (Bianchi et al. 1998 ; Middleton et al. 2004).
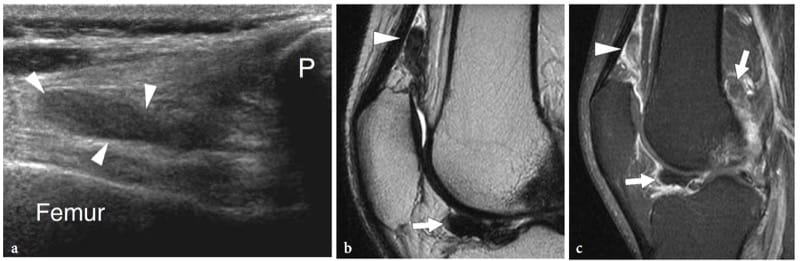
Illustration 39. a–c. Synovite villonodulaire pigmentée : type diffus. une image US longitudinale 12–5 MHz obtenue au-dessus du récessus suprapatellaire montre un épaississement hypoéchogène de la synoviale (têtes de flèches), un aspect assez non spécifique. P, rotule. b Les images IRM pondérées en T2 sagittales et pondérées en T1 avec suppression de la graisse c confirment les résultats de l'échographie (tête de flèche) et révèlent des lésions supplémentaires (flèches) situées dans les cavités articulaires antérieures et postérieures. L'aspect hypointense de ces lésions en séquences pondérées T2 suggère fortement une synovite villonodulaire pigmentée.
23. LIPOME ARBORESCENS
Le lipome arborescens, également appelé lipome synovial diffus ou prolifération villositaire de la synoviale, est une lésion réactive monoarticulaire rare donnant lieu à une prolifération villositaire focale contenant de la graisse. Elle peut être primaire ou, plus fréquemment, associée à d'autres troubles articulaires, tels qu'une maladie articulaire dégénérative, une polyarthrite rhumatoïde ou un traumatisme antérieur (Al-Ismail et al. 2002 ; Murphey et al. 2004 ; Davies et Blewitt 2005 ; Sheldon et al. 2005). Bien qu'occasionnellement signalé dans la hanche, l'épaule et le coude (Doyle et al. 2002 ; Nisolle et al. 1999 ; Bejia et al. 2005), le lipome arborescens survient le plus souvent dans le genou, en particulier dans la cavité suprapatellaire. Du point de vue clinique, il se manifeste par un épaississement synovial indolore de longue date et des épanchements articulaires intermittents. L'échographie montre que le lipome arborescens est une masse avec des contours en forme d'arbre et des projections villeuses liées au remplacement du tissu sous-synovial par de la graisse mature (Learch et Braaton 2000). En général, la masse est plus échogène que le tissu synovial et est associée à un épanchement articulaire (Fig. 40a). Au cours de la manipulation articulaire, l'examen dynamique permet de démontrer en temps réel la flexion et l'ondulation de va-et-vient des projections villeuses (Learch et Braaton 2000 ; Sheldon et al. 2005). Si un lipome arborescens est suspecté, une IRM doit être obtenue pour confirmer le diagnostic sur la base de l'architecture en forme de fronde et d'une intensité de signal similaire à celle de la graisse dans toutes les séquences d'impulsions (Fig. 40b, c) (Vilanova et al. 2003). La synovectomie est le traitement définitif.
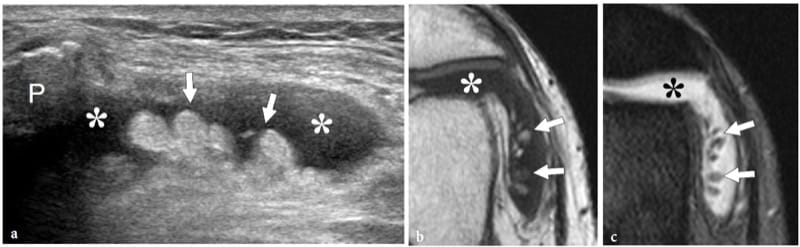
Figure 40. a–c. Lipome arborescens. une image US transversale 12–5 MHz obtenue au-dessus de l'évidement parapatellaire latéral du genou montre une masse frondeuse relativement hyperéchogène intra-articulaire (flèches) délimitée par un épanchement synovial (astérisques). P, rotule. b La corrélation d'imagerie IRM pondérée en T1 transversale et pondérée en T2 avec suppression de graisse c confirme la nature grasse des projections en forme de fronde de la masse.
24. OSTEOCHONDROMATOSE SYNOVIALE
L'ostéochondromatose synoviale primitive (chondromatose synoviale) est une affection bénigne affectant la membrane synoviale qui entraîne la prolifération de nodules chondraux ou ostéochondraux intrasynoviaux. Elle touche le plus souvent le genou (50 % des cas) des hommes d'âge moyen. Par ordre de prévalence décroissante, les autres articulations couramment impliquées sont le coude, la hanche et l'épaule. Au stade précoce de la maladie (type 1), il existe une prolifération synoviale active avec des masses cartilagineuses incrustées dans la synoviale ; puis (type 2), les nodules ostéochondraux deviennent pédonculés et sont libérés au sein de la cavité articulaire ; enfin (type 3), les corps intra-articulaires restent libres avec régression de l'hypertrophie synoviale (Milgram 1977). Les symptômes cliniques comprennent une douleur et un gonflement locaux, suivis d'une raideur, d'un blocage articulaire intermittent dû à des corps lâches piégés entre les surfaces articulaires et de changements articulaires dégénératifs prématurés. La chondromatose synoviale ne doit pas être confondue avec d'autres causes de corps ostéocartilagineux intra-articulaires (chondromatose secondaire). L'échographie peut détecter une synoviale épaissie contenant des nodules chondraux hypoéchogènes qui peuvent ou non subir une calcification. Lorsqu'ils sont minéralisés, ces nodules apparaissent comme des fragments hyper-échogènes brillants avec une ombre acoustique postérieure et sont mieux délimités avec l'US (Fig. 41) (Pai et van Holsbeeck 1995 ; Leekam et Voorneveld 1996 ; Campeau et Lewis 1998 ; Cho et al. 2000). Dans les masses calcifiées lourdes de conglomérat, l'ombrage acoustique postérieur des dépôts calcifiés superficiels peut masquer le reste de l'anomalie synoviale (Roberts et al. 2004). Il n'est pas rare que des fragments migrent hors de l'espace articulaire dans des bourses synoviales communicantes, telles que la bourse semi-membranosus-gastrocnemius ou la bourse iliopsoas (Moss et Dishuk 1984). Lorsque le diagnostic est suspecté sur les résultats de l'échographie, des radiographies standard doivent être obtenues pour confirmer la présence de calcifications lobulaires ponctuées ou denses, qui se produisent dans environ les deux tiers des cas. Le traitement est la synovectomie chirurgicale; cependant, le taux de récidive est supérieur à 25 % (Sheldon et al. 2005).
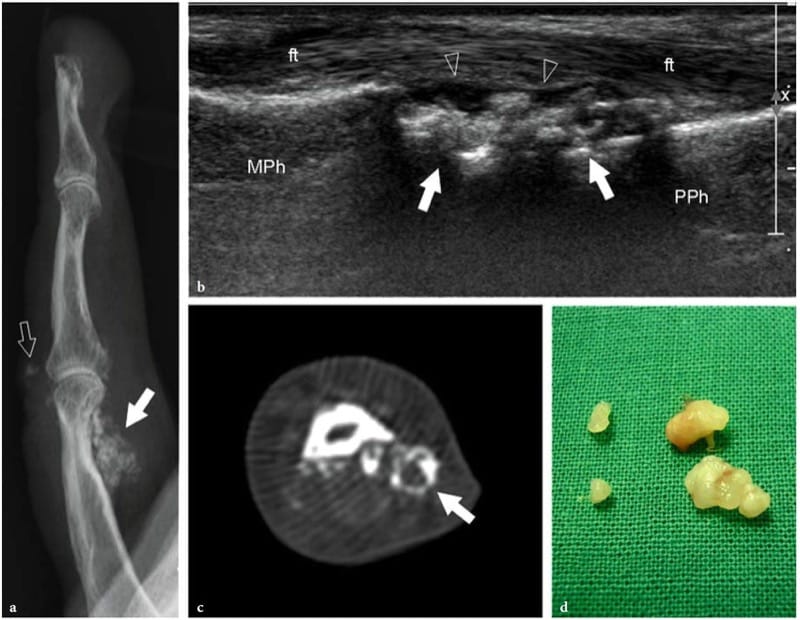
Illustration 41. a–d. Chondromatose synoviale. a La radiographie standard de profil de l'index montre une petite masse calcifiée des tissus mous sur la face palmaire (flèche blanche) de la première phalange. Quelques calcifications sont également visibles sur la face dorsale de l'articulation phalangienne proximale (flèche vide). L'absence d'érosion osseuse et de réaction périostée suggère d'exclure l'atteinte osseuse. b Les images échographiques longitudinales 17-5 MHz obtenues au niveau de l'articulation interphalangienne proximale révèlent un conglomérat de calcifications (flèches) comblant l'évidement articulaire ventral (têtes de flèches) entre l'os et les tendons fléchisseurs (ft). MPh, phalange moyenne ; PPh, phalange proximale. c Corrélation d'imagerie CT axiale. d Le spécimen chirurgical du même cas montre les corps étrangers.
25. HÉMANGIOME SYNOVIAL
L'hémangiome synovial est une tumeur bénigne intra-articulaire rare provenant de la synovie, difficile à diagnostiquer en raison de sa présentation clinique non spécifique de genou douloureux enflé récurrent non traumatique (Narváez et al. 2001 ; Okahashi et al. 2004). Le genou des jeunes adultes et des adolescents est généralement touché. Les symptômes cliniques sont liés à l'effet de masse de la tumeur, qui entraîne une diminution de l'amplitude des mouvements et des épisodes répétitifs de saignement provoquant des douleurs et un gonflement des articulations et pouvant imiter d'autres affections, telles que l'arthropathie hémophilique, l'arthrite ou le syndrome du plateau médial. Les hémangiomes provenant de la synoviale ont une apparence américaine similaire à d'autres hémangiomes des tissus mous, mais la présence de tissu hypoéchogène avec des zones remplies de liquide liées à l'accumulation de sang dans les espaces vasculaires peut générer une confusion avec des affections synoviales plus courantes. Par conséquent, l'examinateur doit être conscient de cette condition pour éviter de faire un mauvais diagnostic et de faire perdre du temps au patient. Dans le type caverneux d'hémangiome synovial, le sang à écoulement lent peut parfois être apprécié dans les espaces anéchoïques de la masse à l'échelle de gris et à l'échographie Doppler couleur (Fig. 42a – c). L'IRM de l'hémangiome synovial est pathognomonique, avec une intensité intermédiaire du signal T1 et une hyperintensité marquée sur les images pondérées en T2 et après administration de gadolinium (Fig. 42d, e). Une prolifération de graisse intratumorale, des canaux vasculaires à faible signal T2 et des phlébolithes peuvent également être trouvés (Fig. 42e, f). Les masses circonscrites peuvent être réséquées sous arthroscopie, tandis que les lésions diffuses nécessitent une chirurgie ouverte (Sheldon et al. 2005).
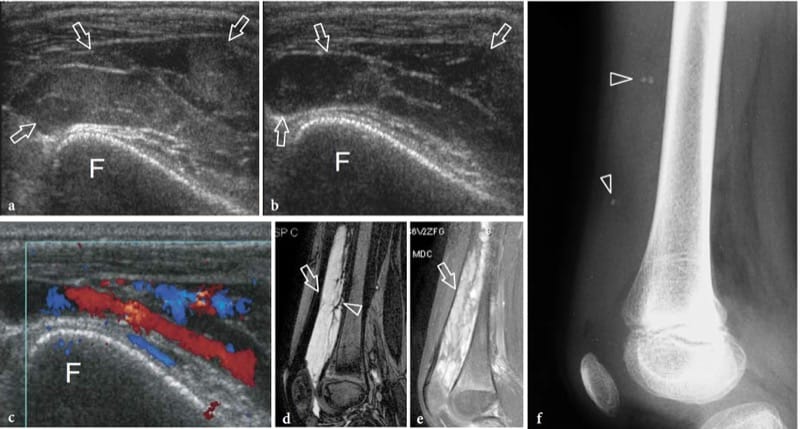
Figure 42. a–f. Hémangiome synovial. a,b Les images US transversales 12–5 MHz obtenues sur la région suprapatellaire a sans et b avec compression avec la sonde montrent un évidement suprapatellaire rempli de liquide (flèches) contenant des échos tourbillonnants à écoulement lent qui changent d'échogénicité en fonction de la pression exercée sur leur. F, fémur. c L'imagerie Doppler couleur affiche le flux veineux remplissant les cavités remplies de liquide contenues dans la cavité. d La corrélation d'imagerie IRM en pondération T2 sagittale et pondérée en T1 post-contraste avec suppression de la graisse montre une lésion nettement hyperintense (flèche) contenant des structures linéaires à faible signal (tête de flèche) représentant des septations fibrograisseuses et des canaux vasculaires intratumoraux. f La radiographie latérale révèle la plénitude de l'évidement suprapatellaire et des phlébolithes dispersés (têtes de flèches), une caractéristique de valeur pour le diagnostic d'hémangiome synovial.