1. CONSIDÉRATIONS HISTOLOGIQUES
Du point de vue histologique, les nerfs sont des cordons ronds ou aplatis, avec une structure interne complexe faite de fibres nerveuses myélinisées et non myélinisées, contenant des axones et des cellules de Schwann regroupées en faisceaux (Fig. 1a) (Erickson 1997). Le long du trajet du nerf, les fibres peuvent traverser d'un faisceau à l'autre et les faisceaux peuvent se diviser et fusionner. Sur la base de la disposition fasciculaire, deux théories ont été émises pour expliquer l'architecture interne d'un nerf : les modèles « câble » et « plexiforme » (Stewart 2003). Le premier stipule que les nerfs sont des structures en forme de câble, dans lesquelles les fascicules courent séparément sur toute la longueur du nerf (Fig. 1b). La seconde affirme que les fascicules alternent division, ramification et réunion le long du trajet du tronc nerveux (Fig. 1c). En fait, les nerfs ont à la fois une disposition en câble et en plexiforme des faisceaux en fonction du niveau d'examen. Dans leur partie la plus proximale (par exemple, le plexus brachial), une organisation plexiforme des fascicules prédomine. Plus distalement (par exemple, le nerf médian), les nerfs présentent une structure en forme de câble avec un degré élevé d'organisation somatique (par exemple, des fibres sensorielles et motrices pour une zone spécifique de la peau ou du muscle contenue dans le même fascicule) (Stewart 2003). Le tissu nerveux est intégré dans une série de couches de tissu conjonctif.
Un examen plus approfondi des gaines nerveuses montre une gaine externe - l'épinèvre externe - qui entoure les faisceaux nerveux. Chaque fascicule est investi à son tour par une gaine conjonctive propre – le périnèvre – qui renferme un nombre variable de fibres nerveuses et est responsable de la barrière « sang-nerf ». Ensuite, les fibres nerveuses individuelles sont investies par l'endonèvre. Le tissu conjonctif intervenant entre la gaine nerveuse externe et les fascicules est communément appelé épinèvre interfasciculaire (épinèvre interne), par opposition à l'épinèvre externe qui entoure tout le tronc nerveux. D'une manière générale, la quantité de tissu conjonctif de l'épinèvre est plus abondante dans les gros nerfs multifasciculaires et dans les régions où le nerf est mobile à travers les articulations (Delfiner 1996). Cet épaississement du tissu conjonctif semble fournir plus d'amortissement pour le nerf et, par conséquent, plus de résistance aux blessures par compression (Delfiner 1996). Extérieurement, l'épinèvre externe (externe) est en continuité avec le mésonèvre, qui est constitué de tissu aréolaire lâche. Cette dernière structure est créditée non seulement de fournir le cadre pour l'apport sanguin entrant dans le nerf, mais aussi de faciliter l'excursion du nerf dans son lit sans traction sur son apport sanguin pendant le mouvement articulaire (George et Smith 1996).
Les nerfs ont un apport vasculaire important pour assurer leur approvisionnement continu en énergie locale nécessaire à la transmission des impulsions et au transport axonal. L'apport vasculaire est formé par un système interconnecté de vaisseaux périneuraux qui cheminent longitudinalement dans l'épinèvre externe et se ramifient entre les fascicules (vaisseaux endoneuraux).
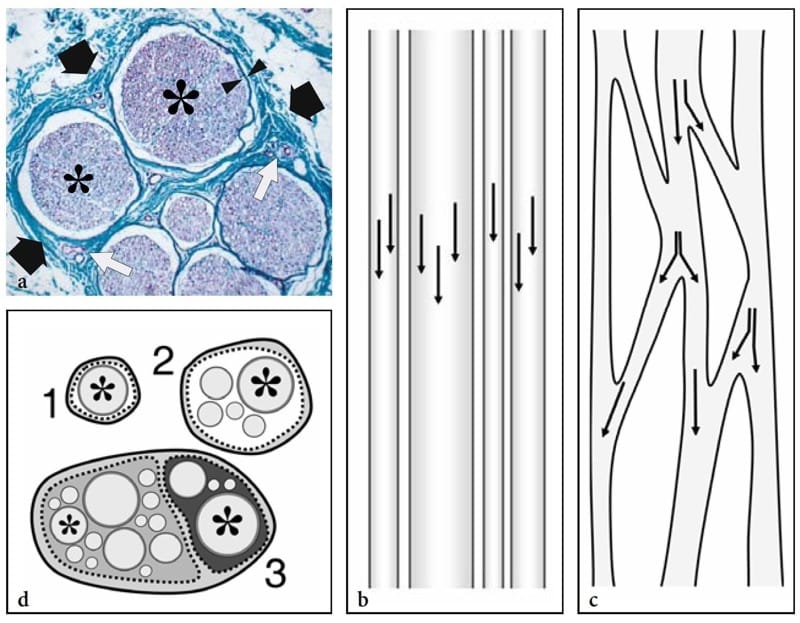
Figure 1. a–d. Histologie nerveuse. une vue en coupe histologique du nerf sural humain (flèches noires) révèle des faisceaux nerveux (astérisques) de taille différente contenant du tissu nerveux (violet) avec des collections d'axones, de gaines de myéline et de cellules de Schwann. Les fascicules individuels sont investis par une fine gaine - le périnèvre (têtes de flèches) - et sont séparés les uns des autres par une enveloppe de tissu conjonctif lâche - l'épinèvre (vert) - contenant de petits vaisseaux intraneuraux (flèches blanches). Spécimen coloré selon la procédure de van Gieson (grossissement original ×150). b,c Des dessins schématiques d'une vue longitudinale à travers le tronc nerveux illustrent les modèles d'organisation fasciculaire. Les flèches indiquent le chemin axonal. b Dans le « modèle de câble », les faisceaux sont parallèles à l'axe nerveux sans échange axonal. c Dans le « modèle plexiforme », les faisceaux se divisent et se rejoignent dans diverses combinaisons, les axones s'entremêlant les uns aux autres. d Dessin schématique d'une vue en coupe transversale des modèles nerveux monofasciculaire (1), oligofasciculaire (2) et polyfasciculaire (3). Dans les nerfs moteurs et sensoriels complexes (3), les fascicules (astérisques) sont de taille différente et peuvent être regroupés dans des zones liées à la fonction au sein du nerf. Ce dessin (3) rappelle la structure du nerf sciatique, dans laquelle les fibres nerveuses du nerf tibial (gris clair) et du nerf péronier (gris foncé) restent étroitement groupées tout au long du trajet du nerf, même en proximal.
2. ANATOMIE AMÉRICAINE NORMALE ET TECHNIQUE DE NUMÉRISATION
Grâce à la dernière génération de transducteurs haute fréquence « petites pièces » et à la technologie des composés, l'échographie est devenue une modalité d'imagerie bien acceptée et largement répandue pour l'évaluation des nerfs périphériques. Les performances améliorées de ces transducteurs ont permis de reconnaître des détails anatomiques subtils au moins égaux ou même plus petits que ceux représentés par l'imagerie par résonance magnétique de surface et de décrire un large éventail de conditions pathologiques affectant les nerfs (Martinoli et al. 1999 ; Keberle et al. 2000 ; Beekman et Visser, 2004). Outre la disponibilité d'une technologie haut de gamme, l'échographie nerveuse nécessite une connaissance approfondie des détails anatomiques et une corrélation étroite des résultats d'imagerie avec les antécédents cliniques du patient et les résultats des études électrophysiologiques. Grâce à ces informations d'identification, l'échographie fournit une imagerie peu coûteuse et non invasive, une vitesse de performance et des avantages importants par rapport à l'imagerie par résonance magnétique, y compris une résolution spatiale plus élevée et la capacité d'explorer de longs segments de troncs nerveux dans une seule étude et d'examiner les nerfs en statique et états dynamiques avec analyse en temps réel.
L'aspect américain des nerfs normaux est assez uniforme, reflétant étroitement leur composition histologique (Fig. 2) (Silvestri et al. 1995). Sur des plans à petit axe, l'échographie montre les nerfs comme des structures en nid d'abeille composées de points hypoéchogènes intégrés dans un fond hyperéchogène dans lequel les structures hypoéchogènes correspondent aux fascicules qui s'étendent longitudinalement dans le nerf, et le fond hyperéchogène se rapporte à l'épinèvre interfasciculaire (Figues. 2a, 3a) (Silvestri et al. 1995). Ce motif ressemble un peu à la section d'un câble électrique. Sur les plans à axe long, les nerfs prennent généralement une apparence allongée avec de multiples zones linéaires parallèles hypoéchogènes, qui correspondent aux faisceaux neuronaux qui s'étendent longitudinalement dans le nerf, séparés par des bandes hyperéchogènes (Fig. 3b) (Silvestri et al. 1995). Dans un nerf individuel, la taille et le nombre des fascicules peuvent varier en fonction de la distance du site d'origine, de la quantité de pression à laquelle le nerf est soumis et de l'apparition d'une ramification nerveuse. Dans les bifurcations nerveuses, par exemple, le tronc nerveux se divise en deux ou plusieurs faisceaux nerveux secondaires, tandis que les faisceaux pénètrent dans une seule des branches divisionnaires sans se diviser. Les limites externes des nerfs ne sont généralement pas définies car elles ont une apparence hyperéchogène similaire à leurs enveloppes conjonctives, y compris l'épinèvre externe, le mésonèvre et les espaces conjonctifs lâches environnants, qui contiennent tous de la graisse.
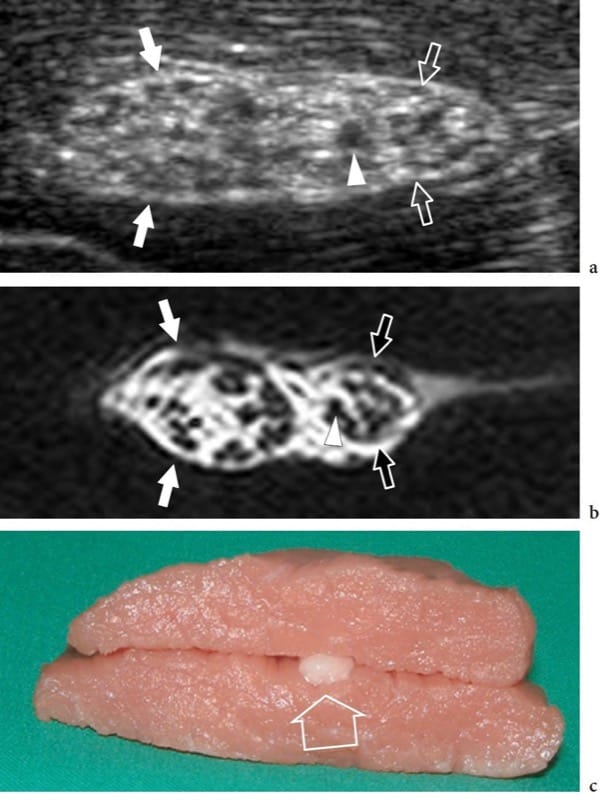
Figure 2. a–c. Anatomie nerveuse. In vitro, une image US à axe court 12–5 MHz du nerf sciatique bovin (flèches) avec IRM pondérée en T1 corrélative b montre une échotexture nerveuse en nid d'abeille composée de petites zones hypoéchogènes arrondies (tête de flèche), les fascicules, qui sont intégrés dans un fond hyperéchogène, l'épinèvre. Observez le regroupement défini des fascicules dans le nerf sciatique pour les nerfs tibial (flèches blanches) et péronier (flèches vides). c Le modèle in vitro a été préparé en incorporant le nerf (flèche ouverte) dans le tissu musculaire.
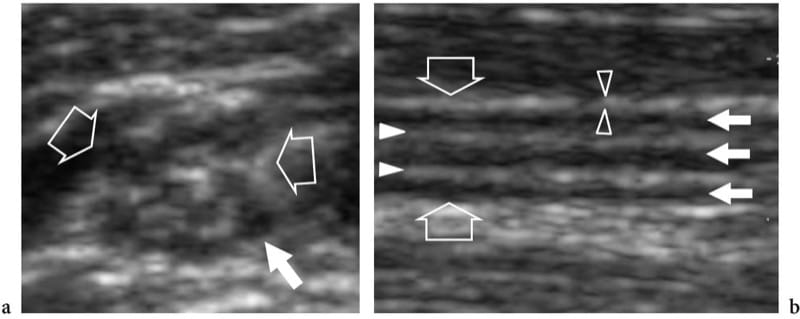
Figure 3.a,b. Échotexture nerveuse normale. a Images échographiques à petit axe et b grand axe 15–7 MHz sur le nerf médian (flèches vides) au milieu de l'avant-bras. En a, les faisceaux nerveux (flèche blanche) sont représentés comme des structures individuelles bien circonscrites de différentes tailles séparées par un épinèvre échogène. Dans ce segment, 11 fascicules sont distingués dans la section transversale du nerf médian. En b, les faisceaux nerveux apparaissent sous forme de bandes hypoéchogènes allongées (flèches blanches) parallèles les unes aux autres. L'épinèvre interne (têtes de flèches blanches) les sépare plus clairement, tandis que l'épinèvre externe (têtes de flèches ouvertes) aide à définir les limites externes du nerf.
Dans des états normaux, les systèmes Doppler couleur et puissance sont, pour la plupart, incapables de reconnaître les signaux faibles et faibles du flux sanguin provenant du plexus périneural et des branches intraneurales. De manière générale, les nerfs sont compressibles et se déforment en fonction du volume des espaces anatomiques dans lesquels ils cheminent ainsi que de l'encombrement et de la conformation des structures périneurales (Fig. 4a, b). Même avec une légère pression appliquée avec la sonde, on peut les voir glisser sur la surface d'une artère ou d'un muscle. En règle générale, chaque faisceau individuel d'un nerf fonctionne indépendamment des autres. À travers les articulations synoviales, ils traversent des passages anatomiques étroits - les tunnels ostéofibreux qui redirigent leur parcours. Le plancher de ces tunnels est constitué d'os, tandis que le toit est constitué d'épaississements focaux du fascia - les rétinacules qui empêchent la luxation et les dommages traumatiques des structures contenues dans le tunnel lors de l'activité articulaire (Martinoli et al. 2000b). Lorsque les nerfs traversent des passages étroits, tels que les foramens neuraux et les tunnels ostéofibreux, de subtils changements d'échotexture peuvent être observés, avec une apparence hypoéchogène plus homogène causée par un tassement plus serré des fascicules et une réduction locale du volume de l'épinèvre (Sheppard et al. 1998) .
Une technique de balayage soigneuse basée sur la connaissance précise de leur position et l'analyse de leurs relations anatomiques avec les structures environnantes est essentielle pour reconnaître les nerfs périphériques par échographie. Contrairement aux autres structures du système musculo-squelettique, les nerfs ne présentent pas de propriétés anisotropes. Par conséquent, l'orientation appropriée de la sonde lors de la numérisation n'est pas nécessaire pour les imager ; cependant, un balayage systématique dans le plan du petit axe est préféré pour suivre les nerfs de manière contiguë à travers les membres (Martinoli et al. 1999). Les balayages à axe long sont moins efficaces à cette fin car les fascicules allongés peuvent être facilement confondus avec les échos des muscles et des tendons courant le long du même plan. Une fois détecté, le nerf est maintenu au centre de l'image US dans son petit axe, puis suivi de manière proximale et distale, en déplaçant le transducteur vers le haut ou vers le bas selon le trajet du nerf. Avec cette technique – que l'on peut appeler la « technique du lifting », l'examinateur est capable d'explorer de longs segments d'un nerf en quelques secondes à travers les membres et les extrémités (Fig. 4c). Si des anomalies nerveuses intrinsèques ou extrinsèques sont rencontrées pendant le balayage, l'examen échographique est alors correctement focalisé sur la région d'intérêt en utilisant des plans de balayage échographiques obliques et longitudinaux. Bien que tous les nerfs principaux puissent être facilement affichés dans les extrémités en raison de leur position superficielle et de l'absence d'os intermédiaire, la représentation du système nerveux périphérique n'est pas possible partout avec l'échographie. En fait, la plupart des nerfs crâniens – à l'exception du nerf vague – et le nerf spinal accessoire (Giovagnorio et Martinoli, 2001 ; Bodner et al. 2002a), les racines nerveuses sortant du rachis dorsal, lombaire et sacré, les chaînes sympathiques et le nerf splanchnique les nerfs de l'abdomen ne peuvent pas être visualisés en raison de leur trajet profond ou de l'interposition de structures osseuses. De plus, les structures périneurales influencent grandement la détection des nerfs dans les membres et les extrémités. Lorsque les nerfs courent profondément, comme chez les patients obèses, leur évaluation peut être difficile. En règle générale, les nerfs du membre inférieur sont plus profonds que ceux du membre supérieur et sont plus difficiles à visualiser. Les nerfs circulant parmi les muscles hypoéchogènes sont détectés plus facilement que ceux entourés de graisse hyperéchogène. De même, un nerf d'un jeune sujet physiquement actif est mieux représenté que le même nerf examiné chez un sujet aux muscles atrophiques.
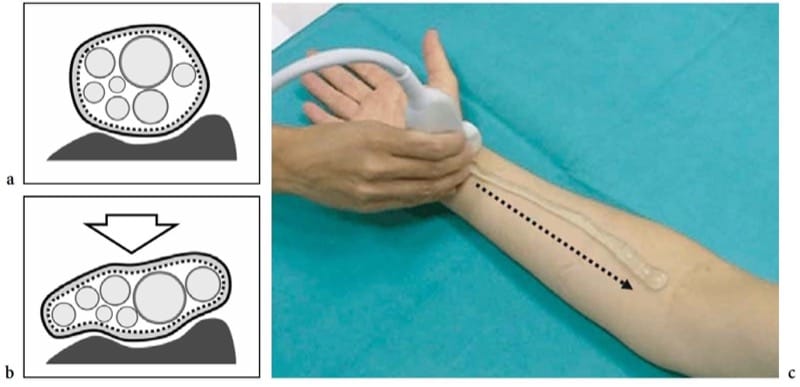
Figure 4. a–c. Réponse à la technique de compression et de balayage nerveux. a,b Dessins schématiques de la vue en coupe d'un nerf reposant sur une surface rigide (os) a au repos et b pendant la compression externe (flèche). Du fait de la souplesse de la gaine épineuriale, le nerf s'aplatit, tandis que les faisceaux, qui sont des structures incompressibles, se redistribuent en fonction des changements de forme du nerf. c La photographie montre la technique standard d'examen des nerfs dans les membres. Le petit axe du nerf médian au niveau du poignet est centré dans le champ de vision de l'image US. Ensuite, le transducteur est balayé vers le haut (flèche en pointillés) le long du trajet du nerf dans l'avant-bras. Cette technique, que l'on peut appeler la « technique du lifting », permet une évaluation simple et fiable des longs segments nerveux en un seul balayage, excluant d'éventuelles anomalies intrinsèques et extrinsèques le long du trajet nerveux. La capacité de l'échographie à suivre si rapidement le trajet complet des nerfs dans les membres est un avantage majeur par rapport à l'imagerie par résonance magnétique.
3. VARIANTES ANATOMIQUES, ANOMALIES HÉRÉDITAIRES ET DE DÉVELOPPEMENT
Compte tenu de l'aspect US caractéristique des nerfs normaux, certaines variantes anatomiques peuvent être reconnues avec cette technique. Parmi celles-ci, la bifurcation proximale du nerf médian au niveau du poignet a été largement rapportée dans la littérature (Propeck et al. 2000 ; Iannicelli et al. 2000 ; Gassner et al. 2002). De même, certaines anomalies héréditaires et développementales du système nerveux périphérique, telles que l'hypertrophie fusiforme du nerf médian par du tissu fibro-gras (appelé hamartome fibrolipomateux), l'hypertrophie des nerfs dans le syndrome de Charcot-Marie-Tooth (Martinoli et al. 2002 ), et l'hypertrophie focale des nerfs dans la neuropathie héréditaire avec risque de paralysie par pression (Beekman et Visser 2002) peut être reconnue par l'échographie. Dans ces troubles, les découvertes américaines peuvent contribuer à la compréhension de la physiopathologie en révélant de manière non invasive certaines informations morphologiques importantes. Des travaux supplémentaires sont toutefois nécessaires pour analyser pleinement l'impact et la fiabilité de l'US dans ce domaine.
4. HAMARTOME FIBROLIPOMATEUX
L'hamartome fibrolipomateux est un trouble nerveux du développement semblable à une tumeur lié à l'hypertrophie de la graisse mature et des fibroblastes dans l'épinèvre qui se présente souvent pendant la petite enfance. Cette affection – également appelée fibrolipome neural, lipome périneural, infiltration graisseuse du nerf, lipofibrome ou lipome neural – a une prédilection certaine pour le nerf médian et ses branches, avec atteinte des membres inférieurs (nerf plantaire, nerf sciatique) signalé comme rare (Marom et Helms 1999; Wong et al. 2006). L'hamartome fibrolipomateux peut être associé à un gigantisme local d'une extrémité, généralement la main ou le pied, lié à une prolifération osseuse, à une prolifération de graisse dans les tissus mous et à une macrodactylie orientée vers le territoire nerveux, caractéristique de la maladie connue sous le nom de macrodystrophie lipomateuse (Amadio et al 1988 ; Murphey et al. 1999). L'aspect américain d'hamartome fibrolipomateux est pathognomonique de cette entité, reflétant la morphologie de la lésion. L'échographie montre un élargissement fusiforme frappant du nerf médian au niveau de l'avant-bras distal à travers la paume, caractérisé par une masse accrue de tissu adipeux hyperéchogène dans l'épinèvre qui entoure et s'interpose entre des fascicules d'apparence normale (Fig. 5a à d) (Murphey et al. 1999; Chen et al. 1996). Au niveau du canal carpien, le nerf médian affecté peut devenir symptomatique plus tôt que les autres nerfs en raison de son empiétement par le rétinaculum des fléchisseurs. Dans ces cas, la détection de faisceaux nerveux qui semblent gonflés de manière focale dans la masse adipeuse indique une compression et la nécessité d'une libération du canal carpien (Fig. 5e – g). Le dégonflement de la masse peut compromettre la vascularisation intraneurale, provoquant des déficits moteurs et sensoriels catastrophiques ou une réponse de guérison intense qui peut compromettre davantage la fonction (Marom et Helms 1999).
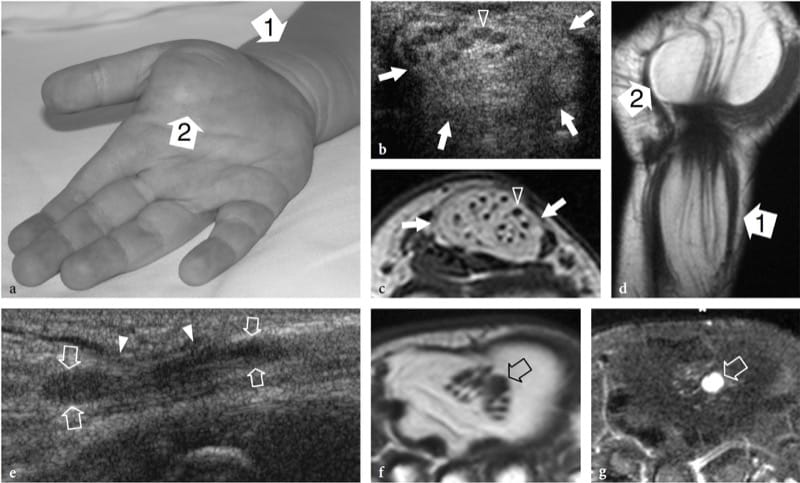
Figure 5. a–g. Hamartome fibrolipomateux. a Photographie de la main droite d'un enfant de 3 ans présentant des symptômes légers de neuropathie médiane et un gonflement et une sensibilité diffus des tissus mous s'étendant du radius distal (1) à la face radiale de la paume (2). b Une image échographique transversale 12–5 MHz obtenue à proximité du canal carpien avec des images IRM corrélatives transversales c et coronales pondérées en T1 montre un élargissement fusiforme anormal du nerf médian (flèches). Le nerf présente des fascicules d'apparence normale (tête de flèche) entrecoupés de graisse hyperéchogène dans l'épinèvre. Il existe une corrélation étroite entre les résultats de l'échographie et ceux de l'IRM. Dans le plan coronal, l'IRM met en évidence une croissance anormale de la graisse prédominante en dehors de l'espace confiné du canal carpien. e L'image échographique longitudinale 12–5 MHz au niveau du canal carpien identifie le gonflement fusiforme d'un fascicule individuel (flèches) juste en profondeur du rétinaculum des fléchisseurs (têtes de flèches). Les images IRM transversales correspondantes pondérées en T1 f et pondérées en T2 avec suppression de la graisse g confirment la présence d'un seul faisceau hyperintense en T2 gonflé (flèche), par rapport aux faisceaux normaux adjacents, indiquant peut-être une anomalie compressive. Le patient a ressenti un soulagement des symptômes après l'opération et la douleur ne s'est pas reproduite pendant 1 an de suivi postopératoire.
5. MALADIE DE CHARCOT-MARIE-TOOTH
La maladie de Charcot-Marie-Tooth est un groupe complexe et hétérogène de troubles héréditaires du système nerveux périphérique, également connus sous le nom de neuropathies motrices et sensorielles héréditaires, qui se caractérise par une neuropathie périphérique hypertrophiée due à la croissance anormale (comme un bulbe d'oignon) de Schwann cellules (Fig. 6a, b). Les caractéristiques cliniques les plus courantes comprennent une démarche instable due à une faiblesse distale progressive des muscles péroniers, un pied creux, des réflexes tendineux profonds déprimés ou absents et une légère perte sensorielle. Les anomalies histopathologiques impliquent tous les nerfs du corps et se produisent principalement dans les faisceaux. Bien que le système de classification de la maladie de Charcot-Marie-Tooth soit en constante évolution (car tous les gènes responsables n'ont pas encore été décrits), les formes les plus courantes incluent les types autosomiques dominants 1A et 2 qui sont liés à la duplication de l'ADN d'une région sur le chromosome 17 qui code pour une protéine de myéline périphérique, et le type lié à l'X qui est lié à une mutation du gène qui code pour la connexine 32, qui est une protéine de jonction lacunaire (Schenone et Mancardi 1999). Le degré d'altérations électrophysiologiques varie considérablement parmi les patients atteints de différentes formes de la maladie, en particulier dans le type 1A, en raison de différences phénotypiques et de l'action de facteurs stochastiques ou de la modulation environnementale de la gravité de la maladie (Schenone et Mancardi 1999). Les nerfs semblent plus gros que la normale mais conservent une échotexture fasciculaire normale (Heinemeyer et Reimers 1999; Martinoli et al. 2002). En considérant les principaux types génétiques de la maladie de Charcot-Marie-Tooth, tels que les types autosomiques dominants 1A et 2 et le type lié à l'X, les patients atteints de type 1A ont des fascicules nettement plus grands que les patients atteints des autres sous-types de la maladie. Chez ces patients, le diamètre des faisceaux et la surface nerveuse résultante sont plus du double de ceux observés chez les sujets sains et dans le type 2 et le type lié à l'X (Fig. 6c, d) (Martinoli et al. 2002). Il n'y a pas de corrélation entre la taille fasciculaire maximale du nerf et les caractéristiques électrophysiologiques, telles que les latences distales, les vitesses et l'amplitude (Martinoli et al. 2002). Dans ce contexte clinique spécifique, l'échographie peut être utilisée pour aider le neurologue à identifier une maladie non reconnue chez les patients présentant des symptômes non spécifiques, à différencier le sous-type génétique 1A et à fournir un outil de dépistage utile pour une première sélection des individus d'une famille affectée qui sont subir des bilans génétiques.
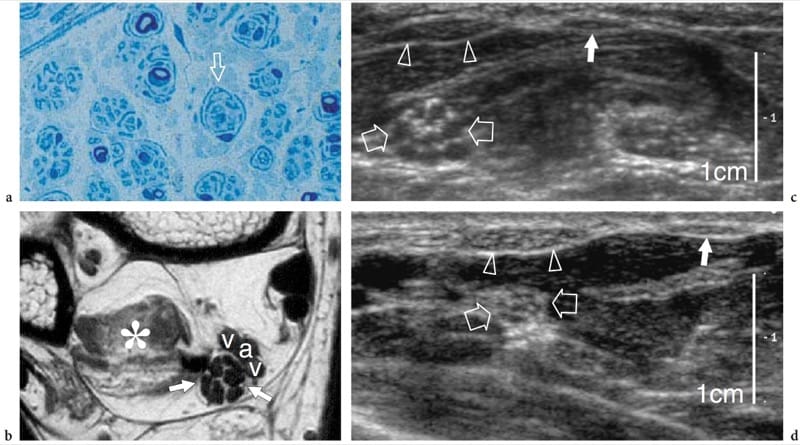
Figure 6. a–d. Maladie de Charcot-Marie-Tooth chez une femme de 37 ans atteinte d'une maladie de type 1A. une coupe histologique d'un fascicule du nerf sural montre l'aspect anormal en «bulbe d'oignon» (flèche) des cellules de Schwann, une découverte particulière de la maladie de Charcot-Marie-Tooth. Grossissement d'origine ×800. b L'IRM transversale pondérée en T1 de la partie postérieure de la cheville révèle un nerf tibial hypertrophié (flèches) caractérisé par des fascicules enflés. Le nerf est beaucoup plus gros que la normale. Notez les modifications atrophiques du muscle long fléchisseur de l'hallux (astérisque) et de l'artère tibiale postérieure adjacente (a) et des veines (v). c Image échographique 12–5 MHz à petit axe sur l'avant-bras moyen révélant une hypertrophie du nerf médian (flèches vides) et de ses faisceaux. d L'image US correspondante de 12 à 5 MHz du nerf médian obtenue à des fins de comparaison chez une femme en bonne santé au même grossissement indiqué en c montre un nerf médian plus petit (flèches ouvertes) et des fascicules. Notez la taille équivalente des tendons fléchisseur radial du carpe (têtes de flèche) et long palmaire (flèche blanche) sur les deux images. L'échelle de grossissement est indiquée à droite.
6. NEUROPATHIE HÉRÉDITAIRE AVEC CAPACITÉ DE PARALYSIE DE PRESSION
La neuropathie héréditaire responsable des paralysies de pression, également connue sous le nom de neuropathie tomaculeuse, est une maladie héréditaire autosomique dominante caractérisée par une tendance à développer des neuropathies focales après un traumatisme banal lié à une délétion du chromosome 17p11.2-12 produisant une expression réduite de la myéline périphérique. protéine 22 (Verhagen et al. 1993). Sur le plan histopathologique, un gonflement de la gaine de myéline en forme de saucisse, appelé tomacula, est responsable de l'hypertrophie nerveuse multifocale. Les études électrophysiologiques mettent en évidence une ou plusieurs neuropathies par occlusion sur fond de polyneuropathie motrice et sensorielle. Les nerfs les plus fréquemment impliqués sont : le nerf péronier au niveau du tunnel fibulaire, le nerf cubital au niveau du tunnel cubital, le nerf radial au niveau du sillon spiralé et le nerf médian au niveau du canal carpien (Verhagen et al. 1993 ; Beekman et Visser 2002 ). L'échographie est capable de reconnaître l'hypertrophie focale des nerfs non seulement au niveau des tunnels ostéofibreux qui sont généralement impliqués, mais également le long du parcours des nerfs dans les membres (Fig. 7). Il est concevable que les gonflements de myéline en forme de saucisse (tomacula) trouvés dans les études sur les fibres nerveuses taquinées chez les patients atteints de ce trouble soient responsables de l'hypertrophie nerveuse (Beekman et Visser 2002).
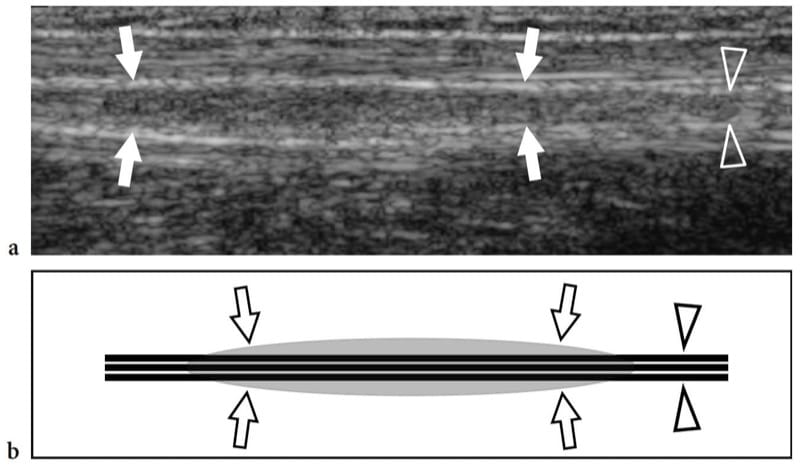
Figure 7.a,b. Neuropathie héréditaire avec risque de paralysie de pression chez un homme de 42 ans présentant une légère neuropathie médiane et ulnaire. Une image US à axe long 12–5 MHz du nerf ulnaire (têtes de flèches) au niveau de l'avant-bras moyen avec une corrélation de dessin schématique b révèle un léger épaississement fusiforme (flèches) du nerf hors des tunnels ostéofibreux.
7. INSTABILITÉ NERVEUSE
L'échographie dynamique du coude peut être utilisée pour aider à mettre en évidence une luxation anormale du nerf ulnaire, avec ou sans syndrome de claquement du triceps. Cette constatation se produit généralement dans le tunnel cubital, un tunnel ostéofibreux formé par une rainure entre l'olécrâne et l'épicondyle médial et ponté par le rétinaculum d'Osborn. Le balayage dynamique pendant la flexion complète du coude peut permettre une représentation continue de la luxation intermittente du nerf cubital sur l'épicondyle médial si le rétinaculum est lâche ou absent (Jacobson et al. 2001). La luxation du bord médial du triceps peut également se produire en combinaison avec la luxation du nerf cubital (Jacobson et al. 2001). Dans ce syndrome, la luxation du nerf cubital est secondaire au claquement du triceps et le balayage dynamique montre que le chef médial du triceps et le nerf cubital restent en étroite continuité lorsqu'ils se disloquent sur l'épicondyle médial.
8. SYNDROMES COMPRESSIFS
D'un point de vue physiopathologique général, la compression nerveuse peut survenir de manière aiguë ou se développer de manière chronique. De courtes périodes de constriction entraînent un ralentissement et une défaillance de la conduction à travers le point de constriction, tandis que la partie nerveuse distale de la région qui a été comprimée conserve une fonction normale. Les anomalies de la conduction, généralement désignées par le terme « neuroapraxie », ont tendance à se résoudre, mais il peut y avoir une latence prolongée jusqu'à la guérison complète. Ce type de blessure survient généralement dans le nerf radial au niveau de la rainure en spirale de l'humérus, la soi-disant « paralysie radiale du samedi soir », et dans le nerf péronier autour de la tête et du cou du péroné, la soi-disant « paralysie péronière des jambes croisées ». ”. Si la compression locale est prolongée, une ischémie induite par une compression sévère directe, une distorsion mécanique de l'architecture nerveuse, peut entraîner des lésions plus importantes de la gaine de myéline et une dégénérescence axonale (dégénérescence wallérienne) des fibres nerveuses et un déficit nerveux persistant dû à une perturbation de l'axoplasme après le relâchement de la compression (Delfiner 1996). Dans le piégeage nerveux chronique, l'irritation ou la compression du nerf peut induire une interférence avec l'apport microvasculaire intraneural et une réaction ischémique affectant principalement l'épinèvre. La congestion veineuse peut produire un œdème endoneural avec une pression de fluide accrue dans l'environnement des fascicules, induisant ainsi un syndrome de microcompartiment (Shon 1994; Delfiner 1996). Dans les premiers stades, les symptômes peuvent être intermittents ou même soulagés après l'exercice, parallèlement à la récupération de la circulation intraneurale et au drainage de l'œdème intraneural. Au fur et à mesure que la maladie progresse, l'œdème soutenu de l'épinèvre peut se transformer en changements fibrotiques avec épaississement et fibrose des gaines nerveuses, contribuant davantage à une constriction chronique du nerf. Une compression prolongée entraîne des lésions de la gaine de myéline et une dégénérescence axonale induite par la fibrose, avec perte définitive de la fonction nerveuse et atrophie des muscles innervés. Les troncs nerveux comprimés de manière chronique sont généralement minces au site de compression (avec réduction du nombre de fibres myélinisées) et gonflés à proximité du point de compression. Les conséquences physiologiques liées à la compression chronique sont le ralentissement des vitesses de conduction et, occasionnellement, le blocage de la conduction.
9. SYNDROMES DE PIÉGEAGE NERVEUX
L'atteinte nerveuse de causes extrinsèques peut survenir n'importe où dans le corps. Cependant, il est plus fréquent sur les sites anatomiques où le nerf passe dans des tunnels ostéofibreux inextensibles ou sous une bande proéminente ou anormale de muscle, de tissu conjonctif ou de crête osseuse qui attache le nerf. L'évaluation diagnostique des syndromes nerveux compressifs repose essentiellement sur les caractéristiques cliniques et les tests électrophysiologiques, et l'intérêt principal de l'imagerie réside dans l'évaluation des cas difficiles ou atypiques, ou lorsqu'une masse est suspectée sur des bases cliniques. Ces dernières années, l'échographie a été de plus en plus proposée comme une alternative efficace et peu coûteuse à l'imagerie par résonance magnétique pour la détection des lésions compressives.
Dans les syndromes de piégeage nerveux, l'échographie peut démontrer des changements à la fois dans la forme et l'échotexture du nerf, le plus courant étant un aplatissement soudain (signe d'encoche) avec une réduction focale de la section transversale du nerf au point de compression et un gonflement du nerf qui se produit à proximité du niveau de compression (Fig. 8) (Buchberger et al. 1991; Martinoli et al. 2000b). Le gonflement nerveux est généralement fusiforme, s'étendant sur 2 à 4 cm de long et semble maximal à proximité immédiate du niveau de compression, où le nerf s'aplatit brusquement. Compte tenu de ces caractéristiques, l'échographie est un moyen précis d'identifier le niveau de compression situé juste devant la partie nerveuse enflée. Bien que l'aplatissement nerveux doive être considéré comme le principal signe de compression nerveuse, l'analyse quantitative de l'épaississement nerveux au moyen de la formule de l'ellipse [(diamètre AP maximum) × (diamètre LL maximum) × (π/4)] s'est avérée la plus efficace. critère constant pour le diagnostic à divers sites de piégeage (Chiou et al. 1998; Duncan et al. 1999; Bargfrede et al. 1999). À titre accessoire, le balayage dynamique peut montrer une mobilité réduite du nerf au-dessus de la masse ou sous le rétinaculum, mais ce dernier signe est trop subjectif et difficile à quantifier par échographie (Nakamichi et Tachibana 1995). Au moins au niveau du canal carpien, la section transversale du nerf médian a également été considérée comme un indice de sélection des patients atteints d'une maladie grave pour lesquels une décompression chirurgicale est indiquée (Lee et al. 1999). Il est concevable que la perte d'axones puisse être associée à une hypertrophie nerveuse en tant qu'expression d'une quantité accrue d'œdème endoneural (Beekman et al. 2004b). Dans les neuropathies par compression, l'échotexture nerveuse peut devenir uniformément hypoéchogène avec perte du motif fasciculaire au niveau du site de compression et à proximité de celui-ci (Fig. 9). En général, les changements hypoéchogènes se produisent progressivement et deviennent plus sévères à mesure que le nerf se rapproche du site de compression (Martinoli et al. 2000b). Ils dérivent du gonflement des fascicules individuels et de la diminution de l'échogénicité de l'épinèvre. La paroi externe du nerf, qui est normalement indéfinie et fait partie d'un continuum avec l'épinèvre et la graisse environnante, devient nette et bien délimitée. La représentation de tels changements peut augmenter la confiance dans le diagnostic et dans la détermination du niveau exact de la lésion. En cas de piégeage par du tissu cicatriciel, des difficultés diagnostiques peuvent survenir pour distinguer les changements échotexturaux liés au nerf comprimé de la cicatrice elle-même, en raison d'un aspect hypoéchogène similaire. Ensuite, une représentation améliorée des signaux de flux sanguin intraneural peut être appréciée avec des techniques Doppler couleur et puissance comme signe de perturbations locales de la microvasculature nerveuse qui se produisent dans un contexte de compression (Martinoli et al. 2000b). Le schéma hypervasculaire est plus clairement apprécié dans les nerfs hypoéchogènes enflés des patients atteints d'une maladie chronique de longue date. Les signaux de flux intranerveux sont constitués de nombreux pédicules vasculaires qui pénètrent dans le nerf à partir de l'épinèvre superficiel pour s'étendre perpendiculairement aux fascicules (Fig. 10) (Martinoli et al. 1999, 2000b).
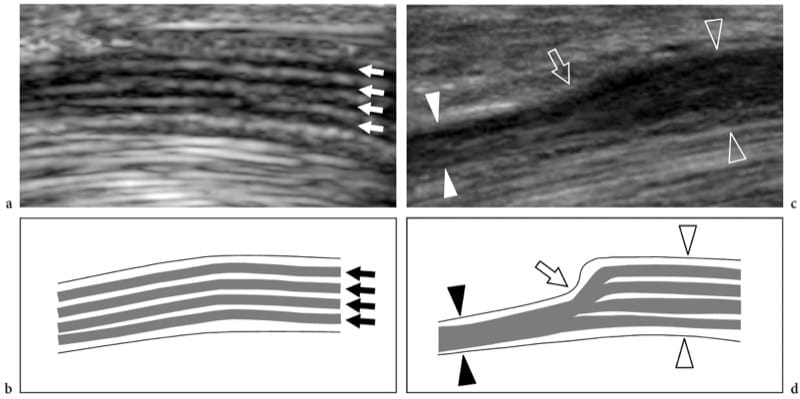
Figure 8. a–d. Neuropathies par piégeage : modifications de la forme des nerfs. Une image US à axe long 15–7 MHz du nerf médian au niveau du canal carpien avec une corrélation de dessin schématique b chez un volontaire sain montre un nerf de taille normale et une délimitation claire de l'arrangement fasciculaire (flèches). c L'image échographique 17-5 MHz à grand axe correspondante du nerf médian chez un patient atteint de neuropathie médiane sévère révèle un changement brusque (flèche) de la taille du nerf au bord proximal du rétinaculum (point de compression). Le nerf est aplati (têtes de flèches blanches) dans le canal carpien et nettement enflé (têtes de flèches ouvertes) à proximité du niveau de compression.
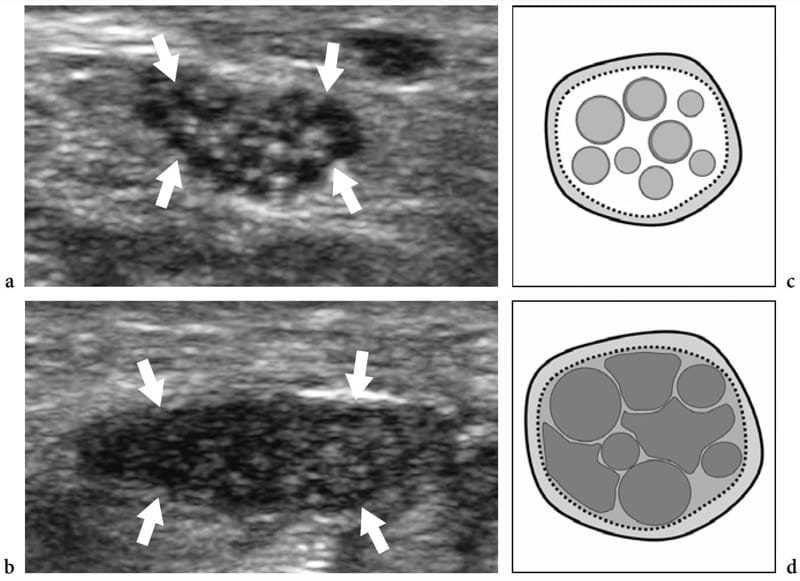
Figure 9. a–d. Neuropathies par piégeage : modifications de l'échotexture. a,b Images échographiques à axe court 17–5 MHz du nerf médian droit obtenues a au niveau du radius distal et b juste en avant du point de compression chez un patient atteint d'un syndrome du canal carpien de longue date. Lorsque le nerf (flèches) se rapproche du site de compression, des modifications hypoéchogènes croissantes sont détectées en raison de l'encombrement des faisceaux œdémateux et de l'échogénicité réduite de l'épinèvre. Cela conduit à une perte complète de l'échotexture fasciculaire. c,d Corrélation schématique.
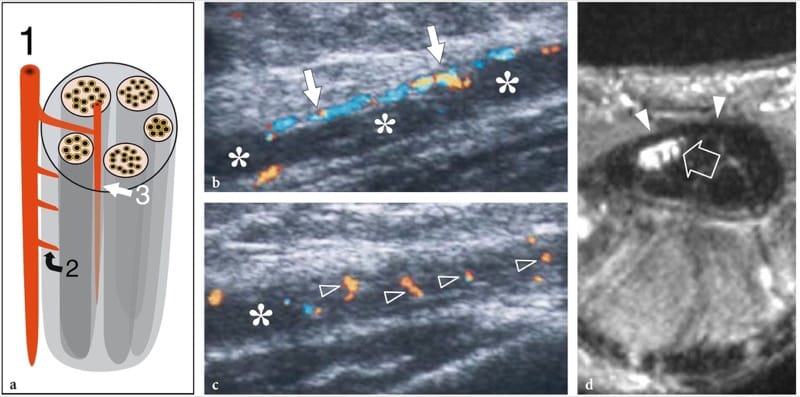
Figure 10. a–d. Neuropathies par piégeage : modifications microvasculaires. un dessin schématique illustre le système vasculaire nerveux, composé de vaisseaux périneuraux (1) longeant le nerf. Ces vaisseaux dégagent des branches intraneurales qui traversent l'épinèvre externe (2) et se répartissent longitudinalement (3) entre les faisceaux. b, c Les images échographiques Doppler couleur 12–5 MHz à axe long du nerf médian (astérisques) chez un patient de 56 ans atteint du syndrome du canal carpien montrent des signaux de flux subtils provenant du plexus périneural longitudinal (flèches) et une série de branches (pointes de flèches) courant parmi les fascicules. d L'image IRM transversale correspondante pondérée en T1 avec suppression de la graisse Gd et obtenue juste en profondeur du rétinaculum des fléchisseurs (têtes de flèches) révèle une absorption marquée de produit de contraste dans le nerf médian (flèche).
Sur la base de l'évaluation américaine, les syndromes de compression nerveuse peuvent être divisés en trois classes principales. Le premier comprend les gros nerfs (c'est-à-dire le médian, l'ulnaire, le radial, le sciatique, le tibial, etc.) qui sont facilement représentés par échographie au site de compression. Dans ces cas, l'évaluation échographique peut être efficacement réalisée avec un équipement conventionnel (milieu de gamme) et le diagnostic est basé sur une analyse de reconnaissance de formes et des mesures quantitatives. Le second comprend les petits nerfs (c'est-à-dire l'interosseux postérieur et antérieur, le musculo-cutané, le péronier, le sural, le plantaire, etc.) dont la représentation nécessite un équipement haut de gamme et des transducteurs performants. Dans ces cas, les mesures quantitatives ne sont généralement pas appliquées. La troisième classe comprend les nerfs qui ne sont pas détectables par US parce qu'ils sont soit trop petits (c. trajet intrapelvien du nerf sciatique et du nerf fémoral, etc.). Dans ces cas, le diagnostic échographique repose uniquement sur l'évaluation indirecte des muscles innervés pour identifier les signes de dénervation. Dans les deux premières classes, il existe de nombreux sites de compression nerveuse échographiques au niveau du membre supérieur et inférieur, et quels que soient le site et le nerf concernés, les signes échographiques décrits précédemment sont quasiment pathognomoniques de neuropathie compressive. Ils comprennent : la région de l'encoche spino-glénoïde-supra-épineuse dans l'épaule postérieure pour le nerf suprascapulaire (Martinoli et al. 2003); l'espace quadrilatère pour le nerf axillaire (Martinoli et al. 2003 ; la rainure en spirale de l'humérus pour le nerf radial (Peer et al. 2001 ; Bodner et al. 1999, 2001 ; Rossey-Marec et al. 2004 ; Martinoli et al. 2004); la zone supinatrice du coude pour le nerf interosseux postérieur (Bodner et al. 2002b ; Chien et al. 2003 ; Martinoli et al. 2004) et le poignet pour la branche superficielle du nerf radial ; les tunnels cubital et Guyon pour le nerf cubital (Chiou et al. 1998 ; Puig et al. 1999 ; Okamoto et al. 2000 ; Martinoli et al. 2000b, 2004 ; Nakamichi et al. 2000 ; Bianchi et al. 2004 ; Beekman et al. 2004a ; Beekman et Visser 2004); l'avant-bras moyen pour le nerf interosseux antérieur (Hide et al. 1999) et le canal carpien pour le nerf médian (Altinok et al. 2004 ; Buchberger et al. 1991, 1992 ; Nakamichi et Tachibana 1995 ; Bertolotto et al. 1996 ; Lee et al. 1999 ; Chen et al. 1997 ; Duncan et al. 1999 ; Martinoli et al. 2002b ; Kele et al. 2003 ; Bianchi et al. 2004 ; El Miedany et al. 2004 ; Yesildag et al. 2004 ; Wilson 2004; Wang et al. 2004 ; Kotevoglu et Gülbahce-Saglam 2005 ; Koyuncuoglu et al. 2005 ; Ziswiler et al. 2005); la hanche postérieure ou la cuisse proximale pour le nerf sciatique (Graif et al. 1991); la tête et le cou fibulaire pour le nerf péronier commun (Martinoli et al. 2000b); le tunnel tarsien du nerf tibial (Martinoli et al. 2000b) et les espaces inter-métatarsiens pour les nerfs interdigitaux (Redd et al. 1989; Lire et al. 1999 ; Sobiesk et al. 1997 ; Quinn et al. 2001).
En ce qui concerne les résultats électrophysiologiques, une corrélation positive entre la section transversale du nerf et la gravité des résultats électromyographiques a été trouvée, alors qu'une corrélation négative modeste semble exister entre les paramètres électrodiagnostiques, tels que la vitesse motrice, l'amplitude CMAP, le SNAP distal , et la section transversale du nerf (Kele et al. 2003 ; Beekman et al. 2004 ; El Miedany et al. 2004 ; Ziswiler et al. 2005). De manière générale, l'échographie peut compléter les études de conduction nerveuse dans l'évaluation des syndromes de compression nerveuse. Il peut être informatif chez les patients avec des réponses motrices ou sensorielles absentes, lorsqu'il est difficile de localiser le site de compression. Une étude américaine positive peut réduire l'incertitude des études de conduction nerveuse et, par conséquent, réduit le besoin d'autres études d'exclusion. En outre, l'échographie peut identifier des signes anormaux dans l'environnement nerveux, tels qu'une synovite, des masses occupant de l'espace ou des muscles anormaux, fournissant des informations importantes dans le cadre préopératoire.
Après décompression chirurgicale, l'aspect échographique et la mobilité des nerfs affectés peuvent s'améliorer, et il est possible de visualiser la morphologie altérée du tunnel ostéofibreux après libération du rétinaculum (Martinoli et al. 2000b ; El-Karabaty et al. 2005).
10. BLESSURES D'ÉTIREMENT
Les lésions d'étirement nerveux surviennent généralement à la suite d'entorses ou de foulures répétitives, ainsi que d'une utilisation excessive. Une blessure caractéristique est l'avulsion des racines nerveuses qui survient lors d'un traumatisme du plexus brachial lors d'accidents de la route (Shafighi et al. 2003 ; Graif et al. 2004). Un autre site typique de traction nerveuse est la fosse poplitée, où le nerf péronier peut être étiré lors d'entorses de haut grade, de luxations ou de fractures du genou (Gruber et al. 2005). Dans les lacérations nerveuses complètes, l'échographie révèle une rupture des fascicules avec rétraction et trajet ondulé des terminaisons nerveuses (Shafighi et al. 2003 ; Graif et al. 2004 ; Gruber et al. 2005). La gaine nerveuse externe peut être intacte. Si une lésion de traction provoque une déchirure partielle du nerf, un névrome fusiforme (névrome de traction) peut se développer sous la forme d'un gonflement irrégulier du tissu hypoéchogène le long du trajet du nerf sectionné sans signe de discontinuité nerveuse (Fig. 11) (Bodner et al. 2001; Graif et al. 2004). Dans les cas bénins, le névrome peut n'impliquer qu'un ou quelques fascicules tandis que la section transversale du nerf apparaît assez normale ou légèrement agrandie.
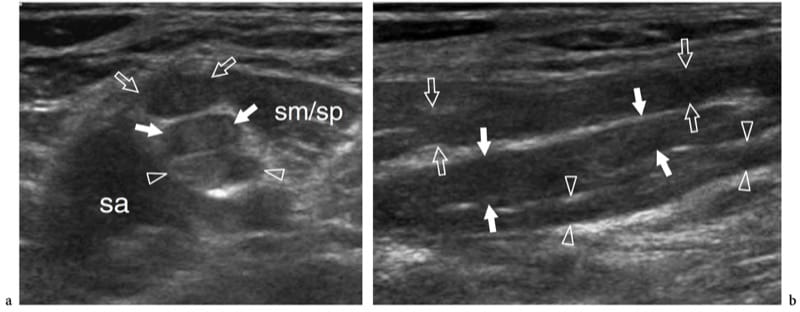
Figure 11. a, b. Lésion par étirement (syndrome du brûleur/dard) des nerfs du plexus brachial chez un rugbyman de 25 ans avec fourmillements persistants irradiant de l'épaule gauche à la main et faiblesse progressive des muscles des membres après une blessure de contact importante. a Les images américaines à petit axe et à grand axe 12–5 MHz sur la zone interscalène montrent un épaississement segmentaire des composants C5 (flèches ouvertes), C6 (flèches blanches) et C7 (têtes de flèches) du plexus (troncs supérieur et moyen ), reflétant des névromes fusiformes liés à un traumatisme d'étirement. sa, scalène antérieur ; sm/sp, muscles scalène moyen/scalène postérieur. Dans le syndrome du brûleur / dard, une imagerie IRM de la colonne cervicale doit toujours être effectuée pour exclure les lésions nerveuses à l'intérieur du canal rachidien ainsi que les hernies discales, les lésions ligamentaires, les lésions facettaires et les fractures non déplacées.
11. TRAUMATISME DE CONTUSION
Les traumatismes par contusion surviennent le plus souvent là où les nerfs sont étroitement apposés aux surfaces osseuses sur les sites à faible mobilité et sont donc plus vulnérables aux blessures externes. Dans la plupart des cas, un tel traumatisme se résout d'eux-mêmes et ne provoque pas de changements morphologiques détectables à l'échographie (Fig. 12). Des traumatismes mineurs répétés par contusion sont généralement nécessaires pour provoquer des anomalies de la substance nerveuse qui peuvent être détectées par échographie. Un traumatisme de contusion typique est celui impliquant le nerf radial où il perce le septum intermusculaire latéral, ou le nerf péronier profond contre les os du milieu du pied chez les joueurs de football qui reçoivent des coups répétés sur le dos du pied (Schon 1994 ; Quinn et al. 2001) . Ces lésions conduisent au développement d'un épaississement fusiforme segmentaire du nerf au site du traumatisme. Un type particulier de traumatisme par contusion est celui impliquant des nerfs cubitaux instables au niveau du tunnel cubital chez les patients sans rétinaculum d'Osborne. Chez les sujets prédisposés, les frottements répétés du nerf contre l'épicondyle lors de la flexion du coude peuvent entraîner des lésions chroniques et un déficit fonctionnel, dits « névrite de friction ». Dans ces cas, le nerf apparaît enflé et hypoéchogène à la suite de changements fibrotiques et montre un épinèvre externe épaissi (Jacobson et al. 2001).
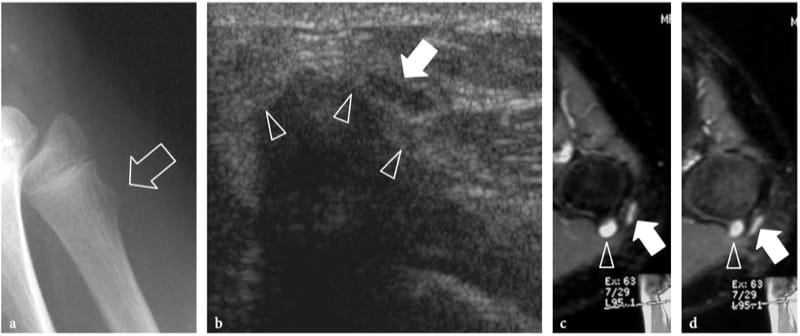
Figure 12. a–d. Traumatisme par contusion nerveuse. Neuropathie péronière chez un garçon de 15 ans avec apparition d'un pied tombant après avoir reçu un coup sur le genou latéral. a Un cliché de profil montre une exostose (flèche) au niveau de la métaphyse fibulaire. b L'image US transversale 12–5 MHz révèle un conflit du nerf péronier (flèche) contre le composant cartilagineux (têtes de flèche) de l'exostose. Le nerf est enflé et hypoéchogène. c, d Les images IRM transversales corrélatives GRE T2* avec suppression de la graisse montrent un nerf hyperintense (flèche) traversant l'exostose (tête de flèche). Notez la coiffe T2-hyerintense de l'exostose.
12. BLESSURES PÉNÉTRANTES
Dans les plaies pénétrantes (il s'agit souvent de fragments de verre !), il peut y avoir une interruption partielle ou complète des faisceaux nerveux. Les cellules de Schwann en régénération et les axones se développent de manière aléatoire sur le site de la lésion pour tenter de rétablir la continuité du nerf. Généralement, l'écart entre les fascicules séparés est large et de nouvelles pousses axonales se développent dans de nombreuses directions. Une masse fibreuse hypoéchogène est le résultat d'un tel processus de réparation désorganisé. Dans les déchirures complètes, les névromes du moignon (névromes terminaux) apparaissent comme de petites masses hypoéchogènes en continuité avec les bords opposés du nerf sectionné (Provost et al. 1997 ; Graif et al. 1991 ; Simonetti et al. 1999). Habituellement, leur taille est légèrement supérieure au diamètre axial du nerf. La plupart ont des marges bien définies ; cependant, lorsqu'ils sont attachés aux tissus environnants par des adhérences et enrobant du tissu cicatriciel, leurs bords peuvent être irréguliers ou mal définis (Bodner et al. 2001). La représentation américaine des névromes terminaux peut cartographier l'emplacement des extrémités nerveuses, qui peuvent être déplacées et rétractées du site de la blessure (Fig. 13a – c). Lorsque les extrémités nerveuses sont rapprochées, la majeure partie du névrome peut les envelopper imitant une déchirure partielle. D'une certaine manière, cela semble suggérer que l'US est incapable de quantifier le degré de lésion nerveuse dans un névrome fusiforme. Lorsque le nerf est partiellement déchiré, le névrome hypoéchogène peut enfermer des faisceaux réséqués et conservés donnant lieu à un gonflement fusiforme homogène du nerf ou peut être vu émerger spécifiquement des faisceaux réséqués, tandis que les faisceaux non affectés peuvent être appréciés poursuivant leur course le long du tissu fibreux. Masse (Fig.14). Dans ce dernier cas, l'échographie est en mesure d'estimer la quantité (pourcentage) de fascicules impliqués dans le névrome (Fig. 14d). Dans l'ensemble, l'échographie peut aider l'examen clinique et les études de conduction nerveuse à fournir des informations sur l'état du nerf lésé, et en particulier à décider si un traitement chirurgical précoce est nécessaire. Cela est particulièrement vrai pour les lésions nerveuses mineures sans atteinte axonale.
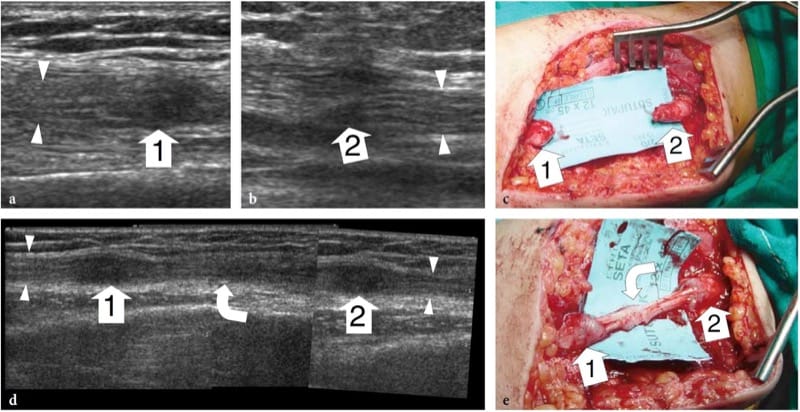
Figure 13. a–e. Déchirure nerveuse complète chez une fille de 12 ans avec perte de fonction du nerf médian après avoir reçu une blessure pénétrante au bras par un fragment de verre. En situation aiguë, le patient a été opéré d'une lacération de l'artère brachiale. a,b Les images échographiques grand axe 15-7 MHz au niveau de la lésion montrent une discontinuité du nerf médian. Notez les moignons proximaux et distaux (têtes de flèches) du nerf sectionné se terminant par un névrome terminal hypoéchogène (1, 2). c La vue chirurgicale brute montre une rétraction discrète (écart de 4 cm) des extrémités nerveuses. d Après chirurgie réparatrice, une image US grand axe 12–5 MHz montre la greffe du nerf sural (flèche courbe) interposée entre les extrémités nerveuses (têtes de flèche). Un épaississement hypoéchogène fusiforme est observé au niveau du site d'anastomose proximal (1) et distal (2) : il doit être considéré comme une constatation normale. Une image en écran partagé a été utilisée, les deux écrans étant alignés pour un champ de vision étendu. e Corrélation chirurgicale.
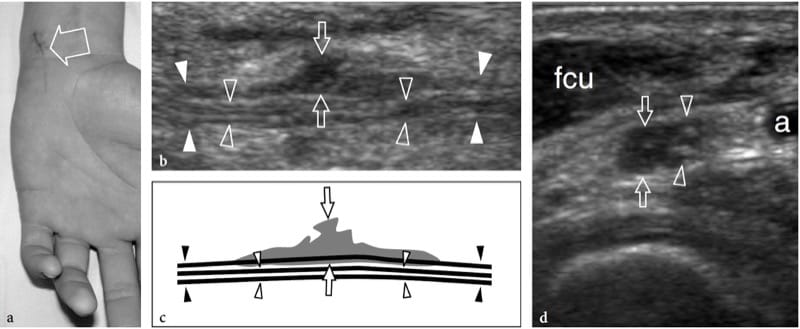
Figure 14. a–d. Déchirure partielle du nerf cubital au niveau du poignet chez un garçon de 15 ans. La blessure a été produite par un objet pointu et a entraîné un déficit moteur sélectif. a La photographie montre le site de la blessure (flèche). Observer la déformation en demi-flexion de l'annulaire et de l'auriculaire liée à la faiblesse des muscles interosseux ulnaires-innervés. b Image échographique 15–7 MHz grand axe sur le tronc principal du nerf ulnaire (têtes de flèches blanches en b, têtes de flèches noires en c) avec une corrélation de dessin schématique c révèle un tissu hypoéchogène (flèches) impliquant une partie des faisceaux nerveux, tandis que certains ont conservé les fascicules (pointes de flèche ouvertes) traversent le site de la blessure sans être affectés. d L'image US à axe court 15–7 MHz montre les parties affectées (flèches) et préservées (têtes de flèches) du nerf cubital. On observe un tissu fibreux hypoéchogène impliquant environ 50% des fascicules du côté médial du nerf, ceux qui donnent naissance à la branche motrice profonde. Inversement, les fascicules latéraux normaux continueront dans la branche sensorielle superficielle du nerf. a, artère ulnaire ; fcu, muscle fléchisseur ulnaire du carpe.
13. ÉLÉMENTS POSTOPÉRATOIRES
Chez les patients présentant une déchirure partielle du nerf, une procédure délicate de neurolyse interne du nerf et de sa gaine est principalement utilisée pour réparer les faisceaux nerveux interrompus ou pour éliminer le tissu cicatriciel intraneural. Avec cette procédure, le risque principal consiste en une lésion involontaire des faisceaux préservés et en la formation d'une nouvelle cicatrice postopératoire à proximité de la surface nerveuse. Avec une section complète du nerf, une intervention chirurgicale plus complexe est nécessaire. Le choix approprié d'une technique de reconstruction adéquate dépend de la longueur de l'espace intervenant entre les extrémités nerveuses après le retrait des tissus irréversiblement endommagés et des névromes terminaux. Lorsque l'écart est court, une anastomose « bout à bout » est préférée étant donné qu'une tension importante sur les moignons nerveux suturés peut être évitée. Lorsque l'écart est large, le pontage par greffe nerveuse pour obtenir une anastomose « extrémité nerveuse proximale-greffe-extrémité nerveuse distale » est la technique de choix. Pour cette dernière procédure, le tissu est généralement prélevé sur des nerfs sensoriels superficiels mineurs, tels que le nerf sural ou les nerfs cutanés brachial et antébrachial médial. Des sutures très fines placées dans l'épinèvre externe et interfasciculaire sont utilisées pour l'anastomose. Ils sont facilement appréciés par échographie sous forme de taches hyperéchogènes brillantes dans la substance nerveuse et ne doivent pas être confondus avec des signes pathologiques, tels que des calcifications dans le tissu granulomateux (Fig. 15). En chirurgie reconstructive nerveuse, l'échographie permet une évaluation postopératoire fiable de la continuité du nerf au niveau de l'anastomose, et peut écarter les collections périneurales. Une augmentation légère et fusiforme de la taille du nerf au niveau des sutures est une constatation normale. En revanche, un renflement irrégulier marqué du tissu hypoéchogène au niveau de l'anastomose, impliquant éventuellement un côté du nerf, doit être considéré comme un signe pathologique, indiquant une fusion inadéquate des bords nerveux et la formation d'un névrome post-chirurgical (Graif et al. 1991 ; Peer et al . 2001). Une tension excessive sur les bords nerveux et une infection sont des causes possibles d'anastomose défectueuse. Dans ce contexte clinique, l'échographie peut compenser les limites de l'électrodiagnostic et de l'examen clinique en fournissant des informations fiables sur la taille, l'étendue et la localisation des cicatrices post-chirurgicales et des névromes par rapport à une intervention chirurgicale ultérieure (Peer et al. 2003).
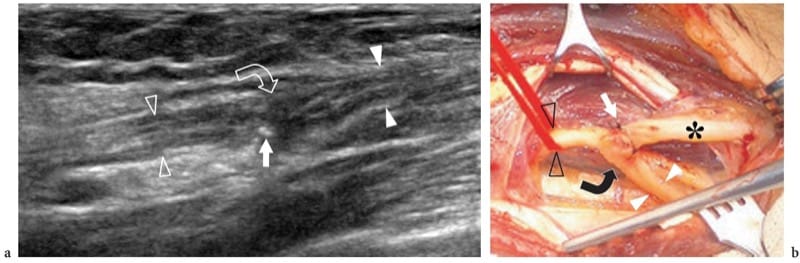
Illustration 15. a, b. Chirurgie reconstructive nerveuse. Cet homme de 62 ans a subi une amputation du nerf médian au niveau de l'avant-bras en raison d'un enrobage par un sarcome des tissus mous. Alors que le moignon du nerf proximal était implanté dans le muscle fléchisseur superficiel des doigts, le moignon distal était anastomosé avec le nerf cubital par une suture termino-latérale. Après la chirurgie, il y avait récupération partielle de la fonction du nerf médian. a Image échographique grand axe 17–5 MHz sur l'anastomose avec vue chirurgicale corrélative b montrant le moignon distal du nerf médian (têtes de flèches blanches) suturé au nerf ulnaire (têtes de flèches ouvertes). Notez un certain épaississement fusiforme du nerf au site d'anastomose (flèche courbe) avec quelques points fins (flèche droite) apparaissant comme de minuscules structures hyperéchogènes en forme de points à la surface du nerf. Astérisque, nerf cubital en aval de l'anastomose.
En plus des causes primaires (liées aux traumatismes, liées à la neurolyse), la formation de cicatrices peut survenir à la suite d'une intervention chirurgicale qui n'a pas été principalement dirigée vers le nerf (c'est-à-dire, réparation d'une fracture, chirurgie vasculaire, etc.). Le tissu cicatriciel peut envelopper le nerf dans son ensemble ou adhérer à sa surface (Fig. 16). Le nerf apparaît aplati et indiscernable à l'intérieur de la cicatrice ou peut être déformé à sa périphérie avec un gonflement focal réactif lié à l'œdème et à la congestion veineuse (Figure 16c,h). Dans ces circonstances, la cicatrisation nerveuse peut entraîner une douleur persistante et retarder la récupération de la fonction nerveuse en raison de la traction constante sur le nerf et de la capacité limitée de translation longitudinale lors des mouvements articulaires. Dans le cadre postopératoire, des découvertes américaines de lésions iatrogènes accidentelles des nerfs périphériques ont été rapportées dans les nerfs radial, fémoral, accessoire et sciatique (Graif et al. 1991 ; Peer et al. 2001 ; Bodner et al. 2002a ; Gruber et al. . 2003).
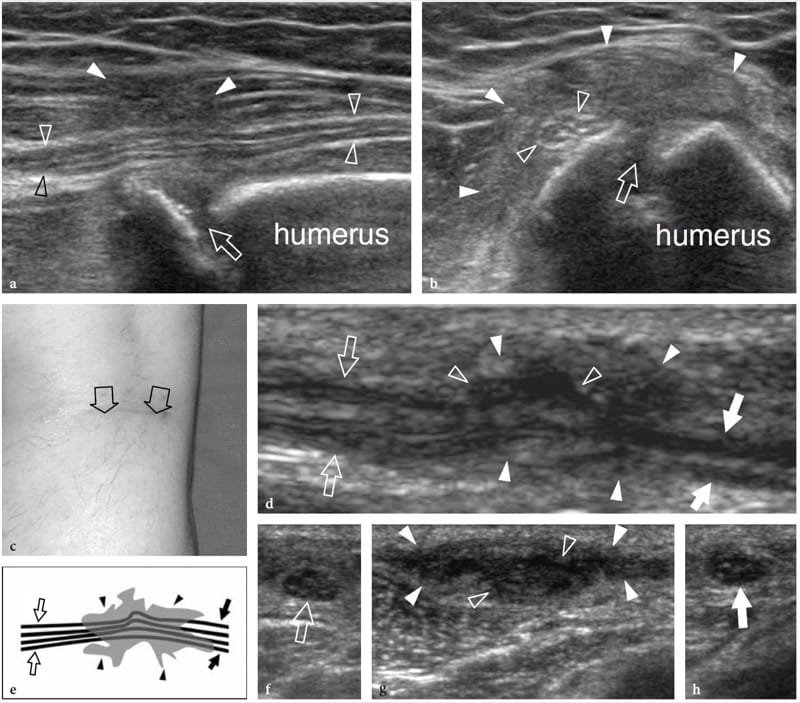
Figure 16. a–h. Encaissement postopératoire des nerfs par du tissu cicatriciel. Deux cas différents. a,b Nerf radial enfoui dans un cal fibreux après réparation d'une fracture de la diaphyse humérale. a Les images échographiques grand axe et b petit axe 17–5 MHz montrent un enrobage focal du nerf radial (têtes de flèches ouvertes) par une masse hypoéchogène mal définie (têtes de flèches blanches) se développant sur le site de la fracture (flèche) reflétant la formation de fibres cal. L'échotexture fasciculaire du nerf est conservée dans le cal. Le patient a subi un deuxième regard chirurgical pour libérer le nerf du cal. c–h Nerf péronier encaissé dans une cicatrice après décapage chirurgical de la veine saphène. c La photographie montre l'accès chirurgical. d L'image américaine 12–5 MHz à axe long du nerf péronier (flèches) avec une corrélation de dessin schématique révèle une distorsion et un pincement des faisceaux nerveux (têtes de flèches ouvertes) par un tissu cicatriciel hypoéchogène (têtes de flèches blanches). f–h Les images US à axe court 12–5 MHz obtenues de f proximal à h distal montrent le nerf péronier normal (flèche ouverte) qui devient indiscernable (têtes de flèche ouvertes) dans la cicatrice (têtes de flèche blanches) puis telle quelle (flèche blanche) sort de la cicatrice pour retrouver une apparence normale.
14. TROUBLES RHUMATOLOGIQUES ET INFECTIEUX
Dans plusieurs troubles rhumatologiques, tels que la polyarthrite rhumatoïde, la polyartérite noueuse, la granulomatose de Wegener et les syndromes de Churg-Strauss et de Sjögren, l'un des signes cliniques de la vascularite est l'apparition de signes neurologiques (Lanzillo et al. 1998 ; Rosenbaum 2001). Du point de vue physiopathologique, la neuropathie liée aux vascularites affecte les grands troncs nerveux produisant une dégénérescence multifocale des fibres à la suite d'une angiopathie nécrosante des petites artères nerveuses, dite mononeuropathie multiple (Said et Lacroix 2005). Chez ces patients, la neuropathie n'est pas corrélée avec les paramètres de la maladie, tels que l'activité de la maladie, le facteur rhumatoïde et les scores fonctionnels et radiologiques, et il existe une implication séquentielle des nerfs individuels à la fois dans le temps et anatomiquement (Nadkar et al. 2001). Les vitesses de conduction nerveuse ne sont généralement pas nettement réduites par rapport à la normale, à condition que le potentiel d'action nerveux ou musculaire composé ne soit pas sévèrement réduit en amplitude (Sivri et Guler-Uysal 1998). Bien que la mononeuropathie multiple soit la manifestation la plus courante, des syndromes de compression des nerfs peuvent également survenir aux sites où les nerfs passent à proximité d'une articulation synoviale (c.-à-d. tunnel cubital, tunnel tarsien, tunnel de Guyon) ou d'un ou plusieurs tendons à gaine synoviale (c. , tendons fléchisseurs au niveau du canal carpien, long fléchisseur de l'hallux au niveau du tunnel tarsien) ou des bourses para-articulaires (c.-à-d. bourse iliopsoas à la hanche). Étant donné que l'évaluation clinique des nerfs est souvent limitée chez ces patients par des symptômes simultanés résultant d'une atteinte articulaire, l'imagerie échographique peut contribuer à distinguer les neuropathies de compression liées au dérangement des articulations, aux épanchements et au pannus synovial des neuropathies sans compression. Ceci est basé sur le fait que la mononeuropathie multiple ne conduit pas à une morphologie altérée du nerf affecté, contrairement aux neuropathies par piégeage.
15. LÈPRE
La lèpre (maladie de Hansen) est une maladie infectieuse chronique due à Mycobacterium leprae qui, dans ses nombreuses et diverses formes cliniques, atteint la peau et les nerfs (Fig. 17a). Bien que dans le monde occidental la lèpre ne soit presque observée que chez les immigrants, elle est endémique dans les pays en développement (tropicaux et subtropicaux) avec 12 millions de personnes touchées ; elle représente donc la neuropathie la plus diffuse au monde. La lèpre se transmet probablement par une infection par gouttelettes, mais un contact familial prolongé est nécessaire et la plupart des gens ne sont pas sensibles à la maladie. Du point de vue clinique, la lèpre peut être regroupée en deux formes polaires – tuberculoïde et lépromateuse – entre lesquelles les formes limites présentent un spectre intermédiaire de phénotypes (Ridley et Jopling 1966). Dans la lèpre tuberculoïde, il existe une réponse immunitaire intense : une infiltration agressive de cellules épithélioïdes et lymphoïdes dans le nerf provoque un épaississement de l'épinèvre et du périnèvre et une destruction des faisceaux. Dans le type lépromateux, la réponse immunitaire est indolente et une prolifération active des bacilles se produit : cette forme montre une meilleure préservation de l'architecture nerveuse. La transition vers une forme de lèpre plus résistante peut produire des épisodes de névrite aiguë, tels que ce que l'on appelle la «réaction d'inversion» et «l'érythème noueux lépreux». Au cours de ces phases, un segment nerveux peut devenir intensément douloureux et tendre. Au fur et à mesure que la maladie progresse, des épisodes ultérieurs de névrite s'ajoutent au déficit jusqu'à ce que le nerf affecté puisse être complètement détruit. Les anomalies sensorielles précèdent généralement la paralysie. Le symptôme initial de l'atteinte nerveuse est la perte sensorielle, qui augmente la fréquence des traumatismes mineurs, entraînant des infections et éventuellement des blessures mutilantes et la cécité. Les sites préférés de gonflement des nerfs dans la lèpre sont similaires à ceux des neuropathies par compression (c. ). Comparé à un nerf chroniquement comprimé, cependant, l'élargissement du nerf est plus étendu et moins circonscrit. Chez les patients lépreux, l'échographie est capable de révéler des anomalies nerveuses, notamment un gonflement nerveux, des modifications hypoéchogènes de l'épinèvre et une perte de l'écho-texture fasciculaire (Fig. 17b, c) (Martinoli et al. 2000c). Ces changements nécessitent de multiples épisodes de réactions lépromateuses et un effet cumulatif avec le temps pour se manifester à l'US. En fait, l'hypertrophie nerveuse est bien corrélée avec les patients qui ont déjà subi des réactions d'inversion (Martinoli et al. 2000c). Au cours d'une réaction d'inversion, le segment nerveux affecté est nettement épaissi, intensément douloureux et sensible (Fornage et Nerot 1987 ; Martinoli et al. 2000c). Le début de ces réactions peut être indiqué par un schéma d'hyperémie intraneurale à l'imagerie Doppler couleur et puissance (Figure 17d-h) (Martinoli et al. 2000c). Ces signes suggèrent une progression rapide des lésions nerveuses et un mauvais pronostic sauf si un traitement antiréactionnel est instauré (Martinoli et al. 2000c). Plus rarement, des abcès «froids» des tissus mous peuvent être observés à partir du nerf affecté et se propager à travers les plans fasciaux des membres et des extrémités (Fig. 18).
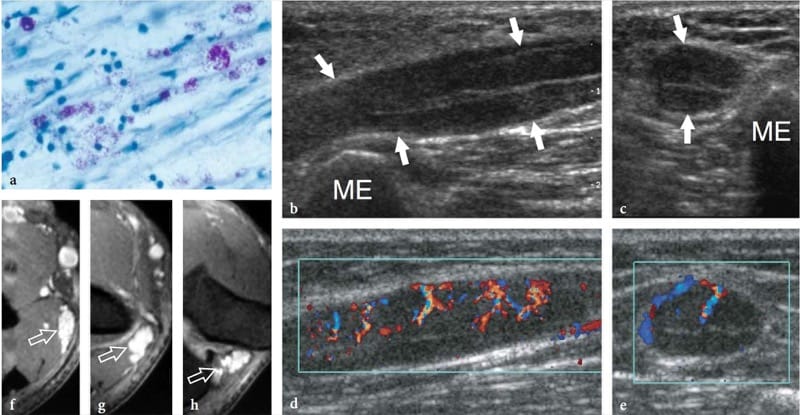
Figure 17. a–h. Réaction d'inversion dans la lèpre. a Une vue microscopique du nerf sural chez un patient de 25 ans atteint de lèpre révèle la présence de mycobactéries (violet) parmi le tissu nerveux. coloration de Ziehl-Nielsen ; grossissement d'origine ×800. b–h Nerf ulnaire droit d'un homme de 22 ans atteint de lèpre tuberculoïde borderline examiné au coude au cours d'une réaction d'inversion. b Les images américaines à 12–5 MHz en échelle de gris à axe long et à axe court montrent un gonflement important du nerf (flèches) avec un élargissement fusiforme lisse des fascicules individuels. ME, épicondyle médial. Les images Doppler couleur 12–5 MHz correspondantes d long axe et e petit axe montrent une augmentation spectaculaire du flux sanguin dans les vaisseaux endoneuraux. f–h La séquence crânienne à caudale d'images IRM avec suppression de la graisse améliorée par Gd à travers le coude médial montre une amélioration marquée du contraste dans le nerf (flèche).
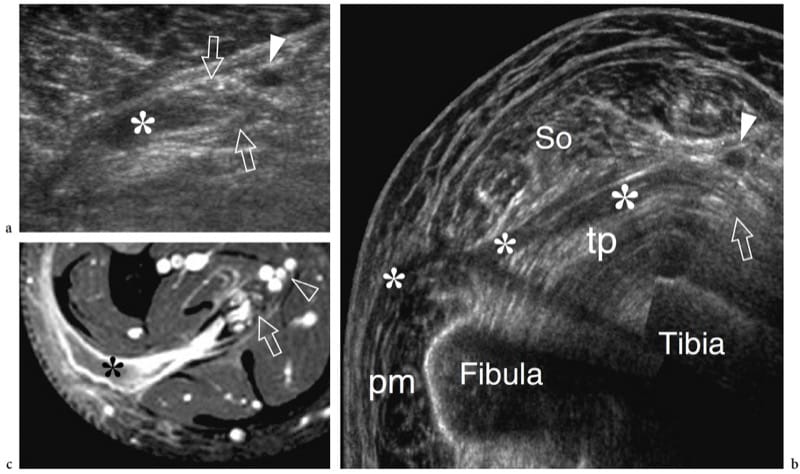
Figure 18. a–c. Abcès neurogène dans la lèpre. a Coupe transversale et b images échographiques à champ de vision étendu de 12 à 5 MHz sur le nerf tibial (flèches) au tiers médio-distal de la jambe montrent une collection de liquide (astérisque) provenant de la substance nerveuse et se propageant le long du fascia plans, profonds du muscle soléaire (So) et superficiels du tibial postérieur (tp) et des péroniers (pm). c L'image IRM corrélative avec suppression de graisse améliorée par Gd montre une amélioration discrète du contraste dans les parois de l'abcès. Notez l'origine de l'abcès du nerf. Pointe de flèche, vaisseaux tibiaux postérieurs. L'aspiration de liquide a révélé un matériel nécrotique aseptique.
16. TUMEURS ET ÉTATS DE TYPE TUMEUR
Les tumeurs des nerfs périphériques comprennent deux formes bénignes principales - le schwannome (également appelé neurinome ou neurilemmome) et le neurofibrome et la tumeur maligne de la gaine nerveuse périphérique, qui dérive le plus souvent de la transformation maligne (sarcomateuse) d'un neurofibrome (Murphey et al. 1999). De plus, d'autres masses, telles que des hémangiomes, des lymphomes et des kystes ganglionnaires, peuvent parfois se développer dans le nerf disséquant les fascicules et se dilatant à l'intérieur du tissu neural. La survenue de ces masses est rare mais elles peuvent entraîner un dysfonctionnement nerveux et des symptômes locaux et ne doivent pas être confondues avec les tumeurs de la gaine nerveuse les plus courantes. Enfin, une variété de néoplasmes extrinsèques des tissus mous, à la fois bénins avec un comportement agressif et malins, peuvent impliquer un nerf lors de leur propagation locale.
17. TUMEURS DE LA GAINE NERVEUSE PÉRIPHÉRIQUE
Les tumeurs des gaines nerveuses périphériques dérivent des cellules de Schwann. La douleur et les symptômes neurologiques sont inhabituels, sauf dans les grosses tumeurs (Murphey et al. 1999; Reynolds et al. 2004). De manière générale, le diagnostic américain de ces tumeurs repose sur la représentation d'une masse solide hypoéchogène en continuité directe avec un nerf à ses pôles proximal et distal (Fornage 1988 ; Beggs 1999 ; Martinoli et al. 2000a ; Lin et Martel 2001 ; Reynolds et al. 2004). La détection de la jonction entre la tumeur et le nerf d'origine nécessite un balayage minutieux car les extrémités nerveuses peuvent être déformées et étirées sur la masse. De plus, l'origine nerveuse d'une masse provenant d'un petit nerf (constitué d'un seul faisceau hypoéchogène) peut ne pas être évaluée de manière fiable : cela peut être particulièrement vrai dans les lésions superficielles. Certaines caractéristiques différentielles ont été décrites parmi les histotypes tumoraux, et en particulier entre les schwannomes et les neurofibromes.
Les schwannomes sont des tumeurs encapsulées à croissance lente que l'on trouve plus fréquemment dans les extrémités. Elles sont composées de cellules néoplasiques qui ont les caractéristiques ultrastructurales et le phénotype antigénique des cellules de Schwann mais ne contiennent pas d'axones (Woodruff 1993). La plupart apparaissent comme des masses globoïdes solitaires situées le long d'un nerf et excentriques par rapport à l'axe nerveux, avec une échotexture hypoéchogène homogène, une amélioration acoustique postérieure et un schéma hypervasculaire à l'imagerie Doppler couleur et puissance (Fig. 19a, b) (Fornage 1988 ; Beggs 1999 ; Martinoli et al. 2000a ; Lin et Martel 2001 ; Reynolds et al. 2004). Parfois, des modifications kystiques intratumorales liées à l'accumulation de matrice myxoïde (schwannome kystique) et à des calcifications (schwannome ancien) peuvent être reconnues (Fig. 20) (Isobe et al. 2004). Distinguer les schwannomes kystiques des ganglions intraneuraux peut être facilité par la localisation caractéristique de ces derniers (voir ci-dessous). Dans les schwannomes, l'extrémité proximale du nerf à l'extérieur de la tumeur peut apparaître épaissie et hypoéchogène avec perte du motif fasciculaire, produisant ainsi un aspect effilé de la masse ovale. Ceci peut être apprécié même pour un long segment nerveux et semble, au moins en partie, refléter l'infiltration de cellules tumorales le long des faisceaux (Graif M., données non publiées). De telles anomalies ne sont généralement pas observées à l'extrémité distale du nerf affecté. De plus, on peut voir des schwannomes se développer à partir d'un fascicule individuel, qui apparaît épaissi de manière diffuse même à distance de la masse, alors que les autres fibres du même nerf sont déplacées par la masse de la tumeur mais restent inchangées en termes de taille et d'échotexture. (Fig. 21). Cela peut expliquer pourquoi certains schwannomes semblent avoir une continuité centrale avec le grand axe du nerf.
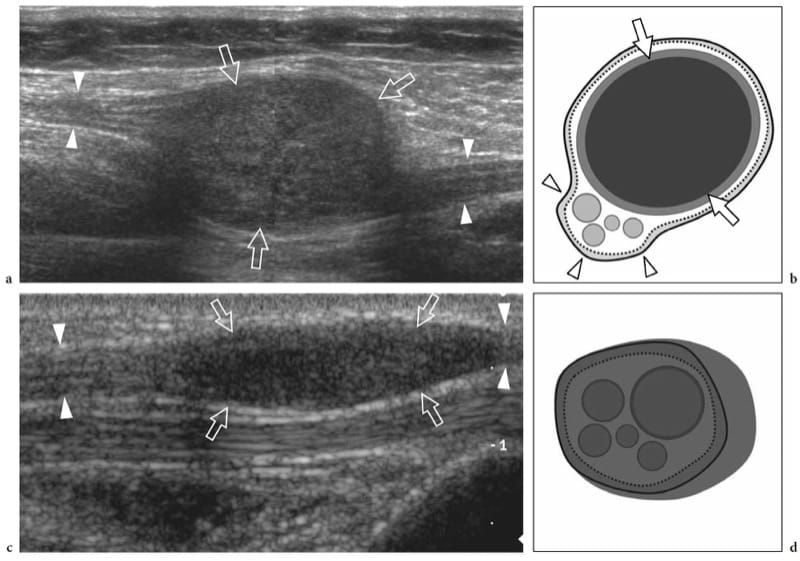
Figure 19. a–d. Tumeurs des gaines nerveuses périphériques. a,b Schwannome du nerf tibial à la jambe postérieure. Une image US à échelle de gris 12–5 MHz à axe long avec une corrélation de dessin schématique b représente la tumeur comme une masse hypoéchogène globoïde (flèches) qui se développe de manière excentrique à la périphérie du nerf (têtes de flèches). c,d Neurofibrome du nerf médian à l'avant-bras distal. c L'image américaine à échelle de gris 12-5 MHz à axe long avec corrélation de dessin schématique d montre la tumeur sous la forme d'une masse hypoéchogène en forme de fuseau (flèches) se dilatant dans le nerf et impliquant les faisceaux (têtes de flèches). L'élargissement focal du nerf et la disparition du motif fasciculaire sont observés.
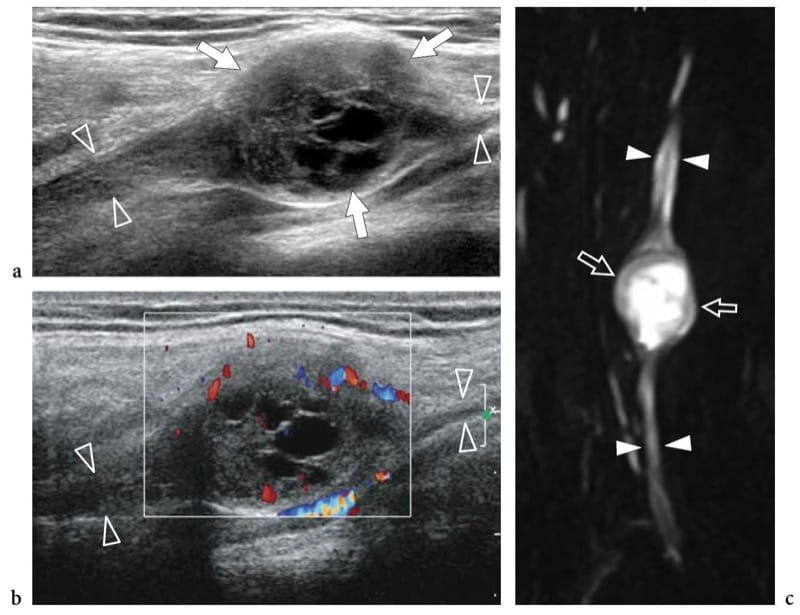
Figure 20. a–c. Schwannome kystique. a,b Les images échographiques Doppler couleur 12–5 MHz sur le nerf radial (têtes de flèches) sur le nerf radial (têtes de flèches) au niveau du bras avec une corrélation IRM-neurographique montrent une masse arrondie (flèches) avec des modifications kystiques intratumorales, liées à accumulation de matrice myxoïde, en continuité avec le nerf parent (têtes de flèches). La tumeur présente un schéma hypervasculaire composé de signaux Doppler couleur périphériques et centraux.
Les neurofibromes, quant à eux, sont intimement associés au nerf parent, se développant de manière fusiforme (et non globoïde), le nerf entrant et sortant des extrémités de la lésion (Fig. 19c, d) (King et al. 1997 ; Lin et Martel 2001). Histopathologiquement, elles sont composées d'un mélange de types cellulaires dont le prédominant présente les caractéristiques des cellules périneurales. Au fur et à mesure que les cellules prolifératives d'un neurofibrome se développent, elles se propagent à travers l'épinèvre dans les tissus mous environnants. Les neurofibromes peuvent être classés en trois formes : localisé, diffus et plexiforme (associé à la neurofibromatose de type 1). La variété localisée est la plus fréquente, représentant environ 90 % des cas (Murphey et al. 1999). Souvent, un signe cible formé par une région hyperéchogène centrale subtile au sein de la masse hypoéchogène peut être trouvé dans ces tumeurs, reflétant un foyer fibrotique central entouré de tissu myxomateux périphérique (Fig. 21b – d) (Lin et al. 1999). Les neurofibromes sont moins hypervasculaires que les schwannomes en imagerie Doppler couleur et puissance. Contrairement aux neurofibromes localisés, les neurofibromes diffus impliquent principalement la peau et le tissu sous-cutané et se présentent comme une élévation de la peau en forme de plaque avec un épaississement du tissu sous-cutané (Fig. 22a, b) (Murphey et al. 1999).
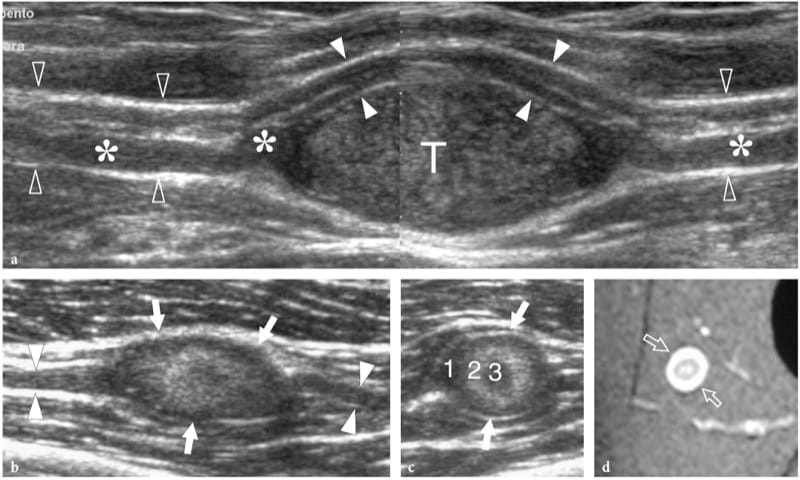
Figure 21. a–d. Tumeurs de la gaine des nerfs périphériques : découvertes particulières aux États-Unis. Deux cas différents. un Schwannome du nerf médian au niveau du sillon bicipital. L'image échographique grand axe 12–5 MHz représente la tumeur (T) comme une masse hypoéchogène excentrique en continuité avec le nerf (têtes de flèches ouvertes). À ses extrémités proximale et distale, la tumeur est reliée à un faisceau gonflé (astérisques), tandis que les autres faisceaux (têtes de flèches blanches) restent intacts et déplacés à la périphérie de la masse. Une image en écran partagé a été utilisée, les deux écrans étant alignés pour un champ de vision étendu. b–d Neurofibrome. b Les images américaines grand axe et c petit axe 12–5 MHz d'un petit neurofibrome de la cuisse avec corrélation d'imagerie IRM pondérée en T2 avec suppression de la graisse révèlent une masse ovale bien délimitée (flèches) en continuité avec le nerf fémoro-cutané postérieur (pointes de flèches). La tumeur est caractérisée par des couches hypoéchogènes et hyperéchogènes concentriques (1, 2, 3) compatibles avec le signe cible échographique.
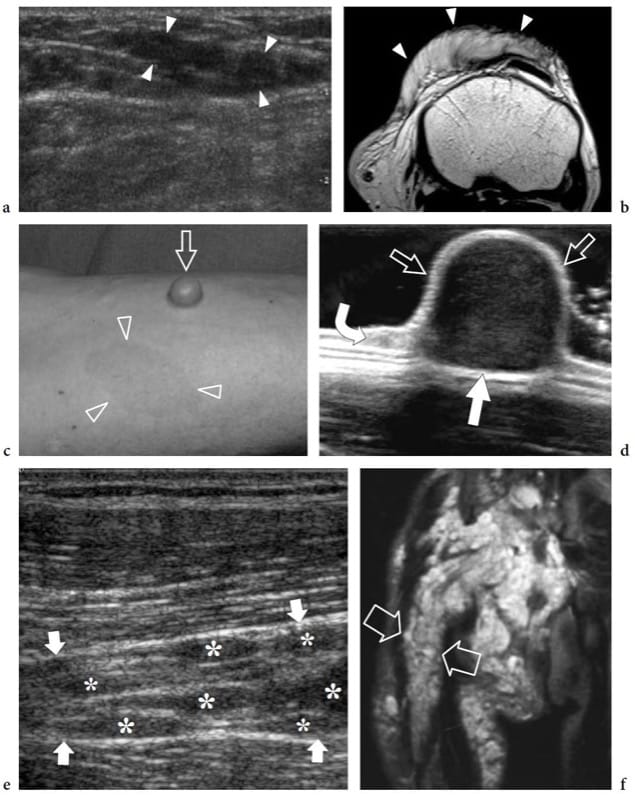
Figure 22. a–f. Neurofibrome : spectre des apparitions américaines. Trois cas différents. a, b Neurofibrome diffus. a Transverse 12–5 MHz US et b IRM pondérées en T1 de la région suprapatellaire chez un enfant de 10 ans sans neurofibromatose montrent une masse infiltrante mal définie (têtes de flèches) s'étendant le long du tissu sous-cutané de la partie antérieure du genou. c,d Neurofibrome sessile. c Photographie de l'avant-bras droit d'un homme de 43 ans atteint de neurofibromatose montrant un neurofibrome cutané sessile (flèche) associé à des taches café au lait (têtes de flèches). d L'image US 17–5 MHz montre le neurofibrome sessile comme une masse hypoéchogène solide superficielle (flèches droites) provenant du derme (flèche courbe). e–f Neurofibromes plexiformes. e L'image échographique 12–5 MHz à axe long sur le nerf sciatique chez un enfant de 8 ans atteint de neurofibromatose intra- et extra-abdominale montre plusieurs neurofibromes (astérisques) provenant de faisceaux individuels du nerf sciatique (flèches). f L'IRM coronale pondérée en T2 du bassin et de la partie proximale de la cuisse montre d'innombrables neurofibromes le long d'un nerf sciatique épaissi et hyperintense (flèches).
En ce qui concerne la tumeur maligne de la gaine nerveuse périphérique, les seules constatations qui peuvent faire suspecter à l'examinateur qu'une tumeur nerveuse est maligne sont une augmentation soudaine de la taille d'un nodule auparavant stable et la présence de marges et d'adhérences indistinctes de la masse avec les tissus environnants. Surtout chez les patients atteints de neurofibromatose de type 1, un nodule qui grossit rapidement indique la nécessité d'une biopsie immédiate.
Malgré ces différences, l'échographie ne peut pas faire la distinction entre le schwannome, le neurofibrome et la tumeur maligne de la gaine nerveuse périphérique (Lin et Martel 2001 ; Reynolds et al. 2004). L'échographie peut contribuer à l'évaluation préopératoire de l'étendue de la maladie, en définissant la relation de la tumeur avec les structures neurovasculaires adjacentes et les muscles environnants et également en facilitant la planification chirurgicale. Après évaluation par imagerie, une biopsie par aspiration à l'aiguille fine de la masse peut être réalisée en toute confiance sous la direction des États-Unis. Au cours de la biopsie, une douleur atroce est fréquemment déclenchée par l'insertion de l'aiguille. Du point de vue chirurgical, les schwannomes peuvent être décortiqués en préservant la continuité et la fonction nerveuse (Murphey et al. 1999). Dans le cadre postopératoire, un épaississement hypoéchogène résiduel du nerf au site de résection de la tumeur est presque invariablement observé avec l'échographie : cela doit être considéré comme une constatation normale (Fig. 23). La récidive est inhabituelle. En revanche, la résection chirurgicale des neurofibromes nécessite de sacrifier le nerf parent car la masse ne peut pas être séparée des fascicules nerveux, et une greffe nerveuse ultérieure est nécessaire pour préserver et restaurer la fonction. Bien que la prise en charge chirurgicale puisse être acceptable dans les neurofibromes cutanés, les lésions profondes sont généralement prises en charge de manière conservatrice pour éviter un déficit fonctionnel.
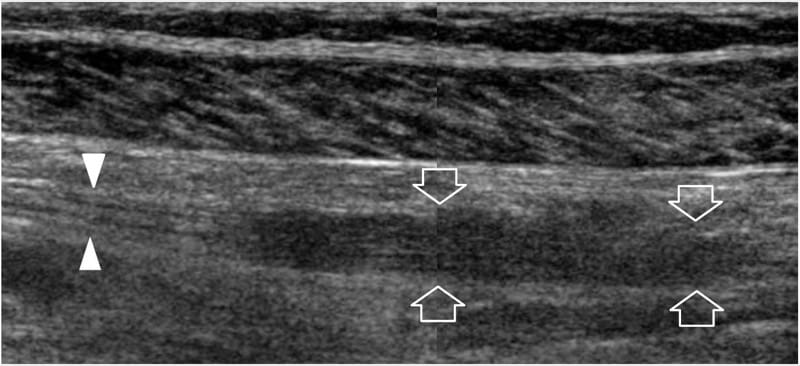
Figure 23. Tumeurs des gaines nerveuses périphériques : découvertes postopératoires. Image échographique grand axe 12–5 MHz sur le nerf tibial (têtes de flèches) au niveau de la partie postérieure médiane de la jambe chez une femme de 48 ans qui a déjà été opérée d'un schwannome montre un épaississement hypoéchogène résiduel (flèches) du nerf au site de résection tumorale avec perte de l'échotexture fasciculaire. Ce résultat était stable à 3 ans de suivi. Une image en écran partagé a été utilisée, les deux écrans étant alignés pour un champ de vision étendu.
La neurofibromatose de type 1 (maladie de von Recklinghausen), une maladie héréditaire autosomique dominante relativement fréquente (1:2500-3000 naissances) liée à une altération d'un gène sur le chromosome 17, se présente avec la triade clinique typique de lésions cutanées (café-au- taches de lait), malformations squelettiques (scoliose) et déficience mentale. Une atteinte généralisée par les neurofibromes de variété localisée, diffuse et plexiforme se produit avec des tumeurs provenant de petits nerfs dermiques et de gros nerfs profonds. Dans la neurofibromatose, les neurofibromes localisés intéressent souvent le derme et le tissu sous-cutané : lorsqu'ils sont pédiculés, on parle de « fibrome molluscum » (Fig. 22c, d) (Murphey et al. 1999). Dans la neurofibromatose plexiforme (multinodulaire) - la forme pathognomonique de la maladie - d'innombrables neurofibromes sont générés à partir des fascicules d'un grand tronc nerveux, qui est généralement impliqué sur un long segment avec ses branches, conduisant à ce que l'on appelle le "sac de -apparition de vers" du nerf affecté lors d'une inspection macroscopique et d'une imagerie par échographie résultant de l'épaississement diffus et tortueux du nerf (Figues. 22e, f, 24) (Murphey et al. 1999). Un élargissement géant défigurant des extrémités peut être associé, ce qu'on appelle l'éléphantiasis neuromatosa (Murphey et al. 1999). Les neurofibromes plexiformes sont indiscernables des schwannomes plexiformes plus rares qui surviennent sporadiquement chez les enfants et les jeunes adultes : ces derniers ne sont pas associés à la neurofibromatose de type 1 et ne subissent pas de transformation maligne (Fig. 25) (Ikushima et al. 1999 ; Katsumi et al. 2003).
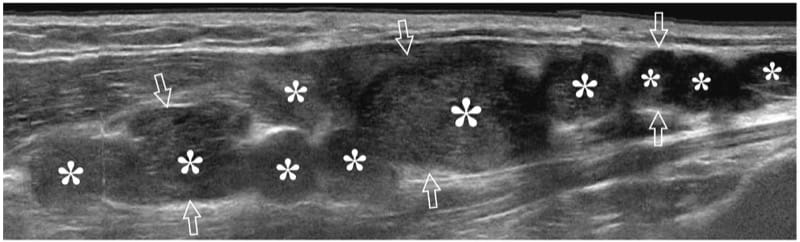
Figure 24. Neurofibromatose plexiforme. L'image US à champ de vision étendu de 17 à 5 MHz sur le nerf médian (flèches) au niveau de l'avant-bras chez un patient atteint de neurofibromatose montre plusieurs neurofibromes plexiformes (astérisques), dont certains ont une zone hyperéchogène centrale représentant la cible pancarte. Le nerf médian est nettement élargi et présente un aspect multinodulaire contourné.
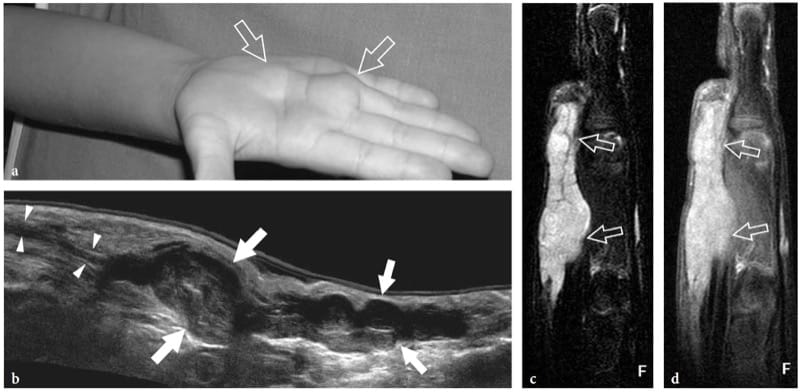
Illustration 25. a–d. Schwannome plexiforme. a Photographie de la main droite d'un enfant de 4 ans avec une masse palpable allongée (flèches) sur la paume, poussant entre les troisième et quatrième métacarpiens. b Image échographique à champ de vision étendu de 17 à 5 MHz orientée le long de l'axe longitudinal de la masse avec suppression de la graisse c La corrélation d'imagerie IRM pondérée en T2 et d post-contraste GRE pondérée en T1 démontre une masse hypoéchogène multinodulaire (flèches) composée de fascicules contournés gonflés provenant du nerf médian (têtes de flèches) et se ramifiant distalement. La tumeur apparaît hyperintense en T2 et après administration de gadolinium.
18. HÉMANGIOME ET LYMPHOME NON HODGKINIEN
Les hémangiomes nerveux sont des tumeurs extrêmement rares provenant de la muqueuse endothéliale de l'endonèvre à partir de laquelle de nouveaux vaisseaux apparaissent ou se replient dans les nerfs du tissu périneural. La plupart sont reconnus chez les enfants et les jeunes patients; il n'y a pas de prévalence de genre. Les tumeurs ont tendance à s'agrandir avec l'âge ou à cause de facteurs stimulants tels qu'un traumatisme (Bilge et al. 1989). Les hémangiomes nerveux ont une prédilection pour le nerf médian ; une artère médiane persistante a été préconisée pour expliquer cette prévalence (Prosser et Burke 1987). Les signes cliniques comprennent un gonflement nerveux palpable au niveau de l'avant-bras distal avec ou sans symptômes de syndrome du canal carpien. L'échographie révèle un nerf médian nettement enflé contenant de grands espaces remplis de liquide intraneural séparant les fascicules (Fig. 26). Typiquement, ces espaces anéchoïques sont orientés selon le grand axe du nerf et compressibles avec le transducteur. L'imagerie Doppler couleur et puissance montre un flux sanguin lent en leur sein (Fig. 26c). Les formes d'onde veineuses sont prédominantes lors de l'analyse Doppler spectrale. La neurolyse chirurgicale des hémangiomes nerveux n'est pas recommandée car les vaisseaux intraneuraux font partie du système « vasa nervorum » et en raison de la répartition entremêlée des vaisseaux avec les fascicules. Chez les patients symptomatiques, une libération du canal carpien peut être effectuée pour améliorer les symptômes cliniques.
Les lymphomes non hodgkiniens primitifs affectant les nerfs périphériques sont très rares. La plupart impliquent le nerf sciatique et sont le résultat d'une propagation directe à partir de tumeurs adjacentes (Roncaroli et al. 1997). La neuropathie périphérique peut également être appréciée en l'absence d'atteinte directe du nerf en tant que manifestation paranéoplasique des troubles lymphoprolifératifs. Du point de vue histopathologique, les nerfs atteints présentent une infiltration néoplasique étendue de l'endonèvre et du périnèvre. Les faisceaux nerveux sont séparés par des infiltrats diffus de cellules lymphoïdes néoplasiques contenues dans un épinèvre épaissi (Eusebi et al. 1990). L'échographie révèle une masse nerveuse hétérogène avec distorsion et gonflement des faisceaux individuels (Fig. 27). Le traitement consiste généralement en une chimiothérapie et une radiothérapie (Pillay et al. 1988).
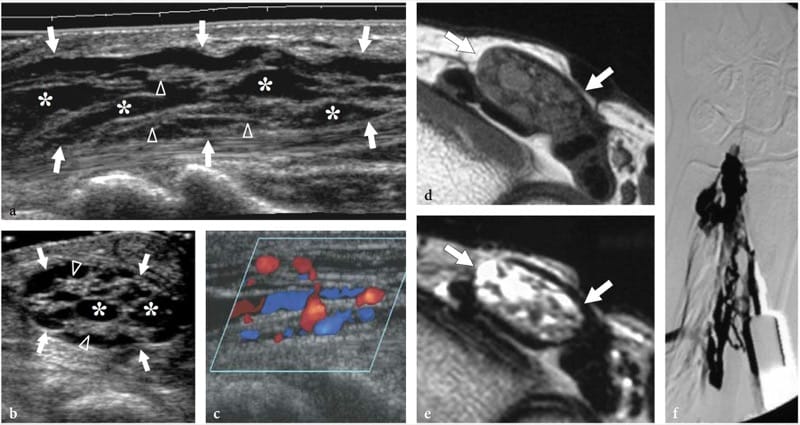
Figure 26. a–f. Hémangiome du nerf médian chez une femme de 40 ans atteinte du syndrome du canal carpien et d'un volumineux hémangiome intramusculaire s'étendant des muscles fléchisseurs de l'avant-bras jusqu'au canal carpien. Le patient a subi une libération du rétinaculum et une résection partielle de la masse avec ablation du muscle fléchisseur superficiel des doigts. a Les images américaines à axe long et b à axe court de 17 à 5 MHz obtenues au niveau du radius distal montrent un nerf médian élargi (flèches) avec des espaces remplis de liquide anormal intra-nerveux (astérisques) longeant les fascicules (têtes de flèches). c L'image longitudinale Doppler couleur 12–5 MHz US révèle un flux sanguin lent dans les espaces intraneuraux indiquant un hémangiome. Les vaisseaux sont compressibles et présentent des formes d'onde veineuses. d,e Les images IRM transversales d pondérées en T1 et pondérées en T2 montrent une augmentation de l'intensité du signal T2 dans l'épinèvre entourant les faisceaux du nerf médian (flèches), en raison de la présence de vaisseaux anormaux dans la substance nerveuse. f L'angiographie numérique en soustraction confirme la présence d'un réseau veineux dans le nerf médian.
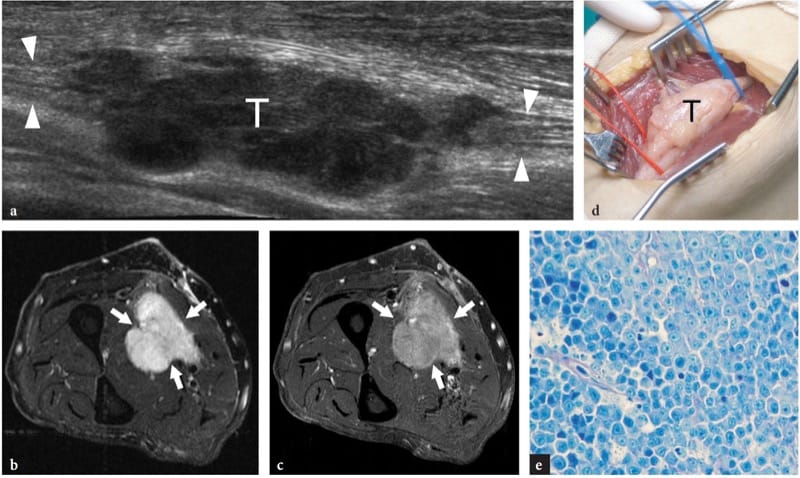
Figure 27. a–e. Lymphome non hodgkinien primitif du nerf médian chez un homme de 62 ans présentant une masse des tissus mous indolore à croissance lente au milieu de l'avant-bras. a Image échographique à champ de vision étendu de 17 à 5 MHz avec suppression transversale de la graisse b pondérée en T2 et c pondérée en T1 avec injection de gadolinium La corrélation d'imagerie IRM montre une masse hypoéchogène multinodulaire lobulée (T) en continuité avec les nerf médian (têtes de flèches), aspect bien différent de celui des tumeurs des gaines nerveuses périphériques. La tumeur (flèches) apparaît en hypersignal diffus en T2 et après administration de gadolinium. d L'aspect chirurgical macroscopique confirme le caractère neurogène de la masse (T). L'échantillon histologique montre une atteinte diffuse du tissu nerveux par des éléments lymphoïdes. Grossissement d'origine ×800.
19. GANGLIONS INTRANEURAUX
L'incidence des ganglions intraneuraux est relativement faible, affectant le plus souvent le nerf péronier commun (Yamazaki et al. 1999). Ce nerf prend naissance au sommet de la fosse poplitée à partir du nerf sciatique et descend jusqu'à la tête fibulaire, où il se divise en ses deux branches terminales : le nerf péronier profond et le nerf péronier superficiel. Autour du col fibulaire, le nerf péronier profond dégage une petite branche articulaire récurrente pour alimenter la capsule de l'articulation tibiofibulaire supérieure. La terminaison capsulaire de cette petite branche peut conduire au développement de ganglions intraneuraux (Spinner et al. 2003, 2005). En fait, cette branche sert de conduit pour que le liquide du kyste passe de l'espace articulaire au nerf (Spinner et al. 2003). Le liquide articulaire dissèque l'épinèvre entre les fascicules et se déplace vers le nerf péronier profond, le nerf péronier commun et même le nerf sciatique, formant un kyste intraneural allongé. Les ganglions intraneuraux n'ont pas de capsule fibreuse ni de revêtement synovial et doivent être différenciés des ganglions extraneuraux plus courants. En tant que prolongement de l'articulation tibiofibulaire supérieure, ils apparaissent comme des masses kystiques fusiformes contenues dans la gaine nerveuse qui se développent dans l'espace entre l'épinèvre et les faisceaux nerveux (Martinoli et al. 2000b).
20. ENCASTREMENT NERFEUX PAR LES TUMEURS EXTRINSEQUES
Les tumeurs extrinsèques des tissus mous peuvent impliquer des nerfs normaux par contiguïté. Ils peuvent soit déplacer et comprimer le nerf à la périphérie de la masse sans signes infiltrants, soit incorporer le nerf. Dans un premier temps, l'intégrité du nerf peut être préservée lors de la chirurgie après ablation ou dégonflement de la masse. Dans ce dernier cas, l'intervention chirurgicale est obligée de sacrifier le nerf encaissé avec la tumeur (Fig. 28). L'échographie peut aider à évaluer l'étendue de la tumeur avant l'opération et à définir la relation exacte de la masse avec le nerf et ses branches divisionnaires (Fig. 29).
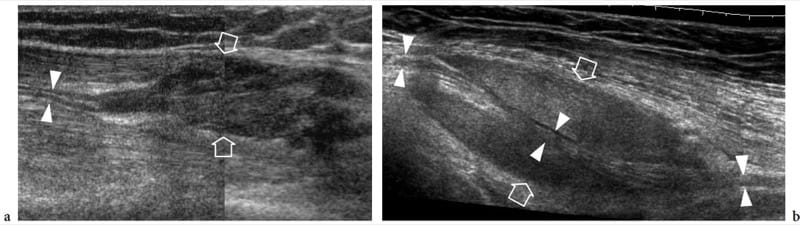
Illustration 28. a, b. Atteinte nerveuse par les tumeurs extrinsèques. Deux cas différents. une image échographique longitudinale 12–5 MHz sur le genou latéral chez un patient de 25 ans atteint d'une tumeur desmoïde récidivante après chirurgie montre le nerf péronier (têtes de flèches) incorporé par la masse (flèches). b Image longitudinale oblique 12-5 MHz US sur le tiers médio-distal du bras chez une femme de 67 ans atteinte de liposarcome montrant un long segment du nerf radial (têtes de flèches) enveloppé par le néoplasme (flèches). Dans les deux cas, la chirurgie a été obligée de sacrifier le nerf impliqué.
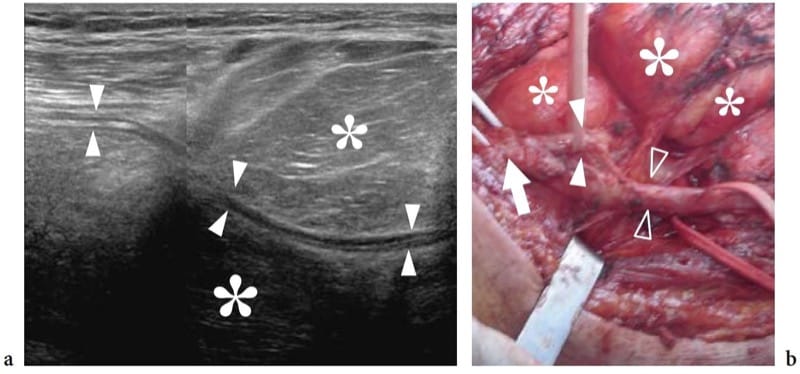
Illustration 29. a, b. Atteinte nerveuse par les tumeurs extrinsèques. une image longitudinale oblique 12-5 MHz US sur la fosse poplitée montre une grande masse lipomateuse (astérisques) enveloppant le nerf péronier (têtes de flèches). Une image en écran partagé a été utilisée, les deux écrans étant alignés pour un champ de vision étendu. b La vue chirurgicale macroscopique montre la bifurcation du nerf sciatique (flèche) dans les nerfs tibial (pointes de flèche ouvertes) et péronier (pointes de flèche blanches). Ce dernier nerf peut être vu replié dans la masse (astérisques). L'examen anatomopathologique a révélé un liposarcome.
21. VAISSEAUX SANGUINS
Un traité complet et approfondi sur les artères et les veines circulant dans les membres et les extrémités et la pathologie associée dépasse la portée d'un livre sur le système musculo-squelettique. Ici, nous nous concentrerons sur les aspects généraux de la pathologie vasculaire liés aux maladies musculo-squelettiques. L'analyse de la pathologie vasculaire appropriée des artères et des veines des membres, telles que la maladie athéroscléreuse et l'insuffisance veineuse, est traitée de manière plus appropriée dans d'autres manuels et dans la littérature spécifique (Polak et al. 1989 ; Edwards et Zierler 1992 ; Foley et al. 1989 ; Fraser et Anderson 2004).
22. CONSIDÉRATIONS HISTOLOGIQUES
Sur la base de leur architecture histologique, les artères peuvent être divisées en quatre groupes différents : les artères élastiques, les artères musculaires de taille moyenne, les petites artères et les artérioles (c'est-à-dire que les artères radiales et ulnaires appartiennent au groupe musculaire de taille moyenne). Les artères élastiques sont les plus grosses du corps; ils se dilatent lorsque le cœur se contracte et reviennent à un calibre normal en diastole. Les artères musculaires sont des vaisseaux de taille petite et moyenne avec une lumière relativement étroite et des parois épaisses constituées de fibres musculaires lisses disposées circonférentiellement qui restreignent la lumière lorsqu'elles se contractent. Le tonus de la composante musculaire lisse dépend du système nerveux autonome et est responsable de la forme transversale ronde des artères, des niveaux de pression artérielle et des fonctions de régulation du flux sanguin (c'est-à-dire un volume de flux accru dans les muscles squelettiques pendant l'exercice ). La paroi artérielle est composée de trois couches concentriques : l'intima (tunique interne) contenant la muqueuse endothéliale ; la média (tunique intermédiaire) abritant le tissu musculaire lisse ; et l'adventice (tunique externe) caractérisée par un tissu fibreux fusionnant avec l'espace conjonctif lâche autour du vaisseau (Fig. 30a). Dans une artère musculaire, la lamina elastica interne se situe entre l'intima et la média, tandis que la lamina elastica externe sépare la média de l'adventice.
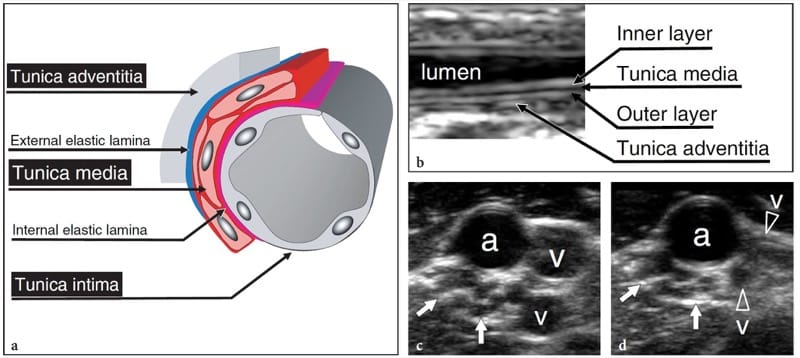
Figure 30. a–d. Anatomie des artères musculaires. un dessin schématique d'une vue en coupe transversale à travers une artère musculaire de petite à moyenne taille illustre l'organisation histologique de la paroi vasculaire composée de trois couches concentriques. De l'intérieur vers l'extérieur, ce sont : la tunique intima, composée d'endothélium ; la tunique médiane, caractérisée par des cellules musculaires lisses ; et la tunique adventice, composée de tissu conjonctif lâche en continuité avec les espaces périvasculaires. L'intima est séparée de la média par la lamina elastica interne ; et la média de l'adventice par la lamina elastica externe. b Image échographique long axe 17–5 MHz d'une petite artère montrant la structure ordonnée de la paroi artérielle composée d'une combinaison de couches hyper et hypoéchogènes. Ce sont : une couche échogène interne due à l'interface du sang avec l'intima et la lamina elastica interne ; une couche intermédiaire hypoéchogène due à la tunique médiane ; une couche échogène externe donnée par l'interface acoustique entre la lamina elastica externa et l'adventice. c,d Images échographiques 17–5 MHz à petit axe sur le faisceau neurovasculaire majeur du bras obtenues c sans et d avec compression de la sonde. Une gaine conjonctive hyperéchogène commune investit une artère (a), deux veines satellites (v) et un nerf (flèches). L'artère peut être distinguée des veines adjacentes sur la base de son profil en coupe transversale plus arrondi, de sa paroi multicouche, de sa pulsatilité (non illustrée) et du fait qu'elle ne s'effondre pas lors de l'application d'une pression de transducteur dessus.
Par rapport aux artères, les veines ont des parois plus minces et des lumières plus grandes. L'une de leurs principales fonctions est de stocker le sang et ils ont besoin de muscles pour repousser le sang vers le cœur. Étant donné que les parois veineuses peuvent s'effondrer, la forme du vaisseau varie en fonction des conditions des tissus environnants, y compris le positionnement et la gravité du sujet. Contrairement aux artères, la stratification de la paroi veineuse n'est pas si distincte : l'intima est très fine (seules les plus grosses veines contiennent une quantité discrète de tissu conjonctif sous-endothélial) ; la média est plus fine que l'adventice, et les deux couches se fondent l'une dans l'autre. Les veines périphériques peuvent être doubles ou multiples lorsqu'elles accompagnent une artère de taille moyenne et sont, en général, plus variables que les artères elles-mêmes, des anastomoses se produisant très souvent entre elles. De nombreuses veines petites à moyennes contiennent des valves (Fig. 31).
Ce sont des plis lâches en forme de poche de l'intima, qui s'étendent dans la lumière de la veine. L'ouverture des cuspides empêche le reflux de sang et favorise l'écoulement vers le cœur. Le sang qui coule vers le cœur passe par les poches (Fig. 31a, b); si le flux s'inverse, le sang remplit les poches obstruant ainsi la lumière de la veine et empêchant l'accumulation de sang (Fig. 31c, d). Lorsqu'un sujet est debout, le retour veineux des jambes dépend principalement de l'activité des muscles du mollet, ce qu'on appelle la pompe du mollet.
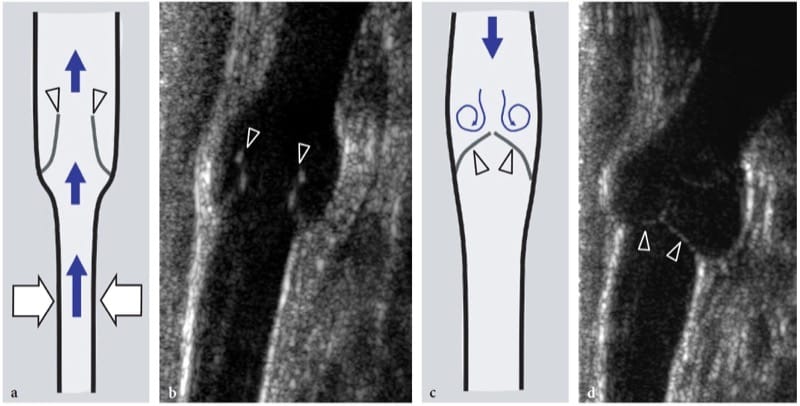
Figure 31. a–d. Valves veineuses. a,c Des dessins schématiques et des images échographiques corrélatives b,d grand axe 12–5 MHz sur une veine périphérique illustrent les effets hémodynamiques d'une valve sur le flux sanguin veineux. a,b Lors de la contraction des muscles du mollet (flèches blanches), les cuspides (têtes de flèches) de la valve s'ouvrent, permettant au sang (flèches bleues) de s'écouler vers le cœur. c,d Une fois que l'action musculaire a cessé, le flux tend à s'inverser, fermant les cuspides de la valve. La fermeture de la valve empêche le sang de le diriger vers l'arrière.
23. ANATOMIE AMÉRICAINE NORMALE ET TECHNIQUE DE NUMÉRISATION
Comme les artères des membres sont relativement superficielles, des images échographiques de très bonne qualité sont généralement obtenues avec les transducteurs utilisés pour les applications musculo-squelettiques. Semblable à d'autres applications, la sélection de la fréquence de transducteur appropriée dépend de la corpulence du patient et de la profondeur du vaisseau à examiner. Changer les réglages de la machine d'une application musculo-squelettique à un réglage spécifique vasculaire et réduire le gain peut aider à réduire les mouchetures artificielles dans la lumière du vaisseau qui peuvent générer une confusion avec le thrombus. Dans les états normaux, les artères des membres apparaissent comme des structures pulsatiles : la pulsatilité est mieux appréciée sur les plans de petit axe lors d'une observation prolongée. Ce signe est généralement suffisant pour évaluer les artères des membres lors d'une étude conventionnelle du système musculo-squelettique à des fins non liées.
Sur la base d'études de microdissection corrélatives et de l'utilisation de sondes intravasculaires à haute résolution, l'échographie démontre la paroi normale d'une artère musculaire de petite à moyenne taille sous la forme d'une structure à trois couches. Un écho linéaire acoustique brillant interne dérive de l'interface du sang avec l'intima et la lamina elastica interne, et une couche échogène externe est produite par réflexion à l'interface entre la lamina elastica externe et l'adventice (Chong et al. 1993 ; Siegel et al. 1993). Étant principalement composée de muscle lisse, la tunique médiane apparaît comme une bande mi-hypoéchogène intervenant entre les deux couches échogènes (Chong et al. 1993; Siegel et al. 1993). En revanche, la paroi des artères élastiques, dont la média est riche en élastine, apparaît uniformément échogène (Chong et al. 1993 ; Siegel et al. 1993 ; Martin et al. 1997).
Lorsqu'une maladie vasculaire est suspectée, l'imagerie Doppler couleur et l'analyse Doppler spectrale peuvent compléter les résultats en échelle de gris pour déterminer la perméabilité et le rétrécissement des vaisseaux. En règle générale, l'examen Doppler doit être effectué le long de l'axe longitudinal des vaisseaux avec un angle Doppler de 60° ou moins (32a). Étant donné que la plupart des vaisseaux des extrémités suivent une trajectoire parallèle à la peau, l'orientation du faisceau doit être utilisée comme paramètre par défaut pour obtenir des angles Doppler adéquats. Au repos, l'analyse Doppler spectrale des formes d'onde de flux et l'imagerie Doppler couleur des artères des membres supérieurs et inférieurs démontrent un schéma caractéristique de résistance distale élevée (Fig. 32b). En réponse à l'exercice et à l'activation musculaire, la vasodilatation produit généralement un flux direct plus élevé tout au long du cycle cardiaque, en particulier en diastole, reflétant une diminution des résistances (Fig. 32c).
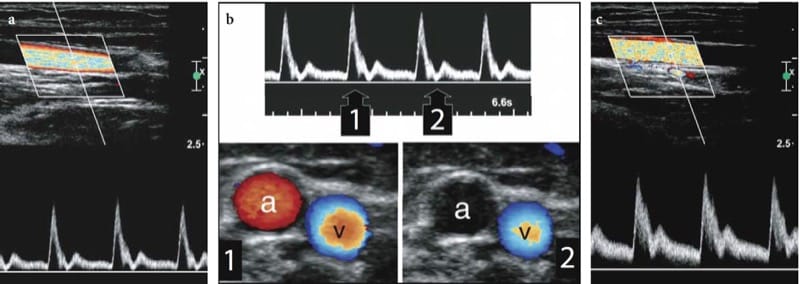
Illustration 32. a–c. Résultats d'imagerie Doppler normaux dans l'artère brachiale. une analyse Doppler pulsé montre un flux pulsatile normal à haute résistance avec des oscillations en diastole. Une boîte de couleur dirigée est utilisée pour obtenir un angle Doppler adéquat et des tracés Doppler nets. b Apparition en imagerie Doppler couleur d'un flux dans l'artère brachiale à haute résistance (a). Il existe des preuves de signal de flux de couleur dans la systole (1) mais pas dans la phase diastolique précoce (2). Un flux sanguin continu est détecté dans la veine brachiale adjacente (v) avec un remplissage complet de la lumière du vaisseau, indiquant la perméabilité. c Suite à des serrements répétés du poing, la vasodilatation qui en résulte produit un flux vers l'avant plus élevé tout au long du cycle cardiaque, en particulier en diastole.
Contrairement aux artères, les veines des membres ont des parois échogènes très fines qui sont souvent impossibles à distinguer des espaces échogènes environnants, en particulier lorsque le vaisseau est effondré. Le système veineux est examiné en plaçant la sonde perpendiculairement à la direction du flux vasculaire en utilisant la technique dite de compression (sonographie de compression), car la non compressibilité est le signe le plus sensible et spécifique de la thrombose veineuse (Cronan et al. 1987 ; Fraser et Anderson 2004). La raison pour laquelle la compression est appliquée dans le plan transversal est liée au fait que la sonde peut glisser hors du vaisseau dans l'axe longitudinal, ce qui peut entraîner un résultat faussement négatif (Chin et al. 2005).
Dans un premier temps, une légère pression est utilisée pour ne pas affaisser la veine (Fig. 33a). La sonde chevauchant à la fois l'artère et la veine, une pression supplémentaire est ensuite appliquée. Si la veine est perméable, les parois s'effondrent et se superposent complètement (Fig. 33b). Lorsque la pression est relâchée, la lumière de la veine revient à la normale. Si la veine contient des caillots, elle ne s'effondrera pas mais restera distendue lors de l'application de la pression de la sonde (Fig. 33a, b). Dans les veines des membres inférieurs, l'imagerie Doppler et l'analyse spectrale révèlent un flux veineux monophasique plutôt que des formes d'onde triphasiques. En revanche, les veines des membres supérieurs présentent un flux plus pulsatile en raison de leur plus grande proximité avec le cœur (Chin et al. 2005). L'utilisation d'une vitesse faible (3–6 cm/s) et de réglages de filtre bas est obligatoire pour éviter une occlusion veineuse artificielle. Dans des conditions normales, le débit veineux doit être augmenté à l'inspiration et réduit à l'expiration. L'absence de variation peut indiquer une lésion obstructive ou compressive plus proximale, et une évaluation plus approfondie est nécessaire. La manœuvre de Valsalva peut également être utilisée comme moyen d'évaluer le système veineux le plus proximal. L'application d'une augmentation distale (par exemple, serrer le mollet pour évaluer la veine poplitée, serrer le pied pour évaluer les veines tibiales) entraîne une augmentation du signal Doppler couleur et spectral (Fig. 33c, d). Ce phénomène indique que les segments veineux entre le point de compression et la position de la sonde sont perméables. Une dilatation veineuse peut survenir en présence d'une thrombose veineuse aiguë.
Parmi les variantes anatomiques, la duplication des veines, notamment au niveau fémoral (20 %) et poplité (35 %), est fréquente. Dans ce cas, les veines sont généralement plus petites que dans un seul système et peuvent être une source potentielle d'erreur lors de l'analyse Doppler en onde continue.
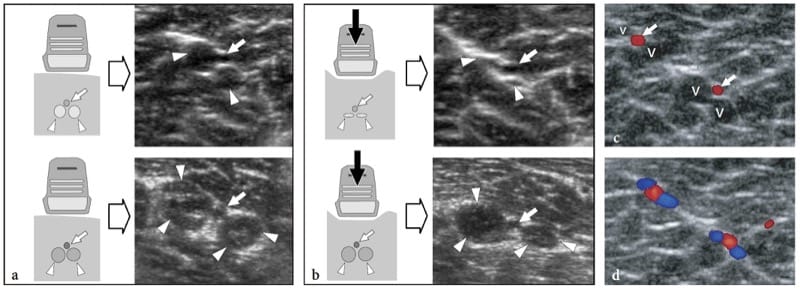
Figure 33. annonce. Technique de compression dynamique pour évaluer la perméabilité veineuse. a,b Dessins schématiques et images échographiques 17–5 MHz à petit axe correspondantes obtenues chez deux patients différents sur des veines gémellaires perméables (images supérieures) et thrombosées (images inférieures) (têtes de flèches). La flèche indique l'artère gémellaire. a La sonde est d'abord maintenue transversalement aux vaisseaux sans appliquer de pression dessus. Les veines perméables et thrombosées présentent un profil arrondi. Quelques échos internes reflétant des caillots sanguins sont observés dans l'image inférieure. b L'application d'une pression avec la sonde sur les veines provoque un affaissement des parois antérieure et postérieure lorsqu'elles sont perméables (image du haut). Au contraire, les veines remplies de thrombus restent distendues. c,d Manœuvre d'augmentation distale. c L'image US Doppler couleur obtenue au repos sur des veines gémellaires normales ne révèle pas de flux sanguin spontané dans ces veines (v). Observez le flux de couleur spontané dans les artères gémellaires (flèches). d Suite à une compression manuelle distale du mollet, le flux sanguin devient apparent dans les veines gémellaires. Cette manœuvre d'augmentation suggère la perméabilité des veines du mollet.
24. TROUBLES VASCULAIRES MUSCULO-SQUELETTIQUES
Comme déjà dit, nous nous intéresserons ici à une description succincte de la pathologie vasculaire liée à des lésions traumatiques ou à des maladies musculo-squelettiques spécifiques qui doivent être connues par l'échographiste lors de la réalisation d'une étude américaine du système musculo-squelettique. Les autres pathologies vasculaires, même si elles sont pertinentes, ont été omises car en dehors des objectifs de ce livre.
25. TROUBLES ARTÉRIELS
En raison de leur localisation superficielle et de leur apposition étroite aux os, les artères des membres et des extrémités sont particulièrement vulnérables aux lésions traumatiques. Sur la base de son pathomécanisme, le traumatisme artériel peut être subdivisé arbitrairement en trois types principaux : les lésions directes aiguës consécutives à une plaie pénétrante par un objet pointu ou des lacérations artérielles contondantes liées à un traumatisme majeur d'étirement ou de contusion (y compris les entorses de haut grade, les ecchymoses, les articulations disloquées et fractures-luxations à proximité des artères – telles que les fractures humérales supracondyliennes pour l'artère brachiale, les luxations glénohumérales pour l'artère axillaire, les fractures fémorales supracondyliennes pour l'artère poplitée et la luxation du genou pour l'artère tibiale postérieure) ; des microtraumatismes répétés chroniques causant des dommages progressifs à la paroi vasculaire pouvant entraîner des pseudo-anévrismes, des anévrismes et une occlusion vasculaire ; et des lésions iatrogènes entraînant soit une thrombose, soit une hémorragie locale. Lorsque les principaux troncs artériels des membres sont impliqués, les lésions traumatiques directes sont des urgences cliniques et, dans la plupart des cas, nécessitent une réparation chirurgicale immédiate pour éviter une ischémie aiguë des membres, un choc hypotenseur et la mort liée à la perte de sang (Davison et Polak 2004). L'échographie Doppler a été préconisée pour le diagnostic des traumatismes artériels aigus aux extrémités en situation d'urgence, mais sa sensibilité est inférieure à celle de l'angioscanner (Fry et al. 1993 ; Knudson et al. 1993 ; Miller-Thomas et al. 2005 ; Rieger et al. 2006). Semblable à l'IRM, l'échographie Doppler couleur présente des limites importantes dans ce domaine, liées au temps considérable nécessaire pour établir le diagnostic. De plus, l'imagerie Doppler couleur dépend de l'opérateur, peut être inadéquate dans l'évaluation du flux artériel en aval d'une lésion artérielle, est susceptible de confusion créée par les vaisseaux collatéraux et peut ne pas convenir aux patients présentant des plaies ouvertes (Rieger et al. 2006 ).
L'imagerie Doppler couleur semble plus utile pour identifier et surveiller les lésions artérielles mineures survenant lors d'un traumatisme qui ne nécessitent pas de prise en charge opératoire immédiate spécifique - telles que les lésions intimales, les faux anévrismes et les occlusions vasculaires mineures - afin d'évaluer si elles disparaissent ou progressent (Schwartz et al 1993). De même, les techniques d'échographie en niveaux de gris et d'imagerie Doppler semblent plus pertinentes pour identifier les lésions artérielles accidentelles secondaires aux microtraumatismes chroniques et aux syndromes de surmenage. Ces lésions surviennent généralement au niveau de la main, où les branches de l'artère ulnaire peuvent être pincées entre la peau et l'hammate sous-jacente à la suite de traumatismes externes répétés contre la paume (Fig. 34). Cette affection, communément appelée «syndrome du marteau hypothénarien», entraîne une lésion intimale, une thrombose ou un anévrisme suivi d'une ischémie digitale, d'une douleur ou d'une masse palpable dans la main (Okereke et al. 1999; Liskutin et al. 2000; Velling et al. 2001). Des anomalies vasculaires similaires peuvent survenir au niveau de l'artère pédieuse dorsale à la suite de traumatismes contondants répétés sur le dos de la cheville et du milieu du pied (Yamaguchi et al. 2002 ; Ozdemir et al. 2003). Dans ces cas, les techniques US et Doppler doivent être la modalité d'imagerie de première intention. L'angiographie par soustraction numérique ou l'angio-IRM avec contraste peut encore être requise par le chirurgien vasculaire pour une planification préopératoire précise. D'autres causes rares de lésions artérielles fermées associées à des anomalies du système musculo-squelettique sont liées à des variantes anatomiques, telles que : une lésion de l'artère poplitée due à des anomalies osseuses chez des patients présentant des exostoses multiples héréditaires (Chamlou et al. 2002) ; syndrome de piégeage de l'artère poplitée, produit par une insertion proximale anormale du chef médial du gastrocnémien (Fig. 35) (Wright et al. 2004); et le piégeage de l'artère brachiale dans le bras secondaire à la présence d'un processus supracondylien et du ligament de Struthers, appelé syndrome du processus supracondylien (Talha et al. 1987).
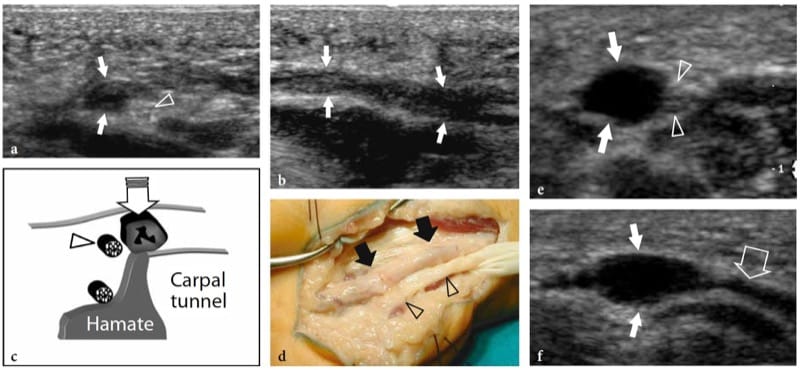
Figure 34. a–f. Syndrome du marteau hypothénarien. Deux cas différents de travailleurs manuels - l'un mécanicien automobile, l'autre haltérophile - qui avaient le marteau professionnel dans la main droite. a–d Occlusion de l'artère ulnaire. a Des images américaines transversales et b longitudinales à 15–7 MHz au-dessus de l'éminence hypothénar avec un dessin schématique c et une corrélation de vue chirurgicale brute d montrent une occlusion complète de l'artère ulnaire (flèches) au point où elle passe à côté du crochet de l'hamatum. Notez la branche sensorielle non blessée adjacente du nerf cubital (tête de flèche). La vue opératoire montre une artère pâle épaissie courant adjacente au nerf cubital. Le patient présentait des symptômes ischémiques aux quatrième et cinquième doigts. e,f Anévrisme de l'artère ulnaire. e Les images échographiques transversales et f longitudinales à 12–5 MHz sur l'éminence hypothénar montrent un anévrisme (flèches blanches) de l'artère ulnaire (grande flèche ouverte). Il n'y a pas d'échos évidents dans la lumière, indiquant l'absence de thrombus. Le patient ne se plaignait que d'une légère douleur au niveau de l'anévrisme. Pointes de flèches, branche sensorielle du nerf cubital.
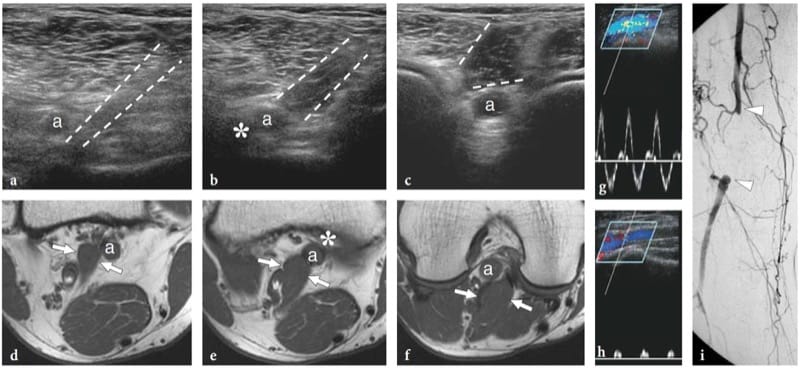
Figure 35. a–i. Syndrome de compression de l'artère poplitée. a–c Une série d'images échographiques transversales à 17–5 MHz de la fosse poplitée avec corrélation d'imagerie IRM d–f pondérée en T1 chez un homme de 45 ans présentant une claudication induite par l'exercice de son membre inférieur droit démontre une évolution médiale anormale de l'artère poplitée (a), qui passe de médial en latéral à travers une bande musculaire anormale (ligne pointillée en ac, flèches en df) située dans le creux poplité. À l'imagerie Doppler couleur (non illustrée), l'occlusion du vaisseau est initiée au point où l'artère est étroitement apposée au coin postéro-médial du condyle fémoral médial (astérisque) et est donc vulnérable à la compression par le muscle anormal. L'imagerie IRM a permis de classer cette anomalie musculaire en type 2. g, h L'analyse Doppler spectrale réalisée g au niveau de l'artère poplitée supérieure et h en aval dans l'artère tibiale au niveau de la jambe proximale révèle g flux pulsatile normal crânien à l'occlusion et h amortissement des formes d'onde d'écoulement distal. i L'angiographie en soustraction numérique antéropostérieure montre une occlusion segmentaire (têtes de flèches) de l'artère poplitée avec remplissage collatéral par les artères géniculées.
En ce qui concerne les lésions iatrogènes, les procédures de cathétérisme artériel peuvent être responsables de dissections vasculaires, d'hématomes des tissus mous, de pseudo-anévrismes et de formation de fistules artério-veineuses (Clevert et al. 2005 ; Schwartz et al. 1991). Ces lésions sont généralement situées au site de ponction, y compris l'aine pour l'artère fémorale et ses branches divisionnaires (Roubidoux et al. 1990 ; Helvie et al. 1988) et le bras médial pour l'artère brachiale (Chuang et al. 2002). La neuropathie fémorale et médiane basée sur la compression est une complication bien établie des hématomes et des pseudo-anévrismes après cathétérisme artériel (Jacobs et al. 1992 ; Chuang et al. 2002). L'imagerie Doppler couleur est utile pour différencier les complications du cathétérisme de l'artère fémorale, telles que l'hématome, le faux-anévrisme et la fistule artério-veineuse. Il met en évidence un faux-anévrisme artériel sous la forme d'un sac périvasculaire avec des parois échogènes épaissies (thrombus mural) contenant un flux tourbillonnant avec des couleurs rouges et bleues alternées (Fig. 36a – c). En général, le collet reliant l'artère au faux-anévrisme est mieux reconnu en imagerie Doppler couleur qu'en échographie en niveaux de gris (Schwartz et al. 1991). Lors de l'analyse spectrale Doppler, le flux sanguin dans le cou présente des vitesses élevées bidirectionnelles lorsque le sang pénètre dans la cavité de l'artère endommagée en systole (débit affiché au-dessus de la ligne de base) et sort en diastole (débit affiché en dessous de la ligne de base), le soi-disant "à signal de va-et-vient (Fig. 36d) (Sacks et al. 1989). D'autre part, les résultats caractéristiques des fistules artério-veineuses comprennent : une connexion visible entre l'artère et la veine, une masse mouchetée multicolore (motif en mosaïque) au site de la fistule, la propagation de pixels de couleur dans les tissus mous périvasculaires, un flux diastolique élevé dans la forme d'onde artérielle proximale à le site de la fistule, une diminution du débit dans l'artère caudale à la fistule et un flux turbulent à grande vitesse, parfois avec une composante pulsatile, dans la veine efférente (Helvie et Rubin 1989 ; Roubidoux et al. 1990). Les procédures guidées par échographie pour traiter les faux-anévrismes avec compression directe de la sonde et injection de thrombine sont décrites ailleurs. Dans le cadre postopératoire, les techniques d'échographie et de Doppler se sont avérées utiles pour évaluer les pontages afin de détecter l'apparition d'échecs précoces, notamment les sténoses, les thromboses et les collections infectieuses (Fig. 37).
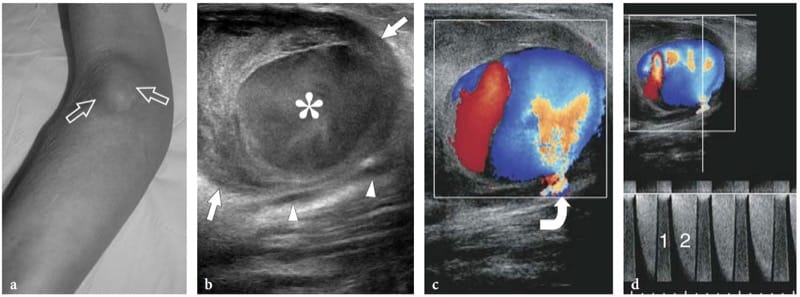
Figure 36. a–d. Pseudoanévrysme iatrogène de l'artère brachiale. a Photographie de la partie antérieure du coude droit d'une femme de 72 ans présentant une grosseur pulsatile des tissus mous en expansion (flèches) qui s'est développée après une procédure de canulation veineuse. Les images échographiques transversales b en niveaux de gris et c Doppler couleur 17–5 MHz sur la masse révèlent une grande masse complexe (flèches droites) avec des parois épaissies et une cavité centrale remplie d'un flux tourbillonnant (astérisque) compatible avec un pseudo-anévrisme de l'artère brachiale ( pointes de flèches). Le flux lent dans le faux-anévrisme rend le sang échogène à l'imagerie en niveaux de gris. L'imagerie Doppler couleur montre la continuité de la cavité du faux-anévrysme avec une artère brachiale déplacée au moyen d'un collet fin (flèche courbe). d L'analyse Doppler spectrale obtenue dans le tractus communicant affiche des vitesses bidirectionnelles lorsque le flux vers l'avant (1) en systole est éjecté (2) en diastole.
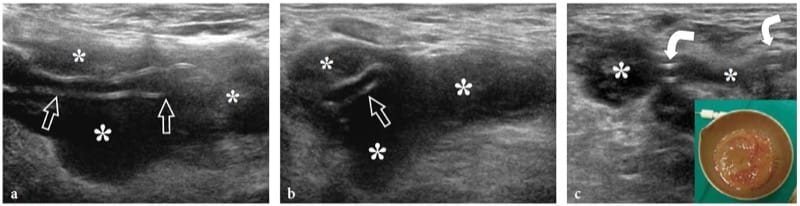
Illustration 37. a–c. Abcès autour d'un greffon de pontage. a Images échographiques grand axe et b petit axe 17–5 MHz sur un pontage aorto-fémoral occlus (flèches) chez un patient diabétique de 70 ans avec une jambe amputée et des signes cliniques de septicémie. Notez l'aspect rétréci du greffon entouré d'une collection liquidienne (astérisques). c Drainage percutané préopératoire de la collection. Le cathéter (flèches courbes) est visible à l'intérieur de l'abcès presque vide (astérisques). Comme le montre l'insert, l'aspiration a entraîné un matériau purulent.
26. TROUBLES VEINEUX
Un traumatisme direct du système veineux profond et superficiel ne produit qu'occasionnellement une lésion vasculaire, telle qu'un anévrisme ou une occlusion veineuse. Bien que rare, la possibilité d'un anévrisme veineux doit cependant être prise en compte afin de ne pas confondre un anévrisme avec un kyste ganglionnaire (lorsqu'il est perméable) ou une masse solide des tissus mous (lorsqu'il est thrombosé). La mise en évidence de la continuité du segment veineux dilaté avec une veine superficielle, même petite, et un flux sanguin détecté au sein de la masse peuvent aider au diagnostic (Fig. 38a – d). Lorsqu'ils sont thrombosés, les anévrismes veineux peuvent constituer un défi diagnostique car ils se présentent sous la forme de masses solides avasculaires non spécifiques (Fig. 38e). Des thromboses veineuses post-traumatiques peuvent parfois être rencontrées à la suite d'élongations musculaires dues à l'étirement des parois vasculaires. Ce type de traumatisme survient généralement dans les veines infrapoplitées (les veines gémellaires sont les plus fréquemment impliquées) des patients atteints de lésion de la jambe de tennis (Delgado et al. 2002). L'œdème musculaire post-traumatique et l'hématome peuvent également produire une compression puis une occlusion des veines intramusculaires à basse pression. De même, l'absence prolongée de contracture des muscles du mollet à la suite de douleurs locales et d'une immobilisation post-traumatique peut être impliquée comme cause possible de thrombose veineuse.
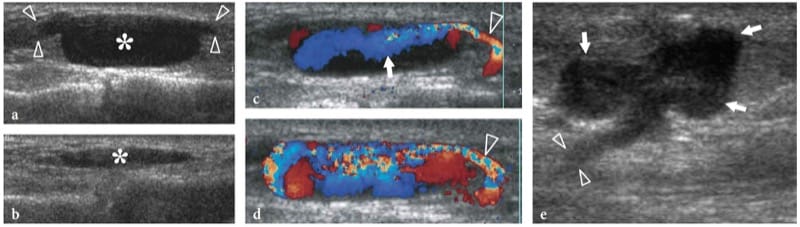
Figure 38. a–e. Anévrismes veineux. Deux cas différents. Images échographiques Doppler couleur 12–5 MHz à axe long a,b en échelle de gris et c,d obtenues a,c,d sans et b avec compression de la sonde sur une masse compressible de tissus mous du dos du milieu du pied dans un patient avec des fractures médio-tarsiennes cicatrisées révèlent une lésion ovale remplie de liquide (astérisques) reliée à ses extrémités opposées à une petite veine superficielle (têtes de flèches). Comme indiqué en b, la masse est entièrement compressible sans thrombus interne. Ce signe, associé à la mise en évidence des extrémités veineuses et du flux sanguin interne à l'imagerie Doppler couleur, peut éviter la confusion avec les kystes ganglionnaires. Tout en relâchant la compression de la sonde, on peut voir le flux sanguin (flèche) entrer dans l'anévrisme depuis la veine mère (tête de flèche) pour remplir complètement sa cavité. e Varices superficielles thrombosées. L'échographie sagittale 12–5 MHz sur la face postéro-médiale de la jambe montre une masse hypoéchogène polycyclique (flèches) en continuité avec un pédicule fin (têtes de flèches) dirigé vers la profondeur, aspect non spécifique à l'examen échographique. Après résection chirurgicale, cette masse s'est révélée être une varice thrombosée.
Au membre inférieur, l'échographie de compression et l'imagerie Doppler couleur permettent de diagnostiquer facilement une thrombose veineuse profonde et de distinguer un problème vasculaire d'autres affections musculo-squelettiques qui peuvent l'imiter, notamment un kyste de Baker rompu ou un hématome post-traumatique. La description classique de la thrombose veineuse est celle d'une veine élargie avec des parois épaissies contenant du matériel échogène avec de multiples vaisseaux collatéraux environnants (Murphy et Cronan 1990). Sur la base des résultats de l'imagerie, l'échographie peut distinguer une occlusion complète (Fig. 39a, b) d'une thrombose partielle non occlusive (Fig. 39c, d). Un thrombus non occlusif peut ne pas modifier le schéma de flux Doppler spectral. Dans certains cas, la tête du thrombus peut flotter librement dans la lumière du vaisseau (Fig. 4.39e,f). Ce résultat doit être indiqué dans le rapport car il se rapporte à un risque accru d'embolie. Bien que beaucoup aient essayé de dater le thrombus sur la base de sa réflectivité, de telles tentatives ont été inefficaces (Murphy et Cronan 1990). Dans la thrombose veineuse chronique, la recanalisation du thrombus peut se présenter sous la forme d'un réseau de minces canaux de flux hypoéchogènes dans le thrombus échogène, provoquant finalement une résorption évidente du caillot et la réouverture du vaisseau (Fig. 39g, h). La réduction du débit spontané et la compressibilité incomplète de la veine accompagnent ces stades dans le membre post-phlébitique. On voit souvent des vaisseaux collatéraux rétablir la perméabilité veineuse (Fig. 40a). Si la recanalisation ne se produit pas, les veines thrombosées chroniquement se caractérisent par une taille rétrécie, des parois épaissies et irrégulières et la formation de vaisseaux collatéraux (Fig. 39i, j). L'œdème des tissus mous ou des muscles peut être une découverte accessoire avec une thrombose veineuse résultant d'une stase veineuse (Fig. 40b). L'échographie peut facilement diagnostiquer une thrombophlébite, qui nécessite un traitement avec des anti-inflammatoires et non, du moins systématiquement, un traitement anticoagulant (Fig. 40c, d).
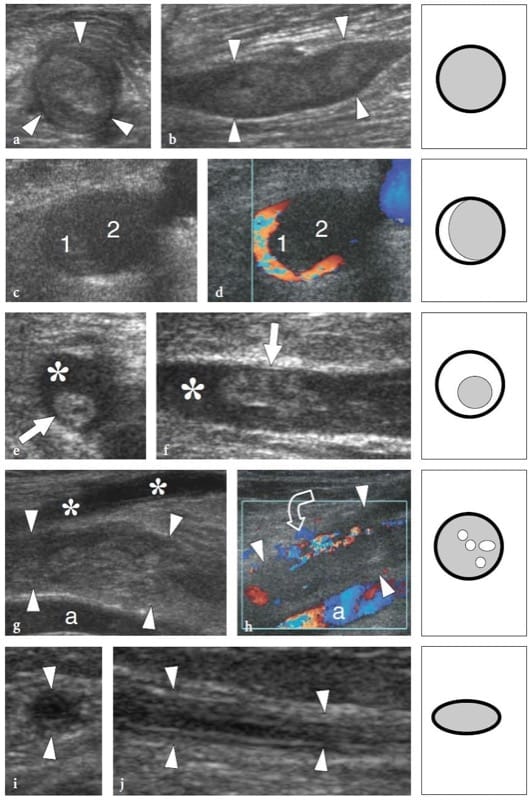
Figure 39. a–j. Thrombose veineuse : spectre des apparitions échographiques chez différents patients. a,b Thrombose veineuse complète. a Images américaines à petit axe et b grand axe 12–5 MHz d'une veine intramusculaire (têtes de flèche) du soléaire contenant du matériel hautement échogène compatible avec un thrombus chronique. Cette veine était incompressible aux États-Unis. c,d Thrombose veineuse partielle. c Image US en échelle de gris 12–5 MHz petit axe de la veine poplitée montrant une lumière distendue contenant un matériau réfléchissant (1) évocateur de thrombose. d L'image Doppler couleur transversale corrélative 12–5 MHz US confirme la présence d'une zone de thrombus non occlusif avec un flux sanguin entourant la périphérie du caillot avec un aspect en croissant. Notez qu'une partie de la lumière non échogène (2) était également thrombosée indiquant des phases successives d'apposition de thrombus avec le temps. e,f Thrombus flottant. e Les images US petit axe et f grand axe 12–5 MHz de la grande veine saphène montrent la tête proximale du thrombus (flèche) flottant librement dans la lumière du vaisseau perméable (astérisque). Pendant l'observation en temps réel, le thrombus pouvait être vu frapper contre la paroi du vaisseau. Ce type de thrombus est en corrélation avec le risque le plus élevé d'embolie. g,h Thrombus recanalisé. Les images échographiques grand axe g en niveaux de gris et h couleur Doppler 12–5 MHz sur la partie postérieure du genou montrent une veine poplitée élargie (têtes de flèches) contenant un thrombus hétérogène. De minuscules canaux hypoéchogènes longitudinaux avec écoulement (flèche courbe) sont visibles à l'intérieur du thrombus reflétant un processus de recanalisation partielle. Observer l'artère poplitée (a) et les collatérales veineuses superficielles (astérisques). i,j Occlusion veineuse chronique. i Les images US petit axe et j grand axe 12–5 MHz de la petite veine saphène montrent un vaisseau occlus (têtes de flèches) qui semble nettement rétréci. Les dessins schématiques sur le côté droit des images américaines rapportent le profil en coupe d'une veine avec disposition du thrombus (gris) et de la lumière perméable (blanc) en relation avec les différents types de thrombose veineuse décrits.
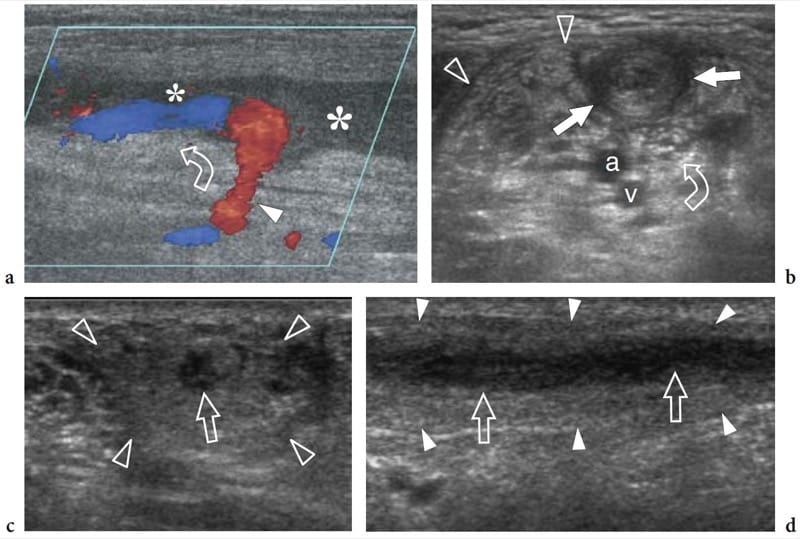
Figure 40. a–d. Anomalies vasculaires et des tissus mous courantes associées à une thrombose veineuse. Trois cas différents. a Ouverture des vaisseaux collatéraux. L'image Doppler couleur grand axe 12–5 MHz US sur une veine saphène supérieure thrombosée (astérisques) montre un processus de recanalisation partielle (flèche courbe) par un vaisseau collatéral (tête de flèche). b Œdème musculaire lié à une stase veineuse. L'image US à échelle de gris 12–5 MHz à axe court sur la fosse bicipitale montre une veine céphalique thrombosée (flèches) qui se trouve superficielle à l'artère brachiale (a), le nerf médian (flèche incurvée) et une veine brachiale perméable (v ). Notez l'œdème sous-fascial (têtes de flèches) impliquant le muscle biceps brachial à la suite d'une stase veineuse. c,d Thrombophlébite superficielle de la partie inférieure de la jambe. c Les images US petit axe et d grand axe 12–5 MHz sur une veine saphène inférieure thrombosée (flèches) montrent des parois vasculaires mal définies et un large halo hyperéchogène (têtes de flèches) entourant la veine thrombosée compatible avec la graisse sous-cutanée enflammée réactive.
27. TUMEURS VASCULAIRES
La tumeur vasculaire la plus fréquente, l'hémangiome des tissus mous, n'est pas traitée dans ce chapitre car elle a déjà été rapportée sous ses différentes formes : dans le cadre des masses cutanées et sous-cutanées, au chapitre 3 pour sa localisation intramusculaire, et au chapitre 5 en relation avec son type synovial. Une tumeur d'origine vasculaire qui a reçu une attention particulière dans la littérature américaine est l'angioléiomyome (léiomyome vasculaire), un histotype bénin rare provenant de la tunique médiane des veines, composé d'un conglomérat de vaisseaux à parois épaisses associés à des muscles lisses (Sardanelli et al. 1996 ; Hwang et al. 1998). Elle est le plus souvent localisée à un membre, notamment le bas de la jambe et le pied (50 à 70 % des cas) (Hwang et al. 1998). L'angioléiomyome provoque des douleurs qui sont souvent liées à des problèmes de chaussures et peuvent être déclenchées par un traumatisme même léger. L'échographie montre un nodule arrondi hypoéchogène solide bien délimité, généralement de moins de 2 cm de diamètre, avec un ou plusieurs pédicules artériels se ramifiant à l'intérieur (Fig. 41). L'analyse Doppler spectrale montre un schéma d'écoulement à haute résistance (Sardanelli et al. 1996). En pratique clinique, l'angioléiomyome doit être considéré dans le diagnostic différentiel des lésions nodulaires douloureuses des extrémités. D'autres tumeurs vasculaires comprennent des histotypes agressifs rares, tels que l'hémangioendothéliome, l'hémangiopéricytome et l'angiosarcome, qui sont tous caractérisés par une apparence US non spécifique.
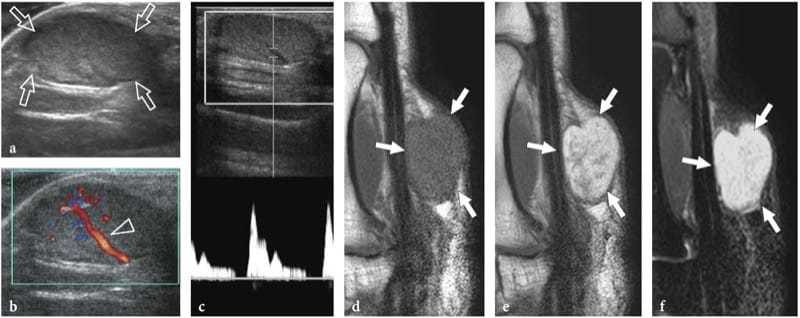
Figure 41. a–f. Angioléiomyome. a,b Les images échographiques sagittales a en niveaux de gris et b en Doppler couleur de la paume montrent une masse hypoéchogène solide sous-cutanée nettement délimitée (flèches) avec un grand pédicule artériel se ramifiant à l'intérieur (tête de flèche). c L'analyse Doppler spectrale des vaisseaux intratumoraux montre des formes d'ondes artérielles à haute résistance. d–f Sagittale d pondérée en T1, e post-contraste pondérée en T1 et f pondérée en T2 avec suppression de la graisse La corrélation d'imagerie IRM révèle une masse principalement hyperintense (flèches) en intensité du signal T2 et après l'administration de gadolinium. Dans l'image post-contraste, de petits foyers hypointenses sont visibles dans la tumeur.