La stimulation nerveuse périphérique (SNP) est actuellement un sujet d'intérêt accru après des décennies de déclin apparent. Une partie de cette popularité accrue peut être attribuée à l'avènement de nouvelles techniques d'imagerie, y compris l'échographie. Deux études de faisabilité récentes sur des cadavres frais ont suggéré que l'échographie (US) pourrait être utilisée pour placer des électrodes sans lésion nerveuse apparente à côté des nerfs périphériques, comme pour le placement d'un cathéter nerveux [1, 2]. Ces rapports ont été suivis d'une petite série de cas de patients recevant des implants permanents, avec généralement de bons résultats. Le placement sous échographie a permis un essai percutané, empêchant l'incision chez les non-répondeurs et, dans de nombreux cas, produit une analgésie durable au-delà d'un an. Les sondes percutanées conçues pour la stimulation de la moelle épinière placées par échographie ont permis le test peropératoire de plusieurs paramètres de stimulation différents. La visualisation échographique permettait également de placer des électrodes au-dessus ou au-dessous du nerf ou même deux dérivations parallèles placées au niveau du nerf [1]. Les utilisations historiques du PNS sont apparues après la publication de la théorie du contrôle de porte [3]. Les premières expériences de Wall et Sweet avec le SNP cherchaient essentiellement à mettre à l'épreuve le « contrôle de porte » [4]. Les premières études menées par plusieurs auteurs étaient prometteuses, mais les difficultés techniques et les problèmes de sélection des patients étaient courants [5–6]. En raison du déclin de l'intérêt, la conception et l'amélioration technique des dérivations pour les nerfs périphériques ont pris du retard par rapport aux progrès techniques comparatifs des dérivations de stimulation de la moelle épinière au cours des deux dernières décennies. Les premières versions des électrodes à manchette et des électrodes bouton ont été largement remplacées par les cordons commerciaux actuels (fil plat à quatre contacts circulaires). Les procédures ouvertes neurochirurgicales continueront probablement d'être la méthode prédominante de placement de ces dispositifs. Reste à savoir si la technique guidée par échographie servira uniquement de méthode d'essai, permettra un placement permanent dans certaines zones anatomiques ou aidera à développer la base de preuves pour le SNP.
1. PREUVES ACTUELLES
Il n'y a pas d'études prospectives majeures à ce jour, ce qui a été relaté récemment par Bittar et Teddy [10]. Davis a déploré ce manque de preuves dans un éditorial au sujet de la neuromodulation périphérique [11]. Les questions concernant le rôle de la neurolyse sur l'analgésie observée après le SNP, les effets placebo, les effets de la kinésithérapie, les changements d'analgésiques ou simplement une attention accrue aux besoins des patients ont toutes été soulevées comme facteurs de confusion possibles. Les plus grandes séries cliniques imprimées sont celles d'Eisenberg et al. [12] et la Cleveland Clinic [9]. Dans la série d'Eisenberg, 46 patients atteints de neuropathies douloureuses isolées ont reçu le SNP. Ils ont rapporté de bons résultats chez 78% des patients et mauvais chez 22%. Les scores visuels analogiques de douleur sont passés de 69 ± 12 avant la chirurgie à 24 ± 28 en postopératoire [12]. Quatre étiologies majeures ont été identifiées : lésions nerveuses après opération autour de la hanche ou du genou, neuropathie par compression, douleur après greffe nerveuse ou neuropathie douloureuse après injection nerveuse traumatique [12]. Dans la série Cleveland Clinic, le résultat le plus notable était le besoin élevé de reprise chirurgicale, une moyenne de 1.6 interventions par patient [9]. Dans certains cas, un névrome peut être à l'origine de la douleur neuropathique (Fig. 1).
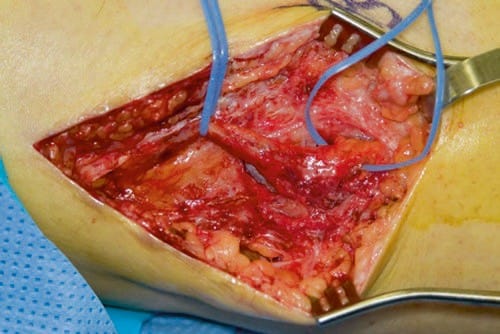
Fig.1 Un nerf péronier est représenté avec un gros névrome. (Photo gracieuseté de Spinner, Robert J., MD Mayo Clinic)
2. SÉLECTION DES PATIENTS ET RÔLE DE LA NEUROLYSE
La sélection des patients pour les interventions sur les nerfs périphériques est d'une importance primordiale. Il est important de diagnostiquer correctement la maladie, car de nombreux troubles sont classés dans la catégorie des douleurs régionales complexes ou des «douleurs neuropathiques» en raison d'une terminologie imprécise. Les syndromes maintenus par le système sympathique peuvent bien répondre aux implants du SNP, en particulier si la douleur est prédominante dans une distribution nerveuse [8, 9]. Des douleurs résistantes à une intervention chirurgicale antérieure telles qu'une transposition du nerf et un névrome en continuité avec une bonne conservation fonctionnelle sont d'autres candidats possibles. Les douleurs qui persistent malgré une neurolyse externe ou interne antérieure peuvent également être de bons candidats. Les patients doivent avoir précédemment échoué à un bon traitement pharmacologique avec des médicaments neuromodulateurs standard. La neurolyse externe fait référence à l'élimination du tissu cicatriciel autour du nerf de manière circonférentielle. Si le piégeage du nerf est vu, il est mobilisé et libéré. La neurolyse externe présente peu de risque de lésion fasciculaire. Les potentiels d'action nerveux peuvent être utilisés pour mieux évaluer la fonction nerveuse que les études cliniques ou standard EMG/conduction nerveuse. La neurolyse interne peut être utilisée pour les syndromes douloureux, en particulier en cas de perte incomplète de la fonction nerveuse distale. Le risque de lésion ou de rupture fasciculaire est plus élevé avec la neurolyse interne [13].
3. CONSIDÉRATIONS ANATOMIQUES
Un problème qui complique tout placement d'électrodes nerveuses périphériques dans les quatre extrémités est que les nerfs doivent glisser librement dans les plans fasciaux/musculaires avec leur alimentation vasculaire lorsque l'extrémité se déplace. Les nerfs peuvent être piégés par du tissu cicatriciel et les bords rugueux d'une électrode externe peuvent, avec le temps, provoquer une constriction et des cicatrices. Les nerfs périphériques mixtes sont également caractérisés par un arrangement fasciculaire interne complexe. En bref, les troncs nerveux peuvent avoir des axones sensoriels, moteurs et mixtes à divers endroits du nerf périphérique. Cette configuration anatomique transversale complexe signifie qu'une stimulation optimale du faisceau sensoriel souhaité pourrait, par exemple, se situer au niveau de la face médiale du nerf cubital dans un placement supracondylien, mais changer d'emplacement en quelques millimètres vers un emplacement postérieur. Si l'amplitude de la stimulation est trop élevée au-dessus du seuil sensoriel, les faisceaux moteurs plus profonds dans le tronc peuvent facilement être activés, provoquant des crampes musculaires et/ou des douleurs. Une étude récente a examiné ces problèmes de plus près, en particulier les effets de l'épaisseur, du diamètre et de la position périnerveux du fascicule dans le tronc nerveux sur les seuils d'excitation axonale et le recrutement neuronal. Un modèle de nerf fémoral humain dans une électrode de manchette circonférentielle nerveuse a été étudié. L'étude a montré que la stimulation des faisceaux cibles dépend fortement de l'anatomie en coupe transversale du nerf stimulé. L'épaisseur moyenne du périnèvre était de 3.0 ± 1.0 % du diamètre du fascicule. Une épaisseur accrue du périnèvre humain ou un diamètre de fascicule plus grand augmente le seuil d'activation électrique. Si un grand fascicule voisin était présent, il pourrait également affecter l'activation de la stimulation du fascicule cible jusqu'à 80 ± 11% [14].
4. STIMULATION DU NERF RADIAL
Le nerf radial est très proche de la surface latérale de l'humérus en un point situé à 10–14 cm en amont de l'épicondyle latéral. Le nerf est en forme de scaphoïde et suffisamment superficiel pour être raisonnablement bien vu à l'échographie. L'échographie commence généralement au niveau du coude et, avec la sonde dans une orientation transversale au bras, se poursuit de manière proximale jusqu'à ce que l'approche souhaitée soit identifiée. L'aiguille peut être avancée dans le plan avec le transducteur pour se situer entre le nerf et l'humérus. La tête latérale du muscle triceps recouvre le nerf ici, et bien que l'on souhaite éviter la transgression de grandes quantités de tissu musculaire, il n'y a pas d'approche plus optimale du nerf dans un emplacement superficiel au-dessus de l'humérus. Les structures vasculaires, y compris l'artère brachiale profonde et la branche de l'artère radiale récurrente, peuvent être à proximité anatomique et doivent être scannées, car on souhaite éviter de blesser ces structures [14]. La ou les électrodes peuvent être ancrées dans le fascia superficiel du muscle triceps. Une boucle de tension au niveau du site où l'électrode sort du muscle est également souhaitable. Le placement du générateur doit être aussi proche que possible des câbles pour éliminer la traction et la migration des câbles. La disposition fasciculaire du nerf radial peut ne pas être favorable à la stimulation de syndromes douloureux plus distaux, par exemple, la branche sensorielle distale du nerf radial dans des endroits au-dessus du coude. Chez un patient de la première série de cas de mise en place d'un stimulateur guidé par échographie, par exemple [3], le seuil du patient entre l'activation sensorielle et motrice était trop étroit pour être thérapeutique. La ténosynovectomie d'A de Quervain, par exemple, peut avoir causé une lésion du nerf superficiel de la branche radiale distale. Ainsi, une meilleure approche pour stimuler cette branche radiale distale était au milieu de l'avant-bras, immédiatement en profondeur du muscle brachioradial. En fin de compte, la patiente ci-dessus [3] a nécessité le placement ouvert d'une électrode plate au niveau de la branche radiale superficielle distale pour améliorer son analgésie. Les résultats opératoires ouverts comprenaient des cicatrices périneurales et des névromes. Cette branche aurait pu être visualisée par échographie près de l'artère radiale où l'imagerie peut être améliorée en utilisant le Doppler à flux couleur.
5. STIMULATION DU NERF ULNAIRE
Le nerf cubital est très proche de la surface de la peau, superficiel par rapport au chef médial du muscle triceps. Dans les récentes études de faisabilité anatomique [1, 2], le nerf a été identifié à un point situé à 9–13 cm en amont de l'épicondyle médial dans le bras médial/postérieur, un emplacement dans lequel il était généralement facilement identifiable et également à proximité de l'humérus. L'échographie peut commencer au niveau du coude et, avec la sonde dans une orientation transversale par rapport au bras, continuer à scanner plus proximalement jusqu'à ce que les arrangements fasciculaires nerveux puissent être bien identifiés. L'aiguille peut être avancée d'arrière en avant sur la face médiale du bras pour se situer entre le nerf et l'humérus, en restant superficielle par rapport à la tête médiale du triceps. Souvent, les patients souffrant de syndromes douloureux du nerf cubital tels que le statut du syndrome du tunnel cubital après l'échec de la chirurgie de transposition peuvent être de bons candidats. Dans ces cas, le nerf peut avoir déjà été transposé chirurgicalement, ce qui le rend plus facilement identifiable. L'échographie peut permettre de visualiser de gros névromes. Le nerf passe dans le tunnel cubital après être passé dans le sillon ulnaire derrière l'épicondyle médial. Le tunnel cubital est formé par l'arc aponévrotique du fléchisseur ulnaire du carpe comme son plafond où l'aponévrose s'attache à l'épicondyle médial et à l'olécrane, avec le plancher formé par les ligaments médiaux du coude et le muscle fléchisseur profond des doigts [14]. Cette zone est une zone potentielle de compression du nerf.
6. STIMULATION DU NERF MEDIAN
Le nerf médian pénètre dans la fosse antécubitale en dedans du muscle biceps et de son tendon et à côté de l'artère brachiale. L'artère sert de bon point de repère pour scanner le faisceau neurovasculaire, identifier le nerf médian et continuer à scanner distalement. Dans la partie supérieure de l'avant-bras, en un point situé à environ 4–6 cm en aval du pli antécubital, le nerf passe entre les deux têtes du muscle rond pronateur, puis passe sous le pont sublimis des deux têtes du fléchisseur superficiel des doigts (Fig. 2). Il existe de nombreuses communications fasciculaires neurales potentielles entre les nerfs médian et ulnaire qui sont souvent dans l'avant-bras. La plus importante est l'anastomose de Martin-Gruber. La plupart de ces anastomoses de Martin-Gruber impliquent des fibres du nerf médian passant au nerf ulnaire, l'inverse étant beaucoup moins fréquent. D'autres connexions anormales peuvent également exister. Fait intéressant, la toute première série de PNS5 impliquait probablement un certain type de connexion anormale, les distributions sensorielles médiane et ulnaire étant stimulées par l'application d'une stimulation au nerf ulnaire.
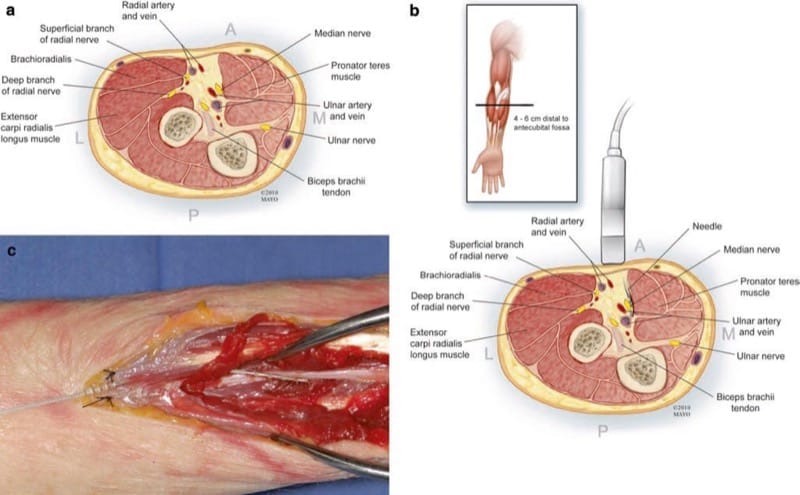
Fig.2 (a) Anatomie en coupe du nerf médian à environ 4–6 cm en aval de la fosse antécubitale de l'avant-bras supérieur. (b) Une approche US dans le plan long axe du nerf médian est représentée, en gardant l'aiguille et l'électrode plus près du muscle et en évitant l'artère ulnaire. ( c ) Dissection de cadavre frais après le placement d'électrodes guidées par les États-Unis. Site d'entrée anatomique à environ 4–6 cm en aval de la fosse antécubitale (ancre suturée au fascia superficiel) montrant une sonde placée longitudinalement et située en avant du nerf médian
La stimulation du nerf médian peut être effectuée soit au-dessus du coude, soit au-dessous. La stimulation sous le coude peut rencontrer l'une de ces anastomoses aberrantes ou stimuler le nerf entre les têtes pronatrices où la compression peut être plus probable.
7. NERF SCIATIQUE À LA BIFURCATION POPLITÉE
Le nerf péronier commun peut être identifié à son point de ramification du nerf sciatique, un point situé à 6–12 cm en amont du pli poplité. L'échographie commence généralement au niveau du pli poplité et, avec la sonde dans une orientation transversale par rapport à la jambe, se poursuit de manière proximale jusqu'à ce que le nerf souhaité soit identifié. Un placement transversal ou longitudinal peut être utilisé, le placement transversal étant plus tolérant au mouvement, mais un plus grand nombre d'électrodes possibles en contact avec les nerfs avec un placement longitudinal. L'emplacement de l'artère poplitée est noté pour éviter la ponction vasculaire lors du placement des électrodes. L'aiguille peut être avancée de postéro-latéral à antéro-médial dans un plan légèrement oblique, en essayant d'éviter de traverser le muscle biceps fémoral (Fig. 3). La zone distale de la bifurcation du nerf sciatique, à une courte distance au-delà de la branche tibiale, est raisonnablement facilement visible à l'échographie. L'électrode peut être ancrée sur le fascia du muscle biceps fémoral. Au cours des études de faisabilité anatomique, la zone proche de la tête fibulaire a également été évaluée pour des placements potentiels sous échographie, mais il y a très peu de marge de manœuvre anatomique et les sondes actuelles ne sont pas bien conçues pour cette zone. Les zones supramalléolaires peuvent être des sites attractifs pour cibler le nerf péronier superficiel mais n'ont pas encore été tentées.
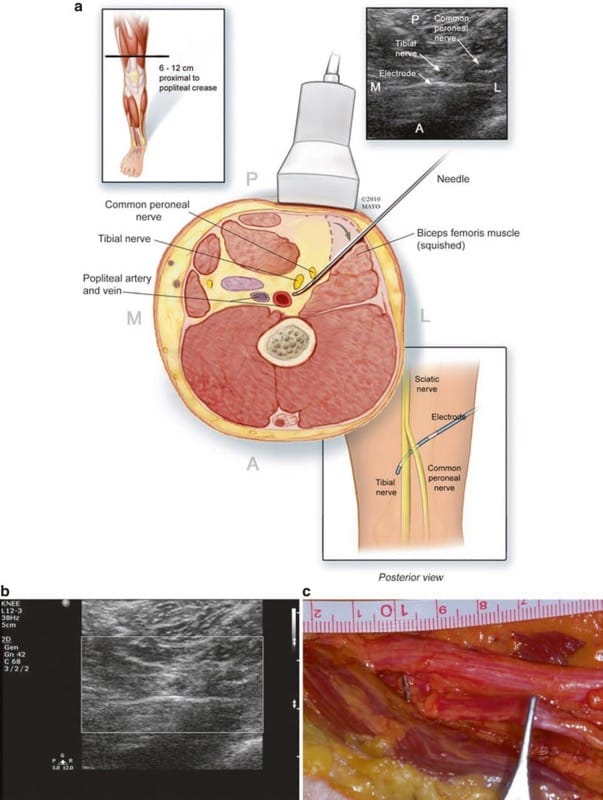
Fig.3 (a) Anatomie en coupe transversale et technique de visualisation US à petit axe, avec placement perpendiculaire des électrodes pour couvrir à la fois les nerfs tibial et péronier commun. (b) Une vue agrandie de la vue américaine en (a). ( c ) Dissection anatomique du placement des électrodes juste en aval de la bifurcation sciatique similaire à ( a ) et ( b ) mais passant entre les nerfs tibial et péronier commun (CP). A noter que deux contacts électriques sont visibles sous les branches nerveuses tibiale et péronière commune. Les forceps sont sur le CP plus distalement.
8. NERF TIBIAL POSTÉRIEUR
Le nerf tibial postérieur peut également être abordé plus distalement dans la jambe. Environ 8 à 14 cm en amont de la malléole médiale, le nerf est à proximité immédiate du muscle tibial postérieur, du digitorum profundus, d'une ou deux grosses veines et du long fléchisseur de l'hallux. L'échographie commence généralement à la cheville près de la malléole médiale, avec la sonde dans une orientation transversale à la jambe, et se poursuit ensuite de manière proximale jusqu'à ce que l'approche souhaitée soit identifiée. L'emplacement de l'artère tibiale postérieure est noté pour éviter la ponction vasculaire lors du placement des électrodes. L'aiguille peut être avancée d'avant en arrière le long de la face médiale de la cheville pour se trouver juste en surface (ou en profondeur) par rapport au nerf. Des précautions doivent être prises pour minimiser les traumatismes des tissus environnants et éviter la transgression de ces structures musculaires. Le générateur d'impulsions peut être placé à la surface du fascia du muscle gastrocnémien médial.
9. CONCLUSION
Le SNP peut être accompli en utilisant un guidage mini-invasif. En général, la réalisation d'implantations permanentes doit continuer à se faire de manière ouverte jusqu'à ce qu'une expérience clinique significative soit acquise et que les résultats à long terme soient plus clairs. De futures études prospectives en double aveugle et le développement de nouvelles électrodes pourraient être utiles pour faire progresser cette technique peu invasive.