Les opioïdes jouent un rôle indispensable dans la pratique de l'anesthésiologie, des soins intensifs et de la gestion de la douleur. Une bonne compréhension de la pharmacologie des opioïdes, y compris les aspects scientifiques fondamentaux et cliniques, est essentielle pour l'utilisation sûre et efficace de ces médicaments importants. Ce chapitre se concentrera presque exclusivement sur les agonistes des récepteurs opioïdes intraveineux utilisés en périopératoire.
1. PHARMACOLOGIE DE BASE
Structure-Activité
Les opioïdes d'intérêt clinique en anesthésiologie partagent de nombreuses caractéristiques structurelles. La morphine est un alcaloïde benzylisoquinoline (Fig.1). De nombreux opioïdes semi-synthétiques couramment utilisés sont créés par simple modification de la molécule de morphine. La codéine, par exemple, est le dérivé 3-méthyle de la morphine. De même, l'hydromorphone, l'hydrocodone et l'oxycodone sont également synthétisées par des modifications relativement simples de la morphine. Des altérations plus complexes du squelette moléculaire de la morphine se traduisent par des agonistes-antagonistes mixtes comme la nalbuphine et même des antagonistes complets comme la naloxone.
La série d'opioïdes fentanyl est chimiquement liée à la mépéridine. La mépéridine est le premier opioïde entièrement synthétique et peut être considérée comme le prototype de la phénylpipéridine clinique (voir Fig 1). Le fentanyl est une simple modification de la structure de base de la phénylpipéridine. D'autres congénères de fentanyl couramment utilisés, tels que l'alfentanil et le sufentanil, sont des versions un peu plus complexes du même squelette de phénylpipéridine.
Les opioïdes partagent de nombreuses caractéristiques physicochimiques en commun, bien que certains médicaments individuels aient des caractéristiques uniques. En général, les opioïdes sont des bases faibles hautement solubles qui sont fortement liées aux protéines et largement ionisées au pH physiologique. Les propriétés physicochimiques des opioïdes influencent leur comportement clinique. Par exemple, des molécules syndiquées relativement non liées telles que l'alfentanil et le rémifentanil ont une latence plus courte jusqu'à l'effet maximal après l'injection d'un bolus.
Mécanisme
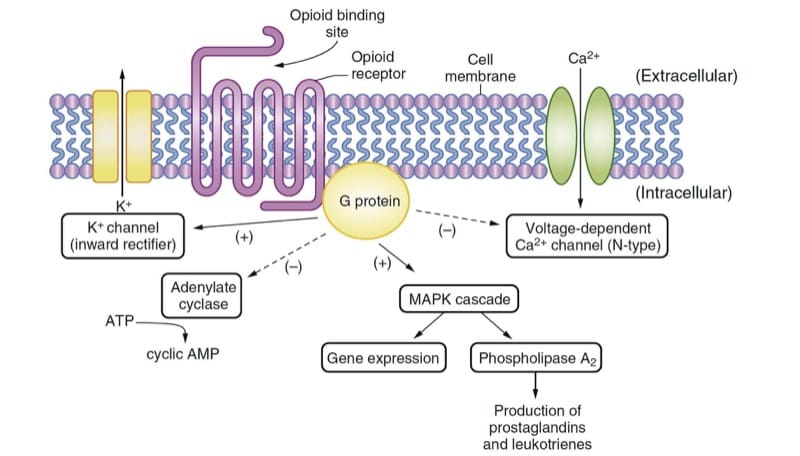
Les opioïdes produisent leurs principaux effets pharmacologiques en interagissant avec les récepteurs opioïdes, qui sont typiques de la famille des récepteurs couplés aux protéines G largement présents en biologie (par exemple, β-adrénergiques, dopaminergiques, entre autres). L'expression de récepteurs opioïdes clonés dans des cellules en culture a facilité l'analyse des mécanismes de transduction du signal intracellulaire activés par les récepteurs opioïdes.(1) La liaison des agonistes opioïdes avec les récepteurs conduit à l'activation de la protéine G, produisant des effets principalement inhibiteurs (Fig. 2); ces effets aboutissent finalement à une hyperpolarisation de la cellule et à une réduction de l'excitabilité neuronale.
Trois récepteurs opioïdes classiques ont été identifiés à l'aide de techniques de biologie moléculaire : μ, κ et δ. Plus récemment, un quatrième récepteur opioïde, ORL1 (également appelé NOP), a également été identifié, bien que sa fonction soit assez différente de celle des récepteurs opioïdes classiques. Chacun de ces récepteurs opioïdes a un dosage biologique expérimental couramment utilisé, un ou plusieurs ligands endogènes associés, un ensemble d'agonistes et d'antagonistes, et un spectre d'effets physiologiques lorsque le récepteur est agonisé. Bien que l'existence de sous-types de récepteurs opioïdes (par exemple, μ1 μ2) ait été proposée, il n'est pas clair d'après les techniques de biologie moléculaire que des gènes distincts existent pour eux. Une modification post-traductionnelle des récepteurs opioïdes se produit certainement et peut être responsable de données contradictoires concernant les sous-types de récepteurs opioïdes.(2)
Les opioïdes exercent leurs effets thérapeutiques sur plusieurs sites. Ils inhibent la libération de substance P par les neurones sensoriels primaires de la corne dorsale de la moelle épinière, atténuant le transfert des sensations douloureuses vers le cerveau. Les actions des opioïdes dans le tronc cérébral modulent la transmission nociceptive dans la corne dorsale de la moelle épinière par des voies inhibitrices descendantes. On pense que les opioïdes modifient la réponse affective à la douleur par des actions dans le cerveau antérieur; la décérébration empêche l'efficacité analgésique des opioïdes chez le rat.(3) De plus, la morphine induit des changements de signal dans les « structures de récompense » du cerveau humain.(4)
Des études sur des souris génétiquement modifiées ont fourni des informations importantes sur la fonction des récepteurs opioïdes. Chez les souris knock-out pour les récepteurs opioïdes μ, l'analgésie induite par la morphine, l'effet de récompense et l'effet de sevrage sont absents.(5,6) Il est important de noter que les souris knock-out pour les récepteurs μ ne présentent pas non plus de dépression respiratoire en réponse à la morphine.(7)

- Fig.2 Mécanismes d'action des opioïdes. Le ligand ou médicament endogène se lie au récepteur opioïde et active la protéine G, entraînant de multiples effets qui sont principalement inhibiteurs. Les activités de l'adénylate cyclase et des canaux Ca2+ voltage-dépendants sont déprimées. Les canaux K + rectifiants vers l'intérieur et la cascade de protéines kinases activées par les mitogènes (MAPK) sont activés. AMP, adénosine monophosphate ; ATP, adénosine triphosphate.
Métabolisme
Les opioïdes administrés par voie intraveineuse dans l'utilisation clinique périopératoire de routine sont transformés et excrétés par de nombreuses voies métaboliques. En général, les opioïdes sont métabolisés par le système microsomal hépatique, bien que la conjugaison hépatique et l'excrétion subséquente par le rein soient importantes pour certains opioïdes. Pour certains opioïdes, la voie métabolique spécifique impliquée a des implications cliniques importantes en termes de métabolites actifs (par exemple, la morphine, la mépéridine) ou une durée d'action ultra courte (par exemple, le rémifentanil). Pour d'autres opioïdes, la variation génétique de la voie métabolique peut modifier radicalement les effets cliniques (par exemple, la codéine). Ces nuances sont abordées dans une section ultérieure axée sur les médicaments individuels.
2. PHARMACOLOGIE CLINIQUE
Pharmacokinetics
Les différences pharmacocinétiques sont la base principale de la sélection et de l'administration rationnelles des opioïdes dans la pratique de l'anesthésie périopératoire. Les principaux comportements pharmacocinétiques sont (1) la latence jusqu'à la concentration maximale au site d'effet après l'injection du bolus (c'est-à-dire la cinétique initiale du bolus), (2) le temps nécessaire à la décroissance cliniquement pertinente de la concentration après l'injection du bolus (c'est-à-dire la cinétique finale du bolus ), (3) le temps jusqu'à la concentration à l'état d'équilibre après le début d'une perfusion continue (c'est-à-dire la cinétique initiale de la perfusion) et (4) le temps jusqu'à la diminution cliniquement pertinente de la concentration après l'arrêt d'une perfusion continue (c'est-à-dire la rétro-perfusion). cinétique finale).
L'application des concepts de pharmacocinétique des opioïdes à l'anesthésiologie clinique nécessite la reconnaissance de plusieurs principes fondamentaux. Premièrement, un tableau de variables pharmacocinétiques a une valeur clinique limitée. Comprendre le comportement pharmacocinétique est mieux réalisé par simulation informatique. Deuxièmement, les opioïdes administrés par injection bolus ou perfusion continue doivent être considérés séparément. (8) Troisièmement, les informations pharmacocinétiques doivent être intégrées aux connaissances sur la relation concentration-effet et les interactions médicamenteuses (c'est-à-dire la pharmacodynamique) pour être cliniquement utiles.
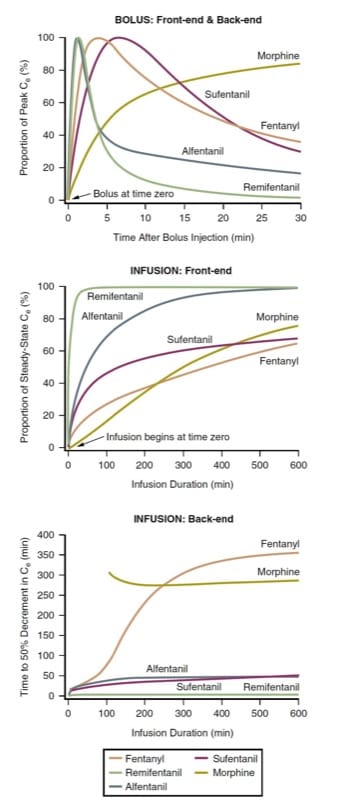
La latence jusqu'à l'effet maximal et le décalage de l'effet après l'injection du bolus (c'est-à-dire la cinétique initiale du bolus et la cinétique finale du bolus) de divers opioïdes intraveineux peuvent être définis en prédisant l'évolution dans le temps des concentrations au site d'effet après l'administration d'un bolus . Étant donné que les opioïdes diffèrent en termes de puissance (et donc de dosages requis), à des fins de comparaison, les concentrations au site d'effet doivent être normalisées au pourcentage de la concentration maximale pour chaque médicament. Considérant la morphine, le fentanyl, le sufentanil, l'alfentanil et le rémifentanil comme parmi les opioïdes les plus couramment utilisés en peropératoire, la simulation pharmacocinétique illustre comment les opioïdes diffèrent en termes de latence jusqu'à l'effet maximal après l'administration d'un bolus (Fig.3, panneau supérieur). (9-12)
La simulation d'une injection bolus (voir Fig.3, panneau du haut) a des implications cliniques. Par exemple, lorsqu'un début rapide de l'effet opioïde est souhaitable, la morphine peut ne pas être un bon choix. De même, lorsque l'objectif clinique est une brève durée de l'effet opioïde suivi d'une dissipation rapide, le rémifentanil ou l'alfentanil peut être préféré. Notez comment la concentration de rémifentanil a diminué très sensiblement avant même que la concentration maximale de fentanyl ait été atteinte. La simulation illustre pourquoi la cinétique frontale du fentanyl en fait un médicament bien adapté à l'analgésie contrôlée par le patient (PCA) (voir également les chapitres Récupération post-anesthésique et Gestion de la douleur périopératoire). Contrairement à la morphine, l'effet maximal d'un bolus de fentanyl se manifeste avant qu'une période typique de verrouillage de l'ACP ne se soit écoulée, atténuant ainsi un problème de « cumul des doses » (voir également le chapitre Prise en charge de la douleur périopératoire).
La latence jusqu'à l'effet maximal est régie par la vitesse à laquelle le plasma et le site d'effet s'équilibrent (c'est-à-dire le paramètre ke0). Les médicaments dont l'équilibrage est plus rapide ont une fraction « diffusible » plus élevée (c'est-à-dire la proportion de médicament syndiqué et non lié) et une solubilité élevée dans les lipides. Cependant, une très forte dose d'un opioïde, même à action lente, peut produire une apparition apparemment rapide (parce qu'un niveau de médicament suprathérapeutique dans le site d'effet est atteint même si la concentration maximale survient plus tard).
Cette simulation de perfusions simples à débit constant a des implications cliniques évidentes. Premièrement, le temps nécessaire pour atteindre une fraction substantielle de la concentration ultime à l'état d'équilibre est très long dans le cadre d'une utilisation peropératoire. Pour atteindre un état proche de l'équilibre plus rapidement, il faut administrer un bolus avant de commencer (ou d'augmenter) la perfusion. Le rémifentanil représente peut-être une exception partielle à cette règle générale. En outre, les concentrations d'opioïdes augmenteront pendant de nombreuses heures après le début d'une perfusion ; en d'autres termes, les concentrations augmentent généralement même si le débit de perfusion peut être le même depuis des heures ! Le fait que le rémifentanil atteigne un état proche de l'équilibre relativement rapidement explique certainement en partie pourquoi il est devenu un médicament populaire pour l'anesthésie intraveineuse totale (TIVA).
Le temps d'équilibre après le début d'une perfusion continue est également mieux examiné par la simulation pharmacocinétique. En utilisant les mêmes prototypes qu'avec l'administration en bolus, la simulation pharmacocinétique (Fig. 3, panneau du milieu) montre le temps nécessaire pour atteindre des concentrations au site d'effet à l'état d'équilibre (c'est-à-dire la cinétique frontale de la perfusion).
Le temps de décalage de l'effet après l'arrêt d'une perfusion à l'état d'équilibre est mieux exprimé par la simulation de demi-temps contextuelle (CSHT).(13) Défini comme le temps nécessaire pour obtenir une diminution de 50 % de la concentration après l'arrêt d'une perfusion continue, perfusion à l'état d'équilibre, le CSHT est un moyen de normaliser le comportement pharmacocinétique des médicaments afin que des comparaisons rationnelles puissent être faites concernant le décalage prévu de l'effet du médicament. Le CSHT est ainsi focalisé sur la cinétique « back-end de perfusion ».
Le panneau inférieur de (Fig.3) est une simulation CSHT pour les opioïdes couramment utilisés. Pour la plupart des médicaments, le CSHT change avec le temps. Ainsi, pour les perfusions brèves, les cinétiques de retour prédites pour les différents médicaments ne diffèrent pas beaucoup (le rémifentanil est une exception notable à cette règle générale). Au fur et à mesure que le temps de perfusion s'allonge, les CSHT commencent à se différencier, fournissant une base rationnelle pour la sélection des médicaments. Deuxièmement, en fonction de la durée souhaitée de l'effet opioïde, des médicaments à action plus courte ou plus longue peuvent être choisis. Enfin, les allures de ces courbes diffèrent selon le degré de baisse de concentration requis. En d'autres termes, les courbes représentant le temps nécessaire pour atteindre une diminution de concentration de 20 % ou de 80 % (par exemple, les simulations de temps de diminution de 20 % ou de 80 %) sont assez différentes.(8) Ainsi, selon la technique d'anesthésie appliquée , les simulations CSHT ne sont pas nécessairement les simulations cliniquement pertinentes (c'est-à-dire qu'une diminution de 50 % peut ne pas être l'objectif clinique). De plus, la simulation CSHT pour la morphine ne tient pas compte des métabolites actifs (voir la discussion ultérieure sur les médicaments individuels sous « Caractéristiques uniques des opioïdes individuels »).

- Fig.3 Pharmacocinétique des opioïdes. Simulations illustrant le comportement pharmacocinétique frontal et secondaire après administration par injection bolus ou perfusions continues de morphine, de fentanyl, d'alfentanil, de sufentanil et de rémifentanil à l'aide de paramètres pharmacocinétiques tirés de la littérature (voir le texte pour plus de détails).(9-12,45)
Pharmacodynamique
À bien des égards, les opioïdes μ-agonistes peuvent être considérés comme des égaux pharmacodynamiques avec d'importantes différences pharmacocinétiques ; c'est-à-dire que les effets thérapeutiques et indésirables sont essentiellement les mêmes. Leur efficacité en tant qu'analgésiques et leur propension à produire une dépression ventilatoire sont indiscernables l'une de l'autre. Des différences pharmacodynamiques existent avec les mécanismes des récepteurs non opioïdes tels que la libération d'histamine.
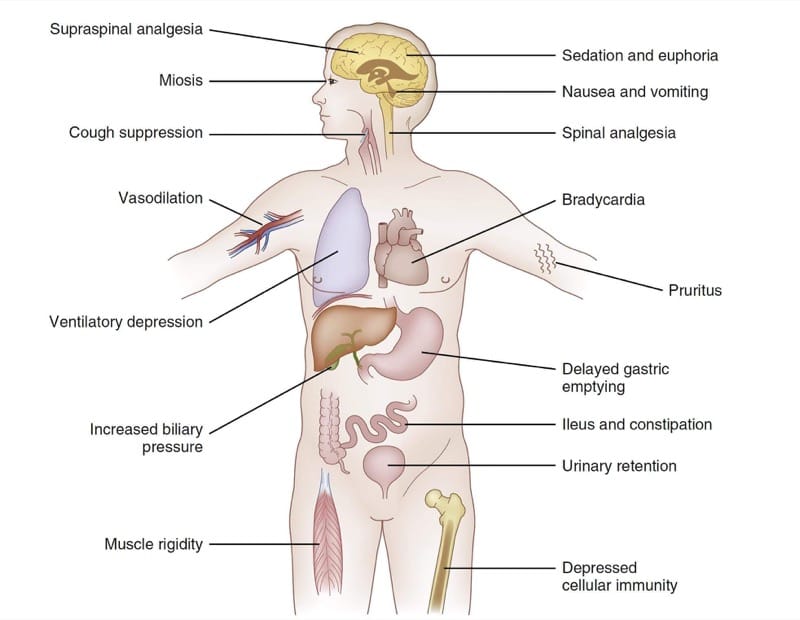
Parce que le système nerveux influence profondément la fonction de tout le corps, des effets pharmacodynamiques μ-agonistes opioïdes sont observés dans de nombreux systèmes organiques. La figure 4 résume les principaux effets pharmacodynamiques des congénères du fentanyl. Selon les circonstances cliniques et les objectifs cliniques du traitement, certains de ces effets répandus peuvent être considérés comme thérapeutiques ou indésirables. Par exemple, dans certains contextes cliniques, la sédation produite par les μ-agonistes peut être considérée comme un objectif thérapeutique. Chez d'autres, la somnolence serait clairement considérée comme un effet indésirable.

- Fig. 4 Pharmacodynamie des opioïdes. Un tableau récapitulatif des effets sélectionnés des congénères du fentanyl (voir le texte pour plus de détails).
Effets thérapeutiques
Le soulagement de la douleur est le principal effet thérapeutique des analgésiques opioïdes. Agissant au niveau des récepteurs μ spinaux et cérébraux, les opioïdes procurent une analgésie à la fois en atténuant le trafic nociceptif de la périphérie et également en modifiant la réponse affective à la stimulation douloureuse au niveau central.
Les μ-agonistes sont les plus efficaces pour traiter les sensations de « seconde douleur » portées par les fibres C non myélinisées à conduction lente ; ils sont moins efficaces pour traiter les sensations de « premières douleurs » (portées par de petites fibres A-delta myélinisées) et les douleurs neuropathiques. Un aspect unique de l'analgésie induite par les opioïdes (contrairement aux médicaments comme les anesthésiques locaux) est que les autres modalités sensorielles ne sont pas affectées (par exemple, le toucher, la température, entre autres).
En périopératoire (certainement en peropératoire), la somnolence induite par les μ-agonistes fait également partie des effets visés. Le cerveau est le substrat anatomique de l'action sédative des μ-agonistes. Avec des doses croissantes, les μ-agonistes finissent par produire de la somnolence et du sommeil (le soulagement de la douleur contribue sans aucun doute à la promotion du sommeil chez les patients inconfortables à la fois avant et après l'opération). Avec des doses suffisantes, les μ-agonistes produisent une activité d'onde delta prononcée sur l'électroencéphalogramme, qui ressemble au schéma observé pendant le sommeil naturel.
Les μ-agonistes peuvent bien sûr produire un soulagement significatif de la douleur à des doses qui ne produisent pas de sommeil. C'est la base clinique de leur utilisation dans le traitement de la douleur chez les patients ambulatoires. Pourtant, l'administration de doses supplémentaires produit à terme une somnolence (et, par conséquent, l'impossibilité de demander des doses supplémentaires) et constitue le fondement scientifique essentiel de la sécurité des dispositifs PCA (voir également le chapitre sur la gestion de la douleur périopératoire). Cependant, même de fortes doses d'opioïdes ne produisent pas de manière fiable une absence de réponse et une amnésie et, par conséquent, les opioïdes ne peuvent pas être considérés comme des anesthésiques complets lorsqu'ils sont utilisés seuls.
Les opioïdes suppriment également le réflexe de la toux via les centres de la toux dans la moelle. L'atténuation du réflexe de la toux rend vraisemblablement moins probable la toux et le « choc » contre le tube endotrachéal à demeure.
Effets indésirables

La dépression de la ventilation est le principal effet indésirable associé aux médicaments μ-agonistes. Lorsque les voies respiratoires sont sécurisées et que la ventilation est contrôlée en peropératoire, la dépression de la ventilation induite par les opioïdes est sans conséquence. Cependant, la dépression respiratoire induite par les opioïdes dans la période postopératoire peut entraîner des lésions cérébrales et la mort.
Les μ-agonistes modifient la réponse ventilatoire aux concentrations artérielles de dioxyde de carbone au niveau du centre de contrôle ventilatoire de la moelle. La dépression de la ventilation est médiée par le récepteur μ ; Les souris knock-out pour les récepteurs μ ne présentent pas de dépression respiratoire due à la morphine.(14)
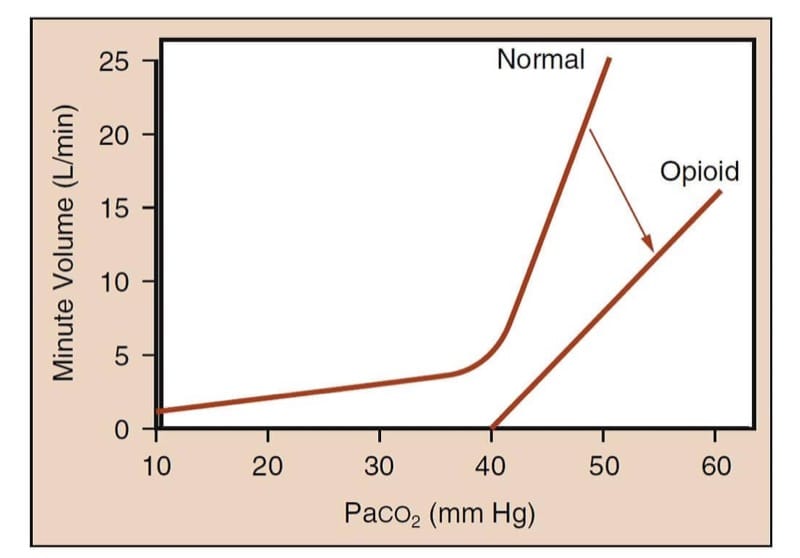
Chez les humains non médicamentés, les augmentations de la pression partielle de dioxyde de carbone artériel augmentent considérablement le volume minute (Fig.5). Sous l'influence des analgésiques opioïdes, la courbe est aplatie et décalée vers la droite pour une pression partielle de dioxyde de carbone donnée et indique que le volume minute est plus petit.(15) Plus important encore, la forme en "bâton de hockey" de la courbe normale est perdue ; c'est-à-dire qu'il peut exister une pression partielle de dioxyde de carbone en dessous de laquelle le patient ne respirera pas (c'est-à-dire le « seuil apnéique ») en présence d'opioïdes.

- Fig.5 Méthodologie de l'étude sur la dépression ventilatoire induite par les opioïdes. La méthode caractérise la relation entre Paco2 et le volume minute. La courbe intitulée "Normal" représente la réponse attendue du volume minute à l'augmentation des niveaux de Paco2 chez un humain éveillé. Notez l'augmentation spectaculaire du volume minute à mesure que la tension de CO2 augmente. La courbe intitulée « Opioïde » représente la réponse émoussée du volume minute à l'augmentation des niveaux de CO2 après l'administration d'un opioïde. Notez que la pente de la courbe diminue et la courbe n'a plus la forme d'un "bâton de hockey" ; cela signifie qu'aux niveaux physiologiques de Paco2, le patient recevant suffisamment d'opioïdes peut être apnéique ou sévèrement hypoventilatoire. (Adapté de Gross JB. Lorsque vous respirez IN, vous inspirez, lorsque vous NE respirez PAS, vous... expirez : nouvelles connaissances concernant la dépression ventilatoire induite par les opioïdes. Anesthesiology. 2003;99:767-770, utilisé avec autorisation .)
Les signes cliniques de ventilation déprimée sont assez subtils avec des doses modérées d'opioïdes. Les patients postopératoires recevant un traitement analgésique opioïde peuvent être éveillés et alertes et pourtant avoir un volume minute significativement diminué. La fréquence respiratoire (souvent associée à un volume courant légèrement augmenté) diminue également. Au fur et à mesure que la concentration d'opioïdes augmente, la fréquence respiratoire et le volume courant diminuent progressivement, aboutissant finalement à un rythme ventilatoire irrégulier puis à une apnée complète.
De nombreux facteurs peuvent augmenter le risque de dépression ventilatoire induite par les opioïdes. Les facteurs de risque évidents comprennent une forte dose d'opioïdes, un âge avancé, l'utilisation concomitante d'autres dépresseurs du système nerveux central (SNC) et une insuffisance rénale (pour la morphine). Le sommeil naturel augmente également l'effet dépresseur ventilatoire des opioïdes.(16)
Les opioïdes peuvent altérer la physiologie cardiovasculaire par une variété de mécanismes différents. Comparativement à de nombreux autres anesthésiques (p. ex. propofol, anesthésiques volatils), les effets cardiovasculaires des opioïdes, en particulier les congénères du fentanyl, sont toutefois relativement minimes (la morphine et la mépéridine sont des exceptions - voir la section suivante sur les médicaments individuels).
Les congénères du fentanyl provoquent une bradycardie en augmentant directement le tonus du nerf vague dans le tronc cérébral, qui peut être bloqué expérimentalement par micro-injection de naloxone dans le noyau du nerf vague ou par vagotomie périphérique.(17,18)
Les opioïdes produisent également une vasodilatation en déprimant les centres vasomoteurs du tronc cérébral et, dans une moindre mesure, par un effet direct sur les vaisseaux. Cette action diminue à la fois la précharge et la postcharge. Les diminutions de la pression artérielle sont plus prononcées chez les patients présentant un tonus sympathique accru, tels que les patients souffrant d'insuffisance cardiaque congestive ou d'hypertension. Les doses cliniques d'opioïdes ne modifient pas sensiblement la contractilité myocardique.
Les opioïdes peuvent induire une rigidité musculaire, généralement à partir de l'administration rapide de fortes doses de bolus des congénères du fentanyl. Cette rigidité peut même rendre la ventilation via un ballon et un masque pendant l'induction de l'anesthésie presque impossible en raison de la rigidité et de la fermeture des cordes vocales.(19) L'apparition de la rigidité a tendance à coïncider avec le début de l'absence de réponse.(20) Bien que le mécanisme de la rigidité musculaire induite est inconnue, il ne s'agit pas d'une action directe sur le muscle car elle peut être éliminée par l'administration de médicaments bloquants neuromusculaires.
La constriction pupillaire induite par les μ-agonistes peut être un signe diagnostique utile indiquant un effet opioïde en cours. Les opioïdes stimulent le noyau Edinger-Westphal du nerf oculomoteur pour produire un myosis. Même de petites doses d'opioïdes provoquent cette réponse et très peu de tolérance à l'effet se développe. Ainsi, le myosis est un indicateur utile, bien que non spécifique, de l'exposition aux opioïdes, même chez les patients tolérants aux opioïdes. La constriction pupillaire induite par les opioïdes est réversible à la naloxone.
Les opioïdes ont des effets importants sur la physiologie gastro-intestinale. Les récepteurs opioïdes sont situés dans tout le plexus entérique de l'intestin. La stimulation de ces récepteurs par les opioïdes provoque une contraction tonique du muscle lisse gastro-intestinal, diminuant ainsi les contractions péristaltiques coordonnées. Cliniquement, cette contraction entraîne un retard de la vidange gastrique et vraisemblablement des volumes gastriques plus importants chez les patients recevant un traitement opioïde avant l'opération. Après l'opération, les patients peuvent développer un iléus induit par les opioïdes qui peut potentiellement retarder la reprise d'une alimentation adéquate et la sortie de l'hôpital. Une extension de ce problème aigu est la constipation chronique associée à un traitement opioïde à long terme.
Des effets similaires sont observés dans le système biliaire, qui possède également une abondance de récepteurs μ. Les μ-agonistes peuvent produire une contraction du muscle lisse de la vésicule biliaire et un spasme du sphincter d'Oddi, provoquant potentiellement un cholangiogramme faussement positif lors d'une chirurgie de la vésicule biliaire et des voies biliaires. Ces effets sont complètement réversibles à la naloxone et peuvent être partiellement inversés par un traitement au glucagon.
Bien que les effets urologiques soient minimes, les opioïdes peuvent parfois provoquer une rétention urinaire en diminuant le tonus du détrusor de la vessie et en augmentant le tonus du sphincter urinaire. Ces effets sont en partie à médiation centrale, bien que des effets périphériques soient également susceptibles étant donné la présence généralisée de récepteurs opioïdes dans le tractus génito-urinaire.(21,22) Bien que la rétention urinaire associée à la thérapie aux opioïdes ne soit généralement pas prononcée, elle peut être gênante chez les hommes. , en particulier lorsque l'opioïde est administré par voie intrathécale ou épidurale.
Les opioïdes dépriment l'immunité cellulaire. La morphine et l'opioïde endogène β-endorphine, par exemple, inhibent la transcription de l'interleukine 2 dans les cellules T activées, entre autres effets immunologiques.(23) Les opioïdes individuels (et peut-être les classes d'opioïdes) peuvent différer en termes de nature exacte et d'étendue de leurs effets immunomodulateurs. Bien que l'altération de l'immunité cellulaire induite par les opioïdes ne soit pas bien comprise, une altération de la cicatrisation des plaies, des infections périopératoires et une récidive du cancer sont des effets indésirables possibles.
Interactions avec des médicaments
Les interactions médicamenteuses peuvent reposer sur deux mécanismes : pharmacocinétique (c'est-à-dire lorsqu'un médicament influence la concentration de l'autre) ou pharmacodynamique (c'est-à-dire lorsqu'un médicament influence l'effet de l'autre). Dans la pratique de l'anesthésie, bien que des interactions pharmacocinétiques involontaires se produisent parfois, des interactions pharmacodynamiques se produisent avec pratiquement tous les anesthésiques et sont souvent produites par conception.
L'interaction pharmacocinétique la plus courante dans la pharmacologie clinique des opioïdes est observée lorsque des opioïdes intraveineux sont associés au propofol. Peut-être en raison des modifications hémodynamiques induites par le propofol et de leur impact sur les processus pharmacocinétiques, les concentrations d'opioïdes peuvent être plus élevées lorsqu'elles sont administrées en association avec une perfusion continue de propofol.(24)
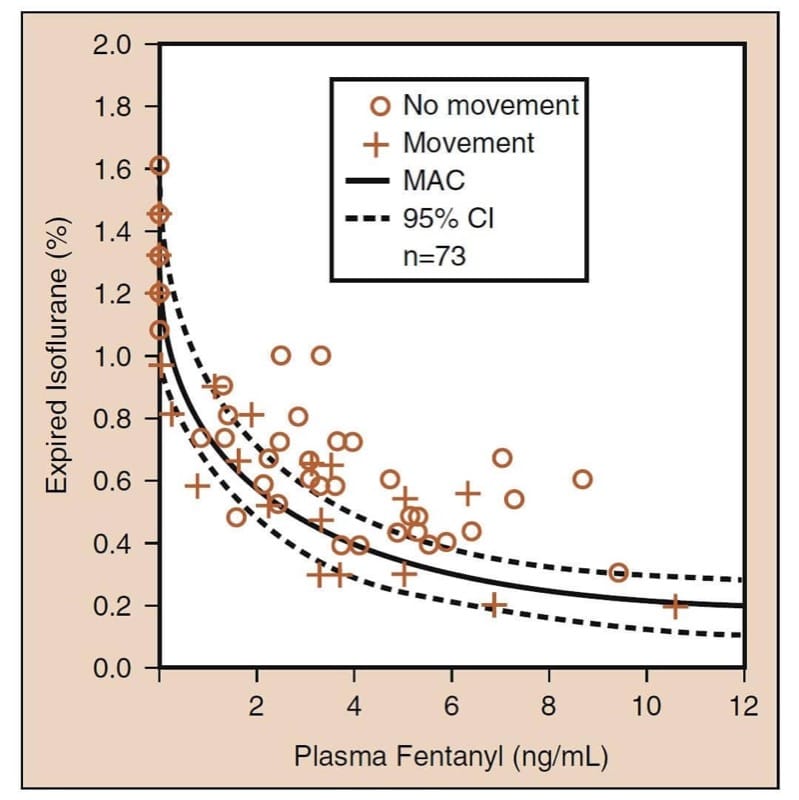
L'interaction médicamenteuse pharmacodynamique la plus importante impliquant des opioïdes est l'interaction synergique qui se produit lorsque les opioïdes sont combinés avec des sédatifs. (25) Lorsqu'ils sont combinés avec des anesthésiques volatils, les opioïdes réduisent la concentration alvéolaire minimale (MAC) d'un anesthésique volatil (Fig.6). Un examen attentif des données de «réduction des opioïdes-MAC» révèle plusieurs concepts cliniquement critiques (voir Fig.6). Premièrement, les opioïdes réduisent de manière synergique le MAC. Deuxièmement, la réduction de la MAC est substantielle (jusqu'à 75 % ou plus). Troisièmement, la majeure partie de la réduction de la MAC se produit à des niveaux d'opioïdes modérés (c'est-à-dire que même des doses d'opioïdes modestes réduisent considérablement la MAC). Quatrièmement, la réduction du MAC n'est pas complète (c'est-à-dire que les opioïdes ne sont pas des anesthésiques complets). L'ajout de l'opioïde ne peut pas éliminer complètement le besoin de l'autre anesthésique. Et cinquièmement, il existe un nombre infini de combinaisons hypnotiques-opioïdes qui permettront d'atteindre la MAC (cela implique que les cliniciens doivent choisir la combinaison optimale en fonction des objectifs de l'anesthésie et de l'opération). Tous ces concepts s'appliquent également lorsque les opioïdes sont utilisés en association avec le propofol pour TIVA. (26)

- Fig.6 Réduction de la concentration alvéolaire minimale (MAC) des anesthésiques volatils par les opioïdes : l'exemple prototype de l'isoflurane et du fentanyl. La courbe pleine est MAC ; les courbes en pointillés sont les intervalles de confiance (IC) à 95 % (voir le texte pour plus de détails). (Adapté de McEwan AI, Smith C, Dyar O, et al. Isoflurane minimum alveolar concentration reduction by fentanyl. Anesthesiology. 1993;78:864-869, utilisé avec permission.)
Populations spéciales
Défaillance hépatique
Même si le foie est l'organe métabolique principalement responsable de la biotransformation de la plupart des opioïdes, l'insuffisance hépatique n'est généralement pas suffisamment grave pour avoir un impact majeur sur la pharmacocinétique des opioïdes. Bien entendu, la phase anhépatique de la transplantation hépatique orthotopique est une exception notable à cette règle générale (voir également le chapitre transplantation d'organe). Avec l'administration continue de médicaments, les concentrations d'opioïdes qui dépendent du métabolisme hépatique augmentent lorsque le patient n'a pas de foie. Même après une résection hépatique partielle, une augmentation du rapport des glucuronides de morphine à la morphine se produit, indiquant une diminution du taux de métabolisme de la morphine.(27) Étant donné que le métabolisme du rémifentanil est totalement indépendant des mécanismes de clairance hépatique, sa disposition n'est pas affectée lors de la transplantation hépatique. .(28)
Les considérations pharmacodynamiques peuvent être importantes pour le traitement aux opioïdes chez les patients atteints d'une maladie hépatique grave. Les patients atteints d'encéphalopathie hépatique en cours sont particulièrement vulnérables aux effets sédatifs des opioïdes. Par conséquent, cette classe de médicaments doit être utilisée avec prudence dans cette population de patients.
Insuffisance rénale
L'insuffisance rénale a des implications d'importance clinique majeure en ce qui concerne la morphine et la mépéridine (voir la discussion suivante sur les médicaments individuels). Pour les congénères du fentanyl, l'importance clinique de l'insuffisance rénale est beaucoup moins marquée. Le métabolisme du rémifentanil n'est pas affecté par une maladie rénale. (29)
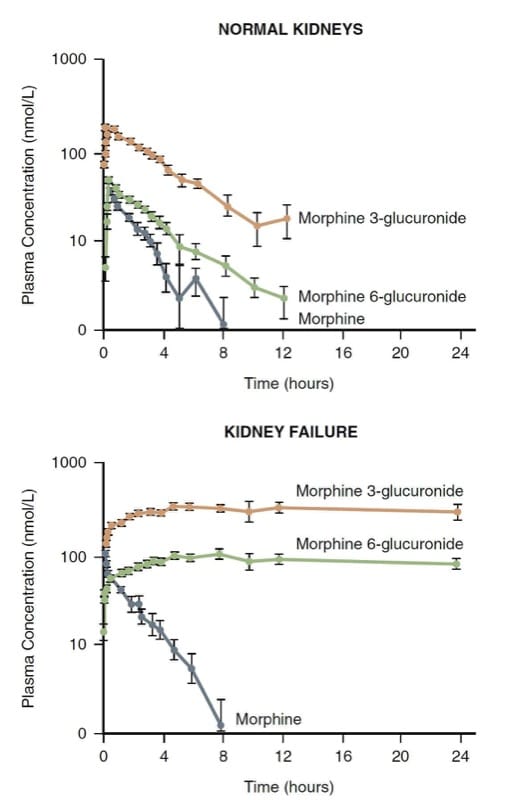
La morphine est principalement métabolisée par conjugaison dans le foie ; les glucuronides solubles dans l'eau qui en résultent (c'est-à-dire la morphine 3-glucuronide et la morphine 6-glucuronide—M3G et M6G) sont excrétés par le rein. Le rein joue également un rôle dans la conjugaison de la morphine et peut représenter jusqu'à la moitié de sa conversion en M3G et M6G.
Le M3G est inactif, mais le M6G est un analgésique d'une puissance rivalisant avec la morphine. Des niveaux très élevés de M6G et une dépression respiratoire potentiellement mortelle peuvent se développer chez les patients insuffisants rénaux (Fig.7). (30) Par conséquent, la morphine peut ne pas être un bon choix chez les patients dont les mécanismes de clairance rénale sont gravement altérés.
La pharmacologie clinique de la mépéridine est également significativement altérée par l'insuffisance rénale. La normépéridine, le principal métabolite, a des effets analgésiques et excitateurs sur le SNC qui vont de l'anxiété et des tremblements aux myoclonies et aux crises franches. Étant donné que les métabolites actifs sont soumis à l'excrétion rénale, la toxicité sur le SNC secondaire à l'accumulation de normépéridine est particulièrement préoccupante chez les patients insuffisants rénaux. Cette lacune de la mépéridine a amené de nombreux formulaires hospitaliers à restreindre son utilisation ou à la supprimer complètement du formulaire.

- Fig.7 La pharmacocinétique de la morphine et de ses métabolites chez des volontaires sains versus des insuffisants rénaux. A noter l'accumulation importante des métabolites en cas d'insuffisance rénale. (Adapté de Osborne R, Joel S, Grebenik K, et al. The pharmacokinetics of morphine and morphine glucuronides in rein failure. Clin Pharmacol Ther. 1993;54:158-167, utilisé avec permission.)
Genre
Le sexe peut avoir une influence importante sur la pharmacologie des opioïdes. La morphine est plus puissante chez les femmes que chez les hommes et a un début d'action plus lent chez les femmes.(31) Certaines de ces différences peuvent être liées aux hormones gonadiques cycliques et à des facteurs psychosociaux.
Âge
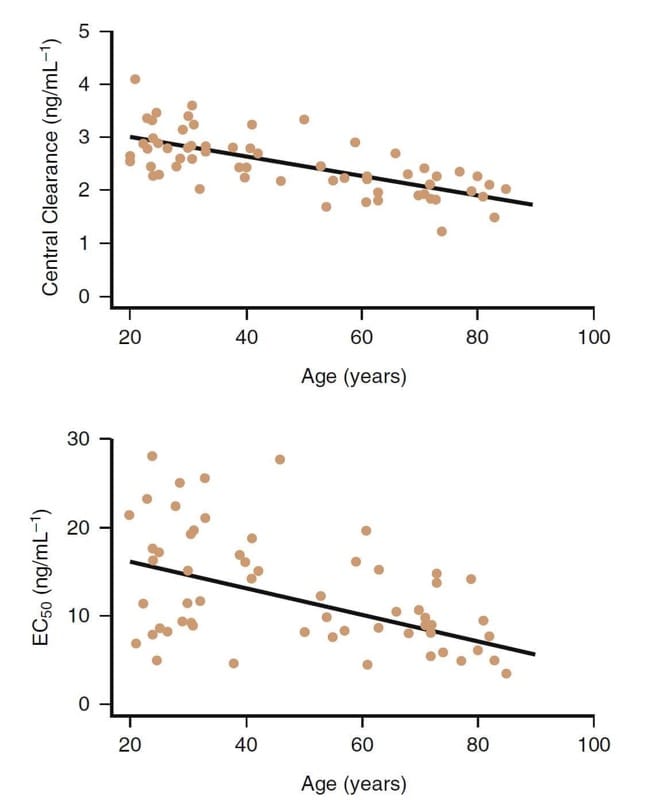
L'âge avancé est clairement un facteur important influençant la pharmacologie clinique des opioïdes. Par exemple, les congénères du fentanyl sont plus puissants chez les patients âgés (Fig.8).(32,33) Des diminutions de la clairance et du volume de distribution central se produisent également chez les patients âgés.
Avec l'âge avancé, bien que les changements pharmacocinétiques jouent également un rôle, les différences pharmacodynamiques sont principalement responsables de la diminution de la dose requise chez les patients âgés (> 65 ans). Les doses de rémifentanil doivent être diminuées d'au moins 50 % ou plus chez les patients âgés. Des réductions de dosage similaires sont également prudentes pour les autres opioïdes.

- Fig.8 L'influence de l'âge sur la pharmacologie clinique du rémifentanil. Bien qu'il existe une variabilité considérable, en général, les sujets âgés ont une clairance centrale plus faible et une puissance plus élevée (c'est-à-dire une CE50 plus faible)32.
Obésité
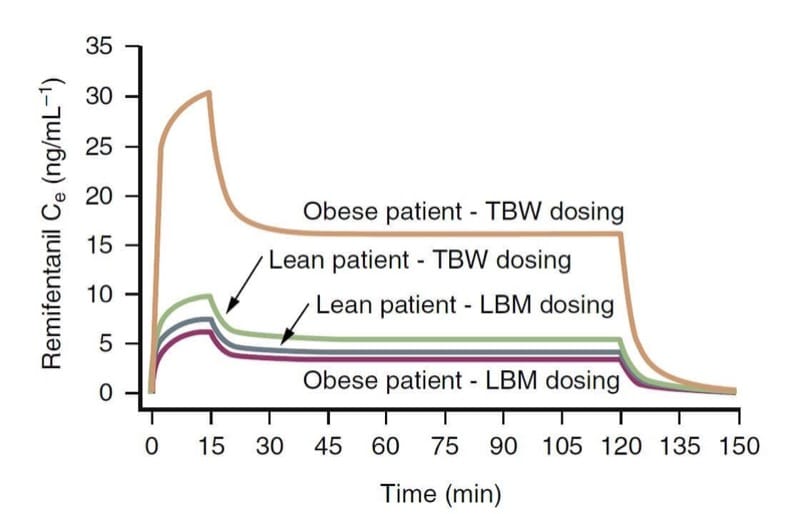
Le poids corporel est probablement un facteur important influençant la pharmacologie clinique des opioïdes. Les variables pharmacocinétiques des opioïdes, en particulier la clairance, sont plus étroitement liées à la masse corporelle maigre (LBM) qu'au poids corporel total (TBW). Concrètement, cela signifie que les patients souffrant d'obésité morbide ont besoin d'une dose plus importante que les patients maigres pour atteindre la même concentration cible, mais pas autant que le suggérerait leur TBW. (34)
Par exemple, comme illustré par la simulation pharmacocinétique (Fig. 9), un schéma posologique basé sur le TBW entraîne des concentrations au site d'effet de rémifentanil beaucoup plus élevées qu'un calcul de dosage basé sur le LBM. (35) En revanche, les schémas posologiques TBW et LBM entraînent des concentrations similaires pour les patients maigres. Ces concepts s'appliquent probablement aussi à d'autres opioïdes.

- Fig.9 Une simulation pharmacocinétique illustrant les conséquences du calcul de la dose de rémifentanil en fonction du poids corporel total (TBW) ou de la masse corporelle maigre (LBM) chez les patients obèses et maigres (injection bolus de 1 μg/kg suivie d'une perfusion de 0.5 μg/kg /min pendant 15 minutes et 0.25 μg/kg/min pendant 105 minutes supplémentaires). Notez que le dosage basé sur le TBW chez un patient obèse entraîne des concentrations considérablement plus élevées. (Adapté de Egan TD, Huizinga B, Gupta SK, et al. Remifentanil pharmacokinetics in obese versus lean patients. Anesthesiology. 1998;89:562-573, utilisé avec permission.)
Caractéristiques uniques des opioïdes individuels
Codéine
La codéine, bien qu'elle ne soit pas couramment utilisée en peropératoire, a une importance particulière parmi les opioïdes en raison de la nuance pharmacogénomique bien caractérisée qui lui est associée. La codéine est en fait une prodrogue ; la morphine est le composé actif. La codéine est métabolisée (en partie) par O-déméthylation en morphine, un processus métabolique médié par l'isoforme microsomique hépatique CYP2D6.(36) population caucasienne) ou dont le CYP2D6 est inhibé (par exemple, les patients prenant de la quinidine) ne devraient pas bénéficier de la codéine même s'ils présentent une réponse normale à la morphine. (10)
Morphine
La morphine est l'opioïde prototype auquel tous les nouveaux arrivants sont comparés. Rien ne prouve qu'un opioïde synthétique soit plus efficace pour contrôler la douleur que la morphine naturelle. Sans la libération d'histamine et l'hypotension résultante associée à la morphine, le fentanyl n'aurait peut-être pas remplacé la morphine comme opioïde le plus couramment utilisé en peropératoire.
La morphine a un temps d'action lent. Le pKa de la morphine la rend presque complètement ionisée au pH physiologique. Cette propriété et sa faible solubilité dans les lipides expliquent la latence prolongée de la morphine jusqu'à son effet maximal; la morphine pénètre lentement dans le SNC. Cette fonctionnalité présente à la fois des avantages et des inconvénients qui lui sont associés. La latence prolongée jusqu'à l'effet maximal signifie que la morphine est peut-être moins susceptible de provoquer une dépression respiratoire aiguë après l'injection d'un bolus de doses analgésiques typiques par rapport aux opioïdes à action plus rapide. D'autre part, le temps d'apparition lent signifie que les cliniciens sont peut-être plus susceptibles de « cumuler » de manière inappropriée plusieurs doses de morphine chez un patient souffrant de douleur intense, créant ainsi le potentiel d'un « dépassement » toxique.(39)
Le métabolite actif de la morphine, M6G, a des implications cliniques importantes. Bien que la conversion en M6G ne représente que 10 % du métabolisme de la morphine, le M6G peut contribuer aux effets analgésiques de la morphine même chez les patients ayant une fonction rénale normale, en particulier avec une utilisation à long terme. En raison du taux d'extraction hépatique élevé de la morphine, la biodisponibilité de la morphine administrée par voie orale est significativement plus faible qu'après injection parentérale. L'effet de premier passage hépatique sur la morphine administrée par voie orale entraîne des taux élevés de M6G. En fait, le M6G peut être le principal composé actif lorsque la morphine est administrée par voie orale.(40) Comme indiqué dans la section précédente, « Insuffisance rénale », l'accumulation de M6G à des niveaux potentiellement toxiques chez les patients dialysés est une autre implication importante de ce métabolite actif.
Le fentanyl
Le fentanyl est peut-être l'opioïde le plus important utilisé dans la pratique moderne de l'anesthésie. En tant que congénère original du fentanyl, son application clinique est bien ancrée et très diversifiée. Le fentanyl peut être administré de nombreuses façons. En plus de la voie intraveineuse, le fentanyl peut être administré par voie transdermique, transmuqueuse, transnasale et transpulmonaire.
L'administration transmuqueuse orale de citrate de fentanyl (OTFC) permet d'atteindre plus rapidement des niveaux de pointe plus élevés que lorsque la même dose est avalée. (41) L'évitement de l'effet de premier passage entraîne une biodisponibilité sensiblement plus grande. Le fait que l'OTFC soit non invasif et d'apparition rapide en a fait une thérapie efficace pour les accès douloureux paroxystiques chez les patients cancéreux tolérants aux opioïdes, souvent en association avec un patch transdermique de fentanyl (voir également le chapitre 40).
alfentanil
L'alfentanil a été le premier opioïde à être administré presque exclusivement par perfusion continue. En raison de sa demi-vie terminale relativement courte, on prévoyait à l'origine que l'alfentanil avait un décalage rapide de l'effet après l'arrêt d'une perfusion continue. (42) Les progrès ultérieurs des connaissances pharmacocinétiques (c'est-à-dire le CSHT) ont prouvé que cette affirmation était fausse. ( 8) Cependant, l'alfentanil est en fait un médicament à action brève après une seule injection en bolus en raison de sa « fraction diffusible » élevée ; il atteint rapidement les concentrations maximales au site d'effet, puis commence à décliner (voir la discussion précédente sur la « Pharmacocinétique »). L'alfentanil illustre comment un médicament peut présenter différents profils pharmacocinétiques selon la méthode d'administration (c'est-à-dire, bolus versus perfusion continue). L'alfentanil, plus que le fentanyl ou le sufentanil, présente un métabolisme hépatique imprévisible en raison de la variabilité interindividuelle importante du CYP3A4 hépatique, la principale enzyme responsable de la biotransformation de l'alfentanil.
sufentanil
La caractéristique distinctive du sufentanil est qu'il s'agit de l'opioïde le plus puissant couramment utilisé dans la pratique de l'anesthésie. Parce qu'il est intrinsèquement plus efficace au niveau du récepteur opioïde, les doses absolues utilisées sont beaucoup plus faibles par rapport aux autres médicaments moins puissants (par exemple, 1000 fois moins que les doses de morphine).
rémifentanil
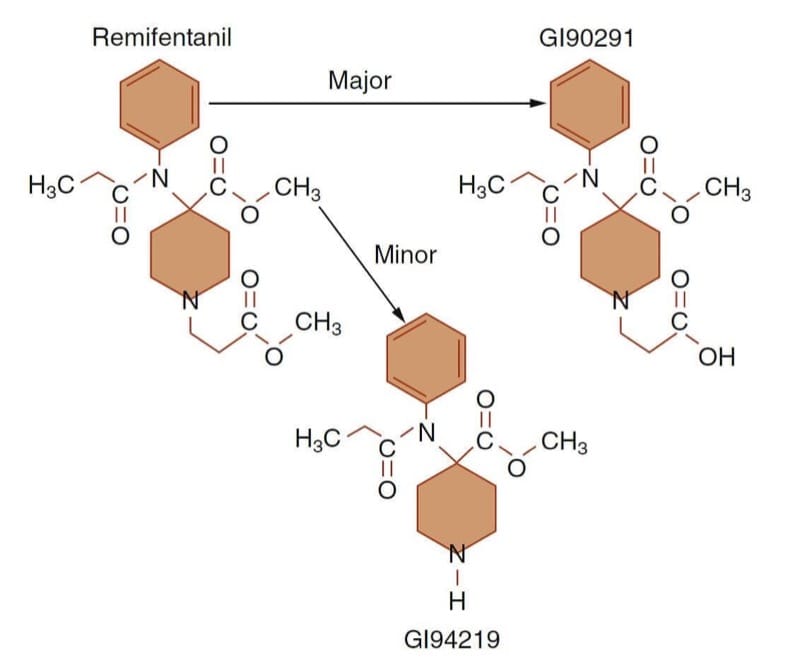
Le rémifentanil est un exemple prototype de la façon dont des objectifs cliniques spécifiques peuvent être atteints en concevant des molécules avec des relations spécialisées structure-activité (ou structure-métabolisme). En perdant son activité agoniste des récepteurs μ lors de l'hydrolyse de l'ester, il en résulte un opioïde à très courte durée d'action (Fig.10). (43) Le besoin perçu non satisfait à l'origine du développement du rémifentanil était d'avoir un opioïde avec un début et un décalage rapides afin que le médicament puisse être titré de haut en bas selon les besoins pour répondre aux besoins dynamiques du patient pendant les conditions d'anesthésie et de chirurgie en évolution rapide.
Par rapport aux congénères du fentanyl actuellement commercialisés, le CSHT du rémifentanil est court, de l'ordre d'environ 5 minutes. (44) D'un point de vue pharmacodynamique, le rémifentanil présente une courte latence jusqu'au pic d'effet similaire à l'alfentanil et une puissance légèrement inférieure à celle du fentanyl. (45)
Le rôle du rémifentanil dans la pratique de l'anesthésie moderne est maintenant relativement bien établi. Le rémifentanil est peut-être le mieux adapté aux cas dans lesquels son profil pharmacocinétique réactif peut être exploité à son avantage (p. ex., lorsqu'une récupération rapide est souhaitable ; lorsque les besoins anesthésiques fluctuent rapidement ; lorsque la titration des opioïdes est imprévisible ou difficile ou lorsqu'il existe un danger substantiel pour les opioïdes surdosage ou lorsqu'une technique opioïde « à forte dose » est avantageuse mais que le patient ne sera pas ventilé mécaniquement après l'opération)(46). Il est également couramment administré par un bolus intraveineux lorsqu'une très brève impulsion d'effet opioïde suivie d'une récupération rapide est souhaitée (par exemple, en préparation d'une injection d'anesthésique local pendant les soins d'anesthésie surveillés) (voir le chapitre sur l'anesthésie ambulatoire).

- Fig.10 Voie métabolique du rémifentanil. La désestérification (c'est-à-dire l'hydrolyse des esters) par des estérases plasmatiques et tissulaires non spécifiques en un métabolite acide inactif (GI90291) représente la grande majorité du métabolisme du rémifentanil. (Adapté de Egan TD, Huizinga B, Gupta SK, et al. Remifentanil pharmacokinetics in obese versus lean patients. Anesthesiology. 1998;89:562-573, utilisé avec permission.)
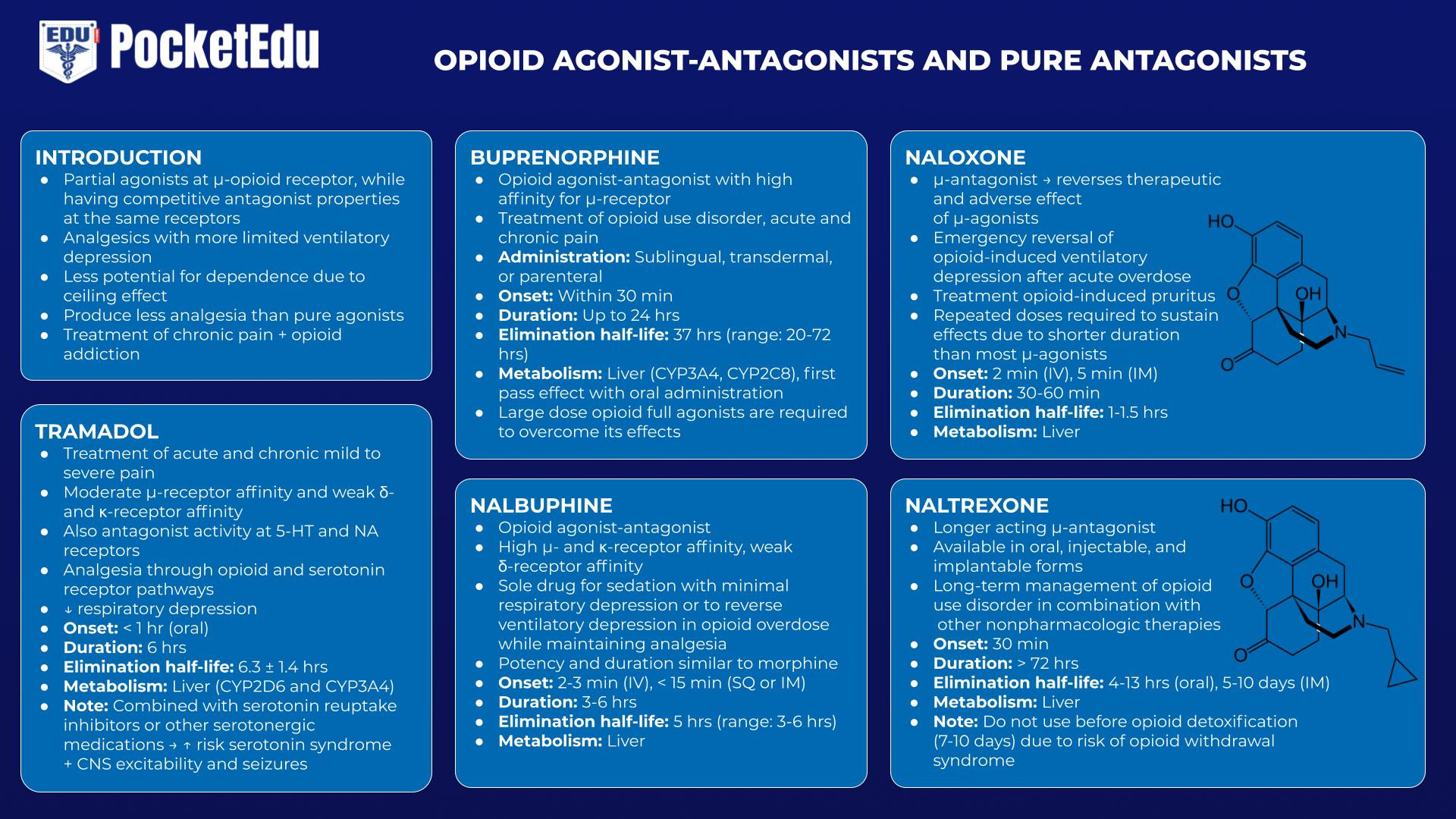
Agonistes-antagonistes opioïdes et antagonistes purs
Les agonistes-antagonistes opioïdes agissent comme des agonistes partiels au niveau du récepteur μ, tout en ayant des propriétés antagonistes compétitives au niveau des mêmes récepteurs. Ces médicaments servent d'analgésiques avec une dépression ventilatoire plus limitée et un moindre potentiel de dépendance car ils présentent un « effet plafond », produisant moins d'analgésie par rapport aux agonistes purs. Le potentiel d'abus plus faible était le principal besoin non satisfait perçu sous-jacent au développement de ces médicaments. Les médicaments de cette catégorie sont utilisés pour le traitement de la douleur chronique, ainsi que pour le traitement de la dépendance aux opioïdes. Ces médicaments provoquent un certain degré d'antagonisme compétitif lorsqu'ils sont administrés en présence d'une activité agoniste totale continue (par exemple, lorsqu'ils sont administrés après la morphine et d'autres agonistes purs). Les antagonistes opioïdes purs, dont la naloxone est le prototype, sont des antagonistes compétitifs complets du récepteur opioïde dépourvus de toute activité agoniste. Ces antagonistes purs sont utilisés dans la prise en charge des surdoses aiguës d'opioïdes et de l'abus chronique.
Tramadol
Le tramadol est un analgésique à action centrale avec une affinité modérée pour les récepteurs μ et une faible affinité pour les récepteurs κ et δ. Notamment, le tramadol a également une activité antagoniste au niveau des récepteurs de la 5-hydroxytryptamine (5-HT) et de l'acétylcholine nicotinique (NA). Tout en fournissant une analgésie par les voies des récepteurs opioïdes et de la sérotonine, le tramadol comporte moins de risque de dépression respiratoire. Cependant, lorsqu'il est combiné avec des inhibiteurs de la recapture de la sérotonine ou d'autres médicaments sérotoninergiques, il comporte un risque de syndrome sérotoninergique ainsi que d'excitabilité et de convulsions du SNC.(47)
La buprénorphine
La buprénorphine est un agoniste-antagoniste des opioïdes avec une forte affinité pour le récepteur μ. Il peut être administré par voie sublinguale, transdermique ou parentérale, mais subit un important métabolisme hépatique de premier passage avec l'administration orale. Bien que des doses modérées puissent être utilisées pour traiter la douleur chronique, des doses plus élevées utilisées dans le traitement de la douleur chronique peuvent antagoniser les effets d'autres opioïdes, rendant difficile le traitement de la douleur aiguë ou chronique. Parce qu'il se lie aux récepteurs opioïdes avec une telle affinité et que sa demi-vie d'élimination est de l'ordre de 20 à 72 heures, des agonistes complets opioïdes à forte dose sont nécessaires pour surmonter ses effets.(48)
Nalbuphine
Également agoniste-antagoniste des opioïdes, la nalbuphine a une puissance et une durée d'action similaires à la morphine. Il peut être utilisé comme médicament unique pour la sédation avec une dépression respiratoire minimale, ainsi que comme médicament pour inverser la dépression ventilatoire en cas de surdose d'opioïdes tout en maintenant une certaine analgésie.(49)
Naloxone/Naltrexone
La naloxone est un μ-antagoniste injectable qui annule à la fois les effets thérapeutiques et indésirables des μ-agonistes.(50) L'indication la plus courante de la naloxone est l'inversion d'urgence de la dépression ventilatoire induite par les opioïdes après une surdose aiguë. Son rôle important à cet égard a valu à la naloxone d'être inscrite sur la « Liste des médicaments essentiels » de l'Organisation mondiale de la santé. La naloxone est parfois utilisée à des doses beaucoup plus faibles lors de la sortie de l'anesthésie pour rétablir un effort ventilatoire adéquat et ainsi accélérer l'extubation de la trachée. Le traitement du prurit induit par les opioïdes (ne nécessitant que de petites doses) est une autre application thérapeutique courante.
Bien que la naloxone soit très efficace pour inverser la dépression ventilatoire associée aux opioïdes, elle a de nombreux effets indésirables, notamment le syndrome de sevrage aigu, les nausées, les vomissements, la tachycardie, l'hypertension, les convulsions et l'œdème pulmonaire, entre autres.(51) l'action est plus courte que celle de la plupart des μ-agonistes est un point clé dans la détermination du schéma posologique ; des doses répétées peuvent être nécessaires pour maintenir ses effets.
En réponse à l'épidémie d'abus d'opioïdes aux États-Unis, de nouveaux systèmes de livraison ont été développés qui sont destinés à une utilisation d'urgence par des profanes en cas de surdose d'opioïdes; ceux-ci comprennent les vaporisateurs nasaux et les préparations pour auto-injecteurs.(52,53)
La naltrexone, un μ-antagoniste des opioïdes à action plus longue disponible sous forme orale, injectable et implantable, est utilisée dans la prise en charge à long terme des toxicomanes aux opioïdes en association avec d'autres thérapies non pharmacologiques. (54)
3. APPLICATION CLINIQUE
Les opioïdes jouent un rôle vital dans pratiquement tous les domaines de la pratique de l'anesthésie. Dans le traitement de la douleur postopératoire, les opioïdes sont d'une importance primordiale, alors que dans la plupart des autres contextes de la médecine périopératoire, les opioïdes sont des compléments thérapeutiques utilisés en association avec d'autres médicaments.
Indications cliniques courantes
L'analgésie postopératoire est l'indication la plus ancienne du traitement aux opioïdes dans la pratique de l'anesthésie. À l'ère moderne, l'administration d'opioïdes via des dispositifs PCA est peut-être le mode d'administration le plus courant. Ces dernières années, les opioïdes sont de plus en plus associés en postopératoire à divers autres analgésiques, tels que les anti-inflammatoires non stéroïdiens (AINS), pour en accroître l'efficacité et la sécurité.
À l'échelle internationale, l'indication clinique la plus courante des opioïdes dans la pratique de l'anesthésie est leur utilisation pour ce que l'on appelle désormais l'anesthésie équilibrée. Ce terme peut-être erroné évoque l'utilisation de plusieurs médicaments (p. ex., anesthésiques volatils, bloqueurs neuromusculaires, sédatifs-hypnotiques et opioïdes) à des doses plus faibles pour produire l'état d'anesthésie. Avec cette technique, les opioïdes sont principalement utilisés pour leur capacité à diminuer la MAC. Une hypothèse de base sous-jacente à cette approche d'anesthésie équilibrée est que les médicaments utilisés en combinaison atténuent les inconvénients des médicaments individuels (c'est-à-dire les anesthésiques volatils) utilisés à des doses plus importantes en tant que thérapie médicamenteuse unique.
«L'anesthésie aux opioïdes à forte dose», une technique décrite à l'origine pour la morphine dans les premiers jours de la chirurgie à cœur ouvert (55) et plus tard associée aux congénères du fentanyl,(56) est une autre application courante des opioïdes en anesthésie clinique. Le fondement scientifique original de cette approche était que de fortes doses d'opioïdes permettaient au clinicien de réduire au minimum la concentration d'anesthésique volatil, évitant ainsi la dépression myocardique directe et d'autres effets hémodynamiques indésirables chez les patients dont le système cardiovasculaire était déjà compromis. De plus, le fentanyl produit souvent une bradycardie relative qui pourrait être utile chez les patients atteints d'ischémie myocardique. Bien que le concept général soit toujours appliqué, les doses d'opioïdes utilisées sont actuellement plus faibles. Les opioïdes sont également administrés pour leurs éventuels effets bénéfiques en termes de cardioprotection (c'est-à-dire de préconditionnement).
TIVA est une indication plus récente et de plus en plus populaire pour les opioïdes dans la pratique de l'anesthésie. Cette technique repose entièrement sur des médicaments intraveineux pour la fourniture d'une anesthésie générale. Le plus souvent, des perfusions continues de rémifentanil ou d'alfentanil sont associées à une perfusion de propofol. L'opioïde et le sédatif sont souvent administrés par des pompes activées par perfusion contrôlée (TCI). Un avantage évident de cette technique, peut-être parmi d'autres, est le bien-être amélioré du patient dans la période postopératoire précoce, y compris moins de nausées et de vomissements et souvent une sensation d'euphorie. (57)
Sélection et administration rationnelles des médicaments
Dans l'articulation d'une base scientifique pour la sélection rationnelle des opioïdes, les considérations pharmacocinétiques sont extrêmement importantes. En effet, les μ-agonistes (opioïdes) peuvent être considérés comme des égaux pharmacodynamiques avec d'importantes différences pharmacocinétiques(58). opioïde qui permet le mieux au clinicien d'y parvenir (dans le cadre de contraintes évidentes telles que des préoccupations pharmaco-économiques).
Lors de la sélection de l'opioïde approprié, parmi les questions clés à aborder, il y a la rapidité avec laquelle l'effet opioïde souhaité doit être atteint ? Combien de temps l'effet opioïde doit-il être maintenu ? Dans quelle mesure est-il essentiel que la dépression ventilatoire induite par les opioïdes ou la sédation se dissipent rapidement (p. ex., le patient sera-t-il ventilé mécaniquement après l'opération) ? La capacité d'augmenter et de diminuer rapidement le niveau d'effet opioïde pendant l'anesthésie est-elle critique ? Y aura-t-il une douleur importante après l'opération qui nécessitera un traitement aux opioïdes ? Toutes ces questions portent sur le profil temporel optimal de l'effet opioïde. Les réponses à ces questions sont abordées par l'application de concepts pharmacocinétiques.
Par exemple, lorsqu'une brève impulsion d'effet opioïde suivie d'une récupération rapide est souhaitée (par exemple, pour fournir une analgésie pour un bloc rétrobulbaire), un bolus de rémifentanil ou d'alfentanil peut être préféré. Lorsqu'un effet opioïde de longue durée est souhaité, par exemple lorsqu'il y aura une douleur postopératoire importante ou lorsque la trachée restera intubée, une perfusion de fentanyl est un choix prudent. Si le patient doit être éveillé et alerte peu de temps après la fin de la procédure (par exemple, une craniotomie dans laquelle les chirurgiens espèrent effectuer un examen neurologique en salle d'opération immédiatement après l'opération), une perfusion de rémifentanil pourrait être avantageuse.
La formulation d'une stratégie d'administration rationnelle nécessite également la bonne application des principes pharmacocinétiques. Un objectif important de tout schéma posologique est d'atteindre et de maintenir un niveau d'effet opioïde à l'état d'équilibre. De nos jours, afin d'atteindre une concentration à l'état d'équilibre au site d'action, les opioïdes sont fréquemment administrés par perfusion continue. Ceci est de plus en plus accompli grâce à l'utilisation de la technologie TCI, qui nécessite que le clinicien soit familiarisé avec le modèle pharmacocinétique approprié pour l'opioïde d'intérêt. Lorsque ces systèmes ne sont pas disponibles, le clinicien doit se rappeler que les perfusions doivent être précédées d'un bolus afin d'atteindre un état quasi stable en temps opportun.
4. DÉVELOPPEMENTS ÉMERGENTS
Opioïdes et récidive du cancer
L'influence de la thérapie aux opioïdes sur la récidive du cancer est controversée. Comme les effets immunosuppresseurs des opioïdes (en particulier la morphine) et leur impact sur l'angiogenèse ont été démontrés dans des études animales et in vitro, des inquiétudes concernant l'influence de ces médicaments sur la récurrence du cancer et la survie ont émergé. Certaines données rétrospectives précoces comparant les taux de récidive du cancer chez les patients recevant une analgésie opioïde postopératoire standard avec ceux recevant des techniques alternatives (p. d'autres études ont trouvé des résultats contradictoires. Une étude rétrospective de plus de 34,000 1996 patientes atteintes d'un cancer du sein de 2008 à 59 n'a démontré aucune association entre le traitement aux opioïdes et la récidive du cancer. (819) De même, une étude rétrospective de 60 patients atteints d'un carcinome hépatocellulaire ayant reçu soit du fentanyl intraveineux postopératoire, soit une péridurale postopératoire avec de la morphine n'a trouvé aucun effet sur la survie sans récidive.(XNUMX)
Cependant, d'autres études ont suggéré des résultats améliorés avec des techniques d'épargne des opioïdes. Une revue de 984 patients atteints d'un cancer du poumon non à petites cellules de 2006 à 2011 a révélé une amélioration de la survie et une survie sans maladie plus longue dans les stratégies de gestion de la douleur épargnant les opioïdes. (61) Ainsi, le rôle de la thérapie opioïde périopératoire dans la récidive du cancer reste controversé ; les essais en cours permettront d'affiner davantage la prise de décision clinique liée à l'anesthésie dans le traitement des patients oncologiques.
Épidémie d'abus d'opioïdes
Les décès liés à l'abus et au détournement d'opioïdes sur ordonnance ont explosé aux États-Unis et ailleurs. (62) En plus des décès, ce schéma généralisé de prescription et d'abus d'opioïdes illicites a entraîné une énorme augmentation des admissions dans les établissements de traitement de l'abus d'opioïdes. (63) La tendance peut être due, du moins en partie, aux pratiques de prescription d'opioïdes pour les douleurs chroniques qui peuvent prédisposer certains patients à la dépendance. (64,65)
L'épidémie a atteint un tel niveau de crise que les autorités gouvernementales fédérales et étatiques aux États-Unis ont promulgué une législation et mis de côté des fonds pour soutenir la recherche, la prévention et le traitement du problème. (66,67) La distribution de naloxone en pharmacie approuvée par l'État (sans ordonnance d'un médecin) pour les patients remplissant des ordonnances d'opioïdes est un exemple notable des efforts soutenus par une telle législation. (68) En outre, des sociétés professionnelles et les Centers for Disease Control and Prevention (CDC) ont produit de nouvelles lignes directrices pour la prescription d'opioïdes. (69) Il s'agit actuellement d'un domaine d'intenses discussions publiques et d'investigations médicales.
5. QUESTIONS DU JOUR
- Un patient a besoin d'une analgésie contrôlée par le patient (PCA) postopératoire. D'un point de vue pharmacocinétique, quels sont les avantages relatifs du fentanyl par rapport à la morphine pour une utilisation dans l'ACP ?
- Quel paramètre pharmacocinétique est le plus approprié pour décrire le temps de décalage d'une perfusion continue d'opioïdes ?
- Quels sont les effets des opioïdes sur la ventilation minute et la réponse ventilatoire au dioxyde de carbone ?
- Comment l'insuffisance rénale affecte-t-elle la pharmacocinétique de la morphine et de la mépéridine ?
- Un patient souffrant de dépression respiratoire postopératoire à cause de la morphine reçoit de la naloxone par voie intraveineuse. Quels sont les effets secondaires potentiels de la naloxone ?
- Quelles questions clés doivent être abordées lors de la sélection d'un opioïde pour une utilisation peropératoire ?