1.历史
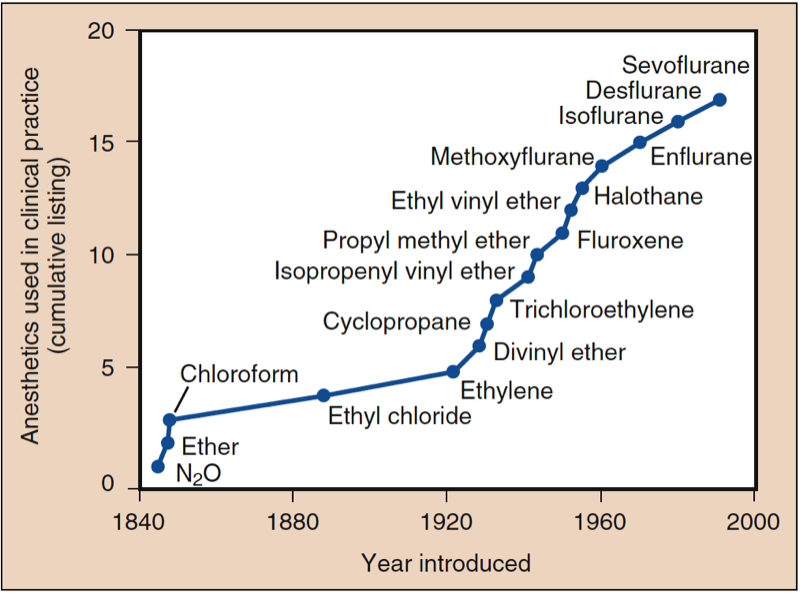
吸入麻醉的发现反映了美国和英国临床医生和科学家的贡献(图1)(1)。 现代麻醉中最常用的吸入麻醉剂包括挥发性液体(即氟烷、恩氟烷、异氟烷、地氟烷和七氟烷)和单一气体(即一氧化二氮)(图 2 和图 3)。 氟烷、安氟烷和异氟烷不再常用。 然而,这些吸入麻醉剂均不符合“理想”吸入麻醉剂的所有标准,而且药物之间的化学特性也各不相同。

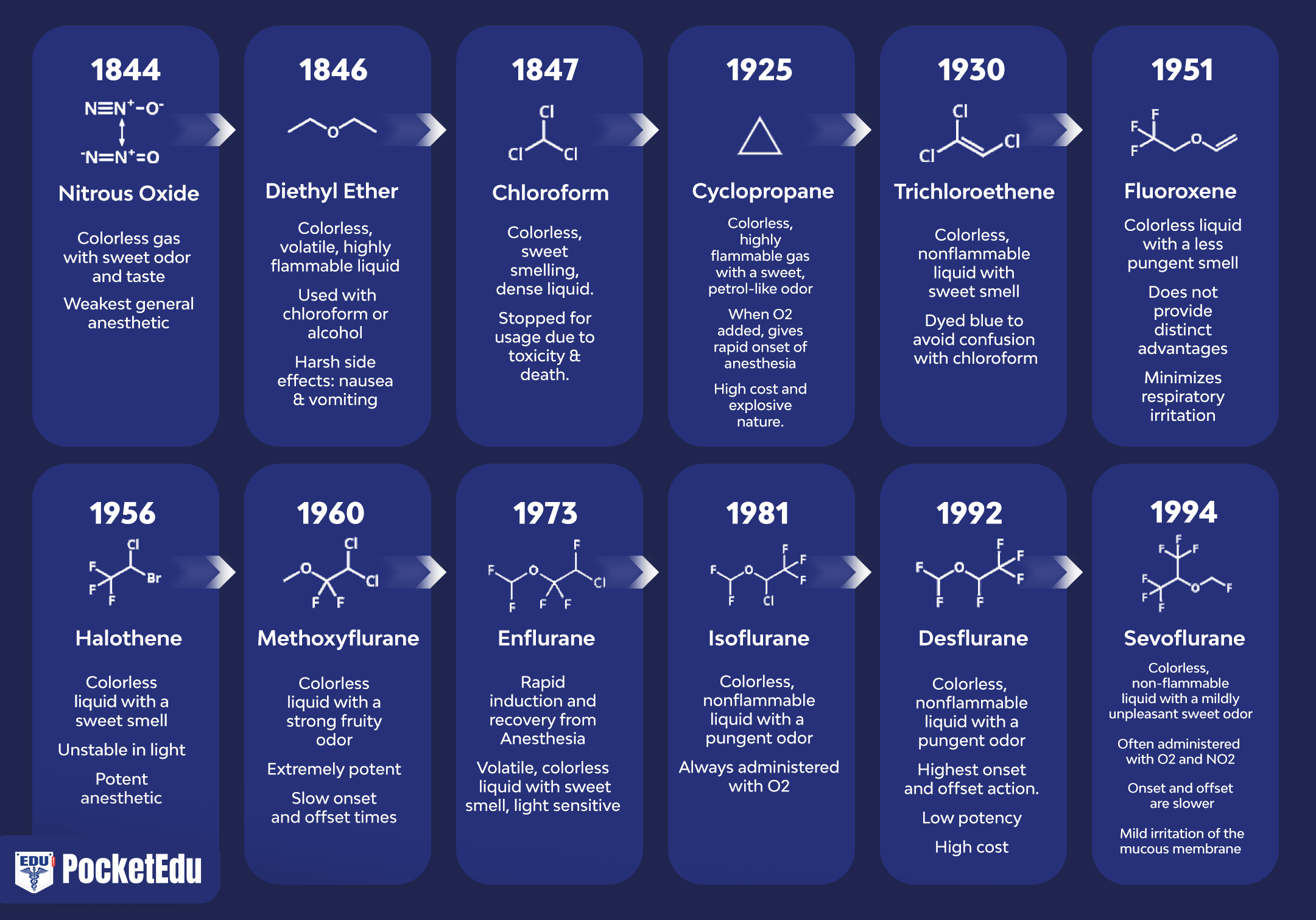
- 图 1. 临床实践中使用的麻醉剂。 麻醉的历史始于一氧化二氮 (N2O)、乙醚和氯仿的引入。 1950年后,除乙基乙烯基醚外,所有引进的药物都含有氟。 从氟烷开始引入的所有麻醉剂都是不易燃的。 (来自 Eger EI。Desflurane (Suprane):A Compendium and Reference。Nutley,NJ:Anaquest;1993:1,经许可使用。)

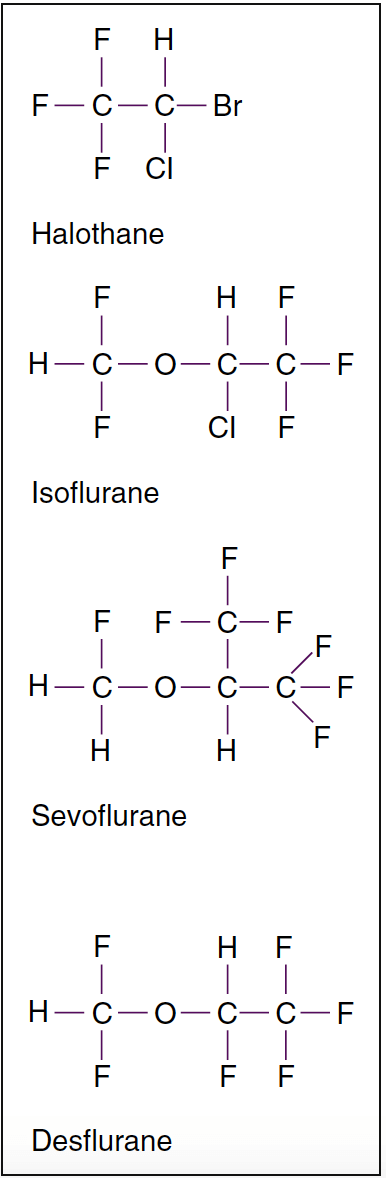
- 图 2. 强效挥发性麻醉剂的分子结构。 卤化挥发性麻醉剂在室温下是液体。 在挥发性麻醉剂中,氟烷是烷烃衍生物,其余均为甲乙醚衍生物。 异氟烷是安氟烷的化学异构体。

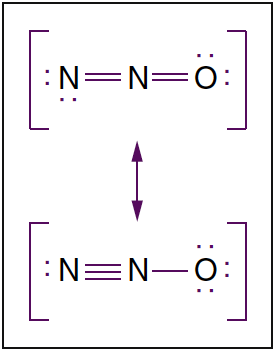
- 图 3. 一氧化二氮的分子结构。 一氧化二氮是存在于两个共振结构中的线性分子。 点表示非键合电子。
2. 第一次吸入麻醉药
笑气
一氧化二氮气体于 1772 年由英国化学家、作家和一神论牧师约瑟夫·普里斯特利 (Joseph Priestley) 首次合成。 42 年后,汉弗莱·戴维爵士 (Sir Humphry Davy) 使用一氧化二氮进行牙科镇痛。 尽管他怀疑一氧化二氮可能用于减轻手术疼痛,但直到 29 年后,一位名叫 Horace Wells 的 1842 岁牙医使用它给自己服用一氧化二氮,才发现它减轻了他的疼痛。 具体来说,他于 XNUMX 年在康涅狄格州哈特福德的一次公开展览中注意到一氧化二氮的催眠和镇痛作用。第二天,威尔斯自己接受了一位牙医同事的拔牙手术。 威尔斯在拔牙过程中只感到轻微的疼痛,随后他学会了合成一氧化二氮的方法,并将其提供给自己的患者。 两年后,他安排在马萨诸塞州综合医院演示使用一氧化二氮给药的无痛牙科手术。 由于没有完全成功,威尔斯因这次示威而名誉扫地。
乙醚
波士顿牙医威廉·莫顿 (William Morton) 注意到,在“乙醚嬉戏”期间,乙醚因其令人陶醉的效果而被吸入,其效果与一氧化二氮相似。 和威尔斯一样,莫顿在他的牙科诊所中使用了乙醚,然后于 16 年 1846 月 1842 日(“乙醚日”)在马萨诸塞州综合医院展示了它的麻醉特性。 与威尔斯的惨败形成鲜明对比的是,莫顿的演示受到了热烈欢迎。 乙醚麻醉成功的结果很快发表在波士顿医学和外科杂志上。 虽然 Crawford Long 在 4 年给病人注射乙醚,比莫顿早 XNUMX 年,但他没有公开他的工作,因此,传统上认为莫顿发现了乙醚产生麻醉的能力。
氯仿
来自苏格兰爱丁堡的产科医生詹姆斯·辛普森 (James Simpson) 开发了氯仿,这种氯仿没有二乙醚所见的长期诱导、易燃性和术后恶心。 氯仿作为吸入麻醉剂很快在英国流行开来,尽管二乙醚在北美的医疗实践中占主导地位。 不幸的是,氯仿与多起不明原因的术中死亡和许多肝毒性病例有关。
3. 1920 年至 1940 年间的吸入麻醉药
1920 年至 1940 年间,乙烯、环丙烷和二乙烯基醚被引入使用作为麻醉剂,通过产生更快、更令人愉快的麻醉诱导以及允许在手术的结论。 然而,每个都有严重的缺点。 许多是易燃的(即乙醚、二乙烯基醚、乙烯和环丙烷),而其他完全被氯卤化的是有毒的(即氯仿、氯乙烷和三氯乙烯)。
4. 氟化学和现代吸入麻醉剂
氟化学技术从生产第一批原子武器的努力中发展而来,发现了一个偶然的、对社会有益的目的,即提供一种合成现代吸入麻醉剂的方法 (2,3)。 现代吸入麻醉剂部分或全部被氟卤化(见图 2)。 氟化提供更高的稳定性和更小的毒性。
氟烷
氟烷于 1956 年引入临床实践并得到广泛应用。 与较早的麻醉剂相比,它有几个优点,包括不易燃、气味宜人、器官毒性较小以及与乙醚相比可以更快地诱导麻醉和苏醒的药代动力学特性。 不幸的是,在商业使用 4 年后,氟烷麻醉后暴发性肝坏死的报告开始出现在其他肝损伤原因不明显的患者身上。 不可预测的肝损伤问题刺激了对其他挥发性麻醉剂的研究。 氟烷还使心肌对儿茶酚胺的致心律失常作用敏感。
甲氧基氟烷
甲氧氟烷于 1960 年首次引入临床实践。在其引入的头十年内,出现了甲氧氟烷麻醉导致肾衰竭的报告,导致研究证实由于这种麻醉剂代谢产生的无机氟化物会导致剂量相关的肾毒性。
安氟醚
恩氟烷于 1972 年引入临床实践。与氟烷不同,它不会使心脏对儿茶酚胺敏感,并且与肝毒性无关。 然而,恩氟烷会被代谢为无机氟化物,并可能导致脑电图 (EEG) 出现癫痫发作活动,尤其是在高浓度给药和存在低碳酸血症的情况下。
异氟醚
异氟醚于 1980 年引入临床实践,并在临床上得到广泛应用。 它与心律失常无关。 因为它不像氟烷和恩氟烷那样容易代谢,所以异氟烷的毒性较小。 与它的前身相比,异氟醚可以更快地开始手术麻醉和更快地苏醒。
七氟醚和地氟醚
七氟醚和地氟醚仅用氟卤化,分别在 1960 世纪 1970 年代后期和 2,3 年代首次合成 (1980)。 两者都很昂贵且难以合成,因此没有立即考虑用于商业用途。 在 XNUMX 年代,根据一种新的认识重新考虑了它们的发展,即越来越多的麻醉实践在门诊进行,并且仅用氟卤化的药物在血液和组织中的溶解度较低,从而可以更快地苏醒和恢复。
5. 作用机制
吸入麻醉剂如何产生麻醉状态的问题可能在生物组织的许多层面上得到解决,包括它们在中枢神经系统中的作用位置、它们相互作用的分子以及这种生物相互作用的性质。 回答这些问题需要能够测量麻醉效果 (4)。 尽管吸入麻醉药用于手术麻醉已有近 160 年的历史,但对于什么构成麻醉状态,还没有一个单一的、公认的定义。 出于实验目的,对手术刺激和术中事件遗忘反应的不动的操作定义已被证明是有用的。
可测量的特征
所有吸入麻醉剂的可测量和普遍特征包括不动和记忆删除效应的产生。 不动性是通过抑制 50% 患者向手术切口移动所需的麻醉剂最低肺泡浓度 (MAC) 来衡量的 (2,5)。 然而,健忘症或意识的存在很难保证。 尽管镇痛是麻醉状态的一部分,但也无法在无法记忆的不动患者身上进行测量。 疼痛的替代指标(即增加心率或全身动脉血压)表明吸入麻醉剂不会抑制疼痛刺激的感知。 一些吸入麻醉剂在低浓度下具有痛觉过敏(疼痛增强)作用。 骨骼肌松弛是吸入麻醉剂的一种常见但不普遍的中枢作用,一氧化二氮可以增加骨骼肌张力。
不动
强效吸入麻醉剂主要通过它们对脊髓的作用来产生不动,正如去大脑动物中 MAC 的测定所证明的那样 (6)。 对啮齿动物的研究表明,一氧化二氮会激活起源于导水管周围灰质脑干的下行去甲肾上腺素能通路,进而抑制脊髓背角的伤害感受输入 (7,8)。
记忆删除效果
杏仁核、海马体和皮质等脊柱上结构被认为是麻醉剂遗忘效应的极有可能目标。
中枢神经系统抑制和离子通道
吸入麻醉药通过其对离子通道的作用产生中枢神经系统抑制,离子通道控制神经系统的电行为 (4)。 吸入麻醉剂可能通过增强抑制性离子通道的功能和阻断兴奋性离子通道的功能来产生麻醉作用。 增强抑制性离子通道的功能会导致神经元超极化。 当氯阴离子通过 γ-氨基丁酸 A (GABAA) 受体或甘氨酸受体进入神经元时,或者当钾阳离子通过钾离子通道流出神经元时,就会产生超极化。 阻断兴奋性离子通道的功能可防止正电荷进入神经元(即钠离子通过 N-甲基-D-天冬氨酸 [NMDA] 受体或钠通道),从而防止神经元去极化。 麻醉剂也可能影响神经递质的释放,这种作用可能部分由调节神经递质释放的离子通道介导。
6. 物理特性
分子结构
现代吸入麻醉剂,除一氧化二氮外,都是卤代烃。 氟烷缺乏存在于异氟醚、七氟醚和地氟醚上的醚部分,因此它能够产生室性心律失常。 异氟醚和地氟醚的区别仅在于一个氯原子取代了氟。 氟取代赋予了更高的稳定性和对新陈代谢的抵抗力。
蒸气压和输送
一氧化二氮在环境温度下以气体形式存在,但在较高压力下会变成液体。 其余的吸入麻醉剂在环境温度下是液体。
可变旁路汽化器
氟烷、七氟烷和异氟烷由可变旁路蒸发器(Tec 4、5 和 7;北美 Draeger 19.n 和 20.n)输送。 可变旁路蒸发器包含两股流入的新鲜气体——一股接触液体麻醉剂的储液槽(贮槽),另一股绕过贮槽。 在麻醉剂的饱和蒸气压的控制下,穿过贮槽的气流变得充满麻醉剂。 因为挥发性麻醉剂在远低于其饱和蒸气压的分压下产生临床上有用的麻醉,所以离开贮槽的气体必须被未与麻醉剂接触的气体稀释。 离开汽化器的气体中麻醉剂的浓度由通过贮槽通道与旁路通道的新鲜气体的相对流量(即分流比)决定。 当临床医生调整蒸发器刻度盘或电子控制时,就会控制离开蒸发器的麻醉剂输出浓度。 可变旁路蒸发器具有温度补偿功能,可在很宽的温度范围内保持恒定的输出,并根据不同的蒸气压针对每种麻醉剂进行校准。 如果麻醉剂蒸汽进入旁路通道,蒸发器倾斜或过度填充可能会导致输送过量的麻醉剂。
用于 Datex-Ohmeda 麻醉输送装置 (ADU) 机器的 Datex-Ohmeda Aladin 盒式汽化器是一个单一的电子控制汽化器,其旁路安装在 ADU 内,集液槽位于可互换的磁性编码盒内,用于输送氟烷,恩氟醚、异氟醚、七氟醚和地氟醚。 Aladin 利用可变旁路作为调节输出浓度的手段,通过中央处理器 (CPU) 的活动来实现。 CPU 从多个来源接收输入,包括浓度设置、流量计以及内部压力和温度传感器,然后调节蒸发室出口处的流量控制阀。 如果盒(集水槽)中的压力超过旁路室中的压力(如果在地氟醚给药期间室温超过 22.8°C,则会发生这种情况),则单向止回阀设计为关闭,以防止麻醉饱和气体逆流回流到ADU 伴随随后的麻醉剂过量。
加热蒸发器
地氟醚在海平面的蒸气压在 700°C 时为 20 mm Hg(室温下接近沸腾状态),通过可变旁路蒸发器输送会产生不可预测的浓度。 出于这个原因,使用专门设计的蒸发器(Tec 6,Datex-Ohmeda)将地氟醚气体加热到 2 个大气压的压力,以根据麻醉提供者对浓度刻度盘的调整来准确计量和输送地氟醚蒸气。 与可变旁路汽化器相比,Tec 6 的地氟醚输出浓度在一定气压范围内是恒定的 (9)。 因此,在高海拔地区,在给定的 Tec 6 挥发罐设置和输出(体积百分比)浓度下,地氟醚的分压将低于海平面,导致麻醉剂量不足,除非针对更高的海拔地区进行调整:所需汽化器设置 =(海平面所需汽化器设置 × 760 毫米汞柱)/当地气压(毫米汞柱)(10)。 可变旁路汽化器可能会发生相反的情况(更大的输出)。 然而,麻醉活性的药理学相关定量参数是分压,而不是体积百分比。 因此,尽管对于相同的蒸发器设置,蒸发器的麻醉输出在更高的海拔高度发生,但与蒸发器设置相关的两个位置的输送分压和麻醉效果将相似。
经济和环境考虑
新鲜气体流速直接影响挥发性液体的使用量,进而影响麻醉剂输送的成本。 更高的新鲜气体流量(等于或高于每分钟通气量)最大限度地减少再呼吸,并允许在吸入分压和中枢神经系统 (CNS) 分压之间更快地达到平衡。 然而,使用非再呼吸流量会导致麻醉剂流失到环境中,因此只能在有限的几分钟内使用,通常是在麻醉诱导时,或在轻度镇静和即将进行手术刺激的情况下。 人们越来越意识到吸入麻醉剂释放对总体温室气体排放和气候变化的影响。 潜在的环境影响似乎源于大气寿命气体,以及每种麻醉剂独特的红外吸收光谱。 吸入麻醉剂在大气中的寿命存在很大差异(一氧化二氮、地氟醚、七氟醚和异氟醚的估计寿命分别为 114、10、3.6 和 1.2 年)。 个体的红外吸收光谱不同,地氟醚相对具有最大的二氧化碳当量影响,而七氟醚具有最低的二氧化碳当量影响。 尽管吸入麻醉剂对整体气候变化的影响仍然是一个有争议的话题,但有几点值得考虑。 首先,使用低新鲜气体流量(0.5-1 升/分钟)将抵消成本和排放到环境中。 其次,开发回收和再利用麻醉剂的系统有望进一步限制环境影响并节省资金 (11)。
稳定性
通过新陈代谢或与二氧化碳吸收剂(尤其是在干燥时)的相互作用引起的麻醉降解会产生几种潜在的有毒化合物 (11)。
代谢和降解
甲氧氟醚会产生无机氟化物,这是过去长时间麻醉后零星发生肾毒性(即高输出性肾功能衰竭)的原因。 七氟烷分解产生的化合物 A(即氟甲基-2,2-二氟-1-[三氟甲基]乙烯基醚)和氟烷产生的类似化合物在长期接触后对动物具有肾毒性。 在人类中,长时间使用七氟烷麻醉和低新鲜气体流量(1 升/分钟)会导致化合物 A 暴露足以产生短暂的蛋白尿、酶尿和糖尿,但没有证据表明血清肌酐浓度升高或长期有害影响关于肾功能。 尽管如此,七氟醚的包装说明书建议将低新鲜气体流量(<2 L/min)限制在七氟醚麻醉时间少于 2 MAC 小时(即 MAC 浓度 × 给药持续时间)。
二氧化碳吸收剂和放热反应
影响暴露于二氧化碳吸收剂的挥发性麻醉剂降解量的变量包括吸收剂的条件(即水合作用和温度)和化学成分、新鲜气体流速、每分钟通气量,以及最重要的麻醉剂本身 (12) . 尽管地氟醚和异氟醚在温度高达 60°C 以上的水合二氧化碳吸收剂中非常稳定,但无论温度如何,含有氢氧化钠和氢氧化钾的常规二氧化碳吸收剂的完全干燥都会导致降解并从所有挥发性麻醉剂中产生一氧化碳。 高新鲜气体流速(尤其是那些超过正常每分钟通气量的流速)会加速吸收剂的干燥,而干燥会导致加速降解。 因为降解是一个放热过程,所以吸收剂温度可能会急剧升高。
干燥的二氧化碳吸收剂与挥发性麻醉剂(尤其是七氟烷)相互作用导致的放热反应会在吸收剂罐内产生极高的温度 (13,14)。 温度升高可能导致罐或麻醉回路中的爆炸和火灾。 采取措施确保二氧化碳吸收剂保持足够的水合作用(即定期更换吸收剂、在无人值守的麻醉机上调低或关闭新鲜气体流量、限制新鲜气体麻醉期间的气体流速,以及当对吸收剂的水合作用有疑问时,改变它)。 具有减少或不存在单价碱(即氢氧化钠和氢氧化钾)的市售二氧化碳吸收剂在暴露于挥发性麻醉剂时不会发生广泛降解,无论吸收剂水合状态如何。
7. 吸入麻醉药的相对效力
吸入麻醉剂之间的相对效力最常见的描述是抑制 50% 的患者对手术切口做出反应所需的运动 (5)。 该剂量(剂量反应曲线上的一个点)被指定为 MAC。 由于 MAC 的标准偏差约为 10%,95% 的患者不应因吸入麻醉剂 1.2 MAC 时的切口而移动,并且 99% 的患者不应因吸入麻醉剂 1.3 MAC 时的切口而移动. MAC 受多个变量的影响,但不受性别或手术和麻醉持续时间的影响。
MAC 允许比较麻醉剂之间的效力; 1.15% 的异氟醚与 6% 的地氟醚在防止年龄和体温相似的患者因手术切口而引起的运动方面是等效的。 值得注意的是,不同吸入麻醉剂的 MAC 值是相加的。 例如,0.5 MAC 的一氧化二氮与 0.5 MAC 的异氟醚一起给药与 1 MAC 的任何吸入麻醉剂在防止切口响应运动方面具有相同的效果(反映麻醉剂诱导的脊髓水平反射反应抑制)( 6). 防止对手术切口做出反应所需的大脑麻醉剂浓度可能大于 MAC。
产生健忘症所需的麻醉剂剂量可能比 MAC 具有更大的可变性。 阻止回忆语言刺激的异氟醚肺泡浓度在 0.20% 的志愿者中为 50 MAC,在 0.40% 的志愿者中为 95 MAC (15)。 假设剂量反应呈标准正态分布,则防止回忆的最低浓度的标准差因此约为平均值的一半 (0.1 MAC)。 参照标准正态曲线,我们可以计算出,麻醉需求最高的 1 名受试者中有 100,000 名受试者需要的浓度比平均值高 4.27 个标准差 (SD)(即大于 0.627 MAC)以防止回忆言语刺激。 然而,必须谨慎地将此值外推到手术环境中,因为与语言刺激相比,防止回忆疼痛所需的剂量可能要大得多 (16)。 防止对手术切口的运动反应(反映在 MAC 中)所需的浓度与抑制意识和防止回忆所需的浓度之比在单独的强效吸入麻醉剂之间略有不同,并且在强效吸入麻醉剂集体与一氧化二氮之间存在显着差异。 给予异氟醚的志愿者在给予 0.45 MAC 的异氟醚时没有表现出回忆,而在给予多达 0.6 MAC 的一氧化二氮时确实发生了回忆 (17)。
8. 吸入麻醉药的药代动力学
吸入麻醉药的药代动力学描述了它们从肺泡摄取(吸收)到全身循环、在体内的分布,以及最终被肺部消除或主要在肝脏中代谢。 通过控制吸入麻醉剂的吸入分压 (PI)(与气相中的浓度 [%] 相同),会产生一个梯度,使麻醉剂从麻醉机输送到其作用部位,脑。 吸入麻醉的主要目标是实现麻醉剂的恒定和最佳脑分压 (Pbr)。
大脑和所有其他组织与动脉血输送给它们的吸入麻醉剂的分压 (Pa) 保持平衡。 同样,血液与麻醉剂的肺泡分压 (PA) 平衡:
PA ⇄ Pa ⇄ Pbr
保持恒定和最佳的 PA 成为控制 Pbr 的间接但有用的方法。 吸入麻醉剂的 PA 反映了它的 Pbr,这也是 PA 被用作麻醉深度指标、麻醉诱导和恢复率的反映,以及等效效力的衡量标准的原因(参见前面“相对效力”下的讨论吸入麻醉剂”)。 了解决定 PA 和 Pbr 的因素可以让麻醉师巧妙地控制和调整输送到大脑的吸入麻醉剂的剂量。
决定肺泡分压的因素
吸入麻醉剂的 PA 和最终的 Pbr 由输入(输送)到肺泡中减去药物从肺泡到肺动脉血液中的摄取(损失)来确定。 吸入麻醉剂的输入取决于 PI、肺泡通气量 ( ˙VA) 和麻醉呼吸系统的特性。 吸入麻醉剂的吸收取决于溶解度、心输出量 (CO) 和肺泡-静脉分压差 (PA - Pv)。 这六个因素同时起作用来确定 PA。 吸入麻醉剂的代谢和经皮损失不会显着影响麻醉诱导和维持期间的 PA。
吸入麻醉分压
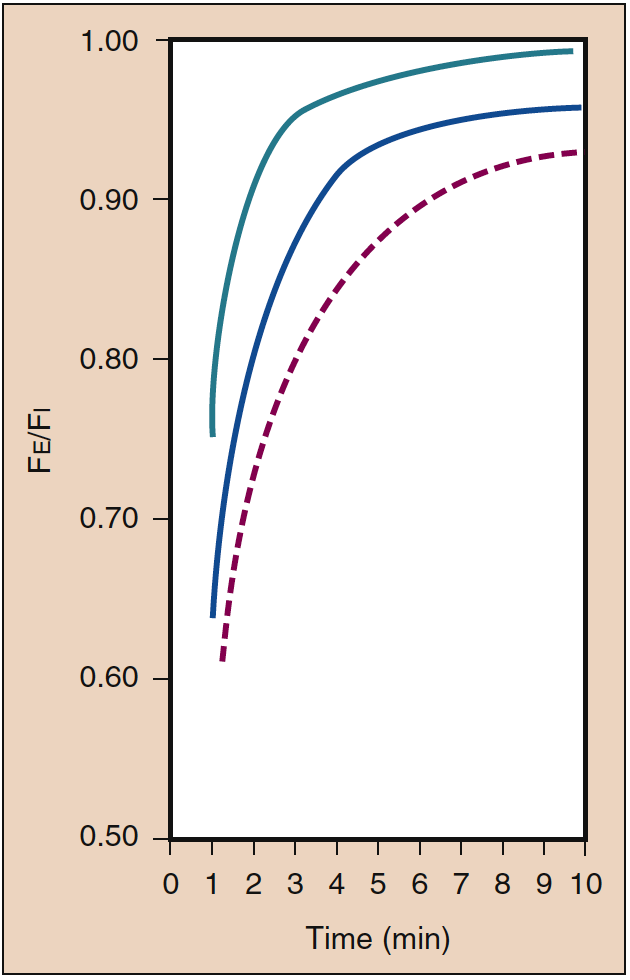
在吸入麻醉剂的初始给药期间需要高 PI。 这种初始的高 PI(即输入)抵消了吸收到血液中的影响,并加速了麻醉的诱导,如 PA 的增加速率所反映的那样。 PI 的这种效应称为浓度效应。 在临床上,产生浓度效应所需的浓度范围可能只有一氧化二氮才有可能(图 4)(19)。

- 图 4. 吸入浓度 (%) (Fi) 对肺泡(呼气末)浓度 (Fe) 增加速率的影响称为浓度效应。 线条表示浓度为 85%(绿色)、50%(蓝色)和 10%(红色虚线)。 (来自 Eger EI。吸入麻醉药浓度对肺泡浓度上升率的影响。麻醉学。1963;24:153-157,经许可使用。)
随着时间的推移,随着血液吸收的减少,PI 应该降低以匹配减少的麻醉剂吸收。 如果麻醉提供者要实现维持恒定和最佳 Pbr 的目标,则降低 PI 以匹配随时间减少的摄取是至关重要的。 例如,如果 PI 随时间保持恒定(输入常数),则 PA(和 Pbr 反映的麻醉深度)将随着麻醉剂进入血液的吸收随时间减少而逐渐增加。
二次气体效应
第二种气体效应是一种独立于浓度效应而发生的独特现象。 大量吸收一种气体(第一种气体)以加速同时施用的伴随气体(第二种气体)的 PA 增加速率的能力被称为第二种气体效应。 例如,一氧化二氮最初的大量吸收加速了伴生气体如挥发性麻醉剂和氧气的吸收。 伴随氧化亚氮给药早期阶段的 PaO10 瞬时增加(约 2%)反映了氧化亚氮对氧气的第二种气体效应。 PaO2 的这种增加被指定为肺泡氧合过度。 所有吸入气体(即第一种和第二种气体)的气管流入增加以及第二种气体在较小肺容积中的浓度(即集中效应)是因为第一种气体的大量吸收是第二种气体的解释影响。 尽管第二种气体效应是基于已证实的药代动力学原理,但其临床重要性值得怀疑。
肺泡通气
˙VA 的增加与 PI 一样,促进吸入麻醉剂的输入以抵消吸收到血液中。 净效应是 PA 和麻醉诱导的增加速度更快。 可以预见的是,通气不足会产生相反的效果,减缓麻醉的诱导。
导致过度通气和静脉回流减少的肺部受控通气通过增加输入(即增加 ˙VA)和减少摄取(即减少 CO)加速 PA 的增加速度。 因此,在肺部控制通气期间麻醉剂过量的风险可能会增加,并且当肺部通气从自主通气变为控制通气以维持与目前相似的 PA 时,降低挥发性麻醉剂的 PI 可能是适当的在自主通气期间。
过度通气的另一个影响是脑血流减少,因为 PaCO2 会相应降低。 可以想象,增加麻醉剂输入对 PA 增加率的影响将被减少的麻醉剂输送到大脑所抵消。 理论上,冠状动脉血流量可能保持不变,因此增加麻醉剂输入会导致心肌抑制,而脑血流量减少会阻止中枢神经系统抑制的伴随发作。
麻醉呼吸系统
影响 PA 增加速率的麻醉呼吸系统的特性包括系统体积、吸入麻醉剂在系统橡胶或塑料部件中的溶解度以及从麻醉机流入的气体。 麻醉呼吸系统的容量充当缓冲器以减缓 PA 的实现。 来自麻醉机的大量气体流入抵消了这种缓冲作用。 吸入麻醉剂在麻醉呼吸系统组件中的溶解度最初会减慢 PA 增加的速度。 在麻醉结束时,麻醉呼吸系统中分压梯度的逆转导致麻醉剂洗脱,从而减慢 PA 下降的速度。
可溶性
吸入麻醉药在血液和组织中的溶解度用分配系数表示。 分配系数是一种分配比,描述了吸入麻醉剂如何在平衡的两相之间分配(当分压相同时)。 例如,血气分配系数为 10 表示吸入麻醉剂在血液中的浓度为 10,在肺泡气体中的浓度为 1,此时该麻醉剂在这两个阶段的分压相同。 分配系数与温度有关。 例如,当液体温度降低时,气体在液体中的溶解度增加。 除非另有说明,分配系数针对 37°C 给出。
血气分配系数
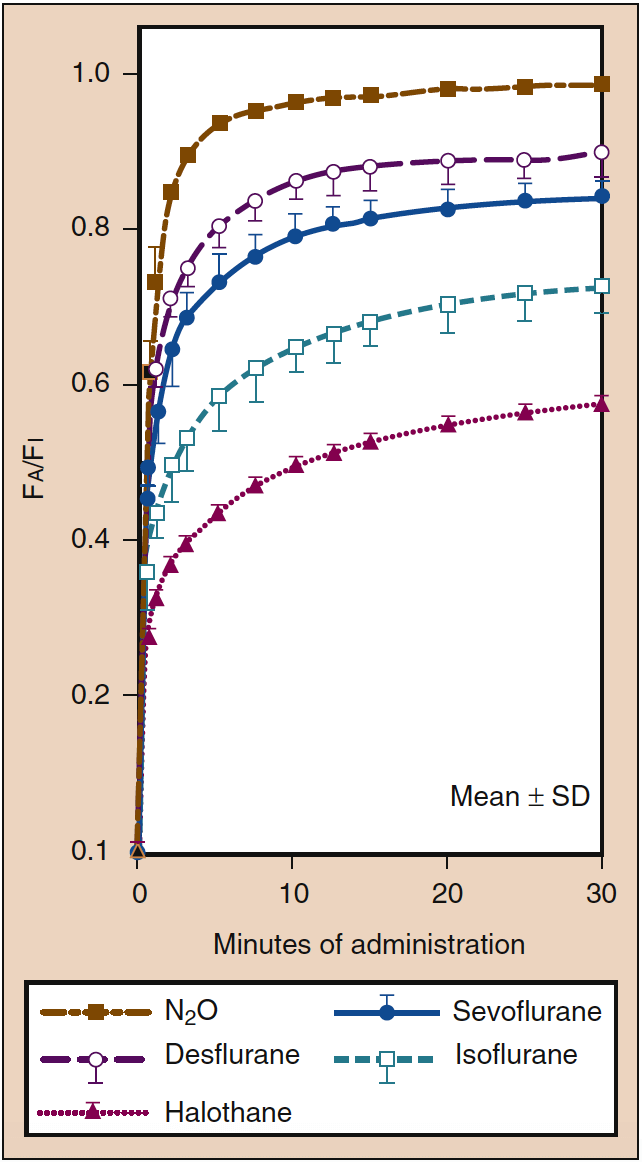
高血溶性意味着大量吸入的麻醉剂必须在与气相达到平衡之前溶解(即吸收)在血液中。 血液可以被认为是一个药理学上无活性的储库,其大小由麻醉剂在血液中的溶解度决定。 当血气分配系数高时,在 Pa 与 PA 达到平衡之前,必须有大量的麻醉剂溶解在血液中(图 5)(18)。 临床上,高血溶性对PA增加速率的影响可以通过增加PI在一定程度上抵消。 当血液溶解度低时,在达到平衡之前必须将最少量的麻醉剂溶解在血液中,这样 PA 以及 Pa 和 Pbr 的增加率就会很快(见图 5)(20)。

- 图 5. 血气分配系数是肺泡浓度 (Fa) 向恒定吸入浓度 (Fi) 增加速率的主要决定因素。 麻醉诱导的速度与 Fa 的增加速度平行。 尽管血液溶解度相似(见表 1),一氧化二氮(棕金色虚线)的 Fa 增加速度比地氟醚(紫色虚线)或七氟醚(蓝色实线)更快,反映了浓度对一氧化二氮的影响(见图 4)。 与一氧化二氮相比,地氟醚和七氟醚更大的组织溶解度也可能导致这些药物的 Fa 增加速度更慢。 SD,标准差。 (来自 Yasuda N、Lockhart SH、Eger EI II 等人。七氟醚和异氟醚在人体中的动力学比较。Anesth Analg。1991;72:316-324,经许可使用。)
组织-血液分配系数
组织-血液分配系数决定了组织与 Pa 平衡所需的时间(见表 1)。 这个时间可以通过计算每个组织的时间常数(即,可以溶解在组织中的吸入麻醉剂的量除以组织血流量)来预测。 挥发性麻醉剂(如异氟醚)的脑血分配系数导致时间常数约为 3 至 4 分钟。 任何组织(包括大脑)与 Pa 的完全平衡需要至少三个时间常数。 这是在假设 Pbr 相似之前将此挥发性麻醉剂的 PA 保持 10 至 15 分钟的基本原理。 溶解性较差的麻醉剂,如一氧化二氮、地氟醚和七氟醚的时间常数约为 2 分钟,在大约 6 分钟内达到完全平衡(即三个时间常数)。
通过组织间扩散进行麻醉转移
越来越多的证据表明,一部分麻醉剂的吸收可能不是通过血液流向各种组织,而是通过从对麻醉剂亲和力较低的组织到较高的组织(即从瘦组织到脂肪组织)的直接转移,例如内脏之间的界面和网膜脂肪(参见“上下文敏感的半场”)。 较大的人 (21) 和动物 (22) 可能具有更大的瘦脂肪表面积界面显示出更多的七氟醚和异氟醚摄取。 在临床实际持续时间(少于 12 至 24 小时)的麻醉期间通过血流转移到大块脂肪不太可能解释这些差异,因为大块脂肪室接收的血流量相对较小且其尺寸相对较大。
一氧化二氮和甲硫氨酸合酶失活
一氧化二氮在麻醉剂中是独一无二的,因为它会使甲硫氨酸合成酶失活,这种酶调节维生素 B12 和叶酸代谢。 尽管酶失活对许多患者的影响可能是微妙的或亚临床的,但那些患有潜在危重疾病或先前存在维生素 B12 缺乏症的患者可能会遭受神经系统或血液系统后遗症。 同型半胱氨酸需要功能性甲硫氨酸合酶才能转化为甲硫氨酸,当其在血液中的浓度升高时,会增加不良冠状动脉事件的风险 (23)。 与未接受一氧化二氮的患者相比,在颈动脉内膜切除术期间接受一氧化二氮的患者显示出显着升高的同型半胱氨酸水平和心肌缺血发作的频率 (24)。
一氧化二氮转移到封闭的气体空间
一氧化二氮的血气分配系数 (0.46) 是氮气 (34) 的 0.014 倍。 这种不同的溶解度意味着一氧化二氮离开血液进入充满空气的腔体的速度比氮气离开腔体进入血液的速度快 34 倍。 由于一氧化二氮的这种优先转移,充气腔的体积或压力增加。 一氧化二氮进入由顺应性壁包围的充满空气的空腔(例如,肠气、气胸、肺大泡、空气栓塞)导致气体空间膨胀。 相反,一氧化二氮进入由不顺应壁(例如,中耳、脑室、幕上硬膜下腔)包围的充满空气的空腔会导致压力增加。
充气腔中体积或压力增加的幅度受一氧化二氮的 PA、流向充气腔的血流和一氧化二氮给药持续时间的影响。 在动物模型中,吸入 75% 的一氧化二氮可在 10 分钟内使气胸体积增加一倍 (25)。 闭合性气胸的存在是一氧化二氮给药的禁忌症。 对有胸部外伤史(即肋骨骨折)的患者使用一氧化二氮时,肺部顺应性降低可能反映了一氧化二氮引起的先前未被识别的气胸扩大。 同样,与静脉空气栓塞相关的气泡在暴露于一氧化二氮时会迅速膨胀。 与气胸或气泡(即静脉空气栓塞)的快速膨胀相反,一氧化二氮产生的肠气体积增加缓慢。 如果手术时间短,是否对接受腹内手术的患者使用一氧化二氮的问题并不重要。 然而,当术前肠气体量增加(例如,肠梗阻)时,将一氧化二氮的吸入浓度限制在 50% 可能是一个谨慎的建议。 按照这个指南,即使在长时间的手术中,肠气量最多也会增加一倍 (25)。
心输出量
CO 通过从肺泡中带走或多或少的麻醉剂来影响肺动脉血液的吸收,从而影响 PA。 高 CO(例如,由焦虑引起)导致更快速的吸收,从而减慢 PA 的增加速率和麻醉的诱导。 低 CO(例如,休克)会加快 PA 的增加速度,因为血液中吸收较少以对抗输入。 一个普遍的临床印象是休克患者的麻醉诱导是迅速的。
分流
从右向左的心内或肺内分流会减慢麻醉诱导的速度。 这种减慢反映了不含麻醉剂的分流血液对来自通气肺泡的血液中麻醉剂分压的稀释作用。 在存在右向左分流的情况下,PaO2 降低的原因是类似的机制。
左向右分流(例如,动静脉瘘、挥发性麻醉剂引起的皮肤血流量增加)导致输送到肺部的静脉血含有比流过静脉血中更高的麻醉剂分压纸巾。 因此,左向右组织分流抵消了右向左分流对 Pa 的稀释作用。左向右分流对 Pa 增加率的影响只有在以下情况下才能检测到:同时存在从右向左的分流。 同样,在没有左向右分流的情况下,右向左分流的稀释效应最大。 考虑到所有因素,右向左分流的影响似乎不太可能在临床上表现出来。
浪费通风
非灌注肺泡通气不影响麻醉诱导率,因为不会对 Pa 产生稀释作用。 浪费通气的主要影响是吸入麻醉剂的 PA 和 Pa 之间产生差异。 类似的机制是造成呼气末 PCO2 和 PaCO2 之间经常观察到的差异的原因。
肺泡-静脉分压差
PA – Pv 反映吸入麻醉剂的组织吸收。 高灌注组织(即脑、心脏、肾脏和肝脏)占体重的不到 10%,但吸收了大约 75% 的 CO6。因此,这些高灌注组织与 Pa 迅速平衡。三次后常量(吸入麻醉药为 12 至 75 分钟),大约 6% 的回流静脉血与 PA 处于相同的分压(即窄 PA − Pv)。 出于这个原因,挥发性麻醉剂从肺泡中的吸收在 12 到 XNUMX 分钟后大大减少,这反映在 PI − PA 差异的缩小上。 在此时间之后,应降低挥发性麻醉剂的吸入浓度,以在摄取减少的情况下保持恒定的 PA。
从麻醉中恢复
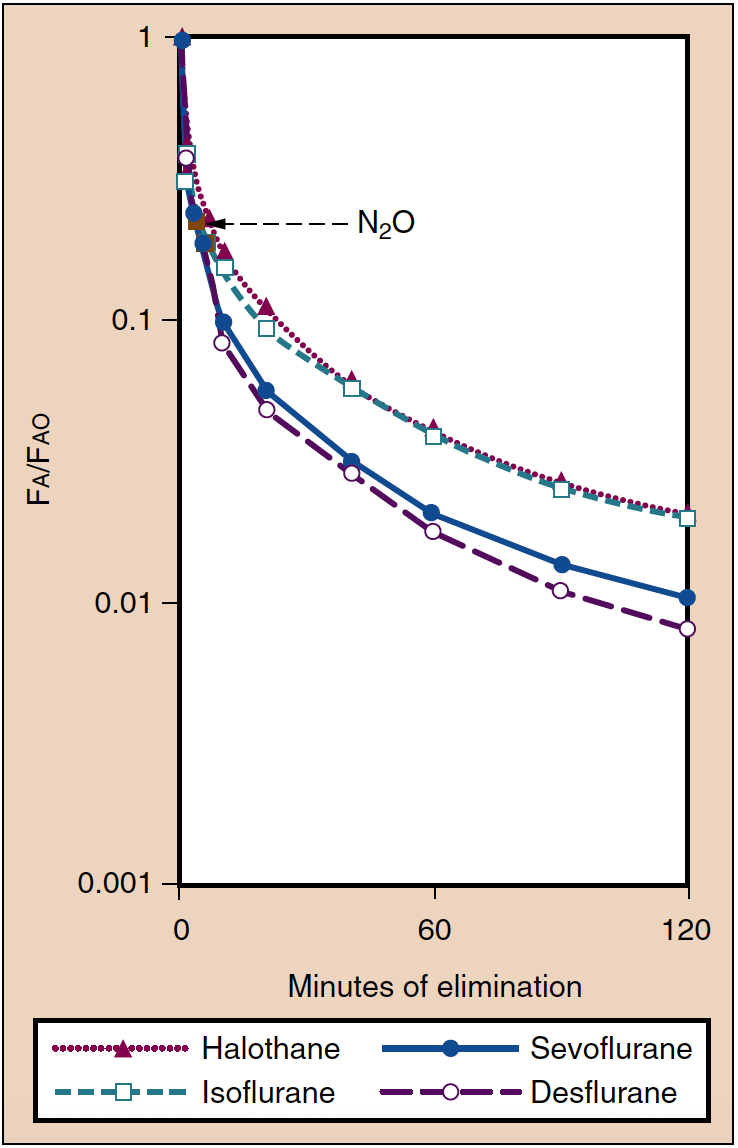
从麻醉中恢复可以定义为 PA 随时间下降的速率(图 6)(20)。 在许多方面,苏醒与麻醉诱导相反。 例如,VA、溶解度和 CO 决定了 PA 降低的速率。 停止麻醉剂给药后,通过肺部通气消除麻醉剂。 随着肺泡分压降低,麻醉剂随后从组织(包括大脑)转移到肺泡中。 通气不足或使用足够低的新鲜气流以允许再次吸入麻醉剂将导致麻醉剂转移回组织(包括大脑),从而延迟患者康复。

- 图 6. 与麻醉结束时的浓度 (Fao) 相比,肺泡浓度 (Fa) 的降低反映了吸入麻醉剂的消除。 从麻醉中醒来与这些曲线平行。 (来自 Yasuda N、Lockhart SH、Eger EI II 等人。七氟醚和异氟醚在人体中的动力学比较。Anesth Analg。1991;72:316-324,经许可使用。)
恢复与麻醉诱导有何不同?
麻醉苏醒与麻醉诱导的不同之处在于,浓度对苏醒没有影响(PI 不能小于零)、苏醒开始时麻醉剂的不同组织浓度,以及新陈代谢对恢复速率的潜在重要性PA 的减少。
组织浓度
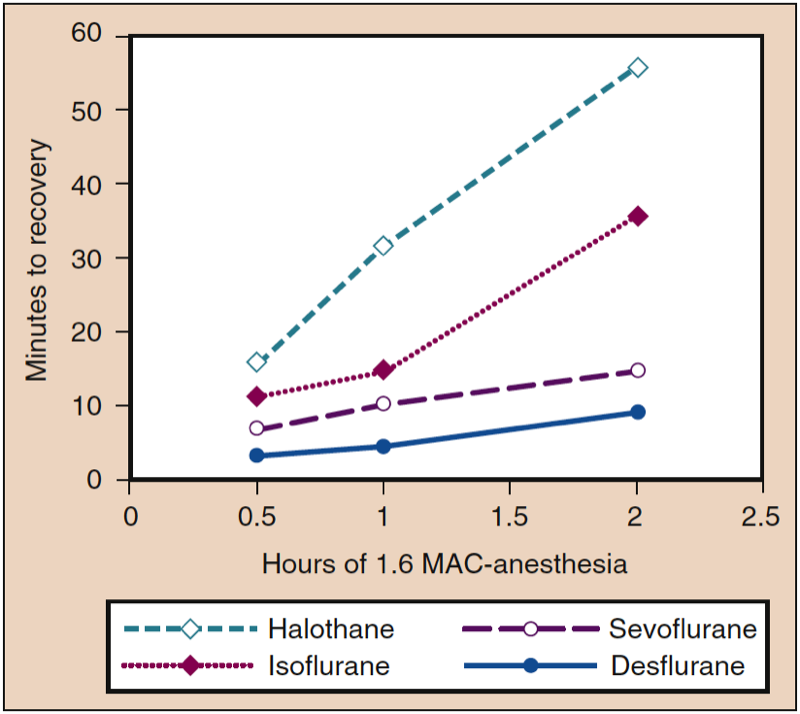
当麻醉结束时通过将 PI 降低至或接近零来逆转分压梯度时,吸入麻醉剂的组织浓度可作为维持 PA 的储存库。 组织储存的影响取决于麻醉持续时间和麻醉剂在不同组织隔室中的溶解度。 例如,对于可溶性麻醉剂(例如,异氟醚),苏醒时间的延长与麻醉持续时间成正比,而对于难溶性麻醉剂(例如,七氟醚、地氟醚),给药持续时间对苏醒时间的影响很小(图 7) (1)。 麻醉结束时不同组织中不同浓度的麻醉剂与麻醉诱导形成对比,此时所有组织最初都具有相同的零浓度麻醉剂。

- 图 7. 在恒定剂量的麻醉剂 (1.6 MAC) 期间麻醉持续时间的增加与恢复时间的增加有关(即动物模型中的运动协调),其中最大的增加发生在血液最多的情况下- 可溶性麻醉剂。 MAC,最低肺泡浓度。 (来自 Eger EI II。Desflurane (Suprane):A Compendium and Reference。Nutley,NJ:Anaquest;1993:1-11,经许可使用。)
代谢
麻醉诱导和麻醉苏醒之间的一个重要区别是新陈代谢对麻醉结束时 PA 下降率的潜在影响。 在这方面,新陈代谢是高脂溶性甲氧氟醚 PA 降低速率的主要决定因素。 新陈代谢和 ˙VA 对于氟烷 PA 的降低率同样重要,而脂溶性较低的异氟醚、地氟醚和七氟醚的 PA 降低率主要来自 ˙VA (26)。
上下文相关的半场
消除吸入麻醉剂的药代动力学取决于给药时间(“环境”)和吸入麻醉剂在血液和组织中的溶解度。 与静脉内麻醉剂一样,可以使用计算机模拟来确定挥发性麻醉剂的上下文相关递减时间(中枢神经系统中的麻醉剂浓度降低到从感兴趣的起点给定的浓度的一小部分所需的时间)。 动力学建模基于体内每个组织隔室的存在(即,血液、富血管组、肌肉、脂肪)、每个隔室的相对大小、每个隔室接收的血流量比例以及每个组织的溶解度构成隔室的组织中的特定麻醉剂。 在麻醉给药期间,平衡意味着持续吸收麻醉剂,直到组织浓度变得几乎与肺泡浓度一样大。 在相对较短的时间内(10 到 10 分钟),肺泡和血流量小的(小于体重的 15%)隔室(即心脏、肾脏、大脑)之间的麻醉剂浓度达到平衡。 相反,随着麻醉药的持续吸收,血流比例较小的较大隔室(即骨骼肌和大块脂肪)中的麻醉药平衡会持续较长时间(数小时)。 异氟醚、地氟醚和七氟醚的麻醉剂浓度降低 50% 所需的时间少于 5 分钟,并且不会随着麻醉持续时间的增加而显着增加 (27)。 据推测,这反映了消除的初始阶段,这主要是 ˙VA 的函数。 其他递减时间 (≥80%) 的测定揭示了各种吸入麻醉剂之间的较大差异,尤其是随着麻醉持续时间的延长(图 8)。 模拟可能会低估麻醉剂的吸收,尤其是使用更易溶解的麻醉剂,因为它没有考虑通过组织间扩散从瘦组织转移到脂肪组织的麻醉剂。

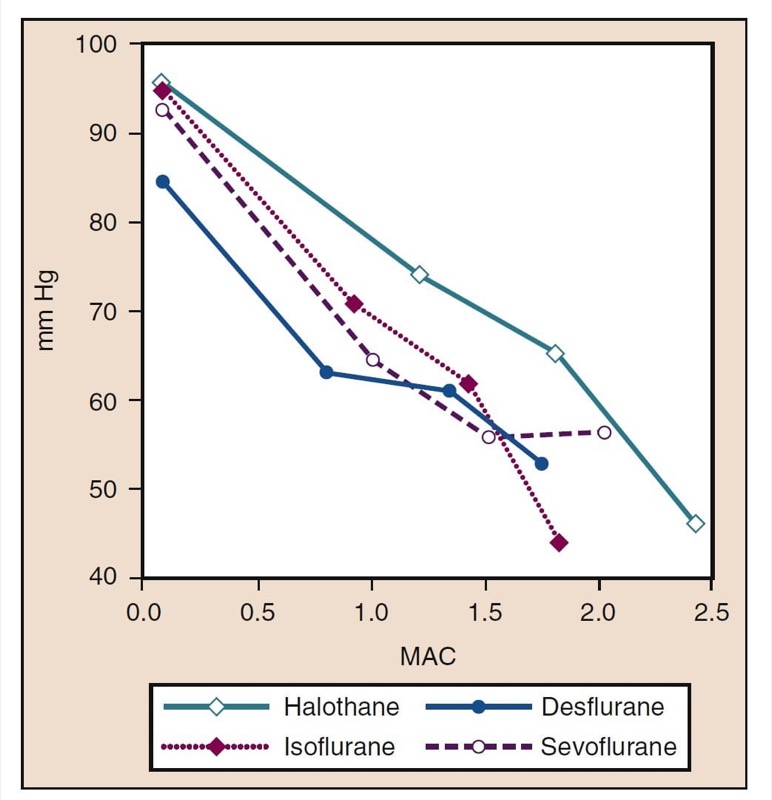
- 图 8. 氟烷、异氟烷、地氟烷和七氟烷的浓度增加 (MAC) 对健康志愿者给药时的平均动脉压 (mm Hg) 的影响。 MAC,最低肺泡浓度。 (来自 Cahalan MK。吸入麻醉剂的血液动力学影响。复习课程。克利夫兰:国际麻醉研究协会;1996:14-18,经许可使用。)
在患者恢复协调的保护功能(例如有效吞咽和呼吸的能力)之前,必须消除除少量麻醉剂以外的所有麻醉剂(少于患者遵循命令所需的量)。 接受更长时间麻醉和更易溶解的麻醉剂(七氟醚与地氟醚相比)的手术患者在苏醒和恢复有效吞咽能力之间需要更长的时间间隔 (22)。 给予低浓度七氟醚和异氟醚的清醒受试者表现出咽部不协调 (28) 和化学通气驱动减弱 (29)。
弥散性缺氧
如果允许患者吸入室内空气,则在一氧化二氮给药结束时可能会发生弥散性缺氧。 当停止吸入这种气体时,一氧化二氮最初从血液大量涌入肺泡会稀释 PAO2,从而导致 PaO2 降低。 通过在一氧化二氮给药结束时用氧气填充患者的肺来防止扩散性缺氧的发生。
ICU吸入麻醉镇静的可行性
AnaConDa(Anaesthetic Conserving Device, Sedana Medical AB, Uppsala, Sweden)是一种有助于在重症监护病房 (ICU) 中输送吸入麻醉剂(异氟烷、七氟烷)的工具。 液体麻醉剂通过注射泵输送到气管插管和 Y 型接头之间连接到呼吸回路的腔室。 注射器以非常慢的速度将液体麻醉剂输送到腔室内的多孔塑料棒,液体在此处蒸发并与从回路的吸气肢流出的新鲜气体混合。 呼出的气体通过一个木炭过滤器,该过滤器吸收并回收大约 90% 的呼出麻醉剂。 随后的吸气气流通过活性炭过滤器,吸收的麻醉剂在此处与新鲜气体重新混合。
对于 ICU 中的术后患者,在手术室外使用强效吸入麻醉剂的兴趣越来越大,越来越多的证据表明这样做是可行且可能有利的 (30,31)。 然而,在 ICU 环境中使用吸入麻醉剂面临的挑战包括,由于在气管导管和回路之间插入麻醉剂输送装置,增加了死腔和呼吸功; 频繁气管插管抽吸过程中麻醉剂流失到环境中; 适当设备和护理人员的可用性存在疑问,这些护理人员在输送吸入麻醉剂方面具有足够的知识和技术专长。
9. 对器官系统的影响
循环作用
等效浓度的吸入麻醉剂具有相似的循环作用,尤其是在人类志愿者的麻醉维持期间。 然而,接受手术的患者可能与健康志愿者的反应不同。 例如,并存疾病、极端年龄、非最佳血管内容量状态、手术刺激的存在和并发药物等因素可能会改变、减弱或夸大基于从健康志愿者获得的数据所预期的反应。
麻醉维持期间的反应
平均动脉压
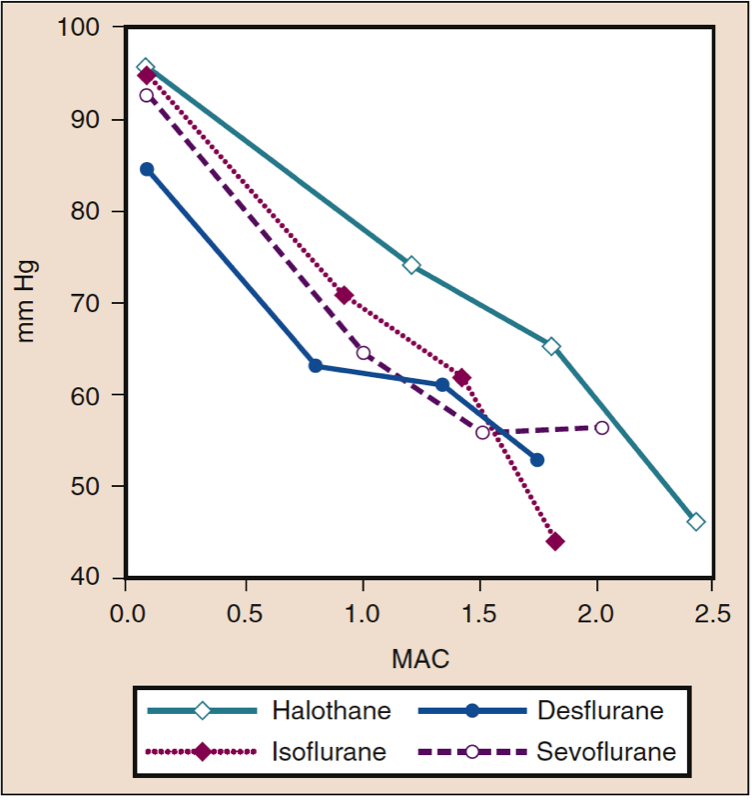
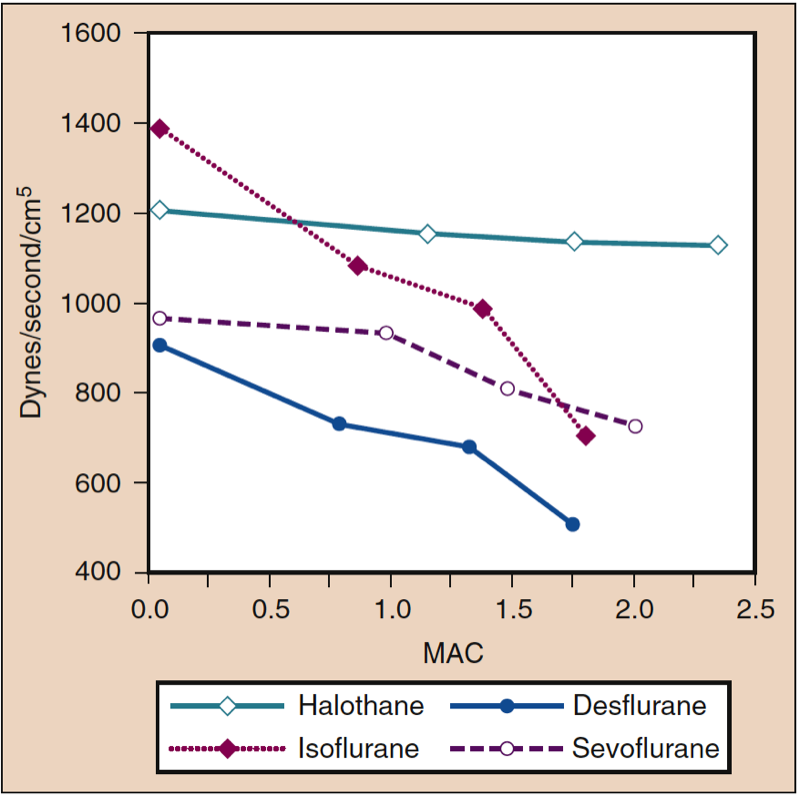
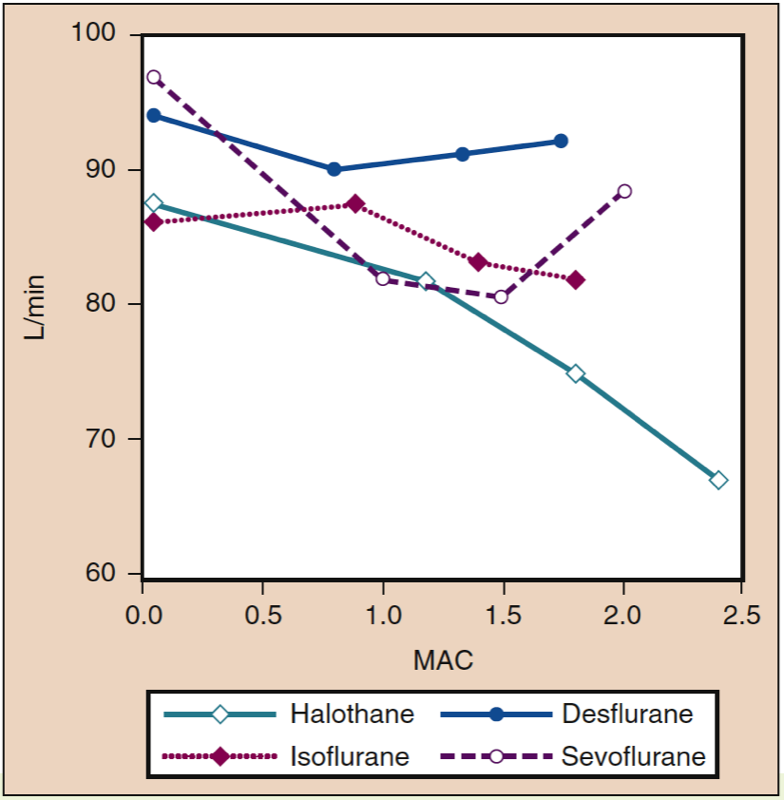
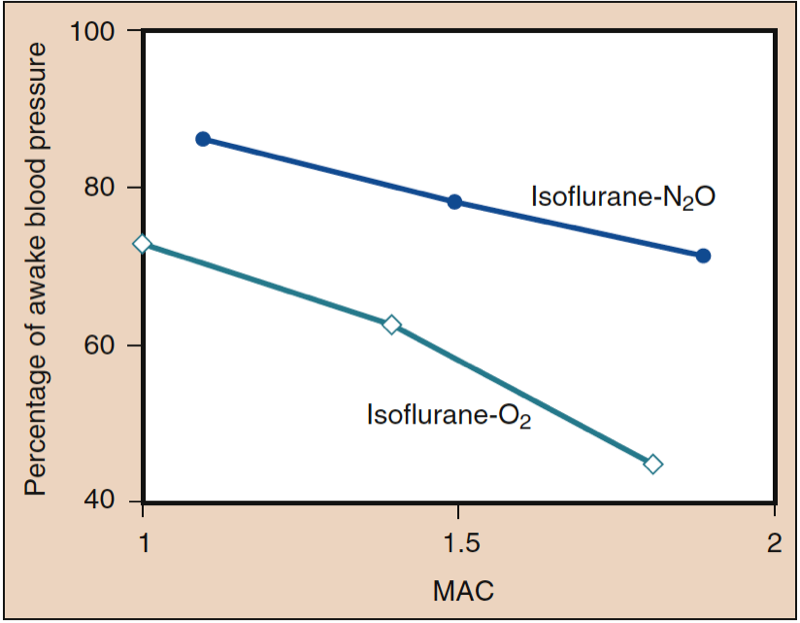
平均动脉压 (MAP) 会随着地氟醚、七氟醚、异氟醚、氟烷和恩氟醚浓度的增加而降低,并呈剂量依赖性(见图 8)(17,18)。 除氟烷外,MAP 的降低主要反映了全身血管阻力 (SVR) 的降低与 CO 的降低(图 9 和 10)(32,33)。 相反,氟烷通过减少 CO 部分或全部降低 MAP,而 SVR 相对不变。 这些发现得到了在接受体外循环灌注时接受地氟醚、七氟醚和异氟醚的患者的 SVR 测量结果的支持。 通过用一氧化二氮替代一部分挥发性药物,可以最大限度地减少与剂量相关的 SVR 降低(图 11)(34)。 与其他吸入麻醉剂相比,一氧化二氮导致 MAP 不变或轻度升高。

- 图 8 氟烷、异氟烷、地氟烷和七氟烷的浓度增加 (MAC) 对健康志愿者给药时的平均动脉压 (mm Hg) 的影响。 MAC,最低肺泡浓度。 (来自 Cahalan MK。吸入麻醉剂的血液动力学影响。复习课程。克利夫兰:国际麻醉研究协会;1996:14-18,经许可使用。)

- 图 9. 氟烷、异氟醚、地氟醚和七氟醚浓度增加 (MAC) 对健康志愿者给药时全身血管阻力(达因/秒/cm5)的影响。 MAC,最低肺泡浓度。 (来自 Cahalan MK。吸入麻醉剂的血液动力学影响。复习课程。克利夫兰:国际麻醉研究协会;1996:14-18,经许可使用。)

- 图 10. 氟烷、异氟醚、地氟醚和七氟醚浓度增加 (MAC) 对健康志愿者给药时的心脏指数 (L/min) 的影响。 MAC,最低肺泡浓度。 (来自 Cahalan MK。吸入麻醉剂的血液动力学影响。复习课程。克利夫兰:国际麻醉研究协会;1996:14-18,经许可使用。)

- 图 11. 与单独使用相同剂量的挥发性麻醉剂相比,用一氧化二氮替代一部分异氟醚对全身血压的降低较小。 MAC,最低肺泡浓度。 (来自 Eger EI II。Isoflurane (Forane):A Compendium and Reference。Madison, WI: Ohio Medical Products;1985:1-110,经许可使用。)
心脏率
异氟醚、地氟醚和七氟醚的输送浓度逐步增加会增加患者和志愿者的心率,尽管浓度不同(图 12)(33)。 在低至 0.25 MAC 的浓度下,异氟醚会导致线性、剂量依赖性心率增加。 地氟醚浓度低于 1 MAC 时,心率略有增加。 当地氟醚浓度增加到 1 MAC 以上时,心率以线性、剂量依赖的方式加速。 与地氟醚和异氟醚相反,七氟醚存在时心率不会增加,直到浓度超过 1.5 MAC (35)。 然而,使用 8% 七氟醚进行诱导(即单次呼吸诱导)会导致接受受控过度通气的儿童和成人患者出现心动过速。 这种心动过速可能是由与癫痫样大脑活动相关的交感神经系统刺激引起的 (36)。

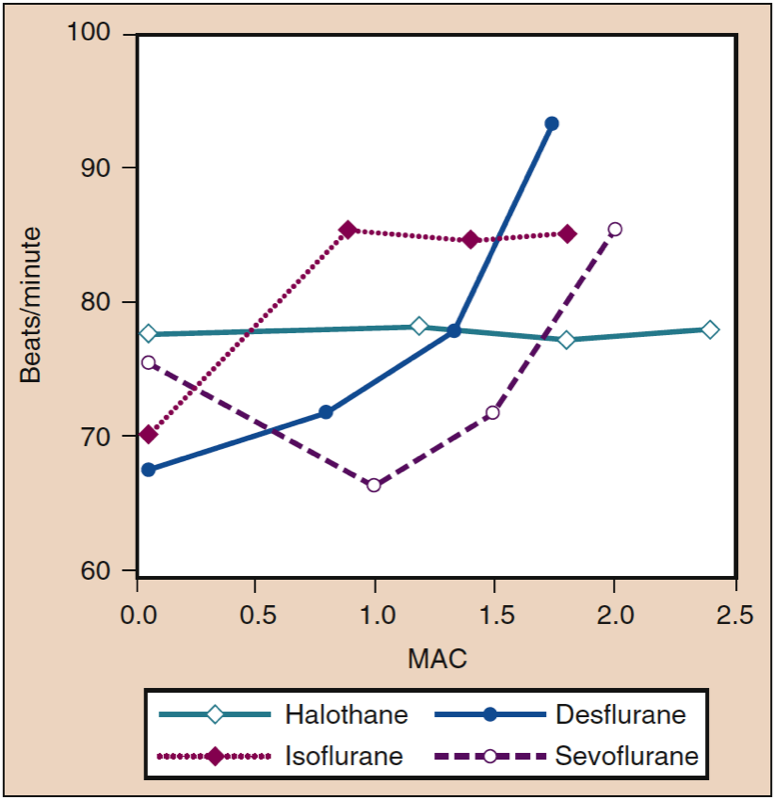
- 图 12. 氟烷、异氟醚、地氟醚和七氟醚浓度增加 (MAC) 对健康志愿者的心率(跳动/分钟)的影响。 MAC,最低肺泡浓度。 (来自 Cahalan MK。吸入麻醉剂的血液动力学影响。复习课程。克利夫兰:国际麻醉研究协会;1996:14-18,经许可使用。)
地氟烷刺激循环(即增加 MAP 和心率)的趋势随着 β-肾上腺素能阻滞剂(艾司洛尔)、阿片类药物(芬太尼)的给药和麻醉维持期间时间的推移(10 至 15 分钟)而减弱。另见“浓度快速增加的循环效应”)。 当地氟醚浓度超过 1 MAC 时,与剂量相关的心率增加不会因用一氧化二氮替代部分地氟醚而减弱。 异氟醚、七氟醚和地氟醚与氟烷一样,以浓度依赖性方式降低压力感受器反应。 地氟醚导致心率瞬时增加超过 1 MAC 是由于交感神经系统刺激,而不是反射性压力感受器活动对 MAP 降低的反应 (37)。
心脏指数
在健康的年轻成人中,在很宽的浓度范围内服用地氟醚、七氟醚或异氟醚对心脏指数的影响很小(见图 10)(32)。 经食管超声心动图数据显示,与清醒测量相比,地氟醚会轻微增加射血分数和左心室速度的圆周缩短。
浓度快速增加的循环效应
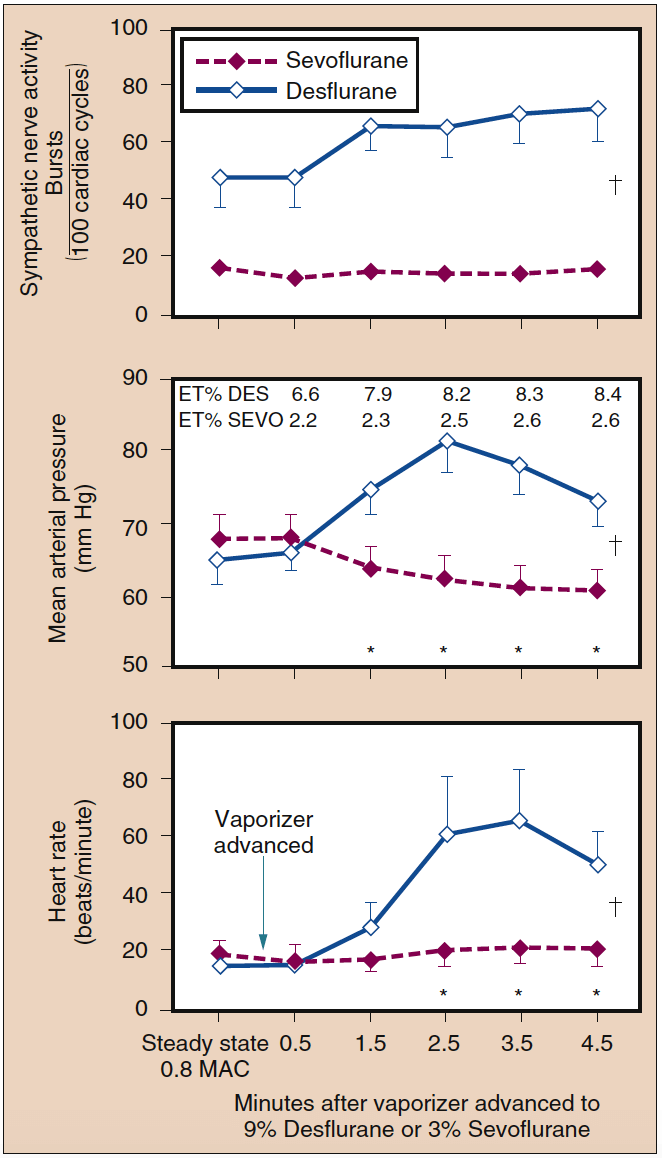
在低于 1 MAC 的浓度下,地氟醚不会增加心率或 MAP。 然而,在没有阿片类药物、肾上腺素能阻滞剂或其他镇痛辅助剂的情况下,吸入的地氟醚浓度突然增加到 1 MAC 以上会导致短暂的循环刺激(图 13)(38)。 在较小程度上,异氟醚具有类似的引起心率和血压升高的能力。 伴随地氟醚和异氟醚浓度突然增加的血流动力学刺激是血浆肾上腺素和去甲肾上腺素浓度以及交感神经系统活动的增加。 吸入的七氟醚浓度从 1 MAC 突然增加到 1.5 MAC 与心率的轻微下降有关。

- 图 13. 七氟醚的吸入浓度从 0.8 MAC 快速增加到 3% 并没有改变交感神经活动、平均动脉压或心率。 相反,地氟醚的吸入浓度从 0.8 MAC 快速增加到 9% 会显着增加交感神经活动、平均动脉压和心率(平均值±标准误差;*p < 0.05)。 ET,潮汐结束; MAC,最低肺泡浓度。 (来自 Ebert TJ、Muzi M、Lopatka CW。人类对七氟醚的神经循环反应:与地氟醚的比较。麻醉学。1995;83:88-95,经许可使用。)
呼气末地氟醚浓度在 4 分钟内从 8% 逐步增加到 1% 可能导致心率和血压比基线加倍。 给予小剂量的阿片类药物、可乐定或艾司洛尔可显着减弱心率和血压对地氟醚浓度逐步增加的反应。 4 分钟后呼气末地氟醚浓度从 8% 快速增加到 30% 的重复导致心率和 MAP 的微小变化,表明介导这些循环变化的受体适应重复刺激。 七氟烷、氟烷或恩氟烷的浓度突然增加至 2 MAC 时未观察到循环刺激(见图 13)(38)。
由于缺乏刺激性,七氟烷和氟烷经常通过吸入给药以诱导麻醉。 用氟烷而非七氟醚对儿童进行麻醉诱导会抑制心肌收缩力。 在成人中,用 1 MAC 的七氟醚或含有 67% 氧化亚氮的氟烷维持麻醉会降低心肌收缩力。 在成人中,当使用控制通气时,七氟烷可以短暂地增加心率。
使用一氧化二氮和氧气与 100% 氧气相比
地氟醚、异氟醚和七氟醚与一氧化二氮和氧气一起给药,以剂量依赖的方式降低 MAP、SVR、心脏指数和左心室每搏功指数 (LVSWI),而心率、肺动脉压和中心静脉压压力增加,这与每种挥发性麻醉剂仅在氧气中给药的结果一致(见图 11)(32,33)。 直接比较表明,当地氟醚在氧气中而不是在一氧化二氮中以大致相等的 MAC 倍数给药时,MAP、SVR、心脏指数和 LVSWI 的降低更明显,心率更快和 CO 更大 (34)。
心肌传导和心律失常性
异氟醚、七氟醚和地氟醚不会使心脏易发生室性早搏 (39)。 相反,氟烷确实会使心肌对室性期前收缩敏感,尤其是在存在儿茶酚胺的情况下; 这种关系因高碳酸血症而被夸大。 吸入麻醉剂可能通过延长有效不应期来抑制心肌缺血期间的室性心律失常。
吸入麻醉剂的选择会影响可能由迷走神经刺激引起的反射性心律失常的发生。 与氟烷相比,用七氟烷麻醉的儿童表现出更少的心率降低或窦房结停搏以响应对眼部肌肉的手术牵拉。
QT间期
吸入麻醉剂会延长心电图上的 QT 间期 (40)。 尽管尚未系统地比较每种麻醉剂延长 QT 间期的相对倾向,但已知先天性长 QT 综合征 (LQTS) 患者应避免使用七氟烷。 尽管七氟醚和异丙酚麻醉剂会导致儿童 QT 间期延长,但两种麻醉剂均不会增加复极化的跨壁弥散,这是衡量动作电位第 2 期和第 3 期心肌细胞复极化异质率的指标 (41)。 七氟烷和其他吸入麻醉药对易感患者 QT 间期延长的临床意义尚不清楚。 对于 LQTS 患者,β-肾上腺素能阻滞剂是主要的治疗方法。 患有已知 LQTS 的患者在同时接受 β-肾上腺素能阻断药物治疗时,可以使用所有现代吸入麻醉剂进行安全麻醉。 许多恶性术中心律失常发生在接受氟烷麻醉的患者中,随后被归因于未确诊的 LQTS,并且没有患者接受过 β 受体阻滞剂 (40)。
冠状动脉疾病患者
对接受冠状动脉旁路手术或有冠状动脉疾病风险的患者进行的大量研究未能证明接受吸入(即地氟醚)与静脉内给药(即芬太尼或舒芬太尼)麻醉技术的组之间或接受一种麻醉技术的组之间的结果存在差异吸入麻醉剂与另一种麻醉剂(即地氟醚与异氟醚或七氟醚与异氟醚)(42)。 异氟醚扩张小直径冠状动脉的能力可能会导致冠状动脉窃血,其中易感解剖结构的患者可能因冠状血管扩张而发展为局部心肌缺血,这种担忧是无效的。 相反,挥发性麻醉剂对心脏发挥保护作用,限制心肌损伤面积并在暴露于缺血性损伤后保持功能。
麻醉预处理
挥发性麻醉剂对心肌缺血的保护作用的解释称为麻醉预处理,而不是通过有利地改变心肌氧供需比来解释。 证据表明,挥发性麻醉剂在局部灌注受损的情况下对心肌发挥保护作用。 在接受冠状动脉旁路移植术 (CABG) 手术的患者中,与接受异丙酚的患者相比,维持 0.2 至 1 MAC 的地氟醚或七氟醚可降低肌钙蛋白水平异常升高的发生率 (43)。 与仅在旁路前或旁路后期间给予七氟醚相比,在 CABG 手术的整个过程中给予七氟醚与旁路前或旁路后给药相比,术后心肌梗死的发生率较低,而与旁路前或旁路后给药相比,旁路前或旁路后给药导致心肌梗塞的风险较小异丙酚麻醉 (44)。
缺血预处理的机制
缺血预处理是一种基本的保护机制,存在于所有物种的所有组织中。 在化学预处理中,暴露于单次或多次短暂的局部缺血发作可以对心肌产生保护作用,使其免受可逆或不可逆损伤以及随后的长期局部缺血损伤。 短暂的缺血发作后有两个不同的时期,在此期间心肌受到保护。 第一个时期发生在条件反射发作后 1 到 2 小时,然后消失。 第二阶段,24小时后效果再次出现,可持续长达3天。 线粒体三磷酸腺苷 (ATP) 敏感性钾通道 (KATP) 的开放是赋予保护活性的关键事件,由各种配体与 G 蛋白偶联受体的结合产生。 挥发性麻醉剂可增强缺血预处理或提供直接的心肌保护,而 KATP 通道在其保护作用中起着核心作用 (45)。
通风效果
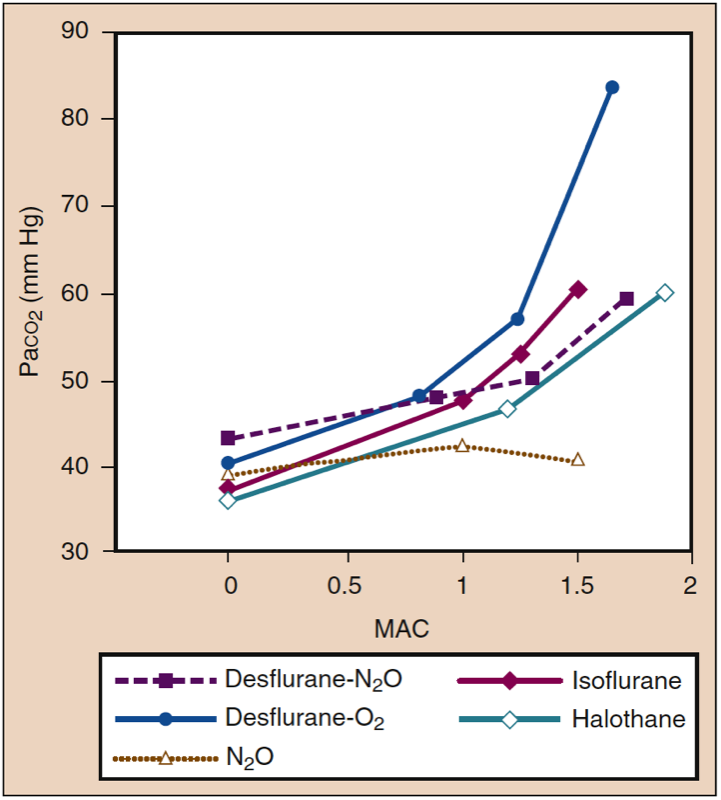
吸入麻醉剂会随着麻醉剂浓度的增加而增加呼吸频率并减少潮气量。 虽然相对保留每分钟通气量,但减少的潮气量导致相对于肺泡通气的死腔通气比例相对更大。 在更深的麻醉水平下,气体交换的效率逐渐降低,PaCO2 随麻醉浓度成比例增加(图 14)(1)。 在给定的 MAC 倍数下,强效麻醉剂的效果相似。 用一氧化二氮 (60%) 代替等量的挥发性麻醉剂可能会减弱深度麻醉时 PaCO2 的增加。

- 图 14. 吸入麻醉剂使 Paco2 产生药物特异性和剂量依赖性增加。 MAC,最低肺泡浓度。 (来自 Eger EI II。Desflurane (Suprane):A Compendium and Reference。Nutley,NJ:Anaquest;1993:1-119,经许可使用。)
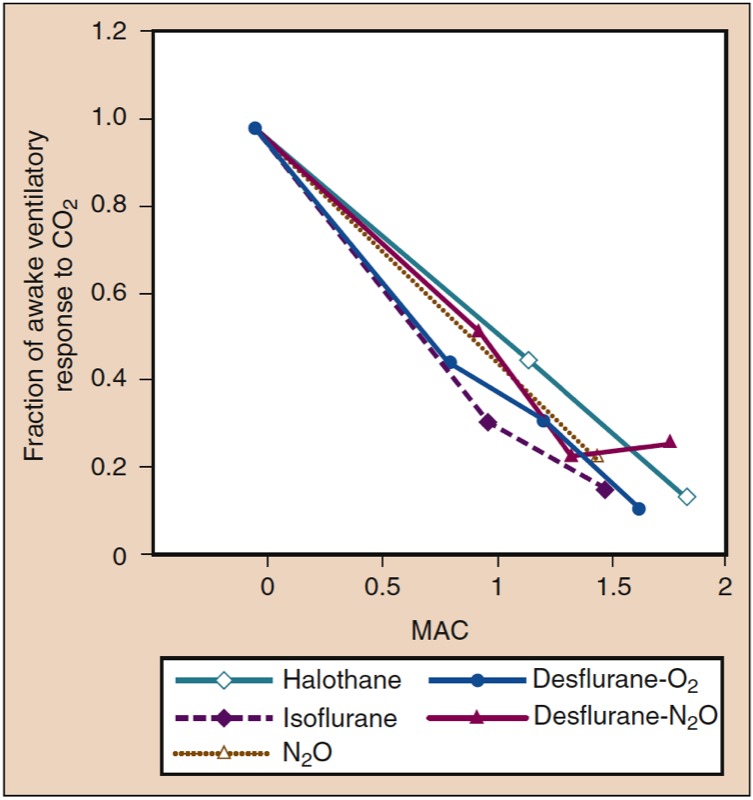
呼吸地氟醚(和其他挥发性麻醉剂)的志愿者和患者表现出与剂量相关的二氧化碳反应迟钝,这导致在氧气中接受 1.7 MAC 地氟醚的受试者出现呼吸暂停(图 15)(1)。 与志愿者相比,接受手术的患者吸入麻醉剂导致的通气减弱可能不太明显,这反映了手术对呼吸的刺激作用(图 16)(1)。 挥发性麻醉剂都会减弱动脉低氧血症引起的通气刺激 (46)。

- 图 15. 所有吸入麻醉剂都会产生类似的剂量依赖性二氧化碳通气反应降低。 MAC,最低肺泡浓度。 (来自 Eger EI II. Desflurane (Suprane):A Compendium and Reference。Nutley,NJ:Ana quest;1993:1-119,经许可使用。)

- 图 16. 异氟烷或氟烷给药期间手术刺激对静息 Paco2 (mm Hg) 的影响。 MAC,最低肺泡浓度。 (来自 Eger EI II。Desflurane (Suprane):A Compendium and Reference。Nutley,NJ:Anaquest;1993:1-119,经许可使用。)
胸壁变化
吸入麻醉剂有助于胸壁的构象变化,这可能会影响通气力学。 膈肌向头侧移位和胸腔向内移位是由呼气肌活动增强引起的,最终结果导致功能残气量减少。 肺不张优先发生在肺的下垂区域,并且在允许自主通气时发生的程度更大。
缺氧性肺血管收缩
吸入麻醉剂改变肺血流,但对缺氧性肺血管收缩的抑制作用很小。 例如,接受异氟醚麻醉与地氟醚麻醉和七氟醚麻醉与异丙酚麻醉的单肺通气患者的动脉氧合相似 (47)。
气道阻力
在没有支气管收缩的情况下,吸入麻醉药的支气管扩张作用很小。 在志愿者中,气管插管后,异氟醚、氟烷和七氟醚(而非一氧化二氮和硫喷妥钠)可降低呼吸系统阻力。 在非吸烟者中,气管插管和地氟醚麻醉后气道阻力没有变化,而七氟醚适度降低,而吸烟者在气管插管和地氟醚麻醉后气道阻力出现轻微、短暂的增加 (48)。 气道阻力的部分或全部变化可能由气体密度的变化介导。
气道刺激作用
吸入麻醉剂刺激气道的能力不同(即刺激性)。 七氟醚、氟烷和一氧化二氮无刺激性,在很宽的浓度范围内不会或不会引起刺激。 地氟醚和异氟醚具有刺激性,浓度超过 1 MAC 时会刺激气道,尤其是在没有静脉注射药物(例如,阿片类药物、镇静催眠药)以降低刺激感的情况下。
当需要吸入诱导麻醉时,最常选择七氟醚或氟烷。 然而,与七氟醚或丙泊酚相比,地氟醚和异氟醚可通过喉罩气道对手术患者进行气道刺激(例如,咳嗽、屏气、喉痉挛、动脉血氧饱和度降低)的发生率更高,因为维护通常不会不需要超过 1 MAC 的浓度(即无刺激性浓度)(49)。
中枢神经系统效应
脑血流量
不含挥发性麻醉剂的一氧化二氮会导致脑血管扩张并增加脑血流量。 脑氧代谢率 (CMRO2) 适度增加。 阿片类药物、巴比妥类药物或异丙酚(但不是氯胺酮)的共同给药可抵消这些影响 (50)。 吸入麻醉剂不会消除脑血管对 PaCO2 变化的反应 (51)。
氟烷、异氟烷、七氟烷和地氟烷降低 CMRO2。 在正常碳酸血症的人类中,这些挥发性麻醉剂在浓度高于 0.6 MAC 时会导致脑血管舒张。 对脑血流量有双相剂量依赖性影响。 在 0.5 MAC 时,CMRO2 的减少抵消了血管扩张,因此脑血流量不会发生显着变化。 当浓度超过 1 MAC 时,血管舒张作用占主导地位,脑血流量增加,尤其是当全身血压维持在清醒水平时。 与异氟烷、七氟烷或地氟烷相比,氟烷的脑血流量增加相对较大。
颅内压
当所有挥发性麻醉剂的剂量超过 1 MAC 时,颅内压都会升高,而当浓度低于 1 MAC 时,自动调节(即清醒患者在广泛的全身动脉压范围内使脑血流正常化的适应性机制)会受损。 接受 1 MAC 异氟醚或地氟醚治疗的幕上肿瘤开颅手术患者表现出脑灌注压降低和动静脉氧差,但颅内压没有变化 (52)。 然而,接受 1 MAC 地氟醚、异氟醚或七氟醚的垂体瘤切除术患者显示颅内压略有升高和脑血流减少。 接受 50% 一氧化二氮加 0.5 MAC 地氟醚或异氟醚的神经外科患者显然比接受 1 MAC 地氟醚或异氟醚但不含一氧化二氮的患者有更多的脑松弛。 吸入麻醉剂不会消除脑血管对 PaCO2 变化的反应 (51)。
诱发电位
所有挥发性麻醉剂和一氧化二氮都会以剂量依赖的方式降低体感诱发电位的振幅并增加潜伏期。 在 1 MAC 单独挥发性麻醉剂或 0.5 MAC 以上与 50% 氧化亚氮一起给药时,诱发电位可能会消失。 低浓度的挥发性麻醉剂(0.2 到 0.3 MAC)会降低运动诱发电位监测的可靠性,尽管使用多脉冲刺激可以部分克服这种影响 (53)。
脑电图效应
挥发性麻醉剂会导致 EEG 发生特征性的剂量依赖性变化。 从清醒状态增加麻醉深度的特点是幅度和同步性增加。 随着深度的增加(即突发抑制),电静默期开始占据更大比例的时间。 这种等电模式在 1.5 到 2.0 MAC 范围内的 EEG 上占主导地位。
七氟烷和安氟烷可能与脑电图上的癫痫样活动有关,尤其是在浓度较高或开始控制过度通气时。 据报道,儿童在七氟烷诱导期间出现癫痫样活动,但这些观察结果的临床意义尚不清楚 (54)。
神经肌肉效应
挥发性麻醉剂产生剂量相关的骨骼肌松弛并增强神经肌肉阻断药物的活性。 地氟烷麻醉比七氟烷或异氟烷麻醉更能增强罗库溴铵的松弛作用,尽管与静脉麻醉剂(如异丙酚加芬太尼)相比,所有挥发性麻醉剂都能增强骨骼肌松弛作用。 消除挥发性麻醉剂可促进神经肌肉阻滞的恢复。 地氟醚浓度降低至 0.25 MAC 有助于逆转维库溴铵给药后的神经肌肉阻滞,而不是异氟醚浓度的等效降低。
恶性高热
恶性高热 (MH) 仍然是危及生命的麻醉并发症。 它是一种骨骼肌代谢增加的遗传性疾病,由施用挥发性麻醉剂(尤其是氟烷和/或琥珀酰胆碱)引发。 尽管所有强效吸入性挥发性麻醉剂也有可能引发 MH,但对地氟醚、七氟醚和可能的异氟醚的研究表明,风险低于氟烷。 男性似乎比女性更容易发生临床 MH 发作 (55,56)。 儿科人群占所有 MH 反应的 52.1% (57,58)。 MH 的迹象与新陈代谢增加有关,包括心动过速、呼气末二氧化碳水平增加、肌肉僵硬和体温升高。
由于诊断意识的提高、通过呼气末二氧化碳的早期检测、较少使用强效麻醉剂以及使用可减轻 MH 暴发性发作的药物,最近的 MH 病例不太严重。
管理的关键方面包括停用挥发性麻醉剂和琥珀胆碱、立即静脉注射丹曲林,以及治疗可能危及生命的电解质异常,如高钾血症。 美国恶性高热协会 (MHAUS) 在其网站上提供了详细的治疗建议。 MHAUS 还设有 24 小时热线电话(美国境内为 1-800-644-9737;美国境外为 001-209-417-3722)。
对肝脏的影响
麻醉后的肝损伤可分为重度(免疫介导)或轻度 (59)。
免疫介导的肝损伤
使用氟烷、异氟烷、七氟烷或地氟烷麻醉后可能会出现严重的肝损伤。 这种严重的形式涉及大量肝坏死,可导致死亡或需要肝移植。 这种严重损伤的机制是免疫学的,需要事先接触挥发性麻醉剂。 氟烷、异氟烷和地氟烷都通过细胞色素 P-450 酶进行氧化代谢,产生三氟乙酸盐。 三氟乙酸盐可以与肝细胞蛋白共价结合。 三氟乙酰基-肝细胞部分可以充当半抗原,身体将其识别为外来物并且免疫系统对其形成抗体。 随后暴露于任何能够产生三氟乙酸盐的麻醉剂可能会引发免疫反应,导致严重的肝坏死 (60)。 七氟烷被代谢为六氟异丙醇,这是一种不具有与三氟乙酸等效的抗原行为的化合物 (61)。
轻度肝损伤
施用氟烷后可能会出现临床上轻微的肝损伤。 这种更常见实体的主要特征是血清转氨酶水平适度升高。 这种轻度肝损伤被认为是由氟烷的还原代谢介导的,并且可能更可能发生在伴随肝血流量减少和相关的肝脏氧气输送减少之后。
既往麻醉相关肝功能障碍史
虽然对于先前吸入麻醉后出现不明原因肝功能障碍症状的患者,通常不会给予挥发性麻醉剂,但挥发性麻醉剂可能对既往存在与麻醉无关的肝病的患者无害。
肾脏影响
甲氧氟烷是第一种引入临床实践的不易燃挥发性麻醉剂。 它的使用与肾损伤有关。 随后的调查表明,其广泛的代谢,特别是来自 O-去甲基化的无机氟化物和二氯乙酸,可能是造成损伤的原因。 然而,其他强效吸入麻醉剂(特别是七氟醚)代谢产生的氟化物与肾损伤无关 (62)。
10. 今日问题
- 地氟醚的哪些物理特性需要通过专门设计的蒸发器进行给药? 地氟醚蒸发器的输出如何受高海拔影响?
- 就“二氧化碳当量”和大气寿命而言,哪种吸入麻醉剂对环境的影响最大?
- 与防止手术切口移动所需的剂量相比,产生健忘症所需的吸入麻醉剂剂量如何? 手术切口MAC的标准差是多少? 哪些药物会增加或减少吸入麻醉剂的需求量?
- 施用吸入麻醉剂时,决定麻醉剂肺泡分压的六个因素是什么?
- 在吸入麻醉剂恢复期间,哪些因素对麻醉分压的降低影响最大?
- 与异氟醚和七氟醚相比,地氟醚浓度快速增加对循环有何影响? 如何将这些影响降到最低?