Colin JL McCartney e Stephen Choi
INTRODUZIONE
I blocchi nervosi periferici offrono molti vantaggi ai pazienti, tra cui un migliore controllo del dolore e una riduzione degli effetti collaterali correlati all'anestesia generale. Per ottimizzare il sollievo dal dolore riducendo la dose totale di anestetico locale, sarebbe utile aggiungere un farmaco che accelera l'insorgenza e prolunga il blocco sensoriale o l'effetto analgesico. I miglioramenti nella nostra conoscenza dei meccanismi del dolore del sistema nervoso periferico (SNP) ci consentono di sviluppare metodi per prolungare l'analgesia riducendo al contempo gli effetti avversi mediati a livello centrale e periferico. Negli ultimi 20 anni sono stati testati numerosi farmaci e molti si sono dimostrati clinicamente utili quando aggiunti all'anestetico locale per il blocco dei nervi periferici o quando utilizzati per l'infiltrazione locale o l'analgesia intra-articolare. Questi farmaci sono noti come adiuvanti analgesici. Questo capitolo esamina il razionale e l'attuale base di prove per l'uso di adiuvanti analgesici e riassume le migliori strategie per ottimizzare il controllo del dolore e ridurre gli effetti avversi dopo un intervento chirurgico in caso di blocco dei nervi periferici, infiltrazione locale o iniezione di farmaci nello spazio intra-articolare.
RAZIONALE D'USO
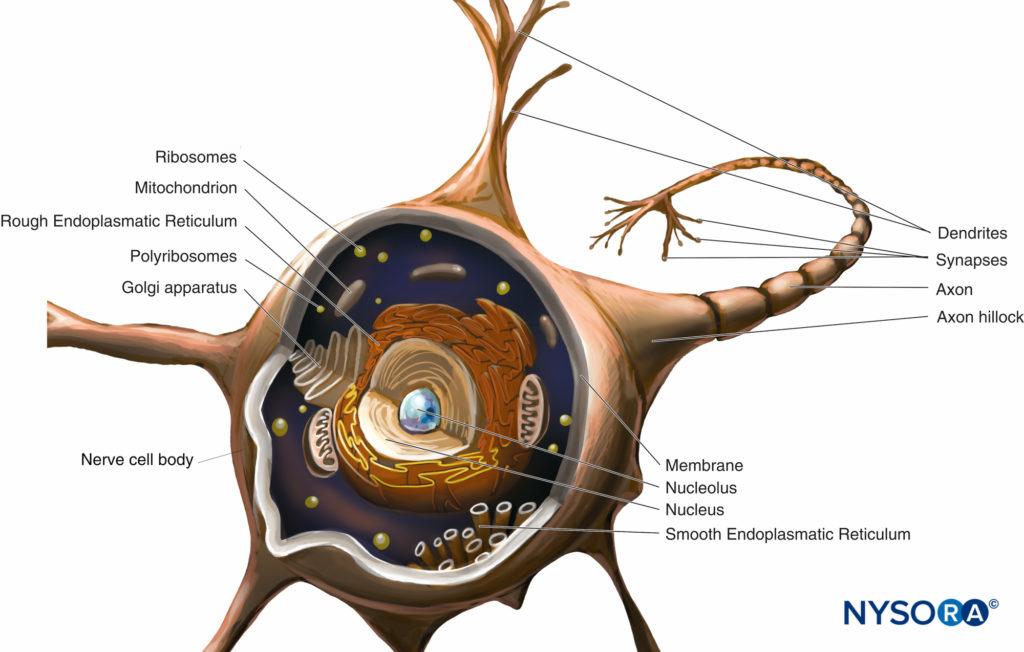
La trasmissione del dolore nel SNC e nel SNP coinvolge una complessa serie di neurotrasmettitori e percorsi che non sono facilmente bloccati da un solo tipo di farmaco o tecnica. Il coinvolgimento di diverse classi di neurotrasmettitori nel sito della lesione, nel nervo periferico, nel corno dorsale del midollo spinale e nei siti sopraspinali è responsabile della trasmissione della nocicezione. L'uso di agonisti ai recettori inibitori e antagonisti ai recettori eccitatori consente un approccio “multimodale” con ottimizzazione del controllo del dolore e riduzione degli effetti avversi. Nel 1645 Cartesio propose un meccanismo per la trasmissione del dolore, suggerendo che un impulso di dolore periferico fosse trasmesso direttamente dalla periferia al cervello da un sistema "cablato" senza alcuna modulazione intermedia (Figure 1 ).
Questa teoria della trasmissione del dolore era ampiamente ritenuta vera fino a 40 anni fa. Nel 1965, Melzack e Wall hanno proposto la loro rivoluzionaria teoria del controllo del dolore che suggeriva che il dolore potesse essere modulato o "cancellato" in un certo numero di punti nel percorso del dolore. Ricerche successive hanno identificato il corno dorsale (lamina II) del midollo spinale come un importante sito di potenziale modulazione e i trattamenti successivi per il dolore acuto e cronico hanno utilizzato questa conoscenza con buoni risultati. Alla luce di queste conoscenze sono stati sviluppati trattamenti come l'uso di oppioidi spinali e la stimolazione nervosa elettrica transcutanea (TENS). La teoria del gate ha anche cambiato molte strategie di gestione del dolore (spesso senza successo) dalle tecniche in cui abbiamo cercato di ablare le vie del dolore chimicamente o chirurgicamente a tecniche di modulazione più recenti mediante le quali tentiamo di inibire le influenze eccitatorie e migliorare le influenze inibitorie all'interno della via del dolore. Negli ultimi decenni sono avvenuti importanti progressi anche nella nostra conoscenza di come il dolore viene generato e trasmesso dal SNP al sistema nervoso centrale (SNC). La modulazione del dolore nel SNP coinvolge anche numerosi trasmettitori e meccanismi che eccitano e inibiscono le vie nocicettive. Nel SNP, in condizioni fisiologiche normali, i segnali nocicettivi vengono prodotti quando le fibre A-α e C sono stimolate dal calore, dalla pressione o da diverse sostanze chimiche prodotte dal danno tissutale e dall'infiammazione (potassio, istamina, bradichinina, prostaglandine, adenosina trifosfato [ATP]) . I segnali nocicettivi sono trasmessi agli strati superficiali della lamina II del corno dorsale nel midollo spinale, dove sono modulati sia a livello presinaptico che postsinaptico e anche da vie di controllo discendenti eccitatorie e inibitorie dal tronco cerebrale (Figure 2 ). I segnali che riescono ad attraversare questa porta viaggiano nel tronco cerebrale e nel talamo prima di raggiungere la corteccia cerebrale per produrre uno stimolo doloroso. I mediatori chimici in una vasta gamma sono prodotti nel SNP e hanno influenze sia eccitatorie che inibitorie sulla trasmissione del nervo sensoriale periferico sia nella fase acuta che in quella cronica della lesione (Figure 3 ). Questi possono attivare direttamente il nervo (ATP, glutammato, 5-idrossitriptamina [5-HT], istamina, bradichinina); migliorare la depolarizzazione sensibilizzando il nervo ad altri stimoli (prostaglandine, prostacicline e citochine come le interleuchine); o fornire un ruolo regolatore sul neurone sensoriale, sulle cellule infiammatorie e sulle fibre simpatiche (bradichinina, tachichinina e fattore di crescita nervoso).
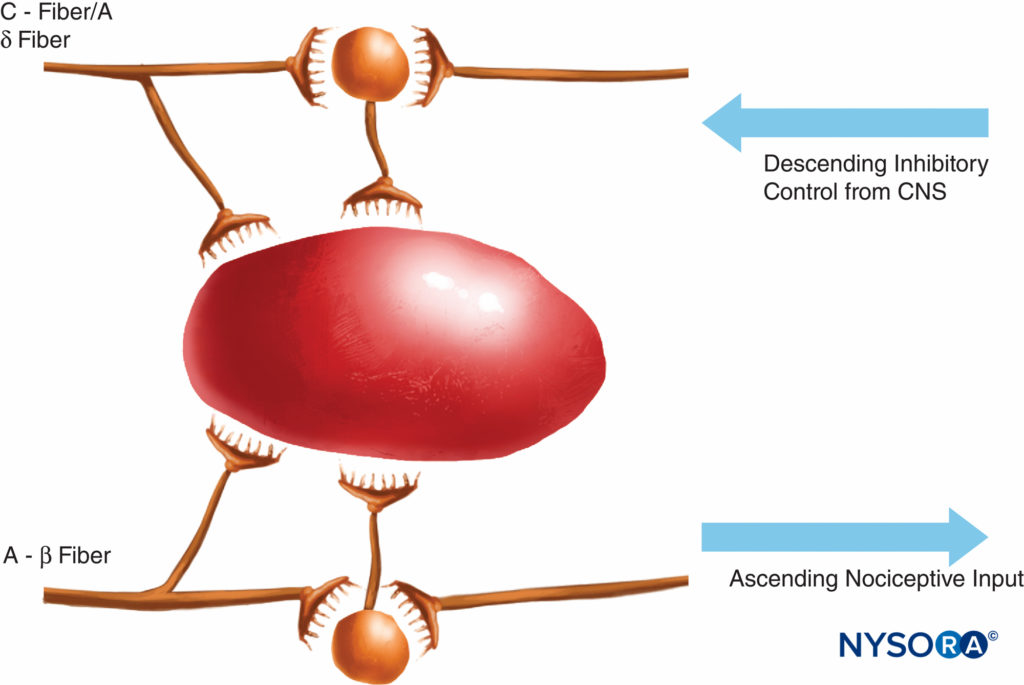
FIGURA 2. La teoria del gate proponeva che le piccole fibre (C) attivassero sistemi eccitatori (neurone nero) che successivamente eccitavano le cellule di uscita; queste ultime cellule avevano la loro attività controllata dall'equilibrio delle inibizioni mediate dalle grandi fibre (A-β) (mediate da oppioidi endogeni) e anche dai sistemi di controllo discendenti dal sistema nervoso centrale (mediato da noradrenalina e serotonina).
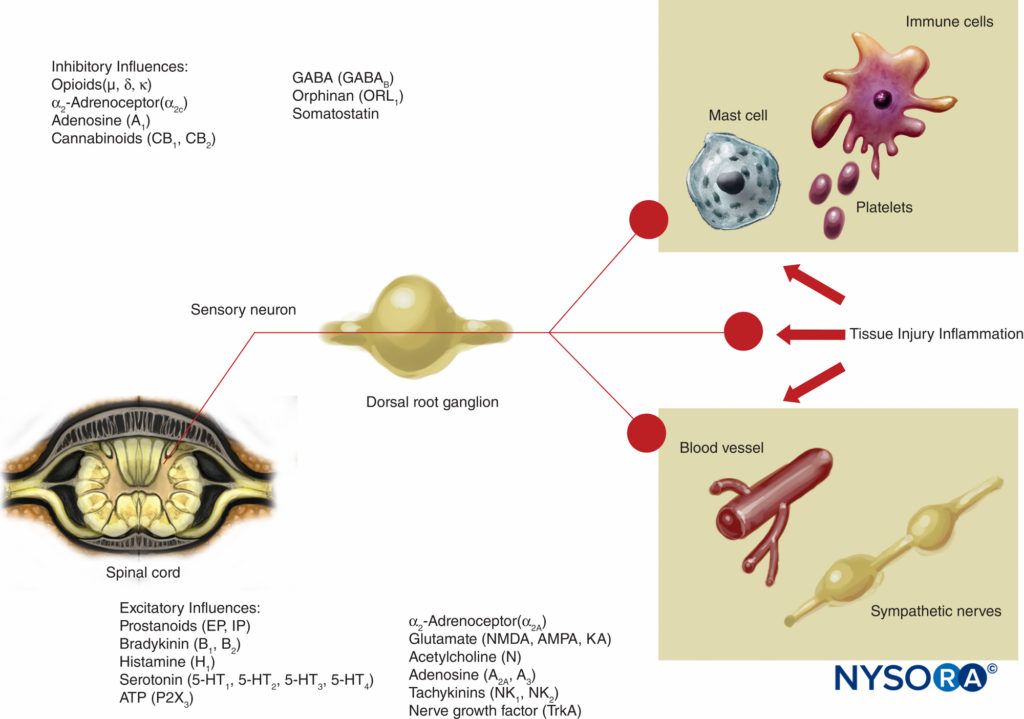
FIGURA 3. Influenze eccitatorie e inibitorie sull'attività dei nervi periferici da parte dei mediatori rilasciati da lesioni e infiammazioni tissutali e da una varietà di agenti che agiscono sui neurorecettori. AMPA = acido α-ammino-3-idrossi-5-metilisossazolo-4-propionico; KA = acido kainico; NMDA = N-metil-d-aspartato; NK = neurochinina; TrkA = recettore della tropomiosina chinasi A.
RAZIONALE PER L'USO DI COADIUVANTI ANALGESICI
Come notato in precedenza, la trasmissione del dolore nel SNC e nel SNP coinvolge una complessa serie di neurotrasmettitori e percorsi che non sono facilmente bloccati da un solo tipo di farmaco o tecnica. Un certo numero di farmaci nell'armamentario dell'anestesista, inclusi oppioidi, farmaci antinfiammatori non steroidei (FANS), α2-agonisti, desametasone e antagonisti dell'N-metil-aspartato (NMDA), hanno attività in questi siti d'azione e possono avere benefici se applicato nel SNP. È importante sottolineare che nessuno ha dimostrato neurotossicità a concentrazioni clinicamente rilevanti.
Questa conoscenza può aiutare l'anestesista regionale in diversi modi:
- Nella selezione di adiuvanti agli anestetici locali per accelerare l'insorgenza, prolungare l'effetto e ridurre la dose totale richiesta.
- Suggerire agenti che possono migliorare l'analgesia postoperatoria senza prolungare gli effetti avversi degli anestetici locali.
- Suggerire agenti che agiscono prevalentemente in siti periferici senza effetti centrali, ottimizzando così l'analgesia riducendo al minimo gli effetti collaterali del SNC.
ANALGESICI OPIOIDI
Durante l'infiammazione, i recettori oppioidi sono espressi nelle fibre sensoriali periferiche e nelle cellule immunitarie; inoltre, da queste cellule vengono rilasciati oppioidi endogeni e bilanciano l'aumento dello stato nocicettivo prodotto dall'infiammazione. Un numero crescente di lavori suggerisce un'intima relazione tra gli oppioidi endogeni e il sistema immunitario. Christoph Stein e colleghi a Berlino hanno condotto una serie di studi pionieristici che hanno descritto la capacità del sistema immunitario di fornire oppioidi endogeni e la capacità dell'infiammazione di stimolare il movimento dei recettori degli oppioidi nel sito della lesione, consentendo così il verificarsi dell'antinocicezione. Tuttavia, questi cambiamenti non si verificano immediatamente dopo l'infortunio e possono richiedere fino a 96 ore per verificarsi. I recettori oppioidi e i neuropeptidi (p. es., la sostanza P) sono sintetizzati nel ganglio della radice dorsale e trasportati lungo i microtubuli intraassonali nei processi centrali e periferici del neurone afferente primario (Figure 4 ). Ai terminali, i recettori oppioidi sono incorporati nella membrana neuronale e diventano recettori funzionali. Su attivazione da parte di oppioidi esogeni o endogeni (rilasciati dalle cellule immunitarie), i recettori oppioidi si accoppiano alle proteine G inibitorie. Ciò porta alla soppressione diretta o indiretta (attraverso la diminuzione dell'adenosina monofosfato ciclico) delle correnti di Ca2+ o Na+ e alla successiva attenuazione del rilascio della sostanza P.
La permeabilità del perineurio è aumentata all'interno del tessuto infiammato, migliorando la capacità degli oppioidi di raggiungere i recettori bersaglio. Numerosi studi hanno applicato gli oppioidi nel SNP sia ai nervi periferici che allo spazio intra-articolare. Sebbene molti studi abbiano affermato un beneficio analgesico degli oppioidi applicati per via periferica, pochi studi hanno incorporato un gruppo di controllo con un oppioide applicato per via sistemica per il confronto. Senza l'inclusione di un controllo, è impossibile interpretare se l'oppioide periferico stia avendo un vero effetto periferico o sia invece trasportato al SNC per indurre analgesia. La vera analgesia da oppiacei mediata perifericamente può essere utile se associata a una migliore analgesia oa una riduzione degli effetti avversi rispetto alla somministrazione sistemica. Se l'effetto è mediato centralmente, non vi è alcun chiaro vantaggio rispetto alla somministrazione sistemica.
Oppioidi perineurali
I recettori oppioidi identificati sulle fibre afferenti primarie vengono trasportati dal ganglio della radice dorsale al sito dell'infiammazione; tuttavia, mentre sono in fase di trasporto assonale, potrebbero non essere facilmente raggiunti dagli agonisti degli oppioidi. Questo potrebbe spiegare il motivo per cui due recenti revisioni sistematiche pubblicate nel 1997 e nel 2000 hanno trovato poche prove a favore dell'aggiunta di oppioidi agli anestetici locali nel blocco dei nervi periferici. Una tabella aggiornata degli studi che esaminano la somministrazione perineuronale di oppioidi (esclusi buprenorfina e tramadolo) mostra che il beneficio analgesico rimane ambiguo (Tabella 1). Inoltre, Peng e Choyce hanno esaminato l'uso di oppioidi nell'anestesia regionale endovenosa (IVRA) con conclusioni deludenti simili.
TABELLA 1. Risultati di studi che esaminano l'effetto degli oppioidi perineuronali/perineurali (esclusi tramadolo e buprenorfina).
| Studi totali | Risultati complessivi | Risultati del controllo sistemico |
|---|---|---|
| 19 Studi commissionati | 10 di supporto | 7 controllo sistemico: 5 solidale; 2 negativo |
| 9 negativo | 12 nessun controllo sistemico: 5 supporto; 7 negativo. |
Nonostante questi risultati deludenti, i due agonisti degli oppioidi che hanno dimostrato efficacia analgesica quando somministrati per via perineuronale sono la buprenorfina e il tramadolo. La buprenorfina è un agonista parziale del recettore µ con un'affinità recettoriale molto elevata rispetto al fentanil (24 volte) o alla morfina (50 volte). Inoltre, ha una solubilità lipidica intermedia, che gli consente di attraversare la membrana neurale. Candido e colleghi hanno aggiunto 0.3 mg di buprenorfina (un agonista parziale degli oppioidi) a una combinazione di mepivacaina e tetracaina nel blocco ascellare e hanno riscontrato un aumento di quasi il 100% della durata dell'analgesia rispetto alla somministrazione del blocco ascellare più la stessa dose di buprenorfina intramuscolare con nessun aumento significativo degli effetti avversi. Ciò supporta l'effetto analgesico periferico della buprenorfina e i primi risultati di due studi che hanno esaminato la buprenorfina senza un gruppo di controllo sistemico. Gli studi che esaminano la buprenorfina sono presentati in modo più dettagliato in Tabella 2.
TABELLA 2. Studi che esaminano la buprenorfina come adiuvante analgesico con anestetici locali.
| Autore/Data | Pazienti/ ATTIVITA' E GRUPPI | Tipo di blocco | Dosare | Anestetico locale | Sistemico Control | Risultati |
|---|---|---|---|---|---|---|
| Viel 1989 | 20/2 | Sopraclaveare | 3 mcg/kg | Bupivacaina 0.5% 40 ml | Non | Analgesia prolungata rispetto al gruppo morfina (35 vs. 18.25 h); nessuna differenza nel blocco sensoriale. |
| Bazin 1997 | 89/4 | Sopraclaveare | 3 mg/kg | Bupivacaina 0.5% Lidocaina 1% | Non | Analgesia prolungata rispetto al gruppo di controllo (20 vs. 11.5 h) |
| Candido 2001 | 40/2 | Sopraclaveare | 0.3 mg | Mepivacaina 1% Tetracaina 0.2% | Non | Analgesia prolungata rispetto al gruppo di controllo (17.4 vs. 5.3 h) |
| Candido 2002 | 60/3 | Ascellare | 0.3 mg | Mepivacaina 1% | Sì | La durata media dell'analgesia postoperatoria è stata di 22.3 ore nel gruppo ascellare rispetto a 12.5 ore nel gruppo IM e 6.6 ore nel gruppo placebo. |
| Tetracaina 0.2% | IM |
Il tramadolo è un debole agonista degli oppioidi con una certa selettività per il recettore µ che inibisce anche la ricaptazione della noradrenalina e stimola il rilascio di serotonina nello spazio intratecale. La noradrenalina e la serotonina sono trasmettitori della via di controllo discendente nel midollo spinale e migliorano l'analgesia. Kapral e colleghi hanno utilizzato una dose di 100 mg di tramadolo come adiuvante della mepivacaina nel blocco del plesso brachiale ascellare. Hanno diviso 60 pazienti in tre gruppi: un gruppo ha ricevuto mepivacaina all'1% con 2 ml di soluzione fisiologica, il secondo gruppo ha ricevuto mepivacaina all'1% con 100 mg di tramadolo e il terzo gruppo ha ricevuto mepivacaina all'1% con 2 ml di soluzione salina e 100 mg di tramadolo per via endovenosa. Questo studio ha dimostrato una maggiore durata del blocco motorio e sensoriale nel gruppo tramadolo ascellare che è sopravvissuto significativamente (p <.01) sia al gruppo endovenoso che al gruppo placebo. Robaux e colleghi hanno successivamente condotto uno studio dose-risposta con placebo e dosi di 40, 100 e 200 mg di tramadolo aggiunte a una dose fissa di mepivacaina all'1.5% nel blocco ascellare e hanno scoperto che la dose da 200 mg forniva la migliore analgesia senza un aumento degli effetti avversi. Alemanno e colleghi hanno utilizzato una dose di tramadolo da 1.5 mg/kg come adiuvante allo 0.5% di levobupivacaina (0.5 ml/kg) per il blocco interscalenico. Qui, 120 pazienti sono stati divisi in tre gruppi: un gruppo ha ricevuto solo anestetico locale, il secondo gruppo ha ricevuto anestetico locale con tramadolo sistemico e il terzo gruppo ha ricevuto anestetico locale con tramadolo perineurale. Mentre entrambi i gruppi che hanno ricevuto tramadolo hanno sperimentato un'analgesia prolungata rispetto al placebo, il gruppo che ha ricevuto tramadolo perineurale ha manifestato un'analgesia prolungata rispetto al tramadolo sistemico (14.5 vs. 10.1 ore; p <.001).
Oppioidi intra-articolari e altre vie periferiche di somministrazione
Gli agonisti degli oppioidi somministrati nel tessuto infiammato si legheranno ai recettori degli oppioidi sui terminali sensoriali e indurranno analgesia. Studi sugli animali hanno indicato che questi recettori periferici degli oppioidi sono espressi 96 ore dopo la lesione infiammatoria iniziale. La somministrazione intra-articolare di oppioidi produrrà quindi analgesia solo in pazienti con infiammazione preesistente. Kalso e colleghi hanno esaminato sistematicamente il ruolo degli oppioidi intra-articolari nel 1997 e hanno stabilito che esistevano prove per un beneficio prolungato dalla morfina intra-articolare senza effetti avversi significativi a dosi da 1 a 5 mg. Non è stata rilevata alcuna risposta alla dose. Articoli recenti hanno supportato questa scoperta e hanno mostrato i benefici di morfina intra-articolare, tramadolo, buprenorfina e sufentanil. Tuttavia, una revisione sistematica degli effetti della morfina intra-articolare ha dimostrato solo un lieve effetto analgesico [riduzione della scala analogica visiva per il dolore (VAS) di 12–17 mm] ma non ha potuto escludere che l'effetto fosse mediato dall'assorbimento sistemico.
ALPHA2-AGONISTI E CLONIDINA
La clonidina è un α2-agonista con alcuni effetti α1-stimolatori. È stato tradizionalmente usato come agente antipertensivo ed è stato notato per molti anni per avere effetti sedativi e analgesici. Più recentemente, è stato stabilito che i recettori α2 esistono nel corno dorsale del midollo spinale e la stimolazione di questi recettori produce effetti analgesici inibendo il rilascio presinaptico dei trasmettitori eccitatori, tra cui la sostanza P e il glutammato. La clonidina intratecale media l'analgesia aumentando i livelli di acetilcolina, che a sua volta stimola i recettori muscarinici. L'eccitazione muscarinica aumenta i livelli di acido γ-amino butirrico sulla fibra afferente primaria, inibendo il rilascio del neurotrasmettitore eccitatorio glutammato. La clonidina iniettata vicino ai nervi periferici con o senza farmaci anestetici locali sembra mediare l'analgesia in diversi modi. La clonidina ha proprietà anestetiche locali e potenziali d'azione composti tonicamente inibiti delle fibre C maggiori delle fibre A-α nel nervo sciatico di ratto ed era paragonabile alla lidocaina nella sua capacità di inibire le fibre C nel nervo vago del coniglio. La clonidina ha anche un effetto farmacocinetico sulla ridistribuzione dell'anestetico locale mediato da un effetto vasocostrittore a livello del recettore α1. Recenti modelli animali hanno dimostrato e supportato lavori precedenti che la clonidina facilita prevalentemente il blocco dei nervi periferici attraverso la corrente cationica attivata dall'iperpolarizzazione e che questo effetto è indipendente da qualsiasi effetto vasocostrittore. Un'aggiunta più recente alla selezione degli α2-agonisti è la dexmedetomidina, che è selettiva per il recettore α2 e che attualmente è studiata principalmente come agente sedativo nelle unità di terapia intensiva. Ci si può aspettare che la dexmedetomidina produca non solo un'analgesia più profonda, ma anche maggiori effetti avversi a causa della selettività dell'azione. La stimolazione del recettore α2 produce ipotensione, bradicardia e sedazione a dosi più elevate e questi effetti possono superare qualsiasi beneficio analgesico prodotto dall'uso di questi agenti.
Applicazione perineuronale
Oltre 30 studi sull'uomo hanno ora esaminato l'effetto della clonidina sugli anestetici locali nel blocco dei nervi periferici. Vi sono buone prove da questi studi che la clonidina in dosi fino a 1.5 µg/kg prolunga il blocco sensoriale e l'analgesia quando somministrata con anestetici locali per il blocco dei nervi periferici. Ciò supporta la prima opinione di Murphy e colleghi secondo cui la clonidina è un adiuvante benefico quando aggiunta al blocco nervoso periferico e che l'effetto è molto probabilmente mediato nel SNP. Sebbene numerosi studi abbiano esaminato l'effetto della clonidina aggiunta al blocco dei nervi periferici, solo pochi hanno controllato un effetto sistemico. Singelyn e colleghi hanno valutato 30 pazienti che hanno ricevuto un blocco del plesso brachiale ascellare con 40 ml di mepivacaina all'1% più 5 µg/mL di epinefrina. I pazienti sono stati randomizzati in tre gruppi e hanno ricevuto (1) solo anestetico locale, (2) anestetico locale più 150 µg di clonidina somministrata per via sottocutanea o (3) 150 µg di clonidina nel blocco del plesso brachiale con anestetico locale. La clonidina aggiunta al blocco del plesso ascellare brachiale ha ritardato di due volte l'insorgenza del dolore, senza effetti avversi rispetto al controllo sistemico. Hutschala e colleghi hanno recentemente dimostrato l'effetto analgesico periferico della clonidina nei volontari quando aggiunta al blocco del plesso brachiale con lo 0.25% di bupivacaina.
Tuttavia, altri studi recenti non hanno dimostrato alcun beneficio generale dell'aggiunta di clonidina ad anestetici locali a lunga durata d'azione come bupivacaina e ropivacaina. Più recentemente, una meta-analisi di Popping e colleghi ha stimato che la clonidina ha prolungato l'analgesia postoperatoria, il blocco sensoriale e il blocco motorio rispettivamente di 122, 74 e 141 minuti. La clonidina, tuttavia, ha anche aumentato la probabilità di ipotensione (odds ratio [OR] 3.61), svenimento (OR 5.07), sedazione (OR 2.28) e bradicardia (OR 3.09). Non è stata osservata alcuna risposta alla dose tra un intervallo di 30 e 300 µg, con la maggioranza che ha ricevuto 150 µg. L'aggiunta di clonidina ai blocchi nervosi periferici continui non è vantaggiosa. Ilfeld e colleghi hanno dimostrato in due studi che sia 0.1 che 0.2 µg/mL di clonidina aggiunti a un'infusione continua di ropivacaina allo 0.2% non sono riusciti a ridurre i punteggi del dolore o l'uso di analgesici orali dopo un intervento chirurgico agli arti superiori. La dexmedetomidina, come ipotizzato in precedenza, produce effettivamente un effetto più profondo sull'analgesia quando applicata per via perineurale in combinazione con anestetici locali. Quattro studi lo hanno recentemente esaminato e una meta-analisi ha suggerito che la dexmedetomidina prolunga gli effetti analgesici dei blocchi del plesso brachiale di 284 minuti. È interessante notare che, nonostante le preoccupazioni iniziali sul fatto che la dexmedetomidina possa avere effetti emodinamici maggiori rispetto alla clonidina, non sembra essere così.
Anestesia regionale endovenosa
L'anestesia regionale endovenosa è una tecnica di anestesia regionale utile e semplice, specialmente per le procedure periferiche minori degli arti superiori, che è limitata dalla tolleranza al laccio emostatico e dalla scarsa analgesia postoperatoria. La clonidina ha dimostrato in numerosi studi di migliorare il tempo di insorgenza e la tolleranza al laccio emostatico intraoperatorio. Solo uno studio ha dimostrato un miglioramento dell'analgesia postoperatoria nel primo periodo postoperatorio rispetto al placebo. Reuben e colleghi hanno randomizzato 45 pazienti a 40 ml di lidocaina allo 0.5% con clonidina 1 µg/kg, lidocaina da sola con clonidina endovenosa e lidocaina da sola con soluzione fisiologica endovenosa. I pazienti a cui è stata somministrata clonidina con lidocaina hanno manifestato un dolore significativamente inferiore e hanno richiesto meno analgesici rispetto ai pazienti degli altri due gruppi. Dosi più elevate di clonidina (150 µg) hanno prodotto significativamente più sedazione e incidenza di ipotensione. Ad oggi solo uno studio ha utilizzato la dexmedetomidina nell'IVRA. Memis e colleghi hanno aggiunto 0.5 µg/kg di dexmedetomidina allo 0.5% di lidocaina e hanno dimostrato una riduzione del tempo di insorgenza e un miglioramento dell'analgesia postoperatoria rispetto al placebo senza effetti avversi significativi.
Tecniche intraarticolari
L'effetto intra-articolare della clonidina è stato esaminato quando somministrata con e senza anestetico locale ed è stato riscontrato che ha effetti benefici sull'analgesia postoperatoria. Ci si può aspettare che l'aggiunta di morfina e clonidina abbia effetti additivi. Due studi hanno esaminato questa domanda, di cui uno ha dimostrato un miglioramento dell'analgesia e l'altro nessuna differenza. Studi preclinici hanno dimostrato che, analogamente agli oppioidi, l'analgesia mediata dalla clonidina è potenziata dall'infiammazione, sebbene al momento il meccanismo non sia evidente.
DESAMETASONE
Il desametasone è un potente corticosteroide sintetico con una potenza antinfiammatoria circa sette volte superiore a quella del prednisolone e un'attività mineralcorticoide molto ridotta. L'emivita è di circa 36-54 ore in ambito perioperatorio. L'efficacia del desametasone come antiemetico postoperatorio (da 4 a 10 mg per via endovenosa) è stata confermata da oltre 60 studi randomizzati controllati, con una recente meta-analisi che ha stimato un OR di 0.31 e un numero necessario per il trattamento di 3.7 (NNT). Date le sue proprietà antinfiammatorie sistemiche, gli effetti analgesici di una singola dose endovenosa preoperatoria di desametasone sono stati studiati in oltre 24 studi randomizzati con effetti modesti fino a 24 ore. Questa meta-analisi, pubblicata nel 2011, includeva 2751 pazienti e stimava che i punteggi della scala di valutazione verbale per il dolore (VRS) fossero ridotti a un massimo di 0.64 punti fino a 24 ore dopo la somministrazione di desametasone. Prima di queste revisioni, studi in vitro e murini sull'azione farmacologica specifica del desametasone hanno prodotto diverse nuove applicazioni oltre alla somministrazione sistemica.
Applicazione perineurale
Si ritiene che i corticosteroidi perineurali esercitino il loro effetto attraverso diversi meccanismi, tra cui l'attenuazione del rilascio di mediatori infiammatori, la riduzione della scarica neuronale ectopica e l'inibizione della scarica mediata dal canale del potassio delle fibre C nocicettive. È opinione diffusa che il desametasone migliori la qualità e la durata del blocco nervoso periferico quando somministrato in combinazione con anestetici locali. La Food and Drug Administration (FDA) statunitense (o qualsiasi altro organismo di regolamentazione), tuttavia, non approva il desametasone per la somministrazione perineurale. Tuttavia, numerosi studi hanno valutato gli effetti della combinazione di desametasone (da 4 a 10 mg) con anestetico locale per i blocchi nervosi periferici. I blocchi nervosi periferici degli arti superiori e inferiori eseguiti con desametasone hanno dimostrato un prolungamento dell'analgesia o un blocco sensoriale/motorio compreso tra circa il 50% e il 75% oltre a quello eseguito con il solo anestetico locale. Solo uno studio fino ad oggi ha confrontato il desametasone perineurale con quello sistemico nel contesto dei blocchi nervosi periferici. Questo studio ha randomizzato i pazienti a bloccare il plesso brachiale interscalenico con placebo o 8 mg di desametasone perineurale o sistemico. Gli autori hanno dimostrato un prolungamento del blocco in entrambi i gruppi di desametasone da 12 ore a circa 20 e 22 ore rispettivamente per la somministrazione sistemica e perineurale e hanno concluso che la somministrazione di desametasone sistemica e perineurale erano equivalenti. Sono necessari ulteriori studi per confrontare gli effetti del desametasone perineurale e sistemico prima di poter trarre conclusioni finali. Nella pratica non sono emerse preoccupazioni per le complicazioni legate al desametasone, come gli effetti sulla glicemia e la neurotossicità del conservante utilizzato nei flaconcini multidose. In particolare, una singola dose di desametasone, somministrata per via perineurale o sistemica, non ha aumentato la glicemia in misura clinicamente significativa. Studi murini sul bisolfito di sodio non hanno dimostrato neurotossicità con la somministrazione intratecale.
Anestesia regionale endovenosa
Bigat e colleghi hanno studiato gli effetti dell'aggiunta di desametasone alla lidocaina IVRA in uno studio randomizzato. Settantacinque pazienti sono stati randomizzati a lidocaina con placebo, 8 mg di desametasone con lidocaina o 8 mg di desametasone sistemico. In questo studio, il desametasone sistemico non ha esercitato alcun effetto sull'efficacia dell'IVRA, mentre la lidocaina più desametasone ha dimostrato caratteristiche di blocco migliorate.
ANTAGONISTI DEI RECETTORI N-METIL-ASPARTATO
All'interno del corno dorsale del midollo spinale sia acido ionotropico [N-metil--aspartato (NMDA)], acido α-ammino-3-idrossi-5-metilisossazolo-4-propionico (AMPA), acido kainico (KA) e acido metabotropico i recettori del glutammato sono coinvolti nella segnalazione nocicettiva e nella sensibilizzazione centrale in condizioni di dolore cronico. Recentemente, sono stati trovati più recettori del glutammato nei terminali nervosi periferici e possono contribuire alla segnalazione del dolore periferico. L'iniezione del glutammato agonista del recettore NMDA nel muscolo massetere produce dolore sia nei ratti che nell'uomo. La successiva iniezione di antagonisti del recettore NMDA come ketamina e destrometorfano attenua il dolore.
Numerosi studi hanno esaminato l'effetto degli antagonisti NMDA nella produzione di analgesia mediata perifericamente nei pazienti. Tverskoy e colleghi hanno infiltrato bupivacaina con ketamina allo 0.3% o placebo per pazienti con erniorrafia inguinale e hanno scoperto che la ketamina migliorava significativamente le azioni anestetiche e analgesiche di un anestetico locale somministrato per l'anestesia di infiltrazione. La ketamina è stata utilizzata come unico anestetico nell'IVRA, ma i pazienti hanno subito effetti avversi eccessivi sullo sgonfiaggio del laccio emostatico. Altri lavoratori hanno aggiunto ketamina (0.1 mg/mL) o clonidina (1 µg/kg) alla lidocaina per l'IVRA. I pazienti nel gruppo ketamina hanno avuto il miglior controllo del dolore, sebbene sia la clonidina che la ketamina abbiano ridotto significativamente il consumo di analgesici rispetto alla sola lidocaina, con lievi effetti collaterali psicomimetici nel gruppo ketamina. Due studi hanno esaminato l'uso della ketamina intra-articolare. Dal e colleghi hanno randomizzato i pazienti a ketamina intra-articolare (0.5 mg/kg), neostigmina, bupivacaina o placebo. I pazienti che hanno ricevuto tutti e tre i farmaci hanno avuto miglioramenti simili nell'analgesia con la flessione del ginocchio rispetto al placebo; tuttavia, il gruppo ketamina ha avuto la durata più lunga dell'analgesia. Brill e colleghi hanno condotto uno studio dose-risposta utilizzando fino a 1 mg/kg di ketamina intra-articolare dopo l'artroscopia del ginocchio e hanno scoperto che il beneficio analgesico si è verificato solo nella prima ora dopo l'intervento chirurgico rispetto al placebo. Il magnesio ha effetti bloccanti NMDA e blocca il canale ionico sul recettore NMDA durante i normali stati fisiologici. L'input nocicettivo persistente nel corno dorsale del midollo spinale rimuove il magnesio, consentendo l'afflusso di calcio e cambiamenti intracellulari che portano a stati di dolore persistenti. Turan et al hanno sfruttato questo potenziale analgesico nel SNP aggiungendo 1.5 g di magnesio a lidocaina 0.5% per IVRA. Il magnesio ha ridotto il tempo di insorgenza e ha prolungato significativamente l'effetto analgesico fino a 6 ore dopo l'intervento chirurgico senza differenze negli effetti avversi. Nel complesso, gli antagonisti NMDA potrebbero avere un potenziale significativo per la produzione di analgesia mediata perifericamente in futuro, sebbene gli agenti attualmente disponibili (tranne il magnesio in IVRA) abbiano effetti limitati e a dosi più elevate producano effetti avversi eccessivi.
INIBIZIONE DELLA CICLOOSSIGENASI
Le prostaglandine sensibilizzano le terminazioni nervose periferiche agli effetti dei mediatori chimici endogeni rilasciati durante la lesione tissutale. I FANS inibiscono la produzione di prostaglandine attraverso il loro noto effetto di inibizione della ciclossigenasi (COX). L'applicazione di FANS direttamente nel SNP sembrerebbe quindi sensata come mezzo per ridurre il dolore attraverso un meccanismo periferico.
Anestesia regionale endovenosa
Numerosi autori hanno aggiunto ketorolac all'IVRA in dosi da 5 a 60 mg, producendo un miglioramento della tolleranza al laccio emostatico intraoperatorio e dell'analgesia postoperatoria. Steinberg e colleghi hanno condotto uno studio dose-risposta con ketorolac in IVRA usando placebo, dosi di ketorolac da 5, 10, 15, 20, 30 e 60 mg. È stato riscontrato che 20 mg era la dose ideale, con dosi più basse che producevano meno analgesia e dosi più elevate non più efficaci. L'acido lisina acetilsalicilico 90 mg (equivalenti a 50 mg di acido acetilsalicilico) è stato aggiunto alla prilocaina per l'IVRA con prolungamento dell'analgesia postoperatoria.
Amministrazione intraarticolare
L'uso di ketorolac da solo, con anestetico locale o anestetico locale e morfina, non è più efficace del solo anestetico locale quando somministrato nello spazio intraarticolare. Leggi di più su Infiltrazione intraarticolare e periarticolare di anestetici locali.
Infiltrazione
Ketorolac è stato infiltrato con successo in una dose da 30 a 60 mg dopo la riparazione dell'ernia, dando un effetto simile all'infiltrazione con bupivacaina. Tuttavia, l'infiltrazione locale non è risultata più efficace della somministrazione sistemica.
ANALGESIA COLINERGICA
I recettori muscarinici mediano l'analgesia nel corno dorsale del midollo spinale e la neostigmina ha prodotto analgesia quando somministrata sia nello spazio intratecale che epidurale. La neostigmina è stata applicata anche nel SNP in numerosi studi, con risultati generalmente deludenti. Van Elstraete e colleghi e Bone e colleghi hanno aggiunto neostigmina 500 µg all'anestetico locale nel blocco del plesso brachiale ascellare. Uno studio non ha dimostrato alcuna differenza e l'altro ha riscontrato solo una significativa riduzione del dolore a 24 ore, senza differenze in altri punti temporali. Anche la neostigmina aggiunta all'anestetico locale per l'IVRA è stata deludente. Turan e colleghi hanno aggiunto 500 µg di neostigmina alla prilocaina allo 0.5% e hanno riscontrato un miglioramento dell'insorgenza del blocco sensoriale e motorio e della compensazione con un tempo prolungato alla prima richiesta di analgesico. Tuttavia, McCartney e colleghi hanno condotto uno studio simile utilizzando neostigmina 1 mg aggiunto a lidocaina 0.5%, senza differenze riscontrate tra i gruppi. Nel complesso, la neostigmina sembra deludente come adiuvante analgesico per il blocco dei nervi periferici o IVRA. La neostigmina, tuttavia, è stata utilizzata con successo come adiuvante analgesico per uso intra-articolare dopo l'artroscopia del ginocchio. Yang e colleghi hanno eseguito uno studio dose-risposta e hanno scoperto che 500 µg erano più efficaci, che era più efficace di 2 mg di morfina intra-articolare. L'efficacia della via analgesica colinergica intra-articolare rispetto agli scarsi risultati con l'applicazione perineuronale può essere correlata alla presenza della risposta infiammatoria nello spazio intra-articolare, aumentando l'efficacia analgesica dell'acetilcolina con un meccanismo ancora da definire .
SOMMARIO
I blocchi nervosi periferici forniscono significativi benefici anestetici e analgesici per i nostri pazienti. Adiuvanti analgesici come oppioidi, α2-agonisti, antagonisti del recettore NMDA e altri agenti possono essere aggiunti agli anestetici locali sia per facilitare l'insorgenza che per prolungare gli effetti anestetici e analgesici attraverso i meccanismi esistenti nel SNP. Diversi agenti sono efficaci quando somministrati nello spazio perineuronale o intra-articolare e quando somministrati in IVRA o infiltrazione locale (Tabella 3). La dimensione dell'effetto di ogni particolare adiuvante è variabile, con il desametasone che produce la dimensione dell'effetto maggiore. La nostra conoscenza in evoluzione dei meccanismi nocicettivi nel SNP consentirà di sviluppare nuove tecniche in futuro per migliorare ulteriormente la gestione del dolore.
TABELLA 3. I migliori adiuvanti analgesici nel sistema nervoso periferico per via di somministrazione.
| strada | Agente e dose |
|---|---|
| Perineuronale/perineurale | desametasone 4-10 mg; buprenorfina 0.3 mg; clonidina 1–2 μg/kg; tramadolo 200 mg |
| IVRA | Dexmedetomidina 0.5 μg/kg; magnesio 1.5 g |
| Intraarticolare | Clonidina 150 μg; morfina 5 mg |
| Infiltrazione locale | Ketamina 3 mg/ml |
NB: Nella precedente edizione di questo testo si fa riferimento a diversi studi scritti dal Dr. S. Reuben che sono stati poi ritirati. Questi riferimenti sono stati rimossi. Tutti i riferimenti rimanenti in cui era coinvolto il dottor Reuben che non sono stati ritirati sono ancora referenziati.
BIBLIOGRAFIA
- Kehlet H, Dahl JB: Il valore di "multimodale" o "analgesia bilanciata" nel trattamento del dolore postoperatorio. Anesth Analg 1993;77:1048–1056.
- Raja SN, Meyer RA, Ringkamp M, et al: Meccanismi neurali periferici della nocicezione. In Wall PD, Melzack R (a cura di): Textbook of Pain, 4a ed. Churchill-Livingstone, 1999, pp 11–57.
- Dickenson AH: La teoria del dolore del controllo del cancello resiste alla prova del tempo. Fr. J Anaesth 2002;88:755–757.
- Millan MJ: L'induzione del dolore: una revisione integrativa. Prog Neurobiol 1999;57:1–164.
- Sawynok J: analgesici topici e ad azione periferica. Pharmacol Rev 2003;55:1–20.
- Williams BA, Hough KA, Tsui BY, Ibinson JW, Gold MS, Gebhart GF: neurotossicità degli adiuvanti utilizzati nell'anestesia perineurale e nell'analgesia rispetto alla ropivacaina. Reg Anesth Antidolorifico 2011; 36(3): 225–230.
- Likar R, Mousa SA, Philippitsch G, et al: L'aumento del numero di cellule infiammatorie che esprimono oppioidi non influisce sull'analgesia intraarticolare con morfina. Fr. J Anaesth 2004;93:375–380.
- Brack A, Rittner HL, Machelska H, et al: Controllo del dolore infiammatorio mediante reclutamento mediato da chemochine di cellule polimorfonucleate contenenti oppioidi. Dolore 2004;112:229–238.
- Machelska H, Cabot PJ, Mousa SA, et al: Controllo del dolore nell'infiammazione governato dalle selectine. Nat Med 1998;4:1425–1428.
- Stein C, Schafer M, Machelska H: Attaccare il dolore alla fonte: nuove prospettive sugli oppioidi. Nat Med 2003;9:1003–1008.
- Mousa SA, Zhang Q, Sitte N, et al: le cellule della memoria contenenti beta-endorfine e i recettori mu-oppioidi subiscono il trasporto nel tessuto infiammato periferico. J Neuroimmunol 200;115:71–78.
- Picard PR, Tramer MR, McQuay HJ, et al: Efficacia analgesica degli oppioidi periferici (tutti tranne intra-articolari): una revisione sistematica qualitativa di studi randomizzati e controllati. Dolore 1997;72:309–318.
- Murphy DB, McCartney CJ, Chan VW: Nuovi analgesici aggiuntivi per il blocco del plesso brachiale: una revisione sistematica. Anesth Analg 2000;90: 1122–1128.
- Fanelli G, Casati A, Magistris L, et al: Il fentanil non migliora le caratteristiche del blocco nervoso dell'anestesia del plesso brachiale ascellare eseguita con ropivacaina. Acta Anaesthesiol Scand 2001;45:590–594.
- Karakaya D, Buyukgoz F, Baris S, et al: L'aggiunta di fentanil alla bupivacaina prolunga l'anestesia e l'analgesia nel blocco del plesso brachiale ascellare. Reg Anesth Antidolorifico 2001;26:434–438.
- Likar R, Koppert W, Blatnig H, et al: Efficacia dell'analgesia periferica da morfina nel tessuto infiammato, non infiammato e perineurale di pazienti di chirurgia dentale. J Pain Symptom Manage 2001;21:330–337.
- Nishikawa K, Kanaya N, Nakayama M, et al: Fentanyl migliora l'analgesia ma prolunga l'insorgenza del blocco del plesso brachiale ascellare per meccanismo periferico. Anesth Analg 2000;91:384–387.
- Choyce A, Peng P: una revisione sistematica dei supplementi per l'anestesia regionale endovenosa per le procedure chirurgiche. Can J Anaesth 2002; 49: 32–45.
- Gutstein H, Akil H: analgesici oppioidi. In Hardman J, Limbird L (a cura di): Goodman & Gilman's The Pharmacological Basis of Therapeutics, 10a ed. McGraw-Hill, 2001, p 601.
- Lanz E, Simko G, Theiss D, et al: Buprenorfina epidurale: uno studio in doppio cieco sull'analgesia postoperatoria e sugli effetti collaterali. Anesth Analg 1984;63:593–598.
- Candido KD, Winnie AP, Ghaleb AH, et al: La buprenorfina aggiunta all'anestetico locale per il blocco del plesso brachiale ascellare prolunga l'analgesia postoperatoria. Reg Anesth Antidolorifico 2002;27:162–167.
- Candido KD, Franco CD, Khan MA, et al: Buprenorfina aggiunta all'anestetico locale per il blocco del plesso brachiale per fornire analgesia postoperatoria in pazienti ambulatoriali. Reg Anesth Pain Med 2001;26:352–356.
- Viel EJ, Eledjam JJ, De La Coussaye JE, et al: Blocco del plesso brachiale con oppioidi per alleviare il dolore postoperatorio: confronto tra buprenorfina e morfina. Reg Anesth 1989;14:274–278.
- Bazin JE, Massoni C, Bruelle P, et al: L'aggiunta di oppioidi agli anestetici locali nel blocco del plesso brachiale: Gli effetti comparativi di morfina, buprenorfina e sufentanil. Anestesia 1997;52: 858–862.
- Alhashemi JA, Kaki AM: Effetto della somministrazione intratecale di tramadolo sul dolore postoperatorio dopo resezione transuretrale della prostata. Fr. J Anaesth 2003;91:536–540.
- Kapral S, Gollmann G, Waltl B, et al: Il tramadolo aggiunto alla mepivacaina prolunga la durata di un blocco del plesso brachiale ascellare. Anesth Analg 1999;88:853–856.
- Robaux S, Blunt C, Viel E, et al: Tramadol aggiunto all'1.5% di mepivacaina per il blocco del plesso ascellare brachiale migliora l'analgesia postoperatoria in modo dose-dipendente. Anesth Analg 2004;98:1172–1177.
- Alemmano F, Ghisi D, Fanelli A, et al: Tramodol e 0.5% levobupivacaina per blocco interscalenico a colpo singolo. Minerva Anestesio 2013;78(3): 291–296.
- Kalso E, Tramer MR, Carroll D, et al: sollievo dal dolore dalla morfina intra-articolare dopo un intervento chirurgico al ginocchio: una revisione sistematica qualitativa. Dolore 1997;71:127–134.
- Brandsson S, Karlsson J, Morberg P, et al: Morfina intraarticolare dopo ricostruzione artroscopica del LCA: uno studio in doppio cieco controllato con placebo su 40 pazienti. Acta Orthop Scand 2000;71:280–285.
- Rasmussen S, Larsen AS, Thomsen ST, et al: glucocorticoidi intra-articolari, bupivacaina e morfina riducono il dolore, la risposta infiammatoria e la convalescenza dopo meniscectomia artroscopica. Dolore 1998;78:131–134.
- Alagol A, Calpur OU, Kaya G, et al: L'uso del tramadolo intraarticolare per l'analgesia postoperatoria dopo chirurgia artroscopica del ginocchio: un confronto tra diverse dosi intraarticolari ed endovenose. Knee Surg Sport Traumatol Arthrosc 2004;12:184–188.
- Varrassi G, Marinangeli F, Ciccozzi A, et al: Buprenorfina intra-articolare dopo artroscopia del ginocchio. Uno studio randomizzato, prospettico, in doppio cieco. Acta Anaesthesiol Scand 1999;43:51–55.
- Vranken JH, Vissers KC, de Jongh R, et al: La somministrazione intraarticolare di sufentanil facilita il recupero dopo l'artroscopia del ginocchio in day-case. Anesth Analg 2001;92:625–628.
- Gupta A, Bodin L, Holmstrom B, Berggren: una revisione sistematica degli effetti analgesici periferici della morfina intraarticolare. Anesth Analg 2001;93(3):761–770.
- Unnerstall JR, Kopajtic TA, Kuhar MJ: Distribuzione dei siti di legame dell'alfa 2 agonista nel ratto e nel sistema nervoso centrale umano: analisi di alcuni correlati funzionali e anatomici degli effetti farmacologici della clonidina e dei relativi agenti adrenergici. Brain Res 1984;319:69–101.
- Kuraishi Y, Hirota N, Sato Y, et al: inibizione noradrenergica del rilascio della sostanza P dalle afferenze primarie nel corno dorsale spinale del coniglio. Cervello Ris 1985;359:177–182.
- Fleetwood-Walker SM, Mitchell R, Hope PJ, et al: un recettore alfa 2 media l'inibizione selettiva da parte della noradrenalina delle risposte nocicettive dei neuroni del corno dorsale identificati. Cervello Ris 1985;334:243–254.
- Baba H, Kohno T, Okamoto M, et al: Facilitazione muscarinica del rilascio di GABA nella substantia gelatinosa del corno dorsale spinale di ratto. J Physiol 1998;508:83–93.
- Butterworth JF 5°, Strichartz GR: Gli agonisti alfa 2-adrenergici clonidina e guanfacina producono un blocco tonico e fasico della conduzione nelle fibre del nervo sciatico di ratto. Anesth Analg 1993;76:295–301.
- Gaumann DM, Brunet PC, Jirounek P: La clonidina migliora gli effetti della lidocaina sul potenziale d'azione della fibra C. Anesth Analg 1992;74:719–725.
- Eisenach JC, Gebhart GF: amitriptilina intratecale. Interazioni antinocicettive con morfina per via endovenosa e clonidina intratecale, neostigmina e carbamilcolina nei ratti. Anestesiologia 1995;83: 1036–1045.
- Kroin JS, Buvanendran A, Beck DR, et al: Il prolungamento della clonidina dell'analgesia della lidocaina dopo il blocco del nervo sciatico nei ratti è mediato dalla corrente cationica attivata dall'iperpolarizzazione, non dagli alfa-adrenorecettori. Anestesiologia 2004;101:488–494.
- Singelyn FJ, Dangoisse M, Bartholomee S, et al: L'aggiunta di clonidina alla mepivacaina prolunga la durata dell'anestesia e dell'analgesia dopo il blocco del plesso brachiale ascellare. Reg Anesth 1992;17:148–150.
- Hutschala D, Mascher H, Schmetterer L, et al: La clonidina aggiunta alla bupivacaina migliora e prolunga l'analgesia dopo il blocco del plesso brachiale attraverso un meccanismo locale in volontari sani. Eur J Anestesia 2004; 21:198–204.
- Culebras X, Van Gessel E, Hoffmeyer P, et al: la clonidina combinata con un anestetico locale a lunga durata d'azione non prolunga l'analgesia postoperatoria dopo il blocco del plesso brachiale ma induce cambiamenti emodinamici. Anesth Analg 2001;92:199–204.
- Popping DM, Elia N, Marret E, Wenk M, Tramer MR. Clonidina come adiuvante degli anestetici locali per i blocchi dei nervi periferici e del plesso: una meta-analisi di studi randomizzati. Anestesiologia 2009;111(2): 406–415.
- Ilfeld BM, Morey TE, Enneking FK: infusione perineurale infraclavicolare continua con clonidina e ropivacaina rispetto alla sola ropivacaina: uno studio randomizzato, in doppio cieco, controllato. Anesth Analg 2003;97:706–712.
- Ilfeld BM, Morey TE, Thanikary LJ, et al: Clonidina aggiunta a un'infusione perineurale interscalenica di ropivacaina continua per migliorare l'analgesia postoperatoria: uno studio randomizzato, in doppio cieco, controllato. Anesth Analg 2005;100:1172–1178.
- Abdallah FW, Brull R: Effetti facilitatori della dexmedetomidina perineurale sul blocco del nervo neuroassiale e periferico: una revisione sistematica e una meta-analisi. Fr. J Anaesth 2013;110(6):915–925.
- Alayurt S, Memis D, Pamukcu Z: L'aggiunta di sufentanil, tramadolo o clonidina alla lignocaina per l'anestesia regionale endovenosa. Terapia intensiva di Anaesth 2004;32:22–27.
- Gentili M, Bernard JM, Bonnet F: L'aggiunta di clonidina alla lidocaina per l'anestesia regionale endovenosa previene il dolore del laccio emostatico. Anesth Analg 1999;88:1327–1330.
- Reuben SS, Steinberg RB, Klatt JL, et al: Anestesia regionale endovenosa con lidocaina e clonidina. Anestesiologia 1999;91:654–658.
- Lurie SD, Reuben SS, Gibson CS, et al: Effetto della clonidina sul dolore del laccio emostatico degli arti superiori in volontari sani. Reg Anesth Antidolorifico 2000;25:502–505.
- Memis D, Turan A, Karamanlioglu B, et al: Aggiunta di dexmedetomidina alla lidocaina per l'anestesia regionale endovenosa. Anesth Analg 2004;98:835–840.
- Joshi W, Reuben SS, Kilaru PR, et al: analgesia postoperatoria per chirurgia artroscopica del ginocchio ambulatoriale con clonidina e/o morfina intraarticolari. Anesth Analg 2000;90:1102–1106.
- Tan PH, Buerkle H, Cheng JT, et al: Confronto parallelo in doppio cieco di dosi multiple di apraclonidina, clonidina e placebo somministrate per via intra-articolare a pazienti sottoposti a chirurgia artroscopica del ginocchio. Clin J Pain 2004;20:256–260.
- Gentili M, Juhel A, Bonnet F: effetto analgesico periferico della clonidina intraarticolare. Dolore 1996;64:593–596.
- Gentili M, Houssel P, Osman M, et al: Morfina e clonidina intra-articolari producono analgesia comparabile ma la combinazione non è più efficace. Fr. J Anaesth 1997;79:660–661.
- Buerkle H, Schapsmeier M, Bantel C, et al: azione antinocicettiva termica e meccanica della clonidina spinale rispetto a quella somministrata perifericamente nel modello dell'articolazione del ginocchio infiammata di ratto. Fr. J. Anaesth 1999; 83:436–441.
- Steroidi corticali surrenali. In fatti e confronti sulla droga, 5a ed. Fatti e confronti, 1997, pp 122–128.
- De Oliveira GS Jr, Castro-Alves LJ, Ahmad S, Kendall MC, McCarthy RJ: Desametasone per prevenire nausea e vomito postoperatori: una meta-analisi aggiornata di studi randomizzati controllati. Anesth Analg 2013;116(1):58–74.
- De Oliveira GS Jr, Almeida MD, Benzon HT, McCarthy RJ: desametasone sistemico perioperatorio a dose singola per il dolore postoperatorio: una meta-analisi di studi randomizzati controllati. Anestesiologia 2011;115(3): 575–588.
- Attardi B, Takimoto K, Gealy R, Severns C, Levitan ES: up-regulation indotta da glucocorticoidi di un mRNA del canale K+ ipofisario in vitro e in vivo. Canali recettoriali 1993;1:287–293.
- Eker HE, Cok OY, Aribogan A, Arslan G: Gestione del dolore neuropatico con metilprednisolone nel sito della lesione nervosa. Antidolorifico 2012;13:443–451.
- Johansson A, Hao J, Sjolund B: L'applicazione locale di corticosteroidi blocca la trasmissione nelle normali fibre C nocicettive. Acta Anaesthesiol Scand 1990;34:335–338.
- Cummings KC 3rd, Napierkowski DE, Parra-Sanchez I, et al: Effetto del desametasone sulla durata dei blocchi nervosi interscalenici con ropivacaina o bupivacaina. Fr. J Anaesth 2011; 107:446–453.
- Fredrickson MJ, Danesh-Clough TK, White R: desametasone adiuvante per blocchi sciatici e caviglia bupivacaina: risultati di 2 studi randomizzati controllati con placebo. Reg Anesth Pain Med 2013;38(4):300–307.
- Movafegh A, Razazian M, Hajimaohamadi F, Meysamie A: Il desametasone aggiunto alla lidocaina prolunga il blocco del plesso brachiale ascellare. Anesth Analg 2006;102:263–267.
- Parrington SJ, O'Donnell D, Chan VW, et al: Il desametasone aggiunto alla mepivacaina prolunga la durata dell'analgesia dopo il blocco del plesso brachiale sopraclaveare. Reg Anesth Antidolorifico 2010;35:422–426.
- Tandoc MN, Fan L, Kolesnikov S, Kruglov A, Nader ND: Il desametasone adiuvante con bupivacaina prolunga la durata del blocco interscalenico: uno studio prospettico randomizzato. J Anesth 2011;25:704–709.
- Vieira PA, Pulai I, Tsao GC, Manikantan P, Keller B, Connelly NR. Il desametasone con bupivacaina aumenta la durata dell'analgesia nel blocco del plesso brachiale interscalenico ecoguidato. Eur J Anaesthesiol 2010;27:285–288.
- Desmet M, Braems H, Reynvoet M, et al: IV e desametasone perineurale sono equivalenti nell'aumentare la durata analgesica di un blocco interscalenico a colpo singolo con ropivacaina per la chirurgia della spalla: uno studio prospettico, randomizzato, controllato con placebo. Fr. J Anaesth 2013; 111(3):445–452. Epub prima della stampa.
- Thangaswamy CR, Rewari V, Trikha A, Dehran M, Chandralekha: Desametasone prima dell'isterectomia laparoscopica totale: uno studio dose-risposta controllato randomizzato. J Anesth 2010;24:24–30.
- Worni M, Schudel HH, Seifert E, et al: Studio controllato randomizzato su steroidi a dose singola prima della tiroidectomia per malattia benigna per migliorare la nausea, il dolore e la funzione vocale postoperatori. Ann Surg 2008;248: 1060–1066.
- Taniguchi M, Bollen AW, Drasner K. Bisolfito di sodio: capro espiatorio per la neurotossicità della cloroprocaina? Anestesiologia 2004;100(1):85–91.
- Bigat Z, Boztug N, Hadimioglu N, Cete N, Coskunfirat N, Ertok E: il desametasone migliora la qualità dell'anestesia regionale e dell'analgesia per via endovenosa? Uno studio clinico randomizzato e controllato. Anesth Analg 2006;102(2):605–609.
- Coderre TJ, Katz J, Vaccarino AL, et al: Contributo della neuroplasticità centrale al dolore patologico: revisione delle prove cliniche e sperimentali. Dolore 1993;52:259–285.
- Price DD, Mao J, Mayer DJ: meccanismi neurali centrali degli stati di dolore normali e anormali. In Fields HL, Liebskind JC (a cura di): Progressi nella ricerca e gestione del dolore. IASP Press, 1994;61–84.
- Dickenson AH, Chapman V, Green GM: La farmacologia degli eventi mediati da amminoacidi eccitatori e inibitori nella trasmissione e modulazione del dolore nel midollo spinale. Gen Pharmacol 1997;28: 633–638.
- Alfredson H, Forsgren S, Thorsen K, et al: recettori del glutammato NMDAR1 localizzati ai nervi nei tendini di Achille umani. Implicazioni per il trattamento? Knee Surg Sport Traumatol Arthrosc 2001;9:123–126.
- Cairns BE, Hu JW, Arendt-Nielsen L, et al: differenze legate al sesso nel dolore umano e nella scarica afferente del ratto evocate dall'iniezione di glutammato nel muscolo massetere. J Neurophysiol 2001;86:782–791.
- Svensson P, Cairns BE, Wang K, et al: L'iniezione del fattore di crescita del nervo nel muscolo massetere umano evoca allodinia meccanica e iperalgesia di lunga durata. Dolore 2003;104:241–247.
- Cairns BE, Svensson P, Wang K, et al: L'attivazione dei recettori NMDA periferici contribuisce al dolore umano e alle scariche afferenti di ratto evocate dall'iniezione di glutammato nel muscolo massetere. J Neurophysiol 2003;90:2098–2105.
- Tverskoy M, Oren M, Vaskovich M, et al: La ketamina migliora gli effetti anestetici e analgesici locali della bupivacaina mediante il meccanismo periferico: uno studio su pazienti postoperatori. Neurosci Lett 1996;215:5–8.
- Amiot JF, Bouju P, Palacci JH, et al: Anestesia regionale endovenosa con ketamina. Anestesia 1985;40:899–901.
- Gorgias NK, Maidatsi PG, Kyriakidis AM, et al: Clonidina contro ketamina per prevenire il dolore del laccio emostatico durante l'anestesia regionale endovenosa con lidocaina. Reg Anesth Antidolorifico 2001;26:512–517.
- Dal D, Tetik O, Altunkaya H, et al: L'efficacia della ketamina intra-articolare per l'analgesia postoperatoria nella chirurgia artroscopica ambulatoriale. Artroscopia 2004;20:300–305.
- Brill S, McCartney CJ, Sawyer R, et al: Analgesia intra-articolare con ketamina dopo artroscopia del ginocchio: uno studio di determinazione della dose. Dolore Clinica 2005;17: 25–29.
- Turan A, Memis D, Karamanlioglu B, et al: Anestesia regionale endovenosa con lidocaina e magnesio. Anesth Analg 2005;100: 1189–1192.
- Reuben SS, Steinberg RB, Kreitzer JM, et al: Anestesia regionale endovenosa con lidocaina e ketorolac. Anesth Analg 1995;81: 110–113.
- Steinberg RB, Reuben SS, Gardner G: La relazione dose-risposta di ketorolac come componente dell'anestesia regionale endovenosa con lidocaina. Anesth Analg 1998;86:791–793.
- Corpataux JB, Van Gessel EF, Donald FA, et al: Effetto sull'analgesia postoperatoria dell'acetilsalicilato di lisina a piccole dosi aggiunto alla prilocaina durante l'anestesia regionale endovenosa. Anesth Analg 1997;84:1081–1085.
- Reuben SS, Duprat KM: confronto dell'infiltrazione della ferita con ketorolac rispetto all'anestesia regionale endovenosa con ketorolac per l'analgesia postoperatoria dopo chirurgia ambulatoriale della mano. Reg Anesth 1996;21:565–568.
- Ben-David B, Katz E, Gaitini L, et al: confronto tra IM e infiltrazione locale di ketorolac con e senza anestetico locale. Fr. J Anaesth 1995;75:409–412.
- Connelly NR, Reuben SS, Albert M, et al: Uso del ketorolac preincisionale nei pazienti con ernia: sito endovenoso rispetto a quello chirurgico. Reg Anesth 1997; 22:229–232.
- Bosek V, Cox CE: confronto dell'effetto analgesico del ketorolac somministrato localmente e per via sistemica nei pazienti con mastectomia. Ann Surg Oncol 1996;3:62–66.
- Van Elstraete AC, Pastureau F, Lebrun T, et al: Neostigmina aggiunta al blocco del plesso ascellare della lidocaina per l'analgesia postoperatoria. Eur J Anaesthesiol 2001;18:257–260.
- Bone HG, Van Aken H, Booke M, et al: Miglioramento dell'anestesia del blocco del plesso brachiale ascellare mediante somministrazione concomitante di neostigmina. Reg Anesth Antidolorifico 1999;24:405–410.
- Turan A, Karamanlyoglu B, Memis D, et al: Anestesia regionale endovenosa con prilocaina e neostigmina. Anesth Analg 2002;95(5): 1419–1422.
- McCartney CJ, Brill S, Rawson R, et al: Nessun beneficio anestetico o analgesico della neostigmina 1 mg aggiunto all'anestesia regionale endovenosa con lidocaina 0.5% per la chirurgia della mano. Reg Anesth Pain Med 2003;28: 414–417.
- Yang LC, Chen LM, Wang CJ, et al: analgesia postoperatoria da neostigmina intra-articolare in pazienti sottoposti ad artroscopia del ginocchio. Anestesiologia 1998;88:334–339.
- Gentili M, Enel D, Szymskiewicz O, et al: analgesia postoperatoria da clonidina intraarticolare e neostigmina in pazienti sottoposti a artroscopia del ginocchio. Reg Anesth Pain Med 2001;26:342–347.
Colin JL McCartney e Stephen Choi